Note: Descriptions are shown in the official language in which they were submitted.
~265~34
-- 1 --
La présente invention a pour objet, à titre de
composés nouveaux, des hydroxy-l acyloxy-8 acyl-10
anthrones, qui sont des dérivés de la dihydroxy-1,8
anthrone-9 ou anthraline, leur procédé de préparation et
5 leur utilisation en médecine humaine ou vétérinaire et en
cosmétique.
En thérapeutique, humaine ou vétérinaire, ces
composés sont des agents anti-proliferatifs, notamment dans
le traitement du psoriasis et des verrues, ou des agents
10 anti-inflammatoires dans le traitement des rhumatismes, des
dermatoses et de l'eczéma.
En cosmétique, ces composés sont des agents anti-
acnéiques, anti-pelliculaires, anti-séborrhéiques et anti-
chute.
Les hydroxy-l acyloxy-8 acyl-10 anthrones
présentent par rapport à l'anthraline et à certains derivés
de l'anthraline, tels que ceux décrits dans le brevet U.S.
no. 4.299.846, l'avantage d'être moins irritants, plus
stables et de moins tacher la peau et les vêtements,
20 notamment en lavage basique.
Les hydroxy-l acyloxy-8 acyl-10 anthrones sont par
ailleurs plus actifs que les composés decrits dans la
demande publiée de brevet allemand no. 2.154.609.
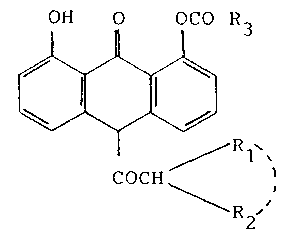
Les hydroxy-1 acyloxy-8 acyl-10 anthrones selon
25 l'invention, peuvent être représentées par la formule
générale suivante:
OH O OCO R3
/
COCH
R2
lZ65134
- la -
dans laquelle:
- Rl représente un atome d'hydrogène ou un radical
alkyle inférieur linéaire,
- R2 représente un atome d'hydrogène, un radical
alkyle, linéaire ou ramifié, ayant de 1 à 6 atomes de
carbone, un radical alkényle, linéaire ou ramifié,ayant de 2
à 6 atomes de carbone,
- ou R1 et R2 pris ensemble, forment avec l'atome de
carbone auquel ils sont attachés un radical cycloalkyle
ayant de 3 à 6 atomes de carbone,
- R3 représente un radical alkyle, linéaire ou ramifié,
ayant de 1 à 6 atomes de carbone, un radical alkényle,
linéaire ou ramifié, ayant de 2 à 6 atomes de carbone, un
radical cycloalkyle ayant de 3 à 6 atomes de carbone, un
radical furyle-2 ou -3, un radical pyridyle-3 ou -4, ou un
radical thiényle-2.
Par radical alkyle inférieur linéaire, on doit
entendre un radical ayant de 1 à 4 atomes de carbone.
Parmi les radicaux alkyles, linéaires ou ramifiés,
compris dans les significations de R2 et R3, on peut
notamment citer les r:dicau~ m~ ~1
,/
.
.. . .
~265134
éthyle, propyle, isopropyle, butyle, isobutyle, tertiobutyle, pentyle ou
isopentyle.
Par radical alkényle, linéaire ou ramifié ayant de 1 à 6 atomes de
carbone on doit entendre un radical allyle, propényle-l ou propényle-2.
Lorsque les radicaux Rl et R2 forment ensemble un radical cyclo-
alkyle, celui-ci est de préférence un radical cyclopentyle ou cyclohexyle.
Parmi les composés de formule (1) on peut en particulier citer les
suivants :
- hydroxy-l acétoxy-8 acétyl-lO anthrone,
- hydroxy-l acétoxy-8 cyclohexylcarbonyl-10 anthrone,
- hydroxy-l isobutyryloxy-8 propionyl-lO anthrone,
- hydroxy-l acétoxy-8 propionyl-lO anthrone,
- hydroxy-l propionyloxy-8 propionyl-10 anthrone,
- hydroxy-l isobutyryloxy-8 cyclohexylcarbonyl-10 anthrone.
La présente invention a également pour objet le procédé de prépa-
ration des hydroxy-l acyloxy-8 acyl-10 anthrones de formule (I) ci-dessus.
Ces composés sont préparés selon le schéma réactionnel suivant :
: ~ OCI ~ ~ R3
(1) COCH~ 1. pyridine COCH ~ Rl~
( 3)~R2; --R2'
La première étape de cette synthèse consiste à faire réagir su. la
dihydroxy-1,8 anthrone-9 (1) ou anthraline, un chlorure d'acide (2) en pré-
sence d'une base telle que la pyridine, la réaction étant effectuée tans un
solvant organique tel que toluène sous atmosphère d'azote et a l'abri de la
lumière et de l'humidité de l'air.
Le chlorure d'acide que l'on fait réagir comportant un proton en
du carbonyle, on suppose qu'il se forme intermédiairement un cétène qui
réagit avec la dihydroxy-1,8 anthrone pour conduire à un adduit qui est ensuite
transformé en dérivé acyl-10 de formule (3).
La deuxième étape consiste à traiter la dihydroxy-1,8 acyl-10
anthrone (_ à l'aide d'un anhydride d'acide de formule (R3C0~20 soit seul,
soit en mélange dans un solvant organique, tel que le toluène ou encore à
l'aide d'un chlorure d'acide R3COCl lorsque l'anhydride correspondant est
difficilement accessible.
Afin d'obtenir de façon préférentielle le d~riv~ (3) monoacylé en
position lO, il est nécessaire d'utiliser un excès de chlorure d'acide par
~3~ 1 2 6 5 1 3 4
rapport à l'anthraline, cet excès étant d'environ 1,5 ~ 3 équivalents.
Par ailleurs, suivant la nature du chlorure d'acide il peut être
interessant d'ajouter la pyridine et le chlorure d'acide en deux fois afin de
limiter la formation de produits di ou triacylés et d'arrêter la réaction
lorsque l'anthraline mise à réagir a été transform~e en produit monoacylé, en
position 10, attendu.
L'agent basique, telle que la pyridine, doit être également utilisé
en excès par rapport à l'anthraline, un excès de 1,8 à 3,2 équivalents
s'étant avéré particulièrement souhaitable.
Après l'addition de la première partie de la pyridine et du chlorure
d'acide, on porte la température à environ 80-90 C pendant 30 minutes ~ 2
heures, puis après refroidissement à temp~rature ordinaire, on ajoute au
mélange réactionnel la quantité complémentaire de pyridine et l'on additionne
le reste du chlorure d'acide. On porte le mélange à nouveau à une température
d'environ 80-90C pendant 1 à 2 heures jusqu'à disparition complète de l'an-
thraline. On peut opérer, pour cette première étape, en milieu plus dilué et
dans ce cas la réaction sera conduite ~ température ambiante en ajoutant la
totalité de la pyridine (de préférence 1,5 à 2 équivalents) en une seule fois
au début de la réaction.
Après refroidissement, on élimine le chlorhydrate de pyridinium
formé par filtration ou extraction à l'eau et l'on concentre la phase tolué-
nique à environ 1/5 de son volume initial.
On procède alors à la purification du produit attendu par chroma-
tographie sur gel de silice.
Les dihydroxy-1,8 acyl-10 anthrones (3) sont en général entrainées
dans les premières fractions d'élution. Ensuite, à l'aide d'un solvant ou d'un
mélange de solvants de polarité croissante, on entraine les dérivés acyl-10
mono, di et triacyloxy éventuellement formés en cours de réaction.
Dans certains cas, le dérivé monoacylé en position 10 peut être
isolé par recristallisation sans qu'il soit nécessaire de procéder à une
chromatographie.
Dans la deuxième étape, lorsque l'on utilise soit un anhydrite
d'acide soit un chlorure d'acide facilement éliminable par évaporation, la
réaction est conduite sans solvant et en large excès des réactifs à une
température comprise entre 80 et 150C.
On peut cependant utiliser un solvant de r~action tel que le toluène
lorsque l'anhydride d'acide ou le chlorure d'acide présente un point d'ébulli-
tion élevé, ce qui permet de faciliter leur élimination par une évaporation
sous vide.
~26513~
-- 4 --
La réaction est alors conduite à une température
comprise entre 70 et 110 C.
L'évolution de la réaction est suivie par
chromatographie sur couche mince et est arrêtée dès que
l'on constate la disparition du produit de départ et la
formation prépondérante du dérivé hydroxy-1 acyloxy-8 acyl-
10 anthrone.
Après la fin de la réaction, on verse, dans le
milieu réactionnel, de l'eau et on procède à différents
lavages, notamment à l'aide de solutions de bicarbonate de
sodium. La phase toluénique est alors séchée sur sulfate de
magnésium puis filtrée. On procède ensuite à la
purlfication du produit attendu soit par recristallisation,
soit par chromatographie sur gel de silice en utilisant de
préférence du toluène ou un mélange toluène-acétate d'éthyle
comme éluant.
En général, le produit de départ non transformé
est entraîné en tête de chromatographie, suivi ensuite des
dérivés diacylés en position 8 et 10 et enfin dans certains
cas des dérivés triacylés en position 1,8 et 10.
Les rendements en hydroxy-1 acyloxy-8 acyl-10
anthrone sont en général compris entre 20 et 50~ par rapport
à la dihydroxy-1,8 acyl-10 anthrone.
La présente invention a également pour objet
l'utilisation des composés de formule (I) en médecine
humaine ou vétérinaire et en cosmétique.
L'invention concerne donc des compositions
cosmétiques ou pharmaceutiques, caractérisées par le fait
qu'elles contiennent, en tant qu'ingrédient actif, au moins
un des composés de formule (I~ précédemment définis associé
à un véhicule ou excipient cosmétiquement ou pharmaceuti-
quement acceptable.
En thérapeutique humaine ou vétérinaire, les
composés selon l'invention, sont de puissants agents anti-
~265~4
- 4a -
prolifératifs notamment dans le traitement du psoriasis et
des verrues et d'excellents agents anti-inflammatoires
notamment dans le traitement des rhumatismes, des dermatoses
et de l'eczéma.
En cosmétique, les composés selon l'invention
peuvent être utilisés dans le traitement de l'acné, des
pellicules,de la séborrhée et de la chute des cheveux.
Les compositions cosmétiques ou pharmaceutiques
peuvent etre préparées par exemple en ajoutant le composé
actif de formule (I), à une concentration comprise entre 0,1
et 5~, dans divers supports inertes non toxiques, solides ou
liquides, généralement utilisés dans les compositions à
usage cosmétique ou thérapeutique.
Les compositions pharmaceutiques peuvent e-tre
administrées par voie entérale, parentérale ou topique.
Pour une administration par voie entérale, les compositions
se présentent sous forme de comprimés, de poudres, de
granulés, de gélules, de pilules, de sirops, de suspensions
ou de solutions.
La posologie est bien entendu fonction de la voie
d'administration et de l'activité recherchée.
Les compositions pharmaceutiques peuvent contenir
en outre des additifs inertes ou éventuellement pharmacody-
namiquement actifs. Les comprimés ou granulés peuvent
contenir par exemple des liants, des charges, des supports
_~
_5_ ~26S134
ou des diluants.
Les compositions liquides peuvent être présentes par exemple SOU8 la
forme d'une solution st~.rile miscible à l'eau. En plus du composé actif, les
gélules peuvent contenir une charge ou un épaississant. Les compositions
pharmaceutiques par voie orale peuvent également contenir des agents d'amé-
lioration de la saveur et des substances habituellement utilisées comme
conservateurs, stabilisants, régulateurs et émulsionnants. On peut également y
ajouter des sels et des tampons.
Les supports et diluants tels qu'énumérés ci-dessuF, peuvent être
constitués de substances organiques ou minérales, par exemple par de la
gélatine, du lactose, de l'amidon, du st~arate de magnésium, du talc, de la
gomme arabique, des huiles végétales et minérales, des charges, des épaissis-
sants, des colorants, des humectants ou des polyalkylène-glycols.
Lorsque les compositions pharmaceutiques sont destinées a une
application topique, celles-ci se présentent sous forme d'un onguent, d'une
pommade, d'un gel, d'une teinture, d'une crème, d'une solution, d'une lotion,
d'une poudre micronisée, d'un spray, d'une suspension, d'un shampooing ou de
tampons inhibés.
Les onguents ou pommades sont préf~rés et sont préparés en mélan-
geant le composé actif selon l'invention à des supports inertes non toxiques
appropriés pour un traitement par voie topique.
On va maintenant donner à titre d'illustration et sans aucun carac-
tère limitatif plusieurs exemples de préparation des composés selon l'in-
ven~ion ainsi que plusieurs exemples de compositions ~ usage thérapeutique et
cosmétique.
EXEMPLE_l
PREPARATION DE L'HYDROXY-l ACETOXY-8 ACETYL-10 ANTHRONE
a) Dihydroxy-1,8 acétyl-10 anthrone
A une solution de 56,5g d'anthraline purifiée (0,25 mole) dans
1750cm3 de toluène anhydre, on ajoute sous agitation à température ordinaire,
27,3cm3 de pyridine anhydre (0,34 mole) puis goutte ~ goutte ~ l'aide d'une
ampoule à brome, 21,4cm3 de chlorure d'acétyle (O,3 mole). Il se produit au
cours de l'addition une légère exothermicité puis après la fin de l'addition
on porte le mélange ~ une température de 90C environ pendant 1 heure. Après
refroidissement, on ajoute à nouveau à 30-35C, 27,3cm3 de pyridine pUi9
goutte à goutte 21,4cm3 de chlorure d'acétyle. On agite alors le mélange
pendant 1 heure à 85-90C. Après avoir vérifié que l'anthraline avait été
transformée en dérivé acétyl-10, le mélange réactionnel est ramené à tempéra-
ture ambiante puis lavé 3 fois ~ l'eau (250cm3). On décante la phase tolué-
nique que l'on sèche sur sulfate de sodium et que l'on concentre ensuite à
-6- ~265~34
environ 300cm3. On dépose alors la solution sur une colonne de gel de silice
et l'on élue à l'aide de toluène et du mélange toluène-chlorure de méthylène
(1:1). Les premières fractions sont rassemblées puis concentrées sous vide. Le
solide obtenu est alors recristallisé dans le tolu~ne et l'on obtient ainsi
21g de cristaux jaune vif de dihydroxy-1,8 acétyl-10 anthrone ayant un point
de fusion de 146C.
Analyse : C16H12O4
Calc. C : 71,63 H . 4,51 O : 23,85
Tr. 71,44 4,34 23,97
b) Hydroxy-l acetoxy-8 acétyl-10 anthrone
Une solution agitée de 3g de dihydroxy-1,8 acétyl-10 anthrone
obtenue ci-dessus, dans 20cm3 d'anhydride acétique, est portée, sous atmos-
phère inerte et à l'abri de la lumière, à une température comprise entre 85 et
95 C pendant 4 h 30. La solution est ensuite concentrée sous pression ré-
duite. Le produit obtenu est solubilisé dans 30cm3 de chlorure de méthyl~ne et
la solution est déposée sur une colonne de gel de silice. Par élution au
chlorure de méthylène, on isole dans les premières fractions 0,8 g de produit
de départ non transformé, puis par élution, à l'aide du mélange chlorure de
méthylène-acétate d'éthyle (95/5~ on isole le produit attendu.
Après concentration du solvant et recristallisation dans l'éther
isopropylique, on obtient 1,3g d'hydroxy-l acétoxy-8 acétyl-10 anthrone sous
forme de cristaux jaunes de point de fusion : 128C
Analyse élémentaire : C18H1405
Calc. C : 69,67 H :4,55 O: 25,78
Tr. 69,14 4,60 26,08
EXEMPLE 2
PREPARATION DE L'HYDROXY-l ACETOXY-8 CYCLOHEXYLCARBONYL-10 ANTHRONE
a) Dihydroxy-1,8 cyclohexylcarbonyl-10 anthrone
A une solution de 50g d'anthraline (0,22 mole) dans 2 litres de
toluène anhydre et 44cm3 de pyridine, on ajoute, en 30 minutes à température
ordinaire et sous agitation, 44cm3 de chlorure d'acide cyclohexane carboxy-
lique (1,5 mole).
On agite le mélange réactionnel à la température ambiante pendant 4
heures.
Le chlorhydrate de pyridinium précipité est éliminé par filtration
puis lavé au toluene. Les filtrats toluéniques sont évaporés sous pression
réduite et le solide résiduel est solubilisé dans 2 litres de dichlorométhane.
La solution obtenue est lavée avec 500cm3 d'eau acidulée, puis 3
fois ~ l'eau et enfin séchée sur sulfate de sodium.
_7_ ~265~3~
Après évaporation du solvant 90US pression réduite on obtient un
solide que l'on dissout à chaud dans 150cm3 de dichloro-1,2 éthane. La solu-
tion est filtrée puis refroidie à l'aide d'un bain de glace et l'on essore
puis sèche les cristaux jaune-oranges qui se sont formés (poids obtenu 31g).
Après une nouvelle recristallisation dans le dichloro-1,2 éthane, on
obtient 25g de dihydroxy-1,8 cyclohexyl casbonyl-10 anthrone de point de
fusion de 220C.
Analyse C21H2004
Calc. C : 74,98 H : 5,99 O : 19,03
Tr. 74,78 5,91 19,22
b) Hydroxy-l acétoxy-8 cyclohexylcarbonyl-10 anthrone
Une solution de 5g de dihydroxy-1,8 cyclohexycarbonyl-10 anthrone
obtenue ci-dessus dans lOOcm3 d'anhydride acétique, protégée de la lumière et
de l'humidité de l'air, est portée sous agitation à une température de 90 C
pendant trois heures. La solution est alors concentrée sous pression r~duite.
Le produit obtenu est dissout dans 50cm3 de chlorure de méthylène et déposé
sur une colonne de gel de silice. Par élution au chlorure de méthylène et
évaporation des phases d'élution, on isole, à partir des premières fractions,
1,2g de produit de départ non transformé.
A partir des fractions suivantes et concentration, on isole 1,5g
d'hydroxy-l acétoxy-8 cyclohexylcarbonyl-lO anthrone.
Par recristallisation dans un mélange toluène-hexane, on obtient,
après séchage, 1,1 g de cristaux jaunesdont le point de fusion est de 154C.
Analyse élémentaire C23H2205
calc. C : 73,00 H : 5,86 O : 21,14
Tr. 73,08 5,85 21,15
EXEMPLE 3
PREPARATION DE L'HYDROXY-l ISOBUTYRYLOXY-8 PROPIONYL-10 ANTHRONE
a~ Dihydroxy-1,8 propionyl-10 anthrone
A une suspension de 56,6g (0,25 mole) d'anthraline purifiée dans
1750cm3 de toluène anhydre, on ajoute à tempérsture ambiante, 27,3m3 de
pyridine anhydre (0,34 mole) puis, goutte à goutte en 20 minutes environ,
26,2cm3 de chlorure de propionyle (0,3 mole). On porte alors le mélange à 85C
environ pendant 1 heure. Après retour à la température ambiante, on ajouee de
nouveau 27,3cm3 de pyridine et 26,2cm3 de chlorure de propionyle puis l'on
porte le mélange pendant 1 heure à une température d'environ 85C.
Le chlorhydrate de pyridinium pr~cipité est filtré puis lavé au
toluène. Les filtrats toluéniques sont alors concentrés à 1 litre environ puis
lavés et séchés sur sulfate de magnéæium. On procède alors à une chromato-
graphie sur gel de silice en utilisant tout d'abord comme éluant le m~lange
-8- 1265134
hexane-toluène puis le toluène.
Après évaporation des différentes fractions, celles contenant la
dihydroxy-1,8 propionyl-10 anthrone sont rassemblées et dissoutes à la tempé-
rature ordinaire dans du toluène. Par addition d'hexane, le produit attendu
précipite et est isolé par essorage.
Après séchage, on obtient 54,6 g de cristaux jaune pâle de dihy-
droxy-1,8 propionyl-10 anthrone ayant un point de fusion de : 154C.
Analyse : C17 H14O4
Calc. C : 72,33 H : 4,99
Tr. 72,14 5,06
b) Hydroxy-l isobutyryloxy-8 propionyl-10 anthrone
Une solution agitée de 10 g de dihydroxy-1,8 propionyl-10 anthrone
obtenueci~dessus dans 50 cm3 d'anhydride isobutyrique, placée sous atmosphère
inerte et à l'abri de la lumière, est portée pendant deux heures à une tempé-
rature comprise entre 100 et 120C. La solution est ensuite concentrée sous
pression réduite.
Le produit obtenu est alors solubilisé dans 50 cm3 de chlorure de
méthylène et la solution est déposée sur une colonne de gel de silice. Par
élution au chlorure de méthylène, on isole tout d'abord le produit de départ,
puis le produit attendu.
Après évaporation des phases d'élution, on obtient 2,5 g d'un résidu
que l'on recristallise dans l'éther isopropylique. On obtient ainsi 1,5 g
d'hydroxy-l isobutyryloxy-8 propionyl-10 anthrone sous forme d'un solide jaune
ayant un point de fusion de 111C.
Analyse élémentaire C21H20O5
Calc. C : 71,57 H : 5,73 0 : 22,70
Tr. 71,27 5,84 22,89
EXEMPLE 4
PREPARATION DE L'HYDROXY-l ACETOXY-8 PROPIONYL-10 ANTHRONE
Une solution de 3 g de dihydroxy-1,8 propionyl-10 anthrone obtenue à
l'exemple 3 (a) dans 30 cm3 d'anhydride acétique est portée pendant deux
heures sous agitation ~ l'abri de la lumière et de l'humidité de l'air, ~ une
température comprise entre 90 et 100C.
La solution est ensuite évaporée sous pression réduite et le produit
obtenu est solubilisé dans du chlorure de méthylène.
On dépose alors la solution sur une colonne de gel de silice. Par
élution au chorure de méthylène, on isole en tête de chromatographie 0,8 g du
produit de départ non transformé et ensuite le produit attendu. Après éva-
poration du solvant et recristallisation dans un mélange hexane-chlorure de
9 1265i34
méthylène, on isole 1,5 g d'hydroxy-l acétoxy-8 propionyl-10 anthrone sous
forme de cristaux jaunes ayant un point de fusion de 106C.
Analyse élémentaire : C1gH1605
Calc. C : 70,36 H : 4,97 O : 24,67
Tr. 70,47 4,95 24,48
EXE~PLE 5
PREPARATION DE L'HYDROXY-l PROPIONYLOXY-8 PROPIONYL-10 ANTHRONE
Une solution de 100 g de dihydroxy-1,3 propionyl-10 anthrone obtenue
à l'exemple 3 (a) et de 100 cm3 de chlorure de propionyle dans 1300cm3 de
toluène anhydre est portée, sous agitation à l'abri de la lumière, à une
température de 80 C pendant quatre heures et abandonnée une nuit à température
ordinaire. On ajoute ensuite 50 cm3 de chlorure de propionyle supplémentaires
et le mélange est porté pendant huit heure~ à 80C. Le mélange réactionnel est
directement concentré sous pression réduite, puis repris par 300cm3 de chlo-
rure de méthylène. La phase de chlorure de méthylène est lavée à l'eau, séchée
sur sulfate de magnésium et déposée sur une colonne de gel de silice.
En éluant au chlorure de méthylène, on isole en tete de chroma-
tographie 17g de produit de départ non transformé, puis ensuite 37 g de
produit attendu. Après deux recristallisations dans l'éther isopropylique, on
obtient 25 g d'hydroxy-l propionyloxy-8 propionyl-10 anthrone sous forme de
cristaux jaunes ayant un point de fusion de 125C.
Analyse élémentaire : C20H1805
Calc. C : 70,9~ H : 5,36 0 : 23,64
Tr. 71,16 5,28 23,76
EXEMPLE 6
PREPARATION DE L'HYDROXY-l ISOBUTYRYLOXY-8 CYCLOHEXYLCARBONYL-10
ANTHRONE
Une solution de 5g de dihydroxy-1,8 cyclohexylcarbonyl-10 anthrone
obtenue à l'exemple 2(a) dans 100cm3 de toluène anhydre et de 15cm3 d'anhydride
isobutyrique est portée, sous atmosphère inerte, au reflux du tolu~ne pendant
6 heures. Le mélange est déposé sur une colonne de gel de silice et élué au
chlorure de méthylène. On élimine ainsi une partie de l'anhydride et de
l'acide isobutyrique. Après concentration des phases d'élution, une partie du
produit de départ non transformé cristallise. Il est essoré ee s~ch~. On isole
ainsi lg du produit de départ. Le filtrat est de nouveau dépos~ sur une
colonne de gel de silice et l'on élue à l'aide de tolu~ne, puis à l'aide des
mélanges toluène-chlorure de méthylène contenant respectivement 20%, 50% et
75% de chlorure de méthylène et enfin ~ l'aide de chlorure de méthylène pur.
Les fractions contenant le produit attendu sont rassemblées puis concentrées à
sec. On obtient 1,5g de produit brut. Par recristallisation dans un mélange
-lO- 1265134
toluène-hexane on isole lg d'hydroxy-l isobutyryloxy-8 cyclohexylcarbonyl-10
anthrone 60UB forme de cristaux jaunes dont le point de fusion est de 146C.
Analyse élémentaire : C25H26O5
Calc : C : 73,86 H : 6,45 O : 19,68
Tr : 74,15 6,49 19,40
EXEMPLES DE COMPOSITIONS PHARMACEUTIQUES ET COSMETIQUES
Exemple l : Comprimé non soluble de 0,5 g
- hydroxy-l propionyloxy-8 propionyl-10 anthrone ...... .0,100 g
- lactose ............................................. .0,082 g
- acide stéarique ..................................... .0,003 g
- talc purifié ........................................ .0,015 g
- édulcorant .......................................... qs
- colorant ............................................ qs
- amidon de riz QS .................................... .0,500 g
Ce comprimé est préparé par compression directe à sec du mél~nge des
différents constituants.
Exemple 2 : Comprimé non soluble de 0,8 &
- hydroxy-l isobutyryloxy-8 propionyl-10 anthrone ..... .....0,200 g
- lactose ............................................. .....0,200 g
- gomme arabique à 20 ~ dans l'eau .................... .....0,080 g
- paraffine liquide ................................... .....0,004 g
- talc purifié ........................................ .....0,016 g
- amidon QSP .......................................... .....0,800 g
Ce comprimé est obtenu en granulant, par voie humide, le mélange
d'hydroxy-l isobutyryloxy-8 propionyl-10 anthrone, d'amidon, de lactose et de
gomme arabique à 20 ~ dans l'eau.
On procède ensuite au séchage puis au tamisage des granulés. Ces
derniers sont ensuite mélangés avec la paraffine et le talc.
Exemple 3 : Granulés en sachets de 3 g
- hydroxy-l acétoxy-8 propionyl-10 anthrone ........... .....0,150 g
- saccharose .......................................... .....Z,220 g
- méthylcellulose ..................................... .....0,030 g
- eau purifiée ........................................ .....0,600 g
La pâte obtenue par mélange des quatre constituants est granulée par
voie humide puis séchée.
26sl~4
Exemple 4 : Capsules de 1 ~contenant 0,5 g de composé actif
contenu de la capsule : suspension huileuse
- hydroxy-l acétoxy-8 cyclohexylcarbonyl-l0 anthrone ....... 0,050 g
- huile de foie de morue QSP ............................... 0,500 g
L'enveloppe de la capsule est fabriqu~e per moulage pUi8 s~chage
d'un mélange approprié composé de gélatine, glycérine, eau et conservateur. La
suspension est introduite dans la capsule qui est ensuite scellée.
Exemple 5 : Gélule contenant 0,3 g de poudre
composition de la poudre :
- hydroxy-l propionyloxy-8 propionyl-l0 anthrone ........... 0,080 g
- amidon de ma;s ........................................... 0,060 g
- lactose QSP .............................................. 0,300 g
La poudre est conditionnée dans une gelule composée de gélatine, de
dioxyde de titane et d'un conservateur.
Exemple 6 : Onguent hydrophobe
- hydroxy-l propionyloxy-8 propionyl-lO anthrone ........... l,OO g
- vaseline ................................................. 49,00 g
- cérésine ................................................. l5,00 g
- huile de vaseline ........................................ 35,00 g
Exemple 7 : Emulsion non ionique pour une application topique
- hydroxy-l isobutyryloxy-8 propionyl-10 anthrone .......... 0,10 g
- eucérine anhydre ......................................... 70,00 g
- huile de vaseline ........................................ l0,00 g
- conservateur QS
- eau déminéralisée stérile QSP ............................ l00,00 g
Pour une bonne conservation, cette émulsion devra être stockée à
l'abri de la chaleur et de la lumière.
Exemple 8 : Gel anhydre
- hydroxy-l propionyloxy-8 propionyl-10 anthrone ........... l,50 g
- "Aérosil 200* (silice) de la sté DEGUSSA ................. 7,00 g
- myristate d'isopropyle QSP ............................... 100,00 g
Exemple 9 : Lait en deux parties à émulsionner extemporanément
Première partie
- hydroxy-l propionyloxy-8 propionyl-l0 anthrone .......... 2,00 g
- "Miglyol 8l2*'(triglycérides des acides caprique/
caprylique) de la sté DYNAMIT NO~EL QSP ................. 20,00 g
* (marque de commerce)
-12- 1 2 6 5 1 3 4
Deuxième partie
- "Tween 8~ (mono-oléate de sorbitan polyoxyéthyléné à
20 moles d'oxyde d'éthylène~ de la Sté ATLAS ............. 10,00 g
- conservateurs QS
- eau déminéralisée stérile QSP ............................ 80,00 g
La première partie est agitée en vue de mettre le compos~ actif en
suspension puis on mélange les deux parties avant d'appliquer le lait.
Exemple lO : Stic~
- hydroxy-l propionyloxy-8 propionyl-lO anthrone ............ 5,00 g
- beurre de cacao .......................................... 12,50 g
- cire d'ozokérite ......................................... 18,50 g
- paraffine blanche raffinée .......................... :.......... 6,25 g
- huile de vaseline ......................................... .... 12,75 g
- myristate d'isopropyle QSP ................................ ... 100,00 g
Exemple 11 : Composition capillaire antichute et antipelliculaire
- hydroxy-l acétoxy-8 cyclohexylcarbonyl-10 anthrone ........ ..... 0,50 g- chlorure stanneux ......................................... ..... 0,30 g
- myristate d'isopropyle ~SP ................................ ... 100,00 g
* (marque de commerce)
,