Note: Descriptions are shown in the official language in which they were submitted.
~L~ 7~ f~
La presente est une demande divisionnaire
de la demande canadienne No. 511.227, deposee le 10 juin 1986
et relative à de nouvelles metaphenylènediamines nitrées ha-
logenees en position 6, à leur procede de preparation et aux
compositions -tinc-toriales pour fibres keratiniques, en parti-
culier pour cheveux humains les contenant.
On utilise, depuis de nombreuses annees, dans le
procédé de teinture des cheveux dit semi-permanent, des colo-
rants directs de la famille des dérivés nitres de la serie
10 ~enzénique. De tels colorants directs sont également utilises
en coloration d'oxydation ou coloration dite "permanente"
en vue d'apporter des reflets aux couleurs de base obtenues
avec les precurseurs de colorants d'oxydation.
La Demanderesse a decouvert de nouveaux colorants
jaunes pouvant être utilises en coloration directe ou en
coloration d'oxydation pour apporter des reflets complementai-
res à la coloration de base. Ces nouveaux composés confèrent
aux cheveux des couleurs stables au lavage, à la lumière
et aux intempéries et se distinguent particulièrement par
20 leur bonne résistance aux lavages.
Tel que décrit dans la demande canadienne No.
511.227, les nouveaux composes conformes à l'invention repon-
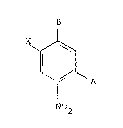
dent à la formule générale:
N~R'
X ~
(I)
I NHR
N02
--1--
J~f~
dans laquelle X désigne un atome d'halo~ène, R et R' dési~nent
indépendamment l'un de l'autre un atome d'hydrogène ou un
radical alkyle, polyhydroxyalkyle, hydroxyalcoxyalkyle,
alcoxyalkyle ou aminoalkyle éventuellement substitué sur
l'atome d'azote, sous reserve qu'au moins un des groupements
R et ~' représente un radical polyh~dro~yalkyle, alcoxyalkyle
ou hydroxyalcoxyalkyle.
Dans la formule (I) ci-dessus, X désigne de prefe-
rence un atome de chlore, de brome ou de fluor. R et R'
déslgnent de préférence un radical alkyle en Cl-C6, pol~-
hydroxyalkyle en C2-C6, hydroxyalcoxy C2-C4 alkvle en Cl-C4,
alcoxy Cl-C3 alkyle en Cl-C6 ou aminoalkyle en Cl-C6 éven-
tuellement substitué sur l'atome d'azote. Les substituants
de ~'atome d'azote sont choisis de préference parmi les grou-
pements alkyle en Cl-C4 et hydroxyalk~le en Cl-C4.
Parmi les groupements R et R' representes par poly-
hydroxyalkyle, alcoxyalkyle, hydroxyalcoxyalkyle pre~eres,
on peut citer les groupements:
CH2 CH2 3
-CH2-CHOH-CH2OH
-CH2-CH2-O-CH2-CH2OH
-CH2-cH2-cH2-o CH3
; Les composes particulierement preferes conformes
à l'invention sont ceux pour lesquels X désigne un atome
de chlore.
Les composés de formule (I) selon l'invention peuvent
être préparés selon différents procédés de préparation.
Un premier procede peut consister à faire réasir
une amine aliphatique de formule RNH2 sur une p-nitroaniline
dihalogénée de formule (II) à une température comprise entre
,i .
--2--
20 et 180C en présence eventuellement dlun solvant tel que
l'eau, les alcools inferieurs, le dioxane, les éthers d'ethy-
lèneglycol ou de diéthylèneglycol, conformément au schema
;reactionnel ci-dessous:
NHR' NHR'
" X ~ RNH 2 X ~
X ~ NHR
NO2 NO2
~II) (I)
Les composés de formule (II) sont obtenus par des
procédes connus en.eux-memes. Ils peuvent ainsi etre préparés
en partant de l'aniline dihalogénée de formule (III) que
l'on transforme en monoarylsulfonamide de formule (IV) par
action d'un arylsulfochlorure suivant le procédé décrit dans
le brevet fransais numéro 1.491.617. Le composé intermédiaire
de formule (IV) est nitré par llacide nitrique concentré
dans l'acide acétique dilué en présence de nitrite de sodium
et en chauffant au reflux pour former le composé de formule
tV) selon le schéma réactionnel suivant:
NH2 NHS02Ar NHS02Ar
X~ X~ X~f~
Tosylation ~ Nitration ~ X
(III) (IV) . (vN)2
En soumettant le composé de formule (V) à l'hydro-
lyse acide comme décrit dans le brevet français numéro
1.491.617, on obtient le composé de formule (II) dans lequel
Rl désigne H.
--3--
7~5'`~
Par action d'un halogénure de formule YR', dans
laquelle Y désigne un atome d'halogène et R' a la significa-
tion indiquée pour la formule (I), sur le compose de formule
(V) en presence de carbonate de potassium dans un solvant
tel que le diméth~lformamide, on obtient un composé de formule
(VI) qui, par hydrolyse acide, conduit au composé de formule
(II) dans lequel R' a les significations mentionnées ci-dessus
à l'exception de H, selon le schéma réactionnel suivant:
NHSO2Ar N \ NHR'
X~ X ~ S02Ar X ~,~\
'I 11 ~ I 11 ~> I 11
~ YR' ~ Hydrolyse ~ X
N02 N02 N02
(V) (VI) (II)
Vn second prccédé de prépa'ation des composés con-
.formes à l'invention peut consis er à faire réagir une amine
aliphatique de formule R'NH2 dans laquelle R' a la signifi-
cation indiquée dans la formule (I) sur une o-nitraniline
dihalogénée de formule (VII) à une température comprise entre
20 et 180C en présence éventuellement d'un solvant tel
que l'eau, les alcools inférieurs, le dioxane, les éthers
d'ethylèneglycol ou de diethylèneglycol selon le schema reac-
tionnel suivant:
X NHR'
X ~ R'NR2 X ~ NHR
NO2 NO2
(VII) _4_
'
7~ ~
Le composé de formule (VII) dans laquelle R estdifférent de l'atome d'hydroyene est obtenu par réaction
d'une amine de ormule RNH2 dans laquelle R a la signification
indiquée dans la formule (I) sur le trihalogéno-2,4,5 nitro-
benzène.
Lorsque R représente un atome d'hydrogène, le compo-
sé de formule (VII) est obtenu par action de NH3 en présence
d'alcool sur le trihalogéno-2,4,5 nitrobenzène ou par toute
autre méthode décrite dans la littérat~re (BEIL 12 p. 734
e~ E II 12, p. 399; BEIL 12 p. 741 ou E III, p. 1676).
Un troisième procédé de préparation des composés
conformes à l'invention peut consister, lorsque dans la formu-
le (I) R a la meme signification que R', différente d'hyclro-
gène, à faire réagir l'amine RNH2 sur le trihalogeno-2,4,5
nitrobenzène en présence éventuellement d'un solvant tels
que ceux définis ci-dessus, selon le schema réactionnel suivant:
X I ~HR
`~1~ RNH 2 X ~
X NHR
N02 N02
(VIII~ (I')
: Les composés intermediaires répondant à la formule
(II)
NHR' ~.
~ (II)
~X
N02
5~
dans laquelle R' désigne un radical alkyle en Cl-C6, poly-
hydroxyalkyle en C2-C6, hydroxyalcoxy (C2-C4) alkyle (Cl-C4),
alcoxy (Cl-C3) alkyle (Cl-C6) ou aminoalkyle en Cl-C6 éven-
tuellement substitué sur l'atome d'azote et X est un atome
d'haloqène, sont nouveaux et constituent un autre aspect de
l'invention.
La presente invention a donc pour objet les nou-
veaux composés intermédiaires de formule (II) ci-dessus, ainsi
que les composés de formule (VII):
X ~
(VII)
I NHR
dans laquelle R désigne un radical alcoxy ~C1-C3) alkyle
(Cl-C6) ou hydroxyalcoxy (C2-C4) alkyle (Cl-C4) et X désigne
halogène, qui sont également nouveau~.
Le substituant de l'atome d'azote peut être un
groupement défini en relation avec les composés de formule
(I).
Les composés de formule (I) définis ci-dessus sont
essentiellement utilisables pour la teinture des fibres kéra-
tiniques et en particulier des cheveux humalns.
Dans cette application, ces composés sont mis en
oeuvre dans des compositions essentiellement caractérisées
par le fait qu'elles contiennent dans un milieu solvant cos-
métiquement acceptable au moins un composé répondant a la
formule (I) dans une proportion suffisante pour la coloraticn
directe des fibres kératiniques ou pour conférer des reflets
complémentaires à la coloration de base obtenue par dévelop-
pement oxydant des colorants d'ox~dation dans le cas où ils
,
--6--
sont utilises dans des compositions tinctoriales d'oxydation.
Ces compositions contiennent les composes selon
l'invention dans des proportions comprises de preference
entre 0,001 et 5~ en poids, et plus preferablement entre
0,01 et 3~ en poids, par rapport au poids total de la compo-
sition tinctoriale.
Elles peuven contenir en outre, des agents tensio-
actifs anioniques, cationiques, non-ioniques, amphotères
ou leur melange. Ces agents tensio-actifs sont presents
dans les compositions de l'invention dans des proportions
comprises de preference entre 0,5 et 55% en poids, et en
particulier entre 4 et 40% en poids, par rapport au poids
total de la composition.
Le milieu cosmetiquement acceptable est generalement
constitue par de l'eau mais on peut egalement ajouter dans
ces compositions des solvants organiques pour solubiliser
les composes qui ne seraient pas suffisamment solubles dans
l'eau. Parmi ces solvants, on peut citer les alcools benzy-
lique de phenylethylique, les alcanols inferieurs tels que
l'ethanol et l'insopropanol, les polyols tels que le glycerol,
les glycols ou ethers de glycol comme le butoxy-2 ethanol,
l'ethylèneglycol, le monoethylether d'ethylèneglycol, le
propylèneglycol, le monoethylether et le monoethylether et
le monomethylether du diethylèneglycol, ainsi que les produits
analogues et leur melange. Ces solvants sont de preference
presents dans des proportions allant de 1 à 75% en poids,
et en particulier de 5 à 50% en poids, par rapport au poids
total de la composition.
Les compositions peuvent être epaissies de prefe-
rence avec des composes choisis parmi l'alginate de sodium,la gomme arabique, la gomme de xanthane, les derives de la
~7~
cellulose tel que la méthylcellulose, l'hydroxyéthylcellulose,
l'hydroxypropylméthylcellusose, la carboxyméthylcellulose
et les polymères divers ayant la fonction d'épaississant
tels que plus particulierement des dérivés d'acide acrylique.
Il es-t également possible d'utiliser des agents épaississants
mineraux tels que la bentonite. Ces agen-ts epaississants
sont presents de preference dans des proportions comprises
entre 0,1 et 10~ en poids, et en particulier entre 0,5 et
36 en poids, par rappor. au poids total de la composition.
Les compositions selon l'invention peuvent egalement
contenir differents adjuvants habituellement utilisés dans
les compositions tinctoriales pour cheveux, tels que des
agents de pénetration, des agents sequestrants, des agents
filmogenes, des tampons et des parfums.
Ces compositions peuvent se presenter sous des formes
diverses telles`que liquide, crème, gel ou toute autre forme
appropriee pour realiser une teinture des cheveux. Elles
peuvent en outre être conditionnees en~lacons aerosols en
presence d'un agent propulseur.
Le pH de ces compositions tinctoriales peut être
compris entre 3 et 11,5 et de preference entre 5 et 11,5.
On l'ajuste ~ la valeur souhaitee à l'aide d'un agent alca-
linisant tel que l'ammoniaque, les carbonates de sodium,
de potassium ou d'ammonium, les hydroxydes de sodium ou de
potassium, les alcanolamines telles que la mono-, la di-
ou la triethanolamine, les alkylamines telles que l'ethylamine
ou la triéthylamine ou à l'aide d'un agent d'acidification
tel que les acides phosphorique, chlorhydrique, tartrique,
acetique, lactique ou citrique~
Lorsque les compositions sont destinees à être
~ 3~
utilisées dans un procéde de coloration directe de cheveux,
elles peuvent contenir en plus des colorants conformes à
l'invention, d'autres colorants directs tels que les coloran-ts
azoïques tel que l'amino-4-methyl-2'-N,N~ hydroxyéthyl)
amino-4' ~phénylazobenzène ou anthraquinoniques, comme par
exemple la tetra-amino-1,4,5,8 anthraquinone, des colorants
nitrés de la série benzénique différents des composés de
formule (I), et plus particulièrement les composés suivants:
- la méthyl-2 nitro-6 aniline,
- le nitro-3 amino-4 phénol,
- le nitro-3 N-~ -hydroxyethylamino-4 phenol,
- le nitro-3 amino-4 methyl-6 phénol,
- l'amino-3 nitro-4 phénol,
- l'amino-2 nitro-3 phénol,
- le nitro-3 N-~ -hydroxyéthylamino-6 anisole,
- le N- ~, y-dihydroxypropylamino-3 nitro-4 anisole,
- le ~N-methylamino-3, nitro-4) phenoxyethanol,
- le (N-méthylamino-3, nitro-4) phényl ~, ~-dihydro-
. xypropyléther,
- la N,N' (-~ -hydroxyéthyl) nitroparaphénylènediami-
ne,
- la nitro-3,N'-méthylamino-4,N,N di-~ -hydroxyéthyl-
aniline,
- le (nitro-3,N-~ -hydroxyéthylamino-4) phenoxyetha-
nol,
- le (nitro-3,N-~ -hydroxyethylamino-4) phényl
~, ~-dihydroxypropylether.
Les concentrations de ces colorants directs autres
que les colorants de formule (I) peuvent être comprlses entre
30 0,001 et 5~ en poids par rapport au poids total de la compo-
sition.
_g_
~ 7~ D~
Une forme de realisa-tion particulièrement interes-
sante reside dans l'utilisation des colorants de formule
(I) avec des colorants nitrés benzéniques bleus ou vlolets
répondant à la formule (IX):
NHR2
~b No2
(IX)
\
R4
dans laquelle R2 désigne un atome d'hydrogène, un radical
alkyle inferieur ayant de préférence 1 à 4 atomes de carbone,
un radical monohydroxyalkyle ayant de préférence 2 à 4 atomes
de carbone ou polyhydroxyalkyle ayan. de préférence 2 à 4
atomes de carbone, alcoxy (Cl-C4) alkyle (Cl-C4), R3 et R4
ont séparément les mêmes significations que R2 mais ne peuvent
pas désigner un atome d'hydrogène.
Ces colorants peuvent être utilisés sous forme
de bases libres ou de sels.
Des colorants nitrés benzéniques bleus ou violets
particulièrement intéressants utilisables avec les composés
de formule (I) sont choisis parmi:
- le N-méthylamino-2, N,N-bis~ -hydroxyéthylamino-5
nitrobenzène,
- le N-méthyl amino-2 (N-méthyl, N-~ -hydroxyéthyl)
amino-5 nitrobenzène,
- le N- ~-hydroxyéthylamino-2-N,N-bis-~ -hydroxye-
thylamino-5 nitrobenzène,
.
--10--
~L~7g~
- le N-~ -hydroxyethyl amino-2-(N-methyl, N-~ -hy~
droxyéthyl) amino-5 nitrobenzène,
- le N- ~ -hydroxypropylamino-~-N,N-Dls~~ -hydroxy-
ethyl, amino-5 nitrobenzè.ne,
- le N-méthylamino-2-(N-methyl, ~ dihydro-
xypropyl) amino-5 nitrobenzène,
- l'amino-2~ -bis ~-hydroxyethylamino 5-nitro-
benzène,
- le (N-éthyl, N-~ -hydroxyethyl) amino-4, ~-hydro-
xyethylamino-l nitro-2 benzène,
- le ~ dihydroxypropylamino-l, nitro-2~ -méthyl,
N- ~-hydroxyéthyl) amino-4 benzène,
- le ~-methoxyéthylamino-l, nitro-2, di ~-hydro-
xyéthyl amino-4 benzène.
Ces colorants sont présents dans les compositions
: conformes à l'invention dans les proportions indiquées
ci-dessus.
Le procédé de teinture des fi~res keratiniques,
en particulier des cheveux humains mettant en oeuvre ces
colorants et les compositions indiquees ci-dessus, consiste
à appliquer les compositions pendant un temps de pose de
5 à 40 minutes sur lesdites fibres, à les rincer, à les laver
eventuellement, à les rincer à nouveau et à les secher.
~ .e autre forme de realisation des compositions
conformes à l'invention est l'utilisation sous forme de lotion
capillaire colorante de mise en plis conferant tout a la
fois aux cheveux une legère coloration et ameliorant la tenue
de la mise en plis. Elle se presente dans ce cas sous orme
de solution aqueuse, alcoolique ou hydro-alcoolique renfermant
au moins une resine cosmétique et son application s'ef~ectue
sur des cheveux humides, préalablement lavés et rinces~ qui
sont eventuellement enroulés puis sechés.
--11--
~ 3~
Les résines cosmétiques utilisées dans les lotions
de mise en plis peuvent être en particulier la polyvinylpyr- -
rolidone, les copolymères acide crotonique-acétate de ~inyle,
vinylpyrrolidone-acétate de vinyle, anhydride maléique-éther
~utylvinylique, anhydride maleique-ether methylvinylique,
ainsi que tout autre polymère cationique, anioniaue, non-ioni-
que ou amphotère, habituellement utilisé dans ce type de
composition. Ces resines cosmetiques entrent dans les compo-
sitions de l'invention à raison de 1 à 3% en poids, et de
pre~erence de 1 à 2% en poids, par rapport au poids total
de la composition.
Lorsque les compositions conformes à l'inven-tion
constituent des compositions tinctoriales d'oxydation, les
composés repondant à la formule (I) sont essentiellemen-t
utilisés en vue d'apporter des reflets complementaires à
la teinture finale.
Ces compositions contiennent alors en association
avec au moins un colorant nitré de formule (I) des précurseurs
de colorant par oxydation. Elles peuvent contenir par exem-
ple des p-phénylènediamines telles que la p-phénylènediamine,
la p-toluylènediamine, la diméthyl-2,6 p-phénylènediamine,
la diméthyl-2,6 méthoxy-3 p-phénylènediamine, la N-~ -métho-
xyethyl p-phénylènediamine, la N,N-di- ~-hydroxyéthylamino-4
aniline, la N,N-(e-thyl, carbamylméthyl) amino-4 aniline,
ainsi que leurs sels.
Elles peuvent contenir également des paraaminophénols
comme par exemple le paraaminophénol, le N-méthyl paraamino-
phénol, le chloro-2 amino-4 phénol, le chloro-3 amino-4 phénol
et leurs sels.
Ces compositions peuvent également contenir des
dérivés hétérocycliques de la pyridine ou de la morpholine
-12-
tels que par exemple la diamino-2,5 pyridine, l'amino-7 ben-
zomorpholine.
Comme cela est bien connu, les compositions tinc-
toriales d'oxydation contenant les colorants nitrés de formule
(I) peuvent contenir, en association avec les précurseurs
de colorants par oxydation de type para, eventuellement des
précurseurs de colorants de type ortho, ainsi que des coupleurs
bien connus dans l'état de la technique. A titre de coupleurs,
on peut citer notamment: les métadiphénols tels que résorcine,
la methyl-2 resorcine, les metaaminophenol, le methyl-2 amino-5
phenol, le méthyl-2 N-(~ -hydroxyéthyl) amino-5 phenol,
l'hydroxy-6 benzomorpholine et leurs sels, les métaphénylè-
nediamines telles que le (diamino-2,4) phénoxyéthanol, le
N-~ -hydroxyéthylamino-4 amino-2 anisole, l'amino--6 benzomor-
pholine, le N-(~ -hydroxyéthylamino-2 amino-4) phenoxyethanol,
le (diamino-2,4-phényl~ -dihydroxypropyléther et leurs
sels, les métaacylaminophénols, les métauréidophénols, les
métacarbalcoxyaminophénols tels que le méthyl-2 acetylamino-5
phénol, le méthyl-2 uréido-5 phénol, le méthyl-2 carbethoxya-
mino-5 phenol.
On peut enfin mentionner comme autres coupleurs
utilisables l'o~-naphtol, les coupleurs possedant un groupement
méthylène actif tels que les composés dicétoniques et les
pyrazolones et les coupleurs héterocycliques derives de la
pyridine, comme par exemple la diamino-2,4 pyridine, ainsi
que leurs sels.
Ces compositions contiennent en plus des précurseurs
de colorants par oxydation, des agents réducteurs tels que
plus particulièrement le sulfite de sodium, l'acide thiogly-
colique, l'acide thiolactique, le bisulfite de sodium, l'acide
~a~}~
ascorbique et l'hydroquinone. Ces agents anti-oxydants sont
présents dans des proportions comprises entre 0,05 et 1,5
en poids par rapport au poids total de la composition.
Les précurseurs de colorants par oxydation peuvent
être utilisés dans les compositions de l'invention à des
concentrations comprises entre 0,001 et 5% en poids, et de
preférence entre 0,03 et 2~ en poids sur la base du poids
total de la composition. Les coupleurs peuvent etre présents
dans des proportions comprises entre 0,001 et 5~ en poids,
10 et de préférence entre 0,015 et 2% en poids.
Le pH de ces compositions est de préférence compris
entre 7 et 11,5 et il est ajusté à l'aide d'agents alcalini-
sants définis ci-dessus.
Le procédé de teinture des fibres kératiniques,
en particulier des cheveux humains, mettant en oeuvre une
composition tinctoriale d'oxydation consiste à appliquer
sur les cheveux la composition tinc~oriale comprenant à la
fois le colorant selon l'invention et les precurseurs de
colorants et à dévelop~er la coloration à l'aide d'un agent
oxydant présent dans la composition tinctoriale ou blen appli-
qué sur les cheveux dans un deuxième temps.
L'agent oxydant est choisi de préférence parmi
l'eau oxygénée, le peroxyde d'uree et les persels et on utilise
en particulier une solution d'eau oxygénée à 20 volumes.
Une fois que l'on a applique sur les fibres kerati-
niques la composition avec l'agent oxydant, on laisse poser
pendant 10 à 50 minutes, et de preference 15 à 30 minutes,
après quoi on rince les fibres kératiniques, on les lave
éventuellement au champooing, on les rince à nouveau et on
sèche.
Les composés de formule (I) peuvent egalement etre
.,
-14-
appliques dans des procedes en plusieurs temps, comportant
au moins une etape consistant à appliquer le coloran-t de
formule (I) sur les fibres dans des conditions et dans des
proportions suffisan-tes pour le colorier.
Les exemples suivants sont destines à illustrer
l'invention sans pour autant presenter un caractère limitatif.
EXEMPLE-DE-PREPARATIQN ~
-
Pr~pa~atio~-de-la dichloro-2~5-nitr~-4-aniline intermediaire
NH2
Cl ~ ~
~ Cl
N02
N-~ NHS02 ~ ~lS0
Cl ~ lè~e etapel ~ 2ème etape ~
~Cl ~Cl ~\Cl
~2
~H2
3ème étape ~ ~
Cl
N02
-15-
3-~7~ ~,f~
lère-étape:
Préparation-de la-dichloro-2,5-N-beRzènesulfonyl
aniline
On dissout 1 mole (162g) de ~chloro-2,5 aniline
dans 650 ml de pyridine, on ajoute 1~1 mole (138 ml) de chlo-
rure de benzènesulfonyle, la temperature etant comprise entre
35 et 45C. Après 2 heures de chauffage, on coule le milieu
reactionnel dans un mélange de 2 kg de glace dans 2 1 d'eau
additionnés de 550 ml d'acide chlorhydrique concentré. Le
précipité ainsi obtenu est essoré, lavé à l'eau. Par traite-
ment à la soude normale on élimine un insoluble. Par neutra-
lisation à l'acide chlorhydrique concentré, le produit atten-
du précipite du filtrat. Il fond à 132C.
2ième etape:
Préparation.de la-dichloro-2,5 nitro-4~N-benzène
sulfonyl-aniline
On ajoute à 825 ml d'acide acétique dilué par-un
égal volume d'eau, 2,8 g de nitrite de sodium, 0,41 mole
(125 g) de dichloro-2-,5 N-benzènesulfonyl aniline préparée
à l'étape précédente et 2,44 moles (102 ml) d'acide nitrique
(d = 1,52). On porte le milieu réactionnel au reflux pendant
1 heure. Après refroidissement du milieu réactionnel, on
essore le produit attendu. On le lave à l'eau, puis on le
recristallise de l'acide acétique. Il fond à 180C.
3ème étape:
Préparation de la-dichloro-2,5-nitro-4-aniline
On met en suspension dans 600 ml d'acide sulfuri-
que concentré 0,44 mole (154 g) de dichloro-2,5 nitro-4 ben-
zènesulfonyl aniline préparée à l'étape précédente. Après
24 heures d'agitation à température ambiante, le milieu
.
: .
-16-
~'7~
reactionnel est verse sur 5 kg de glace. Le produit attendu
precipite. Apres lavage à neutralite et sechage, il fond
à 156QC.
L'analyse du produit ob~enu donne les resultats
suivants:
Analyse Calcule pour Trouve
C6H4Cl2~2o2
C 34,78 34,62
H 1,93 1,98
N 13,53 13~40
O 15,46 15,66
Cl 34,30 34,2
XEM~LE DE PRE~ARATION B
Pre~aration-de la-~ichloro-2,5-nitro-4 N-ethylaniline
intermediaire
NE~C2H5
Cl ~ ~ Cl ~ SOZ
Cl lère etape ~ Cl
N02 N2
~ 2H5
2ème étape ~ Cl
N02
-17-
3~
lère-etape:
:
Preparation de-la-dichloro-2,5-nitro-4-N, ~~éthyl-
benzène sulfo~yl) aniline
On chauffe à 110C pendant 8 heures le melange
constitue de 0,29 mole (107 g) de dichloro-2,5 nitro-4 N-ben-
zène sulfonyl aniline, de 0,3 mole (41 g) de carbonate de
potassium et de 0,6 mole (62,4 ml) d'iodure d'ethyle dans
600 ml de diméthyl~ormamide. On coule le milieu reactionnel
sur 2,5 kg d'eau glacee. Après essorage et lavage, le produit
obtenu est recristallise de 450 ml d'acide acetique. Après
sechage, il fond à 125C.
2ème etape:
Preparation-de la dichloro-2,5 nitro-4 N-ethylaniline
A 340 ml d'acide sulfurique concent~e, on ajoute
à 0C, 0;23 mole (84,7 g) de dichloro-2,5 nitro-4 N,N(ethyl
benzènesulfonyl) aniline préparé à l'etape precedente, la
temperature atteint 20C. Après 4 heures d'agitation, le
milieu reactionnel est verse dans de l'eau glacee. Le produit
attendu precipite. Après lavage à neutralite et séchage
sous vide, il est recristallise du benzène. Il ~ond à 105C.
L'analyse du produit obtenu donne les resultats
suivants:
AnalyseCalcule pour Trouve
C8H8N202C12
C 40,88 .40,94
H 3,43 3,48
N 11,92 11,90
o 13,61 13,76
Cl 30,16 30,05
~,7g~
EXEMPLE - DE - PREPAR~TION - C
NHC2H5
T NHCH2CEI20CH2CH20H
N02
Préparation de la-chloro-2~ hyd~oxyéthoxy)
éthylami~o-nitro-4 N-éthyl aniline
On porte au bain-marie bouillant pendant 30 rninutes,
0,01 mole (2,35 ~) de dichloro-2,5 nitro-4 N-ethylaniline
dans 10 ml de ~( ~ '-hydroxyéthoxy) éthylamine.
Après refroidissement, le milieu réactionnel est
dil~é par 100 ml dleau glacée. Le produit attendu précipite.
Apres séchage, il est recrlstallise de l'acétate d'ét~yle,
une filtration a chaud permet d'éliminer un insoluble noir.
Il fond à 100C.
L'analyse du produit obtenu donne les résultats
suivants:
Analyse Calcule pour Trouvé
Cl 2H1 8N304Cl
C 47,45 47,24
H 5,97 6,02
N 13,83 13,80
o 21,07 21,21
Cl 11,67 11,91
-19-
~L2~ 35~
EXEMPLE DE-PREP~RATION-D
NH2-
Cl ~ ~ ~
NHCH2CHOHCH20H
N02
Préparation-de la chloro-2-N~ dihydroxypro-
pylamino-5-nitro-4 aniline
On chauffe à 110C 0,025 mole (5,14 g) de dichlo-
ro-2,5 nitro-4 aniline, 7,5 g d'amino-3 propanediol-1,2 dans
15 ml d'éther dimethyliaue du diethylène glycol addi-tionné
de 5 ml d'eau.
O~ mai~tient le ChGU~fag2 pendar.t 5 h~ure~. ~pres
10 dilution du milieu reactionnel par 150 ml d'eau glacée, le
produit attendu précipite. Après essorage et séchage, il
est recristallisé d'un mélange dioxane-éthanol. Il fcnd--à
205C.
L'analyse du produit obtenu donne les résultats
suivants:
Analyse Calculé pour Trouvé
C9H12N34Cl
C 41,31 41,33
H 4,62 4,68
N 16,06 16,11
o 24,46 24,73
Cl 13,55 13,68
-20-
XEMPLE-DE-~R ~ARATION-E
NHCH2CH20CH
Cl \ ~ ~
NHCH2CH2NH2
N02
Preparation du chlorhydrate de-la chloro-2~ -ami-
noéthylamino-5 nitro-4 N-~ -méthoxyéthyl aniline
lère-étape:
Pré~aration de la dichloro-4,5 n t
noéthyl~aniline
A une solution de 78 g d'éthylènediamine dans 100 ml
d'e-thanol à 96 et 117 ml d'eau, on ajoute à 0,13 mole (30,6 g)
de trichloro-1,2,4 nitro-5 benzene. Après lh30 de chauffage
au reflux, le milieu réactionnel refroidi. Après dilution
à l'eau glacée le produit attendu precipite. Il fond à
84C-87C.
2ème étape:
Preparation du chlorhydrate de la-chloro-2 ~-amino-
ethylamino-5 nitro-4 N-~--methoxyethylaniline
On chauffe au bain marie bouillant pendant 4h30
0,1 mole ~28,6 g) de dichloro-4,5 nitro-2 N-~ -aminoethyla-
nillne preparee à la lère etape dans 60 ml de methoxy-2
ethylamine. Après refroidissement et dilution par 200 ml
d'eau glacee le precipité est recristallisé de l'isopropanol.
Solubilise à chaud dans un melange hydroalcoolique additionne
d'acide chlorhydrique, le produit attendu precipite sous
forme de chlorhydrate. Il se decompose à 260-265C.
-21-
~Y~
L'analyse du produit obtenu donne les résultats
suivants: -
AnalyseCalcule pour Trouvé
cllH18N403C12
C~ 40,63 40,66
H~ 5,58 5,29
N~ 17,23 17,38
EX~MP~E-D~-PREP~RATIQ~-F
Cl NHCH2CH20CH3
NHCE~2CH20CH3
N02
Preparation de_la chloro-2 ~-methoxyethylamlno-5
nitro 4-N-~ -methoxyethylanlline
On chauffe au reflux 0,9 mole (67,6 g) de 2-metho-
xyethyl amine dans 30 ml de dioxane. On ajoute par portions
0,15 mole (34 g) de trichloro-1,2,4 nitro-5 benzène. On
chauffe 4 heures au reflux. Après refroidissement, dilution
à l'eau glacee et neutralisation par l'acide chlorhydrique
concentre. On essore le produit attendu. Recristallise
de l'ethanol à 96, il fond à 106C.
L'analyse du produit obtenu donne les resultats
suivants:
AnalyseCalcule pour Trouve
12H18 304Cl
C% 47,45 47,66
; H~ 5,97 6,01
N% 13,83 13,76
0% 21~07 21,23
Cl~11,67 11,81
EXEMPI.E-DE-PR~P~R~TIQN-G
2CH2CH20CH3
Cl~ ~ ~
I ~HCH3
N02
Preparation de la-chloro-2-methylamino-5 nitro-4
N- ~ -methoxypropyl aniline
lère etape:
Preparation de la dichloro-4,5 nitro-2 N-methyla-
niline
On introduit à temperature ambiante 0,3 mole (68 g)
de trichloro-1,2,4 nitro-5 benzène dans 200 ml d'une solution
de methylamine à 33~ dans l'éthanol, la température atteint
50C. On maintient la température 1 heure. Apres refroidis-
sement, dilution par un litre d'eau ~lacée et neutralisation
par l'acide chlorhydrique concentré, on essore le produit
attendu. Après purification par l'ethanol à 96 au reflux
afin d'eliminer un insoluble, puis recristallisation de l'acé-
tate d'isopropyle, il fond à 145C.
L'analyse du produit o~tenu donne les résultats
suivants:
AnalyseCalcule pour Trouve
C7H6N2O6cl2
C% 38,04 38,02
H% 2,73 2,73
N~ 12,67 12,79
o% 14,48 14,44
Cl~ 32,08 31,97
~;~71)~
2ème-etape: -.
.
Préparation-de la-chloro-2 méthylamino-.5.nitro-4
N- ~ -méthoxy propylaniline
On chauffe au bain marie bouillant pendant 4 heures
0,059 mole (13 g) de dichloro 4,5 nitro-2 N-méthylaniline
préparée à l'etape precedente dans 40 ml de 3-methoxypropy-
lamine. Après dilution à l'eau glacée, acidification par
l'acide chlorhydrique concentré, on essore le produit attendu.
Recristallisé de l'éthanol à 96, il fond à 99C.
L'analyse du produit obtenu donne les resultats
suivants:
Analyse - Calcule pourTrouve
CllH16N3O3Cl
C% 48,27 48,3~
H% 5,89 S,91
N% 15,35 15,38
0~ 17,54 17,55
Cl% 12,95 12,90
- EXEMPLE DE-PREPA~ATION-~
NHCH2CH0HCH20H
Cl ~
~ NHCH2CHOHCH2OH
N02
Preparation de-la-chloro-2 ~ dihydroxypropyla-
mino-5-nitro-4 N-~ -dihydroxypropylaniline
On chauffe 5 heures au reflux 0,15 m~le (34 g)
de trichloro 1,2,4-nitro-5 benzène et 0,9 mole (82 g) d'ami-
no-3 propanediol-1,2 dans 30 ml dioxane.
-24-
7~5'-~
On dilue le milieu réactionnel par 1 litre d'eau
glacee après neutralisation par l'acide chlorhydrique concen-
tre à pH 7, le produit attendu est séparé du milieu réaction-
nel par chromatographie sur colonne par élution par un mélange
hydroalcoolique (65~ eau-35% methanol). Apres evaporation,
on obtient un extrait que l'on recristallise de l'éthanol
à 95 . Il fond à 129 C.
L'analyse du produit obtenu donne les resultats
suivants:
AnalyseCalcule pour Trouve
Cl2Hl8clN3o6
C% 42,92 42,93
H% 5,3G 5,~1
N~ 12,52 12,S9
0% 28,61 28,76
Cl~ 10,58 10,37
EXEMPLE DE COMPO5ITION5 TIN~TORI~LE5
Les marques de commerces mentionnees dans ces
.exemples designent les produits suivants:
20 CELLOSI~E WP 03 - hydroxy éthylcellulose vendu par la
Societe UNION CARBIDE
ALFOL C 16/18 - alcool cétylstéarylique vendu par
la Societé CONDE~
CIRE DE LANETTE E - cétylstéaryl sulfate de sodium vendu
par la Société HENKEL
CEMULSOL B - huile de ricin éthoxylée vendu par
la Societé RHONE POULENC
COMPERLAN KD - diéthanolamide d'acide gras de coprah
vendu par la Société HENKEL
30 EUTANOL G - octyl-2 dodécanol vendu par la Societe
HENKEL
-25-
MERGITAL C.S. - alcool cetyl stearylique a 15 moles
O.E. vendu par la Société HENKEL
TRILON B - acide éthylène diamine tétracétique
CEMULSOL NP 4 - nonylphénol à 4 moles d'oxyde d'éthylè-
ne vendu par la Societé RHONE POVLENC
CEMULSOL NP 9 - nonylphenol à 5 molec; d'oxyde d'éthy-
lène vendu par la Societe RHONE POVLENC.
EXEMPLE 1
On prepare la composition tinctoriale suivante:
Chloro-2 N- ~, ~-dihydroxypropylamino-5 nitro-4
aniline 0,05 g
Butoxy-2 éthanol 10 g
CELLOSIZE WP 03 (marque de commerce)2 g
Chlorure de cétyl dimethyl hydroxyethyl
amonium 2 g
Triethanolamine en solution aqueuse à 1~ 0,5 g
Eau qsp 100 g
Le pH est égal à 7,5
Ce mélange, applique 40 minutes à 28C sur cheveux
decolores, leur confère, après champooing et rinçage, une
coloration jaune dore.
EXEMPLE 2
On prépare la composition tinctoriale suivante:
Chloro-2 N-~ , ~ -dihydroxypropylamino-5 nitro-4
aniline 1,8 g
Ethanol à 96 10 g
ALFOL C 16/18 (marque de commerce)8 g
Cire de LANETTE E (marque de commerce) 0,5 g
CEMULSOL B (marque de commerce) 1 g
30 Diéthanolamide oléique 1,5 g
Amino 2-méthyl 2-propan-1-ol en solution à
25~6 0,3 g
-26-
Eau qsp 100 g
Le pH est égal à 10,1
Ce melange, applique 15 minutes à 30C sur cheveux
décolorés, leur confère, après shampooing et rinçage, une
coloration jaune doré à reflets beige.
EXEMPLE 3
On prépare la composition tinctori.ale suivante:
Chloro-2 ~ hydroxyéthoxy) éthylamino-5
nitro-4 N-éthylaniline 0,4 g
10 Butoxy-2 ethanol 20 g
ALFOL C 16/18 (marque de commerce) 8 g
Cire de LANETTE E (marque de commerce) 0,5 g
CEMULSOL B (marque de commerce) 1 g
Diethanolamide olei.que 1,5 g
Amino 2-methyl 2-propan-1-ol en solution à
25% 0,3 g
Eau qsp 100 g
Le pH est egal à 10,5
Ce ~élange, applique 20 minutes à 28C sur cheveux
naturellement blancs à 90%, leur confère, après shampooing
et rinçage, une coloration jaune vert.
EXEMPLE 4
On prepare la composition tinctoriale suivante:
Chloro-2 ~ '-hydroxyéthoxy) éthylamino-5
nitro 4 N-éthylaniline 1 g
Ethanol à 96 10 g
COMPERLAN KD (marque de commerce)2,2 g
Acide laurique 0,8 g
Monoéther ethylique de l'éthylèneglycol 2 g
30 Monoéthanolamine 1 g
Eau qsp 100 g
Le pH est égal à 8
f.~
Ce melange, applique 15 minutes à 30C sur cheveux
decolores, leur confère, après shampooing et rinçage, une
coloration jaune citron lumineux.
EXEMPLE-5
On prepare la composition tinctoriale suivante:
Chloro-2 N-~, ~-dihydroxypropylamino-5
nitro-4 aniline 0,2 g
~-hydroxyethylamino-4 nitro-3 phenol0,06 g
N,N-bis-~ -hydroxyethylamino-4 nitro-2
10 N-(~ -hydroxyethyl) aniline 0,15 g
Butoxy-2 ethanol 20 g
CELLOSIZE WP 03 (marque de commerce) 2 g
Laurylsulfate d'ammonium 5 g
Ammoniaque en solution aqueuse à 4~0,5 g
Eau qsp 100 g
Le pH est egal à 8,3
. Ce melange, applique 20 minutes à 28C sur cheveux
: decolores, leur confère, après shampooing et rinçage, une
coloration champagne rose.
EXEMP~E.6
On prepare le melange tinctorial suivant:
Chloro-2 N- ~, ~-dihydroxypropylamino-5
nitro-4 aniline 0,5 g
N,N-bis( ~ -hydroxyethylamino-4 nitro 2
N- ~-hydroxypropylaniline 0,2 g
Ethanol à 96 10 g
Monoethanolamide d'acide laurique1,5 g
Acide laurique 1 g
CELLOSIZE WP 03 (marque de commerce) 5 g
30 Monoéthanolamine 2 g
Eau qsp 100 y
Le pH est egal à 9~3
-28-
Ce melanye, applique 30 minutes à 30C sur cheveux
blonds fonce, leur. confère, après shampooing et rincage, une
coloration chatain clair.
EXEMPLE-7
On prepare la composition tinctoriale suivante:
Chloro-2N- ~ dihydroxypropylamino-5 nitro-4
aniline 0,3 g
Paraphenylènediamine 0,05 g
Paraaminophénol 0,06 g
10 Résorcine 0,05 g
~-hydroxyéthylamino-4 hydroxy-2 toluène0,03 g
ALFOL C 16/18 tmarque de commerce)19 g
EUTANOL G (marque de commerce) 4,5 g
. MERGITAL C.S. (marque de commerce)2,5 g
Laurylsul~ate d'ammoniurn 10 g
Polymère cationique présentant le motif
récurrent suivant: 4 g
. CH3 CH3 -
_ _ CH3 (C1~3 CH3 Cl~ _
Alcool benzylique 2 g
20 Ammoniaque à 22 ~e 11 ml
TRILON B (marque de commerce) 1 g
Bisulfite de sodium à 35 Be 1,2 g
- Eau qsp 100 g
Le pH est égal à 10,1
1~7~
Au moment de l'emploi, on ajoute 100 g d'eau oxy-
génée à 20 volumes.
Le mélange, applique 25 minutes à 30C sur des
cheveux naturelleme~t blancs à 90~, leur confère, après
shampooing et rinçage, une coloration blond fonce cendre.
EXEMPLE-8
On prépare le mélange tinctorial suivant:
Chloro-2 ~-méthoxyéthylamino-5 nitro-4
N-~ -methoxylethylaniline 0,47 g
10 Butoxy-2-ethanol 10 g
C~MULSOL NP 4 (marque de cornmerce) 12 g
CEMULSOL NP 9 (marque de commerce)15 g
Alcool oléique polyglycérolé à
2 m de glycérol 1,5 g
Alcool oléique polyglycerolé à ~ m de
glycérol 1,5 g
Triethanolamine qsp pH = 9,1
Eau qsp 100 g
Ce mélange applique 20 minutes à 35C sur cheveu~
décolores leur confère après shampooing et rinçage une colo-
ration jaune pale.
EXEMPLE-9
On prépare le mélange tinctorial suivant:
Chlorhydrate de chloro-2 ~-aminoéthylamino-5
nitro-4 N-~ -méthoxyéthylaniline 0,066 g
Ethanol à 96 11,5 g
Ammoniaque à 20% 6,6 g
CELLOSIZE WP 03 (marque de commerce) 2 g
Laurylsulfate d'ammonium 5 g
30 Eau qsp 100 g
pH 10,4
-30-
1 ~7~(3~'L
Ce melange applique 30 minutes à 35C sur cheveux
permanentes leur confère après shampooing et rinçaye une
coloration jaune paille.
EXEMPLE`10
On prepare le melange tinctorial suivant:
Chloro~2 methylamino-5 nitro-4
N- ~-methoxypropylaniline 0,38 g
Ethanol à 96 10 g
ALFOL C 16/18 (marque de commerce)8 g
10 Cire de LANETTE E (marque de commerce) 0,5 g
CEMULSOL B (marque de commerce) 1 g
Diethanolamide.oléique 1,5 g
Triethanolamine 0,5 g
Eau qsp 100 g
pH: 8
Ce melange applique 30 minutes à 35C sur cheveux
naturellement blancs à 90% leur confère après shampooing
et rinçage une coloration jaune pâle.
EXEMPL~ 11
On prepare le melange tinctorial suivant:
Chloro~2 ~ dihydroxypropylamino-5
nitro-4 N- ~, Y-dihydroxypropylaniline2,5 g
Butoxy-2 éthanol 10 g
Ammoniaque a 20% 10 g
CELLOSIZE WP 03 (marque de commerce)2 g
Chlorure de cétyl diméthyl hydroxyéthyl
ammonium 2 g
Eau qsp 10 n g
pH: 11,1
Ce mélange appliqué 25 minutes à 30C sur cheveux
naturellement blancs à 90% leur confère après shampooing
et rinsage une coloration jaune vif.
-31-
1~7~ L
~XEM~LE 12
On prepare le melange tinctorial suivant: ',
Chloro-2 f, ~-dihydroxypropylamino-S
', nitro-4 N-~ dihydroxypropylaniline0,09 g
2-N- ~-hydr~xyethylamino 5-N,N-bis-~ -hydro-
xyethyl amino nitrobenzène 0,1S g
Tetramino anthraquinone 0,1 g
4-amino 2'-methyl 4-di-~ -hydroxyethylaminophenyl
azobenzene 0,05 g
10 CELLOSIZE ~P 03 (marque de commerce)2 g
Lauryl sulfate d'ammonium 5 g
Ethanolamine , qsp pH: 9,7
Eau qsp 100 g
Ce me,lange applique 20 minutes à ~5C sur cheveux
naturellement blancs à 90%, leur confère après shampooing
et rinc,age une coloration bronze cendre.