Note: Descriptions are shown in the official language in which they were submitted.
- ~ 2~S8~
La présente invention concerne un procédé de
préparation électrolytique en bains de sels fondus de terres
rares ou de leurs alliages et un dispositif pour la mise en
oeuvre de ce procedé.
On entend pour terres rares (TR) dans la
description qui suit tout élément appartenant au groupe
formé par l'yttrium et les lanthanides excepté le samarium
l'europium, l'ytterbium et e thullium.
Actuellement, l'électrolyse en milieu fondu d'un
chlorura de terre rare et notamment du néodyme pose des
problème par les très faibles rendements obtenus. ~eci est
dû à une forte solubllité du métal en présence de son
chlorure. Un tel procédé est décrit dans l'article de
T.KURITA (Denku Kagaku, 1967, 35 (7) p. 49~-501). On y
fait état d'un rendement qui n'atteint pas 20~ de néodyme
pur dans le cas d'un bain fondu constitué par du chlorure de
néodyme et du chlorure de potassium.
Un premier objectif de l'invention est donc la
préparation d'une terre rare par voie électrolytique dans
des conditions telles que le procédé soit applicable
industriellement.
Un deuxième objectif de l'invention est la mise au
point d'un procédé de préparation d'alliages de terres rares
qui soit lui aussi transposable industriellement
Enfin un autre objectif de l'invention est
l'élaboration d'un dispositif per~ettant notam~ent la mise en oeuvre
des procédés ci-dessus.
Selon la présente invention, il est prévu un
procédé de préparation d'un métal de terre rare ou d'un
alliage de métal de terre rare avec au moins un métal choisi
dans le groupe des métaux de terres rares et des mé-taux de
transition par électrolyse en bain de sels fondus,
caractérisé en ce qu'on réalise sur électrodes solides,
l'électrolyse d'au moins un chlorure d'une terre rare dans
~J
~ 2765~3~
un bain de sels comprenant essentiellement du chlorure de
lithium et du fluorure de lithium.
Selon la présente invention, il est également
prevu un procédé de préparation de néodyme métal caractérisé
en ce que l'on réalise sur anode en graphite et sur cathode
en tungstène ou en néodyme, l'électrolyse d'un bain
comprenant du chlorure de néodyme, du chlorure de lithium et
du fluorure de lithium.
Selon la présente invention, il est également
prévu un procédé de préparation d'un alliage de néodyme et
de fer caractérisé en ce que l'on réalise sur anode en
graphite et cathode consommable de fer, l'électrolyse d'un
bain comprenant du chlorure de néodyme, du chlorure de
lithium et du fluorure de lithium.
- Selon un mode, réalisation particulièrement
préféré de l'invention, le bain comprend au moins à titre de
métal alcalin du lithium.
L e p ro c é d é e st m i s en o e uv r e
dans unè cellule pour électrolyse en bain de sels fondus,
comprenant une cuve dont le fond est prolongé par une zone
de soutirage, une anode et une cathode sur lesquelles on
réalise l'électrolyse d'au moins un chlorure d'une terre
rare dans un bain de sels, l'anode étant constituée par une
couronne centrée autour de la cathode.
Le procédé peut etre également mis en oeuvre
dans une cellule pour électrolyse en bain de sels fondus,
comprenant une cuve dont le fond est prolongé par une zone
de soutirage, une anode et une cathode sur lesquelles on
réalise l'électrolyse d'au moins un chlorure d~une terre
rare dans un bain de sels, cellule dans laquelle le fond de
la cuve est prolongé par une zone de soutirage constituée
d'une conduite de section transversale interne inférieure à
celle de la cuve, laquelle zone s'ouvre au fond de la cuve
et forme un espace de décantation pour le bain fondu
'~ '
~ ;~76iS8~
- 2a -
recueilli dans cette zone.
La conduite précitée peut s'ouvrir au centre du
fond de la cuve.
Le procédé de l'invention permet d'obtenir un
métal de bonne pureté ou un alliage à haute teneur en terre
rare avec des rendements métal élevés pouvant dépasser 80%
et ceci dans des conditions applicables industriellement.
D'autres caractéristiques et avantages de
l'invention seront mieux compris à la lecture de la
description qui va suivre, et des exemples concrets mais non
limitatifs, de mise en oeuvre du procédé. On fera aussi
réference aux dessins annexés pour lesquels:
- la fig. 1 est une vue en coupe schématique d'un
premier mode de réalisation d'une cellule d'électrolyse
selon l'invention.
- la fig. 2 est une vue en coupe schématique d'un
second mode de réalisation d'une cellule d'électrolyse
selon l'invention.
Comme indiqué plus haut,l'invention concerne la
préparation des métaux et alliages- de terres rares. Elle
s'applique plus particulièrement à la préparation du néodyme
métal à partir du chlorure de néodyme, elle offre en effet
dans le cas du néodyme une amélioration particulièrement
importante du rendement.
L'invention concerne aussi la préparation
d'alliages et notamment la préparation d'alliages à base de
néodyme.
Les alliages susceptibles d'être préparés sont les
alliages entre terres rares exemple Nd-La, Nd-Ce, Nd-Pr ou
bien des alliages entre une ou plusieurs terres rares et un
métal choisi dans le groupe des métaux de transition. On
peut mettre en oeuvre comme métaux de transition tous les
métaux présentant un point de
'~D '
~ z~s~
fusion superieur à la temperature du bain de sel fondu au moment de
l'electrolyse, temperature qui par exemple peut varier entre 650C
et 1100~C. A titre d'exemple de tels metaux, on peut citer le fer,
le cobalt, le nickel et le chrome. C'est ainsi que selon l'invention
on peut preparer notamment les alliages suivants : Nd-Fe, La-Fe,
Nd-La-Fe, Pr-Fe.
Selon l'invention, on part du chlorure de la terre rare
que l'on cherche à preparer sous la forme metal. Pour l'obtention
d'un alliage comprenant plusieurs terres rares on part alors d'un
bain comprenant un melange des chlorures de chacune de ces terres
rares. Ces chlorures doivent de preférence présenter une teneur en
eau inférieure à 6 % en poids.
Le bain qui sert à l'electrolyse comprend outre le ou les
chlorures de terre rare, un ou plusieurs chlorures alcalins ou
alcalino-terreux et un ou plusieurs fluorures alcalins ou alcalino-
terreux.
Il s'est revélé avantageux d'utiliser à titre de métal
alcalin le lithium. La présence d'halogénure de lithium dans le
bain a pour effet d'augmenter nettement le rendement.
Enfin, selon le mode de realisation prefere de l'invention, le
bain comprend au moins un fluorure de lithium et un chlorure de
lithium. Dans ce cas, on obtient genéralement les meilleurs
rendements.
La proportion du ou des chlorures de terre rare du bain
peut varier entre 10 et 70 % en poids, elle est plus particulière-
ment comprise entre 15 et 45 %.
Par ailleurs, la proportion en poids entre le ou les
chlorures alcalins ou alcalino-terreux d'une part et le ou les
fluorures d'autre part varie de préférence entre 1,5:1 et 3:1.
Il est avantageux enfin d'utiliser un bain présentant une
teneur en un ou plusieurs fluorures d'au moins 15 7,.
La temperature du bain durant l'electrolyse est fixée de
manière à être supérieure à la température de fusion du bain
électrolytique.
1~:7~;S~3S
D'une manière genérale, cette température est comprise
entre 650~C et 1100C, notamment entre '00 et 900C.
Les conditions concernant pllls particulièrement l'electro-
lyse vont etre décrites ci-dessouc.
En ce qui concerne les électrodes, on utilise généralement
une zr.ode en graphite. La nature de la cathode peut varier en
~orction du type de produit préparé.
Lors de la préparation d'une terre rare pure, on utilise
avantageusement ur,e cathode de tungst~ne. On pourra aussi utiliser
une cathode constituée de la mëme terre rare que l'o~ cherche à
preparer. On utilisera des cathodes du même type pour préparer un
alliage de terres rares entre elles.
Dans le cas de la préparation d'un alliage d'une terre
rare avec un metal de transitionJ la cathode serà une cathode
consommable constituée de ce metal de transition ou du meme alliage
terre rare-metal de transition que celui que l'on cherche à obtenir.
La tension aux bornes des électrodes sera généralement
comprise entre 4 et IU V.
Les densités de courant cat~odiques (Dcc) peuvent varier
2 _ .!
entre 70 A.dm et IU0 A.dm , plus particulièrement entre lUU et
~0 A.dm . Les densités de courant anodiques (Dca) sont générale-
ment comprises entre ~U et ~U A.dm
Par ailleurs, on s'est aperçu quiil etait avantageux de
conduire l~electrolyse dans des condltlons telles que l'on alt une
presslon partielle de chlore dans la phase gazeuse qui SOlt d'au
moins l,01.1u4 ~a ~U,l atmosphère). ~ans un tel cas, il y a une
transformation des oxychlorures presents dans le bain selon la
réaction ~r~u~l ~ Cl~ ~ TRCl~ + 1/~ U~ ; les oxychlorures y ont en
effet été apportes comme impuretés avec les chlorures de terres
rares. Dans ce cas, on peut utiliser comme produits de départ des
chlorures de terres rares pouvant presenter un taux en oxychlorure
allant jusqu'à ~5 ~ en poids.
Des exemples vont maintenant ëtre donnés. Les essais
décrits ont éte e~fectués dans des creusets d'alumine avec des
anodes de graphite de diamètre de lU à ~5 mm ; la distance inter-
. ,
.
~765~3~
polaire etait de 65 mm pour les exemples I à 4. Pour chaque électro-
]yse, le métal produit a été récupéré après refroidissement dans le
creuset. Ies compositions des bains sont données en % en poids.
Le rendement métal indiqué deslgne le rapport du métal de
terre rare obtenu par rapport au metal correspondant au chlorure de
terre rare (~RC13) lntroduit.
EXEMPLE 1 - Obtention du neodyme metal.
On realise à 850C et sur cathode de tungstène (0 = 4 mm)
l'électrolyse de 800 g d'un mélange fondu de composition
NdC13 : 13,3 % ; LiCl : 62,0 % ; LiF : 24,7 %. Cette électrolyse a
eté effectuée avec un courant d'intensité I = 8,5 A, ce qui corres-
pondait à une densité de courant cathodique d.c.c. = 690A.dm , et
à une densité de courant anodique d.c.a. = à 60A.dm . La tension
aux bornes des électrodes était comprise entre 4,6 et 5,0 V. Une
électrolyse de 4 heures a fourni, avec un rendement métal de 40 %,
24,1 g de métal dont les teneurs en néodyme, lithium et tungstène
etaient respectivement 98 %, 0,07 % et ' 1 %.
EXEMPLE 2 - Obtention d'un alliage neodyme-fer à faible teneur en
fer.
800 g de bain de composition très voisine de celle
correspondant au melange electrolysé dans l'exemple 1, NdC13 13 %,
LiCl 62 ~, LiF 25 %, ont été utilisés. L'électrolyse a eté effectuée
à 730C sur une cathode constituée de 65 g d'alliage Nd/Fe à 20 %
de fer (alliage préalablement fabrique par calciothermie). Le
contact electrique a été assuré au moyen d'une tige d'acier.
L'intensité du courant d'électrolyse était élevee, 25 A, mais ne
correspondait qu'à une faible d.c.c. (llOA.dm ) ; la d.c.a était
de 250A.dm . Après une électrolyse de 1 heure 20 minutes, on a
récuperé 48 g de métal (rendement métal de 80,4 %), contenant au
moins 89 % de Nd, 8,7 % de fer et 0,1 % de lithium
EXE~LE 3 ~ Obtention d'un alliage néodyme-fer.
La masse et la composition du bain d'électrolyse ainsi
que la température étaient identiques à celles considerees dans
l'exemple 2 (le chlorure de neodyme contenant 7,5 % d'oxychlorure
,
~.;Z7f~i8~
et 2,7 % d'eau). L'intensité du courant d'électrolyse était plus
faible ~13,5 A). A la cathode, constituee par une grille en fer
(consommable) et un contact en acier, la d.c.c. était de 100 A.dm
La d.c.a. avait pour valeur 135 A.dm . Après 2 heures et 30 minutes
d'electrolyse, on a obtenu 50 g de metal (rendement métal de 84 %)
contenant au moins 85 % de Nd, 12 % de fer et 0,7 % de lithium.
Dans les exemples qui suivent (4 à 8) la durée d'élec-
trolyse est donnée par rapport a to qui est le temps theoriquement
necessaire à la reduction de la totalite du TRC13 si le rendement
metal était de 100 %.
EXEMPLE 4 - Obtention de lanthane pur.
On part d'un bain de composition suivante : LaC13 13 %,
LiCl 62 %, LiF 25 ~. On utilise une cathode constituée par une
barre de tungstène, la d.c.c est de 690 A.dm , la d.c.a. de
60 A.dm . La distance interpolaire est de 65 mm. La température
est de 800C. Après t = to, on obtient un metal dont la teneur en
lanthane est d'au moins 95 %, le rendement métal est de 33 %.
EXEMPLE 5 - Obtention d'un alliage lanthane-fer.
Le bain a la composition suivante : LaC13 25 %, LiCl 53 %,
LiF 22 ~. On utilise une cathode constituée par une barre de fer,
la d.c.c. est de 165 A.dm , la d.c.a. de 215 A.dm et la distance
interpolaire de 60 mm. La température est de 840~C. On obtient
après t = 1,5 to un alliage comprenant 92 % de La et 7 % de Fe. Le
rendement métal est de 34 %.
EXEMPLE 6 - Obtention d'un alliage neodyme-lanthane.
On part d'un bain ayant la composition suivante
NdC13 26 %, LaC13 9 %, LiCl 46 %, LiF 19 %. La cathode est une
barre de tungstène, la d.c.c. est de 276 A.dm , la d.c.a. de
235 A.dm et la distance interpolaire de 63 mm. La temperature est
~ Z7~51~5
de 860C. Après une durée dlélectrolyse de t = 0,7 to, on obtient
avec un rendement métal de 57 %, un alliage de composition
~d 81 %, La 18 ~, avec une teneur en lithium de 0,1 %.
EXEMPL~ 7 - Obtention d'un alliage néodyme, lanthane, fer.
Le bain présente la composition suivante : NdCl3 15 %,
LaC13 I0 %, LiCl 53 %, LiF 22 %O
La cathode est une barre de fer, la d.c.c. est de
100 A.dm , la d.c.a. de 142 A.dm et la distance interpolaire de
40 mm. La temperature est de 750C. Après t = 1,5 to, on obtient
avec un rendement métal de 74 %, un alliage de composition suivante:
~d 55 %, La 37 %, Fe 9,2 %, Li 0,5 %.
EXEMPLE 8 - Obtention d'un alliage praséodyme-fer.
On utilise un bain avec la composition qui suit
PrCl3 25 %, LiCl 53 %, LiF 22 %. La cathode est du même type que
dans l'exemple 7, la d.c.c. est de 100 A.dm , la d.c.a. de
14U A.dm et la distance interpolaire de 45 mm. La temperature du
bain est de 750C. Après t = 1,5 to, on obtient un alliage de
composition Pr 86 %, Fe 12 %, Li 0,5 %. Le rendement metal est de
6n %.
EXEMPLE 9 - Obtention de lanthane pur.
On utilise un bain de composition suivante : LaC13 30 % ,
~Cl 38,~ %, LiCl 31,4 %. L'anode est en graphite, la cathode est en
lanthane avec un contact en acier. La d.c.c. est de 55 A.dm , la
d.c.a. de 130 A.dm , la distance interpolaire de 40 mm. La tempéra-
ture du bain est de 690~C. Après 3 heures 31 minutes, on obtient 67
g de métal, le rendement metal est de 56 %.
EXEMPLE 1 n -
C~t exemple concerne la préparation d'alliages néodyme-
fer. On a fait varier la composition du bain. Dans tous les cas,
l'anode est en graphite et la cathode est une tige de fer.
~ Z~5~3~
Les résultats sont reportés dans le tableau ci-dessous.
T désigne la température du bain en C
t désigne la durée de l'électrolyse par rapport 2 to défini
ci-dessus
Di désigne la distance interpolaire en mm
R designe le rendemen~ metal tel que défini ci-dessus.
T A B L E A U
¦ Composition bain ¦ Dca Dcc t Di Nd Fe
25 NdC13 - 53 LiCl - 22 LiF ___ 750 lS0 ;00 x 1J5 45 88 12 l70
. . - . ........ .. _ _
22 NdC13 - 47 LiCl - 31 NaF 750 100 100 x 1,5 50 89 11 ~60
22 NdC13 - 48 LiCl - 30 CaF2 750 106 100 x l,S SS 87 13 54
25 NdC13 - 53 LiCl - 22 LiF 840 100 200 x 1,5 28 86 14 77
25 NdC13 - 53 KCl - 22 LiF 840 100 100 x l,S 47 88 12 52
30 NdC13 - 62 KCl - 8 NaF 840 100 llS x 1,7 SS 87 13 31
__ _
26 NdC13 - 32 KCl - 42 BaF2 840 100 120 x 1,3 58 88 12 21
_ _ _
25 NdC13 - 33 LiCl - 20 NaCl - 22 LiF 740 100 140 x l,S SS 88 12 46
25 NdC13 - 53 LiCl - 22 LiF 830 100 250 x 2 42 84 16 34
25 NdC13 - 53 LiCl - 22 LiF 840 100 200 8 1,5 28 86 14 77
. _ ~
25 NdC13 - 53 LiCl - 22 LiF 820 64 100 x l,S 52 88 12 72
35 NdC13 - 46 LiCl - 19 LiF 53D 115 250 x 2,D 35 56 14 50
EXEMPLE 11 -
.
Cet exemple concerne la préparation d'un alliage gado-
linium-fer.
On utilise un bain de composition : Gd C13 26 % ; LiCl
52,3 ~ ; LiF 21,7 %.
L'anode est en graphite, la cathode en fer. La température
du bain est de 940C, la d.c.a. de 89 A.dm , la d.c.c. de
250 A.dm , la distance interpolaire de 46 mm. Après t = 0,94 to,
on obtient un alliage de composition Gd 86 ~, Fe 14 %. Le rendement
métal est de 42 %.
Le dispositif pour la mise en oeuvre du procédé va
maintenant être décrit.
La cellule selon l'invention est concue de manière à
permettre la coulée ou le soutirage par son fond du métal ou de
l'alliage formé. Elle comporte donc dans sa partie basse une zone
de soutirage dans laquelle on recueille par décantation le produit
forme, cette zone ayant une configuration telle ou étant munie de
moyens de soutirage tels que l'on puisse extraire facilement le
métal ou l'alliage.
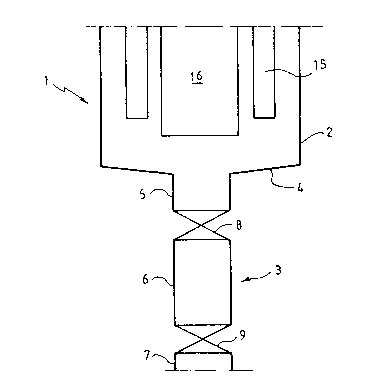
En se référant aux figures, on peut voir une telle
cellule 1, constituee d'une partie haute 2, généralement une cuve
cylindrique et d'une partie basse se présentant sous la forme d'une
conduite 3 constituant la zone de soutirage. Cette zone presente
une section transversale interne inferieure à celle de la partie
haute et de preference elle est constituee par une conduite
s'étendant dans le prolongement vertical de la cuve et présentant
avantageusement une section transversale cylindrique. La conduite 3
débouche de préférence au centre du fond 4 de la partie haute.
Pour faciliter la coulée du produit on peut prévoir un
fond 4 légèrement incliné vers le bas, par exemple de l'ordre de
1()~ .
La partie haute de la cellule est munie de moyens de
chauffage extérieur du type chauffage électrique par rayonnement,
contact ou induction ou bien chauffage par brûleur à gaz ou à fuel.
7~S~3~
Les figures ] et 2 illustrent deux modes de réalisatlons
particuliers de la zone de soutirage.
Sur la figure 1, la zone ou condulte de soutirage 3 est
constituee de trois zones dis~inctes, une zone de raccordement 5,
une zone centra~e 6 et une zone externe 7. La zone centrale 6 est
séparée des deux autres par des vannes 8 et 9 à ouverture totale et
commandees à distance. Cette zone 6 ainsi délimitee forme un espace
de decantation. Les zones 5 et 6 sont chacune munies de moyens de
chauffage du type chauffage électrique par exemple.
En ce qui concerne les dimensions, on peut noter que le
diamètre et la hauteur de la zone 6 est fonction de la frequence de
soutirage. Géneralement, on peut prevoir une hauteur de la zone 6
compris entre 2,5 fois et 6 ~o~s celle de la zone 5.
La zone de soutirage 3 de la figure 2 est elle aussi
constituée de trois zones, une zone de raccordement 103 une zone
centrale 11 dont la particularité est de présenter une section
transversale inférieure à celle du reste de la zone 3 et notamment
de la zone 10 et une zone externe 12. Cette meme zone 12 est
elle-même divisée en deux parties : une partie 13 adjacente à la
zone 11 et une partie externe 14. Ces deux parties se distinguent
essentiellement l'une de l'autre par le fait qu'elles comportent
des moyens de chauffage indépendants.
La zone 11 est munie elle aussi de moyens de chauffage.
On préfère utiliser pour les parties 13 et 14 des moyens de chauf-
fage électriques par contact ou par rayonnement et en ce qui
concerne la partie 14 par induction éventuellement et pour la zone
11 des moyens de chauffage tres souples par exemple du type ~rûleur
a fuel ou à gaz.
Les dimensions de la zone de soutirage sont la aussi
fonction de la fréquence de soutirage. De préférence, les diamètres
des zones 10 et 12 sont identiques et sont dans un rapport de 2 à 4
environ avec celui de la zone 11. En ce qui concerne les hauteurs,
on peut prévoir des hauteurs sensiblement voisines pour ]es zones
10 et 11 et la partie 14, celle de la partie 3 etant 3 à 5 fois
plus importante.
~ Z~SBS
l,'ensemble de la cellule d'électrolyse est réalisé en un
materiau susceptible de resister à la temperature du boain et à la
corrosion due aux différents produits ~is en oeuvre. On peut citer
comme matériau convenable la fonte, notamment la fonte grise à
graphite lamellaire ou sphéroIdal. On peut aussi utiliser de la
fonte alliée au chrome ou au nickel ou de préférence au molybdène-
silicium.
Différentes formes et disposition d'électrode peuvent
être utilisees dans le cadre de la cellule de l'invention.
On utilise generalement une anode en graphite. En ce qui
concerne la cathode, la nature de celle-ci depend du type de
produit préparé comme cela a été vu plus haut : tungstène pour une
terre rare pure, cathode consommable en metal de transition ou en
alliages terre rare-metal de transition pour les alliages.
Généralement, on utilise une cathode cylindrique, placée
verticalement dans la cuve, de préférence au centre. En particulier
dans le cas où la zone de soutirage de la cellule est constituée
par une conduite cylindrique, il est avantageux de disposer la
cathode à la verticale de cette conduite.
Selon un mode de réalisation préféré de l'invention, la
cathode est creuse et cylindrique. On peut prévoir ainsi
l'alimentation de la cellule en chlorure de terre rare par la
partie centrale creuse de la cathode.
Enfin il est aussi possi,ble d'utiliser une cathode
horizontale.
Différentes formes d'anodes peuvent être utilisées :
Comme cela appara~t sur la figure 1, l'anode peut etre
constituée par un ou plusieurs cylindres 15 -verticaux disposés
autour de la cathode 16. On peut utiliser par exemple six cylindres
15.
Selon le mode de realisation de la figure 2, l'anode peut
etre aussi constituee par une couronne circulaire 17 centree autour
de la cathode 16.Au lieu d'une couronne on pourrait utiliser aussi
des secteurs de couronne.
Enfin, il est à noter que l'on dispose avantageusement
dans la cellule les electrodes de manière que l'extremite inferieure
~ 2~6~1S
12
- de la cathode soit plus proche du fond de la cuve que les extré~ités
inferieures de ou des anodes.
Le fonctionnement des dispositifs décrlt~ ci-dessus va
maintenant être donné.
On alimente en continu la cellule en chlorure de terre
rare par une trémie. Dans le cas d'une cathode creuse du type
décrit plus haut, le chlorure est introduit dans la partie centrale
de cette électrode.
Le métal ou l'alliage formé pendant l'électrolyse tombe
au fond de la cuve et est récuperé dans la zone de soutirage d'une
maniere cyclique.
Dans le cas du dispositif de la figure 1, la vanne 8
étant ouverte, la vanne 9 fermée, on laisse le métal ou l'alliage
remplir totalement la zone 6. Une fols le remplissage terminé, on
~erme la vanne 8 et on ouvre la vanne 9 de manière a permettre
ainsi l'écoulement du produit dans la zone externe 7.
Avec le dispositif de la figure 2, on procède de la
maniere suivante. La partie 14 de la zone l2 est maintenue froide,
c'est~à-dire à une température inférieure à la température de
fusion du bain et on laisse décanter le métal ou llalliage dans la
partie 13, les zones 10, 11 et 13 étant chauffées. On refroidit
ensuite très rapidement la zone ll et il~s'y forme un bouchon de
sel. On chauffe ensuite rapidement la partie externe 14 de la zone
12 pour couler le produit recueilli en 13. On laisse ensuite
refroidir les parties 13 et 14 pour former un nouveau bouchon de
sel dans la zone 12 et on réchauffe progressivement la zone 11.
Naturellement, le dispositif qui a eté décrit ci-dessus
peut s'appliquer à tout type d'électrolyse en bain de sels fondus
dans lequel on recueille par décantation un produit final. Son
application ne se limite donc pas aux bains qui ont ete decrits
plus particulièrement dans la présente description.
Bien entendu, l'invention n'est nullement limitee aux
modes de realisation decrits qui n'ont eté donnés qu'à titre
d'exempl~s. En particulier, elle comprend tous les moyens consti-
tuant des equivalents techniques des moyens décrits ainsi que leurs
combinaisons si celles-ci sont mises en oeuvre dans le cadre de la
protection revendiquée.
.