Note: Descriptions are shown in the official language in which they were submitted.
- l -
NOUVEAUX DERIV~S BENZOFUR~NNIQUES, L~URS PROCED~S DE PREPA-
RATION ET C~MPOSITIONS MEDI~AMEN~EUSE ~T COSMETIQUE 1ES
~ONTENANT.
L'invention concerne de nouveaux composés
chimiques constitues par des dérivés benzofuranniques, ainsi
que des procedés de préparation permettant d'obtenir ces
nouveaux composes. L'invention concerne aussi l'utilisation
de ces nouveaux composés, soit en cosmetique, soit en
médecine (humaine et vétérinaire) dans des préparations
pharmaceutiques destinées au traitement des affections
dermatologiques liées à un désordre de la kératinisation
(différenciation-prolifération), au traitement des
affec~ions dermatologiques, ou autres, à composante inElam-
matoire et~ou immuno-allergique, au traitement de l'atopie,
qu'elle soit cutanée ou respiratoire, au traitement des
maladies de dégénérescence du tissu conjonctif et des
tumeurs, dans le traitement du psoriasis rhumatoide, ainsi
que dans des préparations pharmaceutiques pour le domaine
ophtalmologique, notamment dans le traitement des
cornéopathies.
L'action thérapeutique de la vitamine A sous sa
forme acide, aldéhyde ou alcool, est bien connue en
dermatologie (voir à cet égard la publication "EXPERIE~TIA",
volume 34, pages 1105-1119 tl978)); cette action dans le
traitement des proliférations cutanées, de l'acné, du
psoriasis e-t des affections analogues, sera désignée ci-
après par l'expression générique "action de type rétinoide".
On a cons-taté que des produits ayant une structure analogue
à la vi-tamine A présentaient également une action de -type
rétinolde, mais que l'effet secondaire d'hypervitaminose
toxique pouvait, pour certains composés, être multiplié par
un facteur plus petit que le facteur multiplicatiE de
Y~ ~
.
:-
~9~
- la -
l'effet rétinoique recherché (voir à cet égard "EUR. J. MED.
CHEM.-CHIMICA THERAPEUTICA, Janvier-Février 198Q, 15, numero
1, pages 9-15); P. LOELIGER ET COLL. on décrit, dans cette
derni~re publication, un dérivé de formule (i~:
,
.
~ .
.
,
.
~ ~ ~C02C2H5 ( i )
3C
La chaine latérale insaturée de ce composé de
formule (i) est identique à celle de l'acide rétinoique
naturel de formule (ii) :
' X~'~ C 02H ( i i )
On connait également, par la demande de brevet
allemand n 2 437 607, une famille de composés à action
rétinoique correspondant à la formule générale (iii) :
~3 ~ ~ ~ ~ ~ ~ ,R6 (iii)
R 4J~ R I
R5
formule dans laquelle les substituants R3 et R',entre
autres, peuvent former ensemble un noyau benzénique accolé
au premier. On note la présence d'une chaine latérale
diméthyl-3,7 tétraénique, qui est la même que celle des
co~posés (i) et (ii) précités.
On connaît également, par le brevet allemand
n 3 121 091, un composé à action anti-séborrhéique,
correspondant à la formule générale (iv) :
,
: .
R14
R' ~ COY
R'2 ~ R'3 (iv)
formule dans laquelle Rl et R'2 peuvent également former
ensemble un noyau benzénique accolé au premier.
On connait également, par le brevet américain n
3 755 604, un procédé pour diminuer la production de sébum
à l'aide d'un acide 2-trans-4-trans-pentanediénoique de
for~ule (v) :
CO~H (v)
On a constaté, selon l'invention, que l'on pou-
vait remplacer le noyau naphtalénique des formules (iii)
et (iv) par un noyau de formule :
~0~
qui consiste en un noyau 2,3,4,4a-tétrahydro-4a, 10jlO-
tri~éthyl-lH-3,9b-méthano dibenzofuranne, que l'on désignera
danc ce qui suit par "TTMDBF", sans perdre pour cela le
ben_~ice de l'action rétinoique.
. . ; : ~
L2949~1
L'invention a pour objet le produit indus-
triel nouveau que constitue un nouveau composé chimique
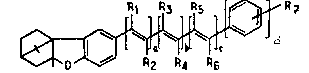
correspondant à la formule générale (I) :
~ R5
0 ~2 ~4 R6
0
formule dans laquelle .
- a, b, c et d sont des entiers pouvant prendre,
indépendamment l'un de l'autre, les valeurs 0 ou 1,
avec la condition que la somme a + b + c + d soit
supérieure ou égale à 2 ;
- R1, R2, R3 ? R4, R5, et R6, représentent, indé-
pendamment, un atome d'hydrogène, un radical alkyle
en C1-C6 ;
~ R7 représente :
- un radical correspondant à la formule (II) :
-CH2R8 (II),
formule dans laquelle R8 représente un atome
d'hydrogène, un radical alkyle en C1-C6, un
radical monG- ou polyhydroxyalkyle en C2-C6,
.,
,
:
:, ~
~7;~
un radical correspondant à la formule (III
- ~ - Rg (III),
formule dans laquelle Rg represente :
- un atome d'hydrogène ;
- un radical alkyle en C1-C6;
- un radical - ~ , où R'
\ R~
et R", identiques ou différents, `~
représentent un atome
d'hydrogène, un radical alkyle
C1-C6, un radical mono ou
polyhydroxyalkyle C2-C6, un
radical alkènyle C3-C6, R' et
R" pouvant former un hétérocy-
cle avec l'atQme d'azote auquel
ils se rattachent, le radical
~,R'
-N pouvant, en outre, être
: \ R"
le reste d'un amina-acide ou
d'un sucre aminé ;
- un radical -OR1o, où R10 re-.
présente un atome d'hydrogène,
un radical alkyle en Cl~C20,
un radical mono- ou polyhydro-
xyalkyle en C2-C~, le groupe-
ment -ORlo pouvant également
être dérivé d'un sucre ;
ainsi que les sels pharmaceutiguement acceptables ou cosmétique-
ment acceptables et isomères de ce compose chimique.
,~i` .
, . - ,
.
Parmi les radicaux alkyle en Cl-C6 particulièrement
utilisables dans les significations`des radicaux Rl à R9 ,
R' et R", on peut citer les radicaux méthyle, éthyle, iso-
propyle, butyle et tertiobutyle, et, de préférence, pour
à R6, le radical méthyle.
Parmi les radicaux al~yle en Cl-C~0 particulière-
ment utilisables dans les significations du radical Rlo, on
citera, de préférence, les radicaux méthyle, éthyle, propyle J
éthyl - 2 hexyle, octyle, dodécyle, hexadécyle et octadécyle.
Lorsque les radicaux R', R" et Rls représentent
un radical mono- ou polyhydroxyalkyle en C2-C6, celui-ci
est, de préférence, un radical hydroxy-2 éthyle, dihydroxy-
2,3 propyle ou le reste de pentaérythritol.
Parmi les radicaux alkényle en C3-C6 utilisables
dans les significations des radicaux R' et R", on citera,
en particulier, les radicaux propényle, butényle et isopen-
tényle.
Lorsque les radicaux R' et R" forment un hétérocy-
cle avec l'atome d'azote sur lequel ils se rattachent,
celui-ci est, de préférence, un radical pipéridino, morpho-
lino, pipérazino, pyrrolidino ou (hydroxy-2 éthyl)-~ pipéra-
zino.
Lorsque le groupement -OR10 est dérivé d'un sucre,
ce dernier est, par exemple, le glucose, le mannitol ou
l'ér~thritol.
. . .
-
.:
~94~
-- 7
Les composés de formule (I) ou leurs isomères
peuvent se présenter sous forme de leurs sels pharmaceuti-
quement acceptables ou cosmétiquement acceptables; il peut
s'agir soit de sels pharmaceutiquement acceptables ou cosmé-
tiquement acceptables de zinc, d'un métal alcalin oualcalino-terreux ou d'une amine organique lorsqu'ils
comportent, au moins une fonction acide libre, soit de sels
pharmaceutiquement acceptables ou cosmétiquement acceptables
d'un acide minéral ou organigue, notamment de chlorhydrate,
l~ de bromhydrate ou de citrate, lorsqu'ils comportent au moins
une fonction amine.
Parmi les composés particulièrement préféres selon
l'invention, on peut mentionner ceux qui correspondent aux
formules générales (Ia), (Ib), (Ic), (Id), (Ie):
~3
11
R~o ( Ia~
CH3~H3 ~
11
C~o_R1 (Ib)
11
~ ~ 1
,,, . ":
' , ~ ' ' ~ , ' ' ' ' ` ' '
'
~3 ~L2~a9~g~
li
IR~ R~
~ ~ (Id)
0G113 ~ ~ ~ R'
/~1C~N~ (Ie
c`~ns lesquelles R1 et R3 représentent l'hydrogène ou un radical
c^thyle, R9 représente N- R ou OR1o, R~ et R~ identiques ou différents,
représentent un atome d'hydrogène ou un radical alkyle en C1 C6,
F.10 représentant un atome d'hydrogène, un radical alkyle en C1-C20
o~u un radical mono- ou polyhydroxy~alkyle en C2-C6-
Parmi les composés préf`érés de formule (Ia), on
peut citer les deux composés suivants :
~Ethoxycarbonyl-4-méthyl-3-butadiène-lE,3~ -yl-2-TTM3BF,
~arboxy-4-méthyl-3-butadiène-lE,3~ -yl-2-TTMDBF.
Parmi les composés préférés de formule (Ib), on
p~ut citer les deux composés suivants :
. ~thoxycarbonyl-7-méthyl-6-heptatriène-2E,4E,6~ -yl-2-TTMDBF,
. ~arboxy-7-méthyl-6-heptatriène-2E,4E,6~ -yl-2-TTMDBF.
Parmi les composés préférés de formule (Ic), on
~eut citer les deux composés suivants :
~Méthoxycarbonyl-4'-phényl)-2-méthyl-1-éthene-1~ -yl-2-TTMDBF
~C~rboxy-4'-phényl)-2-méthyl-1-éthène-1~ -yl-2-TTMDBF.
~ethyl~inocarborlyl-4'-phél1y')-2-i.1é~hyl-1-éthene-1E~ -yi-2-'~'T'~DBF.
. ~Ethoxycarbonyl-4'-phényl)-2-éthène-1E~ -yl-2-TTMDBF.
. ~Carboxy-4'-phényl)-2-éthene-1E] -yl-2-TTMDBF.
, . , ~,~
9 ~29~g~
Parmi les composés préférés de formule (Id), on
peut citer les deux composés suivants :
. ~Méthoxycarbonyl-4'-phényl)-4-méthyl-3-butadiène-1E 7 ~ -yl -2-TTMDBF,
. ~Carboxy-4'-phényl~-4-méthyl-3 butadiène-lE, ~ -yl-2-TTMDBF.
. ~Carboxy-4'-phér,yi)-4 méthyl-1-butadiène-lE,3E~-yl-2-~TMDBF.
. LMéthoxycarbonyl-4'-phényl~-4-méthyl-3-butadiène-lE,3~ -yl-2-
r~BF.
Parmi les composés préférés de f`orrr,ule (Ie), on
~eut citer le composé suivant :
,~Ethylaminocarbonyl-7-méthyl-6 heptatriène-2E,4E,6~-yl-2-TTMDBF.
L'invention a également pour objet les procédés
de préparation des nouveaux composés de formule (I).
Selon l'invention, la synthèse des composés de
formule (I) consiste :
- ou bien à faire réagir un composé de formule
(IV) :
71
~ ~ (IV)
sur un composé de formule (V) :
~ (V)
~2 R4 R~
`. ;:
~2~ 7:~
- ou bien faire réagir un composé de rormule (VI):
~ ~ (VI)
sur un composé de formule (VII) :
~ ~ (VII)
RJ, IR~
fo~mules dans lesquelles a, b, c, d, R1, R2, R3, R4, R5,
R6 et R7 ont les si~nifica~ions indiauées précedemment.
avec les conditions, d'une part, que les sommes
,
.
.:
., ~
':
: ,
~z~
b ~ c ~ d et c ~ d, respectivement dans les formules (V)
et (VII) soient chacune supérieure ou égale à 1, et,
d'autr~ part, que R7 ne puisse représenter le groupe de
formule (III) :
_ C~Rg~ \III) ,
quand R~ est un atome d'hydrogène ou un radical alk~le en
C1-C6, les groupes A et B dans les formules (IV) et (V) i
(VI) et (VII) ci-dessus re~résentant l'un --------------
un groupe oxo, alors que l'autre est :
a) ou bien un groupement triarylphosphonium de
1~ formule (VIII) :
-P ~X~ ~ (VI~I) ,
formule dans laquelle X est un groupement aryle et Y~ un anion monovalent d'un acide organique ou inorganique ;
b) ou bien un groupement dialkoxyphosphinyle
de formule (IX ) :
~ ~ 2 (IX) ,5
formule dans laquelle Z représente un reste alkoxy en C1-C6.
Lorsque A et B représentent, l'un un groupe oxo,
et l'autre un groupement triarylphosphonium, on effectue
la réaction des composés (IV) et (V) ou des composés (VI)
et (VII) , -----------_-------_-__--____-_--------_--_--___
en présence d'un alcoolate de métal alcalin, tel que le
méthylate de sodium, en présence d'un hydrure de métal al-
calin, tel que l'hydrure de sodium, en présence de butyl-
. ~ .
4~
lithium dans un solvant tel que le tétrahydro~uranne ou lediméthylformamide, ou bien en présence d'un carbonate alca-
lin tel que le carbonate de potassium ~ans un alcool tel
que l'isopropanol, ou encore en présence d'un oxyde d'al-
kylène, éventuellement substitué par un groupe alkyle,notamment dans un solvant tel que le dichlorométhane, la
température de réaction étant comprise entre -80C et la
température d'ébullition du mélange réactionnel.
Lorsque A et B représentent, l'un, un groupe
oxo et, l'autre, un groupement dialkoxyphosphinyle, on ef-
fectue la réaction des comDosés (IV) et (V) ou des com~osés
(VI) et (VII) en présence -----------------------------------
d'une base et, de préférence, en présence diun solvant
organique inerte ; la réaction peut etre effectuée, par
exemple, au moyen d'hydrure de sodium dans du benzène,
du toluène, du diméthylformamide, du tétrahydrofuranne,
du dioxanne ou du diméthoxy-1,2 éthane, ou également au
moyen d'un alcoolate, par exemple au moyen de méthylate de
sodium dans le méthanol ; la condensation peut être éga-
lement réalisée en utilisant une base minérale, telle quela potasse ou la soude, dans un solvant organique tel que
le tétrahydrofuranne, ou également au moyen d'un carbonate
alcalin, par exemple au moyen de carbonate de potassium
dans l'eau, ou ercore au moyen de butyllithium dans le
tétr~hydrofuranne. On peut ajouter au mélange réactionnel
un é~her-couronne susceptible de complexer le cation
métallique contenu dans la base, ce qui permet d'augmenter
la force de celle~ci. La réaction est, de préférehce,
effectuée dans un intervalle de température compris entre
-~OCC et le point d'ébullition du mélange réactionnel.
La condensation du composé de formule (IV) sur le
... ....
.
- :
:
13
composé de formule (V) est particulièrement appropriée pour la synthèse
des composés de formule (Ia), (Ic) et de certains composés de formule (Id).
La condensation du composé de formule (VI) sur le composé de
formule (VII) est particulièrement appropriée pour la synthèse des composés
5 de formule (Ib) et de certains composés de formule (Id). :
Les composés de formule (IV) à (VII) sont des com-
posés connus ou peuvent être préparés par des methodes
connues. :
Le composé de formule (I) obtenu par les procédés
de préparation selon l'invention peut subir des modifica-
tions fonctionnelles du substituant R7 Parmi les modifi-
cations fonctionnelles de ce substituant R7, on citera,
par exemple, la préparation d'alcools, d'acides et de
leurs sels, d'amides à partir des esters correspondants.
Toutes ces modifications fonctionnelles peuvent être
réalisées par des modes opératoires connus en soi.
Les composés de formule (I) sont obtenus à
l'état de mélange cis/trans que l'on peut séparer, si on le
désire, de manière connue en soi, en les composés cis et
trans ou isomériser en composés entièrement trans.
On a constaté que les composés de formule (I)
présentent une bonne à excellente activité dans le test
d'inhibition de l'ornithine décar~oxylase après induction,
par "~ape stripping", chez le rat nu, (Martine BOUCLIER et Coll.
--- Dermatologica 169, n 4 (1984)). Ce test est admis
comme mesure de l'action des rétinoides sur les phénomènes
de prolifération cellulaire.
Les composés de formule (I) nresentent e~.,lement
une activité renforcée dans le test de différenciation des
cellules de tératocarcinome embryonnaire de souris (cellu-
les F9 : "Cancer Research" 43, page 52681 1983).
37~
14
Enfin, les composés selon l'invention présentent
une excellente activité comédolytique dans le test de la
souris rhino décrit par 3UNNE and al. dans Internatio~lal
Journal of Cosmetic Science 3, 23-28 (1981).
Les composés de formule (I) conviennent donc
particulièrement bien pour trai~
ter les affections dermatologiques liees à un désordre de
la kératinisation ( différenciation-prolifération) ainsi que
les affections dermatologiques, ou autres, à composante
inflammatoire et/ou immuno-allergique, et notamment pour
traiter les acnés vulgaires, comédoniennes ou polymorphes,
les acnés séniles, solaires et les acnés médicamenteuses
ou professionnelles, les formes étendues et/ou sévères de
psoriasis et les autres troubles de la kératinisation,
et, notamment les ichtyoses et états ichtyosiformes, la ma-
ladie de Darier, les kératodermies palmo-plantaires, les
leucoplasies et états leucoplasiformes, le lichen-plan,
toutes proliférations dermatologiques bénignes ou malignes,
sévères ou étendues ; ils sont également actifs
20 cor,~re le psoriasis rhumatoide ; - -----------------------
------------- ils peuvent être utilisés dans le traitement
de l'atopie cutanée comme l'eczéma ou de l'atopie respira-
toire ; ils peuvent être préconisés dans les épidermolyses
bulleuses dystrophiques et dans la pathologie moléculaire
2~ du collagène ; ils trouvent aussi une indication dans les
carcinomes induits par les ultra-violets (carcinogénèse
solaire), dans l'épidermodysplasie verruciforme et formes
apparentées ; enfin, ils trouvent une application dans le
dot~Jaine ophtalmologique, notamment pour le traitement des
cornéopathies
La présente invention a donc aussi pour objet
.. .
- . . ~ . ~ ~
.,. ; - : ~ ~:
~2~
une nouvelle composition medicamenteuse, destinée notamment
au traitement des affections susmertionnées, caractérisée
par le fait qu'elle comporte, dans un support pharmaceuti-
quement acceptable, comme substance(s) active(s),au moins
un composé de formule (I) et/ou au moins un de ses isomères
et/ou au moins un de ses sels.
Lorsque les composés de formule (I) sont utilisés
par voie topique, on observe une bonne activité de
ceux-ci sur une très grande ~amme de dilution ; on peut
utiliser, notamment, des concer,trations en substance(s)
active(s) allant de 0,0005% à 2% en poids. Il est bien
entendu possible d'utiliser des concentrations supérieures,
lorsque ceci est rendu nécessaire pour une application
thérapeutique particulière ; toutefois, les concentrations
préférées en principe actif sont comprises entre 0,002 et
1~ en poids.
Les compositions topiques se présentent avantageu~
sement sous la forme d'onguents, de gels, de crèmes, de
pommades, de poudres, de teintures, de solut.ions, de sus-
pensions, d'émulsions, de lotions, de sprays, de timbres
ou de tampons imbibés. Les composés en cause sont mélan-
gés à des supports inertes non toxiques, généralement li-
quides ou pâteux, appropriés au traitement par voie topi-
que.
Les substances pharmaceutiquement actives préci-
tées peuvent être utilisées par voie entérale. Par voie
orale, on administre lesdites substances actives à raison
d'environ 2~ g jusqu'à 2 mg par jour et par kg de poids
corporel ; une posologie excessive peut se manifester sous
la forme d'une hypervitaminose A reconnaissable à ses
symptômes et pouvant faire craindre une toxicité hépatique
nécessitant un contrôle biologique de la fonction hépatique.
La dose nécessaire peut être administrée en une ou plu
sieurs prises. Pour l'administration par voie orale, les
~ ~ ,
::
. .
~2~
16
formes appropriées sont, par exemple, les comprimés, les
gélules, les dragées, les sirops, les suspensions, les
émulsions, les solutions, les poudres, les granulés ; un
mode d'administration préferé consiste à utiliser des gé-
lules contenant de 0,1 mg à environ 1 mg de substance(s)active~s).
Les substances pharmaceutiquement actives peuvent
être administrées par voie parentérale, 50US forme de so-
lutions ou suspensions pour perfusions ou injections intra-
veifieuses ou intramusculaires.Dans ce cas, on administrelescites substances actives à raison d'environ 2 ~g jusqu'à
2 mg par jour et par kg de poids corporel ; un mode d'admi-
nistration préféré consiste à utiliser des solutions ou
suspensions contenant de 0,01 mg à 1 mg environ de substan-
ce(s) active(s) par ml.
Lorsque les substances pharmaceutiquement activessont utilisées par voie oculaire, elles se présentent,
avantageusement, sous forme de solutions ou de poudres
à diluer pour collyres.
~0 Le support pharmaceutiquement acceptable peut
comporter de l'eau, de la gélatine, du .lactose, de l'amidon,
du talc, de la vaseline* de la gomme arabique, des polyal-
coylène-glycols, du stéarate de magnésium. Les comprimés,
poudres, dragées, granulés ou gélules peuvent contenir des
liants, des charges, des supports pulvérulents. Les solu-
tions, cremes, suspensions, émulsions ou sirops peuvent
contenir des diluants, des solvants, des epaississants.
Les composés de formule (I), ainsi que le.s sels et
les isomères de ces composés, trouvent également une applica-
tion dans le domaine cosmétique, en particulier, dans l'hy-
giène corporelle et capillaire et, notamment, dans le trai.te-
ment des peaux à tendance acnéique, des peaux physiologiquement
sèches, des séborrhées, de la chute des cheveux, pour la re-
pousse des cheveux, pour lutter contre l'aspect gras de la
peau ou des cheveux. Ils ont également un pouvoir préventif et
* (marque de commerce)
,
.
9~1
curatif contre les effets nefastes du soleil.
La présente invention a donc aussi pour objet
une nouvelle composition cosmétique, caractérisée par le
fait qu'elle comporte, dans un support cosmétiquement ac-
ceptable, comme substance(s) active(s), au moins un composéde formule (I) et/ou au moins un de ses isomères et/ou
au moins un de ses sels ; cette composition peut se présen-
ter sous forme de lotion, gel, crème, savon, shampooing
ou analogue.
La concentration en substance(s) cosmétiquement
active(s) est comprise entre 0,0005 et 2% en poids et, de
préférence, entre 0,01 et 1% en poids par rapport au poids
total de la composition.
Dans le ~raitement des désordres sus-mentionnés,
les composés selon l'invention, utilisés dans les
compositions ci-dessus définies, agissent -----------
en accroissant la production épithéliale folliculaire des
cellules non-adhérentes, délogeant ainsi et faisant partir
le contenu du comédon acnéique. Ces composés réduisent la -
taille des glandes sébacées et inhibent partiellement lasëcrétion du sébum.
Les compositions selon l'invention peuvent conte-
nir des additifs inertes, ou bien pharmacodynamiquement
ou cosmétiquement actifs et, notamment, des agents hydra-
tants, comme la thiamorpholinone et ses dérivés ou l'urée ;
des agents anti-séborrhériques, tels que la S-carboxylmé-
thy~cystéine, la S-benzyl-cysté2mine, leurs sels et leurs
dér-vés, la tloxolone ; des agents arlti-acnéiques comme
le peroxyde de benzoyle ; des antibiotiques, comme l'éry-
thromycine et ses esters, la néomycine, les tétracyclines
ou les polyméthylène -4,5 isothiazolones-3 ; des agents
favorisant la repousse des cheveux comme le "Minoxidi~"
(diamino-2,4 pipéridino-6 pyrimidine oxyde-3) et ses déri-
vés, l'anthraline et ses dérivés, le"Diazoxide"(chloro-7-me-
~, * (marque de commerce)
" :
~ ..
18
thyl-3 benzothiadiazine-1,2,4 dioxyde-1,1) , le"Phénytoin"
(diphényl-5,5 imidazolidinedione-2,4) ou l'iodure d'oxa-
propanium ; des agents anti-inflammatoires stéroïdiens
et non stéroidiens ; des caroténoïdes et, notamment, le
~-carotène ; des agents anti-psoriasiques tels que
l'anthraline et ses dérivés, les acides eicosatétraynoI-
que-5,8,11,14 et -triynoIque-5,8,11, leurs esters et
leurs amides.
Les compositions selon l'invention peuvent
également contenir àes agents d'amélioration de la saveur,
des agents conservateurs, des agents stabilisants, des
agents régulateurs d'humidité, des agents régulateurs de pH,
des agents modificateurs de pression osmotique, des agents
émulsionnants, des filtres UV-B et UV-A, des antioxydants
tels que l'd -tocophérol, le butylhydroxy-anisole ou le
butylhydroxy-toluène.
Pour mieux faire comprendre l'objet de l'invention,
on va en décrire maintenant plusieurs exemples de réalisa-
tion.
EXEMPLE 1
Préparation d'un composé de formule :
_
CH3 ~H3
C~2~
a) preparation du composé de formule :
Ce produit est obtenu selon le mode opératoire
.
- : : ~: -;
. ~ .
.. . : .
~ ` ,: ' :~ ' ''
~Z~ ti,
19
décrit par J.L. FRY et W.J. WFST, J. Org. Chem. 1981,
v. 46 (10~ 2177-2179.
;
, ` . ';' . ; '
.
: . .' - . ~
.. ..
.
- j ~ . .: . .. .
- .. . : . .: .
.
.
` ` ~2~4~
b) ~re~aratlon du com~ose_de formule :
g)
~ ~3
On ajoute lentement une solu~ion de 9,2 g de com-
posé obtenu en a) et 3,2 cm3 de chlorure d'acétyle dans
60 cm3 de dichlorométhane à une solut:ion prealablement
10 refroidie à -10C de 6g de chlorure d'aluminium dans 60cm3
de dichlorométhane. On agite pendant deux heures en lais-
sant le mélange réactionnel revenir à température ambiante.
On verse sur une solution saturée de chlorure d'ammonium et
on extrait la phase organique à l'éther. Les phases orga-
niques sont réunies, séchées sur sulfate de sodium et le
solvant est distillé sous pression réduite. Le résidu ob-
tenu est recristallisé dans l'éthanol.
On obtient un composé possédant les caractéris-
tiques suivantes :
- Point de fusion : 139CC
r~max = 291 nm
- Spectre UV (chloroforme) ~ = 14230
Analyse élémentaire :
_ _ .
25 ANALYSE ELEMENTAI~E C H 0_ =
Calculé. ................ 79,96 8,20 11,84
Trouvé......... ...... 80,01 8,20 11,68
c) préparation du composé de formule :
___________________________~_____
CH3
. , `
. . . . .
, ~ , . ` ` ' `
~ ~ , . - . . . ~,.
t2g'~9~1
10g du composé obtenu en b) et 7,2 g de cyanomé-
thylphosphonate de diethyle sont dissous dans 40 cm3 de
tétrahydrofuranne. Cette solution est ajoutée à une sus-
pension de 4 g de potasse broyée dans 60 cm3 de tétrahydro-
furanne. On agite pendant 2 heures à température ambiante,puis on dilue par 500 cm3 de toluène. On filtre sur célite.
Après évaporation du solvant, et recristallisation dans
l'éthanol, on obtient 8 g de produit attendu possédant les
caractéristiques suivantes :
- Spectre UV (chloroforme) : ~max = 313 nm
ANALYSE ELEMENTAIRE C H ¦ O
C~lculé.................. 81,87 7,90 ~45 4,77
TFouvé................... 81,89 8,00 5.60 4,85
d) préparation du composé de formule :
___ ______________________________
~H3
~ CHO
On refroidit à -78C une solution de 2,93g de
co~posé obtenu en c) dans 50 cm3 d'un mélange 50:50
toluène-hexane. On ajoute 12 cm3 de solution 1M d'hydrure
de diisobutyl-aluminium dans le toluène. On agite pendant
3 heures en laissant la température remonter à 0C. On
refroidit à -78C et on ajoute 30 g de gel de silice désac-
ti~ée par 6 cm3 d'eau en suspension dans un mélange 50:50
ét~.er-hexane. On laisse revenir à température ambiante en
une heure, puis on filtre. Le gel de silice est lavé à
l'éther.
Après évaporation du solvant et recristallisation
dar.s l'éther isopropylique, on obtient le produit attendu
.
.
.
22
sous forme de cristaux blancs possédant les caractéristiques
suivantes : I
- Point de fusion : 102C
- Spectre UV (chloroforme) : {~ ax _ 2~61n~m
-
ANALYSE ELEMENTAIRE C O
_
Calculé................... 81~04 8,1~ 10,80
~rouvé.................... 81,08 8,21 10,76
i
e) préparation du composé de formule :
___________________ __ __~_______
CH3 e~7~3
J C2C2~5
On refroidit à -50C une solution de 1,5 g de
diisopropylamine et 6 cm3 de butyllithium 2J5M dans 25 cm3
de tétrahydrofuranne. On ajoute 25 cm3 d'hexaméthy].phospho-
ramide,puis 3,4 g d'éthoxycarbonyl-3-méthyl-2-propen-2-yl-
phosphonate de diéthyle dans 5 cm3 de tétrahydrofuranne. On
agite pendant une heure à -50C,puis on refroidit à -78C.
On 2 joute 3 g de composé obtenu en d). Après une heure à
-7~C, on laisse revenir à température ambiante. Le mélange
réa-tionnel est dilué par une solution saturée de chlorure
d'a~lmonium. La phase aqueuse est extraite à l'éther. Les
phases organiques sont réunies, lavées à l'eau et séchées
sur sulfate de sodium~ Le solvant est distillé sous pression
réduite et le résidu est chromatographié sur gel de silice
(solvant : hexane ~ 1 à 3% d'acétate d'éthyle). Après
recnistallisation dans l'hexane, on obtient 1,6 g de produit
attendu possédant les caractéristiques suivantes :
- , . ~ ~ . .
,. -: ,
. . .
: .
. ~ .
- Point de fusion : 92C
- Spectre UV (chloroforme) ~max 367 nm
= 39390
- 1 1
ANALYSE ELEMENTAIRE C H O
_ _ __
Calculé.................. 79,76 8,43 11,81
Trouvé................... 79,78 8,45 11,65
f) préparation du composé de formule :
________________________________
CH3 ~H3
R, ~:
On chauffe pendant 1 heure à 60C une solution
de 1,4g de composé obtenu en e), 1g de potasse dans 20 cm3
d'eau et 20 cm3 d'éthanol. On distille l'éthanol puis on
acidifie par de l'acide chlorhydrique 2N. On filtre, lave
à l'eau et recristallise dans l'acétone. On obtient 1g de
produit attendu possédant les caractéristiques suivantes :
- Point de fusion : 240C
t~ max = 352 nm
- Spectre UV (méthanol) :~
~ -- 37000
hNALYSE ELEMENTAIRE H I O
Calculé..................... 79,33 8,06 12,68
Tr~uvé.......... ...... 79,36 8,08 12,58
::
~ , :
-```` ~2~4L9~
24
EXEMPLE 2
Préparation d'un composé de formule :
~3
~ co2H
a) preparation du compose_de formule :
O ,:
1~ ~
On refroidit à -30C une solution de l1 cm3 de
tétrachlorure de titane dans 100 cm3 de dichlorométhane. On
introduit en 40 minutes,en maintenant la température à
-30C, un mélange de 11,4 ~ de composé obtenu dans l'exemple
ia) et 4,4 cm3 de dichlorométhylméthyléther. On agite pen-
dant une heure à -20C,puis pendant deux heures à tempéra-
ture ambiante. Le mélange réactionnel est versé sur de
l'eau glacée et la phase organique est lavée à l'eau. Après
évaporation du solvant et recristallisation dans l'hexane,
on obtient 6,7 g de produit attendu possédant les caracté-
ristiques suivantes :
- Point de fusion : 140C
- Spectre UV (chloroforme) :~ ~max 301 nm
~ = 16190
._ _
ANALYSE ELEMENTAIRE C H O
Calculé................ 79,65 7,56 12,48
Trouvé................. 79,53 7,90 12,33
.. . ~ - . ,
.. . .. .
```` ` ~ 2~97~
b) preparation du_compose de formule :
~ C2C2 5
Ce composé est obtenu selon le mode opératoire
décrit à l'exemple 1e) dans lequel le composé de l'exemple
1d) est remplacé par le composé de l'exemple 2a). Le produit
attendu est purifié par chromatographie sur gel de silice
(solvant : hexane à 2% d'acétate d'éthyle). Il possède les
caractéristiques suivantes :
- Point de fusion : 73C
C ~max = 347 nm
- Spectre UV (chloroforme): ~ = 31400
ANALYSE ELEMENTAIRE C H 0
.
Calculé................... 78,69 8,20 13,11
Trouvé.................... 78,53 8,23 13,24
c) préparation du composé de formule :
____________________________,____
CH3
Ce composé est obtenu selon le mode opératoire
décrit dans l'exemple 1f), dans lequel le composé de l'exem-
ple le) est remplacé par le composé de l'exemple 2b). Il
possède les caractéristiques suivantes :
.: ~
`, ~ ~ ' ' ~: ' ' :
:: :
., : .. ~ , : .
26
- Point de fusion : 160C
~ max - 347 nm
- Spectre UV (chloroforme)` :
_ - 22500
_
ANALYSE ELEMENTAIRE C H O
Calculé...................... 78,11 7,69 14,20
Trouvé....................... 78,46 7,79 14,43
EXEMPLE 3
Préparation d'un composé de formule :
CO~H
5 ~
a) préparation du composé de formule :
________________________________
~3 ~ 02CH3
On met en suspension 5,4 g de produit obtenu
dans l'exemple 1b) dans 30 cm3 de méthanol et 2 cm3 d'eau.
On ajoute 0,6 g de borohydrure de sodium et on agite à tem-
pérature pendant 16 heures. Le mélange réactionnel est ver-
sé sur de la glace. Le précipité et la phase aqueuse sont
extraits par 3 fois 60 cm3 d'éther. La phase organique est
séchée sur sulfate de sodium et le solvant est distillé
sous pression réduite. On obtient 5,7 g de produit que l'on
redissout dans 50 cm3 d'éther de pétrole. La solution est
refroidie vers -10C et on ajoute, en 30 minutes environ,
35 1, &3 g de tribromure de phosphore en maintenant la tempé-
rature au-dessous de -10C. Après l'addition du tribromure
- ' : ' ' ,
de phosphore, on agite pendant 12 heures à température
ambiante. Le mélange réactionnel est versé sur de la ~lace.
On extrait par 3 fois 60 cm3 d'éther. La phase organique
est lavée par une solution aqueuse de bicarbonate de sodium,
puis par une solution saturée de chlorure de sodium.
Après séchage sur sulfate de sodium,puis évaporation du
solvant, on récupère 5,5g de cristaux jaunes qui sont re-
dissous dans 50 cm3 de toluène. On ajoute 4,1 g de triphé-
nylphosphine, on agite pendant 12 heures à température am-
biante, puis pendant 6 heures à 55C. On laisse refroidir,puis on filtre le précipité, on le lave à l'hexane et on.le sèc'ne.
On obtient 6,5 g de produit jaune pâle qui est redissous
dans 100 cm3 d'~sopropanol. On ajoute 1,7 g de paraform~l-
benzoate de méthyle et 2g de carbonate de potassium. On
chauffe pendant 4 heures au reflux. On refroidit,puis on
filtre et on concentre le solvant sous pression réduite. Le
résidu est purifié par chromatographie sur gel de silice
(solvant : hexane-acétate d'éthyle : 98-2).
Le produit obtenu possède les caractéristiques
suivantes :
- Point de fusion : 130C
. ~max = 325 nm
- Spectre UV (chloroforme) :~
L ~ = 22000
hNALYSE ELEMENTAIRE C ¦ H ¦ O
Calculé.................... 80,56 7,51 11,92
Trouvé........... .... 80,61 7,49 11,97
b) preparation du composé de formule :
~ 3 ~ C02H
~,
::
.
28
Ce composé est obtenu selon le mode opératoire
décrit dans l'exemple 1f) dans lequel le composé de l'exem-
ple 1e) est remplacé par le composé de l'exemple 3a).
Le produit obtenu possède les caractéristiques
suivantes :
- Point de fusion : 240C
~ max = 312 nm
- Spectre UV ~acide acétique) :
_ - 22900
A~ALYSE ELEMENTAIRE
Calculé ................... 80,38 7,26 12,35
Trouvé 80,19 7,30 12,65
__
EXEMPLE 4
Préparation d'un composé de formule :
CH3 CH~ û
11
~ ~ ~ NHC2H5
On agite pendant 15 minutes un mélange de 0,6 cm3
de chlorure de thionyle et 2,2 g d'imidazole dans 20 cm3 de
tétrahydrofuranne. On filtre, puis on lave le précipité
avec 10 cm3 de tétrahydrofuranne. Le filtrat et le sol~ant de
lavage sont reunis. On ajoute 2 g de composé obtenu à l'exem-
ple 1f) et on agite à température ambiante pendant 2 heures.
On ajoute 1 cm3 d'éthylamine et on agite pendant 15 minutes.
Le mélange réactionnel est versé dans de l'eau. Après extrac-
tion à l'éther, distillation du solvant sous pression rédui-
te et recristallisation dans l'éthanol, on obtient 1,87 g du
produit attendu possédant les caractéristiques suivantes :
. ,i : : -:
"
,. . .
7:3~
29
- Point de fusion : 141C
~max : 353 nm
~ Spectre UV (méthanol) :
: 43800
_ _
ANALYSE ELEMENTAIRE C H N O
C27~3sNO~ 0~25 H~O
~ . . _ __ _ ~
Calculé.................. 79,08 8,73 3,42 8,78
Trouvé................... 73,9l 8,61 3,39 6,56
EXEMPLE 5
Pr~paration d'un composé de formule :
C H~ ~ ~ NH ~2~15
On agite pendant 15 minu~es à 4~cC u~ mélan~e de 1,8 g de
carbonyldiimidazole et 3l5 g de composé obtenu à l'exemple
3b)dans 50 cm3 de dichlorométhane. Le solvant est distillé
sous pression réduite puis on ajoute 50 cm3 de tétrahydro-
furanne et 3 cm3 d'éthylamine. On agite pendant 15 mn puis
on distille le solvant sous pression réduite. Le produit
brut est chromatographié sur gel de silice puis recris-
tallisé dans l'éthanol à 95 D/~, On obtient 2,2 g du produit
attendu sous forme de cristaux blancs possédant les carac-
téristiques suivantes :
- .
- .:
. .
.
,
~ - , ,~; .
- Polnt de ~usion : 130C
~max : 311 nm
- Spectre UV ( MeOH)
23900
ANALYSE ELEMENTAIRE C H N O
C28~33N2
~_
Calculé.................. 80,938,00 3,37 7,70
Trouvé................... 80,458,15 3,24 8,40
EXE~PL~ 6
Préparation d'un composé de formule :
O
On chauffe pendznt 30 mn à 60C un mélange de 0,384 g
d'hydrure de sodium, 2,52 g d'éthoxycarbonyl-4-benzyl-
phosphonate de diéthyle et une goutte de penta oxa-1,4,
7,10,13 cyclopentadécane dans 50 cm3 de tétrahydrofuranne.
On ajoute 2,5 g de composé obtenu à l'exemple 1d)et on
agite pendant une heure à 60C. Le mélange réactionnel
est versé sur une solution saturée de chlorure d'ammo-
nium et le produit est extrai~ à l'acétate d'éthyle.
La phase organique est séchée sur sulfate de sodium et
le solvant est distillé sous pression réduite.
L'huile jaune ainsi obtenue est dissoute dans 100 cm3
de solution hydroalcoolique de potasse (2 g de potasse
dans 100 cm3 d'éthanol à 90 %). On chauffe à 80C pen-
dant une heure. Après réfroidissement, le mélange réac-
tionnel est acidifié. Le précipité est filtré et après
recristallisation, on obtient 2 g de produit attendu
",
31
sous forme de cristaux jaunes possédant les caractéristiques
suivantes :
- Point de fusi~n;250 C
Amax 353 nm
- Spectre ~V (n)éthan~
: 37700
_ _
ANALYSE ELEMENTAIRE C H O
~28~303
_ ~ _
Calculé.................... 81,13 7 ,29 11,58
~rouvé. a l ,12 7,32 ll, 4 5
EX~MPLE 7
~réparation d'un composé de formule :
~ ~ 2 5
~ ~ ~
On agite pendant 1 heure à 30C un mélange de 0,5 g d'hydrure
de sodium, 3 g d'éthoxycarbonyl-4-benzylphosphonate de
diéthyle et une goutte de penta oxa-1,4, 7, 10, 13 cyclopenta-
décar.e dans 25 cm3 de tétrahydrofuranne. On ajoute 2,56 g
de composé obtenu à l'exemple 2a)en solution dans 25 cm3
de tétrahydrofuranne. On agite pendant une heure à 30C. Le
mélange réactionnel est dilué par du toluène puis filtré sur
célite. Le solvant est distillé sous pression réduite.
L'huile obtenue est redissoute dans le toluène et filtrée
sur gel de silice. Après distillation du solvant sous pres-
sion réduite et recristallisation dans l'éther de pétrole,
on obtient 2,4 g de produit attend~ sous forme de cristaux
jaunes possédant les caractéristiques suivantes :
:
. .. ~ . . .
: ' , ' ~ ~ ' ' .
~' .
:~ " ' '.' ':
;' ' , ' ' . '
~Z~ ~7
32
Polnt de ~usion :114 C
r ~max : 352nm
_ Spectre VV (CH2Cl2) l ~ 35500
_ _
ANALYSE ELEMENTAIRE ~ C H O
C27'~303 _ _ _ _
Calculé.................. 80,56 7,51 11,92
Trouvé................... 80,43 7,52 11,66
1 0 _ _
E~1PL~ 8
Préparation d'un come~sé de formule :
~r
Ce composé est obtenu selon le mode opératoire décrit dans
l'exemple lf)dans lequel le composé de l'exemple le)est
remplacé par le composé de l'exemple 7.
Le produit obtenu possède les caractéristiques suivantes :
- Point de fusion : 250C
Amax :350 nm
- Spectre UV ~tOH)
~ :34000 .
ANALYSE ELEMEN~AIRE C H O
_ _ _ _ _ _
Calculé.,............... 80,18 7,00 12,82
7rouvé.................. 80,06 7,20 12,75
. ~ ' ' ' '`'
` ., ., , ' ' . ' ' ~
-- ~2
33
EXEMPLE 9
Préparation d'un com~sé de formule :
~ ~13 ~ 3
5 ~,~,~,~
Ce composé est obtenu selon le rnode opératoire décrit à
l'exemple 3a) dans lequel le composé de l'exemple Ib) est
remplacé par le composé de l'exemple 2a) et le paraformyl-
benzoate de méthyle est remplacé par le (méthoxycarbonyl-
4-phenyl)-3-méthyl-2-propénal.
Le produit obtenu possède les caractéristiques suivantes :
- Point de fusion : 124-126C
~max : 360 nm
. - Spectre UV (.CH2Cl2) : ~ 38600
.
ANALYSE ELEMENTAIRE C H 0
C29 H3203
_ _ . .
Calculé................ 81,31 7,48 11,21
Trouvé................. &1,25 7,44 11,25
~, :
.
:
:~ . . ..
.
:: :
.
7~
34
EXEMPLE10
On prépare des comprimés non solubles de 0,5 g
chacun, ayant la formulation suivante :
- Composé de l'exemple 3b)....................... 0,050 g
- Lactose......... , 0,082 g
- Acide stéarique................................ 0,003 g
- Talc puririé................................... 0,015 g
- Edulcorant.q.s.
- Colorant...q.s.
- Amidon de riz .. q.s............................ 0,500 g
On cbtient ces comprimés renfermant chacun 0,05g
de principe actif par compression directe à sec du mélange
des différents constituants. Ces comprimés sont administrés
à raison de 2 à 4 comprimés par jour dans le traitement du
psoriasis. ~'amélioration est visible entre le 30ème et le 60ème jour de
traitement, suivant la gravité des cas traités. On peut remplacer le com-
posé de l'exemple 3b) par la même quantité de composé de l'exemple 7 ou 9.
EXEMPLE11
.
On prépare un gel pour une application topique en
réalisation la formulation suivante :
- Composé de l'exemple 1fl...................... 0,05 g
- Ethanol....................................... 43,00 g
- oe-tocophérol................................. 0,05 g
Polymère de l'acide acrylique ~ haut poids
moléculaire, vendu SOU3 la dénomina-
tion "CARBOPOL 94~' par la société "GOODRICH
C.~EMICAL Co"................................. 0,50 g
- Triéthanolamine en solution aqueuse
à 20%......................................... 3,80 g
- Eau............................................ 9,30 g
- Propylèneglycol .... q.s....................... 100,00 g
On peut remplacer le composé de l'exemple lf) par
la même quantité de composé de l'exemple 6 ou 8.
Ce gel est appliqué sur une peau à dermatose ou
sur une peau acnéique à raison de 1 à 3
*tmarque de commerce)
4~ ~
fois par jour et on constate une amélioration signi~icative
dans un délai compris entre 4 et 12 semaines selon la gra-
vité du cas traité.
EXEMPLE12
On prépare une composition cosmétique anti-solaire
en réalisant la formulation suivante :
- Composé de l'exemple 2b)...................... 1,00 g
- Benzylidene camphre........................... 4,00 g
- Triglycérides d'acides gras(C8 à C12)......... 31iOO g
- Monostéarate de glycérol...................... 6,00 g
- Acide stéarique............................... 2,00 g
- Alcool cétylique.............................. 1,20 g
- Lanoline...................................... 4,00 g
- Conservateurs................................. 0,30 g
- Propanediol................................... 2,00 g
- Triéthanolamine............................... 0,50 g
- Parfum.............. ,....... ..,.............. 0,40 g
- Eau déminéralisée... q.s..... ~................ 100,00 g
On applique cette compositi`on sur le
visage et le corps d'un sujet à peau sensible avant expo-
sition au soleil. On renouvelle l'application plusieurs
fois au cours de l'exposition au soleil. On constate
que cette composition confère une excellente protection
à la peau traitée.
. . .
, ~ :
~ ~ ,
, :
; ',
,. , . .... :.:
~ ~g ~ ~ 7
36
EXEMPLE13
On prépare une crème anti-séborrhéique en réali-
sant la formulation suivante :
- Stéarate de polyoxyéthylène
(40 moles d'OE) vendu
sous le nom de "MYRJ 52" par
la société "ATLAS"............................... 4 g
- Mélange d'esters laurique de sor-
bitol et de sorbitan, polyoxyéthyléné
à 20 moles d'OE vendu sous le nom
de "TWEEN 20" par la société "ATLAS"............. 1,8 g
- Mélange de mono et distéarate de
g'ycérol vendu sous la dénomina-
tion de "~ELEOL" par la Société
"GATTEFOSSE"..................................... 4,2 g
- Propylèneglycol.................................. 10 g
- Butylhydroxyanisole.............................. 0,01 g
- Butylhydroxytoluène.............................. 0,02 g
- Alcool ceto-stéarylique......... ~................ 5 9 2 g
20 - C~nservateurs..................................... qs
- P~rhydrosqualène................................. 18 g
- Mélange de triglycérides capry-
lique-caprique vendu sous la dénomi-
nation de "MIGLYOL 812" par la
s~ciété "DYNA~IT NOBEL"........................... 4 g
- S-carboxyméthylcystéine........................... 3 g
- Triéthanolamine 99%............................... 2~5 g
- Ccmposé de l'exemple 4 0,02 g
- Eau................................. qsp 100 g
Dans cet exemple, on peut remplacer le composé
de l'exemple 4 par la même quantité du composé de l'exe~.ple
5.
*(marque de commerce)
' .!.~, . `
,.',, ~:
- :~.
`
. . .~ ` .
~2~
EXEMPLE 14
On prépare une crème anti-acneique en procédant
au mélange des ingrédients suivants :
- Mélange de stéarat,esde glycérol et de
polyéthylèneglycol (75 moles)
vendu sous le nom de "GELOT 64"
par la société "GATTEFOSSE". .................... 15 g
- Huile de noyau polyoxyéthylénée à
6 moles d'OE vendue sous le
nom de "LABRAFIL M 2130 CS"
par la société "GATTEFOSSE"...................... 8 g
- Perhydrosqualène................................. 10 g
- Colorant......................................... qs
- Conservateurs.................................... qs
5 - Parfums............ ~............................. qs
- Tioxolone........................................ 0,4 g
- Polyéthylèneglycol 400........................... ~ g
- Eau purifiée..................................... 58,5 g
- Sel disodique de l'acide éthylènedia-
mine tétracétique................................ 0,05 g
- Composé de l'exemple 1f.......................... 0,02 g
EXEMPLE1~
On prépare une lotion capillaire contre la chute
des cheveux et favorisant la repousse des cheveux en procé-
dant au mélange des ingrédients suivants :
- Propylèneglycol.................................. 20 g
- Ethanol.......................................... 34,92 g
- Polyéthylèneglycol 400........................... 40 g
30 - Eau................................................ 4 g
- Butylhydroxyanisole............................... 0,01 g
- Butylhydroxytoluène............................... 0,02 g
- Composé de l'exemple 1f........................... 0,02 g
- Minoxidil*........................................ 1 g
*(marque de commerce)
q ,
~.
.,
~2~4~7~
3~
EXEMPLE 16
Il s'agit d'un kit anti-acné comprenant deux
parties :
a) on prépare un gel en réalisant la formula-
tion suivante :
- Alcool éthylique................................. 48 J 4 g
- Propylèneglycol.................................. 50 g
- CARBOPOL 940..................................... 1 g
- Diisopropanolamine 99%........................... 0,3 g
10 - Butylhydroxyanisole............................... 0,05 g
- Butylhydroxytoluène.............................. 0,05 g
- ~ -Tocophérol.................................... 0,1 g
- Composé de l'exemple 3b)......................... 0,Q2 g
b) on prépare un gel en réa-
15 lisant la formulation suivante :
- Alcool éthylique................................. 5 g
- Propylèneglycol.................................. 5 g
- Sel disodique de l'acide éthylènedia-
mine tétracétique................................ 0,05 g
20 - CARBOPOL 940.... ;.................................. 1 g
- Triéthanolamine 99%.............................. 1 g
- Laurylsulfate de sodium.......................... 0,1 g
- Eau purifiée..................................... 75,05 g
- Peroxyde de benzoyle hydraté à 25%............... 12,8 g
Le mélange des deux gels se fera extem-
poranément~ poids pour poids.