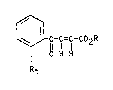Note: Descriptions are shown in the official language in which they were submitted.
~f~ 7~ii
La présente invention concerne de nouveaux dérivés de l'acide 4-
phényl 4-oxo 2-buteno1que, leur procédé de pr~paration, leur applicat;on
comme médicaments et les co~positions les renfermant.
L'invention a ainsi pour objet, sous tou~es les formes stéréoisomeres
5 possibles, les composes de formule (I) :
~ -C-l-C02R (I~
1n R1
dans laquelle R1 repr~sente un rad;cal alkoxy renfermant de 1 ~ 8 atomes
de carbone, R repr~sente un atome d'hydrogene ou un radical alkyle
renfermant de 1 ~ 8 atomes de carbone, ainsl que leurs sels alcalins,
15 alcalino-terreux, d'ammonium ou d'amines pharmaceuti~[uement acceptables.
Lorsque R represente un radical alkyle, il s'agit de pr~férence du
radical méthyle, éthyle, n-propyle, 1sopropyle, n-butyle, isobutyle,
terbutyle ou n-pentyle.
R1 represente de préference un radical méthoxy, éthoxy ou n-
20 propoxy.
Les produ;ts de formule I poss~dent une double liaison et peuvent sepr~senter sous forme d'isomère E ou ~ et ces différents isomères entrent
, , : . . , , : .,
:: ~ . , .~ : : : . :
2 ~ 7~;
bien entendu dans le cadre de llinvention.
Les sels alcalins ou alcalino-terreux des produits de formule (I)
dans laquelle R représente un atome d'hydrog~ne, peuvent être les sels
de sodium, de potassium, de lithium ou de calcium.
Les sels d'amines des produits de formule (I) dans laquelle R
représente un atome d'hydrog~ne, sont les sels d1amines usuelles. Parmi
les amines usuelles, on peut citer les monoalcoylamines, telles que, par
exemple, la methylamine, l'éthylamine, la propylamine, les dialcoyl
amines, telles que par exemple, la diméthylamine~ la diéthylamine, la
10 di-n-propylamine~ les trialcoylamines, telles que la triéthylamineO On
peut citer également la pipéridine, la morpholine, la pipéra2ine et la
pyrrolidine.
L'invention a plus particulierement pour objet les composés de
formule I tels que définis précédemment, pour lesquels R représente un
15 atome d'hydrog~ne ainsi que leurs sels alcalins, alcalino~terreux,
d'ammonium ou d'amines ainsi que ceux pour lesquels R1 repr~sente un
groupement méthoxy.
Parmi les compos~s de l';nvention, on peut citer tout
particulièrement l'acide ~E) 4-(2-méthoxyphényl) 4-oxo 2-butenoqque ainsi
20 que ses sels alcalins, alcalino-terreux d'ammonium ou d'amines.
La partie expérimentale exposée c;-apr~s montre que les produits de
l'invent;on présentent des propriétés pharmacologiques beaucoup plus
intéressantes que l'acide 4-phényl 4-oxo 2-but~noïque décrit en tant que
m~dicament dans le brevet français 2.515.û38
25 Les composés de formule I ains; que leurs sels présentent
d'int~ressantes proprietés pharmacologiques : ils manifestent une
importante act;vité antiulc~reuse dans les affections du tractus
digestif. De plus, ils manifestent lorsqu'ils sont mis en contact avec
la muqueuse gastrique, une activité antisecrétoire et une activité cyto-
30 pro~ectrice.
Ces propriétés justif;ent l'ut;lisat;on des composés de formule Iainsi que de leurs sels pharmaceutiquement acceptables, à titre de
médicaments.
L'invention a donc pour objet, à titre de médicaments, les composés
35 de formule I ains; que leurs sels alcalins, alcalino-terreux~ d'ammonium
et d'amines, pharmaceutiquement acceptables.
L'invention a tout particulièrement pour objet, à titre de m~dicament,
l'acide (E) 4-(2-méthoxy phényl) 4-oxo 2-buténoique, ainsi que ses sels
alcalins, alcalino-terreux, d'ammonium ou d'amines pharmaceutiquement
40 acceptables.
.:, ` ~` ' -
.
,
3 ~2~76
Les médicaments selon l'invention trouvent leur emploi en
thérapeutique humaine ou animale, notamment dans le traitement des
hyper-chlorhydries, des ulcères gastriques et gastro-duodénaux, des
gastrites, des hernies hiatales, des affections gastriques et gastro-
5 duod~nales s'accompagnant d'hyperacidité gastrique.
La posologie, variable selon le produit utilisé et l'affection en
cause, peut s'échelonner par exemple entre 0,05 et 2 9 par jour che~
l'adulte par voie orale.
La pr~sente demande a encore pour objet les compositions
10 pharmaceutiques qui contiennent a titre de principe actif au moins un
médicamerlt précité. Ces compositions sont réalis~es de facon à pouvoir
être administrees par la voie digestive ou parent~raleO
Elles peuvent ~tre solides ou liquides et se présenter sous les
formes pharmaceutiques couramment utilisees en médecine humaine ou
15 an;male, comme par exemple, les compr;m~s s;mples ou dragéifiés, les
gélules, les granulés, les suppos;~oires, les préparations injectables ;
elles sont pr~par~es selon les methodes usuelles.
Le ou les pr;ncipes actifs, peuvent y être incorporés à des
excipients habituellement employés dans ces composit;ons
20 pharmaceutiques, tels que le talc, la gomme arab;que, le lactose,
l'am;don, le stéarate de magnésium, le beurre de cacao~ les véhicules
aqueux ou non, les corps gras d'orig;ne an;male ou végétale, les dérivés
paraffiniques, les glycols, les divers agents mouillants, dispersants ou
émulsifiants, les conservateurs.
L'invention a également pour objet un procédé de préparation des
composes de formule (I), caractérisé en ce que llon fait reagir l'acide
glyoxylique sur un dérive de formule tII):
~,
COCH3 ~II)
R1
dans laquelle R1 conserve sa signification précedente, en présence d'un
agent déshydratant, pour obtenir le composé de formule ~I) correspondant
35 que l'on soumet, si désiré, soit a l'action d'une base pour en former le
sel, soit à l'action d'un agent d'estérification pour obtenir un composé
de formule I dans laquelle R représente un radical alkyle renfermant de 1
à 8 atomes de carbone.
~'invention a encore pour objet une variante du procédé précedent
40 caracterisé en ce que l'on fait réagir un composé de formule (III):
...... .
.
. . : ,. . . :~
.~ .
~2~
r (III)
R1
dans laquelle R1 conserve sa signif;cation préc~dente avec l'anhydr;de
malé1que pour obten;r le composé de formule I correspondant dans
laquelle R repr~sente un atome d'hydrogene.
Dans un mode de r~alisation pr~f~r~ du proc~d~ de l';nvention :
10 - l'agent de déshydratation est un acide comme, par exemple,
l'acide acbtique ;
-- la base à laquelle on soumet, s; d~sire, le compose de formule I dans
laquelle R repr~sente un atome d'hydrogène est, par exemple,
l'hydroxyde de sodium, l'hydroxyde de potassium, l'hydroxyde de
Lithium, l'hydroxyde de calc;um, l'éthylate de sodium, l'ethyla~e de
potassium, l'ammon;ac ou une amine, telle que par exemple la
methylamine, l'éthylamine, la propylamine, la d;méthylam;ne~ la
di~thylamine, la di-n-propylamine, la triéthylamine, la pip~ridine, la
morphol;ne, la pipérazine ou la pyrrolidine ;
Zû - la réaction avec la base est realis~e, de preférence dans un solvant
ou un mélange de solvants, tels que l'eau, l'éther ~thylique~ l'ethanol,
l'ac~tone ou l'acéta~e d'éthyle ;
- la r~act;on d'estérificat;on a lieu, par exemple, en faisant réagir
l'acide de formule I avec l'alcool de formule R-OH en milieu acide,
par exemple, en présence d'acide chlorhydrique, phosphorique ou
paratoluène sulfonique.
L'esterifica~ion peut naturellement être réalisee selon les autres
procedés usuels, comme, par exemple, en faisant réagir le chlorure
d'acide et l'alcool ou bien l'anhydride d'acide et l'alcool ou encore en
30 faisant réagir l'ac;de et l'alcool en pr~sence de dicyclohexylcarbo-
diimide~
Dans la variante du procédé, la réaction entre le compos~ de formule
tIII) et l'anhydride malelque a lieu en présence de chlorure d'aluminium.
Acide ~E) 4-~2-m~thoxyph~nyl) 4-oxo 2-but~no1~ue
.
On porte au reflux pendant 8 heures un mélange de S g de Z-méthoxy
acbtophenone, 3,û6 9 d'acide 0lyoxylique monohydrate, SO cm3 d'acide
ac~tique et 5 cm3 d'acide chlorhydrique. On evapore les solvants sous
pression reduite, reprend le residu ~ ther éthyl1que, filtre et
recristallise dans l'ether~ On obtient 2,5 g de produit attendu.
4û F = 146-148~C.
. . . , , :
' ~
`; ~ . ' ~
5 ~,2~76
r ~ .
: comprim~s.
On a préparé des comprim~s répondant à la formule suivante :
~ produit de l'exemple 1......................... ~... ....100 mg
5 - excipient q.s. pour un comprim~ terminé à ~........ ~. 300 mg.
(Detail de l'excipient : lactose, amidon de blé, am;don traité, amidon
de riz~ stéarate de magnésium, talc).
Exemple 3 : GéluLes.
On a prépare des g~lules repondant à la formule suivante :
10 - produit de l'exemple 1............................. ....100 mg
- excip;ent q.s. pour une gélule terminée à.......... ...300 mg
tDétail de l'excipient : talc, stearate de magnésium, aérosil~.
~0~ C~
1 ) =_~
La technique utilisée est d~crite par H.SHAY et al dans
Gastroenterology 5, 43, 1945.
On ut;lise des rats m3les pesant environ 200 g (10 animaux par lot),
20 prives de nourriture depuis 48 heures, mais disposant à volonté de
soluté glucosé à 8 %. On ligature le pylore des rats légèrement
anesthésiés ~ ther, puis dès la fin de l'opération, on administre les
produits à tester à des doses diverses ou pour les animaux temoins, une
solution de carboxym~thyl cellulose à 0,5 % par voie intraduodenale~
25 pu;s on suture l'incision abdominale.
Trois heures plus tard, les an;maux sont sacr;f;és et leur estomac
pr~levé après ligature de l'oesophage. Le suc gastr;que est prélevé et
centrifug~. On relève alors le volume et sur 100 ~l de suc gastrique, on
détermine l'acidit~ totale par titrage à pH 7 à l'aide de soude NJ10.
Les pourcentages de variation d'acid;te totale des secrét;ons
gastriques sont calcules par rapport aux résultats obtenus avec les
an;maux t~moins.
Les résultats sont rapportés dans le tableau figurant ci-après.
2) Détermination de l'activité antiulcéreuse.
, ,, _ , _
3S Ulcère de stress.
La technique consiste à induire sur des rats des ulcères au niveau de
l'estomac par stress (contrainte et froid).
La technique utilisée est décrite par E.C. SENAY et R.J. LEVINE,
Proc. Soc. Exp. Biql. 124, 1221 ~1967).
On utilise des rats femelles de 150 g (5 animaux par lo~) mis a jeun
* ~marque de commerce)
~: .
.' ~ ' ` ' '.
.:
6 ~ 6
pendant 48 heures avec de l'eau "ad Libitum" et du solute glucosé
pendant 8 heures. Les animaux recoi~ent par sonde oesophagienne le
produit teste ou wne solution de carboxymethyl cellulose à 0~5 X pour
les animaux temoins.
5 Deux heures plus tard " es animaux sont emmaillotes dans un corset de
grillage, leurs pattes sont li~es et l'ensemble est place dans un refri-
gerateur ~ 8~C pendant deux heures. Les rats sont dégagés et tués à
l'ether.
Leurs estomacs sont prélev~s~ ouverts selon la grande courbure et
10 examines à la loupe binoculaire ; la gravité des lesions est côtee de O
à 3 pour chaque estomac.
On calcule pour chaque lot de rats l'intensite moyenne des
ulcérations, on deter~ine ensuite pour chaque lot le degr~ d'ulceration
par rapport aux temoins.
Les resultats sont rapportés dans le tableau figurarlt ci après. Le
produit 1 est le produit de l'exsmple 1, le produit p le produit
de l'exemple 1 du brevet français 2.515.038
3) ~ .
La dose letale 50 (DL5n) a été evaluée aprbs administration des
20 produits par voie orale chez la souris.
Les resultats sont rapportes dans le tableau figurant ci-après.
RESULTATS :
Activite antisecrétoire et anti-
Produit DL5~ ulcéreuse ~var.% par rapport aux
mg/kg t~moins).
Doses mg/kg Conc.Acide Ulc~ration
1 370 10 - 78 ~ 80
p 25û 10 - 66 - 54
Conclusion : Le produit de l'exemple 1 presente une activ;te anti-
secretoire gastrique nettement plus importante que le produit de
l'art antérieur~