Note: Descriptions are shown in the official language in which they were submitted.
9~S7Z
La présente invention est relative a de nouveaux
salicylates lipophiles comportant au moins un groupement
ammonium quaternaire, leur procéde de preparation et les
compositions pharmaceutiques et cosmetiques les contenant.
On a décrit dans l'etat de la technique l'utilisa-
tion de differents sels d'hexadecyl trimethylammonium dont le
salicylate comme agent germicide. Voir en particulier SHELTON
et al., J.A.C.S. (1946), 68. 753 ainsi que GAUTIER et al.,
Bull. Soc. Chim. France 11955), 634 et Broh-Kahn, Intern.
Rec. Med. (1960), 173, 219.
La Demanderesse vient de decouvrir, ce qui fait
l'objet de l'invention, de nouveaux salicylates lipophiles
d'ammonium quaternaires.
Elle a constate en particulier que ces composes
etaient particulièrement actifs en tant qu'agents bacterici-
des et keratolytiques, dans le traitement de dermatoses
infectieuses ou non, pouvant être d'origine bacterienne,
fongique ou/et liees à l'implantation de certaines levures à
caractère pathogène. Notamment, ces nouveaux- composes
20 presentent l'interêt de pouvoir ê-tre utilises dans le
traitement de l'acne, des comedons, du psoriasis et de
prevenir des infections cutanees dont l'apparition est un
phenomène secondaire à un stress cutane quelconque tel que
les coupures, les brûlures, les erythèmes solaires ou les
inflammations diverses. En outre, ils presentent de bonnes
proprietes antipelliculaires et desodorisantes.
La Demanderesse a decouvert, egalement, que
cer'cains composes presentent de bonnes proprietes d'absorp-
tion de lumière de rayonnement UV.
--1--
: ' ~
~Z9~7Z
De plus, ces composés peuvent être utilisés
avantageusement en opthalmologie et pour le traitement des
infections buccales et les inflammations des mugueuses
nasales et plus généralement pour le traitement des maladies
virales. Ces composés présen-tent par ailleurs des propriétes
spermicides.
Ces composés présentent, par ailleurs, de bonnes
propriétés d'agents conservateurs. Certains, parmi ces
composés, peuvent être utilisés pour leurs pxopriétes
tensioactives et de stabilisant de mousse.
La Demanderesse a decouve~t, notamment, que ces
nouveaux composés présentaient un intérët particulier dans le
traitement de l'acné.
L'acné, comme cela est bien connu, est un désordre
cutané, polymorphe, survenant à la puberté et régressant
spontanément dans la grande majorité des cas, vers 20 à 25
ans. L'acnë concerne, chez les individus touchés, toutes les
zones riches en glandes sébacées (le front, la face, les
ailes du nez, le torse, le dos) à l'exception du cuir
chevelu.
L'étiopathogénie de l'acné, bien que mal définie,
prend son origine dans la formation d'une lesion caracteris-
tique, le comédon. Celui-ci résulte de l'obs-truction du
canal pilos bacé par suite d'une diskératinisation de la zone
de l'infundibilum du canal.
Cette obstruction a pour effet majeur de modifier
la rheologie du sebum et les caracteristiques physico-chimi-
ques du milieu, tels que pH, tension de vapeur d'oxygène,
etc...
S~Z
Cette modification permet l'hyperprolifération des
souches résidentes cucanées, principalement le PROPIONIBACTE-
RIUlM ACNES, qui est une souche anaerobie ou aéro-tolérante.
L'hyperprolifération bactérienne a pour conséquen-
ce de libérer dans le milieu certaines proteases ou
hyaluronidases, d'origine bactérienne, qui provoquent une
lyse du sac folliculaire et ainsi la libération des composés
inflammatoires au sein du derme et déclenchent la réaction de
type inflammatoire de l'organisme.
. Si la nature des composés inflammatoires est a
l'heure actuelle non déterminée, leur origine bactérienne
semble faire peu de doute, expliquant le bon succes
thérapeutique dans l'acné inflammatoire de composés
antibactériens tant 2ar voie orale que par voie topique. . ~.
On a préconisé, dans ce but, tres souvent des ~;
agents antibac-tériens, comme les antibiotiques tels que
l'erythromycine, la tétracycline, la clindamycine, dans le
traitement de l'acné. Ces composés donnent des résultats
excellents, mais leur u-tilisation trop poussée rend les
souches de PROPIONIBACTERIUM ACNES résistantes a ces mêmes
~antibiotiques, de telle sorte que le traitement répété peut
s'avérer peu efficace.
La Demanderesse a decouvert que les nouveaux
salicylates lipophiles d'ammoniums quaternaires avaient une
activité antioactérienne in vitro vis-a-vis du PROPIONIBACTE-
RIUl~l ACNES, similaire à celle des antibiotiques utilisés
antérieurement, sans pour autant induire des phénomènes de
résistance bactérienne.
Les nouveaux salicylates lipophiles d'ammoniums
quaternaires sont particulierement plus actifs sur les
souches de PROPIONIBACTERIU~I ACNES que le salicylate
9~957Z
d'hexadécyltriméthylammonium, ainsi que d'autres dérivés
d'ammoniums quaternaires à contre anion organique connus de
l'etat de la technique.
Les salicylates lipophiles d'ammoniums quaternai-
res conformes à l'inven-tion presentent égalemen-t l'avantage
d'être peu agressifs pour la peau~ Ces nouveaux composés
sont 2ar ailleurs plus aptes à pénétrer le stratum corneum
dans le cas d'une application topiqu~.
L'invention a donc pour objet, à titre de composés
nouveaux, . des salicylates lipophiles quaternaires définis
cl-apres.
Un autre objet de l'invention est constitué par
des com2ositions de traitement thérapeutique contenant les
composés définis ci-dessus.
L'invention vise également une composition et un
procédé de traitement cosmetique à base de ces composes.
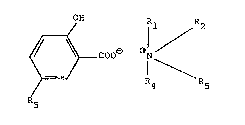
Les salicylates lipophiles d'ammoniums quaternai-
res qui constituent l'objet prlncipal de l'invention, sont
des composes repondant essentiellemen-t à la forMule:
::
,OH
Rl R2 ~I)
R4 3
R5
dans laquelle:
(i) Rl, R2, R3 et R4, ;dentiques ou differents,
designent un radical alkyle ou alkylecycloalkyle, sature ou
insaturé, en cl à C22, pouvant éventuellement etre interrompu
par un ou plusieurs groupements choisis parmi les groupements
--4--
.
~Z~ 2
éther, thioéther, sulfoxyde, ester, amide, sulonamide,
carbamate, ureido et/ou pouvant porter en bout de chaine ou
dans la chalne au moins un atome d'halogène ou un groupement
hydroxyle;
tii) R3 et/ou R4 désigne(nt) un groupement:
8--~OC2H3R7]n ~OCH2CHOH-CH
dans lequel:
O < n < 4 et p désigne 0 ou 1,
R8 désigne H ou un radical alXyle, alkényle,
alkylcycloalkyle ou al]sylaryle en Cl à C18, ~es groupements
alkyles pouvant etre linéaires ou ramifies et les cycles --
aliphatiques ou aromatiques pouvant éventuellement porter un
ou plusieurs substituant(s) al~syle ou alcoxy en Cl à C4;
R7 désigne un atome d'hydrogène ou un groupe CH3
ou CH2OH, sous réserve que lorsque'R7 désigne CH2OH, R8 es,t
différent de H et p est égal à 1, et dans les autres cas, p=0,
le groupement (OC2H3R7) pouvant désigner l'un
et/ou l'au-tre des enchainements suivants:
--CH2-f~- ; -O-CH-CH2-
R7 7
dans lesquels Rl et R2~ont les signlfications déslgnées au
paragraphe (i);
(iii) R4 designe le groupement:
~C~2~
129~o57Z
dans lequel n designe 0 ou l, auquel cas Rl, R2 et R3 ont les
signirications indiquees ci-dessus, R6 représente un atome
d'hydrogène ou d'halogène, ou un groupement hydroxyle, un
reste alkyle ou hydroxyalkyle ou un reste acyle en Cl à Cl8;
(iv) Rl et R2 forment un heterocycle aromatique
(auquel cas R3 n'existe pas) repondant à la formule:
~ N~
~ R4
dans laquelle R4 a les significations indiquees ci-dessus;
(v) Rl et R2 forment un heterocycle non aromati-
que, sature ou insature, éventuellement interrompu pa. un
atome d'oxygène ou un atome d'azote ou un atome de soufre;
auquel cas R4 represente un groupement défini ci-dessus et R3
represente un groupement tel que défini dans le paragraphe
(i);
(vi) Rl, R2 et R3 foi-ment ensemble avec un ou
plusieurs atomes d'azote auxquels ils sont lies des derives
polycycliques tels que le diazabicyclo-octane ou l'hexamethy-
lène té'cramine, R4 representant dans ce cas un groupement tel
que déiini dans les paragraphes (i) ec (iii).
D'une manière genérale, les groupements ammonium
sont tels qu'au maximum deux des radicaux Rl à R4 sont
constitués de 12 ou 21us de 12 atomes de carbone consécutifs.
Dans les différents cas evoques ci-dessus, R5
désigne un groupement:
12~S7;~
~11 ~ ( CH2 ) n~C~3
O n varian-t de 0 a 10 inclus.
Les composés conformes a l'invention sont préparés
de pré~erence a partir d'un sel, tel que plus particuliere-
ment, le carbonate des ammoniums quaternaires correspondants,
solubilise en milieu alcoolique, et de preference dans le
mëthanol auquel on ajoute le derive d'acide salicylique
lipophile choisi solubilise egalement dans un alcool tel que
l'éthanol ou le methanol, ou encore dans un ether comme le
tetrahydro~uranne. La reaction demarre toute seule et est
suivie d'un degagement de gaz carbonique.
Des composes preferes sont notamment choisis parmi
les composes suivants: octanoyl-5 salicylate d'hexadecyltri-
methylammonium, decanoyl-S salicylate d'hexadecyltrimethylam-
monium, dodecanoyl-5 salicylate d'hexadecyltrimethylammonium,
octanoyl-5 salicylate d'hexadecylpyridinium, decanoyl-S
salicylate d'hexadecylpyridinium, dodecanoyl-5 salicylate
d'hexadecylpyridinium, octanoyl-5 salicylate de benzyl
dimethyl hexadécylammonium, decanoyl-5 salicylate de
benzyldim~;thyl hexadécylammonium, dodecanoyl-5 salicylate de
benzyldimethyl hexadecylammonium, decanoyl-5 salicylate de
benzyltrimethylammonium, decanoyl-5 salicylate d'hexadecyldi-
methyl hydroxyethyl ammonium, dodecanoyI-5 salicylate de
tetramethyl-ammonium, decanoyl-5 salicylate de dodecylethyl-
dimethyl-ammonium, decanoyl-5 salicylate de trimethyl
~-hydroxyethylammonium, dodecanoyl-S salicylate de trimethyl
~-hydroxyéthylammonium, dodécanoyl-5 salicylate de N-hexade-
cyl N-m~thylimidazolinium, decanoyl-5 salicylate de N-dodecyl
N-methylmorpholinium, dodecanoyl-5 salicylatede N-methyl
N-octylpiperidinium,, dodecanonyl-S salicylate d'azonia-l~aza-
4'b~cyclo [2'.2'.2'] octyl hexadécane, octanoyl-5
salicylate de benzethonium, dodecanoyl-S salicylate de
--7--
~9~S7;~
benzethonium, octanoyl-5 salicylate de N-(chloro-3 allyle)-
hexaminium, dodecanoyl-5 salicylate de N-(chloro-3 allyle)
hexaminium.
Les compositions pharmaceutiques, oDjet de
l'invention, sont essentiellement caracterisées par le fait
qu'il s'agit de compositions topiques contenant dans un
milieu pharmaceutiquement acceptable et approprie pour une
application topique, au moins l'un des composes repondant à
la formule (I) ci-dessus.
Ces compositi.ons sont particulièrement appropriees
pour le traitement de diverses dermatoses telles que l'acne.
Les compositions peuvent se presenter sous forme
de solution ou dispersion aqueuse ou anhydre, ou bien sous
forme d'emulsion ou suspension, contenant au moins un compose
repondant à la formule (I) dans des concentrations comprises
entre 0,001 et 15% en poids par rapport au poids total de la
composition, et de preference comp.rises entre 0,05 et 5%.
Ces compositions peuvent contenir des vehicules et
adjuvants pharmaceutiquement acceptables, bien connus dans
l'etat de la technique. On peut par exemple preparer des
solutions en utilisan-t un ou plusieurs solvant(s) organi-
que(s) acceptable(s) du point de vue physiologique choisi(s), en
plus de l'eau, parmi les solvants tels que l'acetone, l'ethanol,
l'alcool isopropylique, les ethers de glycol, tels que les
produi-ts vendus sous la marque de commerce DO~ANOL, les
polyglycols et polyethylèneglycols, les esters, de preference
les lactates d'ethyle ou d'isopropyle, d'al~yle en Cl-C4,
d'acides à courte chaine, les triglycerides d'acides gras,
tels que les produits vendus sous la marque de commerce
MIGLYOL, le myristate d'isopropyle, les huiles animales,
minerales, vegetales et les polysiloxanes.
~29~72
Les compositions conformes à l'invention peuvent
egalement renfermer des agents épaississants tels que la
cellulose et/ou des dérivés de la cellulose à raison de 0,5 à
20% en poids par rapport au poids total de la composition.
Elles peuvent également con-tenir des gommes comme la gomme de
xanthane, de guar, de caroube, la ~ornme arabique ou bien des
polyethylène glycols, des bentones et des montmorillonites,
etc
Ces compositions conformes à l'invention, peuvent
egalernent contenir, en association, des agents antiacneiques
tels que les derives retinoiques, les agents antibacteriens,
les anti-inflammatoires, les steroldiens à action non
hormonale, notamment la pregnenolone, dejà connue pour le
traitement et les soins de la peau, dont les propriet~s sont
decrites dans le brevet américain No. 2.791.534.
On peut ajouter, si nécessaire, un adjuvant c'lloisi
parmi les agents anti-oxydants, les tensio-actifs, d'autres
agen-ts conservateurs, des agents filmogenes, des kéra-toly-ti-
ques ou comédolytiques, des parfums et des coloran-ts.
Par exemple,parmi les anti-oxydants, on peut citer
la t-butylhydroxyquinone, le butyl hydroxyanisole, le butyl
hydroxy~oluene et l'~-tocophérol et ses derivés.
Les formes galéniques principalement conditionnées
pour la voie topique, se présentent sous forme de crèmes, de
laits, de gels, de dispersions ou microémulsions, de lotions
plus ou moins épaissies, de tampons imbibés, de pommades, de
sticks ou bien sous forme de formulations aérosols en forme
de spray ou de mousse, ou encore sous forme de pain de savon.
Un objet de l'invention reside dans l'utilisation
des composés de formule (I) ci-dessus pour la préparation de
telles compositions destinées au traitement des dermatoses.
s~
Les composi-tions conformes a l'invention peuvent
egalement être utilisees pour le traitemen-t cosmetique de la
peau, notamment comme agents comedolytiques, keratolytiques,
antisolaires, verrulytiques ou comme agents traitants les
cheveux ou le cuir chevelu.
Ces compositions peuvent adopter des formes
similaires à celle indiquee ci-dessus et contenir des
adjuvants habituellement utilises en cosmetique dans des
compositions destinées au soins et au traltement cosmétique
de la peau.
Le procédé de traitement cosmétique consiste à
appliquer une telle composition sur la peau.
L'activité antibactérienne des composés conformes
à l'invention a été étudiée par la méthode de dilution en vue
de déterminer la Concentration Minimale Inhibitrice (C.M.I.)
suivant la méthode décrite et employée par G.A. DENYS et al.,
Antimicrobial Agents~and Chemotherapy (1983) 23, 335-337, et
J.J. LEYDEN et al., ~. Am. Acad. Dermatol. (1983) 8 (1) 41-5,
en utilisant comme souche de PROPIONIBACTERIUM ACNES, la
souche ATCC 6919.
Les concentrations minimales inhibitrices (C.M.I.)
expriMées en ~ug/ml (DMSO) des salicylates lipophiles
d'ammoniums quaternaires, conformes à l'invention, ~igurent
dans le tableau I ci-après.
--10--
i7~
I _ I ~
~ ,. ~ ~N U )
P;~ ~: * * Y ~ ~ Y ~
~ ~ ~ ~ :~ X~
~O ~O ~O ~O ~D ~O
~r tl) Cl) ~ tl) Cl.) ~
_ _
X~ ~ X ~ ~ . ~.
H .
,. ~ ~ IDrl ~ 3~
.
H ~ r ~1 ~
~: ~ X . X .~ ~
~ 6~ ~, ~ ~o ~ r~ ~ ; ~
~ ~1 (~1 ~1 ~ ~i ~ ~ r-l H
_ ~` ~ __
`~X ~X S `~X
a) ~ _ ~
, S S. ~ S
~ ~ ~ ~ ~ ~ U~
~a) ~ ~ ~ ~ ~ ~ ~ ~ ~ ~'c ~
Q. ~ S~ S~ a~ ,~ ul~ ~i~ ~ u~ o
~O~ ~ _ _ ~ ~ ~ ~ ~ 0~ ~.~ ~ 'O `~
,~Z ~S ~ ~ ~S ~ d~ ~ `E~
O ~ ~ rd h ~ ~ ~ ~ ~n) ~ ~0 ~ ~ ~ ~n~-
z u~ z; ~ ~ u~ ~ o ~ a ~ a ~ o ~,
Z ~ ~ ~ ~ ~ ~O ~ CO
_ . __ .
--11--
S7~
.., ~ ~, ~ __
~C ~1 ~ 5
~c~ Y m~ ~ ~ O~ Y
~ ¢~ ~3 ~ ~ X~D
~ ~ ~ r~l ~ ~
~ ~ Y 3 '_ 3 l
_ ~ ~ ~ ~ -,.,
~O ~D ~D ~
K C ~ ~:: Y ~C
__ .
K Z Y Y Y ~ Y
_ ~ ~ ~
~ ~C~ Y~ Y~ X~ Y~ Y~
~ , ~
H ~ ~ ~ ~r Ir) . ~D
,¢ ~ ~i o` ~i ~1 ~ ~ :`
~ ~ : :
~ , __ _ ~ .
a~ ~ ~ ~ ~ ~ ~ ~ ~
~ ~ ~ ~ ~ ~ ~ C: ~ ~ ~
,~ ~ ~ X ~, ~ t,~ ~ ~, ~ ~ 'C
~ ~rs U ~ U ,C ~ :~ U ~ U \~ Q
.~ ~ ~ '~ ~ '~ :~ ~ '~ ~ '~
Ou~ Q. u~ ~ ~ Ln u~ u~
~i~f~ u)~ . I ,~- I h I U
U~ ~ ~ ~ ~ ~ ~ ,1 ~ ~ ~ ~ ~ O
~a ~ ~ ~ ~ ~ ~ u u ~ u
~ ~ 8~ ~ `~ ~ a~`~ `~ `~
o o
z o~ ~ ~ _~ ~
--12--
~2~7Z
~ ~:~ :~ ~ _ r~
tr;U~ ~ $ ~ ~ ~ Y~
~ C ~ ~ D,~, ~
~;~ Y o U~
_.
~ .
P~ Y~ ~ ~ :~
' ~ Y~ ~C~ ~ ~ ~ ~ .
~3
_~ ~ r1 ~ ~ . Z
~ ~;~ ~ ~ ~ q 1~
H O~ ~
~:1 ~ U-) , 01~ ~i . C~ o ~1`
~3 . .
. .
O I ~ ~ ~ I
~ ~al Q ~1 t) ~ (`1 ~: t~ ~
~Q) ~ ~ ~' ~ '~ ~ ~ Z ~ ,~ Z
O ~ ~ ~ ~ ~ ~ ~ Z ~ ul~
a a ~ r ~ ~ ~ ~ ~ ~ 3 ~ J ~ ~ ;~
~o a ~ ~ ~ 0 ~ ~ ~ ~ u ~o ~ ~ ~ ~ h ~ ~e
_
O ~n ~D 1- ~0 CS~ O
~ ~ ~ ~ ~1
__ _ ,
--13~
9~tS72
..
t~U' ~) N ~3 ~ m~,
~ X~ ~ ~ ~
~ ~: l l ~ ~ D
. C~ ~ ~ ~
~; . ' ' ~, ~ ~ ~ . .
X~
~ l l ~z. Y l
o
.~ .
_ ,, .
H ~ ~i a~ u~ ~I
.~¢ ~ C5~ ~ ~i ~1 ~
F~ ~ . __
~_................................. _ :"
0~ ~ ~- ~ ~ ~
O ~ ~; (~ ~ r ~ ~ ~} .
~, ~ , ~ ~ n ~ u~ ~ Lr) ~3
o ~ ~ ~0~ 8 ~ ~ ~
E ~ Z '~ ~ Z ~æ. a ~ ~ ~ 8 ~d
.
O ~1 ~`I r~ ~ ~n
z;
-14-
~LZ9~i7Z
Il ressort de ce tableau que les salicylates
lipophiles conformes à l'invention sont nettement plus actifs
sur la souche PROPIONIBACTERIUM ACNES que les salicylates
antérieurement préconisés dans l'état de la technique.
Les exemples suivants sont destinés à illustrer,
d'une part les procédés de préparation des composes conformes
à l'invention, et d'autre part des compositions pharmaceu-
tiques et cosmetiques mectant en oeuvre ces composes.
_XEMPLE DE PREPARATION l_
Preparation d'octanoyl-5 salicylate de N-hexadecyl
N,N,N-trimethylammonium: compose No. 4 (tableau I).
A une solution de 2,62 g (4,16 mmoles) de
carbonate d'hexadecyltriméthylammonium dissous dans 15 ml de
méthanol, sont ajoutes 2 g (7,57 mmoles) d'acide octanoyl-5
salicylique dissous prealablement dans 15 ml de méthanol; le
mélange est agité 1 heure à température ambiante puis le
solvant est évaporé et le résidu solide blanc obtenu est
recristallisé dans un m~lange acetone/ether diethylique pou-
conduire à 3,8 g (91,5% de rendement) d'octanoyl-5 salicylate
d'hexadecyltrimethylammonium.
.
F = 130C (acetone/ether diethylique)
Analyse elémentaire: C34h~lNO4; M = 547,9
C H N
Calculé ~ 74,54 11,22 2,56
Trouvé % 74,48 11,~31 2,62
Les spectres de RMN lH et C confirment la
structure attendue avec les valeurs caractéristiques du
cation ammonium et de l'anion octanoyl-5 salicylate.
EXEMPLE DE PREPARATION 2
Préparation du decanoyl-5 salicylate de N-hexade-
cyl N,N,N-trimethylammonium: compose No. 5.
-15-
.
.~ ~
5~Z
A une solution de 2,2g (3,5 mmoles) de carbonate
d'hexadécyltriméthylammonium dissous dans 15 ml de méthanol,
sont ajoutés 2 g (6,85 mmoles) d'acide decanoyl-5 salicylique
dissous préalablement dans 15 ml d'éthanol; le melange est
agi~e 1 heure à température ambiante, puis les solvants sont
évaporés et le résidu solide blanc obtenu est recristallisé
dans un mélange acétone/éther diéthylique pour conduire a 3,8
g (96~ de rendement) de décanoyl-5 salicylate d"nexadecyltri-
méthylammoniurn.
F = 130C (acétone/ether diéthylique)
Analyse élémentaire: C36H65NO4; M = 575,9
C I~ N
Calculé ~ 75,08 11,37 2,43
Trouvé ~ 75,05 11,42 2,44
Les spectres de RMN H et C confirment la
structure attendue avec les valeurs caracteristiques du
cation ammonium quaternaire et de l'anion décanoyl-5
salicylate.
EXE~IPLE DE PREPARATION 3
Préparation du dodécanoyl-5 salicylate de
N-hexadécyl ~,N,N-triméthyl.ammonium: composé No. 6.
A une solution de 2 g (3,18 mmoles) de carbonate
d'hexadecyltriméthylammonium dissous dans 15 ml de methanol,
sont ajoutés 2 g (6,25 mmoles) d'acide dodecanoyl-5
salicylique dissous prealablement dans 15 ml d'éthanol; le
melange est agite 1 heure à température ambiante, puis les
solvants sonc évapores et le résidu solide blanc obtenu est
recristallise dans un mélange acetone/ethe. diethylique pour
conduire à 3,5 g (93~ de rendement) de dodécanoyl-5
salicylate d'hexadécyltriméthylammonium.
F - 130C (ac~tone/éther diethylique)
-16-
~ ;~9~7Z
Analyse elem2ntaire: C38H~gNO4; ~1 = 604
C H N
Calcule % 75,57 11,52 2,32
Trouve % 75,17 11,61 2,5
Le spectre de RM~ du C confirme la st.uctu~e
attendue avec les valeurs caractëristiques du cation ammonium
quaternaire e-t de l'anion dodecanoyl-5 salicylate.
Le spectre UV (ethanol) demontre une
absorption ~ max = 280 nmi le coefficient d'extinction
molaire ~ = 14080.
~EMPLE DE P~E?ARATION 4
Preparation de l'octanoyl-5 salicylate de
N-hexadecylpyridinium - monohydrate: compose INo. 7.
A une solution de 2,5 g (3,79 mmoles) de carbonate
d'hexadécylpyridinium dissous dans 15 ml de methanol, sont
ajoutés 2 g (7,57 mmoles) d'acide octanoyl-5 salicylique
dlssous préalablement dans 15 ml de rnéthanol; le mélange est .
agité 1 heure à temperature ambiante, puis le residu brut
marron obtenu est filtré et le ril-trat est évaporé à sec pour
conduire à 4,2 g (98% de rendement) d'octanoyl-5 salicylate
d'hexadecylpyridinium. -
Analyse elementaire: C36H57NO4, 2
C H N
Calcule % 73,8 10,15 2,39
Trouve % 73,22 9r77 2,31
Le spectre de R~N du C confirme la structure
attendue avec les valeurs caracteristiques du cation ammonium
quaternaire et de l'anion octanoyl-5 salicylate.
Le spectre UV (ethanol) demontre une
absorption ~ = 279 nm; le coefficient d'extinction
rnolaire ~ = 21450.
-17-
~299~72
EXEMPLE DE PREPARA'rION 5
,
Préparation du décanoyl-5 salicylate de N-hexadé-
cylpyridinium - sesquihydrate: compose No. 8.
A une solution de 2,3 g (3,44 mmoles) de carbonate
d'hexadécylpyridinium dissous dans 15 m 1 de méthanol, sont
ajou-tés 2 g (6,85 mmoles) d'acide décanoyl-S salicylique
dissous ?réalablement dans 15 ml d'éthanol; le mélange est
agité 1 heure à température ambiante, puis les solvants sont
évaporés et le résidu marron obtenu est recristallisé dans un
mélange acétone/éther diéthylique pour conduire à 3,9 g (96~
de rendement) de décanoyl-5 salicylate d'hexadécylpyridinium.
F = 73C (acétone/éther diéthylique)
Analyse élémentaire: C38H61NO4, 1,5~2O; M = 622,9
C H N
Calculé % 73,27 10,36 2,25
Trouvé ~ 73,64 9,64 1,82
~: Le spectre de R'~N du 13G confirme la structure
: a-ttendue avec les valeurs caractéristiques du cation ammonium
~ quaternaire aromatique et du décanoyl-S salicylate.
: EXEMPLE DE PREPARATlON 6 ~
: Préparati:on du ~ dodécanoyl-5 :: salicylate de
:
N-hexadécylpyridinium - hydrate: composé No. 9.
: ~ une solutlon de 2,1 g (3,14 mmoles) de carbonate
d'hexadécylpyridinium dissous dans 15 ml de méthanol, sont
ajoutés 2 g (6,25 mmoles) diacide dodecanoyl-5 sallcyllque
- ,
dlssous préalablement dans 15 ml d'éthanol le mélange est
agité 1 heure à température ambiante, puis les solvants sont
évapores et le résidu marron obtenu est recristallise dans un
melange acétone/éther diéthylique pour conduire à 3,7 g (95
de rendement) de dodecanoyl-5 salicylate d'hexadécylpyridi-
nium.
-18-
,
,,
" '. , . ' ~ ~ ' '
S72
F = 79C (acétone/éther diéthylique)
Analyse élémentaire: C40H~5NO4, lH2O; M = 642
C 11 N
Calculé ~ 74,84 10,52 2,18
Trouve ~ 74,61 10,12 1,96
Le spectre de RMN du 13C confirme la structure
attendue avec les valeurs caractéristiques du cation ammonium
quaternaire aromatique et du dodécanoyl-5 salicylate.
Le spectre UV (éthanol) démontre une
absorption ~ ma~ = 279 nm; le coefficient d'extinc~ion
molaire ~= 18910.
EXEMPLE DE PREPARATION 7
Préparation de l'octanoyl-5 salicylate de N-benzyl
N~N-dimethyl N-hexadécylammonium: com~osé No. 10.
A une solution de 3 g (3,84 mmoles) de carbonate
de benzyldi.nethyl hexadécylammonium dissous dans 15 ml de
méthanol, sont ajoutés 2 g (7,57 mmoles) d'acide octanoyl-5
salicylique dissous préalablement dans 15 ml de méthanol; le
.-nélange est agité 1 heure à température arnbiante, puis le
solvant est évapore et le residu blanc est recrystallisé dans
un mélange acétone/éther diéthylique pour conduire à 4,5 g
(95% de rendement) d'octanoyl-5 salicylate de benzyldiméthyl-
:~exadécylammonium.
~ = 114C (acétone/éther diéthylique)
Analyse élémentaire: C40H65NO4; M = 623,9
C H N
Calculé % 77,00 10,50 2,24
Trouvé ~ 77,02 10,58 2,38
Le spectre de RMN du 13C confirme la structure
attendue avec les valeurs caractéristiques du cation ammonium
quaternaire et de l'octanoyl-5 salicylate.
--19--
9~S7~
Les composés des exemples No. 8 à 21 sont préparés
d'une manière analogure à celle décrite dans les exemples 1 à
7.
EXE~PLE DE PREPARATION 8
Préparation du decanoyl-5 salicylate de N-benzyl
N,N-dimethyl N-hexadécylammonium: composé No. 11.
F = 113C (acétone/éther diéthylique)
Analyse élémen-taire: C42H69NO4; M = 652
C H N
Calculé % 77,37 10,67 2,15
Trouve % 77,22 10,b9 2,25
EXE~PLE DE PR~PARATION 9
Préparation du dodécanoyl-5 salicylate de N-benzyl
N,N-diméthyl N-hexadécylammonium: composé No. 12.
F = 117C (acétone/éther diéthylique)
Analyse élémentaire: C4~H73NO4i M = 680,08
.
C . H N ~:.
Calculé ~77,71 10,82 2,06
Trouvé ~77,15 10,81 2,08 ~.
Le spectre UV (éthanoI) démontre une
absorption ~ max = 281 nm; le coefLicient d'extinction
molaire ~ = 17720. ~ -~
EXEMPLE DE PREPARATION 10
Préparation du décanoyl-5 salicylate de N-benzyl
N,N,N-triméthylammonium: composé No. 13.
F = 135C (acétone/éther diéthylique)
Analyse élémen-~aire: C27H39NO4i M = 441,6
C H N
Calcule % 73,43 8,9 3,17
Trouvé % 73,01 8,74 3,18
-20-
~29~57Z
EXE~PLE DE PREPARATION 11
Preparation du decanoyl-5 salicylate de N-hexade-
cyl N,N-diméthyl N,~-hydroxyethylammonium: compose No. 14.
Analyse elementaire: C37H68NOs, 1/2H2O; ~l = 615,96
C H N
Calcule % 72,15 11,29 2,12
Trouve % 72,51 10,85 2,27
EXEMPLE DE PREPARATION 12
Preparation du dodecanoyl-5 salicylate de
: 10 N,N,N,N-tetramethylammonium: compose No. 15.
F = 97C (acétone/ether diéthylique)
Analyse élementaire: C23H40NO4; M = 390,15
C H N
Calcule % 70,8 10,33 3,59
Trouve % 70,27 9,87 3,38
EXEMPLE DE PREPARATION 13
Preparation du dodecanoyl-5 salicylate de
trimethyl ~-hydroxyethylammonium: compose No. 18.
F = 67C (acetone/ether diethylique)
Analyse elementaire: C24H41NO5; M = 423,6
C H N
Calcule % 68,05 9,76 3,31
Trouvé % 68,09 9,59 2,69
Spectre UV (éthanol) = ~max = 230 nm; ~= 16640
EXEMPLE DE PREPARATION 14
Preparation du décanoyl-5 salicylate de trimethyl
~-hydroxye'chylammonium: compose No. 17.
Analyse ele~lentaire: C22H35NO5 3/4H2O; M = 407r6
C H N
Calcule % 64,82 9,51 3,43
Trouve % 64,75 9,36 3,01
-21-
~29~ 2
EY,EMPLE DE PREPARATION 15
Prëparation du décanoyl-5 salicylate de diméthyl
ethyl dodecyl ammonium: compose No. 15. i~
F = 65C (acétone/ether diethylique)
Analyse elémentaire: C33H59NO4,H2O; ~1 = 551,9 ¦
C H N
Calculé % 71,8 11,14 2,62
Trouv~ % 72,07 10,74 2,33
EXE~lPLE DE PREPARATION 16
Preparation du dodecanoyl-5 salicylate de
- . j . .
N-hexadecyl N-méthyl imidazolinium: composé No~ 20. ~ -
F = 82C (acétone/ether diethylique)
Analyse elementaire C39~66N241' 5H2O; M = 654
C H N
Calculé % 71,62 10,62 4,28 1 -
Trouve % 71,82 10,68 4,02
Spectre UV (éthanol) =~ max - 281 nm; = 15385
EXEMPLE DE PREPARATION 17
:
Preparation du dodecanoyl-5 salicylate d'azonia-
l'aza-4'bicyclo[2'.2'.2']octyl hexadécané: composé No. 23.
F = 96C (acétone/ether diéthylique)
~nalyse élementaire: C41H72N2O4~H2O;
C H ~ N
Calcule ~ 72,95 11,04 4,15
- ~ :
Trouve % 7~,57 10,93 4,3
EXEMPLE DE PREPARATiON 18
Preparation du dodecanoyl-5 salicylate de
N-methyl, N-octyl pipéridinium: composé No. 22.
F = 45C (acetone/ether diéthylique)-
Analyse elémentaire: C33H57NO4,0,5 H20; M = 540,9
;.
.
-22-
, . ,
... . . . .
72
C H N
Calculé % 73,28 10,81 2,59
Trouve % 73,31 11,02 2,7
EXEMPLE DE PREPARATION 13
Preparation du decanoyl-5 salicylate de N-dodecyl,
N-me~hyl morpholinium: compose Wo. 11.
~ = 78C (acetone/éther diethylique)
Analyse elementaire: C34H59NO5; M = 561,8
C H N
Calcule % 72,68 10,58 2,49
Trouve % 72,58 10,68 2,6
Les exemples suivants sont destines a illustre^
plus particulièrement des compositions pharmaceutiques ou
cosmetiques mettant en oeuvre les composes conformes à
l'invention.
E~EMPLE DE PREPARATION 20
.
Preparation d'octanoyl-S salicylate de benzetho-
nium.
A une solution de 3,7 g (4,2 mmoles) de carbonate
20 : de benzethonium dissous dans 100 ml de methanol, sont ajoutes
2,2 g (8,4 mmoles) d'acide octanoyl-5 salicylique dissous
prealablement dans 100 ml de methanol; le mélange est agité 1
heure à température ambiante, puls la solution est filtree et
le filtrat est evapore à sec pour conduire à 5,5 g (98% de
rendement) d'octanoyl-5 salicylate de benzethonium.
Analyse elémentaire: C42H61NO6, 2 ;
C H N
Calcule % 70,85 9,20 1,97
Trouve % 70,93 9,07 2,07
-23-
1~3)95~Z
Le spectre de R~ du 13C confirme la structure
attendue avec les valeurs caracteristiques du cation ammonium
quaternaire et de l'anion octanoyl salicylate.
E~L~IPLE DE PREPARAT~ON 21
Préparation du dodécanoyl-S salicylate de
benzéthonium.
A une solution de 2,82 g (3,2 mmoles) de carbonate
de benzéthonium dissous dans 100 ml de méthanol, sont ajoutés ~ :
2 g (6,4 mmoles) d'acide dodécanoyl-5 salicylique dissous
préalablement dans 100 ml d'éthanol; le mélange est agité 1
heure à temperature ambiante, puis la solution es-t filtrée et
le filtrat est évaporé à sec pour conduire à 4,5 g (97% de
rendement) de dodécanoyl-5 salicylate de benzethonium.
Analyse élémentaire C4~H69N6'H2i PM = 750
C H N
Calculé % 73,66 9,54 1,87
Trouvé % 73,60 9,48 1,85
Le spectre de RMN du C confirme la structure
attendue avec les valeurs caractéristiques du cation ammonium
quaternaire et de l'anion dodecanoyl-5 salicylate.
Le terrne benzethoniu;n designe:
N,N-diméthyl N-[2-[2-[4-(1,1,3,3-tétraméthylbutyl) phénoxy]-
éthoxy]éthyl]benzèneméthaminium, ou
benzyldiméthyl[2-[2-(p-1,1,3,3,--tétraméthylbutylphénoxy)
ethoxy]é-thyl]ammonium.
Compositions pharmaceutiques et cosmétiques
EXEMPLE 1 , .
On prépare la composition suivante:
- Hydroxypropycellulose 1,5 g
- Décanoyl-5 salicylate d'hexadécyl-
triméthylammonium . 3,0 g
-24-
;~ 7Z
- Iso;?ro2anol qsp loO g
EXEMPLE 2
On prépare la composition suivante:
- Hydroxypropycellulose 1,5 g
- Lactate d'ethyle 15,0 g
- Dodecanoyl-5 salicylate d'hexadecyl-
trimethylammonium 2,0 g
- Isopropanol qsp loo g
EXEMPLE 3
On prépare la composition suivante:
- Hydroxypropycellulose 1,0 g
- Butylhydroxytoluène 0,02 g
- Decanoyl-5 salicylate de benzyl-
triméthylammonium 0,5 g
- Ethanol qsp loO g
EXEMPLE 4
On p^ pare la composition sui.vante:
- Hydroxypropycellulose 1,5 g
- Butylhydroxytoluène 0,01 g
- Triglycérides d'acide gras en C8-C12 10,0 g
- Dodécanoyl-5 salicylate d'hexadecyl-
pyridinium 5,0 g
- Isopropanol ` qsp 10 0 g
Les compositions des exemples 1 à 4 se presentent
sous forme de gel et sont particulièrement des-tinees au
traitement topique de l'acne.
EXEMPLE 5
On prepare la cornposition suivante:
- Isopropanol 4~,0 g
- Dodecanoyl-5 salicylate d'hexadecyl-
trimét'nylaimnonium 5,0 g
-25-
~29~S~;~
- Triglycérides d'acides gras en C8-C12 49,0 g
EXEMPLE 6
On prépare la composition suivante:
- Ethanol 69,0 g
- Lactate d'éthyle 10,0 g
- Décanoyl-5 salicylate d'hexadécyl-
~yridinium 1,0 g
- Triglycérides d'acide gras en C8-C12 20,0 g
EXEMPLE 7
On prépare la composition suivante:
- Isopropanol 47,0 g
- Acetone 10,0 g
- Lactate d'éthyle 10,0 g
- Décanoyl-5 salicylate de benzyl-
triméthylammonium 3,0 g
- Triglycérides d'acide gras en C8-C12 30,0 g
EXE~IPLE 8
On prépare la composition suivante:
- Ethanol 95,08 g
- Butylhydroxytoluène 0,02 g
,
- Octanoyl-5 salicylate d'hexa-
- .
décyltriméthylammonium ~ ~ 4,0 g
Ces compositions des exemples 5:, 6, 7 et 8 se
présentent sous forme de lotion particulierement efficace
dans le traitement de l'acné.
EXEMPLE 9
On prépare la compositlon suivante:
- VASELINE blanche ~ 50,0 g
- Huile de VASELINE 15,0 g -
- Paraffine raffinée 32,0 g
- Dodécanoyl-5 salicylate d'hexa-
* Marque de commerce. -26-
: 3LZ~7Z
décyltrinéthylamrnonium 3,0 g
Cette composition se présente sous forme de stick
approprié pour le traitement de l'acné.
EXEMPLE 10
On prépare la composition suivante:
- VASELINE blanche 50,0 g
- Huile de VASELINE 13,0 g
- Paraffine raffinée 32,0 g
- Dodécanoyl-5 salicylate de trimethyl
~-hydroxyéthylammonium 5,0 g
Cette composition se presente sous forme de stick
approprie pour la p.otection des lèvres contre le rayonnement
solaire.
~3~ -27-