Note: Descriptions are shown in the official language in which they were submitted.
13~6~5;~ `
La présente invention concerne l'utilisation à
titre de coupleur du 2,4-diamino-1,3-dimêthoxybenzène ou
l'un de ses sels, en association avec des précurseurs de
colorants d'oxydation pour la teinture des fi~res
kératiniques et en particulier des cheveux humains, une
composition de teinture capillaire contenant ledit
coupleur, un procédé de teinture utilisant ladite
composition, et un procédé de préparation dudit coupleur.
On sait qu'il est courant d'utiliser, pour la
teinture des fibres kératiniques telles que les cheveux
humains ou les fourrures, des compositions tinctoriales
contenant des précurseurs de colorants d'oxydation et en
particulier des para-phénylène diamines, des ortho- ou
para-aminophenols que l'on désigne généralement sous le
terme de ~ases d'oxydation.
On sait également que pour faire varier les
nuances obtenues avec ces bases d'ox~dation, on utilise
des modificateurs de coloration ou coupleurs, et en
particulier des métaphénylènediamines aromatiques, des
; 20 métaaminophénols et des métadiphénols.
Dans les milieux alcalins oxydants utilisés
habituellement en teinture d'oxydation, les para-phénylè-
nediamines e. para-aminophenols donnent naissance en
présence de coupleurs tels que les métaphénylènediamines à
des indamines ou des indoanilines colorées.
Les indamines formées à partir de métaphénylène-
diamines et de para-phenylènediamines en milieu alcalin
oxydant, et plus particulièrement en présence d'eau
oxygénée, confèrent aux fibres kéra-tiniques des colora-
tions bleues tres puissantes. Les indoanilines formées apartir de métaphénylènediamines et de para-aminophénols en
- 1 - ~
~L3~1~95iZ
milieu alcalin oxydant confèrent aux fibres keratiniques
des colorations rouges plus ou moins pourpres. Selon les
bases d'oxydation auxquelles elles sont associees, les
metaphenylènediamines peuvent donc donner des colorations
rouges ou bleues qui sont deux couleurs fondamentales en
teinture capillaire indispensables pour obtenir non~ j!;
seulement des noirs et des gris mais aussi des châtains `
cuivres ou cendres. On voit donc le rôle extrêmement
important joue par les metaphenylènediamines en teinture
capillaire d'oxydation.
Il est important par ailleurs que les precurseurs
de colorants d'oxydation et les coupleurs qui sont
utilisés dans les compositions tinctoriales d'oxydation
confèrent aux cheveux, en milieu a:Lcalin oxydant, des
colorations stables à la lumière, au lavage, aux
intemperies et à la transpiration. I1 est souhaitable que
ces colorations soient peu selectives ou non sélectives,
c'est-à-dire que les couleurs obtenues sur cheveux
naturels et sur cheveux sensibilisés par une permanente ou
une decoloration soient sensiblement identiques. Il est
nécessaire également que ces composes beneficient d'une
bonne innocuité.
On connaît déjà de nombreux coupleurs du type des
metaphenylènediamines substituees sur le noyau aromatique.
Cependant~ un grand nombre d'entre-eux ne repondent pas
aux exigences souhaitees.
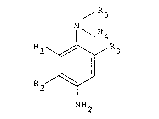
La Demanderesse vient de decouvrir que ]e
2,4-diamino-1,3-dimethoxybenzène, compose connu en
lui-même, ainsi que ses sels d'addition avec un acide,
satisfont à l'ensemble de ces exigences et peuvent être
utilises avantageusement comme coupleurs en association
~r~
.~
13~6~S~
~vec d'autres précurseurs de colorants d'oxydation et
notamment des précurseurs de type para. Un autre avantage
de ce coupleur est d'être non mutagène.
La présente invention a donc pour Gbjet
l'utilisation à titre de coupleur du 2,4~diamino-1,3-dimé-
thoxybenzène ou l'un de ses sels d'addition avec un acide,
en association avec des précurseurs de colorants d'oxydation
pour la teinture des fibres kératiniques et en particulier
des cheveux humains.
Le 2,4-diamino-1,3-diméthoxybenzène ou l'un de
ses sels, associé aux p-phénylenediamines en milieu
alcalin oxydant, confère aux cheveux des colorations
bleues puissantes plus ou moins riches en vert ou en
pourpre.
Lorsque ce coupleur est associé aux p-aminophé-
nols, en milieu alcalin oxydant, il confère aux cheveux
des colorations rouges de bonne stabillté.
La présente invention a donc également pour objet
une composition de teinture capillaire comprenant, dans un
support aqueux cosmétiquement acceptable, le 2,4-diami-
no-1,3-diméthoxybenzène ou l'un de ses sels d'addition
avec un acide, à titre de coupleur, en association avec au
moins un précurseur de colorant d'oxydation de type para.
L'invention vise également un procédé de teinture
capillaire mettant en oeuvre la révélation par un oxydant
utilisant une composition telle que définie ci-dessus.
Le chlorhydrate de 2,4-diamino-1,3-diméthoxy
benzène peut etre préparé selon des procédés connus, comme
par exemple par réduction du 2,4-dinitro-1,3-diméthoxy
benzène par un mélange d'acide chlorhydrique concentré et
d'étain. Le 2,4-dinitro-1,3-diméthoxybenzène est obtenu
~3n6~
par alkylation de la 2-nitro rësorcine qui conduit au
2-nitro-1,3-dimethoxybenzène qui est alors nitré. On
obtient ainsi le 2,4-dinitro-1,3-dimethoxybenzène. Ce
procede est decrit plus en détail dans BAKER, J.C.S.,
287~-7~ tl932).
Ce procede, long et coûteux, permet d'obtenir du
chlorhydrate de 2,4-1,3-diamino-dimetoxybenzène n'ayant
q'une purete moyenne.
Or, la Demanderesse a decouvert un nouveau
procéde de preparation du 2,4-diamino-1,3-dimethoxybenzène
d'une grande facilite de mise en oeuvre, qui constitue un
autre objet de l'invention.
Ce procede consiste à réduire et déshalogéner,
consecutivement ou simultanement, du 2,4-diméthoxy-3,5-di-
nitrochlorobenzène.
Procede I - reduction suivie d'une deshaloge-
nation:
OCH3 OICH3 ~CH3
0 Cl ~ /`~ " N2 Cl ~ ~y~ ~ NH2
reduction l deshalogenation ~ 1
\ OCH3 ~ \OCH3 ~ ~ CH3
2 H2 2
(I)
Le 2,4-dimethoxy-3,5-dinitrochlorobenzène peut être reduit
par le fer en presence d'acide ace'ique, à une temperature
comprise entre 50 et 100 C. On obtient ainsi le
2,4-dimethoxy-3,5-diaminochlorobenzène qui est alors
soumis â une reaction de deshalogenation. Cette réaction
s'effectue dans l'eau, dans un alcool inferieur ou dans un
melange hydroalcoolique, en presence de palladium sur
~3~95Z
charbon, d'acetate d'ammonium et de formiate de triethyl-
amine, à une temperature comprise en-tre 50C et la
temperature de reflux du solvant.
Procédé II - reduction et deshalogenation
simultanees: ~
OCH3 3
C l~l~ NO 2 ~,, NH 2
ll > I 11
~ OCH3 ~ OCH ~ `
N02 H2
(II) (I)
Le 2,4-dimethoxy-3,5-dinitrochlorobenzène peut être reduit
et déshalogéné simultanément sous pression d'hydrogène en
présence de palladium sur charbon comme indique dans
l'article de RYLANDER intitule "Catalytic Hydrogenation"
dans le Recueil "ORGANIC SYNTHESIS" édité par ACADEMIC
PRESS INC.
Pour favoriser la reaction, il est preferable
d'ajouter de l'acetate d'ammonium ou de la triethylamine.
Cette réaction s'effectue dans un solvant qui
peut etre de l'eau, un alcool inférieur ou un mélange
hydroalcoolique à une temperature variant entre 50C et
200C.
Le compose de formule (II), à savoir le
2,4-dimethoxy-3,5-dinitrochlorobenzène, peut être obtenu
selon l'un des trois procédés suivants:
a) Premier procédé
Ce procede est decrit dans l'Article de E.J.E.
HUFFER s.j. intitule "Les trichloro dinitrobenzènes, leur
reaction avec le methylate de sodium et avec
~ -
,na,
~3~6~
l'ammoniaque", article paru dans la revue intitulee
"Recueils de travaux chimiques des Pays-Bas", Recueil No.
40, pages 464-471.
Il consiste à nitrer le 1,2,4-trichlorobenzène
par l'acide nitrique fumant en presence éventuellement de
H2 S04 pour obtenir le 1,2,4-trichloro-3,5-dinitrobenzène.
- 5a -
3~S~95Z
Les atomes de chlore en positions 2 et 4 sont ensuite
substitués par un groupement methoxy par reaction d'un
methylate alcalin. Le procede est schematise ci-après:
OCH
hitration MeOA ~ W2
NO
~ NO2 2
;II)
A etant un metal alcalin.
b) Deux eme Procede
Il consiste à nitrer le 2,4-diméthoxychloro-
benzène par l'acide nitrique ~umant en presence eventuel-
lement de H2SO4. On obtient en une seule etape le
2,4-dimethoxy-3,5-dinitrochlorobenzène. Ce procede est
schematise ci-dessous:
OCH3 OCH
OCH3 ~0 3
c)Troisième Procede (II)
Le 3,6-dichlorophenol ou le 3,4-dichlorophenol
subit une methylation suivie d'une nitration puis d'une
substitution des atomes de chlore par un groupement
methoxy par action d'un methylate alcalin. Ces reactions
peuvent être representees par les deux schemas ci-après:
13~69~
~) OH OCH3
F ~ ~thylation` 1 ~ ~ ---t--t-io~n _
OCH3 OCH3
CI CH30A ~ ~ ~ OC3
N02 2
~) Cl Cl (II)
10c] ~ ~ ~ethylation ~ nitration
Fl OICH3
Cl ~ No2 Cl ~ N02
OCH3 C330A ~ CH3
N02 ~2
A étant un metal alcalin.
Les compositions de teinture capillaire
d'oxydation conformes à ]'invention comprennent, dans un
support aqueux cosmetiquement acceptable, le 2,4-diamino-
1,3-dimethoxybenzène ou l'un de ses sels d'addition avec
un acide, à ti-tre de coupleur, et au moins un precurseur
de colorant d'oxydation de type para.
Le precurseur de colorant d'oxydation de type
para est préferablement choisi parmi les derives
benzeniques ou heterocycliques, comme par exemple la
pyridine, sur lesquels so..t fixes en position para deux
groupements amino ou un groupement amino et un groupement
hydroxy, Ces precurseurs de colorants d'oxydation peuvent
-
~3a~9~;2
etre presents dans les compositions tinctoriales sous
forme de bases libres ou sous forme de sels d'addition
d'acides.
Les precurseurs de colorants d'oxydation
particulièrement preferes utilisables conformement à ~ .
l'invention sont choisis parmi les para-phenylènediamines
repondant à la formule generale (III) ci-après:
/ R5
1 \ R4
Rl~/R3 ~.~
R ~
2 1 (III) :
ou les sels correspondants, formule dans laquelle Rl, R2
et R3 sont identiques ou différents et representent un
atome d'hydrogène ou d'halogène, un radical alkyle ayant 1
à 4 atomes de carbone, un radical alcoxy ayant 1 à 4
atomes de carbone, R4 et R5 sont identiques ou differents
et repr~esentent un atome d'hydrogène, un radical alkyle,
hydroxyalkyle, alcoxyalkyle, carbamylalkyle, mesyl~mino-
alkylè, acetylaminoalkyle, ureidoalkyle, carbethoxyamino-
alkyle, piperidinoalkyle, morpholinoalkyle, les groupes
alkyle ou alcoxy representes par R4 et R5 ayant 1 à 4
atomes de carbone, ou bien R4 et R5 peuvent ~ormer
conjointement avec l'atome d'azote auquel ils sont lies,
un heterocycle piperidino ou morpholino sous reserve que
Rl ou R3 representent un atome d'hydrogène lorsque R4 et
R5 ne representent pas un atome d'hydrogène.
- 8 -
~3~6952
Parmi les composes de formule (III), on peut
citer la p~phenylènediamine, la p-toluylènediamine, la
methoxyparaphenylènediamine, la chloroparaphenylènedi-
amine, la 2,6-dimethyl-p-phenylènediamine, la 2,5-
diméthyl-paraphénylènediamlne, la 2,3-dimethyl-p-phe-
nylènediamine, l'isopropyl-p-phénylènediamine, la
2-méthyl-S-méthoxy-paraphénylènediamine, la 2,6-dimethyl-
5-methoxy-paraphenylènediamine, la N,N-diméthylparaphe-
nylènediamine, la 3-methyl-4-amino-N,N-diéthylaniline, la
N,N-di(~ - hydroxyethyl)paraphénylènediamine, la 3-méthyl-
4-amino-N,N-di-(~-hydroxyethyl)aniline, la 3-chloro-4-ami-
no-N,N-di-(~-hydroxyethyl)aniline, la 4-amino-N,N-(ethyl,
carbamylméthyl) aniline, la 3-méthyl 4~amino-N,N-(éthyl,
carbamylmethyl)aniline, la 4-amino-N,N-(éthyl, ~-pipéridi-
noéthyl)aniline, la 3-méthyl-4-amino-N,N-(éthyl,
~-pipéridinoéthyl)aniline, la 4-amino-N,N -(ethyl, ~-morpho-
linoéthyl)aniline, la 3-méthyl-4-amino~N,N-(éthyl,
~-morpholinoethyl) aniline, la 4-amino-N,N-(ethyl,
~-acéthylaminoéthyl)aniline, la 4-amino-N,~-méthoxyéthyl-
20~ aniline, la 3-méthyl-4-amino-N,N-(ethyl,~acetylamino-
éthyl)aniline, la 4-amino-N,N-(ethyl,~-mésylamino-
éthyl)aniline, la 3-méthyl-4-amino-N,N-(éthyl,~-mésyl-
aminoéthyl) aniline, la 4-amino-N,N-(éthyl,B-sulfo-
éthyl)aniline, la 3-méthyl-4-amino-N,N-(éthyl,~-sulfo-
éthyl)aniline, la N-[(4'-amino)phényl~ morpholine, la
N-[(4'-amino)phényl] pipéridine. Ces précurseurs de
colorants par oxydation de type para peuvent etre
introduits dans la composition tinctoriale sous forme de
base libre ou sous forme de sels, tels que sous forme de
chlorhydrate, de bromhydrate ou de sulfate.
g
~3~69S~'
L~ 2,4-diamino-1,3-dimethoxybenzène ou ses sels
peut egalement etre utilise avec des para-aminophenols
pour donner des nuances particulièrement stables à la
lumière, aux intemperies et au lavage après developpement
en presence d'oxydant. Parmi les para--aminophenols, on
peut citer le p-aminophenol, le 2-methyl-4-aminophenol, le
3-methyl-4-aminophénol, le 2-chloro-4-aminophenol, le
3-chloro-4-aminophenol, le 2,6-diméthyl-4-aminophenol, le
3,5-dimethyl-4-aminophenol, le 2,3-dimethyl-4-aminophenol,
le 2,5-dimethyl-4-aminophenol, le 2-hydroxymethyl-4-amino-
phenol, le 2-(~-hydroxyethyl)-4-aminophenol, le 2-
methoxy-4-aminophenoi, le 3-methoxy-4-aminophenol.
Le 2,4-diamino-1,3-diméthoxy benzène ou ses sels
peut egalement etre utilise avec des precurseurs de
colorants d'oxydation para heterocycliques parmi lesquels
on peut citer la 2,5-diaminopyridine, la 2-hydroxy-5-ami-
nopyridine, la tetraaminopyrimidine.
Les compositions tinctoriales selon l'invention
peuvent egalement contenir des precurseurs de colorants
d'oxydation de type ortho tels que les orthoaminophenols,
orthophenylènediamines, orthodiphenols. On peut citer par
exemple la l-amino-2-hydxoxybenzène, le 6-méthyl-1-hydro-
xy-2-aminobenzène, le 4-methyl-1-amino-2-hydroxy-benzène.
Les compositions tinctoriales conformes à
l'invention contenant le 2,4-diamino-1,3-dimethoxy benzène
ou ses sels peuvent contenir eventuellement d'autres
coupleurs connus en eux-memes tels que les metadiphenols,
les metaaminophenols, les metaphenylènediamines, les
metaacylaminophenols, les metaureidophenols, les
-- 10 --
~3(~6~52
métacarbalcoxyaminophénols, l'o(~naphtol, les coupleurs
possédant un groupe méthylène actif tels que les composés
~-cétoniques et les pyrazolones.
On peut citer en particulier, à titre d'exemple,
le 2,4-dihydroxyphénoxyéthanol, le 2,4-dihydroxyanisole,
le métaaminophénol, la résorcine, le monomethyléther de
resorcine, le 2-methyl-5-aminophenol, le 2-methyl-5-N-(~
hydroxyethyl)aminophénol, le 2-méthyl-5-N-(~-mésylami-
no-ethyl)aminophenol, le 2,6-diméthyl-3-aminophenol, la
6-hydroxybenzomorpholine, le 2,4-diaminophénoxyéthanol, la
6-aminobenzomorpholine, le 2-[N-(~-hydroxyethyl)amino-
4-amino] phenoxyéthanol, le 2-amino-4-N-(~-hydroxyéthyl)-
aminoanisole, le (2,4-diamino-phenyl-~,~-dihydroxypropyl-
éther, la 2,4-diaminophé~ethylamine, le 3,4-methylènedi-
oxyphénol, la 3,4-méthylènedioxyaniline et leurs sels.
On peut ajouter à ces compositions, comme cela
est bien connu en vue de nuancer ou enrichir en reflets
les colorations appo.tées par les précurseurs de colorants
d'oxydation, des colorants directs tels que des colorants
azoïque, anthraquinoniques ou les dérivés nitrés de la
série benzenique.
L'ensemble des composes para et des coupleurs
utilises dans les compositions tinctoriales conformes à
l'invention represente de préférence de 0,1 à 7~ du poids
total de ladite composition. La concentration en
~,4-diamino-1,3-dimethoxybenzène peut varier entre 0,05 et
3,5~ du poids total de la composition.
Le support aqueux cosmetiquement acceptable a un
pH qui peut varier entre 8 et lli il est de preférence
compris entre 9 et 11.
~1~116~352
Il est ajusté à la valeur desiree à l'aide d'un
agent alcalinisant tel que l'ammoniaque, les carbonates
alcalins, les alcanolamines comme la mono-, la di- ou la
triethanolamine.
Les compositions tinctoriales conformes à
l'invention contiennent egalement dans leur forme de
realisation preferee des agents tensio-actifs anioniques,
cationiques, non-ioniques, amphotères ou leurs melanges.
Parmi ces agents tensio-actifs, on peut citer plus
particulièrement les alkylbenzènesulfonates, les
alkylnaphtalène-sulfonates, les sulfates, les ether-
sulfates et sulfonates d'alcools gras, les sels d'ammonium
quaternaire tels que le bromure de trimethylcétylammonium,
le bromure de cetylpyridinium, les ethanolamides d'acides
gras eventuellement oxyethylenés, les acides, les alcools
et les amines polyoxyethylenes, les alcools polyglyce-
roles, les alkylphenols polyoxyethylenes ou polyglycéroles
ainsi que les alkylsulfates polyoxyethylenes. Les agents
tensio-actifs sont presents dans les compositions
conformes à l'invention dans des proportions comprises de
preference entre 0,5 et 40% en poids, et plus particuliè-
rement entre 4 et 30% en poids, par rapport au poids total
de la composition.
Ces compositions peuvent egalement contenir des
solvants organiqùes pour solubiliser les composes qui ne
seraient pas suffisamment solubles dans l'eau. Parmi ces
solvants, on peut mentionner à titre d'exemple, les
alcanols inferieurs en Cl-C4 tels que l'ethanol et
l'isopropanol; le glycerol; les glycols ou ethers de
glycol comme le 2-butoxyethanol, l'ethylèneglycol, le
propylèneglycol, le monoethylether et le monomethylether
- 12 -
du diethylèneglycol, ainsi que les produits analogues et
leurs melanges. Les solvants sont présents de preference
dans une proportion comprise entre 1 et 40% en poids, et
en particulier entre 5 et 30% en poids, par rapport au
poids total de la composition.
Les agents epaississants que l'on peut ajouter dans
les compositions conformes à l'invention sont pris
notamment dans le groupe forme par l'alginate de sodium,
la gomme arabique, les derives de la cellulose tels que la
methylcellulose, l'hydroxyethylcellulose, l'hydroxypropyl-
cellulose, l'hydroxymethylcellulose, la carboxymethyl-
cellulose, les polymères d'acide acrylique, la gomme de
Xanthane. On peut également utiliser des agents epais-
sissants minéraux tels que la bentonite. Ces agents
epaississants sont presents de preference en des
proportions comprises entre 0,1 et 'i% en poids, et en
particulier entre 0,5 et 3~ en poids, par rapport au poids
total de la composition.
Les compositions peuvent contenir des agents
anti-oxydants choisis en particulier parmi le sulfite de
sodium, l'acide thioglycolique, le bisulfite de sodium,
l'acide ascorbique et l'hydroquinone. Ces agents
anti-oxydants sont presents dans la composition dans des
proportions comprises de preference entre 0,05 et 1,5% en
poids, par rapport au poids total de la composition.
D'autres adjuvants utilisables conformement à
l'invention sont par exemple des agents de penetration,
des agents sequestrants, des tampons et des parfums.
Les compositions tinctoriales conformes à
l'invention peuvent se presenter sous des formes diverses
telles que sous forme de liquides, de crèmes, de gels ou
13(~ S,~
sous toute autre forme appropriée pour realiser une
teinture des fibres keratiniques et notamment des cheveux
humains. Elles peuvent egalement etre conditionnées en
flacons aerosols en presence d'un agent propulseur.
Les compositions tinctoriales conformes à
l'invention, contenant un precurseur de colorant par
oxydation de type para et le 2,4-diamino-1,3-dimethoxy
benzène ou l'un de ses sels, sont utilisees dans un
procede de teinture capillaire mettant en oeuvre la
revelation par un oxydant.
Conformement à ce procede, on melange au moment
de l'emploi la composition tinctoriale decrite ci-dessus
avec une solution oxydante en une quantite suffisante,
puis on applique le melange obtenu sur les cheveux.
La solution oxydante contient des agents
d'oxydation tels que l'eau oxygenee, le peroxyde d'uree ou
les persels tels que le persulfate d'ammonium. On utilise
de préference une solution d'eau oxygenee à 20 volumes.
Le melange obtenu est applique sur les cheveux;
20~ on le laisse poser pendant 10 à 40 minutes, de preference
15 à 30 minutes, après quoi on rince les cheveux, on les
lave au shampooing, on les rince à nouveau et on les
sèche.
Un autre procede de mise en oeuvre du 2,4-diamino
1,3-dimethoxy benzène conforme à l'invention consiste à
teindre les cheveux suivant un procede en plusieurs temps,
selon lequel dans un premier temps, on applique le
precurseur de colorant d'oxydation de type para au moyen
d'une composition sus-definie et dans un second temps, on
applique le 2,4-diamino-1,3-dimethoxybenzène L'agent
oxydant est present dans la composition appliquee dans le
- 14 -
5~
second temps ou bien applique sur les cheveux eux-mêmes
dans un troisième temps, les conditions de pose, de
sechage et de lavage etant identiques à celles indiquées
au procede ci-dessus.
Les exemples ci-après servent à mieux illustrer
l'invention mais ne sont en aucun cas limitatifs de sa
portee.
Exemple de preparation no. 1 : Procedé I
Première Etape : Reduction
Preparation du dlchlorhydrate de 2,4-dimethoxy-3,5-diami-
nochlorobenzène
A 270 ml d'eau additionnes de 27 ml d'acide
acetique prealablement chauffes à 80C, on ajoute 100 g de
. fer en poudre reduit à l'hydrogène et peu à peu, sous
agitation, 0,25 mole (66 g) de 2,4-dimethoxy-3,5-
dinitrochlorobenzène. Les additions terminées on maintient
le milieu reactionnel au bain marie bouillant pendant 30
minutes supplementaires. Après refroidissement, le milieu
reactionnel est centrifuge. Les boues ferriques qui
contiennent le produit attendu sont reprises sous brassage
par de l'acetone. Après filtration des boues ferriques
puis lavage à l'acetone, le produit attendu precipite du
filtrat acetonique par ajout d'une solution d'acide
chlorhydrique dans l'ethanol. Après essorage et lavage, le
produit est recristallise à chaud d'un melange d'acide
chlorhydrique et d'eau.
L'analyse elementaire du produit obtenu donne les
resultats suivants:
AnalyseCalcule pour C8H13N2C11O2 Trouve
C%34,85 34,85
H%4,72 4,82
`
~3~fi~Z
N% 10,16 10,03
o% 11,62 11,80
C1~ 38,65 38,46
Deuxième Etape : deshalogenation
Preparation du dichlorhydrate de 2,4-diamino-1,3-
dimethoxybenzène
On chauffe à 75C sous agitation le melange
constitue par 77 g d'acetate d'ammonium, 42 g de palladium
a 10~ sur charbon, 0,25 mole t69 g) de dichlorhydrate de
2,4-dimethoxy-3,5-diaminochlorobenzène dans 420 ml
d'ethanol additionnes de 50 ml d'eau. On ajoute 75 g de
triethylamine puis, goutte à goutte, 31 g d'acide
formique. Après 30 minutes de chauffage supplementaire,
le milieu reactionnel est filtre chaud. Le filtrat est
evapore à sec. Par ajout d'acetate d'ethyle, on precipite
les sels mineraux que l'on elimine par essorage. On
ajoute au filtrat seche sur sulfate de sodium 100 ml d'une
solution alcoolique d'acide chlorhydrique 7N. Le produit
attendu precipite, il est recristallise d'un melange d'eau
et d'une solution d'acide chlorhydrique dans l'ethanol.
L'analyse elementaire du produit obtenu donne les
resultats suivants~
AnalyseCalcule pour c8H14N2O2C12 Trouve
C~39,83 39,75
H~5,81 5,79
N~11,62 11,60
O~13,28 13,54
Cl~29,46 29,29
- 16 -
~3n695i2
Exemple de préparation no 2 : Procede II
Preparation du dichlorhydrate de 2~4-diamino-1,3-
dimethoxybenzène tdirectement à partir du _,4-dimethoxy-
3,5-dinitrochlorobenzène)
On chauffe à 80 C pendant 1 heure sous une
pression de 20 kg d'hydrogène le melange constitué par 0,1
mole (26,2 g) de 2,4-diméthoxy-3,5-dinitrochlorobenzène,
15,4 g d'acétate d'ammonium et 5,2 g de palladium à 10~
sur charbon dans 100 ml d'éthanol additionnés de 15 ml
d'eau. -
Le milieu réactionnel est filtré chaud afin
d'éliminer le catalyseur. Le filtrat est évaporé à sec
sous pression réduite. On ajoute de l'acétate d'ethyle au
filtrat afin de precipiter les sels minéraux que l'on
élimine par filtration. On sèche le filtrat sur sulfate
de sodium. Le produit attendu précipite par ajout de 43
ml d'une solution 7N d'acide chlorhydrique dans l'éthanol
absolu. Il est identique au produit préparé dans
l'exemple de préparation no. 1.
Exemple de teinture 1
_ __
On prépare le mélange tinctorial suivant:
- dichlorhydrate de 2,4-diamino-1,3-
diméthoxybenzène 0,602 g
- p-phénylènediamine 0,27 g
- Alcool oleique polyglycérolé à
2 moles de glycérol 4,5 g
- Alcool oléique polyglycérolé à
4 moles de glycérol 4,5 g
- Oléylamine oxyethylenee à 12 moles d'O.E.
venduesous la marque de commerce ETHOMEEN 0 12
par la Societe ARMOON HESS CHEMICAL LTD. 4,5 g
~3~695Z
- Diéthanolamide de coprah vendu sous la
marque de commerce COMPERLAN KD par la
Société HENKEL 9 g
- Propylène glycol 4 g
- 2-butoxy-ethanol 8 g
- Ethanol à 96% 6 g
- Sel pentasodique de l'acide diethylène
triamine pentacétique vendu sous la marque
de commerce MASQUOL DTPA par la Société
PROTEX 2 g
- Hydroquinone 0,15 g
- Solution de bisulfite de sodium à 35Bé 1,3 g
- Ammoniaque à 22 Bé 10 g
- Eau qsp 100 g
- p~: 10
Au moment de l'emploi, on ajoute 100 g d'eau
oxygenee à 20 volumes. Le melange, applique 20 minutes à
30C sur des cheveux permanentés, leur confère, après
shampooing et rin~cage, une.coloration bleu grisâtre fonce.
Exemple de teinture 2
On prépare le melange tinctorial suivant:
- Dichlorhydrate de 2,4-diamino-1,3-
diméthoxybenzène 0,602 g
- p-aminophenol 0,275 g
- Alcool oleique polyglycerole à 2 moles
de glycerol 4,5 g
- Alcool oIéique polyglycérole à 4 moles
de glycérol 4,5 g
- Oléylamine oxyéthylénée à 12 moles d'O.E.
30 vendue sous la marque de commerce.ETHOMEEN 0 12
par la Société ARMOON HESS CHEMICAL LTD. 4,5 g
- 18 -
;
~3~9S2
- Diéthanolamide de coprah vendu sous la marque
de commerce COMPERLAND KD par la Societe
HENKEL 9 g
- Propylène glycol 4 g
- 2-butoxyethanol 8 g
- Ethanol à 96 6 g
- Sel pentasodique de l'acide diethylène
triamine pentacetique vendu sous la marque
de commerce MASQUOL DTPA par la Societe
PRO~EX 2 g
- Hydroquinone 0,15 g
- Solution de bisulfite de sodium à 35Be 1,3 g
- Ammoniaque à 22 ~e 10 g
- Eau qsp 100 g
- pH : 10
Au moment de l'emploi, on ajoute 100 g d'eau
oxygenée à 20 volumes. Le mélange, applique 20 minutes à
30C sur des cheveux decolores, leur confère, après
shampooing et rinçage, une coloration rouge pourpre
grisatre.
Exemple de teinture 3
On prepare le melange tinctorial suivant: ~-
- Dichlorhydrate de 2,4-diamino-1,3-dime-
thoxybenzène 0,602 g
- Dichlorhydrate de 4-amibo-N,B-methoxy-
ethylaniline 0,598 g
- Nonylphenol oxyethylene à ~ moles O.E.
vendu sous la marque de commerce CEMULSOL NP 4
par la Societe RHONE POULENC 12 g
- Nonylphenol oxyethylene à 9 moles O.E.
vendu sous la marque de commerce CEMULSOL NP 9
-- 1~ --
~3~695Z
par la Societe RHONE POULENC 15 g
- Alcool oléique polyglycerole à 2 moles
de glycerol 1,5 g
- Alcool oleique polyglycerole à 4 moles
de glycerol 1,5 g
- Propylène glycol 6 g
- Acide ethylène diamine tetracetique vendu
sous la marque de commerce TRILON B 0,12 g
Ammoniaque à 22 Be 11 g
- Acide thioglycolique 0,6 g ~ :
- Eau qsp 100 g
pH : 10,5
Au moment de l'emploi, on ajoute 100 g d'eau
oxygenee à 20 volumes. Le melange, applique 20 minutes à
35C sur des cheveux decolores, leur confère, après
shampooing et rin~cage, une coloration bleu fonce.
Exemple de teinture 4
On prepare le melange tinctorial suivant:
- Dichlorhydrate de 2,4-diamino-1,3-dimethoxy-
benzène 2-methyl-4-aminophenol 0,31 g
- Nonylphenol oxyethylene à 4 moles O.E. vendu
sous la marque de commerce CEMVLSOL NP 4 par
la Societe RHONE POULENC 12 g
- Nonylphenol oxyethylene à 9 moles O.E. vendu
sous la marque de commerce CEMULSOL NP 9 par
la Societe RHONE POULENC 15 g
- Alcool oleique polyglycerole à 2 moles
de glycerol 1,5 g
- Alcool oleique polyglycerole à 4 moles
de glycerol 1,5 g ~-
- Propylèneglycol 6 g
- 20 -
69~2
Acide éthylène diamine tetracetique vendu
sous la marque de commerce TRILON B 0,12 g
Ammoniaque à 22Be 11 g
Eau qsp 100 g
pH : 10,0
Au moment de l'emploi, on ajoute 100 g d'eau
oxygenee à 20 volumes. Le melange, applique 25 minutes à
C sur des cheveux decolores, leur confère/ après
shampooing et rinSage, une coloration rouge pourpre
grisâtre.
Exemple de teinture 5
On prepare le melange tinctorial suivant:
Dichlorhydrate de 2,4-diamino-1,3-dimethoxy-
benzène 0,602 g
Dichlorhydrate de p-toluylènediamine 0,49 g
Alcool cetylstearylique vendu sous la marque
de commerce ALFOL C 16/18 par la Soc:iéte
CONDEA 8 g -
Sulfate cetylstéarylique de sodium vendu sous
la marque de commerce CIRE DE LANETTE E par
la Societe HENKEL 0,5 g
Huile de ricin ethoxylee vendu sous la marque
de commerce CEMULSOL B par la Societe
RHONE POULENC 1 g
Diethanolamide oleique 1,5 g
Sel pentasodique de l'acide diethylène
triamine pentacetique vendu sous la marque
de commerce MASQUOL DTPA par la Societe
PROTEX 2,5 g
Ammoniaque à 22 Be 11 g
Eau qsp 100 g
- 21 -
~3~6952
- pH : 10
Au moment de l'emploi, on ajoute 100 g d'eau
oxygénee à 20 volumes. Le melange, appliqué 25 minutes à
35C sur dec cheveux naturels, leur confère, après
shampooing et rinçage, une coloration bleu pourpre foncé.
Exemple de teinture 6
On prépare le mélange tinctorial suivant:
- Dichlorhydrate de 2,4-diamino-1,3-diméthoxy-
benzène 0,089 g
- Paraphénylènediamine 0,134 g
- Paraaminophénol 0,16 g
- Résorcine 0,13 g
- Métaaminophenol 0,09 g
- 2-methyl-5-N-(B-~hydroxyéthyl)aminophenol 0,1 g
- Nonylphénol.oxyéthylene à 4 moles O.E.
vendu sous la marque de commerce .
CEMULSOL NP 4 par la Société RHONE POULENC 12 g
- Nonylphénol oxyethylene à 9 moles vendu
sous la marque de commerce CEMULSOL NP 9
par la Societe RHONE POULENC 15 g
- Alcool oleique polyglycérolé à 2 moles
de glycérol 1,5 g
- Alcool oléique polyglycerole à 4 moles
de glycerol 1,5 g
- Propylène glycol 6 g
- Acide ethylènediamine tetracetique vendu i
sous la marque de comme.rce TRILON B 0,12 g .
- Ammoniaque à 22 Be 11 g
- Eau qsp 100 g
- pH : 3.6
- 22 -
~3~i9~Z
Au moment de l'emploi, on ajoute 100 g d'eau
oxygenée à 20 volumes. Le mélange, appliqué 25 minutes à
35C sur des cheveux permanentés, leur confère, après
shampooing et rinçage, une coloration gris pourpre foncé.
Exemple de teinture 7
On prépare le mélange tinctorial suivant:
- Dichlorhydrate de 2,4-diamino-1,3-diméthoxy-
benzène 1,2 g
- Dlchlorhydrate de N,N-di-(B-hydroxyéthyl)
paraphénylènediamine 1,34 g
- Alcool cétylstéarylique vendu sous la
marque de commerce ~LFOL C 16/18 par la
Société CONDEA 8 g
- Sulfate cétylstéarylique de sodium vendu
sous la marque de commerce CIRE DE ~ANETTE E
par la Société HENKEL 0,5 g
- Huile de ricin éthoxylée vendu sous la
marque de commerce CEMULSOL B par la
Société RHONE POULENC 1 g ~-
20 - Diéthanolamide oléique 1,5 g
- Sel pentasodique de l'acide diéthylène
triamine pentacétlque vendu sous la marque
de commerce MASQUOL DTPA par la Société
PROTEX 2,5 g
- Ammoniaque à 22 B 11 g
- Eau qsp 100 g
- pH : 9,9
Au moment de l'emploi, on ajoute 100 g d'eau
oxygénée à 20 volumes. Le mélange, appliqué 15 minutes à
35C sur cheveux naturellement blancs à 90~, leur confère,
après shampooing et rinçage, une coloration bleu tamise.
- 23 -
13~6~52
Exemple de teinture 8
On prépare le mélange tinctorial suivant:
- Dichlorhydrate de 2,4-diamino-1,3-diméthoxy-
benzène 1~2 g
- Dichlorhydrate d'isopropyl-p-phénylene-
diamine 1,1 g
- CARBOPOL 934 (marque de commerce;
Société GOODRICH CHEMICALS) 3 g
- Alcool à 96 11 g
10 - 2-butoxyéthanol 5 g
- Bromure de triméthylcétylammonium 2 g
- Acide éthylène diamine tétracétique vendu
sous la marque de commerce TRILON B 0,2
- Ammoniaque a 22Bé 10 g
- Bisulfite de sodium à 35 Bé 1 g
- Eau qsp 100 g
- pH : 9
Au moment de l'emploi, on ajoute 100 g d'eau
: oxygenee à 20 volumes. Le mélange, appliqué 25 minutes a
35C sur des cheveux naturellement blancs a 90~, leur
confère, après shampooing et rinçage, une coloration bleu
tamise. f
,,
- 24 -