Note: Descriptions are shown in the official language in which they were submitted.
1 3 1 527~
La pr~sente invention telle que ci-après d~crite a
pour objet Ull procéd~ de préparation de nouvelles oximes
dérivées de l'acide 3-sub~itué 7-amino thiazolyl acétamido
c~phalosporanique, de formule I:
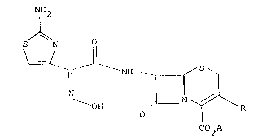
NH2
S N
~ ~ ~ NH r S ~
H 0 N ~ R
C0 A
isomère ~y~, dans laguelle R représente soit un radical
alkyle ayant de 1 à 5 atomes de carbone, soit un radical
CH2-S-Rl dans leque.l Rl représente ou bien un radical 2-
methyl 1,3,4-thiadiazolyle, ou bien un radical 1-m~thyl
tétrazolyle, ou bien radical:
~R2
~ S ~
dans lequel R2 représente un radical alkyle ayant de 1 à 4 atomes de
carbone ou un radical alkoxy ayant de 1 à 4 atomes de carbone,
ou bien Rl représente un radical acyle ayant de 2 à 4
atomes de carbone et ~ représente un atome
d'hydrogène ou un équivalent de métal alcalin, alcalino-
terreux, de magnésium ou d'une base organique amin~e.
L'invention telle que revendiquée exclut toutePois
les composés de formule I dans laquelle R est un radical
C~l2-S-R1 dans lequel R1 est un radical 2-méthyl 1,2,4~
-- 1 --
1~ "
thiadiazolyle, un radical l-méthyl tetrazolyle ou un radical
2 dans laquel R2 représente un radical methyle ou un radical
S N alkoxy ayant de 1 à 4 atomes de carbone.
Les radicaux alkyle que R peut repr~senter ~ont,
par exemple, les radicaux m~thyle, ~thyle, propyle,
isopropyle, butyle, sec-butyle, tért-butyle, pentyle~
Les groupements alkyle que peut repr~senter R2
sont les radicaux methyle, éthyle, propyle, isopropyle,
.. .
.
,
1 31 527~
butyl, sec-butyle, tert-butyle.
Parmi les groupements acyle que peut représenter
Rl, on citera les groupements acétyle, propionyle, n-butyryle
ou isobutyryle.
Parmi les valeurs de A, on peut citer un
équivalent de sodium, de potassium, de lithium, de calcium
ou de magnésium, parmi les bases organiques aminées, on peut
citer la triméthylamine, la diéthylamine, la triéthylamine,
la méthylamine, la propylamine, la N,N-diméthyl éthanol
lo amine, le tris(hydroxyméthyl)amino méthane, l'arginine ou la
lysine.
L'invention a particulièrement pour objet un
procédé de préparation des produits de formule (I), telle
que définie précédemment, isomère syn, dans laquelle R
représente soit un radical alkyle ayant de 2 à 5 atomes de
carbone, soit un radical -CH2-S-R1 dans lequel R1 représente
un radical acyle ayant de 2 à 4 atomes de carbone et A est
défini comme précédemment, ainsi que des produits de formule
(I), telle que définie précédemment, isomère syn, dans
laquelle R représente un radical -CH2-S-R1, dans lequel R
représente un radical
R2
N
~ S ~
dans lequel R2 est défini comme précédemment, et A conserve
la signi~ication précitée.
L'invention a plus particulièrement pour objet un
procédé de préparation des produits de formule (I), telle
que définie précédemment, dans laquelle R représente un
radical -CH2-S-R3, dans lequel R3 représente un radical
acétyle, et A représente un atome d'hydrogène ou de sodium,
ainsi que des produits de formule (I),
'
; - 2 -
1315274
telle que dé-finle précéden~nent, dans laquelle R représente un
radical -CH2-S-R3, dans lequel R3 représente un radical
/ N
\S/
dans lequel R4 représente un radical méthyle ou méthoxy, et A
représente un atome d'hydrogène ou de sodium.
Parmi les composés ob-tenus selon le procédé de
l'invention, on peut citer :
- l'acide 7-/2-(2-aminothiazol 4-yl)2-hydroxyimino
acétamid~J3-méthyl ceph-3-ème 4-carboxylique isomère syn et
son sel de sodium,
- l'acide 7-/2-~2-aminothiazol 4-yl)2-hydroxyimino
acétamid~J3-/(l-méthyl tétrazol 5-yl)thiométhy~ ceph-3-ème
4-carboxylique isomère syn et son sel de sodium.
- l'acide 7-/2-(2-aminothiazol 4-yl)2-hydroxyimino
acétamid~/3-/(2-méthyl 1,3,4-thiadiazol 5-yl)thiométhy~/
ceph-3-ème 4-carboxylique isomère syn et son sel de sodium,
ainsi que
- l'acide 7-/2-(2-amino thiazol 4-yl)2-hydroxyimino
acétamid~/3-~acétylthio)méthy~/ceph-3-ème 4-carboxylique
isomère syn et son sel de sodium.
Il est entendu que les produits de formule I précé-
demment cités peuvent exister :
- soit sous la forme indiquée par ladite formule I ;
- soit sous la forme des produits de formule Iz :
J~
S NH q
3 o \~/ ~ I z
--OH ,r- N \ f--R
C2A
1 3 1 5 2 7 l-lr
Le procédé de préparation des composés de formule I,
objet de l'invention, est caractérisé en ce que l'on -traite
un produit de formule II :
H2N~ " 'S `
C2Al
dans laquelle R a la signification indiquée précédemment et
Al représen-te un atome d'hydrogène ou le reste d'un groupement
ester facilement éliminable par hydrolyse acide ou par hydro-
génolyse, par un acide de formule III, isomère ~y~ -
NHR'
,/~
S 2~-
~ / CO2H III
N
~ OR"
ou un dérivé fonctionnel de cet acide, formule III dans laquelle
R' représente un groupement facilement éliminable par hydrolyse
acide ou par hydrogénolyse ou R' représente un groupement
chloracétyle et R" représente un groupement facilement élimina-
ble par hydrolyse acide ou par hydrogénolyse ou R" représente
un groupement chloracétyle, pour obtenir un produit de
formule IV :
~HR'
O ,, S
j IV
~~~~~ OR" ~ _.
C2Al
isomère syn, produit que l'on traite par un agent d'hydrolyse
-- 4 --
1 31 527~
acide, un agent d'hydrogénolyse, par la thiourée ou par
plusieurs des agents précités selon les valeurs de R', R" et
Al, pour obtenir un produit de formule I dans laquelle A
représente un atome d'hydrogene que l'on salifie, le cas
échéant, selon les méthodes usuelles, pour obtenir les produits
de formule I dans laquelle A représente un équivalent de métal
alcalin, alcalinoterreux , de magnésium ou d'une base organi-
que aminée.
Parmi les groupements facilement éliminables par
hydrolyse acide ou par hydrogénolyse que peuvent représenter
R' et R", on peut citer les groupements tert-pentyloxy
carbonyle, terbutyloxy-carbonyle, trityle, benzyle, benzhydryle,
trichloroéthyle,carbobenzyloxy, formyle, trichloroéthoxy-
carbonyle ou 2-tétrahydropyrannyle. Le substituant R" peut
également représenter le groupement l-méthyl l-méthoxy éthyle
qui est un groupement protecteur spécifique des alcools.
Parmi les restes des radicaux esters facilement
éliminables par hydrolyse acide ou par hydrogénolyse que peut
représenter Al on peut citer les radicaux benzhydryle, tert-
butyle, benzyle, paraméthoxy benzyle et trichloroéthyle.
Dans un mode préférentiel d'exécution du procédé, on
traite le produit de formule II par un dérivé fonctionnel de
l'acide de formule III, tel que l'anhydride ou le chlorure
d'acide, l'anhydride pouvant être formé in situ par action du
chloroformiate d'isobutyle ou du dicyclohexylcarbodiimide
sur l'acide. On peut également utiliser d'autres halogénures
ou encore d'autres anhydrides formés in situ par action d'autres
chloroformiates d'alcoyle, d'un dialcoylcarbodiimide ou d'un
autre dicycloalcoylcarbodiimide. On peut également utiliser
d'autres dérivés d'acides, tels que l'azide d'acide, l'amide
d'acide ou un es-ter d'acide activé forrné, par exemple, avec
l'hydroxy succinimide, le paranitrophénol ou le 2-~-dinitro-
-- 5 --
1 31 5274
phénol. Dans le cas où la réaction du produit de formule II
s'effectue avec un halogénure de l'acide de formule yénérale
III ou avec un anhydride formé avec un chloroformiate d'iso-
butyle, on procède, de préférence, en présence d'un agent
basique.
Comme agent basique, on peut choisir, par exemple,
un carbonate de métal alcalin ou une base organique tertiaire,
telle que la N-méthyl morpholine, la pyridine ou une trialcoyl-
amine, telle que la triéthylamine.
La transformation des produits de formule IV en
produits de formule I a pour but de remplacer les substituantsR' et R" par des atomes d'hydrogène et de remplacer le sub-
stituant Al lorsque celui-ci représente le reste d'un groupe-
- ment ester facilement éliminable par hydrolyse acide ou par
hydrogénolyse, par un atome d'hydrogène.
Pour ce faire, on utilise un ou plusieurs agents
d'hydrolyse acide lorsque R' et R", identiques ou différents,
représentent chacun un groupement éliminable par hydrolyse
acide et Al représente un atome d'hydrogène ou le reste d'un
groupement ester facilement éliminable par hydrolyse acide.
On utilise un ou plusieurs agents d'hydrogénolyse lorsque R' et
R", identiques ou différents, représentent chacun un groupement
facilement éliminable par hydrogénolyse et Al représente un
atome d'hydrogène ou le reste d'un groupement ester facile-
ment éliminable par hydrogénolyse.
On utilise la thiourée lorsque R' ou/et R" représentent
un radical chloroacétyle, on utilise de plus un acide et/ou
un agent d'hydrogénolyse selon les valeurs de Al
On utilise un acide, un agent d'hydrogénolyse et la
thiourée lorsque R' ou R" représente un radical chloracétyle
et lorsque l'un des radicaux R', R" et Al représente un
groupement facilement éliminable par hydrolyse acide et l'autre
-- 6 --
1 31 527~
représente un groupement facilemen-t éliminable par hydroyénolyse.
Comme agent d'hydrolyse acide auquel on soumet
éventuellement les produits de formule IV, on peut citer
l'acide formique, l'acide trifluoroacétique ou l'acide acéti-
que. Ces acides peuvent être employés anhydres ou en solution
aqueuse. On peut également utiliser le système zinc-acide
acétique.
On utilise, de préférence, un agent d'hydrolyse acide,
tel que l'acide trifluoroacétique anhydre ou les acides
formique ou acétique aqueux, pour éliminer les groupements
tert-pentyloxy carbonyle, tert-butoxy carbonyle ou trityle que
peuvent représenter les radicaux R' et R" ou les groupements
benzhydryle, tert butyle ou paraméthoxy benzyle que peut
représenter Al. On utilise, de préférence, le système æinc-
acide acétique, pour éliminer le groupement trichloroéthyle que
peuvent représenter R', R" et Al
On utilise, de préférence, un agent d'hydrogénolyse
tel que l'hydrogène en présence d'un catalyseur, pour éliminer
les groupements benzhydryle et carbobenzyloxy que peuvent
représenter R' et R" et benzyle que peut représenter Al.
La réaction de la thiourée sur le produit de formule
IV dans lequel R' représente un groupement chloroacétyle, est
réalisée, de préférence, en milieu neutre ou acide. Ce type
de réaction est décrit par MASAI~I (JACS, 90, 4508 (1968).
La salification des produits de formule I dans
lesquels le substituant A représente un atome d'hydrogène
peut être effectuée selon les méthodes usuelles. La salifica-
tion peut, par exemple, être obtenue par action sur ces acides
d'une base minérale, telle que, par exemple, l'hydroxyde de
sodium ou de potassium ou le bicarbonate de sodium, ou d'un
sel d'un acide carboxylique aliphatique substitué ou non
substitué, tel que l'acide diéthylacétique, l'acide éthyl
1 31 527A,
hexanoique ou, plus spécialement, l'acide acétique.
Les sels préférés des acides précédemmen-t cités
sont les sels de sodium.
La salification peut éyalement être obtenue par
action d'une base organique comme la triéthylamine, la diéthyl-
amine, la triméthylamine, la méthylamine, la propylamine, la
N,N-diméthyléthanol amine ou le tris (hydroxy méthyl) amino
méthane. Elle peut être aussi obtenue par action de l'arginine
ou de la lysine.
Pour la préparation des sels, les solvates des acides
libres peuvent également être utilisés comme produits de départ
à la place des acides libres.
Cette salification est réalisée de préférence dans
un solvant ou un mélange de solvants, tels que l'eau, l'éther
éthylique, le méthanol, l'éthanol ou l'acétone.
Les sels sont obtenus sous forme amorphe ou cristalli-
sée selon les conditions réactionnelles employées.
Les sels cristallisés sont préparés de préférence en
faisant réagir les acides libres avec l'un des sels des acides
carboxyliques aliphatiques mentionnés ci-dessus, de préférence,
avec l'acétate de sodium.
Dans la préparation d'un sel de sodium, la réaction
est réalisée dans un solvant organique approprié, tel que par
exemple, le méthanol, solvant qui peut contenir de petites
quantités d'eau.
L'invention a églament pour objet un procédé de
préparation des produits de formule IA :
NH2
~ N~ ~ R5 IA
C02A
1 31 527D,
isomère syn, dans laquelle R5 représente soit un radical al-
kyle ayant de 1 a 5 atomes de carbone~ soit un radical
CH2-S-Rl dans lequel Rl représente ou bien un radical 2-méthyl
1,3,4-thiadiazolyle, ou bien un radical l-méthyl tétrazolyle,
ou bien un radical :
R2
N
~ E: ~
dans lequel R2 représente un radical alkyle ayant de 1 a 4
atomes de carbone, ou bien Rl représente un radical acyle ayant
de 2 à 4 atomes de carbone, soit R5 représente un radical acé-
toxyméthyle, soit R5 représente un radical carbamoyloxyméthyle
-CH2-O-I-NH2, soit R5 représente un atome de chlore ou un
radical méthoxyle et A représente un atome d'hydrogène ou un
équivalent de métal alcalin, alcalino-terreux, de magnésium ou
d'une base organique aminée, caractérisé en ce que l'on traite
un produit de formule IIA :
H2N \ S
IIA
~ ~ R5
C2Al
dans laquelle R5 a la signification précédente e-t Al represente
un atome d'hydrogene ou le reste d'un groupement ester facile-
ment éliminable par hydrolyse acide ou par hydrogénolyse, par
un acide de formule V :
_ g _
1 3 1 527 llr
NH-R'
~\
V
CH3
~ O-C-CH3
1CH3
isomère syn, ou un dérivé fonctionnel de cet acide, formule
dans laquelle R ' représente un groupement facilement éliminable
par hydrolyse acide ou par hydrogénolyse ou R ' représente un
radical chloracétyle, pour obtenir un produit de formule VI :
NHR '
O
NH~ ~S ~
\C ~CH3 o j \~\ R5
'\ C02Al
isomère sYn, produit que, le cas échéant, lorsque Al représen-te
un atome d'hydrogène, l'on salifie ou traite par un dérivé d'un
groupement ester facilement éliminable par hydrolyse acide ou
par hydrogénolyse et produit de formule VI ou son sel que, soit
l'on traite par un acide minéral aqueux pour obtenir un produit
de formule VII :
NHR '
S~
, -S `~ VI I
~H o~ "~ R5
CO 2Al
-- 10 --
t 31 5~7l~
isomère syn, produit de formule VII que l'on traite par un
acide carboxylique, par un agen-t d'hydrogénolyse, par la
thiourée ou par deux de ces agents selon les valeurs de R' e-t Al
pour obtenir un produit de formule IA dans laquelle A représente
un atome d'hydrogène, soi-t l'on traite par un agent d'hydrolyse
acide et, le cas échéant, selon les valeurs de R' et A1 par
un agent-d'hydrogénolyse, par la thiourée ou par ces deux
agents, pour obtenir un produit de formule IA dans laquelle
A représente un atome d'hydrogène, produit que l'on salifie, le
cas échéant, pour obtenir un produit de formule IA dans lequel
A représente un équivalent de métal alcalin, alcalino-terreux,
de magnésium ou d'une base organique aminée.
La réaction des produits de formules IIA et V est
effectuée dans les mêmes conditions que la réaction des produits
de formule II avec les produits de formule III.
La salification éventuelle et l'estérification
éventuelle des produits de formule VI sont effectuées dans les
conditions habituelles. On peut citer par exemple l'action
du diazodiphényl méthane.
L'acide minéral aqueux avec lequel on traite le
produit de formule VI pour obtenir le produit de formule VII
est de préférence l'acide chlorhydrique aqueux. On opère
par exemple en utilisant de l'acide chlorhydrique N ou 2N
et en conduisant la réaction à température ambiante pendant
un temps compris entre une demi-heure et plusieurs heures. On
amène ensuite à pH neutre par addition d'une base telle que
le carbonate acid de sodium.
Lorsque l'on utilise un acide carboxylique pour
transformer les produits de formule VII en produits de formu-
le IA, on utilise de préférence un acide organique aqueux
tel que l'acide formique aqueux.
L'acide que l'on utilise pour transformer directement
-- 11 --
131527~
les produits de formule VI en produits de formule IA est de
préférence un acide organique aqueux employé à une température
supérieure ~ la température ambiante. On emploie de préférence
l'acide formique aqueux utilisé à environ 50C. La salifica-
tion éventuelle des produits IA obtenus est effectuée dans
les mêmes conditions que décrites précédemment.
Les produits de formule générale I, possèdent une
très bonne activité antibiotique, d'une part sur les bactéries
gram(~) telles que les staphylocoques, les streptocoques et
notamment sur les staphylocoques pénicillino-résistants et
d'autre part, sur les bactéries gram(-) notamment sur les
bactéries coliformes les I<lebsiella, les Salmonella et les
Proteus.
Ces propriétés rendent aptes lesdits produits de
formule I, pharmaceutiquement acceptables, ~ être utilisés
comme médicaments et notamment comme médicaments antibiotiques,
dans le traitement des affections ~ germes sensibles et
notamment dans celui des staphylococcies, telles que septicémies
à staphylocoques, staphylococcies malignes de la face ou
cutanées, pyodermites, plaies septiques ou suppurantes, anthrax,
phlegmons, érésipèles, staphylococcies aigues primitives ou
post-grippales, bronchopneumonies, suppurations pulmonaires.
Ces produits peuvent également être utilisés comme
médicaments dans le traitement des collibaciloses et infections
associées, dans lcs infection~ à Proteus, a l<lebsiella et
Salmonella et dans d'autres affections provoquées par des
bactéries à gram (-).
Parmi les m~dicaments selon l'invention, on retient
les produits de formule I pharmaceutiquement acceptables,
dans laquelle R représente soit un radical alkyle ayant de
2 à 5 atomes de carbone, SOlt un radical -CH~-S-Rl dans lequel
- 12 -
.~
1 31 527a,
Rl représente un radical acyle ayant de 2 à 4 atomes de carbone
et A a la signification précitée, ainsi que les produits de
formule I dans laquelle R représente un radical -CH2-S-R1,
dans lequel Rl représente un radical
N~ 2
J~s /
dans lequel R2 représente un radical alkyle ayant de 1 à 4
atomes de carbone~
Parmi ces médicaments, on retient en particulier
les produits de formule I dans laquelle R représente
un radical -CH2-S-R3 dans lequel R3 represente un radical
acétyle et A represente un atome d'hydrogène ou un
équivalent de sodium, ainsi que les produits de formule I
dans laquelle R représente un radical -CH2-S-R3
dans laquelle R3 représente un radical
1 S~
dans lequel R4 représente un radical méthyle ou méthoxy et A
représente un atome d'hydrogène ou un équivalent de sodium.
Parmi les médicaments selon l'invention, on retient
plus particulièrement:
- l'acide 7-/2-(2-amino-thiazol 4-yl)2-hydroxyimino
acétamid~ 3-méthyl ceph-3-ème 4-carboxylique, isomère ~y~ et
son sel de sodium,
- l'acide 7-/2-(2-aminothiazol 4-yl)2-hydroxyimino
acétamid~/3-/(1-méthyl tét~azol 5-yl)thiom~thy~/ceph-3-ème 4-
carboxylique iSOm~rQ ~y~ et son sel de sodium,
- l'acide 7~/2-(2-aminothiazol 4-yl)2-hydroxyimino
acétamid~ 3-~(2-méthyl 1j3,4-thiadiazol 5-yl)thiométhy~ ceph-3-
ème 4-carboxylique isomère syn et son sel de sodium, ainsi que
- l'acide 7-/2-(2-aminothiazol 4-yl)2-hydroxyimino
- 13 -
`.;'-r ~
1 31 5~7l~
acétamid~/3-/(acé-tylthio)méthy~ ceph-3-ème 4-carboxylique
isomère syn et son sel de sodium.
Les composés de formule I, pharmaceutiquement
acceptables, peuven~ ainsi être utilisés pour préparer des
compositions pharmaceutiques renfermant, à titre de principe
actif, l'un au moins desdits composés.
Ces compositions peuvent être administrées par
voie buccale, rectale, parentérale, intramusculaire ou par
voie locale en application topique sur la peau et les muqueuses.
Elles peuvent être solides ou liquides et se présen-
ter sous les formes pharmaceutiques couramment utilisées en
médecine humaine comme, par exemple, les comprimés, simples
ou dragéifiés, les gélules, les granulés, les suppositoires,
les préparations injectables, les pommades, les crèmes, les
gels, elles sont préparées selon les méthodes usuelles. Le
ou les principes actifs peuvent y être incorporés à des
excipients habituellement employés dans ces compositions
pharmaceutiques, tels que le talc, la gomme arabique, le
lactose, l'amidon, le stéarate de magnésium, le beurre de
cacao, les véhicules aqueux ou non, les corps gras d'origine
animale ou végétale, les dérivés paraffiniques, les glycols,
les divers agents mouillants, dispersants ou émulsifiants,
les conservàteurs.
La dose administrée est variable selon l'affection
traitée, le sujet en cause, la voie d'administration et le
produit considéré. Elle peut être, par exemple, comprise
entre 0,250 g et 4 g par jour, par voie orale chez l'homme
avec le produit décrit à l'exemple 3, ou encore comprise entre
0,500 g et 1 g, trois fois par jour, par voie intramusculaire.
Le procédé, objet de l'invention, permet de préparer
les produits industriels nouveaux de formule gellérale A :
- 14 -
1 31 527~
NHR'
S N 0 A
\ ~I NH
C2Al
isomère ~y~, dans laquelle R', R5 et Al ont la définition
indiquée ci-dessus et R6 représente un groupement l-méthyl
l-méthoxy éthyle ou un atome d'hydrogène, notamment les
produits de formule générale A ci-dessus, dans laquelle R5
a la définition indiquée ci-dessus, à l'exception d'acétoxy
méthyle et plus particulièrement parmi ces derniers, ceux pour
lesquels R6 représente un atome d'hydrogene.
Les produits de formule II dans laquelle R représente
un radical :
R
N -
` CH2-S S ~
dans lequel R2 represente un radical aIkyle aYant de 1 à 4 atomes
de carbone peuvent être ~repares par reaction d'echange en
faisant agir sur l'acide 7-amino cepha~osporanique un pro-
duit de formule B :
: _ ~ 2
HS ~ S ~ B
selon des méthodes connues en elles-memes.
Les produits de formule B qui ne sont pas connus
peuvent être préparés par action du sulhydrate de sodium ou
- 15 -
1 31 527~,
du thioacétate de sodium ou de la -thiourée en présence de
potasse sur un produit de formule C :
R2
N \~ C
C1 \ S /
Les produits de formule V peuvent etre préparés par
action du 2-méthoxy propène sur un produit de formule :
N~IR'
~_I / C2~I
- OH
Un exemple d'une telle préparation est donné plus
loin dans la partie expérimentale.
Les exemples suivants illustrent l'invention sans
toutefois lui conférer aucun caractère limitatif.
EXEMPLE 1 - Acide 7-/2-(2-amino thiazol-4-yl3 2-(hydroxyimino)
_
acétamid~/ 3-méthyl ceph-3-ème 4-carboxylique isomère syn.
Skade A Ester tert butyli~ue de l'acide 7-/2-(2-tritylamino
____ __ ______________ __ ________________ ________ ______
thiazol-4-yl) 2-/(1-méthyl l-méthoxy éthoxy) imino~ acétamid~J
__________ _____ _______ __________ ______ ______ _________
3-methyl ce~h-3-ème 4-carboxyli~ue isomère syn.
On place 2,33 g d'acide 2-(2-tritylamino thiazol-4-yl)
2-(1-méthyl l-méthoxy éthoxy lmino) acétique isomère syn dans
10 cm3 de chlorure de méthylène. On ajoute 1,25 g d'ester
tert-butylique de l'acide 7-amino désacétoxy céphalosporanique
et 2,5cm3 de chlorure de méthylène. On refroidit la solution
par un bain d'eau glacée et introduit en ampoule ~ 0, -~ 5C
en 18 minutes 1,082 g de dicyclohexyl carbodiimide dans 10 cm3
de chlorure de méthylène.
La dicyclohexylurée cristallise environ 10 minutes
après le début de l'introduction. On agite 3 heures à 0, ~ 5C.
On laisse revenir à température ambiante en 30 minutes puis
- 16 -
1 31 527~
agite une heure à 20 - 25C. On rajoute à 0, -~ 5C 0,93 cm3
d'une solution molaire de dicyclohexyl carbodiimide dans le
chlorure de méthylène. On agite une heure à 0, ~ 5C, essore
l'urée formée et la rince au chlorure de méthylène. On en
obtient 0,671 g. On distille à sec sous vide la solution
obtenue et obtient 4,622 g d'une résine qui constitue le
produit attendu brut.
Le produit est purifié sur colonne de silice en
éluant avec un mélange benzène - éther (1-1). On recueille
une fraction homogène que l'on amène à sec poids = 2,238 g.
~tade B : Acide 7-~ -(2-amino thiazol-4-yl) 2-(hydroxyimino)
acetamido7 3-methxl ceph-3-ème 4-carboxyli~ue isomère syn.
On place sous argon 20 cm3 d'acide trifuoroacétique
sous agitation à température ambiante et ajoute 2 g de produit
obtenu au stade A. On agite 10 minutes à température ambiante.
On distille ensuite sous vide jusqu'à un volume de 8 cm3~ On
refroidit la solution au bain de glace et introduit lentement
60 cm3 d'éther isopropylique. On agite 10 minutes à température
ambiante essore et rince à l'éther isopropylique. On sèche sous
vide et obtient 1,5 g de produit.
Ce produit est placé sous argon et on ajou-te 7,5 cm3
d'acide formique à 50 % d'eau. On chauffe à 40C sous
agitation pendant 15 minutes. On essore et rince par 2 fois
1 cm3 d'acide formique à 50 % d'eau et 3 fois par 1 cm3 d'eau
distillée. On récupère 319 mg de triphényl carbinol. On
distille à sec et ajoute de l'éthanol. On reprend par 15 cm3
d'éther triture et essore. On rince à l'éther, sèche et
obtient 0,973 g de produit attendu Rf = 0,3 (acétone ~ 10 %
d'eau).
L'acide 2-(2-tritylamino thiazol 4-yl) 2-(1-méthyl
l-méthoxy éthoxy imino) acétique isomère ~y~, utilisé au
départ de l'exemple 1 a été préparé comme suit : On agite 20
- 17 -
1 31 527ll
minutes à température arnbiante 12,9 g d'acide 2-/(hydroxy)
imin~J2-(2-trityl amino thiazol 4-yl) acétique isornère
syn dans 120 cm3 de chlorure de méthylène et 12 cm3 de
2-méthoxy propène. On concentre à sec et ayite de nouveau
30 minutes dans 60 cm3 de chlorure de méthylène et 12 cm3
de méthoxy propène~ On concentre à sec sous pression
réduite.
On ob-tient le produit attendu que l'on utilise
dans cet état.
EXEMPLE 2 : Sel de sodium de l'acide 7-/2-(amino thiazol-
4-yl)2-hydroxyimino acé-tamido/3-méthyl ceph-3-ème 4-carboxy-
li~ue isomère syn.
On dissout 0,927 g de l'acide préparé à l'exemple 1
dans 4,8 cm3 d'une solution molaire d'acétate de sodium dans
le méthanol. On essore la solution et la rince par 2 fois
0,6 cm3 de la meme solution d'acétate de sodium et 2 fois
0,6 cm3 de méthanol.
On ajoute lentement au filtrat 12 cm3 d'éthanol à
100 %. Le sel de sodium précipite. On essore à température
ambiante et rince à l'éthanol (3 fois 2 cm3) et à l'éther.
On sèche sous vide et obtient 517 mg de produit attendu.
Les liqueurs mères sont diluées par 6 cm3 d'éthanol,
ce qui permet d'obtenir un deuxième jet de 58 mg de produit.
Spectre RMN : (C 3)2
1,93 ppm : méthyl en 3
6,61 ppm : proton du thiazole.
EXEMPLE 3 : Acide 7-/2-(2-amino thiazol-4-yl) 2-hydroxyimino
acétamido73-/(1-méthyl tétrazol-5-yl) thiomethy~J ceph-3-ème
.
4-carboxylique isomère syn.
Stade A : Acide 7-/2-(2-tritylamino thiazol-4-yl) 2-~ -méthyl
_______ _______ ________ _________________ _____ _____ _
l-méthoxy éthoxy) imino acétamid~J3-(1-méthyl tétrazol-
________ ______ ____ __________ _________ __________
- 18 -
1 31 5~7~1,
5-yl) thiomét'hy~ ce~h-3-ème 4-carboxyli~ue isomère syn.
__ ___________ ___ ________________ __ ________ ___ _
On porte 20 rninutes SOU9 agitation ~ température
ambiante 4,3 g d'acide 2-(2-tritylarnino thiazol-4-yl) 2-hydroxy-
imino acétique isomère syn dans 25 cm3 de chlorure de méthylène
e-t 4 cm3 de méthoxypropène. On concentre à sec, reprend par
25 cm3 de chlorure de méthylène et ajoute 1,1 g de dicyclohexyl
carbodiimide. Après 50 minutes d'agitation à température
ambiante, on essore la dicyclohexylurée formée (0,8 y),
refroidit le filtrat à - 30C et ajoute la solution refroidie
à - 30C de 1,64 g d'acide 7-amino 3-(1-méthyl tétrazol-5-yl
thiométhyl)céphalosporanique dans 8 cm3 de chlorure de
méthylène et 1,2 cm3 de triéthylamine.
On laisse revenir à température ambiante pendant
1 h 30, reprend par 20 cm3 d'acétate d'éthyle, agite 10
minutes avec 20 cm3 d'acide chlorhydrique normal. L'acide
2-(2-tritylamino thiazol-4-yl) 2-hydroxyimino acétique
isomère syn en excès précipite. On essore ce produit, décante'
en ampoule, sèche et concentre à sec. On obtient le produit
attendu.
Stade B : Sel de diéthylamine de l'acide 7-/2-(2-tritylamino
_____ _ ____~_______ _____ ____ _________ __ ____ ______
thiazol-4-yl) 2-/(1-méthyl-1-méthoxy éthoxy)imino acétamid~
__________ _____ ____ __________ ______ _______________
3-(1-méthyl tétrazol-5-yl) thiométhyl7 ce~h-3-ème ~-carboxyli~ue
_________ _____________ ___________ ____ ________________ __ __
isomère s~n.
Le produit obtenu au stade A est repris par 10 cm3
d'acétate d'éthyle. On ajoute 0,5 cm3 de diéthylamine et
précipite par 100 cm3 d'éther. On essore 2,748 g de sel
attendu.
Stade C : Acide 7-~2-(2-tritylarnirlo thiazol 4-yl) 2-h~ro~cy-
__~____ ________ ______ __ _________________ ____~_ ____ _
imino acetam_do7 3-~ l-methyl tetrazol-5-yl) thiomethy~/
ce~h-3-eme_4-ca_boxyli~ue_lsonnère syn.
Le produit obtenu au stade B est agité ~0 minutes
avec 10 cm3 d'acétone et 3,5 cm3 d'acide chlorhydrique normal.
-- 19 --
1 31 527/1r
On classe l'acétone extrait à l'acétate d'éthyle, sèche,
concentre à peti-t volume ~t précipite par addition de 50 cm3
d'éther. On obtient 1,83 g de produit attendu.
S__de D : Ac_d_ _-/2-(2-amlno_ h _zol-4-yll_2-hydroxyim_no
acetamido ~_3-/(l_methyl_tetra_ol-5_yl)_th_ométhy~_ceph-_-èm_
4-carboxylique isomère syn.
________ __ ____________ _
On agite 10 minutes le produit obtenu au stade C avec
4 cm3 d'acide formique aqueux (2 volumes d'acide pour un
volume d'eau). On concentre à sec, triture dans 10 cm3 d'eau,
essore, lave à l'eau et empâte à l'éther pour éliminer le
triphényl carbinol. On dissout le produit brut dans 15 cm3
d'acétone à 20 % d'eau, essore l'insoluble et triture dans
10 cm3 d'éthanol. On obtient 1 g de produit impur que l'on
empâte dans 5 cm3 d'un mélange chlorure de méthylène-éthanol
(1-1) et obtient 0,6 g de produit attendu.
Analyse C15H155N9S3 1 EtoH = 543,63
Calculé : NY 23,1 S% 17,7
~rouvé : 22,2 17 7
RMN (CD3)2s
6,65 ppm : proton du thiazole.
7,25 ppm: amine libre.
Spectre IR Nujol
Absorption à 1770 cm 1 caractéristique du ~-lactame.
Exemple 4 - Acide 7-/2-(2-amino thiazol-4-yl) 2-hydroxyimino
acétamid~/ 3-/(acétylthio) méthy~/ ceph-3-ème 4-carboxylique
isomère syn.
Stade A . Sel de diéthylamine de l~acide 7-/2-(2-trit~lamino
_______ ______ _____ ___ ___ ____________ _ ______ ______
thiazol-4-yl) 2-/(1-méthyl l-méthoxy éthoxy) imino acétamid~/
__________ _____ _ __ _~ ________ _ ______ ___________~____
3-(acétylthio) méthy~ ceph-3-ème 4-carboxyli-que isomère syn.
_______ ______ _ __ ___~_ _ _ _____ __ ____________ _
On agite 20 minutes à température ambiante 4,3 g
d'acide 2-(2-tritylamino thiazol-4-yl) 2-hydroxyimino acétique
isomère syn dans 25 cm3 de chlorure de méthylène et 4 cm3 de
-- 20 --
131527~
méthoxypropène.
On opère ensuite comme au stade A de l'exemple 3
en ajoutant l,2g d'acide 3-acetylthiométhyl 7-arnino céphalos-
poranique.
Sans isoler l'acide libre correspondant, on procède
ensuite comme au stade B de l'exemple 3 et isole 2,64 y de
sel attendu.
Stade B : Acide 7-/2-(2-tritylamino thiazol -4-yl) 2-hydroxy-
imino acetam_do/3-~ acetylthio) methy ~ ceph-3-ème 4-carboxyli-
~ue isomère syn.
On place le produit obtenu au stade A dans 10 cm3d'acétone et 3,5 cm3 d'acide chlorhydrique 2N. On chasse
l'acétone, extrait à l'acétate d'éthyle et triture à l'éther.
On essore le condensat et obtient le produit attendu.
Stade C : Acide 7-/2-(2-amino thlazol_4-yl) 2-h~droxyimino
acétamido~ 3-/(acét~lthio) méthy~ ce~h-3-ème 4-carboxylique
__ __ -- __________ _____ __ __
isomère syn.
_________ _
Le produit obtenu au stade B est agité 10 minutes
avec 4 cm3 d'acide formique aqueux (2 volumes d'acide pour un
volume d'eau) à 45C. On concentre à sec sous vide, triture avec
5 cm3 d'eau, essore et sèche sous vide. On obtient 1 g de
produit impur qui est dissout dans 20 cm3 de méthanol. On
essore un insoluble, concentre au demi, ajoute 20 cm3 d'éthanol,
concentre de nouveau au demi , essore, lave à l'éthanol et à
l'étherr On obtient 0,5 g de produit purifié.
Analyse C15ll156N5S3 0~5 EtOH = 480~5
Calculé : ~/O 14,57 S% 20,00
Trouvé : 14,3 20,1
' RMN ( CD3 ) 2S
6,66 ppm : proton du cycle thiazole.
Spectre IR Nujol.
Absorption à 1776 cm 1 caractéristique du ~-lactame.
- 21 -
1 31 527'-~
EXEMPLE 5 - Acide 3-acétoxyméthyl 7-~ ~2-(2-amino thiazol-4-
yl) 2-h~droxyimin~/acétamid ~ ceph-3-ème 4-carboxylique isom~re
syn.
Stade A - Sel de diéthylamine de l'acide 3-acétox~méthyl 7-
_______ ____________ ____________~_____________ ____ ____
/ ~ ~(2-tritylarnino thiazol 4-yl) 2-/1-méthyl l-methoxy ethox~
iminoZacetamid~ ce~h-3-ème 4-carboxyli~ue isomère syn.
On dissout l'acide 2-(2-tritylamino thiazol 4-yl) 2-(1-
méthyl l-méthoxy éthoxy imino) acétique isomère syn, obtenu
selon le procédé décrit à l'exemple 1 à partir de 47,25 g
d'acide 2-(2-tritylamino thiazol 4-yl) 2-hydroxyimino acétique
dans 230 cm3 de chlorure de méthylène. On ajoute 12,5 g de
dicyclohexyl carbodiimide et agite une heure à température
ambiante. On essore la dicyclohexylurée formée que l'on rince
avec un peu de chlorure de méthylène (on en obtient 9,82 g).
On ajoute au filtrat la solution de 13,6 g d'acide 7-amino
céphalosporanique dans 70 cm3 de chlorure de méthylène et
14 cm3 de triéthylamine. On agite deux heures à température
ambiante. On lave en ampoule avec 350 cm3 d'acide chlorhydrique
N, décante, lave à l'eau, sèche et concentre à sec. On dissout
le résidu dans 100 cm3 d'acétate d'ethyle et amorce la cristal-
lisation. On laisse cristalliser 30 minutes, essore et récupère
5,5 g de produit de départ. Le filtrat est concentré à sec
et le résidu est agité 30 rninutes avec 200 cm3 d'éther isopro-
pylique. Après essorage e-t séchage, on obtient 37,35 g de
condensat brut. Pour le purifier on procède ainsi : le produit
est dissout dans 148 cm3 d'acétate d'éthyle. On ajoute 5,5
cm3 de diéthylamine et précipite sous vive agitation par 650
cm3 d'éther. On essore, lave à l'ét'her, s~che et obtient
26,35 g de produit attendu. On concentre ensuite à sec le
filtrat, reprend par 50 cm3 d'éther e-t obtient un deuxième jet
de 2,8 g identique au premier jet en C.C.M. Le sel de diéthyl-
amine est utilisé ainsi pour la suite de la synthèse.
- 22 -
1 31 5274
RMN CDC13 60 z
\ 3( ) (a) = 1,54 ppm
\ (b) = 3,27 ppm
0- 3( )
3( )
proton du cycle thiazole : 6,78 ppm
Stade B : 3-acétoxyméthyl 7-/ /2-(2-tritylamino thiazol 4~yl)2-
_______ ~_ _____ ____ ____ __~_____ ________~________ ____
-methyl l-methoxy éthoxy/imino7acéty ~amlno ce~h-3-eme 4-
carboxylate de di~hényl méthyle isomère syn.
______ _._________ ___ ______ ____________ _
On introduit 4,15 g de sel de diéthylamine obtenu
au stade A dans 40 cm3 de chlorure de méthylène et 55 cm3
d'acide chlorhydrique 0,lN.
On agite 10 minutes ~ température ambiante, décante,
lave la phase organique par deux fois 25 cm3 d'eau. Cette
phase est ensuite séchée, essorée et rincée au chlorure de
méthylène.
On introduit en dix minutes sous agitation 15 cm3
de diazodiphényl méthane à 8 % dans le benzène. On agite 15
minutes à température ambiante puis évapore les solvants sous
pression réduite à 30. On reprend à l'éther isopropylique,
délite et évapore le solvant sous pression réduite. Après une
nouvelle reprise à l'éther isopropylique, on essore et rince.
Après séchage, on obtient 4,41 g de produit attendu.
RMN C~C13
(e) _~3C - NH
~ N
(d) H ~ N~ _~S ~
~ N ~ CH20~CH3 ~b)
a = 1,53 ppm, ~ CH (a)
b = 2,01 ppm, ~ / 3 CO CH ~2
c = 3,25 ppm, / \` (e)
d = 6,78 ppm, 0 CH (a)
(e) = 7,33 ppm. / 3
CH3(c)
- 23 -
1 31 527~
Stade C : 3-acetoxyrnethyl 7-~ /2-(2-tri-tylarnlno_-thlazol ~-yl)
2-(hydroxy)imin~acétamid~ ce~h-3-eIrle 4-carbox~late de
____ ____ _____ ____ ___ ___ ________________ _______
diphényl méth~l isomère syn.
_ _ _ _ _ _ _ _ _ _ _ _ . _ _ _ _ _ _ _ _ _ _
On place 2,775 g de produit obtenu au stade B précédent
dans 14 cm3 d'acétone et ~,5 cm3 d'acide chlorhydrlque N. On
agite deux heures à température ambian-te et chasse l'acétone
sous pression réduite.
On ajoute 20 cm3 d'acétate d'éthyle, agite puis
décante. On lave la phase organique par 4 ~ois 10 cm3 d'eau
légèrement salée. Les eaux de lavage sont extraites par 5 cm3
d'acétate d'éthyle. Les fractions organiques sont réunies
et séchées. On essore, rince à l'acé-tate d'éthyle puis
évapore le solvant sous pression réduite. Le résidu est repris
à l'éther et cristallisé. On délite, essore et rince à l'éther.
Après séchage, on obtient 1,88 g de produit attendu.
RMN CDC13 60 ~Iz
6,88 ppm : proton du cycle thiazolique
7,33 ppm : proton des noyaux phényles.
Rf = 0,5 (éluant = éther à 20 % d'acétone).
Stade D : Aclde 3-acetox~neth~1-7-/ /2-(2-amlno thiazol-4-yl)
2-hydroxyimin~ acetamido/ ceph-3-eme 4-carboxylique isomère syn.
On place les 1,88 g de produit obtenu au stade C
dans 15 cm3 d'acide trifluoroacétlque pur. On conserve au
repos 15 minutes après dissolution, dilue alors en agitant avec
100 cm3 d'éther isopropylique. On agite 5 minutes, essore et
rince à l'éther isopropylique.
Après sechage, le tri~luoro ac~-tate obtenu est dissout
dans 2 cm3 d'éthanol contenarlt 0,2 cm3 de pyridine.
On essore, rince deux fois à l'éthanol et ob-tient le
produit attendu.
RMN (CD ) SO
- 3 2
- 24 -
1 31 527l~
( C )
N112
\ ~' 1l
(b)
(a) : singulet à 2,01 ppm
(b) : singulet à 6,67 ppm
(c) : singulet ~ 7,08 ppm
(d) : singulet à 11,3 ppm
EXEMPLE 6 - Acide 3-acétoxymé-thyl 7- ~ 2-(2-amino thiazol-4-yl)
2-hydroxyimin~/ acétamid~/ ceph-3-ème 4-carboxylique isomère syn.
Stade A . 3-acétoxyméthyl 7-/ /2-(2-tritylamino thiazol-4-yl)
_______ ________ ____ ____ ~_______ _________________ __
2-~ -methyl l-methoxy éthox ~ im_n~Jacetamido ce~h-3-ème 4-carbo-
xylate de tert-butyle isomère syn.
On dissout dans 120 cm3 de chlorure de méthylène
l'acide 2-(2-tritylamino thiazol 4-yl)2-(1-méthyl l-méthoxy
éthoxyimino) acétique isomère syn obtenu à l'exemple 1. On
ajoute 9,84 g d'ester tert-butylique d'acide 7-amino céphalos-
poranique. On refroidit à ~ 10C et ajoute 6,6 g de dicyclo-
hexylcarbodiimide. On enlève le bain réfrigérant et laisse
trois heures sous agitation à température ambiante. On essore
la dicyclohexylurée obtenue (4g) concentre à sec et dissout
le résidu dans 25 cm3 d'acétate d'éthyle. On ajoute 100 cm3
d'éther et lave avec 100 cm3 d'acide chlorhydrique 0,2N et 100
cm3 d'eau et 20 cm3 de solution molaire de carbonate acide de
sodium. On précipite ainsi le sel de sodium du produit de
départ que l'on essore, sèche et en récupère 3,9 g).
On lave ~ l'eau, sèche, essore, concentre à sec.
On reprend par 50 cm3 d'éther, amorce et complète la
- 25 -
1 3 1 527~,
cristallisation par addition de 50 cm3 d'éther isopropylique.
On essore, lave et sèche. On obtient 10,8 g de produit
attendu. F ~-160C.
RMN CDC13
(a) 1,53 ppm
N~
(b) 3,26 ppm \ 0 C~I3(a)
proton du thiazole : 6,76 ppm C CH3(a)
0-C~I3(b)
Stade B : 3-acétoxyméthyl 7- r /2~(2-trit~lamino thiazol 4-yl)
_______ ________ ____ ____ _________ _________________ __
2-(hydroxy)imin~acétamido~ce~h-3-ème 4-carboxyla-te de tert-
____ ____ _____ ________ __ ______________._ ______._______
butyle isomère syn.
___ ____________ _
On porte trois heures sous agitation à température
ambiante la solution de 0,812 g de produit obtenu au stade A
dans 4 cm3 d'acétone et 1 cm3 d'acide chlorhydrique normal.
On ajoute 1 cm3 de solution molaire de carbonate acide de
sodium aqueux, 10 cm3 d'eau et 5 cm3 d'acétate d'éthyle. On
obtient 0,551 g de produit attendu. F ~ 200C.
AnalYSe : C38H377N5 2
Calculé : C% 61,69 H% 5,04 N% 9,47 S% 8,66
Trouvé : 61,5 5,0 9,1 8,4.
RMN : CDC13 60 MHz
1,55 ppm : tert-butyle,
6,88 ppm : proton du thiazole.
Stade C : Acide 3-acetoxymethyl ~ 2-(2-amino thiazol-4-yl)
2-hydroxyimin~ acétamid~ ce~h-3-ème 4-carbbxylique isomère
___ ____ ____ _________ ___ ________________ __ __________
syn.
On opère comme au stade D de l'exemple ~ à partir de
0,551 g de produit obtenu au stade B précédent et de 5 cm3
d'acide trifluoroacétique. On obtient un produit identique
à celui obtenu à l'exemple 5.
EXEMPLE 7 - Acide 3-acétoxyméthyl 7-/ /2-(2-amino thiazol-4-yl)
2-hydroxyimin~/acétamid~/ ceph-3-ème 4-carboxylique isomère syn.
_
- 26 -
1 31 527~
Stade A : Sel de diéthylamine de l'acide 3-acétoxy méthyl 7-
________ ____________ __________________________ _____ ____
/ /2-(2-tritylamino thiazol 4-yl) 2-hydroxy irnino7acétamid~
____ ___ ___~___________ _ ______ ____ _____ ________
ce~h-3-ème 4-carboxyli~ue isomère syn.
__ ________________ __ ____________ __
On dissout 7,6 g de sel de diéthylamine de l'acide
3-acétoxyméthyl 7-/ /2-(2-tritylamino thiazol 4-yl)2-(1-mé-thyl
l-méthoxy éthoxy)imino7acéty~ amino ceph-3-ème 4-carboxylique
isomère syn préparé au stade A de l'exemple 5 dans 30 cm3
d'acétone et 10 cm3 d'acide chlorhydrique 2N. On agite 40
minutes à température ambiante, ajoute 20 cm3 d'eau, chasse
l'acétone à 30C, sous pression réduite. On ajoute 25 cm3
d'acétate d'éthyle, décante, réextrait, lave à l'eau, sèche
et essore, on ajoute au filtrat 1 cm3 de diéthylamine, triture,
glace et essore le sel de diéthylamine formée, le lave à l'éther
et obtient 6 g de produit pur.
Analyse : C H 0 N S
38 40 7 6 2
Calculé : ~/O 60,30 H% 5,33 ~/O 11,10 S% 8,47
Trouvé : 60,5 5,7 10,9 8,2.
RMN ( CD3 ) 2so
6,63 ppm : proton du thiazole,
7,33 ppm : proton du trityle.
Stade A : Acide 3_acetoxymethyl7-~ ~2-(2-amino_thiazol-4-yl)
2_hydroxy_m_no/acetamido7_ceph-3-ème-4--c--r--b-oxyli~ue _somère
syn.
Les 6 g de sel de diéthylamine obtenus au stade A
sont portés à 45 pendant 15 minutes dans 18 cm3 d'acide
formique aqueux ~ 50 %.
On essore le triphényl carbinol, concentre le filtrat
à sec sous pression réduite, en reprenant plusieurs fois à
l'éthanol absolu. On obtient le produit attendu qui est
identique au produit des exemples 5 et 6.
EXEMPL~ 8 - ~cide 3-acétoxyméthyl 7-~ ~2-(2-amino -thiazol-4-yl)
2-hydroxyimino7acétamido7 ceph-3-ème 4-carboxylique isomère syn.
- 27 -
1 31 527~
- 8,29 g du sel de diethylamine obtenu au stade A de
l'exemple 5 son-t portés à 45C pendant 15 minutes dans 24 cm3
d'acide formique aqueux à 50 %.
On essore le triphénylcarbinol, concen-tre le filtrat
à sec sous pression réduite en reprenant plusieurs fois a
l'éthanol absolu. On isole 3,5 g de produit attendu.
Le produit est identique au produit obtenu aux
exemples 5, 6 et 7.
EXEMPLE 9 - Acide 3-~ ~(5-méthyl 1,3,4 thiadiazol-2-yl)
thiométhy~/ 7-/2-(2-amino thiazol-4-yl) 2-hydroxyimin
acétamid~ ceph 3-ème 4-carboxylique isomère syn.
Stade A : Sel de_diethylamine de l'acide_3-~ 5-methyl 1L3L4-
thiadiazol-2-yl) thiomethy~ 7-~ -(2-tritylamino thiazol-4-yl)
2-/(1-methyl l-methoxy éthoxy) imin~ acetamid~ceph-3-ème
4-carboxyli~ue isomère syn.
________ __ ____________ _
On introduit à 20C 1,002g d'acide 2-(2-tritylamino
thiazol-4-yl) 2-~(1-méthyl l-méthoxy éthoxy)imin~ acétique
isomère syn dans 3 cm3 de chlorure de méthylène. On introduit
ensuite à 20C sous azote 0,23 g de dicyclohexyl carbodiimide~
On agite à 20 - 25 C pendant une heure et obtient une suspen-
sion de dicyclohexylurée.
On mélange par ailleurs 0,344 g d'acide 7-amino
3-~(5-méthyl 1,3,4-thiadiazol-2-yl) thiométhy~J ceph-3-ème
4-carboxylique et 2 cm3 de nitrométhane. A la suspension
obtenue, on ajoute à 20 - 25C, 0,28 cm3 le triéthylamine. On
obtient une solution brune à laquelle on ajoute sous agitation
à 20 - 25C en 5 minutes, la suspension d'anhydride et d'urée
précédemment obtenue. On rince par du chlorure de méthylène
et agite 2 heures. On essore la dicyclohexylurée que l'on rince
au chlorure de méthylène. On recueille 0,2 g de dicyclohexyl-
urée.
On agite la solution obtenue avec 8 cm3 d'acide
- 28 -
1 31 5~7~
chlorhydrique a~ueux normal. Un précipité brun est essoré
et rincé à l'eau et au chlorure de méthylène. On obtient 0,4 g
de produit constitué principalemen-t d'acide 7-amino 3-/(5-
méthyl 1,3,4-thiadiazol-2-yl) thiomé-thy~J ceph-3-ème 4-carboxy-
lique de départ.
On lave la solution organique à l'eau distillée
jusqu'à neutralité. On sèche e-t distille sous pression
réduite. On reprend par 5 cm3 d'acétate d'éthyle. On essore
à température ambiante un insoluble que~ l'on rince à l'acé-tate
d'éthyle.
Cet insoluble est constitué par 0,32 g d'acide
2-(2-tritylamino thiazol-4-yl) 2-hydroxyimino acétique isomère
syn.
On concentre la solution obtenue jusqu'~ environ
4 cm3. On ajoute 0,1 cm3 de diéthylamine et dilue ~ 20C
par 9 cm3 d'éther isopropylique~
On agite une heure à 20 - 25C essore et rince le sel
par l'acétate d'éthyle et l'éther isopropylique.
On sèche et distille sous pression réduite et
obtient 0,72 g de produit attendu.
R~N (CDC13 60 MHz)
6,76 ppm (proton en 5 du thiazole)
7,28 ppm (protons du groupement trityle).
Stade B : Acide 3- ~-methyl lL3L4-thiadiazol-2-yl) thiometh~
7-/2-(2-tritylamino thiazol-4-yl) 2-/hydroxyimin~ acetamid~/
ce~h-3-ème 4-carboxyli~ue - isomère syn.
On place 6,93 g de produit obtenu au stade A dans
28 cm3 d'acétone. On ajoute à 20 - 25C à la solution obtenue
8,6 cm3 d'une solution 2 N d'acide chlorhydrique aqueux. On
agite deux heures trente minute à 20 - 23C. On rajoute ~,3 cm3
d'acide chlorhydrique aqueux 2N puis 28 cm3 d'eau distillée.
On distille l'acétone sous vide sans dépasser 35C.
- 29 -
1315~7ll
On essore à température ambiante, lave jusqu'à
neutralité, sèche sous pression réduite.
On obtient 5,79 g de produit attendu impur.
Ce produit est purifié comme suit :
On dissout 2,79 g de produit précédent dans 8,4 cm3
de chlorure de méthylène. On ajou-te a 20 - 25C en 5 minutes
28 cm3 d'acétate d'éthyle.
On agite 30 minutes, essore, rince ~ l'acétate
d'éthyle, sèche sous pression réduite et ohtient 2,22 g de
produit.
On concentre les liqueurs organiques sous vide à
environ 5 cm3 et obtient après essorage un deuximème jet de
0,27 g.
~N (CDC13, 60 ME~z)
7,01 ppm (proton en 5 du thiazole)
7,31 ppm (protons du groupement trityle).
Stade C : Acide 3-~ /(5-methyl 1~3,4-thiadiazol-2-yl) thiomethy
7-/2-(2-amino thiazol-4-yl) 2-hydroxyimin~ acétamido/ ce~h-3-ème
__ ____________________ ______ ____ ____ ________ ___ _______
4-carboxylique isomère syn.
On place 2,48 g de produit obtenu au stade B, dans
7,5 cm3 d'acide formique à 33 % d'eau. On agite à 45 - 50C
pendant 15 minutes sous azote. On ajoute à 45 - 50C 2,5 cm3
d'eau distillée. On essore aussitôt à 50C le triphénylcarbinol
précipité et le rince par 3 fois 2,5 cm3 d'acide formique à
50 % d'eau. On sèche sous pression réduite et obtien-t 0,77 g
de triphényl carbinol. On distille le filtrat sous pression
réduite et reprend par 5 cm3 d'eau distillée. On triture, essore
à 20C et rince par de l'eau distillée, pUi9 par de l'éther.
On s~che sous vide et obtient 1,15 g de produit
attendu. On empâte pendant 30 minutes dans 11,5 cm3 d'éthanol.
On essore et rince par de l'éthanol, puis de l'éther~ On sèche
sous vide et obtient 1,06 g de produit attendu.
- 30 -
1 31 5274
RMN (DMSO, 60 ~Iz)
6,7 ppm (proton en 5 du thiazole)
2,68 ppm (méthyl du g~oupement thiadiazole).
EXEMPLE 10 - Sel de sodium de l'acide 3-~ ~(5-méthyl 1,3,4-
thiadiazol-2-yl) thiométhy~J 7-~2-(2-amino thiazol-4-yl)
2-hydroxyimin~/acétamid~J ceph-3-ème ~-carboxylique isomère syn.
On reprend à température ambiante 1 g d'acide obtenu
à l'exemple 9 par 15 cm3 de méthanol et 2,2 cm3 de solution
méthanolique de triéthylamine lM pendant 5 minutes sous agita-
tion. On essore un insoluble (poids : 0,066 g). On le rincepar du méthanol. Au filtrat on ajoute 3 cm3 d'une solution
méthanolique d'acétate de sodium. Le sel de sodium précipite
immédiatement et on le dilue par 50 cm3 d'éthanol. On agite
15 minutes à température ambiante, essore et rince par 3 fois
2 cm3 d'éthanol et 3 fois 5 cm3 d'éther. On sèche sous pression
réduite et obtient 0,511 g de produit at-tendu. On concentre
les liqueurs organiques sous pression réduite jusqu'à 15 cm3,
essore et rince par 3 fois 0,5 cm3 d'éthanol et 3 fois 5 cm3
d'éther. On sèche sous vide et obtient 0,200 g de produit.
On empâte 30 minutes à température ambiante dans 7 cm3
d'étnanol les deux jets de produit. On essore et rince par
de l'éthanol et de l'éther. On sèche sous vide et obtient
0,679 g de produit attendu.
RMN DMSO, 60 MHz
2,66 ppm (méthyl du groupement thiadiazole)
6,65 ppm (proton en 5 du thiazole).
EXEMPLE 11 - On a réalisé une préparation pour injection de
formule :
- sel de sodium de l'acide 7-~2-(2-amino thiazol-4-yl) 2-
hydroxyimino acétamid~/ 3-méthyl ceph-3-ème 4-carboxylique
isomère syn ............................................ 500 mg
- Excipient aqueux stérile q.s.p. ...................... ..5 cm3.
- 31 -
1 3 1 527'~
EXEMPLE 12 - On a realisé une préparation pour injection de
formule :
- Acide 7-/2-(2-amino thiazol~4-yl) 2-hydroxyimino acétamid~/
3-~(1-méthyl tétrazol 5-yl) thiométhy~/ ceph-3-ème 4-carboxy-
lique isomère syn ........................................... 500 mg
- Excipient aqueux stérile q.s.p. ........................... 5 cm3.
EXEMPLE 13 - On a réalisé une préparation pour injec-tion de
formule :
- ~cide 7-/2-(2-amino thiazol-4-yl) 2-hydroxyimino acétamid~
3-/(acétylthio) méthy~/ ceph-3-ème 4-carboxylique isomère
syn ......................................................... 500 mg
- Excipient aqueux stérile q.s.p. ........................... 5 cm3
EXEMPLE 14 - On a réalisé des gélules répondant à la formule :
- Acide 7-/2-(2-amino thiazol-4-yl) 2-hydroxyimino acétamid~/
3-/(1-méthyl tétrazol-S-yl) thiométhy ~ceph-3-ème 4-carboxyli-
que isomère syn ............................................. 250 mg
- Excipient q. 5 .p. pour une gélule terminée à ............. 400 mg
Etude pharmacoloqique des produits de l'invention
~/ Ac _vité in vitro :
Méthode des dilutions en milieu liquide
__________________________________ ____
On prépare une série de tubes dans lesquels on
répartit une même quantité de milieu nutritif stérile. On
distribue dans chaque tube des quantités croissantes du produit
à étudier, puis chaque tube est ensemencé avec une souche
bactérienne.
Après incubation de vingt-quatre ou quarante-huit
heures ~ l'étuve à 37C, l'inhibition de la croissance est
appréciée par transilluminatlon, ce qui permet de déterminer
les concentrations minimales inhibitrices (C. M. I.) exprimées
en,ug/cm3.
Les résultats suivants ont été ob-tenus :
- 32 -
1 31 527l-~
Prodult de l'exern~le 2
---
SOUCIlES C.M.I. en ,ug/ml
24 H ! 48 I-I
Staphylococcus aureus ATCC 6 538 Pen-
Sensible .................................. 5 ~ 5
___________________________________________ ______ __________
Staphylococcus aureus UC 1 128 Pen-
Résistant ................................. 5 1 5
_______________________ ___________________ _______ __________
Staphylococcus aureus exp N 54 146 _______ __________
Streptococcus pyogènes A 561 .............. 0,1~ 0,2
___________________________________________ ______ __________
Streptococcus faecalis 5 432 .............. 40 40
___________________________________________ _______ _________
Streptococcus faecalis 99 F 74 ............ ~ 40 ~ 40
___________________________________________ _______ __________
Bacillus sub-tilis ATCC 6 633 ............. ...5 20
___________________________________._______ ______ _____ ____
Escherichia Coli Sensible Tétracycline
ATCC 9 637 ................................ 2 2
__________~________________________________ ______ ________
Escherichia Coli Résistant Tétracycline
ATCC 11 303 ............................... 1 2
_____________________________ _____________ _______ __________
. Escherichia Coli Exp. TO26B6 .............. 2 2
___________________________________________ _______ __________
Escherichia Coli Résistant Gentamicine,
Tobramycine R 55 123 D . _______ _____ ____
I~lebsiella pneumoniae Exp. 52 145 ........ 1 1
___________________________________________ _______ __________
I~lebsiell~ pneumoniae 2 536 Résistant
Gentamycine ............................... ...3 5
___________________________________________ ________ __________
Proteus mirabilis (indol-) A 235 ............... 1 2
_______________________________________ ___ ____.___ __________
Salmonella typhimurium 420 ................ 1 2
___________________________________________ ________ ________
Enterobacter cloacae 681 ..................... 10 20
___________________________________________ ________ __________
Providencia Du 48 ............................ 10 40
___________________________________________ ________ __________
Serratia Résistant Gentamicine 2 532 ...... ~40 ? 40
- 33 -
1 3 1 527~
Produit de l'exem~le 3
_____~_____ _____ ____
SOUCHES C.M.I en ~g~ml
24 H 48 H
_
Staphylococcus aureus ATCC 6 538 Pen-
Sensible .............................................. 0,2 0,2
_ ___ __ __ __ __ __ __ _____ _____ ____ ___ _______ _ ___ ___ __ _ ________ I
Staphylococcus aureus UC1 128 Pen-
Résistant.................................................. 0,5 0,5
_ _ ___ ______ ____ ____ __________ ______ _____ _ __ __ __ ___ __ ___ ___ I
Staphylococcus aureus exp. N 54 146....................... 0,2 0,5
_________________________________________ _________ _________
Streptococcus pyogènes A 561 .~........................... ~0,02 ~ 0,02
10_________________________________________ _________ __ ______
Streptococcus faecalis 5 432 ............................... 2 3
_________________________________________ _________ _________
Streptococcus faecalis 99 F 74 ............................. 5 20
_______________________ ___________._____ _________ _________
Bacillus subtilis ATCC 6 633 .......................... 0,5 1
_________________________________________ _________ _________
Escherichia Coli Sensible Té-tracycline
ATCC 9 637 ............................................ 0,1 0,1
_________________________________________ __________________
Escherichia Coli Résistant Tétracycline
ATCC 11 303 ........................................... ~0,02 ~0,02
_________________________________________ _________ ________ I
Escherichia Coli Exp. T026B6 .......................... 0,1 0,1
_____________________________.___________ _________ _________
Escherichia Coli Résistant Gentamicine,
Tobramycine R 55 123 D ................................ 0,1 0,1
_________________________________________ _________ ________
I~lebsiella pneumoniae Exp. 52 145 .................... ~0,02 0,05
___________________ ___________________ _ _________ _________
I~lebsiella pneumoniae 2 536 Résistant
Gentamycine ........................................... 0,5 0,5
_______ _________________________________ _________ ________
Proteus mirabilis (indol-) A 235 ...................... 0,05 0,1
_________________________________________ _________ _________
.~ Salmonella typhimurium 420 ..... ~........... 0,1 0,1
_____________________________________ ___ _________. _________
~ Enterobacter cloacae 681 ................... 3 5
_________________________________________ _________. _________
Providencia Du 48 .......................... 1 2
_________________________________________ _________. __________
Serratia Résistant Gen-tamicine 2 532 ... 1 ¦ 2
_
- 34 -
1 3 1 5 2 7 '1
Produit de l'exem~le 4
________~________ ____
C.M.I. en)lg/ml
SOUC~IES ___________________
24 H 48 H
.
Staphylococcus aureus ATCC 6 538 Pen-
Sensible ................................ 0,5 0,5
_________________________________________________ _________
Staphylococcus aureus UC 1 128 Pen-
Résistant ............................... 0,5
________________________________________ _________. _________
Staphylococcus aureus exp. N 54 146..... 0,5
________________________________________ _________ _________
Streptococcus pyogènes A 561 ............ ~0,02 0,Q3
________________________________________ __________ .__________
Streptococcus faecalis 5 432 ............ 5 >40
__________________________________.______ _________. ._________
Streptococcus faecalis 99 F 74 .......... 10 40
________________________________________ _________ _________
Bacillus subtilis ATCC 6 633 ............ 0,5 1
________________ _______________________ _________. ._________.
Escherichia Coli Sensible Tétracycline
ATCC 9 637 .............................. 0,5 0,5
________________________________________ _________. _________
Escherichia Coli Résistant Tétracycline
ATCC 11 303 ............................. 0,2 0,2
________________________________________ _________. _________
Escherichia Coli Exp. TO2~B6 ............ 0,5 0,5
________________________________________ _________. __________
Escherichia Coli Résistant Gentamycine,
Tobramycine R 55 123 D .................. 0,5 0,5
_______ ________________________________ ________ . _________
I~lebsiella pneumoniae Exp. 52 145 ...... 0,2 0,5
________________________________________ __________ __________
I~lebsiella pneumoniae 2 536 Résistant
Gentamycine ............................. 2 3
________________________________________ _________~ _________
Proteus mirabilis (indol-) A 235 ........ 0,2 0,2
____ .___________________________________ --~------~--------- -~----------------1
Salmonella typhimurium 420 .............. 0,5 0,5
________________________________________ __________. __________
Providencia Du 48 ....................... 10 40
____ ___________________________________ ____________________
Serratia Résistant Gentamycine 2 532 ..1 20 ¦ 40
- 35 -
131527~
Produit de l'exem~le_10
_ _ _ _ _ _ _ _ _
C.M.I. en~u~/ml
SOUC~IES __________ _ ______
_ 18II ~ 24 II
_ _
Staphylococcus aureus ATCC 6 538 Pen-
Sensible ................................ 0,5 0,5
________________________________________ __________ _________
Staphylococcus aureus UC 1 128 Pen-
Résistant ............................... 0,5 0,5
________________________________________ __________ _________
Staphylococcus aureus exp. 54 146........ 0,5 0,5
________________________________________ __________ _________
Staphylococcus aureus CO 15 Résistant
Céphalexine ............................. 2 3
________________________________________ __________ _________
Streptococcus pyogènes A 561 ............ 0,1 0,1
________________________________________ __________ _________
Streptococcus faecalis 5 432 ............ 1 2
________________________________________ __________ _________
Streptococcus faecalis 99 F 74 .......... 2 2
________________________________________ __________ _________
BaciLLus subtilis ATCC 6 633 .. .. ________ _ 0,5
Escherichia Coli Sensible Tétracycline
ATCC 9 637 .............................. 0,2 0,2
_ _ ____ __ ____ _ __ _ _ __ __ __ __ ___ __ __ _ __ _ _ __ _ _ __ __ __ ___ _ __ _ _ _ ___
Escherichia Coli Résistant Tétracycline ,-
ATCC 11 303 ............................. ~0,02 ~0,02
_ __ ___ ___ _ _ _ __ _ ___ __ __ _ _ _ _ __ __ ___ _ __ _ _ _ _ __ __ ___ __ _ __ _ __ __ _ _
Escherichia Coli Exp. TO26B6 ............ 0,2 0,2
___________________________________.____ __________ _________
Escherichia Coli Résistant Gentamycine, .
Tobramycine R 55 123 D .................. 0,5 0,5
________________________________________ __________ _________
I~lebsiella pneumoniae Exp. 52 145 ...... 0,05 0,1
________________________________________ __________ _________
I~lebsiella pneumoniae 2 536 Résis-tant
Gentamycine ............................. 1 2
________________________________________ __________ _________
Proteus mirabilis (indol-) A 235 ........ 0,1 0,:L
_ _ _ __ __ __ _ __ _ _ _ _ ___ __ _ ___ ___ _ _ __ _ __ _ _ _ _ _ _ _ _ __ __ __ _ ___ _ _ __ __
Salmonella typhimurium 420 .............. 0,2 0,2
_ . _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ ._ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
Enterobacter cloacae 681 ................ 2 2
_ ___ _ _ _ __ __ _ _ _ __ _ __ _ _ __ _ _ __ _ _ _ _ _ _ _ __ _ _ _ _ _ _ __ _ _ _ _ _ _ _ _ _ _ _ _ _
Providencia Du 48 ....................... 3 3
_______________________________.________ __________ ________
Serratia Résistant Gentamycine 2 532
- 36 -
1 31 5~74
~J Activi-té in vivo
Infection experimentale à Proteus Morganii A 256.
On a étudié l'action du produit de l'exemple 3 sur
une infection expérimentale à Proteus Morganii de la souris.
On a infesté des lots de dix souris mâles d'un
poids moyen de 20 g par injection intrapéritonéale de 0,5 cm3
d'une culture de 22 heures dans un milieu à PH 7 de la souche
de Proteus Mirabilis A 256 diluée au 1/10.
On a administré par injection sous-cutanée, une
heure, cinq heures et vingt-quatre heures après l'injection
une quantité déterminée de produit.
Les résultats suivants ont été enregistrés:
Mortalité apres Souris
_ survivantes
4h30 5hl5 5h30 22h 24h ¦24h30lau 8ème jour
_ i
Temoin _____ _____ ______ _____ _____ ______ 0/10
Produit de
l'exemple 3 9 1 0/10
3 x 0,025 mg
______________ _____ _____------------------------------1----------------------------------------
Produit de
l'exemple 3 3 1 1 1 4/10
3 x 0,05 mg _____ _____ ______ _____ _____ ______ ______________
Produit de
l'exemple 3 10/10
3 x 0,1 mg I