Note: Descriptions are shown in the official language in which they were submitted.
132~9~
PROC~DE D~ PREPARATION D'ALLIAG~S MERES
De FER ET DL NFODYME PAR EL~CTROLYS~ D~ S~LS OXYG~NFS
~N MILI~U FLUORUR~S FDNDUS
: ..
DOMAIN~ T~C~NIQUE DL L'INVENTION
L'invention concerne un procédé de préparation d~alliages mères de fer
- néodyme par électrolyse d'un sel de néodyme contenant de l'oxygène
dans un milieu contenant principalement des fluorures fondus, à l'aide - ---
d'une cathode en fer et d'une anode à base de carbone. :
.:
ErAT D~ L'ART ANTERIEUR
La littérature décrit un certain nombre de procédés très notablement
différents du nôtre permettant d~obtenir divers types d'alliages contenant
des lanthanides,
:. ':' -
Dans le cas de l'obtention électrolytique des alliages fer néodyme on
retiendra essentiellement:
::
- L'électrolyse de l'oxyde de néodyme en milieu fluorures fondus sur
cathode en fer (~.MORRIC~ - ~. SHEDD et ~.HENRIE - US Bureau of Mines
- rapport 7146 - 1968). Les auteurs décrivent très som~airement leur
procédé basé sur une cellule comprenant une cathode en fer et deux anodes
en graphite. L'électrolyte est composé de 11% de LiF et 89% de NdF3
fondus à 985~C. La base de ce bain liquide est refroidle de manière
à solldlfler les gouttelottes d'alllage. Le soluté à électrolyser est
un oxyde de Néodyme courant dont les propriétés physico-chimiques ne
sont p~s décrites.
Il est bien connu que dans un tel bain fondu les oxydes calcines clas
siques ne se dissolvent que très peu et surtout que tres lentement,
ce qui conduit non seulement à de fréquentes polarisations de concentra- ,
tion ~ais à la formation de boues importantes au fond du creuset, qui
perturbent l'exploitation de la cellule. Par ailleurs la tension théorique
d'electrolyse sur anode carbone avec formation de CO est de l'ordre
de 1,6 V. La tension annoncée par les auteurs, de l'ordre de 27 volts ,
pour une intensité de 50 à 100 A, implique une surtension phenoménale, ~ ~
2 132~19~
La precipitation de l'alliage sous forme de nodules solides qui tombentsur un fond de bain solidifié et sont noyés dans laboue ne permet leur
extraction que par arrêt de l'électrolyse, et concassage du bain solidi-
fié. Le procédé décrit ne peut donc, pour toutes ces raisons, être consi-
déré comme exploitable industriellement.
- L'électrolyse du chlorure de néodyme en milieu chlorures fondus (F.
SEON et G. BAR~HOLE - Rhône Poulenc - CA 1,276,585, délivré le
21/11/90), pénalisée pa~ une forte réoxydation du métal réduit. ~ '
- L'électrolyse du fluorure de néodyme en milieu fluorures fondus ~K.
ITOH et al. Sumitomo Light Metal - 177 233). -
Ce procédé est fondamentalement différent de celui que nous proposons
dans la mesure ou il s'agit d~une électrolyse de fluorure de néodyme
totalement exempt d'oxyde, dont le mécanisme d'oxydation à l'anode condult ~ -à la formation exclusive de fluor et/ou de composésfluorés du carbone,
ce qui entraîne: tension théorique de décomposition élevée, polarisation
anodique importante, délitement excessif du carbone. Le traltement des
résidus anodiques, gaz et charbonnaille, n'est d'ailleurs pas décrit,
OBJBT DB L'INVkNTlON
La présen~e invention concerne un procédé très per~ormant réunissant
les avantages de l'électrolyse d'ions contenant de l'oxygéne, dissous
dans un ~luorure fondu, sur anode consommable dépolarisante et de l'utili-
sation judicieuse de sels oxygénés à grande cinétique de dissolution. ~ : '
Ces composés sont tout spécialement choisis et/ou préparés ou peuvent --
résulter de réactions in-situ d'espèces préalablement choisies. Leur
comportement à l'électrolyse est fondamentalement différent de celui
des oxydes calcinés classiques.
::.
:. . :- . .
En effet, l'utilisation de sels conduisant, par oxydation anodique d'anions
oxyfluorés dissous, à des espèces réagissant avec le carbone anodique
pour donner CO et/ou CO2 permet d'abaisser notablement la tension néces-
saire à leur électrolyse et par là même de diminuer la quantité d'énergie
spécifique consommée lors de la mise en oeuvre du procédé. Encore faut- -
.....
:'',,.., ,",'''.':
'"'.
::, . --'
132~1~
,.
- 3 -
il que ces sels libèrent très rapidement leurs oxydes à la
dissolution.
un certain nombre de proc~dures et de dispositifs permettent
en outre d'améliorer de manière substantielle l'économie du
proc~dé.
Selon la pr~sente invention, il est prévu un procédé de
préparation électrolytique d'un alliage mère de fer et de
néodyme par réduction d'un mélange comprenant au moins un
composé oxygéné réactif de néodyme dans un bain
d'électrolyte d'halogénures fondus avec au moins une cathode
métallique et une anode en carbone caractérisé en ce que
dans le but de réduire la quantité d'énergie spécifique et
d'abaisser le coût opératoire du procédé:
- on constitue un bain d'halogénures fondus principalement
par mélange de fluorures fondus dont le potentiel de
décompo~ition est voisin de celui de NdF3 ou plus négatif
permettant par effet de complexation de solubiliser des
oxyde~ du soluté ~ réduire,
- on con~titue de tel soluté par un mélange de sels
contenant principalement un composé oxygén~ réactif du
néodyme très rapidement soluble dans l'électrolyte fondu et
- on règle la température de travail entre 640 et 1030~C
avec une densité de courant anodique comprise entre o,l et
1,5 A/cm2 et une densité de courant cathodique comprise
entre 2 et 30 A/cm2.
l$ ' "
- 3a - 132S~9 ~ ~
'DESCRIPTION DE L'INVENTION
Dans le cadre de l'inventicn, l'électrolyte doit: ~:
- être capable de complexer les ions oxydes, c'est-à-dire de dlssoudre
le sel sollde à électrolyser par attaque de ses molécules,
- de dissoc1er ces dernières en anions et cations (solvolyse) et de
former par association avec les ions du solvant des anions et/ou cations -:-
solubles et stabilisés~ :
- malntenlr le dégré d'oxydatlon sous lequel gQ trouvent les lons néodyme
dlssous et complexés de manlère à llmlter les réactlons parasites à
la cathode ou avec les produits de réductlon~
- être plus stable aux électeodes que le sel à électrolyser, c'està-
dire que le d~maine d'électroactivité du solvant doit totalement englober
celui du sel à électrolyser
Dans le cas de l'électrolyse d'un sel de néodyme, l'électrolyte peut ~:
donc être _constitué de l'un des sels sulvants ou de leur mélange: NdF3,
8cF3, YF3, LaF3, CaFz, MgF2, 8aF2, LiF. Certains addltlfs tels que CaCl2,
MgC12, E3aC12 et LlCl peuvent modifler favorablement certaines proprlétés
physlcochlmlques des mélanges de fluorures, par exemple vlscoslté et/ou
denslté et/ou réslstlvlte électrlque ;: :
Ln procédé que nous propo~on~ 131ustré par les flgures 1 et 2 est basé -.
sur l'électrolyse d'un composé du neodyme
.::
ll) soluble dans un des mélanges fondus cltés cl-dessus, ::
(11) dont le domalne d'électroactlvlté est molns étendu que celul de
3~ l'électrolyte, - .
~ill) dont le catlon réaglt rapldement a la cathode et
~lv) dont l'anlon réaglt avec l'anode ce qui permet d'abalsser la tenslon
,'-,''
' ,"
: ~, ':'
' ,:.:. . ',
,;'-: ,'',,,
132~19~ -
d'électrolyse : certains sels de néodyme contenant de l'oxygène convena-
blement choisis et/ou préparés peuvent contenir à l'usage que nous propo-
sons
D~SCRIPTION DES FIGUR~S
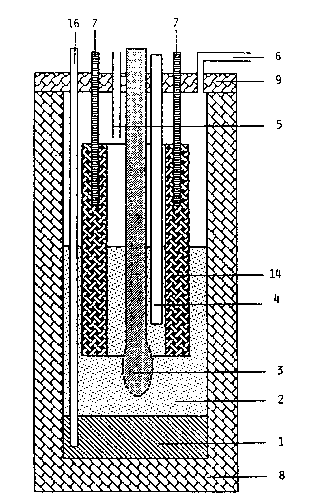
La figure 1 représente une cellule d'électrolyse consitutée d'un creuset
(8) en nitrure de bore fermé par un couvercle 9 de même composition,
d'une cathode 3 en fer pur et d'une anode tubulaire 14 en matériau carboné
concentrique à la cathode 3. L~électrolyte est un sel fondu 2 dans lequel
on introduit à travers un tube guide 4 des "cigarettes" ou des granulés
de poudre à électFolyser. L'alliage liquide formé à la cathode ruisselle
et il est recueilli en fond de cellule 1. Il peut être soutiré à l'aide
d'un tube 16 en fer ou en métal peu attaquable. Les amenees de courant
positives 7 sont en inconel. Les gaz anodiques sont balayés et entraînés
par un gaz inerte, grâce aux orifices en inconel 5 et 6.
La figure 2 représente une cellule de conception légèrement différente.
Le creuset 10 est en fer ou en matériau peu attaquable protégé intérieu-
rement sur sa hauteur par une céramique non-conductrice I9 telle que,
par exemple, du nitrure de bore disposé dans un conteneur 12 en graphite
et fermé par un couvercle 13 en nitrure de silicium. L'anode est un
cylindre massif 15 en matériau carboné entouré de plusieurs cathodes
3 en fer constituant les génératrices d'un cylindre extérieur concentrique
à l'anode 1 5. L'introduction du composé à électrolyser dans le sel fondu
et l'évacuation des gaz anodlques s'effectuent selon des dispositifs
4,5,6 identlques a ceux de la figure 1.
C'est à partir de ces types de cellules que l'on peut décrire plus préci-
sément le procédé. Ils ne constituent pas pour autant une limitation
de l'invention.
Le soluté à électrolyser doit se dissoudre très rapidement dans le solvant
sinon il peut y avoir au voisinage de l'électrode positive une déplétion
en ions oxydes ce qui provoque la polarisation de l'électrode. Nous
avons constaté, par mesures impédancemétriques, telles que celles décrites
dans la publication de G. PICARD et al. Light Metals (1987) p. 507 que
les oxydes de néodyme calcinés commercialement disponibles sont longs
.. . .. .
1 3 2 5 1 9 ~
à se dissoudre ce qui provoque des boues au fond de la cellule d'électro-
lyse et conduit rapidement à un blocage de la production. Par contre,
l'oxyde de néodyme, très réactif car mal cristallisé, obtenu par sous-
calcination contrôlée du carbonate ou de l'oxalate ou autres sels de
néodyme d~acides organiques, le carbonate, l'oxalate, le nitrate, le
sulfate, l~oxychlorure et l~oxyfluorure de néodyme ont un comportement
tout à fait différent et peuvent être utilisés sans problème avec des
résultats étonnants.
On remarque en effet que les traces d~hydratation résiduelle du réseau,ainsi que la décomposition incomplète du sel, au moins dans le cas du
carbonate, du nitrate, de l'oxalate,(et autres sels organiques) favorisent
encore bien plus franchement la dissolution en créant in situ par agita-
tion locale liée au départ des gaz à la surface du sel fondu une excellen-
te dispersion de la poudre et une amélioration de son mouillage, donc
de son attaque, par le solvant ionisé,
.;''":': "'
On choi4it et on contrôle ainsi le niveau de sous-calcination après
~, . . .
analyse de la courbe thermogravimétrique du composé de départ. -'
- .~. .,:
:.: -
Nous avons ob~ervé parallèlement que l'addition au sel fondu d'oxyde
de bore ou de borate de néodyme, dans une proportion de 1 à 12% (exprimés ~:en B203) améliorait la cinétique de dissolution, auprixd'une réduction
du bore a la cathode.Toutefols cette présence de bore dans l'alllage
fer n~odyme n'e0t pas eorc~ment lndésirable elle est même recherchée
pour la fabrlcatlon d'alllages fer - néodyme - bore utilisés dans l'indus-
trie des almants,
Dans le cadre du procédé, la mise en solution de bore dans l'alliage
peut aussi s'effectuer par des additions de ferro-bore, mélangé ou non
au sel à électrolyser, dans une proportion allant jusqu'à 12% de bore. ~
L'un des principes du procédé repose sur la réaction des espèces oxyfluo-
rées dissoutes et adsorbées sur l'anode en carbone ce qui permet d'abais-
ser la tension d'électrolyse. -
: . ,.' ..'"
La densité de courant à l'anode, c'est-à-dire la vitesse à laquelle -
on ~consomme~ les ions oxydes est ajustée de telle manière que la vitesse
6 132~19~
de "production" de ces ions par solvolyse soit au moins aussi grande
que la vitesse de "consommation" sinon on observe une polarisation de
l'électrode. -
Lorsque la cathode est constituée ou recouverte d~un métal donnant un
alliage avec le néodyme, comme par exemple le fer, le nickel ou le cobalt,
le néodyme réduit diffuse dans la cathode, s~allie et si la température
le permet, l'alliage formé fond et s'écoule. Dans ce dernier cas, une
température locale suffisante au voisinage de la cathode permet l'obten-
tion d'un film liquide et la diffusion simultanée dans ce liquide du
métal constituant le substrat cathodique et du néodyme produit par réduc-
tion.
Le néodyme est très soluble dans ce film liquide cathodique. Cette solubi-
lité, en diminuant la valeur absolue de la tPnsion réelle de décomposition
des sels de néodyme Saction sur l~activité du métal réduit dans l'alliage -~
cathodique) favorise la réduction du néodyme au détriment des autres ;
cations présents dans le solvant et peu solubles dans le film liquide
et améliore la sélectivité.
;-: -
On choisit une denslté de courant cathodique permettant d'apporter la
quantité suffisante de néodyme pour s'allier à tout le fer qui diffuse
et former l'alliage sous forme liquide. Sinon le métal obtenu doit être
refondu ultérleure-ent.
A partlr des prlncipes généraux qui viennent d'être exposés, les condi-tlons préclses de mlse en oeuvre du procédé sont les suivantes:
~ .
- l'électrolyte est un mélange de fluorures fondus dans une gamme de
températures comprises entre 640~C, valeur généralement admise pour
la fusion de l'alliage eutectique Fe-Nd, et 1030~C et de préférence
entre 750 et 1000~C, contenant essentiellement en pourcentages pondéraux
LiF 8 à 19% et NdF3 81 à 92%, auquel on rajoute, comme additifs modifiant
les propriétés chimiques, des halogénures alcalinoterreux jusqu'à 38
et de l'oxyde de bore (B2O3) jusqu'à 12~ en poids du mélange cidessus.
- On introduit dans cet électrolyte des solutés oxygénés ou leur mélange
:
:.:
~32~19~ ;
comme par exemple : oxyde de néodyme réactif obtenu par sous-calcination
contrôlée sur la base de la courbe d'évolution thermogravimétrique,
. . .
de carbonate ou d~oxalate de néodyme, carbonate, oxalate, nitrate, sulfate,
oxyhalogènure, ou autre sel d~acide organique ou éventuellement borate
de néodyme, susceptibles d'engendrer par réaction in-situ des espèces -
oxygénées très réactives capables de se dissou~re très rapidement dans
l'électrolyte.
'."'::'-'
- L'anode dépolarisante est en carbone et réagit avec l'oxygène produit
et le bain pour donner un mélange gazeux contenant notamment C0, C02,
CF4. La densité de courant qui pour des raisons de productivité du procédé
doit être suffisante, doit impérativement être inférieure à la densité
de courant limite, c~est-à-dire la valeur au-delà de laquelle la quantité
d'espèces qui devraient être déchargées à l'anode pour maintenir cette i~
densité devient supérieure à la quantité d'ions oxydes qui arrivent ~- -
à l'anode Si la tension aux bornes est suffisante on électrolyse alors -
les fluorures du solvant et on forme ainsi des composés de surface fluoro-
carbonés peu conducteurs: l'anode se polarise, parfois même de manière
irréversible, Ce phénomene, et donc la densité de courant limite, dépend
d'un certain nombre de paramètres, et en particulier de la nature de
l'électrode, de la vite~se de dissolution du sel, c'est-à-dire de la
génération des espèces oxyfluorées, et du transport de ces espèces
~convectlon, diffusion)
Dans la pr~tlque on travalllera avec une densité anodique comprise entre
0,1 et 1,5 A/cm2, maig de préférence entre 0,3 et 1,1 A/cm2,
- La cathode consommable est en fer. La densité cathodique doit être
a~ustée de manière à ce que la quantité de fer diffusant dans le film
llquide de surface et la quantité de néodyme électro-réduit, solubilisé
dans ce film forment par combinaison des deux éléments un alliage liquide
à la température de travail. Cet alliage peut alors ruisseler le long
de l'électrode et former en bout une goutte qui tombe au fond du creuset. : -
Dans la pratique, la densité de courant cathodique de travail à la surface :
de l'électrode se situe dans une gamme de 2 à 30A/cm2 et de préférence
de 4 à 20A/cm2,
- La cathode peut aussi être une ~pseudo-cathode en fer", c'est-à-dire :
un conducteur électronique peu attaquable, recouvert de fer déposé à
. .;.'., '
' ''~ '
. .'::-.:
- 132~94
sa surface par électrolyse, parallèle à celle des composés de néodyme,
d~un fluorure ou d~un oxyde de fer.
- L~alliage fer néodyme produit par ajustement des densités de courant
est liquide dans la plage de températures 640~ à 1030~C et de préférence
de 750~ à 950~C. Il s~écoule et il est recueilli dans un creuset en
fer ou en matériaux peu attaquables comme, par exemple, des métaux:
W, Mo, Ta ou des céramiques: BN, Si3N4, AlN.
L'étude soigneuse du procédé général nous a permis de préciser les condi-
tions optimales de mise en oeuvre, que nous nous proposons de décrire
et d'illustrer par des exemples concrets.
.:
Les rapports de densité de courant aux électrodes conduisent à envisager -
au moins deux types de géométrie de cellule, telles que celles décrites ,dans les figures 1 et 2, qui ne consituent pas en elles-mêmes une limita-
tion de l'invention~
- le bain fondu est contenu dans un creuset soit en céramique t~N, Si3N4)
soit en fer, en graphite ou en métal peu attaquable, éventuellement
protégé intérieurement sur sa hauteur à la traversée du bain fondu,
par une céramlque non-conductrice. Ce dernier dispositif n'est proposé
que dans le cas ou le chauffage est assuré par un four extérieur. Dans
le procéq~ lndu~triel ou l'~nergle thermlque est apportée pnr effet
Joule lnterne, cette garn1ture non-conductrlce peut être assurée par
un talu~ de bain ~olidiflé ou remplacée par un éloignement suffisant
des parois.
- La cathode est une tige en fer cylindrique et l'anode est un cylindre
concentrique de même axe que celui de la cathode.(Cas de la figure 1).
:
- Le creuset est identique au creuset précédent, mais l'anode est un
bloc de carbone sensiblement cylindrique, strié, et vertical pour facili- -
ter l'échappement des bulles de gaz, pouvant tourner autour de son axe,
entouré d'une série d'au moins deux cathodes composées de tiges de fer
constituant les génératrices d'un cylindre extérieur à l'anode et de
mêmé axe que cette dernière. La mécanisation des cathodes permet de
.,"''' '.
'' ' ''' '-
.
'" ~: ',
"~
9 132~19~
les rapprocher ou de les éloigner seules ou en groupe de l'anode. Si ; --~
l'anode est immobile on observe une usure préférentielle du carbone
au regard des cathodes. Ce type d'usure irrégulière peut être compensé -~
par un mouvement lent de rotation de l'anode autour de son axe. Mais
on a également remarqué que cette rotation engendrait des mouvements - -
du bain qui d~une part amélioraient la dispersion dans le sel fondu
de la poudre à électrolyser et favorisaient ainsi sa dissolution et
qui d~autre part permettaient une meilleure élimination des bulles de -
gaz à la surface de l'anode. La vitesse de rotation adaptée à la taille
de la cellule se situe généralement dans une gamme de 1 à 20 tours par -
minute selon les effets recherchés~ '
.: '" ', :'
- L'analyse par barbotage, chromatographie et spectrographie de massedes ga~ anodiques prélevés sur une cellule étanche balayée à l'Argon,
montre que ces derniers, pollués par des poussières provenant de la
cellule, sont constitués principalement de HF, CO, CO2, CF4. Il est
possible d'arrêter les poussières et HF dans un système constitué d'un
lit de granulés, obtenus par pastillage, broyage et calibrage de poudre '
du composé de néodyme à électrolyser, et d'un filtre à manches ou à
poches. On peut également diriger ces gaz sur un laveur humide. On injecte
dans la solution un peu de chlorure de néodyme capable de réagir avec
HF dilué. La suspension contenant essentiellement NdF3 et des poussières
de cellule conduit àpres traitement à une poudre pouvant servir de soluté
a électrolyser. CO, C~2 et CF4 résiduels ayant traversé l'un de ces
systemes de captage sont traltés de manière à oxyder le CO en CO2 en
contrôl~nt 1~ r~actlon ~ l'alde d'un an~lyseur d'lmbrûlés, i fixer le
C~2 sur un llt de chaux et à récupérer ainsi le CF4 Ce gaz peut être
ensuite prépurlflé sur des tamis moléculaires, liquéfié et distillé.
- Le CF4 témoigne d'une réaction parasite avec le bain et conduit à
envisager co~me soluté à électrolyser un mélange contenant de l'oxyfluo-
rure de néodyme. Ce composé peut être obtenu par une réa~tion analogue
à celle décrite ci-dessus dans le cas d~un traitement humide, à savoir
réaction d'une solution aqueuse diluée d'acide fluorhydrique sur une
solution de chlorure de néodyme. Le précipité colloïdal obtenu est séché
puis calciné modérément. L'analyse par rayons X montre qu'il s'agit -
d'un mélange contenant NdOF et NdF3.
1--32~4
- On cherche toutefois à réduire la réaction parasite conduisant à CF4,en limitant la formation de composés d'insertion defluor dans le carbone
par utilisation d~anodes composites à base de cokes durs contenant des
oxydes. On réalise pour cela des mélanges de granulés de carbone à ten- -
dance isotropique (comme par exemple le coke de brai ou le coke de Gilsonite),
de 1 à 25% d'oxyde de fer et/ou de nickel et/ou de néodyme et de 1 à
22~ de brai de houille
Ces mélanges sont mis en forme et cuits, graphitisés ou non, de 950
à 3000~C et de préférence de 1050 à 1250~C. On observe alors avec de
telles anodes non seulement une réduction de la quantité de CF4 produite
mais aussi un abaissement substantiel de la surtension anodique par
suite de l'effet électrocatalytique des oxydes utilisés. ~
.:'
- Du côté cathodique l'alliage liquide formé ruisselle et s'écoule dans
le creuset en ~er ou en matériau peu attaquable. Afin d'éviter toute
réaction avec le bain entraînant la perte d'une partie du métal produit,
il peut être intéressant de porter la nappe métallique à un potentiel - intermédiaire entre celui de l'anode et de la cathode, mais voisin de
ce dernier, à condition toutefois de ne pas perturber le processus électro-
chlmique entre anode en carbone et cathode en fer de faible section.
L'alliage liquide de fond et les parties métalliques qui peuvent le
contenlr sont msintenues éloignés des électrodes. Le potentiel est appli-
qu~ au travers d'une r~sistance de très ~orte valeur llmitant les courants
de fulte entre anode et alllage de fond, alllage de fond et cathode.
Sl le creuset est conducteur électronique, on applique ce potentiel
au creuset. Sinon on utilise une tige conductrice électronique peu at-
taquable portée a ce potentiel (par exemple du tungstène), gainée de
nitrure de bore a la traversé du bain et dont l'autre extrémité libre
plonge dans le métal réduit.
'- . '"'.' ' '
- Quant au métal, il est régulièrement soutiré en utilisant un tube
en fer ou en métal peu attaquable, donc sans pollution gênante de l'al-
liage liquide, par aspiration dans une poche dans laquelle on réduit
la pression au-dessous de 50 kPa, ce qui rend naturellement le procédé
continu et industriel.
132519~ ::
11 -
.
Nous donnons ci-dessous a titre non limitatif quelques exemples de mise
en oeuvre de notre procédé:
EXEMPLE 1
On utilise une cellule telle que celle représentée sur la figure 1 consti- ~ -
tuée d'un creuset cylindrique 8 en nitrure de bGre de diamètre intérieur
10 cm, d'une cathode 3 constituée d'une tige de fer doux de diamètre
0,4 cm et d'une anode 14 constituée d~un tube en carbone de diamètre
intérieur 7 cm, concentrique à la cathode, et obtenu à partir d'un mélange
de coke de Gilsonite et de 2~ de Fe2O3 comme électrocatalyseur~ Les
électrodes plongent de 3 cm dans l'électrolyte.
.
La cellule est équipée d'un couvercle 9 maintenu sous légère surpression -de gaz neutre destiné à entraîner les gaz anodiques par les orifices
S et 6 et empêcher les entrées d'air. L'ensemble est porté dans un four
électrique pouvant atteindre des températures voisines de 1100~C.
Le bain de sels 2 utilisé est un mélange (en poids) de LiF 13~, BaF2
31~, NdF3 S6% fondu-à 870~C.
On alimente par le tube 4 la cellule à l'aide de "cigarettes~ de diamètre
6 oo, longueur 30 om, masse 3 9 d'oxalate de néodyme préalablement calciné :
~ 500~C de manière i ce que la transformatlon en oxyde ne soit pas complète.
Les co~po~s volatlls réslduels qul s'echnppent brutalement au contact
du baln fondu permettent une dispersion de la poudre et une dissolution
plus rapide des particules dans le sel fondu.
L'intensité du courant qui traverse la cellule est de 45 A, ce qui corres~
pond à une densité cathodique de 11,9 A/cm2 et une densité anodique
de 0,68 A/cm2. La tension aux bornes est maintenue constante (9V) grâce -
à un montage potentiostatique. On observe alors sur l'enregistrement
de l'intensité des ~ondulations~ correspondant à la formation et à l'écou-
lement des gouttes vers le fond du creuset.
L'analyse des gaz par chromatographie en phase gazeuse après piégeage
de HF et des poussières donne, en semi-continu, la composition en volume
suivante CF4: 12~, CO2: 8~, CO: 80~. On corrige en fonction de ces résul-
132~19~
tats la composition de l'électrolyte en rajoutant, en plus de l'oxyderéactif ex-oxalate, des cigarettes de NdF3.
Les gaz quant à eux barbotent dans one solution aqueuse alcaline puis,
passent sur un catalyseur permettant en présence d'une quantité d'oxygène
pilotée par une sonde d~imbrûlés en zircone, la transformation quasi-
totale du CO en CO2.
Les dernières traces de CO sont piégées par barbotage dans du formiate
cuivreux amoniacal. le CO2 et la vapeur d'eau sur un lit d'oxyde de
potassium. Le traitement des gaz se termine par un passage sur une succes-
sion de tamis moléculaires. On obtient en sortie un tétrafluorométhane
C~4, qui, après liquéfaction et distillation peut être utilisable pour
des applications dans l'industrie électronique.
L'électrolyse est poursuivie pendant 32 h grâce à des introductions
régulieres de cigarettes d'oxalate sous-calciné et au besoin de NdF3 ;
et à une introduction régulière des tiges cathodiques en fer dans le
sel fondu rythme de leur consommation A la fin de l'expérience, on
aspire par l'intermédiaire d'un tube en fer le métal liquide contenu -
dans le fond du creuset et on le siphone sous atmosphere d'Argon dans ~-
un récipient en nitrure de bore muni d'un couvercle.
Le bilan de l'opération est donné dans le tableau 1 et l'analyse du
métal obtenu dans le tableau 4.
' ' .
,", / ' ,:
13251~
13
'' "'. '~'.
TABLEAU 1
CO~DITIONS EXPERIMENTALES
BAIN CREUSETS Nitrure de Bore
NdF3 % 56 ELECTRODES
LiF % 13 Cathode Fer doux ~1)
BaF2 % 31 Anode Carbone
B 203 % 0 Coke de Gilsonite
Température C 870 Brai de houille
Additif 2~Fe 203
Cuisson 1150~C
MARCHE DE LA CELLULE ~ -
Tension cellule V 9
Intensité cellule A 45
Densité cathodique A/cm2 11,9
Densité anodique A/cm 20,68
Addition de sels Nd 340 cigarettes (69) d~oxyde réactif ~ matières
volatiles soit 1925 9 de Nd203 et 40 cugarettes de NdF3 (corrections
Durée 32 heure~,
RESULTATS
Masse d'alliage produite (9) 1890 9
M~sse de néodyme produite (9) 1625 9
~aradny 63~
132~
14
':
EXEMPLE 2
On utilise une cellule (fig. 2) légèrement différente de celle décrite
dans l'exemple 1. Un creuset profond 10 en fer doux protégé intérieurement ~
sur sa hauteur par une chemise 19 en nitrure de bore est disposé dans ~ -
un récipient en graphite 12. Muni d~un couvercle 13 en nitrure de silicium,
l'anode cylindrique 15 en carbone strié obtenu à partir de coke de brai -de houille, de diamètre 7 cm est pleine et animée d'un lent mouvement
de rotation (6 tours par minute). Elle est entourée de 4 cathodes cylin- -
driques 3 en fer doux de diamètre 0,2 cm. Les électrodes plongent de '
2 cm dans l'électrolyte obtenu par fusion et maintien à 850~C dans un
four électrique de 78~ de NdF3, 17~ de LiF et de 5% d'oxyde de bore
en poids -~
On utilise dans ce cas comme apport régulier d~électrolyte des "cigarettes"
de diamètre 4 mm, longueur 30 mm, masse ~ 9, de carbonate de néodyme
sous-calciné a 500~C de manière à ce que les espèces volatiles résiduelles
dispersent la poudre dans l'électrolyte dont la hauteur dans la cellule ~ -
et la composition en NdF3 et B2O3 sont maintenues constante8par additions
après analyses régulières du bain
La cellule est allmentée sow 8,4 volts et 39 A, ce qui corre~pond
une densit~ cathodique de 7,8 A/cm2 et une densité anodique de 0,89
A/cm2. L'usure de l'anode conduit à une augmentation de la densité anodi~
que qui nécessite avant la fin de l'expérience un changement de cette
dernière avant apparition d'une polarisation irréversible. -~
L'échange standard est très rapide grâce à l'utilisation du "couvercle ~-
central anodique~ 17. -~
Au bout de 53 heures d'électrolyse contrôlée par des additions régulières
de réactifs et l'introduction des cathodes en fonction de leur consomma-
tion dans des conditions analogues à celles de l'exemple 1, on extrait - -
les équipements anodique, cathodique, le couvercle et ses dispositifs - -
annexes. On extrait alors le creuset en fer et pour des raisons de simpli-
cité on verse le tout dans un large récipient en graphite, On laisse - -
refroidir et l'on sépare mécaniquement le métal du bain solidifié, Les
..,, :
~,' .'~'''"
.: . .:
. ., ~' ,.: ,
132519~
résultats de cet essai et l~analyse du métal sont portés dans les tableaux
2 et 4. -
TABLEAU 2
CONDITIONS EXPERIMENTALES
BAIN CREUSET Fer -
NdF3 % 78
LiF % 17 ELECTRODES
BaF2 % ~ Cathodes Fer doux (4)
B203 % 5 - Anode carbone
Température ~C 920 coke de brai
brai de houille
Cuisson 1150~C
MARCHE DE LA OELLUL~
Tension cellule V 8,4
Intensité cellule A 39
Densité cathodique A/c~2 7,8
Densité anodique A/cm2 0,89
Additionfi de sels Nd: 430 cigarettes (69) d'oxyde réactif + matières
volatlles solt 2460 9 de Nd203, 55 de NdF3 ert 16 de B203.
Durée 53 heures/
., .
RBSULTA~S
Masse d'alllage produlte ~9) 2460 9
M~s~e de néodyme produite (9) 2110 9
Faraday 57%. ~
-,.:':; ;~-
EXEMP~E 3
La géométrie de la cellule est identique à celle de l'exemple 2. (fig.
2), avec un creuset 10 en molybdène. Mais cette fois la composition
de l'anode est différente. On l'obtient en effet à partir d'un mélange
~en poids) de coke de brai de houille 74%, oxyde de néodyme llt et brai
de houille 15~; le mélange est malaxé à 150~C, pressé à 100~C et calciné
à 1150~C. -
L'électrolyte est identique à celui de l'exemple 2. Mais le sel à électro-
'
:
- 132519~ :
16
lyser, composé en partie d'un mélange d'oxyde réactif et oxyfluorure
de néodyme est obtenu de la manière suivante:
- à l'aide d'un barbotage d'acide fluorhydrique gazeux dilué dans l'air
dans une solution aqueuse de chlorure de néodyme on obtient un précipité ~ :
colloïdal qui est séché à l'étuve puis porté pendant 30 minutes à 850~C
L'analyse par diffraction des rayons X montre qu'il s'agit d'un melange
d'oxyfluorure (phase majoritaire), de fluorure et d'oxyde de néodyme
Cette poudre est alors mélangée à de l'oxyde réactif ex-oxalate tel
qu'utilisé dans l'exemple l.
.:
- L'électrolyse ~25 heures) est conduite dans des conditions voisines ::.
de celle de l'exemple 2 à savoir 36 A, 7,8 V, soit 0,82 A/cm2 de densité
anodique et 7,16 A/cm2 de densité cathodique. Les corrections de composi-
tion d'électrolyte se font de maniere plus fine à partir de prélèvements : ~.
de bains ll par heure) qui sont analysés rapidement par diffraction
des rayons X. Les conditions d'essais et résultats sont reportés dans :
les tableaux 3 et 4. -~
~'''';-~
' . .
':',,,' ',.
.,,,_ / '.''.. '.:
'~
'~
, '' ':
'''' "'. ' ;~
' ' '-
:~ '
- 1 3 2 ~
17
. "
TABLEAU 3 . :.
CONDITIONS EXPERIMENTALES
BAIN
NdF3 % 78 CREUSET Molybdène .
LiF % 17 ELECTRODES
BaF2 % ~ Cathodes Fer doux t4)
B203 % 5 - Anode Carbone prégraphitique
Température ~C 920 Coke de brai 74%
Brai de houille 15~ ~ .
Additif Nd203 11%
Cuisson 1150~C
MARCHE DE LA CELLULE
Tenslon cellule V 7,8 -
Intendsité cellule A 36
Denslté cathodique A/cm2 7,2
Denslté anodique A/cm2 0,82
Additions de sels Nd: 190 cigarettes (69) d'oxyde réactif + matières ~;
vol~tiles dont 50 mixtes Nd203 réactif + NdOF "récupéré~ et 8 de B203. .;.: .. ;
: ... ..
Durée 25 heures .; .~
RESULTATS . . .
Ma~se d'alliage produlte (9) 1160 9
Masse de néodyme produite (9) 950 9 ..
Paraday 59~
~ ' . '.
18 132~ 9~ ~
_ l I .. - .
~o z a ~ o ~ o O O O o r~
z ~ ~ v v v
1~ 1~ 1 I
_, Z U O ~ o ~ O ~, ~ ~ 0 o ~ .
¦ ~ ~ ~ ~ ~ V V V
¦ e ~ _
t I a Z U a o o o o o o o ~ '
~ ---~ ~ v v c
t~ -~ x ~ v
e o I I v
! ~
v ~0 ,~ .. -
e ~ e E ~, v ~ ~:
L v E ¦ 1~ Z 1~ m ~ m ~ ~ o
~ ~ ~ . .: . .
.. ....