Note: Descriptions are shown in the official language in which they were submitted.
1 3344o7
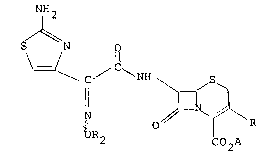
La présente inventlon a pour objet un procédé de prépa-
ration des nouvelles alcoyloximes dérivées de 1 ' acide 7-amino
thiazolyl acétamido céphalosporanlque de formule générale I:
NH2
C (I )
\C ' \ NH ~ ~S \
OR N\l R
2 C07i'~
0
dans laquelle R represente ou bien un radical:
-CH -S-R '
dans lequel R' represente un groupement acyle ayant de 2 a 4
atomes de carbone, un radical 2-méthyl 1,3,4-thiadiazolyl, ou un
radical l-methyl tétrazolyl, ou bien un radical alkyle ayant de
1 a 5 atomes de carbone, R2 represente un radical alkyle saturé
ou insaturé ayant de 1 a 4 atomes de carbone, A représente un
atome d'hydrogène ou un équivalent de métal alcalin de métal
alcalino-terreux, de magnésium ou d'une base organique aminée et
le trait ondulé signifie que le groupe OR2 se trouve dans la
positlon ~
Comme groupement acyle pouvant être represente par R',
on peut citer les groupements acétyle, propionyle, n-butyryle ou
isobutyryle. Parmi les radicaux alkyle représentés par R, on
peut citer les radicaux méthyle, ~thyle, propyle, isopropyle,
butyle, isobutyle, tert-butyle et pentyle.
Parmi les valeurs de R2 ~ on peut citer les radicaux
méthyle, éthyle, propyle, isopropyle, butyle, sec-butyle, tert-
butyle, vinyle, propényle, butényle, éthynyle ou propargyle.
Parmi les valeurs de A, on peut citer notamment un
équivalent de sodium, de potassium, de lithium, de calcium ou de
magnésium; parmi les bases organiques qui peuvent être represen-
tees par ~, on peut citer la trimethylamine, la triethylamine,
- 1 334407
la methylamine, la propylamine, la N~N-dimethyl ethanol amine
ou le trls (hydroxyméthyl) amino méthane, l~arg1nine ou la
lysine .
Les composes de formule I obtenus par le procede
selon l`invention, qui sont definis comme ayant la forme isomère
syn, peuvent egalement être representes par la formule
gênérale suivante:
N~2
~ ~NH ~S
C2A
Contrairement a leurs isomères anti qui peuvent être
representes par la formule génerale:
Nl~ 2
~H
/~\
R2/N ~l\R
02A
L' invention a pour objet r es produits de formule
g~nérale I dans ~.aquelle le groupe OR2 est dans la position
Llinvention a plus particulierement pour objet:
- les produits de formule I, dans laquelle R
represente un radical:
-`CH2-S_R'
dans lequel Rl représente un groupement acyle ayant de 2 à
4 atomes de carbone, un radical 2-méthyl 1,3,4-thiadiazolyl,
ou un radical l-méthyl tétrazolyl;
~ -- 2 .
1 334407
- les produits de ~ormule I ! dans laquelle R représen-
te un radical alkyle ayant de 1 ~ 5 atomes de carbone:
- les produits de formule I, dans laquelle R2 représen-
te un radical méthyle, R représente un radical:
-CH2-5-R'
dans lequel R! représente un radical acétyle, un radical 2-méthyl
1,3,4-thiadiazolyl ou un radical l-méthyl tétrazolyl et A repré-
sente un atome d'hydrogène;
- les produits de formule I, dans laquelle R2 repré-
sente un radical méthyle, R représente un radical:
-CH2-5-R '
dans lequel R' représente un radical acétyle, un radical 2-méthyl
1,3,4-thiadiazolyl ou un radical l-méthyl tétrazolyl et A repré-
sente un atome d'hydrogène, ou un équivalent de métal alcalin,
de métal alcalino-terreux, de magnésium ou d'une base organique
aminée;
- les produits de formule I, dans laquelle R2 représen-
te un radical méthyle, R représente un radical méthyle ou iso-
propyle et A représente un atome dlhydrogène; et
- les produits de formule I, dans laquelle R2
représente un radical méthyle, R représente un radical:
dans lequel R' représente un radical acyle ayant de 2 a 4 atomes
de carbone et A représente un atome d'hydrogène ou un équivalent
de métal alcalin.
Parmi les produits de formule générale I, on peut citer
notamment les produits décrits ci-après dans les exemples et
particulièrement:
L'acide 7-//2-(2-amino 4-thiazolyl) 2-méthoxy imino
acétyl/amino/ 3-/(1-m~thyl tétrazol S-yl) thio méthyl/ ceph-3-ème
4-carboxylique isomère ~;
L'acide 7-//2- (2-amino 4-thiazolyl) 2-méthoxy imino
acétyl/amino/ 3-/(2-méthyl 1,3,4-thiadiazol S-yl) thio méthyl/
-- 3 --
~ 334407
ceph~3-eme 4-carboxylique ifiomere ~;
L~acide 3-acétyl thio méthyl 7-//-2-(2~ amino 4-thiazo-
lyl) 2-méthoxy imino acétyl/ amino/ ceph~3-8me 4-carboxylique
isomere syn;
L'acide 7-//2-(2-amino 4.~thiazolyl) 2-méthoxy imino
acétyl/ amino 3-isopropyl ceph-3~eme 4-carboxylique isomère syn;
L'acide 7-//2- (2-amino 4-thiazolyl) 2-méthoxy imino
acétyl/ amino/ 3-méthyl ceph-3-~me 4-carboxylique isomere syn;
Le sel de sodium de l'a-i-e 7-//2-(2-a~ n ozo~yl)
", '
,;"'''
,
//
/
1 334407
2-méthoxyimlno acétyl/amino/ 3-/( 2-méthyl 1, 3, 4-thiadiazol 5-yl )
thiométhyl/ceph-3-ème 4-carboxylique isomère synj
Le sel de sodium de l'acide 7-//2-(2-amino 4-thiazolyl)
2-méthoxy imino acétyl/amino /3-/(1-méthyl tétrazol-S-yl)thiométhyl/
ceph-3-ème 4-carboxylique isomère synJ
Le sel de sodium de 1 ' acide 3-a~étyl thiométhyl 7-//2-
( 2-amino 4-thiazolyl ) 2-méthoxy imino acétyl/ amino/ceph-3-ème
4-carboxyLiqu~ isomère syn1`
Le sel de sodium cristallisé de 1 'acide 3-acétyl
thiométhyl 7-//2-(2-amino 4-thiazolyl) 2-méthoxy imino ac~tyl/
amino/ceph-3-ème 4-carboxylique i~;omère svn.
Il est entendu que les produits de formule I précédemment
cités peuvent exister:
- Soit sous la forme indiquée par ladite formule I:
- Soit sous la forme de produits de formule Iz:
/H
N
S `NH O
~/ ~ Nll ( Iz )
'~ \
C2A
dans laquelle R, Rl, R2 et A ont la signification précitée.
L ' invention a également pour ob jet un procédé de prépara-
tion des produits de formule I, caracterisé en ce que l'on traite
un produit de formule II:
2 s
`r~' ~ ( II )
O ~ \~l
CO 2A '
_ 5 _
1 334407
dans laquelle R a la signification donnée initialement et A'
represente un atome d'hydrogene ou un groupement facilement éli-
minable par hydrolyse acide ou par hydrogénolyse choisi dans le
groupe constitué par les radicaux benzhydryle, tert-butyle,
benzyle, paraméthoxybenzyle et trichloroethyle, par un acide de
formule III: NH-R'
~ O
\=~\C OH (III)
1 O N~
--~R 2
ou par un dérivé fonctionnel de cet acide, formule III dans
laquelle le groupe OR2 est en position ~, R' 1 représente un
groupement facilement éliminable par hydrolyse acide ou par
hydrogénolyse choisi dans le groupe constitué par les radicaux
tert-butoxy carbonyle, trityle, benzhydryle, trichloroéthyle,
et carboben~yloxy, et R2 a la signification donnée initialement,
20 pour obtenir un produit de formule I ':
NH-R'l
~\ /C--N /~i ( I ' )
~\` R
C2A '
R2
produit de formule I! que l'on traite par un agent d'hydrolyse
acide, un agent d'hydrogénolyse ou les deux agents précités
selon les valeurs de Rll et de Al, pour obtenir un produit
30 voulu de formule I:
-- 6 --
.~
5~ o 1 334407
`~N~ ~S
TN \~/J\ R
(~ 2
OR2
dans laquelle A représente un atome d'hydrogene et R et R2
ont la signification indiquée initialement, produits de formule I
que l'on salifie, le cas échéant, selon les méthodes usuelles
pour obtenir les produits de formule I, dans laquelle A représen-
te un équivalent de métal alcaLin, de métal alcalino-terreux,
de magnésium ou d'une base organique aminée.
Dans un mode préférentiel d'exécution du procédé, on
trai te le produit de formule II par un dérivé fonctionnel de
l'acide de formule III, tel que l'anhydride ou le chlorure
d'acide, l'anhydride pouvant être formé in situ par action du
chloroformiate d' isobutyle ou du dicyclohexylcarbodiimide sur
l'acide. On peut également utiliser d'autres halogénures ou
e~core d'autres anhydrides formés in situ par action d'autres
chloroformiate~ d'alcoyle, d'un dialcoylcarbodiimide ou d'un
autre dicycloalcoyle carbodiimide. On peut également utiliser
d'autres dérivés d'acides, tels que l'azide d'acide, l'amide
d'acide ou un ester d'acide activé formé, par exemple, avec
l'hydroxy succinimide, le paranitrophénol ou le 2-4 di-nitrophé-
nol. Dans le cas o~ la réaction du produit de formule II
s'effectue avec un halogénure de l'acide de formule générale
III ou avec un annydrideformé avec un chloroformiate
d'isobutyle, on procede, de préférence, en présence d'un agent
basique.
,~ 7 _
1 ~34407
Comme agent basique, on peut choisir, par exemple,
un carbonate de métal alcalin ou une base organique tertiaire,
telle que la N-méthyl morpholine, la pyridine ou une trialcoylamine,
telle q~e la triéthylamine.
La transformation des produits de formule I ' en produits
voulus de formule I a pour but de remplacer le substituant
R'l par un atome d'l~ydrogène, et, lorsque A' est différent d'un
atome d'hydrogene, de remplacer A' par un atome d'hydrogène.
Pour ce faire, on traite le produit de formule I' par
lo un agent d'hydrolyse acide lorsque 1~'1 représente un y--/u~
facilement éliminable par hydrolyse acide et que A' représente
un atome d'hydrogèlle ou un groupement facilenlent éliminable par
hydrolyse acide.
On traite le produit de formule I' par un agent d'~lydro-
génolyse lorsque R'l représente un groupement facilement 15lim;n~
par hydro~énolyse et que A ' représente un atolne d ' hydrogène ou
un y-~,uu. 1 faciler~ent l-linlinahl~ par hydrogénolyse.
On traite le produit de formule I' par un agent d'hydro-
lyse acide et par un ager~t d'hydrogénolyse, lorsque l'un des
~substituants R'l ou A' représel-te un gro~pement facilement
éliminable par hydrolyse acide et 1 ' autre substituant représente
un groupement facile~n~nt élimil~able ~)ar hydrog~llolyse.
Comme agent d'hydrolyse acide auquel on soumet
les produits de formule I', on peut citer l'acide formique,
l'acide trifluoroacetique ou l'acide acetique. Ces acides peuvent
être employés anhydres ou en solu~ion aqueuse. On peut également
utilis~r le système zinc-acide acétique.
On utilise, de préférence, un agel-t d"lydrolyse acide,
tel que l'acide trifluoroacétique anhydre ou les acides formique
ou acétique aqueux, pour éliminer les groupements tert-butoxy
carbonyle ou trityle que peut reprcsenter le radical R'l ou les
groupements benzhydryle, tert-butyle ou paraméthoxy benzyle que
-- 8 --
p~ut représenter A~. 1 334407
On utilise, de preference, le systame zinc-acide acéti-
que, pour éliminer le groupement trichloroethyle que peuvent
représenter R'l et A~.
On utilise, de preference, un agent d'hydrogenolyse,
tel que l'hydrogane en présence d'un catalyseur, pour éliminer les
groupements benzhydryle et carbobenzyloxy que peut représenter R'
et benzyle que peuvent representer ~'1 et A'.
Les produits de formule I' ou I peuvent être salifiés
selon les methodes usuelles. La salification peut, par exemple,
être obtenue par action sur ces acides d'une base minerale, telle
que, par exemple, l'hydroxyde de sodium ou de potassium ou le
bicarbonate de sodium, ou d'un sel d'un acide carboxylique alipha-
tique substitue ou non tel que l'acide diethylacétique, l'acide
éthyl hexanoique ou, plus spécialement, l'acide acétique.
Les sels preferesdes acides précédemment cités sont
les sels de sodium.
La salification peut également être obtenue par action
d ' une base organique comme la triethylamine ou la diéthylamine .
Pour la preparation des sels, les solvates des acides
libres peuvent egalement être utilises comme produits de depart à
la place des acides Libres.
Cette salification est realisee de preference dans un
solvant ou un melange de solvants, tels que l'eau, l'ether
ethylique, le methanol, l'éthanol ou l'acétone.
Les sels sont obtenus sous forme amorphe ou cristallisée
selon les conditions réactionnelles employees.
Les sels cristallises sont prepares de preference en
faisant reagir les acides libres avec l'un des sels des acides
carboxyliques aliphatiques mentionnés ci-dessus, de preférence,
avec l'acétate de sodium.
Dans la préparation d~un sel de sodium, la réaction est
realisée dans un solvant organique approprié, tel que par exemple
~ g _
1 334407
le méthanoL, solvant qui peut contenir de petites quantités d~eau.
Il est bien évident que pour mettre en oeuYre le
procédé de préparation des produits de formule I dans lesquels
le groupe OR2 est dans la position _~, on utilise, de.s produits
de formule III dans lesquels le groupe OR2 est dans la position
syn .
Laprésente invention a également pour objet une
variante du procédé de préparation des produits de formule I:
NH2
~I \NI~ s (I)
OR2 o J i //~R
C02H
et de leurs sels, formule I dans laquelle R et R2 ont la signifi-
cation indiquée précédemment, et corrrespondant a un produit de
formule I dans laquelle A représente chacun un atome d'hydrogene
et R et R2 ont la signification indiquée précedemment, caractéri-
sée en ce que ou bien l'on traite par un acide un sel d'un pro-
duit de formule I ' dans laquelle R' 1 représente un groupement
facilement éliminable par hydrolyse aclde pour obtenLr un produit
de formule I OU bien l'on traite par un agent d'hydrogénolyse un
sel d'un produit de formule I' dans laquelle R'l représente
un groupement facilement éliminable par hydrogénolyse pour obtenir
un sel d' un produit de formule I .
L'acide utilisé pour hydrolyser les sels des produits
do formule I' dans laquelle R'l repr~scnt~ un group~m~nt facile-
ment éliminable par hydrolyse acide est de préférence l'acide
formique. On peut cependant utiliser l~acide trifluoroacétique
ou l ~ acide acétique . Ces acides peuvent être employés anhydres
- 10 -
ou en solution aqueuse. 1 3 3 4 4 07
Comme agent d'hydrogénolyse, auquel on soumet les sels
des produits de formule I ' dans laquelle R'l représente un
groupement facilement éliminable par hydrogénolyse. On peut citer
1 'hydrogénation catalytique.
La présente invention a également pour objet une autre
variante du procédé de préparation des produits de formule I,
caractérisée en ce que l'on traite un produit de formule II:
2~ /S
~_N~f~
CO 2A '
dans laquelle R a la signification indiquée précedemment et A' a
égalel~ent la significatlon indiquée préc~demment avec un acide
de formule IIIA:
NHCOC112Cl
S/~N
~ C021~
'~/ IIIA
OR2
ou un dérivé fonctionnel de cet acide, formule IIIA dans laquelle
R2 a la signification indiquée précédemment pour obtenir un
produit de formule VI:
NI~COC112Cl
S ~ O vI
N N~
OR2 o~ \fJ\R
co2~ ~
-- 1 1 --
1 334107
produit que 1 ~on traite par la thiourée et le cas échéant! selon
la valeur de Al par un agent d'hydrolyse acide ou d~hydrogénolyse
pour obtenir un produit de formule I.
La réaction de l'acide de formule II avec l!acide de
formule IIIA est effectuée dans les mêmes conditions que celles
de l!acide de formule II avec l'acide de formule III.
La réaction de la thiourée sur le produit de formule
VI est réalisée de préférence en milieu neutre ou acide. Ce
type de réaction est décrit par MASAKI (JACS, 90, 4508 (1968).
L!invention a également pour objet un procédé de
préparation des produits de formule I:
NH2 A
S N (IA)
C- NH_ / ~`1
N ~ N~\CH S-R '
OR2 2
dans laquelle R2 a la signification donnée précédemment, A'l
représente un atome d'hydrogène ou un équivalent de métal alcalin,
alcalino-terreux, de magnésium ou dlune base organique aminée,
R' représente un groupement acyle ayant de 2 a 4 atomes de car-
bone, un radical 2-méthyl 1,3,4-thiadiazolyl, ou un radlcal
l-méthyl tétrazolyl et le trait ondulé signifie que le groupe
OR2 est en position sYn, ces produits correspondant à des produits
de formule générale I, caractérisé en ce que l!on traite
un produit de formule IV:
;
-- 12 ~
1 3~44~7
NH2
S/~ N 0
~ C J~ NH
~` cl~2 0 -CH3
C0211 oC
dans laquelle ~2 a la signification indiquée initialement
10 par un produit de formule V:
R'-S~I (V)
dans laquelle E~' a la signification indiquée ci-dessus, pour obte-
nir les produits de formule I '
NH2 A
S~ O
\= ~ C J--NH ~ S ( I ~A)
o~\~ C~12-S-R'
0
2 C021
que l'on salifie éventuellelnellt, pour obtenir les produits de
formule IA, dans laquelle A'l représente un équivalent de nlétal
alcalin, de métal al~alino-t~rreux, de magnésiunl ou d'une base
organigue aminée~
L'action du produit de formule V sur le produit de
formule IV est réalisée, de préférence, dans un mélange eau-
acétone, mais on peut également utiliser un autre solvant aqueux,
tel qu 'un mélange eau-dioxanne, eau-tétrahydrofuranne ou eau-
alcool éthylique.
La réaction est, de préférence, conduite en présence
d'un tampon maintenant dans le milieu un pH légèrement acide, tel
qu'un mélange p~losphate acide de sodium - bicarbonate de sodium,
-- 1 3 --
1 334407
mais on peut également opérer sans tampon,
La salification des produits de formule I'A peut être
réalisée selon les méthodes usuelles décrites ci-dessus.
Il est bien évident que pour mettre en oeuvre le procé-
dé de préparation des produits de formule IA dans lesquels
le groupement OR2 est dans la position ~, on utilise pour
des produits de formule IV dans lesquels le groupement OR2
est dans la position syn.
Les produits de formule générale I qui sont sous la
10 forme syn possèdent une très bonne activité antibiotique, d'une
part sur les bactéries gram (t), telles que les staphylocoques,
les streptocoques et notamment sur les staphylocoques pénicilli-
no-résistants et d'autre part, sur les bactéries gram (-) notam-
ment sur les bactéries coliformes, les Klebsiella, les Salmonel-
la et les Proteus.
Ces propriétés rendent aptes lesdits produits pharma-
ceutiquement acceptables à être utilisés comme mPrl;~-~mPnts dans
le traitement des affections à germes sensibles et notamment dans
celui des staphylococcies, telles que septicémies à staphylocoques,
20 staphylococcies malignes de la face ou cutanée, pyodermites,
plaies septiques ou suppurantes, anthrax, phlegmons, érésipèles,
staphylococcies aigues primitives ou post-grippales, broncho-
pneumonies, suppurations pulmonaires.
Ces produits pharmaceutiquement acceptables peuvent
également être utilisés comme médicaments dans le traitement des
collibacilloses et infections associées, dans les infections à
Proteus, à Klebsiella et ~ Salmonella et dans d'autres affections
provoquées par des bactéries 1~ gram (-) .
Les produits de formule I pharmaceutiquement acceptables
30 et de structure ~ peuvent être employés pour la préparation
de compositions pharmaceutiques renfermant, ~ ~ titre de principe
actif, 1 ' un au moins desdits produits .
~ 14 --
1 3~4407
Il faut mentionner plus particulierement les compositions
pharmaceutiques renfermant, ~i titre de principe actif, l'un au
moins des produits pharmaceutiquement acceptables de formule I:
- dans laquelle R représente un radical:
dans lequel R' représente un groupement acyle ayant de 2 a 4
atomes de carbone, un radical 2-méthyl 1,3,4-thiadiazolyl, ou
un radical l-méthyl tétrazolyl,
- dans laquelle R représente un radical alkyle ayant de 1 à 5
atomes de carbone
- dans laquelle R2 représente un radical méthyle, R représente un
radical méthyle ou isopropyle et A représente un atome d'hydrogè-
ne, et notamment les produits pharmaceutiquement acceptables de
formule I, dans laquelle R2 représente un radical méthyle, R
représente un radical:
-CH -9 R'
dans lequel R' représente un radicalacetyle~ un radical 2-methyl
1, 3, 4-thiadiazolyl ou un radical l-methyl tetrazolyl et A repré-
sente un atome d'hydrogène ou un équivalent de métal alcalin,
alcalino-terreux, de magnésium ou d'une base organique aminée.
Il faut spécialement mentionner les compositions pharma-
. ceutiques renfermant a titre de principe actif 1 ' un au moins des
produits de formule I dans laquelle R2 représente un radical mé-
thyle, R représente un radical:
-CH2-5-R'
dans lequel R' represente un radical acyle ayant de 2 à 4 atomes
de carbone et A représente un atome d ' hydrogène ou un
équivalent de metal alcalin.
On peut citer les compositions pharmaceutiques
renfermant a titre de principe actif l'un au moins des produits
suivants:
L~acide 7-//2- (2-amino 4-thiazolyl) 2-méthoxy imino
acétyl/ amino/ 3-/(1-méthyl tetrazol S-yl~ thio methyl/ ceph-3-
-- 15 --
eme 4-carboxylique isomère syn; 1 334407
Llacide 7-//2.~(2-~amino 4-thiazolyl) 2-méthoxy imino
acétyL,/ amino/ 3-/(2-méthyl 1,3,4~thiadiazol S-yl) thio methyl/
ceph-3-ème 4-carboxylique isomère ~;
L'acide 3-acetyl thio methyl 7-//2-(2-amino 4-thiazolyl)
2-méthoxy imino acetyl/ amino/ ceph-3-ème 4-carboxylique isomere
syn;
L'acide 7-//2-(2-amino 4-thiazolyl) 2-methoxy imino
acetyl/ amino/ 3-isopropyl ceph-3-ème 4-carboxylique isomere syn;
L'acide 7-//2-(2-amino 4-thiazolyl) 2-methoxy imino
acétyl/ amino/ 3-méthyl ceph-3-eme 4-carboxylique isomère syn;
Le sel de sodium de l'acide 7-//2-(2-amino 4-thiazolyl)
2-methoxy imino acétyl/ amino/3-//(2-methyl 1,3,4-thiadiazol S-yl)
thiomethyl/ceph-3-ème 4-carboxylique isomère syn;
Le sel de sodium de l'acide 7-//2-(2-amino 4-thiazolyl)
2-méthoxy imino acétyl/amino /3-/(1-méthyl tétrazol-S-yl)thio-
méthyl/ceph-3-ame 4-carboxylique isomère syn;
Le sel de sodium de 1 ' acide 3-acétyl thiométhyl
7-//2- (2-amino 4-thiazolyl) 2-méthoxy imino acetyl/ amino/ceph-
3-ème 4-carboxylique isomère ~; et
Le sel de sodium cristallisé de 1 ' acide 3-acétyl thio
méthyl 7-//2- (2-amino 4-thiazolyl) 2-méthoxy imino acétyl/amino/
ceph-3-ème 4-carboxylique isomère syn.
Ces compositions peuvent etre administrees par voie
buccale, rectale, parenterale, intramusculaire ou par voie locale
en application topique sur la peau et les muqueuses.
Elles peuvent etre solides ou liquides et se presenter
sous les formes pharmaceutiques couramment utilisées en medecine
humaine, comme, par exemple, les comprimes, simples ou drageifies,
les gelules, les granulés, les suppositoires, les preparations
injectablesr les pommades, les Crèmes, les gels; elles sont
préparées selon les méthodes usuelles. Le ou les principes actifs
peuvent y être lncorpores à des excipients habituellement
- 16 ~
1 334407
employés dans ces compositions pharmaceutiques, tels que le talc,
la gomme arabique, le lactose, l'amidon, le stéarate de magnésium
le beurre de cacao, les véhicules aqueux ou non, les corps gras
d'origine animale ou végétale, les dérivés paraffiniques, les
glycols, les divers agents mouillants, dispersants ou émulsifiants,
les conservateurs.
La dose administrée est variable selon l'affection
traitée, le sujet en cause, la voie d'administration et le produit
considéré. Elle peut être, par exemple, comprise entre 0,250 g
l0 et 4 g par jour, par voie orale chez l 'homme avec le produit
décrit à l'exemple 4, 60u 10, ou encore comprise entre
0,500 g et 1 g, trois fois par jour, par voie intramusculaire
ou intraveineuse.
1'invention permet également d'obtenir, a titre de
produits industriels nouveaux, les produits de formule:
NHCOCH2Cl
~
¦¦ \ / S,~
~ \ R
OCH3 C~2H
dans laquelle R a la définition indiquée précédemment, utiles
pour la préparation des produits de formule I, telle que définie
précédemment .
1es produits de formule II, dans lesquels R représente
un radical:
et qui ne sont pas connus, peuvent être préparés par réaction
30 d'échange a partir de l'acide 7-amino céphalosporanique. I~n
exemple d'une telle préparation est donné plus loin dans la
partie expérimentale.
- 17 -
T_ ~
1 3-4407
Les produits de formule III sont préparés en faisant
agir la thiourée sur un produit de ~ormule B:
ClCH2~C-C--C02alc (B)
O N~G
~""'/
~ 18 -
1 334407
dans laquelle R2 a ~.a signification précitée et alc représente un
radical all~yle ayant de 1 a 4 atomes de carbone, pour obtenir
après traitement par une base, un produit de formule:
N112
S~
CO alc ( C )
C/ 2
N
R2
que l'on traite par un dérivé fonctionnel d'un groupement facile-
ment éliminable par hydrolyse acide ou par ~lydrogénolyse, pour
obtenir un produit de Lormule:
R ~ 1
SJ~, ( D )
\~ C02alc
b
N
OR2
dans laquelle R'l, R2 et alc ont la signification indiquée précé-
demment, produit que 1 'on traite par une base, puis pdr un acide,
pour obtenir les produits de formule II cherchés. Un exemple
d'une telle préparation est donllé plus loin dans la partie
expérimentale .
On obtient les produits de formule III ayant la confi-
guration svn lorsque 1 'action de la thiourée sur les produits de
formule ~ est conduite soit dans un solvant aqueux tel que
l'acétone aqueuse ou l'éthanol aqueux, soit à température ambiante,
en faisant agir une quantité sensiblement stoechiométrique de
thiourée et pendant une duree assez courte de 1 'ordre de 1 a 3
-- 19 --
1 334407
heures soit lorsque toutes les conditions précédentes sont
réunies .
La configuration sYn des produits (C) obtenus
peut ensuite être conservée pour les produits (D) et III.
Les produits de formule B sont préparés par
action du diazométhane ou des halogénures ou des sulfates
d'alcoyles correspondants sur l'~-chloro a-oxyimino acétyl
acétate d ' éthyle décrit dans J . of Medicinal Chemistry
1973, 16 (9), 978.
Les produits de formule IV sont préparés par
action d'un acide de formule:
~--R ' 1
S N
~ C0211
Cl/ (III)
N
2 0 oR2
dans laquelle R'1 et R2 ont la signification indiquée ci-
dessus sur l'acide 7-amino céphalosporanique, réaction
suivie éventuellement d'une hydrolyse acide ou d'une
25 hydrogénolyse. Un exemple d'une telle préparation est
donné plus loin dans la partie expérimentale.
De la même facon que précédemment, les produits
de formule IV de configuration sYn sont obtenus par action
sur l ' acide 7-amino céphalosporanique des produits de
30 formule III de configuration svn obtenus de la facon
décrite précédemment.
Les produits de formule IIIA sont préparés en
faisant agir un dérivé fonctionnel du groupement chloro-
acétyle de préférence l'anhydride chloroacétique ou un
35 halogénure sur le produit (C) réaction suivie par un trai-
tement par une base puis par un acide.
-- 20 --
,~
1 334407
Les exemples suivants illustrent l'invention sans
toutefois lui conférer aucun caractère limitatif.
Exemule 1 : Acide 7-//2-) ~2-tritYlamino 4-thiazolYl) 2-
méthoxY imino acétYl/ amino/ 3-/(2-méthYl 1,3,4-~h;Arl;A7nl
5-Yl ) thiométhYl/ ceuh-3-ème 4-carboxyliaue
On mélange 2, 5 g du sel de sodium de 1 ' acide 2-
( 2-tritylamino 4-thiazolyl ) 2-méthoxy imino acétique avec
40 cm3 de chlorure de méthylène et 5 cm3 d'acide chlorhy-
drique 2 N. On décante, lave à 1 'eau, sèche et concentre.
L'acide brut est dissous dans 30 cm3 de tétrahy-
drofuranne sec. On ajoute 0,7 g de dicyclohexylcarbodi-
imide, agite 45 minutes à température ambiante, essore la
dicyclohexyl urée formée, refroidit à -5C et ajoute la
solution de o,895 g d'acide 7-amino 3-/(2-méthyl 1,3,4-
thiadiazol 5-yl) thiométhyl/ ceph-3-ème 4-carboxylique dans
10 cm3 d'eau et o,g cm3 de triéthylamine (préalablement
refroidie à oC). On laisse revenir à température ambiante
en une heure trente minutes, chasse le tétrahydrofuranne,
ajoute 40 cm3 de chlorure de méthylène, lave à l'acide
chlorhydrique dilué, puis à l'eau, sèche et concentre à
sec .
On dissout le résidu dans 8 cm3 de dioxanne et
ajoute, goutte à goutte, 3 cm3 de solution saturée de
bicarbonate de sodium, agite 30 minutes, filtre, lave à
l'éther, récupère 0,554 g de produit de départ sous forme
de sel de sodium, chasse le dioxanne, reprend au chlorure
de méthylène, lave à l'acide chlorhydrique N, puis à l'eau,
on sèche et concentre à sec . On triture dans 1 ' éther,
essore, lave à 1 ' éther et obtient 1, 9 g de produit brut .
On agite ce produit dans 5 cm3 d ' acétate
d'éthyle,
-- 21
;^
,~
1 334407
ajoute 5 cm3 d'éther, agite, essore, lave. On obtient
1,47 g de produit partiellement purifié que l'on dissout
dans 2 cm3 de chlorure de méthylène et précipite par 25 cm3
d ' éther . Après essorage et lavage, on obtient 1, 4 g de
5 produit attendu.
On obtient ainsi l'acide 7-//2-(2-tritylamino 4-
thiazolyl ) 2-méthoxyimino acétyl/amino/ 3- ( 2 -méthyl 1, 3, 4-
thiadiazol 5-yl ) thiométhyl/ceph-3-ème 4-carboxylique qui
a la conf iguration sYn .
Le sel de sodium de l'acide 2-(2-tritylamino 4-
thiazolyl ) 2-méthoxy imino acétique isomère sYn utilisé au
départ de 1 ' exemple 1 précédent, a été préparé comme suit:
Stade A: ~-chloro a-méthoxY imino acétyl acétate d'éthyle:
On place 22,5 g de r-chloro a-oximino acétylacé-
tate d'éthyle dans 100 cm3 de chlorure de méthylène.
On place sur un bain de glace et ajoute lentement
sous agitation une solution fraîche de diazométhane (à 21,6
g/l) soit 275 cm3. On laisse cinq minutes en contact et
détruit 1 ' excès de diazométhane par un peu d ' alumine . On
concentre, puis purifie par élution sur silice au chlorure
de méthylène. On obtient 11,93 g de produit attendu.
Stade 8: 2- ( 2-amino 4-thiazolYl ) 2-méthoxy imino acétate
d ' éthYl e:
On place 1 g de y-chloro a-méthoxy imino acétyl
acétate d'éthyle, 3 cm3 d'éthanol absolu et 0,42 g de
thiourée broyée. On agite à température ambiante deux
heures environ. On dilue avec 60 cm3 d'éther, le
chlorhydrate obtenu cristallise, on agite, essore, lave,
sèche et obtient 685 mg de chlorhydrate. on les dissout
dans 4 cm3 d'eau à 50OC, ajoute de l'acétate de potassium
jusqu'à p~l 6, l'amine libérée cristallise. On refroidit,
essore, lave à l'eau, sèche et obtient 270 mg de produit
attendu .
F = 161C.
-- 22 --
1 334407
Le produit obtenu a la configuration sYn RMN
(CDCl3 60MHz) p.p.m. : 4,0 (N-OCH3), 6,7 (proton du cycle
thiazol ique ) .
Stade C: 2- ( 2-tritYlamino 4-thia~olYl ) 2-méthoxY imino
5 acétate d ' éthYle:
4, 6 g de produit préparé selon le stade précédent
sont dissous à 30C dans 92 cm3 de chlorure de méthylène.
On refroidit à -10C, ajoute 2,9 cm3 de triéthylamine,
- 22a -
1 334407
- 35C, ajoute en 15 minutes, 6,1 g de chlorure de trityle, laisse
reverlir à température ambiante, soit en tout deux lleures trente.
On lave à l'eau, puis à l'acide c}~lorllydrique 0,5 N et a l'acétate
de sodium dans 1 ' eau . On sèche, concentre, reprend à 1 ' éther,
concentre de nouveau, dissout dans le méthanol, ajoute de l'eau et
de l'ét}-er, laisse cristalliser, essore, lave à l'éther et obtient
6,15 g de produit attendu. F = 120C.
1e produit obtenu a la configuration syn.
Stade r): Sel de so~iuln d~ l'a~ide 2-(2-tritylalllino 4-thiazolyl)
2-métlloxy imino acétique:
7,01 g d'ester obtenu au stade B sont dissous dans
35 cm3 de dioxanne. On porte à 110 au bain d'huile et ajoute en
5 minutes, 9 cm3 de soude 2 N, laisse 30 minutes au reflux sous
agitation. Le sel de sodium cristallise. On refroidit, essore,
lave au dioxanne, puis à 1 'éther et obtient un premier jet de
5, 767 g de sel. On concentre la solution mère et obtient un
second jet de 1,017 g, soit en tout 6,784 g de sel de sodium.
L,e produit obtenu a la conf iguration svn
Exemple 2: /~cide 7-//2-(2-amino 4-thia~olYl) 2-méthoxy imino
acétyl/ amino/ 3-/(2-méthyl 1,3,4-thiadiazol 5-yl) thiométhYl/
ceph-3-ème 4-carboxylique
Les 1,4 g de produit obtenu à l'exemple 1 sont portés
sous agitation dans 5 cm3 d'acide formique aqueux à SO %, à 57C
pendant 15 minutes. On ajoute 5 cm3 d'eau, refroidit à la tempé-
rature ambiante, essore, ajoute 5 cm3 d'éthanol, concentre à se~,
triture l'éther et obtient 0,687 mg de produit brut.
Le produit est dissous dans 7 cm3 d ' eau et 0, 2 cm3 de
tri~thylamine, on essore, rince et acidifie par 0,2 cln3 d'acide
formique à 50 %. On agite, essore, lave à l'alcool et à l'étl~er,
On obtient un premier jet de 0, 275 g.
Analyse: C17lll75N7S4 (o,5 EtOH)
Calculé: C % 39,25 H % 3,66 N % 17,80 S % 23,28
23--
1 3~4407
Trouv~ : 39, 3 3, 5 17, 9 23 ,1
Le produit obtenu a la configuration syn
RMN (DMSO, 60 Mllz) p.p.m.: 3,85 (N--OC1~3) 6,76 (proton du cycle
thiazolique ) .
Exemple 3 : Acide 7-//2- ( 2-tritvlamino 4-thiazolYl ) 2-méthoxv
imino acét~l/ amino/ 3-/(l-métllYl tétrazol S-yl) thiom~Sthyl/
ceph-3-ème 4-carboxYlique
On utilise 2,33 g du sel de sodiuln de l'acide 2-(2-
tritylamino 4-thiazolyl) 2-méthoxy imino acetique et, en opérant
commc à l'exemple 1, obtient l'aclde brut que l'on dissout dans
30 cm3 de chlorure de méthylène ~ On a joute 0, 7 g de dicyclohexyl
carbodiimlde et laisse 50 minutes à température ambiante sous
agitation et 90US gaz inerte. On essore la dicyclohexyl urée
formée, refroidit a - 5C ~t ajoute en une fois la solution de
0,854 g d'aclde 7-amino 3-/(1-méthyl tétrazol S-yl) thiomethyl/
ceph-3-ème 4-carboxylique dan3 10 cm3 de chlorure de méthylène et
0, 75 cm3 de triéthylamine. On laisse revenir à température
ambiante, a joute 1 cm3 d'acide acétique, essore apr~s 10 minutes,
lave à l'eau additionnée d'acide chlorhydrique, sèche, concentre,
reprend par 8 cnl3 de dioxanne, ajoute 2,5 cm3 de solution saturée
de bicarbonate de sodium~ On essore le sel de sodium de 1 'acide
tritylé initial, rince avec un mélange éther-dioxanne (1-1), puis
à l'éther. On chass~ le dioxanne, rcprend au chlorure de méthy-
lène, lave à l'eau additionnée d'acide chlorhydrique, sèche et
concentre. On triture dans l'éti~er, essore, lave à l'éther et
obtient 2, 29 g de produit brut. On agite ensuite le produit une
heure à 10C dans l'éti~anol, essore, lave à l'éther et obtient
1,42 g de produit purifi~C.
Le produit obtenu a la configuration syn
Exem~le 4 : 7~cide 7-//2- ( 2-amino 4-thiazolvl ) 2-méthoxY imino
acétyl/ amino/ 3-/(1-méthyl tétrazol S-Y1) thiométhYl/ ceph-3-ème
4-carboxylique
-- 24 --
l 334407
On place 1, 4 g de produit préparé a 1 ' exemple 3 dans 5
cm3 d'acide formique aqueux à 50 % dans un bain d'eau à 55C.
Après 15 minutes, on ajoute 5 cm3 d'eau, refroidit, essore, con-
centre le filtrat après y avoir ajouté S cm3 d'éthanol. On
repren~ par S cm3 d'alcool, triture, essore, lave à l'éthanol,
puis à l'éther, essore, sèche, empâte dans un mélange chlorure
de méthylène-éther (1 - 1), essore,lave et obtient 0,557 g de
produit pur.
Analyse: C16H1705~953 (0,5 EtOH)
Calculé: C % 38,19 H % 3,77 N % 23,58 S % 18,00
Trouvé : 38,1 3,9 22,5 17,7
I,e produit obtenu a la configuration syn
R~IN (DMSO, 60M~z) p.p.m.: 3,83 (N-OCI~3) 6,73 (proton du cycle
thiazolique ) .
Exemple S : Acide-3-acétyl thio méthyl 7-//2- ( 2-tritylamino 4-
thiazolyl ) 2-méthoxY imino/ acétyl amino/ ceph-3-ème ~-carboxylique
A partir de 3,1 g de sel de sodium de l'acide 2-/2-
tritylalIIino 4-thiazolyl) 2-méthoxy imino/ acétlque dans 40 cm3
de chlorure de méthylène et 6,5 cm3 d'acide chlorhydrique 2 N,
on prépare comme à l'exel,Iple 1, l'acide correspondant. Cet acide
est dissous dans 30 c~n3 de chlorure de mét~lylène. On ajoute 0,8 g
de dicyclohexyl carbodiimide et agite 1 h~ure 30 dans un bain
d'eau et glace. On essore la dicyclo~exyl urée formée, refroidit
à - 5C et ajout~ en une fois une solution de 1,1 g d'acide 7-amino
3-acétyl thio méthyl ceph-3-ème 4-carboxylique dans 13 cm3 de
chlorure de méthylène et 0,9 cm3 de triéthylamine (à 0C). On
laisse revenir ~ température alnbiante, a joute 1 cln3 d ' acide
acétique, essore l'insoluble, lave à l'eau additionn~e d'acide
chlorhydrique, puis à 1 'eau, concentre, reprend le résidu dans
le dioxann~, ajoute 3,5 cm3 d'une solution de bicarbonate de sodium
saturée, essore après 30 minutes, lave au mélarlge dioxanne-éther
et récupère 0,64 g de sel de sodium de l'acide trit~/lé initial.
-- 25 --
1 3 ~4407
On chasse le dioxanne, reprel~d par 30 cm3 de clllorure de méthylène,
lave à 1 ' eau additionnée d ' acide chlor~lydrique ( 10 cm3 d ' eau et
10 cnl3 d'acide chlorhydrique 2 N), a l'eau et concentre. On
triture avee 25 cm3 d'~ther, essore, lave et obtient 1,89 g de
produit brut.
On reprécipite deux fois par di6solution dans 3 crn3
d'acetate d'éthyle et addition de 25 cm3 d'éther. On obtient
O, 89 g c~^ produit attendu.
Le produit obtenu a la coniguration sYn
L ' acide 7-amino 3-acétyl thio rnéthyl ceph-3-è~ne 4-carbo-
xyliq~le utili3c~ au dép~rt de l"-:x-~mple S, a été préparé co~nme suit:
Or~ l~lace 5,/14 g ~'acidl~ 7-.)mino ~ P}Ialoiporanique et
SO cm3 cl'cau à 1 ~ I'hydroq~linone sous gaz irlc~rt~!. Or~ agite et
ajoute 1,7 g de bicarbonate de sodium, puis ajoute, après disso-
lution, 3 g de thioacétate de pot~ssium. On a~lte 3 heures à
60C, refroidit ~t acidifie à l'acide accStique. On agite à
température anbiante, essore, lave, sèche et obtient 4,9 g de
produit attendu.
Exell1ple 6: ~cide 3-acétvl thio métl~vl 7-//2-(2-alnino 4-tlliazolYl)
2-m-~tl~oxy imil-o acc~tYl/ a~ni no/ cePh-3-èlne ~-carboxylique
Le produit obtenu à 1 'c ,c~mple 5 est agité 15 minutes
darls ul~ bain à 55C avec 5 cm3 d'acide forrnique aqueux à 50 %.
On ajoute 5 cm3 d'alcool au filtrat et concentre à sec. 01~ délite
dans 5 cm3 d'alcool et obtient en deux jets, 440 mg de produit
que l'on dissout dans 6 cm3 d'acc~tone aqueux à 50 ,S. On ajoute
20 n~g de noir de carbone, essore et chasse partiellement 1 ' acétone .
On obtient, après essorage, O, 265 g de produit pur.
AnalvSe: C16111706NsS3 (0~25 C~3 3
Calculé: C % 41,39 11 % 3,83 N ,' 14,41 S % 19,78
Trouvé : 41, 2 3, 8 , 14, 4 19, 8
Le produit obtenu a la confiquratior~ ~iYn
Kl~ (DMSO 60~111z) 3,83 (N-OC113), 6,73 (proton du cycle tlliazolique).
-- 2~ --
- 1 334407
Exemple 7: 7-//2-(2-tritYlamino 4-thiazolvl) 2-méthoxY
imino acétY1/ amino/ 3-isoDrol~Yl ceuh-3-ème 4-carboxYlate
de tert-butYle
On déplace 1,65 g de sel de sodium de l'acide
2/(2-tritylamino 4-thiazolyl) 2-méthoxy imino/ acétique
comme indiqué à l ' exemple 1.
L'acide résiduel est dissous dans 25 cm3 de
chlorure de méthylène sec. On ajoute 0,71 g de dicyclo-
hexylcarbodiimide, agite 10 minutes en bain d'eau glacée et
ajoute 0,965 g d'ester tert-butylique de l'acide 7-amino 3-
isopropyl ceph-3-ème 4-carboxylique. On laisse deux heures
sous agitation à température ambiante, essore la dicyclo-
hexyl urée, lave à l'eau (10 cm3) contenant 2 cm3 d'acide
chlorhydrique 2 N, puis à l'eau, puis avec 10 cm3 d'eau
contenant 5 cm3 de solution saturée de bicarbonate de
sodium. On sèche et concentre à sec. On dissout le résidu
dans l'éther, essore, lave à l'éther isopropylique et
obtient 1, 66 g de produit attendu .
Le produit obtenu a la conf iguration svn .
Exem~le 8: Acide 7-//2-(2-amino 4-thiazolYl) 2-méthoxy
imino acétYl/ amino/ 3-isol~ro~Y1 ce~h 3-ème 4-carboxYlique
Les 1,66 g de produit obtenu à l'exemple 7 sont
agités 15 minutes à température ambiante avec 6 cm3 d'acide
trifluoro acétique. On ajoute 60 cm3 d'éther
isopropylique, essore, lave à l'éther isopropylique et
obtient 0,825 g de produit sous forme de sel de l'acide
trifluoro acétique.
On dissout ce produit dans 6 cm3 d ' eau et 4 cm3
d'acétone. On ajoute 0,2 cm3 de pyridine, chasse
l'acétone. On obtient un premier jet de 0,232 g.
On concentre le filtrat, reprend par 3 cm3 d'eau
et isole encore 0,194 g du même produit, soit en tout 0,426
g-
AnalYse: C16H19O5N5S2 (0,25 CH3COCH3)
Calculé: C % 46,23 H % 4,88 N % 15,41 S % 14,10
Trouvé: 46,1 4,7 15,5 14,1
-- 27 --
~ 3:34407
L~ produit obtenu a la configuration sYn
l (I)MSO GOMIIZ) p.p.m.: 3,83 (N-OC113): 6,78 (proton du cycle
thiazolique ) .
Exemple 9: 7-//2-(2-tritylamino 4-tlliazolvl) 2-méthoxy imino
acétyl/ amino/ 3-métllyl cepll-3-ème 4-carboxylate de tert-butyle
On déplace 2,3 9 de sel de sodium de l'acide 2-/(2-
trityl amino 4-thiazolyl ) 2-méthoxy imino/ acétique selon le pro-
duit indiquC~ à l'ex~mple 1.
L ' acide brut résiduel est dissous dans 30 cm3 de chlorure
de méthylène, on ajoute 1,1 g de dicyclohexyl carbodiiMide, puis,
après 5 minutes,l,35 g d'ester tert-butylique de l'acide 7-amino
desacétoxy céphalosporanique. On agite deux heures, essore,
lave à l'eau, à l'eau acififiée avec de l'acide chlorhydrique,
a l'eau et enfin avec une solution saturée de bicarbonate de
sodium, sèche, concentre, reprend à l'éther, essore, concentre à
sec et obtient 2,8 g de produit pur.
Le produit obtenu a la configuration sYn
Exemp]e 10: Acide 7-~/2-(2-amino 4-thiazolYl) 2-méthoxy imino
acétyl/ amino/ 3-méthyl ceph-3-ème 4-carboxylique
2,3 g de produit preparé à l'exemple 9 sont additionnés
de 8 cm3 d'acide trifluoro acétique. On agit~ lS rninutes à
température ambiante et a joute 80 cm3 d'éther isopropylique. On
agite, essore et lave à l'éther isopropylique. On obtient 1,12 g
de produit sous forme de sel de l'acide trifluoro acétique. On
les reprend par 10 cm3 d'ét~lanol a 40C. On parfait la cristal-
lisation par addition de 0, 2 cm3 de pyridine, refroidit à + 10C,
essore, lave a l'éthanol et à l'éther et obtient 0,531 g de produit
pur .
~nalYse: C14H15051~552 (, 25 EtOI~)
Calculé: C % 42,6 11 % 4,06 W % 17,13 S % 15,68
Trouy~ : 42,2 3,9 1~,6 ~ 15,5
Le produi t obtenu a la configuration sYn
-- Z 8
-
- 1 334407
~IN (12M~O, 60MIIz) p.p.m.: 3,35 (N--OC~13), 6,7~3 (proton du cycle
thiazoliqu~
Exemple 11 : Acide 7-//2- ( 2-tritylamino 4-tlliazoLyl ) 2-1nétlloxy-
imino acttyl/ amino/ 3-/(1-n~étllYl tt~trazol S-Y1) thio méthyl/
ceph-~-eme 4-carboxylique
On place 2,7 9 d'acide 3-acétoxy méthyl 7-//2-(2-
tritylamino 4-thiazolyl ) 2-méthoxyimino acétyl/ amino/ ceph-3-ème
4-carboxylique, 0,624 g de phospllate monosodique, 1,51 g de bicar-
bonate de sodium, 1, 32 g de l-méthyl S-mercapto tétrazole, 40 cm3
d'eau et 20 cm3 d'acétone. On laisse une nuit à 48C et une heure
à 60C. Après purification, on obtient le produit attendu isomère
svn identique à celui décrit à l'exemple 3.
Exemple 12: Acide 7-//2-(2-arnino 4-thiazolyl) 2-méthoxy imino
acétyl/ amino/ 3-/(1-méthyl tétrazol S-yl/ tl~io méthyl/ ceph-3-ème
4-carboxylique
~u départ de 1,7 g d'acide 3-dCC~tOXy méthyl 7-//2-
(2-amino 4-tl~iazolyl) 2-méthoxyimino acétyl/ amino/ ceph-3-ème
4-carboxylique, 0,624 g de phosphate monosodique, 1,51 g d~
bicarbonate de sodium, 1,32 g de l-métl~yl S-mercapto tétrazole,
40 cm3 d'eau et 20 cm3 d'acétone et en laissant une nuit à 43C
et une heure à 60C, on obtient le produit attendu isomère svn
identique à celui décrit à 1 'exemple 4.
Les acid~s 3-acétoxy méthyl 7-//2-(2-tritylamino 4-
thiazolyl ) 2-méthoxyimino acétyl/ amino/ ceph-3-ème 4-carboxylique
isomère syn utilisé au départ de 1 'exemple 11 et 3-acétoxy méthyl
7-//2- ( 2-amino 4-thiazolyl ) 2-rnéthoxyimino acétyl/ amino/ ceph-
3-~me 4-carboxylique isomère sYn utilisé au départ de l'exemple
12, ont c'té préparés comme suit:
a) Acide 3-acétoxy méthyl 7-/~2-(2-tritylamino 4-thia-
zolyl) 2-mc thoxyimino ac~tyl/ amir~o/ ceph-3-ème 4-carboxylique:
On place 3,06 g de sel de sodium de l'acide 2-(2-
tritylamino 4-thiazolyl ) 2-méthoxyimino acétique dans 65 cm3 de
_ 29 --
1 334407
chlorure de méthylène et 6,5 cm 3 d'acide chlorhydrique 2
N, lave à l ' eau, sèche et concentre à sec, pour obtenir
quantitativement 1 'acide libre .
L'acide libre obtenu est dissous dans 30 cm3 de
chlorure de méthylène sec. On ajoute 0,78 g de
dicyclohexyl carbodiimide et agite une heure à température
ambiante. On essore la dicyclohexyl urée formée,
refroidit à 10C, ajoute une solution de l,01 g d'acide 7-
amino céphalosporanique dans 13 cm3 de chlorure de
méthylène et 0, 9 cm3 de triéthylamine . On laisse revenir
à température ambiante, a j oute 1 cm3 d ' acide acétique,
essore, lave à l'eau additionnée d'acide chlorhydrique à
1 ' eau, sèche, concentre à sec, reprend avec 10 ml de
dioxanne, a j oute 1 cm3 d ' eau et 3 cm3 de solution saturée
de carbonate acide de sodium. On agite, essore, lave et
concentre à sec. on reprend au chlorure de méthylène, lave
avec 10 cm3 d'eau et 5 cm3 d'acide chlorhydrique normal,
décante, lave à l'eau, sèche, délite dans l'éther et
obtient 1,747 g de produit brut que l'on purifie par
dissolution dans l'acétate d'éthyle suivie de précipitation
à l'éther. On obtient 1,255 g de produit pur.
Le produit obtenu a la conf iguration sYn
b) Acide 3-acétoxYméthY1 7-//2-(2-amino 4-
thiazolYl) 2-méthoxvimino acétvl/ amino/ ceph-3-ème 4-
carboxYliaue:
0, 975 g du produit obtenu ci-dessus sont agités
dix minutes à 55C dans 4 cm3 d'acide formique aqueux à
50%. On ajoute 4 cm3 d'eau, essore, concentre à sec sous
vide . On délite dans 2 cm3 d ' éthanol, essore, lave à
l'éthanol, puis à l'éther et obtient 0,428 g de produit
pur .
Le produit obtenu a la configuration sYn
RMN (DMSO, 60MHz) p.p.m.: 2,03 -(C-CH3), doublet 9,58,
J = 8Hz (CONH); 6,76 (proton du cycle thiazolique).
-- 30 --
f
-
1 334407
Exemple 13: Acide 3-acétyl thio methyl 7=//2-(2-amino 4-thiazo-
lyl) 2-mé thoxy imino acétyl/ amino/ ceph-3^eme 4-carboxylique
isomère syn.
On met en solution 4,55 g d'acide 3-acétoxy méthyl
7-//2- (2-amino 4-thiazolyl) 2-methoxy imino acétyl/ amino/ ceph-
3-eme 4-carboxylique isomere ~, 1,7 g de thioacétate de
potassium, 2 g de phosphate monosodique deshydraté, 1,05 g
de carbonate acide de sodium et 20 cm3 d'eau distillee. On
porte a 70C pendant 1 heure 30. On acidifie par 2 cm3 d'acide
formique et extrait avec 4 fois 60 cm3 d'acetate de méthyle
(on essore un insoluble).
On lave la solution organique a l'eau, on seche et
concentre à sec. On dissout le residu obtenu dans 20 cm3
d'acétone à 10% d'eau. On ajoute 0,5 g de charbon actif.
On ajoute S minutes, essore le noir, le lave a l'acétone à 10%
d'eau et concentre le filtre a sec. Le residu est traité a
l'éthanol absolu, on essore, lave a l'alcool puis a l'éther.
On obtient 1,9 g de produit pur en CCM.
RMN (DMSO, 60MHz) 3,85 (N-OCH3): 6,75 (proton du cycle thiazo-
lique).
Le produit est identique a celui obtenu a 1 ' exemple 6 .
Exemple 14: Sel de sodium de l'acide 7-//2-(2-amino 4-thiazolyl)
2-méthoxy imino acetyl/ amino/ 3-/(2-methyl 1,3,4-thiadiazol S-yl)
thiomethyl/ceph-3-eme 4-carboxylique isomere syn.
On ajoute a une solution de 2,3 g d'acide 7-//2-(2-amino
4-thiazolyl)2-methoxy imino acetyl/ amino/ 3-(2-methyl 1,3,4-
thiadiazol S-yl) thiomethyl/ ceph-3-~me 4-carboxylique isomere
syn prepare selon l'exemple 2 dans 5 cm3 d'acétone, une solution
aqueuse de carbonate acide de sodium de maniere a obtenir un pH
de 7. On ajoute 0,4 9 de noir animal, agite 5 minutes, essore le
noir et le lave a l'acétone aqueux 1-1.
On ajoute 50 cm3 d'éthanol au filtrat décoloré et
concentre a sec sous vide a 30C. On reprend le residu par S cm3
-- 31 _
1 334407
d'éthanol! triture les cri5taux, essore, lave à l'éthanol, puis
à l~éther. On obtient 1,3 g de produit attendu,
Analys~: Na: Calculé; 4,18 % Trouvé: 4,70
I~ltra-Violet dans l'éthanol:
Max. 235 nm El= 360 ~zl9 800
Z~5 nm ~1~ 32Z ~-17 7~
///
/
,/
- 32 -
1 334407
Inflexion 280 nm El = 295
dans l'éthanol à N/10 d'acide chlorhydrique.
Inflexion 218 nm El = 244
Max 266-267 nm El = 406 ~ = 22 300
Inflexion 280 nm E1 = 363
Exemple 15: Sel de sodium de l'acide 7-//2-(2-amino 4-thiazolYl)
2-méthoxy imino acétyl/ amino/ 3- ( l-méthyl tétrazol-5-yl ) thio-
méthyl/ceph-3-ème 4-carboxylique isomère syn.
On place 3, 35 g d ' acide 7-//2- ( 2-amino 4-thiazolyl ) 2-
méthoxy imino acétyl/ amino/ 3-/(1-méthyl tétrazol-5-yl) thiométhyl/
ceph-3-ème 4-carboxylique isomère sYn préparé selon 1 ' exemple 4
dans 7 cm3 de méthanol et 7 cm3 de solution molaire aqueuse de
carbonate acide de sodium. On agite 5 minutes à température
ambiante, essore les parties insolubles, les rince deux fois avec
un mélange méthanol-eau 1-1.
On ajoute en agitant d'abord 85 cm3 d'éthanol, le sel de
sodium cristallise, on ajoute ensuite 170 cm3 d'éther, agite 10
minutes, essore, lave à l'éthanol-éther 1-1, puis à l'éther et
sèche. On obtient 3, 26 g de produit attendu.
Le produit est purifié comme suit:
On dissout le sel précédent dans 40 cm3 d'eau, ajoute
0, 6 cm3 d ' acide acétique pour revenir à pH 6, 8-7, on dilue à 1 ' étha-
nol, chasse les solvants sous pression réduite à une température
inférieure à 35 C . On reprend à 1 ' éthanol pour éliminer 1 ' eau et
amène à sec.
Le résidu est repris dans 16 cm3 de méthanol puis on
dilue par 160 cm3 d'acétone, le sel cristallise. On agite 5
minutes, essore, lave à 1 ' acétone puis à 1 ' éther .
On obtient 2, 3 g de produit attendu.
/~/D = -13,5 + 1 (à 1 %, dans l'eau).
Analyse : Na Calculé : 4, 31 % Trouvé : 4, 8 %
-- 33 --
1 334407
Exemple 16: Sel de sodium de 1 ' acide 3-acétyl thiométhyl 7-//2-
~ 2-amino 4-thiazolyl ) 2-méthoxy imino acétyl/ amino/ ceph-3-ème 4-
carboxylique isomère syn.
Gn place à température ambiante 4,5 9 d'aclde 3-acétyl
thiométhyl 7-//2- ( 2-amino 4-thia701yl ) 2-méthoxyimino acétyl/ amino/
ceph-3-ème 4-carboxylique isomère syn préparé selon l'exemple 6,
dans 9 cm3 de méthanol et 9 cm3 d ' une solution molaire de carbonate
acide de sodium dans 1 ' eau . On agite cinq minutes à température
ambiante, essore les parties insolubles, rince par un mélange de
méthanol et d'eau (1-1). On ajoute sous agitation 110 cm3 d'étha-
nol, le sel de sodium cristallise. On dilue par 220 cm3 d'éther
éthylique, agite,essore, lave par un mélange éthanol-éther 1-1
puis à 1 'éther. On sèche et obtient le produit attendu.
Le sel de sodium obtenu est purifié comme suit:
On dissout le produit dal~s 40 cm3 d'eau, ramène le p~l à
6,8-7 par addition de quelques gouttes d'acide acétique. On dilue
par 100 cm3 d'éthanol puis chasse les solvants sous pression
réduite à une température inférieure à 35 C . On reprend le con-
centrat, délite deux fois avec 50 cm3 d'éthanol, amène à sec la
20 ~econde fois. On dissout le résidu dans 15 cm3 de méthanol, filtre
l'insoluble, puis dilue la solution méthanolique par 150 cm3
d ' acétone .
Le sel de sodium cristallise, on agite 5 minutes puis
essore, lave à l'acétone puis à l'éther. On sèche sous pression
réduite. On obtient 1, 8 9 de produit attendu.
/c~/20 = -31 + 2 (à 0,6 %, dans l'eau).
Analyse: lla , Calculé: 4,65 % Trouvé: 4,9 %
Ultra-Violet .
Dans 1 ' éthanol
Max. 235 nm El = 419
Inflexion 260 nm El = 343
Inflexion 300 nm El = 122
34 _
1 334407
Dans 1 'éthanol-acide chlorhydrique ~1/10.
Inflexion 230 nm El = 280
Max. 263 nm El = 391 = 19 700
Exem3le 17: SeL de sodium microcristallisé de 1 'acide 3-acétY
thiométhYl 7-//2-(2-amino 4-thiazolyl)2-méthoxy imino acétyl/
amino/ cePh-3-ème 4-carboxylique isomère syn.
On agite 471,5 mg d'acide 3-acétyl thiométhyl 7-//2-(2-
amino 4-thiazolyl ) 2-méthoxy imino acétyl/ amino/ ceph-3-ème 4-
carboxylique isomère syn préparé selon l'exemple 6 avec 1,5 cm3
de solution molaire d ' acétate de sodium anhydre dans du méthanol
anhydre. On ajoute 0,5 cm3 d'éthanol, essore un léger insoluble,
ajoute 2 cm3 d'éthanol, le sel de sodium cristallise. On essore,
lave au méthanol puis sèche à 1 ' étuve à 45 C sous vide .
On obtient 0, 25 g de sel non hygroscopique.
Analyse : Na : Calculé : 4, 66 %
~rouvé : 4, 6 %
Exemple 18: Acide 3-acétYl thio méthvl 7-//2-(2-amino 4-thiazolyl)
2-méthoxyimino acétyl/ amino/ceph-3-ème 4-carboxYlique isomère syn.
Stade A: Acide 3-acétyl thio méthyl 7-/~2- ( 2-chloroacétamido 4-
thiazolyl ) 2-méthoxy imino acétyl/ amino/ ceph-3-ème 4-carboxylique
isol~ère syn.
On place 15,3 g d'acide 2-(2-chloroacétamido 4-thiazolyl)
2-méthoxy imino acétique isomère syn dans ao cm3 de chlorure de mé-
thylène. A 5C, on ajoute 8 cm3 de triéthylamine. A 0C sous
azote, on introduit 3,8 cm3de chlorure de thionyle et 26 cm3 de
chlorure de méthylène. On laisse 15 minutes à 0C, puis ajoute
7 cm3 de triéthylamine. On introduit à 0C sous azote, 14,4 g
d ' acide 7-amino 3-acétyl thio méthyl ceph-3-ème 4-carboxylique
dans 100 cm3 de chlorure de méthylène et 14 cm3 de triéthylamine .
On laisse remonter à 20C, puis agite une heure. Cette solution
est distillée à sec sous vide vers 30 - 35 C. On dissout le résidu
dans 250 cm3 d'eau, passe au noir, ajoute 50 cm3 d'acide C~llorhy-
35 --
-
-
1 334407
drique 2 N. On essore le précipité, lave à 1 ' eau. Le produit
brut obtenu est mis en suspension dans 80 cm3 d'éthanol. A + 5C,
on ajoute 7 cm3 de triéthylamine. On ajoute d'un seul coup sous
agitation à + 5C, 15 cm3 d'acide sulfurique 4 Il, le produit
cristallise après 15 minutes. On essore, lave à l'éthanol par
empâtago, puis à 1 'éther, sèche sous vide et obtient le produit
attendu .
Stade B: Acide 3-acétyl thio méthyl 7-//2-(2-amino 4-thiazolyl)
2-méthoxy imino acétyl/ amino/ ceph-3-ème 4-carboxylique, isomère
syn:
On met en suspension 5,48 g d'acide obtenu au stade A
précédent dans 10,6 cm3 d'eau et 912 mg de thiourée. A 20C, on
ajoute 1 g de carbonate acide de potassium. Après dissolution,
on agite 6 heures vers 20C sous azote. La précipitation gommeuse
commence après une heure et demie environ. On ajoute alors 30 cm3
d'eau 46 3 cm3 d'acide formique. On refroidit à 5C. On essore,
lave à l'eau contenant 10 % d'acide formique. On dissout le résidu
vers 5C dans 30 cm3 d'eau contenant de la triéthylamine. A 5C,
on ajoute 3 cm3 d'acide formique, on essore le précipité, lave
par empâtage à 1 ' eau contenant de 1 ' acide formique. On élimine
la gomme brun foncé. Les phases aqueuses sont réunies et traitées
au noir . On obtient une solution jaune clair que 1 ' on sature
de sulfate d'ammonium. On essore le précipité, empâte à l'eau,
essore, lave à 1 ' eau et obtient un précipité A.
Les liqueurs mères sont saturées au sulfate d ' ammonium,
ce qui donne un précipité que l'on essore, lave 3 fois à l'eau
et obtient le précipité B.
Les précipités A et B sont réunis, On reprend à
l'éthanol, agite une heure à 20C et laisse 16 heures à 0C.
On essore, lave à 1 ' éthanol, à 1 ' éther, sèche sous vide et obtient
le produit attendu, isomère syn. Le produit est identique à
celul obtenu aux exemples 6 et 13.
-- 36 _
1 334407
L ' acide 2- ( 2-chloroacétamido 4-thiazolyl ) 2-méthoxy
imino acétique isomère syn utilisé au départ de 1 ' exemple 23 a
été préparé comme suit:
a ) 2- ( 2-chloracétamldo 4-thiazolyl ) 2-méthoxy imino
acétate d'éthyle, isomère syn:
On place 45, 8 9 de 2- ( 2-amino 4-thiazolyl ) 2-méthoxy
imino acétate d'éthyle, isomère syn dans 200 cm3 de chlorure de
méthylène. On en distille 20 cm3 pour sécher, refroidit à 10C
et ajoute 50 cm3 de pyridine. On ajoute 41 9 d'anhydride mono-
io chloracétique et chauffe légèrement jusqu'à dissolution. On
laisse six heures à 20~C sous azote, ajoute S cm3 d'eau, agite
et verse dans 300 cm3 d'acide chlorhydrique 2 N glacé. On décante,
extrait au chlorure de méthylène, lave à 1 ' eau, au carbonate
acide de sodium, à 1 'eau, sèche, passe au charbon actif, concentre
et ajoute 300 cm3 d'éther isopropylique. Le produit cristallise.
On concentre jusqu'à obtention d'une pâte épaisse, glace, essore,
lave à l'éther isopropylique, sèche et obtient 45,4 9 de produit.
F . = 113 C .
On obtient un échantillon pur par recristallisation dans
20 un mélange de chlorure de méthylène et d'éther isopropylique
F. = 118C.
R.M.N. (CDC13 60 Mhz) 0 (d)
H-N- C- CH 2 Cl
S~l 0 (C) (a)
H ~~ C-~l\ 2 3
(e) N
\OCH3 (b)
(a) triplet centré sur 1,38 p.p,m. J = 7hz
(b) singulet 4,05 p.p.m.
(c) quadruplet centré sur 4,44 p.p.m. J = 7 hz
(d) singulet 4, 33 p.p.m.
(e) singulet 7,27 p.p.m.
_ 37 _
-
(f) singulet 9,95 p.p,m. 1 334407
b) Acide 2-(2-chloracétamido 4-thiazolyl) 2-méthoxy
imino acétique, isomère syn:
On place 46 g de produit obtenu au stade a ) précédent
dans 230 cm3 d'éthanol absolu. On ajoute à 20C sous azote, 30 cm3
de lessive de soude pure. Le produit se dissout, le sel de sodium
commence à cristalliser, puis le milieu prend en masse. Après
seize heures, on essore et lave. Le sel obtenu est dissous dans
l'eau, on glace, ajoute 100 cm3 d'acide chlorhydrique 2 N, sature
au chlorure de sodium, extrait à 1 ' acétate d ' éthyle contenant 10 %
d'éthanol, On sèche, passe au noir, distille sous vide, entraîne
l'eau par du benzène, reprend au chlorure de méthylène, distille a
sec, reprend au chlorure de méthylène, glace, essore, lave, sèche
et obtient 34,5 g de produit attendu. F = 200C environ. On
purifie le produit par recristallisation dans un mélange acétone-
éther isopropylique.
Analvse: C8H804N3ClS = 277,68
Calculé: C % 34,60 H % 2,90 N % 15,13 Cl % 12,77 S % 11,55
~rouvé : 34,8 2,8 14,8 12,6 11,5
R.M.N. (DMSO 60 Mhz) 0 (b)
( e ) H-N--cH
S~l N
H~ ~ C02H (c )
(d) H
OCH3 ( a )
(a) singulet 3,92 p.p.m.
(b) singulct 4,38 p.p.m.
(c) singulet environ 5, p.p.m.
(d) singulet 7,58 p.p.m.
30 (e) singulet 12,6 p.p.m.
Exemple lY:
On a réalisé une préparation pour in]ection de formule:
,. -- 311 --
- ` I 334407
- Acide 7-//2- ( 2-amino 4-thiazolyl ) 2-méthoxyimino
acétyl/ amino/ 3-/(1-méthyl tétrazol 5-yl) thio méthyl/ ceph-3-ème
4-carboxylique ........................ 500 mg 7
- Bxcipient aqueux stérile q. 5.p....... 5 cm3.
Exemple 20:
On a réalisé une préparation pour injection de formule:
- Acide 3-acétyl thio méthyl 7-//2- ( 2-amino 4-thiazolyl )
2-méthoxyimino acétyl/ amino/ ceph-3-ème 4-carboxylique. 500 mg,
- Excipient aqueux stérile q. s .p. .... 5 cm3.
Exemple 21:
On a réalisé une préparation pour injection de formule:
- Sel de sodium de 1 'acide 3-acétyl thio méthyl 7-//2-
( 2-amino 4-thiazolyl ) 2-méthoxy imino acétyl/ amino/ ceph-3-ème
4-carboxylique ......................... 500 mg.
- Excipient aqueux stérile q.s.p........ 5 cm3.
Exemple 22:
On a réalisé des gélules répondant à la formule:
- Acide 7-//2-(2-amino 4-thiazolyl) 2-méthoxy imino
acétyl/ amino/ 3-/(1-méthyl tétrazol-5-yl) thio méthyl/ ceph
20 3-ème 4-carboxylique .................. 250 mg.
- Bxcipient q. s . pour une gélure terminée à . . 400 mg.
Bxemple 23 :
On a réalisé des gélules répondant à la formule:
- Acide 3-acétyl thio méthyl 7-//2-(2-amino 4-thiazolyl)
2-méthoxy imino acétyl/ amino/ ceph-3-ème 4-carboxylique.. 250 mg
- Excipient q. s . pour une gélule terminée à .... 400 mg.
Etude pharmacoloqique des produits
A) Activité in vitro:
Méthode des dilutions en milieu liquide:
On prépare une série de~ tubes dans lesquels on répartit
une même quantité de milieu nutritif stérile. On distribue dans
chaque tube des quantités croissantes du produit à étudier, puis
-- 39 --
1 334407
chaque tube est ensemencé avec une souche bactérienne.
Après incubation de vingt-quatre ou quarante-huit
heures à l'étuve à 37C, l'inhibition de la croissance est appré-
ciée par transillumination ce qui permet de déterminer les concen-
trations minimales inhibitrices (C. M. I. ) exprimées en ug/cm3.
Les résultats suivants ont été obtenus:
-- 40 --
1 334407
Produit de 1 ' exeml~le 2
C . M . I . en llg/ml
SOUCHES
24 H 48 H
Staphylococcus aureus ATCC 6 538
Pen-Sensible
Staphylococcus aureus UC 1 128 2 2
Pen-Résistant
Staphylococcus aureus exp. n 54 146 2 2
Streptococcus pyogènes A 561...... S 0,02 S 0,02
Streptococcus faecalis 5 432...... 1 2
Streptococcus faecalis 99 F 74.... 2 5
Bacillus subtilis ATCC 6 633 ..... o, 6
Escherichia Coli Sensible Tétra- 0, 6 0, 6
cycline ATCC 9 637
Escherichia Coli Résistant Tétra- 0 ,1 0, 2
cycline ATCC 11 303
Escherichia Coli Exp. TO26B6 ..... 0,4 0,4
Escherichia Coli Résistant o, 4 o, 4
Gentamicine, Tobramycine R 55 123 D
Klebsiella pneumoniae Exp. 52 145 . . . 0, 05 0 ,1
Klebsiella pneumoniae 2 536 Résistant 0, 6
Gentamicine ..........................
Proteus mirabilis (indol-) A 235.. 0,2 0,2
Salmonella typhimurium 420........ o,6 o,6
-- 41 --
1 334407
-
Produit de l'exemule Z (suite. . . )
C .M. I . en llg/ml
SOUCHES
24 H 48 H
Enterobacter cloacae 681.. 40 40
Providencia Du 48......... 2 5
Serratia Résistant Gentamicine 2 532..
-- 42 --
~r~
1 334407
Produit de l ' exemPle 4
C.M. I . en ILg/ml
SOUCHES
24 H 48 H
Staphylococcus aureus ATCC 5 638
Pen-Sensible
Staphylococcus aureus UC 1 128 2 2
Pen-Résistant
Staphylococcus aureus exp. n 54 146 2 2
Streptococcus pyogènes A 561........ S 0,02 S 0,02
Streptococcus faecalis 5 432........ 2 2
Streptococcus faecalis 99 F 74...... 2 10
Bacillus subtilis ATCC 6 633........ 2 5
Escherichia Coli Sensible Tétra- 0, 4 0, 4
cycline ATCC 9 637
Escherichia Coli Résistant Tétra- 0, 05 0, 05
cycline ATCC 11 303
Escherichia Coli Exp . TO26B6 ...... , 2 o, 2
Escherichia Coli Résistant 0, 2 0, 2
Gentamicine, Tobramycine R 55 123 D
Klebsiella pneumoniae ~xp. 52 145 .. 0,02 0,02
Klebsiella pneumoniae 2 536 Résistant 0, 4 0, 6
Gentamicine
Proteus mirabilis (indol-) A 235.... 0,05 0,05
Proteus vulgaris (indol~) A 232..... 3 20
-- 43 --
1 334407
Produit de 1 ' exeml)le 4 ( suite . . . )
C . M . I . en llg/ml
SOUCHES
24 H 48 H
Salmonella typhimurium 420.. 0,2 0,2
Enterobacter cloacae 681.... 20 20
Providencia Du 48........... 2 2
Pseudomonas 3 935 Exp. SG... 20 40
Serratia Résistant Gentamicine 2 532
~,
. 1 334407
Produit de
SOUCHES l ' exemple 6
C.M. I . en llg/ml
24 H 48
Staphylococcus aureus ATCC 6 538 2 2
Pen-Sensible
Staphylococcus aureus UC 1 128 5 5
Pen-Résistant
Staphylococcus aureus exp. n 54 146 2 2
Streptococcus pyogènes A 561...... ~ 0,02 ~ 0,02
Streptococcus faecalis 5 432...... 5 5
Streptococcus faecalis 99 ~ 74.... 5 ~ 40
Bacillus subtilis ATCC 6 633...... 1 2
Escherichia Coli Sensible Tétra- 0, 6 0, 6
cycline ATCC 9 637
Escherichia Coli Résistant Tétra- 0 ,1 0 ,1
cycline ATCC 11 303
Escherichia Coli Exp . T026~36 ... ' 4 ' 4
Escherichia Coli Résistant 0, 6 o, 6
Gentamicine, Tobramycine R 55 123 D
Klebsiella pneumoniae Exp . 52 145 . . . 0 ,1 0 ,1
Klebsiella pneumoniae 2 536 Résistant 1 2
Gentamicine
Proteus mirabilis (indol-) A 235.. 0,05 o,
Proteus vulgaris (indol+) A 232... 5 10
-- 4s --
1 334407
Produit de
SoUC~ES l ' exemple 6
C.M. I . en llg/ml
24 H 48 H
Salmonella typhimurium 420 .. o, 4 o, 4
13nterobacter cloacae 681.... 10 20
Providencia Du 48............ 10 10
Serratia Résistant Gentamicine 2 532 1 2
1 334407
Produit de
SOUCHES l'exemple 10
C.M. I . en llg/ml
24 H 48 H
Staphylococcus aureus ATCC 6 538 20 40
Pen-Sensible
Staphylococcus aureus UC 1 128 40 40
Pen-Résistant
Staphylococcus aureus exp. n 54 146 40 40
Streptococcus pyogènes A 561........ 0, 05 0, 05
Streptococcus faecalis 5 432........ 20 > 40
Streptococcus faecalis 99 F 74...... 20 > 40
Bacillus subtilis ATCC 6 633........ 20 > 40
Escherichia Coli Sensible Tétra- 0, 6 0, 6
cycline ATCC 9 637
Escherichia Coli Résistant Tétra- 0, 2 o, 2
cycline ATCC 11 303
Escherichia Coli Exp . TO26B6 ...... o, 4 o, 6
Escherichia Coli Résistant 0, 6 o, 6
Gentamicine, Tobramycine R 55 123 D
Klebsiella pneumoniae Exp. 52 145 .. 0,1 0,1
Klebsiella pneumoniae 2 536 Résistant 0, 6 2
Gentamicine
Proteus mirabilis (indol-) A 235.... 0,1 0,2
Proteus vulgaris (indol+) A 232..... 3 20
-- 47 --
- .r
~ 3~4407
Produit de
SOUCHES l'exemple 10
C.M. I . en ~Ig/ml
24 H 48 H
Salmonella typhimurium 420.. 0,6 0,6
Providencia Du 48.. 2 5
Serratia Rési~tant Gentamicine 2 532 5 10
-- 48 --
-~-?
. .
- 1 334407
Produit de l'exemule 16
C . M . I . en llg/ml
SOUCHES
24 H 48 H
Staphylococcus blanc pathogène 69 396 2 2
Staphylococcus blanc 21 976 3 5
Staphylococcus doré 68 666 3 5
Escherichia Coli 73 316 0, 2 0, 2
Escherichia Coli 72 806
Escherichia Coli 69 916 0,4 0,4
Escherichia Coli 69 886 0, 6
Escherichia Coli 68 696 0, 4 0, 4
Escherichia Coli 68 956 0, 4 0, 4
Escherichia Coli 21 976 0,6 0,6
Escherichia Coli 19 976 0,6 0,6
-- 49 --
:=
-
~ ~344~7
B) Infection expérimentale à Escherichia Coli TO26B6:
On a étudié 1 ' action des produits des exemples 6 et I0
sur une infection expérimentale d'Escherichia Coli de la souris.
On a infesté des lots de dix souris m81es d'un poids moyen de 22 g
par injection intrapéritonéale de 0.5 cm3 d'une culture de vingt-
quatre heures en bouillon nutritif de la souche Excherichia Coli
TO26B6 de l'Institut Pasteur diluée au 1/5,5 ème par de l'eau
distillée .
On a administré par injection sous cutanée ou per os une
10 heure, cinq,heures et vingt-quatre heures après l'injection, une
quantité déterminée de produit.
On a noté la mortalité pendant huit jours.
Les résultats ont été les suivants:
_ 50 _
1 3;~4407
.,, .,, " o o o o o
~ L E ~ o e~ 1` ~
~a )
,U~
~ .
U~
O ,_
r~
"
~
N
T ,_
N
C~l
o
~'~ O
N
_ O
E o ~ E ~; E ~ ~ E
Y Q O ~ ~ ~ ~ . C`~ ~ ~L r7
.r~ ~ O O ~ O O ~ O ~ O O ~ O
~11 L ~ L ~) X O X L _ X
5 1 -
L C E ~ r~ ~ N C`.l ~`
c", ~a 3a~ 1 334407
~o
U~
O N
0
Il~ I
I_ I
N
N
o
0
N
,_
N
O ~, N
I
.,1
E o o O
~ Q o~ C~
>
0 0 0 0 0
~D E ~U ~ ~D E ~U
E ~ 0 ~ ~ E ~
_~ CL ~ r1 EO- 0 -~ E _ .-1 E - .-1 E
-o X X ~ X X ' X o X O O X
L -- L ~ L -- L -- L ~
-- 5Z --
1 3~4~07
C) Infection expérimentale à l<lebsiella pneumoniae:
On a étudié l ' action des produits des exemples 4 et 6
sur une infection expérimentale à Rlebsiella pneumoniae de la
souris. On infeste des lots de dix souris mâles d'un poids moyen
de 21 g par injection intrapéritonéale de 0,5 cm3 d'une culture
en bouillon nutritif de la souche Klebsiella rn~ 52 145
diluée au l/lOOe par de l'eau distillée.
On a administré par voie sous cutanée une demi-heure,
quatre heures, huit heures, vingt-quatre et trente deux heures
après l'injection, une quantité déterminée de produit.
On a noté la mortalité pendant 10 jours.
}e~ t~ l~nt ~td i~ s~ t~
_ 53 _
1 334407
L ~ ~ E L '-- ~ --
o ~ ~a, o O o a~ O o
o
r~
C~
cr:
1-- I ~
0
o
C~l
E E E E E
X X X X X
~ E ~ ~ ~ E ~ o)
V ~ ~ E
'-I ~ ~ ~ ~ V ~
E O X O X O X O X O X
L L L k U, L
-- 54
1 334407
D) InfectLon expérimental_ a K1_bsiella p_e_m_nlae.
On a étudié 1 ' action des produits des exemples 14 et
16 sur - une infection expérimentale de Klebsiella pneumoniae
de la souris. On a infesté des lots de dix souris mâles d'un
poids moyen de 21,5 g par injection intrapéritonéale de
0,5 cm3 d'une culture de 24 heures en milieu nutritif de la
souche Klebsiella pneumoniae 52 145, diluée au 1/1000 par de
1 ' eau distillée .
On a administré par voie sous-cutanée une heure,
cinq heures et 24 heures après l'injection, une quantité
déterminée de produit.
On a noté la mortalité pendant dix jours.
Les résultats ont été les suivants:
_~ 55 _
1 334407
0 ~", ~ ~ .0 ~D ~o O O o ~ ~ O O
,
~o
~o ~ N
In
o
o
U~
El
E E ~ E ~t E ~ E ~O E ~D E (D E E ~O E
E E E E E E E E E Q
X X x X X X X x X x
O ~ 0 1~ 0 ~ O ~ O
E o o o ~ ~ 17 ~ u
i- n ~ O, L ", n n ~ L
-- 56 --
,!