Note: Descriptions are shown in the official language in which they were submitted.
2~74~9
WO91/05767 PCT/FR90/007S5
POLYURETHANES COMPORTANT DES SEOUENCES VINYLIOUES. LEUR
PROCEDE DE FABRICATION ET LEUR APPLICATION A LA FORMULATION
DE PEINTURES
La presente invention concerne l'introduction de
sequences vinyliques dans les polyurethanes. Elle porte
donc sur des polyurethanes comportant des séquences
vinyliques, sur des procédes de fabrication de ces -
polyurethanes et sur leur application a la formulation de
peintures.
Les disulfures de thiurame sont connus comme
agents ayant la triple fonction d'initiateur, d'agent de
transfert de chaîne et d'agent de terminaison (désignés par
l'abreviation "iniferters") dans la polymérisation radica-
laire de monomères vinyliques. Ainsi, les iniferters
i 15 disulfures de tétraalkylthiurame ont été décrits par
Takayuki Ostu et al dans "Makromol. Chem. Rapid., Commun.
- 3, 127-132 (1982). Des disulfures de thiurame fonctionnels
sont présentés comme iniferters dans la demande de brevet
.l européen EP-A-O 237 792, les groupes fonctionnels envisagés
comprenant les fonctions hydroxyle, carboxyle et amine.
;I La presente invention concerne l'application de
certains iniferters disulfures de thiurame fonctionnels a
la fabrication de polymeres vinyliques dont les fonctions
terminales peuvent être à leur tour condensees avec un
composé organique comportant au moins deux fonctions alcool
ou deux fonctions isocyanate.
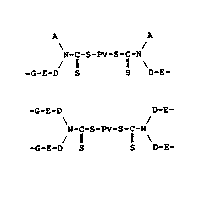
La présente invention a donc d'abord pour objet
`; un polyurethane comportant des motifs de type
A A
N-C-S-Pv-S-C-N (Ia)
:. / 11 11 \ .
; -G-E-D S S D-E-
ou
-G-E-D D-E-
N-C-S-Pv-S-C-N (Ib)
/ 11 11 \
~ -G-E-D S S D-E-
:
.~
:
., ~ ~ : . ; ~. .. . .
.. : . , . :
` . ." ' ~' ' `~'.
, , ' , ' ... . . . :
.
2067489
WO91/05767 PCT/FR90/007~
où: .
- A est choisi parmi les groupes alkyles, cycloalkyles,,
aryles, arylalkyles et alkylaryles, et les sequences
polyoxyalkylènes et polyesters,
- D est choisi parmi les groupes alkylenes,
cycloalkylènes, arylènes, alkylarylenes et
arylalkylenes, et peut comporter au moins un
hetéroatome tel que l'azote ou l'oxygene,
- E représente :
. un groupement -NH-C-O-, auquel cas G représente
O
le squelette hydrocarbone d'un compose organique
comportant au moins deux fonctions alcool, ou
, -lS bien - ,
un groupement -O-C-NH, auquel cas G représente
O
le squelette hydrocarbone d'un composé organique -,
comportant au moins deux fonctions isocyanate,
' et
¦ _ Pv représente une séquence polymere issue d~au moins
un monomere vinylique.
Ces polyuréthanes sont de préference tels que la sequence
polymère Pv possede une masse moleculaire moyenne en nombre
, comprise entre 102 et lo6 environ, et plus particulièrement
entre 103 et 105 environ.
Ils ont principalement un caractere lineaire -
dans le cas ou G represente le squelette hydrocarbone d'un
composé organique ne comportant pas plus de deux fonctions
' alcool ou isocyanate, bien que des réactions secondaires
d'isocyanates sur les liaisons uréthane puissent conduire à ~ -
des liaisons allophanates et donc à une réticulation
~' partielle. Dans le cas où G repesente le squelette
. 35 hydrocarbone d'un compose organique comportant plus de deux
fonctions alcool ou isocyanate, les polyurethanes selon
l'invention sont des produits reticules.
:
~7~9
`VO9l/0576, PCT/FR90/00755
: 3
La présence de sequences vinyliques dans ces
polyurethanes permet notamment d'ameliorer la stabilite au
soleil (W) des peintures a base de polyuréthanes et de
donner un brillant à ces peintures.
Les groupes aikyle et alkylène entrant respecti-
vement dans les definitions de A et D sont notamment des
groupes en C1-Cl2~ en particulier en C~-C6; les groupes
cycloalkyle et cycloalkylene sont notamment des groupes
mono- ou polycycliques en C3-Cl2, en particulier en Cs-C7;
les groupes aryle et arylène sont notamment des groupes en
l C6-Cls incluant un ou plusieurs noyaux aromatiques tels que
-, phényle ou naphtyle.
:~ La sequence polyoxyalkylene pouvant entrer dans
la définition de A peut être representee par l'une des
formules suivantes :
Rlo ~ (-CHZ-cH2-o-) C-CH2--CH2-
:~ .
~O~(-cH2-cH-o-)c-cH2-cH-
CH3 CH3
' 20
R10-- t - ICH-cHz-o- ) C-CH-CH2-
CH3 CH3
.,
Rlo~O~ [ -CH2) 4-- ] c- ( CH2) 4
'
ou :
~ R~o représente un reste alkyle, cycloalkyle ou aryle ;
et
- c vaut de 1 a lOOO, de preference de 1 à 200.
La séquence polyester pouvant entrer dans la
définition de A peut être representee par l'une des
formules suivantes :
-: O O O
. . Il 11 11
Rl 1 -C-O-Rl2- ~ --C-R13-C-O-R12- ] d
.,
i` ' . : ::'
:', ' ' '~ ~' '
` :~. . . :: : ~ .
WO91/05767 ~ ~ ~ 7 4 8 9 PCT/FR90/0075~ .
: 4
o O
.~ Il 11 .
-[-C-R13-C-O-Rl2-]d- ; et
O o ' -.
:~ 5
R~1--[--0--C--R13--c R~2 ]d
,,, OU: :.
- R11 est tel que défini ci-dessus pour R10 ;
~ ~ R~2 et R13 sont choisis parmi les groupes alkylene,
; 10 cycloalkylene, arylène, alcénylène, alcénylarylene et
peuvent comprendre au moins un hetéroatome et/ou au
~ moins un reste -N-,
R14
R14 etant choisi parmi les groupes alkyle, cycloalkyle
l et aryle, et pouvant comporter des substituants ; et
; - d vaut de 1 à 300, de préference, de 1 a 50.
Comme monomeres vinyliques dont peut être issue .
la séquence polymere Pv, on peut citer notamment : -
, 20 - un acrylate ou methacrylate d'alkyle dont le groupe
J alkyle linéaire ou ramifie, et comprenant le cas
:i échéant au moins un héteroatome sous forme par
exemple d'un atome d'halogene, de groupe carbonyle,
hydroxyle ou amino, possede de 1 a 20 atomes de
carbone, tels que ceux de méthyle, éthyle, n-butyle,
tertiobutyle, 2-ethylhexyle, stéaryle, 2,2,2-tri- .
fluoroethyle, hydroxyéthyle, hydroxyethylimidazoli-
' done et hydroxyethyloxazolidone,
; - un acrylate ou méthacrylate d'aryle tel que les
methacrylates de benzyle et de phényle,
-~ - un hydrocarbure vinylaromatique tel que le styrène,
le vinyltoluène, l'Q-méthylstyrène, le methyl-4
styrène, le methyl-3 styrene, le methoxy-4 styrène,
. l'hydroxymethyl-2 styrène, l'ethyl-4 styrene,
l'ethoxy-4 styrène, le diméthyl-3,4 styrène, le
.. .
~ . . .. ~ . . . . . , .. ~
2 o 5 ~ ~ 8 9
WO9l/0~76/ PCT/FR90/0075
; 5
chloro-2 styrène, le chloro-3 styrène, le chloro-4
methyl-3 styrène, le tert.-butyl-3 styrene, le
dichloro-2,4 styrène, le dichloro-2,6 styrene et le
l vinyl-1 naphtalene,
- 5 - un acrylate ou methacrylate epoxyde tel que
l'acrylate et le methacrylate de glycidyle, le
' 2-époxyethylbicyclo[2.2.1]hept-5(6)-yl (méth)acrylate
et le produit d'époxydation de l'acrylate de
. dicyclopentényloxyethyle,
10 - un acrylamide ou méthacrylamide, un acrylate ou
. méthacrylate de dialkylaminoalkyle et leurs sels
! quaternaires,
- l'acrylate et le methacrylate de (norbornyloxy-2)-2
éthyle et de (diméthanodécahydronaphtyloxy-2)-2
ethyle,
- un nitrile insaturé tel que l'acrylonitrile ou le
i méthacrylonitrile,
- une maleimide N-substituée telle que la N-éthyl-
maleimide, la N-isopropylmaléimide, la N-n-butyl-
. 20 maléimide, la N-isobutylmaleimide, la N-terbutyl-
- maléimide, la N-n-octylmaléimide, la N-cyclohexyl-
maléimide, la N-benzylmaleimide et la N-phényl-
maleimide,
. .
- un anhydride d'acide dicarboxylique insature tel que
J 25 l'anhydride maleique, lianhydride itaconique,
. l'anhydride citraconique ou l'anhydride tetrahydro-
~ phtalique,
' - l'acide acrylique ou méthacrylique,
~-~ - un acrylate ou methacrylate de polyol comme les
diacrylates et diméthacrylates de l'éthyleneglycol,
~ du propyleneglycol, du 1,3-butanediol, du
.~ 1,4-butanediol, du 1,6-hexane-diol, du neopentyl-
:~; glycol, du 1,4-cyclohexane-diol, du 1,4-cyclohexane-
dimethanol, du 2,2,4-trimethyl-1,3-pentanediol, du
2-ethyl-2-méthyl-1,3-propanediol, du 2,2-diethyl-
i 1,3-propanediol, du diethylèneglycol, du dipropylène-
~ glycol, du triéthylèneglycol, du tripropyleneglycol,
. ~ . .
... .
~ ~7 'i'~
~ WO91/05767 PCT/FR90/0075~s
. . .
~ 6 :
- du tetraéthylèneglycol, du tetrapropyleneglycol, du
. triméthylolethane, du trimethylolpropane, du
glycerol, du pentaérythritol, les triacrylates et
triméthacrylates du triméthylolethane, du :
5 trimethylolpropane, du glycerol, du pentaérythritol,
~ les tetraacrylates et tétraméthacrylates du penta-
: erythritol, les di(meth)acrylates a hexa(meth)-
acrylates du dipentaérythritol, les poly(méth)-
acrylates de polyols mono- ou polyethoxyles ou mono-
ou polypropoxylés tels que le triacrylate et le
trimethacrylate du triméthylolpropane triethoxylé, du -
trimethylolpropane tripropoxylé ; le triacrylate et
le trimethacrylate du glycérol tripropoxylé ; le
. triacrylate, le trimethacrylate, le tetraacrylate et
le tétraméthacrylate du pentaerythritol tétra- :-
éthoxylé, :
- un diene tel que le 1,3-butadiene, 1'isoprène, le
. 1,3-pentadiene, le 1,4-pentadiène, le 1,4-hexadiène,
le 1,5-hexadiene, le 1-9-décadiene, le 5-méthylène-
:l 20 2-norbornene, le 5-vinyl-2-norbornene, les 2-alkyl-
2,5-norbornadienes, le 5-éthylidene-2-norbornène, le
5-(2-propényl)-2-norbornene, le 5-(5-hexényl)-2-
norbornene, le 1,5-cyclooctadiene, le bicyclo [2,2,2]
octa-2,5-diène, le cyclopentadiene, le
.;l 25 4,7,8,9-tétrahydroindène et l'isopropylidene
. tétrahydroindène,
.s - un halogénure de vinyle ou de vinylidene, tel que le
. bromure de vinyle et les chlorures de vinyle et de
.~ vinylidene,
;:~ 30 - les esters vinyliques tels que l'acetate de vinyle et
le crotonate de vinyle;
- le 9-vinylcarbazole, la vinyl-2-pyridine, la
~ vinyl-4-pyridine, la 1-vinyl-2-pyrrolidinone, le
i vinyltrimethoxysilane, le vinyltrim~ethylsilane et le
l-vinylimidazole, et
~` - les methacrylates de trialkylsilyle ou de
trialcoxysilyle tels que le méthacrylate de 3-(tri-
, .
. .
... .
~0~ ~89
; WO91/05767 PCT/FR90/0075~
methoxysilyl)propylet le methacrylate de trimethyl-
silyle et le methacrylate de 2-(triméthylsilyloxy)-
ethyle.
On peut preparer les polyurethanes selon
l'invention dans lesquels E représente un groupement
-NH-C-O- et G represente le squelette hydrocarboné d'un
o
composé organique comportant au moins deux fonctions alcool
en faisant reagir un polymere de formule :
A A
N-C-S-Pv-S-C-N (IIa)
' / 11 ~1 \
O=C=N-D S S D-N=C=O
.~ ou
;, .
O=C=N-D D-N=C=O
. N-C-S-Pv-S-C-N (IIb)
:: 20
~ O=C=N-D S S D-N=C=O
' .
1 le cas échéant en melange avec au moins un autre compose
organique comportant au moins deux fonctions isocyanate,
~ avec au moins un composé de formule :
: 25 HO-G-OH (III)
: le cas echéant en mélange avec au moins un autre compose organique comportant au moins deux fonctions alcool.
. . Comme compose de formule (III) on peut citer,
par exemple, l'ethylène glycol, le propanediol, le
30 butanediol-1,4, le butanediol-2,3, le diméthyl-2,2
propanediol-1,3, l'adipate d'éthylène glycol, les
polyethylèneglycols, polypropyleneglycols et copolymères
oxyde d'ethylène-oxyde de propylène statistiques et à
blocs, de masse moleculaire comprise entre environ 400 et
: 35 40 000, les composés polyhydroxylés de masse moleculaire
~ , .
WO91/0~767 ~ 4 ~ 9 PCT/FR90/0075~
comprise entre e~viron 400 et environ 600, les polyéthers
et les polyesters.
La réaction du polymère de formule (IIa) ou
(IIb) et du composé de formule (III) est effectuee de
5 préference en presence d'un catalyseur tel que l'acetyl-
acetonate de fer, une amine tertiaire, un naphténate de
plomb ou de cobalt, ou encore un sel d'etain comme les
dicarboxylates de dialkyletain, et de preférence en
utilisant un rapport molaire tNCO]/[OH] des fonctions
IO isocyanate du polymere (IIa) ou (IIb) aux fonctions alcool
du composé (III) sensiblement égal a l.
Pour préparer le polymère de formule (IIa), on
peut procéder de la façon suivante :
- dans une première étape, on fait réagir avec un
haloacide XH un composé de formule :
A-NH-D-COOH (IV) -
pour obtenir le composé de formule : ~ .
` A-NH~-D-COOH . (V) ;
~ 20 X 9
- dans une seconde étape, on fait reagir le compose (V)
, avec un agent d'halogénation, pour obtenir le composé
~ de formule :
A-HN -D-COX (VI)
i 25
', X ~
,!, - dans une troisième étape, on fait réagir le composé
(VI) avec un azoture de formule :
i R3Si-N3 (VII)
., 30 ou R est un reste alkyle, cycloalkyle ou aryle ou une
combinaison d'au moins deux de ces restes, pour
obtenir le composé de formule :
A-NH~-~-CON3 (VIII)
35 X ~
;~ - dans une quatrieme etape, on fait reagir le compose
. (VIII) avec le disulfure de carbone, en presence d'au
moins un agent oxydant, pour obtenir le compose de
formule :
,
,
.. .
~' : .'. ' , '. ' .' ': ' : ' , ~ ` , ., . . ':
. ' " ' ' , ' ~ , ' ' .' ' . ' , ' ' :: . ' ' ~ ' ' . " ' ' '. '
. ;~ ' ~ ' ' , . ' ' ' ' , . ': ..
,'' " ' ' ' . ' , . `' . , ; .' ',', ~' ' ' ' : ' '
'
~ 7'~
' `W O 91/05767 P ~ ~FR90/0075
g
~- IS-C-N ~ (IX) ; et
, 1 11 \ .
¦ S D-CON3 1 2
: . --
` - dans une cinquième étape, on conduit la polyméri-
sation radicalaire d'un monomere vinylique Mv en
présence du composé (IX) comme agent ayant la triple
fonction d~initiateur, d~agent de transfert de chaîne
et d'agent de terminaison.
Les conditions genérales de réaction de la
premiere étape sont notamment les suivantes :
On travaille a une temperature genéralement
15 comprise entre environ 0-C et la température ambiante.
Dans un mode de realisation particulier, un haloacide,
comme par exemple HCl, est additionné lentement sur l'amino
t acide (IV) mole à mole pour donner le sel (V).
Les conditions de reaction de la deuxieme etape
~ Z0 sont notamment les suivantes :
-. On conduit la reaction a une température
j généralement comprise entre environ 20 et 120-C, de
;~ préférence, a environ 80-110-C. On travaille par exemple
en milieu pyridine. L'agent d'halogenation peut être,
.3 25 entre autres, le chlorure de thionyle.
Les conditions de réaction de la troisieme étape
' sont notamment les suivantes :
On conduit la reaction genéralement aux environs
de 60-C. On travaille de préference en milieu solvant
30 polaire, comme le dimethylformamide (DMF) et le tétra-
hydrofurane (THF).
Conformément a un mode de realisation
particulier, le compose (VI) est melangé avec l'azoture de
~; trimethylsilane (Me3Si-N3) comme compose (VII) dans l'un
35 des solvants indiques ci-dessus et il est porte au re~lux
~'' pendant environ 13 heures. Le compose (VIII) est un solide
recupére par filtration.
.
, :
~.......................................................................... .
~ .
. ~ .
~, : . . , . ~ : . . ~ :: ;. . . . . .
WO91/0~76, ~ 9 PCT/FR90/0075
Les conditions de reaction de la quatrieme etape
sont notamment les suivantes :
On travaille genéralement aux environs de la
temperature ambiante. La reaction est généralement
conduite avec utilisation d~un rapport sensiblement
équimolaire de CS2 a l'amine quaternisee (VIII) ou non
quaternisee. -
L'agent oxydant est ajoute, par exemple, a
raison d'environ l mole par mole de CS2, et il est choisi,
par exemple, parmi l'iode, l'eau oxygénee, les hypo-
chlorites de métaux alcalins, les hydroperoxydes d'alkyle
et d'aryle, et l'hexacyanoferrate de potassium.
La reaction peut être effectuée en présence
d'une amine tertiaire (par exemple, la triéthylamine ou la
pyridine), à raison d'au minimum 2 moles par mole d'amine
quaternisee et l mole par mole d'amine non quaternisée. La
~,reaction peut être effectuée en milieu solvant, CS2 ou
l'amine tertiaire pouvant du reste faire office de solvant.
'La réaction de la cinquième étape peut être
~;20 effectuée sous une pression allant jusqu'à 30 bars environ
et le cas echéant, en présence d'un solvant commun au
monomere Mv et à la séquence polymere Pv, tel qu'un hydro-
carbure aromatique (toluene, xylène, etc.) ou un éther
(tétrahydrofuranne, diglyme).
Les conditions de polymérisation de la cin-
quième étape sont naturellement variables selon la nature
du monomère vinylique Mv, du solvant et de la pression,
i~ mais comprennent genéralement une température comprise
entre 50-C et 130-C environ et une duree comprise entre 0,5
et 48 heures environ. Lorsqu'une basse temperature et/ou
une faible duree sont choisies, il peut se produire la
formation intermediaire d'un polymère de formule :
'' ': '
A A
~ \ /
35 N-C-S-Pv-S-C-N (X)
d N30C-D S S D-CON3
. , .
,.:, . . , : . . .. . , . ~ . .
.: . , . . : . ,.; .,, : . . ... ... .
.. .. ~ . , .. . . .. .: ~ . ,
. ~ ' , , . ,.~ ' i ~
2 ~ 9
` WO91/0576, PCIIFR90/0075~
11
qui est ensuite converti en polymère de formule (IIa) par
chauffage au reflux en solution dans un solva~t approprié a
la chaîne de polymère, par exemple, le toluène, pendant
environ 12 à 24 heures.
Conformement à une variante, on fait réagir le
compose (IV) ou (V), en presence d'une amine tertiaire,
comme la triéthylamine, et d'ùn chloroformiate d'alkyle ou
de cycloalkyle comme ClCO2C2Hs, avec un azoture de metal
alcalin, pour obtenir respectivement un composé de formule:
, 10 , A-NH-D-CON3 (XI)
ou le composé de formule (VIII) que l'on soumet ensuite à
la quatrieme étape telle que définie ci-dessus.
Conformément à une autre variante, on peut, à la
cinquieme étape, chauffer en milieu solvant le compose (IX)
15 pour obtenir le compose de formule :
A
0 1 S-C-N (XII) ; et
,., 11 \ -~- .
S D-N=C=O
. 2
dans une sixieme etape, conduire la polymérisation radica-
laire d'un monomere vinylique Mv en présence du composé de
formule (XII) comme agent ayant la triple fonction d'ini- -~
tiateur, d'agent de transfert de chaîne et d'agent de
terminaison.
La ~uantite d'iniferter (IX) ou (XII) intro-
duite dans la cinquième ou sixieme etape est generalement
comprise entre 5 x 10-5 mole/l et 0,1 mole/l par rapport au
monomère vinylique.
Pour preparer le polymère de formule (IIa), on
peut également utiliser un procede consistant à faire
reagir un polymère de formule :
:\
WO91/0576/ ~ U ~ 7 4~ 3 PCT/FR90/0075~
; ~
12
.~
. A A
' \ /
N-C-S-Pv-S-C-N tXIII )
`, / 11 11 \
OH-D S S D-OH
avec un compose organique comportant au moins deux
:~ fonctions isocyanate dont l'une est beaucoup plus réactive
que l'autre vis-à-vis des fonctions hydroxyle, le rapport
' molaire dudit compose organique au polvmère (XIII) étant au
moins égal à 2. Comme exemple de tel compose organique, on
peut citer notamment l'isophorone diisocyanate.
Pour preparer le compose de formule (XII) on
peut également faire réagir un composé de formule :
....
A A
\ / -
~ N-C-S-S-C-N (XV) ~
,' / 11 11 \ :~ ' -
HO-D S S D-OH
,~
~ avec un composé organique comportant au moins deux
. 20 fonctions isocyanate dont l'une est beaucoup plus réactive
que l'autre vis-à-vis des fonctions hydroxyle, le rapport
molaire dudit composé organique au compose (XV) étant au
moins égal à 2.
~:' Pour préparer le polymere de formule (IIb), on
.' 25 peut procéder de la façon suivante : .
~:: - dans une premiere etape, on fait réagir avec un
. haloacide XH un composé de formule :
HOOC-D-NH-D-COOH (XVI)
pour obtenir le compose de formule :
~- 30 HOOC-D-NH2-D-COOH (XVII)
. X~
- dans une seconde étape, on fait reagir le compose
(XVII) avec un agent d'halogenation, pour obtenir le
35 compose de formule :
,, .
.
, .
. .
~ ' , ', . , .,,.~,,`i.''. '.
' '` ', ' ,. ' ' ~ ' ': ",~,.' '.i'"' ' '
,
~3~7~
::WO91/05767 PCT/FR90/0075
13
XOC-D-NH2-D-COX (XVIII)
X --
- dans une troisième etape, on fait reagir le composé
. S (XVIII) avec un azoture de formule (VII) pour obtenir
le compose de formule :
N3OC-D-NH2-D-cON3 (XIX) : :
X 9
10 - dans une quatrième etape, on fait reagir le composé (XIX) avec le disulfure de carbone, en presence d'au
moins un agent oxydant, pour obtenir le composé de
- formule : -
, I D-CON3
' 15 /
~ S-C-N (XX) ; et
11 \ ~'. .
S D-CON3 2 -.-
- dans une cinquieme étape, on conduit la
polymérisation radicalaire d'un monomère vinylique Mv .
en présence du composé (XX) comme agent ayant la
triple fdnction d'initiateur, d'agent de transfert de -~
chaine et d'agent de terminaison.
Les conditions genérales de reaction sont
analogues a celles déja décrites pour la synthèse d'un :
polymere de formule (IIa) a partir d'un compose de formule
- (IV). Les mêmes variantes de procéde peuvent être prevues,
notamment celle consistant a chauffer le compose (XX) en
: 30 milieu solvant pour obtenir le composé de formule : -
D-N=C=O
. -S-C-N (XXI) ;
S D-N=C=O 2 :
puis, dans une sixieme étape, à conduire la polymerisation
de Mv en presence du compose (XXI) agissant comme
iniferter.
. ';,` ~'' '.
.~.
WO9l/05767 2 Q 6 7 4 8 9 PCT/FRgo/007
.:
14
Pour preparer le polymère de formule (IIb), on
peut egalement utiliser un procede consistant à faire
. reagir un polymère de formule :
HO-D D-OH
N-C-S-Pv-S-C-N (XXII)
'''~, / 11 11 \ .
. OH-D . S S D-OH
avec un composé organique comportant au moins deux
fonctions isocyanate dont l'une est beaucoup plus réactive
que l'autre vis-à-vis des fonctions hydroxyle, le rapport
'~t' molaire dudit compose organique au polymere (XXII) étant au
moins égal à 2. Comme exemple de tel composé organique, on
peut citer notamment l'isophorone diisocyanate.
. 15 Pour préparer le compose de formule (XXI), on
~` peut également faire réagir un composé de formule :
, , .
.1 HO-D D-OH
'.i \ /
~3 N-C-S-S-C-N (XXIII)
/ 1~
HO-D S S D-OH
avec un compose organique comportant au moins deux
fonctions isocyanate dont l'une est beaucoup plus reactive
que l'autre vis-a-vis des fonctions hydroxyle, le rapport
` 25 molaire dudit composé organique au compose (XXIII) étant au
-~ moins égal à 2.
Il convient de noter la restriction suivante ~:
pour la mise en oeuvre de la variante de procéde comportant
une sixieme étape de polymérisation de Mv en presence d'un
compose de formule (XII) ou (XXI) : dans ce cas, le
!i monomere Mv ne devra pas être porteur d'une fonction
~ . alcool, acide ou anhydride, en d'autres termes, il ne
i pourra pas être choisi parmi les acides acrylique et
méthacrylique, les (meth)acrylates hydroxyles ou de polyol
et les anhydrides d'acide dicarboxylique insature.
.~ La formule developpee complète d'un polyurethane
selon l'invention dans lequel E represente un groupement
,. .
x
,.
.,:
.. ~', . ,: ,
': ~ : . '-', '~ , ' ' ' ':
t WO91/05767 ~ 8 ~ PCT/FR90/0075~
.
~ .
' . -NH-C-O et G represente le squelette hydrocarboné d'un
o ~ ;.
t compose organique comportant au moins deux fonctions alcool
5 s'ecrit comme suit, en désignant par K le motif de type
(Ia) ou (Ib) et en supposant que le rapport [NCO]/[OH] des
fonctions isocyanate du polymère de formule (IIa) ou (IIb)
aux fonctions alcool du compose (III) est egal à 1. :
, .. ..
~. HO-tKt- G-E-D S S D-N=C=O
\ 11 11
: N-C-S-Pv-S-C-N
/ \ (XXIV) -:
A A
~. 15 ou
,~
, HO-tK~-E-D S S D-N=C=O
N-C-S-Pv-S-C-N
20/ \ (XXV)
HO ~K~G-E-D D-N=C=O
n étant un nombre entier compris entre 1 et 50 environ
, inclusivement.
. On peut préparer les polyuréthanes selon
l'invention dans lesquels E représente un groupement
. -O-C-NH- et G représente le squelette hydrocarboné d'un
.`,, O
.~. composé organique comportant au moins deux fonctions
isocyanate, en faisant reagir un polymère de formule :
A A ~.
N-C-S-Pv-S-C-N (XIII)
'"` ' / 11 11 \ .'
^, 35 OH-D S S D-OH
. . .
A'l le cas écheant en melange avec au moins un autre compose .
., organique comportant au moins deux fonctions alcool, avec
au moins un compose de formule :
.. . .
~ .
" ~ , , ' ' ! , , . . , ~ . ,;;,; . . `, ~ ' . .
W091/0576, 2 ~ ~ 7 ~ 8 9 PCT/FR90/0075~
O=C=N-G-N=C=O (XIV),
le cas échéant en melange avec au moins un autre compose
organique comportant au moins deux fonctions isocyanate.
Des polymères (XIII) sont dejà connus par le document
EP-A-237 792 cité precedemment.
Comme compose de formule (XIV), on peut citer,
entre autres, l'hexaméthylène diisocyanate, le trimethyl-
hexamethylène diisocyanate, le methyl-l diisocyanato-2,4
cyclohexane, la dicyclohexylméthanediisocyanate-4,4', le
toluylène diisocyanate, le 4,4'-diphényl-méthane
diisocyanate, l'isophorone diisocyanate, le xylylène
diisocyanate.
La réaction du polymère de formule (XIII) ou
(XXII) et du composé de formule (XIV) est effectuée de
préference en présence d'un solvant anhydre tel que le
toluène, à une température comprise entre environ 20-C et
la température d'ebullition du solvant. Elle est effectuee
de préférence en presence d'un catalyseur de même nature ~-
~ que celui décrit pour la réaction entre un polymere (IIa)
; 20 ou (IIb) et le composé (III), et de préférence en utilisant
un rapport molaire [NCO]/[OH] des fonctions isocyanate du
;~, composé (XIV) aux fonctions alcool du polymere (XIII) ou
. (XXII) sensiblement égal a 1.
La formule développée complete d'un polyuréthane
selon l'invention dans lequel E représente un groupement
-O-C-NH- et G représente le squelette hydrocarboné d'un
O
composé organique comportant au moins deux fonctions
isocyanate, s'ecrit comme suit, en designant par K le motif
de type (Ia) ou (Ib) et en supposant que le rapport
[NCO]/[OH] des fonctions isocyanate du composé (XIV) aux
fonctions alcool du polymère de formule (XIII) ou (XXII)
est égal a 1 :
- ~ :- - . -, ., , ; . . -. -
: -: .. , . - : -
, . ~ : . :
.
:
., , ~, . .
~ 091t0~767 2 0 ~ 7 A 8 9 PCT/FR90/0075;
~ . .
~` 17
O=C=N ~K~G-E-D S S D-OH
N-C-S-Pv-S-C-N
/ \ (XXVI)
~j 5 A A
. .:
! ;' OU
O=C=N-(K~-G-E-D S S D-ON
N-C-S-Pv-S-C-N
/ \ (XXVII)
J O=C=N-~K~G-E-D D-OH
-, n étant un nombre entier compris entre 1 et 50 environ
I5 inclusivement
,;
Exemple 1
Pré~aration du chlorure de l'acide 4-(methvlamino)- -
butvriaue hYdrochloré : CH3-NH2-(CH2)3-COCl
, 20 Cl-
~' L'acide 4-(méthyl amino) butyrique hydrochlore
e depart CH3-~H2-(CH3)2-Co2H est disponible commercia-
Cl3
lement. Néanmoins, il est possible de quaterniser l'amine
en masse ou en solution dans de l'ether par addition lente --
~,~ d'une solution aqueuse d'HCl a temperature ambiante en
,1 quantité equimoleculaire. Le sel est extrait de la phase
aqueuse avec du HCCl3.
On melange 76,8 g (0,5 mole) d'acide 4-(methyl-
amino)butyrique hydrochloré avec 1~,6 ml (238 g ; 2 moles)
de chlorure de thionyle et 40,5 ml (39,5 g ; 0,5 mole) de
s' pyridine. On porte le milieu réactionnel au reflux jusqu'a
~ dissolution complète du solide (en l'espace d'environ 1-4
i~ 35 heures). On sépare l'excès de SOC12 par filtration. On
lave le solide avec du chloroforme et on le sèche sous
vide.
. ~ .
!
wo 91/05767 '2 0 ~ 7 4 ~ 9 Pcr/FR90/007s~
18
Exemple 2 :
Préparation de la 3-azocarbonvl ~ro~vl (N-m thvl)
amine hvdrochlorée
.
On dissout 17,2 g (0,1 mole) de chlorure de
l'acide 4-(~ethylamino)butyrique hydrochlore dans 350 ml de
; THF avec 12,5 g (0,11 mole) d'azoture de trimethyl silane
(Me3SiN3). On porte l'ensemble au reflux pendant
13 heures. On récupère le précipité par filtration. On le
dissout ensuite dans du chlorure de méthylene, on le flltre
et on le sèche sur Na2SO4. Apres filtration, on elimine le
chlorure de methylène.
.
Exem~le 3 :
Autre méthode ~our la ~réDaration de la 3-azo-
carbonyl propyl (N-méthvl)amine
On refroidit a 0-C une suspension de 15,4 g (0,1
mole) d'acide 4-(methyl amino)butyrique hydrochlore en
1 suspension dans l'acetone (400 ml). On additionne lente-
¦ ment 30,3 g (0,3 mole) de triéthylamine en solution dans
100 ml d'acetone. On agite le melange pendant 1 heure
supplementaire a 0 C avant d'y additionner 21,7 g
(0,2 mole) de chloroformiate d'éthyle en solution dans
100 ml d'acétone. On agite le milieu réactionnel 1 heure
durant à 0-C avant d'y introduire goutte à goutte 26 g
; ~0,4 mole~ d'azoture de sodium dans 400 ml d'eau distillee.
Apres la fin de l'addition, l'agitation est maintenue
j pendant 4 heures a 0-C. On verse ensuite le mélange dans
2 litres d'un mélange eau/glace. On récupère le solide par
filtration. Apres dissolution dans du chlorure de
:! methylene, on le seche sur sulfate de sodium. Après
filtration, on conduit l'evaporation de CHzCl2 sous
pression reduite. La 3-azocarbonylpropyl (N-methyl)amine
est obtenue avec un rendement de 85~.
- . - . :
,, . ~ . . . . ~: ,
, . ., ,~. - .
. .
WO91/0576/ 2~ 7 ~ 8 ~ PCT/FR90/0075
19
Exemple 4 :
Pre~aration de l'iniferter
, CH3
IN-C-S -
/ 11
C~(CH2)3 S
(a) Sur 5,15 g (0,05 mole) de la 3-azocarbonyl
i 10 propyl (N-methyl)amine, obtenue a l'Exemple 3, dissoute
. dans 150 ml de chloroforme, on additionne 3 ml (0,05 mole)
. de CS2 a température ambiante sous agitation. On y
, introduit ensuite 6,5 ml (5,05 g : 0,05 mole) de triethyl- -
amine. On ajoute au mélange réactionnel 6,3 g (0,05 mole)
15 d'iode dans 50 ml d'HCCl3. On laisse la reaction se
t derouler jusqu'à ce que tout l'iode soit consomme (environ
1 heure). Le produit est isolé par elimination par lavage
de l'iodure d'ammonium avec un mélange glace-eau, puis - -
séchage de la solution et évaporation du HCCl3 sous vide.
. 20 On obtient 10 g (98%) d'un produit contenant :
33,1~ C ; 4,1% H ; 7,4% O , 29,5% S et 25,8~ N.
.~ .
(b) Avec liazocarbonyl propyl (N-méthyl) amine
~G hydrochlorée obtenue à l'Exemple 2 comme substance de -
depart, on proc`de de la même manière qu'au paragraphe (a)
ci-dessus, à la différence que, dans ce cas, la triethyl-
amine est additionnee au milieu réactionnel à raison de
2 moles pour 1 mole du compose hydrochlore de départ.
Exem~les 5 a 11
Polvmerisation radicalaire du methacrvlate de methvle
(Exem~les 5 à 8) ou de n-butvle rExem~les 9 a 11). en
présence de l'iniferter de l'Exem~le 4
:, :
Mode o~eratoire aeneral
' On effectue les polymérisations dans des ballons
munis d'une agitation, qui sont scelles sous vide ou
.~' . '.
.
., ' ' ''. ' , " ' ~ ' . '~ . ' . , ~:
` ~057~g9
WO91/05767 PCT/FR90/007S~
.
maintenus sous gaz inerte (N2, argon) apres introduction
des réacti~s. Lorsque l'iniferter est soluble dans le
monomère, la polymerisation est realisée en masse ; dans le
cas contraire, le monomère est dilué par moitié avec de
5 1'acétate d'ethyle ou de butyle comme solvant. La quantité
~, désirée d'iniferter, le monomère et eventuellement le
, solvant sont introduits dans le ballon qui est ensuite
3 dégazé. La polymérisation est conduite à l'abri de la
~, lumière, en immergeant le recipient dans un bain d'huile
lO thermostate à la temperature requise, pendant le temps
; désiré. Après polymérisation, le ballon est retiré du bain
d'huile, refrigéré dans un mélange isopropanol-carboglace,
et le polymère est dilué par de l'acétate d'éthyle puis
~ précipité goutte a goutte dans de l'heptane. Le précipite
; 15 ou le produit resineux obtenu est recueilli dans un creuset
en verre fritté, lavé à l'heptane, séché a 45 C pendant
12 heures sous vide. Les resultats sont indiqués dans le
, Tableau I ci-apres.
: i
;';l
: I
:;
~,
:.i
. ~,
.,,
:..
,
',:',
-
.~''
.,
. .
... ~ .. , . . . - - . . , , ~
, . . , ,. : : .: ,: .. :
;, .. : ; . : .
. :
VO 91/OS767 2 ~ ~ 7 4 ~ 9 PCT/FR90/0075
TABLEAU I
5 ~E~ Tempé- ¦ Temps de M I ~Fonction-~
Monomere [In]xlO3 rature polym. ** I *** nalite
* C (h.) l l ****
10 5 61 60 72 41000 2,5 _
6 92 70 48 29000 1 9 _
7 MMA 70 85 24 25000 1 7 2,1
8 1 95 95 24 8000 1,4 1,9
15 9 60 95 24 lOOOO 1,5 2
MMB 8j ll ll 9000 1,4 2
100 ll .. 6000 l,3 2
, :-.... .
* [In] concentration en iniferter en mole/1 de :
monomere
** Mn : Masse moléculaire moyenne en nombre determinée
I par GPC
-*** I : indice de polydispersité (M,~/Mn)
**** determinee au moyen d'un spectrometre infrarouge a
transformee de Fourier a partir de la bande NCO ia
2320 cm1.
Exem~le 12
Svnthese de l'iniferter disulfure de N.N'-diéthvl
, N,N-bis(2-hvdroxvethvl~thiurame
. . .
CH3 CH2\ l -
N-C-S _
H0-CH2-CH2 S 2
. _ . ', "'.
26,9 g (0,33 mole) de 2-ethoxyaminoethanol dans :
350 ml de HCCl3 sont mis en presence de 20 ml (0,33 mole)
de CS2 et 33 g (0,33 mole) de triethylamine. 42,8 g
(0,33 mole) d'iode en solution dans 125 ml de chloroforme
sont alors additionnés à la solution tout en maintenant la
.. . .. . . ..
wo 9lJo;76/ ~ 3 ~ 7 ~ 8 9 Pcr/FR90too75~ -
22
temperature ~ ODC. Le milieu reactionnel est maintenu sous
agitation jusqu'à disparition complète de l'iode.
Le melange est lave à l'eau, séche, puis le
, chloroforme est évapore sous vide partiel. Un liquide
: 5 visqueux jaune est obtenu (50 g, rendement 90%).
Exem~les 13 à 15
Polvmerisation du methacrylate de méthyle en presence
de l'iniferter de l'Exem~le 12
Le mode opératoire est ldentique a celui des
Exemples 5 à ll.
Les résultats sont donnés dans le Tableau II, Mn
et I ayant la même definition que dans le Tableau I.
~ TABLEAU II
: 15 _ l
.~ Ex. [DHTD] Temps de TempératureMn I ¦% de soufre
polym. (h) C (en poids)
, 13 30 48 . 8530 000 1,9 0,42
14 60 24 9517 000 1,7 0,75
24 957 000 1,4 1,82
.~`.
DHTD] : concentration en disulfure de N,N'-diethyl
; N,N'-bis(2-hydroxyéthyl)-thiurame en mole/l de
monomere
~ 30 Exemple 16
; Préparation de polyurethane a ~artir de
~ . polymethacrylate de butyle a ~-diisocYanate
. ~
On mélange energiquement 30 g (9,1 x 102 mole)
` du composé de l'Exemple 11 et 30,3 g (6,33 x 102 mole) de:
:,.
.- ~
, . .
~ ' ' .
, ' ' ' ~ '~
''. ' , ' ' " ' . ". ' . . , ' ' ', ' ., ~ " ' I ' ' ' ` '
WO 91/05767 ;.~ n ~ 7 ~ ~ 9 PCI'/FR90/00755
23
,5'
., / 2
O=C=N-(CH2)6-N
.~ \ ...........
.! lCI -r- ~ CH2)6-N=C=O
~ O H
,~3
¦ 10 commercialise par la Sociéte BAYER sous la denomination ...
"Desmodur N", et 105 g (0,105 mole) d'un polyoxyethylène :
~-dihydroxyle de masse 1000. La température est alors
i portée a 100C pendant 2 heures. Le film.obtenu est
'5 insoluble dans la N,N-diméthylacétamide. Son spectre
~. 15 in~rarouge, entre les absorptions entre 3270 et 3325 cm~1
; dues aux vibrations des liaisons N-H et celles entre 1650
et 1740 cm~t dues aux vibrations des liaisons C=O, revèle
la presence de liaisons uréthane. Les bandes correspondant . -
aux fonctions isocyanate entre 2300 et 2320 cm-~ ont `:
q 20 totalement disparu.
,i
c Exemple ~7
.j PréDaration de Dolvuréthane à ~artir de Dolv- -
q methacrvlate de méthyle ~ ~-dihvdroxvlé
.. i On mélange énergiquement 35 g t5 x 103 molej du ::
.~ 25 polymere de l'Exemple 15 et 1,6 g (3,3 x 103 mole) de : .
.~ Desmodur N... La température du milieu réactionnel est
` portee à 80-C pendant 40 minutes. Le spectre infrarouge du ~ :
J polyuréthane obtenu est qualitativement semblable a celui
- de l'Exemple 16 en ce qui concerne les absorptions dues aux ~.
: 30 vibrations des liaisons -N-H et -C=O.
.,j ,
, 3 '
., .
' ~', ' '.
.,
.,
''.
, . . .
' " ~ . ~' . ' , . .
~::
WO91/05767 2 d ~ 7 4 g 9 PCT/FR90/00755
24
Exem~le 18
Pré~aration de l'iniferter de formule
NCO C~3-CHz
¦ 1 ~ N-C-S - _
CH3 1 ~ ~ CH2-NH- 11 -0-CH2-CH2 S
CH3 CH3 O _ 2
Sur 20,5 g (9,~ x lo2 mole) d'isophorone
diiosocyanate en solution dans du toluène anhydre dans
lequel 20 mg (3 x 105 mole) de dilaurate de dlbutylétain
ont éte introduits, on additionne lentement, sous
agitation, 30 g (9,l x lO 2 mole) du compose de l'Exemple
11, de maniere à conserver le melange réactionnel aux
environs de 40~C. Apres la fin de l'addition, le mélange
j est conserve sous agitation a cette température pendant 2
heures supplémentaires.
Après évaporation de la solution, le dosage des
fonctions isocyanates est réalise suivant la technique
., classique de la n-dibutylamine.
Le spectre infrarouge présente a 2310 cm1 la
bande caracteristique des fonctions isocyanates.
` 25 50 g (99%) du composé sor.t obtenus contenant :
47,95% C : 6,95% H : 13,15% N 23,16% 5 : 11,73% O.
.,
:' :
~ 7 ~89
!~ WO 91/05767 PCT/FR90/00755
:.
~7
Exemple 19
;. Pre~aration du Dolvmere de formule :
`~ NCO CH3-CH2
~ 5 ' \ N--C--S-Pv-
. ~ / 11
CH r CH2 NH llc O cH2 cH2 s
'j CH3 CH3 0
~' 10 ,,, ~
, .. .
CH2-CH3 NCO
:~ -S-C-N ~"1~ : -
,~. 15 S CH2-CH2-0-1CI-NH-CH2 ~r CH3 - :
3 3
Sur un melange de 2,22 g ( 10'2 mole) d'isophorone
diisocyanate, de toluène anhydre et de lO mg
~i 20 (1,5 x 105 mole) de dilaurate de dibutyletain maintenu
sous agitation à 40-C a l'abri de l'humidite de l'air, on
additionne lentement 35 g (5 x 10-3 mole) du polymère de
l'Exemple 15 en solution dans du toluene anhydre. Apres la
~ fin de l'addition, le mélange est maintenu 2 heures sous
'`1 2s agitation à 40-C. Un polymethacrylate de methyle (PMMA)
i`l ayant la formule ci-dessus, ou Pv = PMMA, est recupére par
~:3 précipitation dans de l'hexane anhydre.
Le dosage des groupements isocyanates effectué
par la technique classique avec la n-dibutylamine donne une
ij~ 30 fonctionnalité en -NCO voisine de 2.
.,
,
'.~.
,, .
,, ~
~ 1 ~
.; -. . - . ~ , ... .... . . . . . . , . ~ . , ,
~' i ' ' ' ' ' . ' ` ' ' ' " ' '' .'.'; ' . ' . ` ' ,` :` " ' ' ' ' ',: . "
: ~ . ' . . ' . ' , . ' . " . '. ' .-' . ,: ' ., ' '.. " ".. . . .