Note: Descriptions are shown in the official language in which they were submitted.
WO 91/11190 PCI/FRgl/00062
207aOfi7
~UR AUTO-INACTIVANT AVIAIRE
La présente invention concerne de nouveaux vecteurs
rétroviraux, d'origines aviaires, d'inté~ration et d'expression d'au moins un
gène hétérologue dans des cellules aviaires.
La présente invention constitue un développement des
inventions décrites dans les demandes de brevets européen EP 178 996 et
international WO 89/03877 au nom de la présente demanderesse. Il
conviendra de s'y reporter si nécessaire pour la meilleure intelligence de la
présente invention.
Par gène héterologue, on entend désigner un gène qui ne se
trouve pas dans le ~énome aviaire d'origine et de préférence qui ne se
trouve pas dans le génome d'un virus. Il peut s'agir d'un gène utile codant
pour une protéine d'intérêt industriel destinée à être obtenue par culture
cellulaire ou bien d'un gène pouvant présenter un intérêt particulier pour
l'élevage des oiseaux, notamment les poulets ou les cailles, ou encore un
gène codant pour une protéine immunogène destinée à servir de vaccin, ou
encore il peut s'agir d'un gène marqueur en particulier de résistance à un
antibiotique.
Les rétrovirus sont maintenant largement utilisés pour le
transfert de gène à cause de leur efficacité élevée en ce qui concerne à la
fois leur pénétration à travers la membrane cellulaire ee l'intégration de
leur génome dans l'ADN de la cellule hôte. Les vecteurs retroviraux dans
lesquels les séquences étrangères insérées sont transcrites directement sous
le contrôle de promoteurs internes, sont particulièrement intéressants. Ils
permettent une traduction efficace de l'ARN transcrit sous la forme d'une
protéine native. Toutefois, on ob5erve des interférences fonctionnelles
entre les promoteurs viraux et interne5.
C'-5t pourquoi on a développé ~elon la présente invention une
nouvelle génération de vecteurs rétroviraux aviaires. Ces vecteurs portent
des mutations dans leurs "longues séquences répétées" terminales
(séquences dites LTR) qui inactivent la transcription du provirus intégré
sans affecter l'expression des promoteurs internes.
WO 91/lll90 PCr/FR9ltOO~2
2 0 ~ 2
Ces vecteurs sont appelés SIN ("self inactivating"), c'est-à-dire
auto-inactivants.
L'article de Dougherty et Temin 1987, PNAS 84, 1197-1201,
décrit un vecteur auto-inactivant construit à partir du virus de dinde SNV
5 qui ne peut être amplifié que par la lignée D-17-Rev-A, laquelle en ou~re
ne produit des virions infectieux essentiellement que sur les cellules de
dinde et de chien, I'efficacité d'infection sur d'autres espèces aviaires étant
très faible.
Plus précisément, la présente invention a pour objet un
10 vecteur viral d'intégration et d'expression d'au moins un gène hétérologue
dans des cellules aviaires, constitué à partir d'un génome proviral provenant
des rétrovirus aviaires AEV et rétrovirus aviaires apparentés notamment du
type RAV ou RSV et comprenant entre deux séquences LTR aviaires
le(s)dit(s) gène(s) hétérologue(s) qui se trouve(nt) sous le contrôle de
15 promoteur(s) interne(s) hé~érologue(s), caractérisé en ce que des délétions
ou des mutations dans la LTR 3' ont été effectuées de manière à inactiver
les promoteurs viraux présents dans les LTR, ladite LTR 3' provenant des
rétrovirus RAV-O, RAV-I, RAV-2.
Les modifications de structures du génome viral apportées par
20 les vecteurs selon l'invention inactivent totalement les promoteurs viraux
présents dans les LTR des formes provirales intégrées dans les cellules
cibles du transfert.
Par promoteur interne hétérologue, on entend désigner un
promoteur qui ne se trouve pas naturellement dans le génome d'un
25 rétrovirus aviaire et que l'on a placé entre les deux 5équences LTR.
Dans un mode de réalisation 5elon l'invention, le promoteur ou
la séquence enhancer, selon les cas, de la LTR 3' du génome viraJ sont
délétés en tout ou partie. Le virus issu de ce génome introduit dans Je
génome des cellules infectées un provirus dont la LTR S' est copié sur la
30 LTR 3' selon le processus classique de synthèse de l'ADN proviral à partir
de l'ARN virionique.
Plus précisément, on effectue une délétion dans la région U3
de la LTR 3'.
WO 91/11190 PCI~FR91/00062
3 207~67
En particulier, on peut procéder à des mutations ou délétions
ponctuelles dans les boîtes CAAT et TATA ou éliminer lesdites boîtes.
Etant donné que la région U3 de la LTR 3' sert de matrlce
pour la synthèse de la région correspondante de la LTR 5' dans ~a
5 transcription inverse, toute mutation dans U3 dans la LTiR 3' apparaît dans
les deux LTR après un cycle de réplication virale. C'est pourquoi la
mutation qui détruit le promoteur de la LTR 3' donne naissance à un
provirus inactif dans les cellules infectées. Toutefois, on a observe qu'une
transcription à partir d'un promoteur interne, peut toujours avoir lieu.
Dans le cas où on utilise une LTR 3' issue d'un virus dont les
LTR sont naturellement très peu actives, il suffit alors de procéder à des
- délétions ou mutations ponctuelles pour inactiver les promoteurs viraux
présents dans les LTR. On peut citer comme LTR 3' naturellement très peu
active celle du virus RAV-0.
Les délétions dans la LTR 3' influencent non seulement
l'inactivation des vecteurs mais aussi l'efficacité du transfert dans les
cellules c'est pourquoi, selon une autre caractéristique de la présente
invention, les vecteurs portent en 5' la LTR du virus RSV (virus du sarcome
20 de Rous). Cette LTR possède une activité transcriptionnelle très élevée.
notamment plus élevée que celle des virus RAV-I et RAV-2~ Ce5
constructions améliorent la transcription du génome viral Jors de la
transfcction des cellules helper et par conséquent augmentent le nombre de
particules virales produites~
Dans les vecteurs selon l'invention, le5 gènes héterologues
(gènes de sélection ou gène utile) sont de fason appropriée sous le contrôle
de promoteurs internes hétérologues. Toutefois, dans le cas du gène de
sélection, celui-ci peut être animé directement par la LTR 5' et non pas
associé à un promoteur interne propre, le gène hétérologue utiie etant sous
30 le contrôle de promoteurs internes hétérologues.
Dans les génomes des vecteurs SIN selon l'inventlon. on peut
intégrer des unités transcriptionnelles dans lesquelles le gène hétérologue
WO 91/111g0 PCI/FR91/00062
est associé à son propre promoteur dans son génome d'origine, à titre de
promoteur interne hétérologue. Dans les cellules infectées, seuls ces
promoteurs internes seront alors fonctionnels.
Le fonctionnement correct de ces vecteurs a été vérifié et les
résultats sont présentés ci-après.
D'une part, I'expression des gènes insérés est initiée au niveau
de leurs promoteurs internes respectifs. D'autre part, dans les cellules
infectées les LTR des vecteurs deviennent inactives. Enfin, les vecteurs ne
peuvent ressortir des cellules infectées, même après infection de ces
dernières avec un virus assistant (helper) compétent.
Les vecteurs selon l'invention apportent par conséquent une
grande sécurité d'utilisation puisque dans les cellules infectées d'une part,
les LTR inactives ne peuvent altérer le fonctionnement des sequences
génétiques adjacentes au site d'insertion du provirus, et d'autre part le
provirus ne peut plus générer de virus transmissible.
Dans un mode de réalisation particulier, les vecteurs ont été
construits à partir d'élémcnts de génome issus des rétrovirus RAV-I, RAV-2
et/ou AEV en ce qui concerne la partie entre les deux LTR.
On peut citer notamment des constructions vectorielles
constituées cssentiellement à partir du génome du rétrovirus RAV-2 dans
lequel les boîtes CAAT et TATA ont été délétées dans la LTR 3' dudit
génome. Dans un mode de réalisation, le vecteur comporte comme LTR 3':
- la séquence U3 de la LTR de RAV-2 dans laquelle les boîtes
CAAT et TATA ont été déléeés, et
- les séquences R et U5 de la LTR de RAV-I.
De fason appropriée, les vecteurs selon l'invention comportent
deux gènes hétérologues, à savoir un 8ène de sélection et un gène utile.
Lorsque le vecteur e5t construit à partir du génome du
rétrovirus de l'érythroblastose aviaire (AEV), les gènes hétérologues sont
avantageusement placés en positions des oncogènes v-erbA et v-erbB~
On entend par gène de sélection un gène marqueur de
résistance notamment de résistance à une drogue analogue à un
antibiotique. On peut citer en particulier le gène hygroR de résistance à
I'hygromycine G418 et le gène néo de résistance à la néomycine.
.
WO 91/11190 PCI'/FWI/00062
2o7~o67
Bien entendu, les gènes marqueurs qui ont été cites ne le son~
qu'à titre d'exemples purement illustratifs. Il est possibJe d'utiliser tout
autre gène de résistance comme gène marqueur.
On entend par gène utile un gène codant pour une protéine
5 d'intérêt autre qu~un gène de sélection.
Dans un mode de mise en oeuvre approprié, les gènes
hétérologues sont placés sous le contrôle de promoteurs internes
hétérologues, notamment le promoteur simier SV40 ou métallothionéine
humain MTlla.
Dans un mode de mise en oeuvre des vecteurs selon
i'invention, le gène de sélection est placé sous le contrôle du promoteur
simien SV40 et le gène hétérologue utile est placé sous le contrôle du
promoteur métallothionéine humain lla (MTlla).
Dans un autre mode de mise en oeuvre, le gène de sélection
15 est animé directement par la LTR 5' et non pas associé à un promoteur
propre.
Le sens de transcription d'un gène hétérologue inséré dans le
vecteur doit être opposé à celui de la LTR dans le cas où ledit gène
hétérologue contient une séquence de contrôle de polyadénylation. Dans le
20 cas contraire, le gène hétérologue pourra être inséré dans le sens de
- transcription de la LTR, le transcrit dudit gène utilisant alors le signal
polyA fourni par la LTR 3'. Dans Je cas où le gène héterologue inséré
contient des introns, ce gène doit obligatoirement être inséré dans le sens
de transcription inverse, afin d'éviter toute interférence entre les signaux
25 de contrôle d'épissage de ce gène et ceux du génome viral.
Dans un mode de réalisation, le gene de sélection est inseré
dans le sens de transcription rétroviral et le gène utile est inséré dans le
sens opposé par rapport a celui de la transcription rétrovrrale.
On a utilisé à titre d'exemple de gène hétérologue utile le
30 gène codant pour l'histone H5 et on a montré que l'expression de H5 dans
des fibroblastes de caille ou de poulet normaux ou transformés n'a pas
affecté significativement les propriétés de croissances des cellules
transformées, mais a inhibé la prolifération des fibroblastes normaux.
WO 91/lllgO PCI/FR91/00062
6~
Selon un autre exemple, le gène hétérologue est le gène de E.
Coli codant pour la beta-galactosidase.
En particulier des vecteurs porteurs d'une LTR 3' dérivée du
virus RAV-0, naturellement dépourvue de séquences enhancer, ont été
5 construits dans lesquels la boîte CAAT est délétée:
Ces vecteurs portent les séquences suivantes de 51 en 3~:
- une LTR 5' du virus RSV,
- une séquence leader du virus RAV^l,
- un ~ène de résistance, tel que NeoR,
10 - un ~ène hétérologue d'intérêt, tel que le gène de E. Coli codant pour une
- beta-galactosidase rnunie d'un signal d'adre55age nucléaire, sous le con~rôle
du promoteur du virus SV40,
- la séquence non codante 3' et la LTR 3' du virus RAV-0 délétée de la
boîte CAAT.
15Ces vecteurs ont été te5té5 et 50nt fonctionnels et offrent une
sécurité maximum d'inactivation puisque la LTR RAV-0 en 3' a subi une
délétion dans la séquence promoteur CAAT.
Compte tenu du fait que les rétrovirus aviaires sont des virus
à ARN, la terminolo~ie virus pourra parfois dé5igner le génome proviral
20 sous forme d~ADN de même que dans certains cas le gène étranger pourra
être sous forme d'ARN, en particulier lorsqu'il est inséré dans le génome
d'un virion. Les techniques permettant de passer d'une forme ADN à 12
forme ARN et réciproquement, 50nt connues et sont la transcription et la
transcription reverse. Le virus recombinant peut être utilisé tel quel sous
25 forme de virions ARN ou de génome proviral sous forme d'ADN comportant
l'in~ertion d'un gène étranger lui aussi sous forme d'ADN et correspondant
à la transcription reverse de l'ARN du ~irUs~ peut etre intégré dans un
vecteur à ADN tel qu'un plasmide, un cosmide, ou un phage par exemple.
Pour des raisons de commodité, les constructions ont été
30 réalisées tout d'abord sur des plasmides comportant une séquence composite
d'ADN correspondant au transcrit reverse d'un vecteur rétroviral à ARN
d'un virus tel que décrit précédemment.
WO 91/111gO PCI'/FIW1/00062
20750~7
La présente invention a également pour objet un procédé de
préparation d'un vecteur selon l'invention caractérisé en ce qu~on effectue
des délétions ou des mutations dans la LTR 3' aviaire de manière à
inactiver les promoteurs viraux présents dans lesdites LTR et en ce qu'on
insère le(s)dit(s) gène(s) hétérologue(s) sous le contrôle d'un promoteur
interne hétérolo~ue ou du promoteur de la LTR S'.
Dans un mode de mise en oeuvre du procédé, on insère dans le
vecteur pDAI au site Xbal une cassette transcriptionnelle d'un gène
hétérologuc.
Par exemple, la cassette transcriptionnelle du ~ène hétéro-
logue consiste dans le vecteur pBO~ tel que représenté à la figure 6 dans
lequel on,insère ledit gène hétérolo~ue au niveau des sites de restriction du
polylinker compris entre la séquence d'initiation de transcription sous
forme du promoteur MTlla et la séquence de terminaison de transcription
et de polyadénylation dérivée du gène de l'histone HS, ladite cassette étant
encadrée par deux site Xbal permettant son isolement puis son insertion au
site Xbal unique du vecteur pDAI.
La pré-ente invention concerne en outre un procédé de
~, modification de cellules caractérisé en ce qu'on effectue une transfection
ou infection selon les cas desdites cellules avec des vecteurs selon
l'invention.
La présente invention concerne donc des cellules transfectées
;, ou infectées par les vecteurs selon l'invention qu'ils soient sous forme de
plasmide ou de virus respectivement. Il est évident que la transfection
2S primaire sera en ~énéral effectuée avec des vecteurs de type plasmidique,
,~ c'est-à-dire que le rétrovirus aviaire sera sous forme de l'ADN de son
génome mais en présence dc l'ADN d'un virus assistant de5 cellules
transfectées vont dans ce cas se transformer et libérer les virus
recombinants qui vont pouvoir transfecter d'autres cellules. Ce type de
processus permet é~alement de constituer des stocks de virus vecteurs
utilisables par la suite à la place des vecteurs plasmidiques.
~,
: 35
..
.
WO 91/11190 PCr/FR91/00062
?,Qr~6~
Les rétrovirus tels que AEV, RAV-I, RAV-2 sont défectifs pour
leur réplication. Pour se répliquer, ces virus nécessitent la présence dans la
meme cellule hôte d'un virus assistant fonctionnel comme il est connu de
l'homme de l'art.
La présente invention a également pour objet un procédé de
modification de cellules caractérisé en ce qu'on effectue une co-infection
ou co-transfection selon les cas avec un virus assistant qui comporte les
gènes assurant la réplkation dudit vecteur.
Les cellules modifiées selon l'invention peuvent être diverses
mais sont de préférençe des cellules aviaires, de type hématopoiétique,
germinale ou de type fibroblastique.
Les cellules préférées pour la mise en oeuvre des vecteurs de
I'invention sont les fibroblastes d'embryon de poulet ou de caille. Toutefois
les vecteurs selon l'invention permettent de modifier des cellules de dinde,
de canard et d'autres oiseaux.
Enfin, I'invention concerne le procédé de préparation d'un
protéine déterminée dans lequel on cultive les cellules modifiées par un
vecteur selon l'invention dans lequel un gène étranger code pour ladite
protéine et en ce que l'on récupère la protéine de la culture cellulaire.
D'autres avantages et caractéristiques de la présente invention
apparaîtront à la lumière de la description détaillée d'un exemple de
réalisation donné à titre purement illustratif et comme modèle pour
I'intégration et l'expression d'un gène hétérologue, en utilisant le gène de
I'histone H5.
La description qui va suivre est faite en référence aux figures
I à 8.
~`
..
~, ;~..
.
W O 91/llt90 PCT/FR91/00062
20750~7
Fi~ure 1 schema illustrant le transfert de la délétlon de la
3'LTR a la S'LTR (1) Un ~octeur retrotrlrai delot~ tans le
promotour de 3'LTR t portant un g~no otrang-r (~) a~oo son propre
promoteur (P), ost transfecte dans dos cellules helper ~2) Apre~
S m tegratior, l'ADN proriral est transcrit a partir tu promoteur de
5'LTR, et les transcrlts trlraux contenant la deletlon dans la
realon U3 sont encapsid~J dans dos part~culos vlralo6
snfectleuse~ (3) Dan~ des ccllules mfectees par ce~ partlculcs
v rale~ dépourvuos de helper, l'ARN viral est transcrit par
transcrlptlon m~rerse dans une moleculke d'ADN double-brln
montrane une rogion U3 dol~t~o dan~ los doux LTR A m sl, tans ces
cellules, la transcriptlon trlralo est a~olie et soule la
transcr~ption a partir du pro~ot-us int-rne peut avoir lieu Le
trlangle m t~qu- la t~lotlon; ca-- bachuro- rogion U3, case
po mt~ o rogion US, caJo clairo rogion R
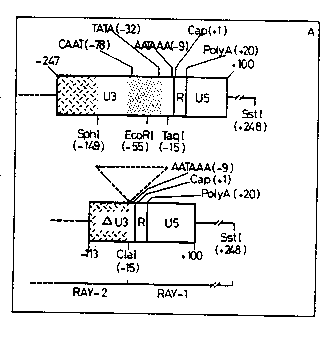
Fiogs~ ! Stsucture de LTR normalos (en ~aut) et deletées (en
as~ La iocaii~atlon tes slgnaux de rogulatlon transcrlptlonneile
est ~ndlqu~o L J ZOn-J hachur-o ot po m till-- dans la roglon U3
~ 20 reprosentont reJpeCtlvem nt les reg~ons tu enhancor et du
; p~omotour La rogion U3 teleteo ~provonant to l'ADN provir~1
RA~-2) a oto la~o, par los llD~ers Clal, aux reg~ons R ot US de la
LTR te RAV-1 L- trlanglo po~nt~llo ~ntiquo l'~t-ntuo do la
et~on~ (~) Struoturo doo voctouro rotrov~raux. Dan~ pT2~3',
ter~vo d'AEV, le gono to ro~stanoo a la ~ooryo~no (3001 ost
transcrlt dpu~s la LTR v~ralo, alors qu- tans pDAl, ~1 ost
~ranscr~t a partir du promotsur to SV40 m t-rno (SV) pDAl, doslve
essontlellomont to RAV-~, contlont un- reglon U3 doleteo dan~ 13
;~'LTR pDA~Y et pDA~S ont ete derlv~s to pDAl on msérant
respoct~vement les genes nph (reslstanco a l'hygromyc m e) e~ ~i
~os ~loohos ~ntlqu-nt la tlroct~on transor~ptlonnolle dos
~f'erents genes Dans pDA~Y, 13 r~g~on codant pour hph, llée ~u
W O 91/11190 PCT/FR91/00062
2a~'6~ 1 o
slte de polyadenylatlon du gene de la thym~d m e kina~e (Tk), a ete
placée SOUQ le contrôle du promoteur de SV40. Dans pDA~5, le
promo~eur de la mctal1Othlonelno humalno MT-IIA (MT) a eté Ut:il3e
pour transcrlre le gene ~5 contenant son propre slgnal de
polyadenylatlon (Pol HS). Ca~es hachuree. clalre et po~nt;llee.
reJpectl~ement LTR de AEV, RAV-2 ot RAV-1; SD et SA:
r-~p-ctlve~ nt donn-ur t acoept-ur d'~p~Jage; ~U3; r~g~on U3
déletee; ~o: ~hol; ~: a~al; C:Clal. L'eohelle (en paires de
kilobases:kb) est lndlquée en bas.
F~ e 3 .4nalyse par Southorn blott m g de cellules OT6 lnrectees
par DAH5. 15 ~g d'ADN, l~olé de cellule~ lnfecte-~ (bande~ 5 et ~!
et non 1~fectees (ba~de~ 4 et 6), ont ete digereq par ~bal (bandes
4 et ~) ou ~hol ~bandes t; et 1). Apre~ electrophore~e et ;ransrert
sur n~trocellulo~e, la plage de tran~fert ("blot") a ete hybrldee
a~cc une sonde de H5 opeciflque. Leo quant~té de fragment de
reotrictlon oorre~pontant a 10, 1 et 0,1 oopio~ de gene H5 par
genome (roopectl~rent bante~ 1, 2 ot 3) ¢nt ~t~ tralteeJ en
: 20 parallele. La~bda ADN dig~r~ par EooRI ot ~intIII a ~t~ utilise
coume marqueur dc taille. Une repr~entation ~ch~m~tlque de la
.~ o~rte de restriction de DA~5 est montre au ~a~ de la figure.
Fi~.~ç ~ Eo~al de protectlon par la nuoleaoe S1 de l'ARN
cytop1asrlque transorlt dans des cellulos CT6. 20 ug d'ARN
. cytopl~8rique, i5010 de oellules 30n infeotoes (bande l) et de
cellulos mrocteos par DA~5 (bandos 2 et 53, ont eto bybrl~es a~ec
la sonde do H5 DanJ les bandOJ 3 ot 4. los oollul-~ ont ~te
trait~os rosp-ctlvement avec 50 mM et 100 ~M de Z~Cl~, ~vant
l'~solement do l'ARN. Dan- la ~and- 5, d-- o~llul-s ~n~eot~es ont
ete malntenues pendant 50 generatlons sans ~eleot~on par G4le
avan~ l'extrac:ion. Un fragment de 1~25 p~ isole de pMTX5 ee
represontant la sonde de H5 ~bando 6) a protoge ~15 nuoleotldes
apres d~gostlon Sl Les chlftres dans la marge gauche
representent les tailles, en nucleotldes, des tragmenes utlllses
oomme marqueurs de poids moleculaire
WO 91/11190 PCI/FR91/00062
11
207~0~7
Fi~ure 5: Détection par Western blotting de H5 dans des cellules QT6
infectées. Les protéines nucléaires, isolées de cellules QT6 infectées par
DAH5 (bandes 1, 2 et 3) ou de cellules QT6 non infectées (bandes 4, 5 et 6),
ont é~é soumises à une électrophorèse sur gel de polyacrylamide-SDS et
transférées sur nitrocellulose. H5 a été détectée après incubation avec des
anticorps anti-H5 et la protéines A 1. Les cellules ont été traitées avec
100 mM de ZnC12 (bandes 2 et 5). Les bandes 7, 8 et 9 représentent
l'équivàlent de 0,5 llg, 1 IJ8 et 2 llg de HS purifiée, et les bandes 10, 11 et
12 montrent la quantité de H5 présente tans 5.106, 10.106 es 20.106
érythrocytes de poulet.
FiRure 6: représente p~OL. Ce plasmide a été construit à partir de la
cassette de transcription H5 contenant le promoteur MTIIA, la séquence
codante de H5 et la séquence polyA. La séquence codante de H5 a été
éliminée par digestion EcoRI + Smal et rcmplacée par un oli~onucléotide
de synthèse présente figure 6. on peut cnvisagcr de remplacer le promoteur
MTIIA par un autre promoteur.
Fi~ure 7: Structure des vecteurs rétrovirus OVA. Les triangles noirs
indiquent les positions des promoteurs de transcription internc, tandis que
les triangles blancs indiquent la position dcs délétions U3. La présence ou
I'absence d'un élément enhancer, d'une boîte CAAT et d'une boîte TATA
- dans chaque LTR aval est indiquée à droite.
Fi~ure 8: représente la construction des vecteurs du type OVA.
EXEMPLE 1.
Le transfert et l'expression de l'histone H5 ont été effectués
dar~ des fibroblastes aviaires normaux et transformée par un vccteur
rétroviral SIN. Le vecteur, appelé pDAH5, a été obtenu par mutation dans
Ia LTR 3' en éliminant les bo;tes CAAT et TATA. La séquence codant pour
H5 insérée dans pDAHS a été contr~lée par le promoteur de métallo-
thionéine MT-IIA humaihe.
L'infection de cellules de caille QT6 par lc virus DAH5 a
conduit à l'intégration d'une copie de gène H5 étranger par génome et à la
formation de transcrits d'ARNm initiés correctement et de protéine H5
Cependant, I'expression de la séquence H5 exoeène était constitutive et
non inductible, par ions Zn . Le taux de H5 dans les cellules QT6 était
équivalent de cclui d'un érythrocyte de poulet mature.
WO 91/11190 PCI/FR91/00062
5~ 12
L'expression de H5 dans des cellules QT6 transformées
infectées par DAH5 ou des fibroblastes d'embryon de poulet transformés
par AEV-ES4 a eu seulement de légers effets sur la vitesse de croissance e~
n'a pas inhibé la réplication cellulaire. Inversement, I'expression de H5 dans
5 des fibroblastes de caille et de poulet normaux a été spectaculaire: les
cellules ont acquis l'aspect de fibroblastes sénescents, elles poussaient très
Ientement et les noyaux semblaient compacts, elles étaient souvent
dépourvues de cytoplasme.
L'analyse de la modification post-traductionnelle de H5 dans
10 les cellules QT6 a montré qu'une phosphorylation peut être impliquée dans
Ies effets différentiels de la protéine dans des cellules normales e~
transf ormées.
I - MATERIEL ET METHODES
15 1. Construction d'un vecteur rétroviral pour le transfert et l'expression de
la séquence codante pour HS
Le principe des vecteurs SIN est illustré sur la figure 1.
La construction du vecteur pTXN3' a été publiée récemment (3
et WO 89/03877). Le génome de pDAI est dérivé du génome du virus
! 20 associé au sarcome de Rous-2 (RAV-2) après modification de la LTR 3'.
On a construit une LTR aviaire mutée par délétion de la
région U3 isolée de la LTR du virus de la leucose aviaire RAV-2 entre les
nucléotides -149 et -15 (en regard du site cap transcriptionnel: nucléotide
+1). C'est-à-dire que la séquence en aval du site Sphl dans U3 a été
25 supprimée. Cette délétion a éliminé les boîtes CAAT et TATA mais a laissé
intact la région de enhancer située en amont de la position -149 (6,16, 22J.
La région U3 de RAV-2 délétée a ensuite été liée aux région5 R et U5
isolées de la LTR de RAV-I. C'est-à-dire que la séquence dé~étee de U3 a
été remplacée par le fragment Taql-Sstl dérivé de la LTR de RAV-I. Ce
30 fragment contient esseritiellement les séquences R et U5 et 14 nucleotides
résiduels de U3. Le linker Clal a été inséré à la jonction des fragments
dérivés de RAV-I et RAV-2. La LTR hybride présente donc une délétion de
134 nucléotides qui a éliminé les boftes CAAT et TATA. La LTR délétée
ainsi reconstituée a été utilisée pour remplacer la LTR 3' normale dans le
35 vecteur pDAI. Le vecteur pDAl a été construit à partir de RAV-2 et il
porte une cassette transcriptionnelle contenant le gène néo iié au
WO 91/11190 PCI/Fl~91/00062
13 2~7aO67
-
promoteur précoce de SV40 inséré dans le meme sens de transcription de la
transcription viraJe (fi~ure 3). Plus précisément, le fragmen Xho I interne
du ~énome de RAV-2 a été éliminé et remplacé par une cassette contenan~
dans l'ordre des séquences ga8 portant ainsi Xbal, le enhancer et le
promoteur précoce du virus simien SV40 et la séquence codant pour le gène
de la néomycine phosphotransférase bactérienne (néo) (2S).
Comme virus témoin, on a construit le ~énome pDAHY dérivé
de pDAI en insérant une cassette contenant la séquence codant pour
0 I~hy~romycine ~ phosphotransférase (hph~ entre le promoteur précoce de
SV40 et le si~nal de polyadénylation de ~SV Tk. Cette cassette de
transcription a été insérée dans le sens opposé par rapport au gène néo.
Plus précisément, le vecteur pDAHY a été dérivé de pDAI en insérant au
site Xbal une cassette contenant la séquence codant pour l'hy~romycine ~
phosphotransférase bactérienne (hph) ( I l ). Ce ~ène a été mis 50US le
contrôle du enhancer et du promoteur précoce de SV40. Le signal de
polyadénylation du gène de la thymidine kinase (Tk) de l'herpes virus (HSV)
a été ajouté à l'extrémité 3'.
Comme contrôle supplémentaire, le virus pTXN3', un vecteur
qui exprime le gène néo de la LTR virale, a été utilisé en parallèle.
Le génome du vecteur pDAHS a été construit à partir de pDAI
` en insérant une cassette de transcription contenant la séquence codant pour
`1 HS lié au promoteur du 8ène de la métallothionéine MT-IIA humaine. Dans
1 cette construction, la séquence HS fournit son propre signal de poly-
- 25 adénylation et elle a été insérée en direction anti-sens par rapport à la
. transcription rétrovirale. Plus précisément, le ~énome pDAH5 a étéconstruit à partir de pDAI en insérant à Xbal une cassette contenant la
séquence codant pour HS avec son propre signal de polyadénylation lié au
promoteur MT-IIA (13~. L'unité de transcription de H5 en tant que cassette
de transcription du 8ène hph a été inséré dans le sens opposé par rapport à
la transcription commandée par la LTR.
Tous ces génomes rétroviraux ont été transfectés dans la
li~née de cellules helper G qui libéraient uniquement des vecteurs
rétroviraux dépourvus de virus assistants (helper free) ~24). Le ~itre du virus
DAH5 dépourvu d'assistant (helper free) était de 100 rfu/ml (unité formant
résistance/ml) comme déterminé par sa capacité d'induire la résistance à
G4 18 chez les cellules de caille QT6 réceptrices.
W O 91/11190 PCT/FR91/000~2
6'~ 14
2. Colluloc Le~ flbroblastes d'em~ryon de poulet t OE F) ont e~e
prépares et cultives comme décsit precedemment (9). Les
sibroblastes d'em~ryon de callle ~ OE F) ont ete prepares et
culti~ec dan~ leo m~moo oonditlonc. Loo cellule~ de poulot
~EV-ES4, let fibroblaoteo de caille CT6 ~l7) et leo cellule~
helper de caille G (~4) ont ete cultives dans le milieu de culture
CEF Los cellules AEY-ES4 éta~ent derlvees de OE F lntectes par le
vlrUs AE~-ES4 (9); oeo oellules ont éte malntenues en culture
penaant ~lusleur~ molc avant d'etre utlliseeo La select~on pour
les colonles de cellules neomyc m e-recl~tante~ a ete ~alte en
presence ae G~18 (Gibco) a une concentratlon de 200 ~g/mi
;
3. Tr~ f-otio~ t i~lfootio~. Los cellules helper G ont
ete transfectees par la methode du polybrene-dimethyl sulfoxyde
(14). Lcc sucponslons ~lraleo ont ote rooueillieo pondant des
p rlodeJ de 12 houroo ~ part~r doo oolluloo du productour
rouc-confluentec (3 ml par boite de lO0 mm), pul~ centrlfugee~
pendant 15 m m ~ 2500 9 et filtree~ cur dec filtrec li~nt
,albi~ment les protelnes (~ poreI. Lo~ ceilulos. ensomocees d
ralson do 5 105 ooiluloo par boito do 60 mm. ont ete lnfooteeJ
avec l ml de Jolutlon ~rlrale pendant dou:e heure~, pUl~
sclectionnoe~ tan~ G4l~ Le-~ colonies reJlstantes ont eté evaluees
;0 a 15 ~ours ~pres l' m sootlon
4. I~d~otio~ p~r l- z~o d~ pro-ot-ur do ~T~ .d~ loe
O-11Q1-e i~f-ot~--. L-J oellul-- ont ~t~ lnou~-o~ pondant 24 h
dans lo mlllou de culturo CEF ~upplomonee a~teC so ~M ou 100 ~M de
_3Cl2 (Yer~k, Lo ZnCl~ a ete proparo JOUS formo de Jolutlon de
rosor-e 10 ~Y dans un ta~pcn s~lsn ~30tonlquo et stocko ~ ~4'C
5. Cl~otiquo do oroios~noo doe oolluloa i~fooeOoa. Le~
cellule~ ont eee ensemencee~ a ra~on de 5 105 cellule par boit.e
WO 91/11190 PCr/FR91/00062
207~0~7
de 60 mm et le mll~eu a en~ulee ete change chaque ~our. A chaque
délal, u~e ou trols boite~ par type cellul~ire ont ete
trypslnlsées et le~ ceilulos ont eté decomptee~.
6. ~ULa1~JO d'~DN ot d'~N . Un ~DN de haut pold~ moléeulaire
ete extrait commo décrit precedemment (10). ApreQ digestion de 15
~g par de~ enzym~ de ~t-e~trlctlon approprlee~, le~ }ragment3 ont
e~e ~paree par eleotrphore~e ~ur do~ gel~ d'agaro~e a 0,8%
L'~DN a en~ulte eee tran~fere eur de~ filtre~ en nitrocellulo~e et
hybrlde avec une ~onde marquée amorcee au hasard. Les fi1treS ont
ete f m aiemont lavo~ dan~ do~ condltlons extrem~men~ rlgoureuses
expoae~ a une pell~cule ~odak-~-Omat. La ~onde ut~ ee éta
un fragment EcoRI-~mnl derlve de pHTH5
L'ARN cellulalre total a ete purlfie apres lyse de~ cellules
dans un tampon oontenant 1 m~ de Dithlotreltol et 0,2~ de Nom det
P40 e~entiellorent com~e decrlt procedommont ~10). De~
exporienco~ dc cartographio S1 o~t eto offoctuoo~ conformement
Fa~aloro et al. (~). Un fragm nt d- ro~trlctlon Bam~I-P~tl
contonant la ~equonce codant pour ~5 a et~ i~ole a partlr de pMTH5
et ~arque ~ l extremite 5' par ~r 32Pl~TP ct la polynucléoelde
: ~ina~e. La sonde a etc coprecipitéo a~eo 10 ~g d' M N total e~
rerl6e en ~u~pon6~0n dans le tampon d'hybrldatlon Sl contenant 40
nM de Pipes lpip~raz m e N-N' bl~(ac~de 2-ethane ~ulfo m que. pH
6,4)r 400 mff de NaCl, l m~ d'EDT~] L'hybrldatlon ~ ete effectllee
pend~nt 6-9 b ~ 56-C, puis les hybride6 ont ete digeerès avec 900 U
do nuoleaso Sl par mi ao tampon do dlgostlon (~0 m~ d'acetate ae
~od~um p~ 4,5, 250 m~ do NaC1, 2 mM do Z~S04) p~ndant 30 mln ~
31'~. L'ADN reslJtant ~ la nucl~a-- S1 a te~ f malement pas~e dans
un gel do polyaorylamldo ~ 6~ oe expo~e a uno pelliculo
Yodak-~-Omat. L'ident~te de~ fragments protoge~ a ete detèrm~nee
par comlgratlon avec des marqueurs de poids molécula~re approprle
7. Tr-~of-rt ~l-otrophor~tiqu- d-- prot~ o our p~pior
do nitrooolluloJo. Los hlstonos totalos one ote oxeralte~ ~vec
H~S04 Qes noyaux purlfies ~19). Lo~ ex~ral~s rassembles on; e~e
W O 91/11190 ~ t~ 6 PCT/FR9l/00062
dlalyses et lyophil~es. Les hl~tones ont ete analysee~ p~r
electrophorése sur gel dc polyacrylamide-SD~ (dodecyl Qulfat~ de
sodlum) (l5). L'eloctrtranstert du gei de poiyacrylam~de sur
paplor de n~trocoiluiose a ete effoctue pondant 1 heure ~ 24 v et
les filtres ont eté f malement lncub~ avoc des antlcorps antl-H5
et la protélne A marqu~o au 125I. 1-10.105 spm (Amer~ham Corp.)
La productlon d'antlcorp~ chez tes lap ms lmmu m 3es par ~5 a ete
rapportoo prooodomm nt (18) L-~ anticorpJ antl-~S ont ~t~
pur~fies lmmuno~p~clfiquoment par chromatographie d' affi~lte avec
H5 con~uguee au Sepharosc 4~. Lcur Immunoréactlvite ~ ete
controlee par radlolmmunodosage en phase soiide (19).
8- I~om nofluore~o-noa. Les cellule~ ont éte cultlvees sur de~
lame~ L~b Tek ~i}es labora~or~es), puls fixees tans l ~thanol
aDSO1U SU1V1 d acctono a temperature am~lante. Apres lava~e avec
PES-PMS~ [io mM de ta2pon de pho~phato do sodlum, p~ 7.4, 0.l5 M
de NaCl, 0.1 m~ de ph~yl mèthyl sulphonyl fluorure], les cellules
ont ete lncuD~es pendant 30 m~n a 4-C a~ec de~ anticorps antl-H5
purifle~ par aff m lt~. D-J antloorp~ anti-lapln marquoJ a la
fluor-soolne ont on~ult- ote a3OutoJ ot loJ o-llul-J oolorooJ ont
ete exam m ee~ ~u mlcroscope Olympu~ equipe t'une ~pl-illum matlon.
De~ phot~micrographie~ ont ete prl~e~ avec une oamcra Olympus et
une pelllcuie couleur Kodak. ~e~ temp~ d'expo~t~on oe de deve-
ioppe nt oon~tants ont eto utlll~eJ pour l'lmpro~Jlon.
9. ~u~ d- pho~phoryl~tio~ d- ln prot~ino ~5. Les
collulea ont oto ancuDeeJ pentant 4 h tanJ un mlllou es~en~le
~n~mal x-mpt do PhOJPhat~, PU~ Ont et~ mart~uees pentant
1 h tan~ le m~me m~liou par ~ mCi de H3P04 m~rqu~ au 32p ~Amer~h~m
Corp 1 Le~ hlJtonos rlches en ly~nc ont eto xtra~teJ avec de
l'~cate perchiorlche ~ 5~ e~ soumises ~ une eloctrophore~e comme
decrlt plu~ haut. La pho5phorylat~0n de H5 a éte détectee apres
r.ran~tcrt tu qe1 sur paplcr de nltrocellulo~e e~ autorad~ograp~1e
de la plaae de transrere ("blot.'l. La mome place de eransrert
~'blot") a ete ut~llsee pour la detectlon de la protelne H5 avec
!~n antlcorps ant~-~5 et ur. con~ugue prote m e A-peroxydase de
-
W O 91/11190 PCT/FR91/00062
77
2075~b7
ramfort ~mcr~bam) ~5 ~ ete rlnalement ~lsuali~cc par lncuba~lon
dans 10 m~ de Trls, p~ 7,1, 0,0~5% de H202, 0,04% de
4-amlnoantlpyrlne ~sigma! et 0.2~ de phenol.
ll - RESULTATS
ulal~-- d- l'~ t d- l'lJU~ ir~ d~o l-e a-lluloe
cnt6 i~fo~t~-r p~r OU~lS. Des cellules CT6, une lignec de
fibro~lastes de caille transformes chimiquemcnt (17), ont eté
:. 10 lnsectee~ par une reserve dc vlru6 DA~5 depour~u d ~ssistant ("helper free"~
pll6 seleotrlonnees par G418 et amplifioes dan~ des cultures
polyclonales. Ces cellules n ont pa~ li'oere de v1rus et le~
surnageants des cultures surinfectees par un ~lrus assistant (helper)
normai etalent lncapa~los de transmettre la reslstance ~ G41~.
Etant donne qu aucun vlru~ n a pu tre retrouve. nous ooncluons
que dans les cellules infectoe~ par D~S, le pro~irus mtegre e~t
inactif du point de ~ue de la transoription. Pour determiner la
: presenoo, l'or p n~satlon et le nombre de coples du vecteur d'ADN
ntrodult, un ~DN de h~ut polds l~oulairo pro~-nant de cellules
CT6 mfoctoes ou non rnroctees a ~te pr~pare lS ~g d'ADN ont ete
digeere~ par des enzymes do restriction et ont ete 0Xam~30S par la
: metnode du Soutnern blottlng avec un- sonde oont-nant la reglon
codant pour ~5 ~flg 3! L'-nzyme de rostrlotion ~hol ooupe aeux
fols ~ l'inter~our iu vecteur et la prosonoo d un fragment de 4.6
: 25 kiloka~s (kb) o~t~par consequont caracter~stlque des genes
~ntacts ~5 et noo. Le fraament attendu do 4.6 kb a ete deteote
tanJ leJ oellule~ infootoos ~bando ~), ma~s 11 n'~talt pa~ pr~ent
dans l'ADN do~ oelluleJ non lnfoct~e5 ~b~nde 6).Pour teJter plu~
'
W O 91/11190 PCT/FR91/00062
~ 18
preo~sement la presence d un fragment MTII-H5 lntact, l'AON de
cellules GT6 lnfectees et non lnfectee~ a eté coupé par ~bal.
Comme prevu. un rragment de 2,1 kb a eee detecte dans le6 cellules
lnfectee~ lbande 5) et n a pa~ ete detecte dans les cellules no~
lnfectées (bande 4) Ce~ donnees montren~ que les provlrus ln~éres
n ont paR subl de rearrangements majeur6 et presentalent la
structure attendue. Le~ rragment~ de haut po~ds molecuia~re
: ob~er~es dans les ccllule~ mfectce~ et non m focteos
correspondent au gene H5 endogane. A p rtlr des ~ntensltes ~es
bandes à 2,1 et 9,5 kb dans les cellule~ i~fectees, on a
estlme qu un gene ~5 exogene s'etalt lntegre par genome
ceilulalre Pour conflrmer cette ostamat~on, on a comparé
l lntcnslte de la oande de 2,1 kb a ~elle tonnee par une ~uantlt~
; ^onnue de sequenc~s H5. 15 ~g t'ADN ganom~que avlalre repré~entent
o.106 genomes av alres. Les bandos 1. 2 ee 3 cont~ennent
resp~ctlvement o 105. 6.106 et 6.107 cop~es de plasmlde p~Tho
dl~ere par EcoRI. Sl on compare l'intonslte d'hybrldatlon du
fraymcnt de 0,3 kb de la bando 2 au fragment de 2.1 kb de la bande
5, nous con~rmon~ qu'une COple tU prOVlrU~ 3A~S a ete mseree par
genome
Pour determin~r le8 t~ux de transcr~ts specifi~ues du gene Y5
dans des celluies CT6 mrec~ees par DAH5 e~ non mrectees~ ~une
anaiyse quantltatl~e avec la nuolcaJe Sl a ete utlllsee frlg 4)
L~ ~cnde d' ~DN ct.~lt un fragment 5~m~I-Pstl de 1026 pb ~sole du
plasn~de pMT~5. Ce Itragment contient le promoteur te MT-;;A ee lk
nucl~otmde~ de la ~equence codant pour H5. Lo~ tran~crlts ~n1t1es
au promoteur do MT-II~ do~ont otro protogcs aur uno longuour de
316 pb (l3~ Co~mo prevu, un ~ragmont proteqe do pros do 315
nuclèat~te6 a ete tetecte avec l'ARN te cellules OT6 ~ntec~eec par
~AH5 (bandes ~ a 5~ Un rracment protege de la mo~me tallle a ete
detecte dans aes collulos OT6 lnrocteoJ par DAH5 ma m~onu-s en
culture pend~nt 50 aeneratlon6 sanr select~on p~r G41~ (bande 5~
Aucun fr3ament protege n a e~e detectee avoc l ARN de cellulec 3TG
non msec~-e~ (bande 1~. Le promoteur de NT-I;A huma~ne peu~ e~re
,ndu~ pas des me~ m l~ur~ ~el~ que 7n~ 3) Po~ es~e:
W O 91/11190 PCT/FR91/00062
20750b`7
19
l'expreJslon reaulee du gene HS ~ partlr du promoteur lnterne, des
OT6 infectees ont été exposees pendant 24 h a SO ~M (bande 3) ou
100 ~M de ZnCl~ (bante 4) avan~ lsolement de l'ARN. La quan~lte
d ARNm de ~5 n'a pas augmente significatlvement par rapport
l'A~N des celluies non ~ntectees (bande 2!. On peut en
conclure que la tranJcript~on de la sequencO cod~nt pour HS a éte
efficacement et corroctoment i m tiée dans les cellule~ OT6 et que
l'addition de Zn~ n'a pas augmonté le degre ie transcriptlon. De
plus la ~equence codant pour ~5 une roi~ tran~reree tan~ les
cellules OT6 eealt exprmmee de facon stable pondant au ~olns 50
~eneratlons de culture~ libéree~ de la ~electlon par G418
2. EspreJ~ion do 1~ prot~in~ ~5 dnn~ d~s fibrobla~tes OT6
infe~t~ pnr 1- ir~J D ~ 5. La JyntheJe de l'hl~tone H5 a e~e
~e~uree dan~ de~ cellule~ CT6 lnfectées par DA~S et non ln~ectecs
Le~ hlstones totales ont été extraltes de noyaux purifies lsolés
des cellule~ re~poctivo~. Los prote m o~ ont etee analy~eos par
eloctrophoreJo Jur gol de polyaorylamido, tranJfereoJ sur
nitrocellulo~e et la pro~ence de ~5 a ete detectee apres
~ncubat~on te la plage de transfert ("blot") avec un antlcorps
antl-~5 et la prote m e A-l~SI ~fig. S). Cot antlcorps n a tonne
aucun slonal lor~qu'il a ete to~te oontre 10J hia~one~ to~aies te
cellule~ OT6 non m foctee~ tralteos aroc 0 ~bande 6), 50 uM ~bande
Si ou 100 ~M do ~nC12 (bande 4) Un slgDal nettement lsible a~ec
la me~e ~ob~l~to de ~S pu~1f~ee (bandeJ 7, ~, 9) ou de ~S
d'hi~toneJ totales d erythrocytes de poulet (bandes 10. !1. '2). 3
eto detocto avoc los hlstonos totaloJ do 5,106 oollulos ~6
l~octoes par ~5 tra~too~ avoc 100 U~ do ZnCl2 (bante 1). 50 uM
de ZnCl~ (bando 2~ ou pas de ZnC12 (bando 3). Pour ~onter de
: quant~fler la productlon de H5 dans dos cellules OT6 infoctee~,
tes quantltes connuos de H5 purltlee. 0,5 ug Ibande 7). 1 ~g
lcande ~ et ~ ua ~bando 91, ou d'hlstono~ totalos extra~tes de
- lQ6 (bande l0). l0 l06 (bande ll~ ou ~0.l06 ~bande 12!
er~throcytes do poulets adultes ont e~e soum~sos a une
eiectro,D~ore~o sur ie mome gel. A partlr to coq roouitats, on
peut conciure que la ouant~te de H5 pre~onte dans 5 10
- w o gl/lllgo ~ Q ~ 20 PCT/FR9l/00062
cellule- OT~ lntectee~ p~r D~H5 est eqUl~alente A la au~ntlte dc
H5 produlte par 5.10 erythroc~tes de poulets adultec et que ie
n a pas au~men~e le ~egre de productlon de ~5. La
io~ailiatlsn nuciealrs de H5 dans le3 cellules 3T6 lntec~oes ? r
DA~5 a ete contlrmee par l~munofluorescence.
3. Propri~t~r d~a oollul~a 0~6 ~t d~o f ibrobla~t~i
trnnafor~e pnr ~IEr-ES~ ~spri ~nt 1~ prot~ino ~5. Des
cultures de OT6 lnrecteeo par DA~5 ont doveloppe de grands ro~ers
~n~es contenant de~ cellule~ phénotyplquement non dlfferente~ i^
cellules 0~6 non lntectées ou de cellules lnfeceeec par le vlru-
-.emol~ e ia meme f~corm des .lbroblastes de poulet
~rans~ormes par ie retrovlrus a~lalre AEV-ES4, ont ete lnfec~es
par 3AffS ~es celP:les cn~ developpe deo foyer~ ne pou~ant ~re
dlstlr~gue~ de ceux de cellules lnfectees par TgN3' et fl3 n ont
pas pu etreamplltleos~non montre~. ~our ox~m~ner de racon plus
approrondle sl la protolne H~ pouvalt a~olr un cer~aln effe~ sur
le~ cellules tran~formees, on a comçare la clnetique de
roljsance de sellules oT6 non mfestee a celle de OT6 lnfestees
par DA~5 ou p~r ~N3'. Les ~rols typos collulalros ont e~e
~nsemences lndl~duellemon~ ~ la momo donslte dans des boi~e~ ce
ju mm et -ul:lves dan~ les meme condltlons. Ensult-, ~ dlfferen~r
del~ls, i~ cellulos ont et~ tryps1nisees et decomptees
On peut voir que les cellules QT6 infectées par DAH5 ont présen~é une
crolssance piu~ lente que lç~ coilule~ ~T6 non ~nfeotoes ou
lnfeotoos pa~ TDN3' Los temp3 do gonorat~on ont pu ~tre es~me
_0 h pour e3 ceiiuls~ OT~ ~emo1ns et a '5 h pour ioC coilules CS~
?rOdUlSant A protelne H5 On peut dono conciurs que
i expre~s:-r. ie i~ prote~ne H ne semDle ~o1r que peu d effe~ ~u:
13 _role~anoe des ^ellule~ 0~5 et le5 fibroblaste3 tr n3~0rmes p3r
A~V-ES~
4. Espre~io~ et effets de 1~ protAine ~5 daD~ des
fibro~lasto# nor us 3es ~ibroblastes ~'embr70n de pouler
W O 91/11190 PCT/FR9l/00062
207aO~'7
( OE F) et des fibroblastes d'embryon de caille (OEF) ont ete
lnfectes soit par le vlrus DA}I5 SOlt pas les vlrus temolns, T ~ 3'
ou DA~Y 31X ~ours apros selectlon dans un mlileu contenant G~i6
des grands clonos donses ae flbroblastes ont ste o~serves aans ies
_ultures de celiules de ca~lle et de poulet lnfectees par cnaque
VlsUS temo m Dans toutes les cultures infectées
par DA~5 seulcment quelques petlts agre~ats de cellules dlspersees
ont ete oDJerveJ. Ces cellules poussaient très
lentement et elle n'ont pas pu etre effioacemont replquee-, en
consequence, elles n'ont pas pu etre amplifiees De plus, 1~
piupart ae ces ceilulos som~la~ene malade~ et presenealent une
morphoioale apiat~e eeo~l~e ~dont quo a cell~ de flbro~ia~tes
_enescents Les memes o~servat~ons ont ete faltes d~ns SlX
exper ences md~pendantos en utilisant des fibroblastes
secondalres de poulet ou de ca~lle Etant donne que les ceiiuies
~nteceeos par le vlrus tomoln DA~Y sombla~ont aUJs~ sa~nes que aes
fibroDlastes normaux, l'offot obJcr~o avec le vlrus D~5 est le
plus probablemont d~ a l'expre~ion do la sequence codant pour ~5
Conm~ ces collulo~ ao to~oloppaiont tro~ mal, on n'a pas pu
effoctuor d'analyJe l~oulair- ot on oon~ quonce l'oxpro~s~on de
la proteine ~5 a ete analyJee par ~ounofluoresconce ;
une colorat~on selon Giemsa Wri~ht du mtme champ a et~
ettectuoe pour a~st~ngu~r ies noyaux ot le cyeopiasme
LOJ f~robla~to~ do poulot normaux ~nfoctes par DA~5 one
presonte une fluorescence hceerogene lorsqu'ils ont ete eraltes
avec anti-HS Toutes les cellules préseneaient tes
noyaux sluoroJoen~s ee l'lntonslto to la ~tluor-soonc~ est on Donno
oorr~latlon av-o la struoture de h ohromatlne Les
noyaux bautom~nt condonJos pre~onta~-nt la fluor-saonce l~ pius
:lve, tandl; les noyaux avec uno chromatine mo ms condensee
presentalene uno falble tluorosconc-
Certains noyaux nautomone cond-nJ-J s-mbialene eere oxpuises
des cellule Tnversement les tibroblastos normaux non ln~ s
n'ont pas p~eaen~e de ~luorescence significatlve ee ls
con~enalent dec noyaux avec une chromat1ne dlspersee typlque
.
wo g~ go Q~ 22 PCT/FR9l/00062
5- ~5 e~t phoephor~l~e dnn~ lo~ oellulo~ CT6. Il re~ort des
résultats obtenus que l expresslOn de 1~ protelne ~5 n a qu un
ea~ble erret sur la crolssance de cellules transrormees. Am sl,
oomme etapç su1vante. on a reoherch~ des modirloat~one
poet-traductlonnelles possible~ de cette protelne entrainant son
lnact1~atlon dans ces cellules. ~tant do~né que la pho phorylatlon
pourr~lt etre lmpllquee dans l' m actlvatlon de ~5 aux stades
precoceJ de l'erythropol~so normale ~27), on a examlne
i~etendue de la phosphorylatlon de H5 dans lo cellule~ OT6. Des
cellules OT6 lnfectees par DA~5 et non lnfectées ont ete lncubees
en presence de ~3P04 marque au 32p Le~ h~stone~ rlches en lys m e
ont ensulte ete eXtralteS, soumi~es ~ une électrophorese sur un
gel te polvacryiar~de-SDS, eransrerees sur r.ltrocellulose et
l lmportance de la phosphorylatlon a ~t~ dlroctomont anaiyQee par
autorad~ographlede la plage de transfert ("blot"~. Une
protelne pho~phorylee, absente dans les cellules OT6 te~olns
(bande 1~ a ote dotoctoo dans dos cellulo~ OT6 in~toct~os par DAH5
(bande 2\ Pour id-ntlfi-r cotto prot~ino, la m m pla~e de
transfert ("blot") a ete traitoo a~oc un anticorps antl-H5, un
conjugue ~rote m e A-peroxydase et la 4-a~ino-antipyr~ne comme
cubstrat. L~ prote m e H5 a ete dotectoo dans lo~ collules CT6
m rectee~ par DAH5 (bando 4i ot dan~ lo~ hlston-s totalos
^xtral~çs d~eryt~rocy~es de poulçe !k~nde 5), tandls qu aucune
:one n'a ote ob~or~oe dans le~ cellules OT6 temo~ns (bande 3). La
prote m e phosphorylee tetectee dans la bante ~ a en gros ia meme
moblllte que la protelne H5 identifi~e dans leJ bandoJ 4 et. 5
Nous pouvonJ do~c ooncluro quo la prot~ne H5 05t phosphorylec
dans les cellulo~ OT6 l~OCt~O~ par D~S
6. Discu~ion
Ces exemple temon~re le transfert et ' expresslon
eff~cacos de l'hlJtone H5 dans des fibrobiastos normaux e~
~ransfo,mes Le veceeur SIN decrlt dans cette etude a ett
_~nstru~t a parta: ~u ~!lruS de la leucose a~rla~re RA'-~ La
W O 91/11190 23 '; PCT/FR91/00062
2075~!h'7
delee~on de~ ~equenoes du promoteur dan~ la 3'LTR contult ~
l'integration d'un pro~irus mactif tan~ le~ cellules infectees.
Le vecteur a transféré une copie
de oequenoo ~5 etrangero dans le genome do a~a~ue oelluie
lnfeotee Il A ete trouve que ce transtert e~t tres stable etant
donne que la ~equence H5 inseree etalt enaore pre~ente dans des
cellules cult~v~oJ pondant 50 gonoratmons sans pres~lon selectlve.
Dans les cellules infectées avec le vecteur SIN de
DAHS, le~ sequences ~5 otaient eran~criteJ a p4rtir du promoteur
de MT-IlA lnterne. ~tant donne qu'aucun virus vecteur n'a pu etre
recuperé des cellules m t,ectees meme apre5 ~ur m f,ectlon avec un
rus auxlllaire, aucune transcription n'a été
m tlee a partlr de la 5'LTR. Le voctour SIN tecrlt lCl
est tout à fait fiable et efficace.
lS
On n ' a pas observé t ' ef f ets
slgnificatifs doJ ion~ Zn~ sur l'effioaoito to tranJcription de
H5 tans let oellulos infoctooJ. ~ome sans stimulation. l'unlte de
transcrlpt~on te H5 int~groo etait actmvo. L'actlvlto con~tltutlve
du promoteur de MT-IIA et son abJence de repon~e ~ux lons Zn~;
dans le ~ecteur de DA~5 pourralont otro m horontos a co promoteu:
dans une collule avlairo. ou pourra~on~ otro du~ aux eftfots
st m~lateurs croe~ par le promotour de SV40 prox~mal oY les LTR
La quantlto do H5 produmte par collulo OT6 m roctoo pas DAH5
' e~t ~omblablo a oolle trôuveo dans doJ orythrooytot av~alres
maturoJ C'e~t pourquo~, 10J offoto do H5 danJ lo~ oellulo~
in~ect~o~ peuvont otre comparos aux oonditlonJ phyJ~oloq~que~
natl~os.
L'exprorJlon do H5 dans dos fibroblastos tran~form~,
-'est-~-dire des fibroblasteJ de caille 0~6 ou doJ fi~robla3te~
d o~oryon do pouiet transtormos par AEV-ES4, n'a paJ lDhlbe ieur
orolssanco ln vltro. Des OT6 lnfoct~os pas DA~5 no proJen~ent
qu une faibie augmentatlOn de ieur temp~ do goneratlon, de 20 ~ 25
- h~ures, mals lour capaclté de csoitre commo une li~née etabl~a !. e
W O 91/11190 ~3 ~ 6 24 PCT/FRgl/00062
pas ete dim~nuee. Ce resultat montre explicltement que la
production constante de ~5 a peu d'effet sur le phenotypo te
' f~robiastes transtormes.
Les fi~roblastes de caille ou de poulot normaux expr~mant la
protelne HS exogène presentalent un potentiel te csolssance tre~
l~m~te et n'ont pu etre m replques m developpes. De plus. ces
cellule~ ressenblent a tos cellulo~ ~onoooonto~ avoc uno
morphologle ~platie, un cytoplasme vacuoli~e ee des noyaux
o condensés. La condensat~on de la chromatine dans ces cellules
etalt dlrectement llee a l'expre~lon de ~5 etant donne que les
novaux plus conden~es ont pre~onte la fluoro~cence ia plu~ VlVe
lorsqu'-ls ont ete traltes avec l'antlcorp~ ~nt~-H5 De plus,
certa ms noyaux avec une chromatine hautement condenJ~e etaient
expulses des cellules. Ces aonneos montrent par consequent ~ue HS
presente des erfots tres d~fferones dans des tibrobla~tes normaux
et transtormes.
Lo rolo blolog~quo ao ~5 a oto rogulloremont lio a l'ldoe
qu'll s'a~ t d'un reproJ~our aonoral. Co po m t do vuo ost conflsme
par le le fa~t quo, lorsque les noyaux ont ete roactlves par la
fuslon d'erythrocytoJ de poulot avoc dos celluleJ HeL , les
evonemene-2 procooo~ constatos compronnont uno decondonsatlon àe ia
cnronat m o, uno initiatlon do ynth--- d'ARN ot uno di~parlelon ae
HS (~) Une etude reoente realiJeo par mlcro-injectlon de H5 dan~
des mqobla~tos de rat L6 en proliferation. lignoo cellulaire qul
ConcJorVe le poton~lel do se differonclor on myotubulos, a mon~re
que ;a ml~ratlon et la localisaelon to H5 da~- lo- noynux ~alon-.
llees a la dlm~nut~on do la taillo dos cellulos, la vacuDl~satlon
du cytoplasme, le ta~somont doJ noyaux et l'inhi~lt~on de ;~
tran~crlptlon et do la repllcatlon 14).
;e fa~t que H5 est hautement pho~phoryloe dans le~ collule~
^T5 transformeos ~nfoctee~ rappolle le procoJsus o~serve dans
1 erythropolose normaie. La pro~ence te ~5 a éte d~tectse ~ un
nlveau redult dans dos çrythroblaJteJ on ~tat de dlv~slon prococe
Dans ces sellules. 1~ pro~elne nouvellement oynthet~ee es~
W O 91/11190 PCT/FR91/00062
25 2075o67
trln~portee d~n~ le ~oy~u ou elle est modiflee p~r un proce~sus
mpllquant la pho~phorylatlon unidirectlonnelle continue pendant
laqueile neut groupemcnts phosphoryles peuvent ètre lntrodules.
Aux s~ados termlnaUX de la maturatlon do~ ervthrocytos, ia
; protelne phosphorylée est déphosphorylée e~ ce dernler evenemen~
e~t en bonne corrélation avec l'arret de la synthese d'ADN et
d' M N ee la condensatlon de la chromatlne (S. 26). On n'a
pa~ pu analy~er l'etendue de la pho~phorylation de H5 dans des
fibroblastes normaux mfectes par DA~S otant donne que ces
cellule~ n ont paQ pu etre a~plifiees.
Lc moca m ~me exact d'lntoractlon de ~5 avoc i'ADN dans io
ohromatlne n e~t pa~ connu. Cepondant, on peu~ envlsager un
mécamsme qUl permot ~ la cellule de traitor do grandeJ quantltes
iS de HS sans deterloratlon du m~tabollsmo ccllulalre, La
pho~phoryiatlon de H; proault uno prot~lno qul a mo~ns d'afflnlte
pour l'ADN. par neutrali~atlon de~ charge~, C'e~t pourquol, le~
acides amin~J modifies doivent otro looalioo~ dano des domaines
qul sont dec~fJ pour cotte intor~ction. c'eot-~-dire la reglon
C-term~nale (re~idus 100-182) qui o~t la rogion qui oontribue le
plus a la condensation de la chromatine par neutrallsatlon
partlel;e doJ phoJphates de l'ADN. La ~S non modifioe montrant
plus a'afr m~t~ pour lo~ structuroJ d'ordro ~uperleur de
cnroma~ m o ot d'ACN. ~o l~oralt otrolterNnt a 1'ADN, spoclatoment
aux r~glon~ rlcho~ en A-T. on ~o condon5ant ot/ou en chan~e~nt sa
confor~at~on t20) ot, ~e oette manioro. en bloquant la liaison de
la maoh~nerle do transcrlptlon et do ropllcat~on.
Il sora ~ntoros~ant d'otudior lo~ vo~oo motabollque~ qu~ son~
d~rectomont rosponsablos do la phosphorylation do ~S dans dos
-ellulos eransftormoos et lour rolat~on avoa l'oxpro~slon d'
oncoaenes Etant donne que lo~ tibroblaJtos OT6 et AEV-ES4 ~ont
~ransforre~ par do~ evenements lnltlaux differont~. il est
probable que les deux processus aativent des H5-kinases cormunes
L'analv~o des motiflcatlons te HS dan~ dlvorJos collules
nfectees par DAHS peut ^rre utll! pour det~ m r le role de oette
WO 91/11190 PCr/FR91~00062
6~ 26
protéine dans la réplication et la différenciation cellulaires et dans la
connaissance des mécanismes de transformation onco~énique.
EXEMPLE 2
Vecreurs portant des séquences du virus RAV-0 et une LTR 5' de RSV
Deux vecteurs porteurs d'une LTR 3' dérivée du virus RAV-0,
naturellement dépourvue de séquences enhancer, ont été construits.
Le vecteur OVA-ZZ porte les séquences suivantes de 5' en 3':
- Une LTR du virus RSV,
- Une séquence leader du virus RAV- 1,
- Le gène de résistance NeoR,
- - Le ~ène de E. Coli codant pour une beta-galactosidase munie d'un slgnaJ
d'adressage nucléaire, sous le contrôle du promoteur du virus SV40 (gène
SVnlslacZ, fourni par J.F. Nicolas de l'lnstitut P~asteur de Paris. cf. Bonnerotet al. 1987, Proc. Natl. Acad. Sci. USA 84. 6795-6799),
- La séquence non codante 3' et la LTR du virus RAV-0.
Le vecteur OVA-Zdel est identique au précédent sauf dans sa
partie 3' où la LTR 3' de RAV-0 délétée de 50 nucléotides comprenant sa
boite CAAT.
Le virus OVA-Zdel peut être produit à un titre de 1000
particules/ml conférant l'activité beta-galactosidase aux cellules infectées.
Par contre le ~ène NeoR n'est pas exprimé dans les cellules infectées, ce
qui confirme le caractère auto-inactivant (SIN) de ce vecteur.
~ OrA-2Z
LTR RSV NtoR SVnl~l~cZ l.TR RAY~)
~ } OYA-Zdol
L ~r~--~
LTR RSV NeoR SYnl~lecZ LTR RAV(0) délétée
' ': ' ' ,
~, .
'
WO 91/11190 PCI/FRg1/00062
27
2o75o67
Les vecteurs OVA-ZZ et OVA-Zdel ont été transfectés dans la
lignée helper Isolde. Les surnageants de pools de cellules helper résistantes
au G418 ont été titrés sur cellules QT6 d'une part par sélection au G418
(titre NeoR) et d'autre part par révélation in situ de l'activité beta-
5 galactosidase ~titre lacZ). Le rapport des deux titres révèle que seul
OVA-Zdel est capable d'une auto-inactivation significative: OVA-ZZ donne
100 G418rfu/ml et 100 lacZfu/ml. L'activité de résistancc au G418 des
cellules infectées par ce vecteur résulte sans doute de la transcription
initiée au niveau de la LTR 5', qui reste donc assez active. Nous avons donc
construit OVA-Zdel, un vecteur similaire à OVA^ZZ mais dont la LTR 3~,
toujours issue de RAV-0 a été délétée de sa boite CAAT. La titration a été
réalisée à partir de 20 clones de cellules helper transfectées. L'un des
clones produit 1000 lacZfu/ml et aucune (~20/ml) G418ru. Ce résultat
démontre l'efficacité et l'inocuité du vecteur OVA-Zdel.
Des expériences ultérieures ont permis de mieux comprendre
Ies facteurs qui contrôlent l'efficacité du transfert de gène et de l'auto-
inactivation, en comparant OVA-ZZ et OVA-Zdel avec une construction
portant une LTR 3' de RSV (OVA-D):
- L'expression transitoire du ~ène nlslacZ dans des cellules QT6
transfectées est réduite de 5 à 10 fois par la délétion de la LTR de RAV-0.
- Le niveau d'ARN messager initié à la LTR S' dans les cellules
helper résistantes au G418 n'est pas affecté par les séquences 3'.
- L'encapsidation des ARN porteurs des séquences de RAV-0 est
réduite d'un facteur 2 ou 3.
2S Ces résultats permettent d'expliquer pourquoi le titre lacZ obtenu
avec OVA-Zdel reste inférieur de 100 fois à celui obtenu avec OVA-D.
On a construit des vecteurs dérlvé- de leuco~e aviaire avec un
promoteur de transcription interne et diverses ~équences non-codantes en
3'. Des délétions sont introduites dans l'élément U3 LTR aval ~3') pour
30 obtenir l'auto-inactivation de la transcription à médiation LTR après un
. ycle de réplication. Cependant, les séquences non-codantes en 3' semblent
déterminer non seulement l'aptitude à l'auto-inactivation des vecteurs,
!naiS également l'efficacité du transfert de gene. Une analyse plus poussée
révèle l'influence de ces séquences tant sur l'expression du gène interne
35 que sur l'encapsidation de l'ARN. Les éléments construits avec une LTR 5'
.. . ~ ~ ' . ' . .
:~ .
WO 91/11190 ~ PCr/FR91/00062
28
de RSV permettent de réaliser un transfert de gène efficace tout en
inactivant fortement la transcription promue par LTR en 5~.
L'aptitude des vecteurs auto-inactivants à pro~uire une
préparation virale de tirre élevé et à inactiver pleinement le promoteur
LTR repose surtout sur la mutation qui est créée- Cependant, les
conséquences de la muta~ion des séquences virales non codantes en 3' sur la
transcription, le traitement, la traduction, I'encapsidation et la transcrip-
tion inverse de l'ARN sont très imprévisibles (R34, R43, R47).
On décrit ici la construction de plusieurs vecteurs dérivés de
0 leucose aviaire avec divers séquences non codantes en- 3'. L'influence de cesséquences en 3' sur l'expression du virus est analysée plus avant et révèle
ses diverses conséquences sur l'expression et la réplication des virus.
MATERIAUX ET PROCEDES
Contruction des plasmides OVA (fi~ures 7, 8)
On construit DAI en assemblant dans pBR322 les fra~ments
suivants: un fragment Xhol à partir de pRAV-2 (R45) portant une LTR
RAV-2 pleinement active et une séquence leader, un Xhol-Xbal de pTXN3'
portant une partie de la séquence GAG du virus d'érythroblastose aviaire
(R29), un fragment Accl-Bgltl de pSV2Neo (R50) dans l'orientation directe,
et une LTR en 3' délétée. La LTR délétée est créée par assemblage de la
partie 3' du génome RAV-2 (de Xhol à un linker Clal inséré dans le site
Sphl qui est situé à 149 nucléotides en amont du site de la capsule). Cette
délétion enlève les boîtes TATA et CAAT.
On construit OVA en assemblant le polylinker de pBluescript
(Stratagene SanDiego), les fragments suivants: le fraRment Ndel-EcoRI de
pUT507 (RS2) (portant 0,5 kh de séquences de RSV souche Schmldt-Ruppin
D, couvrant une partie du gène v-src et la partie amont d'U3), I'EcoRI-Xhol
de pRAV-I (R35) (de U3 à GAG) un Xhol-Xbal de pTXN5' (R29b
WO91/1119~ PCT/FR91/00062
.: 29
207aO~7
(gène NeoR) et le fragment Sall-BamHI de pMuMLVSVnlslacZ
(R24) (le promoteur SV40) suivi par une version mutée
du gène lacZ d'E. coli codant pour une protéine ciblée
au noyau de la cellule). Etant donné l'insertion
de petits fragments de polylinker pBluescript, cette
structure est flanquée de deux sites de restriction
SpeI.
Pour construire OVA-D, on transfère le
fragment Ndel-Xhol d'OVA entre les sites Saml et
Xhol de pBluescript (pour fournir une séquence non
codante en 3' type RSV complète), puis on insère
le fragment OVA Spel dans le site Spel amont dans
: l'orlentation droite. On construit OVA-ZZ en transfé-
rant le fragment HindIII-BamHI de pGJ18 ~R19) porlant
IS deux copies de RAV~0) LTR dans pBluescrlpt (donnant
BluZZ~, pu~s en insérant le fragment OVA Spel dans
le site ~indIII de BluZZ dans l'orientation correcte,
après remplissage partiel des extrémités saillantes
par la polymérase de Klenow. On obtient OVAZdel en
. 20 délétant BluZZ par digestion à Ndel et religationà faible concentration d'ADN ~donnant BluZdel) et
en.insérant le fragment OVA Spel au site HindIII,
Culture cellulaire
Tous les réactifs sont achetés auprès de
Gibco. On cultive des cellules helper Isold ~R44)
dans un milieu William5 additionné de 54 de sérum
de foetu~ de veau, 2~ de ~rum de poulet, NaCl
~60 mM), pénicilline ~1000 u/ml), streptomycine
(0,05~, phl~omycine (50 ~g/ml) et hygromycine
(50 ~g/ml). On cultive QT6 (R36) et des fibroblastes
embryonnaires de poulet préparés à partir de
.
WO91~11190 PCT/FR9ltO0062
~ 30
à partir d'embryons S/O SPAPAS âgés de l0 jours (CEP,
R45) dans un milieu HamPl0 additionné de 5% de
sérum de veau, 1% de sérum de poulet, 2% de bouillon
de tryptose phosphaté, de la pénicilline et de la
streptomycine. On change le milieu tous les trois
jours.
Transfectio~, production de virus et titrage
On transfecte l'ADN de plasmide purifié
par production de bandes CsCl (R39) dans des ~ellules
10 Isold soit par précipltation au phosphate de calcium
(R40) soit au polybrène (R41). ~n séle~ionne les
uellules (250 ug/ml) avec G418 (Gibco) 24 heures
après tranfection, pendant au moins l0 jours. On
récolte le surnageant viral à partir de cellules
15 subconfluentes 16 heures après changement du milieu,
et on centrifuge (2000 g, S minutes~ pour enlever
les débris cellulaires. Pour le titrage, on ajoute
~l à 500 ~l de surnageant de cellules helper
à des cellules QT6 ou CEF (S x l0 cellules par 25 cm2).
20 On sélectionne les cellules infectées avec G418 au
bout de 24 heures, ou on les colore pour déterminer
l'activité de nlslacZ au bout de 48 heures ~RS3)
Analyse de 1'ARN
On extrait l'ARN à partir de cellules helper
25 ou de surnageant centrifugé (45 minutes, '5000 tpm
dans un rotor de ~ackman SW41) par digestion à la
prot~inase K et extraction au ph~nol-CHCl3 co~me
il est dit (R39). On hybride les produits de buvardage
à fentes et de buvardage Northern avec un échantillon
d'ARN synthétisé in vitro marqué avec 32P en utilisant
des techni~ues standards. On proc~de à l'établisse-
ment de la carte Sl comme il est dit (R39).
-~
.
' -
-
WO91/11190 PCT/FR9l/00062
207aO67
RESULTAT~S
Une importante délétion dans les éléments promoteurs
du LTR en 3' réduit le titre
du virus
La figure 7 montre la structure de DAl,
vecteur portant le g~le ~eoR promu par le promoteur
SV40 et inséré dans l'orientation directe(par rapport
à la transcription du virus). On délète la séquence
U3 de la LTR en 3' à partir du nucléotide -149 à -15
10 (jusqu'au site de capsule ; voir matériaux et procédés).
Cette délétion comprend la boîte C M T et la boite
TATA mais ni la séquence enhancer ni le signal de
polyadénylation. Plusieurs autres vecteurs sont
dérivés de DAl par insertion d'un gène additionnel
15 entre la LTR en 5' et le promoteur SV40, dans l'orien-
tation inverse.
On transfecte ces produits de construction
dans les cellules helper, qui sont ensuite sélec-
tionnées avec G418, et on titre les virus recombinants
20 à partir du surnageant cellulaire. Les titres viraux
sont faibles, allant de 3U G418 rfu/ml à 200 G418
rfu/ml lorsqu'on te~te les populations de cellules
clonales. On surinfecte les cellules infectées ré-
sistantes avec un virus helper compétent pour la
25 réplication pour sauver les virus non inactivés.
Comme aucun virus recombinant n'e8t aauvé dans un
ensemble d'environ 100 clonea cellulair-a 1nfoct~s,
on conclut que la délét~on inact~vo efficacement
le promoteur LTR en 5' après un cycle de répli-
30 cation vlrale.
L'analyse d'ARN Sl ~Choue à détecter lesARN promus par LTR et par SV40 dans les cellules
WO91/11190 ~ PCT/FR91/00062
~ 32
helper transfectées résistantes à G418. (Une expé-
rience témoin a ~té réalisée avec succès avec
pTXN3', vecteur antérieurement décrit (R29J). Ainsi,
il est vraisemblable que la stabilité et/ou le traite-
S ment d'extrémité en 3' de l'ARN soit affectés parla mutation LTR en 3'. L'ajout d'un signal de poly-
adénylation SV40 en aval du LTR en 3' échoue à réta-
blir le titre viral ~données non représentées). Par
conséquent, une approche semblable à celle qui a
10 été utilisée avec succès pour gén~rer des virus auto-
inactivants dérivés de virus de nécrose de rate de
rat aboutit à un faible succès avec les virus dérivés
de leucose aviaire.
Modifi~ation des séquences non codantes en 3 ! seulement
Pour permettre une comparaison directe
de diverses séquences non codantes en 3' et étudier
précisément leur influence sur l'efficacité du trans-
fert de gène, on met au point une série de vecteurs
qui ne diffèrent que par leur extrémité 3'. On y
: 20 parvient en construisant OVA, plasmide qui peut fournir
sous la forme d'un seul fragment de restriction une
; cassette portant (Ae 5' à 3') une LTR pleinement active
de type RSV, une séquence leader RAV(l), la séquence
codante NeoR, et le gène nlslacZ commandé par le
25 promoteur de transcription SV40 (comme l'unité SV40-
nlslacZ est placée dans l'orlentation avant, il e3~
concevable que la réinitiation de traduction puisse
se produire à faible fréquence ~ur les transcripts
promus par LTR en 5', et rendent compte d'une faible
30 partie de la traduction de nlslacZ).
La cassette OVA est insérée en amont de diverses L~R
WO91/11190 PCT/FR~1/00062
33 207~7
qui fournissent le signal nécessaire pour le traitement
d'extrémité en 3' des transcripts promus par LTR
en 5' et SV40.
Comme témoin positif, on utilise la LTR
RSV pleinement active comme LTR en 3' et on obtient
OVA-D. OVA-ZZ possède le RAV(0) LTR non
muté comme séquence 3'. Cette LTRestnaturellement
résente dans un provirus endogène qui peut être cultivé
à un titre relativement élevé (R32) et s'est révélé
10 posséder une activité de promoteur, de terminateur,
mais non d'enhancer ~Rl4, Rl9). On attend donc du
produit de construction OVA-ZZ une
auto-inactivation très limitée mais un transfert
de gène efficace. Pour augmenter l'aptitude à l'auto-
inactivation, on construit également OVA-Zdel en
délétant 50 nucléotides comprenantla boite CAAT
de RAV(0).
Le titre viral est influencé par les séquences
non codantes en 3'
On effectue des titrages de virus à base
: de révélation in situ d'activité de bêta-galac-
tosidase ou de sélection G418 à partir de cellules
helper transfectées de façon stable ~tableau I).
Le titre exprimé sous forme de lac+fu/ml ~'itre lacZ)
25 résulte des efficacités combinées du transfert de
gène et de l'expression du gène interne. La compa-
raison avec le titre exprimé soug la forme G418r~u/ml
~titre NeoR~ donne une estimation de llauto-inactivation~
OVA-D semble donner un titre élevé dans les deux
dosages, confirmant que les virus de leucose aviaire
.. comme les virus de leucémie murine, peuvent loger
le promoteur interne. A notre surprise, l'efficacité
WO 91/11190 PCI`/FWt/OOn62
~ 34
du transfert de gène est spectaculalrement rédulte
. avec OVA-2Z (100 lac+fu/ml) et le vecteur ne présente
aucun s~gne d'auto-inactivation (100G418rfu/ml~. -
La délétion de la boîte CAAT en 3' dans OV-Zdel
i aboutit à une amélioration dans l'efficacité du trans-
fert de gène et à l'augmentation du rapport entre
le titre lacZ et NeoR. Pour améliorer à la fois l'ef-
ficacité du transfert de gène et l'auto-inactivation,
on isole 20 clones de cellules helper transfectées
10 avec OVA-Zdel et on y titre à la fois l'expression
de nlslacZ et de NeoR. 10 de ces clones ne donnent
aucun virus (< 20 lac+ ou G418rfuiml). Les résultats
obtenus avec les quatre clones qui donnent le titre
lacZ le plus élevé sont reportés au tableau II. Le
15 rapport entre les deux titres viraux (c'est-à-dire
l'efficacité de l'auto-inactivation) varie largement
d'un clone à l'autre et peut dépasser 60. Par conséquent,
OVA-Zdel peut être considéré comme un vecteur de
rétrovirus auto-inactivant efficace.
L'auto-inactivation est encore confirmée
dans une expérience de sauvetage du virus qui échoue
à donner un virus recombinant après surinfection
par RAV(l) ~<20 lac+fu/ml).
Les ~équences en 3' influent sur l'eYpression
25 transitoire du gène interne
Pour acquérir des informations 9upplé-
mentaires sur les facteurs qui d~terminent la produc-
tion de virus dans les cellules helper, on transfecte
des cellules Isold ou QT6 avec les plasmides OVA
30 et on dose 48 heures plus tard l'expression transi-
toire du gène SV40-nlslacZ par coloration ln situ
(tableau III). Dans ces conditions, OVA-D et OVA-
WO91/11190 PCT/FR91/00062
20 7'i0 67
ZZ donnent des résultats similaires. La délétiond'U3 dans OVA-Zdel altère l'expression transitoire
de SV40-nlslacZ. Ces résultats confortent l'idée
que le modeste titre viral obtenu avec OVA-Zdel
est lié à un défaut dans l'expression de SV-nlslacZ
; et que la partie délétée de l'élément RAV(0) U3
porte un signal important pour l'expression du gène
viral. Bn revanche, le faible titre viral obtenu
avec OVA-ZZ n'est pas en corrélation avec l'expres-
sion transitoire de nlslacZ, ce qui indique qu'une
étape post-transcriptionnelle de production virale
est également contrariée lorsqu'on utilise la séquence
~AV(O) 3l. Les transcripts promus par
SV40 sont moins abondants que les transcripts promus
par L~R en 5' dans les cellules transfectées de façon
stable mais le niveau constant des deux
ARN dans ces cellules n'est pas clairement dépendant
des séquences non codantes en 3'.
Bien que cette observation soit un argument
contre un engagement possible des séquences 3' dans
` la transcription virale, elle peut être biais~e par
le fait que seules les cellules produisant suffisam-
ment d'ARN viral pour résister à la sélection G418
sont considérées dans ce dernier cas.
V~ri~t;on clo~le d~ns l'espre~sion du gène
SV~0-nlslacZ d~ns les cellulos infoct~o-
On coloro dos clonos d- collulo5 infectées
ré~itant à G418 ~clones G418R) pour d~terminer l'acti-
vité de ~-galactosidase. Bien que cette analyse soit
effectuée sur un nombre de clones limlté, elle
aboutlt ~ plusieurs observations intéressantes :
: . ' . :, '
O91/11190 ~ PCT/FR91/00062
q ~ ~ 36
- Certains clones G418R ne contiennent
pas de cellules lac+ cell. Ceci pourralt résulter
d'une mutation se produisant dans le gène nlslacZ.
Cependant, comme les cellules helper G418R/lac peuvent
produire un virus recombinant lac+ (données non
représentées) et cor,-~e un faible nlveau d'expression
de gène NeoR suffit pour fournir une résistance à
G418 (voir ci-dessus et R29), il est plus vraisemblable
que les cellules G418R/lac- expriment en fait
10 nlslacZ, mais en dessous du niveau seuil nécessaire
pour colorer positivement dans le dosage in situ.
Un effet de position peut expliquer la raison pour
la~uelle le phénotype est presque constant dans un
seul clone G418R. Il est donc vraisemblable qu'une
15 coloration lacZ in,situ aboutisse à une sous-estimation
de l'efficacité effective du transfert de gène.
- La proportion relative des clones G418R/lac-
et G418R/lac+ dépend du vecteur qui est utilisé pour
infecter les cellules. Comme on s'y attend d'après
20 des dosages transitoires, ce rapport est semblable
pour OVA-D et OVA-ZZ et est supérieur à celui que
l'on obtient avec OVA-Zdel.
L'analyse d'ARN révèle que le~ aéquences non codantes
en 3' influencent l'efficacité de l'enveloppage de
25 l'AR~.
Un faible titre viral peut r~sulter soit
d'une production xéduite de partlcule virales por-
tant l'ADN vecteur par le9 cellule8 helpér, soit
d'un faible niveau d'expression de gène viral dans
30 les cellules infectées. Pour identifier quelle est
l'étape limitante dans la présente situation, on
WO 91/11190 PCI/FR91/00062
37 2075~fi7
analyse les ARN de rétrovirus dans les cellules helper transfectées de façon
stable par OVA-D, OVA-Z7 et OVA-Zdel (clone A) et dans les particules
virales qu~elles produisent. L'analyse de buvardage à fentes montre que le
titre viral est en corrélation avec la quantité d'ARN de rétrovirus
5 enveloppée dans les particules de virus mais non avec le niveau constant
d'ARN vecteur présent dans les cellules. L'analyse quantitative révèle que
les transcripts d'OVA-ZZ et OVA-Zdel initiés à la LTR en 5' sont sous-
représentés dans les particules virales. L'enveloppa~e de l'ARN semble donc
être une étape limitante dans la production de virus pour OVA-7' e~
1 0 OVA-Zdel.
On montre ici que les séquences non codantes en 3' influencent
I'aptitude à l'inactivation des vecteurs rétrovirus mais égalemen~
I'efficacité du transfert de gène à médiation rétrovirale dans les cellules
aviaires. Comme les délétions U3 qui ont été test es affectent le titre
15 viral, on est porté à supposer que les séquences LTR jouent un rôle dans ce
phénomène.
Toutefois OVA-Zdel avec une LTR 5' de RSV nous permet de
produire 100 lacZfu/ml tout en inactivant pleinement le promoteur LTR.
20 Tableau 1: Titra~e du virus
On transfecte les cellules helper et on les soumet à sélection
par G418. On titre alors le surna~eant cellulaire sur des cellules QT6 et
~; CEF pour l'expression de NeoR comme de lacZ. On fait la moyenne du tltre
viral à partir d'au moins 3 expériences differentes de transfection.
Tableau ll: Variation clonale dans le titre viral obtenu avec OVA-Zdel
On titre 20 clones de cellules helper transfectées de façon
stable avec OVA-Zdel pour l'expression du gène NeoR comme. Iac'. A, B, C
et D sont les quatre clones qui donnent le titre lacZ le plus élevé.
W091/11190 PcT/FR9l/ooo62
20~ rl 38
Tableau III : E~pression transitoire de SVnlslacZ
dans le~ vecteurs OVA.
Expression transitoire : on transfecte
des cellules QT6 par précipitation au phosphate de
calcium ou avec du polybrène ~voir matériaux et pro-
cédés~. On fixe les cellules au bout de 48 heures
et on les colore pour déterminer l'activité de
~-galactosidase. Lorsque plus de 500 cellules sont
positives pour l'expression transitive de nlslacZ
sur une seule boite, on extrapole le nombre total
de cellules lac+ à partir d'un comptage exhaustif
effectué s~r une surface limitée. La dernière piste
indique les rapports moyens relatifs à OVA-D.
Tableau I
¦Construct ¦DA(l) IOVA-D¦ OVA ZZ ¦OVA Zdel
~aL~L 10 000 100~ 250
NeoR fu/ml ¦ ~ 10010 000 100 100
Tableau II
Construct~ :~ OVA-ZZ OVA-Zdel
Ca Phospbate _6000 6000 _
Polvbrene182 154 = 26
Tableau III
~ ~ b ~ 1200 1 400
G4 1 8rfu/ml _ 2000 250 -- ~ 20 200
Rapport 7.3 6.4 60 _ 2.2
WO 91/11190 PCI/FR91/00062
39 207~067
BIBLIOGRAPHIE
1. Affolter, M., J. Cote, J. Renaud and A. Ruiz-Carillo. 1987. Regulation of
histone and BA-globin gene expression during differentiation of chicken
erythroid cells. mol. Cel. Biol. 7, 3663-3672.
2. Appels, R., L. ~olund and R.N. Rin~ertz. 1974. Biochemical analysis of
reactivated chick erythrocyte nuclei isolated from chick HeLa
heterokaryons. J. Mol. Biol. 85:182-190.
3. Benchaibi, M., F. Mallet, P; Thoraval, P. Savatier, J.H. Xiao, G. Verdier,
J. Samarut and J.V. Nigon. 1989. Avian retroviral vectors derived from
avian defective leukemia virus: role of the translational context of the
inserted gene on efficiencv of the vectors. Virolo~y 169~ 26.
4. Bergman, M.G., E. Wawra and M. Win~e. 1988. Chicken histone H5
inhibits transcription and replication when introduced into proliferating
cells by microinjection. J. Cell Sci. 91:201-209.
5. Briand, G., D. Kmiecik, P. Sautiere, D. Wouters, O. Borie-Loy, G. Biserte,
A. Mazen and M. Champagne. 1980. Chicken erythrocyte histone H5.
FEBS Lett. 112:147-
6. Cullen, B.R., K. Raymond and G. Ju. 1985. Functional analysis of the
transcription control region located within the avian retroviral long
terminal repeat. Mol. Cell. Biol. 5:438-447.
7. Emerman, M. and H.M. Temin. 1984. Genes with promoters in retrovirus
vectors can be independently suppressed by an epigenetic mechanism.
Cell 39:4S9-467.
8. Favaloro,J., R. Treisman and R. Kamen. 1980. Transcription maps of
polyoma virus specific RNA:analysis by two dimensional nuclease Sl gel
mapping. methods enzymol. 6S:718-749.
9. Gandrillon, O., P. Jurdic, M. Benchaibi, J.H. Xiao, J. Ghysdael and J.
Samarut. 1987. Expression of the v-erb A oncogene in chicken embryo
fibroblasts stimulates their proliferation in vitro and enhances tumor
growth in vivo. Cell 49:687-697.
WO 91/11190 PCI'/FR91/00062
6~ -
10. Garcia, M., R. Wellin~er, A. Vessaz and H. Diggelman. 1986. ~ new site
of integration for mouse mammary tumor virus proviral DNA common
~o ~alb/c (C3H) mammary and Kidney adenocarcinomas. 1:127-134.
I l. Gritz, L., and J. Davies. 1983. Plasmid-encoded hygromycin 3
resistance: the sequence of hydromycin B phosphotransferase gene and
its expression in Escherichia coli and Saccharomyces cerevisiae. Gene
25: 179- 188.
12. Hwan~, L.S. and E. Gilboa. 1984. Expression of genes introduced into
cells by retroviral infection is more efficient than tha~ of genes
introduced into cells by DNA transfection. J. Virol. 50:417-424.
13. Karin, M. and R.l. Richards. 1982. Human metallothionein genes-
primary structure of the metallothionein-ll gene and a related
processed gene. Nature (London) 299:797-802.
14. Kawai, S. and M. Nishizawa. 1984. New procedure for DNA transfection
with polycation and dimethyl sulfoxyde. Mol. Cell. ~iol. 4:1172-1174.
IS. Laemli, V.K. 1970. cleavage of structural pro~ein during the assembly
of the head of bacteriophage T4. Nature 2S6:680-685.
16. Laimins, L.A., P. Tsichlis and G. Khoury. 1984. Multiple enhancer
domains in the 3' terminus of the prague strain of Rous sarcoma virus.
Nucleic Acids Res. 12:6427-6442.
17. Moscovici, D., M.G. Moscovici, H. Jimenez, M.M.C. Lai, M.J. Hayman and
P.K. Vogt. 1977. Continuous tissue culture cell lines derived from
; chemically induced tumors of japanese quail. Cell 11:95- 103.
18. Mura, C.V. and B.D. Stollar. 1981. Fluorescence-activated sorting of
isolated nuclei. Exp. Cell. Res. 135:31-37.
19. Mura, C.V. and B.D. Stollar. 1981. Serological detection of homologies
of H10 with H5 and Hl histones. J. E~iol. Chem. 256s9767-9769.
20. Mura, C.V. and B.D. Stollar. 1984. Interaction of Hl and H5 histones
with polynucleotides of E- and Z- conformation 3iochem. 23:6141-6152.
WO 91/11190 PCI/FR9l/00062
41 207~S0~7
-
21. Mura. C.V., G. Setterfield and J.M. Neelin. 1982. Immunofluorescent
localization of Iysine-rich histones in isolated nuclei from adult and
embryonic chicken erythrocytes. Can. J. Biochem. 60:215-223.
22. Norton, P. and J.M. Coffin. 1987. Characterization of Rous Sarcoma
virus sequences essential for viral gene expression. J. Virol. 61:1171-1179
23. Richards, R.l., A. Heguy and M. Karin. 1984. Structural and functional
analysis of the human metallothionein-lA gene: differential induction
by metal ions and glucocorticoids. Cell 37:263-272.
24. Savatier, P., C. ~agnis, P. Thoraval, D. Poncet, M. Belakebi, F. Mallet,
C. Legras, F.L. Cosset, J.L. Thomas, Y. Chebloune, C. Faure, G. Verdier,
J. Samarut and V. Nigon. 1989. Generation of a helper cell line for
packaging avian leukosis virus-based vectors. J. Virol. 63:513-522.
25. Southern, P.J. and P. Ber~. 1982. Transformation of mammalian cells
to antibiotic rresistance with a bacterial gene under control of the
; 15 SV40 early region promoter. J. Mol. Appl. Genet. 1:327-341.
26. Sung, M.T. and E.F. Freedlender. 1978. Sites of in vivo phosphorylation
of histone H 5. Biochem. 12: 1864- 1869.
27. Sung, M.T., J. Harford, J. Bundman and G. Vidalakas. 1977. Metabolism
of histones in avian erythroid cells. Biochem. 16:279-285.
28. Varmus, H. and R. Swanstrom. 1982. Replication of retrovirueses. In (R.
Weiss, N. Teich, H. Varmus and J. Coffin, Eds.), RNA Tumor Viruses
Molecular biology of Tumor Viruses" pp. 369-512. Cold Spring Harbor
Laboratory, Cold Spring Harbor, N.Y.
29. Wu, R.S., H.T. Panusz, C.L. Hatch and W.M. Gonner. 1986. histones and
their modifications. CRC Crit. Rev. I~iochem. 20:201-210.
WO 91/11190 PCI`/FR91/00062
rl 4 2
REFERENCES BlaLlOGRAPHlQUES DE L'EXEMPLE 2
-R3: Galileo. D. S.. G. E. Gray, G. C. Cwens, J. Maprs and J. A. Sanes. 1990. Neurons ana glia
anse ~rom a common progenitor in chicken optic tectum: Demonstration ~nlh two retrovirus3s
and cell-type specitic ar~odies. Proc. Natl. acad. Sd. USA. 87:458-462.
- R4: Danix. J-L. 1986. Circuiarizalion ot reboviral genomic RN~ and the cor~ol o~ RNA
translation, packaging anrJ reverse lrarWdptiort. Biochimie 68: g41~949.
- R7: Darlix. J-L. 1986. Cor~o~ ot Rous w~rna vinus transbffon and packa9in9 by the 5 and 3
untranslatr~d sequences. J. Mol. Biol. 189: 421~4.
R 10: Flanagan. J.R.. A. M. Krieg, E. E. Max and A. S. Kahn. 1989. Negative control region al
tne 5 end ot rnunne leukernia vin~s bng terminal repeats. Mol. C~U. Biol. 9: 739-746
R 11: Murphy, J. E.. and S. P. Gott. 1989. Constnuction and anal~rsis ol deletion mutations in
me U5 reglon ot Moloney rnunne leukernia virus: E~ects on RNA parkaging ana reverse
~ranscnptlon.
R 13: Ludw, P A., J. M. Bishop. H. E. Varrnus and M. R. Capecchi. 1983. Location and
lunctlon ot retroviral and SV40 se4uences that enhance bioehernicat transtormation atter
mlcrolnjection ot DNA. Cell 33: 705-716.
R14: Herrnan, S. A., and J. M. Coffin. 1986. Dillerer~ trar~ption trom the bng terminal
repeats ot integrated avian teukosis vinus DNA. J. Virol. 60: 497-505.
- R16: Emerrnan. M. and H. M. Temin. 1986. Ouanlltaive anaiyds ot gene suppression in
integrated retrovirus vectors. Mol. CeU. Biol. 6: 792-800.
- R17: Swain. A. anrJ J. M. cOnin. 1989. Po~n at cor~ct sites In genome RNA is not
requlred tor retrovirus repiication d genome enc p~tion. J. Virol. 63: 3301-3306.
R18: Nonon. P. A. ~nct J. M. CoHln. 1987. Car~ctedz tion d Rous sarcorna vin~s sequences
essential tor viral gene exDression. J. Virol. 61: 1171-1179.
R19: Cullen, B. R., A. M. Skatt<a and G. Ju. 1983. Endogenous avian retroviruses contain
2 5 oe~iclent promoter and leader sequences. Proc. NaU. Acati. SC'. USA 80: 2946-2950
R23: 0Ougheny, J. P. and H. M Ternin 1987. A prornoterieU retrovlral vQctor indlcat~ls ~hat
tnere are seoiuences In U3 requlred lor 3 RNA proCeuung. Proc. Nati. Acad. Scl. USA 84
1 197-1201 .
R24: Bonnerot. C. D. Roc;tncoun, P. Brlant. G. Grimber and J.F. Nicolas. 1987. A n
galaaosidase hybrid proteln targe~ed to nucld as a mari'er tor developmental stuaies Proc
Natl. Acad. Sci. USA 84: 6795-6799.
R29: ~enchal~i. M., F. MaUet, P Thoraval, P. Savaber. J. H. Xiao, ~;. Verdier, J. Samarut ana V
M. Niqon 1989. Avian retro~nral veaors derived ~rom avian de~eative leukemia virus: Role ot the
ranslatlonal context ot the Insened gene on etHdency o~ the vectors. Virobgy 169: 15-26
R30: Cone. R. C.. Weber-aenarous A., Baorta. D and R. C. MulUgan .19a7 Regulated
exPresslon ot a comPlele human 13-glo~in gene ancoded by a transmissible retrovlrus vectors
Mol Cell. Biol. 7 :B87-897
WO 91/11190 PCI/FR91/00062
43
207~067
- R31: Emerman. M. ana H. M. Temln. (1984). Genes With promolers in relrovinus vectors can De
ndepenaently suPpressed cy an eplgene~lc mecnanism. Cell 39: 459-467.
R32: Sorge. J. A.. W. Ricci and S. H Hughes. 1983. Cis aing RNA pacl(aging lo~s ln the
115- nucleonde direct repeal ot Rous sarcoma vinus. J. Virol. 48: 667-675.
5 R33: RNA lumour vinuses.19B5 R. Weiss, N. Teich, H. Vamnus and J. Coffln eas. Cold Spnng
HarOor s~oralory. Cold Spring Har~or. N. Y.
- R34: Yu. S. F., T. Von RDden, P. Karrlott, C. Ga~r, M. S~r~t, U. RDlher, W. F. Anderson,
E. F. Wagner anc E. Giiboa.1986. Sen-ina~iivating retrovirai vectots designed tortrans~ar o~
whole genes into mamrnalian cells. Prr c. Natl. Acad. Scl. USA 83: 3194-3193.
- R35: Payne . G. S. . S. A. Cou,r~neidge, L. B. Cnttenden, A. M. Fadlv, J. M. Bishop and H. M.
Varrnus. Analysis ot a~vian /eukosis DNA and flNA in b~sal turnors: Viral gene expression is no~
rer~uirea for the main~enance of the tumor state. C~D23, 311 19~1
R~6: Mosoovid, C.. M. C. Mosowid, H. Jirner~z, M. M. C. Lai, M. J. Hayman and P. K. Vog~.
1976. Continuous tissue cu(ture cell lines derived trom chemically inauced tumors ot japanes
l 5 quail. Cell 11: 95-103.
R~9: Maniatis, T., E. F. F~itsch and J. M. Samarook.1982. Mobwhr clon~ng: a laboratory
rnanual. Cold spnng harOor labotatory, Colci Sprhg Harbor. N. Y.
R40: Dusty MiUer, A., D. R. Trauber and C. 8u~irnore: 1986. Facsors imohed in produaion ot
helper vlnus-tree relrovir ts vectors. Som. CèU. Mol. Genet. 12: 175-lB3.
R41: Chaney. W. G. . D. R. Howard. J. W. Poltard, S. SaUustio and P. Stan~ey.1986. High-
2~ ~requency IranSteCtiOn ot CHO cells using polyOrene. Som. CeU. Mol. Genet.12: 237-244.
R43: Yee. J. K., J. C. Moores, D. J. JoUy, J. A. wOm and J. G. Respess.1987. Gene
expression trom IranscJi~ionaUy disa01ed retroviral vectors. Proc. Natl. Acad. Sci. USA 84:
5197-5201.
- R44: Cossel, F-L.. C. Legras, Y. Chebbune. P. Savatier, P. Thoraval, J. L. Thomas J.
Samanut. V. M. Nigon and G. Verdier.1990. A new avian ktukosis vinus basea Dac~taging cell
2 5 line Ihat uses two separale transcornplemerlting heiper genomes. J. Virol. 64: 1070-1078.
R45: Bizub D., R. A. Katz and A. M. SSkaika 1984 Nucieollde sfJquence ot non coding
reglons m Rous sssoaat~d vinus-2: compan50n dl~lineats conufv~i reglons Irnponant In
replicaoon and oncogenesis.
R46: Hughes. S. H. . in Viral vectors.1988. Y. Giuzman and S. H. Hughes eas. Cold Spr~ng
HarDor LaDoratory. Cold Spring HarDor. N. Y.
R47: IwaKaza K. ana H. M. Temln .1990. The U3 region is not necessary tor 3 end tormanon
ot spleen necrosls vlrus RNA. J. Virol. 64: 6329-6334.
R48: Denome R. M. anc C. N. Colle. 1988. Panem ot polyadenyiation site seleaion in gene
constnucts contalning muniple ~oolyaaenylation signal. Mol. Call. Biol. 8: 4849-4a39.
R49: Katz R. A.. B. R. Culien. R. Malavarca and A. h~. Skaika.1986. Role ol the a~an retroYlnJs
mRNA leaaemn expresslon: Evidenca tor novel translational control. Mol. Cell. Biol. 6: 372-
379.
W O 91/11190 PCT/FR91/00062
44
3&~
R50: Sou~hem P. J. anc P. Berg. 1982- Transtonmation ot mammalian cenns to antibiotic
reslstance wlth a oactenal gene unaer control o~ the SV40 eany promoter reglon.
J. Mol. Appl. Genet. l: 327 341.
R51: Sealy. L.. M. L. Privalsky. G. Moscovlci. C: Moscovia anct J. M. Bishop. 1983. Sile- -
speatic mutagenesls ot avian erythroblastosls virus: erbB is requlred tor oncogeniaty. Virology
130: 155-178.
RS2: Gormen C.M., G.T. Merlino, M.C. Willingham, I. Past~an and B.~.
Howard. 19e2. The Fous s = virus lcng te~m~n21 repeat is a strcng
promDter when introduced in a variety of eukariotic cells by DNA-mediated
t~ansfection. Proc. ~latl. Acad. Cci. USA 7~: 6777-6781.
.RS3: Sanes J.R., J.L.R. Rubenstein and J.F. Nioolas. 1986. Use o~ a
recombinant retrovirus to study post-implantation cell lineage in mDuse
embry~s. EM30 J. 5: 3133-3142.
.
.~