Note: Descriptions are shown in the official language in which they were submitted.
WO 93/21171 P~JFR93/00361
21~00~q~ :.
'"
APPLICATION DE DERIVES D'ACIDE 2H 1,2,4-BENZOT~IADIAZINE~ DIOXYDE-3-CARBOXY-
LIQUE A LA PREPARATION DE MEDICAMENTS ANTAGONISTES DES RECEPTEURS NMDAtAMpA~
AINSI QUE PRODUITS NOUVEAUX, LEUR PREPARATION ET LES MEDICAMENTS LES CONTENANT
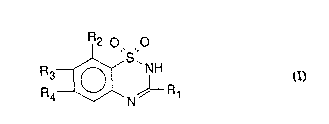
La présente invention concerne l'application de derivés d'acide 2H- :
1,2,4-benzothiadiazine~ dioxyde-3-carboxylique de formule:
R2 o ~ , O .' ' .
R4 ~ N~iJ R~
un sel d'un tel composé ou un précurseur d'un tel composé à la préparation
de médicarnents antagonistes du récepteur NMDA eVou du récepteur AMPA, .
les nouveaux composés de formule (I~, leur préparation et les médicaments ;
les contenant. ~ ~ .
-
Danslatormule (1~
- R1 repr~sente un radical carboxy, alcoxy~arbonyle, tétrazolyle, -CO-NH2,
-CO-NH-alk, -CO-N(alk)~, -CO-NI IOH, -(:~O-N(alk)OH, -CO-NH-O-Rs,
: 15 -CO-N(alk)-ORs ou un groupe convertible en radical carboxy in vivo,
. "
. .,
::~ - R2j R3 et R4, identiques ou différents~ représentent un atome d'hydrogène
~: ~ ou d'halogène ou un radical alkyle, -~
: ~: - Rs représente un radical alkyle ou phénylalkyle et
, .
, . ~
alk represente un radical alkylène ou alkyle.
: :: 20 ~ ll est entendu que les compos&s de ~vrmule (I) peuvent également se :
trouver sous leur forme tautomère:
R
:~ 12 ~`S~ ~ "
R3 ~ ~ ,~
~,
' `'''
-'~':'
WO 93/21171 PClr/FR93/00361 `
- 2
Comrne groupes convertibles en radical carboxy in vivo, on peut citer
les radicaux -C0-R6 dans le~uel R6 représente un radical -0-alk-R7,
- O-alk-O-C O-alk, -O-alk-O-C O O alk, -O-alk-O-C O-R 7, -C)-alk-O H, ;~
- O-alk-C)-alk, -O-alk-S-alk, -O-alk-O-R 7, -0-alk-S-R 7 -O-alk-C C3 O H,
S - O-alk-C O O alk, -O-alk-N R 8 R 9, -N H-alk-O-C O-alk, -N ~l-alk- O-C O O alk,
-NH-alk-O-CO-R7, -NH-alk-OH, -NH-alk-O-alk, -Nl i-alk-S-alk, -Nl l-alk-O-R7, ; .
-NH-alk-S-R7,-NH-alk-COOH,-NH-alk-COOalk,-NH-alk-NRgP~g. ~,,
Dans ces d~initions, alk représente un radical alkylbne ou alkyle, R
est un radi~ai phenyle, P~8 et Rg, identiques ou différents, représentent un
10 atome d'hydrogene ou un radical alkyle, phényle ou phénylalkyle ou bien
forrnent avec l'atome d'æote auquel ils sont rattachés un eycle pipéridino, ;~
morpholino ou pyrrolidino. -
Les atomes d'halogène sont les atomes de chlore, brome, fluor et
iode.
1~ Dans les définitions qui pré~édent et celles qui seront citées ci-après, ; -
sau~ mention corltraire, les radicaux alkyle, alcoxy et alkylbne et les portionsalkyle, alcoxy et aîkyîbne contiennent 1 a 6 atomBs de carbone en chaîne
droi~e ou rami~iée et de pr~feren~,ie 1 à 4 atomes de carbone.
;~ ~ Les compos~s de formule (I) pour lesquels soit R~, R3 et R
représentent un atome d'hydrogène et R1 représente un radical c~rboxy,
alcoxycarbonyle, -C0-NH~ ou -C0-NH-alk; soit R4 reprbsente un atorne de
chlore ou de brome, R2 et R3~ représentent un atome d'hydrog~ne et P~
repré~sente un radical carboxy~, alcoxycarbQnyle, -CO-NH2 ou -~0-N! I-alk,
soit R3 représente ;un~ ;atome~ de chlore ou de brome, R2 et R4 représentent
un~atome d'hydrogbne et;R~ représent~ un radical carboxy, alcoxycarbonyle,
GO-NH2 ou -C0-NH-alk ont deja été dacrits comme diur~tiques ~F~ussian
Pharmàcol.; and Toxico!., 40, 19-23 (1977~; Farm. Zh. (Kiev~,2, 62 (1983);
Chem. Abst., 99, 38439g (1983)).
Les autres Gomposés de formule (i), les sels de ces cornposes ~u IB5
préc~rseurs de ces composés sont no~Jveaux et 0n tant que tels font partia ~ -
de l'invention. Ce sont les composés de 10rmule (i) pour lesquels: ~ ~
-~ ~
: ,.
:
WO 93/21171 ~ ~ 3 ~ o ~ ;~ PCI/FR93/003fil
3 '
- R1 représente un radical carboxy, aicoxycarbonyle, tétrazolyle, -CO-NH2,
-CO-NH-alk, -CO-N(alk)2 -CO-NHOH, -CO-N(alk)OH, -CO-NH-O-Rs, ~
-CO-N(alk)-ORs ou -CO-R6 dans le~uel R6 représente un radical -0-alk-R7 i: .
-O-alk-O-CO-alk, -O-alk-O-C:OOalk, -O-alk-O-CO-R7, -O-alk-OH,
5 -O-alk-O-alk, -O-alk-S-alk, -O-alk-O-R7, -0-alk-S-R7, -O-alk-COOH,
-O-alk-COOalk, -O-alk-NRgRg, -NH-alk-O-CO-alk, -NH-alk-O-COOalk, : ~:
-NH-alk-Q-CO-R7, -NH-alk-C)H, -NH-alk-O-alk, -Nl l-alk-S-alk, -NH-alk-O-R7, : ^:
-NH-alk-S-R7,-NH-alk-COOH,-NH-alk-COC)alk,-NH-alk-NRgRg, ~,.,',
- R2, R3 et R4, identiques ou differents, représentent chacun un atome
d'hydrogbne ou d'halogène ou un radical alkyle, .
- Rs représente un radical alkyle ou phénylalkyle, i
- R7 représente un radical phényle,
~: .
- R8 et Rg, identiques ou différents, représentent chacun un atome
d'hydrogène ou un radical alkyle,~phényle ou phénylalkyle ou bien forment
:~ ~ 15 avec l'atome d'azote ~uquel ils ssnt rattachés un cycle pipéridino, morpholino
` ou pyrrolidinog
- alk représente un radical alkylène ou alkyle,
à l'exception: des ~composés pour lesqL~els soit R2, P~3 et R4 représentent un
atom~ d'hydrogène et R1 représente un radical carboxy, alcoxycarbonyle,
20 -G(:-NH2 ou -GO-NH-alk; ~soit R4 représ~nte un atome de chlore ou de
bromej~ R~ et R3 ~représentent un atorne d'hydrQgbne et R1 repr~sente un
radlcal carboxy, alcoxycarbonyle, :-CO-NH2~ ou -CO-NH-alk; soit R3
représente:un atome~de~chlore ou de brome, R2 et R4 représentent un
atome ~d'hydrogbne~ et R;1 représente un radical carboxy, alcoxyc~rbonyle,
: ~ ~ 25 -CO-NH2 ou -CO-NH^alk. ::
l es médicaments contenant au moins un composé nouveau de
ormule (lj, un s01 d'un tet composé ~ou un pré~urseur dlun tel composé 70nt
également partie de:l'invention.
Les nouveaux composés de formule (i) pour lesquels ~1 represente
30 un :radica! carboxy peuvent être~ prépares par hydrolyse des compos0s d~
. ~ ,.
WO 93/21171 PCI/FR93~00361
2~ ` 4
forrnute (I) correspondants pour lesquels R1 représente un radical
alcoxycarbonyle.
Cette hydrolyse s'effectue géneralement au moyen d'un base telle
qu'un hydroxyde de métal alcalin (soude, potasse, hydroxyde de lithium par
5 exemple), au sein d'un solvanf inerte tel qu'un alcool ou un m~lange eau-
alcool, eau-tétrahydrofuranne, e~u-dioxanne, à une température cornprise
entre 20 et 10QC ou au moyen de triméthylsilanolate de potassium, au sein
d'un sotvant inerte ~el que le tétrahydrofuranne, le dioxanne, le
dichlorométhane, ~ une température voisine de 20C.
Les nouveaux composés de tormule (I) pour lesquels R~ r~présente
un radical alcoxycarbonyle peuvent être préparés par cyclisation ~'un dériv~
de ~ormule: :
R
: ~ 12
~3~r S2NH2 (Il)
R4~NH--CO-COORlo
dans laquelle R2, R3 et R4 ont les mêmes significations que dans la formule
(1) et ~10 représente un radical alkyle.
~: Cette cycllsation s'effectue de préférence au moyen d'une base telle
:~ qu'un alcoolate de mbtai alcalin, au sein de l'alcool correspondant, à une
t~mpérature cc)mprise en~re 15 et 70C~
:: ~Les dériv~s de formule (113 peuvent être préparés par action d'un
20 dérivé de formuie ~
~ C(~ OOR1o (111
dans laquelle R10 a la m~me signification que dans la formule (Il) s~r un
~ .~
dérivé de formule ~
~, ~ : ',
','
;
:
';.;~'",',
,~.,
WO 93~21171 ~ 1 3 0 ~ ~ ~PCr/FRg3/~0361 :
R2 ` '"~
i`~
R3~ ~ S2NH2 (IV)
R4~ H2 ;`
dans laquelle R2, R3 et R~ ont les mêmes signi~ieations que dans la ~ormule
(1). ....
Cette reaction s'effectue au sein d'un solvant inerte tel que le ~:
té~rahydrofuranne, en présence d'une base telle qu'une amine tertiaire :~:
(triéthyiarnine par exemple), à une temp~rature voisine de 20C. ~ `
,:
Les dérivés de ~ormule (IV) sont commercialisés ou peuvent etr~
: obtenus par application ou adaptation des méthodes décrites par J. H. ~;.
SHO~T et coll., J. Amer. Chem. Soc., 82, 1135 ~1960)~ Y. GIRA~D et ooll., J. .:
Chem. Soc. P~rkin Trans 1, 1, 1043 (1979~, J. G. TC)PLISS et coli., J. M~d.
Chem., 6, 122 (1963), dans le brevet US 3251837 et dans les exemples. En
particulier, ces dérivés peuvent ~tre préparés par action d'ammoniac sur un ~ -
dérivé de formule: ;
R3~So2cl (V)
R4~ H2
,.,.,~:
15~: dans iaquelle R2, R3 ~t~R4 ont les mêmes signdications que dans la formule
Cette réaction s'effectue généralement à~une temperature voisine de
: ~: ` 2Q~
~s~dérivés de:formule (V) pèuvent être ~preparés par action de
20 ~CISO3H sur une a~iline de tormule ~
. .
R2
R3 ~L (Vl)
R4 NH2
:: ,.~ .
, .
WO 93/21171 PCI`/FR93/00361
2~-c3a~3gr~i 6
dans laquelle R2, R3 et R4 ont les mêmes signi~ications que dans la formule
Cette réaction s'effectue à une température voisine de 1 00C. ~;
Les nouveaux composés de ~orrnule (I) pour lesquels R1 représente
un radical alcoxycarbonyle peuvent égalernent être préparés par action d'un
dérivé de ~orrnule (IV) sur un oxalate de dialkyle. :~
Ce~te réaction s'~ffectue de préférence au moyen d'une base telle
qu'un alcoolate de métal alcaiin, au sein d'un solvant inerte tel qu'un alcool, à
une température voisine de 20~C. -~
Les composés de formule (I) pour lesquels R1 représente un radical
tétrazolyle peuvent être préparés par réaction d'azoture de sodium sur un
dérivé de~ormule ~
R3~ `NH (Vll)
R4 ~C--N
dans laquelle R2, R3 et R4 ont les mêmes signi~iations ~ue dans ~a formule .
, . .~.
:.".-:
~: : Cette réaction s'effectue de préférence au sein d'un solvant inerte tel
que Je~diméthyiformamide,~le dim~thoxyéthane, à une temperature comprise
I erl~re~20~:et !atemperature:d'ébullition:du milieu réactionn~
Les dérivés de~formule (VII) peuvent être obtenus par action de
~: 2 0 pentachlorure de phosphore ou de chlorure de phosphoryie sur un amide de ;
formule~
: , .
n . .,
F/3~5~H (Vlll)
R~ ~LCONH2 ~. -
. , ~ ...
~ .
, :
WO9Y21171 21~ ~ O :j PCI/FIR93/01)361
dans laquelle R2, R3 et R4 ont les mêmes significations que dans la formule ~ ;~
(1). .. :
. , .
Cette réaction s'effectue généralement à une ternpérature comprise :~
entre 2Q et 1 60C.
.
Les amides de formule (Vlll) peuvent être préparés à partir des :~
composés de formule (I) pour lesquels R1 représente un radical carboxy ou
alcoxycarbonyle par toute rnéthode connue permettant de passer d'un acide
ou d'un ester à un amide primaire ou secondaire et notammen~ par
adaptation des méthodes décrites par Q. E. KENT et coll., Organic :
Syntheses, lil, 490; W. S. BISHOP, Organic Synthesis, 111, 613. :
Les composés de formule (I) pour lesquels R1 représenta un-radical 1
-CO-NH~, -CO-NH-alk, -CO-N(alk)2, -CO-NHOH, -CO-N~alk)OH, . ;~
-CO-NH-O-Rs, -CO-N~a!k)-ORs peuvent être préparés par ~éaction d'un
; cornposé de formule (l~ ~orrespondant~ pour lequel R1 repres~nte un radical
carboxy ou alcoxycarbonyle sur un dérive de ~ormule:
, .
i-iN(R1 1~-R12: : ~IX)
dans iaquelle R11 représent~ un atome d'hydrog~ne ou un radical alkyle et
R12~représente un:atcme d'hydrogbne ou un radical alkyle, hydroxy, -O-alk 1
ou:-ORs dans lequel Rs représente un~ radical alkyle ou phénylalkyle.
Lorsque l'on met en oeuvre l'acide, on opère en présenee d'un agent
:de condensation: peptidique tel ~ ~qu'u~ carbo~iimide (par exemple le
dicyclohexylcarbodiimide) ou le N,l~ diimidazolecarbonyle, dans un solvant
i: : inerte~ tel qu'un éther ~tétrahydrofuranne, dioxanne par exemplej, un amide
(dir~éthylformamide~;par ~exemplé):~ ou un~ :~solvant chloré ~ (chlorure d~
~: 25 m~ethyl~e:,~chloroformeparexemple~,àunetempératurecomprise~ntre0C :
e~ la température de re~lux du rnilieu :réactionnel. `
Lorsque: I'on: met en ~oeuvre un :ester,; on opère soit en milieu
or9anique éventueilement en~;présence diun accepteur d'acide tel que le `;
butyllithlum, le lithien de la~diisopropylamine ou une base organique azot~e
(trialkylaminet pyridine, diaza-1,8 bicyclo~5.4.~] undécene-7 ou diaza-1,5 ;.
; bicycio[4.3.0] n~nbne par exemple), dans un sol~nt tel qUB cité ci-dessus ou i~
. .,-
: .
,~
WO 93/21171 PClr/FR93/00361
0~
un mélange de ces solvants, à une températur~ comprise entre 0C et la
température de reflux du milieu réactionnel, soit en milieu hydroorganique
biphasique en présence d'une base alcaline ou alcalinoterreuse (soude,
potasse par exernple) ou d'un carbonate ou bicarbonate d'un m~tal alcalin ou
5 alcalinoterreux, à une température comprise entre 0 et 40C.
Les nouveaux composés de formule (I) pour lesquels R1 représente
un radical -CO-R6 dans lequel R6 représente un radical -O-alk-R7,
-O-alk-V-CO-alk, -O-alk-O-COOalk, -O-alk-O-CO-R7, -O-alk-OH,
-O-alk-O-alk, -O-alk-S-alk, -O-alk-O-R7, -O-alk-S-R7, -O-alk-COOH,
10 -O-alk-COOalk, -O-alk-NRgRg, -NH-alk-O-CO-alk, -NH-alk-C)-COOalk,
-NH-alk-O-CO-R7~-NH-alk-OH,-NH-alk-O-alk,-NH-alk~S-alk,-NH-alk-O-R7,
-NH-alk-S-R7, -NH-alk-COOH, -NH-alk-COOalk, -NH-alk-NRgRg, peuvent
être préparés par réaction d'un composé de formule ~I) correspondant pour
lequel R1 représente un radical carboxy ou alcoxycarbonyle sur un dérivé ds
15 ~ormule
:~ : R6-H ()~
dans laquelle R6 a les rnêmes signific:ations que ci-dessus.
: Cette r~a~tion s'effectue dans les conditions décrites précédernment
pour la réaction cles acides ou des esters avec les dérivés de ~ormule (IX).
Z0~ ~ Les composés de~formule (I)~:peuvent être purifiés par les méthodes
connues habitu~lles, par exernple::par cristallisation, chromatographie ou
extraction~
Les composés de formule (I)~ :'peuvent être éventuellement
trans~or~més en sels métalliques ou~en sels d'addition avec les bases azotées
: 25 selon des méthodes ~nnues en~soi. Ces sels peuvent ~tre obtenus par
action d'une~ base métallique (alcalin~ ou alcalinoterreuse par ex~mple), de
I'ammoniac, d'un t~traaikylammonium, d'une amine ou d'un sel d'un acide
organique sur un composé ~de ~ormule (I), dans un solvant. Le sel ~ormé est
séparépar les méthodeshabituelles.
1: ~ 30 Ces sels ~ont également partie de l'invention.
: : . :;,.
:::
;',:
: : :"
,, ~
wo g3/2,l71 2 . ~ PCI`/FR93/00361
9 ~:
Comme exemples de sels pharmaceutiquement acceptables,
peuvent être cités les sels avec les métaux alcalins (sodiurn, potassium,
lithium) ou avec les métaux alcalinoterreux (calcium, magnésium), le sel
d'ammonium, les sels de tétraalkylammonium (tétrabutylammonium par
5 exemple), les sels de bases azotées (éthanolamine, triméthylamine,
méthylamine, benzyiamine, N-benzyl-~phénéthylamine, choline, ar~inine, ~ ~
leucine, Iysine, N-méthyl glucamine~. ;
Les composés de ~ormule (I) présentent des propriétés
pharmacologiques intéressantes. Ces composés sont des antagonistes non
compétitifs du r~cepteur N-méthyl-D-aspar~ate (NMDA) et, plus
particulièrement, ce sont des ligands pour les sites modulateurs ~e la glycine
du récepteur NMDA.
,
Par ailleurs, certains composés de formule (I) sont deq antagonistes
du récepteur acide -amino-3-hydroxy-5-méthyl-4-isoxazolepropionique
(AMPA), connu aussi sous le nom de récepteur du quisquaiate.
Ces composés sont donc utiles pour traiter ou prévenir toutes les
ischémies (telles l'ischémie focal~ ou globale) consécutives ~ des accidents
vasculaires cérébraux, un arrêt cardiaque, une hypotension artérielle, une
~ intervention chirurgicale cardiaque ou pulmonaire ou une hypoglyeérnie;; 20 sévére. Ils sont égalemen~ utiles dans le traitement des effets dus à une
anoxiej qu'elle soit périnatale ou consécutive à une noyade ou à des lésions
cérébro-spinales.~ Ges composés peuvent également être utilisés pour trait~r
o u prévènir l'év~lution de maladies neurodégénératives, de la chorée
d'HVNTlNGTQN, de la maladie d'ALZHElMER, des maladies du
m~toneurone, de la sclérose latérale amyotrophique, de l'atrophie olivo-
pontoGérébelleuse, de la maiadie de PARKINSON. Ces composés psuvent
aussi être utilisés v is-à-vis des manifesta~ion~ épileptogènes eVou
convulsives, pour ie traitement des traùmatismes cerébraux ow spinaux, de
I'~nxiété (KEHNE et c~ll., Eur. J.~ ~Pharma~olO, 193, 283 ~1991~, de la
dépression ~TRULLAS et coll.,Eur.~ J. Pharmacol., 185, 1 (1990), de la
~schizophrénie (RE~NOLDS, TIPS, 13, 116 ~1992), e~ tant qu'analgésiques
(DICKENSON et c~il., Neurosc. Letters, 121, 263 (1991), antianorexiques
~SORRELS et coll., Brain Res., 572, 265 (1992), antiémétiques,
, .
., :
-.~
~ ~ .
WO 93/21171 PCr/FR93/00361
antimigraineux et pour traiter les ernpoisonnements par des neurotoxines ou
d'autres substances agonistes du récepteur ~IMDA, ainsi que les troubles
neurologiques associés aux maladies virales telles que le sida (LiPTON et
coll., Neuron, 7, 111 (1991), la rage, la rougeole et le tétanos (BAGETTA et
5 ooll., Br. J. Pharmacol., 101, 776 (1990). Ces composés sont aussi utiles
pour la prévention des symptomes d'abstinence aux drogues et ~ I'alcool et
de l'inhibition de l'accou~umance et de la dépendance aux opiacés.
L'affinité des composés de formule (I) pour le site glycine lié au
récepteur NMDA a été déterminée en étudiant l'antagonisme de la ~ixation
10 spécifique du [3H]-DCKA (acide 6,8-dichloro kynurbnique) sur des
membranes de cortex cérébral de rat selon une rnéthode dérivée de celle
décrite par ~ARON et coll., Eur. J. Pharm., 206, 149 (1991). La [3H]-DCKA
(20nM) est mis ~ incuber en présence de 0,~ mg de protéines à 4C p~ndant
10 minutes dans du tampon HEPES (acide (N-[2-hydroxyéthyl]pipérazine-N'-
15 [2-éthanesulfonique]) 50 mM, pH7,5. La fixation non spécifique est
déterminée en présence de glycine lmM. La radioactivité liée est sépar~e
par ~iltration sur filtres Whatman GF/B. L'activité inhibitrice de ces produits ~st
généralement inférieure à 100 IlM.
L'affinité des composés de formule ~I) vis-à-vi~ du récepteur AMPA a
20 été déterminée en ~tudiant l'antagonisme de la fixation spécifique du
[3H]-AMPA sur des rnembranes de cortex cérébral de rat (HONC)RE et coll.,
; NeuroscienGe ietters, 54, 27 (1985)). Le [3H]-AMPA est mis à incuber en~: présence de 0j2 mg de protéines à 4C pendant 30 minutes dans du tampon
KH2POq 10mM, KSGN 100mM, pH7,5. La flxation non spécifique est
2s déterminée en ~présenc de~L-glutamate 1mM. La radioactivite liée est
- séparée par ~iltration sur ~iltres PHARI\~AGIA (Printed Filtermate A) L'activit~
i nhibltrice de ces produits est généralement in~érieure à 100 ~M.
~ Les compos~s d~ formule ~I) présentent une toxicite faiblè. Leur
DL50 est supérieure à 50~ mg/kg par voie IP.~ ~
:
30 : sontparticulièrBment intéressantscomme ~ntagonistes du r~cepteur
NMDA les composés de~ formule (i) pour lesquels R1 represente un radical
carboxy ou alcoxycarbonyle et R2t R3 et R4 sont des atomes d'hydrogène ou
bien R2 et R3 représentent des atomes d'hydrogène et R4 représente un
: ~,
WO 93/21171 ;~; i ''' 1~ 0 9 ``~ PCr/FR93/00361
1] ~ :
atome d'halogène ou bien R3 représen~e un atome d'hydrogene et R2 et R4
représentent des atomeis d'halogène ou des radicaux alkyle.
Sont particulièrement intéressants comme antagonistes du récepteur
AMPA les composés de ~ormule (I) pour leisquels R1 représente un radical
5 carboxy, R2 et P~4 représentent un atome d'halogène ou un radical alkyle et
R3 représente un atome d'hydrogène.
~ . ~
D'un intéret particulier sont les composés suivants ~
- 2H-1,2,4-ben20thiadiazine-1,1-dioxyde-3-carboxylate d'~thyle, ~:
- acide 2H-1,2,4-benzothiadiazine-1,1-dioxyde-3-carboxylique,
- 6,8-dichloro-2H-1,2,4benzothiadiazine-1,1-dioxyde-3 carboxylate de
méthyle, '
- acide 6,8-dichloro-2H-1,2,4-benzothladiazine-1,1-dioxyde-3-carboxylique,
- 6-iodo-2H-1,2,4-benzothiadiazine~ dioxyde-3-carboxylate de m~hyle,
acide 6-iodo-2H-1,2,4-benzvthiadiazine-1,1-dioxyde-3-carboxylique,
I ~ 15 - 6,8-di~luoro-2H-1,~j4-benzothi~diazine-1,1-dioxyde-3-carboxylate de
méthyle, ~ ~ i
acide 6,8-difluoro-2H-1,2,4-benzothidia~ine-1,1-dioxyde-3-carboxylique,
6,8-diméthyl-2H-t,2,4-benzothiadia~ine-1,1-dioxyde-3-carboxylate de
m~thyle,
20 -:aoide 6,8-diméthyl-2H-1,2,4-benzothiadiazine-1,1-dioxyde-3-carboxylique,
acide~ 8-iodo-2H-1,2,4-benzothidla~lne-1,1-dioxyde-3-carb~xylique,
- acide 6,8-dib-omo-2H-1,2,4-benzothiadiæine-1,1-dioxyde-3-carboxylique,
acid~ 6-chioro 2H-1,2,4-benzothiadiazine-1,1-dioxyde-3-carboxyliqu
Les exemples suivants il!ustrent !'invention sans la limiter.
25 ~m~
! ~
A 100 cm3 d'une solution lN de~méthylate d~ sodium dans le méthanol
agit~e sous azote à une tempérahJre voisine de 20~C, on coule lentement
WO 93/21171 ~ 3 3 PCr/FR93/00361`
12
':
une solution de 17,2 g de 2-aminobenzènesulfonamide et de 14,6 9 d'oxalate
de diéthyle dans 40 cm3 de méthanol. Après 24 heures d'agitation à cette ;
température, le milieu réactionnel est versé dans 2 litres d'eau distillée et
acidifié à l'aide d'acide chlorhydrique 1 N. Le précipité formé est filtré et lavé à
5 I'eau jusqu'à pH neutre, puis solubilisé dans 50 cm3 de diméthylforrnamide
chauffés à 100(::. La solution obtenue est refroidie et diluée avec 150 cm3
de méthanol. Les cristaux formés sont filtrés et lavés avec du méthanol. 5,3 9
de produit ainsi obtenu sont solubilisés dans 70 cm3 de diméthyl~ormarnide
puis ajoutés à 40 cm3 d'une solution de 1,4 g de potasse dans l'éthanol
10 absohJ. Le milieu réa~tionnel est agité à une température voisine de 20C
pendant 15 heures puis concentré à sec sous pression réduite. Apre~s
addition d'éther éthylique et ~iltration de l'insoluble, on obtient 6,4 g de sel de
potassium de 2H-1 ,2,4-benzothiadiazine-1,1 dioxyde-3-carboxylate-~'éthyle
s~us forme de poudre londant à 235~C.
c , ~ f
~ealp,e ~
5,4 g - de~ sel de potassium de 2H-1,2,4-benzothiadiazine
dioxyde-3-carboxylate d'éthyle sont solubilisés dans un rnélange de
20~ cm3 d'~éthanol et de 50 cm3 d'eau distillée chauffé à ~0~C. On ajoute
alors t,1 9 de potasse et on laisse la réaetion se poursuivre pendant 1 heure.
20 Le pr~cipité formé est filtré, lavé avec de l'éthanol puis séché pour conduire à
,7 9 de disel de potassiurn de l'acide 1,2,4-ben~othiadiazine
1,1-dioxyde-3-~arboxyliq~ue sous forme d'une poudre dont le point de fusion
est supéri~ur à 27aC ~Analyse % calcuié C:31,78; H:1,33; N:9,26; S:10,60;
% trouv~ C:32,4; H:1,2; N:9,3; S:10,8).
., .
25 x~m~1~ 3
A une solution methanolique~de méthylate de~sodium, préparée par additior)
de 0,75 9 de sodium dans 5Q cm3~de méthanol~, on ajoute sou~ azote 11 g de
4,6-dichloro~2^éthyloxalylarnino-benzènesul~onamide en sotution dans ie
méthanol à 4û~C. La réaction est~ poursuivie 2 heures à cette température,
30 puis 1~ mili~u réactionnel~ ~st concentré à se~ sous pression réduite. Le solide
ainsi obtenu est repris darts 1 litre d'eau distillée puis acidifié à l'aide d'acide
chlorhydrique 1N pour conduire à un précipité blanc. Après ~iltration, lavage ~`
et séchage, on obtient 8,6 g de 6,8-dichloro-2H- 1 ,2,4^benzothiadiazine
: : :~,,.',,
,,~ .,.
WO 93/21171 PCI`/FR93/û03bl
2 L~iJoi~
13
1,1 dioxyde-3-carboxylate de méthyle fondant vers 270C (Analyse % calculé
C:34,97; H:1,96; Cl:22,94; N:9,06; S:10,37; % trouvé C:34,8; H:1,8; Cl:22,8;
N:9,2; S:10~4).
Le 4,6-dichloro-2-~thyloxalylamino-benzènesulfonamide peut être préparé de
5 la manibre suivante : à une solution de t 2 9 de 2-amino-4,6-dichloro
benz~nesuHonamide et de 7,1 cm3 de triéthylamine dans 40 cm3 de
tétrahydrofuranne anhydre re~roidie à 5C, on ajoute goutte à goutte, en
environ 30 minutes, une solution de 5,8 cm3 de chlorure d'éthyloxalyle dans
5 cm3 de tétrahydro~uranne. Après une nuit d'agitation à une température
10 voisine de 20C le milieu réactionnel est concentré à sec sous pression
` réduite. Le résidu solide est lavé à l'eau puis solubilisé à chaud dans
120crn3 d'éthanol aqueux à 10% d'eau. Après refroidissement, filtration et
sécha~e des cristaux formés, on obtient 11 g de 4,6-dichloro-2-éthyl
oxalylamino-benzenesulfonamide ~ondant à 200~C.
15 Le 2-amino-4,6-dichlorobenzènesulfonamide peut etre prépar~ selon la
m~thode décrite par J.H. SHORT et U. BlERMACtlER, .J. Arn. t:h~rn. Soc.
82, 1135-1 137 (1960).
, ,.
3,1 9 de 6,8-dichloro-2H-1,2,4-benzothiadiazine-t,1-dioxyde-3-carboxylat~
20 ~ d0 méthyle ~n solution dans 400 cm3 d'éthanol absolu sont traités à 50~C
par 120 crn3 d'une solution aqueuse de potasse à 1%. Après 1 heure de
réaction à cette température~, le précipité formé est filtré, l~vé à l'éthanol puis
à I'eau et séché pour conduire à 3,2 g d'hydrate du disel de potassium d~
I'acide 6,8-di~hloro-2H-1,2,4-benzothiadiazin~-1,1-dioxyde-3-carboxylique
25 sous forme de~ poudre~fondant~ à ~une ternpérature s~périeure à 300C
(Analyse % calculé G:24,68; H:1,04; Cl:18,21~; N:7,20; S:8,24; % trouvb
C:25,5; H:1,1; Cl:17,9; N:6,9; S:719).
, ~
':.
~, ,~ . .
WO 93/21171 PCr/Fl;t~3/00361
1 ~ 14
Exemple 5
A une solution de rnéthylate de sodium, préparée à partir de 10 cm3 de
méthanol et de 0,06 9 de sodium, on ajoute une suspension de 1,03 g de
2-éthyloxalylamino-4-iodobenzènesulfonarnide dans 125 crn3 de méthanol.
5 Le mélange réactionnel est chauffé ~ 40C pendant 4 heurss, puis concentré
sous vide (16 mm de mercure). Le solide blanc obtenu est repris par
150 cm3 d'eau, filtré et le filtrat est amené à pH 1 avec de l'acide
chlorhydrique normal. Le précipité ~ormé est filtré, séché à l'air, puis à 50C
sous vide (2 mm de mercure) pour donner 0,68 9 de 6-iodo-2H-1,2,4
10 benzothiadiazin~-1,1-dioxyde-3-carboxylate de rnéthyie fondant au-dessus
de 260~C .(Analyse % calculé C:29,53; H:1,93; N:7,65; 0:17,48; S:8,76,
% trouvé C 29,9; H:2,Q; N:8,0; 0:17,4; S:8,6).
Le 2-éthylox~lylarnino-4-iodobenzènesulfonamide peut ê~re préparé de la
manière suivante: à une solution de 1,35g de 2-amino-4iodo
15 ben~ènesulfonamide dans 10 cm3 de tétrahydro~uranne et de 0,65 crn3 de
~riethylamine on ajoute ~ 5C une soiution de 0,62 ~ de chlorure
d'éthyloxalyle dans 5 cm3 de tétrahydrofuranne. Le mélange réactionnel est
agité pendant 2 heures à tempéra~ur~ ambiante, puis concentré sous vide
(16 mm de mercure). Le solide obtenu est trituré avec 15 cm3 d'~thanol
20~ aqueux (50% en volumes), ~iltré et séché à i'air pour ~ournir 1,039 de
2-ethyloxaly!amino-4-iodoben~enesulfonamide utilisé tel quel dans les
synthèses ultérieures. ~
Le 2-amino-4-iodobenzènesuNonamide peut être préparé de la rnanière
suivante : à une solution refroidie à -5C de 17,7 g d'isocyanate de
25 chlorosulfonyle dans 110; cm3 de nitrométhane on ajoute lentement une
solution ~de 21,9~g de 3-iodoaniline dans 35 cm3 de nitrométhane, puis vers
0C, 16,67 g de~ chlorure d'alurniniumi On chauffe ensuite ~ reflux et on
stoppe la réaction~quand ia température de r~flux atteint 1Q1-102C par
refroidiss~ment dans un bain de glace. Le mélange réactionnel est versé sur
30 de la glace pilée et le précipité~formé est ~ ré, lavé à l'eau et séché à l'air. Le
produit brut est purffié par chromatographie de la manière suivante 9 9 de
melange sont dissous dans 200 cm3 de méthanol et 50 cm3 de triéthylamine,
fixés sur 20 g de silice par concentra~ion à l'évaporateur rotati~, déposes sur
;: .i,.
,~
., .;~
WO 93/21171 PCI /FR93~00361
~ :1 3 ~
une colonne de 500 9 de silice et élués avec un mélange d'acétate d'éthyle,
de méthanol et de tri~thylamine (80/20/1 en volumes). On isole ainsi une
~raction qui, après évaporation, est recristallisée deux fois dans l'isopropanol,
traitée avec 20cm3 d'acide chlorhydrique décinormal, filtrée et séch~e à
5 50C pour donner 0,95 g de 6-iodo-1t2,4-benzothiadiazine-3(4H)-one-1,1-
dioxyde fondan~ au dessus de 260C. Ce produit est ensuite hydrolysé par
chauffage à 140C pendant 3 heures avsc 50 cm3 d'acide sulfurique à 50%
(en volumes)~ Le mélange réactionnel est refroidi et alcalinisé à
I'ammoniaque, ie précipité formé 0st extrait avec 100 cm3 de tert-butyle
10 méthyle oxyde et la solution organique est évaporée sous vide (16 mm de
mercure) pour donner 0,8 g de 2-amino-4-iodobenzènesulfonamide tond~nt ~
1 60Co
ExemP!~
Une suspension de 0,4 9 de 6-iodo-2H-1,2,4^benzothiadiazine~ dioxyde-3
15 carboxyiate de rnéthyle dans 150 cm3 d'éthanol contenant 0,18 9 de potasse
en pastille est chauffée pendant 2 heures à 50(:, puis refroidie dans un bain
de glace. Le solide formé est filtre, rincé avec de l'éthanol et séché à l'air. On
obtient 0,44 g du disel de potassium de l'acide 6-iodo-2H- 1 ,2,~-
benzothiadiazine~ ioxyde-3-carboxylique ~ondant au-dessus de 260(:~
20 (Analyse % calculé C:22,44; H:0,71; N:6,54; S:7,49, % trouv~ C:22,0; H:0,9;
N:6,5; S:7,4).
Exemple 7
On ~opère~ comme dans I'exemple 5 mais à partir de 1,8g g de
2-éthyioxalylamino-4,6-difluorobenzènesulfonamicle. On obtient 1,4 9 de
2j 6,8-ddluoro-ZH-1,2,4-benzoth~iadiazine-1,1-dioxyde-3-carboxylate de méthyle
fondant ~au-dessus de ~260G ~ (Analyse % calculé ~:39,14; H:2,1g; F:t3,76;
N~:10,14; S:11l61, % trouvé C:39,2; H:2,2; F:13,5; N:10,1; S:11,~).i
Le 2-ethyloxalylamino-4,6-difluorobénzènesutfonamide peut être préparé
Gomme dans liexemple ~ pour la préparation du 2-éthyloxalylamino-4-
30 iodobenzèn~sulfonamide ~ mais à~ partir de 3 g de 2-amino-4,6-
difluorobenz~nesulfonamide et de 1,97 9 de chlorure d'é~hyloxalyle. On
~3 rCI'/FR93/00361
16
,,'''
obtient 1,89 g de 2-éthyloxalylaminv-4t6-difluorobenzènesul~onamide utilisé
tel quel dans les synthèses ultérieures.
Le 2-amino-4,6-di~luorobenzènesul~onarnide peut être préparé comme dans
l'exemple 5 pour la préparation du 2-amino-4-iodobenzènesulfonamide mais
5 à partir de 10 g de 3,5-difluoroaniiine. Le produit brut résultant de la
cyclisation est ~xtr,~it avec 600 cm3 d'acétate d'éthyle au total et la solutionorganique est évaporée sous vide (16 mm de mercure). Le résidu
d'évaporation est purifié par battage dans le tert-butyle méthyle oxyde, filtr~
et séché. On obtient 11,72 g de 6,8-difluoro-1,2,4-benzothiadiiazine-3~4H)~
10 one-1,1-dioxyde que l'on hydrolyse ensuite avec 220 cm3 d'acide sulfurique
5û% ~en volun~es) pendant 5 heures à 130C. Le mélange r~actionnel est
retroidi, alcalini.sé ~ pH 8 et extrait~avec 900 cm3 d'~cétate d'~thyle au ~otal.
La salution organique est évaporée~ sous vide (16 mm de mercure~ et le
résidu d'évaporation est purHié par chromatographie sur color)ne de silice
15 (500 g) avec un mélange de cyclohexane et d'acétate d'~thyle ~70-30 ~n
vohJrnes) pour donner 4,86 9 de 2-amino-4,6-di~luorobenzènesulfonamide
sous forme d'un ~solide~ rose ~pâle utilisé tel quel dans les synthèses
ulterieures.
, ,.. ",.,
2 0 On~op~re comme dans~l'exempie 6 mais à partir de 1 g de 678-difluoro-2H~
n~ 1,2,4-benzothiad~ ne~ dioxyde-3-~carboxylate~ de méthyle. On obtient
1,13~9 du~disel de potassium; de I'acide~6,8-difluoro-2H-1,2,4-benzothidiazine-
dioxy~e-3-carboxy~ 7ue fondant au-dessus de 260C (Analyse % calculé ;
C:28,40;~ ~ H:0,60; ~ F:1~1,23; ~ N:8,28, S:9,48, ~ % t rouvé C:29,3; H:0,4; F:1 1 ,û; ~ "
25 ~ ~ N:8,5; S:9j7).
Ex~nple 2 ~
` On opbre ~ comme dans l'exemple 5 mais à partir d~ 5,24 9 d~ ~,', ,"!~ '"
2-éthyloxalyiamino-4,6-diméthylbenzbn~su.fonamide. On obtient 3,88 g de ~ ;~
6,~-diméthyl-2H-1,2,4-benzothiadiazine-1,1-dioxyde-3-carboxylate de I`
30 ~ méthyle~ondant ~ 260C,
: : ~
~..,
~' : ~: ''
`~
WO 93121171 2 1 3 ~ D g -~ Pcr/FR93/oo36l ~
1 7
Le 2-éthyloxalylamino-4,6-diméthylbenzènesulfonamide peut être préparé
cornme dans l'exemple 5 pour la préparation du 2-éthyloxalylamino-4-
iodobenzènesuHonamide mais à partir de 4,15 9 de 2-amino-4,6-
diméthylbenzènesulfonamide et de 2,73 9 de chlorure d'éthyloxalyle. On
5 obtient 5,24 g cle 2-éthyloxalylamino-4,6-diméthylbenzènesulfonamide utilisé
tel quel dans les synthèses ultérieures.
Le 2-amino-4,6-diméthylbenzènesulfonamide peut être prépare comme dans
l'exemple 5 pour la préparation du 2-amino-4,6-difluorobenzbnesulfonamide
mais à partir de 12,12 g de 3,5-diméthylaniline. On obtient 11,31 g de 6,8-
10 dirnéthyl-1,2,4-benzothidiazine-3(4H)-one-1,1-dioxyde que l'on soumet
I'hydrolyse acide dans les rnemes conditions, ce qui conduit, aprbs
chromatographie sur ~olonne de silice avec un m~lange de cyclohe~ane et
d'acétate d'éthyle (70-30 en volumes), à 6,15 9 de 2-amino-4,6-
diméthylben~ènesul~onamide sous forme de solide ros0 pâle utilisé tel quel
15 dans les synthèses ultérieures.
Ex~rn~le lO-
(:)n op~re comm~ dans llexemple 6 mais à partir de 2,88 9 de 6,8-dimethyl-
H-1,2,4-benzothiadiazine-1,1-dioxyde-3-carboxylate de méthyle. On obtient
1~; 3,6 9 du disel de pot~ssium de l'acide 6,8-diméthyl-2H-1,2,4~
20 benzothiadiazine-1 !t-dioxyde-3-carboxylique fondant au-dessus de 260C
Analyse % calculé C:36,35; ~H:2,44; N:8,48, % trouvé C:36,5; H:2,0; N:8,4).
Exerr ple 11
On: opère comme dans I'example 6 mais à partir de 2,9 9 de 7-m~thyl-2H-
1,2,4-ben~othiadiazine-1l1-dioxyde-3-carboxylate de méthyle. On obtient
25 3,4i g du disei de potassium de llàcide 7-méthyl-2H-1,2,4-benzothidiazine-
1,1-dioxyde-3-carboxylique fondant au-dessus de 260C (Analyse % calculs
C:34~16; H:1,91; N:8,85, S:10,13, % trouvé C:34,2; H:1,6; N:8,7; S:10,4).
Le 7-méthyl-2H-1,2,4-benzothiadiazine-1,1-dioxyde-3-carboxylate de m~thyle
peut ~tr~ prépare ~comme dans llexemple 5 pour la pr~paration du
30 2-éthyloxalylamino-4-iodob~nz~nesuHonarnide mais à partir de 5,6~ 9 de
;~ 2-éthyloxalylamino-5-méthylbenzènesulfonamide. On obtient ainsi 3,94 9 de
: : ~ ;:
.,,
';~ ~'"
WO93/21171 PCr/FR93/00361
?,~3~g~3 18
7-méthyl-2H-1,2,4-benzothiadiazine-1;1-dioxyde-3-carboxylate de méthyle
fondant au-dessus de 260~C ~Analyse % calculé C:47,24; H:3,96; N:11,02; ~-
S:12,61, % trouvé C:47,2; H:4,0; N: 11,1; S:12,5).
Le 2-éthyloxalylamino-5-méthylbenzènesulfonamide peut être préparé
comme dans l'exemple 5 pour la préparation du 2-amino-4,6- ~-
di~luorobenzèneisulfonamide mais à partir de 4,8i5 9 de 2-amino-5- ;
m~thylb0nzènesul~0namide et de 3,55 g de chlorure d'éthyloxalyle. On
obtient 5,65 g de 2-éthyloxalylamino-5-méthylbenzènesul~onamide fondant
208C.
Le 2-amino-5-méthylbenzènesulfonamide peut être préparé selon le procéd~
décrit par Y. GIRARD et coll., J~ Chem. Soe., Perkin Trans.l, 1, 1043 (1979).
Ex~mple 12
~,
C)n opère comme dans l'exemple 6 à partir de 2,35 g de 7-méthoxy-2H-1,214-
bsnzcthiadiazine-1,1-dioxyde-3-carboxylate de méthyle. On obtient 2,52 9 du
disel de potassium de l'acide 7-méthoxy-2H-1,2,4-benzothidiazine-1~
dioxyde-3-carboxylique ~ondant au-dessus de 260C (Analyse % calcule
C:32,52; H:1,87; N:8,43; S:9~65, % trouvé C33,2; H:1,7; N:8,5; S: 9,5). ;
:: LQ 7-méthoxy-2H-1~2,4-benzothiadiazine-1,t-dioxyde-3-carboxylate de ;
rnéthyle peut êtr~ préparé comme dans l'exemple 5 pour la préparation du
6-iodo-2H-1,2,4-benzothiadiazine-1,1-dioxyde-3-carboxylat~ de méthyle mais
à partir de 5,15 9 de 2-éthyloxalylamino-5-méthoxybenzènesulfonamide. On
obtient 2 g d~ 7 méthoxy-2H-1,7,4-benzothidiazine-1,1-dioxyde-3
carbvxylate de méthyle fondant à 257C.
. ~
Le~ 2-éthyloxa!ylamino-5-méthoxybenzènesul~onamide peut être prepar~
comme dans l'exemple 5 pour la préparation du 2~ éthyloxalylarnino-4-
iodob~enzènesulfonamide mais à partir de 4,13~ del 2-amino 5-
méthoxybenzènesul~onamide et de 2,8g de chlorure d'~thyloxalyle. On
obtien~ 5,1i5 9 de 2-éthy!oxalylamino-5-méthoxybenzbnesu!fonamid0 ~ondant
à 178C. ~ ~
Le 2-amino-5-méthoxybenzbnesul~onamide peut être préparé selon le brevet --
VS 325~837. `;~
'':
~"
WO 93/21171 PCT/FR93/003
~3~0~3
19
Fxem~l~ 1 3
On opère comme dans l'exemple 6 mais à partir de 0,39 g de 8-iodo-2H-
1,2,4-benzothiadiazine-1,1-dioxyde-3-carboxylate de méthyle. On obtient
0,36 9 du disel de potassium de l'acide 8-iodo-2H-1,2,4-benzothidiazine-1,1-
5 dioxyde-3-carboxylique fondant au-dessus de 260C ~Analyse % calcul~
C:21,53; H:1,13; 1:28,43; N:6,28; S:7,18, % trouvé C:21,5; H:1,1; 1:28,6;
N:6,~; S:6,8).
Le 8-iodo-2H-1,2,4-benzothiadiazine-1,1-dioxyde-3-carboxylate de méthyle
p~ut etre préparé comme dans l'exemple 5 pour la préparation du 6-iodo-2H-
10 1 ,2,4-benzothiadiazine-1 ,1-dioxyde-3-carboxylate de méthyle mais à partir de
0,54 g de 2-éthyloxalylamino-6-méthylbenzènesulfonamide. On obtient ainsi
0,39 g de 8-iodo-2H-1,2,4-iodobenzothiadiazine 1,~-dioxyde-3-carboxylate
de méthyle utilisé tel quel dans les synthèses ultérieures.
Le 2-éthyloxalylamino-6-iodobenzbnesul~onamide~ peut être prépar~ comme
15 dans l'exemple 5 pour la préparatio~ du 2-éthyloxalylamino-4-
iodobenzbnesul~onamide mais à partir de 0,65 g de 2-amino-6-
iodo~enzènesulfonamide et de 0,30 9 de chlorure d'éthyloxalyl~. On obtient
0,54 g de 2-éthyloxaiylamino-6-iodobenzènesulfonamide utilisé tel quel dans
I es~ synthèses ultérieures.
;~ 20 Le 2-amino-6-iodobenzènesulfonamide peu~ être pr paré comme dans
; . . . ~
I'ex~rnple 5~ pour la~ préparation du 2-amino-4-iodoberlzbnesulfonamide mais
à p~rtir de 3-iodoaniline et en ~ poursuivant l'élution de la colonne
chromàtographique avec un mélange d'acétate d'éthyle, de méthanol et d~
trléthylamine~70/30/1 en volumes). Apres traitement acide, on obtient 0,6 9
2~ dei 8-iQdo-1,2,4benzothiadlazine-3(4H)-one-191-dioxyde. Ce prodult ~st
n~suiteihydrolysé~dans~ies m~mes conditions pour donner le 2-amino-6
iodobenzènesul~onarni~e~sous forme d'~n solide`jaun~ p~le uYilisé tél quel
dans les~ synthèses ult~rieures. ~ ~ ~
On opbre comme dans l'exemple 6~ mais à partir de 1,6~ g de 6,8-dibromo-
~2H-1,2,4-benzothiadiazine-1,1-dioxyde-3-carboxylate de methyle. On obtient
.
~ ~;
:
~, i3 ~ ~ 9 PCI /FR93J00361
1,72 g du disel de potassium de l'acide 6,8-dibromo-2H-1,2,4-
benzothiadiazine-1,1-dioxyde-3-carboxylique londant au-dessus de 260C
(1H RMN: 7,52 ppm (d, J=1 ffz, 1H Ar), 7,70 (d, J=1 Hz, 1H Ar); IR: 1400
cm-1 ~COO-), 1325 cm-1 (S(:~2), 1150 cm-1 (S02)).
Le 6,8-dibromo-2H-1,2,4-benzothiadiazine-1,1-dioxyde-3-carboxylate de
m~thyle peut être prépare t,omme dans J'exemple 5 pour la préparation du
6-iodo-2H-1,2,4-benzothiatliazine~ dioxyde-3-carboxylate de méthyle mais
~ partir de 2,6 g de 2-~thyloxalylamino-4,6-dibromobenzbnesuHonamide. On
obtient 1,68 g de 6,8-dibromo-2H-1l2,4-benzothiadiazine-1,1-dioxyde 3-
carboxylate de m~éthyle utilisé tel quel dans les synthèses ultérieures.
Le 2-éthyloxalylamino-4,6-dibromobenzènesulfonarnide peut etre prépar~
comme dans l'exemple 5 pour la préparaticn du 2-éthyloxalylamino-4-
iodobenzènesulfonamide rnais à partir de 2,86 9 de ~ 2-amino-4,6
dibromobenzènesulfonamide et de 1,18 g de chlorure d'~thyloxalyle. On
obtient 256 9 de 2-éthyloxalylamino-4,6-dibromobenzènesulfonamid~ utilisé
tel qUBI dans les synthèses ultérieures.
..
Le 2-~rnino-4,6-dibromoben~ènesulfonamide peut être préparé comrne à
I'exemple 5 pour la préparation du 2-amino-4,6-di~luorobenzènesul~onamide
mais à partir de 21,9 g de 3,5-dibromoaniline. On obtient, apr~s
chromatographie sur silice, 15,5 9 de 6,8-dibrorno-1,2,4-benzothiadiazine- `~
3(4H)-one-1,1-dioxyde que l'on soumet à l'hydrolyse acide dans les mêmes
c~nditions, ce qui ~ournit, après purifioation sur colonne de siliGe~ 5,1 g de
2-amino-4,B-dibromobenzène sulfonamide sous forme de solide beige clair
utilise t~l quel dans ~les synthèses ultérieures. `
25~ ~ La 3,5-dibromoan~iline peut être preparée selon IQ procédé décrit par F~. G
SHEPHERD, J. Org. Chem. 12, 275~ 47~. ;
On opère cornme dans l'exemple 6 mais à partir de 0,9 g de 6-chloro-211~
1,2,4-benzothiadiazine~ dioxyde-3-carboxylate da méthyle~ On obti~nt
0,74~9 du disel de potassium de l'acide 6-chloro-2H-1,2,4-benzothiadiazine-
1,1-dioxyde-3-carboxylique ~ondant à une température supérieure à 260C ~ ;~
..
!
WO 93/21171 PCI/FR93/0(3361
2I30095
2 l 1 ~
(Analyse /O calculé C:28,52; H:0,90; Cl:10,53; N:8,32; S:9,52, % trouvé
C:28,5; H:0,78; Cl:10,6; N:8,1; S:9,1).
Le 6-chloro-2H-1,2,4-benzothiadiazine-1,1-dioxyde-3-carboxylate de m thyle
peut être prépar~ comme dans l'exemple 5 pour la préparation du 6-iodo-2H-
1,2,4-benzothiadiazine-1,1-dioxyde-3 carboxylate de méthyle mais ~ partir de
5,8 g de 2-éthyloxalylamino-4-chlorobenzènesulfonamide. C)n obtient 2,3 g
de 6-chloro-2H-1,2,4-benzothiadiazine-1,1-dioxyde-3-carboxylate de mkthyle
utilisé tel quel dans les synthèses ultérieures.
.
Le 2-éthyloxalylamino-4-chlorobenzènesulfonamide peut être préparé
comme dans l'exemple 5 pour la préparation du 2^éthyloxalylamino-4- -;;
iodobenz~nesuHonamide mais à partir de 4,6 g de 2-arnino-4-chloroben~ène
sulfonamide et de 3 g de chlorure d'éthyloxalyle. On obtient 3,8 9 de 2-
éthylox~lylamino-4-chlorobenzènesulfonamide utilisé tel quel dans les
synthèses ultérieures.
1~ Le 2-amino-4-chlorobenzènesulforlamide peut être préparé selon la méthode ~i
décrite~par J.G. TOPLISS et coll., J. Med. Chem., 6, 122 (1963). ~ `
, .
Les médicarnents selon l'in~/srltion sont constitu~s par un cornposé
de formul~ (I) sous forme libre ou sous ~orme d'un sel, ~ I'état pur ou sous
forme d'une composition~ dans laquelle il est associé ~ tout autre pro~luit
pharmaceutiquement compatible, pouvant être inerte ou physiologiquement
actif. Les médicaments; selon I'invention peuvent être employés par voie
orale,~parentérale, rectale~outopique.
Comme compositions solides pour ad~ministration orale, peuvent etre
utilisés des comprim~s, des piluîes.~ des poudres (capsule9 de g~latine
~i 25 cachets~ ou des granulés. Dans ces compositions, le principe acti~ selon
I 'invention est m~langé à un ou plusieurs diluants inertes, tels que amidon,
cellulose, saccharosè, lactcse ou ~ silice, sous courant dlargon. C~es
cornpositions peuvent également compren:dre des substances autres que les
diluants, par exempie un ~ou plusieurs lubrifiants teis que îe stéarat~ de
magnésium ou le talct un colorant, un;~enrobage (dragées~ ou un vBrnis.
~;
:
WO93/Z1171 ~, P~/FR93/00361 `
22
Comme compositions liquides pour administration orale, on peut i
utiliser des solutions, des suspensions, des émulsions, des sirops et des
élixirs pharmaceutiquement acceptables contenant des diluants inertes tels
que l'eau, I'éthanol, le glycérol, les huiles végétales ou l'huile de paraffine.Ces compositions peuvsnt comprendre des substances autres qUB les -
diluants, par exemple des produits mouillants, édulcorants, épaississants,
aromatisants ou stabilisants.
. .
Les compositions stériles pour administration parentérale, peuvent
être de pré~érence des solutions aqueuses ou non aqueuses, des
suspensions ou des émulsions. Comme solvant ou véhicule, on peut
employer l'eau, le propylènegiyool, un polyéthylèneglycol, des huiles
végétales, en particulier l'huile d'olivel des esters organiques injectables, par
exemple l'oléate d'~thyle ou d'autres solvants organiques convenables. Ces
compositions peuven~ également contenir des adjuvants, en particulier des
agents mouillants, isotonisants, émulsifiants, dispersants et stabilisants. La
~ stérilisation peut se ~alre de plusieurs ~açons, par exemple par ~iitration
- ~ aseptisante, en incorporant à la composition des agents stérilisants, par irra-
diation vu p~r chauffage. Elies ~peuvent également etre preparées sous ~orme
de compositions solides stériles qui peuvent être dissoutes au moment de
20 ~I'emploi dans de l'eau stérile ou tout autre milieu stérile inject~ble.
Les compositions pour administration rectale sont les suppositoires
ou les capsules rectales qui contiennent, outre le produit actif, des excipientstels que le beurre~ de cacao, des glycérides semi-synthéticlues ou des
polybthylènegtycols.
; 2$ ~ ~ Les compositions pour~ administration topique peuvent être parexemple des crèmes, lotions, ~collyres, collutoires, gouttes nasales ou
aérosols.
"
En thérapeutique humaine, les composés selon l'invention sont
particulièrement utiles pour le traltement et/ou la prévention des conclitions
30 qui requièr~nt l'administration d'un antagoniste du récepteur NMDA ou d'un
antagoniste du récepteur AMPA. Ces composés s~nt notamment utiles pour
traiter ou prévenir toutes les ischémies et en particulier l'ischérni~ cérébrale~
les effets dus à une anoxie, liévolution de maladies neurodég~nératives, de
. - .
~, ~
....
~ .:
W~ 93/21171 213 i~ ~ 9 ~ PCr/FR93/00361
23
':
la chorée d'HUNTlNGTON, de la mal~die d'ALZHElMER, des maladies du
rnotoneurone, de la sclérose latérale amyotrophique, de l'atrophie olivo-
pontocérébelleuse et de la maladie de PARKlNSONt vis-à-vis des
manifes~ations épileptogènes eVou convulsives, pour le traitement des
5 traumatismes cérébraux ou spinauxt d~ l'anxiétét de la dépression, de la
schizophrénie, en tant qu'analgésiques, antianorexiques antiémétiques,
antimigraineux et pour traiter les empoisonnements par des neurotoxines ou
d'autres substances agonistes du récepteur NMDA, ainsi que les troubles
neurologiques associ~s aux maladies virales telles que le sida, la rage, la
10 rougeole et le tétanos. Ces composés sont aussi utiles pour la prévention
des symptomes d'abstinence aux drogues et à l'~lcool et de l'inhibition de
l'aecoutumance et de la dépendance aux opiacés
Les doses dépendent de l'effet recherché, de la dwee du traitement
et de la voie d'administration utilisée; elles sont généralement comprises
15 entre 10 mg et 100 mg par jour par voie orale pour un aduite avec des doses
unitaires allant de 5 mg à 50 mg de substance active.
D'une façon générale, le médecin déterrnin~ra la posologie
appropirée en fonction de l'âge, du poids et de tous les autres facteurs
propres au sujet à traiter.
20 Les exemples suivants illustrent des compositions selon l'invention:
EXEMP! E A
~ .
On prépare1 selon la technique habituelle, des gélules dosées à
50 mg de produit actif ayant la composition suivante: ~-
- Acide 6,~-dichloro-2H-1,2,4-benzothiadiazine~
.
` 25 -dioxyde-3-carboxylique.......................... 50mg
- Cellulose...................................... 18 mg
- Lactose........... u..................................... 55 mg
- Silioeoolloïdale............. ~...................1 m~
- Carboxymethylamidon sodique.. O.................. 10 m~
3G - Talc.............................. .............. 10 mg
- Stéarate de magnésium............. .............. 1 rng -
...
~,.
WO 93/21171 P~/FR93/00361
a~1 24
EXEMPLE B .
On prepare selon la technique habituelle des comprimés dosés à ;
50 mg de produit actif ayant la composition suivante: ~:
:
- 6,8-dichloro-2H-1,2,4-benzothiadiazine-1,1 ~ `
-dioxyde-3-carboxylate de méthyle................ 50 rng ~::
- Lac~ose......................................... 104 mg
- Cellulose....................................... 40 mg
-Polyvidone........................................ 10mg :;
- Carboxyméthylamidon sodique..................... 22 mg
- Talo............................................ 10 mg
- Stéarate de magnésium............................ 2 mg ~.
- Silice colloïdale................................ 2 mg
- Mélange d'hydroxyméthylcellulose, glycérine, oxyde de , ~
titane (72-3,5-24,5) q.s.p. 1 comprimé pelliculé ~ermin~ ~ 245 mg -.
15 EXEMPLE C
On prépare une solution inJectabl~ contenant 10 mg de produit actif ..
ayantlacom,~osition suivante: -
, ,, i;
- Acide 2H-1,2,4-benzothiadiazine-1,1 ; .
dioxyde-3-carboxyiique........................ 10 mg
- A~ideb~n~oïque.... O.................................. 80 mg
Alcool benzylique................................. .... Q,06 cm3 ~-
nzoa~e de sodium............................. 80 mg
;~ Ethanol à ~95~ %............................... 0,4 cm3 ~ .
- Hydroxyde de: sodium.... ~..................... 24 mg ~:
23 ~- Propylene gly~ol.. ~........ ~........................ 1,6 cm3
- ^ Eau................ q.s.p. 4 cm3 ~-
. .
.
. ;,'~.
' :~ '
, ,.
: '
~ ;',
.-:~..
-:;...