Note: Descriptions are shown in the official language in which they were submitted.
wo 93/23389 ~ ~ ~ 6 ,? I 1 PCI /FR93/00477
NO~JVEAUX I2ERIVES DU TAXANE~. LEURP~RATIO~1
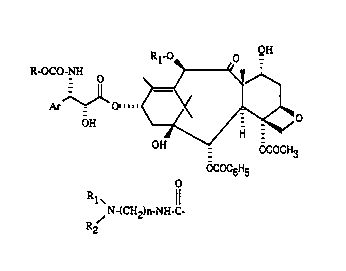
- I,a presente invention concerne de nouvealLlc dérivés du taxane de fonnule
générale: ~`
- R-OCo-NH O ;~
OH 7~
OH - OCOCH3
.~,, OCOC6H5
leur préparation et les compositions pharmaceutiques qui les contiennent.
Dans la formule générale (I), Ar représente un radical aryle, Rl représente
un atome d'hydrogène ou un radical acétyle ou un radical de formule générale:
o
s' R~
N-(CH2)n-NH-C- (II)
., .
10 dans laquelle:
R1 et R2, identiques ou différents, représentent un atome d'hydrogène ou un radical
aLkyle contenant 1 à 4 atomes de carbone en chaîne droite ou ramifiée, ou bien Rl et
.- R2 forment ensemble avec l'atome d'azote auquel ils sont lié;s un hétérocycle, sature
ou non saturé, à 5 ou 6 chaînons contenant éventuellement un second hétéroatome
;~'f 15 choisi parmi les atomes d'azote (éventuellement substitué par un radical alkyle
~ contenant 1 à 4 atomes de carbone ou benzyle), d'oxy~ène et de soufre,
;~i
nestégalà20u3,
et R représente
- un radical alcoyle droit ou ramifié contenant 1 à 8 atomes de carbone, alcényle
20 contenant 3 à 8 atomes de carbone, alcynyle contenant 3 à 8 atomes de carbone,
cycloalcoyle contenant 3 à 6 atomes de carbone, cycloalcénvle contenant 4 à 6
- atomes de carbone ou bicycloalcoyle contenant 7 à 10 atomes de carbone, ces radi-
caux étant éventuellement substitués par un ou plusieurs substituants choisis parmi
les a~omes d'halogène et les radicaux hydroxy, alcovloxv contenant 1 à 4 atomes de
25 carbone, dialcoylamino dont chaque partie alco!,~le contient 1 à 4 atomes de carbone.
.!
"~
-;
2136
`'~
.. ,
I
pipéridino, morpholino, pipérazinyl-1 (éventuellement substitué en -4 par un radical
alcoyle contenant 1 à 4 atomes de carbone ou par un radical phénylalcoyle dont la
partie alcoyle contient 1 à 4 atomes de carbone), cycloalcoyle contenant 3 à 6 atomes
de carbone, cycloalcényle contenant 4 à 6 atomes de carbone, phényle, cyano,
/? 5 carboxy ou alcoyloxycarbonyle dont la partie alcoyle contient 1 à ~ atomes de
3 carbone,
- ou un radical phényle éventuellement substitué par un ou plusieurs atomes ou radi-
` caux choisis parmi les alomes d'halogène et les radicaux alcoyles contenant 1 à 4
atomes de carbone, alcoylox,v contenant 1 à 4 atomes de carbone,
`~ 10 - ou un radical hétérocyclyle azoté saturé ou non saturé contenant -? OU 6 chaînons et
éventuellemen~ substitué par un ou plusieurs radicaux alcoyles contenant 1 à 4
5 atomesde carbone,
étant entendu que les radicaux cycloalcovles, Cyf cloalcényles ou bicycloalcoyles peu-
vent être éventuellement substitués par un ou plusieurs radicaux alcoyles contenant 1
à 4 atomes de carbone.
De préference Ar représente un radical phényle ou a- ou ~-naphtyle éven-
tuellement substitué par un ou plusieurs atomes ou radicaux choisis parmi les atomes
f d'halogène (fluor, chlore, brome, iode) et les radicaux alcoyles, alcényles, alc,vnvles,
, aryles, arylalco- les, alcox-, alcoylthio, ar lox-, arvlthio, hydroxy, hydroxyalcoyle,
?? 20 mercapto, form~ le. acyle. acylamino, aroylamino, alcoxycarbonylamino, amino,
allcylamino, dialkylamino, carboxv, alcoxycarbonvle, carbamoyle, dialcoylcarba-
moyle, cyano, nitro et trifluoromethyle, élant entendu que les radicaux alcoyles et les
portions alcovles des autres radicaux contiennent 1 à 4 atomes de carbone que les
radicaux alcényles et alc~,nvles coMiennem 3 à 8 atomes de carbone et que les radi-
? 25 caux aryles sont des radicaux phényles ou ~- ou ~-naphtyles.
Dans le brevet européen EP-A-0 2~3 738 est décrit le docetaxel (Taxotere(g
) et dans Chem. Abslr., 107. 211;32r (1987) sont décrits le paclitaxel (Taxol(É~)) et
son épimère en position -7 qui présentent des activités équivalentes.Il a eté trouve
que les produits selon l'invention manitestent une activite significative sur des
cellules resistantes à des produits anticancereux connus.
? Selon la présente in-~ention, les nouveaux dérives du taxane de formule
générale (I) peuvent être obtenus par chauffaoe d'un dérivé de formule générale:
?
3 ~U!L~E \A''n~
2~35211
2 bis
R-OCO-I`III o ~ (111)
` ' OH OCOCH3
. OCOC6H5
. .
.,
. ~
1A
,..,;,
FEU~LLE i~r~
-
WO 93/23389 ~ I ~ 5 21 I PCr/FR93/00477
dans laquelle R, Rl et Ar sont définis comme préeédemment, en solution dans un
alcool aliphatique contenant 1 à 4 atomes de carbone (méthanol, éthanol, propanol, ~.
isopropanol) à une température comprise entre 20C et 97C en présence d'une
quantité catalytique d'acide de Lewis tel que le bromure de zinc. La durée du
5 chauffage peut varier de 6 heures à 8 jours.
Les dérivés du taxane de formule générale (III) dans laquelle Rl représente
un atome d'hydrogene ou un radical ac~étyle peuvent être obtenus par action d'undérivé réactif de formule générale:
R-O-CO-X (IV)
10 dans laquelle R est défini comme précédemment et X représente un atome d'halo-
gène (fluor, chlore) ou un reste -O-R ou -O-CO-OR, sur un dérivé de la baccatine III
ou de la désacétyl-10 baccatine III de formule générale:
OH ~O ~ )
OH OC0CH3
OCOC6H5
dans laquelle Ar est défini comme précédemment, G1 représente un groupement
15 protecteur de la fonction hydroxy tel qu'un radical trichloro-2,2,2 éthoxycarbonyle
ou triaL~cylsilyle, dialkylarylsilyle, aL~cyldiarylsilyle ou triatylsilyle dans lequel
chaque partie alkyle contient 1 à 4 atomes de carbone et chaque partie aryle repré-
sente de préférence un radical phényle et G2 représente un radical acétyle ou ungroupement protecteur de la fonction hydroxy tel qu'un radical trichloro-2,2,2
20 éthoxycarbonyle, pour donner un produit de formule genérale:
R O C~ o ~ ~VI)
OCOC6H~
w093~23389 PCr/FR93/00477 i ~
213~2~ I 4
. .
dans laquelle Ar, R, Gl et G2 sont définis comme précédemment, suivie du rempla-'. cement des groupements G1 et éventuellement G2 par des atomes d'hydrogène pour
-~ donner le produit de formule générale (III).
. Le dérivé de la baccatine III ou de la désacétyl-10 baccatine m de formule
-~ 5 générale (V) peut être obtenu par action d'un acide minéral ou organique, dans des
conditions qui son~ sans effet sur les groupements pro~ecteurs Gl et G2, sur un
` produit de forrnule générale:
soc-N ~ O H
- R2~R3 OH OCOCH3
OCOC6H5
dans laquelle Ar, Gl et G2 sont définis comme précédemment, B,oc represente le
' 10 radical tert-butoxycarbonyle et R2 et R3, identiques ou différents, représentent un
atome d'hydrogène ou un radical alcoyle contenant 1 à 4 atomes de carbone, éven-tuellement substitué par un ou deux radicawY aryles (phényle) ou aryle (phényle) ou
bien R2 et R3 forment ensemble avec l'atome de carbone auquel ils sont liés un cycle
ayant de 4 à 7 chaînons.
; 15 Le produit de formule (VII) peut être obtenu par action d'un dérivé de l'oxa-
zolidine de formule générale:
Ar~ ~COOH
Boc-N O (VIII)
X
R2 R3
dans laquelle Ar, R2, R3 et Boc sont définis comme précédemment, éventuellement
rous forrne d'anhydride sur un denvé du taxrne de forrnule generale:
wo 93/23389 21 3 6 ~1 1 pcr/FRg3/oo477
. 5
~' HO~ ~ nx)
OH - OCOCH3
,.~,. O(:C~C6H5
dans laquelle Gl et G2 sont définis comme précédemment, en opérant en présence
d'un agent de condensation et d'un agent d'activation dans un solvant organique à une
température comprise en~e 0 et 90C.
. 5 Le dérivé de l'oxazolidine de forrnule générale (VIII) peut être obtenu par
saponification en milie~ basique de l'ester correspondant qui est lui-même obtenu par
; action d'un méthoxyalcène éventuellement subs~tué par un ou plusieurs radicawc
aryles, d'un gem-diméthoxyalcane éventuellement substitué par un ou plusieurs radi-
caux aryles ou d'un gem dimé~oxycycloalcane contenant 4 à 7 atomes de carbone
-s 10 sur un dérivé de la phénylisosérine de formule générale:
- Ar ~COOR4
'.'-if ~ (X)
BocNH OH
;r' dan~ laquelle Ar et Boc sont définis comme précédemment et R4 représente un radi-
cal alcoyle contenant 1 à 4 atomes de carbone éventuellement substitué par un radi-
< cal phényle
~',f 15 Le produit de formule générale (X) peut être obtenu par acylation d'un
dérivé de la ~phénylisosérine de fonnule générale:
Ar ~COOR4
~ (XI)
H2N OH
~, dans laquelle Ar et R4 sont définis comme precédemment.
Le dérivé de la ~phénylisosérine de formule ~énerale (XI) peut etre obtenu
selon les méthodes connues et en particulier à paIIir de l'acide ~phénylglycidique
dans les conditions décrites parJ-N. Denis et coll., J. Org. Chem., ~L 46-50 (1986).
~3
,.
WO 93/2338g PCr/FR93/00477
. .
`~ 2~ 36~ 1 6
Les dérivés de formule générale ~III) dans laquelle Rl représente un radical
de formule générale (II) dans laquelle Rl, R2 et n sont définis comme précédemment
peuvent être obtenus par action d'une amine de formule générale:
Rl~
- /N-(CH2~n-NH2 (XII)
R2
~, 5 dans laquelle R~ 2 et n sont définis comme précédemment, sur un dérivé du taxane
, de fonnule générale:
C13CCH20COO O-CO-OCH2CC13
R-O-CO-NH
Ar _ ~0 (~II)
OH - OCOCH3
OCOC H
dans laquelle Ar et R sont définis comme précédemment, suivie du remplacement du,'.! gr~upement protecteur en -7 (Cl3CCH2OCO-) par un atome d'hydrogene en opérant
~:. 10 à une température inférieure à 50C.
L'exemple suivant illustre l'invention.
~:X~'I~
A une solution de 2,5 g de tert-butoxycarbonylamino-3 hydroxy-2 phenyl-3
propiona~e-(2R,3S~ d'acétoxy4 benzoyloxy-2c~ époxy-513,20 trihvdroxy-1,7t3,10~3
oxo-9 taxène-11 yle-13a dans 500 cm3 de méthanol on ajoute 0,25 g de bromure de
zinc anhydre. Le milieu réactionnel est chauffé sous agitation pendant 50 heures à
une température voisine de 50C puis refroidi à une température voisine de 20C et
maintenu sous agitation à cette température pendant 1~ heures. Le milieu reactionnel
est ensuite concentré à sec sous pression réduite (2,7 kPa) à 50C~ On obtient 2,5 g
20 d'une meringue blanche que l'on purifie par chromatographie sur 60 g de silice
(0,063-0,2 mm) contenus dans une colonne de 2,5 cm de diamètre [éluant: dichlo-
rométhane-méthanol (98-2 en volumes)~ en recueillant des fractions de 20 cm3~ Les
fractions 19 à 35 sont réunies et concentrées à sec sous pression reduite (2,7 kPa) à
une température voisine de 40C~ On obtient ainsi 1,2 _ d'une merin~ue blanche que
25 l'on purifie à nouveau par une seconde chromato~raphie sur 60 tT de silice
:` ~
;~ '^- W 0 93/23389 2~ 3 62 1 1 PC~r~FR93/00477
.. . .
-3 (0,063-0,2 mm) contenus dans une colonne de 2,5 cm de diamètre [éluant :
dichlorométhane-méthanol (99-1 en volumes)] en recueillant des fractions de 10
cm3. Les &actions 26 à 40 sont réunies et concentrées à sec sous pression réduite
(2,7 kPa) à une température voisine de 40C. On obtient ainsi 0,91 g de tert-
butoxycarbonylamino-3 hydroxy-2 phényl-3 propionate-~2R,3S) d'acétoxy4
benzoyloxy-2a époxy-5~,20 trihydroxy-1,7a,10~ oxo-9 taxène-11 yle-13 sous
forme d'une medngue blanche dont les caractéristiques sont les suivantes:
- pouvoir rotatoire: la~20D = -35 (c = 0,41; méthanol)
- spectre de RMN (250 MHz; CDCl3)
~ (ppm): 1,11 (s, 3H: -C~3 16 ou 17); 1,25 ~s, 3H: -C~3 16 ou 17); 1,32 (s, 9H:
~, -C(C~13)3); 1,73 (s, 3H: -C~3 19); 1,78 (s, 3H: -C~3 18); 2,15 à 2,45 (m, 4H:
-C~2- 6 et -C~2- 14); 2,5 (s, 3H: -COC~3); 3,3 (m, lH: -O~l 2'); 3,68 (ddd, lH,
J=12,6et4Hz:-~7);3,94(d,1H,J=7Hz:-~3) ;4,13(m,1H:-OH10) ;4,4
(ab, 2H, Jab = 9 Hz: -C~2- 20); 4,64 (m, lH: -~ 2'); 4,72 (d, lH, J = 12 Hz:
-0~7);4,92(dd,1H,J=9et5Hz:-~5);5,29(dd,1H,J=lOet2,5Hz:-~3');
5,42 (d, lH, J = 10 Hz: -NHCO-); 5,46 (s, lH: -~ 10); 5,75 (d, lH, J = 7 Hz:
-~ 2); 6,28 (t, lH, J = 8,5 Hz: -~ 13); 7,2 à 7,5 (m, 5H: -C6~s 3'); 7,52 [t, 2H,
J = 7,5 Hz: -OCOC6Hs (-~ 3 et -~ 5)]; 7,63 [t, lH, J = 7,5 Hz: -OCOC6Hs
(-~1 4)]; 8,14 [d, 2H, J = 7,5 Hz: -OCOC6Hs (-~ 2 et -~ 6).
Les nouveaux produits de formule générale (l) présentent des activités bio-
logiques particulièrement intéressantes.
Les nouveaux produits de fonnule générale (I) manifestent une activité
inhibitrice significative de la prolifération cellulaire anormale et possèdent des pro-
priétés thérapeutiques permettant le traitement de malades ayant des conditions
pathologiques associées à une prolifération cellulaire anormale. Les conditions
pathologiques incluent la prolifération cellulaire anormale de cellules malignes ou
non malignes de divers tissus et/ou organes comprenant, de manière non limitative,
les tissus musculaires, osseux ou conjonctifs, la peau, le cerveau, les poumons, les
organes sexuels, les systèmes lymphatiques ou rénaux, les cellules marnmaires ousanguines, le foie, I'appareil digestif, le pancréas et les glandes thyroides ou adré-
nales. Ces conditions pathologiques peuvent inclure également le psoriasis, les
tumeurs solides, les cancers de l'ovaire, du sein, du cerveau, de la prostate, du colon,
de l'estomac, du rein ou des testicules, le sarcome de Kaposi, le cholangiocarcinome,
le choriocarcinome. Ie neuroblastome, la tumeur de Wilms, la maladie de Hodgkin,
-- 21362~ ~
les lymphomes granulocytaires ai~us ou chroniques. Les nouveaux produits selon
l'invention sont particulièrement utiles pour le traitement du cancer de l`ovaire. Les
produits selon l'invention peuvent être utilisés pour prévenir ou retarder l'apparition
ou la réapparition des conditions pathologiques ou pour traiter ces conditions
S pathologiques.
Les produits selon l'invention peuvent être administrés à un malade selon
différentes formes adaplées à la vcie d'administration choisie qui, de préférence, est
la voie parentérale. L'administration par voie parentérale comprend les admirlistra-
tions intraveineuse, intraperitonéale, intramusculaire ou sous-cutanée. Plus particu-
lièrement préférée est l'administration intrapéritonéale ou intraveineuse.
- La présente invention comprend également les compositions pharmaceu-
' tiques qui contiennem au moins un produit de ~ormule générale (I) en une quantité
suffisante adaptée à l`emploi en thérapeutique humaine ou vétérinaire. Les compo-
sitions peuvent être préparées selon les méthodes habituelles en utilisant un ou plu-
sieurs adju--ants, supports ou excipients pharmaceutiquement acceptables. Les sup-
ports convenables inciuent les diluants, les milieux aqueux steriles et divers solvants
non toxiques. De prérerence les compositions se présentent sous forme de solutions
ou de suspensions aqueuses, de solutions injeclables qui peuvent contenir des agents
émusifiants, des colorants, des préservatifs ou des stabilisants.
Le choix des adjuvants ou excipients peut être déterminé par la solubilité et
les propriétés chimiques du produit, le mode particulier d'administration et lesbonnes pratiques pharmaceutiques.
Pour l'administration parentérale, on utilise des solutions ou des suspensions
stériles aqueuses ou non aqueuses. Pour la préparation de solutions ou de suspensions
non aqueuses peuvent être utilisés des huiles véaétales naturelles telle que l'huile
d'olive, l'huile de sésame ou l'huile de paraffine ou les esters organiques injectables
tel que l'oléate d'éthyle. Les solutions stériles aqueuses peuvent être constituées d'une
solution d'un sel pharmaceutiquement acceptable en solution dans de l'eau. Les
~j solutions aqueuses conviennent pour l'administration intraveineuse dans la mesure où
le pH est convenablement ajusté et où l'isotonicite est realisée, par exemple, par une
quantité suffisante de chlorure de sodium ou de olucose. La stérélisation peut être
réalisée par chauffa~e ou par tout autre moyen qui n'altère pas la composition.
Il est bien entendu que tous les produits entrant dans les compositions selon
l'invention doi~ent etre purs et non to~iques pour les quantites utilisées.
FEIll-LE ~/IO~IFlEE
~, -
wo 93/23389 213 6 21 1 pcr/FR93/oo4
Les compositions peuvent contenir au moins 0 01 % de produit thérapeuti-
quement ac~if. La quantité de produit actif dans une composition est telle qu'une
posologie convenable puisse être prescrite. De préférence, les compositions sontpréparees de telle façon qu'une dose unitaire contienne de 0,01 à 1000 mg environ de
5 produit actif pour l'adminis~ation par voie parenterale.
Le traitement thérapeutique peut être effectué concuremment avec d'autres
~aitements thérapeutiques incluant des médicaments antinéoplastiques, des anticorps
monoclonaux, des thérapies immunologiques ou des radiothérapies ou des
modificateurs des réponses biologiques. Les modificateurs des réponses incluent, de
10 manière non limitative, les lymphokines et les cytokines telles que les interleukines,
les interférons(a, ~ ou ~) et le TNF. D'autres agents chimiothérapeutiques utiles dans
le traitement des désordres dus à la prolifération anormale des cellules incluent, de
manière non limitative, les agents alkylants tels que les moutardes à l'a~ote comme la
mechloretamine, le cyclophosphamide, le melphalan et le chlorarnbucil, des sulfo-
15 nates d'alkyle comme le busulfan, les nitrosourees comme la carrnustine, la lomu-
sine, la sémustine et la streptozocine, les triazènes comme la dacarbæine, les antimé-
tabolites comme les analogues de l'acide folique tel que le méthotrexate, les ana-
logues de pyrimidine comme le fluorouracil et la cytarabine, des anslogues de
purines comme la mercaptopurine et la thioguanine, des produits naturels tels que les
20 alcaloides de vinca comme la vinblastine, la vincristine et la vendésine, des épipodo-
phyllotoxines comme l'étoposide et le teniposide, des antibiotiques comme la dacti-
nomycine, la daunorubicine, la doxorubicine, la bléomycine, la plicamycine et lamitomycine, des enzymes comme la L-asparaginase, des agents divers comme les
complexes de coordination du platine tel que le cisplatine, les urees substituées tel
25 que l'hydroxyurée, les dérivés de méthylhydrazine comme la procarbazine, les sup-
presseurs adrénocoticoïques comme le mitotane et l'aminoglutéthymide, les
hormones et les antagonistes comme les adrénocorticostéroides comme la predni-
sone, les progestines comme le caproate d'hydroxyprogestérone, I'acétate de
méthoxyprogestérone et l'acétate de megestrol, les oestrogènes comme le diéthylstil-
30 bestrol et l'éthynylestradiol, les antioestrogène comme le tamoxifène, les andro&ènescomme le propionate de testostérone et la fluoxymes~erone.
Les doses utilisées pour mettre en oeuvre les méthodes selon l'invention
sont celles qui permettent un traitement prophylactique ou un maximum de réponsethérapeutique Les doses varient selon la forme d'adrninistration, le produit particu-
35 lier sélectionné et les caractéristiques propres du sujet à traiter. En général, les doses
-- 2136211
, 10
sont celles qui sont thérapeutiquement efficaces pour le traitement des désordres dus
à une prolifération cellulaire anormale. Les produits selon l'invention peuvent être
.- administrés aussi souvent que nécessaire pour obtenir l'effet t'nérapeutique désiré.
Certains malades peuvent répondre rapidement à des doses relativement fortes ou
5 faibles puis avoir besoin de doses d'entretien faibles ou nulles. Généralement, de
faibles doses seront utilisées au début du traitement et, si nécessaire, des doses de
i plus en plus fortes seront administrées jusqu'à l'obtention d'un effet optimum. Pour
d'autres malades il peut être nécessaire d'adminislrer des doses d'entretien 1 à 8 fois
par jour, de préférence 1 à 4 fois, selon les besoins physiologiques du malade consi-
10 déré Il est aussi possible que pour ceftains malades il soit nécessaire de n'utiliser
qu'une à deux administrations journalières.
Chez l'homme, les doses sont genéralement comprises entre 0,01 et
200 mg/kg. Par voie intrapéritonéale, les doses seront en géneral comprises entre 0,1
et 100 mg/kg et, de préférence entre 0,5 et 50 mg/kg et, encore plus spécifiquement
15 entre 1 et 10 mg/kg. Par voie intraveineuse, les doses sont généralement comprises
entre 0,1 et 50 mg/kg et, de préférence entre 0,1 et; mg/kg et, encore plus spécifi-
quement entre 1 et 2 mg/kg. Il est entendu que, pour choisir le dosage le plus appro-
prié, devront être pris en compte la voie d'administration, le poids du malade, son
état de santé général, son âge et tous les facteurs qui peuvent influer sur l'efficacité
20 du traitement.
L'exemple suivant illustre une composition selon l'invention.
EXEMPLE
On dissout 40 mg du produit obtenu à l'exemple 1 dans 1 cm3 d'Emulphor
EL 620 (~ et 1 cm3 d'éthanol puis la solution est diluée par addition de 18 cm3 de
25 sémm physiologique.
La composition est administrée par introduction dans une perfusion d'un
;~Jsoluté physiologique pendant 1 heure.
.~
~;~
F~UlLLE ~