Note: Descriptions are shown in the official language in which they were submitted.
WO 94/20109 PCT/FR94100207
APPLICATION DE DERIVES DE
2H-1,2,4-BENZOTHIADIAZINE-3(4~1)-ONE-1,1-DIOXYDE COMME
ANTAGONISTES NON COMPETITIFS DU RECEPTEUR NMDA
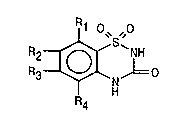
La présente invention concerne une nouvelle application
5 thérapeutique des composés de formule:
1 O~ "0
R3~N,L=o
ou d'un sel d'un tel composé.
Dans la formule (I), R1, R2, R3 et R4, identiques ou différents,
représentent un atome d'hydrogène, d'halogène ou un radical alkyle ou
10 alcoxy étant entendu que R1, R2, R3 et R4, ne représentent pas tous les
quatre un atome d'hydrogène.
Dans les définitions qui précédent et celles qui suivent, les radicaux
alkyle et alcoxy contiennent 1 à 6 atomes de carbone en chaîne droite ou
ramifiée, et, de préférence, de 1 à 4 atomes de carbone.
Les composés de formule (I) sont décrits comme antihypertenseurs
(brevet BE 614008), antimicrobiens (ll Farmaco, 29, 915 (1974); ll Farmaco,
28, 777 (1973)), bactéricides (Chem. Abst., 98, 179337 (1983)),
hyperglycémiques (J. Pharmacol. Exp. Ther., 164, 421 (1968), pour leur goût
sucré (Chem. Abst., 55, 19943 (1960) et comme intermédiaires de synthèse
(brevet EP 161498; Chem. Abst., 85, 63097 (1976); Chem. Abst. 69, 2940
(1968)).
Il a maintenant été trouvé que ces composés sont des antagonistes
non compétitifs du récepteur N-méthyl-D-aspartate (NMDA) et, plus
particulièrement, sont des ligands pour les sites modulateurs de la glycine du
récepteur NMDA.
WO 9~/20109 PCT/FRg4/00207 ~
2~5~9~ 2
Les composés de formule (I) peuvent être préparés par réaction
d'une aniline de formule:
R3~NH2 (Il)
R4
dans laquelle R1, R2, R3 et R4 ont les mêmes significations que dans la
5 formule (I) avec l'isocyanate de chlorosulfonyle.
Cette réaction s'effectue au sein d'un solvant inerte tel que le
nitrométhane, le nitroéthane, le nitrobenzène, le disulfure de carbone, le
tétrachloroéthane, en présence d'un catalyseur de type FRIEDEL-CRAFTS
tel que le chlorure d'aluminium, le tétrachlorure de titane, le tétrachlorure de10 zirconium, à une température de 40 à 1 05C.
Les composés de formule (I) peuvent etre purifiés par les méthodes
connues habituelles, par exemple par cristallisation, chromatographie ou
extractions.
Les composés de formule (I) peuvent être éventuellement
15 transformés en sels métalliques ou en sels d'addition avec les bases azotées
selon des méthodes connues en soi. Ces sels peuvent être obtenus par
action d'une base métallique (alcaline ou alcalinoterreuse par exemple), de
l'ammoniac, d'un tétraalkylammonium, d'une amine ou d'un sel d'un acide
organique sur un composé de formule (I), dans un solvant. Le sel formé est
20 séparé par les méthodes habituelles.
Comme exemples de sels pharmaceutiquement acceptables,
peuvent être cités les sels avec les métaux alcalins (sodium, potassium,
lithium) ou avec les métaux alcalinoterreux (calcium, magnésium), le sel
d'ammonium, les sels de tétraalkylammonium (tétrabutylammonium par
25 exemple), les sels de bases azotées (éthanolamine, triméthylamine,
méthylamine, benzylamine, N-benzyl-~-phénéthylamine, choline, arginine,
leucine, Iysine, N-méthyl glucamine).
WO 94/20109 ~ 1 5 3 9 5 1 PCT/FR94/00207
En tant qu'antagonistes non compétitifs du récepteur N-méthyl-D-
aspartate (NMDA) et plus particulibrement comme ligands pour les sites
modulateurs de la glycine du récepteur NMDA, ces composés sont utiles
pour traiter ou prévenir toutes les ischémies (telles l'ischémie focale ou
globale) consécutives à des accidents vasculaires cérébraux, un arrêt
cardiaque, une hypotension artérielle, une intervention chirurgicale cardiaque
ou pulmonaire ou une hypoglycémie sévére. lls sont également utiles dans le
traitement des effets dus à une anoxie, qu'elle soit périnatale ou consécutive
à une noyade ou à des lésions cérébro-spinales. Ces composés peuvent
également être utilisés pour traiter ou prévenir l'évolution de maladies
neurodégénératives, de la chorée d'HUNTlNGTON, de la maladie
d'ALZHElMER, de la sclérose latérale amyotrophique, de l'atrophie olivo-
pontocérébelleuse, de la maladie de PARKINSON. Ces composés peuvent
aussi être utilisés vis-à-vis des manifestations épileptogènes eVou
convulsives, pour le traitement des traumatismes cérébraux ou spinaux, de
l'anxiété (KEHNE et coll., Eur. J. Pharmacol., 193, 283 (1991), de la
dépression (TRULLAS et coll.,Eur. J. Pharmacol., 185, 1 (1990), de ia
schizophrénie ~REYNOLDS, TIPS, 13, 116 (1992), en tant qu'analgésiques
(DICKENSON et coll., Neurosc. Letters, 121, 263 (1991), antianorexiques
(SORRELS et coll., Brain Res., 572, 265 (1992), antiémétiques,
antimigraineux et pour traiter les empoisonnements par des neurotoxines ou
d'autres substances agonistes du récepteur NMDA, ainsi que les troubles
neurologiques associés aux maladies virales telles que le sida (LIPTON et
coll., Neuron, 7, 111 (1991), la rage, la rougeole et le tétanos (BAGETTA et
coll., Br. J. Pharmacol., 101, 776 (1990). Ces composés sont aussi utiles
pour la prévention des symptomes d'abstinence aux drogues et à l'alcool et
de l'inhibition de l'accoutumance et de la dépendance aux opiacés.
L'affinité des composés de formule (I) pour le site glycine lié au
récepteur NMDA a été déterminée en étudiant l'antagonisme de la fixation
spécifique du [3H]-DCKA (acide 6,8-dichloro kynurènique) sur des
membranes de cortex cérébral de rat selon une méthode dérivée de celle
décrite par BARON et coll., Eur. J. Pharm., 206, 149 (1991). Le [3H]-DCKA
(20nM) est mis à incuber en présence de 0,1 mg de protéines à 4C pendant
10 minutes dans du tampon HEPES (acide (N-[2-hydroxyéthyl]pipérazine-N'-
35 ~2-éthanesulfonique]) 50 mM, pH7,5. La fixation non spécifique est
WO 94/20109 21~9~ ~ PCT/FRg4/00207 ~
déterminée en présence de glycine 1mM. La radioactivité liée est séparée
par filtration sur filtres Whatman GF/B. L'activité inhibitrice de ces produits est
généralement inférieure à 100 ,uM.
Les composés de formule (I) présentent une toxicité faible. Leur
5 DL50 est supérieure à 50 mg/kg par voie IP.
D'un intérêt particulier sont les composés suivants:
- 5-chloro-2H-1,2,4-benzothiadiazine-3(4H)-one-1,1-dioxyde,
- 6-iodo-2H-1,2,4-benzothiadiazine-3(4H)-one-1,1-dioxyde,
- 6,8-diméthyl-2H-1,2,4-benzothiadiazine-3(4H)-one-1,1-dioxyde,
10 - 6-chloro-2H-1,2,4-benzothiadiazine-3(4H)-one-1,1-dioxyde,
- 6,8-dichloro-2H-1,2,4-benzothiadiazine-3(4H)-one-1,1-dioxyde.
FXFMPLE 1
A une solution refroidie à -5C de 17,7 g d'isocyanate de chlorosulfonyle
dans 110 cm3 de nitrométhane, on ajoute lentement une solution de 12,76 g
de 2-chloroaniline dans 35 cm3 de nitrométhane, puis vers 0C 16,67 g de
chlorure d'aluminium. On chauffe ensuite jusqu'à reflux et on stoppe la
réaction dès que la température de reflux atteint 101 -102C par
refroidissement dans un bain de glace. Le mélange réactionnel est versé sur
de la glace pilée et le précipité obtenu est filtré, lavé à l'eau et séché à l'air.
20 Le solide coloré (12,47 g) est cristallisé dans 160 cm3 d'isopropanol et
recristallisé dans 135 cm3 d'isopropanol pour donner 5,5 g de
5-chloro-2H-1,2,4-benzothiadiazine-3(4H)-one-1,1-dioxyde fondant à 245C.
FXEMPLE 2
On opère comme à l'exemple 1 mais à partir de 17,7 g d'isocyanate de
25 chlorosulfonyle, 21,9 g de 3-iodoaniline et 16,67 g de chlorure d'aluminium
au sein du nitrométhane. Une partie du produit brut (9 g) est
chromatographiée sur colonne de silice (500 g) avec un mélange d'acétate
d'éthyle, de méthanol et de triéthylamine (80/20/1 en volumes) et le produit
WO 94/201Q9 ~ 15 3 9 5 1 PCT/FR94/00207
obtenu (4 g) est cristallisé deux fois dans l'isopropanol, traité par 20 cm3
d'acide chlorhydrique 0,1 N, filtré et séché à 50C pour donner 0,95 g de
6-iodo-2H-1,2,4-benzothiadiazine-3(4H)-one-1,1-dioxyde sous forme de
solide blanc cassé fondant au-dessus de 260C (Analyse % calculé C:25,94,
H:1,56, N:8,64, 1:39,16, 0:14,81, S:9,89, % trouvé C:26,3; H:1,5; N:8,8;
1:39,0; 0:14,6; S:9,6).
FXFMPI F 3
On opère comme dans l'exemple 1 mais à partir de 17,7 9 d'isocyanate de
chlorosulfonyle, 12,12 g de 3,5-diméthylaniline et 16,67 g de chlorure
d'aluminium au sein du nitrométhane. Le produit brut (17 g) est traité par
battage dans 100 cm3 de tert-butyle méthyle oxyde et fournit après filtration
et séchage 11,3 g de 6,8-diméthyl-2H-1,2,4-benzothiadiazine-3(4H)-one-
1,1-dioxyde sous forme de solide beige clair fondant au-dessus de 260C
(Analyse % calculé C:47,78, H:4,45, N:12,38, 0:21,21, S:14,17, % trouvé
C:47,1; H:4,5; N:12,4; 0:21,1; S:14,1).
I~XF~/IPL~ 4
On opère comme dans l'exemple 1 mais à partir de 51 9 d'isocyanate de
chlorosulfonyle, 38,1 g de 3-chloroaniline et 49,35 g de chlorure d'aluminium
au sein du nitrométhane. Le produit brut (19,2 g) est recristallisé dans
20 I'isopropanol bouillant pour conduire à 8,3 g de
6-chloro-2H-1,2,4-benzothiadiazine-3(4H)-one-1,1-dioxyde sous forme de
solide beige clair fondant au-dessus de 260C (Analyse % calculé C:36,14,
H:2,17, Cl:15,24, N:12,04, 0:20,63, S:13,78, % trouvé C:36,1; H:2,4; Cl:15,0,
N:11,7; 0:20,8; S:13,3).
25 FXEMPLE~ 5
On opère comme dans l'exemple 1 mais a partir de 3,5 g d'isocyanate de
chlorosulfonyle, 3,24 g de 3,5-dichloroaniline et 3,29 g de chlorure
d'aluminium au sein du nitrométhane. Le produit brut (3 g) est recristallisé
dans la 2-butanone bouillante pour conduire à 0,8 g d'hydrate de
30 6,8-dichloro-2H-1,2,4-benzothiadiazine-3(4H)-one-1,1-dioxyde sous forme
de solide blanc fondant au-dessus de 260C (Analyse % calculé C:31,48,
WO 94/20109 PCT/E~R94/00207
2~3~
H:1,51, Cl:26,55,N:10,49, 0:17,97, S:12,00, % trouvé C:31,5; H1,5; Cl:26,5,
N:10,4; 0:17,3; S:12,1).
Les médicaments sont constitués par un composé de formule (I)
sous forme libre ou sous forme d'un sel, à l'~tat pur ou sous forme d'une
5 composition dans laquelle il est associé à tout autre produit
pharmaceutiquement compatible, pouvant être inerte ou physiologiquement
actif. Ces médicaments peuvent être employés par voie orale, parentérale,
rectale ou topique.
Comme compositions solides pour administration orale, peuvent être
10 utilisés des comprimés, des pilules, des poudres (capsules de gélatine,
cachets) ou des granulés. Dans ces compositions, le principe actif selon
l'invention est mélangé à un ou plusieurs diluants inertes, tels que amidon,
cellulose, saccharose, lactose ou silice, sous courant d'argon. Ces
compositions peuvent également comprendre des substances autres que les
15 diluants, par exemple un ou plusieurs lubrifiants tels que le stéarate de
magnésium ou le talc, un colorant, un enrobage (dragées) ou un vernis.
Comme compositions liquides pour administration orale, on peut
utiliser des solutions, des suspensions, des émulsions, des sirops et des
élixirs pharmaceutiquement acceptables contenant des diluants inertes tels
20 que l'eau, I'éthanol, le glycérol, les huiles végétales ou l'huile de paraffine.
Ces compositions peuvent comprendre des substances autres que les
diluants, par exemple des produits mouillants, édulcorants, épaississants,
aromatisants ou stabilisants.
Les compositions stériles pour administration parentérale, peuvent
25 être de préférence des solutions aqueuses ou non aqueuses, des
suspensions ou des émulsions. Comme solvant ou véhicule, on peut
employer l'eau, le propylèneglycol, un polyéthylèneglycol, des huiles
végétales, en particulier l'huile d'olive, des esters organiques injectables, par
exemple l'oléate d'éthyle ou d'autres solvants organiques convenables. Ces
30 compositions peuvent également contenir des adjuvants, en particulier des
agents mouillants, isotonisants, émulsifiants, dispersants et stabilisants. La
stérilisation peut se faire de plusieurs fa~ons, par exemple par filtration
~ wo 94~20109 ~ ~ 5 3 ~ 5 1 PCT/FR94/00207
.
; ~
aseptisante, en incorporant à la composition des agents stérilisants, par irra-
diation ou par chauffage. Elles peuvent également être préparées sous forme
de compositions solides stériles qui peuvent être dissoutes au moment de
l'emploi dans de l'eau stérile ou tout autre milieu stérile injectable.
Les compositions pour administration rectale sont les suppositoires
ou les capsules rectales qui contiennent, outre le produit actif, des excipientstels que le beurre de cacao, des glycérides semi-synthétiques ou des
polyéthylèneglycols.
Les compositions pour administration topique peuvent être par
exemple des crèmes, lotions, collyres, collutoires, gouttes nasales ou
aérosols.
En thérapeutique humaine, les composés selon l'invention sont
particulièrement utiles pour le traitement et/ou la prévention des conditions
qui requièrent l'administration d'un antagoniste du récepteur NMDA ou d'un
antagoniste du récepteur AMPA. Ces composés sont notamment utiles pour
traiter ou prévenir toutes les ischémies et en particulier l'ischémie cérébrale,les effets dus à une anoxie, I'évolution de maladies neurodégénératives, de
la chorée d'HUNTlNGTON, de la maladie d'ALZHElMER, de la sclérose
latérale amyotrophique, de l'atrophie olivo-pontocérébelleuse et de la
maladie de PARKINSON, vis-à-vis des manifestations épileptogènes et/ou
convulsives, pour le traitement des traumatismes cérébraux ou spinaux, de
l'anxiété, de la dépression, de la schizophrénie, en tant qu'analgésiques,
antianorexiques, antiémétiques, antimigraineux et pour traiter les
empoisonnements par des neurotoxines ou d'autres substances agonistes du
récepteur NMDA, ainsi que les troubles neurologiques associés aux maladies
virales telles que le sida, la rage, la rougeole et le tétanos. Ces composés
sont aussi utiles pour la prévention des symptomes d'abstinence aux
drogues et à l'alcool et de l'inhibition de l'accoutumance et de la dépendance
aux opiacés.
Les doses dépendent de l'effet recherché, de la durée du traitement
et de la voie d'administration utilisée; elles sont généralement comprises
entre 10 mg et 100 mg par jour par voie orale pour un adulte avec des doses
unitaires allant de 5 mg à 50 mg de substance active.
WO 94/20109 PCT/lF~94/00207 ~
215~
D'une façon générale, le médecin déterminera la posologie
appropriée en fonction de l'âge, du poids et de tous les autres facteurs
propres au sujet à traiter.
Les exemples suivants illustrent des compositions selon l'invention:
5 FXEMPLE A
On prépare, selon la technique habituelle, des gélules dosées à
50 mg de produit actif ayant la composition suivante:
- 5-chloro-2H-1,2,4-benzothiadiazine-3(4H)-
one-1,1-dioxyde.....;............. ~......................... 50 mg
- Cellulose........................ ............ .............. 18 mg
- Lactose.......................... ............ .............. 55 mg
- Silice colloïdale................ ............ ............... 1 mg
- Carboxyméthylamidon sodique............................10 mg
- Talc...................................................10 mg
- Stéarate de magnésium...................................1 mg
FXFMPLE R
On prépare selon la technique habituelle des comprimés dosés à
50 mg de produit actif ayant la composition suivante:
- 6-iodo-2H-1,2,4-benzothiadiazine-3(4H)-
one-1,1-dioxyde.........................................50 mg
- Lactose................................................104 mg
- Cellulose..............................................40 mg
- Polyvidone.............................................10 mg
- Carboxyméthylamidon sodique............................22 mg
2~ - Talc...................................................10 mg
- Stéarate de magnésium...................................2 mg
- Silice colloïdale.......................................2 mg
- Mélange d'hydroxyméthylceliulose, glycérine, oxyde de
titane (72-3,5-24,5) q.s.p. 1 comprimé pelliculé terminé à 245 mg
30 EXEMPLE C
~ WO 94/20109 2 1~ ~ 9 5 1 PCT/FR94/00207
On prépare une solution injectabie contenant 10 mg de produit actif
ayant la composition suivante:
- 6,8-diméthyl-2H-1,2,4-benzothiadiazine-3(4H)-
one-1,1-dioxyde................................. 10 mg
- Acide benzolque.............. ~..................... 80 mg
- Alcool benzylique......................... ......... 0,06 cm3
- Benzoate de sodium........................ ......... 80 mg
- Ethanol à 95 %............................ ......... 0,4 cm3
- Hydroxyde de sodium....................... ......... 24 mg
- Propylène glycol.......................... ......... 1,6 cm3
- Eau.......................... q.s.p. 4 cm3