Note: Descriptions are shown in the official language in which they were submitted.
2154428
ALLIAGES Ä BASE DE Ti, Ru, Fe et O ET
USAGE DE CEUX-CI POUR LA FABRICATION DE CATHODES POUR
LA SYNTH~SE ÉLECTROCHIMIQUE DU CHLORATE DE SODIUM
La présente invention a pour objet de nouveaux alliages
nanocristallins à base de Ti, Ru, Fe et O. Elle a également pour objet un
procédé de préparation de ces nouveaux alliages. Elle a enfin pour objet
l'usage
d'alliages de même composition mais de structure pas nécessairement
nanocristalline pour la fabrication de cathodes pour la synthèse
électrochimique
du chlorate de sodium, ainsi que les cathodes ainsi fabriquées.
Le chlorate de sodium (NaCIO~ est un produit utilisé en très grosse
quantité comme agent de blanchiment dans l'industrie des pâtes et papier. Ä ce
sujet, on estime à près de 2 millions de tonnes la quantité de chlorate de
sodium
produite par an en Amérique du Nord.
Au niveau industriel, le chlorate de sodium est synthétisé dans des
cellules d'électrolyse telles que celle schématisée sur la i~gure 1 des
dessins
annexés, identifiée comme "art antérieur". Chacune de ces cellules comprend
une pluralité d'électrodes bipolaires 1 disposées en ligne entre une cathode 3
constituée de plaques d'acier doux orientées verticalement à une extrémité 5
de
la cellule, et une anode 7 constituée de plaques de titane recouverte d'oxyde
de
ruthénium orientées verticalement à l'autre extrémité 9 de la cellule. Chaque
électrode bipolaire 1 comprend elle-même une cathode 11 constituée de plaques
d'acier doux 15 et une anode 13 constituée de plaques 17 de titane recouvertes
d'oxyde de ruthénium. Les plaques 15 formant la cathode 11 sont disposées de
façon à venir s'intercaler entre les plaques jouant le r6le d'anode 7 à
l'extrémité
9 de la cellule ou entre les plaques 17 constituant l'anode 13 de l'électrode
bipolaire adjacente. La jonction entre la cathode 11 et l'anode 13 de chaque
électrode bipolaire 1 est obtenue par un joint de soudure par explosion.
La réaction chimique mise en oeuvre dans la cellule est la suivante:
NaCI + 3H20 -~ NaCl03 + 3H2
De façon typique, la solution présente dans chaque cellule
comprend de 100 à 130 g/I de NaCI, de 580 a 660 g/I de NaCl03 et de 2 é 5 g/I
2I~44~8
2
de Na2Cr20~, ce dernier produit étant utilisé comme agent stabilisateur tout
en
assurant une haute efficacité de courant. Le pH de la solution est de 5.8 à
6.8
et la température d'opération est de l'ordre de 70°C.
De façon également typique, les conditions d'opération aux
jonctions sont les suivantes:
tension à la jonction: 3,2 volts sous une densité de
courant de 250 mA/cm2 au
niveau des électrodes
potentiel d'équilibre (courant 0): 2,3 volts
surtension é la jonction: 900 mV
Dans les conditions ci-dessus exposées, un taux d'extraction de
chlorate de sodium de l'ordre de 80 g par litre de solution peut être obtenu.
En
outre, l'hydrogène gazeux qui est produit à chacune des cathodes de la cellule
est récupérée et utilisée pour des fins énergétiques.
La présente invention résulte de travaux de recherche effectués par
la Demanderesse en vue d'améliorer l'efficacité électrique des cellules de
synthèse du chlorate de sodium, dont la consommation est très élevée (de
l'ordre de 50 a 100 MW par usine). Toute amélioration amenant à une réduction
de cette importante consommation électrique pourrait en effet générer des
économies annuelles de plusieurs millions de dollars.
Une façon d'obtenir une telle amélioration de l'efficacité électrique
des cellules est bien sûr de réduire la surtension dite d"'hydrogéne" qu'il
est
requis d'appliquer au potentiel d'équilibre é la surface des cathodes pour
obtenir
le dégagement d'hydrogène voulu et la synthëse simultanée du chlorate de
sodium à la surface des anodes.
Ä ce sujet, on comprendra en effet ctu'une réduction de la
surtension d'hydrogène de 300 à 400 mV peut améliorer l'efficacité énergétique
d'une cellule de production de 10 à 13%.
Des recherches extensives ont donc été effectuées en vue de
remplacer les cathodes d'acier utilisées jusqu'à présent par des cathodes
faites
en des matériaux de plus haute performance. Ainsi des essais extensifs ont été
faits sur des électrodes d base de nickel, de ruthénium, de titane, de
platine, de
~1~442~
3
carbone et tungstène, etc... Si certains des matériaux ainsi essayés se sont
avérés efficaces en laboratoire, des contraintes industrielles ont toutefois
amené
à un rejet de la quasi-totalité d'entre eux pour les diverses raisons
suivantes : prix
excessif, manque de longévité (les cathodes en acier doux utilisées
actuellement
ont un temps de vie d'environ 7 ans) et/ou un risque d'accident (notamment
dans le cas des électrodes à base de Ni car ce métal est un catalyseur de
décomposition de l'hypochlorite, qui peut conduire à la production d'oxygène
et
de là à des risques d'explosion avec l'hydrogène gazeux produit
simultanément).
II a toutefois été découvert, et c'est ce qui est à la base de la
présente invention, qu'un alliage de composition et de structure très
particulières
est non seulement très efficace pour la fabrication de cathodes pour la
synthèse
du chlorate de sodium, mais est également peu cher, extrêmement résistant et
très sécuritaire en usage.
Cet alliage nouveau qui constitue un premier objet de la présente
invention, est caractérisé en ce qu'il a, d'une part, une structure
nanocristalline
et qu'il répond, d'autre part, à la formule suivante:
Tir+x Ru, s+y Fer;+Z lao+c M
dans laquelle:
M représente un ou plusieurs métaux qui peuvent étre substitués
au fer et sont choisis dans le groupe constitué par le chrome, le manganèse,
le
vanadium, le tungstène, l'antimoine, le plomb et le platine, le métal préféré
étant
le chrome;
x est compris entre -30 et +50, préférentiellement entre -20 et +20
et plus préférentiellement encore entre -5 et +5;
y est compris entre -10 et +35, préférentiellement entre -10 et + 15
et plus préférentiellement encore entre -5 et +5;
z est compris entre -25 et +70, préférentiellement entre -25 et +25
et plus préférentiellement encore entre -5 et +5;
t est compris entre -28 et + 10 et préférentiellement entre -28
et +5; et
u est compris entre 0 et 50 et préférentiellement entre 0 et 10,
la somme des nombres x + y + z + t + u étant égale à 0.
214428
4
Par "structure nanocristalline", on entend dans la description qui
suit et les revendications annexées, que l'alliage se présente sous la forme
d'une
poudre de cristallites de taille inférieure à 100 nm et de préférence
inférieure à
30 nm.
Tel qu'il ressort de la formule ci-dessus, l'alliage nanocristallin selon
l'invention peut comprendre une certaine quantité d'un ou plusieurs métaux M
utilisés à titre de catalyseurs ou de stabilisants, ou encore plus simplement
pour
améliorer l'efficacité de courant. Le ou les métaux M viennent se substituer
au
fer et sont de préférence choisis parmi les métaux suivants: Cr, Mn, V, W, Sb,
Pb
ou Pt. Le métal M qui est tout particuliérement préféré à cause de son
efficacité
et son prix raisonnable est le chrome.
L'alliage nanocristallin selon l'invention peut être préparé de
différentes manières. On peut partir d'un mélange des métaux précurseurs
choisis parmi le titane, le ruthénium, le fer et le ou les métaux M ou encore
d'un
mélange des métaux ci-dessus et d'oxydes de ceux-ci, que l'on broie
mécaniquement dans une atmosphère inerte ou d'oxygène.
Ce procédé de préparation par broyage mécanique constitue un
second objet de la présente invention.
On comprendra toutefois que l'alliage de formule ci-dessus définie
mais de structure pas nécessairement nanocristalline peut aussi être fabriqué
par
d'autres techniques telles que la pulvérisation cathodique réactive d'une
cible de
composition appropriée ou encore par des techniques de solidification à partir
de l'état liquide telles que l'hypertrempe sur roue, l'atomisation et la
condensation de phases gazeuses, ou encore par projection plasma.
L'alliage nanocristallin selon l'invention qui se présente sous la
forme d'une poudre, peut, une fois préparé, être compacté à froid ou à
température modérée pour former des électrodes qui peuvent être utilisées
comme cathodes pour la synthèse du chlorate de sodium.
Cette méthode de fabrication de cathodes pour la synthèse
électrochimique du chlorate de sodium et les cathodes ainsi obtenues
constituent
un troisième objet de l'invention.
~1~~4~:
II convient de mentionner que ce troisième objet de l'invention n'est
toutefois pas exclusivement restreint à cette méthode de fabrication de
cathodes
é partir de l'alliage nanocristallin en poudre ci-dessus défini. En effet, on
peut
également fabriquer des cathodes efficaces par des techniques autres que
celles
5 de la compaction des poudres, en utilisant des alliages de même composition
que précédemment mais de structure pas nécessairement nanocristalline.
L'invention couvre donc également des cathodes faites à partir d'un
alliage de même formule mais de structure qui n'est pas nanocristalline, et
dont
la mise en forme est faite d'autres façons. Ainsi la poudre de l'alliage ci-
dessus
décrit peut être projetée sur un substrat en utilisant une technique plasma ou
être
mélangée avec un liant et "peinturée" sur un support d'électrode ou être
déposée
sur un support par électro-codéposition. Elle peut aussi être insérée dans un
milieu poreux servant de support. Le revêtement peut être fabriqué par
déposition en phase vapeur (pulvérisation magnétron, évaporation, etc.).
L'usage de ces cathodes pour la synthèse du chlorate de sodium
constitue enfin un quatrième et dernier objet de la présente invention.
A ce sujet, il a été découvert pue les cathodes fabriquées à partir
de l'alliage nanocristallin selon l'invention sont très stables dans
l'électrolyte
utilisé et inertes face à la décomposition de l'hypochlorite. II a également
été
découvert que les cathodes fabriquées à partir de ces matériaux ont une
surtension d'hydrogène, mesurée sous une densité de courant de 250 mA/cm2
à 70°C, qui est inférieure d'environ 300 mV à celle des cathodes
d'acier
présentement utilisées dans l'industrie. Plus précisément, ces cathodes ont
une
surtension d'hydrogène égale à environ 600 mV au lieu de 900 mV. Cette baisse
de la surtension représente un gain net d'énergie électrique de plus de 10%.
L'invention ainsi que ses avantages seront mieux compris à la
lecture de la description plus détaillée mais non limitative qui va suivre,
faite en
se référant aux dessins annexés dans lesquels:
la figure 1 est une vus schématique de dessus d'une cellule
d'électrolyse de type conventionnel utilisée pour la synthèse du chlorate de
sodium;
CA 02154428 2002-08-14
6
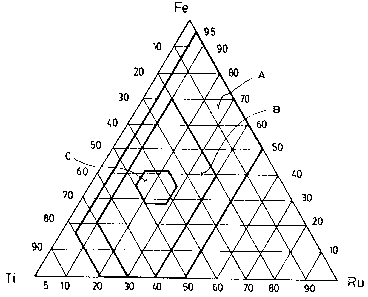
la figure 2 est un diagramme ternaire montrant les concentrations
de base et préférentielles en Ti, Ru et Fe de l'alliage selon l'invention;
la figure 3 est un diagramme ternaire identique à celui-ci de la
figure 2, montrant les concentrations respectïves en Ti, Ru et Fe des alliages
selon l'invention qui ont été préparés et düment testés;
les figures 4a à e sont des spectres de diffraction X d'un mélange
de Ti et Ru02 broyé dans un creuset en acier, en fonction du temps;
la figure 5 est un spectre de diffraction X d'un alliage de formule
Ti22 Ru" Fe3~ 03o selon l'invention, tel qu'obtenu après quarante heures de
broyage;
la figure 6 est un spectre de diffraction X d'un alliage de formule
Ti,4 Ru, Fe,~ O~ selon l'invention, tel qu'obtenu après quarante heures de
broyage;
les figures 7 et 8 sont des diagrammes donnant la valeur de la
surtension mesurée sur des cathodes préparées à partir de plusieurs des
alliages
identifiés sur la figure 3, sous une densité de saurant de 250 mA/cm2;
la fïgure 9 est un graphïque donnant la valeur de la surtension
d'hydrogène mesurée avec une cathode d'acier doux (o) et une cathode
fabriquée avec l'alliage dont le spectre de dïffraction X est donné sur la
figure 5
(o), au cours d'une période de plus de 675 h d'électrolyse (1 mois); et
les figures 10 et 11 sont des graphiques donnant la valeur de la
surtension d'hydrogène en fonction du nombre d'heures de broyage effectuées
sur des alliages où 5096 et 100% du fier ont été respectivement remplacés par
du
chrome.
Tel que précédemment indiqué, l'alliage nanocristallin selon
l'invention répond à la formule suivante:
Tir+X Rui s+y Fe2s+Z Oao+r M
dans laquelle
M représente un ou plusieurs métaux qui peuvent être
substitués au fer et sont choïsis dans le groupe constitué par le chrome, le
manganèse, le vanadium, le tungstène, l'antimoine, le plr~mb et le platine, le
métal préféré étant le chrome;
2I~~~28
x est compris entre -30 et +50;
y est compris entre -10 et +35;
z est compris entre -25 et +70; et
t est compris entre -28 et + 10,
u est compris entre 0 et 50
la somme x + y + z + t + u étant égale à 0.
Si l'on fait abstraction de l'oxygène et du métal M, cette définition
correspond sensiblement à la zone la plus large identifiée par la lettre "A"
sur le
diagramme ternaire illustré sur la figure 2.
Comme on peut le constater, l'alliage selon l'invention peut être
constitué exclusivement de fer, ruthénium et oxygène (cas où x est égal à -30
et
u est égal à 0). Cet alliage sans titane est toutefois moins stable que ceux
contenant ce métal. L'alliage selon l'invention peut aussi être constitué
exclusivement de titane, ruthénium et oxygène (cas où z est égal à -25 et u
est
égal à 0). Cet alliage nanocristallin particulier est très bon mais coûteux.
Quel
que soit le cas, l'alliage doit contenir du ruthénium. Toutefois, la quantité
de
ruthénium ne doit pas être trop élevée à cause, d'une part, du prix élevé de
ce
métal, et d'autre part et surtout, de son manque de stabilité lorsqu'il est
utilisé
dans une solution électrolyte.
Le fer est reconnu pour ses bonnes propriétés relativement au
dégagement de l'hydrogène. C'est d'ailleurs pourquoi il est actuellement
utilisé
dans l'industrie. Le composé FeTi est par ailleurs connu comme étant un bon
matériau d'absorption de l'hydrogène. Le ruthénium joue quant à lui le rôle de
catalyseur. C'est sans doute ce qui rend l'alliage de formule ci-dessus donnée
très efficace lorsqu'il est utilisé comme cathode pour la synthèse du chlorate
de
sodium. En effet, c'est justement à la cathode que se produit la dissociation
de
l'eau en hydrogène qui se dégage sous forme gazeuse.
4uant à l'oxygène, il s'avère que sa présence n'affecte pue très
peu les propriétés de l'alliage dans la gamme de concentration envisagée
notamment lorsque celui-ci est utilisé comme cathode pour la synthèse de
chlorate de sodium. La présence d'oxygène est toutefois difficile à "éviter",
à
moins de travailler exclusivement sous atmosphère inerte avec des poudres
préalablement réduites.
2~~442~
8
Tel que précédemment indiqué, l'alliage nanocristallin selon
l'invention peut également comprendre une certaine quantité d'un ou plusieurs
autres métaux M, à titre de catalyseur et/ou stabilisant, ou plus simplement
encore pour améliorer l'efficacité du courant. Ainsi, l'alliage pourrait
comprendre
jusqu'à 50~ atomique de chrome. Cette addition pourrait permettre de réduire
substantiellement ou même éliminer la quantité de Na2Cr20 utilisée comme
additif
dans la solution électrolyte, et dont le but est essentiellement d'augmenter
le
rendement de synthèse en réduisant les risques de décomposition du chlorate.
D'autres métaux qui pourraient possiblement être utilisés comme additifs dans
l'alliage selon l'invention sont le manganèse, Is vanadium, le tungstène,
l'antimoine, le plomb et le platine.
Selon un premier mode de réalisation préféré de l'invention, x, y,
z, t et u sont choisis comme suit:
x est compris entre -20 et +20;
y est compris entre -10 et +15;
z est compris entre -25 et +25;
t est compris entre -28 et +5; et
u est compris entre 0 et +10.
Si l'on fait abstraction de l'oxygène et de l'autre métal M, cette
première définition préférentielle correspond sensiblement à la zone
identifiée par
la lettre "B" sur le diagramme de phase illustré sur la figure 2.
Selon un second mode de réalisation préféré de l'invention, x, y,
z et t sont choisis comme suit:
x est compris entre -5 et +5;
y est compris entre -5 et +5;
z est compris entre -5 et +5;
t est compris entre -28 et +5; et
u est compris entre 0 et +10
Si l'on fait abstraction de l'oxygène et de l'autre métal M, cette
seconde définition préférentielle correspond sensiblement a la zone identifiée
par
lettre "C" sur le diagramme ternaire illustré sur la figure 2. i_es alliages
selon ce
second mode de réalisation préféré sont ceux qui offrent a priori les
meilleures
possibilités commerciales, si l'on tient compte à la fois de leur prix, leur
2154~~8
9
résistance et leur efficacité électrique lorsqu'ils sont utilisés comme
cathodes
pour la synthèse du chlorate de sodium.
L'alliage selon l'invenüon est défini dans les revendications de
produit annexés comme présentant une structure nanocristallite. En effet,
cette
micro structure est favorable à l'obtention d'une faible surtension
d'hydrogène
lorsque l'alliage sert de cathode pour la synthèse du chlorate de sodium.
L'invention n'est toutefois pas restreinte exclusivement à l'usage
d'un cet alliage nanocristallin. II a en effet été découvert que les alliages
polycristallins conventionnels ayant cette formule ont aussi l'avantage
d'offrir une
relativement faible surtension d'hydrogène lorsqu'ils sont utilisés comme
cathodes pour la synthèse du chlorate de sodium.
Pour fabriquer l'alliage nanocristallin selon l'invention, on peut partir
d'un mélange des métaux précurseurs choisis parmi le titane, le ruthénium et
le
fer que l'on broie mécaniquement dans une atmosphère inerte ou l'oxygène, ou
d'un mélange des métaux ci-dessus et d'oxydes de ceux-ci que l'on broie
mécaniquement dans une atmosphère inerte (tel que l'argon) ou d'oxygène. La
durée de ce broyage est extrémement variable et dépend essentiellement de ce
que l'on cherche à obtenir. Cette durée peut être en moyenne de 20 à 50
heures.
Ce procédé de préparation par broyage mécanique constitue un
des objets de l'invention. Pour obtenir la poudre désirée de structure
nanocristalline, le broyage mécanique effectué doit être intense. II convient
en
effet de non seulement obtenir l'alliage voulu mais également réduire la
taille des
cristallites produites à la valeur voulue, c'est-à-dire à quelques dizaines de
nanomètres tout au plus. Pour ce faire, on peut utiliser un broyeur à billes
avec
ou sans mouvement planétaire du plateau, ou encore un attriteur. Ä titre
d'exemples de tels broyeurs ou attriteurs, on peut nommer les broyeurs
commercialisés sous les marques de commerce SPEX 8000 ou FRITCH et les
attriteurs commercialisés par la compagnie ZOZ GmbH.
21~~4~8
Ä titre d'exemple de mise en oeuvre de ce procédé, un mélange
de poudres de Ti et de Ru02 dans une proportion de deux atomes de Ti pour
une molécule de Ru02 a été préparé. Ceci correspond à la formulation de départ
5 suivante: Ti4oRu~0~. Ce mélange a été inséré dans un creuset de fer avec des
billes d'acier et broyé pendant 40 heures. Au cours du broyage, les poudres
ont
"réagi" entre elles. L'oxyde de ruthénium et le titane se sont transformés et
une
nouvelle structure qui s'apparente à celle d'un mélange de.l'intermétallique
de
TiRu et de Ru hexagonal s'est formée.
10 Au fur et à mesure du processus du broyage, la structure cristalline
s'est raffinée. Les cristaux sont devenus de plus en plus petits et du fer
provenant de l'attrition du creuset s'est introduit peu à peu dans le
matériau. Ä
ce sujet, il convient de préciser la quantité de fer et son taux
d'incorporation dans
l'alliage peuvent être contr8lés très précisément après quelques essais. II
convient aussi de préciser que le fer peut aussi être ajouté volontairement au
début du broyage. En fait, la nature des poudres et la composition initiale du
mélange utilisé influent sur le taux d'abrasion du creuset.
Après typiquement une trentaine d'heures de broyage, une fine
poudre nanocristalline (c'est-à-dire des cristaux dont la taille est de
l'ordre de
quelques nanomètres) s'est formée. Cette poudre avait la composition suivante
T130.4 Ru15.9F~.3~30.4
La séquence d'évolution des spectres de diffraction-X du mélange
initial et des poudres formées au fur et à mesure du broyage est présentée sur
la figure 4.
En procédant de la même façon que précédemment avec des
creusets d'acier ou de carbure de tungstène selon le cas et une durée de
broyage de l'ordre de 40 heures, on a procédé à la préparation d'une pluralité
d'autres alliages selon l'invention. Les métaux ou oxydes utilisés comme
produits
de départ et la formule des alliages qui ont ainsi été obtenus sont donnés
dans
le Tableau I ci-dessous.
Dans ce Tableau I, chaque alliage porte un numéro. La "position"
correspondante de chacun des alliages ainsi numérotés dans le diagramme
ternaire illustré sur la figure 2 est donnée sur la figure 3.
~I5~~28
Les spectres de diffraction X des alliages selon l'invention
numérotés 33 et 34 dans le Tableau I sont donnés sur les figures 5 et 6,
respectivement, à titre d'information.
~I~~~?8
12
TABLEAU I
acier
8 Fe + Ru ------~ Fe~5Ru25 (Air)
acier
9 Fe + Ru ------~ Fe~Ru,S (Air)
acier
Fe + Ru -----~ Fe~SRu~ (Air)
acier
11 Fe + Ru _____~ Fe~.SRu".50~
acier
12 Ti + Ru02 -----~ Ti4oRu~0~+ Fe (25%pds)
wc
16 Ti + Ru + Ru02(grad)+Ti0(grad) ------~ Ti48Ru240~
WC
17 Ti + RuCJ2(grad) ------~ Ti4oRu~0~
wc
18 Ti + Ru02(grad)+Fe(25~pds) ------~ Ti~Fe~Ru,eO~
wC
19 Ti + Ru + Fe203 ~----> Ti~Fe~Ru,eO~
acier
Ti + Fe + Ti0 + Fe203 ~----~ Ti~Fe~O~(Ti2Fe0)
acier
21 Ti + Fe203 -----~ Ti45Fe~0~(fi2Fe0,.~
acier
22 Ti + Ti0 + Fe203 ------~ Ti~Fe~O,~(Ti2Fe0~
wC
23 Ti + Fe + Ru + Ti0 + Fe203 ------~ Ti~Fe~Ru,eO~
wc
24 Ti + Ru + Fez03 ------~ Ti,~Fe~Ru,oO~
Fibre Ti + poudre de l'alliage n° 12
WC
26 Ti + Fe + Ru + Ti0 + Fe03 -----i Ti28Fe~Ru,40~
~1~44~8
13
WC
28 Ti + Fe + Ru + Ti0 + -----~ Ti3~Fe,5RU,eO~
Fe203
wc
29 Ti + Ru + Ti0 + Fe03 ------~ Ti42Fe,oRu,BO~
wc
30 Ti + Fe + Ru + Ti0 + ------~ Ti4,Fe5Ru,80~
Fe203
wC
31 Ti + Fe + Ru + Ti0 + ------~ Ti,oFe42Ru,e0~
Fe203
wc '
32 Ti + Fe + Ru + Ti0 + ------~ Ti42Fe,Ru2,O~o
Fe203
wC
33 Ti + Fe + Ru + Fe203 -----~ Ti~Fe3~Ru"
O~o
wc
34 Ti + Fe + Ru + Fe203 -----~ Ti,4Fe~Ru,03o
wc
35 Ti + Fe + Ru + Fe203 -----~ TieFe~Ru40~o
II convient de mentionner que l'alliage de formule ci-dessus mentionné
peut aussi être fabriqué par d'autres techniques telles que la pulvérisation
cathodique réactive d'une cible de composition appropriée ou encore par des
techniques de solidification à partir de l'état liquide telles pue
l'hypertrempe sur
roue ou l'atomisation et la condensation de phases gazeuses, ou la projection
plasma. Dans un tel cas, l'alliage obtenu n'est toutefois pas nécessairement
de
structure nanocristalline.
L'alliage de formule ci-dessus mentionnée, quelle que soit sa
structure une fois préparé, se présente sous la forme d'une poudre ou d'un
revêtement. Dans le cas où il s'agit d'une poudre, celle-ci peut être
compactée
à froid ou à température modérée pour former des électrodes qui peuvent être
utilisées comme cathodes dans la synthèse du chlorate de sodium.
La mise en forme de ces cathodes peut également se faire d'autres
faço~ls. Ainsi la poudre peut être projetée sur un substrat en utilisant une
technique plasma ou être mélangée avec un liant et "peinturée" sur un support
d'électrode. Le revêtement peut également être fabriqué par déposition en
21~44~8
14
phase vapeur (pulvérisation magnétron, évaporation, etc.).
Dans le cadre des recherches ayant conduit à la présente
invention, il a été découvert pue les cathodes fabriquées à partir de
l'alliage dont
la formule chimique est ci-dessus donnée sont très stables dans l'électrolyte
utilisé et inertes face à la décomposition de l'hypochlorite. II a également
été
découvert que les cathodes fabriquées à partir de cet alliage ont une
surtension
d'hydrogène inférieure à celle des cathodes d'acier présentement utilisées
dans
l'industrie. II a en outre été découvert que cette baisse de surtension est
plus
grande lorsque l'alliage a une structure nanocristalline. Ainsi, mesurée sous
une
densité de courant de 250 mA/cm2 à 70°C dans une cellule d'électrolyse,
cette
surtension d'hydrogène est en fait inférieure d'environ 300 mV à celle des
cathodes d'acier, puisque ces dernières ont une surtension d'hydrogène égale
à environ 900 mV alors que les cathodes faites à partir de l'alliage selon
l'invention ont une surtension d'hydrogène de l'ordre de 600 mV. Multipliée
par
le nombre de cathodes et le nombre de cellules d'une usine de production de
chlorate de sodium, cette baisse de la surtension représente un gain net
d'énergie électrique de plus de 10%.
Les figures 7 et 8 des dessins donnent la valeur de la surtension
d'hydrogène mesurée pour plusieurs des alliages nanocristallins selon
l'invention,
identifiées dans le Tableau I et sur la figure 3. Les alliages dont la
surtension
d'hydrogène est donnée sur la figure 7 sont à des alliages dont le rapport
atomique Ti/Ru est égal à 2. Ces alliages se trouvent alignés sur la ligne DD
illustrée sur la figure 3. Ceux dont la surtension d'hydrogène est donnée sur
la
figure 8 sont des alliages dont le pourcentage atomique de Ru est de l'ordre
de
16°~. Ces alliages se trouvent "alignés" sur la ligne EE illustrée sur
la figure 3.
Tel que précédemment indiqué, une baisse notable de la
surtension d'hydrogène est obtenue mémo si l'alliage utilisé pour la
fabrication
des cathodes n'est pas de structure nanocristalline. A titre d'exemple
comparatif,
on a préparé par broyage mécanique intense un alliage nanocristallin selon
l'invention contenant:
49.0% at. Ti
24.5° at. Ru
26.5°~ at. Fe
21~~~428
La surtension mesurée après 60 minutes à 250 mA/cm2 sur une
cathode faite à partir de cet alliage a été de 619 mV.
On a alors préparé par fusion dans un four à arc un alliage
contenant:
5 49.9~o at. Ti
25.1 ~ at. Ru
25.OR6 at. Fe
La surtension mesurée après 10 minutes à 250 mA/cm2 sur une
cathode faite à partir de cet alliage coulé de formule similaire au précédent
mais
10 non nanocristallin, a été de 850 mV.
On constate donc qu'il y a dans les deux cas une baisse de la
surtension d'hydrogène. Toutefois, la baisse obtenue lorsque la structure de
l'alliage est nanocristalline, est nettement plus grande.
Les figures 10 et 11 donnent la valeur de la surtension d'hydrogène
15 mesurée à 250 mA/cm2 sur des cathodes faites à partir d'alliages selon
l'invention où le fer est remplacé en partie (figure 10) ou totalement (figure
11 )
par du chrome, et ce en fonction du temps de broyage. Comme on peut le
constater, la surtension d'hydrogène mesurée sur ces alliages est relativement
basse (inférieure à 700 mV), même lorsque l'alliage n'est pas encore sujet à
un
broyage. Cette surtension baisse davantage dès que l'alliage est broyée, pour
atteindre un plateau après une vingtaine d'heures de broyage. Dans le cas de
l'alliage illustré sur la figure 10, la surtension après 20 h de broyage était
de 552
mV. Dans le cas de celui de la figure 11, cette surtension après 20 h de
broyage
était de 560 mV.
Dans tous les cas, on notera que la surtension d'hydrogène est
inférieure au 900 mV généralement mesurée sur les cathodes d'acier utilisées
actuellement. On notera aussi que cette surtension est encore plus basse
lorsque
l'alliage est sous forme nanocristalline.
Tel qu'indiqué ci-dessus, les cathodes produites avec l'alliage
selon l'invention sont très stables dans la solution d'électrolyte utilisée
dans les
cellules telles que celle illustrée sur la figure 1. Le Tableau II ci-dessous
donne
les pourcentages atomiques de Ti, Ru et Fe dans une électrode produite à
partir
d'un alliage selon l'invention, avant et après 292 heures d'opération dans une
215428
16
cellule d'électrolyse. Comme on peut le constater, ces pourcentages mesurés
par
spectrographie EDX, ont peu évolué avec le temps.
La figure 9 montre également l'évolution de la valeur de la
surtension d'hydrogène mesurée sur une cathode d'acier doux (o) et une
cathode ~ fabriquée é partir de l'alliage dont les étapes de "synthèse" sont
illustrées sur la figure 4. Ces surtensions ont été mesurées sous une densité
de
courant de 250 mA/cm2 à 70°C.
Comme on peut là encore le constater, aucune dégradation
apparente n'a été notée sur une période de presque un mois d'opération (675
heures d'électrolyte).
TABLEAU II
Ti Ru Fe Ti/Ru
(96at.) (96at.) (°6at.)
composition initiale 43.7 22.8 33.5 1.9
292 heures
d'électrolyse 43.3 25.8 30.8 1.7
Comme on peut donc l'apprécier, les cathodes faites à partir de
l'alliage de formule ci-dessus donnée permettent aisément et simplement
d'améliorer l'efficacité électrique des cellules de synthèse du chlorate de
sodium.
Cette amélioration peut être typiquement de 5 à 10 MW pour une usine de 50 à
100 MW. Ces cathodes peuvent donc entraîner des économies annuelles de
plusieurs millions de dollars.
En plus d'être très efficaces et résistantes, les cathodes faites à
partir de l'alliage de formule ci-dessus donnée sont également plus faciles à
"combiner" aux anodes de titane, puisqu'elles peuvent être soudées directement
â ce métal. En fait, l'alliage peut être appliqué sur une plaque de titane qui
peut
se souder à l'anode, ce qui n'est pas le cas des cathodes d'acier qui sont
utilisées actuellement et qui ne peuvent être soudées que par explosion, avec
les
coûts inhérents que cela implique.
Enfin, les cathodes faites à partir de l'alliage de formule ci-dessus
donnée dont extrêmement sécuritaires. II a en effet été constaté que la
vitesse
~1544~8
de décomposition de l'hypochlorite au contact du matériau formant ces cathodes
est très faible, en fait même inférieur à la vitesse mesurée pour les
électrodes de
fer, ce qui signifie un très faible dégagement d'oxygène. Ceci réduit d'autant
les
risques de dégagement simultané d'hydrogène et d'oxygène gazeux avec les
risques inhérents d'explosion pue cela provoque.
TABLEAU III
Matériaux Vitesse de dégagement de l'oxygène
(ml/min.g)
alliage selon l'invention 1.09
Fer (325 mesh) 1.23
Ni0 (noir) ~ 1.61
Ru02 2.20
Le Tableau III montre que parmi tous les matériaux étudiés, la
cathode fabriquée à partir de l'alliage selon l'invention est celle qui est,
la plus
inerte face à la décomposition de l'hypochlorite.
II va de soi que des modifications mineures pourraient être
apportées à ce qui vient d'être décrit sans pour autant sortir du cadre de la
présente invention telle que définie dans les revendications annexées.