Note: Descriptions are shown in the official language in which they were submitted.
WO 96/02138 PCT/FTt95/00921
Compositions fongicides à base de dérivés 3-phényl-pyrazoles pour le
traitement
du matériel végétal de multiplication, nouveaux dérivés 3-phényl-pyrazoles et
leurs
applications fongicides
La présente invention concerne l'utilisation de dérivés 3-phényl-pyrazoles
pour la
protection du matériel végétal de multiplication contre les maladies
fongiques, les
compositions contenant ces dérivés ainsi que de nouveaux dérivés de cette
famille, les
compositions contenant ces derniers et les compositions fongicides les
contenant ainsi
qu'un procédé pour le traitement des végétaux avec ces dérivés.
Certains dérivés 3-phényl-pyrazoles sont décrits notamment dans les demandes
publiées EP 0 538 156 et WO 93/22287 pour leur propriétés intéressantes contre
les
maladies fongiques des parties foliaires des plantes.
Par le terme "matériel végétal de multiplication", on entend désigner toutes
les
parties génératives de la plante qu'on peut utiliser pour la reproduction et
la multiplication
de celle-ci. On peut citer par exemple les graines (semences au sens étroit)
pour les cultures
autres que la pomme de terre, les racines, les fruits, les tubercules, les
bulbes, les rhizomes,
les parties de plantes ou encore les plantes germées et les jeunes plants, qui
doivent être
transplantés après germination ou après la sortie de terre. Ces jeunes plants
peuvent être
protégés avant la transplantation par un traitement total ou partiel par
immersion.
Parmi les produits de multiplication convenant pour le procédé de traitement
selon
l'invention on préferera les:
- graines de dicotylédones : pois, concombre, melon, soja, coton, tournesol,
colza, haricot,
lin, betterave
- graines de monocotylédones: céréales, maïs, riz
- ou les tubercules de pomme de terre.
De préférence les graines seront revêtues de 0,1 à 500 g de matière active par
quintal de
graine, de préférence 1 à 400 g par quintal.
De préférence, dans le cas des tubercules, celles-ci sont revêtues d'une
quantité de matière
active correspondant au trempage dudit produit dans une composition contenant
0,1g/l à
100 g/1 de matière active.
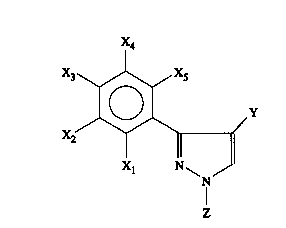
L'invention a plus spécialement pour objet d'une part des compositions pour le
traitement du matériel de multiplication des plantes contre les maladies
fongiques,
caractérisées en ce qu'elles contiennent, comme matières actives au moins un
dérivé 3-
phénylpyrazole de formule I:
WO 96102138 2 PCT/FR95/00921 -
X4
X3 X5
0 Y
X2
Xi N\
N
dans laquelle:
X1, X2, X3, X4 et X5, identiques ou différents, sont:
- un atome d'hydrogène ou d'halogène, un groupe hydroxy, mercapto, cyano,
thiocyanato, nitro, nitroso, amino éventuellement substitué par un ou deux
alkyles ou phényles,
- un radical alkyle, hydroxyalkyle, alkoxyalkyle, aminoalkyle,alkylsulfonyl
alkylthioalkyle alkylsulfinylalkyle, alkylsulfonylalkyle, benzyle, alkényle,
alkynyle, cyanoalkyle, àlkoxy, alkenoxy, alkylthio, alkylsulfinyl,
alkylsulfonyl, formyle, acétyle, alkyl- ou alkoxy(thio)carbonyle, mono ou di
alkylamino(thio)carbonyle, amino(thio)carbonyl, mono- ou
diarylamino(thio)carbonyle, carboxyle, carboxylate, carbamoyle ou
benzoyle,
- un radical phényle, phényloxy ou phénylthio
- un radical alkyle- ou alkoxy- ou mono ou di alkylamino- phényl- sulfényl
ou sulfinyle ou sulfonyle,
- un groupe sulfonique, ses sels, esters et amides dérivés,
- un groupe phosphoryle, substitué par deux groupes choisis dans le groupe
comprenant alkyle, alkoxy, alkylthio et dialkylamino, benzyloxy, phényloxy
ou phényle,
- un groupe trialkyl- ou alkylphényle-silyle,
deux des X1, X2, X3, X4 et X5 adjacents pouvant également former un pont
comprenant de 2 à 4 chaînons, dont au moins un peut être remplacé par un un
atome
d'oxygène,de soufre ou d'azote, et qui peut comporter un ou plusieurs atomes
ou groupes
suivants C, O, S, N, C=O, C=S, SO, S02, CH=CH, les carbones de ce pont pouvant
être ou
non substitués par au moins un atome d'halogène et/ou au moins un groupe
hydroxy,
amino, alkyle, alkoxy alkylthio, mono ou di alkylamino, alkylsulfinyle ou -
sulfonyle ou
alkoxycarbonyle, la partie alkyle étant telle que définie ci-dessous,
2194913
WO 96/02138 3 PCT/FR95/00921
sous réserve que Xlà X5 ne peuvent être à la fois chacun un atome d'hydrogène;
Y est un atome d'hydrogène, d'halogène, un groupe nitro, cyano, hydroxy,
alkylcarbonyloxy, alkoxycarbonyloxy, aminocarbonyloxy, mercapto, carboxyle,
carboxylate, formyle, alkyl(thio)carbonyle, arylcarbonyle,
alkoxy(thio)carbonyle,
carbamoyle, aminoalkyle, thiocyanato ou alkyle, alkényle, alkynyle, alkoxy ou
alkylthio, alkylsulfinyle ou -sulfonyle, la partie alkyle de ces radicaux
étant
éventuellement mono- ou polyhalogénée, un amino éventuellement substitué par
un ou deux alkyles ou phényles; phényle, phénoxy, phénylthio, arylsulfinyle ou
-
sulfonyle,
Y et Xl ou X5 pouvant également former un pont comprenant de 1 à 3 chaînons,
qui peut comporter un ou plusieurs atomes ou groupes suivants C, O, S, N, C=O,
C=S, SO,
S02, CH=CH, les carbones de ce pont pouvant être ou non substitués par au
moins un
atome d'halogène et/ou au moins un groupe hydroxy, alkoxy, alkylthio, mono ou
di
alkylamino, alkylsulfinyle ou -sulfonyle, la partie alkyle étant telle que
définie ci-dessous,
Z est:
- un atome d' hydrogène, d'halogène, un groupe cyano, nitro,
hydroxy ou
-un alkyle, haloalkyl, hydroxyalkyl, formyloxylalkyle, alkyl- ou
aryl(thio)carbonyloxyalkyle, alkoxy(thio)carbonyloxyalkyle,
amino(thio)carbonyloxyalkyle, mono ou dialkylamino(thio)-
carbonyloxyalkyle, cycloalkyl ou cycloalkyl -alkyl, la partie cycloalkyl
pouvant être substituée par le groupe GR4 , défini ci-après,
- alkoxy éventuellement substitué par un hydroxy, un alkoxy,
un alkylthio, alkylsulfinyle ou -sulfonyle ,
-un phényloxy ou phénylthio, phénylsulfinyle ou -sulfonyle
- un amino éventuellement substitué par un ou deux alkyles
- alkényl ou alkynyl, chacun contenant de 3 à 7 atomes de
carbone, éventuellement subtitué
- phényl ou Het, éventuellement subtitué
- un groupe de formule C(=Z1)Z2 dans lequel:
- Z1 est un atome d'oxygène ou de soufre ou un groupe
alkylamino ou alkylimino ou arylamino ou arylimino et
- Z2 est:
- un atome d'hydrogène, d'halogène, un groupe
hydroxy, mercapto, cyano, amino,
- alkyl, alkoxy, haloalkoxy, alkylthio,
2194913
WO 96/02138 4 PCT/FR95/00921
- alkényl ou alkynyl ou alkényloxy, chacun
contenant de 3 à 7 atomes de carbone,
- phényle, phénylalkyl, phénoxy, phénalkyloxy,
-Het ou Het- alkyl,
-phénylalkényl ou phénylalkynyl; Het-alkényl
ou Het-alkynyl
- mono ou di alkylamino, un radical mono- ou
diphényl-amino, ou alkyl- ou arylsulfonylamino,
- un groupe phosphoryle substitué par deux radicaux choisis
parmi le groupe comprenant alkyle, alkoxy, alkylthio, dialkylamino,
cycloalkyl ou cycloalkyl
- alkyl, alkényl ou alkynyl, phényl, phénylalkyl, Het ou Het-alkyl, phényl
ou Het, éventuellement subtitués;
- ou un groupe S(=Z1)(=Z3)Z2, dans lequel Zl et Z2 ont les mêmes
significations que ci-dessus et Z3 a les mêmes significations que sans être
forcément égal à Z1,
ainsi que les formes tautomères de formule I bis, lorsque Z est un atome
d'hydrogène ou
isomères lorsque Z est un groupe de formule C(=Z1)Z2. ou S(=Z1)(=Z3)Z2,
X4
X3
X5
X2 I,
X
Z/N\N
I bis
ainsi que les sels d'hydracide ou d'acide perchlorique ou nitrique ou
sulfurique ou
d'acides alkyl- ou phényl(éventuellement substitué) sulfoniques des dérivés
deformules I
ou I bis et leurs complexes métalliques, et leurs N-oxydes,
étant entendu que dans toutes les significations ci-dessus,
21~49:I~
WO 96/02138 5 PCT/FR95/00921
- la partie hydrocarbonée linéaire de ces groupes peut comprendre de 1 à 7
atomes de carbone et être éventuellement halogénée (de 1 à 8 atomes
d'halogène),
la partie cycloalkyle de ces groupes peut comprendre de 3 à 7 atomes
de carbone et être éventuellement substitué par au moins un substituant
choisi dans le groupe GR4 défini ci-dessous,
- la partie phényle désigne le noyau phényle éventuellement substitué par
1 à 5 substituants choisis dans le groupe comprenant un atome d'halogène,
un alkyle ou alkoxy de 1 à 3atomes de carbone et nitro,
- Het est un radical hétérocyclique, mono ou bicyclique, contenant de 5 à 10
atomes, dont là 4 sont des hétéroatomes (oxygène, soufre, azote,
phosphore);.
-le groupe GR4 comprend :
- un atome d'halogène, ou un groupe cyano, nitro, mono ou
dialkylamino,
- un alkyl, alkoxy, alkylsulfényl, alkylsulfonyl, alkycarbonyl,
alkylthiocarbonyl, alkoxycarbonyl, alkoxythiocarbonyl, mono- ou
dialkykaminocarbonyl ou mono- ou dialkykaminothiocarbonyl, mono ou
dialkylaminosulfonyl, (la partie alkyl de tous ces substituants contenant de 1
à 4 atomes de carbone et pouvant être substituée par 1 à 9 atomes
d'halogène),
De préférence, dans la formule I Y est un atome de chlore ou de brome.
D'autres dérivés préférés sont tels que, dans la formule I, Z est un atome
d'hydrogène ou un groupe C(=Z1)Z2, dans lequel Zl est un atome d'oxygène ou de
soufre.
D'autres dérivés préférés sont tels que, dans la formule I, X1,X2 et X4 sont
un
atome d'hydrogène ou d'halogène ou un groupe nitro, amino ou alkyle,
éventuellement
halogéné, de 1 à 4 atomes de carbone.
D'autres dérivés préférés sont tels que, dans la formule I, X3 est un atome
d'hydrogène ou de fluor.
D'autres dérivés préférés sont tels que, dans la formule I, X1 et/ou X5 sont
un
atome d'hydrogène, .
D'autres dérivés préférés sont tels que dans la formule I, deux substituants
adjacents choisis parmi Xl, X2, X3, X4 et X5 forment un pont comprenant 3 ou 4
chaînons, en particulier un pont méthylènedioxy éventuellement halogéné et de
préférence
fluoré.
Des dérivés particulièrement préférés sont tels que respectivement dans la
formule
I:
WO 96/02138 6 PCT/FR95/00921 ~
a) X1, X3 et X5 sont un atome d'hydrogène et X2, X4 sont chacun un atome de
chlore
b) X 1 est un nitro, X2, X4 sont chacun un atome de chlore X3 est un atome de
fluor et X5 est un atome d'hydrogène c) X 1 est un atome de fluor, X2, X4
sont chacun un atome de chlore X3 est un atome de fluor, X3 et X5 sont un
atome
d'hydrogène
Certains de ces dérivés sont nouveaux et tels que dans la formule I:
Y est un atome de chlore et Z est un atome d'hydrogène,
X1 est un atome d'hydrogène ou d'halogène ou un groupe nitro, amino ou méthyle
X2 est un atome d'halogène ou un groupe nitro, amino ou méthyle,
X3est un atome d'hydrogène ou d'halogène
X4 est un atome d'halogène ou un groupe amino nitro, ou méthyle,
X5 est un atome d'hydrogène ou d'halogène
Des dérivés nouveaux préférés sont tels que dans la formule I:
Y, Z, X1 et X4 sont comme décrits ci-dessus,
X2 est un atome de chlore ou de brome,
X3 et,X5, identiques ou différents, sont chacun un atome d'hydrogène ou de
fluor.
Les dérivés selon l'invention peuvent être préparés selon des procédés en soi
connus tels que décrits dans les demandes publiées EP 0 538 156 et WO
93/22287.
Les exemples suivants illustrent respectivement la préparation de dérivés
nouveaux, leurs caractéristiques physico-chimiques(les structures ont été
vérifiées par
analyse RMN), leurs propriétés fongicides en traitement sur les maladies
foliaires ainsi
que les propriétés fongicides en traitement de semences de l'ensemble des
dérivés selon
l'invention.
Exemple 1: Acides benzoïques.
a) Acide 2,3-dichloro 5-nitro benzoïque.
A une solution refroidie à 5 C de 100 g (0,52 mol) d'acide 2,3-
dichlorobenzoïque
dissous dans 1000 ml d'acide sulfurique concentré, sont ajoutés par portions
58 g (0,57
mol) de nitrate de potassium. Après 1 heure, le milieu réactionnel est versé
dans 8 1 de
glace, filtré sur verre fritté puis séché (rendement 63%; analyse).
b) Acide 3-chloro 4-fluoro 5-bromo benzoïque.
Sous atmosphère d'argon, 10 g (0, 0265 mole) d'acide 3,5-dibromo 4-fluoro
benzoïque sont dissous dans 200 ml de THF sec. 37 ml de n-BuLi 1,6 M en
solution dans l'
hexane sont coulés, goutte à goutte, à-70 C. Au bout d' une heure d'
agitation, 25,1 g
(0,106 mole) d' hexachloroéthane en solution dans 20 ml de THF sec sont
additionnés.
Après 2 heures à-70 C, la température du milieu est ramenée progressivement à
l'
2194913
WO 96/02138 7 PCT/FR95/00921
ambiante. Le mélange réactionnel est hydrolysé avec 50 ml d' eau puis extrait
à 1' éther. La
phase aqueuse est acidifiée par addition d' HCl 1N puis extraite à l' éther.
La phase
organique est séchée sur sulfate de magnésium, concentrée sous pression
réduite. Le solide
est recristallisé dans un mélange heptane/éther pour donner 1,2 g d' acide 3-
chloro 4-fluoro
5-bromo benzoïque (rendement: 18 %; point de fusion: 184 C).
c) Acide 3-bromo 4-fluoro 5-bromo benzoïque.
On dissout 60,8 g de soude en pastilles dans 500 ml d' eau. 26 ml de brome
sont
additionnés en maintenant la température du milieu réactionnel inférieure à +
10 C. 50,0 g
(0,169 mole) de 3-bromo 4-fluoro 5-bromo acétophénone en solution dans 50 ml
de
1o dioxanne sont coulés en maintenant la température du milieu réactionnel
inférieure à
+ 10 C. La température du mélange réactionnel est ramenée à l' ambiante en
contrôlant l'
exothermicité de façon à ne pas dépasser +35 C. L' agitation est poursuivie
1,5 heure à
l'ambiante. La phase aqueuse est extraite à l' éther, acidifié à pH 1 environ
avec HCl 1N,
réextraite à l' éther. La phase organique est séchée sur sulfate de magnésium,
concentrée
sous vide. Le solide est trituré dans l' heptane pour donner 47,5 g d' acide 3-
bromo 4-fluoro
5-bromo benzoïque (rendement: 74 %; point de fusion: 201 C).
d) Acide 3,5-dichloro 2,4,6-trifluorobenzoïque.
Sous atmosphère d' argon et à-70 C, 57 ml d' une solution 1,6 M de n-BuLi dans
l'
hexane sont ajoutés, au goutte à goutte, à une solution de 10,4 g (0,090 mole)
de TMEDA
dans 40 ml de THF sec. A-70 C, 15,0 g (0,075 mole) de 3,5-dichloro 2,4,6-
trifluorobenzène dans 10 ml de THF sec sont additionnés au goutte à goutte.
Après 1 heure
d' agitation à -70 C, le mélange réactionnel est versé sur du dioxyde de
carbone solide
dans 100 ml de THF sec. Le milieu réactionnel est agité en laissant remonter
progressivement la température à l'ambiante, puis hydrolysé à l' eau, extrait
à l' éther. La
phase aqueuse est acidifiée avec HCl 1N, extraite à l' éther. La phase
organique est séchée
sur sulfate de magnésium, concentrée sous vide. Le solide est recristallisé
dans un mélange
heptane/éther (rendement: 54 %; point de fusion 136 C).
e) Acide 3,5-dichloro 2,4-difluorobenzoïque.
Sous atmosphère d' argon et à -50 C, 90 ml d' une solution 1,6 M de n-BuLi
dans l'
3o hexane sont ajoutés, au goutte à goutte, à une solution de 14,3 g (0,090
mole) de
diisopropylamine dans 100 ml de THF sec. Après une demi-heure à -50 C, 20,0 g
(0,109
mole) de 3,5-dichloro 2,4-difluorobenzène dans 70 ml de THF sec sont
additionnés au
goutte à goutte. Le milieu réactionnel est agité 1 heure à -70 C, versé sur
du dioxyde de
carbone solide dans 100 ml de THF sec. Après retour à température ambiante, le
mélange
réactionnel est hydrolysé à l' eau, extrait à l' éther. La phase aqueuse est
acidifiée avec HCl
1N, extraite à l' éther. La phase organique est séchée sur sulfate de
magnésiuin, concentrée
sous vide. Le solide est recristallisé dans un mélange heptane/éther
(rendement: 37 %;
point de fusion: 177 C).
WO 96/02138 8 PCT/FR95100921
f) Acide 3,5-dichloro-2,6-difluorobenzoïque.
On dissout 9,5 g (0,06 mole) d'acide 2,6-difluorobenzoïque et 7,8 ml de
chlorure
d'oxalyle (0,09 mole) dans 50 ml de 1,2-dichloroéthane. On ajoute 5 gouttes de
DMF et
l'ensemble est agité 1 heure à température ambiante. On ajoute 24 g (0,18
mole) de
chlorure d'aluminium et le milieu est porté à 60-70 C. Après passage d'un
courant de
chlore pendant 5 heures, en maintenant la température du milieu réactionnel
entre 60 et 70
C, l'ensemble est versé dans 100 ml d'HCI 1N. Le précipité est récupéré par
filtration,
lavé à l'eau, séché sous pression réduite pour donner 13 g d'un solide crème
(Rendement :
95,6 %; RMN 1H & 13C).
En opérant comme précédemment mais avec les réactifs appropriés on a préparé
les
acides suivants:
- l' acide 3-fluoro 5-bromobenzoïque (Rendement : 78 %; point de fusion:
144 C);
- l'acide 2-nitro ,3-chloro 5-méthylbenzoïque (Rendement : 83 %; point de
fusion:
226 C);
- l' acide 3-fluoro 5-méthoxybenzoïque (Rendement : 90 %; point de fusion:
121 C)
Exemple 2: Acétophénones.
(cf EXEMPLE 4 D de la demande WO 93/22287)
Les acétophénones sont obtenues à partir des acides benzoïques précédemment
obtenus selon le mode opératoire suivant:
a) Chlorure de l'acide 2,3-dibromo-5-méthyl benzoïque.
2,1 g(0,00714 mole) d'acide 2,3-dibromo-5-méthyl benzoïque en solution dans 20
ml de
1,2-dichloroéthane sont traités par l'addition de 0,78 ml (0,107 mole) de
chlorure de
thionyle en solution dans 5 ml de 1,2-dichloroéthane. Le mélange ainsi obtenu
est agité à
60 C pendant environ 5 heures puis concentré sous vide pour conduire à
l'obtention d'une
huile: chlorure de l'acide 2,3 dibromo-5-méthyl benzoïque.
b) (2,3-dibromo-5-méthylphényl) éthanone
On porte à reflux 30 ml d'éther pendant 3 heures un mélange de 0,87g (0,0076
mole)
d'éthylate de magnésium et 1,17 ml (0,0076 mole) de malonate d'éthyle. On
ajoute ensuite
à cette solution hétérogène 2g ( 0,0064 mole ) de chlorure d'acide obtenu
précédemment
dilué dans 5 ml d'ether. Le milieu réactionnel est ensuite agité à reflux
pendant 3 heures.
Après refroidissement, 10 ml d'une solution diluée d'acide sulfurique sont
ajoutés au
milieu réactionnel qui est ensuite extrait à l'éther et lavé à l'eau. Après
séchage sur MgSO4
et évaporation du solvant on obtient une huile directement engagée dans
l'étape de
décarboxylation: dilution dans un mélange de 5 nù d'acide acétique, 5 ml d'eau
et 1 ml
d'acide sulfurique concentré puis chauffage à 70 C pendant environ 2 heures.
Le milieu
2194913
~ WO 96/02138 9 PCT/FR95/00921
réactionnel est ensuite extrait à l'acétate d'éthyle et neutralisé par une
solution aqueuse de
soude. Après séchage sur MgSO4 et évaporation du solvant on obtient une huile:
(2,3-
dibromo-5-methylphényl) éthanone.
De la même manière que ci-dessus sont obtenues les acétophénones suivantes (cf
tableau ci-dessous), à partir des acides benzoïques substitués de façon
appropriée:
X4
X3
5
X2
0 *Me
X1 II
O
X, X2, X3, X4, X. Rdt (%). F C) ou Analyse.
H, Br, F, Cl, H. 50 Analyse.
F, Cl, F, Cl, F. 58 Analyse.
F, Cl, F, Cl, H. 63 48, 5
Me, Cl, F, Cl, H. 13 62
Cl, Cl, H, N02, H. 87 Analyse.
Me, N02, H, F, H. 89 50
F3C, Cl, H, H, H. 42 RMN
Cl, OCF3, H, Br, H. 61 RMN
Cl, OCF3, H, NO , H. 82 RMN
Br, OCF3, H, NO , H. 89 RMN
F, Br, F, Cl, H. 50 RMN
F, Me, F, Cl, H. 10 RMN
F, Cl, H, F, H. 46 RMN
H, F, H, Br, H. 54 73
NO , Cl, H, Me, H. 70 130
H, F, H, OMe, H. 68 66
H, Cl, H, Me, H. 52 RMN
B) Préparation de la (3 5-dichlorophényl) éthanone à partir de 3.5-
dichloroaniline (cf
exemple 4 F de la demande WO 93/22281:
2194913
WO 96/02138 10 PCT/FR95/00921
On ajoute 300 ml d'eau et 70 ml d'acide chlorydrique concentré à 48,6 g (0,30
mole)
de 3,5-dichloroaniline. 30 minutes après, on coule au goutte à goutte 27,5 g
(0,40 mole) de
nitrite de sodium dans 32 ml d'eau en maintenant la température entre 0 et 5
C. Au
mélange réactionnel filtré est ajouté 16,2 g (0,2 mole) d' acétate de sodium.
Cette solution
est coulée au goutte à goutte sur une solution de 28,5 g (0,48 mole)
d'acétaldoxime, de 25,
0 g (0,10 mole) de sulfate de cuivre pentahydraté, de 20,5 g (0,018 mole) de
sulfite de
sodium anhydre et de 121 g (1,50 mole) d'acétate de sodium dans 250 ml d'eau
maintenu à
C. Après 1h d'agitation, le milieu est acidifié par addition d'acide
chlorhydrique
concentré. Après entraînement à la vapeur et chromatographie du produit brut
sur colonne
10 de silice (heptane 90, acétate d'éthyle 10), on récupère 16,6 g (30%) de
(3,5-
dichlorophényl) éthanone, sous forme d'un liquide incolore.
En opérant comme ci-dessus, à partir de la 3-bromo-5-trifluorométhylaniline,
on
obtient la (3-bromo-5-trifluorométhylphényl) éthanone (rendement: 35%; RMN).
b) à partir de 4-acétyl-2,6-dichloroaniline :
15 On recristallise 814 g (4 moles) de 4-acétyl-2,6-dichloroaniline, préparée
selon le
brevet DD 273,435 du 15-11-1989, dans un mélange de 1200 ml d'acide
chlorhydrique
concentré et de 5200 ml d'acide acétique concentré. Après refroidissemnt à 0
C, on coule
en filet une solution de 290 g (4,2 moles) de nitrite de sodium dans 770 ml
d'eau. Après
2h30 à cette température, la solution est coulée sur une solution à 5 C de
2200 ml d'acide
hypophosphoreux à 50% dans l'eau. A la fin de la coulée, on laisse remonter à
température
ambiante puis on ajoute 10 1 d'eau et on extrait la phase aqueuse par du
dichlorométhane.
Après séchage de la phase organique décantée, concentration et distillation du
brut, on
obtient 591 g (rendement 78%, point d'ébullition: 91-95 C sous lmm Hg) de (3,5-
dichloro)phényl éthanone sous forme d'un liquide jaune clair.
En opérant comme ci-dessus à partir de 4-acétyl-6-bromo-2-chloroaniline, on
obtient 89%
de (3-bromo-5-chloro)phényl éthanoneRMN).
En opérant comme précédemment à partir de la 3,4,5-trichloroaniline, on a
obtenu
la (3,4,5-trichlorophényl)-éthanone (rendement:20%; F: 75 C).
Exemple 3: 2-chloroacétophénones
(préparation de chloracétophénone par chloracétylation (Friedel-Crafts) de la
2-chloro-1-
(2-chloro-4-fluoro-5-méthylphényl) éthanone ( Exemple 4 I de la demande WO
93/22287
WO 93 / 22287)
On coule goutte à goutte 14,1 g(0,125 mole) de chlorure de monochloracétyle
dans
une suspension de 16,66 g(0,125 mole) de chlorure d'aluminium anhydre dans 100
ml de
1,2-dichloréthane sec maintenue à la température de -5 C par un bain glace-
acétone.
On coule ensuite goutte à goutte 14,46 g(0,1 mole) de 4-chloro-2-fluorotoluène
à la même
température dans la solution obtenue. Le mélange réactionnel est agité pendant
1 heure à -
WO 96/02138 2194913 11 PCT/FR95/00921
C puis laissé au repos pendant une nuit, enfin porté à 60 C jusqu'à fin de
dégagement
gazeux. Après refroidissement par un bain de glace, on coule goutte à goutte
une solution
de 5 n-il d'acide chlorhydrique conçentré dans 100 ml d'eau. Après décantation
la phase
organique est lavée successivement par 50 ml d'eau, 50 ml de solution saturée
de NaHCO3
5 et 50 ml d'eau puis séchée sur sulfate de magnésium anhydre. Après
évaporation du
solvant, on obtient 22,3 g d'huile jaune pâle de 2-chloro-1-(2-chloro-4-fluoro-
5-
méthylphényl) éthanone, qui cristallise au refroidissement (point de fusion:
32 C;
rendement: 100%).
De même on a obtenu la 2-chloro-1-(3-méthyl-4-fluoro-5-méthylphényl) éthanone
(point
de fusion 86 C, rendement 87%)( FG 993) et la 2-chloro-1-(2-fluoro-3-chloro-4-
fluoro-5-
chloro phényl) éthanone (analyse RMN, rendement 75%).
Exemple 4: 3-bromo-4-fluoro-5-bromo acétophénone
On charge 133,5 g (1,00 mole) de chlorure d'aluminium dans 400 ml de 1,2-
dichloroéthane. L'ensemble est refroidi à + 10 C et on ajoute 13,81 g (0,10
mole) de 4-
fluoroacétophénone dissous dans 10 ml de 1,2-dichloroéthane. Le mileu
réactionnel est
chauffé à + 55 C et on coule, goutte à goutte, 51 ml de brome en 1 heure
environ.
L'agitation est poursuivie pendant 5 heures à + 55 C. Le mileu réactionnel est
ramené à
température ambiante, versé dans de l'eau acidulée glacée et extrait au
dichlorométhane.
Les phases organiques sont séchées sur sulfate de magnésium puis concentrées
sous vide.
On obtient 6,7 g de 3-bromo-4-fluoro-5-bromo acétophénone (rendement: 23%;
point de
fusion: 59 C).
Exemple 5: 3-méthvl-4-fluoro-5-chloro acétophénone
On charge 16,7 g (0,123 mole) de chlorure d'aluminium dans 100 ml de 1,2-
dichloroéthane. L'ensemble est refroidi à + 10 C et on ajoute 8,2 ml de
chlorure d'acétyle.
Au bout d'une demi-heure à + 10 C, on ajoute 15,0 g (0,104 mole) de 2-fluoro-
3chloro
toluène en solution dans 10 ml de 1,2-dichloroéthane. Le mileu réactionnel est
ramené à
température ambiante puis chauffé pendant 3 heures à + 50 C. Après
refroidissement, le
mélange est coulé dans HCl 1N et extrait au dichlorométhane. Les phases
organiques sont
séchées sur sulfate de magnésium puis concentrées sous vide. On obtient 11,6 g
de 3-
méthyl-4-fluoro-5-chloro acétophénone.
Exemple 6: Enaminones ( cf Exemples 5 et 6 de la demande WO 93/22287)
1-(3,5-dichlorophényl)-3-diméthylaminopropèn-2-one-1:
On dissout, à température ambiante et sous agitation, 10g (0,053 mole) de
3',5'-
dicholoroacétophénone dans 50 ml de N,N-diméthylformamide diméthylacétal.
L'agitation
est maintenue et le mélange réactionnel est chauffé pendant 2h à 90 C. Le
milieu est
12194913
WO 96/02138 12 PCT/FR95/00921
concentré à sec, sous pression réduite. Le résidu est repris avec 150 ml
d'heptane. Le résidu
orange est filtré pour donner 10,0 g (rendement 77%, point de fusion: 100 C)
de 1-(3,5-
dichlorophényl)-3-diméthylaminopropèn-2-one- 1.
En opérant de manière analogue, en partant de l'acétophénone convenablement
substituée et du second réactif approprié, on a obtenu les dérivés enaminones
de formule
ci-dessous, rassemblées dans le tableau suivant.
X4
X3
0 X5
X2
X1 11
W
O H
avec W = N(CH3)2
Xl, X2, X3, X4, X5. Rdt (%). F( C) ou Analys
H, Br, F, Cl, H. 80 Analyse.
H, Br, F, Br, H. 82 143
H, Me, F, Cl, H. 28 89
F, Cl, F, Cl, F. 81 128
H, Cl, Cl, Cl, H. 85 143
Me, Cl, F, Cl, H. 69 127
Cl, Cl, H, N02, H. 60 Analyse.
H, Cl, H, Me, H 91 Analyse
F, Br, F, C1, H. 87 121
F, Me, F, Cl, H. 40 RMN
H, F, H, OMe, H. 76 70
Exemple 7: Chloroenaminones.
1-(3,5-diméthyl-4-fluorophényl)-2-chloro-3-diméthylamino-2-propène-1-one.
Une suspension de 6,0 g (0,03 mole) de 2-chloro-3',5'-diméthyl-4'-
fluoroacétophénone dans un mélange de 7,15 g (0,06 mole) de diméthylacétal du
diméthylformamide et de 100 ml d'heptane, est portée à 50 C puis agitée à
cette
température pendant 8 h. Après refroidissement, le milieu réactionnel est
filtré et les
2194913
WO 96102138 13 PCT/FR95/00921
cristaux obtenus lavés à l'heptane puis séchés (3,2 g). Par évaporation
partielle du filtrat on
obtient un nouveau lot de cristaux qui sont traités de la même manière (0,8
g). Les deux
lots réunis sont ensuite chromatographiés sur gel de silice avec élution par
un mélange de
70% d'heptane et de 30% d'acétate d'éthyle, puis 50% heptane et 50% acétate
d'éthyle. On
obtient 1,84 g de 2-chloro-3',5'-diméthyl-4'-fluoroacétophénone de départ et
1,55 g de 1-
(3,5-diméthyl-4-fluorophényl)-2-chloro-3-diméthylamino-2-propène-1-one,
cristaux blancs
se décomposant à 177,5 C (rendement: 20% ).
En opérant de manière analogue, en partant de l'acétophénone convenablement
substituée
et du second réactif approprié, on a obtenu la (3,5-dichloro-2,4-
difluorophényl)-2-chloro-3-
diméthylamino-2-propène-l-one (cf analyse RMN, rendement = 100%).
Exemple 8: 1H-Pvrazoles (cf Exemple 7 de la demande WO 93/22287 )
3-(3,5-dichlorophényl) 1H-pyrazole.
On ajoute lentement et à température ambiante, 2,4 g (0,05 mole) d'hydrate
d'hydrazine à
une solution de 9 g (0,0369 mole) de 1-(3,5-dichlorophényl)-3-
diméthylaminopropèn-2-
one-1 dans 100 ml d'éthanol. Le mélange réactionnel est agité pendant 2 heures
à
température ambiante puis concentré à sec. Le résidu est trituré dans
l'heptane. On obtient
7,1 g (rendement 90%, point de fusion 156 C) de 3-(3,5-dichlorophényl) 1H-
pyrazole.
En opérant de manière analogue, en partant de l'énaminone convenablement
substituée et
du second réactif approprié, on a obtenu les dérivés pyrazoles de formule ci-
dessous,
rassemblés dans le tableau suivant.
X4
X3
0 XS
X2 H
X1
N
N
H
X, X2, X3, X4, X. Rdt (%). F( C) ou Analyse.
H, Br, F, Cl, H. 77 261
H, Br, F, Br, H. 86 201
H, Me, F, Cl, H. 93 156
2194913
WO 96/02138 14 PCT/FR95/00921
F, Cl, F, Cl, F. 47 155
H, Cl, Cl, Cl, H. 69 208
Me, Cl, F, Cl, H. 97 130
Cl, Cl, H, N02, H. 60 Analyse.
Me, N02, H, F, H. 81 98
H, Cl, H, Me, H 80 Analyse.
F, Br, F, Cl, H. 88 161
F, Cl, H, Cl, F. 70 150
F, CF , H, Cl, H. 12 RMN
CF , Cl, H, H, H. 97 RMN
Cl, OCF3, H, Br, H. 82 RMN
CI, OCF3, H, NO , H. 50 RMN
Br, OCF3, H, NO , H. 66 RMN
F, H, H, C1, H. 75 RMN
Cl, H, H, CF3, H. 90 RMN
H, F, H, Br, H. 69 RMN
NO , Cl, H, Me, H. 82 175
H, F, H, OMe, H. 38 83
3-Napht-2-yl 87 162
3-Benzo(b)thien-4-yl 60 147
EXEMPLE 9 : 4-Chloropyrazoles.
A) 3-(3,5-diméthyl-4-fluorophényl)-4-chloropyrazole (composé n 1).
Sous agitation et à température ambiante, une solution froide de 1,5 g
d'hydrate
d'hydrazine dans 30 ml d'acide acétique cristallisable est ajoutée rapidement
à une
suspension de 3,10 g (0,0122 mole) de 1-(3,5-diméthyl-4-fluorophényl)-2-chloro-
3-
diméthylamino-2-propène-1-one dans 20 ml d'acide acétique cristallisable.
Après 7 h
d'agitation à température ambiante le milieu réactionnel est versé dans 200 ml
d'eau. Le
lo solide formé est filtré, lavé à l'eau et séché sous vide en présence de
P205 puis purifié par
chromatographie sur gel de silice avec élution par un mélange de 70% d'heptane
et de 30%
d'acétate d'éthyle. On obtient 2,09 g de 3-(3,5-diméthyl-4-fluorophényl)-4-
chloropyrazole,
solide blanc fondant à 144 C (rendement: 76%).
En opérant de manière analogue, en partant du 1H-pyrazole convenablement
substitué et du second réactif approprié, on a obtenu le 3-(3,5-difluoro-4-
fluorophényl)-4-
chloropyrazole (composé n 2).
2194913
WO 96/02138 15 PCT/FR95/00921
B) 4- chloro-3-(3,5-dichorophényl) 1H-pyrazole (composé n 3):( Exemple 9a de
la demande WO 93/22287): Halogénation de pyrazoles
On dissout, à température ambiante et sous agitation, 2,3g (0,0152 mole) de 3-
(3,5-dichlorophényl) 1H-pyrazole dans 300 ml de dichlorométhane. On ajoute
ensuite 2, 07
g(0,016 mole) de N-chlorosuccinimide, puis on poursuit l'agitation 4 jours à
température
ambiante. Le mélange réactionnel est alors concentré puis chromatographié sur
colonne de
silice (éluant heptane/acétate d'éthyle 70/30). On obtient 1,4 g
(rendement:57%, Point de
fusion :192 C) de 4- chloro-3-(3,5-dichlorophényl) 1H-pyrazole.
En opérant de manière analogue, en partant du 1H-pyrazole convenablement
lo substitué et du second réactif approprié, on a obtenu les dérivés 4-chloro
pyrazoles de
formule ci-dessous, rassemblés dans le tableau suivant.
X4
X3
0 X5
X2 Y
X1
N~
N
1
H
Composé Xl, X2, X3, X4, X5. Y Rdt (%) F( C) ou
n Analyse.
4 H, Br, F, Cl, H. Cl 84 169
5 H, Br, F, Br, H. Cl 88 169
6 H, Me, F, Cl, H. Cl 69 174
7 F, Cl, F, Cl, F. Ci 79 143
8 H, Cl, Cl, CI, H. Cl 61 208
9 F, Cl, F, Cl, H. Cl 30 158
Me, Cl, F, Cl, H. Cl 81 53
11 Cl, Cl, H, N02, H. Cl 70 172
12 Me, N02, H, F, H. Cl 55 126
13 H, Cl, H, Me, H. Cl 85 175
40 F, Br, F, Cl, H. Cl 92 167
41 CF , Cl, H, H, H. Cl 68 78
WO 96/02138 16 ~ PCT/FR95/00921
42 Cl, F, H, OMe, H. Cl 75 156
43 H, F, H, OMe, H. Ci 45 127
44 F, Me, F, Cl, H. Cl 20 119
45 Cl, OCF3, H, Br, H. Cl 56 109
46 l, OCF , H, NO , H. Cl 44 132
47 3r, OCF3, H, NO , H. Cl 86 150
48 H, F, H, Br, H. Cl 39 155
49 F, H, H, Cl, H. Cl 19 116
50 Cl, H, H, CF , H. Cl 71 110
51 F, Cl, H, Cl, F. Cl 75 152
52 NO , Cl, H, Me, H. Cl 55 172
53 3-Napht-2-yl Cl 37 140
C) 4-Chloro-pyrazoles (cf Exemple 12 (Exemple 12 de la demande WO
93/22287).
a - Acétylation:
A 11,0 g (0,046 mole) de 4-chloro, 3-(2,2-difluorobenzo-l,3-dioxol-4-yl)
pyrazole
1H (préparé comme décrit dans la demande de brevet français n 91 12647)
dissous dans
100 ml de THF sont ajoutés 0,25 g (0,005 mole) de 4-diméthylaminopyridine et
4,25 g
(0,,042 mole) de triéthylamine. Sur cette solution est coulée, au goutte à
goutte et à 0 C,
une solution de 3,6 g (0,046 mole) de chlorure d'acétyle dans 50 ml de THF.
L'agitation
est poursuivie 3 h à température ambiante. Le mélange réactionnel est versé
dans 300 ml
d'eau et extrait à l'acétate d'éthyle. Aprés séchage de la phase organique et
concentration
sous vide, le résidu est trituré avec 50 ml d'heptane, filtré et séché. Nous
obtenons 12,8 g
de 1-acétyl-4-chloro-3-(2,2-difluorobenzo-1,3-dioxol-4-yl) pyrazole (composé
14) fondant
à 131 C.
b- Nitration:
A 12,8 g de 1-(acétyl), 4-chloro, 3-(2,2-difluorobenzo-1,3-dioxol-4-yl)
pyrazole
dissous dans 21 ml H2SO4 (96%) et 140 ml CH2C12 sont additionnés, par petites
portions
et à 0 C, 6,3 g (0,063 mole) de KNO3. Le milieu réactionnel est agité 3 h à 0
C puis versé
versé sur 300 cm3 de glace. Le précipité est récupéré par filtration, lavé à
l'eau puis à
l'heptane et séché. Nous obtenons 8,05 g de 4-chloro-3-(2,2-difluoro-5-
nitrobenzo-1,3-
dioxol-4-yl) pyrazole fondant à 180 C (rendement 63%) (composé 15).
En opérant de manière analogue, en partant du 1H-pyrazole convenablement
substitué et du second réactif approprié, on a obtenu les dérivés 4-chloro
pyrazoles de
formule ci-dessus, rassemblés dans le tableau suivant.
2194913
_ WO 96/02138 17 PCT/FR95/00921
Composé Xl, X2, X3, X4, X5. Y Rdt (%). F( C) ou
n Analyse.
16 F, Cl, H, N02, H. Cl 74 147
17 F, Br, H, N02, H. Cl 34 154
18 N02, Cl, H, Cl, H, Cl 55 173
54 F, NO , H, Cl, H. Cl 46 177
55 Cl, NO , H, CF , H. Cl 22 128
56 NO , OMe, H, F, H. Cl 50 158
Exemple 10: 3-(2-amino)phényl-4-chloro pyrazoles (cf Exemple 14 de la demande
WO
93/22287) 3-(2-amino-3,5-dichloro)phényl-4-chloro pyrazole (composé 19)
Dans un ballon tricol de 500 ml sont introduits 14,6 g ( 0,05 mole ) de 3-(2-
nitro-
3,5-dichlorophényl) 4-chloro pyrazole obtenu selon l'exemple 12b, en solution
dans 200
ml d'acide acétique. La solution est portée à 50 C et 8,4 g ( 0,15 mole ) de
fer en poudre
sont introduits par portions. On maintient ensuite le milieu réactionnel sous
agitation à
70 C pendant 5 heures. Après refroidissement, le milieu réactionnel est versé
dans 800 ml
d'eau, filtré sur verre fritté, rincé à l'eau et séché pour conduire à
l'obtention d'un solide
blanc
(Rendement: 90%, PF: décomposition à 300 C) du 3-(2-amino-3,5-dichlorophényl)
4-
chloro pyrazole.
En opérant de manière analogue, en partant du 4-chloro-pyrazole convenablement
substitué, on a obtenu les dérivés 4-chloro pyrazoles de formule ci-dessous,
rassemblés
dans le tableau suivant.
X4
X3
0 XS
X2 Y
X1
N
N
1
H
~19491~
WO 96102138 18 PCT/FR95/00921
composé Xl, X2, X3, X4, X5. Y Rdt (%). F( C) o
n Analyse.
20 NH , Cl, F, Cl, H. Cl 68 160
21 NH, Br, H, Br, H. Cl 47 169
22 Cl, Cl, H, NH, H CI 69 150
23 F, Cl, H, NH , H. Cl 90 145
24 F, Br, H, NH, H. Cl 75 155
57 NH Cl, H, Cl, F. Cl 85 150
58 NO , Cl, H, NH2, H Cl 26 198
Exemple 11: 4-chloro p,vrazoles (Exemple 15 de la demande WO 93/222871.
3-(2-méthvlthio-3.5-dichloro)phénvl-4-chloro pvrazole (composé 25)
Ce composé est obtenu par diazotation du 3-(2-amino-3,5-dichlorophényl)-4-
chloro
pyrazole et réaction avec le diméthyldisulfure, selon les méthodes décrites
dans la
littérature: Rendement 30%; miel.
A partir du sel de diazonium convenablement substitué, et réaction avec le
réactif de
approprié, sont obtenus les composés 3-phényl-4-choro ou bromo pyrazoles de
formule ci
dessus, figurant dans le tableau suivant, dans lequel le groupe introduit est
marqué par une
astérisque:
X4
X3
0 XS
X2 Y
X1
N~
N
1
H
Composé Xl, X2, X3, X4, X. Y Rdt (%). F( C) ou
n Analyse.
26 F*, Cl, H, Cl, H CI 75 180
27 F*, Cl, H, Br, H. Cl 74 175
2194913
WO 96/02138 19 PCT/FR95/00921
28 F*, Br, H, Br, H. Cl 70 170
29 F*, Br, H, Cl, H Cl 63 176
59 F, Br, H, Cl*, H. Cl 64 176
60 F, Me, H, Cl*, H. Cl 57 136
Exemple 12: 3-12-Nitrolphényl-4-chloro-pvrazoles
3-(2-nitro-3,5-dichloro-4-fluoro phényl)-4-chloro pyrazole (composé 30).
On ajoute, goutte à goutte, 0,43 ml (0,0104 mole) d'acide nitrique fumant
(100%) à
une solution refroidie à environ +5 C (bain d'eau glacée) de 2,50 g (0,00943
mole) de 3-
(3,5-dichloro-4-fluorophényl)-4-chloro pyrazole (préparé selon le procédé
décrit dans le
brevet WO 9322287, composé 266) dans 25 ml d'acide sulfurique 100%. Le milieu
réactionnel est agité à froid pendant 20 minutes puis à température ambiante
pendant une
lo heure et enfin versé sur 150 g de glace. Le précipité formé est extrait par
150 ml d'acétate
d'éthyle. La solution obtenue est lavée par 100 ml d'eau, 100 ml d' une
solution saturée
d'hydrogénocarbonate de sodium, 100 ml d'eau, séchée sur sulfate de magnésium
et
évaporée sous vide. On obtient 2,78 g de 3-(2-nitro-3,5-dichloro-4-
fluorophényl)-4-chloro
pyrazole, solide blanc fondant à 196,4 C (rendement: 95%).
En opérant de manière analogue, en partant du 4-chloro-pyrazole convenablement
substitué, on a obtenu les dérivés 3-(2-nitro)phényl-4-chloro pyrazoles de
formule ci-
dessus, rassemblés dans le tableau suivant.
Compos Xl, X2, X3, X4, X5 Y Rdt (%) F( C) o
n Analyse
31 N02, Br, H, Br, H. Cl 25 196
32 NO , Br, F, Br, H. Cl 73 221
33 NO , Me, F, Cl, H. Cl 19 214
34 N02, Cl, F, Me, H. Cl 20 205
61 NO , Me, H, Br, H. Cl 13 184
Exemple 13: 3-15-fluorophényll-4-chloropvrazoles
3-(2,3-dichloro5-fluoro phényl) 4-chloro pyrazole (composé 35).
Le tétrafluoroborate de diazonium du 3-(5-amino-2,3-dichloro-phényl)-4-chloro-
pyrazole est obtenu en coulant goutte à goutte à 0 C une solution aqueuse de
nitrite de
sodium ( 0,0021 mol ) sur une solution contenant 0,002 mol de 3-(5-amino-2,3-
dichloro-
phényl)-4-chloro-pyrazole et 5 ml d'acide tétrafluoroborique en solution
aqueuse à 50%.
Le milieu réactionnel est ainsi agité à 0 C pendant 1 heure puis versé dans 50
ml d'eau et
2194913
WO 96/02138 20 PCT/FR95/00921
de glace. Le précipité obtenu est séché rapidement sous vide puis décomposé
thermiquement à sec à 145 C. Après refroidissement, le milieu réactionnel est
repris au
dichlorométhane et purifié par chromatographie sur gel de silice avec comme
mélange
éluant Acétate d'éthyle / Heptane (25/75) (rendement: 19% ; point de fusion:
122 C).
En opérant de manière analogue, en partant du 4-chloro-pyrazole convenablement
substitué, on a obtenu le 3-(3-chloro-2,5-difluoro phényl)-4-chloro pyrazole
(composé 36)
(rendement: 17%; point de fusion: 150 C).
Exemple 14: 3-(3-chloro 5-hydroxy n~yl) 4-chloro pvrazole (dérivé témoin A).
Dans un tricol de 1000 ml, 49,5 g (0,2 mole) de 4-chloro-3-(3,5-dichloro
phényl)pyrazole (préparé comme décrit à l'exemple 9 de la demande W.O. 9322287
) sont
ajoutés à 500 ml de NMP(N-méthyl-pyrrolidone). On ajoute 43,2 g (0,8 mole) de
méthylate
de sodium et l' ensemble est chauffé à 140 C pendant 50 heures. Après
refroidissement le
mélange réactionnel est coulé dans 500 ml d'eau, acidifié puis extrait à
l'acétate d'éthyle.
Après séchage de la phase organique et concentration sous vide, le résidu est
purifié par
chromatographie sur colonne de silice (éluant: heptane/ acetate d'éthyle
60/40). On obtient
28 g(0,12 mole; rendement: 61%; point de fusion: 222 C) de 4-chloro-3-(3-
chloro-5-
hydroxyphényl) pyrazole.
Exemple 15: 3-(3-chloro 5-fluoro Qhénvl) 4-chloro pyrazole (composé 37).
Dans un tricol de 500 ml et à 0 C, 17,4 g (0,075 mole) de 4-chloro-3-(3-amino-
5-
chloro phényl)pyrazole (préparé comme décrit dans le brevet W.O. 9322287,
exemple 14)
sont ajoutés à 150 ml (1,20 mole) d'acide fluoroborique (à 50% dans l'eau).
5,7 g (0,826
mole) de nitrite de sodium en solution dans 10 ml d'eau sont coulés goutte à
goutte en
maintenant la température entre 0 et 5 C. L'agitation est poursuivie une heure
à
température ambiante. Le solide obtenu est filtré sur verre fritté, lavé à
l'eau puis au
pentane. Une fois sec, le solide est décomposé à 150 C pour donner une huile
brune reprise
dans l'isopropanol à chaud. Après chromatographie sur colonne de silice
(éluant: heptane/
acétate d'éthyle 70/ 30), on obtient 7,9 g (0,0342 mole; rendement: 45,6%;
point de fusion:
150 C) de 4-chloro-3-(3-chloro-5-fluoro phényl) pyrazole.
Exemple 16: PYRAZOLES N-SUBSTITUES (Exemple 19D de la demande
WO 93/22287).
1-acétoxyméthvl-4-chloro-3-(3 5-dichlorophényl)pvrazole (composé 38)
0,15 ml de 1,8-diazabicyclo(5.4.0)undécèn-7-ene est additionné, à température
ambiante, à
une solution de 2,55 g (0,01 mole) de 4-chloro-3-(3,5-dichlorophényl) pyrazole
et 0,90 g
(0,030 mole) de paraformaldéhyde dans 70 ml de THF. Le mélange réactionnel est
agité 4
h à température ambiante. Une solution de 1,20 g(0,015 mole) de chlorure
d'acétyle dans
2194913
WO 96/02138 21 PCT/FR95/00921
ml de THF, est coulée goutte à goutte à 0 C et l'agitation poursuivie 6 h à
température
ambiante. Le milieu réactionnel est concentré à sec. Le résidu est repris avec
15 ml
d'heptane puis séché. Nous obtenons 3,05 g de 1-acétoxyméthyl-4-chloro-3-(3,5-
dichlorophényl)pyrazole fondant à 95 C.
5 En opérant de manière analogue, en partant du 1-H-4-chloro-pyrazole
substitué, on
a obtenu les codérivés de formule I ci-dessous
X4
X3 X5
Y
2
X1 N
N
1
Z
Composé Xl, X2, X3, X4, Y Z Rdt F( C)
n X5. (%). ou
Analyse.
39 NO2, Cl, F, Cl, H. Cl CH2OA 97 100
c
40 F, Cl, H, Cl, H. Cl CH2OA 95 90
c
Exemple 17 : 4-chloro-3-(5-chloro-3-cvano-2-fluorophén~ÉI) pyrazole (composé
62).
On dissout du 3-(3-bromo-5-chloro-2-fluorophényl)-4-chloropyrazole (0,45 g;
0,0014 mole) et du cyanure de cuivre (0,14g; 0,0015 mole) dans du
diméthylformamide
(DMF) (10 ml) et le tout est chauffé à 180 C pendant 8 heures. Après
refroidissement à la
température ambiante, le mélange est versé dans une solution de NH4OH à 14%
(50 ml),
puis extrait à l'acétate d'éthyle (2x50 ml), séché sur MgSO4, evaporé sous
vide. La
purification du résidu huileux sur une colonne sèche de silice (élution avec
30% acétate
d'éthyle dans 1' heptane) produit 0,1 g d'un solide jaune (rendement : 28%;
Point de fusion:
128 C).
219491~
-
WO 96/02138 22 PCTIFR95/00921
Exemple 18 : 4-chloro-l-(4-methylphénylsulfon y1)pyrazole (composé 63).
On dissout du pyrazole (34 g; 0,5 mole) dans CH2Cl2 (350 ml) à 10 C et on
ajoute,
goutte à goutte, une solution de chlorure de sulfuryle (77,6 g; 0,575 mole)
dans CH2C1
(150 ml). Lorsque l'addition est terminée, le mélange est chauffé à reflux
pendant 18
heures. Le dichlorométhane est ensuite éliminé sous vide, le residu mis en
suspension dans
la pyridine (200 ml) et on ajoute par portions du chlorure de p-
toluènesulfonyle (95,33 g;
0,5 mole) . Ce mélange est ensuite chauffé à reflux et laissé refroidir à la
température
ambiante. Le mélange est refroidi dans un bain de glace et on ajoute de l'eau
(800 ml) sous
agitation vigoureuse. Au bout d'une heure un solide se forme. Il est receuilli
par filtration,
lavé à l'eau et recristallisé à partir de l'éthanol pour donner 102 g de 4-
chloro-l-(4-
methylphénylsulfonyl) pyrazole sous forme d'une poudre blanche (rendement :
80%; Point
de fusion: 96-97 C).
Exemple 19 : 4-chloro-5-(3-fluorophényl)-1-(4-méthylphénvlsulfonyl) pvrazole
(composé
64).
On dissout 2,4g (0,0093 mole) de 4-chloro-l-(methylphénylsulfonyl)pyrazole
dans
le tétrahydrofuranne (THF) (20 ml) et refroidit à - 78 C sous argon. On
ajoute, goutte à
goutte, du n-Butyl lithium 2,5 M (3,92 ml; 0,0098 mole) pendant 10 minutes et
le mélange
est maintenu sous agitation à - 78 C pendant 1,25 heure. On ajoute, goutte à
goutte, une
solution de chlorure de zinc dans le THF (10 ml; 0,01 mole) pendant 10
minutes. Le
mélange est maintenu sous agitation à - 78 C pendant 0,5 heure puis à
température
ambiante pendant 2 heures. Alors on ajoute du tétrakis(triphénylphosphine)
palladium
(Pd(PPh3)4 (0,35 g; 0,0003 mole) puis une solution de 3-fluoro iodobenzene
(1,4 g; 0,0062
mole) dans 15 ml de THF. Le mélange est ensuite porté à reflux pendant 18
heures, laissé
refroidir à température ambiante, dilué avec une solution d' EDTA (50 ml) puis
soumis à
une extraction avec (3 x 50 ml) d'éther. L'extrait organique est lavé à l'eau,
séché sur
MgSO4, filtré et evaporé pour donner une huile jaune (4,1 g). La purification
sur colonne
sèche de silice (élution avec 10% acétate d'éthyle dans l'heptane) donne 1,05
g de 4-chloro-
5-(3-fluorophényl)-1-(4-méthylphenylsulfonyl) pyrazole (rendement : 48%; Point
de
fusion: 110-111 C).
En opérant comme précédemment à partir de 4-chloro-1-(méthylphényl
sulfonyl)pyrazole
et d'un réactif approprié, on obtient les composés de formule ci-dessous et
indiqués dans le
tableau suivant :
WO 96102138 2194913 23 PCT/FR95/00921
R Cl
N:N
1
s02
. ~ I
CH3
Composé R. Rendement F ( C) .
n M.
65 Benzo b thién-4- l 56 133
66 (2-Carbométhoxy) 69 170
benzo thién-4- 1
67 Benzo furan-4- 1 67 102
Les réactifs intermédiares appropriés sont obtenus selon les modes opératoires
suivants:
a) 2-carbométhoxy-4-iodobenzo(b)thiophène:
On dissout 30,0 g(0,012 mole) de 2- fluoro-6-iodobezaldéhyde, à température
ambiante et sous atmosphère d'argon, dans le diméthylsulfoxyde sec (150 ml).
On ajoute,
goutte à goutte, en une minute, 14,05 g (0,0119 mole de thioglycolate de
méthyle puis
lo 25,85 g (0,255 mole) de triéthylamine. L'ensemble est chauffé à 60 C
pendant 2 heures,
refroidi à température ambiante et versé, sous agitation, dans un mélange
d'eau et de glace
(1000m1). Le précipité jaune est récupéré par filtration, séché à l'air, mis
en suspension
dans 300m1 de méthanol et chauffé à reflux pendant 10 minutes. La solution est
refroidie à
0 C, le précipité récupéré par filtration et séché sous vide pour donner 30,2
g de 2-
carbométhoxy-4-iodobenzo(b)thiophène, sous forme d'un solide crème (rendement:
79%;
point de fusion: 123-124 C).
b) 2-carbométhoxy-4-iodobenzo(b)furane:
On met en suspension 4,36 g(0,0109 mole) d'hydrure de sodium (60%, en
dispersion dans l'huile) dans 100 ml de tétrahydrofurane sous atmosphère
d'argon. Le
milieu est refroidi entre + 5 C et + 10 C à l'aide d'un bain d'eau glacée. On
ajoute, goutte à
goutte, en 30 minutes, une solution de 10,3 g(0,115 mole) de thioglycolate de
méthyle
dans 50 ml de THF. L'ensemble est agité 5 minutes à cette température. On
ajoute, goutte
à goutte, en 30 minutes, une solution de 21 g (0,084 mole) de 2-fluoro--6-
iodobenzadéhyde
dans 50 ml de THF. La température du milieu monte spontanément à + 40 C.
L'agitation
est poursuivie en une heure à la température de la pièce. Le milieu est traité
avec 2 ml de
WO 96/02138 219 4 91 3 PCTIFR95/00921
24
méthanol et 50 ml d'eau puis concentré sous pression réduite. Le résidu solide
est lavé à
l'eau, trituré à froid avec du méthanol et séché sous pression réduite pour
donner 11,3 g
d'un solide blanc (rendement: 45%; point de fusion: 141-143 C).
c) 2-carboxy-4-iodobenzo(b)thiophène:
On ajoute une solution aqueuse 10M d'hydroxyde de sodium (5,8m1) à un mélange
de 17,0 g (0,053 mole) de 2-carbométhoxy-4-iodobenzo(b)thiophène dans 150 ml
d'éthanol. L'ensemble est chauffé à reflux pendant une heure puis concentré à
sec sous
pression réduite. Le résidu est dissous à l'eau (300 ml) et lavé à l'acétate
d'éthyle (100 ml).
La phase aqueuse est acidifiée à pH = 1 avec HCl 36%. Le précipité est
récupéré par
lo filtration, lavé à l'eau et au diisopropyléther, séché sous pression
réduire à 70 C pour
donner 15,0 g d'un solide blanc (rendement: 93%; point de fusion: 260 C).
d) 4-iodobenzo(b)thiophène:
On met en suspension 4,3 g de chromite de cuivre dopé au baryum dans 70 ml de
quinoléïne et le tout est chauffé à 200 C. On ajoute par portions 13,0 g
(0,043 mole) de 2-
carboxy-4-iodobenzo(b)thiophène. Après cessation du dégagement gazeux (environ
15
minutes), le milieu est ramené à température ambiante, versé dans un mélange
HCl 36%
(100 ml)-glace, filtré sur célite. La célite est rincée à l'eau (200 ml) et à
l'acétate d'éthyle
(100 ml). Le filtrat est réextrait à l'acétate d'éthyle (2x 150 ml), lavé à
l'eau (400 ml) séché
(MgSO4), concentré sous pression réduite pour donner 11,65 g d'une huile
brune. La
purification sur colonne de silice (élution à l'heptane pur) donne 9,6 g d'un
solide jaune
(rendement: 86%; point de fusion: 37-39 C).
Exemple 20: 4-chloro-3-(benzo(b)thién-4-yl)pyrazole (composé 68).
On dissout du 5-(Benzo(b)thién-4-yl)-4-chloro-l-(4-méthylphénylsulfonyl)
pyrazole (3,3 g; 0,00844 mole) dans du DMF (25 ml) puis on chauffe à 110 C
pendant 18
heures. Après refroidissement à la température ambiante, le mélange est versé
dans de la
glace sous agitation avec production d'un produit huileux. Celui-ci est
extrait avec de
l'acétate d' éthyle (2x50 ml), lavé à l'eau (3x100 ml), séché. L'élution sur
une colonne sèche
de silice ( avec 20% acétate d'éthyle dans l' heptane produit 1,4 g d'un
solide jaune après
trituration (rendement : 70%; Point de fusion: 123 C).
En opérant comme précédemment à partir d'un réactif approprié, on obtient le 4-
chloro-3-
(benzo(b)furan-4-yl)pyrazole (rendement : 64%; Point de fusion: 122 C)
(composé 69).
Exemple 21 (Métallation)= 4-chloro-3-(5-chloro-2-fluoro-3-12hénvlthionhénvl)
pyrazole
(composé 70).
On dissout du 3-(3-Bromo-5-chloro-2-fluorophényl)pyrazole (1,10 g; 0,0035
mole)
dans le tétrahydrofuranne (THF) (20 ml) et refroidit à - 78 C sous argon. On
ajoute, goutte
WO 96/02138 25 219 4 913 PCT/FR95/00921
à goutte, du n-Butyl lithium 1,6 M (5,5 ml; 0,0088 mole) pendant 10 minutes
and le
mélange est maintenu sous agitation à - 78 C pendant 0,5 heure. On dissout,
goutte à
goutte, du diphenyldisulfure (1,53 g; 0,007 mole) dans le THF (10 ml) et le
mélange est
maintenu sous agitation pendant 1 heure à-78 C puis jusqu'au lendemain à la
température
ambiante. Alors on ajoute 100 ml d'eau. Le mélange est extrait avec 2x50 ml
d'acetate
d'éthyle, séché sur MgSO4,
évaporé sous vide pour donner un résidu huileux. La purification sur colonne
sèche de
silice (élution avec 30% d'acétate d'éthyle dans l' heptane) donne 0,45 g de 4-
chloro-3-(5-
chloro-2-fluoro-3-phénylthiophényl)pyrazole 38%; RMN 1H & 13C).
En opérant comme précédemment à partir de 4-chloro-3-(3-bromo-5-chloro-2-
fluorophényl) pyrazole et d'un réactif approprié, on obtient les composés de
formule ci-
dessous et indiqués dans le tableau suivant, dans lequel le groupe introduit
est marqué par
une astérisque:
X4
X3 ~ X5
1~ Y
X2
X1 r73r
NH
Composé Xl, X2, X3, X4, X5. Y Rendement F( C).
no %).
71 F, CO H*, H, Cl, H. Cl 37 184
72 F, CHO*, H, Cl, H. Cl 26 RMN
73 F, CO Et*, H, Cl, H. Cl 51 100
Exemple 22: Complexe métallique du 4-chloro-3-(3.5-dichlorophenvl)12vrazole et
de
chlorure de cuivre (composé 74) l.
On dissout du chlorure de cuivre dihydrate (1,70 g; 0,01 mole) dans l'éthanol
absolu (10
ml) et on ajoute du triéthylorthoformiate (1 ml). Ce mélange est maintenu sous
agitation
pendant 0,5 heure à température ambiante et on ajoute du 4-chloro-3-(3,5-
dichlorophenyl)pyrazole (4,95 g; 0,02 mole) dissout dans l'éthanol absolu (10
ml) . Ce
mélange est maintenu sous agitation pendant 0,5 heure à température ambiante
jusqu'au
I~
WO 96/02138 226 PCT/FR95/00921 -
lendemain. On récupère le précipité par filtration, on lave à l'éther
éthylique, sèche sous
pression réduite pour donner 11,8 g d'un solide vert clair (Rendement:
quantitatif; Point
de fusion: 288 C (décomposition).
En opérant comme précédemment à partir du pyrazole et du sel de métal
appropriés, on
obtient, avec un rendement quantitatif, les composés de formule I -- L- M+ --
I et indiqués
dans le tableau suivant :
Composé Xl, X2, X3, Xq, X5. M+ L- Couleur. F( C) .
no
75 H, Cl, H, Cl, H. Cu Br verdâtre 264 (déc.)
76 H, Cl, H, Cl, H. Cu NO bleu 190 (déc.)
77 H, Cl, H, Cl, H. Zn Cl blanc 195 déc.
78 H, Cl, H, Cl, H. Zn AcO blanc > 300
79 H, Cl, H, Cl, H. Ni Cl crème > 300
80 NO , Cl, F, Cl, H. Cu Cl bleu 255 déc.
81 F, Cl, H, Cl, H. Cu Cl vert 287 (déc.
D'autres composés de formule I et en soi connus d'après la demande européene 0
538 156
sont également testés:
composé 82 : 4-chloro-3-(2'-2' difluoro-1',3'-benzodioxol) pyrazole (composé n
25)
de la demande européene 0 538 156)
composé 83 : 4-chloro-3-(2,3-dichlorophényl) pyrazole (composé n 12 de la
demande
européene 0 538 156)
composé 84 : 4-chloro-3-(2 nitro,3-chlorophényl) pyrazole (composé n 120 de
la demande
européene 0 538 156)
La présente invention concerne également un procédé de traitement des plantes
cultivées atteintes ou susceptibles d'être atteintes par les maladies
fongiques caractérisé en
ce que l'on applique sur le matériel de propagation de ces plantes une dose
efficace d'un
composé selon la formule (I). Par dose efficace, on entend une quantité
suffisante pour
permettre le contrôle et la destruction des champignons présents sur ces
plantes cultivées.
Les doses d'utilisation peuvent toutefois varier dans de larges limites selon
le champignon
à combattre, le type de culture, les conditions climatiques, et selon le
composé utilisé.
En pratique, les composés s'appliquent avantageusement à des doses de 0,1 à
500
g de matière active par quintal de semence, et de préférence 1 à 400 g/quintal
.
Par maladies fongiques, on entend les maladies causées par les champignons
phytopathogènes, notamment ceux de la famille des oomycètes, des ascomycètes
et des
basidiomycètes.
WO 96/02138 27 PCT/FR95/00921
Parmi les cultures pouvant faire l'objet d'un traitement fongicide à l'aide
d'un
composé selon l'invention, on peut citer le riz, les céréales, notamment le
blé et l'orge, ainsi
que les plantes légumières. Le riz est une culture préférée pour les
traitements fongicides à
l'aide d'un composé selon l'invention.
Exemple 23: Test in vivo de désinfection des semences
Deux types de protocoles sont utilisés selon qu'on utilise des semences
naturellement infectées (Drechslera gramineal Drechslera teres de l'orge) ou
artificiellement infectées (Cochliobolus sativus/ Fusarium culmorum/ Fusarium
nivale/
Septoria nodorum):
On traite 30 g de graines au bol HEGE avec des matières actives selon
l'invention sous
forme de suspensions concentrées aqueuses, à une concentration de 1,5 litre
par quintal.
On sème 30 graines en pots (7x7x8 cm ) sur substrat tourbe pouzzolane et 3
pots sont
réalisés par traitement. Un témoin non traité contaminé et un témoin non
contaminé(dans le
cas des contaminations artificielles) sont semées dans les mêmes conditions.
Dans le cas des contaminations artificielles, les graines saines traitées sont
semées et une
suspension de spores est apportée à raison de 10 ml de suspension aqueuse par
pot.
La concentration de la suspension varie selon le pathogène étudié:
Pathogène culture nb de spores
Cochliobolus sativus orge 200 000
Fusarium culmorum/ blé, orge 400 000
Fusarium nivale
Septoria nodorum blé 250.000
Les pots sont placés dans une chambre climatique à 5 C à hygrométrie
saturante,
durant une période qui est fonction du test réalisé, à savoir 3 semaines pour
Drechslera
gramineaJDrechslera teres et Cochliobolus sativus et 2 semaines pour Fusarium
culmorum/Fusarium nivale/ Septoria nodorum).
Les pots sont ensuite transférés dans une chambre climatique à 10 C
(photopériode:
8 h. diurne; 16 h. nocturne), humidité relative de 80%, jusqu'à expression des
symptomes.
La notation est faite visuellement en comparaison avec le témoin non traité
contaminé.
Dans ces conditions, on observe, à la dose de 100g/q, une bonne protection (au
moins 75% ou totale):
- sur Drechslera graminea: avec les dérivés suivants: 3, 4, 5, 7, 10, 18, 26,
30, 68, 69;
- sur Drechslera teres: avec les dérivés suivants: 3, 26, 30, 82, 83, 84;
219491.-à
WO 96/02138 28 PCT/FR95/00921
- sur Cochliobolus sativus: avec les dérivés suivants: 3, 26, 30;
- sur Fusarium culmorum: avec les dérivés suivants: 3, 26, 30, 82, 83, 84;
- sur Fusarium nivale: avec les dérivés suivants: 1, 3, 4, 7, 8, 9, 12, 20,
26, 27, 28, 30, 37,
82, 83, 84;
- sur Septoria nodorum: avec les dérivés suivants: 3, 26, 30, 82, 83, 84;
La présente invention concerne également un procédé de traitement des plantes
cultivées atteintes ou susceptibles d'être atteintes par les maladies
fongiques caractérisé en
ce que l'on applique sur les parties aériennes de ces plantes une dose
efficace d'un composé
nouveau de formule (I) tel que défini ci-dessus. Par dose efficace, on entend
une quantité
suffisante pour permettre le contrôle ou la destruction des champignons
présents sur ces
plantes cultivées. Les doses d'utilisation peuvent toutefois varier dans de
larges limites
selon le champignon à combattre, le type de culture, les conditions
climatiques, et selon le
composé utilisé.
En pratique, les composés s'appliquent avantageusement à des doses de 0,002 à
5
kg/ha, et de préférence de 0,005 à 1 kg/ha.
Par maladies fongiques, on entend les maladies causées par les champignons
phytopathogènes, notamment ceux de la famille des oomycètes, des ascomycètes
et des
basidiomycètes.
Parmi les cultures pouvant faire l'objet d'un traitement fongicide à l'aide
d'un
composé selon l'invention, on peut citer le riz, les céréales, notamment le
blé et l'orge, ainsi
que les plantes légumières. Le riz est une culture préférée pour les
traitements fongicides à
l'aide d'un composé selon l'invention.
Exemple 24 : Test in vivo sur Botrytis cinerea sur feuille excisée de tomate :
(souches sensibles et souches résistantes aux benzimidazoles) :
On prépare, par broyage fin, une suspension aqueuse de la matière active à
tester
ayant la composition suivante:
- matière active : 60 mg
- agent tensioactif Tween 80, oléate de dérivé polyoxyéthyléné du sorbitan)
dilué à
10% dans l'eau : 0,3 ml
- on complète à 60 ml d'eau.
Cette suspension aqueuse est ensuite diluée par de l'eau pour obtenir la
concentration désirée en matière active.
Des tomates cultivées en serre (variété Marmande) agées de 30 jours sont
traitées
par pulvérisation avec des suspensions aqueuses telles que définies ci-dessus
et à diverses
concentrations du composé à tester.
WO 96/02138 2194913 29 PCT/FR95/00921
Au bout de 24 heures les feuilles sont coupées et mises dans une boîte de
Pétri
(diamètre 14 cm), dont le fond a été préalablement garni d'un disque de papier
filtre
humide (10 folioles par boîte).
L'inoculum est ensuite apporté à l'aide d'une seringue par dépôt de gouttes( 3
par
foliole) d'une suspension de spores de Botrytis cinerea, sensibles aux
benzimidazoles ou
résistants aux benzimidazoles, obtenue à partir de cultures de 15 jours, mises
ensuite en
suspension à raison de 150 000 unités par cm3.
Le contrôle est fait 6 jours après la contamination en comparaison avec un
témoin
non traité.
Dans ces conditions, on observe, à la dose de 1 g/l, une protection bonne (au
moins 75%) ou totale avec les composés suivants : 1, 2, 3, 4, 5, 6, 7, 9, 10,
12, 13, 19, 20,
21, 26, 27, 28, 30, 31, 32, 33, 34, 35, 36, 37, 39, 40, 62, 68, 70, 74, 75,
76, 77, 78, 79, 80,
81 sur Botrytis sensible aux benzimidazoles.
Exemple 25: Test in vivo sur Pyricularia ory3ae responsable de la
piriculariose du riz :
On prépare, par broyage fin, une suspension aqueuse de la matière active à
tester
ayant la composition suivante :
- matière active : 60 mg
- agent tensioactif Tween 80, oléate de dérivé polyoxyéthyléné du sorbitan)
dilué à
10% dans l'eau : 0,3 ml
- on complète à 60 ml d'eau.
Cette suspension aqueuse est ensuite diluée par de l'eau pour obtenir la
concentration désirée en matière active.
Du riz, semé en godets dans un mélange 50/50 de tourbe enrichie et de
pouzzolane, est traité au stade 10 cm de hauteur par pulvérisation de la
suspension aqueuse
ci dessus.
Au bout de 24 heures, on applique sur les feuilles une suspension aqueuse de
spores de Pyricularia oryzae, obtenue à partir d' une culture de 15 jours,
mise ensuite en
suspension à raison de 100 000 unités par cm3.
Les plants de riz sont placés pendant 24 heures en incubation ( 25 C, 100%
d'humidité relative) , puis mis en cellule d'observation, dans les mêmes
conditions, pendant
5 jours.
La lecture se fait 6 jours après la contamination.
Dans ces conditions, on observe, à la dose de 1 g/l, une protection bonne (au
moins 75%) ou totale avec les composés suivants: 1, 5, 6, 8, 9, 10, 12, 13,
17, 19, 20, 21,
23, 24, 26, 27, 28, 30,31, 32, 33, 34, 35, 36, 37, 39, 40, 68, 70, 80, 81.
219491~
WO 96/02138 30 PCT/FTt95/00921
Exemple 26: Test in vivo sur Plasmopara viticola :
On prépare, par broyage fin, une suspension aqueuse de la matière active à
tester
ayant la composition suivante:
- matière active: 60 mg
- agent tensioactif Tween 80, oléate de dérivé polyoxyéthyléné du sorbitan)
dilué à
10% dans l'eau : 0,3 ml
- on complète à 60 ml d'eau.
Cette suspension aqueuse est ensuite diluée par de l'eau pour obtenir la
concentration désirée en matière active.
Des boutures de vigne (Vitis vinifera), variété Chardonnay, sont cultivées
dans des
godets. Lorsque ces plants sont âgés de 2 mois (stade 8 à 10 feuilles, hauteur
de 10 à 15
cm), ils sont traités par pulvérisation au moyen de la suspension aqueuse ci-
dessus.
Des plants, utilisés comme témoins sont traités par une solution aqueuse ne
contenant pas la matière active.
Après séchage pendant 24 heures, on contamine chaque plant par pulvérisation
d'une suspension aqueuse de spores de Plasmopara viticola obtenue à partir d'
une culture
de 7 jours, mise ensuite en suspension à raison de 100 000 unités par cm3.
Les plants contaminés sont ensuite mis en incubation pendant deux jours à 18 C
environ, en atmosphère saturée d'humidité puis pendant 5 jours à 20-22 C
environ sous 90-
100% d'humidité relative.
La lecture se fait 7 jours après la contamination, en comparaison avec les
plants
témoins.
Dans ces conditions, on observe, à la dose de 1 g/l, une protection bonne (au
moins 75%) ou totale avec les composés suivants : 1, 2, 3, 4, 5, 6, 8, 9, 11,
13, 16, 20, 21,
23, 24, 26, 27, 30, 31, 35, 33, 36, 37, 39, 40, 62, 68, 70, 72, 73, 74, 77,
78, 79, 80, 81.
Exemple 27 = Test in vivo sur Puccinia recondita (rouille du blé) :
On prépare, par broyage fin, une suspension aqueuse de la matière active à
tester
ayant la composition suivante:
- matière active: 60 mg
- agent tensioactif Tween 80, (oléate de dérivé polyoxyéthyléné du sorbitan)
dilué
à 10% dans l'eau : 0,3 ml
- on complète à 60 ml d'eau pour obtenir une suspension/solution à 1 g/l.
Cette suspension aqueuse est ensuite éventuellement diluée par de l'eau pour
obtenir la concentration désirée en matière active.
Du blé, en godets, semé sur un substrat tourbe terre pouzzolane 50/50, est
traité au
stade 10 cm de hauteur par pulvérisation de la suspension aqueuse ci dessus.
2194913
- WO 96/02138 31 PCT/FR95/00921
Des plants, utilisés comme témoins sont traités par une solution aqueuse ne
contenant pas la matière active.
Au bout de 24 heures, une suspension aqueuse de spores (100000 sp/cm3) est
pulvérisée sur le blé; cette suspension a été obtenue à partir de plants
contaminés. On place
ensuite le blé pendant 24 heures en cellule d'incubation à environ 20 C et à
100%
d'humidité relative, puis pendant 7 à 14 jours à 60% d'humidité relative.
Le contrôle de l'état des plants se fait entre le 8ème et le 15ème jour après
la
contamination, par comparaison avec un témoin non traité.
Dans ces conditions, on observe, à la dose de 1 g/l, une protection bonne (au
moins 75%) ou totale avec les composés suivants : 1, 2, 3, 4, 5, 6, 7, 8, 9,
10,12, 13, 20,
21, 26, 27, 28, 30, 31, 32, 33, 35, 37, 40.
La présente invention a également pour objet des compositions, utilisables
comme
agents fongicides, contenant comme matière(s) active(s) un (ou plusieurs)
composé selon
la formule (I) tel que décrit précédemment, en mélange avec les supports
solides ou
liquides, acceptables en agriculture et les agents tensio-actifs également
acceptables en
agriculture. En particulier sont utilisables les supports inertes et usuels et
les agents tensio-
actifs usuels.
Ces compositions peuvent contenir aussi toute sorte d'autres ingrédients tels
que,
par exemple, des colloïdes protecteurs, des adhésifs, des épaississants, des
agents
thixotropes, des agents de pénétration, des stabilisants, des séquestrants,
etc... Plus
généralement les composés utilisés dans l'invention peuvent être combinés à
tous les
additifs solides ou liquides correspondant aux techniques habituelles de la
mise en
formulation.
D'une façon générale, les compositions selon l'invention contiennent
habituellement de 0,05 à 95 % environ (en poids) d'un composé selon
l'invention (appelé
par la suite matière active), un ou plusieurs supports solides ou liquides et,
éventuellement,
un ou plusieurs agents tensioactifs.
Par le terme "support", dans le présent exposé, on désigne une matière
organique
ou minérale, naturelle ou synthétique, avec laquelle le composé est combiné
pour faciliter
son application sur la plante, sur des graines ou sur le sol. Ce support est
donc
généralement inerte et il doit être acceptable en agriculture, notamment sur
la plante traitée.
Le support peut être solide (argiles, silicates naturels ou synthétiques,
silice, résines, cires,
engrais solides, etc...) ou liquide (eau, alcools, notamment le butanol
etc...).
L'agent tensioactif peut être un agent émulsionnant, dispersant ou mouillant
de
type ionique ou non ionique ou un mélange de tels agents tensioactifs. On peut
citer par
exemple des sels d'acides polyacryliques, des sels d'acides lignosulfoniques,
des sels
d'acides phénolsulfoniques ou naphtalènesulfoniques, des polycondensats
d'oxyde
d'éthylène sur des alcools gras ou sur des acides gras ou sur des amines
grasses, des
21949~~
WO 96/02138 32 PCT/FR95/00921 --
phénols substitués (notamment des alkylphénols ou des arylphénols), des sels
d'esters
d'acides sulfosucciniques, des dérivés de la taurine (notamment des
alkyltaurates), des
esters phosphoriques d'alcools ou de phénols polyoxyéthylés, des esters
d'acides gras et de
polyols, les dérivés à fonction sulfates, sulfonates et phosphates des
composés précédents.
La présence d'au moins un agent tensioactif est généralement indispensable
lorsque le
composé et/ou le support inerte ne sont pas solubles dans l'eau et que l'agent
vecteur de
l'application est l'eau.
Ainsi donc, les compositions à usage agricole selon l'invention peuvent
contenir
les matières actives selon l'invention dans de très larges limites, allant de
0,05 % à 95 %
(en poids). Leur teneur en agent tensio-actif est avantageusement comprise
entre 5 % et 40
% en poids.
Ces compositions selon l'invention sont elles-mêmes sous des formes assez
diverses, solides ou liquides.
Comme formes de compositions solides, on peut citer les poudres pour poudrage
(à teneur en composé pouvant aller jusqu'à 100 %) et les granulés, notamment
ceux
obtenus par extrusion, par compactage, par imprégnation d'un support granulé,
par
granulation à partir d'une poudre (la teneur en composé dans ces granulés
étant entre 0,5 et
80 % pour ces derniers cas), les comprimés ou tablettes effervescents.
Les composés de formule (I) peuvent encore être utilisés sous forme de poudres
pour poudrage ; on peut aussi utiliser une composition comprenant 50 g de
matière active
et 950 g de talc ; on peut aussi utiliser une composition comprenant 20 g de
matière active,
10 g de silice finement divisée et 970 g de talc ; on mélange et broie ces
constituants et on
applique le mélange par poudrage.
Comme formes de compositions liquides ou destinées à constituer des
compositions liquides lors de l'application, on peut citer les solutions, en
particulier les
concentrés solubles dans l'eau, les concentrés émulsionnables, les émulsions,
les
suspensions concentrées, les aérosols, les poudres mouillables (ou poudre à
pulvériser), les
pâtes, les gels.
Les concentrés émulsionnables ou solubles comprennent le plus souvent 10 à 80
% de matière active, les émulsions ou solutions prêtes à l'application
contenant, quant à
elles, 0,001 à 20 % de matière active.
En plus du solvant, les concentrés émulsionnables peuvent contenir quand c'est
nécessaire, 2 à 20 % d'additifs appropriés comme les stabilisants, les agents
tensio-actifs,
les agents de pénétration, les inhibiteurs de corrosion, les colorants ou les
adhésifs
précédemment cités.
2194913
WO 96/02138 33 PCT/FR95/00921
A partir de ces concentrés, on peut obtenir par dilution avec de l'eau des
émulsions
de toute concentration désirée, qui conviennent particulièrement à
l'application sur les
cultures.
A titre d'exemple, voici la composition de quelques concentrés émulsionnables
:
Exemple CE 1 :
- matière active 400 g/l
- dodécylbenzène sulfonate alcalin 24 g/l
- nonylphénol oxyéthylé à 10 molécules
d'oxyde d'éthylène 16 g/l
- cyclohexanone 200 g/l
- solvant aromatique q.s.p. 1 litre
Selon une autre formule de concentré émulsionnable, on utilise :
Exemple CE 2
- matière active 250 g
- huile végétale époxydée 25 g
- mélange de sulfonate d'alkylaryle et
d'éther de polyglycol et d'alcools gras 100 g
- diméthylformamide 50 g
- xylène 575 g
Les suspensions concentrées, également applicables en pulvérisation, sont
préparées de manière à obtenir un produit fluide stable ne se déposant pas et
elles
contiennent habituellement de 10 à 75 % de matière active, de 0,5 à 15 %
d'agents
tensioactifs, de 0,1 à 10 % d'agents thixotropes, de 0 à 10 % d'additifs
appropriés, comme
des anti-mousses, des inhibiteurs de corrosion, des stabilisants, des agents
de pénétration et
des adhésifs et, comme support, de l'eau ou un liquide organique dans lequel
la matière
active est peu ou pas soluble : certaines matières solides organiques ou des
sels minéraux
peuvent être dissous dans le support pour aider à empêcher la sédimentation ou
comme
antigels pour l'eau.
A titre d'exemple, voici une composition de suspension concentrée :
Exemple SC 1 :
- matière active 500 g
- phosphate de tristyrylphénol polyéthoxylé 50 g
WO 96102138 34 PCT/FR95/00921
- alkylphénol polyéthoxylé 50 g
- polycarboxylate de sodium 20 g
- éthylène glycol 50 g
- huile organopolysiloxanique (antimousse) 1 g
- polysaccharide 1,5 g
- eau 316,5 g
Les poudres mouillables (ou poudre à pulvériser) sont habituellement préparées
de
manière qu'elles contiennent 20 à 95 % de matière active, et elles contiennent
habituellement, en plus du support solide, de 0 à 30 % d'un agent mouillant,
de 3 à 20 %
d'un agent dispersant, et, quand c'est nécessaire, de 0,1 à 10 % d'un ou
plusieurs stabilisants
et/ou autres additifs, comme des agents de pénétration, des adhésifs, ou des
agents
antimottants, colorants, etc...
Pour obtenir les poudres à pulvériser ou poudres mouillables, on mélange
intimement les matières actives dans les mélangeurs appropriés avec les
substances
additionnelles et on broie avec des moulins ou autres broyeurs appropriés. On
obtient par là
des poudres à pulvériser dont la mouillabilité et la mise en suspension sont
avantageuses ;
on peut les mettre en suspension avec de l'eau à toute concentration désirée
et ces
suspensions sont utilisables trés avantageusement en particulier pour
l'application sur les
feuilles des végétaux.
A la place des poudres mouillables, on peut réaliser des pâtes. Les conditions
et
modalités de réalisation et d'utilisation de ces pâtes sont semblables à
celles des poudres
mouillables ou poudres à pulvériser.
A titre d'exemple, voici diverses compositions de poudres mouillables (ou
poudres
à pulvériser) :
Exemple PM 1
- matière active 50%
- alcool gras éthoxylé (agent mouillant) 2,5%
- phényléthylphénol éthoxylé (agent dispersant) 5%
- craie (support inerte) 42,5%
Exemple PM 2:
- matière active 10%
- alcool synthétique oxo de type ramifié, en
C 13 éthoxylé par 8 à 10 oxyde d'éthylène
(agent mouillant) 0,75%
- lignosulfonate de calcium neutre (agent
9 13
WO 96/02138 35 PCT/FR95/00921
dispersant) 12%
- carbonate de calcium (charge inerte) q.s.p. 100 %
Exemple PM 3:
Cette poudre mouillable contient les mêmes ingrédients que dans l'exemple
précédent, dans les proportions ci-après :
- matière active 75%
- agent mouillant 1,50%
- agent dispersant 8%
- carbonate de calcium (charge inerte) q.s.p. 100%
Exemple PM 4:
- matière active 90%
- alcool gras éthoxylé (agent mouillant) 4%
- phényléthylphénol éthoxylé (agent dispersant) 6%
Exemple PM 5:
- matière active 50%
- mélange de tensio-actifs anioniques et
non ioniques (agent mouillant) 2,5%
- lignosulfonate de sodium (agent dispersant) 5%
- argile kaolinique (support inerte) 42,5%
Les dispersions et émulsions aqueuses, par exemple les compositions obtenues
en
diluant à l'aide d'eau une poudre mouillable ou un concentré émulsionnable
selon
l'invention, sont comprises dans le cadre général de la présente invention.
Les émulsions
peuvent être du type eau-dans-l'huile ou huile-dans-l'eau et elles peuvent
avoir une
consistance épaisse conune celle d'une "mayonnaise".
Les composés selon l'invention peuvent être formulés sous la forme de granulés
dispersibles dans l'eau également compris dans le cadre de l'invention.
Ces granulés dispersibles, de densité apparente généralement comprise entre
environ 0,3 et 0,6 ont une dimension de particules généralement comprise entre
environ
150 et 2000 et de préférence entre 300 et 1500 microns.
La teneur en matière active de ces granulés est généralement comprise entre
environ 1 % et 90 %, et de préférence entre 25 % et 90 %.
Le reste du granulé est essentiellement composé d'une charge solide et
éventuellement d'adjuvants tensio-actifs conférant au granulé des propriétés
de
dispersibilité dans l'eau. Ces granulés peuvent être essentiellement de deux
types distincts
219491`~
WO 96/02138 36 PCT/FR95100921
selon que la charge retenue est soluble ou non dans l'eau. Lorsque la charge
est
hydrosoluble, elle peut être minérale ou, de préférence, organique. On a
obtenu d'excellents
résultats avec l'urée. Dans le cas d'une charge insoluble, celle-ci est de
préférence minérale,
conune par exemple le kaolin ou la bentonite. Elle est alors avantageusement
accompagnée
d'agents tensio-actifs (à raison de 2 à 20 % en poids du granulé) dont plus de
la moitié est,
par exemple, constituée par au moins un agent dispersant, essentiellement
anionique, tel
qu'un polynaphtalène sulfonate alcalin ou alcalino terreux ou un
lignosulfonate alcalin ou
alcalino-terreux, le reste étant constitué par des mouillants non ioniques ou
anioniques tel
qu'un alkyl naphtalène sulfonate alcalin ou alcalino-terreux.
Par ailleurs, bien que cela ne soit pas indispensable, on peut ajouter
d'autres
adjuvants tels que des agents anti-mousse.
Le granulé selon l'invention peut être préparé par mélange des ingrédients
nécessaires puis granulation selon plusieurs techniques en soi connues
(drageoir, lit fluide,
atomiseur, extrusion, etc...). On termine généralement par un concassage suivi
d'un
tamisage à la dimension de particule choisie dans les limites mentionnées ci-
dessus. On
peut encore utilisé des granulés obtenus comme précédemment puis imprégnés
avec une
composition contenant la matière active.
De préférence, il est obtenu par extrusion, en opérant comme indiqué dans les
exemples ci-après.
Exemple GD 1: Granulés dispersibles
Dans un mélangeur, on mélange 90 % en poids de matière active et 10 %
d'urée en perles. Le mélange est ensuite broyé dans un broyeur à broches. On
obtient une
poudre que l'on humidifie avec environ 8 % en poids d'eau. La poudre humide
est extrudée
dans une extrudeuse à rouleau perforé. On obtient un granulé qui est séché,
puis concassé
et tamisé, de façon à ne garder respectivement que les granulés d'une
dimension comprise
entre 150 et 2000 microns.
Exemple GD2 : Granulés dispersibles
Dans un mélangeur, on mélange les constituants suivants :
- matière active 75%
- agent mouillant (alkylnaphtalène sulfonate de sodium) 2%
- agent dispersant (polynaphtalène sulfonate de sodium) 8%
- charge inerte insoluble dans l'eau (kaolin) 15%
Ce mélange est granulé en lit fluide, en présence d'eau, puis séché, concassé
et
tamisé de manière à obtenir des granulés de dimension comprise entre 0,15 et
0,80 mm.
M94913
WO 96/02138 37 PCT/FR95/00921
Ces granulés peuvent être, utilisés seuls, en solution ou dispersion dans de
l'eau de
manière à obtenir la dose cherchée. lls peuvent aussi être utilisés pour
préparer des
associations avec d'autres matières actives, notamment fongicides, ces
dernières étant sous
la forme de poudres mouillables, ou de granulés ou suspensions aqueuses.
En ce qui concerne les compositions adaptées au stockage et au transport,
elles
contiennent plus avantageusement de 0,5 à 95 % (en poids) de substance active.