Note: Descriptions are shown in the official language in which they were submitted.
CA 02209432 1997-06-30
Utilisation de dérivés amino-alcools à fonction urée dans et pour la
préparation de
compositions cosmétiques ou dermatologiques
La présente invention concerne l'utilisation de dérivés amino alcools à
fonction urée dans
et pour la préparation de compositions cosmétiques ou dermatologiques en
particulier
leur utilisation comme agents hydratants dans des produits de soin pour la
peau ou
comme agents de conditionnement dans des produits capillaires.
On connaît dans l'état de la technique un certain nombre de composés amino-
alcools à
fonction urée. Certains ont été notamment décrits dans le brevet US 3.135.790.
et sont
utilisés comme agents émulsifiants dans des formulations de peintures ou de
laques ou
comme intermédiaires de synthèse. D'autres tels que ceux décrits dans le
brevet
DE 1 125 905, notamment le N-méthyl-N-(2,3,4,5,6-penta-hydroxy-n-hexyl)-N'-n-
octyl-
urée, sont utilisés comme additifs pour textiles, agents de lavage, agents de
réticulation
ou comme émulsifiants. On utilise certains dérivés amino-alcools à fonction
urée dans le
brevet US 2.891.944 pour leurs propriétés insecticides. On a décrit également
le 3-(3-
octadécyluréido)-1,2-propanediol dans l'article J. Med. Chem. 31(4), 858-863,
1988, pour
son activité sur certaines cellules cancéreuses.
La Demanderesse a découvert de manière surprenante que des dérivés amino-
alcools à
fonction urée particuliers dont on définiera la structure ci-dessous
présentaient des
propriétés cosmétiques intéressantes, en particulier des propriétés
hydratantes de la
peau.
On a en effet constaté qu'en appliquant ces produits sur la peau, il est
possible d'en
diminuer la perte en eau et/ou d'augmenter la fixation d'eau dans le Stratum
Corneum.
Ces composés peuvent donc être utilisés comme agents hydratants, notamment de
la
peau chez l'humain.
Ils permettent de conserver ou de restaurer la souplesse de la peau, son
élasticité, sa
résistance au mouvement du corps et sa fonction de barrière à l'entrée des
substances
toxiques. Ils peuvent ainsi être utilisés dans des produits de soin pour les
peaux sèches
ou prédisposés à l'assèchement.
1
CA 02209432 1997-06-30
Ces composés présentent de façon inattendue une activité de barrière de
perméabilité à
l'eau sur la peau considérablement plus importante que leurs homologues
carbamates
ou amides connus en cosmétique pour leurs propriétés hydratantes.
La demanderesse a découvert également de façon surprenante que les dérivés
amino-
alcools à fonction urée selon l'invention, utilisés dans des compositions
capillaires,
confèrent aux cheveux un toucher particulièrement doux et facilitent leur
démêlage. Ils
peuvent être ut~isés comme agents de conditionnement des cheveux.
L'objet principal de l'invention concerne donc l'utilisation de dérivés amino-
alcools à
fonction urée que l'on définira par la suite, dans et pour la préparation de
compositions
cosmétiques ou dermatologiques.
Un autre objet de l'invention concerne les compositions cosmétiques ou
dermatologiques
contenant ces dérivés amino-alcools à fonction urée.
Un autre objet de l'invention concerne donc l'utilisation de ces dérivés amino-
alcools à
fonction urée comme agents hydratants, dans et pour la préparation de
compositions
pour le soin de la peau.
Un autre objet de l'invention concerne donc l'utilisation de ces dérivés amino-
alcools à
fonction urée, comme agents de conditionnement des cheveux dans et pour la
préparation de compositions capillaires.
D'autres objets apparaîtront à la lumière de la description et des exemples
qui suivent.
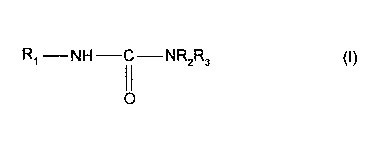
Les dérivés amino-alcools à fonction urée conformes à l'invention répondent à
la formule
générale (I) suivante:
R~ -NH-C-NR2R3 CI)
O
dans laquelle
R, représente un radical alcoyle, linéaire ou ramifié, saturé ou insaturé
ayant de 8 à 22
atomes carbone ;
2
CA 02209432 1997-06-30
- RZ représente un atome d'hydrogène ou un radical alcoyle saturé, linéaire ou
ramifié
ayant de 1 à 6 atomes de carbone ; _
- R3 représente un groupement alcoyle saturé, monohydroxylé ou polyhydroxylé,
linéaire
ou ramifié ayant de 1 à 10 atomes carbone.
De préférence, R, représente un radical alcoyle, saturé ou insaturé, linéaire
ou ramifié,
en C,o-C,B.
De préférence, RZ représente un hydrogène ou le groupe méthyle.
De préférence, R3 représente un radical
- (CH2)n (CHOH)m Z
dans lequel n représente un nombre entier égal à 0 ou 1, m représente un
nombre entier
compris entre 0 et 5, et Z est un radical alcoyle monohydroxylé ou
polyhydroxylé ayant
de 1 à 4 atomes de carbone. En particulier, Z est choisi parmi le groupe
comprenant les
radicaux suivants
-CH20H -CH2-CHZOH -CH(CHZOH)2
-C(CH20H)3 - i (CH20H)2 - i H-CH20H
CH3 CH3
i Hs
- i -CH20H
CH3
Les radicaux R3 plus préférentiels sont choisis dans le groupe constitué par
-CHZ-CHOH-CHZOH -CHZ-(CHOH)4CHZOH
-C-(CH20H)3 -C-(CHzOH)2
CH3
Parmi les composés préférés correspondant à la formule générale (I), on peut
notamment citer
- la N-dodécylaminocarbonyl-N-méthyl-D-glucamine ;
- la N-octylaminocarbonyl-N-méthyl-D-glucamine ;
3
CA 02209432 1997-06-30
- la 1-dodécyl-3-(2-hydroxy-1,1-bis-hydroxyméthyl-éthyl)urée ;
- la N-dodécylaminocarbonyl-D-glucamine ;
- la 1-(2,3-dihydroxypropyl)-3-dodécyl-urée ;
- la 1-dodécyl-3-(2-hydroxy-1-hydroxyméthyl-1-méthyl-éthyl)-urée ;
- la 1-(2-éthylhexyl)-3-(2-hydroxy-1,1-bis-hydroxyméthyl-éthyl)urée ;
- la N-(4Z)-octadéc-9-ènyl-aminocarbonyl-N-méthyl-D-glucamine.
Ces composés peuvent être obtenus par réaction, dans un solvant de préférence
polaire,
d'un aminoalcool de formule RZ-NH-R3 dans laquelle Rz et R3 ont les mêmes
significations que celles indiquées précédemment avec un composé imidazolo
alkyl
carboxamide de formule (II)
O
R-NH C N~N (II)
U
La réaction est généralement effectuée en atmosphère inerte en présence d'un
solvant
tel que le méthanol, à la température correspondant au reflux du solvant, de
préférence
entre 40 et 50°C.
Les composés imidazolo alkyl carboxamide de formule (II) sont obtenus selon
des
méthodes de synthèse connues, notamment dans la référence suivante :
Angewandte
Chemie, International Edition, Vol 1, n°7, 1962.
Les compositions cosmétiques ou dermatologiques selon l'invention sont
caractérisées
par le fait qu'elles contiennent dans un véhicule cosmétiquement ou
dermatologiquement
acceptable au moins un composé de formule (I) tel que défini ci-dessus à
l'exception du
composé N-méthyl-N-(2,3,4,5,6-penta-hydroxy-n-hexyl)-N'-n-octyl-urée.
Les compositions cosmétiques ou dermatologiques selon l'invention comprend de
préférence 0,001 à 15% en poids de composé de formule (I) par rapport au poids
total de
la composition.
Le véhicule cosmétiquement acceptable utilisé dans les compositions de
l'invention est
choisi parmi l'eau; les solvants organiques compatibles avec une application
cutanée ou
capillaire tels que l'acétone, l'isopropanol, l'éthanol; les triglycérides
d'acides gras à 6-24
4
CA 02209432 2001-09-11
atomes de carbone, les éthers de glycol, les esters de polyalkylèneglycols et
les silicones
volatiles ou leurs mélanges.
Les compositions peuvent se présenter sous forme de lotion aqueuse ou
hydroalcoolique, monophasique ou polyphasique, de gel monophasique ou
polyphasique, d'émulsion, de crème, de dispersion vésiculaire de lipides
ioniques ou non
ioniques, lesdites vésicules pouvant alors servir en tant qu'agent
d'encapsulation pour
des ingrédients actifs lipophiles ou hydrophiles, de mousse, de spray.
Les compositions pour le soin de la peau selon l'invention peuvent se
présenter sous
forme de lotion, de gel, d'émulsion, de crème ou de mousse à appliquer sur la
peau.
Les compositions capillaires peuvent se présenter sous forme de shampooing,
d'après-
shampooing à rincer ou non, de compositions pour permanente, défrisage,
coloration ou
décoloration, ou encore sous forme de compositions à rincer, à appliquer avant
ou après
une coloration, une permanente ou un défrisage ou encore entre les deux étapes
d'une
permanente ou d'un défrisage.
Les compositions cosmétiques ou dermatologiques peuvent par ailleurs contenir
des
additifs cosmétiques conventionnels choisis parmi les corps gras, les solvants
organiques, les silicones, les épaississants, les adoucissants, les tensio-
actifs, les
polymères anioniques, cationiques, non-ioniques ou amphotères, les agents anti-
mousses, les agents conditionneurs du cheveu tels que des protéines, des
vitamines, les
agents traitants (agents anti-chute, antipelliculaires), les colorants, les
parfums, les
conservateurs, les agents propulseurs.
Plus précisément, comme corps gras, on peut utiliser une huile ou une cire ou
leur
mélange, des acides gras, des alcools gras, des esters d'acides gras tels que
les
triglycérides d'acide gras en C6 à C~ g, de la Vaseline de la paraffine, de la
lanoline, de
la lanoline hydrogénée ou acétylée.
Parmi les huiles, on peut citer les huiles minérales, animales, végétales ou
les huiles de
synthèse, et notamment l'huile de Vaseline*de paraffine, de ricin, de jojoba,
de sésame,
ainsi que les huiles et les gommes de silicone et les isoparaffines.
* ( marques de commerce )
5
CA 02209432 1997-06-30
Parmi les cires, on peut citer les cires animales, végétales, minérales ou de
synthèse, et
notamment les cires d'abeilles, de Candelila, les ozokérites, les cires
microcristallines
ainsi que les cires et résines de silicone.
Parmi les solvants organiques usuellement utilisés dans les compositions
cosmétiques,
on peut citer plus précisément les mono-alcools ou polyalcools inférieurs en
C1 à Cg
comme féthanol, l'isopropanol, l'éthylèneglycol, le diéthylènegycol, le
propylèneglycol, le
glycérol.
Les agents épaississants peuvent être choisis notamment parmi l'alginate de
sodium, la
gomme arabique, les dérivés cellulosiques tels que la méthylcellulose,
l'hydroxy
méthylcellulose, l'hydroxyéthylcellulose, l'hydroxypropylcellulose,
l'hydroxypropylméthyl
cellulose, la gomme de guar ou ses dérivés, la gomme de xanthane, les
scléroglucanes,
les acides polyacryliques réticulés.
Comme agents tensio-actifs et comme polymères , on peut utiliser tous ceux
bien
connus de l'état de la technique notamment pour leur utilisation dans des
compositions
capillaires.
Les compositions peuvent se présenter sous forme de dispersion vésiculaire de
lipides
amphiphiles ioniques ou non-ioniques. Elles sont préparées notamment en
faisant
gonfler les lipides dans une solution aqueuse pour former des sphérules
dispersées dans
le milieu aqueux comme décrit dans STANDISH & WATKINS, J. Mol. Biol., 13,238
(1965) ou dans les brevets FR-A-2.315.991 et FR-A-2.416.008 de la
demanderesse. Les
différents types de procédés de préparation sont décrits dans "Les liposomes
en biologie
cellulaire et pharmacologie", Edition INSERM/John Libery Eurotext, 1987, pages
6 à 18.
Le pH des compositions selon l'invention est généralement compris entre 4 et 8
et de
préférence entre 5 et 7.
On va maintenant donner à titre d'illustration et sans aucun caractère
limitatif plusieurs
exemples de préparation de composés selon l'invention ainsi que des exemples
de
compositions cosmétiques les contenant.
6
CA 02209432 1997-06-30
Exemple 1 Synthèse de la N-dodécylaminocarbonyl-N-méthyl-D- glucamine
Première étape
Synthèse du 1-N-dodécylaminocarbonyl-imidazole de formule (II)
(R, = C,z Hzs)
Dans un réacteur, on dissout 49 g de N,N'-carbonyldümidazole 700 cm3 de
diméthylformamide anhydre et on maintient sous atmosphère inerte. On ajoute,
de
manière à maintenir la température à une valeur inférieure à 30°C, 55g
de laurylamine.
On maintient sous agitation à température ambiante pendant 8 heures. On verse
le
mélange réactionnel résultant sur 2 litres d'eau et on filtre le précipité
obtenu. Après
séchage, on obtient 75 g (rendement 90 %) de 1-N-dodécylaminocarbonyl-
imidazole
sous forme de poudre blanche.
Deuxième étape
Synthèse de la N-dodécylaminocarbonyl-N-méthyl-D-glucamine de
formule (I) (R, = C,z Hzs , Rz = CH,, , R3 = -CHz-(CHOH)4-CH20H)
On met en suspension, sous atmosphère inerte, 42g de 1-N-dodécylaminocarbonyl-
imidazole et 32 g de N-méthyl-D-glucamine dans 400 cm3 de méthanol. On
maintient le
mélange réactionnel au reflux sous agitation pendant 4 heures. On refroidit
par un bain
de glace puis on filtre le précipité. On le lave par 500 cm3 d'eau puis on le
sèche.
On obtient 49g (rendement 80 %) de N-dodécylaminocarbonyl-N-méthyl-D-glucamine
sous forme de poudre blanche.
Analyse élémentaire
C H N O
Calcule 59,09 10,41 6,89 23,61
(%)
Trouve (%) 58,83 10,45 6,96 23,37
Spectre RMN 1 H 200 MHz conforme
Point de fusion : 116,8°C (FP 89)
7
CA 02209432 1997-06-30
Exemple 2 : Synthèse de la 1-dodécyl-3-(2-hydroxy-1,1-bis-
hydroxyméthyléthyl)urée de formule (I)
(R, = C,z Hzs~ Rz = H~ Rs =_ -C-(CHZOH)s )
On procède selon le même procédé décrit dans l'exemple 1 à partir de 5,2 g de
trihydroxyméthylaminométhane de formule RZ=NH-R3 correspondant où Rz désigne H
et
R3 désigne -C-(CHZOH)3 et 8 g de 1-N-dodécylaminocarbonyl-imidazole de formule
(II)
correspondant où R, désigne C,Z H25 dans 100 cm3 de méthanol.
Analyse élémentaire
C ~H N O
Calcule 61,41 10,91 8,43 19,25
(%)
Trouve (%) 61,40 11,08 8,29 19,12
Spectre RMN 1 H 200 MHz conforme
Point de fusion : 132,4°C (FP 89)
Exemple 3 : Synthèse de la N-dodécylaminocarbonyl- D- glucamine de
formule (I) (R, = C,Z H25 , RZ = H, R3 = -CHz-(CHOH)4-CHZOH)
On procède selon le même procédé décrit dans l'exemple 1 à partir de 6,1 g de
D-
glucamine de formule Rz-NH-R3 correspondant où RZ désigne H et R3 désigne
-CHZ-(CHOH)4 CHzOH) et 7g de 1-N-dodécylaminocarbonyl-imidazole de formule
(II)
correspondant où R, désigne C,Z HZS dans 100 cm3 de méthanol.
Analyse élémentaire
C H N O
Calcule 58,14 10,27 7,14 24,46
(%)
Trouve (%) 58,09 10,21 7,18 24,73
Spectre RMN 1 H 200 MHz conforme
8
CA 02209432 1997-06-30
Point de fusion : 161,5°C (FP 89)
Exemple 4 : Synthèse de la 1-(2,3-dihydroxypropyl)-3-dodécyl-urée de
formule (I)
(R, = C,z Hzs , Rz = H, R3 = _CHz _CHOH-CHZOH )
On procède selon le même procédé décrit dans l'exemple 1 à partir 2,3 g de 3-
amino
1,2-propanediol de formule R2 NH-R3 correspondant où Rz désigne H et R3
désigne
-CHz-CHOH-CHZOH et de 7 g de1-N-dodécyaminocarbonyl-imidazole de formule (II)
correspondant où R, désigne C,z Hz5 dans 100 cm' de méthanol.
Analyse élémentaire
C H N O
Calcule 63,54 11,33 9,26 15,87
(%)
Trouve (%) 63,51 11,45 9,14 16,09
Spectre RMN 1 H 200 MHz conforme
Point de fusion : 121,5°C (FP 89)
Exemple 5 : Synthèse de la 1-dodécyl-(2-hydroxy-1-hydroxyméthyl-1-méthyl-
éthyl)-urée de formule (I)
(R, = C~z Hzs ~ Rz = H~ R3 =_ -C-(CHZOH)z )
CH,
On procède selon le mëme procédé décrit dans l'exemple 1 à partir de 3,5 g de
2-amino-
2-méthyl-1,3-propanediol de formule RZ NH-R3 correspondant où Rz désigne H et
R3
désigne
-C-(CHZOH)z
CH3
et de 7 g de1-N-dodécylaminocarbonyl-imidazole de formule (II) correspondant
où R,
désigne C,z Hz5 dans 100 cm3 de méthanol.
9
CA 02209432 1997-06-30
Analyse élémentaire
C H N O
Calcule 64,52 11,47 8,85 15,17
(%)
Trouve 64,52 11,43 8,84 15,00
(%)
Spectre RMN 1 H 200 MHz conforme
Point de fusion : 60,1 °C (FP 89)
Exemple 6 : Synthèse de la 1-(2-éthylhexyl)-3-(2-hydroxy-1,1-bis-
hydroxyméthyl éthyl)urée de formule (Ij
(R, = C4 H~ -CH-(CZ H5 )-CHZ ), Rz = H, Rs =- -C-(CHZOH)3 )
On procède selon le même procédé décrit dans l'exemple 1 à partir de 14 g de
trihydroxy
méthylaminométhane de formule RZ NH-R3 correspondant où Rz désigne H et R3
désigne
-C-(CHZOH)3 et de 25 g de1-N-2-éthyl-hexylaminocarbonyl-imidazole de formule
(II)
correspondant où R, désigne C4 H,-CH-(CZ HS)-CHZ dans 200 cm3 de méthanol.
Analyse élémentaire
C H N O
Calcule 56,50 10,21 10,14 23,16
(%)
Trouve 56,56 10,35 10,23 23,38
(%)
Spectre RMN 1 H 200 Mhz conforme
Point de fusion : 155,8°C (FP 89)
Exemple 7 : Synthèse de la N-(4Z)-octadéc-9-ènyl-aminocarbonyl-N-méthyl-D-
glucamine, de formule (I)
(R, = Ce H,~--CH=CH-C8 H,B , R2 = CH3, , R3 = -CHZ-(CHOH)4 -CHZOH)
On procède selon le même procédé décrit dans l'exemple 1 à partir de N-méthyl-
D-
glucamine de formule R2-NH-R3 correspondant où RZ désigne CH3 et R3 désigne -
CH2-
CA 02209432 1997-06-30
(CHOH)4 CHZOH et 48 g 1-N-octadéc-9-ènyl-aminocarbonyl-imidazole de formule
(II)
correspondant où R, désigne Ce H"-CH=CH-C8 H,6 dans 300 cm3 de méthanol.
Analyse élémentaire
C H N O
Calcule 63,90 10,72 5,73 19,64
(%)
Trouve 64,07 10,75 5,85 19,90
(%)
Spectre RMN 1 H 200 MHz conforme
Point de fusion : 116,2°C (FP 89)
Exemple 8 : Synthèse de la N-octylaminocarbonyl-N-méthyl-D-glucamine de
formule (I)
(R, = C8 H" , RZ = CH3, , R, _ -CHZ-(CHOH)4 -CHZOH)
1 Synthèse du -N-oct~rlaminocarbonyrl-imidazole
On dissout 80 g de N,N'-carbonyldümidazole dans 900 cm3 de diméthylformamide
anhydre et on maintient sous atmosphère inerte. On ajoute 63 g d'octyl en
maintenant la
température en dessous de 30°C. On maintient sous agitation à
température ambiante
pendant 4 heures. On verse sur 3 litres pour extraire par 4 fois 400 cm3
d'acétate
d'éthyle. On sèche, on filtre et on évapore jusqu'à obtenir 84 g de produit
sous forme
d'une huile pâteuse (Rendement : 86%). Le Spectre RMN 1 H 200 MHz est
conforme.
2 Synthèse de la N-octylaminocarbonyrl-N-méthyl-D-glucamine
On met en suspension, sous atmosphère inerte, 47g de 1-N-octylaminocarbonyl-
imidazole et 42 g de N-méthyl-D-glucamine dans 300 cm3 de méthanol. On
maintient le
mélange réactionnel au reflux sous agitation pendant 3 heures. On refroidit
par un bain
de glace puis on filtre le précipité. On le recristallise dans 300 cm3
d'éthanol.
On obtient 40g (rendement 55 %) de N-octylaminocarbonyl-N-méthyl-D-glucamine
sous
forme de poudre blanche.
11
CA 02209432 1997-06-30
Spectre RMN 1 H 200 MHz conforme
Spectre de masse conforme
Point de fusion : 111,4°C (FP 89)
Analyse élémentaire
C H N O
Calcule 54,84 9,78 . 7,99 27,39
(%)
Trouve (%) 53,58 9,71 8,25 28,34
Exemple 9 : Exemple comparatif
Mesure de la perte insensible en eau (PIE)
Cette mesure s'effectue à l'aide d'un évaporimètre (Servomed) qui détermine
quantita-
tivement l'évaporation d'eau, c'est-à-dire un transport d'eau par diffusion, à
partir d'un
échantillon de Stratum Corneum obturant une capsule cylindrique contenant de
l'eau, le
tout étant placé dans une chambre à température et humidité relatives
contrôlées.
Des capteurs permettent de mesurer la pression partielle de vapeur d'eau en
deux points
situés à des distances différentes de l'échantillon.
On détermine ainsi le gradient de pression partielle de vapeur d'eau entre les
deux
points, et donc le taux d'évaporation conformément à la loi de Fick.
Cette mesure est effectuée pour
a) la N-dodécylaminocarbonyl-N-méthyl-D-glucamine (composé de l'exemple 1 ) ;
b) la N-dodécanoyl-N-méthyl-D-glucamine, homologue amide du composé de
l'exemple
1, connu pour être un agent hydratant que l'on nommera reférence A ;
c) la N-dodécyloxycarbonyl-N-méthyl-D-glucamine, homologue carbamate du
composé
de l'exemple 1, connu pour être un agent hydratant pue l'on nommera reférence
B.
12
CA 02209432 2001-09-11
Les composés sont préparés à raison de 1 % dans un mélange de
dichlorométhane/méthanol (2/1 v/v), puis appliqués sur des morceaux de Stratum
Corneum délipidé.
On mesure, 20 heures après (application, la perte insensible en eau (PIE) pour
chaque
composé.
On obtient les résultats suivants
Compos exemple rfrence rfrence
1 A B
P.I.E. -21 +/-2 -11 +/-3 -9 +/-2
On constate donc que l'application du composé selon l'invention permet de
réduire de
façon plus importante l'évaporation de l'eau contenue dans le Stratum Corneum
par
rapport à ses homologues amide et carbamate.
Exemple 10 : Crème après-shampooing
- N-dodécylaminocarbonyl-N-méthyl-D-glucamine 2 g MA
- Chlorure de distéaryldiméthylamrnonium 2 g
- Hydroxyéthylcellulose vendu sous le nom de
NATROSOL 250 HHR par AQUALON 1 g
- Conservateur, parfum, colorant qs
qsp 100 g
- Eau
pH ajusté à 6 par NaOH
On obtient une crème fluide laiteuse qui après application confère aux cheveux
un
toucher doux et un démêlage facile.
Exemple 11 : Crème de jour pour le visage
On prépare la composition suivante:
alcool cétylique 2,5%
* (marque de commerce)
13
CA 02209432 2001-09-11
tristarate de sorbitan 0,9%
starate de polyoxyde d'thylne (polyoxythyln 40 2%
fois)
starate de glycryle 3%
myristate de myristyle 2%
polyisobutne hydrogn 2,5%
palmitate d'octyle 4%
polydimthylsiloxane (10 cmZ.s) 5%
huile de noyaux d'abricot 5,715%
N-dodcylaminocarbonyl-N-mthyl-D-glucamine 0,5%
. conservateurs 0,5%
eau qsp 100%
On obtient une crème de jour se présentant sous forme d'une émulsion
permettant de
bien couvrir et protéger la peau, particulièrement adaptée pour les peaux
normales et
sèches.
Exemple 12 : Crème de nuit
On prpare la formulation suivante:
. mlange de mono- et di-starate de glycryle
et de starate de polyoxyde
d'thylne 2%
. N-dodcylaminocarbonyl-N-mthyl-D-glucamine 3%
huile de noyaux d'abricot 17%
cyclopentadimthylsiloxane 1,5%
Carbomer (vendu sous la marque CARBOPOL) 0,75%
conservateurs 0,5%
trithanolamine 0,75%
eau qsp 100%
On obtient une crème de nuit, se présentant sous forme d'une émulsion épaisse,
brillante
et très douce à appliquer, qui se révèle nourrissante et hydratante pour la
peau,
particulièrement pour les peaux sèches.
* (marque de commerce)
14