Note: Descriptions are shown in the official language in which they were submitted.
CA 02219571 1997-10-16
WO 96/33999 PCTIFR96/00629
-1-
NOUVELLES TETRAHYDROPYRANO[3,2-d]OXAZOLONES SUBSTITUEES,
LEUR PROCEDE DE PREPARATION ET LES COMPOSITIONS
PHARMACEUTIQUES QUI LES CONTIENNENT
La présente invention conceme de nouveaux composés possédant une structure
tétrahydropyrano[3,2-d]oxazolone, leur procédé de préparation et les
compositions
pharmaceutiques qui les contiennent. Les composés de la présente invention
trouvent une utilisation thérapeutique tout à fait intéressante grâce à leur
pouvoir
s inhibiteur d'angiogenèse.
L'angiogenèse (ou néovascularisation) est définie comme le développement et la
croissance de nouveaux vaisseaux sanguins capillaires. Le processus
d'angiogenèse est essentiel dans de nombreuses situations physiologiques dont
le
développement de l'embryon, la cicatrisation normale de blessures et le
io développement de l'endometrium après menstruation. En dehors de ces
situations,
l'angiogenèse chez l'adulte normal est très rare et la mitose des cellules
endothéliales qui génère les parois des vaisseaux sanguins est très lente,
avec des
temps de renouvellement cellulaire mesurés en années.
Une angiogenèse anormale (c'est-à-dire la stimulation de la croissance de
nouveaux
15 vaisseaux sanguins due à un syndrome pathologique) est une caractéristique
établie
pour de nombreuses maladies, notamment la rétinopathie diabétique, l'arthrite
rhumatoide, les hémangiomes et la croissance de tumeurs solides. L'angiogenèse
peut également jouer un rôle important dans d'autres maladies comme la maladie
artério-coronaire.
20 Dans le domaine de l'oncologie, il a été montré que la croissance de
tumeurs solides
est tout à fait dépendante du développement constant de nouveaux vaisseaux
FEUtLLE DE REMPLACEMENT (RCGLE 261
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96100629
-2-
sanguins et qu'il est corrélé, pour les métastases de certains cancers, avec
la taille
croissante de la tumeur primaire. (J. Folkman, New Engl. Med., 285 (1974),
1182-
1185).
Un traitement pharmaceutique (c'est-à-dire à l'aide d'un inhibiteur
d'angiogenèse)
peut donc stopper la croissance de tumeurs primaires, empêcher ou réduire la =
formation de métastases, empêcher l'apparition de tumeurs secondaires. De tels
inhibiteurs d'angiogenèse sont également utiles dans le traitement de maladies
non-
néoplasiques mentionnées précédemment dans lesquelles apparaît une activité
angiogénique.
Les besoins de la thérapeutique exigent le développement constant de nouveaux
composés inhibiteurs d'angiogenèse dans le but d'obtenir des principes actifs
à la
fois plus actifs, plus spécifiques et moins toxiques.
L'art antérieur de la présente invention est notamment illustré par le brevet
US-A-
3,631,175 qui décrit des dérivés de pyrano[3,2-d]oxazole possédant des
propriétés
fongicides. Des composés à activité anti-angiogénique sont connus (EP-A-357
061,
EP-A-354 787, EP-A-354 767) mais possèdent des structures de type fumagilloi.
La présente invention conceme de nouveaux composés possédant une structure
= tétrahydropyrano[3,2-d]oxazolone et présentant une originalité structurale
et
pharmacologique par rapport aux composés décrits dans l'art antérieur.
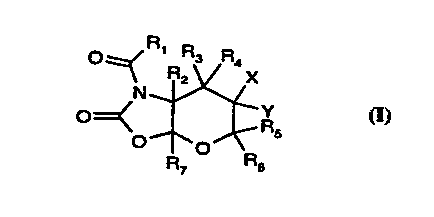
Plus particulièrement, la présente invention a pour objet les composés de
formule
générale (I) :
Oz:=/ R Ra R4
\ R2 x
N
O=< Y
O R5 (~)
7 RB
dans laquelle :
= R, est choisi parmi le radical R et le radical -NH-CO-R,
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-3-
= R est choisi parmi le radical amino, un radical alkylamino, dialkylamino,
alkyle,
alkényle, alkoxy, aryle, arylalkyle, hétéroaryle, hétéroarylalkyle, aryloxy et
hétéroaryloxy,
= R2 est choisi parmi l'hydrogène et un radical alkyle,
s = R3 est choisi parmi l'hydrogène, un radical alkyle, le radical hydroxy, un
radical
alkoxy, un radical aryle, un radical arylalkyle, un radical -(CH2)n-OR8, et un
radical
-(CH2)n-NR8R9,
= R4 représente l'hydrogène ou bien forme une liaison avec Y,
= RS est choisi parmi l'hydrogène, un radical alkyle, un radical aryle, un
radical
arylalkyle, un radical hétéroaryle et un radical hétéroarylaikyle ou bien
forme avec Y
une liaison,
= R6 est choisi parmi l'hydrogène, un radical alkyle, un radical alkylépoxy,
un radical
arylalkyle, un radical arylalkylépoxy, un radical alkényle, un radical
alkynyle, un
radical alkoxycarbonyle, un radical carboxy, un radical aryle et un radical
hétéroaryle,
= R7 est choisi parmi l'hydrogène, un radical alkyle, un radical arylalkyle,
un radical
-(CH2)õ-ORBi un radical -(CH2)n-O-CO-Ra et un radical -(CH2)n-NRSRy,
= R8 et Rg, identiques ou différents, sont choisis, indépendamment l'un de
l'autre,
parmi l'hydrogène, un radical alkyle, un radical aryle et un radical
arylalkyle,
= n prend une valeur choisie parmi 1, 2, 3 et 4,
= X et Y sont tels que :
= X est choisi parmi l'hydrogène, le radical hydroxy, un radical alkoxy, le
radical amino, un radical alkylamino, dialkylamino, le radical -O-CO-R', et le
radical -NH-CO-R'l, où R', a la même définition que R, défini précédemment
et Y représente l'hydrogène,
FEUILLE DE REMPLACEMENT (RE6LE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96100629
-4-
ou bien,
= X représente l'hydrogène et Y forme avec R4 ou R5 une liaison,
ou bien, -
= X et Y forment ensemble un groupement méthylène, un groupement
=CH-alkyle, un groupement =CH-aryle ou un groupement =CH-arylalkyle,
ou bien, =
= X et Y forment ensemble un groupement oxo,
ou bien,
= X et Y forment ensemble un cycle oxirane, avec l'atome de carbone qui les
porte,
ou bien,
= X et Y forment ensemble le radical hydroxy-imino ou un radical =N-O-CO-R'l,
où R', a la même définition que Ri précédemment défini,
ou bien,
= X est choisi parmi un radical alkyle, un radical arylalkyle et un radical
R~
-cH2 S` , et Y est choisi parmi l'hydrogène, le groupement hydroxy et le
Rb
radical O-CO-NH-CO-R' où R' a la même définition que R précédemment
défini, ou forme avec R4 ou R5 une liaison,
= R. et Rb identiques ou différents, sont choisis, indépendamment l'un de
l'autre,
parmi un radical alkyle, un radical aryle, un radical arylaikyle, un radical
hétéroaryle
et un radical hétéroarylaikyle, ou bien forment ensemble avec l'atome de
soufre qui
les porte un radical éventuellement substitué, choisi parmi thiényle, 1.3-
dihydrobenzo[c]thién-2-yle, 2,3-dihydrobenzo[b]thién-1-yie,
perhydrobenzo[c]thién-2-
yie et perhydrothiényle,
étant entendu que :
- le terme "alkyl" compris dans les radicaux alkyle, alkylamino, diaikylamino,
arylalkyle, arylaikylépoxy, hétéroarylaikyle et alkylépoxy désigne un radical
dont la chaîne hydrocarbonnée saturée contient de 1 à 10 atomes de
carbone, en chaîne droite ou ramifiée, et est éventuellement substituée,
FEUILLE DE REARpLACEMENT (F.ECLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/PTt96/00629
-5-
- le terme "alkényle" désigne un radical contenant de 2 à 10 atomes de carbone
en chaîne droite ou ramifiée, éventuellement substituée, et comportant une
insaturation sous forme de double liaison,
- le terme "alkynyle" désigne un radical contenant de 2 à 10 atomes de carbone
en chaîne droite ou ramifiée, éventueilment substituée, et comportant une
insaturation sous forme de triple liaison,
- le terme "alkoxy" compris dans les radicaux alkoxy et alkoxycarbonyle
désigne
un radical dont la chaîne hydrocarbonnée saturée contient de 1 à 10 atomes
de carbone, en chaîne droite ou ramifiée, et est éventuellement substituée,
- le terme "aryl" compris dans les radicaux aryle, arylaikyle, aryloxy,
arylaikylépoxy désigne un radical éventuellement substitué, choisi parmi
phényle et naphtyle,
- le terme "hétéroaryl" compris dans les radicaux hétéroaryle, hétéroaryloxy
et
hétéroarylalkyle désigne un radical éventuellement substitué choisi parmi
furyle, thiényle, thiazolyle, imidazolyle, thiadiazolyle, tétrazolyle,
pyridyle,
quinolyle, isoquinolyle, indolyle et isoindolyle,
et que
- le terme "éventuellement substitué" signifie que les radicaux ainsi
qualifiés
peuvent éventuellement être substitués par une ou plusieurs entités
chimiques choisies parmi :
- hydroxy,
- O-CO-R',, où R', a la même définition que Ri précédemment défini,
- alkoxy,
- alkyle, alkényle, alkynyfe,
- époxy,
- alkylthio,
- halogène, choisi parmi fluor, chlore, brome et iode,
FEUILLE DE REMPLACEMENT (REG:-E 25)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-6-
- trihalogénométhyle,
- nitro, amino, alkylamino et dialkylamino,
- carboxy,
- alkoxycarbonyle,
- alkylcarbonyle,
- alkoxycarbonylaikyle,
- carboxyalkyle,
- aryle, et
- hétéroaryle,
leurs éventuels isomères géométriques et isomères optiques, sous forme pure ou
sous forme de mélange, leurs éventuels sels d'addition à un acide,
pharmaceutiquement acceptables, ainsi que leurs éventuels S-oxydes, N-oxydes
ou
sels d'ammonium quatemaire.
La présente invention s'étend également au procédé de préparation des composés
de formule (1) caractérisé en ce que le furyllithium de formule (11) est
traité par le
composé de formule (I11) :
R2 R3
(11) RYR6 (I11)
R7 O Li O
où R2, R3, R5, R6 et R, sont tels que définis précédemment,
en solvant polaire aprotique, le tétrahydrofurane par exemple, à température
appropriée, choisie dans une gamme allant de -100 C à 30 C, préférentiellement
à
-78 C, afin de conduire au furylcarbinol de formule (IV) :
RZ R
Rs (IV)
R7 O Re
OH
dans laquelle R2, R3, R5, R6 et R7 sont tels que définis précédemment, qui,
soumis à oxydation, par exemple dans le chlorochromate de pyridinium, le N-
2s bromosuccinimide, ou l'hydropéroxyde de tertiobutyle, en présence d'un
acide, tel
que l'acide camphorsulfonique ou l'acide métachloroperbenzoïque, dans un
solvant
FEUiLLE DE REMPLACEMENT (R;L'GLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCTIFR96/00629
-7-
approprié, tel que le dichlorométhane ou le tétrahydrofurane, à une
température
comprise entre O C et 22 C, est réarrangé en pyranone de formule (V) :
R3
RZ / O
HO R5 (V)
R O Rs
7
dans laquelle R2, R3, R5, R6 et R7 sont tels que définis précédemment,
pyranone de formule (V) qui est soumise à l'action d'isocyanate de 2-
chloroacétyle
afin d'obtenir la dihydropyrano[3,2-d]oxazole-2,6-dione de formule (la) :
CI
O R2 Rs
N O
O=< RS (1 )
O O Rs a
R~
dans laquelle R2, R3, R5, R6 et R7 sont tels que définis précédemment,
cas particulier des composés de formule (1) où Ri représente le radical -CH2-
CI, X et
Y forment ensemble le groupement oxo et R4 représente l'hydrogène,
composé de formule (la) qui peut être clivé, sous l'action d'un alcool, tel
que le
méthanol, ou d'une base faible, en composé de formule (VI) :
H R2 Ra
N O
O=< R5
0 (VI)
Rs
R7 où R2, R3, R5, R6 et R7sont tels que définis précédemment,
ls et que l'on soumet aux réactions présentées dans les schémas réactionnels
I, II et III
suivants :
- Schéma réactionnel t -
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96100629
-8-
N F
pY1 H % N O
O Rs O O~(
O %
R.i p ib) O R7 0 (VI)
z
~` CC~ i a H OH
N A'
Oxb) N % H (Q1) O % p
p~ ' ~----- N ~ R.i Rs
O
O
Fl, O O r
F:~ $ . $
= 4
= i
H Ra
4_ ~(IXa) N Rz ~ ? (~1~) IV An011b) N RZ % A
; 0~ Rs p~ p Rs O=<
O ~ R~ O ~
~ H ~ Ri
N ~ 4,'
N p,
4 O~ Alk
H p p Rs N Rz ~ A'
H
% N ~ O~ ~ ~Vi H R'
p~ ~ (Vlll) O ~ p ~ ,
\ O
Rs H % ~ ' p~0 O
A = alkyle, arylalkyle ~N A~
~4lk = alkyle O Rs (XV)
-- : lorsque F; = H O~ O ~
Les réactions présentées dans les schémas réactionnels (I), (11) et (III) ont
ainsi été
réalisées :
Réaction 1 : la réduction de la fonction cétone en alcool est réalisée en
solvant
approprié, le tétrahydrofurane par exemple, à basse température, de -78 C à 20
C,
l'agent réducteur étant choisi parmi les hydrures habituellement utilisés pour
ce type
de réduction. Un réducteur particulièrement adapté dans la présente réaction
est le
triéthylborohydrure de lithium.
Réaction 2 : L'éthérification de la fonction alcool est réalisée selon des
méthodes
classiques connues par l'homme du métier. A titre d'exemple, l'alcool, traité
par une =
base, telle que l'hydrure de sodium, est sousmis à l'action d'un halogénure
d'alkyle
FEUtLLE DE PEi:SPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96133999 PCT/FR96/00629
-9-
de formule Alk-X, où Alk représente une chaîne alkyle telle que définie
précédemment et X représente un atome d'halogène.
Réaction 3: La fonction alcool est soumise à deshydratation, selon des
techniques
classiques, par exemple par chauffage en présence d'acide
paratoluènesulfonique
dans le benzène.
Réaction 4: les réactions d'hydrogénation sont effectuées de manière classique
en
présence de quantités catalytiques de palladium, et d'hydrogène, à pression
atmosphérique ou sous pression faible, à température comprise entre 10 C et 80
C.
Les conditions opératoires préférées pour les hydrogénations catalytiques de
la
présente invention sont celles ou l'hydrogène est à pression atmosphérique, et
à
température ambiante, les réactions étant poursuivies jusqu'à disparition
totale du
composé à hydrogéner.
Réaction 5 : l'estérification de la fonction alcool est obtenue par action
d'un
halogénure de formule R'-CO-X où X représente un halogène et R' est tel que
défini
précédemment, sur l'alcoolate obtenu de manière classique à partir de l'alcool
que
l'on souhaite estérifier.
Réaction 6 : réaction réalisée dans les mêmes conditions opératoires que
celles
mises en oeuvre pour la réaction 5 décrite ci-dessus, en remplaçant
l'halogénure
R'-CO-X par l'isocyanate de formule R'-CO-NCO, où R' est tel que défini
précédemment.
Réaction 7: la fonction cétone est ici soumise à une attaque nucléophile dans
les conditions
connues par l'homme du métier, par exemple attaque par un alkyllithium ou par
un
arylalkyllithium, où les termes alkyl et arylaikyl sont tels que définis
précédemment.
- Schéma réactionnel II -
FEUILLE DE REMPLACEMENT (RCGLE 26)
CA 02219571 1997-10-16
WO 96133999 PCT/FR96/00629
-10- F.:6 ~k
N N~AIK
O==é\ R5
R3 $ O O R (XVIII)
N O H 3 ~k
RS $ N Rz N~H
O
R M) ~ p~ R5 (~')
p p ~
H
(XIx) N Rz ~ N- ~ H R3 H
O~ R5 N N-H Alk
O~ p Rs p==é\ R5 N Rz ~ NyR'
Ri O O~ R5 0
JS! ~) O O R7 O Rs
(~)
~].
O
N N~ ~R'' H
O R H 1 ~ AIk Alk = alkyle
~ 5 N Ny +
R7 p ~ ()Oq O==/\ R5 0
p p s
R7 R (XXU)
Réaction 8: la transformation de la fonction cétone en fonction amine est
obtenue par
traitement par l'acétate d'ammonium (pour l'obtention d'une amine primaire),
par une amine de
formule H2NAIk (pour obtenir une amine secondaire) ou par une amine de formule
HNAIkAIk
(pour obtenir une amine tertiaire), où Alk et Alk représente chacun une chaîne
alkyle telle que
définie précédemment. La réaction est réalisée en présence de cyanoborohydrure
de sodium,
en solvant polaire protique, en solvant alcoolique par exemple, dans le
méthanol ou l'éthanol.
Réaction 9 : la réaction avec le chlorhydrate d'hydroxylamine et l'acétate de
sodium
permet d'obtenir l'oxime attendue. Le milieu réactionnel est un milieu polaire
aprotique,
préférentiellement alcoolique, le méthanol ou l'éthanol par exemple. La
température
de réaction est choisie, en fonction du solvant utilisée, dans une plage
allant de 20 C
à 80 C, à 40 C par exemple dans le méthanol.
Réaction 10 : L'oxime (XIX) est traitée comme décrit dans les réactions 5 ou
6.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-11-
Réaction 11 : La fonction amine est traitée comme décrit dans les réactions 5
ou 6.
- Schéma réactionnel 111 -
N 3 O H F
O < Rs O=< N A
~s
(VI) ~ O R6 (XXIII) O ~ O
H Rs (XXV)
H R3
N CH, N 2
R
O
O==\ Rs ~~~-- O=='\', A alkyle, aryle, arylaikyle
O O ~ O O Rs ---- : lorsque R5 = H
(XXIV) R7 ~ R7 R6
14
3
H R. (XXVIIa)
b
(XxVI) N RZ OH Rb O~ H R3 S R
O~ N
tFl --~ R
O
R~ Rs O R~ O Re 4
R' '~
H H e 3 O _RaN
N kO Ro F3 O~ Rs O~ Rs (~~ N S% qi R6
O O O~ ~ Rb
R7 Fl, O O R. 4
R7
(XXVIIb)
Réaction 12 : Le composé de formule (VI) est engagé dans une réaction de
Wittig sous
l'action d'un composé de formule Ph3P=CH2, pour l'obtention du composé de
formule
(XXIV), ou sous l'action d'un composé de formule Ph3P=CH-A où A représente
alkyle,
aryle ou arylalkyle tels que définis précédemment. Cette réaction est réalisée
dans le
tétrahydrofurane à température comprise entre 60 C et 70 C, les ylures de
phosphonium
étant obtenus par action de tertiobutylate de potassium.
Réaction 13a : la fonction spiro-époxyde est obtenue par action de l'ylure de
dimethylsulfure sur le composé de l'exemple (VI).
Réaction 13b : la fonction spiro-époxyde est obtenue par action de l'acide
métachloroperbenzoique dans le dichlorométhane, à 0 C.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-12-
Réaction 14 : L'attaque de l'époxyde est effectué par un composé de formule
RaSNa, où R. est tel que défini précédemment, dans un solvant approprié, le
diméthylformamide par exemple. Une deuxième attaque est alors réalisée par un
halogénure de formule Rb-X où Rb est tel que défini précédemment et X
représente
un atome d'halogène, attaque réalisée en présence de bromure d'argent dans le
trichlorométhane. Dans le cas où Ra et Rb forment ensemble un cycle, la
réaction
Ra SNa
sera réalisée en une étape en utilisant un composé de formule c
Rti X
L'ensemble des composés de formule (VI) à (XXIX) formant le composé de formule
(Id) qui est finalement soumis à l'action d'un halogénure de formule R-CO-X,
où R est
tel que défini précédemment et X représente un atome d'halogène, dans les
conditions opératoires décrites pour la réaction 5 ci-dessus définie, ou bien
à l'action
d'un isocyanate de formule R-CO-NCO, où R est tel que défini précédemment,
dans
les conditions opératoires décrites pour la réaction 6 ci-dessus définie. Ces
réactions
sont explicitées par le schéma suivant :
O R2 R 3 r{4 X
N Y (Ib)
N R3R4 R-CO-X Rs
R2 X Y O R O R6 O
~ 7 H
O Rs R-CO-NCO % N R
O O R6 O~ R2 R3 R4
R7 (Id) ~ O N XR (IC)
s
O O Rs
7
où R, R2, R3, R4, R5, R6, R7, X et Y sont tels que définis précédemment,
l'ensemble des composés de formule (Ib) et (Ic) formant l'ensemble des
composés de
formule (I) que l'on purifie le cas échéant par une technique classique de
purification,
dont on sépare si on le souhaite les isomères géométriques et les isomères
optiques
par une technique classique de séparation que l'on transforme, le cas échéant,
en
leurs N-oxydes, S-oxydes, en leurs sels d'addition à un acide,
pharmaceutiquement
acceptables, ou en leurs sels d'ammonium quatemaire.
Les composés de la présente invention peuvent également être préparés à partir
d'un composé de formule (II') :
FEUILLE DE P.EMPLQCEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96100629
-13-
R2 3
R5
R7 O
O
où R2, R3, R5 et R7 sont tels que définis précédemment,
sur lequel on fait réagir un lithien de formule (III') :
R6-Li (III')
dans laquelle R6 est tel que défini précédemment,
dans les cond'dions opératoires déalles pour la réacbon du composé de formule
(II) avec le
composé de forrnule (III), de manièm à obtenir ie composé de forrnule (IV)
précédemment défini.
Les composés de formule (I) pour lequels R6 représente un radical alkyle,
alkényle,
alkynyle ou alkylépoxy pourront étre avantageusement obtenus selon le schéma
de
synthèse suivant :
R2 R3 R2 R3
Rs +
t3 - R's -- ~~ Rs
R7 O R7 O R
O pi..i s
H R2 Ra H RZ Ra t~~r O O ~
N hydrogenation N
O~ RS O~ Rg
O O O i) réarrangement oxydatif
R R ii) CI-CH2-CO-NCO
' R-e ' R. 6 iii) clivage
RZ R3
N O
O==<
O O R6
R7
où R2, R3, RS et R7 sont tels que définis précédemment et R's représente un
radical
alkyle ou un radical arylalkyle, la chaîne alkyle comportant de 1 à 8 atomes
de
carbone.
Les radicaux -CO-NH-CO-R et -CO-NH-CO-R', où R et R' sont tels que définis
précédemment, lorsqu'ils substituent les composés de formule (1) peuvent
avantageusement être clivés sélectivement en radicaux -CO-NH2. Cette réaction
de
clivage est réalisée préférentiellement sur colonne de silice, en
chromatographie
FEUlLLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-14-
liquide (HPLC), sur colonne RP1 8 par exemple, ou en conditions acides ou
basiques
contrôlées.
De manière générale, les séparations des éventuels isomères géométriques ou
optiques des composés obtenus à chacune des étapes des synthèses décrites ci-
dessus pourront être effectuées à tout moment jugé opportun par l'homme de
l'art.
De même, selon le degré de stabilité des substituants portés par les composés,
les
différentes réactions présentées ci-dessus pourront être effectuées dans un
ordre
différent de celui présenté dans la présente invention et jugé plus adapté par
l'homme du métier.
Les composés de formule (I) possèdent d'intéressantes propriétés
pharmacologiques. En effet, ces composés sont de puissants inhibiteurs
d'angiogenèse qui ont l'avantage de présenter, par rapport aux composés de
référence, une toxicité générale beaucoup moins importante. Ils présentent
donc un
index thérapeutique excellent. Ces composés trouvent ainsi une application en
thérapeutique en tant qu'agents anti-tumoraux, dans l'inhibition de la
formation et de
la croissance des métastases, ainsi que dans le traitement de la rétinopathie
diabétique, de l'arthrite rhumatoide, des hémangiomes et des maladies artério-
coronaires, et plus généralement dans les affections dues ou reliées aux
troubles de
l'angiogenèse.
La présente invention a également pour objet les compositions pharmaceutiques
contenant les composés de formule (I), leurs éventuels isomères optiques et/ou
géométriques ou leurs éventuels sels d'addition à un acide pharmaceutiquement
acceptables, seuls ou en combinaison avec un ou plusieurs excipients ou
véhicules
inertes et non toxiques.
Parmi les compositions pharmaceutiques selon l'invention, il sera cité plus
particulièrement celles qui conviennent pour l'administration orale,
parentérale,
nasale, rectale, perlinguale, transdermique, oculaire ou respiratoire, et
notamment
les comprimés simples ou dragéifiés, les comprimés sublinguaux, les gélules,
les
suppositoires, les crèmes, les pommades, les gels dermiques, les patches, les
préparations injectables ou buvables, les aérosols, les gouttes oculaires ou
nasales.
La posologie utile varie selon l'âge et le poids du patient, la voie
d'administration, la
nature de l'indication thérapeutique et des traitements éventuels associés et
s'échelonne entre 0,01 et 1 g par jour, en une ou plusieurs administrations.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/F'R96100629
-15-
Les exemples suivants illustrent l'invention mais ne la limitent en aucune
façon. Les
produits de départ sont connus ou préparés à partir de modes opératoires
connus.
EXEMPLE 1 : 1-Chloroacétyl-5-(hept-l-ynyl)-5-méthyl-dihydropyrano
[3,2-d]oxazole-2,6-dione
EtaQe A : 8-(2-furyl)non-6-yl-8-ol
A une solution contenant 14 ml (106,7 mmol) de 1-heptyne dans 150 ml de
diéthyléther refroidie à-78 C et sous atmosphère d'azote, sont ajoutés, goutte
à
goutte, 46,95 mi de n-butyllithium (2,5M) dans l'hexane. L'agitation est
maintenue
une heure à-78 C. 12,89 ml (106,7 mmol) de 2-acétylfurane dans 150 ml de
toluène
sont ensuite ajoutés. Le mélange est de nouveau agité pendant une heure à-78
C.
La solution est alors hydrolysée par une solution aqueuse saturée en chlorure
de
sodium puis extraite au pentane. Les phases organiques recueillies sont
séchées sur
sulfate de magnésium puis filtrées et concentrées. 22 g d'un liquide brun,
correspondant au produit attendu, sont obtenus et utilisés tels quels par la
suite.
Etape B : 2-(heptyn-1-yl)-2-méthyl-3-oxo-dihydro[2Hjpyran-6-ol
A une solution contenant 10 g (48,4 mmol) du composé obtenu à l'étape
précédente
dans 750 ml d'un mélange tétrahydrofurane/eau (2:1) refroidi à 0 C, sont
ajoutés
8,62 g (48,4 mmol) de N-bromosuccinimide. Le mélange est agité pendant une
heure à 0 C. Le milieu réactionnel est ensuite neutralisé par une solution
aqueuse
saturée en hydrogénocarbonate de sodium, puis extrait au pentane. Le
traitement
habituel des phases organiques foumit 11,63 g d'un liquide brun orangé
correspondant au produit attendu, utilisé tel quel par la suite.
Etape C : 1-chloroacétyl-5-(hept-1-ynyl)-5-méthyl-dihydro-pyrano
[3,2-d]oxazole-2,6-dione
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-16-
A 10 g (45 mmol) du composé obtenu à l'étape précédente, dans du
dichlorométhane, sous atmosphère inerte et à 0 C, sont ajoutés 10,75 g (7,6 ml
; 90
mmol) d'isocyanate de chloracétyle. Le milieu réactionnel est agité jusqu'à
disparition
du produit de départ (réaction suivie par chromatographie sur couche mince).
La
s solution est ensuite hydrolysée par une solution aqueuse saturée en chlorure
de
sodium puis extraite au dichlorométhane. Le traitement habituel de la phase
organique foumit, après purification par chromatographie sur colonne de silice
(éluant : heptane/acétate d'éthyle, 4:1), 4 g du composé attendu ainsi que 2,8
g des
deux diastéréoisomères A et B de la 5-(hept-1-yn-1-yl)-5-méthyl-dihydro-
pyrano[3,2-d]oxazole-2,6-dione, sous forme d'une huile brune qui cristallise
(Rf =
0,28, diastéréoisomère A; Rf = 0,16, diastéréoisomère B ; éluant :
diéthyléther/di-
chlorométhane, 2:1).
Analyse élémentaire :(formule brute : C16H2OCIN05 masse moléculaire : 341,79)
C H N CI
% trouvé 56,30 5,93 4,06 10,63
% calculé 56,23 5,90 4,10 10,37
EXEMPLE 2 : 1-Chloroacétyl-5-(hept-1-ényl)-5-méthyl-dihydropyrano
[3,2-d]oxazole-2,6-dione
2 g (115,9 mmol) du composé obtenu à l'exemple 1 sont dissous dans 100 ml de
benzène en présence de 1 g de catalyseur de Lindiar. Le mélange est agité en
présence d'hydrogène à pression atmosphérique jusqu'à disparition totale du
produit
de départ. Après filtration sur célite et concentration du filtrat sous
pression réduite, 2
g d'un solide blanc sont obtenus.
Analyse élémentaire :(formule brute : C16H22CINO5 masse moléculaire : 343,81)
C H N CI
% trouvé 56,16 6,51 3,88 11,10
% calculé 55,90 6,45 4,07 10,31
EXEMPLE 3: 1-Chloroacétyl-5-(3-pentyloxiran-2-yl)-5-méthyl-dihydro
pyrano [3,2-d]oxazole-2,6-dione
FEUILLE DE REMPLACEMENT (RE&4.E 26~
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96100629
-17-
60 mg (0,18 mmol) du composé obtenu à l'exemple 2 sont soumis à une réaction
d'oxydation en présence de 6 ml d'une solution d'acétone saturée en
diméthyldioxirane à 0 C. Le milieu réactionnel est agité pendant une heure à
cette
température. Le solvant est évaporé sous pression réduite et le résidu huileux
ainsi
obtenu, azéotropé avec du toluène. Après concentration sous pression réduite
et
séchage sous vide, le composé attendu est obtenu sous forme de Iyophilisat.
Analyse élémentaire :(formule brute : C16H22CINO6 masse moléculaire : 359,81)
C H N CI
% trouvé 53,49 6,19 3,74 9,77
% calculé 53,41 6,16 3,89 9,85
EXEMPLE 4: 6-[(1-Chloroacétyl-5-(3-pentyloxiran-2-yl)-5-méthyl-tétrahydro-
pyrano[3,2-d]oxazol-2-one]-spiro-2'-oxirane
(Isomère du composé de l'exemple 13)
Etape A : 5-(hept-1-ynyl)-5-méthyl-6-méthylène-dihydropyrano[3,2-d]
oxazol-2-one
A 10 g (28 mmol) de bromure de triphénylméthylphosphonium en suspension dans
40 ml de tétrahydrofurane, sont ajoutés 28 ml d'une solution de tertiobutylate
de
potassium (1 M) dans le tétrahydrofurane. Le milieu réactionnel est chauffé
pendant
une heure à 60-70 C. L'ensemble est ensuite refroidi à 0 C et 2,5 g (9,35
mmol) du
diastéréoisomère A de la 5-(hept-1-ynyl)-5-méthyl-dihydropyrano[3,2-d]oxazole-
2,6-
dione, obtenue à l'exemple 1, dilués dans 30 ml de tétrahydrofurane, sont
ajoutés.
Après agitation pendant deux heures à température ambiante, le milieu
réactionnel
est hydrolysé par une solution saturée en chlorure de sodium puis extrait à
l'éther. Le
traitement habituel de la phase organique foumit, après purification par
chromatographie sur gel de silice (éluant : heptane/acétate d'éthyle, 2:1),
2,08 g du
composé attendu.
Etape B : 6-[5-(hept-1 -ynyl)-5-méthyl-tétrahydropyrano[3,2-d]oxazol-2-
one]-spiro-2'-oxirane
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-18-
A une solution de 1,8 g (6,8 mmol) du composé obtenu à l'étape précédente dans
230 ml de dichlorométhane à 0 C, sont ajoutés 5 g (20,5 mmol) d'acide
métachloroperbenzoïque à 70 %. Après retour à température ambiante, le milieu
réactionnel est agité pendant 12 heures. Le solide formé est filtré et le
filtrat est lavé
avec une solution aqueuse saturée en hydrogénocarbonate de sodium puis avec
une solution aqueuse saturée en chlorure de sodium. Le traitement habituel de
la
phase organique foumit 5 g d'un solide blanc qui, purifiés par chromatographie
sur
gel de silice (éluant : heptane/acétate d'éthyle, 1:1), conduisent à 1,6 g du
composé
attendu.
Etape C : 6-[5-(hept-1-ényi)-5-méthyl-tétrahydropyrano[3,2-d]oxazol-2-
one]-spiro-2'-oxirane
670 mg (2,39 mmol) sont engagés dans la réaction d'hydrogénation décrite à
l'exemple 2 pour foumir 660 mg d'un solide blanc.
Etane D : 6-[5-(3-pentyloxiran-2-yl)-5-méthyl-tétrahydropyrano-
[3,2-d]oxazol-2-one]-spiro-2'-oxirane
660 mg (2,35 mmol) du composé obtenu à l'étape précédente sont oxydés dans les
conditions décrites à l'exemple 3 pour conduire à 650 mg du composé attendu
sous
forme d'une poudre blanche.
Etape E : 6-[1-chloroacétyl-5-(3-pentyloxiran-2-yl)-5-méthyl-tétrahydro-
pyrano[3,2-d]oxazol-2-one]-spiro-2'-oxirane
A 200 mg (0,71 mmol) de composé obtenu à l'étape précédente dans 5 ml de
tétrahydrofurane à-78 C, sont ajoutés 467 l (0,746 mmol) de n-butyllithium.
Après
une demi-heure d'agitation, 84 mg (0,746 mmol) de chlorure de 2-chloroacétyle
sont
ajoutés. Après 10 minutes d'agitation, le milieu réactionnel est hydrolysé par
une =
solution saturée de chlorure de sodium, puis extrait à l'éther diéthylique. Le
traitement habituel de la phase organique foumit 140 mg d'un solide blanc
correspondant au produit attendu.
Rf = 0,39 (heptane/acétate d'éthyle, 1:1).
FE!lILLE DE REMPLACEI'tiRENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-19-
Analvse élémentaire :(formule brute : C17H24CINO6 masse moléculaire : 373,84)
C H N
% trouvé 54,23 6,48 3,59
% calculé 54,62 6,47 3,75
EXEMPLE 5 : 6-[1-Chloroacétylcarbamoyl-5-(3-pentyloxiran-2-yl)-5-méthyl-
tétrahydropyrano[3,2-d]oxazol-2-one]-spiro-2'-oxirane
Composé obtenu à partir de 2-acétylfurane et de 1-heptyne selon le mode
opératoire
décrit dans l'exemple 4, en remplaçant dans l'étape E le chlorure de 2-
chloroacétyle
par l'isocyanate de 2-chloroacétyle.
Analyse élémentaire :(formule brute : C,gH25CIN2O7 masse moléculaire : 414,85)
C H N
% trouvé 51,41 6,02 6,56
% calculé 51,86 6,04 6,72
En procédant selon le mode opératoire décrit dans l'exemple 4, les composés
des
exemples 6 et 7 sont obtenus en utilisant le chlorure d'acyle approprié.
EXEMPLE 6: 6-[1-Cinnamoyl-5-(3-pentyloxiran-2-yl)-5-méthyl-tétrahydro-
pyrano[3,2-d]oxazol-2-one]-spiro-2'-oxirane
(diastéréoisomère A)
Rf = 0,34 (heptane/acétate d'éthyle, 1:1).
Analyse élémentaire :(formule brute : C24H29NO6 masse moléculaire : 427,50)
C H N
% trouvé 66,84 6,89 3,13
= % calculé 67,43 6,84 3,28
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 -20 PCT/FR96/00629
-
EXEMPLE 7 : 6-[1-Cinnamoyi-5-(3-pentyloxiran-2-yl)-5-méthyl-tétrahydro-
pyrano[3,2-d]oxazol-2-one]-spiro-2'-oxirane
(diastéréoisomère B)
Rf = 0,4 (heptane/acétate d'éthyle, 1:1).
Analyse élémentaire :(formule brute : C24H29NOs masse moléculaire : 427,50)
C H N
% trouvé 66,85 6,80 3,29
% calculé 67,43 6,84 3,28
Les composés des exemples 8 et 9 sont obtenus selon le mode opératoire décrit
dans l'exemple 4, en utilisant un excès de chlorure de 2-chloroacétyle dans
l'étape
E, et en utilisant dans l'étape A l'alcyne appropriée.
EXEMPLE 8 : 6-[1-Chloroacétyl-5-(1-hydroxy-2-chloro-heptyl)-5-méthyl-
tétrahydropyrano[3,2-d]oxazol-2-one]-spiro-2'- oxirane
Analyse élémentaire :(formule brute : C17H25C12NO6 masse moléculaire : 410,30)
C H N CI
% trouvé 49,69 6,13 3,29 17,65
% calculé 49,77 6,14 3,41 17,28
EXEMPLE 9: 6-[1-Chloroacétyl-5-(1-hydroxy-2-chloro-5-phénylpentyl)-5-
méthyl-tétrahydropyrano[3,2d]oxazol-2-one]-spiro-2'-oxirane
Analyse élémentaire :
(formule brute : C21 H25C12NO6 masse moléculaire : 458,34)
C H N CI
% trouvé 54,45 5,62 2,70 17,08
% calculé 54,17 5,46 3,01 16,75 25 EXEMPLE 10 : 6-[1-Chloroacétyl-5-heptyl-5-
méthyl-tétrahydropyrano
[3,2-d]oxazol-2-one]-spiro-2'-oxirane
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCTIFR96/00629
-21-
Composé obtenu selon le mode opératoire décrit dans l'exemple 4, étapes A, B
et E,
à partir de 5-méthyl-5-heptyl-dihydropyrano[3,2-d]oxazole-2,6-dione dans
l'étape A,
elle-même obtenue par hydrogénation catalytique (palladium, sulfate de baryum,
dans l'acétate d'éthyle, 1 atmosphère) du diastéréoisomère A de la 5-(hept-1-
ynyi)-5-
méthyl-dihydropyrano-[3,2-d]oxazole-2,6-dione obtenue à l'exemple 1.
Analyse élémentaire :(formule brute : C17H26CINO5 masse moléculaire ; 359,85)
C H N CI
% trouvé 56,62 7,20 3,78 10,51
% calculé 56,74 7,28 3,89 9,85
EXEMPLE 11-1 : 1-Chloroacétyl-5-heptyl-dihydro-pyrano[3,2-d]oxazole-2,6-
dione (Isomère de l'exemple 11-2)
5 g (24,5 mmoi) du composé obtenu selon le mode opératoire décrit à l'étape A
de
l'exemple 1 à partir de furaidéhyde et d'1-heptyne, sont mis en présence de
1,5 g de
catalyseur de Lindlar dans 100 ml de benzène, sous atmosphère d'hydrogène. 5 g
de 1-(furan-2'-yl)octan-l-ol sont obtenus et sont traités selon les modes
opératoires
décrits dans les étapes B et C de l'exemple 1. Le produit brut est isolé par
chro-
matographie pour foumir le composé titre ainsi que le composé de l'exemple 11-
2.
Rf = 0,39 (cyclohexane/acétate d'éthyle, 60:40).
Analyse élémentaire :(formule brute : C1$H22CIN05 masse moléculaire : 331,79)
C H N CI
% trouvé 54,30 6,20 4,24 10,68
% calculé 54,30 6,68 4,22 10,68
EXEMPLE 11-2: 1-Chloroacétyl-5-heptyl-dihydropyrano-[3,2-d]oxazole-2,6-
dione (Isomère de l'exemple 11-1)
Composé obtenu lors de la purification du produit brut obtenu dans l'exemple
11-1.
Rf = 0,28 (cyclohexane/acétate d'éthyle, 60:40).
Caractérisitaues soectrales :
FEUILLE DE REMPLACEI1lENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96100629
-22-
RMN 'H, (DMSO), S(ppm) : 6(1 H, d) ; 4,82 (1 H, d) ;4,75 (1 H, m) ; 4,72 (1 H,
d) ; 4,17
(1 H, dd) ; 3,0-2,8 (2H, AB) ; 1,72 (1 H, m) ; 1,52 (1 H, m) ; 1,45-1,15 (10H,
m) ; 0,82
(3H, t).
EXEMPLE 12 : 1-Chloroacétyl-5-[3-(3-phénylpropyl)oxiran-2-yl]-5-méthyl-
dihydropyrano[3,2-d]oxazole-2,6-dione
Composé obtenu selon le mode opératoire décrit dans les exemples 2 puis 3, en
utilisant dans l'étape A de l'exemple 1, le dérivé acétylénique approprié.
Analyse élémentaire :(formule brute : CmH22CINO6 masse moléculaire : 407,85)
C H N CI
lo % trouvé 59,23 5,38 3,25 8,79
% calculé 58,90 5,44 3,43 8,69
EXEMPLE 13 : 6-[1-Chloroacétyl-5-(3-pentyloxiran-2-yl)-5-méthyl-tétrahydro
pyrano[3,2-a ]oxazoi-2-one]-spiro-2'-oxirane
(Isomère du composé de l'exemple 4)
Etape A : 5-(hept-1-ényi)-5-méthyl-dihydropyrano[3,2-d]oxazole-2,6-dione
Le diastéréoisomère A de la 5-(hept-1-yn-1-yl)-5-méthyl-dihydropyrano[3,2-d]-
oxazole-2,6-dione, obtenu à l'étape C de l'exemple 1, est soumis à
hydrogénation
catalytique selon le mode opératoire décrit à l'exemple 2.
Etape B : 6-[1-chloroacétyl-5-(3-pentyloxiran-2-yl)-5-méthyl-tétrahydro-
pyrano[3,2-d]oxazol-2-one]-spiro-2'-oxirane
1,25 g (4,7 mmol) de composé obtenu à l'étape précédente, dans 15 ml de
tétrahydrofurane sont mis en réaction, à 0 C, avec l'ylure de diméthylsulfure,
obtenu
à partir de 4,92 g (24,1 mmol) d'iodure de triméthylsulfonium et de 24,1 mmol
de n-
butyllithium dans 15 ml de tétrahydrofurane. Le milieu réactionnel est agité
pendant
15 heures, de 0 C jusqu'à température ambiante puis hydrolysé par une solution
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-23-
aqueuse saturée de chlorure de sodium, et extrait à l'éther diéthylique. Le
traitement
habituel de la phase organique foumit 1,3 g d'un solide jaune qui est purifié
par
chromatographie sur gel de silice. Ce composé est alors soumis aux réactions
décrites dans les étapes D et E de l'exemple 4.
Rf = 0,35 (heptane/acétate d'éthyle, 1:1).
Analyse élémentaire :(formule brute : C17H24CINO6 masse moléculaire : 373,84)
C H N CI
% trouvé 54,38 6,38 3,58 9,60
% calculé 54,62 6,47 3,75 9,48
io EXEMPLE 14 : 1-Carbamoyl-5-(3-pentyloxiran-2-yl)-5-méthyl-dihydro-
pyrano[3,2-d]oxazole-2,6-dione
Le diastéréoisomère A de la 5-(hept-1-ynyl)-5-méthyl-dihydropyrano[3,2-
d]oxazole-
2,6-dione, obtenu à l'étape C de l'exemple 1, est soumis à hydrogénation
catalytique,
époxydation, selon les modes opératoires décrits aux exemples 2 et 3, puis
acylation
is par l'isocyanate de 2-chloroacétyle, selon le mode opératoire décrit à
l'exemple 5
suivi d'un passage sur silice.
Caractéristiques saectrales :
RMN 'H ,(DMSO), S(ppm) : 7,7 (1 H, s) ; 7,3 (1 H, s) ; 6,2 (1 H, d) ; 4,95 (1
H, m) ; 3,0
(4H, m) ; 1,8 (2H, m) ; 1,6-1,3 (9H, m) ; 0,9 (3H, t).
20 EXEMPLE 15 : 1 -Chloroacétyl-5-(hept-1 -ényl)-6-hydroxy-5-méthyl-tétra-
hydropyrano[3,2-d]oxazol-2-one
Etape A : 5-(heptyn-1-yl)-6-hydroxy-5-méthyl-tétrahydropyrano[3,2-d]
oxazol-2-one
210 mg (0,786 mmol) du diastéréoisomère A obtenu à'l'exemple 1 sont traités
par
25 1,57 mmol de super-hydrure (LiEt3BH) dans le tétrahydrofurane à-78 C. Après
15
minutes d'agitation, le milieu réactionnel est hydrolysé successivement par de
l'eau,
une solution aqueuse à 10% d'hydroxyde de sodium puis une solution aqueuse à
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-24-
15% d'eau oxygénée et ensuite extrait à l'éther éthylique. Après séchage de la
phase
organique sur sulfate de sodium puis concentration sous vide, 200 mg du
produit
attendu sous forme d'une huile jaune sont obtenus.
Etape B : 1-chloroacétyl-5-(hept-1-ényl)-6-hydroxy-5-méthyl-tétrahydro-
pyrano[3,2-d]oxazol-2-one
Le composé obtenu à l'étape précédente est soumis à hydrogénation catalytique
selon le mode opératoire décrit à l'exemple 2, puis acylé à l'aide de chlorure
de 2-
chloroacétyle selon le mode opératoire décrit à l'étape E de l'exemple 4.
Caractéristiaues spectrales :
RMN 'H, (DMSO), S(ppm) : 5,7 (1 H, d) ; 5,5 (2H, m) ; 5,35 (1 H, d) ; 4,85
(2H, dd) ;
4,45 (1 H, m) ; 3,6 (1 H, m) ; 2,4-2,2 (3H, m) ; 2,0 (1 H, m) ; 1,5-1,3 (9H,
m) ; 0,9 (3H, t).
EXEMPLE 16 : 1 -Chloroacétylcarbamoyl-5-(hept-1-ynyl)-6-hydroxy-5-méthyl-
tétrahydropyrano[3,2-d]oxazol-2-one
Composé obtenu à partir du diastéréoisomère A obtenu à l'exemple 1 traité par
le
ls super hydrure (LiEt3BH) selon les conditions opératoires de l'étape A de
l'exemple
15, puis avec l'isocyanate de chloroacétyle, selon le mode opératoire décrit à
l'étape
E de l'exemple 4.
Caractéristiaues spectrales :
RMN ' H, (DMSO), S(ppm) : 6,0 (1 H, d) ; 5,45 (1 H, d) ; 4,6 (2H, s) ; 4,55 (1
H, m) ; 3,8
(1H, m) ; 2,4 (2H, m) ; 2,3-2,15 (4H, m) ; 1,5-1,25 (6H, m) ; 0,9 (3H, t).
EXEMPLE 17 : 7-Chloroacétylcarbamoyl-6-chloroacétyl-carbamoyloxy-5-(hept-
1-ynyl)-5-méthyl-tétrahydro-pyrano[3,2-d]oxazol-2-one
Composé obtenu selon le mode opératoire de l'exemple 16, en utilisant un excès
d'isocyanate de chloroacétyle dans la demière étape.
Analyse élémentaire :(formule brute : C2oH25CI2N3O8 masse moléculaire :
506,34)
C H N CI
ti
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-25-
% trouvé 47,09 5,01 8,22 14,23
% calculé 47,44 4,98 8,30 14,00
EXEMPLE 18 : 6-[1-Benzoyl-5-(3-pentyloxiran-2-yl)-5-méthyl-tétrahydro-
pyrano[3,2-d]oxazol-2-one]-spiro-2'-oxirane
Composé obtenu selon le mode opératoire décrit dans l'exemple 4, en
remplaçant,
dans l'étape E, le chlorure de 2-chloroacétyle par le chlorure de benzoyle.
Caractéristiaues spectrales :
RMN 'H, (DMSO), S(ppm) : 7,6-7,4 (5H, m) ; 6,1 (1 H, d) ; 4,8 (1 H, q) ; 3,1
(1 H, d) ;
2,85 (2H, m) ; 2,7 (1 H, d) ; 2,3 (2H, m) ; 1,8 (2H, m) ; 1,6-1,4 (9H, m) ;
0,9 (3H, t).
En procédant selon les modes opératoires décrits aux exemples 1 et 2, à partir
de 5-
phénylpentyne, les composés des exemples 19 et 20 sont respectivement obtenus
:
EXEMPLE 19 : 1-Chloroacétyl-5-méthyl-5-(5-phénylpent-1-ynyl)-dihydro-
pyrano[3,2-d]oxazole-2,6-dione
Analyse élémentaire :(formule brute : C20H20CIN05 masse moléculaire : 389,84)
C H N CI
% trouvé 61,44 5,17 3,53 9,53
% calculé 61,62 5,17 3,59 90'09
EXEMPLE 20 : 1-Chloroacétyl-5-méthyl-5-(5-phénylpent-1-ényl)-dihydro-
pyrano[3,2-d] oxazole-2,6-dione
Caractéristiaues sDectrales :
RMN 'H, (DMSO), S(ppm) : 7,5-7,3 (m, 5H) ; 6,0 (d, 1H) ; 5,65 (m, 1H) ; 5,35
(d
élargi, 1 H) ; 4,97-4,7 (m, 3H) ; 3,0 (m, 2H) ; 2,6 (triplet élargi, 2H) ; 2,3
(m,2H) ; 1,6 (m,
2H) ; 1,4 (s, 3H).
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-26-
EXEMPLE 21 : 1-Chloroacétyl-5-méthyl-5-(5-phényl-pentyl)-dihydropyrano
[3,2-d]oxazole-2,6-dione
Composé obtenu par hydrogénation catalytique du composé obtenu à l'exemple 19.
Analyse élémentaire :(formule brute : C2oH24CIN05 masse moléculaire : 393,87)
C H N CI
% trouvé 60,88 6,29 3,45 9,04
% calculé 60,99 6,14 6,56 9,00
EXEMPLE 22 : 1-Chloroacétyl-5-heptyl-5-méthyl-dihydro-pyrano
[3,2-d]oxazole-2,6-dione
Composé obtenu par hydrogénation catalytique du composé de l'exemple 1.
Analyse élémentaire :(formule brute : C16H24CINO5 masse moléculaire : 345,83)
C H N CI
% trouvé 55,92 7,03 3,85 10,16
% calculé 55,57 7,00 4,05 10,25
EXEMPLE 23 : 1-Chloroacétyl-5-(3-méthoxyprop-1-ynyl)-5-méthyl-dihydro-
pyrano[3,2-d]oxazole-2,6-dione
Composé obtenu selon le mode opératoire décrit pour l'exemple 1, à partir de 3-
méthoxypropyne. -
Analyse élémentaire :(formule brute : C13Hl4CIN06 masse moléculaire : 315,71)
C. H N CI
% trouvé 48,89 4,51 4,17 11,42
% calculé 49,46 4,47 4,44 11,23
EXEMPLE 24 : 1-Chloroacétyl-5-(5-méthylhex-1-ynyl)-5-méthyl-dihydro-
pyrano[3,2-d]oxazole-2,6-dione
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96133999 PCT/FR96100629
-27-
Composé obtenu selon le mode opératoire décrit pour l'exemple 1, à partir de 5-
méthylhexyne.
Analyse élémentaire :(formule brute : C16H2oCIN0$ masse moléculaire : 341,79)
C H N CI
% trouvé 56,86 5,81 4,13 10,50
% calculé 56,23 5,90 4,10 10,37
EXEMPLE 25 : 1-Chloroacétyl-5-(3-méthoxypropyl)-5-méthyl-dihydro-
pyrano[3,2-d]oxazole-2,6-dione
Composé obtenu par hydrogénation catalytique du composé de l'exemple 23.
Analyse élémentaire :(formule brute : C13H1$CINO6 masse moléculaire : 319,74)
C H N CI
% trouvé 49,08 5,66 4,31 11,27
% calculé 48,83 5,67 4,38 11,09
EXEMPLE 26 : 1-Chloroacétyl-5-(5-méthylhexyl)-5-méthyl-dihydropyrano
[3,2-d]oxazole-2,6-dione
Composé obtenu par hydrogénation catalytique du composé de l'exemple 24.
Analyse élémentaire :(formule brute : C16H24CIN05 masse moléculaire : 345,83)
C H N CI
% trouvé 55,85 7,16 3,70 10,00
% calculé 55,57 7,00 4,05 10,25
Les exemples 27 et 28 sont obtenus à partir du composé obtenu à l'étape B de
l'exemple 4, en remplacant le chlorure de 2-chloroacétyle par l'isocyanate de
2-
chloroacétyle, selon le mode opératoire décrit à l'étape E de l'exemple 4.
FEUILLE DE RElti:PLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCTlFR96/00629
-28-
EXEMPLE 27 : 6-[1-Chloroacétylcarbamoyi-5-(hept-y -ynyl)-5-méthyl-tétra-
hydropyrano[3,2-d]oxazol-2-one]-spiro-2'-oxirane
Analyse élémentaire :(formule brute : C,eH23CIN206 masse moléculaire : 398,85)
C H N CI
s % trouvé 54,73 5,85 7,01 8,84
% calculé 54,21 5,81 7,02 8,89
EXEMPLE 28 : 6-[1-Carbamoyl-5-(hept-1-ynyl)-5-méthyl-tétrahydropyrano
[3,2-d]oxazol-2-one]-spiro-2'-oxirane
Analyse élémentaire :(forrnule brute : C16H22N20$ masse moléculaire : 322,36)
C H N
% trouvé 59,65 6,94 8,58
% calculé 59,62 6,88 8,69
EXEMPLE 29 : 6-[1-Chloroacétyl-5-[3-(3-phénylpropyl)oxiran-2-yl]-5-méthyl-
tétrahydropyrano[3,2-d]oxazol-2-one]-spiro-2'-oxirane
Composé obtenu selon le mode opératoire décrit dans l'exemple 4, étapes A à E,
en
utilisant dans l'étape A le dérivé acétylénique approprié.
Analyse élémentaire :(formule brute : C2lH24CIN06 masse moléculaire : 421,88)
C H N CI
% trouvé 59,67 5,66 3,29 8,91
% calculé 59,79 5,73 3,32 8,40
EXEMPLE 30 : 6-[1-Chloroacétyl-5-(1-chloroacétyl-carbamoyloxy-2-chloro-5-
phénylpentyl)-5-méthyl-tétrahydro-pyrano[3,2-d]oxazol-2-
one]-spiro-2'-oxirane
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 -29 PCT/FR96/00629
-
Composé obtenu à partir du composé de l'exemple 9, via traitement avec un
équivalent d'isocyanate de 2-chloroacétyle dans le dichlorométhane.
Après 2 heures d'agitation à 0 C, et hydrolyse, la phase organique est
extraite au
dichiorométhane. Après séchage de la phase organique sur sulfate de magnésium,
concentration et trituration dans l'éther, on obtient le composé désiré, sous
forme
d'une poudre blanche.
Analyse élémentaire :(formule brute : C24H27CI3N2O8 masse moléculaire :
577,85)
C H N CI
% trouvé 49,27 4,67 4,79 18,49
% calculé 49,89 4,71 4,85 18,41
EXEMPLE 31 : 1-Chloroacétylcarbamoyl-6-chloro-acétylcarbamoyloxy-5-
heptyl-5-méthyl-tétrahydropyrano[3,2-d]oxazol-2-one
Composé obtenu selon le mode opératoire décrit pour l'exemple 17, à partir du
diastéréoisomère A obtenu dans l'exemple 1 (étape C) que l'on aura
préalablement
réduit en 5-méthyl-5-heptyl-dihydropyrano[3,2-d]oxazole-2,6-dione par hydrogé-
nation catalytique.
Analyse élémentaire :(formule brute : C2aH29C12N308 masse moléculaire :
510,38)
C H N CI
% trouvé 46,83 5,70 7,92 14,00
% calculé 47,07 5,73 8,23 13,89
EXEMPLE 32-1 : .1-Chloroacétylcarbamoyl-6-carbamoyl-oxy-5-heptyl-5-méthyl-
tétrahydropyrano[3,2-d]oxazol-2-one
Composé obtenu lors de la purification par chromatographie liquide (HPLC) sur
RP1 8 du composé de l'exemple 31.
Analyse élémentaire :(formule brute : ClBH28CIN3O7 masse moléculaire : 433,89)
C H N CI
% trouvé 49,76 6,50 9,62 8,77
% calculé 49,83 6,50 9,68 8,17
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-30-
Les composés des exemples 32-2, 32-3 et 32-4 suivants sont obtenus par
clivages
successifs par chromatographie liquide (HPLC) sur colonne RP18 du composé de
l'exemple 17.
EXEMPLE 32-2: 1-Chloroacétylcarbamoyl-6-carbamoyl-oxy-5-(hept 1-ynyi)-5-
méthyl tétrahydropyrano[3,2-d]oxazol-2-one
Analyse élémentaire :(formule brute : C18H24CIN30$ masse moléculaire : 429,86)
C H N CI
% trouvé 50,66 5,70 9,63 8,10
% calculé 50,30 5,63 9,78 8,25
io EXEMPLE 32-3: 1-Carbamoyl-6-chloroacétylcarbamoyl-oxy-5-(hept-l-ynyl)-5-
méthyl-tétrahydropyrano[3,2-d]oxazol-2-one
Analvse élémentaire :(formule brute : C18H24CIN308 masse moléculaire : 429,86)
C H N C1
% trouvé 50,26 5,68 9,43 8,17
% calculé 50,30 5,63 9,78. 8,25
EXEMPLE 32-4: 1-Carbamoyi-6-carbamoyloxy-5-(hept-1-ynyl)-5-méthyl tétra-
hydropyrano[3,2-d]oxazol-2-one
Caractéristiques spectrales :
RMN 'H, (DMSO), S(ppm) : 7,52 (1 H, s) ; 7,11 (1H, s) ; 6,5 (2H, s) ; 5,81 (1
H, d) ;
4,6 (1 H, t) ; 4,31 (1 H, m) ; 2,66-2,3 (2H, m) ; 2,25 (2H, t) ; 1,55-1,25
(6H, m) ; 1,35
(3H, s) ; 0,88 (3H, t).
FEUILLE DE REMpLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-31-
Les composés des exemples 33 et 34 sont obtenus selon le mode opératoire
décrit
dans l'exemple 31, en utilisant dans l'étape A de l'exemple 1, le dérivé
acétylénique
approprié.
EXEMPLE 33: 1-Chloroacétylcarbamoyl-6-chloroacétylcarbamoyloxy-5-(5-
phénylpent-1-ynyl)-5-méthyl-tétrahydropyrano[3,2-d]oxazol-2-
one
Analyse élémentaire :(formule brute : C24H25CI2N308 masse moléculaire :
554,39)
C H N CI
% trouvé 51,79 4,45 7,24 13,09
% calculé 52,00 4,55 7,58 12,79
EXEMPLE 34: 1-Chloroacétylcarbamoyl-6-chloro-acétylcarbamoyloxy-5-(5-
phénylpentyl)-5-méthyl-tétrahydro-pyrano[3,2-d]oxazol-2-one
Analyse élémentaire :(formule brnrte : C24H29C12N308 masse moléculaire :
558,42)
C H N CI
% trouvé 51,86 5,19 7,47 12,99
% calculé 51,62 5,23 7,52 12,70
EXEMPLE 35: 1-Chloroacétylcarbamoyl-5-(hept-1-ynyl)-5-méthyl-dihydro-
pyrano[3,2-d]oxazole-2,6-dione
Composé obtenu à partir du diastéréoisomère A(5-(hept-1-ynyl)-5-méthyl-
dihydropyrano[3,2-d]oxazole-2,6-dione) de l'étape C de l'exemple 1, que l'on
fait
réagir avec l'isocyanate de 2-chloroacétyle au lieu du chlorure de 2-
chloroacétyle
selon le mode opératoire décrit à l'étape E de l'exemple 4.
Analyse élémentaire :(formule brute : C17H21CIN206 masse moléculaire : 384,82)
C H N CI
FEUILLE DE REMPLACEMENT (REGLE 26) _
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-32-
% trouvé 52,87 5,56 7,16 9,47
% calculé 53,06 5,50 7,28 9,21
EXEMPLE 36 : 1-Chloroacétylcarbamoyl-5-(5-méthylhex-1-ynyl)-5-méthyl-
di hydropyrano[3,2-d]oxazole-2,6-dione
Composé obtenu selon le mode opératoire décrit pour l'exemple 35, en utilisant
dans
l'étape A de l'exemple 1, le dérivé acétylénique approprié.
Analyse élémentaire :(formule brute : C17H21 CIN206 masse moléculaire :
384,82)
C H N CI
% trouvé 53,13 5,59 7,08 9,32
% calculé 53,06 5,50 7,28 9,21
EXEMPLE 37 : 1-Chloroacétylcarbamoyl-5-(5-méthylhex-1- yl)-5-méthyl-
dihydropyrano[3,2-d]oxazol-2,6-dione
Composé obtenu via hydrogénation catalytique du composé de l'exemple 35.
Analyse étémentaire :(formule brute : C17H25CIN2O6 masse moléculaire : 388,85)
C H N Ci
% trouvé 53,03 6,57 7,12 9,29
% calculé 52,51 6,48 7,20 9,12
EXEMPLE 38 : 1-Carbamoyl-5-(5-méthylhexyl)-5-méthyl-dihydropyrano
[3,2-d]oxazole-2,6-dione
Composé obtenu au cours de la purification du composé de l'exemple 37, par
HPLC
sur RP 18.
Analyse élémentaire :(formule brute : C15H24N205 masse moléculaire : 312,37)
C H N
% trouvé 58,10 7,84 8,86
% calculé 57,68 7,74 8,97
FEUILLE DE REMPLACEMENT (REGLE 251
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-33-
EXEMPLE 39 : 1-Chloroacétylcarbamoyi-5-heptyl-5-méthyl-dihydropyrano
[3,2-d]oxazole-2,6-dione
Composé obtenu selon le mode opératoire de l'exemple 35, en faisant réagir à
l'étape A de l'exemple 1, le lithien du furane sur l'octanal dans le
tétrahydrofurane à -
78 C.
Analyse élémentaire :(formule brute : CieH23C1406 masse moléculaire : 374,82)
C H N CI
% trouvé 51,35 6,17 7,40 9,47
% calculé 51,27 6,18 7,47 9,46
EXEMPLE 40 : N-(1-Chloroacétyl-5-heptyl-5-méthyl 2-oxo-perhydropyrano
[3,2-d]oxazol-6-yl)acétamide
Etape A : N-(5-heptyl-5-méthyl-2-oxo-perhydropyrano[3,2-d]oxazol-6-
yl)acétamide
Composé obtenu à partir de la 5-méthyl-5-heptyl-dihydropyrano[3,2-d]oxazole-
2,6-
dione, elle-même obtenue par hydrogénation catalytique (palladium sur charbon,
acétate d'éthyle, 1 atmosphère) par traitement par l'acétate d'ammonium (9
éq.) en
présence de cyanoborohydrure de sodium (20 éq.) dans le méthanol à température
ambiante pendant une heure. Après concentration sous vide, le milieu
réactionnel
est dilué dans un mélange acide acétique/anhydride acétique à température
ambiante, et agité pendant 10 heures. Après concentration sous vide et
chromatographie sur silice (heptane/acétate d'éthyle, 1:4), on obtient le N-(5-
heptyl-
5-méthyl-2-oxo-perhydropyrano[3,2-d]oxazol-6-yl)acétamide utilisé tel quel par
la
suite.
Etaoe B : N-(1-Chloroacétyl-5-heptyl-5-méthyl-2-oxo-perhydropyrano
[3,2-d]oxazol-6-yl)acétamide
FEUILLE DE REMPLACEMENT (RcCLE 26)
CA 02219571 1997-10-16
WO 96/33999 -34 PCT/FR96/00629
-
Le composé obtenu à l'étape A est traité par le chlorure de 2-chloroacétyle
selon le
mode opératoire décrit décrit à l'étape E de l'exemple 4, pour conduire au
produit
attendu sous forme d'une poudre blanche
Caractéristiques spectrales :
RMN 'H, (DMSO), S(ppm) : 8,5 (1 H, s) ; 6,55 (1 H, d) ; 6,15 (1 H, d) ; 5,0 (1
H, dd)
4,8 (2H, dd) ; 2,0 (3H, s) ; 1,9 (1 H, m) ; 1,55 (1 H, m) ; 1,45 (5H, m) ; 1,6-
1,10 (10H,
m) ; 0,85 (3H, t).
EXEMPLE 41 : 1-Chloroacétyl-dihydropyrano[3,2-d]oxazole-2,6-dione
Composé obtenu à partir de la 6-hydroxy-2H-pyran-3(6M-one, préparée selon M.
P.
Georgiadis et coli., Org. Prep. Proc. Int., (1992), 24(1), 95-118) selon le
mode
opératoire de l'exemple 1, étape C, puis traitement du produit brut obtenu, à
température ambiante, dans l'acétone pendant 24 heures.
Analyse élémentaire :(formule brute : C8H8CINO5 masse moléculaire : 233,61)
C H N CI
is % trouvé 41,48 3,78 6,30 15,13
% calculé 41,13 3,45 6,00 15,18
EXEMPLE 42 : 1-Chloroacétyl-5-heptyl-5-méthyl-dihydropyrano[3,2-d]
oxazole-2,6-dione 6-(O-acétyloxime)
Etape A : 5-(hept-1-ynyl)-5-méthyl-dihydropyrano[3,2-d] oxazole-2,6-dione
6-oxime
A une solution du diastéréoisomère A de la 5-(hept-1-ynyi)-5-méthyl-
dihydropyrano
[3,2-d]oxazole-2,6-dione (1,08 g ; 0,004 mol), obtenue à l'étape C de
l'exemple 1,
dans du méthanol (35 ml), sont ajoutés le chlorhydrate d'hydroxylamine (1,8 g;
0,0259 mol) et l'acétate de sodium (3 g ; 0,022 mol). Le milieu réactionnel
est agité à
40 C pendant 12 heures. Le milieu réactionnel est ensuite concentré. Le résidu
est
dilué dans le diéthyléther et lavjé à l'eau. Les phases organiques sont
séchées sur
sulfate de magnésium puis concentrées. Le résidu obtenu est repris dans le
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCTIFR96/00629
-35-
diéthytéther et le produit désiré est précipité dans l'hexane. On obtient une
poudre
beige (700 mg) utilisée telle quelle par la suite.
EtaQe B : N-(5-heptyl-5-méthyl-2-oxo-2,3a,5,7a-tétrahydro-1 H-pyrano
[3,2-d]oxazol-6-yi)acétamide
Le composé obtenu à l'étape A (400 mg, 1,4 mol) dans un mélange acide acétique
(12 ml) / anhydride acétique (40 mi) est agité en présence de palladium sur
charbon
(80 mg) sous atmophère d'hydrogène, à pression atmosphérique et température
ambiante pendant 14 heures. Le milieu réactionnel est alors filtré sur célite,
azéotropé avec le toluène. On obtient un résidu gommeux que l'on fait
cristalliser
dans un mélange diéthyléther/pentane. On obtient alors 240 mg d'une poudre
beige
que l'on utilise telle quelle par la suite. Le filtrat est constitué
majoritairement de 5-
heptyl-5-méthyl-dihydropyrano[3,2-d] oxazole-2,6-dione 6(O-acétyloxime) qui
sera
utilisée pour la préparation du composé de l'exemple 42.
Etape C : 1-Chloroacétyl-5-heptyl-5-méthyl-dihydropyrano[3,2-d]oxazole-
2,6-dione 6-(O-acétyloxime)
Le composé obtenu à l'étape B est traité par le chlorure de 2-chloroacétyle,
en
présence de n-butyllithium dans les conditions opératoires décrites à l'étape
E de
l'exemple 4.
Caractéristioues spectrales :
RMN ' H, (DMSO), (S, ppm) : 6 (d, 1 H) ; 4,9 (m, 2H) ; 4,75 (d, 1 H) ; 3,65
(dd, 1 H) ; 2,6
(dd, 1 H) ; 2,05 (s, 3H) ; 1,71 (m, 2H) ; 1,45 (s, 3H) ; 1,25 (m, 10H) ; 0;9
(t, 3H).
EXEMPLE 43: 1-Chloroacétyl-5-heptyl-5-méthyl-dihydropyrano[3,2-d]
oxazole-2,6-dione 6-oxime
Le traitement par le chlorure de 2-chloroacétyle (dans les conditions
opératoires
décrites à l'étape E de l'exemple 4) du composé obtenu à l'étape A de
l'exemple 42
conduit au produit attendu.
Caractéristipues saectrales :
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 -36 PCT/FR96100629
-
RMN 'H, (DMSO), S(ppm) : 11 (s, 1 H) ; 6,05 (d, 1 H) ; 4,9-4,6 (AB + m, 3H) ;
3,15
(dd, 1 H) ; 2,85 (dd, 1 H) ; 2,25 (rrm, 2H) ; 1,65 (s, 3H) ; 1,5-1,20 (m, 10H)
; 0,85 (t, 3H).
EXEMPLE 44 : 6-Butyl-1-chloroacétyl-5-heptyl-5-méthyl-6-hydroxy-tétra-
hydropyrano[3,2-d]oxazol-2-one
Le traitement du produit brut obtenu dans l'exemple 11-1 par le chlorure de 2-
chloroacétyle en présence de n-butyllithium foumit un produit brut que l'on
purifie par
chromatographie sur colonne de silice pour obtenir le produit attendu.
Caractéristiaûes spectrales :
RMN 'H, DMSO, S(ppm) : 5,95 (1 H, d) ; 4,8 (2H, dd) ; 4,3 (1 H, q) ; 3,55-3,45
(1 H,
d) ; 2,60-2,55 (2H, dd) ; 1,8-1,2 (19H, m) ; 0,9 (6H, t).
EXEMPLE 45: Chloroacétyl-5-hexyl-dihydropyrano[3,2-d]oxazole-2,6-dione
Etape A : 1-(2-furyl)heptan-1-ol
A une solution contenant 38,2 ml (35,77 g, 525,4 mmol) de furane dans 500 ml
de
tétrahydrofurane anhydre refroidis à 0 C, sont ajoutés goutte à goutte, 105 ml
de n-
is butyllithium (2,5 M) dans l'hexane. L'agitation est maintenue une heure à 0
C.
Le milieu réactionnel est ensuite refroidi à-78 C, et 36,76 ml (262,7 mmol)
d'heptanal dans le tétrahydrofurane anhydre sont ajoutés goutte à goutte. Le
mélange est de nouveau agité pendant une heure à-78 C. La solution est alors
hydrolysée par une solution aqueuse saturée en chlorure de sodium puis
extraite au
pentane. Les phases organiques recueillies sont séchées sur sulfate de
magnésium
puis filtrées et concentrées. Une huile orange est obtenue (38,6 g)
correspondant au
produit attendu, et est utilisée telle quelle par la suite.
Etape B : 1 -Chloroacétyl-5-hexyl-dihydropyrano[3,2-d]oxazole-2,6-dione
Le composé de l'étape A est soumis aux modes opératoires des étapes B et C de
l'exemple 1 pour conduire à un mélange de deux isomères.
fEUlLLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-37-
Le diastéréoisomère A est isolé par chromatographie sur silice.
Rf = 0,39 (cyclohexane/acétate d'éthyle, 80:20).
Caractéristiques spectrales : -
RMN 'H, (DMSO), S(ppm) : 6,22 (d, 1 H) ; 4,85-4,72 (dd, 2H) ; 4,91 (m, 1 H) ;
4,07
(dd, 1 H) ; 3,0 (dd, 1 H) ; 2,9 (dd, 1 H) ; 1,75 (m, 1 H) ; 1,6 (m, 1 H) ;
1,45-1,15 (m, 8H)
0,83 (t, 3H).
Exemple 46: 1-Chloroacétyl-5-hexyl-dihydropyrano[3,2-d]oxazole-2,6-
dione
Second diastéréoisomère obtenu lors de la synthèse du composé de l'exemple 45.
Rf = 0,33 (éluant : cjrclohexane/acétate d'éthyle, 80:20).
Caractéristiques spectrales :
RMN ' H, (DMSO), S(ppm) : 5,98 (d, 1 H) ; 4,82-4,72 (dd, 2H) ; 4,78 (m, 1 H) ;
4,2 (dd,
1 H) ; 3,0 (dd, 1 H) ; 2,85 (dd, 1 H) ; 1,7 (m, 1 H) ; 1,55 (m, 1 H) ; 1,45-
1,15 (m, 8H)
0,83 (t, 3H).
Exemple 47: (3aS, 5R, 7aS)-1-Chloroacétyl-5 trityloxyméthyl-dihydropyrano
[3,2-d]oxazole-2,6-dione
-CI
I..I
N = ~
O~ H
O O O
H
Composé obtenu en procédant selon le mode opératoire décrit aux étapes B et C
de
l'exemple 1, à partir de (1R)-1-(2-furyl)-2-trityloxyéthanol (décrit dans M.P.
Georgiadis et coli., PoJ. J. Chem., (1990), 64, 823-826).
Caractéristiaues saectrales :
RMN 'H, (DMSO), S(ppm) : 7,5-7,2 (15H, m) ; 6,4 (1 H, d) ; 5,05 (1 H, m) ; 4,8
(2H,
AB) ; 4,4 (1 H, t) ; 3,35 (2H, d) ; 3,2 (1 H, d) ; 3,0 (1 H, d).
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-38-
Exemple 48: 2-(1-Chloroacétyl-2,6-dioxo-dihydropyrano[3,2-d]oxazol-5-yl)
acétate d'éthyle
Composé obtenu en procédant selon le mode opératoire décrit à l'étape C de
l'exemple 1, à partir de (6-hydroxy-3-oxo-3,6-dihydro[2H]pyran-2-yl)acétate
d'éthyle
(préparé selon Sato et coll., J. Org. Chem., (1989), 54, 2085-2091).
Exemple 49: Benzyl-[(1-chloroacétyl-5-heptyl-6-hydroxy-5-méthyl-2-oxo-
tétrahydropyrano[3,2-d]oxazol-6-yl)méthyl]méthylsulfonium
Composé obtenu selon le mode opératoire décrit dans l'exemple 10, en faisant
réagir le 6-(5-heptyl-5-méthyl-tétrahydropyrano[3,2-d]oxazol-2-one]spiro-2'-
oxirane
avec le méthane dithiolate de sodium dans le diméthylformamide, puis avec le
chlorure de benzyle, en présence de bromure d'argent dans le trichlorométhane,
avant de procéder à la réaction de chloroacétylation selon le mode opératoire
décrit
à l'étape E de l'exemple 4.
Exemple 50: Benzyl-[(1-chloroacétyl-6-chloroacétylcarbamoyloxy-5-
1s heptyl-5-méthyl-2-oxo-tétrahydropyrano[3,2-d]oxazol-6-
yl)méthyl]rrméthylsulfonium
Composé obtenu par traitement du composé de l'exemple 49 par l'isocyanate de 2-
chloroacétyle dans les conditions opératoires décrites dans l'exemple 30.
Exemple 51 : 2-[(1-Chloroacétyl-5-heptyl-6-hydroxy-5-méthyl-2-oxo-
tétrahydropyrano[3,2-d]oxazol-6-yl)méthyl]-1,3-dihydro-
benzo[c]thiénylium
Le 6-(5-heptyl-5-méthyl-tétrahydropyrano[3,2-d]oxazol-2-one]spiro-2'-oxirane
obtenu
via hydrogénation catalytique du composé obtenu à l'étape B de l'exemple 4 est
traité par le (2-mercaptobenzyl)méthanol, en présence de méthylate de sodium
dans
le méthanol. La fonction alcool benzylique est alors traitée par le chlorure
de
méthanesulfonyle, en présence de triéthylamine dans le dichlorométhane. La
cyclisation en dihydrobenzo[c]thiophène est finalement obtenue par chauffage à
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-39-
30 C dans le dichlorométhane. Le composé ainsi obtenu est alors chloroacétylé
selon le mode opératoire décrit à l'étape E de l'exemple 4.
Exemple 52 : 1 -Chloroacétyl-5-hexyl-7a-méthyl-dihydropyrano[3,2-d]
oxazole-2,6-dione
Composé obtenu selon le mode opératoire décrit dans l'exemple 45 à partir de 4-
méthyl-2-bromofurane (préparé selon M.E. Maier et coll. , Tet. Lett., (1991),
32, 53-
56) et d'heptanal.
Exemple 53: 1-Chloroacétyl-5-hexyl-7-méthyl-dihydropyrano[3,2-d]
oxazole-2,6-dione
Composé obtenu en procédant selon le mode opératoire décrit à l'exemple 41 à
partir de 2-hexyl-6-hydroxy-4-méthyl-6H-pyran-3-one (obtenue via réarrangement
oxydatif de 1-[2-(3-méthylfuryl)]hexan-1-ol préparé selon Sato et coll., J.
Org. Chem.,
(1989), 54, 2085-2091).
Exemple 54: 1-Chloroacétyl-7-méthoxy-5-méthyl-dihydropyrano[3,2-d]
oxazole-2,6-dione
En procédant comme décrit pour l'exemple 53, à partir de 6-hydroxy-4-méthoxy-2-
méthyl-6H-pyrane-3-one (obtenue via réarrangement oxidatif de 3-méthoxy-furan-
2-yi-
méthanol préparé selon P.A. Weeks et coli., J. Org. Chem., (1980), 45, 1109).
Exemple 55 : 3a-Benzyloxyméthyl-1-chloroacétyl-dihydropyrano[3,2-d]
oxazole-2,6-dione
En procédant comme décrit dans l'exemple 1, étapes B et C, à partir de 2-
benzyloxyméthyl-5-hydroxyméthylfurane (préparé selon O. Achmatowicz et coll.,
Tetrahedron, (1982), 38, 3507-3513) 'le produit titre est obtenu.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 -40 PCTIFR96/00629
-
En procédant de façon similaire aux exemples précédemment décrits, les
composés
suivants ont été obtenus :
Exemple 56: 3a-Benzyloxyméthyl-1-chloroacétylcarbamoyl-5,7a-diméthyl-5-
heptyl-dihydropyrano[3,2-d]oxazole-2,6-dione
Exemple 57: 6-[1-Chloroacétyl-3a-diméthylaminoéthyl-7-méthyl-5,5-diphényl-
tétrahydropyrano[3,2-d]oxazol-2-one]-spiro-2'-oxirane
Exemple 58: 6-Acétylamino-1-chloroacétyl-5-heptyl-perhydropyrano
[3,2-d]oxazol-2-one
Exemple 59: 6-Acétylamino-1 -chloroacétyl-5-heptyl-7a-méthylperhydro-
pyrano[3,2-d]oxazol-2-one
Exemple 60: 6-Benzyloxy-3a-benzyloxyméthyl-1-chloroacétylcarbamoyl-
5-heptyl-5-méthyl-tétrahydropyrano[3,2-d]oxazol-2-one
Exemple 61 : 1-(2-Chloropropanoyl)-5-heptyl-dihydro[3,2-d]oxazole-2,6-
dione
is Exemple 62: 6-Butyl-1-chloroacétylcarbamoyl-5-(2-chloro-1-chloroacétyl-
carbamoyloxyheptyl)-5-méthyl-tétrahydropyrano[3,2-d]
oxazol-2-one
Exemple 63: .1-Chloroacétyl-5,7-diméthyl-6-méthylamino-5-(3-pentyl-
oxiran-2-yl)-tétrahydropyrano[3,2-d]oxazol-2-one
ExemDle 64: 1-Chloroacétylcarbamoyloxy-6-diéthylamino-5-heptyl-tétra-
hydro-pyrano[3,2-d]oxazol-2-one
Exemple 65: 6-Benzylydène-5-(3-chloroacétylcarbamoyloxypropyl)-1-
cinnamoyl-5-méthyl-dihydropyrano[3,2-d]oxazol-2-one
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-41-
ETUDE PHARMACOLOGIQUE
EXEMPLE A: Etude de l'activité anti-proliférative des composés de l'invention
Trois lignées cellulaires ont été utilisées :
- 1 leucémie murine, L1210,
- 1 carcinome épidermoide humain, A431,
- 1 culture primaire de cellules endothéliales d'aorte de porc, CEAP.
Les cellules sont cultivées dans du milieu de culture RPMI 1640 complet
contenant
10% de sérum de veau foetal, 2 mM de glutamine, 50 unités/ml de pénicilline,
50
g/mi de streptomycine et 10 mM d'HEPES (pH = 7,4).
Les cellules sont réparties dans des microplaques et exposées aux composés
cytotoxiques.
Les cellules sont ensuite incubées pendant deux jours (L1210), 3 jours (CEAP)
et 4
jours (A431). Le nombre de cellules viables est ensuite quantifié par un essai
colorimétrique, le Microculture Tetrazolium Assay (Camiichael J., DeGraff W.
G.,
Gazdar A. F., Minna J. D. and Mitchell J. R., Evaluation of a tetrazolium-
based
semiautomated colorimetric assay : assessment of chemosensitivity testing,
Cancer
Res., 47, 936-942, (1987)).
Les composés de la présente invention ont montré une activité anti-
proliférative sur
ces trois lignées cellulaires. A titre d'exemple, les IC50 (concentrations en
composé
qui inhibent à 50 % la prolifération des cellules traitées) sont selon les
lignées
cellulaires, de 3 à 10 fois inférieures à celles de la fumagilline.
EXEMPLE B : Inhibition de la néovascularisation de la membrane chorio-
allantoidtenne d'embryon de poulet
Ce test est réalisé avec des embryons de poulet comme décrit précédemment
(Crum
R., Szabo S. and Folkman J., Science, (1985), 230, 1375-1378). Les oeufs
fécondés
FEUILLE DE RFMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
- 42
(JO) sont incubés à 37 C. Une poche d'air est créée en prélevant 1 ml
d'albumine
(J3), puis une fenêtre est découpée dans la coquille (J4) et la membrane
vitelline est
enlevée pour dégager la membrane chorio-allantoïdienne (MCA).
. Les produits à tester sont solubilisés dans de l'éthanol et déposés sur des
disques
de méthylcellulose qui sont séchés et déposés sur la MCA au jour 6. Entre 8 et
16
oeufs sont utilisés par groupe. La zone située autour du disque est ensuite
examinée
48 heures plus tard. Les oeufs présentant une zone avasculaire supérieure à 4
mm
de diamètre sont dénombrés et les résultats sont exprimés en pourcentage
d'oeufs
présentant une zone avasculaire. Les résultats obtenus pour chacun des
composés
de l'invention sont indiqués dans le tableau 1 suivant :
-Tableau 1 -
Inhibition de la néovascularisation de la
membranne chorioallantoïdienne d'embryon de poulet
Composé % d'oeufs présentant
une zone avasculaire
Exemple 1 70 10
Exemple 9 89 t 7
Exemple 11-1 87 g
Exemple 15 65 t 15
Exemple 16 85 5
Exemple 17 73 8
Exemple 21 71 t 8
Exemple 26 71 1
Exemple 31 86 f 4
Exemple 32-1 76 t 13
Exemple 33, 90 t 4
Exemple 34 75 f 15
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02219571 1997-10-16
WO 96/33999 PCT/FR96/00629
-43-
EXEMPLE C : Activité antitumorale
L'activité antitumorale des composés de l'invention a été étudiée selon le
protocole
décrit par R.I. Geran et coll., Cancer Chemiotherapy Reports, (1972), Part 3,
pages
3 sqq.
Des souris ont été reparties au hasard en groupes traités (11 souris/groupe)
et en un
groupe contrôle de 40 souris.
Des fragments tumoraux ont été implantés au jour 0(impfant sous cutané). Les
composés à tester ont été administrés pendant 12 jours (jour 1 à jour 12) par
voie
i.p.
lo Le poids moyen de la tumeur a été déterminé au jour 13 après implantation.
Le
pourcentage d'inhibition a été calculé selon la formule :
% inhibition = 100 - poids moyen de la tumeur (groupe traité)
poids moyen de la tumeur (groupe témoin)
A titre d'exemple, le composé de l'exemple 31 a montré une inhibition de 79% à
la
dose de 120 mg/kg.
EXEMPLE D: COMPOSITION PHARMACEUTIQUE : COMPRIMES
Formule de préparation pour 1000 comprimés dosés à 50 mg.
Composé de l'exemple 31 .......................................... 50 g
Amidon de blé ............................................................. 15
g
Amidon de maïs ..... ..................................................... 15
g
Lactose
....................................................................... 65 g
Stéarate de magnésium ............................................. 2 g
Silice
........................................................................... 1
g
Hydroxypropylcellulose ............................................... 2 g
FEUILLE DE REMPLACEMENT (REGLE 26)