Note: Descriptions are shown in the official language in which they were submitted.
CA 02245144 2001-03-06
PROCEDE D'ELECTROLYSE D'UNE SAUMURE
* ~ ~ ~ ,~
La présente invention concerne un procédé d'électrolyse d'une
saumure, et, plus précisément d'une solution aqueuse de chlorure de
sodium au moyen d'une cellule d'électrolyse à membrane et d'une
électrode à gaz, ladite électrode étant placée directement contre la
membrane et dans un compartiment cathodique alimenté uniquement par
du gaz.
Plus particulièrement, la présente invention concerne un procédé
de production d'une solution aqueuse d'hydroxyde de sodium par
électrolyse d'une solution aqueuse de chlorure de sodium au moyen d'une
"cathode à réduction oxygène" ayant un rendement en soude (rendement
de courant) et une durée de vie de la membrane améliorés.
Des améliorations remarquables ont été obtenues réoenment en ce
qui concerne les membranes échangeuses d'ions fluorées et ont permis le
développement de procédés d'électrolyse de solutions de chlorure de
sodium au moyen de membranes échangeuses d'ions. Cette technique
permet de produire de l'hydrogène et de l'hydroxyde de sodium dans le
compartiment cathodique et du chlore dans le compartiment anodique
d'une cellule d'électrolyse de saumure.
Pour réduire la consommation d'énergie, il a été proposé dans la
demande de brevet JP 52124496 d'utiliser une électrode à réduction
d'oxygène comme cathode et d'introduire un gaz contenant de l'oxygène
dans le compartiment cathodique pour supprimer le dégagement
d'hydrogène et pour réduire dans une large mesure la tension
d'électrolyse.
Théoriquement, il est possible de réduire la tension d'électrolyse
de 1,23 V en utilisant la réaction cathodique avec apport d'oxygène
représentée par ( 1 ) à la place de la réaction cathodique sans apport
d'oxygène représentée par (2)
2H20 + 02 + 4e- ~ 40H- (1 )
E = + 0,40V (par rapport à une électrode normale à hydrogène ).
4H20 + 4e' -~ 2H2 + 40H- (2)
E = -0,83 V (par rapport à une électrode normale à hydrogène ).
En général, une cellule conventionnelle d'électrolyse à membrane
selon la technologie électrode à gaz, comprend une électrode à gaz placée
CA 02245144 1998-09-22
2
dans le compartiment cathodique de la cellule d'électrolyse pour diviser ce
compartiment en un compartiment à solution du côté de la membrane
échangeuse d'ions et en un compartiment à gaz du côté opposé.
L'électrode à gaz est habituellement obtenue en moulant un mélange
d'une substance hydrophobe telle qu'une résine de polytétrafluoroéthylène
(appelée dans la suite PTFE) et d'un catalyseur ou d'un catalyseur sur
support, de manière qu'elle présente des propriétés hydrophobes
empéchant le passage des liquides. Cependant, une telle électrode à gaz
perd progressivement ses propriétés hydrophobes lorsqu'elle est exposée
à une température élevée de l'ordre de 90°C et à une solution aqueuse
d'hydroxyde de sodium de concentration élevée d'environ 32 % voir plus
en masse au cours d'une électrolyse de longue durée. De ce fait, le liquide
présent dans le compartiment à solution a tendance à pénétrer dans le
compartiment à gaz. De plus, du fait que l'électrode à gaz est constituée
par un mélange comprenant principalement une matière carbonée et une
résine,- elle présente une fragilitë mécanique et a tendance à se fissurer.
Ces inconvénients ont interdit l'utilisation pratique d'une telle électrode à
gaz pour l'électrolyse d'une saumure.
Une telle configuration de cellule d'électrolyse est décrite dans la
demande de brevet FR 2 711 675 (page 2, ligne 13 à page 3 ligne 7 et
figure 1 ).
Afin de résoudre les inconvénients mentionnés plus haut, il a été
proposé dans le brevet JP-B-61-6155 de réunir une cathode à gaz et une
membrane échangeuse d'ions en une seule structure intégrale, c'est-à-dire
une cellule de type électrode é gaz/mernbrane échangeuse d'ions solidaire
sans division du compartiment cathodique.
Si les problèmes de fragilité mécanique ont été ainsi résolus, il
n'en reste pas moins que ce type de configuration de cellule présente des
inconvénients tels que notamment le changement de la membrane et de la
cathode.
Si on effectue le bilan eau dans une cellule d'électrolyse à
membrane comprenant une cathode Constituée de carbone platiné mis en
forme avec du PTFE sur une grille de nickel argenté, on constate que la
réaction électrochimique mise en jeu é la cathode-réaction ( 1 )- consomme
2 moles d'eau pour 4 moles de soude produites, soit 0,5 mole d'eau pour
une mole de soude.
La soude produite doit avoir un titre compris entre 30 et 35
sous peine de diminuer le rendement en courant en augmentant la rétro-
CA 02245144 2001-08-28
3
migration des ions hydroxyle dans la membrane, et de dégrader
physiquement la membrane. Ces spécifications sont données par les
fabricants de membrane chlore-soude, et sont valables pour tous les types
de membranes. Cela implique un apport d'eau pour diluer la soude
produite, de 4,5 moles d'eau par mole de soude (pour avoir une soude à
33 %).
Le flux électro-osmotique à travers la membrane apporte dans le
compartiment cathodique 3,5 moles d'eau par mole de Na+, lorsque la
concentration en NaCI dans le compartiment anodique est de 220 g/1.
On consomme donc 0,5 + 4,5 = 5 moles d'eau pour une mole
de soude. On apporte donc 3,5 moles d'eau par mole de soude, soit un
déficit de 1,5 moles d'eau par mole de soude dans les conditions
classiques de fonctionnement.
II a été proposé dans la demande de brevet EP 686 709 d'apporter
cette eau "manquante" sous forme de gouttelettes d'eau en suspension
dans l'oxygène (brouillard). Or, la cathode est une électrode hydrophobe,
en raison du PTFE qui sert de liant, relativement compacte. De plus
l'oxygène est en contact avec la face arrière de l'électrode. Toute l'eau
apportée par le gaz ne va pas traverser la cathode vers la membrane (à
contre-courant de la soude produite) et va donc servir à diluer la soude de
l'arrière de l'électrode et non pas à l'interface membrane/cathode. II en
résulte que la quantité d'eau disponible au contact de la membrane sera
au mieux de 3,5 moles d'eau par mole de soude, à supposer que l'eau
nécessaire à la réaction électrochimique soit apportée par le gaz. Cela
signifie que la concentration en soude à l'interface membrane/cathode
sera supérieure à 40//3,5 x 18 + 40) x 100 - 38,8 %. Dans ces
conditions, le rendement en courant est mauvais et la durée de vie de la
membrane est diminuëe.
On a maintenant trouvé un procédé d'électrolyse d'une solution
aqueuse de chlorure de sodium au moyen d'une cellule d'électrolyse à
membrane et à cathode à réduction d'oxygène comprenant une membrane
échangeuse de cations qui divise la cellule en un compartiment anodique
et un compartiment cathodique dans lequel ladite cathode est placée
directement contre la membrane échangeuse de cations, ledit
compartiment cathodique étant alimenté par un gaz humidifié contenant
de l'oxygène, caractérisé en ce que, pour obtenir une concentration
pondérale en soude entre la membrane échangeuse de cation et la
CA 02245144 2001-08-28
4
cathode inférieure à 38,8, on utilise, en tant qu'anolyte,
une solution aqueuse de chlorure de sodium ayant une
concentration en chlorure de sodium inférieure à 200 g/1
et, de préférence comprise entre 160 g/1 et 190 g/1 et en
ce que l' eau humidifiant le gaz contenant de l' oxygène est
exclusivement sous forme de vapeur d'eau.
En outre, selon la présente invention, la température du
compartiment cathodique peut être supérieure à la température du
compartiment anodique.
Selon la présente invention, la température du compartiment
cathodique peut être supérieure de 5 ° C à 20 ° C à la
température du
compartiment anodique et, de préférence supérieure de 10 ° C à 15
° C.
Le compartiment cathodique est alimenté par un gaz contenant de
l'oxygène, préalablement humidifié par barbotage dans de l'eau chauffée à
une température allant de 50°C à 100°C et, de préférence, à une
température comprise entre 80°C et 100°C.
Selon la présente invention, l'oxygène humidifié sera introduit
dans le compartiment cathodique de façon à ce que l'eau humidifiant
l'oxygène se trouve sous forme de vapeur d'eau. Ceci peut être obtenu en
maintenant la température du barboteur inférieure ou égale à celle du
compartiment cathodique.
La teneur volumique en vapeur d'eau du gaz humidifié contenant
de l'oxygène est comprise entre 10 % et 80 % et, de préférence
comprise entre 20 % et 60 %.
Le gaz contenant de L'oxygène peut être de l'air, de l'air enrichi en
oxygène ou bien encore de l'oxygène. De préférence, on utilisera de
l'oxygène. La concentration volumique en oxygène dans le gaz est moins
égale à 20 %, et, de préférence, au moins égale à 50 %.
Les gaz enrichis en oxygène, sont, de préférence, préalablement
décarbonatés.
Selon la présente invention, la concentration pondérale en soude
entre la membrane échangeuse de cations et la cathode est inférieure à
38,8 %, de préférence inférieure à 37 %. Le procédé de l'invention
présente l'avantage de conduire à un rendement en soude élevé
(rendement du courant), d'améliorer la durée de vie des membranes
échangeuses de cation et de ne pas perturber de façon significative la
tension de la cellule.
CA 02245144 2001-08-28
4a
En outre, la soude obtenue par le procédé selon la présente
invention possède une pureté équivalente à la soude obtenue selon les
procédés classiques des cathodes à dégagement d'hydrogène.
CA 02245144 1998-09-22
L'invention peut ëtre mise en oeuvre avec un dispositif tel que
décrit ci-aprés.
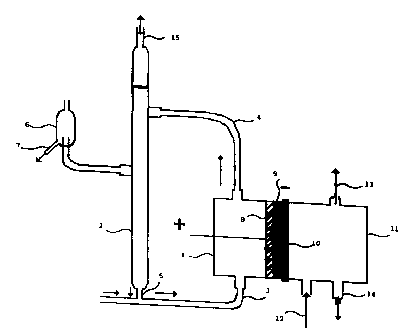
La figure 1 schématise une cellule qui est constituée de
- un compartiment anodique constitué d'un corps de cellule (1 ),
5 d'un dégazeur (2). La solution de chlorure de sodium (saumure) est
introduite par (3) et circule par gaz lift entre le corps de la cellule et le
dégazeur (conduites (4) et (5)). Un trop plein (6) permet d'éliminer par (7)
une partie de la saumure appauvrie. Des ajouts de saumure concentrée
permettent de maintenir la concentration en NaCI dans l'anolyte à la
10 valeur choisie ;
- une anode (81 qui peut être constituée par substrat en titane
revêtu de Ru02 ,
- une membrane échangeuse de cations (9),
- une cathode ( 10) placée directement contre la membrane (9), qui
15 peut être constituée d'une grille de nickel argenté recouverte de carbone
platiné,
- un compartiment cathodique (11 ) constitué d'un corps de cellule.
Le gaz humidifié contenant de l'oxygène est alimenté par le bas de la
cellule (12) et ressort en partie haute (13) dans une colonne d'eau non
20 représentée sur la figure 1 qui fixe la pression de travail. La soude est
soutirée en (14) directement au titre voulue dans le bas de la cellule.
Un capillaire placé entre le joint cathodïque et la membrane (non
représenté sur la figure 1 permet de prélever de la soude entre la
membrane et la cathode afin de mesurer sa concentration. Le chlore sort
25 en (15).
On introduit une solution aqueuse de NaCI dans le compartiment
anodique ( 1 ) par (3) à une concentration pondérale en NaCI telle que
définie précédemment et du gaz humidifié contenant de l'oxygène dans le
compartiment cathodique (11 ) par (12) ; l'eau humidifiant le gaz
30 contenant de l'oxygène étant sous forme de vapeur d'eau.
II n'y a ni ajout d'eau I!iquide, ni circulation de soude, dans le
dispositif décrit ci-dessus.
Selon la présente invention, la température de l'électrolyse est
réglée vert 80-90°C, la température du compartiment cathodique pouvant
35 être supérieure à la température du compartiment anodique.
Lorsque l'on applique une densité de courant aux électrodes, du
chlore provenant de l'électrolyse de la solution aqueuse de NaCI se
dégage dans le compartiment anodique et est évacué via (4) et ( 15), les
CA 02245144 2001-03-06
6
ions hydroxyles, formés par réduction de l'oxygène forment avec les
cations alcalins circulant à travers la membrane, de la soude.
Selon la présente invention, on opère avantageusement avec un
débit d'oxygène qui est supérieur à la consommation de la cathode. La
S température de l'eau dans laquelle barbote le gaz contenant de l'oxygène
peut être augmentée ou diminuée, de même que le débit de gaz humidifié
contenant de l'oxygène pour ajuster le titre de la soude en sortie ( 14) de
la cellule.
Les exemples qui suivent illustrent l'invention.
On utilise la cellule d'électrolyse de solution aqueuse de chlorure
de sodium tel que représentée sur la figure 1.
L'électrolyse est réalisée avec une source d'énergie qui est reliée à
l'anode ( + ) et à la cathode (-) de la cellule de façon à appliquer à la
cellule
une densité de courant i de 3 à 4 k A/mz.
1S L'anode (8) est constituée par un substrat en titane revêtu
d'oxyde de ruthénium Ru02.
La cathode ( 10) est constituée par du carbone platiné mis en
forme avec du PTFE sur une grille de nickel argenté. ( 10 % de platine sur
le carbone ; 0,56 mg de Pt par cmz).
Cette cathode est commercialisée par la Société E-TEK, Inc.
La membrane changeuse de cations (9) est une membrane Nafion*
N966, produite par la Société du Pont de Nemours.
Le gaz utilisé est de l'oxygène pur.
EXEMPLE 1 (non conforme à l'invention)
2S UTILISATION DANS LES CONDITIONS CLASSIQUES D'UNE CELLULE D'ELECTROLYSE
CHLORE-SOUDE
Conditions opératoires
Membrane Nafion~ N966 ; anode substrat de titane recouvert de
Ru02.
Température anodique = Température cathodique = 80 ° C.
Densité de courant i = 3 kA/m2.
L'oxygène est humidifié par barbotage dans de l'eau à 80°C avant
son entrée dans la cellule. Son débit est de 5 I/h.
La teneur volumique en vapeur d'eau de l'oxygène humidifié est
3S d'environ 55 %.
Concentration pondérale en NaCI dans l'anolyte = 220 g/1.
Concentration pondérale de la soude en sortie de cellule = 30 %.
* Marque de commerce
CA 02245144 1998-09-22
¿
Concentration pondérale de la soude entre la membrane et la
cathode = 40 %.
Tension de cellule = 2,2 V.
Rendement en soude - 93 % (bilan réalisé sur 24 heures de
fonctionnement continu).
On constate que le titre soude en sortie de cellule est correct,
mais le rendement est largement inférieur aux valeurs attendues avec ce
type de membrane.
EXEMPLE 2 (non conforme ~ l'invention)
1O APPORT D'EAU EN AUGMENTANT LE DEBIT D'OXYGENE
Conditions opératoires
Membrane Nafion~ N966 ; anode substrat de titane recouvert de
Ru02.
Température anodique = Température cathodique = 80 ° C.
1 S Densitë de courant i = 3 kA/mZ.
L'oxygéne est humidifié par barbotage dans de l'eau é 80°C avant
son entrée dans la cellule, son débit est doublé par rapport à l'exemple 1.
Concentration pondérale en N~ICI dans l'anolyte = 220 g/1.
Concentration pondérale de la soude en sortie de cellule -
20 28,5 %.
Concentration pondérale de la soude entre la membrane et la
cathode = 39 %.
Tension de cellule Ecell = 2,2 V.
Rendement en soude = 93,4 % (bilan réalisé sur 24 heures de
25 fonctionnement continu).
On constate que le titre soude en sortie de cellule est trop faible,
la concentration en soude à l'interface membrane/cathode est inchangée
et est élevée, le rendement quasi-identique : l'eau apportée par l'oxygène
ne traverse pas la cathode pour diluer la soude à l'interface
30 membrane/cathode, elle ne sert donc qu'à diluer la soude à l'arrière de la
cathode.
ExEMPLE 3 (conforme à l'invention)
DIMINUTION DE LA CONCENTRATION EN NACL DANS L'ANOLYTE
Conditions opératoires
35 Membrane Nafion~ N966 ; anode substrat de titane recouvert de
Ru02.
Température anodique = Température cathodique = 80°C.
Densité de courant i = 3 kA/rn2.
CA 02245144 1998-09-22
ô
L'oxygène est humidifié par barbotage dans de l'eau à 80°C avant
son entrée dans la cellule, le débit d'oxygène est identique à celui de
l'exemple 1.
Concentration pondérale en NaCI dans l'anolyte = 190 g/1.
5 Concentration pondérale de Is soude en sortie de cellule = 30 r6.
Concentration pondérale de la soude entre la membrane et la
cathode = 37,5 %.
Tension de cellule = 2,2 V.
Rendement en soude = 95,9 °~6 (bilan réalisé sur 24 heures de
fonctionssment continu).
On constate que le titre soude en sortie de cellule est inchangé, le
rendement est nettement supérieur à celui obtenu dans l'exemple 1, la
tension de cellule n'est pas perturbée.
EXEAIIIPLE 4 (conforme ~1 l'intrention)
15 Les conditions opératoires sort identiques à celles de l'exemple 3,
excepté que la concentration pondärale en NaCI dans l'anolyte est de
170 g/1.
Les résultats sont les suivants
- concentration pondérale de la soude sortie cellule : 32 %,
- concentration pondérale de la soude entre la membrane et la cathode
35 %,
- rendement en soude : 96 %.