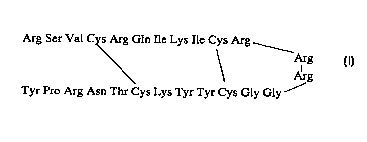Note: Descriptions are shown in the official language in which they were submitted.
CA 0224~18 1998-08-10
WO 97/30082 PCT/FR97/00295
-
Peptide antibactérien et antifongique
La présente invention a pour objet un nouveau peptide riche en protéines ayant
des propriétés antibactériennes et antifongiques, des compositions utilisables en
agriculture et en thérapie hllm~ine ou ~nim~le contenant ce peptide comme matière
active. L'invention concerne égalemPn~ des procédés de traitement des plantes ~ l'aide de
0 ces compositions ainsi que des procédés de préparation de ce peptide.
On sait de longue date que les insectes présçn~ent une résistance efficace contre
les b~t~ s- Cette défense est pour une large part basée sur la synthèse rapide de
plusieurs familles de peptides. Cette défense est due à la synthèse rapide de plusieurs
familles de peptides à large spectre d'activité. Cette synthèse est induite par une blessure
septique ou par l'injection d'une faible dose de bactéries. Parmi les peptides
antibactériens induits, les mieux caractérisés sont les cécropines et les dé~ensines
d'insectes Plusieurs autres peptides antibactériens ont été partiellement caractérisés.
A côté de la classe des in~ectes peu de choses sont connues concernant d'autres
arthropodes. Les scorpions sont des :~nim~llx plus anciens que les insectes au niveau
philogénique.
Il a maintenant été isolé, à partir d'une induction chez le scorpion Androconus
australis, un peptide, qui présente des caractéristiques remarquables ainsi que des
propriétés antibactériennes et antifongiques.
Plus particulièrement un premier aspect de l'invention concerne le peptide de
formule I:
Arg Ser Val Cys Arg Gln Ile Lys Ile Cys Arg
Arg
Arg
Tyr Pro Arg Asn Thr Cys ~ys Tyr Tyr Cys Gly Gly
Dans la suite, la molécule de formule I sera appelée androctonine. Cette molécule,
r de taille réduite, co~ ullt; de 4 résidus cystéine engagés dans deux ponts
intramoléculaires.
3s Un autre aspect de l'invention concerne un prernier procédé pour l'obtention et
l'isolement du peptide ci-dessus, qui est caractérisé en ce que successive,llent:
a) on prélève de l'hémolympe du scorpion Androctonus australis;
CA 0224~18 1998-08-10
WO 97/30082 PCT/FR97/00295
b) on effectue l'extraction par mise en contact d'hémolymphe de An~roctonus
australis obtenue précédemment avec un milieu acide sous agita~ion,
puis par centrifugation;
c) on fractionne le surnageant avec séparation par lavage des molécules
s hydrophiles et élution des molécules hydrophobes par des éléments a~p~ iés
sur colonne séparatrice
d) on purifie les extraits.
e) on caractérise le peptide.
0 L'hémolymphe est prélevée par incision cuticulaire. Elle est recueillie dans un
tube contenant un inhibiteur de protéase. Après centrifugation pour élirniner les cellules
sanguines, le plasma est stocké à -30~C.
De manière préférée la seconc~e. étape (extraction) on met en contact
l'hémolymphe de Androc~onus australis avec un rnilieu acide, con~titue d'une solution
acide d'un acide (de pH de 2). La solution peut être une solution d'un acide minéral ou
organique cornme par e~emple d'acide trifluoroacétique. L'extrait obtenu est ensuite
centrifugé à froid à une vitesse de 30.000 g à 4~C, pendant 25 min.
De manière préférée la troisième étape (fractionnement), l'extrait est déposé sur
une cartouche de phase inverse pour réaliser une extraction en phase solide. Le lavage
des molécules solubles dans l'eau est effectué avec une solution acide diluée et l'élution
des molécules hydrophobes avec un éluant ~roplié. On obtient de bons résultats avec
de l'acide trifluoroacétique pour le lavage et un éluant contenant des quantitéscroissantes d'acétonitrile en solution acide diluée.
De manière préférée la quatrième étape (purification) est effectuée avec un
éluant convenable qui peut être différent ou identique à celui de la phase préc~rlent~.
De manière préférée, dans la dernière étape (caractérisation), la nature du
peptide est analysée selon la méthode de séquençage par dégradation d' Edman (Acta
Chemica Sc~n~;n~via 10 (1956) p; 761-768). Selon cette méthode on obtient les
structures suivantes:
Arg Ser Val X Arg Gln Ile Lys Ile X Arg ~,
Ig
Arg
Tyr Pro Arg Asn Thr X Lys Tyr Tyr X Gly Gly~
Aucun signal n'était détectable dans les positions 4, 10, 16 et 20. (dégradationd'Edman). La présence de cystéines dans ces positions a été montrée par spectrométrie
de masse, la structure alors obtenue étant la ~uiv~le:
_
CA 02245518 1998-08-10
WO 97/30082 P<~ ~97IOO295
-
Arg Ser Val Cys Arg Gln Ile Lys lle Cys Arg ~
Arg
~rg
Tyr Pro Ar~ Asn Thr Cys Lys Tyr Tyr Cys Gly Gly
Les masses mesurées de l'androctonine ci-dessus sont respectivement de:
3076,65 + 0,24 Da;
Or les masses calculées sur la base des données de séquence sont respectivement
0 de:3080,65 + 0,24 Da;
Le défaut de masse correspond à la formation de deux pont disulfure
intramoléculaires .
Afin d'établir la connectivité des ponts disulfure, la molécule a été clivée par une
enzyme, l'endoprotéinase Lys-C, qui rompt la chaîne peptidique après la lysine. Les
peptides obtenus ont été isolés et la spect~ éliie de masse a montré qu'il s'agissait de
deux peptides liés par un pont disulfure. Les séquences ~le~ ites étaient Arg Ser Val
Cys Arg Gln Ile Lys plus Cys Thr Asn Arg Asn Pro Tyr et Ile Cys Arg Arg Arg Gly
Gly Cys Tyr Tyr.
La connectivité des ponts disulfure est ainsi établie et la cystéine 1 est liée à la
cystéine 4, la cystéine 2 à la cystéine 3. Ce résultat peut être schem~ticé ainsi:
Arg Ser Val Cys Arg Gln Ile Lys Ile Cys Arg
~ Arg
Arg
Tyr Pro Arg Asn Thr Cys Lys Tyr Tyr Cys Gly Gly /
Ces bonnes corrélations co~1rrnPnt les séquences proposées.
Les peptides selon l'invention peuvent également être obtenus sans dif~lculté selon
30 un second procédé, par synthèse chimique FMOC (Atherton and Sheppard R.C. (1989),
Solid Phase Peptide Synthesis (IRL, Oxford, UK) suivie d'une renaturation dans une
solution 100mM d'acétate d'ammonium à pH 8,5 pendant 24 h sous agitation à
Le~ ldlulc; ambiante. L'androctonine obtenue présente les mêmes proprietés
cl..o,l,atographiques que la molécule native et la connectivité des ponts disul~ure est
35 identique à celle de la molécule naturelle. La masse mesurée après renaturation (3076,
61 + 0,67) est très semblable à celle de la molçcule native. La molécule synthétique
présente la même activité antibactérienne que la molécllle native sur la bactérie
Micrococcus liteus.
CA 02245518 1998-08-10
WO 97/30082 PCT/FR97/00295
L'ensemble des tests antibactériens et hémolytiques est réalisé avec la moléculesynthétique.
1. L'androctonine ne présente aucun ef~et Iytique sur des hématies de porc ou deboeuf.
s 2. Ces molécules ont des propriétés antibactériennes vis-à-vis des bactéries à
Gram négatif. et à Gram négatif (cf tableau 1), des bactéries phytopathogènes et des
champignons phytopathogènes.
Les exemples suivants illustrent l'obtention et les propriétés antibactériennes des
10 peptides et des compositions selon l'invention.
F.xem~le 1: Isolem~snt et caractérisation du peptide
on procède selon les étapes suivantes:
- extraction et de purification:
L'hémolymphe (3,8 ml) est prélevée par incision de la cuticule. Elle est transférée
dans un tube maintenu au froid en présence d'un inhibiteur de protéases (aprotinine) puis
centrifugée à 30.000 g pendant 25 minutes à 4~C. Le surnageant ainsi obtenu est
imm~ tement sournis aux différentes é~tapes de la purification.
Fractionnement de l 'extrait sur cartouches Sep-Pak C18
Après dépot de l'extrait sur des cartouches Sep-Pak Clg, les molécules à caractère
hydrophile sont élimin~es par un simple lavage par S ml d'eau acid}fiée à l'acide
trifluoacétique (TFA) à 0,05%.
L'élution des molécules hydrophobes est réalisée avec des solutions à 10, 40 et
80% d'acétonitrile en eau acidifiée (TFA 0,05%, 5 rnl par cartouche).
Les fractions recueillies sont dénommées "P.lution 10%", "Elution 40%" et
"Elution 80%" et concentrées sous vide. Les fractions sont ensuite reconctit~ es avec de
l'eau qualité HPLC avant l'analyse en HPLC.
Puri~cation par HPLC des molécules à activi~é antibact~rienne
première ~tape:
La fraction "Elution 40% est analysée sur une colonne de phase inverse
Aquapore OD 300 Clg avec un gradient linéaire d'acétonitrile de 2 à 52% dans l'eau
acidifiée (TFA à 0,05%) en 90 min1~tes (soit une ~llgmP.nt~tion de 0~44% d'acétonitrile
par rninute) pour un débit de 1 rnl/rnin.
Les fractions actives res~lt~ntes sont ensuite purifiées sur une colonne "High
35 Plcssu~t Inert" (HPI) Delta Pak C18 (150*3~9 mm).
L'élution est réalisée daTls un gradient linéaire biphasique d'acétonitrile de 2 à
11% dans l'eau acidifiée (HCl 6mM) en 10 minl~tes et de 11 à 21% en 50 rnin à un débit
de 1 ml/min. La pureté de la fraction active est contrôlée par électrophorèse c~pi11~ire
CA 022455l8 lsss-os-lo
WO 97/30082 PCT~R97/00295
avant la détermination de la sé~uence par dégradation d'Edman et analyse en
spectrométrie de masse.
Exemple 2: Test in vitro: Mesure de l'activité antibactérienne par
s rnicrospectrophotométrie
Pur chaque souche de bactérie utilisée (E.coli; M.luteus) une colonne isolée estmise en suspension dans 10 ml de milieu PB (Poor Broth, milieu Luria Bertani
dépourvu d'extrait de levure) DIFCO et incubée à 30~C pendant une nuit sous agitation
lente.
Les bactéries à tester sont r~men~es à une densité optique à 600 nm de 0,001
dans un milieu de culture ~rais. On dépose 10111 de chaque ~raction dasn des pla~ues de
microtitration en présence de 100 111 de la suspension bactérienne. Au bout de 24 heures
d'incibation à 25~C, on évalue la croissance par la mesure de l'absorbance à 600 nm à
l'aide d'un lecteur de plaque de microtitration.
Dans ces conditions on observe une inhibition à 50% aux concentrations,
exprimées en ,uM, indiquées dans le tableau suivant:
Tableau 1
I i~ I I iÇ~ l l ~ $i~1
I 111 iI ~111 I ! ~1 1_1~1 Gram androctonin
~ ~ ~ ~ ~ ~ _ _~
1~ I 5~11 E I _I _ 1l "
! 1~ ~ ~ ~ ~ l _ ~_ Tr~ ''
~ I! ~ ~ I I 1~1111 MIC (11M)
ri ..... . ,~
Micrococcus luteus + 0,6-1,5
Aerococcus viridans + 0,3-0,6
Bacillus subtilis + 1,5-3,0
Staphylococcus aureus + 15-30
Clavibacter michi ganensis + 6-15
~scherichia coli D22 - >30
Escherichia.coli D31 - 3-6
Escherichia.coli 1106 - 6-15
Salmonella typhimurium - 3-6
.
En llt~ nt le même protocole mais avec des bactéries phytopathogènes, on
obtient les résultats suivants:
CA 02245518 1998-08-10
PCT/E'R97/00295
WO 97130082
Tableau 2
Clavibacter michiganensis 6-15
Pseudomonas syringae 0,5-1
Pseudomonas syringae pv syringae 15-22
Pseudomonas pisi 6-15
Pseudomonas maculicola 3-6
Pseudomonas valerianella 15-22
Pseudomonas syr phaseoli 2-4
Xanthomonas campestris pv campestris 3-6
Xanthomonas vesicatoria 687.3 1,5-3
Xanthomonas vesicatoria B229RI 1,5-3
Xanthomonas phaseolica 1-2
5En utilisant le même protocole mais avec des champignons phytopathogènes, on
obtient les résultats suivants:
Tableau 3
~_____
~@ l . =~ _ androctonine
li ~511 ~11 I ~ l ~1 ~
~ ~ ~i ~ 3~ ~ ~11 I l ~.: .~. MIC (~M)
rll~mri~nons ~ ,s~
Alternaria dauci 4,1-8,216-32
Stemphyllium 4-8 16-32
Fusarium oxysporum L 2-4 > 32
Verticilium toreillis 24 > 32
Botrytis petuniae 4-8 > 32
Fusarium oxysporum meloni 2-4
* milieu supplémenté avec lmM CaC12 et 20 rnM KCI
Pa~ni les cultures pouvant faire l'objet d'un l~ te~ ntil ~ ;P -~ à l'aide d'un
composé selon l'invention, on peut citer à titre d'exemples le riz, les céréales,
n~ lellt le blé et l'orge, ainsi que les plantes arboricoles, fruitières, légurnières.
-
CA 0224~18 1998-08-10
WO 97/30082 PCT/E R97/00295
Parmi les cultures pouvant faire l'objet d'un Traitement antifongiques à l'aide d'un
composé selon l'invention, on peut citer, à titre d'exemples, les cucurbitacées, les
cultures florales (pétunia), et les cultures maraîchères (carottes, tomates, choux).
s Ces résultats montrent l'excellente activité antibactérienne du peptide selon
l'invention, qui peut s'appliquer aux domaines hllm~in, animal et végétal.
La présente invention a également pour objet des compositions, utilisables commeagents antibactériens, contenant comme matière(s) active(s) un (ou plusieurs) composé
selon l'invention tel que décrit précéd~mm~nt en mélange avec les supports solides ou
liq~ lPc, acceptables en ~gric~lltllre et les agents tensio-actifs également acceptables en
~TgnclllT~Tlre. En particulier sont utilisables les supports inertes et usuels et les agents
tensio-actifs usuels. Ces compositions recouvrent non seulemPnt les compositions prêtes
à être appliquées sur la culture à traiter au moyen d'un dispositif adapté, tel qu'un
dispositif de pulvérisation, mais ég~lem~nt les compositions concentrées commerciales
IS qui doivent être diluées avant application sur la culture.
Ces compositions peuvent contenir aussi toute sorte d'autres ingrédients tels que,
par exemple, des colloides protecteurs, des ~lh~sifs7 des ép~i~.ci~s~nt~ des agents
thixotropes, des agents de pénétration, des stabilisants, des séquestrants, etc... Plus
généralement les composés utilisés dans l'invention peuvent être combinés à tous les
20 additifs solides ou liquides correspondant aux techniques habituelles de la mise en
f~Tnn~ tion.
D'une façon générale, les compositions selon l'invention contiennent
habituellement de 0,05 à 9S % environ (en poids) d'un composé selon l'invention
(appelé par la suite matière active), un ou plusieurs supports solides ou liquides et,
25 évent-~ellement, un ou plusieurs agents tensioactifs.
Par le terrne "' U~JpOl i", dans le présent exposé, on désigne une matière organique
ou minérale, naturelle ou synthétique, avec laquelle le composé est combiné pourfaciliter son application sur la plante, sur des graines ou sur le sol. Ce support est donc
généralement inerte et il doit être acceptable en agriculture, notamment sur la plante
30 traitée. Le support peut être solide (argiles, silicates naturels ou synthétiques, silice,
résines, cires, engrais solides, etc...) ou liquide (eau, alcools, notamment le butanol
~, etc.. ).
LTagent tensioactif peut être un agent émulsionnant, dispersant ou mouillant de
type ionique ou non ionique ou un mélange de tels agents tensioactifs. On peut citer par
3s exemple des sels d'acides polyacryliques, des sels d'acides lignosulfoniques, des sels
d'acides phénolsulfoniques ou napht Tlen~ulfoniques, des polycon(lenT~Tt~ d'oxyde
d'éthylène sur des alcools gras ou sur des acides gras ou sur des amines grasses, des
phénols substitués (nv~nlllent des alkylphénols ou des ~lphénols), des sels d'esters
CA 0224~18 Iggs-os-lo
Wo 97/30082 PCT/FR97/00295
d'acides sulfosucciniques, des dérivés de la taurine (notarnment des alkyltaurates), des
esters phosphoriques d'alcools ou de phénols polyoxyéthylés, des esters d'acides gras et
de polyols, les dérivés à fonction sulfates, sulfonates et phosphates des composés
précédents. La présence d'au moins un agent tensioactif est générz~lemen~ indispensable
s lorsque le composé et/ou le support inerte ne sont pas solubles dans l'eau et que l'agent
vecteur de l'application est l'eau.
Ainsi donc, les compositions à usage agricole selon l'invention peuvent contenirles matières actives selon l'invention dans de très larges limites, allant de 0,05 % à 95 %
(en poids). Leur teneur en agent tensio-actif est avantageusement comprise entre 5 % et
lo 40 % en poids.
Ces compositions selon l'invention sont elles-mêmes sous des formes assez
diverses, solides ou liquides.
Cornme formes de compositions solides, on peut citer les poudres pour poudrage
(à teneur en composé pouvant aller jusqu'à 100 %) et les granulés, notamment ceux
obtenus par extrusion, par compactage, par imprégnation d'un suppo~t granulé, par
granulation à partir d'une poudre (la teneur en composé dans ces granulés étant entre 0,5
et 80 % pour ces derniers cas), les co~ s ou tablettes effervescents.
Le peptide selon l'invention peuvent encore être utilisés sous ~orme de poudres
pour poudrage; on peut aussi utiliser une composition comprenant 50 g de matièreactive et 950 g de talc; on peut aussi utiliser une composition comprenant 20 g de
matière active, 10 g de silice finement divisée et 970 g de talc; on mélange et broie ces
constituants et on applique le mélange par poudrage.
Comme formes de compositions liquides ou ~lestin~oçs à constituer des
2s cc,~ osiLions liquides lors de l'application, on peut citer les solutions, en particulier les
concentrés solubles dans l'eau, les concentrés émulsionnables, les émulsions, les
suspensions concentrées, les aérosols, les poudres mouillables (ou poudre à pulvériser),
les pâtes, les gels.
Les concentrés émulsiorln~hles ou solubles colllp~ ment le plus souvent 10 à 80
% de matière active, les émulsions ou so}utions prêtes à l'application contenant, quant à
elles, 0,001 à 20 ~o de matière active.
En plus du solvant, les concentrés émulsionnables peuvent contenir quand c'est
n~cess~ ;, 2 à 20 % d'additifs a~pluplics comrne les stabilis~n~s, les agents tensio-
actifs, les agents de pénétration, les inhibiteurs de corrosion, les colorants ou les
s~flh~.~sifs précédellllllenl cités.
A partir de ces concentrés, on peut obtenir par dilution avec de l'eau des émulsions
de toute concentration désirée, qui conviennent particulièrement à l'application sur les
cultures.
CA 02245518 1998-08-10
WO 971~,0082 PCT/E~97/00295
A titre d'exemple, voici la composition de quelques concentrés émulsionnables:
F.xem~le CF 1:
- matière active 400 g/l
s - dodécylbenzène sulfonate alcalin 24 g/l
. - nonylphénol oxyéthylé à 10 molécules
d'oxyde d'éthylène 16 g/l
- cyclohexanone 200 g/l
- solvant aromatique q.s.p. 1 litre
Selon une autre formule de concentré émulsionnable, on utilise:
F.xemple CE 2
- matière active 250 g
- huile végétale époxydée 25 g
- mélange de sulfonate d'alcoylaryle et
d'éther de polyglycol et d'alcools gras 100 g
- diAndhylfo~ mifl~ 50 g
- xylène 575 g
Les suspensions concentrées, également applicables en pulvérisation, sont
préparées de manière à obtenir un produit fluide stable ne se déposant pas et elles
contiennent habituellement de 10 à 75 % de matière active, de 0,5 à 15 % d'agents
2s ten~io~tif~, de 0,1 à 10 % d'agents thixotropes, de 0 à 10 % d'additifs a~l~p.iés,
comme des anti-mousses, des inhibiteurs de corrosion, des stabili~nt~, des agents de
pénétration et des ~-lh~ if~ et, comme support, de l'eau ou un liquide organique dans
lequel la matière active est peu ou pas soluble: certaines matières solides organiques ou
des sels minéraux peuvent être dissous dans le support pour aider à empêcher la
sédimentation ou comme antigels pour l'eau.
A titre d'exemple, voici une composition de suspension concentrée:
Exe~?le SC 1:
3s - matière active 500 g
- phosphate de tlisLyly~hénol polyéthoxylé 50 g
- alkylphénol polyéthoxylé 50 g
- polycarboxylate de sodium 20 g
CA 0224~18 1998-08-10
WO 97130082 PCT/FR97/00295
- éthylène glycol 50 g
- huile organopolysiloxanique (antimousse) l g
- polysaccharide l,S g
-eau 316,5g
s
Les poudres mouillables (ou poudre à pulvériser) sont habituellement préparées de
manière qu'elles contiennent 20 à 9S % de matière active, et elles contiennent
habituellement, en plus du support solide, de 0 à 30 % d'un agent mouillant, de 3 à 20 %
d'un agent dispersant, et, quand c'est nécess~ire, de 0,1 à 10 % d'un ou pl~lcieurs
10 stabilisants et/ou autres ~ litif~, cornme des agents de pénétration, des a~lh~tfc, ou des
agents antimottants, colorants, etc...
Pour obtenir les poudres à pulvériser ou poudres mo~ les, on mélange
intim~lnent les matières actives dans les mélangeurs a~pr ,p~iés avec les substances
additionnelles et on broie avec des moulins ou autres broyeurs a~ u~liés. On obtient
15 par là des poudres à pulvériser dont la mouillabilité et la mise en suspension sont
avantageuses-; on peut les mettre en suspension avec de l'eau à toute concentration
désirée et ces suspensions sont utilisables trés avantageusement en particulier pour
l'application sur les feuilles des végétaux.
A la place des poudres mouillables, on peut réaliser des pâtes. Les conditions et
20 modalités de réalisation et d'utilisation de ces pates sont semblables à celles des poudres
mouillables ou poudres à pulvériser.
A titre d'exemple, voici diverses compositions de poudres mouillables (ou poudres
à pulvériser):
Exemple PM 1
- matière active 50%
- alcool gras éthoxylé (agent mouillant) 2,5%
- phényléthylphénol éthoxylé (agent dispersant) 5%
- craie (support inerte) 42,5%
F.xemple PM 2:
- matière active 10%
- alcool synthétique oxo de type ramifié, en
C13 éthoxylé par 8 à 10 oxyde d'éthylène
(agent mouillant) 0,75%
- lignosulfonate de calcium neutre (agent
dispersant) 12%
- carbonate de c~lcil~m (charge inerte) q.s.p. 100 %
CA 02245518 1998-08-10
Wo 97/30082 PCT/FRs7/00295
11
Exemple PM 3: - ~
Cette poudre mouillable contient les mêlrles ingrédients que dans l'exemple
précédent, dans les proportions ci-après:
- matière active 75~O
- agent mouillant 1,50%
- agent dispersant 8%
- carbonate de calcium (charge inerte) q.s.p. 100%
~3xemple PM 4:
- matière active 90%
- alcool gras éthoxylé (agent mouillant) 4%
- phényléthylphénol éthoxylé (agent dispersant) 6%
~xem~ple PM 5:
- matière active 50%
- mélange de tensio-actifs anioniques et
non ioniques (agent mouillant) 2,5%
- lignosulfonate de sodium (agent dispersant) 5%
- argile k~olinique (support inerte) 42,5%
Les dispersions et émulsions aqueuses, par exemple les compositions obtenues en
diluant à l'aide d'eau une poudre mouillable ou un concentré émulsionnable selonl'invention, sont comprises dans le cadre général de la présente invention. Les émulsions
25 peuvent être du type eau-dans-l'huile ou huile-dans-l'eau et elles peuvent avoir une
con~i~t~n~e épaisse cornme celle d'une "mayonnaise".
Les composés selon l'invention peuvent être forrnulés sous la forme de granulés
dispersibles dans l'eau également compris dans le cadre de l'invention.
Ces granulés dispersibles, de densité al~arente génér~lemPnt comprise entre
30 environ 0,3 et 0,6 ont une climPn~ion de particules généralement comprise entre environ
150 et 2000 et de ~l-,r~lGnce entre 300 et 1500 microns.
La teneur en matière active de ces granulés est génér~lem~nt comprise entre
environ 1 % et 90 %, et de préférence entre 25 % et 90 %.
Le reste du granulé est essentiellement composé d'une charge solide et
3s évçnt-lellemP-nt d'adjuvants tensio-actifs conférant au granulé des ~lo~;ctés de
rli.cper~ihiTit~ dans l'eau. Ces granulés ~euvGn~ être essentielle-mpnt de deux types
tinrtc selon que la charge retenue est soluble ou non dans l'eau. Lorsque la charge est
hydrosoluble, elle peut être minérale ou, de préférence, organique. On a obtenu
CA 0224~18 1998-08-10
WO 97/30082 PCT/FR97/00295
t2
d'excellents résultats avec l'urée. Dans~le cas d'une charge insoluble, celle-ci est de
préférence rninérale, comme par exemple le kaolin ou la bentonite. Elle est alors
avanta~eusement accompagnée d'agents tensio-actifs (à raison de 2 à 20 % en poids du
granulé) dont plus de la moitié est, par exemple, constituée par au moins un agent r
5dispersant, essentiellement anionique, tel qu'un polynaphtalène sulfonate alcalin ou
alcalino terreux ou un lignosulfonate alcalin ou alcalino-terreux, le reste étant constitué
par des mouillants non ioniques ou anioniques tel qu'un alcoyl naphtalène sulfonate
alcalin ou alcalino-terreux.
Par ailleurs, bien que cela ne soit pas indispensable, on peut ajouter d'autres
10a.ljuv~lts tels que des agents anti-mousse.
Le granulé selon l'invention peut être préparé par mélange des ingrédients
n~cess~i.cs puis granulation selon plusieurs techniques en soi connues (drageoir, lit
fluide, ~tomiceur, extrusion, etc...). On termine généralement par un concassage suivi
d'un f~micsl~e à la ~lim~ncion de particule choisie dans les limites mentionnées ci-
15 dessus. On peut encore utilisé des granulés obtenus comme précédemment puis
imprégnés avec une composition contenant la matière active.
De préférence, il est obtenu par extrusion, en opérant comme indiqué dans les
exemples ci-après.
Fxerr~l?le GI)l: Gr~nulés dispersibles
Dans un mélangeur, on mélange 90 % en poids de matière active et 10 % d'urée
en perles. Le mélange est ensuite broyé dans un broyeur à broches. On obtient une
poudre que l'on humidi~1e avec environ 8 % en poids d'eau. La poudre humide est
e~trudée dans une extrudeuse à rouleau perforé. On obtient un granulé qui est séché,
25 puis concassé et tamisé, de façon à ne garder r~"~e~;livement que les granulés d'une
dimension c~ " i~e entre 150 et 2000 microns.
F.xemple Gl:)2: Granulés dispersibles
Dans un mélangeur, on mélange les conctitll~ntc SuivdlltS:
- matière active 75%
- agent mouillant (alkyln~pht~lène sulfonate de sodium) 2%
- agent dispersant ~polynaphtalène sulfonate de sodium) 8% t
- charge inerte insoluble dans l'eau (kaolin) 15%
3s Ce mélange est granulé en lit fluide, en présence d'eau, puis séché, concassé et
tamisé de manière à obtenir des granulés de l1imt~ncion ct~mrrice entre 0,15 et 0,80 mm.
Ces granulés peuvent etre utilisés seuls, en solution ou dispersion dans de l'eau de
,~lanièle à obtenir la dose cherchée. Ils peuvent aussi être utilisés pour ~ré~ r des
-
CA 0224~l8 l998-08-lO
WO 97/3{~082 PCT/l~g7/00295
13
associations avec d'autres matières actives, notamment antibactériens, ces dernières
étant sous la forme de poudres mouillables, ou de granulés ou suspensions aqueuses.
En ce qui concerne les compositions adaptées au stockage et au transport, elles
contiennent plus avantageusement de 0,5 à 95 % (en poids~ de substance active.
J L'invention concerne ég~lem~o.nt un procédé pour le traitement antibactérien
thérapeutique pour l'homme ou l'animal par ~rimini.ctration d'une dose efficace du
peptide selon l'invention, sous forme libre ou, le cas échéant, sous forme de sels
d'addition avec un acide, de sels Andalliques ou de sels d'addition avec une base
o ph~ eutiquement acceptables, à l'état pur ou sous forme d'une composition dans
laquelle il est associé à tout autre produit ph~rm~ceutiquement compatible, pouvant être
inerte ou physiologiquement actif. Les mP-lic~mP.ntc selon l'invention peuvent être
~lminictrés par voie orale, parentérale, rectale ou topique.
Comme compositions solides pour ~lmini~ctration orale peuvent être utilisés des
comprimés, pilules, poudres (noLa~ ent dans des capsules de gélatine ou des cachets~
ou granulés. Dans ces compositions, le produit actif selon l'invention est mélangé à un
ou plusieurs ~ nts inertes, tels que amidon, cellulose, saccharose, lactose ou silice.
Ces compositions peuvent également comprendre des substances autres, par exempleun ou plusieurs lub}ifiants tel que le stéarate de m~gnPcillm ou la talc, un colorant, un
enrobage(dragées) ou un vernis.
Comme compositions liquides pour a-lmini.ctration orale, on peut utiliser des
solutions, des suspensions, des émulsions, des sirops, et des élixirs ph~rrn~ eutiquement
acceptable conten~nt des ~ ntc inertes tels que l'eau? l'éthanol, le glycérol, les huiles
végétales ou l'huile de paraffine. Ces compositions peuvent également comprendre des
substances autres, par exemple des produits mouillants, édulcorants, ép~ ics~nt.c,
arom~tic~ntc ou stabili.c~ntc .
Les compositions stériles pour ~-lminictration parentérale peuvent être de
plc~ré~Gllce des solutions aqueuses ou non aqueuses, des suspensions ou des émulsions.
Comme solvant ou véhicule, on peut employer l'eau, le propylèneglycol, un
polyéthylène glycol, des huiles végétales, en particulier l'huile d'olive? des esters
organiques convenables. Ces compositions peuvent ég~ mpnt contenir des adjuv~lL~,
en particulier des agents mouillants, isotonisants, çmlll.cifi~nfc, dispersants et
stabilisants. La stérilic~ti~ n peut se faire de dirr~iclltes façons, par exemple par filtration
aseptisante, en incorporant à la composition des agents st~rili.c~nt.c, par irradiation ou par
ch~llff~ge. Elles peuvent être ég~lçm~nt ~é~a,~cs sous forme de compositions solides
stériles, qui peuvent être dissoutes au momPnt de l'emploi dans un milieu stérile
injectable.
. CA 0224~l8 l998-08-lO
WO 97B0082 PCT/1i~97/00295
14
Les compositions pour a~lminictration rectale sont les suppositoires ou les
capsules rectales, qui contiennent, outre le peptide actif, des excipients tels que le beurre
de cacao, des glycérides semi-synthétiques ou des polyéthylène glycols.
Les compositions stériles pour ~imini~tration topique peuvent être par exemple
5 des crèmes, pomm~ s, lotions, collyres, collutoires, gouttes nasales ou aérosols.
En thérapeutique humaine, le peptide selon l'invention est particulièrement utile
dans les traitement antibactériens. Les doses dépendent de l'effet recherché et de la
durée du traitement; elles sont généralment comprises entre 50 et 1000 mg par jour par
voie orale pour un adulte en une ou plusieurs perises.
D'une façon générale, le médecin ~1éte-rminera la posologie qu'il estime la plusa~ opl;GG en fonction de l'âge, du poids et de tous les autres facteurs propres au sujet à
traiter.
Les exemples suivants sont donnés à titre non limit~tif illustrent les
compositions selon l'invention.
Exemple A:
On prépare, selon la technique habituelle, des co-ll~lhllés dosés à 50 mg de
peptide actif ayant la composition suivante:
- peptide androctonine M1 50 mg
- amidon 60 mg
- lactose 50 mg
- stéa;ate de magnésium 2 mg
E;xemple B:
On prépare une solution injectable contanant 20 mg de peptide actif ayant
la composition suivante:
- peptide androctonine M 2 22,4 mg
- eau distillée q.s.p. 2 cm3