Note: Descriptions are shown in the official language in which they were submitted.
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97/00364
1
COMPOSES APPARENTES A LA FAMILLE DES AMIDINIUMS,
COMPOSITIONS PHARMACEUTIQUES LES CONTENANT ET LEURS
APPLICATIONS
La présente invention concerne de nouveaux composés apparentés à la famille
des amidiniums dont en particulier les guanidiniums, des compositions
pharmaceutiques les contenant et leurs applications.
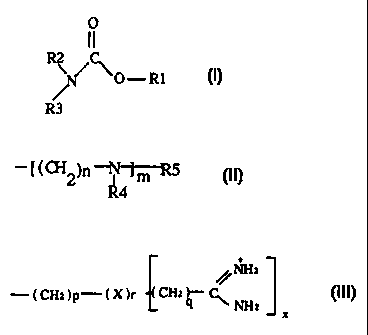
Plus précisément, la présente invention se rapporte à des composés de formule
générale I et leurs sels
O
R2
~O-R1
R3 I
dans laquelle:
- Rl représente un dérivé du cholestérol ou un groupement alkyle amino -
NR'R" avec R' et R" représentant indépendamment fun de (autre un radical
aliphatique, saturé ou non, linéaire ou ramifié en C12 à C22,
R2 et R3 représentent indépendamment fun de l'autre un atome d'hydrogène ou
un groupement de formule générale II avec au moins fun d'entre eux différent
d'un
atome d'hydrogène,
_ L (CH2)n-iV'~5
R4 II
dans laquelle:
- n et m représentent indépendamment fun de l'autre et de manière distincte
entre les groupements R2 et R3 un entier compris entre 0 et 4,
CA 02248186 2004-08-16
2
- R4 et R5 représentent indépendamment l'un de l'autre un atome
d'hydrogène ou un groupement de formule Ill, où au moins R4 ou R5 est
différent de l'hydrogène
NHa
- ( CHa )p ( X )r CHa )- C~
q NHa
x
dans laquelle
p et q représentent, indépendamment l'un de l'autre, un entier compris
entre 0 et 4 et r est égal à 0 ou 1, quand r est égal à 1
X représentant un groupement NH et x étant alors égal à 1 ou
X représentant un atome d'azote et x étant alors égal à 2 et
avec p, q et r pouvant varier indépendamment entre les groupements R4
et R5.
A titre de sous-famille préférée, on citera plus particulièrement dans le
cadre de la présente invention les composés de formule générale I dans
laquelle R2 ou R3 représentent, indépendamment l'un de l'autre, un atome
d'hydrogène ou un groupement de formule IV
NI-i2
_' C ( ~~ )n ~ m ( CHI p~ N
dans laquelle
IV
n, m et p sont définis comme précédemment et R4 représente un atome
d'hydrogène ou un groupement de formule
CA 02248186 2004-08-16
3
NHa
- ( CHa ) - (NHr- Cy NHa
P
V
avec p et r définis comme précédemment,
et avec m, n, p, q et r pouvant varier de manière indépendante entre les
différents groupements R2 et R3.
Ces nouveaux produits de formule générale (I) peuvent se présenter sous
forme de sels non toxiques et pharmaceutiquement acceptables. Ces sels non
toxiques comprennent les sels avec les acides minéraux (acides chlorhydrique,
sulfurique, bromhydrique, phosphorique, nitrique) ou avec !es acides
organiques
(acides acétique, propionique, succinique, maléfique, hydroxymaléique,
benzôique, fumarique, méthanesulfonique ou oxalique) ou avec les bases
minérales (soude, potasse, lithine, chaux) ou organiques (amines tertiaires
comme la triéthylamine, la pipéridine, la benzylamine).
A titre représentatif des composés selon l'invention on peut plus
particulièrement citer les composés de sous-formules générales suivantes:
(H~N)~'' C- NH - (CH2)~ -NH -COO- Rl VI
[(H~N)2+ C- NH - (CH~)3 ] [(H~N)~ C+- NH - (CH2)a ] -N-COO - RI VII
[(H~N)~+ C- NH - (CH~)~ ] ~- N-( CH~2 -NH -COO- R1 VIII
[(HZN)2t C- (CHa)a ] ~ N - COO ~ R1 IX
[ [(HzN)~+ C- (CH2)z ] a- N-( CH~)2] ZN - COO - R1 X
dans lesquelles Rl possède la définition précédente.
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97/00364
4
A titre représentatif des guanidiniums et amidiniums revendiqués, on peut plus
particulièrement citer les composés des sous formules précédentes VII ,VIII et
IX
avec Rl y représentant un groupement cholestéryle. Les trois composés seront
respectivement identifiés ci-après sous la désignation BGSC ( Bis Guanidino
Spermidine Cholesterol ) et BGTC ( Bis Guanidino Tren Cholesterol) et BADC
(bis
chlorhydrate de Bis Amidinium Diéthylènetriamine Cholesterol ).
Les composés revendiqués sont tout particulièrement intéressants sur le plan
thérapeutique pour leurs caractères non toxiques et leur propriétés
amphiphiles.
Compte -tenu de ces qualités, il peuvent notamment être utilisés pour la
complexation
d'acides nucléiques dans la perspective d'une transfection cellulaire de ceux-
ci. Ces
composés peuvent donc être avantageusement employés en thérapie génique.
Les composés VII (BGSC) et VIII (BGTC) sont tout particulièrement
avantageux pour le transfert de gène in vivo. Ces deux composés se complexent
avec
l'ADN et le protègent contre la dégradation due aux variations de pH lors du
transport
vers la cellule à traiter.
L'invention concerne donc une composition pharmaceutique qui comprend au
moins un composé selon l'invention. Dans un mode de réalisation préféré de
(invention
le composé est le Bis Guanidino Spermidine Cholesterol (BGSC) et dans un autre
mode préféré le composé est le Bis Guanidino Tren Cholesterol (BGTC).
La thérapie génique a pour principal objectif de corriger des maladies
génétiques associées à un défaut d'expression et/ou une expression anormale,
c'est à
dire déficiente ou excessive, d'un ou plusieurs acides nucléiques. On tente de
suppléer
à ce type d'anomalies génétiques par le biais de l'expression cellulaire in
vivo ou in
vitro de gènes clonés.
Aujourd'hui, plusieurs méthodes sont proposëes pour la délivrance
intracellulaire de ce type d'information génétique. L'une des technologies
actuellement
mises en oeuvre, repose précisément sur (emploi de vecteurs chimiques ou
biochimiques. Ces vecteurs synthétiques ont deux fonctions principales,
compacter
CA 02248186 1998-08-27
WO 97131935 PCT/FR97/00364
(ADN à transfecter et promouvoir sa fixation cellulaire ainsi que son passage
à travers
Ia membrane plasmique et, Ie cas échéant, à travers les deux membranes
nucléaires.
Des lipides cationiques chargés positivement comme le chlorure de N-[1-(2,3-
dioleyloxy)propyl)-N,N,N-triméthylammonium (DOTMA) ont ainsi ëté proposés.
5 Avantageusement, ils interagissent, sous la forme de liposomes ou de petites
vésicules, spontanément avec de l'ADN, qui est lui chargé négativement, pour
former
des complexes lipides-ADN, capables de fusionner avec les membranes
cellulaires, et
permettent ainsi la délivrance intracellulaire de l'ADN. Toutefois, dans le
cas
particulier du DOTMA, sa bonne efficacité au niveau de la transfection demeure
malheureusement associée à un défaut de biodégradabilité et un caractère
toxique à
(égard des cellules.
Depuis le DOTMA, d'autres lipides cationiques ont été développés sur ce
modèle de structure : groupe lipophile associé à un groupement amino via un
bras dit
"spacer". Parmi ceux-ci, on peut plus particulièrement citer ceux comprenant à
titre de
groupement lipophile deux acides gras ou un dérivé du cholestérol, et
comportant, en
outre, le cas échéant, à titre de groupement amino, un groupement d'ammonium
quaternaire. Les DOTAP, DOBT ou le ChOTB peuvent notamment être cités à titre
représentatifs de cette catégorie de lipides cationiques.
De part leur structure chimique et leur caractère biodégradable, les composés
revendiqués répondent précisément aux exigences requises pour un vecteur de
transfection d'acides nucléiques.
La présente invention vise donc également toute application de ces nouveaux
composés dans la transfection in vitro, ex vivo et/ou in vivo de cellules et
notamment
pour la vectorisation d'acides nucléiques. Elle se rapporte en particulier à
toute
composition pharmaceutique comprenant, outre au moins un composé selon
(invention, un acide nucléique.
Dans les compositions de la présente invention, (acide nucléique associé à au
moins un composé revendiqué peut être aussi bien un acide désoxyribonucléique
qu'un
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97/00364
6
acide ribonucléique. Il peut s'agir de séquences oligonucléotidiques ou
polynucléotidiques d'origine naturelle ou artificielle, et notamment d'ADN
génomique,
d'ADNc, d'ARNm, d'ARNt, d'ARNr, de séquences hybrides ou de séquences
synthétiques ou serai-synthétiques. Ces acides nucléiques peuvent être
d'origine
humaine, animale, végétale, bactérienne, virale, etc. Ils comportent de
préférence un
gène thérapeutique.
Un autre objet de (invention porte donc sur une composition pharmaceutique
contenant en outre un acide nucléique. Préférentiellement cet acide nucléique
est soit
un acide désoxyribonucléique soit un acide ribonucléique. Dans un mode préféré
de
réalisation de l'invention l'acide nucléique comporte un gène thérapeutique.
Au sens de (invention, on entend par gène thérapeutique notamment tout
gène codant pour un produit protéique ayant un effet thérapeutique. Le produit
protéique ainsi codé peut être une protéine, un peptide, etc. Ce produit
protéique peut
être homologue vis-à-vis de la cellule cible (c'est-à-dire un produit qui est
normalement exprimé dans la cellule cible lorsque celle-ci ne présente aucune
pathologie). Dans ce cas, l'expression d'une protéine permet par exemple de
pallier une
expression insuffisante dans la cellule ou (expression d'une protéine inactive
ou
faiblement active en raison d'une modification, ou encore de surexprimer
ladite
protéine. Le gène thérapeutique peut aussi coder pour un mutant d'une protéine
cellulaire, ayant une stabilité accrue, une activité modifiée, etc. Le produit
protéique
peut également être hétérologue vis-à-vis de la cellule cible. Dans ce cas,
une protéine
exprimée peut par exemple compléter ou apporter une activité déficiente dans
la
cellule, lui permettant de lutter contre une pathologie, ou stimuler une
réponse
immunitaire.
CA 02248186 2004-08-16
7
Parmi les produits thérapeutiques au sens de la présente invention, on peut
citer plus particulièrement les enzymes, les dérivés sanguins, Ies hormones,
Ies
lymphokines : interleukines, interférons, TNF, etc (FR26885141, facteurs de
croissance, Ies neurotransmetteurs ou leurs précurseurs ou enzymes de
synthèse, Ies
facteurs trophiques : BDNF, CNTF, NGF, IGF, GMF, aFGF, bFGF, NT3, NTS,
HARP/pléiotrophine, etc Ia dystrophine ou une rninidystrophinè (~'R268I7.86) ,
la
protéine CFTR associée à Ia mucoviscidose, les gènes suppresseurs de tumeurs :
p53,
Rb, RaplA, DCC, k-rev, e.~c (FR2704234.) , les gênes codant pour des facteurs
impliqués dans la coagulation : Facteurs VII, VIII, IX, les gènes intervenant
dans la
réparation de (ADN, Ies gènes suicides (thymidine kinase, cytosine déaminase),
Ies
gènes de (hémoglobine ou d'autres transporteurs protéiques, les gènes
correspondant
aux protéines impliquées dans le métabolisme des lipides, de type
apolipoprotéine
choisie parmi les apolipoprotéines A-I, A-II, A-IV, B, C-I, C-II, C-III, D, E,
F, G, H,
J et apo(a), les enzymes du métabolisme comme par exemple la lipoprotéine
lipase, Ia
lipase hépatique, la lécithine cholestérol acyltransférase, la 7 alpha
cholestérol
hydroxylase, la phosphatidique acide phosphatase, ou encore des protéines de
transfert de lipides comme la protéine de transfert des esters de cholesterol
et la
protéine de transfert des phospholipides, une protéine de liaisons des HDL ou
encore
un récepteur choisi par exemple parmi les récepteurs LDL, récepteurs des
chylornicrons-remnants et les récepteurs.scavenger.etc.
L'acide nuclëique thérapeutique peut également être un gëne ou une séquence
antisens. dont l'expression dans la cellule cible permet de contrôler
(expression de
gènes ou Ia transcription d'ARNm cellulaires. De telles séquences peuvent, par
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97/00364
8
exemple, être transcrites dans la cellule cible en ARN complémentaires d'ARNm
cellulaires et bloquer ainsi leur traduction en protéine, selon la technique
décrite dans
le brevet EP 140 308. Les gènes thérapeutiques comprenent également les
séquences
codant pour des ribozymes, qui sont capables de détruire sélectivement des ARN
cibles (EP 321 201).
Comme indiqué plus haut, l'acide nucléique peut également comporter un ou
plusieurs gènes codant pour un peptide antigénique, capable de générer chez
l'homme
ou (animal une réponse immunitaire. Dans ce mode particulier de mise en
oeuvre,
(invention permet donc la réalisation soit de vaccins soit de traitements
immunothérapeutiques appliqués à l'homme ou à (animal, notamment contre des
microorganismes, des virus ou des cancers. Il peut s'agir notamment de
peptides
antigéniques spécifiques du virus d'Epstein Barr, du virus HIV, du virus de
l'hépatite B
(EP 185 573), du viras de la pseudo-rage, du "syncitia forming virus, d'autres
virus ou
encore spécifiques de tumeurs (EP 259 212).
Préférentiellement, l'acide nucléique comprend également des séquences
permettant l'expression du gène thérapeutique et/ou du gène codant pour le
peptide
antigénique dans la cellule ou (organe désiré. Il peut s'agir des séquences
qui sont
naturellement responsables de l'expression du gène considéré lorsque ces
séquences
sant susceptibles de fonctionner dans la cellule infectée. il peut également
s'agir de
séquences d'origine différente (responsables de (expression d'autres
protéines, ou
même synthétiques). Notamment, il peut s'agir de séquences promotrices de
gènes
eucaryotes ou viraux. Par exemple, il peut s'agir de séquences promotrices
issues du
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97/00364
9
génome de la cellule que l'on désire infecter. De même, il peut s'agir de
séquences
promotrices issues du génome d'un virus. A cet égard, on peut citer par
exemple les
promoteurs des gènes ElA, MLP, CMV, RSV, etc. En outre, ces séquences
d'expression peuvent être modifiées par addition de séquences d'activation, de
régulation, etc. II peut aussi s'agir de promoteur, inductible ou répressible.
Par ailleurs, l'acide nuclëique peut également comporter, en particulier en
amont du gène thérapeutique, une séquence signal dirigeant le produit
thérapeutique
synthétisé dans les voies de sécrétion de la cellule cible. Cette séquence
signal peut
être la séquence signal naturelle du produit thérapeutique, mais il peut
également s'agir
de toute autre séquence signal fonctionnelle, ou d'une séquence signal
artificielle.
L'acide nucléique peut également comporter une séquence signal dirigeant le
produit
thérapeutique synthétisé vers un compartiment particulier de la cellule.
Les lipides cationiques décrits dans la présente invention, et, en
particulier, le
BGTC et le BGSC, sont capables de se complexer avec fADN, et représentent une
alternative avantageuse aux vecteurs viraux pour le transfert d'acides
nucléiques
d'intérêt thérapeutique, in vitro, ex vivo ou in vivo. Du fait des propriétés
chimiques
des groupes guanidinium, et en particulier de leur pKa élevé, ces lipides
cationiques
sont capables de protéger les molécules d'ADN contre les dégradations dues aux
variations de pH. Les résultats présentés dans les exemples montrent que ces
composés permettent la transfection de nombreux types cellulaires, avec une
grande
efficacité. L'efficacité de la transfection dépend en particulier du rapport
lipide
cationique / ADN dans les complexes formés. Un rapport entre les deux composés
particulièrement favorable pour la transfection consiste à avoir 6 à 8 groupes
guanidinium pour un groupe phosphate sur l'ADN.
CA 02248186 1998-08-27
WO 97/31935 PCT/FK97/00364
L'efficacité de transfection des complexes lipide cationique /DNA peut en
outre
être améliorée par addition de lipide neutre, et formation de liposomes
cationiques.
Ces liposomes sont formés par un complexe entre le lipide cationique et le
lipide
neutre. Celui-ci peut être choisi parmi
5 - la dioléoylphosphatidyléthanolamine (DOPE),
- l'oléoyl-palmitoylphosphatidyléthanolamine (POPE),
- le di-stéaroyl, -palmitoyl, -mirystoyl phosphatidyléthanolamine
- leurs dérivés N-méthylés 1 à 3 fois;
- les phosphatidylglycérols,
10 - les diacylglycérols,
- les glycosyldiacylglycérols,
- les cérébrosides (tels que notamment les galactocérébrosides),
- les sphingolipides (tels que notamment les sphingomyélines)
- et les asialogangliosides (tels que notamment les asialoGMl et GM2).
On utilise préférentiellement la DOPE.
Préférentiellement, le composé de l'invention et le lipide neutre sont
présents
dans un rapport compris entre 1 et 5, plus préférentiellement 2 et 4. En outre
le
rapport lipide total (composé de l'invention plus lipide neutre) sur DNA est
avantageusement choisi de sorte que le rapport net de charges positives soit
compris
entre 2 et 5. Particulièrement avantageusement, le rapport est de 3 environ.
L'invention concerne donc également toute composition pharmaceutique
comprenant un composé selon (invention, un lipide neutre et un acide
nucléique.
Préférentiellement le composé selon l'invention est choisi parmi le BGTC et le
BGSC.
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97100364
11
Tout aussi préférentiellement le lipide neutre est la DOPE. L'acide nucléique
est soit
un acide désoxyribonucléique soit un acide ribonucléique. Préférentiellement
(acide
nucléique comporte un gène thérapeutique.
Outre cette application des dérivés d'amidinium revendiqués, il est également
possible d'envisager leur valorisation dans les applications suivantes:
interférence au
niveau d'interactions entre acides nucléiques et protéines résultant dans une
inhibition
ou stimulation de certains processus par exemple de régulation d'expression
génétique
ou d'activité enzymatique ( polymérase, transcriptase, etc....), complexation
sélective
d'espèces anioniques pour leur extraction, leur élimination ou leur détection
à l'aide de
sondes/électrodes à membrane par exemple, utilisation comme rêactif de
laboratoire
pour effectuer des opérations de transfection in vitro, etc.
En conséquence, la présente invention a également pour objet toute application
thérapeutique des dérivés d'amidinium tels que décrits précédemment, soit
directement, soit au sein de compositions pharmaceutiques.
De préférence, les compositions pharmaceutiques de l'invention contiennent
également un véhicule pharmaceutiquement acceptable pour une formulation
injectable, notamment pour une injection directe au niveau de l'organe désiré,
ou pour
une administration par voie topique (sur peau et/ou muqueuse). Il peut s'agir
en
particulier de solutions stériles, isotoniques, ou de compositions sèches,
notamment
lyophilisées, qui, par addition selon le cas d'eau stérilisée ou de sénim
physiologique,
permettent la constitution de solutés injectables.
La présente invention sera plus complètement décrite à (aide des exemples et
figures qui suivent, qui doivent être considérés comme illustratifs et non
limitatifs.
FIGURES
Figure 1 . Représentation schématique des protocoles opératoires de
préparation du BGSC et BGTC.
CA 02248186 1998-08-27
WO 97/31935 PCT/TR97/00364
12
Figure 2 . Représentation schématique des protocoles opératoires de
préparation du BADC.
Figure 3 : Mesure de l'efficacité de transfection en fonction du rapport
composé
lipidique/ADN.
Figure 4 : Mesure de l'efficacité de transfection en fonction du rapport
lipides
totaux / ADN.
Figure 5 : Mesure de l'effet sérum sur l'efficacité de transfection de
cellules
HepG2 (5A), HeLa (5B), NIH 3T3 (5C) et 293 (SD). Barres grises : Présence de
sérum; Barres vides : transfections en absence de sérum pendant 2h.
Figure b : Photographies de cryosections de trachées marines montrant
l'expression de gène reporter dans l'épithélium de (appareil respiratoire
après
transfection in vivo avec des liposomes BGTC/DOPE. (bA) et (bB) : Détection de
l'expression de la beta-galactosidase dans des cellules transfectées,
localisées à la
surface de fépithelium (bA) et dans les glandes sous mucosales (bB); (bC) :
Détection
des cellules exprimant la beta-galactosidase dans les glandes sous-mucosales
par
marquage à fimmunoperoxidase en utilisant un anticorps monoclonal anti-beta
galactosidase; (bD) : détection des cellules exprimant la luciférase dans les
glandes
sous-mucosales par marquage à fimmunoperoxidase en utilisant un anticorps
polyclonal
anti-luciférase; (bE) : coloration à fimmunoperoxidase: contrôle négatif
effectué en
absence d'anticorps.
Figure 7 : Mesure de (efficacité de transfert de gènes in vivo par injection
intraveineuse d'un complexe ADN/BGTC-liposome.
Figure 8 : Mesure de l'efficacité de transfert de gènes in vivo par injection
intrapéritonéale d'un complexe ADN/BGTC-liposome.
A- PRÉPARATION DE DÉRIVES SELON L'INVENTION
MATÉRIEL ET MÉTHODES
CA 02248186 1998-08-27
WO 97131935 PCT/FR97/00364
13
1. Mesures physiques
Les spectres de résonance magnétique nucléaire du proton ( RMN 1H ) ont été
enregistrés sur un spectromètre Bruker AC200. Les déplacements chimiques sont
exprimés en ppm par rapport au TMS.
2. Chromatosraphies sur silice
.Les chromatographies sur couche mince lCCM) ont été effectuées sur des
plaques de gel de silice Merck de 0,2 mm d'épaisseur
.Les chromatographies sur colonne ont été effectuées sur gel de silice 60
Merck de granulométrie 0,040-0,063mm.
EXEMPLE 1:
PREPARATION DU GUANIDINO SPERMIDINE CHOLESTEROL
BGSC
-1; Préparation du Di-Boc carbamate (1)
On ajoute une solution de chloroformate de cholesteryle(0,9g, 2mmo1) et de
Et3N (0,2148, 2mmo1) dans CHzCI~ (40m1) à une solution de 'N,BN-Bocz-
spermidine
(0,6908, 2mmol) dans CHZC12 (20m1). Après reflux pendant 5 heures, le mélange
est
lavé à l'eau (2x50m1), séché sur NazS04 et le solvant est ëvaporé. Le produit
brut est
purifié par chromatographie sur un gel de silice utilisant CHZCI?JMeOH 95/5
comme
éluant pour donner du pur carbamate (1,38, 86%).
'H NMR. 8lCDCl;t 200 Mhz) ; 0,5-2,5(m, structure de cholesteryl, Boc signal
et groupes centraux CH2 depuis le spermidine), 3,1-3,3(m, 8H, N-CHZ),
4,50(m,lH,H~), 5,37(d,lH,H6).
- 2. Préparation de I'aminocarbamate(2)
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97/00364
14
On dissout le composé (1) (1,3g) dans 20m1 de CHZC12 et l'on ajoute à cette
solution refroidie (lit de glace) 2m1 de CF3COZH fraîchement distillé pour
libérer les
groupes protecteurs BOC. Après agitation à température ambiante pendant 3
heures,
on ajoute 50m1 de 'N NaOH et le mélange est extrait avec CHZC12 Les couches
organiques sont lavées à l'eau, séchées sur NazS04 et évaporées pour obtenir
l'aminocarbamate (2) brut (0,945g, 98%).
'H NMR 8(CDC13 200 Mhz) ; 0,5-2,5(m, structure de cholesteryl et groupes
centraux depuis le spermidine), 2,7(m, 4H, CHZ-N-CO-), 3,25 (large m,4H,N-
CHz),
4,49(m,lH,H~), 5,35(d,lH,H6).
3.- Synthèse du BGSC.
On dissout le carbamate (2) brut (0,94g) dans 30m1 de THF/MeOH 85/15. Puis
on ajoute du IH-pyrazolecarboxamidine (0,495g, 3,4mmo1) et du
düsopropylethylamine (0,436, 3,4mmol) dans 30m1 de THF/MeOH 85/15. Après
agitation à température ambiante pendant I8 heures on ajoute lentement 250 ml
de
diethylether et on sépare le précipité obtenu par décantation. Le composé brut
est mis
en suspension trois fois dans du diethylether et séparé par décantation pour
donner du
GSC pur (0,570g, 47%).
1H NMR 8(DMSO d6) 200 MHz ; 0,5-2,5(m, structure du cholesteryl et CHz
central), 3,1(m, 8H, N-CHZ), 4,3(m,lH,H~,,), 5,3(d,lH,H6) ; 7,2 (large s,
8H,NHz+),
7,8{s,2H,NH), Anal. Calc. pour C~,H6,N,02,2HC1,C,62,15 ; H,9,67 ; N,13,71.
Résultat d'analyse élémentaire: C,62,28 ; H,9,81 ; N,13,15.
EXEMPLE 2:
PREPARATION DU GUANIDINO TREN CHOLESTEROL BGTC
l.préparation de l'Aminocarbamate (S)
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97/00364
On ajoute lentement une solution de chloroformate de cholesteryle (1,8g,
4mmol) dans 100 ml de CHZCIz à une saturation de tris(2-aminoethyl)amine(TREN)
(11,68 g, 80 mmol) dans 400 ml de CHZCIz. Après agitation à température
ambiante
pendant deux heures, on libère l'amine inerte par lavage à l'eau (3x100m1) et
après
5 séchage sur NaZS04 on évapore le solvant. On isole (5) sous forme de
trihydrochloride
de la manière suivante : on dissout le produit brut dans lOml de MeOH et l'on
ajoute
goutte à goutte une solution saturée de HCl methanolique (Sml) ; le précipité
obtenu
est séparé par décantation et, pour obtenir un composé pur, est mis en
suspension trois
fois dans MeOH et séparé par décantation. Après séchage sous vide le
trihydrochloride
10 (6) pur est obtenu (1,71g, 64%).
1H NMR 8(CDCIz + ~CD~OD. 200MHz). 0,5-2,4(m, structure de cholesteryl),
2,5(m,2H,CHzNHCO), 2,8(large s,4H,+HN-CHZ), 3,06(large s,4H,CH2NH3+),
3,20(m,2H,''HN-CHz), 4,4(m,lH,H~), 5,3(d,lH,H6), Anal. Calc. pour
C~,H~N40z,3HC1 ;C,61,10 ; H,9,80 ; N,8,38. Résultat : C,61,25 ; H,9,96 ;
N,8,22.
15 2- Préparation du B.GTC
On ajoute lentement une solution de chloroformate de cholesteryle (2,24g,
5mmol) dans 100m1 de CHZCIZ à une large saturation de tris(2-
aminoéthyl)amine(TREN)(29,2g, 200mmol) dans 250m1 de CHZCI2. Après agitation à
température ambiante pendant 2 heures, on libère l'amine inerte par lavage à
l'eau
(3x100m1) et après séchage sur NaaS04, le solvant est évaporé. Le produit brut
(3,2g)
est dissous dans THF/MeOH 50/50 (20m1) ; puis l'on ajoute au mélange du 1H-
pyrazole-1-carboximidine (1,465g,lOmmol) et du düsopropylamine (1,3g, l0mmol).
Après agitation à température ambiante pendant 18 heures, on ajoute du
diethylether
et le précipité obtenu est séparé par décantation. Afin d'obtenir un
échantillon pur, le
composé brut est nus en suspension trois fois dans du diethylether et séparê
par
décantation (2,15g), 60% après séchage sous vide.
1H NMR(DMSOd6. 200MHz) ; 0,5-2(m, structure du cholesteryl),
2,2(m,2H,N-CHZ), 2,6(large s,4H,N-CHI), 3.0(d,2H,N-CHZ), 3,2(large s,4H),
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97/00364
16
4,3(m,lH,H~), 5,3(d,lH,H6), 7,3(large s,BH,NH2+), (7,8(large s,2H,NH). Anal.
Calc.
pour C~H~N802,2HC1 ; C,60,39 ; H,9,57 ; N,15,65. Résultat : C,60,38 ; H,9,67 ;
N,15,56.
EXEMPLE 3:
PREPARATION DU BIS-CHLORHYDRATE DE BIS AMIDINIUM
BA D.
l.Préparation du dinitrile
On ajoute une solution de chloroformate de cholestéryle (8,97g; 20mmo1.)
dans du CH2C12 (100m1) goutte à goutte à une solution d'iminopropionitriIe
(2,468,
20mmo1.) et Et3N ( 2.02 g, 20 mmol dans du CHZC12 (100m1). Après agitation à
la
température ambiante, pendant 6 heures, on lave à Peau (2x 100m1) et sèche sur
Na2S04. Le solvant est évaporé et le produit brut (10,5g) est recristallisé
dans le
méthanol. (8,59g; 80%).
1H NMR 8(CDCIz. 200MHz). 0,5-2,5(m, structure de cholesteryl), 2,7 (m, 4H;
-CHZCN), 3,62 (m, 4H, -CH2-N-), 4,50 (m,lH,H~), 5,39(d,lH,H6).
2. Préparation du dithioamide
Dans une solution du dinitrile, préparé comme décrit précédemment, ( 0,3248,
6mmol.) et de diéthylamine ( 0,8848; l2mmol) dans du DMF (30m1), maintenue à
50°C, on fait barboter pendant 2 heures un léger courant de HzS. On
verse la solution
bleue sur de la glace et on sépare le précipité ainsi obtenu par filtration.
On dissout ce
produit brut dans du CHZCh et lave à l'eau (2x50m1). Après séchage sur Na2S04,
le
solvant est évaporé et le produit obtenu recristallisé deux fois dans du
méthanol
(1,868; 51,5%).
1H NMR(DMSOd6. 200MHz) ; 0,5-2,5(m, structure du cholesteryl>,
2,67(t,4H,N-CHZ), 3,50(t,4H,S=C-CHZ), 4,3(m,IH,H~),5,33(d,lH,H6).
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97/00364
I7
3. Préparation du bis-iodure de dithioamidate
A une solution de dithioamide (0,6038; lmmol) dans de l'acétone (20mI), on
ajoute de (iodure de méthyle (2ml) et on laisse reposer à la température
ambiante
pendant 48 heures. On filtre le précipité obtenu (0,7418; 83,5%). Ce produit
est utilisé
directement sans purification annexe.
4. Préparation du bis chlorhydrate de bis amidinium BADC.
Dans une suspension au reflux du bis-iodure (0,7418; 0,83mmo1.), tel
qu'obtenu précédemment, dans de fisopropanol (lOml) on fait barbotter un
courant de
NH3 pendant 2 heures puis on continue de chauffer au reflux 4 heures
supplémentaires.
On évapore l'isopropanol et le résidus est repris dans du méthanol (lOml).
Après
passage de cette solution sur une résine échangeuse d'ions basique, on fait
passer un
courant d'acide chlorhydrique dans féluant et on évapore à sec. Le bis
chlorhydrate
ainsi obtenu, est dissous dans le minimum d'éthanol { environ 5ml). On filtre
un léger
insoluble et on rajoute au filtrat un large excès d'éther diéthylique. On
obtient une
poudre que fon filtre et fon sèche (320mg; 60%). Une recristallisation dans
fisopropanol permet d'isoler le produit attendu, sous une forme analytiquement
pure.
1H NMR(DMSOd6, 200MHz) ; 0,5-2,6(m, structure du cholesteryl et-CHZ-
amidinium), 3,57 (s, large 4H, N-CHro) 4,3(m,lH,H~),5,3(d,lH,H6), 8,64 (s,
large;
2H; NHa), 9,07 (s; large; 1H; NH), 9,18 (s; large; 2H).
Anal. Cal. Pour C34H~NqOa, 2HCl: C, 65,25. H, 9,32; N, 8,94. Résultat C,
65,40. H, 9,87; N, 9,55.
B: UTILISATION DE DERIVES SELON L'INVENTION POUR LE
TRANSFERT DE GENES IN VITRO ET IN VIVO
MATERIELS ET METHODES
1- Les essais de transfection qui suivent sont effectués avec du BGSC et du
BGTC préparés selon les protocoles décrits dans les exemples 1 et 2.
CA 02248186 2004-08-16
18
2 - Preparation des l~sgmes
Un mélange de lipide cationique et de DOPE (dans un rapport molaire de 3/2)
dans du chloroforme (CHCl3) est évaporé sous vide et remis en suspension dans
une
solution de tampon HEPES 20 mM à PH ?,4, sous une atmosphère N2.
La concentration finale en lipide est de 1,2 mg/ml.
Le mëlange est vortexë pendant 5 mn, puis « soniqué » pendant 5 mn avec .un
sonificateur (Branson Ultrasonic 2210), enfin stocké a + 4°C pendant 24
h pour
hydratation.
La dispersion résultante est « soniquée » de nouveau (Sonifier Branson 450)
pendant 5 à 10 mm pour former des liposomes.
Aprês centrifugation, la solution est filtrëe sur un filtre de diamètre de
pore
0.22p, (Millex GS, Millepore) et stockée à + 4°C.
La taille des liposomes contenant BGSC ou BGTC a été étudiée à l'aide d'un
appareil à diffraction laser (Autosizer 4?00, Malvern Instruments). Cette
étude montre
un pic unique correspondant à un diamètre moyen de 50nm en analyse multimodale
par nombres.
3 - Cultures cellulaires
L'origine (espèce et tissus) de la plupart des lignées cellulaires utilisées
pour les
expériences de transfection est donnée dans le tableau I.
Les cellules de la lignée cellulaire HeLa (P Briand, ICGM Paris) sont dérivées
d'un carcinome humain d'origine épitheliale cervicale.
Les cellules NIH 3T3 (C Lagrou, Institut Pasteur, Lille) sont des fibroblastes
de souris.
* (marques de co~~unexce)
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97/00364
19
La lignée cellulaire NB2A (C. Gouget, Paris) est derivée d'un neuroblastome
de souris.
Toutes les cellules à l'exception des cellules AtT-20 et PC12, ont été
cultivées
dans du milieu Dulbecco modifié (DMEM, GIBCO) complementé avec 10 % de sérum
de veau fetal (FCS; GIBCO), de la pénicilline à 100 unités/ml (GIBCO) et de la
streptomycine (GIBCO) à 100~g/ml.
Les cellules AtT-20 ont été cultivées dans du DMEM/F12 (GIBCO)
complementé avec 10 % de sérum de veau fetal.
Les cellules PC12 ont été cultivées dans du DMEM complementé avec 10 %
FCS et 5 % de sérum de cheval.
Toutes les cellules ont été maintenues en culture dans des boîtes plastiques
(Falcon) sous atmosphère humide à 5 % de C02.
4 - Plasmides
Les plasmides pRSV-Luc (O. BENSAUDE, ENS, Paris), et pRSV-nlsLacZ
ont été amplifiés dans E. Coli et préparés par purification sur gradient CsCI
par des
techniques standard. Dans le plasmide pRSV-nlsLacZ, et le plasmide pRSV-Luc,
le
gène LacZ d'E.coli et sa séquence signal de localisation nucléaire et le gène
luciférase
sont respectivement sous le contrôle transcriptionnel du LTR/RSV (Rous Sarcoma
Virus). Le plasmide pXL2774 comporte le gène codant pour la luciférase sous
contrôle du promoteur du cytomégalovirus (CMV).
5 - Protocole dg transfection in vitro
Le jour précédent la transfection 2 X 105 cellules sont déposées par puits
(plaques à 6 puits Falcon).
Chaque puits contient une lignée cellulaire différente.
Ainsi au jour de la transfection les cellules sont a demi confluentes.
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97/00364
L'ADN plasmidique (5pg) et la quantité désirée de lipide bis-guanidinium ont
été chacun dilués dans 2501 de DMEM sans FCS et vortexé. Après environ 5 min
les
deux solutions ont été laissées à incuber à température ambiante pendant
l5min. Le
mélange de transfection est alors ajouté aux cellules (0,5 ml par puits) qui
ont été
5 lavées avec un milieu sans sérum. Après 4 à 6 heures d'incubation à
37°C, 1 ml de
milieu avec sérum est ajouté dans chaque puits sans que l'on enlève le mélange
de
transfection. 24 heures après la transfection, le milieu est remplacé par 1 ml
de milieu
de culture frais. Les cellules sont recueillies 2 jours après la transfection
pour mesurer
l'expression de la luciferase.
10 Des transfections témoins ont été faites en utilisant des agents de
transfections
commercialisés
- la lipopolyamine Transfectam ~ (JP Behr, Strasbourg, France) a été utilisée
en solution alcoolique à un rapport optimum de charges ioniques
Transfectam ~/DNA 6-8.
15 - la Lipofectin ~ (Life Technologies Inc., Cergy Pontoise, France) qui est
une
formulation de liposomes ayant pour lipide neutre la DOPE et pour lipide
cationique le
DOTMA. (N [ 1 (2,3-dioleyloxy) propyl]-N, N, N- trimethylammonium chloride).
Les complexes ADN/Liposomes ont été obtenus dans les conditions standard
recommandées par le fabricant.
20 - des cellules ont été transfectées par précipitation au phosphate de
calcium.
(Keown, W.A., Campbell, C.R. ; Kucherlapati, R.S. (1990) Methods in Enzymology
;
Academic Press : New York, 185, 527-537).
6 - Mesure de la luciferase pour les transfections réalisées in vitro
L'activité luciferase est mesurée 48 heures après transfection en utilisant
une variante
la procédure de De Wet et al. (De Wet, J.R., Wood, K.V., DeLuca, M., Helinski,
D.R.
& Subramani, S. (1987) Mol. Cell. Biol. 7, 725-?37.)
CA 02248186 2004-08-16
21
- on retire le milieu de culture
- les cellules sont lavées avec une solution saline de tampon phosphate froid
- puis elles sont lysées par incubation dans 250 ~.1 de tampon de lyse (25mM
triphosphate pH7;8, 8 mM MgCl2, 1mM dithiotreitol, 15 % de glycerol et 1 % de
triton X-100).
- on obtient un lysat clair après élimination des matériaux insolubles par
centrifugation (l5mm a + 4°C) dans une microcentrifugeuse.
- un Aliquot (20p.1) d'extrait cellulaire est dilué dans 100p.I de tampon de
Iyse
auquel on ajoute 9p,1 d'ATP 25 mM (sigma) et 20p.1 de luciferine 25mM (sigma).
- les échantillons sont placés dans un luminométre (Lurmei LB950I Berthold,
Nashua, NH) et on mesure l'émission lumineuse pendant 10 secondes.
L'étalonnage de la courbe RLU/Luciferase a été fait en utilisant differentes
dilutions de luciferase de luciole purifiée (sigma) et montre que la partie
linéaire de la
courbe va de 10° a 10' RLU (relative Iight units).
La concentration en protéine a été mesurée par le test BCA (acide
bicinchoninique) en utilisant la secumalbumïne bovine comme tëmoin.
Les données pour l'activité luciférase sont exprimées en RLU/mg de protéine.
7 - PrQtocol~d'injection in vivo au niveau des voies respiratoires de souri
Les souris utilisées sont des souris mâles OFl (poids 30g) issues de Iffa-
Credo
(Lyon, France). Des liposomes cationiques BGTC/DOPE (rapport molaire 3:2) sont
utilisés. Le mélange de transfection est obtenu à partir de 10~.g d'ADN
plasmidique
(dans10u1 eau), 20p.1 de liposomes cationiques dans un milieu Hepes 20mM (pH
7.4),
à une concentration lipidique totale de 5mg%ml. Les agrëgats ADN/lipides ainsi
formés
possèdent un rapport charge de Tordre de 6.
* (marque de cc~rerce )
CA 02248186 2004-08-16
22
Aprês anesthésie des souris avec du pentobarbital, le mélange de transfection
(30~,I) est injecté dans les voies respiratoires par instillation
intratrachéeale via une
canule insérée dans le lumen trachéal. 48h après l'instillation les animaux
sont sacrifiés
par overdose de pentobarbital et les poumons et trachées prélevés pour
analyse.
$- Coloration à fX-ga_1
Pour doser (expression de la beta-galactosidase d'E.coli dans les cultures
primaires, on imprègne les cellules pendant 15 minutes à 4°C avec une
solution de
paraformaldéhyde à 4% et on les incube ensuite avec de fX-gal de substrat beta-
galactosidase chromogénique (Sigma). La coloration bleue des noyaux des
cellules
transfectées est dosëe par microscopie par luminescence.
9-Dosage des cellules X-gaI au niveau des voiesrespiratoires transfectées in
viv
Pour la détection des cellules X-gal au niveau des voies respiratoires, les
poumons et trachées sont traités lh dans du paraforrnaldehyde à 4%, immergés
ensuite
toute une nuit dans du PBS contenant 30% de sucrose, puis incorporés dans un
milieu
de congélation et congelés à l'azote liquide. Des sections de cryostats de 5~.
sont
ensuite colorées pour l'activité de ~3-galactosidase par incubation toute une
nuit avec
du réactif X-gal (Sigma).
10- Dosage de la luciferase au niveau des voies respiratoires transfectées in
vivo
Pour doser l'activité luciférase à l'issue des transfections in vivo, des
fragments
de tissus sont mis en présence de 30,1 de tampon de lyse (25mM Tris-phosphate
pH7.8, ImM dithiothreitol (DTT), 15% glycerol et 1% Triton X-100), lysés en
environ lmin avec un homogéniseur (Polylabo, Strasbourg, France) et conservés
sur
glace. Après centrifugation, 20,1 de lysat ést utilisé pour le dosage.
L'activité
luciferase est exprimée en RLU par mg de protéine.
*(marque de commerce)
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97/00364
23
11- Protocole d'immunohistochimie
Des cryosections d'échantillons de poumons et trachées sont incubées lh avec
soit des anticorps marins monoclonaux anti- (3-galactosidase d'E coli à 5~g/ml
(Genzyme, Cambridge, MA) ou des anticorps de lapin polyclonaux 1:400 dilution
(Promega).
La protéine (3-galactosidase d'Escherichia coli est dosée par coloration à
fimmunoperoxidase en utilisant un anticorps secondaire anti Ig de souris
marqué à la
biotine (Boehringer) et un conjugué streptavidin-POD (Boehringer). La protéine
luciferase est dosée par coloration à fimmunoperoxidase en utilisant un
anticorps de
chèvre anti-lapin (ICN Biomedicals, Inc) et le système peroxidase-
antiperoxidase de
lapin (PAP) (Dako Glostrup, Denmark). Les sections sont examinées par
microscopie
luminescente. Des contrôles négatifs sont effectuées sans anticorps.
EXEMPLE 4:
TRANSFECTIONS IN VITRO A DES RAPPORTS AGENT DE
TRANSFECTION /ADN DIFFERENTS
Afin d'optimiser (efficacité de transfection obtenue avec des agrégats
BGTC/ADN, la demanderesse a étudié (influence du rapport BGTC/ADN sur le taux
de transfection dans 3 types différents de cellules de mammifères connus pour
leur
relative sensibilité au méthodes de transfection classique. Les résultats sont
présentés
en figure 3.
Des expériences de transfection ont donc été réalisées avec des fibroblastes
marins 3T3 des cellules ëpithéliales humaines HeLa et des neuroblastomes de
souris
NB2A. Au cours de ces expériences une certaine quantité fixe de plasmide pRSV-
Luc
a été mise en contact avec des quantités variables de BGTCen solution. Pour
déterminer la fourchette de rapport à étudier la demanderesse est partie du
principe
qu'un ~g d'ADN équivaut à 3 nm de phosphate chargé négativement et que
seulement
deux groupes guanidinium sont chargés positivement au pH neutre de formation
des
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97/00364
24
agrégats et de transfection. On mesure l'activité luciférase 48h après la
transfection.
L'expression de la luciférase est maximale pour des agrégats contenant de 6
(cellules
HeLa) à 8 (cellules 3T3, NB2A) groupes guanidinium pour un groupe phosphate de
l'ADN c'est à dire des agrégats ayant une charge positive importante.
EXEMPLE 5
TRANSFECTIONS IN VITRO AVEC DiFFERENTS TYPES
CELLULAIRES.
Le transfert de gènes par (intermédiaire de lipides cationiques est une
technique de transfection attractive non seulement du fait qu'elle ne
nécessite pas
d'intermédiaires mais aussi parce qu'elle permet de transfecter une très
grande variété
de cellules de tissus et d'organismes différents. Pour étudier l'étendue de
l'efficacité du
BGTC comme agent de transfection plusieurs lignées cellulaires d'origines
diverses ont
été testées. Les résultats sont exposés dans le tableau 1 ci-après. Le rapport
de charges
a été choisi entre 6 et 8 pour une efficacité maximale. Afin d'établir une
comparaison,
des cellules des mêmes lignées ont également été transfectées en utilisant une
lipopolyamine d'une part et d'autre part du phosphate de calcium. Les
résultats
montrent que le BGTC est normalement aussi efficace que le Transfectam et deux
fois
plus efficace que le phosphate de calcium.
Tableau I . Expression de la luciferase dans differentes lignées cellulaires
de
mammifèms transfectées soit par du BGTC, du phosphate de calcium ou du
Transfectam ~.
IZLU/mg
de protines
cellulaires
Espces Lignes Tissus BGTC Phosphate Transfectam~
cellulaire de Calcium
Humain A549 Carcinome du 4 X 105 7 X 10 3,1 X 105
poumon
Singe COS-7 Rein transform2,1 X 3,7 X 10' 8,4 X 10
par 10
SV40
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97/00364
Chien MDCK-1 Rein 3 X 4,5 X 10 2,2 X 10
10
Rat RIN-m5FCellule tumorale2 X 2 X 10' 3,3 X 10'
d'ilot pancreatique10'
ROS Osteosarcome 4,0 4,5 X 105 2,3 X lOb
X 106
PC12 Pheochromocytome3 X 1,7 X IO' 6 X 106
IO'
Souris AtT-20 Tumeur pituitaire2 X 8 X 10' 3 X 10'
10'
Toutes les transfecdons ont été faites au moins deux fois (n?2).
EXEMPLE 6
TRANSFECTIONS IN VITRO EN PRÉSENCE D'UN LIPIDE NEUTRE
Le composé BGSC étant moins soluble en milieu aqueux que le BGTC la
5 demanderesse a utilisé le premier sous forme de liposomes en présence d'un
lipide
neutre la DOPE (dioléoylphosphatidyléthanolamine). Les formulations sont
préparées
dans un rapport molaire 3/2. Une deuxième préparation contenant cette fois ci
du
BGTC a également été préparée avec de la DOPE dans les mêmes conditions.
6.1 - Détermination du rapport lipide total / ADN.
10 La demanderesse a tout d'abord déterminé le rapport lipide/ ADN au cours
d'une expérience de transfection sur des cellules HeLa. La courbe obtenue est
représentée figure 4. Les optima de transfection sont obtenus pour des
rapports
liposomes BGSC/ADN compris entre 1.5 et 5 avec un centre à 2.5-3. Les groupes
guanidinium étant protonés à pH neutre, les meilleurs agrégats BGSC-DOPE/ADN
15 ont une charge positive d'environ 3 (figure 4).
Les meilleurs rapports BGSC-DOPE/ADN sont donc inférieurs à ceux obtenus
avec des agrégats de type BGTC/ADN (entre 6 et 8). La transfection en présence
de
liposomes cationiques est facilitée par la présence de DOPE et les propriétés
fusogéniques de celle-ci.
CA 02248186 1998-08-27
WO 97/31935 ~ PCT/FR97100364
26
6.2 - Transfection de différentes lignées cellulaires par des liposomes
cationiques.
La demanderesse a procédé à des expériences de transfection dans différentes
lignées cellulaires en utilisant des formulations de liposomes cationiques
BGSC-DOPE
et BGTC-DOPE dans des rapports molaires 3/2. Le rapport de charges guanidinium
des lipides / phosphates de fADN est d'environ 2.5 (~3) pour ces deux systèmes
de
transfert de gènes. Une transfection avec la Lipofectin~ sert de témoin. Les
résultats
sont exposés dans le tableau 2 ci-dessous.
Ces résultats montrent que les dérivés du cholestérol portant des groupes
guanidiniums sous forme de liposomes cationiques sont au moins aussi efficaces
pour
la transfection que la Lipofectin. Ces résultats peuvent bien entendu être
optimisés
pour chaque lignée cellulaire.
Tableau 2 Expression de la luciferase dans différentes li " ées cellulaires
e arvotiaues transfectees au moyen de liposomes BGSC/DOPE de liposomes
BGTC/DOPE et de L~fectin
RLU/mg de protéines cellulaires
Lignes liposomes liposomes BGTCLipofectin
Cellulaires BGSC
HeLa 4,6 X 106 7,7 X 106 3,3 X 106
A 549 6 X 105 2 X 105 4 X 106
COS-7 ND 1,4 X 10' 9,5 X 106
MDCK-1 1 X 106 7 X 106 1,9 X 106
ROS ND 9 X 106 6 X 106
NB2 Aa 1,5 X 10' 1,4 X 10' ND
NIH 3T3a 7 X 106 1,5 X 106 ND
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97/00364
27
Toutes les transfections ont été faites au moins trois fois (n?3)
e : mesure moyenne en RLU de l'activité luciferase pour 100~g/500~g de lysat
total (n?4).
EXEMPLE 7
ETUDE DE L'EFFET DE LA PRESENCE DE PROTEINES SERIOUES
SUR L'EFFICACITE DU TRANSFERT DE GENES IN VITRO
La plupart des compositions de transfection à base de lipides cationiques
présentent une efficacité diminuée en présence de sénim. Cet exemple a pour
objet de
tester la sensibilité des composés de l'invention à (effet sérum.
7.1 - Formulations des lipides cationiques
Les lipides décrits dans l'invention sont solubilisés dans de l'éthanol.
i) des solutions de « liposomes » sont obtenus en présence de DOPE comme
suit : la DOPE (AVANTI) en solution dans le chloroforme est ajoutée aux
solutions de
lipide dans féthanol, dans un rapport molaire lipide cationique/DOPE de 3/2.
Après
évaporation à sec les mixtures sont reprises dans l'eau et chauffées à
50°C pendant 30
minutes ;
ü) des solutions de « micelles » sont obtenues en suivant le protocole décrit
pour l'obtention de « liposomes » mais la solution de DOPE est remplacée par
du
chloroforme.
Les solutions sont toutes ajustées à 10 mM en lipide cationique.
7.2 - Acide Nucléique
L'acide nucléique utilisé est le plasmide pXL2774.
7.3 - Mélanges cytofectants (préparation extemporanée)
CA 02248186 1998-08-27
WO 97/31935 PCT/FR9?/00364
28
L'ADN est dilué à 20 ~g/ml dans du NaCI 150 mM et les différentes
formulations de lipide cationique sont diluées dans l'eau à 40, 80,120 et 160
~.M. Les
solutions d'ADN et de lipide sont mélangées volume à volume ce qui donne des
ratios
en nmoles/~g ADN respectivement de 2, 4, 6 et 8 ; la concentration saline est
de 75
mM
7.4. - Transfections
Les cellules sont cultivées dans les conditions appropriées en microplaques de
24 puits (2 cm2/puits) et sont transfectées alors qu'elles sont en phase
exponentielle de
croissance et à 50-70 % de la confluence. Les cellules sont lavées par 2 fois
500 pl de
milieu dépourvu de protéines sériques et remises en croissance soit en milieu
sans
sérum [transfection en absence de sérum], soit en milieu complet [transfection
en
présence de sérum] et 50 ~.1 de mëlange cytofectant [0,5 pg ADN/puits] sont
ajoutés
aux cellules [3 puits/condition lipide-DNA].
Quand les cellules sont transfectées en « absence de sérum » le milieu de
croissance est supplémenté par la quantité appropriée de sérum 2 heures après
la
transfection.
L'efficacité de transfection est évaluée par une mesure de l'expression de la
luciférase selon les recommandations données pour l'utilisation du kit Promega
[Luciferase Assay System]. La toxicité des mélanges cytofectants est estimée
par une
mesure des concentrations protéiques dans les lysats cellulaires.
7.5 - Résultats (Figure 5)
Les résultats obtenus avec quatre types cellulaires [NIH3T3 - 293 - HepG2 -
HeLa] montrent que, dans les conditions testées, les formulations sous forme
de
« liposomes » sont plus efficaces que celles sous forme de « micelles ». Par
ailleurs,
contrairement à ce qui est observé avec la plupart des préparations
cytofectantes
contenant des lipides cationiques, aucun effet inhibiteur significatif lié à
la présence de
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97/00364
29
sérum pour le BGTC sous forme de « liposomes » ou de « micelles » n' a pu être
mis
en évidence dans nos conditions de transfection.
EXEMPLE 8
EXPRESSION IN VIVO DE TRANSGENE DANS LES VOIES
RESPIRATOIRES DE SOURIS AVEC DES LIPOSOMES BGTC/DOPE.
Pour ce faire, nous avons utilisë les liposomes cationiques BGTC/DOPE.
L'obtention des agrégats ADN/liposomes et le protocole d'administration sont
effectués comme décrits en matériel et méthode.
Les cellules X-gal sont détectées dans l'épithelium des voies respiratoires
des
souris traitées 48h après transfection au niveau des cellules du plasmide LacZ
à (aide
des liposomes BGTC/DOPE. Les résultats sont présentés en figure 6.
La plupart des cellules transfectées sont localisées dans la trachée et seules
quelques cellules X-gal sont observées dans les voies respiratoires
secondaires. Ce
type de distribution a déjà été reporté dans d'autres transfections
cellulaires.
Nous avons en outre effectué une imunohistochimie pour identifier le produit
du gène reporter. Majoritairement, ce sont les cellules matures qui sont
transfectées au
niveau de la surface de l'épithélium (figure 6A). Ces données montrent que les
liposomes cationiques sont capables d' induire la transfection de gènes dans
des cellules
non proliferatives et totalement différenciées de l'épithélium des voies
respiratoires.
L'expression du transgène est également détectée dans les glandes sous-
mucosales
(figure 6B). La détection par marquage immunologique des cellules
transfectées, en
utilisant un anticorps monoclonal dirigé contre la (3-galactosidase d'E coli,
confirme
cette expression dans les glandes sous-mucosales et l'épithélium de surface
(figure
6C). L'expression transgénique est également mise en évidence dans les glandes
sous-
mucosales par coloration à l'immunoperoxidase avec un anticorps dirigé contre
la
protéine luciferase après transfection de p RSV-Luc avec BGTC/DOP (figure 6D}.
Des contrôles négatifs sont effectuës sans anticorps (figure 6E).
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97/00364
Ces résultats sont d'un intérêt tout particulier pour la thérapie génique
dirigée
contre la muscavidose. En effet, pour traiter cette pathologie, il est
nécessaire de cibler
les glandes sous-mucosales qui sont le site principal de l'expression de la
CFTR dans
les bronches humaines.
5 EXEMPLE 9
DOSAGE QUANTITATIF DE L'EFFICACITE DE TRANSFECTION
DE BGTC/DOPE IN VIVO
Pour ce faire, les poumons et la trachée de souris, traitées avec du liposome
BGTC/DOPE et du plasmide pRSV-Luc dans les conditions décrites en exemple 8,
10 sont prélevées 48h après la transfection et l'activité luciférase dosée
selon le protocole
décrit dans matériel et méthode.
Les résultats sont présentés dans le tableau 3 ci-après.
Tableau 3
VECTEURS ACTIVITE LUCIFERASE
(RLU/rn rotine)
BGTC/DOPE Liposomes
2.8 x 105
pRSV-Luc (moyenne : 3 x 104 - 8
x 105)
RSV-Lac Z 0
ADN nu
RSV-Luc 0
L'activité luciférase est détectée de manière systématique dans les homogénats
15 de trachée mais pas dans ceux des poumons. Cette observation est en accord
avec les
résultats précédents obtenus lors de l'examen de la distribution des cellules
positives à
l'Xgal. On note que l'expression luciferase est directement liée au plasmide
d' expression puisque qu' aucune activité n' a pu être détectée dans le témoin
contenant
un plasmide LacZ. A titre témoin, il a été également été réalisé une
transfection du
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97/00364
31
plasmide sans vecteur. On n'observe dans cet essai témoin aucune expression de
luciférase.
Ces données démontrent l'efficacité des liposomes BGTC/DOPE pour la
transfection génique in vivo des voies respiratoires.
EXEMPLE 10
TRANSFERT DE GENE IN VIVO PAR INJECTION
INTRAVEINEUSE OU INTRAPERITONEALE
Les formulations des lipides cationiques et l'ADN sont décrits dans l'exemple
7.
10.1 - Effet Dose des lipides cationiques (figures 7-8)
Les souris BalbC âgées de 5 semaines sont injectées par voie intraveineuse
(veine queue) ou intrapéritonéale par 200 ~1 de mélange transfectant en
solution dans
du NaCI 37,5 mM, glucose 5% et l'expression de la luciférase est recherchée à
24
heures post-transfection dans le poumon après injection intraveineuse, et dans
le foie
et la rate après injection intrapéritonéale. Les organes sont prélevés à froid
dans du
tampon de lyse [Promega E153A] additionné d'inhibiteurs de protéase
[Boehringer
1697498] et homogénéisés avec un broyeur Heidolph DIAX600. L'activité
luciférase
est recherchée dans le surnageant 140008 des extraits tissulaires.
Injection intraveineuse
Chaque souris reçoit 50 ~.g d' ADN complexé par différentes concentrations de
BGTC sous forme de « liposomes ». Le rapport optimum en nanomoles lipide
cationique/~g ADN observé est de 9 (figure 7); aucune toxicité n'a pu être
mise en
évidence pour des doses allant jusqu'à 900 nanomoles de BGTC injectées.
Injection intra~ritonéale
CA 02248186 1998-08-27
WO 97/31935 PCT/FR97/00364
32
Le BGTC sous forme de « liposomes » a été injecté avec 100 ~g d'ADN par
souris. Aussi bien dans le foie (figure 8B) que dans la rate (figure 8A), le
maximum
d'expression est obtenu pour i,5 nanomoles BGTC/~,g d'ADN.
10.2 - Cinétique d'expression après injection intraveineuse
Nous avons recherché la biodistribution de l'expression de la luciférase dans
7
organes en tonction du temps suivant l'injection de 200 ~1 de mélange
« liposomes »BGTC/ADN dans du NaCI 37,5 mM, glucose 5% [ 50 ~g ADN et 9
nanomoles BGTC/~,g ADN] dans la veine de la queue de souris BalbC âgées de 5
semaines. Les résultats sont exprimés en picogramme de luciférase extraite par
organe
suivant une courbe de calibration avec de la luciférase commercialisée sous
forme
cristallisée. La limite de détection se situe entre 0,5 et 1 picogramme de
luciférase.
Nous mettons en évidence que, dans les conditions testées, le maximum
d'expression est obtenu à 23 heures post-transfection pour 6 des 7 organes
étudiés, à
savoir le diaphragme, le gastrocnémien, le coeur, le poumon, le rein et la
rate.
L'expression au niveau du foie semble plus précoce. Le maximum d'expression
est
obtenu au niveau pulmonaire avec un taux de 0,5 nanogramme à 23 heures post-
transfection.