Note: Descriptions are shown in the official language in which they were submitted.
- CA 022~7898 1998-12-07
W O 98/44919 PCT~R98/00712
UTILISATION DE DERIVES AMINOTHIOLES~ERS
DANS LE DOMAINE PHARMACEUTIQUE
La présente invention concerne l'utilisation de dérivés aminothiolesters dans lapréparation d'une composition pharmaceutique en vue de lever l'inhibition d'apoptose
due à la présence du gène bc12 dans des cellules transformées.
Il existe deux types de mécanisme impliqués dans la mort des cellules. Le premier de
10 type classique est appelé la nécrose. Morphologiquement, la nécrose est caractérisee
par un gonflement des mitochondries et du cytoplasme et par une altération nucléaire,
suivi de la destruction de la cellule et son autolyse, ceci étant accompagné par un
phénomène d'inflammation. La nécrose survient de manière passive et incidente. La
nécrose tissulaire est généralement due à un trauma physique des cellules ou un poison
15 chimique, par exemple.
L'autre forme de mort cellulaire est appelée l'apoptose [Kerr, J.F.R. and Wyllie, A.H., Br.
~1. Cancer, 265, 239 (1972)], mais contrairement à la nécrose l'apoptose n'entralne pas
un phénomène d'inflammation. Il est décrit que l'apoptose peut se réaliser sous
20 differentes conditions physiologiques. C'est une forme hautement sélective du suicide
cellulaire qui se caractérise par des phénomènes morphologiques et biochimiques
aisément observables. Ainsi, on observe notamment une condensation de la chromatine
associée ou non à une activité endonucleasique, la formation de corps apoptiques et
une fragmentation de l'acide désoxyribonucléique (A.D.N.) par l'activation
25 d'endonucléases en des fragments d'ADN de 180-200 paires de bases (ces fragments
peuvent etre observés par électrophorese sur gel d'agarose).
L'apoptose peut etre considerée comme une mort programmée des cellules- impliquée
dans le développement, la differenciation et le renouvellement tissulaire. Il est
30 egalement considéré que la différenciation, la croissance et la maturation des cellules
sont etroitement liees à l'apoptose et que les substances capables de jouer un role sur
la différenciation, la croissance et la maturation des cellules sont aussi liées au
phenomène de l'apoptose.
35 ll a déjà été décrit dans la demande de brevet WO 96-20701 déposée par la
Demanderesse un composé choisi parmi le méthional, le malondialdéhyde et tout
facteur augmentant le taux intracellulaire du méthional ou du malondialdéhyde pour une
utilisation comme médicament, ce médicament étant plus particulièrement destiné à
augmenter le phénomène de la mort programmée des cellules (I'apoptose) et ainsi peut
CA 022~7898 l998-l2-07
O98/44919 PCT~R98/00712
permettre de traiter de nombreuses maladies, plus particulièrement les maladies liees à
une hyperprolifération cellulaire, telles que dans le cas du cancer, des maladies auto-
immunes ou des allergies. Toutefois, l'addition de méthionai exogène à des cellules en
culture inhibe autant la croissance des cellules transformées que celle des cellules
normales.
Pour essayer d'augmenter le taux de methional endogène dans les cellules
transformées, mais pas dans les cellules normales, son metabolisme a été etudie.
Ainsi, dans le metabolisme du méthional, il est connu que l'acide 4-méthyithio-2-
oxobutanoïque peut être métabolisé in vivo par le complexe déshydrogénase oxo-acide
à chaîne branchée présent dans les mitochondries des cellules du foie, du coeur, et du
muscle squelettique via le méthional pour donner le méthylthiopropionylCoA [cf. Wu, G.
8~ Yeaman, S J. (1989) Biochem. J. 257, 281-284; Haussinger, D., Stehle, T. & Gerok,
W. (198~) J. Biol. Chem. 366, 527-~36; Jones, S.M.A. & Yeaman, S.~. (1986) Biochem.
J. 237, 621-623].11 est également décrit que l'acide 4-méthylthio 2-oxobutanolque peut
être métabolisé in vivo par transamination en methionine [cf. Ogier, G., Chantepie, J.,
Deshayes, C., Chantegrel, B., Charlot, C., Doutheau, A & Quash, G. (1993) Biochem.
Pharmacol. 45, 1631-1644]. Le méthional peut éventuellement aussi etre reduit ouoxydé respectivement en méthionol par une aldéhyde reductase ou en acide méthylthio-
propionique par une aldéhyde déshydrogénase. Le méthional en association avec leradical HO' peut enfin donner du malondialdéhyde et du méthane thiol par une reaction
de ~3-hydroxylation [Quash, G., Roch, A.M., Chantepie, J., Michal, Y., Fournet, G., et
Dumontet, C. (199~) Biochem. J. 305, 1017-1025].
Dans ce qui suit, les abréviations suivantes peuvent être utilisées:
- MTOB représente l'acide 4-méthylthio-2-oxobutanoïque;
- MTPA représente l'acide méthylthiPpropionique;
- E1 représente la décarboxylase du complexe déshydrogénase oxo-acide a chalne
branchée dont le co-facteur est la thiamine pyrophosphate (TPP);
- EZ représente la transacylase du complexe déshydrogénase oxo-acide à chalne
branchée dont le co-facteur est l'acide thioctique (TA);
ALDR représente l'aldéhyde réductase;
ALDH représente l'aldéhyde déshydrogénase.
.
Il a également été décrit que des inhibiteurs de la transaminase impliquée dans la
transformation du MTOB en méthionine, qui sont des composés d'esters de la L-
methionine et de pyridoxal, inhibent sélectivement la croissance de plusieurs types de
CA 022~7898 1998-12-07
W O 98/44919 PCTrFR98/00712
cellules transformées mais pas celle de cellules normales MRC5 et induisent faiblement
l'apoptose également dans les cellules Iymphoïdes BAF3 mises en culture en présence
d'interleukine 3.
5 Dans le cas de pathologies qui sont caractérisées par une surexpression du gène bci2,
tels que notamment les cancers du sein, les Iymphomes des cellules B, ies leucémies,
les neuroblastomes, les adenocarcinomes de la prostate, les prolactinomas et autres
adénomes pituitaires, cette surexpression du gène bc12 confère aux cellules une
résistance à l'apoptose et donc à la chimiotherapie ou aux antiandrogènes (Miyashita, T.
and Reed, J.C. (1993) Blood 81, 151-157; Furuya,Y. et al. (1996) Clinical CancerResearch 2, 389-398).
Par ailleurs, il a éte décrit que l'addition d'un inhibiteur de l'enzyme ALDH, le disulfiram
(à 50 IlM), à des cellules BAF3-bo induisait la fragmentation dans 30% de l'ADN
15 cellulaire, typique de l'apoptose, tandis que dans les cellules BAF3-bc12, resistantes a
l'apoptose, cette augmentation ne dépassait pas 5% (Roch, A.-M. et al., (1996)
Biochem. J. 313, 973-981). L'augmentation de la concentration de disulfiram n'a pas
permis d'obtenir un pourcentage de fragmentation plus élevé a cause de la toxicité
intrinsèque de ce produit.
Un des buts de la présente invention est donc d'inhiber partiellement, voire totalement,
ce caractère résistant à l'induction d'apoptose dû au gène bc12 présent dans les cellules
transformees.
25 Ce but et d'autres sont atteints par la présente invention qui concerne l'utilisation d'au
moins un dérivé aminothiolester de formule (I) pour la préparation d'une composition
pharmaceutique destinée à lever l'inhibition d'un caractère résistant à l'induction
d'apoptose de cellules transformées, ce caractere étant dû au gene bc12 présent dans
ces cellules.
La présente invention concerne également l'utilisation d'au moins un dérive
aminothiolester de formule (I) pour la préparation d'une composition pharmaceutique
destinée à lever l'inhibition du caractère résistant à la chimiothérapie ou aux
antiandrogènes de cellules transformées.
Plus particulièrement, le caractère résistant à la chimiothérapie ou aux antiandrogènes
de cellules transformées est dû au gène bc12 présent dans ces cellules.
CA 022~7898 1998-12-07
WO 98/44919 PCT~F~98/00712
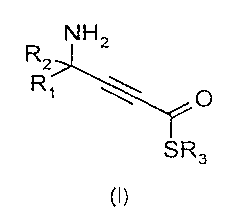
Les dérivés aminothiolesters présentent la formule (I) suivante:
NH2
R1 ~0
SR3
(I)
5 dans laquelle R1, R2 et R3, indépendamment, représentent un radical alkyle, lineaire ou
ramifié, saturé ou insature, de C1-C6.
Parmi les radicaux alkyle linéaire sature ayant de 1 à 6 atomes de carbone, on peut citer
notamment les radicaux méthyle, éthyle, propyle, butyle, pentyie, hexyle.
Parmi les radicaux alkyle ramifiés saturés ayant de 1 à 6 atomes de carbone, on peut
citer notamment les radicaux 2-methylbutyle~ 2-methylpentyle, isopropyle et tertiobutyle.
Parmi les radicaux aikyle insaturés ayant de 1 à 6 atomes de carbone, on peut citer
15 notamment le radical allyle.
De préférence, R1, R2 et R3, independamment, représentent un radical alkyle de C1 à
C3.
20 De préférence, R1 et R2 représentent un radical méthyle et R3 un radical choisi parmi le
radical metilyle, éthyle et propyle.
De manière avantageuse, R1, R2 et R3 representent ie radical méthyle.
25 On utilise avantageusement un composé de formule (I) dans laquelle l'amine est sous
forme d'ammonium, de préférence sous forme d'ammonium organique et
avantageusement sous forme de formiate ou d'acetate d'ammonium. Sous forme
d'ammonium, les composés de formule (l~ présentent l'avantage d'être hydrosolubles, et
donc facilement utilisables.
Ces composés peuvent être obtenus par (1) réaction d'un dérivé dialkylpropar~ylamine,
dans lesquels la fonction amine est protégee (ces composes sont décrits dans la
demande de brevet EP 0 133 4~7), avec une base très forte pour donner le carbanion
du radical propargyle, (2) on fait réagir ensuite ce carbanion avec un oxysulfure de
35 carbone, puis (3) on réalise une réaction d'alkylation sur le soufre du produit obtenu en
CA 022~7898 1998-12-07
W O 98/44919 PCTAFR98/00712
(2) et enfin (4) on déprotège l'amine. Pour obtenir le composé de formule (I) sous forme
d'ammonium, on utilise tout moyen connu en soi. Ainsi, pour obtenir le composé de
formule (I) sous forme de formiate ou d'acétate d'ammonium, on fait réagir le composé
obtenu à l'étape (4) avec respectivement l'acide formique ou l'acide acetique.
S
D'autres caractéristiques, aspects, objets et avantages de l'invention appara~tront
encore plus clairement à la lecture de la description qui va suivre, ainsi que des divers
exemples concrets, mais nullement limitatifs, destinés à l'illustrer.
10 La figure 1 représente le pourcentage de fragments d'ADN obtenus dans des cellules
BA~-bc12 mises en culture pendant 6 heures avec différents composés en fonction des
concentrations (exprimées en ~LM) de ces différents composés qui sont: I'amino-4méthyl-4 pentyne-2 al-1 (représenté par G), le 4-amino-4-méthylpent-2-yne thioate de S-
méthyle ~representé par ~) et le mélange du 4-amino-4-methylpent-2-yne thioate de S-
15 méthyle (à différentes concentrations) et de méthional à 200 ~lM (representé par ~).
La figure 2 représente le pourcentage de fragments d'ADN obtenus dans des cellules
BAF-bO mises en culture pendant 6 heures avec différents composés en fonction des
concentrations (exprimées en ~LM) de ces différents composés qui sont: I'amino-420 méthyl-4 pentyne-2 al-1 (représenté par Cl), le 4-amino-4-méthylpent-2-yne thioate de S-
methyle (représente par ~ et le mélange du 4-amino-4-méthylpent-2-yne thioate de S-
méthyle (à différentes concentrations) et de méthional à 200 ~-M (représenté par ~).
La figure 3 représente le pourcentage de fragments d'ADN obtenus dans des ce!lules
25 LNCaP (ATCC CRL 1740) mises en culture pendant 6 jours avec le 4-amino-4-
méthylpent-2-yne thioate de S-méthyle (représente par ~) en fonction des
concentrations de ce composé (exprimées en ~lM).
Ces composés de formule (I) qui inhibent l'activité de l'enzyme ALDH présentent
30 I'avantage d'être de type "suicide" (liaison covalente irréversible avec l'enzyme ALDH),
de ne pas être toxique et d'inhiber la croissance des cellules transformées
(cancéreuses) et non pas celle des cellules normales.
Les pathologies qui sont caractérisées par une surexpression du gene bc12 sont
35 notamment les cancers du sein, les Iymphomes des cellules B, les leucémies, les
neuroblastomes, les adenocarcinomes de la prostate, les prolactinomas et autres
adénomes pituitaires.
CA 022~7898 1998-12-07
W O 98/44919 PCTAFR98/00712
La composition pharmaceutique selon l'invention comprend un milieu physiologiquement
acceptable .
L'administration de la composition selon i'invention peut être effectuée par voie entérale,
parentérale, topique ou oculaire. De préférence, la composition pharmaceutique est
conditionnée sous une forme convenant à une application par voie systémique (pour
injection ou perfusion).
Par voie entérale, la composition, plus particulièrement la composition pharmaceutique,
10 peut se présenter sous formes de comprimés, de gélules, de dragées, de sirops, de
suspensions, de solutions, de poudres, de granulés, d'émulsions, de microsphères ou
nanosphères ou vésicules lipidiques ou polymériques permettant une libération
contrôlée. Par voie parenterale, la composition peut se présenter sous forme de
solutions ou suspensions pour perfusion ou pour injection.
Les composés de formule (I) selon l'invention sont généralement administrés a une
dose journalière d'environ 0,001 mgtkg a 10Q mg/kg en poids corporel en 1 à 3 prises.
Par voie topique, la composition pharmaceutique selon l'invention est plus
20 particulièrement destinée au traitement de la peau et des muqueuses et peut se
présenter sous forme d'onguents, de crèmes, de laits, de pommades, de poudres, de
tampons imbibés, de solutions, de gels, de sprays, de lotions ou de suspensions. Elle
peut également se présenter sous forme de microsphères ou nanosphères ou vesicules
lipidiques ou polymériques ou de patches polymériques et d'hydrogels permettant une
25 liberation contrôiée. Cette composition par voie topique peut se présenter soit sous
forme anhydre, soit sous forme aqueuse.
Par voie oculaire, ce sont principalement des coilyres.
30 Les composés de formule (I) sont utilisés par voie topique ou oculaire à une
concentration généralement comprise entre 0,0001 % et 10 % en poids, de préférence
entre 0,01 et 1 % en poids, par rapport au poids total de la composition.
Les compositions telles que décrites précédemment peuvent bien entendu en outre
35 contenir des additifs inertes ou même pharmacodynamiquemen~ actifs ou des
combinaisons de ces additifs, et notamment: le methional, de nombreux agents
antinéoplasiques, tels que par exemple la dexamethasone, ia cyclophosphamide, le
CA 022~7898 1998-12-07
W O 98/44919 PCT/FR98/00712
cisplatin, I'étoposide et le BCNU (N,N-{3is(2-chloroéthyl)-N-nitrosourea), qui sont
également capables d'induire l'apoptose.
Ainsi, la présente invention a également pour objet une composition pharmaceutique,
5 caractérisée en ce qu'elle comprend, dans un support physiologiquement acceptable,
au moins un composé de formule (I), tel que décrit ci-dessus, et au moins un composé
choisi parmi le méthional et un agent antineoplasique.
Cette composition est donc plus particulièrement destinée à traiter, de manière
10 préventive ou curative, des maladies liees à une hyperproliferation cellulaire, telle que
les cancers, des maladies auto-immunes ou allergiques.
La composition pharmaceutique comprend de préference le méthional et au moins uncomposé de formule ~I), tel que décrit ci-dessus.
De préférence, I'agent antinéoplasique est capable d'induire l'apoptose et peut ainsi être
choisi parmi ceux cités ci-dessus.
La composition selon l'invention peut etre sous forme d'un kit comprenant au moins un
20 composé de formule ~I), tel que décrit ci-dessus, et au moins un composé choisi parmi le
méthional et un agent antineoplasique, les cornposés de ce kit etant conditionnés de
manière séparée.
Bien entendu, I'homme du metier veillera à choisir le ou les éventuels composés à
25 ajouter à ces compositions de telle manière que les propriétes avantageuses attachees
intrinsèquement à la présente invention ne soient pas ou substantiellement pas altérées
par l'addition envisagee.
On va maintenant donner, à titre nullement limitatif, plusieurs exemples destines à
30 illustrer la présente invention.
EXEMPLE 1
35 Procédé de ~réparation du 4-amino-4-méthylpent-2-yne thioate de S-méthyle
A une solution de 4,519 ~20 mM) de N,N-(1,2-bis~diméthylsilyl)ethane)-1,1-
diméthylpropargylamine ~décrit dans la demande de brevet EP 0 133 407~ dans 100ml
_
CA 022~7898 l998-l2-07
W O 98/44919 PCT~FR98/00712
de tetrahydrofuranne, on ajoute en 5 minutes à -70~C 16 ml d'une solution 1,5 M de n-
butyllithium dans l'hexane. On laisse le milieu réactionnel revenir à temperature
ambiante en 30 minutes puis on agite encore 1 heure à cette ternperature (18~C). Après
retour à - 70~C on cannule 9 ml d'oxysulfure de carbone préalablement condense.
Après une heure d'agitation à -70~C puis 30 minutes à +3~C on ajoute 1,31 ml (21mM)
d'iodure de méthyle et on poursuit l'agitation pendant 2 heures à cette température.
Après dilution dans 400 ml d'éther, on lave par une solution saturée de chlorure de
sodium, on sèche sur sulfate de sodium et on évapore sous vide, I'amine est débloqué
sur gel de silice tel que décrit dans la demande de brevet EP 0 133 407., on isole ainsi
29 (63%) de l'amine.
EXEMPLE 2
Procédé de uréParation du formiate de 4-amino-4-méthylpent-2-yne thioate de S-
1 5 méthYIe
A 418 mg (2,7 mM) de l'amine obtenu à l'exemple 1 dans l'éther anhydre, on ajoute 2,7
mM d'acide formique en solution dans 2 ml d'éther à 0~C. On agite 5 minutes, puis on
porte a température ambiante et on évapore à sec. Apres reprise dans l'éther anhydre,
on disperse le solide et on elimine le surnageant, puis on sèche sous vide et on isole
415 mg (77%) du formiate.d'amine désiré.
EXEMPL~ 3
Effet de différents composés sur l'induction d'apoptose dans les cellules BAF3-bO et BAF3-
bc12
Les cellules utilisées correspondent à une li~nee cellulaire Iymphocytaire de souris BAF3
qui requiert de l'interleukine 3 (IL3) pour croître et qui subit l'apoptose (plus de 80% des
cellules) en l'absence d'lL3 en 16 heures [cf. Collins, M.K.L., Marvel, J., Malde, P. & Lopez-
Rivas, A. (1992) J. Exp Med. 176, 1043-1051].
Les cellules BAF3-bc12 correspondent à des cellules BAF3 transfectées par le gène bc12,
les cellules BAF3-bO correspondent à des cellules BAF3 non transfectées par le gene bc12.
3~ Comme précisé précédemment, les cellules BAF3-bO subissent l'apoptose (plus de 80%
des cellules) en l'absence d'lL3 en 16 heures. Par contre, les cellules BAF3-bc12 qui sont
donc transfec~ées par le gène bc12 ne presentent aucun signe d'apoptose en l'absence
d'lL3.
CA 022~7898 1998-12-07
W O 98/44919 PCTIFR98/00712
Les cellules BAF3-bO ou BAF3-bc12, mises en culture en présence d'lL3, sont marquées par
une adaptation de la méthode décrite dans Wright, S. et al. (1992) J. of Cell. Biochem. 48,
344-35~, en incubant 2,5.105 cellules /ml avec 0,5 ~LCi ~3H]-thymidine pendant 40 heures à
37~C. Après deux lavages avec un milieu de culture, 2,5. 106 cellules sont mises en culture
en présence de différents composés à tester. Après incubation pendant 6 heures, ces
cellules sont récuperées par centrifugation à 4009 pendant 5 minutes et lavées 3 fois dans
du tampon PBS. Les cellules récupérées dans le culot sont Iysees dans 2ml de 0,1% de
Triton X-100, 20mM EDTA, 5mM Tris pH8 et centrifugees à 300009 à 4~C pendant 30
10 minutes. Les surnageants sont récupérés et les culots dissous dans 0,3 ml de 0,5 N NaOH.
Des aliquots du milieu de culture (1ml~, du surnageant (0,3ml) et du culot sotubilise (0,1ml)
sont mis à doser dans le compteur à scintillation. Le pourcentage de fragments d'ADN est
calcule de la façon suivante:
% de fragments = dpm du milieu de culture + dpm du surnaqeant
d'ADN dpm du milieu de culture ~ dpm du surnageant + dpm du culot solubilise
Les resultats sont rassemblés dans les figures 1 et 2.
20 Les résultats de l'amino-4 méthyl-4 pentyne-2 al-1 sont donnés à titre de comparaison.
L'amino-4 méthyl-4 pentyne-2 al-1 (représenté par _) est également un inhibiteur d'ALDH
mais ne correspond pas au composé de formule (I) utilisé dans la presente invention. Son
procedé d'obtention est décrit dans la demande brevet EP 0 133 407.
Le 4-amino-4-méthylpent-2-yne thioate de S-méthyle est le composé obtenu selon le
25 procédé décrit à l'exemple 1.
Ces résultats montrent clairement que la présence du 4-amino-4-méthylpent-2-yne thioate
de S-méthyle, de préference en association avec le méthional, permet de lever l'inhibition
d'apoptose dûe au gène bc12 dans les cellules BAF3-bc12. L'association méthional-4-amino-
30 4-méthylpent-2-yne thioate de S-méthyle est particulièrement intéressante, car elle présente
une synergie de la levée de l'inhibition d'apoptose, en effet seui à 20011M le méthional ne
présente aucune activité (0% de fragments d'ADN).
CA 022~7898 1998-12-07
WO 98/44919 PCT/FR98/00712
EXEMPL~ 4
Effet du 4-amino-4-méthYlpent-2-yne thioate de S-méth~/le sur l'induction d'apoptose dans
les cellules LNCaP
Les cellules utilisées correspondent à une lignee cellulaire d'adénocarcinome de la prostate
LNCaP (ATCC CRL 1740). Les celluies LNCaP sont mises en culture dans un milieu
contenant du milieu RPMI 1640 (commercialise par la société GIBCO) et 7,5 % de serum de
10 veau foetal. Ellles sont marquées par une adaptation de la méthode décrite dans Wright, S.
et al. (1992) J. of Cell. Biochem 48, 344-355, en incubant 2,5.105 cellules /ml avec 0,5 IlCi
r3H]-thymidine pendant 5 jours à 37~C. Après deux lavages avec du tampon PBS, 2,5. 106
cellules sont réincubées dans un milieu de culture frais contenant du milieu RPMI 1640, 7,5
% de serum de veau foetal et du 4-amino-4-méthylpent-2-yne thioate de S-méthyle à des
15 doses indiquées. Apres incubation pendant 6 jours, ces cellules sont récupérées par
centrifugation à 4009 pendant 5 minutes et lavees 3 fois dans du tampon PBS. Les cellules
récupérées dans le culot sont Iysées dans 2ml de 0,1% de Triton X-100, 20mM EDTA, 5mM
Tris pH8 et centrifugées à 30000g à 4~C pendant 30 minutes. Les surnageants sontrécupérés et les culots dissous dans 0,3 ml de 0,5 N NaOH. Des aliquots du milieu de
20 culture (1ml), du surnageant (0,3ml) et du culot solubilisé (0,1ml) sont mis à doser dans le
compteur à scintillation. Le pourcentage de fragments d'ADN est calculé de ia façon
suivante:
25 % de fragments = dpm du milieu de culture + dpm du surnaqeant
d'ADN dpm du milieu de cuiture + dpm du surnageant + dpm du culot solubilise
Les résuitats sont rassemblés dans la figure 3.
30 Ces resultats montrent clairement que la présence du 4-amino-4-méthylpent-2-yne thioate
de S-méthyle permet de lever l'inhibition d'apoptose due au gene bc12 dans les cellules
LNCaP.
_