Note: Descriptions are shown in the official language in which they were submitted.
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
1
Dispositif d'ionophorëse comportant au moins un ensemble
électrode à membrane, pour l'administration transcutanée,de
principes actifs à un sujet
L'invention concerne un dispositif d'ionophorèse
pour l'administration transcutanée de principes actifs à un
sujet, lequel dispositif comporte au moins un ensemble
électrode équipé d'une membrane. Elle se rapporte encore
audit ensemble électrode.
Dans le traitement courant de nombreuses affections,
il est nécessaire d'administrer un médicament ou autre
principe actif à un sujet de manière contrôlée et souvent
prolongée. Parmi les nombreuses techniques mises à la
disposition du galéniste, celle de l'ionophorèse représente
une alternative intéressante pour le contrôle de
l'administration de principes actifs tels que des substances
médicamenteuses dans l'organisme du sujet. Une telle
technique consiste à utiliser le courant électrique pour
contrôler la quantité mais aussi la vitesse de délivrance
d'un principe actif à travers la peau d'un sujet. Dans de
nombreux cas, cette technique s'avère très efficace en
augmentant de manière significative l'apport de principe
actif dû au courant, comparativement à la quantité délivrée
sans courant.
L'administration transcutanée d'un principe actif
par ionophorèse à un sujet est généralement réalisée, à
partir d'une solution aqueuse ou d'un gel aqueux renfermant
le principe actif sous une forme au moins partiellement
ionisée ou sous une forme neutre, en appliquant un signal
électrique entre, d'une part, une première électrode, dite
électrode active, ayant même polarité que les ions du
principe actif à administrer ou une polarité positive si le
principe actif est neutre et se trouvant en contact avec un
élément réservoir, qui renferme le principe actif et se
trouve placé au contact d'une première zone de la peau du
sujet, et, d'autre part, une deuxième électrode, dite
contre-électrode ou électrode passive, de polarité opposée à
CA 02271088 1999-OS-06
WO 98/19735 PCTIF1t97/01997
2
celle associée au principe actif, qui est placée,
directement ou par lè biais d'un électrolyte indifférent,, au
contact d'une deuxième zone de la peau du sujet distincte de
la première zone. hors du passage du courant, généré par
application de la tension entre les électrodes, dans le
circuit ainsi réalisé, les ions du principe actif migrent, à
l'opposé de l'électrode de même polarité (électrode active),
à travers la peau et les tissus du sujet vers l'électrode de
polarité opposée (contre-électrode) et se retrouvent ainsi à
passer dans le système circulatoire du sujet. De même, les
molécules neutres de principe actif sont entraînées, à
l'opposé de l'électrode positive dans le flux aqueux
d'électro-osmose à travers la peau et les tissus du sujet
vers l'électrode négative (contre-électrode) et se
retrouvent également ainsi à passer dans le système
circulatoire du sujet.
Un dispositif d'ionophorèse pour l'administration
transcutanée d'un principe actif à un sujet est du type
comportant un premier ensemble électrode constitué d'une
première électrode, dite électrode active, en contact avec
un élément réservoir actif, adapté, d'une part, pour
contenir un électrolyte renfermant le principe actif sous
une forme au moins partiellement ionisée ou sous une forme
neutre et, d'autre part, pour assurer, lorsqu'il est placé
au contact d'une zone de la peau du sujet, un continuum
conducteur ionique entre ladite première électrode et ladite
zone, un deuxième ensemble électrode constitué soit (i)
d'une deuxième électrode, dite contre-électrode, ou bien, de
préférence, (ii) d'une telle deuxième électrode en contact
avec un élément réservoir agencé pour renfermer un
électrolyte et pour assurer, lorsqu'il est placé au contact
d'une portion de la peau du sujet, un continuum conducteur
ionique entre la deuxième électrode et ladite portion, et un
générateur de signaux électriques connectable à chacune
desdites première et deuxième électrodes de telle sorte que
la première électrode ait même polarité que les ions du
principe actif ou une polarité positive si ledit principe
CA 02271088 1999-OS-06
WO 98!19735 PCT/FR97/01997
3
actif est neutre et que la deuxième électrode ait une
polarité opposée à celle de la première électrode.
La citation WO-A-9116943 concerne un dispositif
d'ionophorèse renfermant au moins un ensemble électrode
donneur, c'est-à-dire un ensemble électrode contenant un
principe actif à administrer, ledit ensemble donneur
comportant une électrode, par exemple une électrode
réversible à base de zinc, d'argent ou/et de chlorure
d'argent, un élément réservoir primaire adapté, d'une part,
pour contenir un électrolyte, qui renferme le principe actif
à administrer sous une forme au. moins partiellement ionisée
ou sous une forme neutre, et, d'autre part, pour assurer,
lorsqu'il est placé au contact d'une zone de la peau d'un
sujet, un continuum conducteur ionique entre ladite
électrode et ladite zone et une membrane en contact, par
l'une de ses faces, avec l'électrode et, par son autre face,
avec l'élément réservoir primaire, ladite membrane étant une
membrane sélectivement perméable aux ions et molécules de
tailles inférieures à un seuil choisi pour prévenir le
passage des ions et molécules du principe actif à travers la
' membrane.
Dans une variante, l'ensemble électrode donneur
comporte également un élément réservoir secondaire
renfermant un électrolyte indifférent, ledit élément
réservoir secondaire étant disposé entre l'électrode et la
membrane de manière à être en contact avec chacune d'elles.
La présence d'une membrane sélectivement perméable
aux ions et molécules de tailles inférieures à celles des
ions et molécules du principe actif dans l'ensemble
électrode donneur d'un dispositif d'ionophorèse, pour
séparer l'élément réservoir primaire, contenant le principe
actif, de l'électrode ou de l'élément réservoir secondaire
en contact avec l'électrode, permet de confiner le principe
actif dans l'élément réservoir primaire et ainsi d'empêcher
ledit principe actif de parvenir au contact de l'électrode
et soit àe s'adsorber sur ladite électrode avec comme
résultat ur:~ augmentation substantielle de la résistivité du
dispositif d'ionophorèse ou bien de subir une dégradation
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97101997
4
due à des réactions avec l'électrode ou catalysées par
l'électrode. En outre; la membrane empêche la migration vers
l'électrode des produits ionisés tels que lipides et
graisses, qui ont tendance à passer, depuis le milieu
sanguin et la peau, dans les ensembles électrodes du
dispositif d'ionophorèse, lorsque celui-ci est en
fonctionnement. Enfin, la présence de la membrane permet
également d'éviter que les contre-ions du principe actif
viennent au contact de l'électrode et la corrode ou/et la
dégrade.
Les membranes sélectivement perméables utilisées
dans la citation WO-A-9116993 peuvent être en un matériau
homogène consistant en un polymère ou en un mélange de
polymères compatibles ou bien en un matériau hétérogène
consistant en une matière polymère additionnée d'un agent
porogène comme le polyéthylèneglycol. Les polymères
utilisables pour constituer lesdites membranes peuvent être
tels que pclycarbonates, polychlorure de vinyle, polyamides,
polymères halogénés, polysulfones, polyacétals, polyéthers
thermoplastiques, résines acryliques, polyuréthanes,
polyamides, polybenzimidazoles, polyacétate de vinyle,
esters de cellulose, celluloses hydroxylées ou carboxylées,
résines époxy, polyoléfines, polyoxyéthylènes réticulés,
alcools polyvinyliques réticulés, polyvinylpyrrolidones
réticulées, copolymères éthylène/acétate de vinyle. Un
matériau préféré consiste en acétate de cellulose renfermant
jusqu'à 20 ~ d'un agent porogène consistant en polyéthylène
glycol de masse moléculaire dans l'intervalle 900 à 8000.
Bon nombre des membranes en matériau polymère,
notamment en polychlorure de vinyle, copolymère
éthylène/acétate de vinyle, polyamide, polyoléfine,
polyacétals, résine époxy, sont relativement impédantes, ce
qui se traduit, au cours du fonctionnement du dispositif
d'ionophorèse incluant la membrane, par une perte
supplémentaire d'énergie électrique par effet Joule.
Les membranes, qui sont obtenues à partir de
polymères fortement hydrophiles, par exemple
polyoxyéthylènes réticulés, polymères réticulés d'acide
CA 02271088 1999-OS-06
WO 98119735 PCT/FR97101997
acrylique, celluloses hydroxylées ou carboxylées et
réticulées, sont peu impédantes, mais elles gonflent
fortement en présence d'eau et sont peu stables dans le
temps à l'état gonflé d'eau.
5 Quant aux membranes poreuses obtenues à partir d'un
matériau polymère renfermant un agent porogène, par exemple
acétate de cellulose renfermant un polyéthylène glycol
oligomère, elles présentent une hétérogénéité structurale se
traduisant, notamment, par des caractéristiques mécaniques
pas toujours satisfaisantes et sont peu imperméables à long
terme au stockage humide.
On a maintenant trouvé, qu'en choisissant comme
matériau constitutif de membrane, un matériau polymère
consistant en au moins un polyétherblocamide
(polyétheresteramide) de composition particulière, on
obtenait une membrane se révélant particulièrement efficace
comme membrane sélectivement perméable pour ensemble
électrode d'un dispositif d'ionophorèse.
Plus particulièrement, la membrane selon l'invention
présente une faible impédance, dans la plupart des cas
inférieure à 1 kohm/cm2, une excellente résistance mécanique
et une grande stabilité dans le temps. Ladite membrane est
étanche à l'eau liquide, résiste à la stérilisation ainsi
qu'à la radiostérilisation et offre une parfaite résistance
2'5 à l'ensemble des agents, notamment alcools et glycols,
promoteurs du passage transcutané du principe actif. Elle
est très perméable à la vapeur d'eau, ce qui permet une
hydratation très rapide dans le cas d'éléments réservoirs de
principe actif ou d'électrolyte montés déshydratés, et
présente un bon compromis entre ses propriétés barrière et
sa conductivité humide. Elle peut faire l'objet d'un
. stockage de longue durée en milieu humide. Cette membrane
peut être obtenue à faible coût, à partir de
. polyétherblocamides ne renfermant aucun stabilisant à
caractère ionique ou toxique et ayant obtenu une
qualification pharmaceutique. Enfin, une telle membrane
présente une bonne adhésion sur la plupart des autoadhésifs
pharmaceutiques, à sec ou à l'état humide, et elle peut être
CA 02271088 1999-OS-06
WO 98!19735 PCT/FR97/01997
6
thermoscellée avec de nombreux matériaux, dont ceux formant
l'ossature du dispositif d'ionophorèse l'incluant.
L'invention a donc pour objet un dispositif '
perfectionné d'ionophorèse comportant au moins un ensemble
électrode donneur équipé d'une membrane sélectivement
perméable en un matériau polymère consistant en au moins un
polyétherblocamide de caractéristiques spécifiques. Elle
concerne également ledit ensemble électrode.
Le dispositif d'ionophorèse selon l'invention, pour
l'administration transcutanée d'un principe actif à un
sujet, est du type comportant (a) un premier ensemble
électrode (dit ensemble électrode donneur) constitué d'une
première électrode (dite électrode active), d'un élément
réservoir primaire, adapté, d'une part, pour contenir un
milieu électrolyte primaire renfermant le principe actif
sous une forme au moins partiellement ionisée ou sous une
forme neutre et d'autre part, pour assurer, lorsqu'il est
placé au contact d'une zone de la peau du sujet un continuum
conducteur ionique entre ladite première électrode et ladite
zone, et d'une membrane en matériau polymère en contact, par
une face, avec la première électrode et, par une autre face,
avec l'élément réservoir primaire, ladite membrane étant
sélectivement perméable aux ions et molécules de taille
inférieure à un seuil choisi, notamment, pour prévenir le
2~5 passage du principe actif neutre ou ionisé à travers la
membrane, (b) un deuxième ensemble électrode constitué soit
(i) d'une deuxième électrode, dite contre-électrode, ou
bien, de préférence, (ii) d'une telle deuxième électrode en
contact avec un ëlément réservoir, dit de contre-électrode,
~30 agencé pour renfermer au moins un milieu électrolyte et pour
assurer, lorsqu' il est placé au contact d' une portion de la
peau du sujet, un continuum conducteur ionique entre la
deuxième électrode et ladite portion, et (c) un générateur
de signaux électriques connectable à chacune desdites
35 première et deuxième électrodes de telle sorte que la
première électrode ait même polarité que les ions du
principe actif ou une polarité positive si ledit principe
actif est neutre et que la deuxième électrode ait une
CA 02271088 2006-04-25
7
polarité opposée à celle de la première électrode et il se
caractérise en ce qué le matériau polymère constituant la
membrane sélectivement perméable consiste en au moins un
polyétherbiocamide formé de .motifs, identiques ou
différents, répondant à la formule C~- A - ô O - B - 0 ,
dans laquelle A est une séquence polyamide issue, par perte
de ses groupements COOH, d'un polyamide dicarboxylique
possédant un groupement COOH à chacune des extrémités de sa
chaîne et B est une séquence polyoxyalkylène issue, par
perte des deux groupements hydroxyles, d'un polyoxyalkylène
glycol dont la chaîne est formée de motifs oxyalkylènes
ayant 2 à 4 atomes de carbone et possède un groupement OH à
chacune de ses extrémités, ledit polyétherblocamide
possédant une masse moléculaire moyenne en nombre comprise
entre 10 000 et 300 000, de préférence entre 10 000 et
200 000 et plus spécialement entre 15 000 et 100 000, et
renfermant une proportion pondérale de séquences polyamides
A comprise entre 35 % et 90 % et de préférence entre 45 $ et
85 %.
La présente invention vise aussi un ensemble électrode donneur,
notamment pour dispositif d'ionophorèse, comportant une électrode active, un
élément réservoir primaire, adapté, d'une part, pour contenir un milieu
électrolyte primaire renfermant un principe actif sous une forme au moins
partiellement ionisée ou sous une forme neutre et, d'autre part, pour assurer,
lorsqu'il est placé au contact d'une zone de la peau d'un sujet, un continuum
conducteur ionique entre ladite électrode et ladite zone, et une membrane en
matériau polymère en contact, par une face, avec l'électrode et, par une autre
face, avec l'élément réservoir primaire, ladite membrane étant sélectivement
perméable aux ions et molécules de taille inférieure à un seuil choisi, ledit
ensemble donneur se caractérisant en ce que le matériau polymère constituant
la membrane sélectivement perméable consiste en au moins un
polyétherblocamide formé de motifs, identiques ou différents, de formule:
CA 02271088 2006-04-25
Ta
C~- A - ô- O - B - 0 , dans laquelle A est une séquence
polyamide issue, par perte de ses groupements COOH,
d'un polyamide dicarboxylique possédant un groupement
COOH à chacune des extrémités de sa chaîne et B est une
séquence polyoxyalkylène issue, par perte des deux
groupements hydroxyles, d'un polyoxyalkylène glycol,
dont la chaîne est formée de motifs oxyalkylènes ayant
2 à 9 atomes de carbone et possède un groupement OH à
chacune de ses extrémités, ledit polyétherblocamide
possédant une masse moléculaire moyenne en nombre
comprise entre 10 000 et 300 000 et renfermant une
proportion pondérale de séquences polyamides A comprise
entre 35 $ et 90 %.
Dans la suite de la description, des modes de réalisations
préférentiels de l'invention seront décrits.
L'invention concerne également un ensemble électrode
donneur, pour dispositif d'ionophorèse, du type comportant
une électrode active, un élément réservoir primaire, adapté,
d'une part, pour contenir un milieu électrolyte primaire
renfermant le principe actif sous une forme au moins
partiellement ionisée ou sous une forme neutre et, d'autre
part, pour assurer, lorsqu'il est placé au contact d'une
zone de la peau du sujet, un continuum conducteur ionique
entre ladite électrode active et ladite zone, et une
membrane en matériau polymère en contact, par une face, avec
l'électrode active et, par une autre face, avec l'élément
réservoir primaire, laquelle membrane est sélectivement
perméable eux ions et molécules de taille inférieure à un
seuil choisi, notamment, pour prévenir le passage du
Principe actif neutre ou ionisé à travers la membrane, ledit
ensemble électrode donneur se caractérisant en ce que le
matériau polymère constituant la membrane sélectivement
CA 02271088 1999-05-06
WO 98/19735 PCT/FR97/01997
8
perméable consiste en au moins un polyétherblocamide ayant
la définition donnée plus haut.
Les polyamides dicarboxyliques HOOC-A-COOH,
possédant un groupement COOH à chacune des extrémités de
leurs chaînes et dont dérive la séquence polyamide A des
motifs ~C- A - ô- O - B - 0 constituant le polyétherblocamide
formant le matériau polymère de la membrane, sont obtenus
comme il est bien connu dans l'art, par exemple par
polycondensation d'un ou plusieurs lactames ou/et d'un ou
plusieurs aminoacides ou encore par polycondensation d'un
acide dicarboxylique avec une diamine, ces polycondensations
étant effectuées en présence d'un excès d'un acide
dicarboxylique organique, dont les fonctions carboxyliques
sont fixées, de préférence, à chacune des extrémités de la
molécule d'acide. Ces acides dicarboxyliques se fixent
pendant la polycondensation comme constituants de la chaîne
macromoléculaire du polyamide et en particulier aux
extrémités de cette chaîne, ce qui permet d'obtenir un
polyamide dicarboxylique possédant un groupement COOH à
chacune des extrémités de sa chaîne.
Le polyamide dicarboxylique HOOC-A-COOH précité peut
être ainsi obtenu par polycondensation, en présence d'un
- acide dicarboxylique ayant 4 à 20, de préférence 5 à 12,
atomes de carbone dans la molécule, d'un ou plusieurs
monomères pris dans le groupe formé par les lactames et
aminoacides ayant 9 à 16, de préférence 5 à 12, atomes de
carbone dans la molécule et les associations d'une ou
plusieurs diamines ayant 9 à 16, de préférence 5 à 12;
atomes de carbone dans la molécule avec un ou plusieurs
acides dicarboxyliques ayant 4 à 18, de préférence 5 à 12,
atomes de carbone dans la molécule. En particulier, les
polyamides dicarboxyliques peuvent être obtenus à partir
d'un ou plusieurs monomères choisis parmi caprolactame,
oenantholac~ame, dodécalactame, undécanolactame,
décanolactame, acide amino-11 undécanoique et acide amino-12
dodécanoique, par exemple polyamide 6, polyamide 11,
polyamide 12, copolyamide 6/11 ou 6/12, ou bien être
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
9
produits par polycondensation de l'hexaméthylène diamine
avec l'acide adipiquè, l'acide azélaique, l'acide sébacique
ou l'acide dodécanedioique-1,12, les séquences polyamides
correspondantes étant connues sous les appellations de
nylons 6.6, 6.9, 6.10 ou 6.12, ou par polycondensation de la
nonaméthylène diamine avec l'acide adipique pour former une
séquence polyamide connue sous l'appellation de nylon 9.6.
Les acides dicarboxyliques ayant 4 à 20 et de
préférence 5 à 12 atomes de carbone dans leur molécule, qui
sont utilisés dans la réaction de synthèse du polyamide
dicarboxylique, d'une part, pour permettre la fixation d'un
groupement COOH à chacune des extrémités de la chaîne
polyamide et, d'autre part, comme limitateurs de chaîne,
peuvent étre avantageusement des acides alcanedioiques
comme, par exemple, les acides succinique, adipique,
subérique, azélaique, sébacique, undécanedioique et
dodécanedioique, ou encore des acides dicarboxyliques
cycloaliphatiques ou aromatiques tels que, par exemple, les
acides téréphtalique, isophtalique, cyclohexane
dicarboxylique-1,9. Ces acides dicarboxyliques sont employés
en excès dans la proportion nécessaire pour obtenir un
polyamide de masse moléculaire désirée selon les calculs
classiques pour la technique de polycondensation.
Les masses moléculaires moyennes en nombre des
séquences A issues des polyamides dicarboxyliques peuvent
varier dans un intervalle assez large, ledit intervalle se
situant avantageusement entre 300 et 15 000 et de préférence
entre 800 et 6 000.
Les polyoxyalkylèneglycols à groupements hydroxyles
terminaux, dont dérive la séquence B des motifs
~C- A - ô- 0 - B - 0 constituant le polyétherblocamide
formant le matériau polymère de la membrane, sont
avantageusement des polymères constitués à partir d'au moins
l' un des motifs récurrents -(CHz-CHz-O~ , CHz- CH-O et
C.'H3
~CHz-CHz-CHz-CHz-O~-, notamment polyoxyéthylèneglycols,
CA 02271088 1999-OS-06
WO 98/19735 PCTIFR97/01997
polyoxypropylèneglycols, polyoxytétraméthylèneglycols,
copoly (oxyéthylène/àxypropylène)glycols, copoly (oxyéthy-
lène/oxytétraméthylène)glycols, copoly (oxyéthylène/
oxypropylène/oxytétraméthylène)gl~cols et mélanges de tels
5 polyoxyalkylèneglycols ou/et de leurs copolymères.
Les masses moléculaires moyennes en nombre des
séquences B issues des polyoxyalkylèneglycols à groupements
hydroxyles terminaux peuvent varier assez largement, par
exemple entre 100 et 6 000, et situent plus particulièrement
10 entre 200 et 3 000.
Le polyétherblocamide peut être obtenu par
polycondensation entre le polyamide dicarboxylique
HOOC-A-COOH et le polyoxyalkylène glycol HO-B-OH en présence
de l'acide dicarboxylique choisi comme limitateur de
chaînes, en opérant à l'état fondu au contact d'un
catalyseur consistant en un tétraalcoxyde de titane,
zirconium ou hafnium. Pour plus de détails sur cette
synthèse, on peut se référer, notamment, aux citations
FR-A-2273021 (catalyseur au titane) et FR-A-2901947
(catalyseur au zirconium ou hafnium).
L'épaisseur de la membrane en polyétherblocamide
peut varier avantageusement entre 10 um et 200 um et se
situe plus particulièrement entre 12 um et 100 um.
L'élément réservoir primaire du premier ensemble
électrode ou ensemble électrode donneur a une épaisseur, qui
est comprise avantageusement entre 50 pm et 1 000 um et se
situe plus particulièrement entre 100 um et 600 um.
Dans une forme avantageuse de réalisation du
dispositif d'ionophorèse, le premier ensemble électrode ou
ensemble éîectrode donneur est pourvu également d'un élément
réservoir secondaire renfermant un électrolyte indifférent,
ledit élément réservoir secondaire étant disposé entre
l'électrode dudit ensemble et la membrane en
polyétherblocamide de manière à être en contact avec chacune
d'elles.
Leàit élément réservoir secondaire a une épaisseur
qui peut parier, par exemple, entre 100 um et 4 mm. Le
volume àe cet élément réservoir secondaire est
CA 02271088 1999-OS-06
WO 98/19735 PCTIFR97/01997
11
avantageusement égal ou supérieur au volume de l'élément
réservoir primaire et il se situe plus particulièrement
entre une fois et 12 fois le volume dudit élément réservoir
primaire.
L'électrode du premier ensemble électrode, c'est-à-
dire l'électrode active de l'ensemble électrode donneur, de
même que l'électrode du deuxième ensemble électrode peuvent
être en un métal ou alliage métallique tel que titane,
platine, acier inoxydable ou encore en un matériau
conducteur électronique non métallique tel que carbone ou
graphite. Avantageusement, au moins l'électrode du premier
ensemble électrode, c'est-à-dire l'électrode active de
l'ensemble électrode donneur, et de préférence l'électrode
de chacun des premier et deuxième ensembles électrodes est
une électrode consommable, c'est-à-dire une électrode
renfermant une matière consommable électrochimiquement, qui
se consomme, par oxydation ou réduction électrochimique
suivant le cas, lors du passage du courant pendant le
fonctionnement du dispositif d'ionophorèse.
L'électrode consommable peut être de type cathode ou
de type anode. Dans une électrode consommable de type
cathode, la matière consommable se consomme par réduction.
Une telle cathode consommable peut être choisie
avantageusement parmi les composés métalliques ionisables
dont les ions métalliques sont susceptibles d'être réduits
électrochimiquement en le métal correspondant. Parmi ces
composés métalliques, on peut citer, à titre non limitatif,
les composés AgCl et CuCl. En particulier, on peut
constituer la cathode consommable en associant le composé
métallique au métal lui correspondant de manière à
constituer, au moins au cours du fonctionnement du
dispositif, une électrode réversible. La matière consommable
de la cathode peut être déposée sur un support, lequel
' support peut consister en un matériau isolant et notamment
en un matériau plastique isolant tel que polypropylène,
polyéthylène, PVC, polyester ou bien en un matériau
conducteur électronique métallique ou non métallique
résistant à la corrosion par l'électrolyte en contact avec
CA 02271088 1999-05-06
WO 98/19735 PCT/FR97/01997
12
l'électrode en l'absence de courant comme, par exemple,
argent, titane, platine, acier inoxydable, carbone,
graphite, polymère conducteur.
Dans une électrode consommable du type anode, la
matière consommable électrochimiquement se consomme par
oxydation. Une telle anode consommable peut être constituée,
au moins en partie, par un métal tel que, par exemple, A1,
Cu, Mg, Zn et Ag. Dans ce cas, on peut en particulier
choisir ledit métal consommable par oxydation
électrochimique parmi ceux, tels que l'argent, susceptibles
de former un système réversible électrochimiquement avec les
ions métalliques résultant de l'oxydation électrochimique de
manière à constituer une anode réversible au cours du
fonctionnement du dispositif. Le matériau de l'anode
consommable par oxydation électrochimique peut être déposé
sur un support consistant en un matériau isolant et
notamment en un matériau plastique isolant tel que
polypropylène, PVC, polyéthylène, polyester ou bien encore
en un matériau conducteur électronique métallique ou non
métallique tel que, par exemple, titane, platine, acier
inoxydable, carbone, graphite, polymère conducteur.
La cathode et/ou l'anode peuvent être agencées pour
constituer des électrodes composites formées d'une
composition à base d'un liant polymère, d'une charge
conductrice pulvérulente ou fibreuse, notamment noir de
carbone ou fibres courtes de graphite, et du matériau
consommable de l'électrode sous forme divisée, à savoir,
dans le cas de la cathode, composé métallique
électrochimiquement réductible seul ou associé au métal
correspondant, et, dans le cas de l'anode, métal ou alliage
métallique choisi pour constituer ladite anode. Le liant
polymère est de préférence un polymère à base d'époxy-1,2
propane et/ou d'époxy-1,2 butane comme décrit dans la
citation FR-A-2722993.
Selon une forme de réalisation du dispositif
d'ionophorèse selon l'invention, qui permet de réaliser
l'administration transcutanée d'une quantité totale donnée
d'un principe actif à un sujet, l'une ou l'autre de la
CA 02271088 1999-05-06
WO 98/19735 PCT/FR97/01997
13
cathode et de l'anode est agencée pour constituer une
électrode, dite électrode limitante, formée d'une quantité
limitée d'une matière consommable électrochimiquement
associée soit à un support conducteur électronique, soit à
un support isolant, ladite matière consommable
électrochimiquement étant soit le composé métallique
électrochimiquement réductible lorsque l'électrode limitante
est la cathode ou bien un métal consommable par oxydation
électrochimique, notamment un métal tel que A1, Mg, Zn et
Ag, lorsque l'électrode limitante est l'anode, et ledit
support conducteur électronique étant réalisé en un matériau
qui résiste à la corrosion par l'électrolyte associé à
l'électrode limitante en l'absence de courant et qui
présente, lorsque l'électrode limitante est la cathode, une
surtension d'hydrogène en présence dudit électrolyte au
moins égale à celle de l'aluminium ou bien qui n'est pas
consommable par oxydation électrochimique lorsque
l'électrode limitante est l'anode, tandis que ladite
quantité limitée de matière consommable électrochimiquement
est choisie pour que la quantité d'électricité nécessaire à
sa consommation électrochimique corresponde à la quantité
d'électricité nécessaire pour administrer la quantité totale
donnée de principe actif au sujet, de telle sorte que la
circulation du courant entre les électrodes (anode et
cathode) soit pratiquement interrompue lorsque la matière
consommable de l' électrode limitante a été consommée, et le
principe actif est présent initialement dans l'élément
réservoir primaire au contact de l'électrode associée, en
quantité supérieure à la quantité totale donnée à
administrer au sujet.
Convient en particulier comme support isolant de
l'électrode limitante, un support en un matériau plastique
isolant tel que polypropylène, polyéthylène, PVC ou
polyester.
Comme support conducteur électronique de la cathode
limitante, on peut utiliser avantageusement un support en un
matériau choisi parmi aluminium, argent, titane, tantale,
vanadium, acier inoxydable, zinc, carbone, graphite et
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
14
polymère conducteur. Convient, par exemple, comme support
conducteur de l'anodé limitante, un support en un matériau
choisi parmi platine, titane, acier inoxydable, or, carbone,
graphite et polymère conducteur.
Les supports conducteurs métalliques des électrodes,
anode ou cathode, peuvent être massifs ou consister en
dépôts métalliques de très faibles épaisseurs sur des films
plastiques isolants. Ces dépôts métalliques peuvent être
réalisés par toute technique connue telle que, par exemple,
métallisation sous vide ou pulvérisation cathodique.
A titre d'exemples non limitatifs d'électrodes
utilisables comme cathodes non limitantes ou limitantes dans
le dispositif selon l'invention, on peut citer des
électrodes à base d'AgCl ou de CuCl sur un support
consistant en le métal correspondant ou un support d'acier
inoxydable, de carbone, de polypropylène, de polyéthylène ou
d'un polymère conducteur. Comme exemples d'anodes
consommables non limitantes ou limitantes dans le dispositif
selon l'invention, on peut mentionner, à titre non
limitatif, les électrodes non limitantes à base d'un métal
consommable par oxydation électrochimique choisi parmi A1,
Ag, Cu, Mg et Zn et les électrodes limitantes à base d'un
tel métal déposé sur un support isolant tel que
polypropylène, polyéthylène ou polyester ou sur un support
choisi parmi titane, acier inoxydable, platine, carbone,
graphite ou polymère conducteur.
Comme indiqué précédemment, la matière consommable
électrochimiquement de l'électrode limitante est présente
dans ladite électrode en quantité telle que la quantité
d'électricité nécessaire à sa consommation électrochimique
corresponde à la quantité d'électricité à utiliser pour
administrer la quantité totale donnée du principe actif au
sujet. Cette dernière quantité d'électricité, qui dépend du
système ionophorétique utilisé, c'est-à-dire des milieux
réactionnels en contact avec la cathode et l'anode, àu
signal électrique appliqué aux électrodes et de la nature
desàites électrodes, est déterminée par le biais d'essais
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
préalables pour chaque type de système ionophorétique mis en
oeuvre.
Le générateur électrique applique entre les
électrodes, électrode active et contre-électrode, du
5 dispositif d'ionophorèse, un signal électrique qui peut être
soit un signal intensiométrique, c'est-à-dire un signal
d'intensité moyenne imposée et, par exemple, constante
(signal intensiostatique), soit, de préférence, un signal
potentiométrique, c'est-à-dire un signal de tension moyenne
10 imposée, par exemple constante (signal potentiostatique). Le
signal électrique de type intensiométrique ou de type
potentiométrique peut être continu ou pulsé et permanent ou
intermittent, avec ou sans inversion temporaire de polarité.
Sa fréquence peut aller de 0 (signal continu) à 500 kHz et
15 plus particulièrement de 0 à 100 kHz. Lorsque le signal
électrique est d'un type pulsé, il peut avoir un rapport
cyclique, c'est-à-dire un rapport entre la durée de
l'impulsion élémentaire, dont la répétition forme le signal
pulsé, et l'intervalle de temps séparant deux apparitions
consécutives de cette impulsion, allant de 0,05 à 0,95 et
plus particulièrement de 0,1 à 0,8.
Avantageusement, la tension moyenne du signal
appliqué par le générateur entre la cathode et l'anode est
choisie entre 0,1 et 50 volts et plus spécialement entre 0,3
et 20 volts de telle sorte que la densité du courant moyen
généré entre lesdites électrodes (cathode et anode) ait une
valeur inférieure à 0,5 mA/cm2, plus particulièrement
comprise entre 0,05 et 0,3 mA/cm2 et tout spécialement entre
0, 05 et 0, 2 mA/cm2.
Le générateur de signaux électriques du dispositif
selon l'invention peut être de tout type connu permettant de
générer des signaux électriques d'intensité moyenne imposée
ou de tension moyenne imposée ou encore des signaux des deux
types, qui sont continus ou pulsés et permanents ou
intermittents, avec ou sans inversion temporaire de
polar-té, et qui présentent les caractéristiques définies
ci-dessus.
CA 02271088 1999-05-06
WO 98/19735 PCT/FR97/01997
16
Le milieu électrolyte primaire, qui est présent dans
l'élément réservoir primaire du premier ensemble électrode
ou ensemble électrode donneur, peut être constitué d'une
solution aqueuse ou d'un hydrogel, adhésif ou non,
renfermant le principe actif à administrer sous une forme au
moins partiellement ionisée ou sous une forme neutre.
L'élément réservoir primaire peut encore se présenter sous
la forme d'un solide hydratable constitué d'une matrice,
autoadhésive ou non, en un matériau polymère hydrophobe dans
laquelle sont dispersés un ou plusieurs polymères
hydrosolubles ou hydrophiles et le principe actif à
administrer. Sous cette forme, l'élément réservoir primaire
doit être hydraté au moment de l'utilisation du dispositif
d'ionophorèse. La concentration en principe actif dans la
phase aqueuse (solution aqueuse ou hydrogel) contenue dans
le milieu électrolyte primaire de l'élément réservoir
primaire est avantageusement comprise entre 0,2 ~ en poids
de la phase aqueuse et la concentration de saturation de
ladite phase aqueuse.
L'électrolyte indifférent contenu dans l'élément
réservoir secondaire du premier ensemble électrode ou
ensemble électrode donneur, peut être constitué d'une
solution aqueuse ou d'un hydrogel renfermant un ou plusieurs
sels pharmaceutiquement acceptables ionisables en phase
aqueuse. Lesdits sels sont, notamment, des sels de métaux
alcalins ou alcalinoterreux tels que chlorures, par exemple
NaCl, sulfates, carbonates, nitrates, phosphates,
ascorbates, citrates, acétates et mélanges de tels sels. On
peut également produire l'élément réservoir secondaire
renfermant le milieu électrolyte indifférent sous la forme
d'un solide hydratable formé d'une matrice polymère
hydrophobe dans laquelle sont dispersés un ou plusieurs
polymères hydrophiles et le ou les sels ionisables ou bien
constitué d'une matrice absorbante hydrophile, par exemple
papier filtre, renfermant le ou les sels ionisables à l'état
dispersé. De tels éléments réservoirs sont préparés en
l'absence d'eau et doivent être hydratés au moment de
l'utilisation du dispositif d'ionophorèse.
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
17
De même, le milieu électrolyte contenu dans
l'élément réservoir du deuxième ensemble électrode peut
consister en une solution aqueuse ou en un hydrogel
renfermant un ou plusieurs sels pharmaceutiquement
acceptables ionisables en phase aqueuse, du même type que
les sels présents dans l'électrolyte indifférent contenu
dans l'élément réservoir secondaire du premier ensemble
électrode.
On peut également envisager de constituer l'élément
réservoir du deuxième ensemble électrode sous la forme d'un
solide hydratable comme indiqué pour l'élément réservoir
secondaire.
Des exemples de gels aqueux ou de solutions aqueuses
épaisses sont notamment décrits respectivement dans les
citations US-A-4766164 et US-A-3103166. Des réservoirs de
principe actif ou seulement d'électrolyte indifférent se
présentant sous la forme de solides hydratables sont
décrits, par exemple, dans la citation WO-A-9116943.
Le milieu électrolyte primaire renfermant le
principe actif, de même que le milieu électrolyte de
l'élément réservoir du deuxième ensemble électrode, peuvent
renfermer, si besoin est, des agents susceptibles de
favoriser le passage transcutané du principe actif comme,
par exemple, des agents vasodilatateurs et/ou des agents
amphiphiles parmi lesquels on peut citer, à titre non
limitatif, des composés du type alcool ou du type ester. Ces
agents sont utilisés en concentrations permettant une bonne
solubilité du principe actif dans le milieu. .
On peut introduire le principe actif à administrer
non seulement dans l'élément réservoir primaire du premier
ensemble électrode, mais également dans l'élément réservoir
du deuxième ensemble électrode en donnant au deuxième
ensemble électrode une structure similaire à celle du
premier ensemble électrode et en constituant l'électrode de
chacun des ensembles électrodes par une électrode
consommable réversible, par exemple une électrode réversible
à base du couple Ag/AgCl. Ceci permet, par inversion de la
polarité des signaux électriques appliqués aux électrodes,
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97101997
18
d'administrer le principe actif alternativement à partir de
l'élément réservoir primaire du premier ensemble électrode
et à partir de l'élément réservoir correspondant du deuxième
ensemble électrode.
Le dispositif d'ionophorèse selon l'invention peut
être réalisé à partir de tout dispositif d'ionophorèse
connu, en agençant au moins l'ensemble électrode dudit
dispositif, qui renferme le principe actif, pour lui donner
une structure correspondant à la structure, sans ou avec
élément réservoir secondaire, du premier ensemble électrode,
équipé d'une membrane en polyétherblocamide, du dispositif
selon l'invention, les électrodes étant de préférence des
électrodes consommables et tout particulièrement des
électrodes réversibles, par exemple électrodes à base du
couple Ag/AgCl, avec, le cas échéant, l'une des électrodes
agencée pour constituer une électrode consommable limitante.
En particulier, le dispositif selon l'invention peut
être un dispositif autonome portable, à fixer par bracelet
ou éventuellement à coller sur la peau, comportant des
électrodes ayant chacune une aire inférieure à 50 cm2 et
plus particulièrement comprise entre 1 cm2 et 30 cm2 et un
générateur de signaux électriques miniaturisé. Ainsi, un
dispositif portable autonome selon l'invention peut avoir
une structure analogue à celle des dispositifs d'ionophorèse
portables autonomes décrits, par exemple, dans les citations
US-A-4325367, EP-A-0060452 et FR-A-2509182, sous réserve
qu'au moins l'ensemble électrode dudit dispositif, qui
renferme le principe actif, ait une structure correspondant
à celle du premier ensemble électrode à membrane en
polyétherblocamide, sans ou avec élément réservoir
secondaire, du dispositif selon l'invention. La cathode peut
être, par exemple, une électrode à base d'AgCl ou de CuCl
sur un support d'argent, de cuivre, de carbone, de
polypropylène, de polyéthylène ou d'un polymère conducteur.
L'anode peut être une anode conventionnelle, par exemple
anode en métal ou alliage métallique tel que titane,
platine, acier inoxydable ou encore en un matériau
conducteur électronique non métallique tel que carbone ou
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
19
graphite, ou bien encore une anode consommable non
réversible ou réversible, par exemple anode en un métal tel
que A1, Cu, Mg, Zn et Ag éventuellement déposée sur un
support isolant tel que polypropylène ou polyester ou sur un
support choisi parmi titane, acier inoxydable, platine,
carbone, graphite et polymère conducteur. Lesdites anode et
cathode, dont l'une ou l'autre peut être agencée comme
indiqué ci-dessus pour former une électrode limitante, ont
chacune une aire inférieure à 50 cm2 et plus
particulièrement comprise entre 1 et 30 cm2.
Lorsque le premier ensemble électrode et le deuxième
ensemble électrode sont fixés à la peau au moyen d'un
adhésif, ceci peut être réalisé en munissant d'une couche
d'un adhésif conduisant les ions, la face, destinée à venir
au contact de la peau, de l'élément réservoir de chaque
ensemble électrode ou une zone entourant ladite face.
Le dispositif d'ionophorèse selon l'invention,
lorsqu'il est équipé d'au moins une électrode à base du
couple Ag/AgCl et, de préférence, comporte une anode et une
cathode à base dudit couple Ag/AgCl, peut encore inclure un
ensemble de contrôle de l'état d'avancement de
l'administration transcutanée du principe actif tel que
décrit dans la citation FR-A-2724115.
. Selon l'invention, il est possible de produire
l'ensemble électrode renfermant le principe actif (premier
ensemble électrode ou ensemble électrode donneur), en
réalisant l'élément réservoir primaire et, s'il est utilisé,
l'élément réservoir secondaire sous la forme de solides
hydratables, comme indiqué précédemment, puis en assemblant
à sec lesdits éléments réservoirs, la membrane et
l'électrode pour former l'ensemble électrode à l'état non
hydraté. On peut, de la même manière, produire, sous la
forme d'un solide hydratable, l'élément réservoir du
' deuxième ensemble électrode et assembler à sec ledit
réservoir avec l'électrode associée (contre-électrode) pour
forme- le deuxième ensemble électrode à l'état non hydraté.
Lesdits premier et deuxième ensembles électrodes sont
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
hydratés seulement lors de la mise en fonctionnement du
dispositif d'ionophorése.
La membrane sélectivement perméable présente dans
l'ensemble électrode renfermant le principe actif (premier
5 ensemble électrode ou ensemble électrode donneur) empêche
pratiquement la migration des ions et molécules, qui ont des
masses moléculaires supérieures à 100 daltons et plus
spécialement supérieures à 300 daltons. La présence de cette
membrane au contact de l'élément réservoir primaire
10 renfermant le principe actif permet de confiner ledit
principe actif dans l'élément réservoir primaire et d'éviter
ainsi sa dilution dans l'élément réservoir secondaire, s'il
est présent, et sa dégradation au contact de l'électrode de
l'ensemble électrode.
15 Le dispositif d'ionophorèse selon l'invention permet
d'administrer à un sujet, par voie transcutanée, des
principes actifs divers. I1 est particulièrement efficace
pour l'administration de principes actifs cationiques ou
anioniques issus de molécules thérapeutiques ayant des
20 masses moléculaires supérieures à 100 daltons, telles que,
par exemple, insuline, métoprolol, hydrocodone,
tétracyclines, salbutamol, acide valproique, propanolol,
arginine-desmopressine, fentanyl ou autres ou encore telles
que celles mentionnées dans la citation WO-A-9116943
(cf. page 24, ligne l, à page 25, ligne 18). Le dispositif
selon l'invention est avantageusement utilisable pour
l'administration de principes actifs, notamment anioniques,
de masses moléculaires élevées, c'est-à-dire supérieures à
300 daltons. Comme exemples de tels principes actifs, on
peut citer les sels alcalins ou alcalinoterreux, notamment
sels de sodium, d'oligosaccharides, dont l'administration
ionophorétique est proposée dans la citation FR-A-27295?4 et
qui sont constitués de deux à douze motifs saccharidiques,
dont certains ou tous ont leurs groupements OH remplacés, au
moins en partie, par des groupements fonctionnels choisis
parmi -OSC-, - COO , -NHSO~,, -NH-acyle, -OP03- et -OT, T
étant un radical hydrocarboné et qui présentent un caractère
ionique prcpre à une administration ionophorétique, lesdits
CA 02271088 1999-OS-06
WO 98/19735 21 PCT/FR97101997
oligosaccharides étant plus spécialement des tri-, tétra-,
penta- ou hexasaccharides et tout particulièrement des
pentasaccharides. Comme autres exemples desdits principes
actifs, on peut encore citer les glycosaminoglycanes
anioniques, dont l'administration ionophorétique est
proposée dans la citation FR-A-2729575 et qui consistent en
sels alcalins ou alcalinoterreux, notamment sels de sodium,
potassium ou calcium, de glycosaminoglycanes anioniques dont
les chaînes mucopolysaccharidiques ont des masses
moléculaires comprises entre 1 000 et 15 000 et plus
spécialement entre 2 500 et 10 000, lesdits glycosamino
glycanes anioniques étant notamment des héparines dont les
chaînes mucopolysaccharidiques sont de basses masses
moléculaires, c'est-à-dire de masses moléculaires telles que
définies ci-dessus.
L'invention est illustrée par les exemples suivants
donnés à titre non limitatif:
EXEMPLE 1 .
Etude du passage transdermique d'un sel de sodium de
pentasaccharide par ionophorèse à intensité imposée.
Le pentasaccharide utilisé correspondait à celui
ayant la formule donnée ci-après .
2 5 0 ~ s coo~ o ~ i o 0
0H oH o OSOS 0 0'~ ~ . oK
wo
o~
1~N60~ °~ ~uao~~ osoy
Préalablement aux essais de passage transdermique du
pentasaccharide, on a déterminé, d'une part, les impédances
(résistance) et, d'autre part, les perméabilités passive et
sous ionophorèse au pentasaccharide d'une série de membranes
comportant des membranes selon l'invention formées à partir
de films de deux polyétherblocamides, commercialisés par la
société ELF ATOCHEM sous les dénominations PEBAX~ MV 1091 et
MV 1079, et des membranes selon l'état de la technique
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
22
formées à partir de films d'acétate de cellulose, de
polyamide 11 ou d'un mélange d'acétate de cellulose et~ de
% en poids de polyoxyéthylèneglycol (POEG) de masse
moléculaire égale à 400.
Les PEBAX MV 1041 et MV 1074 sont des
polyétherblocamides, dont les séquences A consistent en un
polyamide 12 de masse moléculaire moyenne en nombre Mn égale
à 4500 (PEBAX MV 1041) ou 1500 (PEBAX MV 1074) et les
séquences B consistent en un polyoxyéthylène de Mn égale à
10 1500, lesdits polyétherblocamides ayant une Mn d'environ
24000 (PEBAX MV 1041) ou d'environ 21000 (PEBAX MV 1074) et
une teneur pondérale en polyamide de 75 % (PEBAX MV 1041) ou
de 50 % (PEBAX MV 1074).
La perméabilité des membranes au pentasaccharide
sous ionophorèse était déterminée en utilisant un dispositif
d'ionophorèse comportant un compartiment donneur et un
compartiment receveur séparés l'un de l'autre par la
membrane à étudier, le compartiment donneur renfermant le
pentasaccharide sous la forme d'une solution aqueuse à 2 ô
en poids et étant équipé d'une cathode à base d'argent
chloruré (cathode Ag/AgCl) et le compartiment receveur
contenant une solution aqueuse de NaCl à 9 g/litre et étant
équipé égaîement d'une anode à base d'argent chloruré. En
opérant à intensité régulée (0,2 mA/cm2), on appliquait au
système une quantité d'électricité correspondant à 2 mAh,
ladite application étant effectuée en 5 heures.
La perméabilité passive des membranes au
pentasaccharide était déterminée en utilisant un dispositif
comparable à celui décrit ci-dessus mais exempt d'électrode.
Dans chacune des déterminations précitées, on
prélevait des échantillons du liquide contenu dans le
compartiment receveur après des durées déterminées et, par
dosage de l'activité antifacteur Xa desdits échantillons, on
obtenait la quantité de pentasaccharide passée dans le
compartimer.~ receveur à travers la membrane.
Les résultats obtenus sont présentés dans le tableau
IA donné ci-après.
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
23
TABLEAU IA
Matriau de la Rsistance Permabilits
pour pour
diverses
paisseurs
membrane (kS2) une paisseur
de
50 um
Passive Ionophorse
25 um 50 m 75 um 100 sur sur
Dun
1 mois 24h/2 mAh
(u9/cm')(u9/cm-)
PEBAX Mv 1041 0,3 0,8 3 < 2 < 5
PEBAX Mv 1074 0,25 0,6 2 4 6
Actate de 90 80 190 19G < 2
cellulose
Polyamide 11 220 > 1000 ~' 0
Mlange actate 9 6 8,5 12 30
de
cellulose/POEG
$
A la lecture du tableau IA, on constate que les
5 membranes formées de films de polyamide I1 ou d'acétate de
cellulose ne sont pas susceptibles d'être utilisées en
ionophorëse car elles sont trop impédantes et entraîneraient
donc des pertes par effet Joule trop importantes pour un
dispositif d'ionophorèse portatif léger. I1 faut également
10 remarquer que si les membranes obtenues à partir du mélange
acétate de cellulose/POEG (10 ~) ont une impédance moins
élevée que les membranes formées à partir de films d'acétate
de cellulose pur, elles sont beaucoup plus perméables, même
par voie passive, ce qui devrait entraîner une rapide
dilution du principe actif dans les deux réservoirs de
l'ensemble électrode, d'où une perte définitive des
performances potentielles de l'ensemble électrode en cas ce
stockage, si ledit ensemble n'est pas exempt d'eau ou àe
solvant du principe actif.
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
24
Les essais de passage transdermique du
pentasaccharide ont été réalisés avec des membranes selon
l'invention en PEBAX MV 1041 ou PEBAX MV 1074 ayant une
épaisseur àe 50 um et, aux fins de comparaison, avec des
membranes composites de 75 um d'épaisseur obtenues à partir
du mélange acétate de cellulose/POEG (10 ~).
On opérait dans des cellules d'ionophorèse de
structure identique. Chaque cellule d'ionophorèse était
constituée de trois compartiments cylindriques adjacents
coaxiaux de 2 cm2 de section transversale, à savoir, dans
cet ordre, un compartiment donneur, un compartiment receveur
et un compartiment de contre-électrode, ces trois
compartiments étant séparés, chacun du suivant et de façon
étanche, par un morceau de peau de rat nu d'un même lot
servant d'échantillon de peau pour l'étude de la diffusion
transdermique. Le compartiment donneur renfermait une
solution aqueuse à 2 ~ en poids du sel de sodium du
pentasaccharide précité ayant une activité antifacteur Xa de
0,65 unité "Golden Standard" par microgramme. Le
compartiment receveur, d'un volume de 10 ml, renfermait une
solution de NaCl à 9 g/litre et était agité à l'aide d'un
barreau magnétique. Le compartiment de contre-électrode,
d'un volume de 0,5 ml, renfermait une solution aqueuse à 2
en poids de NaCl. A son extrémité opposée au compartiment
receveur, le compartiment donneur était équipé d'une
électrode négative ou cathode consistant en un film de 15 um
d'épaisseur en argent chloruré sur une face pour renfermer
une couche d'AgCl correspondant à 2 mAh/cm2. De manière
identique au compartiment donneur, le compartiment de
contre-électrode était équipé d'une électrode positive ou
anode (contre-électrode) constituée d'un film d'argent de
15 um d'épaisseur faiblement chloruré en surface (quantité
d'AgCl correspondant à 0,1 mAh/cm2). La face chlorurée de
chaque électrode était tournée du côté de l'échantillon de
peau de rat.
Les échantillons de peau de rat avaient été
débarrassés des tissus sous-cutanés et conservés par
congélation à -40°C jusqu'à leur montage dans la cellule
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
d'ionophorèse, faces dermiques tournées vers le compartiment
receveur, après un passage de 15 minutes dans du sérum
physiologique.
Pour chacun des essais réalisés, six cellules
5 d'ionophorèse identiques étaient mises en route
simultanément. La surface active d'échange était de 2 cm~
pour chaque échantillon de peau.
Un générateur de courant, équipé de fonctions de
sécurité lui interdisant de dépasser une tension maximale de
10 5 volts, imposait aux électrodes de chacune des six cellules
d'ionophorèse, un courant continu d'intensité constante
égale à 0,4 mA, soit 0,2 mA/cm2. Le courant produit par le
générateur était appliqué pendant 5 heures, l'électrode du
compartiment donneur de chaque cellule étant reliée au pôle
15 négatif dudit générateur et les contre-électrodes au pôle
positif.
Au bout de ladite durée, on prélevait une partie
aliquote du milieu contenu dans le compartiment receveur et
déterminait, par dosage, la quantité de pentasaccharide
20 ayant traversé la peau séparant les compartiments donneur et
receveur de chaque cellule. Un deuxième prélèvement était
réalisé 22 heures après le début de chaque expérience, soit
17 heures après l'arrêt du signal électrique, afin de
laisser diffuser une part importante des quantités de
25 principe actif pentasaccharide retenues dans l'échantillon
de peau en l'absence de circulation sanguine sous-cutanée.
Cinq essais la à 1e ont été réalisés comme suit .
Essai la . Le compartiment donneur avait un volume
de 0,5 ml (5 mg/cm2 de principe actif) et aucune membrane
n'était utilisée.
Essai lb . Le compartiment donneur avait un volume
de 0,1 ml (1 mg/cm2 de principe actif) et aucune membrane
n'était utiïisée.
Essai lc . Le compartiment donneur comportait un
réservoir de principe actif (élément réservoir primaire)
contenant 0,1 ml d'une solution aqueuse du principe actif à
2 ô en poids (1 mg/cm2 de principe actif) et séparé d'un
compartiment d'électrode (élément réservoir secondaire)
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
26
ayant un volume de 0,8 ml et contenant une solution de NaCl
à 5 g/litre, par une- membrane formée d'un film de 75 ~Zm
d'épaisseur obtenu à partir du mélange précité d'acétate de
cellulose et de 10 ~ en poids de~ POEG de masse moléculaire
égale à 400.
Essai ld . Le compartiment donneur avait la même
structure que celui de l'essai lc, mais la membrane était
constituée d'un film de PEBAX MV 1041 ayant 50 um d'épaisseur.
Essai le . Le compartiment donneur comportait un
réservoir de principe actif (élément réservoir primaire)
constitué d'un hydrogel à base d'agarose ayant une épaisseur
de 250 um et renfermant 2 ~ en poids de principe actif, soit
0,5 mg/cm2 de principe actif, séparé d'un compartiment
électrode (élément réservoir secondaire) ayant un volume de
0,6 ml et renfermant une solution aqueuse de NaCl à
0,5 g/litre, par une membrane consistant en un film de PEBAX
MV 1079 ayant une épaisseur de 50 um.
Pour chacun des essais, on a déterminé sur des
parties aliquotes prélevées dans les compartiments receveurs
des six cellules, l'activité moyenne antifacteur Xa par ml
de milieu représentative de la quantité de pentasaccharide
ayant diffusé dans ces compartiments à l'issue des 5 heures
d'application du courant et 22 heures après le début de
chaque expérience, soit 17 heures après l'arrêt dudit
courant.
Le dosage du pentasaccharide dans le compartiment
receveur était fondé sur la recherche de son activité
antifacteur Xa. Le dosage était réalisé, soit directement
sur le milieu prélevé dans le compartiment receveur, soit
après dilution, à l'aide d'un coffret de dosage ROTACHROM
HEPARIN 8~, de tampon complémentaire pour appareil de dosage
et d'antithrombine III bovine, ces divers éléments étant
fournis par la société STAGO, en faisant appel à un appareil
de dosage HITACHI 717. L'établissement de la courbe
d'étalonnage était effectué à l'aide d'une solution étalon
de pentasaccharide dite étalon "Golden Standard" à laquelle
on a attribué une activité antifacteur Xa égale à 13 unités
par ml.
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
27
Les résultats des essais d'ionophorèse et d'essais
d'administration passive sont rassemblés dans le tableau IB.
Les données présentées dans ce tableau sont des
résultats moyens calculés sur des séries de six cellules
identiques recevant les mêmes quantités d'électricité. Les
écarts standards à la moyenne sont généralement inférieurs à
~, sauf pour le transport passif où l'écart standard à la
moyenne atteint près de 35 ô. Toutes les cellules ont reçu
la même quantité d'électricité à l'exception des cellules de
10 l'essai passif (transport passif sans courant) et des
cellules de l'essai lc, pour lesquelles le générateur était
à la limite de ses possibilités et n'a pu assurer la
totalité du courant demandé en raison de l'impédance élevée
des membranes à base d'acétate de cellulose et de POEG
15 utilisées dans cet essai.
TABLEAU IB
Essai Passif la lb lc ld le
Quantit finale de courant 0 1 1 0,9 1 1
(mAh/cm2)
Quantit initiale de 5 5 1 1 1 0,5
principe actif (mg/cm2)
Activit aXa/ml 5 heures 0,2 23 22 15 59 49
Quantit de principe actif 1 115 110 75 295 245
5 heures (ug/cm2)
Activit aXa/ml 22 heures 0,3 30 28 20 70 62
Quantit de principe actif 1,5 150 140 110 390 310
22 heures (ug/cmz)
Quantit de principe actif 150 140 125 390 310
par mAh (ug/cm2)
Taux d'utilisation du 0,03 3 14 11 39 62
principe actif ()*
* Taux d'utilisation du principe actif = rapport de la
quantité de principe actif à 22 heures à la quantité
initiale de principe actif.
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
28
La lecture du tableau IB montre que le transport
passif du pentasaccharide est très faible, qu'il y a une
certaine antinomie entre les quantités de principe actif
passées par mAh et les taux d'épuisement des électrodes
(taux d'utilisation du principe actif ou rendement produit)
et qu'il est préférable d'utiliser des réservoirs de faible
épaisseur permettant de réduire la quantité de principe
actif si I'on veut en améliorer les rendements, comme il
ressort de la comparaison des essais la et lb.
On constate également, en comparant les essais ld et
lb, que lorsqu'on interpose entre l'électrode et le
réservoir de principe actif une membrane selon l'invention
en un polyétherblocamide et un réservoir d'électrode
(élément réservoir secondaire) de plus grand volume que 'le
volume du réservoir de principe actif (élément réservoir
primaire), on accroît très sensiblement (de presque trois
fois) à la fois la quantité de principe actif administrée
par unité de quantité d'électricité et le taux d'épuisement
en principe actif de l'ensemble électrode donneur.
Le choix de cette combinaison permet d'atteindre des
taux d'épuisement encore plus élevés en utilisant des
réservoirs de principe actif très peu épais, comme le montre
l'essai le, en tirant le meilleur profit des très faibles
quantités de principe actif présentes par unité de surface.
I1 apparaît également que les membranes à base du
mélange d'acétate de cellulose et de POEG sont nettement
moins efficaces que les membranes à base de
polyétherblocamide.
EXEMPLE 2 .
Administration chez le microporc du sel de sodium
d'un pentasaccharide par ionophorèse à densité de courant
imposé.
Le microporc de souche YUCATAN est considéré par les
spécialistes comme un excellent modèle animal pour l'étude
de l'administration chez l'homme des médicaments par
ionophorèse. En effet la structure de la peau de cet animal
est très voisine de celle de la peau humaine.
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
29
Les essais suivants ont été conduits chez le
microporc précité dans le but de comparer l'administration,
par ionophorèse, du sel de sodium du pentasaccharide utilisé
dans l'exemple 1 avec une administration par injection sous
cutanée.
Pour ces essais, on constituait des paires
d'ensembles électrodes adhésifs, chaque paire comportant un
ensemble électrode donneur, équipé d'une électrode négative
réversible (électrode active) et renfermant le
pentasaccharide à administrer et un ensemble électrode
passif formé d'une électrode positive (contre-électrode) en
contact avec un deuxième élément réservoir renfermant un
électrolyte indifférent.
Chaque ensemble électrode donneur avait une
Z5 structure analogue à l'une ou l'autre des structures
schématisées, à titre d'exemple non limitatif, sur les deux
figures du dessin annexé, où .
- la figure 1 illustre un ensemble électrode témoin
formé d'une électrode négative réversible en contact direct
avec un élément réservoir unique ; et
- la figure 2 illustre un ensemble électrode donneur
selon l'invention comportant un élément réservoir primaire
et un élément réservoir secondaire, séparés l'un de l'autre
par une membrane sélectivement perméable en
polyétherblocamide, et une électrode négative en contact
direct avec l'élément réservoir secondaire.
Chaque ensemble électrode témoin schématisé sur la
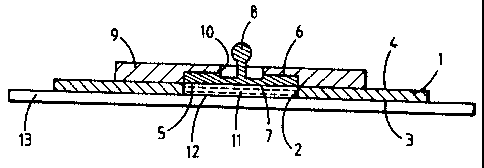
figure 1 ccmportait un disque 1 en mousse de polyéthylène
présentant un évidement cylindrique axial 2, ledit disque
comportant une face adhésive 3 et une face 9 non adhésive,
chacune desdites faces ayant la forme d'une zone annulaire
de deux centimètres de largeur. L'extrémité 5 de l'évidement
du disque, côté face non-adhésive, était obturé par une
électrode 6 ayant la forme d'un disque d'argent chloruré sur
l'une de ses faces, ledit disque ayant une section de
20 cm2. La face chlorurée 7 du disque électrode était
tournée vers l'intérieur de l'évidement. La face non-
chlorurée àudit disque portait une prise de contact 8 du
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
type bouton-pression, soudée à ladite face au moyen d'un
adhésif conducteur électronique, et elle s'appuyait contre
un disque support 9 en mousse de polyéthylène coaxial au
disque 1 et présentant un évidement axial 10 pour permettre
5 l'accès à la prise de contact 8. Ledit disque support, de
diamètre compris entre celui de l'électrode 6 et du
disque 1, était collé sur la face non-adhésive de ce dernier
disque. L'évidement 2 du disque 1 était rempli d'un matériau
poreux absorbant conducteur renfermant le pentasaccharide et
10 formant élément réservoir 11. La face adhésive 3 du disque 1
était enduite d'un adhésif sensible à la pression agréé pour
étre appliqué sur la peau, ladite face 3 et la face 12
adjacente de l'élément réservoir 11 étant initialement
recouvertes d'un film protecteur pelable anti-adhérent 13 en
15 polyester, que l'on retirait avant application sur la peau.
Chaque ensemble électrode donneur selon l'invention
schématisé sur la figure 2 comportait, d'une part, un
disque 1 en mousse de polyéthylène présentant un évidement
cylindrique axial 2 et, d'autre part, un disque étagé 14
20 également en mousse de polyéthylène, ledit disque 14 étant
coaxial au disque 1 et présentant un évidement
cylindrique 15 de même diamètre que l'évidement 2 du
disque 1. Ledit disque 1 comportait une face adhésive 3 et
une face 4 non-adhésive, chacune desdites faces ayant la
25 forme d'une zone annulaire de deux centimètres de largeur.
Le disque étagé 14, de diamètre inférieur à celui du
disque 1, était collé par une face 16 sur la face 4 dudit
disque 1. Les évidements 2 et 15 étaient séparés l'un de
l'autre par une membrane sélectivement perméable 17 en
30 polyétherblocamide, ladite membrane étant collée par une
face à la face 4 du disque 1 et par une autre face à la face
16 du disque étagé 14. L'extrémité 18, la plus éloignée de
la membrane, de l'évidement 15 du disque étagé 14 était
obturée par une électrode 6 ayant la forme d'un disque
d'argent chloruré sur l'une de ses faces, ledit disque ayant
une section de 20 cm2. La face chlorurée 7 du disque
électrode était tournée vers l'intérieur de l'évidement 15.
La face non-chlorurée dudit disque portait une prise de
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97l01997
31
contact 8 du type bouton-pressoir, soudée à ladite face au
moyen d'un adhésif conducteur électronique, et elle
s'appuyait contre un disque support 9 en mousse de
polyéthylène, coaxial au disque 1 et au disque étagé 14 et
présentant un évidement axial 10 pour permettre l'accès à la
prise de contact 8. Ledit disque support, de diamètre
compris entre celui de l'électrode 6 et celui de la face 19
du disque étagé 14, était collé sur ladite face.
L'évidement 2 du disque 1 était rempli d'un matériau poreux
absorbant conducteur renfermant le pentasaccharide (milieu
électrolyte primaire) et constituant un élément réservoir
primaire 11. L'évidement 15 du disque étagé 14 était rempli
d'un hydrogel conducteur 20 renfermant un électrolyte
indifférent et constituant un élément réservoir secondaire.
La face adhésive 3 du disque 1 était enduite d'un adhésif
sensible à la pression agréé pour être appliqué sur la peau,
ladite face 3 et la face 12 adjacente de l'élément réservoir
primaire 11 étant initialement recouvertes par un film
protecteur pelable antiadhérent 13 en polyester, que l'on
retirait avant application sur la peau.
Dans l'ensemble électrode donneur selon l'invention
ainsi que dans l'ensemble donneur témoin, l'électrode 6 en
argent chloruré renfermait une quantité de chlorure d'argent
équivalent à 1,8 mAh/cm2, permettant ainsi à l'électrode de
supporter la quantité de courant traversant les électrodes
pendant la durée de traitement ionophorétique, à savoir
0 , 8 8 mAh / cm2 .
Le milieu électrolyte primaire constituant l'élément
réservoir primaire 11 de l'ensemble électrode donneur selon
l'invention, de même que le matériau poreux absorbant
conducteur formant l'élément réservoir 11 de l'ensemble
électrode témoin, étaient constitués, chacun, d'une feuille
de papier buvard en fibres de cellulose additionnées àe
fibrilles de polypropylène, ayant une surface de 20 cm2 et
une épaisseur de 0,5 mm et étant imbibée, à raison de
50 mg!cmz, d'une solution aqueuse contenant 2 ~ en poids de
pentasaccharide. Chaque élément réservoir 11 contenait en
tout 1 g de solution, soit 20 mg de pentasaccharide pour
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
32
20 cm2 de surface active (1 mg/cm2). On a donc engagé 20 mg
de pentasaccharide en tout par animal.
L'hydrogel conducteur 20 formant l'élément réservoir
secondaire avait une épaisseur de 3 mm et consistait en un
hydrogel à base d' agarose renfermant une solution de NaCl à
0,1 g/1 de ce composé.
La membrane sélectivement perméable séparant les
évidements 2 et 15 de l'ensemble électrode donneur selon
l'invention, c'est-à-dire séparant les éléments réservoirs
primaire 11 et secondaire 20 dudit ensemble électrode, était
constituée d'un film de 50 um d'épaisseur du
polyétherblocamide PEBAX MV 1041 défini dans l'exemple 1.
Dans chaque ensemble électrode passif, l'électrode
positive (contre-électrode) en argent chloruré renfermait
une quantité de chlorure d'argent équivalent à 0,1 mAh/cm~
et l'élément réservoir associé à cette électrode était
constitué d'une feuille de papier buvard en fibres àe
cellulose additionnées de fibrilles de polypropylène ayant
une surface de 20 cm2 et une épaisseur de 0,5 mm et étant
imbibée d'une solution aqueuse de NaCl pour renfermer 6 % en
poids de ce sel.
Un générateur de signaux électriques, connectable
aux électrodes de chaque paire d'ensembles électrodes
permettait de délivrer entre lesdites électrodes un signal
électrique continu d'intensité régulée.
Cinq jours avant chaque essai, les animaux étaient
cathétérisés au niveau des deux jugulaires, ainsi qu'il est
bien connu pour toute expérimentation d'administration de
médicaments, afin de permettre des prélèvements réguliers de
sang destinés à doser les activités antifacteur Xa et, par
là, à évaluer les quantités de principe actif ayant traversé
la peau pour pénétrer le système circulatoire et donc à
vérifier l'efficacité du traitement ionophorétique.
Les animaux, à jeun depuis la veille des
expérimentations, étaient placés dans des hamacs
spécialisés. On collait par simple pression sur le dos de
chaque animal préalablement nettoyé à l'aide d'un tissu
humide, de part et d'autre de la colonne vertébrale, une
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
33
paire d'ensembles électrodes préalablement débarrassés. de
leur film protecteur pelable et on connectait, par
l'intermédiaire de câbles munis de pinces adaptées aux
prises de contact installées à cet effet, l'électrode
négative de l'ensemble électrode donneur au pôle négatif du
générateur et la contre-électrode de l'ensemble électrode
passif au pôle positif dudit générateur.
Entre les électrodes négative et positive de chaque
paire d'ensembles électrodes collés sur l'animal, on
établissait, grâce au générateur, un courant de 2,2 mA (soit
une densité de courant de 0,11 mA/cm2) pendant une durée de
8 heures et on pratiquait divers prélèvements de sang sur
diatube H STAGO~ au cours du temps et ce jusqu'à 30 heures
après le début de chaque expérience soit 22 heures après la
fin du traitement ionophorétique. Chaque essai
ionophorétique a été reproduit sur quatre microporcs mâles
de poids égal à 12,1 kg en moyenne.
Outre l'essai selon l'invention et l'essai témoin
d'administration du principe actif pentasaccharide par
ionophorèse mis en oeuvre comme décrit ci-dessus (essai 2b
selon l'invention et essai 2c témoin), on effectuait
également des essais comparatifs 2a et 2d comme suit, chaque
essai étant reproduit sur quatre microporcs, comme dans le
cas de l'administration ionophorétique .
- essai 2a . mise en place des ensembles électrodes
comme dans les essais d'ionophorèse 2b et 2c, mais sans
application de courant (détermination du transport passif),
- essai 2d . injection sous-cutanée de 0,200 mg/kg
de pentasaccharide en solution injectable.
Dans ces essais 2a et 2d, on pratiquait un certain
nombre de prélèvements sanguins au cours du temps et jusqu'à
30 heures après le début de chaque expérience comme dans le
cas du traitement ionophorétique des essais 2b et 2c.
Les teneurs plasmatiques des différents prélèvements
sanguins, exprimées en unités "Golden standard"
d'antifacteur Xa, sont indiquées dans le tableau II aux fins
de comparaison des taux plasmatiques moyens obtenus sur des
animaux de même souche et de même poids traités avec le même
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
34
principe actif dans les conditions des essais selon
l'invention (essai 2b) et des essais comparatifs (essais .2a,
2c et 2d).
TABLEAU II
Units antifacteur
Xa/ml
Essai 2a 2b 2c 2d
Dure(heures)
0 0 0 0 0
0, 25 0 0, 07 0, 03 0, 11
0, 50 0 0, 14 0, 05 0, 13
1, 00 0 0, 36 0, 09 0, 17
2, 00 0 0, 81 0, 13 0, 22
9, 00 0 1, 3 0, 27 0, 26
6, 00 0 0, 98 0, 29 0, 24
8, 00 0 1 0, 35 0, 15
10, 00 0 0, 79 0, 34 0, 12
12, 00 0 0, 61 0, 14 0, 06
16, 00 0 0, 38 0, 11 0, 06
24,00 0 0,12 0,08 0,00
30, 00 0 0, 04 0, O1 0, 00
mAh 0 0,88 0,88 0
Poids des microporcs 12,3 kg 11,9 kg 12,2 kg 12 kg
PS administr (mg) 0 13,2 9,2 2,4
PS administr 0 0,66 0,21
( mg / cm2 )
PS administr 0,755 0,233
( mg /mAh . cm~ )
Biodisponibilit (%) 0 66 20
La comparaison des résultats présentés au tableau II
fait apparaître que le traitement par voie ionophorétique
pratiqué selon l'invention conduit à des taux plasmatiques,
exprimés en antifacteur Xa, supérieurs de plus de trois fois
à ceux que '_'on obtient par voie ionophorétique en utilisant
un élément réservoir de principe actif identique à celui
utilisé seïon l'invention, mais sans faire appel à la
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
structure à deux réservoirs séparés par la membrane en
polyétherblocamide.
En particulier, la biodisponibilité, c'est-à-dire le
taux de principe actif réellement administré rapporté aux
5 quantités de principe actif dans les ensembles électrodes
donneurs, est d'environ 66 % dans le traitement
ionophorétique selon l'invention (essai 2b) contre seulement
environ 20 % dans le traitement ionophorétique témoin
(essai 2c).
10 On peut encore observer que la biodisponibilité pour
les essais in vivo est supérieure aux taux d'utilisation qui
ont été obtenus pour les essais in vitro (exemple 1).
EXEMPLE 3 .
Administration chez le microporc du sel de sodium
15 d'une héparine de basse masse moléculaire par ionophorèse à
densité de courant imposée.
Les essais décrits dans cet exemple ont été conduits
sur des microporcs de souche YUCATAN, dans le but de
comparer l'administration, par ionophorèse, d'un principe
20 actif constitué du sel de sodium d'une héparine de basse
masse moléculaire à une administration dudit principe actif
par voie passive ou par injection sous-cutanée.
Le principe actif était obtenu comme décrit dans la
citation EP-A-0181252 et possédait une masse moléculaire
25 moyenne allant de 9 000 à 5 000 et une activité antifacteur
Xa, exprimée en Unités Internationales (en abrégé UI), égale
à 100 UI/mg.
Selon les essais, l'administration du principe actif
était réalisée par voie passive (essai 3a), par ionophorèse
30 selon l'invention (essai 3b), par ionophorèse témoin (essai
3c) ou par injection sous-cutanée (essai 3d).
Po;:r les essais d'ionophorèse ou d'administration
passive, on constituait des paires d'ensembles électrodes
adhésifs, chaque paire comportant un ensemble électrode
35 donneur, équipé d'une électrode négative réversible
(électrode active) et renfermant le principe actif à
administrer, et un ensemble électrode passif formé d'une
électrode positive (contre-électrode) en contact avec un
CA 02271088 1999-05-06
WO 98/19735 PCT/FR97/01997
36
deuxième élément réservoir renfermant un électrolyte
indifférent.
L'ensemble électrode donneur de chaque paire
d'ensembles électrodes avait une~structure analogue à celle
schématisée sur la figure 2 dans le cas de l'essai 3b
(ionophorèse selon l'invention) ou à celle représentée sur
la figure 1 dans le cas de l'essai 3c (ionophorèse témoin).
Dans l'ensemble électrode donneur selon l'invention
ainsi que dans l'ensemble donneur témoin, l'électrode 6 en
argent chloruré avait une surface de 25 cm2 et renfermait
une quantité de chlorure d' argent équivalente à 2, 4 mAh/cm2,
permettant ainsi à l'électrode de supporter la quantité de
courant traversant les électrodes pendant la durée du
traitement ionophorétique, à savoir 1,92 mAh/cm2.
Le milieu électrolyte primaire constituant l'élément
réservoir primaire 11 de l'ensemble électrode donneur selon
l'invention, de même que le matériau poreux absorbant
conducteur formant l'élément réservoir 11 de l'ensemble
électrode témoin, étaient constitués, chacun, d'une feuille
de papier buvard en fibres de cellulose additionnées de
fibrilles de polypropylène, ayant une surface de 25 cmz et
une épaisseur de 0,5 mm et étant imbibée, à raison de
50 mg/cm2, d'une solution aqueuse contenant 5 % en poids de
principe actif. Chaque élément réservoir 11 contenait en
tout 1,25 g de solution, soit 62,5 mg de principe actif pour
25 cm2 de surface active (2, 5 mg/cm2) . On a donc engagé 62, 5
mg de principe actif en tout par animal.
L'hydrogel conducteur 20 formant l'élément réservoir
secondaire avait une surface de 25 cm2 et une épaisseur de 2
mm et consistait en un hydrogel à base d' agarose renfermant
une solution de NaCl à 0,1 g/1 de ce composé, la quantité
d'hydrogel représentant 200 mg/cm2.
La membrane sélectivement perméable séparant les
évidements 2 et 15 de l'ensemble électrode donneur selon
l'invention, c'est-à-dire séparant les éléments réservoirs
primaire let secondaire 20 dudit ensemble électrode, était
constituée d'un film de 50 um d'épaisseur du
polyétherblocamide PEBAX MV 1041 défini dans l'exemple 1.
CA 02271088 1999-OS-06
WO 98/19735 PCTlFR97/01997
37
Dans chaque ensemble électrode passif, l'électrode
positive (contre-électrode) en argent chloruré avait une
surface de 25 cm2 et renfermait une quantité de chlorure
d'argent équivalente à 0,1 mAh/cm2. L'élément réservoir
associé à cette électrode était constitué d'un hydrogel
d'agarose ayant une surface de 25 cm2 et une épaisseur de
0,2 mm (200 mg/cm2), ledit hydrogel renfermant une solution
saline à 2 % en poids de NaCl.
Un générateur de signaux électriques, connectable
aux électrodes de chaque paire d'ensembles électrodes
permettait de délivrer entre lesdites électrodes un signal
électrique continu d'intensité régulée.
Les animaux étaient conditionnés pour les essais
comme indiqué dans l'exemple 2. En outre, la mise en place
des paires d'électrodes sur les animaux, pour
l'administration ionophorétique, était réalisée comme décrit
dans ledit exemple 2.
Pour la mise en oeuvre des essais d'ionophorèse
selon l'invention (essai 3b) et témoin (essai 3c), entre les
électrodes négative et positive de chaque paire d'ensembles
électrodes collés sur l'animal, on établissait, grâce au
générateur, un courant de 4 mA (soit une densité de courant
de 0,16 mA/cm2) pendant une durée de 12 heures et on
pratiquait divers prélèvements de sang sur diatube H STAGO~
au cours du temps et ce jusqu'à 30 heures après le début de
chaque expérience soit 18 heures après la fin du traitement
ionophorétique. Chaque essai ionophorétique a été reproduit
sur quatre microporcs mâles.
Outre l'essai selon l'invention (essai 3b) et
l'essai témoin (essai 3c) d'administration du principe actif
par ionophorèse mis en oeuvre comme décrit ci-dessus, on
effectuait également des essais comparatifs 3a et 3d comme
suit, chaque essai étant reproduit sur quatre microporcs,
comme dans le cas de l'administration ionophorétique
- essai 3a . mise en place des ensembles électrodes
comme dans les essais d'ionophorèse 3b et 3c, mais sans
application de courant (détermination du transport passif),
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
38
- essai 3d . injection sous-cutanée de 4,5 mg, de
principe actif en solution injectable.
Dans ces essais 3a et 3d, on pratiquait un certain
nombre de prélèvements sanguins au cours du temps et jusqu'à
30 heures après le début de chaque expérience comme dans le
cas du traitement ionophorétique des essais 3b et 3c.
Les teneurs plasmatiques des différents prélèvements
sanguins, exprimées en unités internationales d'antifacteur
Xa, sont indiquées dans le tableau III aux fins de
comparaison des taux plasmatiques moyens obtenus sur des
animaux de même souche et de même poids traités avec le même
principe actif dans les conditions des essais selon
l'invention (essai 3b) et des essais comparatifs (essais 3a,
3c et 3d) .
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
39
TABLEAU III
Activit
antifacteur
Xa (U.I./ml)
Essai 3a 3b 3c 3d
Dure(heures)
0 0 0 0 0
0, 50 0 0, 09 0, 03 0, 41
l, 00 0 0, 23 0, 09 2, 64
l, 50 0 0, 34 0, 12 3, 09
2, 00 0 0, 92 0, 19 3, 08
3, 00 0 0, 46 0, 13 3, 49
4, 00 0 0, 58 0, 21 3, 39
6, 00 0 0, ~8 0, 26 2, 71
8,00 0 0,72 0,33 2,28
10, 00 0 0, 68 0, 29 0, 21
12,00 0 0,74 0,26 0,12
16, 00 0 0, 18 0, 11 0, 00
24, 00 0 0, 06 0, 09 0, 00
30,00 0 0,00 0,02 0,00
0 1, 92 1, 92 0
Poids moyen des 12,9 kg 13,6 kg 11,9 kg 13 kg
microporcs
PA administr (mg) 0 8,219 3,046 4,5
PA administr 0 0,328 0,122
(mg/cm2 )
PA administr 0,171 0,063
(mg/mAh.cm2)
Biodisponibilit (~) 0 13,1 4,9
CA 02271088 1999-OS-06
WO 98/19735 PCT/FR97/01997
La comparaison des résultats présentés , au
tableau III fait apparaître que le traitement par voie
ionophorétique pratiqué selon l'invention conduit à des taux
plasmatiques, exprimés en antifacteur Xa, supérieurs
5 d'environ trois fois à ceux que l'on obtient par voie
ionophorétique en utilisant un élément réservoir de principe
actif identique à celui utilisé selon l'invention, mais sans
faire appel à la structure à deux réservoirs séparés par la
membrane en polyétherblocamide.
10 En particulier, la biodisponibilité, c'est-à-dire le
taux de principe actif réellement administré rapporté aux
quantités de principe actif dans les ensembles électrodes
donneurs, est d'environ 13.1 ~ dans le traitement
ionophorétique selon l'invention (essai 3b) contre seulement
15 environ 4,9 ~ dans le traitement ionophorétique témoin
(essai 3c).