Note: Descriptions are shown in the official language in which they were submitted.
CA 02271437 1999-OS-06
WO 98/22606 PCT/FR97/02043
ADENOVIRUS RECOMBINANTS BICISTRONIQUES POUR LE TRAITEMENT DE PATHOLOGIES LIEES
AUX
DYSLIPOPROTEINEMIES
La présente invention concerne de nouveaux virus recombinants, leur
préparation et
leur utilisation en thérapie génique, pour le transfert et l'expression in
vivo de gènes
désirés. Plus précisément, elle concerne des vinas recornbinants comprenant au
moins
deux gènes insérés et dont les produits d'e;~pression interviennent au niveau
du
transport inverse du cholestérol. Elle se rapporte également des plasmides
navettes
utiles pour la production d'adénovirus conformes à l'invention. Plus
particulièrement,
la présente invention concerne des adénovirus recombinants défectifs et leur
utilisation
pour la prévention ou le traitement des pathologies liées aux
dyslipoprotéinémies, qui
sont connues pour leurs conséquences graves au niveau cardiovasculaire et
neurologique.
Les dyslipoprotéinémies sont des désordres du métabolisme des
lipoprotéines, responsables du transport, dans le sang et les fluides
périphériques, de
lipides comme le cholestérol et les triglycérides. Elles conduisent à des
pathologies
importantes, liées respectivement à l'hypercholestérolémie ou
fhypertriglycéridémie,
telles que notamment l'athérosclérose.
L'athérosclérose est une maladie complexe, polygénique, qui est définie sur
le plan histologique par des dépôts (plaques lipidiques ou fibro-lipidiques)
de lipides et
d'autres dérivés sanguins dans la paroi des grosses artères (aorte, artères
coronaires,
carotide). Ces plaques, plus ou moins calcifiées selon l'avancement du
processus,
peuvent être jumelées à des lésions et sont liÉies à l'accumulation dans les
artères de
dépots graisseux constitués essentiellement d'esters de cholestérol. Ces
plaques
s'accompagnent d'un épaississement de la paroi artérielle, avec hypertrophie
du muscle
lisse, apparition de cellules spumeuses et accumulation de tissu fibreux. La
plaque
athéromateuse est très nettement en relief sur la paroi, ce qui lui confère un
caractère
sténosant responsable des occlusions vasculaires par athérome, thrombose ou
embolie
qui surviennent chez les patients les plus atteints.
Les hypercholestérolémies peuvent donc conduire à des pathologies cardio-
vasculaires
FEUILLE DE REMPLACEMEN'i' (REG~-E 36)
CA 02271437 1999-OS-06
WO 98I22606 PCT/FR97/02043
2
très graves telles que l'infarctus, la mort subite, la décompensation
cardiaque, les
accidents cérébro-vasculaires, etc.
II est donc particulièrement important de pouvoir disposer de traitements
permettant de diminuer dans certaines situations pathologiques les taux de
cholestérol plasmatique voire de stimuler fefflux de cholestérol (transport
inverse du
cholestérol) au niveau des tissus périphériques afin de décharger les cellules
ayant
accumulé du cholestérol dans le contexte de la formation d'une plaque
d'athérome. Le
cholestérol est véhiculé dans le sang par diverses lipoprotéines dont les
lipoprotéines
de faible densité (L,DL) et les lipoprotéines de haute densité (HDL). Les LDL
sont
synthétisées au niveau du foie et permettent d'approvisionner les tissus
périphériques
en cholestérol. Au contraire, les HDL captent le cholestérol au niveau des
tissus
périphériques et Ie transportent vers le foie où il est stocké et/oa dégradé.
Parmis les dyslipémies les plus courantes figurent celles caractérisées par un
taux du cholestérol LDL (lipoprotéine de faible densité) élevé et
l'hypoalphalipoprotéinémie. Cette dernière se caractérise par un taux du
cholestérol
HDL (lipoprotéine de haute densité) inférieur à 35 mg/dl et elle représente
40% des
cas des dyslipémies (Genest et a1.,1992). L'hypoalphalipoprotéinémie semble
liée à
une déficience génétique d'une ou plusieurs protéines impliquées dans la
synthése, la
maturation et le catabolisme des particules HDL et a souvent pour conséquence
l'apparition prématurée de maladies cardiovasculaires (Dammermann et al.,
l995).
D'une façon générale, il existe une corrélation inverse entre I' incidence de
ces
dernières et le taux des particules HDL (Miller et al., l987).
L'effet protecteur des HDL contre les maladies cardiovasculaires a été
démontré par des expériences de transfert de gène in vivo sur les souches de
souris
susceptibles de développer les lésions athéroscléreuses et cher lesquelles
l'augmentation du nombre de particules HDL inhibe le développement de ces
lésions
(Rubin et a1.,1991; Plump et a1.,1994). Il a été proposé que l'effet
protecteur des
particules HDL soit dü à leur rôle dans le transport inverse du cholestérol
(Reiche et
a1,1989). Le transport inverse est le processus par lequel le cholestérol en
excès est
CA 02271437 1999-OS-06
WO 98/22606 PCT/FR97/02043
3
transféré des tissus périphériques vers le foie pour son élimination (figure 1
). Il est
composé d'une série d'étapes comprenau~t la prise en charge et
l'estérification du
cholestérol sur les particules HDL ainsi que son transfert sur les particules
~ lipoprotéiques de faible densité qui sont reca~ptées ultérieurement par le
foie et ce
processus implique bien entendu la mise en o~~uvre d'un certain nombre de
protéines
comme la CETP, d'enzymes dont la cholestérol acyltransférase et la lipase
hépatique
et/ou leurs co-facteurs comme les apolipoprotéines AI et AIV.
Alors qu'il existe des traitements efficaces pour diminuer le taux du
cholestérol LDL et des triglycérides fondés su:r des médicaments
hypolipidémiques et
antihypertensifs, les soins actuels de fhypoalphalipoprotéinémie n'offrent
qu'une
efficacité limitée.
La présente invention s'intéresse prf:cisément au traitement, par thérapie
génique, des pathologies liées à l'hypoalphalip~oprotëinémie.
L'approche thérapeutique retenue par la présente invention vise à augmenter la
cinétique du transport inverse du cholestérol afin d'induire la régression des
lésions
athéroscléreuses ou bien de prévenir leur formation. Avantageusement cet
objectif est
atteint selon l'invention via une expression simultanée et eftïcace, dans les
cellules à
traiter, d'au moins deux des protéines, enzymes ou co-facteurs intervenant au
niveau
du transport inverse du cholestérol.
Au sens de l'invention, une protéine, enzyme et/ou l'un de leur co-facteur est
considéré comme étant impliqué dans le transport inverse du cholestérol dans
la
mesure où toute perturbation au niveau de sa concentration ce(Iulaire, affecte
automatiquement Ie processus inverse du cholestérol.
A titre représentatif des enzymes concernées on peut plus particulièrement
~ 25 citer la lécithine cholestérol acyltransférase et la lipase hépatique.
( La lécithine choléstérol acyltransféras~e (LCAT) est une glycoprotéine de 67
kDa, synthétisée par le foie, qui catalyse le transfert d'un groupement acyl
de la
lécithine au cholestérol en produisant de la lysophosphatidylcholine et des
esters de
CA 02271437 1999-OS-06
WO 98/22606 PCT/FR97/02043
4
cholestérol (Glomset, 1968). Le cofacteur de cette enzyme est fapolipoprotéine
AI qui
est liée à la surface des particules HDL. En maintenant le gradient de
concentration en
cholestérol entre les cellules périphériques et les HDL, elle joue un rôle
principal dans
la première étape du transport inverse du cholestérol .
La lipase hépatique (LH) humaine est une glycoprotéine de 66 kDa aux
activités triglycéride hydrolase et phospholipase, synthétisée et sécrétée par
ies
hépatocytes. Liée à la surface des cellules hépatiques, via les protéoglycanes
héparine
sulfate, elle participe au métabolisme des chylomicrons, des IDL
(lipoprotéines de
densité intermédiaire) et des HDL. La LH a une affinité particulière pour les
grosses
IO particules HDL dont elle dégrade les phospholipides et les triglycérides en
générant
des particules discoidales de HDL qui ont la propriété d'accepter le
cholestérol
ce! lulaire. La déficience en LH chez l'homme se caractérise pa. une quantité
élevée de
LDL riches en triglycérides, des grosses particules HDL et le développement
précoce
de l'athérosclérose (HegeIe et al., l993).
En ce qui concerne les protéines, il s'agit au sens de l'invention plus
préférentiellement de la protéine de transfert des esters du cholestérol
(CETP). des
apolipoprotéines AI et AIV ou de l'un de leur variants.
La protéine de transfert des esters du cholestérol (CETP) est une
glycoprotéine
de 74 kDa synthétisée dans le tissu adipeux et le foie. Dans le plasma, elle
est
principalement associée aux HDL. C'est là qu'elle catalyse le transfert des
esters de
cholestérol des HDL vers les lipoprotéines de faible densité. Ce transfert est
suivi du
passage des triglycérides des lipoprotéines de faible densité jusqu'aux HDL.
La
surexpression de la CETP chez les souris transgéniques hypertriglycémidiques
inhibe
le développement des lésions athéroscléreuses (Hayek et al., I 995). Cette
expérience
est en accord avec l'observation, chez les individus déficients en CETP, d'un
développement précoce de maladies cardiovasculaires (Zhong et a1.,1996).
L'apolipoprotéine AI est une protéine constituée de 243 acides aminés,
synthétisée sous la forme d'une prépropeptide de 267 résidus, ayant une masse
moléculaire de 28.000 daltons. E!le est synthétisée chez l'homme
spécifiquement dans
CA 02271437 1999-05-06
WO 98R2606 PCT/FR97102043
le foie et l'intestin et elle constitue la protéine essentielle des particules
HDL (70% de
leur masse en protéines). Elle est abondante <sans le plasma ( 1.0- I .2 g/l).
Son activité
la mieux caractérisée sur le plan biochimique est (activation de la lécithine-
cholestérol acyl-transférase (LCAT), mais <ie nombreuses autres activités lui
sont
attribuées, comme notamment la stimulation de fefflux de cholestérol
cellulaire.
L'apolipoprotéine AI joue un rôle majeur dans la résistance à l'athérosclérose
lié au
transport inverse du cholestérol. Son gène, long de l863 bp, a été cloné et
séquencé
(Sharpe et al., Nucleic Acids Res. 12~ ( 1984) 39l 7). Parmi les produits
protéiques à
activité de type apolipopratéi:ne AI, on peut citer notamment les variants
naturels
décrits dans l'art antérieur.
L'apolipoprotéine AIV (apoAIV) est une protéine constituée de 37G acides
aminés, synthétisée spécifiquement dans l'intestin sous la forme d'un
précurseur de
396 résidu. En ce qui concerne son activité physiologique, on sait qu'elle
peut activer
in vitro la lécithin-cholestérol-acyltransféra;;e (LCAT) (Steinmetz et Coll.,
198S, J.
Biol. Chem., 260 : 22S8-2264) et qu'elle pecn, comme l'apolipoprotéine AI,
interférer
avec la fixation des particules de HDL sur les cellules endothéliales
aortiques bovines
(Savion et Côll., 1987, Eur. J. Biochem., 2S7 : 417l-4178). Ces deux activités
indiquent que l'apoAIV intervient très vraisemblablement comme médiateur du
transport inverse du cholestérol. Le gène de l'apoAIV a été cloné et décrit
dans l'an
antérieur (voir notamment WO 92/OS2S3). Parmi les produits protéiques à
activité de
type apolipoprotéine AIV, on peut citer notamment les fragments et dérivés
décrits
dans la demande de brevet FR 92 0080b.
Plus précisément, la présente invention repose sur l'utilisation de virus
recombinants qui permettent de transférer et d'exprimer au moins deux acides
2S nucléiques codant pour des enzymes, protéines et/ou co-facteurs impliqués
dans le
transport inverse du cholestérol.
De manière inattendue, la demanderesse a ainsi mis en évidence qu'il était
possible d'assurer efficacement le transfert et l'expression d'au moins deux
acides
nucléiques à partir d'un même virus recombinant, en intégrant ces acides
nucléiques
CA 02271437 1999-OS-06
WO 98I22606 PCTIFR97/02043
6
dans ledit virus sous la forme d'une unité bicistronique. II est clair que
l'emploi d'un
unique virus et non de deux présente de nombreux intérêts sur le plan
thérapeutique.
Tout d'abord, il est plus avantageux de construire un unique virus
recombinant incorporant les deux gènes que deux virus recombinant respectifs.
De même, la mise en oeuvre sur le plan thérapeutique d'un vecteur tel que
revendiqué permet de réduire de moitié les quantités en virus recombinants
nécessaires à l'expression desdits gènes. Ceci est tout particulièrement
bénéfique au
regard de la réponse immunitaire classiquement manifestée à l'égard des
cellules
infectées par des virus recombinants. Cette réponse imunitaire se traduit
ordinairement par une destruction des cellules infectées et/ou une réponse
inflammatoire importante. Il est clair que ces deux manifestations sont
fortement
préjudiciables au niveau de la durée d'expression des gènes thérapeutiques et
donc de
l'effet thérapeutique attendu.
Enfin, un transfert efficace et à concentration égale de deux virus
recombinants distincts est un événement incertain et qui donc nécessire d'étre
contrôlé par des manipulations supplémentaires. Dans le cas de la mise en
oeuvre
d'un virus recombinant selon l'invention, on peut avantageusement s'affranchir
de ce
type de contrôle.
Avantageusement, les virus revendiqués sont capables de transférer et
d'exprimer efficacement, pour une durée importante et sans effet
cytopathologique,
deux acides nucléiques codant pour des protéines, enzymes et/ou cofacteurs
impliqués dans te transport inverse du cholestérol.
Un premier objet de l'invention réside donc dans un virus recombinant
défectif comprenant au moins deux acides nucléiques codant pour des enzymes,
protéines et/ou co-facteurs, distincts et impliqués dans le transport inverse
du
cholestérol, lesdits acides nucléiques étant liés opérationellement à un
promoteur
transcriptionnel et séparés l'un de l'autre par une séquence codant pour un
site
d'entrée interne du ribosome IRES.
CA 02271437 1999-OS-06
WO 98/22606 PCT/FR97/02043
7
Les acides nucléiques sont de préférence choisis parmi les gènes codant
pour tout ou partie de la lécithine choléstérol acyltransférase (LCAT), la
protéine de
transfert des esters du cholestérol (CETP), la lipase hépatique (LH), les
apolipoprotéines AI et AIV ou l'un de leurs variants.
Les acides nucléiques insérés peuvent être des fragments d'ADN
complémentaire (ADNc), d'ADN génomique (ADNg), ou des constructions hybrides
consistant par exemple en un ADNc dans lequel seraient insérés un ou plusieurs
introns. Il peut également s'agir de séquences synthétiques ou
semisynthétiques.
Comme indiqué ci-avant, il peut s'agir d'un g~;ne codant pour tout ou partie
d'une des
enzymes, protéines et/ou co-facteurs impliqués dans le transport inverse du
cholestérol ou d'un variant de celles-ci. Au. sens de l'invention, le terme
variant
désigne tout mutant, fragment ou peptide possédant au moins une propriété
biologique du produit protéique considéré, ainsi que, le cas échéant, leurs
variants
naturels respectifs.
Ces fragments et variants peuvent ëtre obtenus par toute technique connue
de l'homme du métier, et notamment par modifications génétique et/ou chimique
etlou enzymatique. Les modifications génétiques incluent les suppressions,
délétions.
mutations, etc.
Les acides nucléiques insérés au sEns de l'invention sont préférentiellement
les gènes codant pour tout ou partie des enzymes, protéines et!ou cofacteurs
correspondants humains. Il s'agit plus préférentiellement d' ADNc ou d'ADNg.
Chaque acide nucléique inséré peut également comprendre des séquences
d'activation, de régulation, etc .Par ailleurs, il comprend généralement, en
amont de
la séquence codante, une séquence signal dirigeant le polypeptide synthétisé
dans les
voies de sécrétion de la cellule cible. Cette séquence signal peut être sa
séquence
' signal naturelle, mais il peut également s'agir de toute autre séquence
signal
fonctionnelle, ou d'une séquence signal artificielle.
CA 02271437 1999-OS-06
WO 98/22606 PCT/FR97/02043
g
Selon un mode de réalisation particulier de l'invention, les virus
recombinants revendiqués comprennent au moins un acide nucléique codant pour
la
LCAT. Plus préférentiellement, le second acide nucléique inséré code pour la
LH, la
CETP ou fApoAI.
Comme explicité précédemment, la co-expression des deux acides
nucléiques considérés est assurée via préliminairement la formation d'un ARN
unique qui est ensuite traduit pour conduire aux deux enzymes respectives. A
ces
fins, le virus recombinant incorpore outre les deux séquences d'acides
nucléiques, au
moins un promoteur transcriptionnel, un site de polyadénylation et une
séquence
IRES.
Ce promoteur traneriptionnel est lié opérationellement aux acides nucléiques
codant de manière à produire l'ARNm bicistronique et à conduire l'expression
des
deux enzymes respectives à partir dudit ARNm. Selon un mode préféré de
l'invention, il est placé directement en amont du premier acide nucléique.
Ce promoteur transcriptionnel peut notamment être choisi parmi les
séquences qui sont naturellement responsables de l'expression dudit acide
nucléique
vis à vis duquel duquel il est placé en amont sous réserve bien sûr que ces
séquences
soient susceptibles de fonctionner dans la cellule infectée. Il peut également
s'a<yir de
séquences d'origine différente (responsables de l'expression d'autres
protéines, ou
mëme synthétiques). Notamment, il peut s'agir de séquences de séquences
d'acides
nucléiques eucaryotes ou viraux ou de séquences dérivées, stimulant ou
réprimant la
transcription d'un gène de façon spécifique ou non et de façon inductible ou
non. A
titre d'exemple, il peut s'agir de séquences promotrices issues du génome de
la cellule
que l'on désire infecter, ou du génome d'un virus, et notamment, les
promoteurs des
gènes E 1 A, MLP d'adénovirus, le promoteur CMV, LTR-RSV, MT-1, SV40 etc.
Parmi les promoteurs eucaryotes, on peut citer également les promoteurs
ubiquitaires
(HPRT, vimentine, a-actine, tubuline, etc), les promoteurs des filaments
intermédiaires (desmine, neurofilaments, kératine, GFAP, etc) les promoteurs
de
gènes thérapeutiques (type MDR, CFTR, facteur VIII, etc) les promoteurs
spécifiques
CA 02271437 1999-OS-06
WO 98I22606 PCT/FR97/02043
9
de tissus (pyruvate kinase, villine, promoteur de la protéine intestinale de
liaison des
acides gras, promoteur de factine a des cellules du muscle lisse, promoteurs
spécifiques pour le foie ; Apo AI, Apo AII, Albumine humaine etc) ou encore
les
promoteurs répondant à un stimulus (récepteur des hormones stéroïdes,
récepteur de
l'acide rétinoïque, etc,). En outre, ces séquences d'expression peuvent être
modifiées
par addition de séquences d'activation, de régulation, etc
En ce qui concerne la séquence :IRES, elle dérive de préférence d'un
picornavirus. Plus précisément, cette séquence IRES de picornavirus est issue
soit du
virus encéphalomyocarditis soit du poliovinrs. II s'agit plus
préférentiellement du
fragment issu de l'encephalomyocarditis présent dans le vecteur pCITE-2a+ de
NOVAGEN.
A des fins de clarté de langage, la construction définie par le promoteur
transcriptionnel, les deux acides nucléiques, Ie site de polyadénylation et la
séquence
IRES présente entre les deux acides nucléiques, sera identifiée ci-après sous
la
dénomination cassette bicistronique.
Les virus selon la présente invention sont défectifs, c'est-à-dire incapables
de se répliquer de façon autonome dans la cellule cible. Généralement, le
génome des
virus défectifs utilisés dans le cadre de la présente invention est donc
dépourvu au
moins des séquences nécessaires à la réplication dudit virus dans la cellule
infectée.
Ces régions peuvent être soit éliminées (en tout ou en partie), soit rendues
non-
fonctionnelles, soit substituées par d'autres séquences et notamment par la
cassette
bicistronique définie ci-dessus. Préférentiellement, le virus défectif
conserve
néanmoins les séquences de son génome qui sont nécessaires à l'encapsidation
des
particules virales.
Le virus selon l'invention peut être dérivé d'un adénovirus, d'un virus adéno-
associé (AAV) ou d'un rétrovirus. Selon un mode de réalisation préféré, il
s'agit d'un
adénovirus.
CA 02271437 1999-OS-06
WO 98/22606 PCTIFR97/02043
Il existe différents sérotypes d'adénovirus, dont la structure et les
propriétés
varient quelque peu. Parmi ces sérotypes, on préfere utiliser dans le cadre de
la
présente invention les adénovirus humains de type 2 ou 5 (Ad 2 ou Ad 5) ou les
adénovirus d'origine animale (voir demande W094/26914). Parmi les adénovirus
5 d'origine animale utilisables dans le cadre de la présente invention on peut
citer !es
adénovirus d'origine canine, bovine, murine, (exemple : Mavl, Beard et al.,
Virology
75 ( 1990) 81 ), ovine, porcine, aviaire ou encore simienne (exemple : SAV).
De
préférence, fadénovirus d'origine animale est un adénovirus canin, plus
préférentiellement un adénovirus CAV2 [souche manhattan ou A26/61 (ATCC VR-
10 800) par exemple]. De préférence, on utilise dans le cadre de l'invention
des
adénovirus d'origine humaine ou canine ou mixte.
Préférentiellement, dans le génome des adénovirus de l'invention) la région
E 1 au moins est non fonctionnelle. Le gène viral considéré peut être rendu
non
fonctionnel par toute technique connue de l'homme du métier, et notamment par
suppression totale, substitution, délétion partielle, ou addition d'une ou
plusieurs
bases dans le ou les gènes considérés. De telles modifications peuvent ëtre
obtenues
in vitro (sur de l'ADN isolé) ou in situ, par exemple, au moyens des
techniques du
génie génétique, ou encore par traitement au moyen d'agents mutagènes.
D'autres
régions peuvent également être modifiées, et notamment la région E3
(W095/02697), E2 (W094/28938), E4 (W094/28152, W094/12649, W09/02697)
et LS (W095/02697). Selon un mode préféré de mise en oeuvre, l'adénovirus
selon
l'invention comprend au moins une délétion dans la région E 1 et une délétion
dans la
région E3. Dans les virus de l'invention, la délétion dans la région E 1
s'étend
préférentiellement des nucléotides 455 à 3329 sur la séquence de l'adénovirus
AdS.
Selon un autre mode de réalisation préféré, la cassette bicistronique est
insérée au
niveau de la délétion dans la région E 1.
Un mode particulier de la présente invention concerne donc un adénovirus
recombinant défectif caractérisé en ce qu'il comprend au moins deux acides
nucléiques codant pour des enzymes, protéines et/ou co-facteurs distincts et
impliqués dans le transport inverse du cholestérol, lesdits acides nucléiques
étant liés
CA 02271437 1999-OS-06
WO 9$/22606 PCT/FR97/02043
opérationellement à un promotew transcripti~onnel et séparés l'un de l'autre
par une
séquence codant pour un site d'entrée interne du ribosome IRES.
A titre d'adénovirus recombinants préférés selon (invention on citera plus
particulièrement les adénovirus recombinant~~ défectifs comprenant au moins un
acide
nucléique codant pour la LCAT et un acide nucléique codant soit pour la LH, la
CETP
ou fApoAI, lesdits acides nucléiques étant liés opérationellernent à un
promoteur
transcriptionnel et séparés l'un de l'autre par une séquence codant pour un
site d'entrée
interne du ribosome IRES.
A titre représentatif de ces adénovinus on peut notamment faire mention de
celui représenté en figure 2, contenant les gènes codant respectivement pour
la LCAT
et la CETP et issu de la recombinaison homologue entre le pXL 2974 et le
pXL2822.
Les adénovirus recombinants défectü;s selon l'invention peuvent étre préparés
par toute technique connue de l'homme du métier (Levrero et al.) Gene 1 O l (
1991 )
195, EP 185 573; Graham, EMBO J. 3 ( 1984) 2917). En particulier, ils peuvent
ëtre
préparés par recombinaison homologue entre un adénovirus et un plasmide
portant
entre autre la cassette bicistronique. La recombinaison homologue se produit
après
co-transfection desdits adénovirus et plasmide dans une lignée cellulaire
appropriée:.
La lignée cellulaire utilisée doit de préférence (i) être transformable par
lesdits
éléments, et (ü), comporter les séquences capables de complémenter la partïe
du
génome de fadénovirus défectif, de préférence sous forme intégrée pour éviter
les
risques de recombinaison. A titre d'exemple de lignée, on peut mentionner la
lignée
de rein embryonnaire humain 293 (Graham et al., J. Gen. Virol. 36 ( 1977) 59)
qui
contient notamment, intégrée dans son génome, la partie gauche du génome d'un
adénovirus Ad5 ( I 2 %) ou des lignées capables de complémenter les fonctions
E 1 et
E4 telles que décrites notamment dans les demandes n° WO 94/26914
et
W095/02697. Ensuite, les adénovirus qui se: sont multipliés sont récupérés et
purifiés
selon les techniques classiques de biologie moléculaire, comme illustré dans
les
exemples.
CA 02271437 1999-OS-06
WO 98I22606 PCT/FR97/02043
12
Toutefois, selon un mode privilégié de l'invention, les adénovirus revendiqués
sont préparés selon un procédé original décrit dans la demande de brevet
W096/25506 qui met en oeuvre à titre de plasmide navette, un plasmide
procaryote
comprenant un génome d'adénovirus recombinant bordé par un ou plusieurs sites
de
restriction non présents) dans ledit génome. Ce protocole est notamment
illustré en
figure 2. Ce procédé est particulièrement intéressant puisqu'il permet de
s'affranchir
de l'emploi d'une deuxième construction apportant une autre partie du génome
viral,
et de l'étape de recombinaison dans la lignée de transcomplémentation.
Un second objet de la présente invention porte précisément sur des plasmides
procaryotes particuliers mis en oeuvre pour la production des adénovirus
revendiqués.
Selon un mode préféré de l'invention, ces plasmides procaryotes intègrent la
cassette bicistronique précédemment décrite.
Plus précisément, la présente invention a également pour objet un plasmide
procaryote comprenant un génome d'adénovirus et au moins deux acides
nucléiques
codant pour des enzymes, protéines et/ou co-facteurs distincts et impliqués
dans le
transport inverse du cholestérol, les deux acides nucléiques étant liés
opérationellement à un promoteur transcriptionnel et séparés l'un de l'autre
par une
séquence codant pour un site d'entrée interne du ribosome, IRES.
De manière préférentielle, les plasmides procaryotes selon l'invention
comprennent une première région permettant la réplication dans les cellules
procaryotes et une deuxième région comportant le génome adénoviral bordé d'un
ou
plusieurs sites de restriction non présents) dans ledit génome et dans
laquelle sont
présents au moins deux acides nucléiques codant pour des enzymes, protéines
et/ou
co-facteurs distincts et impliqués dans le transport inverse du cholestérol)
ces deux
acides nucléiques étant liées opérationellement à un promoteur
transcriptionnel et
séparés l'un de l'autre par une séquence codant pour un site d'entrée interne
du
ribosome, IRES.
CA 02271437 1999-OS-06
WO 98I22606 PCT/FR97/02043
13
En ce qui concerne les définitions des enzymes, protéines et/ou co-facteurs
distincts et impliqués dans le transport inverse du cholestérol, le promoteur
transcriptionnel, le site de polyadénylation e;t la séquence IRES de même en
ce qui
touche leur organisation au sein de ladite c:assette on se rapportera à ce qui
a été
décrit précédemment.
La région permettant la réplication dans les cellules procaryotes, utilisée
dans
les plasmides revendiqués, peut être toute origine de réplication
fonctionnelle dans
les cellules choisies. Il peut s'agir d'une origine de réplication issue d'un
plasmide du
groupe d'incompatibilité P (exemple = pRK290) qui permet la réplication dans
les
souches d'E. coli pol A. Plus généralement, il peut s'agir de toute origine de
réplication issue d'un plasmide se répliquant dans les cellules procaryotes.
Ce
plasmide peut ètre un dérivé de RK2, de pBR322 (Bolivar et al., l977), un
dérivé de
pUC (Viera et Messing, 1982), ou d'autres plasmides dérivant du même groupe
d'incompatibilité, c'est à dire de CoIE I ou de pMB 1 par exemple. Ces
plasmides
peuvent être choisis par ailleurs dans d'autre;s groupes d'incompatibilité se
répliquant
chez Escherichia coli. Il peut s'agir de plasmides dérivés de plasmides
appartenant
aux groupes d'incompatibilité A, B, FI, FII, FTII, FN, H 1, H 11, I 1, I2, J.
K, L, N, OF.
P, Q, T, U, W, X, Y, Z ou 9 par exemple. D'autres plasmides peuvent encore
étre
utilisés, parmi lesquels des plasmides ne se: répliquant pas chez E. coli mais
chez
d'autres hôtes tels que B. subtilis, Streptomvces, P.putida, P. aeru inosa,
Rhizobium
meliloti, A~robacterium tumefaciens, ~itaphylococcus aureus, Streptom,
pristinaespiralis, Enterococcus faecium ou Çlostridium. A titre préférentiel,
on utilise
les origines de réplication issues de plasmides se répliquant chez E. coli.
Comme indiqué précédemment, le génome adénoviral présent dans les
plasmides de l'invention est avantageusement un génome complet ou fonctionnel,
c'est-à-dire ne nécessitant pas l'apport d'autres régions, par recombinaison
ou ligature,
pour la production des stocks viraux dans les lignées d'encapsidation
choisies.
Préférentiellement, le génome adénoviral recombinant comprend au moins
des séquences ITR et une séquence permettant l'encapsidation. Dans un mode de
CA 02271437 1999-OS-06
WO 98/22606 PCT/FR97/02043
14
réalisation préféré de l'invention, ce génome de fadénovirus utilisé est
dépourvu de
tout ou partie de la région E 1. Avantageusement, le génome de fadénovirus
utilisé est
dépourvu d'une partie de la région E 1 comprise entre les nucléotides 454 à
3328
(fragment PwII-BgIII) ou 382 à 3446 (fragment HinfII-Sau3A).
Selon un mode de réalisation particulièrement avantageux, le génome de
l'adénovirus utilisé est également dépourw de tout ou partie de la région E3
et/ou E4.
Selon un mode de réalisation particulier de l'invention, il s'agit d'un génome
d'adénovirus dépourvu en régions E 1 et E3.
Plus précisément, les plasmides procaryotes revendiqués comprennent en
orientation 5'-3' au moins une origine de réplication fonctionnelle dans les
cellules
procaryotes, une première partie d'un génome adénoviral comprenant les
séquences
virales ITR yr, un promoteur transcriptionnel, un premier acide nucléique
codant pour
une enzyme, protéine et/ou un co-facteur impliqué dans le transport inverse du
cholestérol, une séquence IRES, un second acide nucléique codant pour une
seconde
enzyme, protéine et/ou un co-facteur impliqué dans le transport inverse du
cholestérol, un site de polyadénylation et une second partie d'un génome
adénoviral
comprenant la région pIX-IVA2.
Avantageusement, les plasmides procaryotes revendiqués selon l'invention
comprennent également une région permettant la sélection des cellules
procaryotes
contenant ledit plasmide. Cette région peut être constituée notamment par tout
gène
conférant la résistance à un produit, et notamment à un antibiotique. Ainsi)
on peut
citer les séquences d'acides nucléiques conférant une résistance à la
kanamycine
(Kanr), à l'ampicilline (Amp,~, à la tétracycline (tet~ ou à la
spectinomycine, par
exemple, qui sont couramment utilisés en biologie moléculaire (Maniatis et
al.,
1989). La sélection de plasmides peut se faire par d'autres séquences d'acides
nucléiques que des gènes codant pour des marqueurs de résistance à un
antibiotique.
D'une manière générale, il s'agit d'un gène qui donne à la bactérie une
fonction qu'elle
ne possède plus (cela peut correspondre à un gène qui a été délété sur le
chromosome
ou rendu inactif), le gène sur le plasmide rétablissant cette fonction. A
titre
CA 02271437 1999-OS-06
WO 98/Z2606 PCT/FR97/02043 .
d'exemple il peut s'agir d'un gène d'un ARN de; transfert qui rétablit une
fonction
chromosomique déficiente (Somoes et al., 199 I ).
Selon un mode préféré, le plasmide procaryote revendiqué comprend au
moins un acide nucléique codant pour la LCA'T, le second acide nucléique étant
S choisi parmi ceux codant pour la CETP, la LH ou l'ApoAI.
A titre représentatif de ces plasmides procaryotes on peut notamment citer le
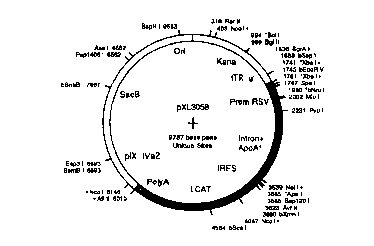
plasmides pXL2974 et pX:L3058, représentés rE;spectivement en figure 4 et 6.
Le
plasmide pXL2974 comprend en orientation 5'-3'.) une origine de réplication,
un gène
de résistance à la spectinomycine, le gène Sac B de sensibilité au sucrose.
les
10 séquences virales ITR y~, le promoteur RSV, les deux transgènes LCAT et
CETP
séparés par l'IRES, le site de polyadénylation et les séquences virales pIX et
IVA2.
Le plasmide pXL3058 comprend en orientation :i'-3', une origine de
réplication, un
gène de résistance à la kanamycine, les séquences virales ITR yr) le promoteur
RSV,
les deux transgènes LCAT et intron+ApoAI séparés par l'IRES, le site de
15 polyadénylation, les séquences virales pIX et IVA.2 et le gène Sac B de
sensibilité au
sucrose.
La présente invention s'étend également aux constructions plasmidiques mises
en oeuvre pour la construction de ces plasmidE;s procaryotes et qui
comprennent
également la cassette bicistronique définie selon l'invention.
Les plasmides procaryotes revendiqués selon l'invention peuvent notamment
ëtre obtenus par transformation d'un plasmide namette initial comportant la
cassette
bicistronique définie selon l'invention à savoir comprenant la séquence codant
pour
un promoteur transcriptionnel lié opérationellemevt à deux acides nucléiques
codant
pour deux enzymes, protéines et/ou co-facteurs distincts impliqués dans le
transport
inverse du cholestérol, un site de polyadénylation et une séquence IRES située
entre
iesdits acides nucléiques.
A titre représentatif de ces plasmides navettes, on peut notamment citer les
plasmides pXL2970 et pXL2984 décrits respectivement en figures 3 et 5.
CA 02271437 1999-OS-06
WO 98I22606 PCT/FR97/02043
16
En ce qui concerne les définitions des enzymes impliquées dans le transport
inverse du cholestérol, le promoteur transcriptionnel et la séquence IRES de
mëme en
ce qui touche leur organisation au sein de ladite cassette on se rapportera à
ce qui a
été décrit précédemment.
Un autre objet de la présente demande concerne toute cellule procaryote
contenant un plasmide procaryote tel que défini ci-avant. Il peut s'agir en
particulier
de toute bactérie pour laquelle il existe un système de vecteur où fADN
recombinant
peut ëtre introduit. Citons par exemple Escherichia coli, Salmonella
typhimurium,
Bacillus subtilis, Pseudomonas putida, Pseudomonas aeru~inosa, A~obacterium
tumefaciens, Rhizobium meliloti ou les bactéries du genre Streptomyces. Ces
cellules
sont obtenues avantageusement par transformation selon les techniques connues
de
l'homme du métier.
Elle vise également l'utilisation d'un virus recombinant, d'un adénovirus
recombinant défectif ou d'une construction plasmidique navette tels que
définis ci-
l S dessus pour la préparation d'une composition pharmaceutique destinée au
traitement
ou à la prévention des pathologies liées à l'hypoalphalipoprotéinémie dont
plus
particulièrement l'athérosclérose et/ou la resténose.
La présente invention concerne également une composition pharmaceutique
comprenant un ou plusieurs virus recombinants défectifs dont adénovims tels
que
décrits prëcédemment. De telles compositions peuvent ëtre formulées en vue
d'une
administration par voie topique, orale, parentérale, intranasale,
intraveineuse,
intramusculaire, sous-cutanée, intraoculaire, etc.
Préférentiellement, la composition selon l'invention contient des véhicules
pharmaceutiquement acceptables pour une formulation injectable. II peut s'agir
en
particulier de solutions salines (phosphate monosodique, disodique, chlorure
de
sodium, potassium, calcium ou magnésium, etc, ou des mélanges de tels sels),
stériles, isotoniques, ou de compositions sèches, notamment lyophilisées, qui,
par
addition selon le cas d'eau stérilisée ou de sérum physiologique, permettent
la
constitution de solutés injectables.
CA 02271437 1999-OS-06
WO 98/Z2606 PCT/FR97/02043 -
17
Les doses de virus utilisées pour (injection peuvent être adaptées en
fonction de différents paramètres, et notamment en fonction du mode
d'administration utilisé, de la pathologie concernée ou encore de la durée du
traitement recherchée. D'une manière gÉ;nérale, les virus recambinants selon
l'invention sont formulés et administrés sous forme de doses comprises entre
104 et
1014 pfu/ml.. Le terme pfu ("plaque forminl; unit") correspond au pouvoir
infectieux
d'une suspension de virions, et est déterminé par infection d'une culture
cellulaire
appropriée, et mesure, généralement après 4$ heures, du nombre de plages de
cellules
infectées. Les techniques de détermination du titre pfu d'une solution virale
sont bien
documentées dans la littérature.
La présente invention offre un ,nouveau moyen très efficace pour le
traitement ou la prévention des pathologies liées à
l'hypoalphalipoprotéinémie, en
particulier dans le domaine des affections cardiovasculaires comme l'infarctus
du
myocarde, l'angor, la mon subite, la décompensation cardiaque, les accidents
cérébro-vasculaires, l'athérosclérose ou la resténose.
En outre, ce traitement peut concerner aussi bien l'homme que tout anima!
tel que les ovins, les bovins, les animaux domestiques (chiens, chats, etc ).
les
chevaux, les poissons, etc.
La présente invention est plus complètement décrite à l'aide des exemples
qui suivent, qui doivent ëtre considérés comme illustratifs et non limitatifs.
LEGE!~iDE DES FIGURES
. Figure l: Représentation schématique du mécanisme présumé du transport
inverse du cholestérol.
Figure 2: Représentation du protocole de production d'adénovirus par
recombinaison homologue dans E. Coli.
Figure 3: Protocole de construction du plasmide navette bicistronique pXL
2970 comprenant RSV-LCAT-IRES-CETP.
CA 02271437 1999-OS-06
WO 98I22606 PCT/FR97/02043
18
Figure 4: Protocole de construction du plasmide procaryote pXL2974
comprenant RSV-LCAT-IRES-CETP.
Figure 5: Protocole de construction du plasmide pXL2984 comprenant RSV-
LCAT-IRES-LH.
Figure 6: Représentation du plasmide procaryote pXL3058 comprenant RSV-
ApoAI-IRES-LCAT.
I MATERIELS ET METHODES
I-1 MATERIELS
I ) Les plasmides utilisés pour la construction des adénovirus recombinants
bicistroniques LCAT-IRES-CETP, LCAT-IRES-LH et Li AT-IRES-ApoAI sont
-pSK IRES (commercialisé par NOVAGEN)
-pXL 26l6 ADNc LCAT Séguret-Macé et al. Circulation 1996, 94 (9}:2177-2184
-pCRII (commercialisé par INVITROGEN)
-pXL 2794 ( W096/25506)
-pXL 2757 ( W096/25506)
2) Les ARN totaux provenant des hépatocytes et des cellules HepG2
3 ) Les cellules 293, cellules de rein humaines, contenant le gène codant pour
la
protéine E 1 adénovirale (Graham et al., I 977)
4) Les bactéries Escherichia coü: sous-type DHSa de génotype EndA 1,recA l
,hsd
R17, supE44,I-,thy-l,gyrA,re1 Al,lacZD MlS,deoR+, F+,dam+,dcm+ (Woodcock et
a1.,1989)
5) Les enzymes et les tampons de restriction sont fournis par New England
Biolabs
I-2 METHODES
TECHNIQUES GENERALES DE BIOLOGIE MOLECULAIRE
CA 02271437 1999-OS-06
WO 98/22606 PCT/FR97/02043
19
Les méthodes classiquement utilisées en biologie moléculaire telles que les
extractions préparatives d'ADN plasmidique, la centrifugation d'ADN
plasmidique en
gradient de chlorure de césium, félectrophorèrse sur gels d'agarose ou
d'acrylamide, la
purification de fragments d'ADN par électroélution, les extraction de
protéines au
phénol ou au phénol-chloroforme, la précipitation d'ADN en milieu salin par de
féthanol ou de fisopropanol, la transformation dans Escherichia coli, etc ...
sont bien
connues de l'homme de métier et sont albondament décrites dans la littérature
[Maniatis T. et al., "Molecular Cloning, a L;aboratory Manual", Cold Spring
Harbor
Laboratory, Cold Spring flarbor, N.Y., 1982; Ausubel F.M. et al. (eds),
"Current
Protocols in Molecular Biology", John Wiley & Sans, New York, l987].
Les plasmides de type pBR322, pUC et les phages de la série M l 3 sont
d'origine commerciale (Bethesda Research Laboratories).
Pour les ligatures, les fragments d'ADN peuvent être séparés selon leur taille
par électrophorèse en gels d'agarose ou d'ac;rylamide, extraits au phénol ou
par un
mélange phénol/chloroforme, précipités à l'éthanol puis incubés en présence de
l'ADN ligase du phage T4 (Biolabs) selon les recommandations du fournisseur.
Le remplissage des extrémités 5' proéminentes peut étre effectué par le
fragment de Klenow de l'ADN Polymérise I d'E. coli (Biolabs) selon les
spécifications du fournisseur. La destruction des extrémités 3' proéminentes
est
effectuée en présence de l'ADN Polymérise du phage T4 (Biolabs) utilisée selon
les
recommandations du fabricant. La destruction des extrémités 5' proéminentes
est
effectuée par un traitement ménagé par la nucléase Sl.
La mutagénèse dirigée in vitro par oligodéoxynucléotides synthétiques peut
ëtre effectuée selon la méthode développée par Taylor et al. [Nucleic Acids
Res. 13
( 1985) 8749-8764] en utilisant le kit distribué par Amersham.
L'amplification enzymatique de fragments d'ADN par la technique dite de
PCR [Polymérise-catalyzed Çhain Reaction, Saiki R.K. et al., Science 230 (
1985)
1350-l354; Mullis K.B. et Faloona F.A., Meth. Enzym. 155 ( 1987) 335-3S0] peut
étre effectuée en utilisant un "DNA thermal cycler" (Perkin Elmer Cetus) selon
les
spécifications du fabricant.
CA 02271437 1999-OS-06
WO 98l22606 PCT/FR97/02043
La vérification des séquences nucléotidiques peut être effectuée par la
méthode développée par Sanger et al. [Proc. Natl. Acad. Sci. USA, 74 ( 1977)
5463-
5467] en utilisant le kit distribué par Amersham.
5
TECHNIQUES DE CULTURE CELLULAIRE
a) Culture des cellules
Les cellules 293 sont cultivées sur milieu d'Eagle (MEM, Gibco BRL) additionné
de
10% de sérum de veau foetal (SVF, Gibco BRL) à 37°C et à 5% de C02.
10 b) Transfection des cellules en culture
Les cellules 293 cultivées dans les boîtes de 100 mm sur milieu MEM et
supplémentées avec 10% de sérum de veau foetal sont transfectées avec 1 ug
d'ADN
par la lipofectamine (Gibco BRL). Six heures plus tard, le milieu est enlevé
et les
cellules sont incubées en milieu complet (MEM + 10% SVF). Les surnageants de
15 culture de cellules transfectées par les plasmides recombinants RSV LCAT-
IRES-
CETP, RSV LCAT-IRES-ApoAI et RSV LCAT-IRES-LH ainsi que les contrôles (3-
galactosidase et le surnageant des cellules non transfectées ont été
recueillis 72h
après transfection et conservés à 4°C. Les tests d'activité des enzymes
LCAT, CETP,
ApoAI et LH sont effectués sur des fractions de 10 à 30 gl de surnageant de
cellules
20 en utilisant le plasma humain comme témoin.
c) Production et purification des adénovirus recombinants
L'ADN adénoviral bicistronique est obtenu par recombinaison homologue dans e.
coli. Par la suite, il est linéarisé par PacI et le virus produit après
transfection des
cellules 293 . Les cellules 293, transcomplémentantes pour la protéine E 1,
sont
transfectées, par la lipofectamine, avec IO~tg d'ADN adénoviral linéarisé.
Après
CA 02271437 1999-OS-06
WO 98I22606 PCT/FR97/02043
21
recouvrement par agar des cellules 293 dans le milieu MEM supplémenté avec 4%
du
SVF et l'incubation de 8 jours à 37°C, les plages contenant le virus
recombinant sont
prélevées et leur profil de restriction analysé.
d) Infection des cellules en culture
L'infection par 0.25 , 0.5 et lml de surnageant contenant l'adénovirus
recombinant
bicistronique est réalisée sur une plaque de 12 puits contenant
approximativement 4
105 cellules 293. Après incubation de 72h en 2 ml du MEM supplémenté avec 2%
de
SVF, le surnageant des cellules infectées est prélevé et les activités
enzymatiques sont
dosées.
VALIDATION BIOCHIMIQUE DES RE;SULTATS IN VITRO
a) Dosage de l'activité LCAT
L'activité LCAT est estimée en mesurant la conversion du 1 '~ C-cholestérol
fibre en
14 C_cholestérol estérifié en utilisant les protéoliposomes en tant que
substrat de la
manière décrite par Chen et al. ( 1982). Les protéoliposomes sont préparés à
partir de
phosphatidyl-choline, du cholestérol, du 14C'-cholestérol et de
l'apolipoprotéine Al et
mis en incubation avec 20 ul de surnageant de culture de transfection à
tester. Les
produits ( 14C-cholestérol libre et 14C-cholestérol estérifié) de la réaction
sont
séparés, par différence de leur solubilité dans le solvant organique, en
chromatographie sur couche mince et détectés par autoradiographie sur Instant
Imager
(Packard). L' activité LCAT est exprimée en pourcentage du 14 C- cholestérol
estérifié par heure et pour 201 de surnageant testé.
b) Dosage de l'activité CETP
L'activité CETP est déterminée en mesurant la capacité de cette enzyme à
transférer
des esters de cholestérol d'une particule li;poprotéique de haute densité
(donneur) à
une particule lipoprotéique de faible densité (accepteur). Les substrats de
cette
réaction ont été fournis par un kit Wak-Che~mie, Medical GmbH. La fluorescence
du
linoléate du cholésterol contenu dans la particule donneuse est éteinte à
l'état natif de
CA 02271437 1999-OS-06
WO 98I22606 PCT/FR97/02043
22
cette dernière et ce n'est qu'en présence de la CETP active, qui va catalyser
le
transfert de la molécule fluorescente jusqu'à la particule acceptrice, que
l'on peut
détecter la fluorescence à 535 nm. L'activité CETP est exprimée en valeur
d'intensité
de fluorescence émise à 535 nm pour 30a1 de surnageant de culture testé et par
heure.
c~ Dosa»'activité LH
L'activité lipase hépatique est estimée en utilisant un substrat
triglycéridique
synthétique fourni par un kit Progen Biotechnik GmbH. Ce substrat contient un
groupement fluorescent pyrène qui est masqué par le trinitrophénol à l'état
natif de la
molécule et l'hydrolyse de cette dernière a pour effet l'émission de
fluorescence à 400
nm. En mesurant l'intensité de fluorescence émise à 400 nm après incubation du
substrat avec l'échantillon à tester et grâce au plasma standard fourni par le
kit on peut
estimer ia quantité (en pmol/min.) de LH contenu dans 20p1 de surnageant.
d) Dosa eg de l'apolipoprotéine AI
I S L'activité Apo AI est estimée en utilisant un anticorps monoclonal anti
ApoAI. Pour
cela, des plaques Immulon II (Dynatech) sont revêtues avec un anticorps
monoclonal
anti ApoAI ( I Omg/ml dans du tampon carbonate pH 9,6), par incubation une
nuit à
4°C, puis saturées par 2% BSA en PBS pH 7,4 une heure à 37°C.
Les surnageants
cellulaires sont ensuite incubés une heure à 37°C, éventuellement après
dilution en
PBS 2% BSA. La révélation est ensuite effectuée par incubation une heure à
37°C
avec un mélange d'anticorps monoclonaux anti ApoAI marqués à la péroxydase, et
dilué au 1 /S000. La fixation des anticorps péroxydés est finalement révélée
par
incubation avec 250p1 de TMB (KPL) et lecture des plaques à 630nm.
TECHNIQUE DE CONSTRUCTION DES PLASMIDES NAVETTES
CA 02271437 1999-OS-06
WO 98/22606 PCT/FR97/02043
23
Les constructions des plasmides bicistroniqu~es sont détaillées dans les
figures 3 à 5.
Les plasmides bicistroniques obtenus sont, en même temps, les plasmides
navettes car
ils contiennent les séquences adénovirales p~IX-IVa2 nécessaires à la
recombinaison
avec le génome viral. Cette recombinaison se produit soit par cotransfection
avec un
génome clivé venant d'un virus ~3-galactosidase (vecteur navette classique),
soit par
double recombinaison dans E-Coli (vecteur navette Coli).
La conformité de séquence de différentes si:ructures plasmidiques est examinée
par
analyse de leur profil de restriction. Cet examen permet de sélectionner des
clones
recombinants qui serviront aux clonages ultérieurs ainsi que de valider tes
résultats
des clonages. Les enzymes de restriction sont choisies de façon à avoir
l'information
la plus complète possible sur l'intégralité de l'ADNc cloné et le nombre de
sites
stratégiques pour le clonage. Néanmoins, ce contrôle ne permet pas d'exclure
l'existence de certaines mutations telles que mutations ponctuelles de
substitution ou
de non-sens qui peuvent se produire à tout stade du clonage. De telles
mutations ne
peuvent être mises en évidence que par séquençage complet de l'ADNc en
question.
Le contrôle ultime de la validité des const~:vctions obtenues est fait par des
tests
biochimiques d'activités enzymatiques de LCïAT, de CETP et de LH in vitro, ou
la
détection de la présence de l'apoA-1.
EXEMPLE 1
Construction des plasmides navettes LCAT -1:RES - CETP
1- Construction du vecteur navette classigue pXL 2970
Le vecteur d'expression pXI. 2968 RSV LCA'r polyA bGH est obtenu par clivage
des
plasmides pXL2616, contenant l'ADNc de la LCAT, d'une part et du plasmide pXL
LPL, sous contrôle du promoteur de RSV et en amont du signal de
polyadénylation du
hormone de croissance bovine, d'autre part, par les enzymes de restriction Sal
I et CIaI
et ligation de fragments résultants par T4 DNA ligase .
Pour se faire:
CA 02271437 1999-OS-06
WO 98I22606 PCT/FR97/02043
24
Les plasmides pXL RSV LPL (2 p.g) et pXL 2616 (2 p,g) sont chacun digérés par
10
unités (u) de Clal, dans du tampon 4 (20mM Tris acétate, IOmM Mg-acétate, 50mM
K-acétate et 1mM DTT) supplementé avec 100 pg/ml de BSA acétylé, pendant 90' à
37°C. 100mM du NaCI et 10u de Sall sont ajoutés et le mélange
réactionnel est remis
en incubation à 37°C pendant encore 90'. Après migration en
électrophorèse sur gel
d'agarose à 0,7 % des produits des digestions, les bandes de 6,5 et de 1,7 kb
correspondant à pXLRSV et à l'ADNc LCAT sont découpées sur gel et extraites
par
un kit Qiaquick. Les deux bandes sont ligaturées par 400u de T4 DNA ligase
après
incubation d'une nuit à 14°C.
Le plasmide recombinant pXL 2969 IRES-CETP est généré à partir du plasmide
bluescript possédant l'ADNc de la CETP modifié à son extrémité 5' par
introduction
d'un site NcoI par amorce PCR 5' GCCTGATAAC CATGGTGGCT GCCACAG 3'
(SEQ ID N° 1 ). Le plasmide ainsi modifié est clivé par NcoI et Sal et
cloné en aval de
la séquence IRES adénovirale inclue dans le plasmide pSKIRES clivé par les
mëmes
enzymes de restriction de la manière suivante:
2,5 pg du plasmide CETP et 2,5 pg du plasmide pSK IRES sont digérés par I Ou
de
Ncol pendant 90' à 37°C dans du tampon 3 (50mM Tris-HCL, 1 OmM MgC
I2,
100mM NaCI et 1mM DTT) suivi de la digestion par 10u de Sall pendant 90' à
37°C.
Les produits des digestions sont mis en migration électrophorétique et les
bandes de
I ,5 Kpb (ADNc CETP) et de 3,5 Kpb sont extraites et ligaturées dans les mëmes
conditions que décrites dans le paragraphe précédent.
Pour obtenir le plasmide pXL2970, on procède comme suit:
Quatre pg du plasmide pXL 2968 sont linéarisés par 10 u du Sall (tampon 3+BSA,
90' à 37°C). L'ADN est, ensuite, extrait par kit Qiaquick et récupéré
dans 50 ~1 de
l'eâu préchauffée à 50°C. Les bouts cohésifs résultants du clivage Sall
sont rendus
francs par incubation avec 5 u de polymérase Klenow pendant 15' à 25°C,
L'ADN est
re-extrait au kit Qiaquick et déphosphorylé par 2 u de phosphatase intestinale
de veau
(CIP) pendant 60' à 37°C. Le plasmide pXL 2969 (4p,g) est d'abord
digéré par 5U de
Smal (tampon 4, 90' à 25°C) puis par 5U de Hincll (tampon 3 +BSA, i 00
mM NaCI,
CA 02271437 1999-OS-06
WO 98/22606 PCT/FR97/02043
90' à 37°C). Les produits des digestions des 2 plasmides sont soumis à
une migration
électrophorétique sur gel d'agarose à 0,7 % et les bandes d'ADN de 8,5 Kpb
(pXL
2968) et de 2,2 Kpb (ADNc IRES CETP) sont extraites au kit Qiaquick et
ligaturées
par 400 u de T4 DNA ligase. (Fig. 3).
5
Les activités LCAT et CETP du plasmide p~!~,2970 sont dosées sur le surnageant
de
culture des cellules 293 trois jours après transfection.
L'activité LCAT de ce plasmide correspond à 3,5% d'esters de cholestérol
formés par
heure et l'activité CETP à I20% (tableau 1 ci.-après). Ces valeurs d'activité,
montrent
10 que le plasmide pXL2970 synthétise bien de la LCAT et du CETP qui sont
catalytiquement actives.
2) Le~lasmide navette-coli LCAT-IRES-CET'P
Dans cette technologie, le vecteur navette doit comprendre
15 -les séquences ITR-répétitions terminales inverses et ~r séquence
d'encapsidation,
nécessaires pour la recombinaison homologie dans E. coli, entourant la
séquence
LCAT-IRES-CETP.
-une origine de réplication col E 1 rendant le plasmide non réplicatif dans la
souche
C2110 E. coli et permettent. ainsi, la clonalité du plasmide recombinant.
20 - un gène suicide saccharose B ((étale pour la bactérie en culture sur
sucrose) et un
gène de résistance à la spectinomycine qui permettront la sélection du clone
recombinant.
Pour se faire, le plasmide bicistronique navette: pXL2970 RSV LCAT-IRES-CETP
est
25 clivé par BstEII et SpeI afin d'y introduire des séquences ITR et w du
génome
adénoviral et ainsi obtenir un plasmide navEate-coli. Les séquences ITR et ~
sont
isolées par digestion du plasmide pXL 2794 par BstEII et XbaI. Le fragment aux
bouts francs contenant la cassette spectinomycine-saccharose B, obtenue par
digestion
du pXL2757 par EcoRV et SmaI a été introduite dans le plasmide navette pXL
2970
+ 2794 linéarisé par bFspI (Fig. 4).
Expérimentalement on procède selon le protocole suivant:
CA 02271437 1999-OS-06
WO 98I22606 PCT/FR97J02043
26
Trois pg du plasmide pXL 2970 sont digérés par 20 u de BstEll (tampon 2 : IOmM
Tris Hcl, IOmM MgCl2, SOmM NaCI, ImM DTT ; 90' à 60°C), puis par 10u
de Spel
(90' à 37°C).
Le fragment d'ADN résultant est extrait au kit Qiaquick et déphosphorylé par 2
u de
la CIP (60' à 37°C). Le plasmide pXL 2794 est digéré par 20 u de BstEll
(tampon 2,
90' à 60°C) suivi de 20 u de Xbal (90' à 37°C). Les bandes de
6,5 Kpb (pXL2970) et
de 2,9 Kpb (ITR ~r et Kanr du pXL2794), extraites après migration
électrophorétique,
sont ligaturés par T4 DNA ligase (40 Ou).
Le plasmide pXL 2970+2794 résultant ( 1,5 pg) est clivé par S u de Fspl
(tampon 4,
60' à 37°C), extrait au kit Qiaquick, et ligaturé (T4 DNA ligase, 400
u) avec le
fragment d'ADN de 3,8 Kpb extrait du gel contenant la cassette sacB-spect~
issue de
la digestion du plasmide pXL 2757 par 10 u de Smal (tampon 4, 90' à
25°C) suivi de
10 u de EcoRV (90' à 37°C).
Le plasmide navette pXL2974 LCAT-IRES-CETP subit une première sélection sur
milieu spectinomycine et milieu spectinomycine+saccharose. Les résultats des
digestions NcoI (6,2+3+2,2+2), NotI ( 13,5 Kpb) et EcoRV ( 1+3+9,5 Kpb) sont
en
conformité avec.la carte de restriction dudit plasmide.
L'activité LCAT du plasmide pXL2974 correspond à 2% d'esters de cholestérol
form;.s par heure et celle de la CETP à 114% (tableau 1 ). On retrouve les
activités
LCAT et CETP au niveau du plasmide navette-coü LCAT-IRES-CETP.
ACTIVITE LCAT ACTIVITE CETP
Plasmide navette 3,5 +/- 0,2% 120 +/-2%
LCAT-IRES-CETP
Plasmide navette-coli 2 +/- 0,2% 114 +/-2% _
LCAT-IRES-CETP
Tableau 1
CA 02271437 1999-OS-06
WO 98/22606 PCT/FR97/02043
27
EXEMPLE 2:
Construction du plasmide navette RSV LCA7.'-IRES-LH
L'ADNc de la LH est cloné dernère l'IRES dans le vecteur bluescript et le
fragment
IRES-LH ensuite inclus d'une façon analogue au vecteur LCAT-IRES-CETP selon le
protocole suivant:
Le plasmide pXL 2971 (4 p.g) est digéré, afin d'éliminer un site Ncol, par 40
U.I. de
BgIII (tampon 3, 90' à 37°C) et puis par 40u de Sall pendant 90' à
37°C. Le fragment
d'ADN de 2,5 Kpb (de masse approximative de 0,5 pg) issu de ces digestions est
soumis, après migration et extraction sur gel, à une digestion ménagée par
Ncol (0,1-1
u Ncol/pg d'ADN) dans du tampon 4 pendant 60' à 37°C. Les produits de
digestion
sont analysés par migration sur gel d'agarose à 0,7 % et la bande de 1,5 Kpb
contenant le ADNc LH ABC, obtenue avec: 0,5 u de Ncol, est ligaturé (T4 DNA
ligase, 400 u) avec le fragment pSK IRES (1,3 pg) résultant des digestions
Ncol et
1 S Sall ( 1 u de chaque enzyme, tampon 3, 3 7°C).
Le vecteur final est présenté en figure 5. Le plasmide bicistronique navette
LCAT-
IRES-LH correspondant porte le nom de pXL2984.
ACTIVIT LCAT ACTIVIT LH
Plasmide navette 1,2 +/- ~D,2% 46 +/-2%
LCAT-IRES-LH
Tableau. 2
EXEMPLE 3
Construction du plasmide navette ApoAI-IRF;S-LCAT
- 25
Le principe général de cette construction est identique aux précédents. La
LCAT est
mutée par PCR en incluant un site supplémentaire NcoI permettant sa ligation
en
CA 02271437 1999-OS-06
WO 98/22606 PCT/FR97102043
28-
bonne place derrière l'IRES. Sa séquence a été entièrement vérifiée. Le
fragment
IRES-LCAT est ensuite ligué dernère fapoA-1. Le vecteur résultant est issu
directement de la technologie Coli et porte le nom de pXL 3058 (figure 6).
Après les
double recombinaisons habituelles Ie vecteur viral résultant a été vérifié en
activité.
L'apoA-I a été détectée en western blot et (activité LCAT ëvaluée à 1.3%
(bruit de
fond à 0.2%).
CA 02271437 1999-OS-06
WO 98l22606 PCT/FR97/02043
29
LISTE DE SÉQUENCES
(1) INFORMATIONS GÉNÉRALES:
S
(i) DÉPOSANT:
(A) NOM: RHONE POULENC ROR:ER S.A.
(B) RUE: 20, Avenue Raymond Aron
(C) VILLE: ANTONY
IO (E) PAYS: FRANCE
(F) CODE POSTAL: 92165
(G) TÉLÉPHONE: 01.55.71.69.22
(H) TÉLÉCOPIE: 01.55.71.72.96
IS (ii) TITRE DE L' INVENTION: VIRUS RECOMBINANTS BICISTRONIQUES
UTILES POUR LE TRAITEMENT DE PATHOLOGIES LIÉES AUX
DYSLIPOPROTEINEMIES
2O (iii) NOMBRE DE SÉQUENCES: 1
(iv) FORME DÉCHIFFRABLE PAR ORDI14ATEUR:
(A) TYPE DE SUPPORT: Tape
(B) ORDINATEUR: IBM PC compatible
2S (C) SYSTEME I>' EXPLOITATION: PC-DOS/MS-DOS
(D) LOGICIEL: PatentIn Rels=ase #1.0, Version #1.30 (OEB)
(2) INFORMATIONS POUR LA SEQ ID N0: ~_.
(i) CARACTÉRISTIQUES DE LA SEQUE~NCE:
(A) LONGUEUR: 27 paires de bases
(B) TYPE: nucléotide
(C) NOMBRE DE BRINS: simple
3S (D) CONFIGURATION: linéaire>.
(ii) TYPE DE MOLÉCULE: ADNc
4O (xi) DESCRIPTION DE LA SÉQUENCE: SEQ ID N0: 1:
GCCTGATAAC CATGGTGGCT GCCACAG
4S