Note: Descriptions are shown in the official language in which they were submitted.
CA 02285886 1999-09-28
1
COMPOSITIONS DESTINÉES Ä ~TRE: UTILISÉES POUR FREINER LA
CHUTE DES CHEVEUX ET POUR INDUIRE ET STIMULER LEUR
CROISSANCE, CONTENANT DES OXADIAZOLOPYRIMIDINES
La présente demande est une demande divisionnaire
de la demande canadienne No. 2.024.156 déposée le 28
août 1990 et relative de nouvelles compositions
destinées à être utilisées, notamment en application
topique, pour freiner la c:zute des cheveux et pour
lo induire et stimuler leur croissance, contenant des
dérivés de l'amino-2 pyrimidine oxyde-3, ainsi qu'à des
nouveaux dérivés de l'amino-2 pyrimidine oxyde-3
utilisés dans ces compositions. La présente demande
divisionnaire concerne de nouvelles compositions
destinées également à être utilisées en application
topique pour freiner la chute des cheveux et pour
induire et stimuler leur croissance, mais contenant des
oxadiazolopyrimid_Lnes, ainsi que de nouvelles
oxadiazolopyrimidïnes utilisées dans ces compositions.
On connaît déjà, dans l'état de la technique, le
diamino-2,4 pipéridino-6 pyrimidine oxyde-3 ou
Minoxidil pour ses propriétés d'agent anti-
hypertenseur, mafia également pour son utilisation dans
le traitement de la chute des cheveux, de la pelade, de
la dermatite desquamante et de l'alopécie.
La Demanderesse a découvert de nouvelles
compositions pour le traitement et la prévention de la
chute des cheveux, utilisées notamment en application
topique, particulièrement efficaces dans le traitement
3o des maladies du cuir chevelu grâce à une famille
CA 02285886 1999-09-28
2
particulière de composés dérivés de l'amino-2
pyrimidine oxyde-3.
Les composés retenus pair la Demanderesse, en plus
du fait qu'ils sont effica~~es pour la repousse des
cheveux et notamment, pour indure et stimuler leur
croissance et freiner leur chute, présentent une
activité anti-hypertensive sensiblement nulle ou plus
faible que celle du Minoxidil.
Ces composés présentent des solubilités dans les
1o milieux habituellement util__sés en cosmétique et en
pharmacie nettement supérieures à celles du Minoxidil.
L'invention a donc pour objet de nouvelles
compositions destinées au traitement et à la prévention
de la chute des cheveux, contenant des composés
particuliers dérivés de l'amino-2 pyrimidine oxyde-3.
L'invention a également. pour objet de nouveaux
dérivés de l'amino-2 pyrimidine oxyde-3 utilisés dans
ces compositions.
Un autre objet concerne l'utilisation des composés
selon l'invention pour la pz~éparation d'un médicament
destiné au traitement thérapeutique de la chute des
cheveux.
Les composit=ions conformes à l'invention sont
essentiellement caractérisées par le fait qu'elles
contiennent dans un milieu physiologiquement
acceptable, au moins un composé répondant à la formule
générale:
CA 02285886 1999-09-28
3
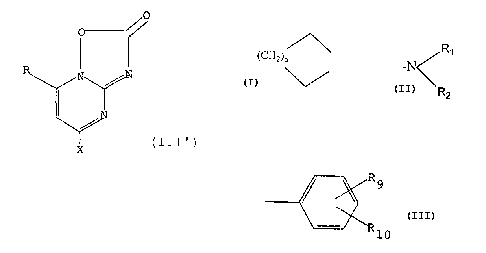
Y
R NHR'
/~
(I)
X
dans laquelle:
R désigne un atome d'hydrogène, un radical alkyle,
saturé et linéaire, en C1-C8 ou forme avec le cycle
pyrimidine, un cycle hydrocarboné de formule:
(CH2 ~~
où n est égal à l, 2 ou 3; X désigne:
(i) un atome d'hydrogène;
(ii) un groupement de formule:
/R1
- /N
R2
dans laquelle RL et R2 identiques ou différents,
désignent un atome d'hydrogène, un groupe alkyle saturé
en C1-C12, linéaire ou ramifié, pouvant être substitué
par un atome d'halogène ou un radical trifluorométhyle,
un groupe alcényle linéaire en Cz-C12, un groupe
cycloalkyle en C3--Clo un groupe aralkyle en C~-C1z ou un
groupement aryle répondant à la formule:
R9
. \
X10
CA 02285886 1999-09-28
4
dans laquelle R9 et Rlo, Identiques ou différents,
désignent un atome d'hydrogène ou d'halogène, ou un
groupe alkyle en C1-C9, hydro:~yle ou alcoxy en C1-C9; ou
bien R1 et R2 forment avec L'atome d'azote auquel ils
sont reliés, un hétérocycle saturé ou insaturé, choisi
par les groupes aziridino, azétidino, pyrrolidino,
pipéridino, hexaméthylèneim:ino, heptaméthylèneimino,
octaméthylèneimino, tétrahydropyridino,
dihydropyridino, pyrrole, pyrrazole, imidazole,
lo triazole, alkyl-4 pipérazino dans lequel le groupement
alkyle comporte de 1 à 4 atomes de carbone, morpholino
et thiomorpholino;
(iii) un groupement -OR3 dans lequel R3 désigne un
radical alkyle saturé en C1--C12, linéaire ou ramifié,
pouvant être sub~;titué par un atome d'halogène ou un
radical trifluorométhyle, un radical alcényle linéaire
en CZ-C12, un radical cycloalkyle en C3-Clo, un radical
( cyclohexyl-1 ) méthyle, un radical aral kyle en C~C12, un
radical phényle éventuellement substitué par un ou deux
groupements qui, indépenda~zunent l'un de l'autre,
désignent un radical alkyle en Cl-C6, un radical alcoxy
en C1-C6, un atome d' halogène ou un radical
trifluorométhyle; ou
(iv) un groupement -SR4, dans lequel R4 a la même
signification que R3 définie ci-dessus;
Y désigne un atome d'oxygène ou un groupement
-OS030;
R' désigne un atome d'hydrogène ou l'un des
groupements suivants:
/R 7
_II_RS. _II_O_R~~. -II_N~
0 O 0 R$
dans lesquels:
CA 02285886 1999-09-28
RS et R6 représentera des radicaux alkyle
inférieurs en C1-Cq;
R~ et Re désignent un atome d'hydrogène ou un
radical alkyle inférieur en C1-C4, à condition qu'ils
5 ne désignent pas simultanément un atome d'hydrogène.
Lorsque Y désigne un atome d'oxygène, les composés
de formule (I), conformes à l'invention, peuvent
coexister avec leur forme ~~automère de formule (I2)
selon l'équilibre suivant:
X
~I) (I2)
Selon la nature du milieu, l'une des formes
tautomères peut être prépondérante par rapport à
l'autre.
Les composés de formule (I), conformes à
l'invention, peuvent être transformés en leurs sels
d'addition d'acides cosmétiquement ou
pharmaceutiquement: acceptablE~s, tels que les sels des
acides sulfurique, chlorhydrique, bromhydrique,
phosphorique, acétique, benzoïque, salicylique,
glycolique, succinique, nicotinique, tartrique,
maléfique, pamoique, méthane sulfonique, picrique,
lactique, etc.
Parmi les composés de formule générale (I), un
certain nombre de composés sont connus en eux-mêmes et
ont été décrits comme agents antihypertenseurs ou comme
intermédiaires de synthèse.
CA 02285886 1999-09-28
6
Ils sont notamment d.=crits dans les brevets
américains Nos. 3.464.987, 3.644.364, 4.013.778 et
4.287.338; le brevet fran~rais No. 2.087.936; les
brevets européens Nos. 58.476 et 57.546 ou cités dans
la littérature technique (C~rn. J. Chem. 1984, 62(6),
1176-80), (Müller, Ramuz, Helv. Chim., Act. 65 (5),
1982, pages 1454-66).
Les composés nouveaux conformes à l'invention
répondent à la formule (I') suivante:
Y
R NHR'
CI')'
X
dans laquelle:
R, R' et Y ont les mêmes significations indiquées
dans la formule (7.) ci-dessus; et
X désigne:
(i) un groupement -SR9, dans lequel R4 désigne un
radical alkyle saturé en C1--C12, linéaire ou ramifié,
pouvant être substitué par un atome d'halogène ou un
radical trifluorornéthyle, un radical alcényle linéaire
en CZ-C12, un radical cycloalkyle en C3-Clo, un radical
2o aralkyle en C~-C1~, un radical phényle éventuellement
substitué par un ou deux groupements qui,
indépendamment l'un de l'autre, désignent un atome
d' halogène, un radical alk~~le en C1-C6, un radical
alcoxy en C1-C6 ou un radical trifluorométhyle; ou
( ii ) un groupement -OR3, dans lequel R3 a la même
signification que R4, à la condition que lorsque Y
désigne un atome d'oxygène, R un groupement alkyle et
CA 02285886 1999-09-28
7
R' désigne un atome d'hydrogène, R3 ne désigne pas un
radical alkyle en C1-C4 ou un radical phényle,
éventuellement substitué ~~ar un ou deux atomes
d'halogène.
Les composés nouveaux de formule (I') peuvent se
trouver sous forme de sels d'addition d'acides
physiologiquement acceptables.
Parmi les composés prés=érés de formule (I') ci-
dessus, on peut c_Lter plus particulièrement:
lo - l'amino--2 méthyl-4 (diméthyl-2,2)propyloxy-6
pyrimidine oxyde-3;
- l'amino--2 méthyl-4 (cyclohexyl-1) méthyloxy-6
pyrimidine oxyde-:3;
- l'amino-2 méthyl-4 (hexenyl-5)oxy-6
pyrimidine oxyde-3;
- l'amino--2 méthyl-4 benzyloxy-6 pyrimidine
oxyde-3;
- l'amino--2 méthyl-4 (diméthyl-2,4)phényloxy-6
pyrimidine oxyde-~3
- l'amino-2 méthyl-4 méthylthio-6 pyrimidine
oxyde-3;
- l'amino-2 méthyl-9: éthylthio-6 pyrimidine
oxyde-3;
- l'amino-2 tétraméthylène-4,5 butoxy-6
pyrimidine oxyde-3;
- le sel interne de l'hydroxyde de l'amino-2
méthyl-4 méthoxy-6 sulfooxy-3 pyrimidinium;
- le sel interne de l'hydroxyde de l'amino-2
méthyl-4 éthoxy-6 sulfooxy-3 :pyrimidinium; et
- le sel interne de l'hydroxyde de l'amino-2
tétraméthylène-4,_'~ butoxy-6 sulfooxy-3 pyrimidinium.
CA 02285886 1999-09-28
8
Les composés conformes à la présente invention
répondant à la formule générale (I), sont obtenus à
partir d'un dérivé amino-2 pyrimidine oxyde-3 substitué
en position 6, de formule suivante:
0
R / NH2
(II)
Z
dans laquelle:
R a la signification indiquée dans la formule
générale (I);
Z désigne un atome d'halogène choisi parmi le
chlore ou le brome, un groupement sulfonate tel que
tosylate, brosylate ou mésylate ou un groupement
phénoxy substitué par des groupes électro-attracteurs,
comme les atomes d'halogène ou des groupements nitro.
Les composés particuliers, selon l'invention,
répondant à la formule (IA):
0
H2
(IA)
dans laquelle R a la signij=ication indiquée dans la
formule (I) ci-dessus, sont obtenus par hydrogénolyse
des composés de formule (II), dans laquelle Z désigne
2o plus particulièrement un atome de chlore ou de brome.
La réduction est effectuée suivant les méthodes
classiques décrites dans la littérature technique (D. J.
Brown, The Pyrimidines, Vol. 16, Supplement II,
CA 02285886 1999-09-28
9
Chapitre X, 360). Leur procéc.é de préparation peut être
représenté par le schéma suivant:
F NH2
Pd/C,H2
I~nTTl~w~w w
Les composés particuliers de formule (IB):
O
2
(IA)
(IB)
OR3
sont obtenus en faisant réagir une solution de
l'alcoolate R30~ W~, dans laquelle R3 a la même
signification que celle indiquée pour la formule
générale (I) et W désigne un métal alcalin tel que le
sodium, le potassium ou le lithium, dans l'alcool
correspondant, sur les composés de formule (II) dans
laquelle Z désigne le chlore ou le brome, ou un
groupement phénoxy substitué par des groupes électro-
attracteurs.
On applique la méthode de Williamson telle que
décrite dans le brevet européen No. 57.546, à une
température comprise entre 40 et 100°C.
La préparation de ces composés peut être
représentée par le schéma suivant:
CA 02285886 1999-09-28
0 0
R OH
R 2 R 0~
3
(II) ~(IB)
SCHEMA B
Les composÉ:s particuliers de formule (IC)
suivante:
T
R NH2
(IC)
5 4
sont préparés en faisant réagir sur les composés de
formule ( II ) un thiolate de formule R4S~, W~, dans
laquelle R4 et W ont les significations indiquées
précédemment, en présence d'un solvant choisi parmi les
10 éthers, de préférence le METHYLCELLOSOLVE (marque de
commerce) ou le diméthyléther de l'éthylèneglycol, à
une température de l'ordre de 50 à 150°C.
On procède suivant les méthodes classiques de la
littérature (D.J. Brown, The Pyrimidines, Vol. 16,
Supplement II, Chapitre VI, Section F).
La préparation de ces composés peut être
représentée par lE: schéma suivant:
CA 02285886 1999-09-28
11
NH2 R NH2
R4SO
Solvant:Eth~
SR4
(II) (IC)
SCHEM,~1 C
Les composés particu.Liers de formule (ID)
suivante:
0
R NH2
(ID)
1
sont obtenus en faisant réagir une amine
R1
H-N'
'R
2
dans laquelle Rl et RZ ont les mêmes significations que
celles indiquées pour la formule générale (I), sur les
lo composés de formule (II). On procède en présence d'un
solvant qui peut être un alcool, de préférence
l'éthanol, ou l'amine servant. de réactif et à la fois
de solvant, à une température comprise entre 20 et
150°C, suivant les procédés décrits dans les brevets
américains Nos. 3.644 364 et 3 464.987.
CA 02285886 1999-09-28
12
La préparation de ces composés peut être
représentée par le schéma suivant:
0 0
/RZ
2 H_N/~ P 2
R' N 'R
1 2
(II) (IDj
SCHEM~~ D
Les composé~> particulic=rs selon l'invention de
formule (I), dans laquelle Y désigne un atome
d'oxygène, obtenus selon les différents procédés
décrits précédemment, peuvent être transformés en leurs
1o homologues 0-sulfates, par sulfatation chimique, selon
les méthodes classiques décrites dans la littérature
(J. Med. Chem. 1983, 26, p. 1791-1793).
On utilise comme réactif de sulfatation les
complexes de trioxyde de soufre-pyridine, de trioxyde
de soufre-triéthy:Lamine ou de trioxyde de soufre-éthyl
diisopropylamine.
Les solvants utilisés sont de préférence le
diméthylformamide, l'acétonitrile, le chloroforme ou
leurs mélanges binaires . La l.empérature est de l' ordre
2o de 0 à 25°C et le temps de réaction varie entre 1 heure
et 24 heures.
Les composés particuliers, selon l'invention, de
formule (I) dans 1_aquelle Y désigne un atome d'oxygène,
peuvent être transformés en leurs homologues amides,
uréides ou carbamates, suivant les méthodes classiques
CA 02285886 1999-09-28
13
décrites dans la littérature (J. MARCH, Advanced
Organic Chemistry, Sème édition, p. 370) par action
respectivement d'un chlorure d'acide, d'un anhydride
d'acide, d'un chlorure d'acide carbamique ou d'un
chloroformiate d'alkyle; on procède en présence d'une
amine tertiaire, l.elle que la pyridine.
Les composés ainsi obtenus, de formule:
0
R NHR'
(IE)
dans laquelle R, R', X ont la même signification que
lo celle indiquée pour la formule (I) définie ci-dessus,
sont facilement hydrolysables, en milieu potasse
alcoolique, par exemple, et peuvent redonner naissance
à leurs précurseurs de formule (I), dans laquelle R'
désigne un hydrogène.
La transformation des composés de formule (I) dans
laquelle Y est 7_'oxygène ei. R' est l'hydrogène, en
leurs homologues 0-sulfates, amides, uréides ou
carbamates, peut être représentée par le schéma
suivant:
CA 02285886 2001-03-23
14
r,
R 2 NH2
Sulfatation
X X
X ~ -lIE1
Les composés de formule (IE), conformes à
l'invention, peuvent constituer des intermédiaires pour
la synthèse des oxadiazolopyrimidines de formule (III)
suivante:
e.
(III)
dans laquelle R et X ont la signification indiquée dans
la formule générale (I).
Les composés (III) sont obtenus par cyclisation-
lo élimination interne des dérivés carbamates ou uréides
de formule (IE) selon les méthodes décrites dans la
littérature (JC. MÜLLER, Helvetica Chimica Acta, Vol.
66, 1983, p. 669-672).
Les composés de formule (III) et leurs sels sont
nouveaux, à l'exception du 2-oxo-2,8-dihydro[1,2,4]oxa-
diazolo[2,3-a]pyrimidine qui est décrit dans le document
CA 02285886 2001-03-23
MÜLLER, RAMUZ, Helvetica Chimica Acta 65 (5), 1982, p.
1454-66, et constituent un autre object de l'invention.
Ils peuvent recevoir des applications diverses et
notamment dans l'utilisation pour le traitement et la
5
prévention de la chute des cheveux.
Ä titre d'exemple d'un composé de formule (III),
on peut citer le méthyl-7-pyrrolidino-5-2H-oxadiazolo-
1,2,4[2,3-aJpyrimidine-oxo-2.
io Les compositions conformes à la présente
invention, contenant dans un milieu physiologiquement
acceptable, au moins un composé répondant à la formule
(I) ou (III) ou l'un de ses sels d'addition d'acides
physiologiquement acceptables, peuvent être appliquées
15 dans le domaine cosmétique ou pharmaceutique, notamment
en application topique sur les chèveux ou le cuir
chevelu. Elles sont destinées pour le traitement et la
prévention de la chute des cheveux et notamment de la
pelade, de l'alopécie ainsi que des dermatites
2o desquamantes.
Ces compositions peuvent comporter, à titre de
milieu physiologiquement acceptablé, tout milieu
approprié pour l'application topique, soit en
cosmétique, soit en pharmacie, et qui soit compatible
2s avec la substance active.
Les composés conformes à l'invention peuvent se
trouver dans ce milieu, soit à l'état dissous, soit à
l'état dispersé, notamment sous forme microniséè.
Les compositions destinées à être utilisées en
3o pharmacie se présentent sous forme d'onguent, de
CA 02285886 2000-12-15
15a
teinture, de crème, de pommade de poudre, de timbre, de
tampon imbibé, de solution, d'émulsion ou de dispersion
vésiculaire, de lotion, de gel, de spray ou de
suspension. Elles: peuvent être, soit anhydres, soit
aqueuses,, selon l'indication clinique.
Les composés :selon l' invention sont présents dans
ces compositions pharmaceutiques à des concentrations
CA 02285886 1999-09-28
16
comprises de préférence enta= 0,1 et 10~ en poids, et
en particulier entre 0,2 et 5~ en poids, par rapport au
poids total de la composition.
Les compositions cosmétiques sont notamment
destinées à être utilisées sous forme de lotion, de
gel, de savon, de shampooing, d'aérosol ou de mousse et
contiennent, dans un support cosmétiquement acceptable,
au moins un composé de formu~_e ( I ) ou l' un de ses sels
d'addition d'acides.
1o La concentration de ce~e composés de formule (I)
dans ces compositions est, de préférence, comprise
entre 0,01 et 5% en poids, et en particulier entre 0,05
et 3~ en poids, par rappo~°t au poids total de la
composition.
Les compositions conformes à l'invention peuvent
contenir différents additifs habituellement utilisés en
cosmétique ou en pharmacie et en particulier des
substances actives, telles <~ue des agents hydratants
comme la thiamorpholinone et ses dérivés ou l'urée; des
2o agents antiséborrhéiques, tels que la S-
carboxyméthylcystéine la S-benzylcystéamine, et leurs
dérivés; la thioxolone.
Les composés conformes ~~ l'invention peuvent être
associés à au moins un composé améliorant encore leur
activité sur la repousse et%ou sur le freinage de la
chute des cheveux, tels que plus particulièrement les
composés suivants:
- les esters d'acide nicotinique, dont plus
particulièrement les nicotin~~tes d'alkyle en C1-C6 et
3o notamment le nicot:inate de méthyle;
- les agents anti-inflammatoires stéroïdiens et
non stéroïdiens bien connus dans l'état de la technique
CA 02285886 1999-09-28
17
et en particulier l'hydrocortisone, ses sels et ses
dérivés, l'acide niflumique;
- les rétinoïdes et plus particulièrement
l'acide t-trans rétinoïque appelé encore trétinoïne,
l'isotrétinoine, le rétinol ou la vitamine A et ses
dérivés, tels que l'acétat:e, le palmitate ou le
propionate, le motrétinide, l'étrétinate, le t-trans
rétinoate de zinc;
- les agents antibactériens choisis plus
lo particulièrement parmi les m<~crolides, les pyranosides
et les tétracyclines et notamment l'érythromycine;
- les agents antagonistes de calcium, tels que
plus particulièrement la cinnarizine et le diltiazem;
- des hormones, tel7_es que l'estriol ou des
analogues ou la thyroxine et ses sels;
- des agents antiandrogènes, tels que
l'oxendolone, la spironolactone, le diéthylstilbestrol;
- des capteurs de radicaux OH, tels que le
diméthylsulfoxyde.
On peut également associer avec les composés de
l'invention, éventuellement en mélange avec les autres,
des composés tels que le Diazoxyde correspondant au
méthyl-3 chloro-7 2H benzot:hiadiazine 1,2,4-dioxyde-
1,1; la Spiroxasone ou 7-(acétylthio)-4',5'-
dihydrospiro [androst 4-ène-17,2'-(3'H)furan]-3 one;
des phospholipides, tels que la lécithine; les acides
linoléique et linolénique; l'acide salicylique et ses
dérivés décrits plus particulièrement dans le brevet
français No. 2.551.542, et plus particulièrement les
3o dérivés d'acide salicylique porteurs d'un groupement
alcanoyle ayant 2 à 12 atome: de carbone en position 5
du cycle benzénique; des acides hydroxycarboxyliques ou
CA 02285886 1999-09-28
18
cétocarboxyliques et leurs esters, des lactones et
leurs sels correspondants; l'anthraline ou la
trïhydroxy-1,8,9 anthracène, les caroténoïdes, les
acides eicosatétraynoique-5,8,11,14 ou eicosa-
triynoïque-5,8,11, leurs esters et amides.
Les composés conformer à l'invention peuvent
également être associés à des agents tensio-actifs dont
plus particulièrement ceux choisis parmi les agents
tensio-actifs non ioniques et amphotères.
1o Parmi les tensio-actifs non ioniques, on citera
plus particulièrement les polyhydroxypropyléthers
décrits notamment dans le:~ brevets français Nos.
1.477.048, 2.091.516, 2.169.787, 2.328.763 et
2.574.786; les alkyl (C8-C9)phénols oxyéthylénés
comportant de 1 à 100 moles d'oxyde d'éthylène et de
préférence 5 à 35 moles d'o~;yde d'éthylène; les alkyl
polyglycosides de formule:
CnH2n+1 (C6Hlo~5) x~~ ~A)
dans laquelle n varie de 8 à 15 inclus et x de 1 à 10
inclus .
Parmi les agents tensio-actifs amphotères, on
citera plus particulièrement les amphocarboxyglycinates
et les amphocarboxypropionates définis dans le
dictionnaire CTFA, Sème édition, 1982, et vendus,
notamment, sous l.a marque dE= commerce MIRANOL par la
Société MIRANOL.
Les composés selon L'invention peuvent être
introduits dans des support=s qui améliorent encore
l'activité au niveau de la repousse, en présentant à la
fois des propriétés avantageuses sur le plan
cosmétique, telles que des mélanges volatils ternaires
d'alkyléther d'alkylèneglycol., en particulier d'alkyle
en C1-C4, éther d' alkylène en C1-C4 glycol ou de
CA 02285886 1999-09-28
19
dialkylèneglycol, de préférence de dialkylène en C1-C9
glycol, d'alcool éthylique et d'eau, le solvant
glycolique désignant plus particulièrement le
monoéthyléther de l'éthylène glycol, le monométhyléther
du propylèneglycol, le monométhyléther du
diéthylèneglycol.
Les composés conforme; à l'invention peuvent
également être int:roduits dans des supports gélifiés ou
épaissis, tels que des supports essentiellement aqueux
lo gélifiés par des hétérobiopo7_ysaccharides, tels que la
que gomme de xant:hane ou le dérivé de cellulose, des
supports hydroalcooliques gélifiés par des polyhydroxy
éthylacrylates ou méthacrylates ou des supports
essentiellement aqueux épaissis en particulier par des
acides polyacry_Liques réticulés par un agent
polyfonctionnel, t:el que ceux: vendus sous la marque de
commerce CARBOPOL par la Société GOODRICH.
Ces compositions peuvent également contenir au
moins un adjuvant pharmaceutiquement ou cosmétiquement
2o acceptable choisi dans le ~~roupe constitué par les
agents conservateurs, des agents stabilisants, des
agents régulateurs de pH, les agents modificateurs de
pression osmotique, les agents émulsifiants, les
filtres UVA et UVB et les agents antioxydants, tels que
l'a-tocophérol, le butylhydroxyanisole, le
butylhydroxytoluène.
Le milieu physiologiquement acceptable peut être
constitué par de l'eau ou un mélange d'eau et d'au
moins un solvant, le solvant étant choisi parmi les
solvants organiques acceptables sur le plan cosmétique
ou pharmaceutique et choisis plus particulièrement
parmi les alcools inférieurs en C1-C4, comme l' alcool
éthylique, l'alcool isopropylique, l'alcool
tertiobutylique, les alkylèneglycols, les alkyléthers
CA 02285886 2000-12-15
d'alkylèneglycol et: de dialkylèneglycol, tels que le
monoéthyléther d'ét.hy.lèneglycol, le monométhyléther de
propylèneglycol, le monométhyléther de diéthylènegly-
col. Les solvant;: lorsqu'ils sont présents, le sont
s dans des proportic:>ns comprises de préférence entre 1 et
80% en poids par rapport au poids total de la
composition.
Les milieux physiologiquement acceptables peuvent
être épaissis à l'aide d'agents épaississants et/ou
io gélifiant:s habitue:Llement utilisés en cosmétique ou
pharmacie, et on peut plus particulièrement citer les
hétérobiopolysaccha:rides tels, que la gomme de
xanthane, les scléroglucanes, les dérivés de cellulose
comme les éther: de cellulose, les polymères
i5 acryliques, réticulés ou non.
Les épaississante sont présents de préférence dans
des proportions comprises entre 0,1 et 5% en poids, et
en particulier ent.rs~ 0,4 et 3% en poids, par rapport au
poids total de la composition.
2o L'invention vise également un procédé de
traitement cosmétique des cheveux ou du cuir chevelu,
consistant à leur appliquer au moins une composition
telle que défin:ïe ci-dessus, en vue d'améliorer
l'esthétique de la chevelure.
2s Un autre objet: de l'invention est constitué par
l'utilisation de ~..a composition contenant les composés
de formu7_e (I) définie ci-dessus, pour la préparation
d'un médicament ayant pour effet d'induire ou de
stimuler la croissance des cheveux et de freiner leur
3o chute.
Le traitement. consiste principalement à appliquer
sur les zones al.opéciques du cuir chevelu d'un
individu, la composition telle que définie ci-dessus.
CA 02285886 1999-09-28
21
Le mode d'application préféré consiste à appliquer
1 à 2 g de la composition sur la zone alopécique, à une
fréquence de une à deux applications par jour, pendant
1 à 7 jours par semaine et CE?C1. pendant une durée de 1
à 6 mois.
Les compositions peuvent. notamment être utilisées
dans le traitement de la pelade, de la chute des
cheveux, des dermatites desquamantes.
Les exemples suivants :pont destinés à illustrer
l0 l'invention sans pour autant présenter un caractère
limitatif.
EXEMPLES DE PRÉPARATION
EXEMPLE 1
Amino-2 méthyl-4 pipéridino-6 pyrimidine oxyde-3
O
H3
NH
H3 2
0
Mode opératoire:
15 g (9,35'10-2 mole) d'amino-2 méthyl-4 chloro-6
pyrimidine oxyde-3 sont introduits en suspension dans
150 ml de pipéridine. Le mé:iange est chauffé à 100°C
pendant 8 heures. Après refroidissement du milieu
réactionnel, le précipité est. filtré, lavé avec de la
pipéridine puis l'éther éthylique. I1 est ensuite
ajouté à 35 ml d'une solution aqueuse de soude à 10~
CA 02285886 1999-09-28
22
contenant 6 g de chlorure de sodium; on laisse agiter
1/2 heure puis on filtre le précipité résultant qui,
après séchage, est recristallisé dans le système eau-
éthanol (80/20).
Masse obtenue= 12,5 g
Rendement= 64%
P. F.= 262°C
Analyse élémentaire pour C1oH16N40; PM= 208.
C H N O
Calculé 57,69 7,69 26,92 7,69
Trouvé 57,76 7,73 26,81 7,71
Les spectres de RMN 1 H et 13C ainsi que le
l0 spectre de masse sont conformes à la structure.
EXEMPLE 2
Amino-2 méthyl-4 pyrrolidino-6 pyrimidine oxyde-3
Mode opératoire:
Dans un tricot de 250 ml muni d'un agitateur
magnétique, d'un thermomètre et d'un réfrigérant, on
place 9 g ( 5, 61 ~ 10-2 mole ) d' amino-2 méthyl-4 chloro-6
pyrimidine oxyde-3 en suspension dans 90 ml de
pyrrolidine. On agite le milieu réactionnel pendant 2
2o heures à température ambiante, soit 25°C. Après avoir
refroidi à 5°C, on filtre le précipité sur verre
fritté. On le lave par 100 m=L d'acétone puis par 2x100
ml d'éther éthylique. Masse obtenue= 8,85 g.
Le précipité est recristallisé dans un mélange
acétonitrile-eau (95/5). On obtient un précipité en
paillettes blanches.
Masse obtenue= 4,70 g
Rendement= 43~
P.F.= 260°C (décomposition).
Analyse élémentaire pour C9H19N40; PM= 194
CA 02285886 1999-09-28
23
C H N 0
Calculé 55,67 7,22 28,86 8,25
Trouvé 55,69 7,29 29,03 8,37
Les spectres de RMN 13C et de masse sont conformes
à la structure.
EXEMPLE 3
Amino-2 méthvl-4 morpholino-6 pvrimidine oxvde-3
Mode opératoire:
Dans un tricol de 100 ml muni d'un agitateur
1o magnétique, d'un thermomètre et d'un réfrigérant, on
place 5 g (3,12'10-2 mole) d'amino-2 méthyl-4 chloro-6
pyrimidine oxyde-3 en sus:oension dans 50 ml de
morpholine. On agite le milieu réactionnel pendant 2
heures à température ambiante, soit 25°C. Après avoir
refroidi à 5°C, on filtre le précipité sur verre
fritté. On le lave par 2x50 rnl d'acétone puis par 2x50
ml d'éther éthylique. Masse obtenue= 9,10 g.
On reprend 1e précipité dans 90 ml de potasse
alcoolique à 10~. On agite 1 heure puis on filtre sur
2o un verre fritté préalablement rempli de silice. La
solution est évaporée à sec.
Le précipité est recristallisé dans un mélange
acétonitrile-eau (90/10).
Masse obtenue= 2,1 g
Rendement= 35~
P. F. > 260°C
Analyse élémentaire pour C9H19N402; PM= 210
C H N 0
Calculé 51,43 6,66 26,67 15,24
Trouvé 51, 48 6, 7.L 26, 57 15, 48
CA 02285886 1999-09-28
24
Les spectres de RMN 13C ~~t de masse sont conformes
à la structure.
EXEMPLE 4
Amino-2 méthyl-4 t;hiomorpholino-6 pyrimidine oxyde-3
On suit le mode opératoire décrit à l'exemple 3,
mais en utilisant la thiomorpholine.
Température: 25°C
lo Temps: 2 heures
Recristallisation dans acétonitrile-éthanol
(90/10)
Rendement= 42~
P. F.= 243°C
Analyse élémentaire pour C9H14N40S; PM= 226
C H N 0 S
Calculé 47,78 6,19 24,78 7,08 14,16
Trouvé 47,88 6,25 24,86 7,22 14,03
Les spectres de RMN 13C ~~t de masse sont conformes
à la structure.
EXEMPLE 5
2o Amino-2 méthyl-4 (N-méthy7_pipérazino)-6 pyrimidine
oxyde-3
On suit le mode opératoire décrit à l'exemple 3,
en utilisant la N-méthylpipérazine.
Température: 30°C
Temps: 18 heures
Recristallisation dans le système acétonitrile-
éthanol (50/50)
Rendement= 36~
P. F.= 220°C
Analyse élémentaire pour CloH1~N50'1/4H20; PM= 223
CA 02285886 1999-09-28
C H N O
Calculé 52, 75 7, 6~~ 30, 77 8, 79
Trouvé 52, 90 7, 6é~ 30, 95 8, 83
Calculé avec 0,25 mole H~0
Les spectres de RMN 13C et de masse sont conformes
à la structure.
5 EXEMPLE 6
Amino-2 méthvl-4 diéthvlamino-6 pvrimidine oxyde-3
Mode opératoire:
Dans un tricol de 250 ml muni d'un agitateur
1o magnétique, d'un thermomètre et d'un réfrigérant, on
place 10 g (6,24'10-2 mole) d'amino-2 méthyl-4 chloro-6
pyrimidine oxyde-3 en suspen~;ion dans 70 ml d' éthanol .
On ajoute à température ambiante 10 équivalents de
diéthylamine, soit 60 ml. he milieu réactionnel est
15 chauffé à 50°C pendant 24 heures. On refroidit à 5°C
puis on ajoute 70 ml de potasse alcoolique à 10~.
On agite 1 heure. On f_Lltre sur un verre fritté
préalablement rempli de silice. La solution est
évaporée à sec.
20 Masse obtenue= 9,5 g.
Le précipité est recristallisé dans
l'acétonitrile.
Masse= 7,15 g
Rendement= 58~
25 P. F.= 188°C
Analyse élémentaire pour CgH16~40: PM= 196
C H N 0
Calcul 55,10 8,16 28,57 8,16
Trouv 54,93 8,13 28,77 8,40
CA 02285886 1999-09-28
26
Les spectres de RMN 13C ~~t de masse sont conformes
à la structure.
EXEMPLE 7
Amino-2 méthyl-4 diméthylamino-6 pyrimidine oxyde-3
On suit le mode opératoire décrit à l'exemple 6,
en utilisant la diméthylamine.
Température: 25°C
lo Temps: 3 heures
Recristallisation dans le système acétonitrile-eau
(90/10)
Rendement= 67~
P. F.= 222°C
Analyse élémentaire pour C~HlzN40% PM= 168
C H N 0
Calculé 50,00 7,14 33,33 9,52
Trouvé 49,99 7,16 33,29 9,64
Les spectres de RMN 13C, 1H et de masse sont
conformes à la structure.
EXEMPLE 8
2o Amino-2 méthyl-4 diallylamino-6 pyrimidine oxyde-3
Mode opératoire:
Dans un tricol de 100 ml muni d'un agitateur
magnétique, d'un thermomètre et d'un réfrigérant, on
place 5 g (3, 1210-2 mole) d' amino-2 méthyl-4 chloro-6
pyrimidine oxyde-3 en suspen~;ion dans 50 ml d'éthanol.
On ajoute à température ambiante 2,2 équivalents de
diallylamine, soit 6,7 g. Le milieu réactionnel est
chauffé à 60°C pendant 24 heures.
On refroidit à 5°C puis on filtre le précipité
correspondant au reste de l'amino-2 méthyl-4 chloro-6
CA 02285886 1999-09-28
27
pyrimidine oxyde-3. La solution est évaporée à sec. On
additionne de l'ét;hanol chlorhydrique jusqu'à pH acide.
Par addition d'éther éthylique, on précipite le
monochlorhydrate de l'amino-2 méthyl-4 diallylamino-6
pyrimidine oxyde-3.
Ce précipité est recristallisé dans un mélange
acétone/éthanol.
Masse obtenue= 1 g
Rendement= 12
P. F.= 166°C
Le dérivé est isolé sous forme de son
chlorhydrate.
Analyse élémentaire pour C11H1~N40C1: PM= 256,5
C H N 0 C1
Calculé 51,45 6,63 21,83 6,23 13,84
Trouvé 51, 56 6, 65 21, 92 6, 38 13, 72
Les spectres de RMN et de masse sont conformes à
la structure.
EXEMPLE 9
Amino-2 méthyl-4(n-butylamino)--6 pyrimidine oxyde-3
On suit le mode opératoire décrit dans l'exemple
2, en utilisant la n-butylamine.
2o Température : 55°C
Temps: 18 heures
Recristallisation dans _Le système acétonitril-eau
(70/30)
Rendement= 49~
P. F.= 216°C
Analyse élémentaire pour C9H16N40; PM= 196
CA 02285886 1999-09-28
28
C H N 0
Calculé 55,10 8,16 28,57 8,16
Trouvé 54,91 8,22 28,72 8,25
Les spectres de RMN 1H et de masse sont conformes
à la structure.
EXEMPLE 10
Amino-2 méthyl-4 benzylamino-6 pyrimidine oxyde-3
On suit le mode opératoire décrit dans l'exemple
2, en utilisant la benzylamine.
Température: 60°C
Temps: 6 heures
1o Recristallisation dans le système eau-éthanol
(75/25)
Rendement= 53~
P. F.= 226°C
Analyse élémentaire pour ClzH1~N40; PM= 230
C 1-i N 0
Calculé 62, 60 6, 09 24, 35 6, 95
Trouvé 62,69 6,02 24,43 7,06
Les spectres de RMN 1H et de masse sont conformes
à la structure.
EXEMPLE 11
Ethoxycarbonylamino-2 méthyl-4 ~ipéridino-6 pyrimidine
oxyde-3
CA 02285886 1999-09-28
29
O 0
H3C \ NH2 H3C /O~/
NE: t
3
+ C2H50COC1 --
N
Par action du chloroformiate- d'éthyle sur
l'amino-2 méthyl-4 pipéridino-6 pyrimidine oxyde-3, en
présence de triéthylamine, on obtient le carbamate
d'éthyle attendu.
Mode opératoire:
Dans un tricot de 50 ml muni d'un agitateur
magnétique, d'un thermomètre et d'une ampoule à
addition, on place 2 g (1,2510-2 mole) d'amino-2
lo méthyl-4 pipéridino-6 pyrimicline oxyde-3 en suspension
dans 20 ml de dichlorométhane préalablement séché sur
tamis moléculaire. On ajoute 1 équivalent de
triéthylamine, soit 1,35 ml. On refroidit le milieu
réactionnel à 0°C et on additionne goutte-à-goutte 1
équivalent de chloroformiate d' éthyle, soit 1, 05 g. On
laisse revenir à température ambiante (25°C) et on
agite 2 heures.
On ajoute 10 ml d'eau au milieu réactionnel. La
phase organique est extraite par:
- 10 ml d'acide chlorhydrique 1~
- 10 ml d'une solution de carbonate de sodium 1~
- 2x10 ml d'eau puis séchée sur sulfate de sodium.
Après filtration sur papier, la solution est
évaporée. On obtient un précipité blanc.
CA 02285886 1999-09-28
Masse obtenue= 2 g
Ce précipité est recristallisé dans 45 ml d'eau.
Masse obtenue= 1,60 g
Rendement= 60~
5 P. F.= 1 34°C
Analyse élémentaire pour Cl3HZON403: PM= 280
C H N 0
Calculé 55,71 7,.14 20,00 17,14
Trouvé 55,80 7,.18 20,09 17,05
Les spectres de RMN 13C ~~t de masse sont conformes
10 à la structure.
EXEMPLE 12
Acétamido-2 méthyl-4 diméthylamino-6 pyrimidine oxyde-3
Suivant le mode opératoire décrit dans l'exemple
11, on fait réagir le chlorure d'acétyle, en présence
15 de triéthylamine, sur l'amino-2 méthyl-4 diméthylamino-
6 pyrimidine oxyde-3.
Température: 25°C
Temps: 2 heures
Recristallisation dans l'acétate d'éthyleméthanol
20 (50/50)
Rendement= 10~
P. F.= 208°C
Analyse élémentaire pour C9H14N402; PM= 210
C H N 0
Calculé 51, 43 6, 67 26, 67 15, 24
Trouvé 51, 32 6, 66 26, 66 15, 36
25 Les spectres de RMN 13C et de masse sont conformes
à la structure.
CA 02285886 1999-09-28
31
EXEMPLE 13
Méthyl-7 pyrrolidi.no-5-2H-oxa~~iazolo-1,2,4[2,3a
pyrimidine-oxo-2
O 0
H3( ~H2
C1-C-N(CH3 ) 2 H C
N /
(Et)3N ~
Mode opératoire:
Dans un tricot de 50 ml muni d'un agitateur
magnétique, d'un thermomètre et d'une ampoule à
addition, on place 2 g (1,25'10-2 mole) d'amino-2
méthyl-4 pyrrolidino-6 pyrimidine oxyde-3 en suspension
1o dans 20 ml de dichlorométhane préalablement séché sur
tamis moléculaire. On ajoute 2 équivalents de
triéthylamine, soit 2,9 ml. On refroidit le milieu
réactionnel à 0°C. On additionne goutte-à-goutte 2
équivalents de di.méthylcarbamoylchlorure, soit 2,2 g.
On laisse revenir à température ambiante (25°C) et on
agite 2 heures.
On refroidit à 0°C puis on filtre le précipité
correspondant au chlorhydrate de triéthylamine. La
solution est évaporée à sec. On reprend le solide
obtenu dans de l'éthanol. Après avoir agité 1 heure, on
filtre le précipité. Ce précipité est recristallisé
dans de l'éthanol.
Masse obtenue= 0,5 g
Rendement= 23~
CA 02285886 1999-09-28
32
P.F.= 255°C (décomposition)
Analyse élémentaire pour CloHlaN402~1isH20; PM= 220
C H N 0
Calculé 53,66 5,54 25,05 15,74
Trouvé 53,96 5,51 25,25 15,66
Les spectres de RMN 1H et de masse sont conformes
à la structure attendue.
EXEMPLE 14
Amino-2 méthyl-4 méthoxy-6 pyrimidine oxyde-3
O O
H3~ VHZ CH30Na H3C NH2
CH30H
C1
On dissout 10 g de sodium dans 750 ml de méthanol.
lo On ajoute 50 g d'amino-2 mét~hyl-4 chloro-6 pyrimidine
oxyde-3 et on porte le milieu réactionnel à reflux
pendant 4 heures. On évapore le solvant, le mélange est
dissous dans 250 ml d'E=_au et 30 ml d'acide
chlorhydrique concentré, filtré puis basifié par
addition de soude. Le précipité blanc obtenu est
recristallisé dans de l'eau.
Rendement= 43~
P. F.= 210°C
Analyse élémentaire pour C6H9r1302'0, 15 HzO; PM= 155
C 1~ N 0
Calculé 45,66 5,90 26,63 21,81
Trouvé 45,77 5,93 26,56 21,84
Les spectres 13C RMN et de masse sont conformes à
la structure attendue.
CA 02285886 1999-09-28
33
EXEMPLE: 15
Amino-2 méthvl-4 éthoxy-6 pyr:imidine oxyde-3
On suit le mode opératoire décrit à l' exemple 14,
en utilisant l'éthanol.
Température: 80°C
Temps: 4 heures
Après mise à sec du mélange réactionnel et
addition d'éther, on filtre le précipité obtenu. On
1o évapore les eaux-mères et on précipite par de
l'acétone. Le précipité blanc: obtenu est recristallisé
dans un mélange ac:étone/eau.
Rendement= 25~
P. F.= 155°C
Analyse élémentaire pour C~H11N302% PM= 169
C f~ N 0
Calculé 49,70 6,51 24,85 18,93
Trouvé 49, 34 6, 6 24, 63 18, 69
Les spectres 1H, 13C RMN et de masse sont conformes
à la structure attendue.
EXEMPLE 16
2o Amino-2 méthyl-4 butyloxy-6 pyrimidine oxyde-3
On suit le mode opérato=_re décrit à l' exemple 14,
en utilisant le butanol.
Température: 118°C
Temps: 4 heures
Recristallisation dans un mélange éther de
Pétrole/Acétone.
Rendement= 34~
CA 02285886 1999-09-28
34
P.F.= 137°C
Analyse élémentaire pour C9H15~'~302% PM= 197
C H N 0
Calculé 54,82 7,61 21,32 16,24
Trouvé 54,74 7,65 21,20 16,41
Les spectres 1H RMN et de masse sont conformes à
la structure attendue.
EXEMPLE: 17
Amino-2 méthyl-4(méthyl-1)éth:yloxy-6 pyrimidine oxyde-3
On suit le mode opératoire décrit à l' exemple 14,
mais en utilisant l'isopropan~~l.
lo Température: reflux
Temps: 48 heures
Recristallisation dans un mélange acétonitrile-eau
(98/2)
Rendement= 10~
P. F.= 190°C
Analyse élémentaire pour CgH13N302% PM= 183
C H N 0
Calculé 52,46 7,10 22,95 17,49
Trouvé 52,44 7,20 22,92 17,58
Les spectres 1H RMN et de masse sont conformes à
la structure attendue.
EXEMPLE 18
Amino-2méthyl-4(diméthyl-2,2)propyloxy-6 pyrimidine
oxyde-3
On dissout 0,32 g de sodium dans 50 ml de
diméthyl-2, 2 propanol-1 à chaud. On ajoute 2 g (0, 0125
mole) d'amino-2 méthyl-4 chloro-6 pyrimidine oxyde-3 et
on porte le milieu réactionnel à 105°C pendant 22
CA 02285886 1999-09-28
heures. On verse le mélange encore chaud dans 300 ml
d'une solution aqueuse de soude à 10~. On extrait avec
de l'acétate d'éthyle et on sèche la phase organique
avec du sulfate de sodium. On concentre et on obtient
5 une huile brune. On filtre sur gel de silice en
utilisant un gradient d'élution avec acétate d'éthyle
et méthanol. Après évaporati~~n, on obtient un produit
brut solide qui est recri:~tallisé dans un mélange
acétonitrile-eau (98/2).
lo Rendement= 17.%
P. F.= 213°C
Analyse élémentaire pour C1oH17N302; PM= 211
C ~ N 0
Calculé 56,87 8,06 19,90 15,16
Trouvé 56,74 8,04 19,80 15,15
Les spectres 1H RMN et de masse sont conformes à
la structure attendue.
15 EXFMPI~i's 19
Amino-2 méthyl-4(cyclohexyl--1)méthyloxy-6 pyrimidine
oxyde-3
On suit le mode opérato_Lre décrit à l' exemple 14,
en utilisant le cyclohexylméthanol.
20 Température: 85°C
Temps: 5 heures
Recristallisation dans un mélange acétonitrile-eau
(98/2)
Rendement: 30~
25 P. F.= 161°C
Analyse élémentaire pour C12H19N302, '0, 1 H20; PM= 237
C H N 0
Calculé 60,25 8,04 17,57 14,13
CA 02285886 1999-09-28
36
Trouvé 60,26 8,05 17,60 14,10
Les spectres 1H RMN et ~~e masse sont conformes à
la structure attendue.
EXEMPLE: 2 0
Amino-2 méthyl-4(hexenyl-5)ox;y-6 pyrimidine oxyde-3
On suit le mode opératoire décrit à l' exemple 14,
en utilisant l'hexène-5 0l-1.
Température: 85°C
Temps: 3 heures, 15 minutes
Recristallisation dans l'acétonitrile
1o Rendement= 27
P. F.= 103°C
Analyse élémentaire pour C11H1~N302, 0, 1'H20; PM= 223
C H N 0
Calcul 58, 66 7, 18, 66 15, O1
65
Trouv 58,68 7,65 18,52 14,93
Les spectres 1H RMN et masse sont conformes
de
la structure attendue.
EXEMPLE 21
Amino-2 méthvl-4 benzyloxy-6 pyrimidine oxyde-3
On suit le mode opératoire décrit à l' exemple 14,
en utilisant l'alcool benzylique.
2o Température: 83°C
Temps: 2 heures 30 minutes
Recristallisation dans un mélange acétonitrile-eau
(98/2)
Rendement= 45~
P. F.= 188°C
CA 02285886 1999-09-28
37
Analyse élémentaire pour Cl2Hi:3N302% PM= 231
C H N 0
Calculé 62,33 5,62 18,18 13,85
Trouvé 62,40 5,59 18,06 13,89
Les spectres 1H RMN et de masse sont conformes à
la structure attendue.
EXEMPLE: 2 2
Amino-2 méthyl-4(diméthyl-2,4)phényloxy-6 pyrimidine
oxyde-3
On suit le mode opératoire décrit à l' exemple 14,
en utilisant le diméthyl-2,4 :phénol.
l0 Température : 7 5°C
Temps: 4 heures
Recristallisation dans un mélange acétonitrile-eau
(95/5)
Rendement= 60~
P. F.= 214°C
Analyse élémentaire pour Cl3HisN30z% PM= 245
C I~ N O
Calculé 63,67 6,12 17,14 13,06
Trouvé 63,60 6,16 17,16 13,19
Les spectres 13C, 1H RMN et de masse sont conformes
à la structure attendue.
2 0 EXEMPLE 2 3
Amino-2 méthvl-4 méthvlthio-6 pvrimidine oxvde-3
CA 02285886 1999-09-28
38
O O
H3 2 CH3SC~Na~ H3 2
W (1)
CH3
Le composé (I) est obtE:nu par action du méthyl-
thiolate de sodium, à chaud, sur l'amino-2 méthyl-4
chloro-6 pyrimidine oxyde-3.
Mode opératoire:
5 g (3,12'10-2 mole) d'amino-2 méthyl-4 chloro-6
pyrimidine oxyde-3 sont introduits dans 75 ml de
diméthoxy-1,2 éthane; on ajoute 5,46 g (7,81'10-2 mole)
de méthylthiolate de sodium puis on porte à reflux
1o jusqu'à disparition du substrat de départ (tréaction=55
heures). Le précipité obtenu, après filtration du
milieu réactionnel, est dissous dans le méthanol et
additionné d'éthanol chlorh~~drique jusqu'à pH=2; le
chlorhydrate du composé (1) est isolé, puis la base
associée est libérée par ajout d'une solution de
méthylate de sodium à 30~ dans le méthanol; après avoir
éliminé les sels par précipitation à l'éther éthylique,
le filtrat résultant est évaporé à sec puis
recristallisé dans le système acétonitrile-éthanol
(70/30). On obtient 1,55 g du composé (1).
Rendement= 29~
P. F.= 172°C
Analyse élémentaire pour C6H9N30S; PM= 171
C H N 0 S
Calculé 42,10 5,26 24,56 9,35 18,71
Trouvé 42,17 5,31 24,65 9,45 18,47
CA 02285886 1999-09-28
39
Les spectres 13C RMN et de masse sont conformes à
la structure attendue.
EXEMPLE: 2 4
Amino-2 méthvl-4 éthvlthio-6 ~yrimidine oxyde-3
5 g (3,1210-2 mole) d'amino-2 méthyl-4 chloro-6
pyrimidine oxyde-3 sont introduits en suspension dans
75 ml de diméthoxy-1,2 éthane; on ajoute 3,92 g
(4,68'10-z mole) d'éthylthio:Late de sodium, puis on
porte à reflux jusqu'à di:~parition du substrat de
lo départ (tréaction=18 heures) . Le précipité issu du milieu
réactionnel est agité en suspension dans 30 ml d'eau
puis filtré, séché et recristallisé dans
l'acétonitrile. On obtient 2,1 g du composé attendu.
Rendement= 36~
P. F.= 152°C
Analyse élémentaire pour C~H11N30S; PM= 185
C H N 0 S
Calculé 45,40 5,94 22,70 8,65 17,29
Trouvé 45, 33 5, 9-'i 22, 82 8, 78 17, 32
Les spectres 1H RMN et c~e masse sont conformes la
structure attendue.
2 o EXEMPLE 2 5
Amino-2 méthyl-4 pyrimidine oxyde-3
O 0
H ~ MeOH/Na2C03 H
3 2 ~ 3 2
Pd/C H2
On mélange 15 g d'a:mino-2 méthyl-4 chloro-6
pyrimidine oxyde-3, 11 g de ~~arbonate de sodium, 2, 4 g
CA 02285886 1999-09-28
de palladium/charbon à 10~ da:zs 1 litre de méthanol. On
hydrogénolyse dana un appareil de PARR sous 2x105 Pa
pendant 2 heures 30 minutes. On filtre le milieu
réactionnel puis on évapore le solvant. Le précipité
5 est extrait par de l'acétate ~~'éthyle bouillant.
Rendement= 20~
P. F.= 145°C
Analyse élémentaire pour CSH~N30; PM= 125
C H N 0
Calculé 48,00 5,6 33,6 12,8
Trouvé 47,97 5,6 33,7 12,87
1o Les spectres 13C RMN et de masse sont conformes à
la structure attendue.
EXEMPI~F: 2 6
Sel interne de l'hydroxydE: de l'amino-2 méthyl-4
diméthvlamino-6 sulfooxy-3 pyrimidinium
~'.~H~
H3 3
H3 H3
NH2 NH2
~N H3 ~ ~ FH3
0~ O O~S-O- Q N
~H ~ p ~ ~ ~ CH
3 3
15 H3 H3 (2 )
Ä une solution de 1,03 ml (0,006 mole) de N,N-
diisopropyléthyl amine dana 8 ml de chloroforme
refroidie dans la glace, on ajoute, sous agitation, 0,2
ml (0,003 mole) d'acide chlorosulfonique. Après attente
20 de 30 minutes, on ajoute 0,252 g (0,0015 mole) d'amino-
2 méthyl-4 diméthylamino-6 pyrimidine oxyde-3 et on
maintient 2 heures entre 0" et 5°C, sous azote. On
CA 02285886 1999-09-28
41
filtre le précipité blanc qu:i s'est formé, puis on le
lave avec un peu de chloroforme.
Après recristallisation dans un mélange
diméthylformamide-eau, on obtient 0,11 g du composé (2)
qui se décompose à 250°C. Le i_endement est de 30~.
Analyse élémentaire pour C~H12:N409S; PM= 248
C H N 0 S
Calculé 33,88 4,84 22,58 25,80 12,90
Trouvé 33,90 4,86 22,62 25,82 12,81
Spectre de masse: conforme.
EXEMPLE 27
1o Sel interne de l'hvdroxvde de l'amino-2 méthyl-4
pyrrolidino-6 sulfooxy-3 pyri:midinium
NH2 ~ 0
N O=~=O
OE-IS-0-
0~
CH3
Dans une suspension de 0,194 g (0,001 mole)
d'amino-2 méthyl-4 pyrrolidino-6 pyrimidine oxyde-3, on
ajoute sous agitation 0,32 g (0,002 mole) de complexe
de trioxyde de soufre-pyridine et on maintient à
température ambiante pendant: 3 heures. On dilue la
solution obtenue par 15 g d'eau glacée. On filtre le
précipité blanc, puis on le lave avec un peut d'eau
2o glacée .
Après recristallisation dans un mélange diméthyl-
formamide-eau, on obtient 0,085 g du composé (3) qui se
décompose à 260°C.
Le rendement est de 31~.
Analyse élémentaire pour C9H14N4O4S; PM= 274
CA 02285886 1999-09-28
42
C H N O S
Calculé 39,42 5,11 20,44 23,36 11,68
Trouvé 39,35 5,16 20,33 23,36 11,61
Spectre de masse: conforme.
EXEMPLE: 2 8
Sel interne de l'hydroxyde de l'amino-2 méthyl-4
pipéridino-6 sulfooxy-3 pyrimidinium
On suit le mode opératoire décrit à l'exemple 27,
en utilisant l'amino-2 méthyl-4 pipéridino-6 pyrimidine
oxyde-3.
Le produit obtenu recristallisé dans un mélange
lo diméthylformamide-eau est un monohydrate qui se
décompose à 184°C.
Le rendement est de 73s.
Analyse élémentaire pour C1oH18N905S% PM= 306
C H N 0 S
Calculé 39,21 5,88 18,30 26,14 10,46
Trouvé 39,27 6,08 18,48 26,02 10,44
Spectre de masse: conforme.
Spectre 1H RMN: conforme.
EXEMPLE 2 9
Sel interne de l'hydroxyde de l'amino-2 méthyl-4
morpholino-6 sulfooxy-3 pyrimidinium
2o On suit le mode opératoire décrit à l' exemple 26,
en utilisant l'am_ino-2 méthyl-4 morpholino-6 pyrimidine
oxyde-3.
Le temps de réaction est. de 3 heures et la tempé-
rature est maintenue entre 5 et 10°C.
Le produit obtenu recristallisé dans un mélange
diméthylformamide-eau se décompose à 250°C.
CA 02285886 1999-09-28
43
Le rendement est de 56~.
Analyse élémentaire pour C9HIqNqOSS; PM= 290
C H N O S
Calculé 37,24 4,83 19,31 27,59 11,03
Trouvé 37,29 4,81 19,39 27,83 10,96
Spectre de masse: conforme.
EXEMPLES 3 0
Sel interne de l'hydroxyde de l'amino-2 méthyl-4
thiomorpholino-6 sulfooxy-3 pyrimidinium
On suit le mode opérato~_re décrit à l' exemple 26,
en utilisant l'amino-2 méthyl-4 thiomorpholino-6
lo pyrimidine oxyde-3.
Le temps de réaction est de 1 heure 30 minutes.
Le produit obtenu recr_~stallisé dans un mélange
diméthylformamide-eau se décompose au-dessus de 260°C.
Le rendement est de 74%.
Analyse élémentaire pour C9H14N904S2; PM= 306
C H N 0 S
Calculé 35,29 4,57 18,30 20,91 20,91
Trouvé 35,15 4,50 18,35 21,10 20,88
Spectre de masse: conforme.
EXEMPLI's 31
Sel interne de l'hydroxyde de l'amino-2 méthyl-4
(méthyl-4 pipérazïno)-6 sulfooxy-3 pyrimidinium
On suit le mode opérato_~re décrit à l' exemple 26,
en utilisant l'amino-2 méthyl-4 (méthyl-4 pipérazino)-6
pyrimidine oxyde-3.
Le temps de réaction est de 3 heures.
Le produit obtenu recristallisé dans un mélange
diméthylformamide-eau se décompose à 265°C.
CA 02285886 1999-09-28
44
Le rendement est de 20~.
Analyse élémentaire pour CloH1vN504S,'0,15 H20; PM= 303
C H N 0 S
Calculé 39,27 5,65 22,91 21,68 10,47
Trouvé 39,18 5,72 23,01 21,68 10,46
Spectre de masse: conforme.
EXEMPLES 32
Sel interne de l'hydroxyde de l'amino-2 méthyl-4
méthoxy-6 sulfooxy-3 pyrimidinium
On suit le mode opératoire décrit à l' exemple 26,
en utilisant l'amino-2 méth;yl-4 méthoxy-6 pyrimidine
lo oxyde-3.
Le temps de réaction est de 1 heure 30 minutes.
Le rendement en produit brut est de 60~.
Spectre de masse: conforme.
EXEMPLE 33
Sel interne de l'hydroxyde de l'amino-2 méthyl-4
éthoxv-6 sulfooxy-3 pyrimidinium
Ä une solution de 1,03 ml (0,006 mole) de N,N-
diisopropyléthylamine dans 8 ml de chloroforme
refroidie dans la glace, on ajoute, sous agitation, 0,2
2o ml (0,003 mole) d'acide chlorosulfonique. Après une
attente de 30 minutes, on ajoute 0,253 g (0,0015 mole)
d'amino-2 méthyl-4 éthoxy-6 pyrimidine oxyde-3 et on
maintient 2 heures entre 0°~~ et 5°C, sous azote. Le
solvant est évaporé. Le résidu repris dans un peu d'eau
laisse cristalliser un produit blanc que l'on filtre et
sèche.
Le rendement en produit brut est de 25~.
Spectre de masse: conforme.
CA 02285886 1999-09-28
EXEMPLE: 3 4
Amino-2 tétraméthylène-4,5 pipéridino-6 pyrimidine
oxyde-3
lère partie:
5 Préparation de l'amino-2 tét:raméthylène-4,5 hydroxy-6
pyrimidine.
Dans un tricol, muni d'un réfrigérant, d'un ther-
momètre et d'une entrée d'~irgon, on dissout 2,15 g
(9,35'10-2 m) de sodium dans 70 ml d'éthanol absolu puis
10 on ajoute 8,95 g (9,3710-2 mole) de chlorure de
guanidinium par portions solides en maintenant la
température à 25°C.
On procède ensuite à une coulée progressive de
16,66 ml d'éthylcyclohexanone-2 carboxylate à 90~
15 ( 9, 3710-2 m) introduite au préalable dans une ampoule à
brome; le temps d'écoulement est de 20 mn et la
température de la réaction exotherme se développe
jusqu' à 45°C.
Lorsque la température du milieu réactionnel est
2o revenue à l'ambiante, on filtre le précipité, on le
lave abondamment à l'eau pour éliminer le chlorure de
sodium puis à l'éthanol; la masse brute ainsi obtenue
est recristallisée dans l'eau.
Masse recristallisée: 11,84 g
25 Rendement= 76,3%
Analyses:
P. F.= 300°C
Analyse élémentaire pour C$H11N30; 0, 1H20; PM= 165
CA 02285886 1999-09-28
46
C H N 0
Calculé 57,55 6,65 25,18 10,55
Trouvé 57,57 6,73 25,09 10,56
Les spectres RMN 1H et ~~e masse sont conformes à
la structure attendue.
2ème partie:
Préparation de l'amino-2 tétraméthylène-4,5 chloro-6
pvrimidine.
Dans un tricot de 250 rr.l, muni d'un thermomètre,
d'un réfrigérant surmonté d'une garde à chlorure de
calcium et d'une agitation magnétique, on introduit
10 g ( 6' 10-2 m) d' amino-2 tét~raméthylène-4, 5 hydroxy-6
pyrimidine dans 1C)0 ml d'oxychlorure de phosphore.
On chauffe l.e milieu à 100°C pendant 1/2 heure,
puis on laisse revenir à température ambiante.
L'oxychlorure de phosphore est évaporé; l'huile obtenue
est versée lentement sur une solution aqueuse
d'ammoniaque à 6,6% (300 ml) en maintenant la
température inférieure à 10°C.
On agite 1/2 heure et on filtre le précipité blanc
obtenu qu'on lave à l'eau jusqu'à neutralité.
La masse brute ainsi ré~:upérée est recristallisée
dans l'éthanol.
Masse recristallisée= 4 g
Rendement= 36,4
Analyses:
P. F.= 207°C
Analyse élémentaire pour C$HloN3Cl; PM= 183, 5
CA 02285886 1999-09-28
47
C H N C1
Calculé 52,32 5,45 22,89 19,34
Trouvé 52,27 5,49 22,98 19,46
Les spectres de RMN 1H et de masse sont conformes
à la structure attendue.
Sème partie:
Préparation de l'amino-2 tétraméthylène-4,5 chloro-6
pyrimidine oxyde-3
Dans un tricot d'un litre muni d'un thermomètre et
d'une agitation magnétique, on introduit 30 g
(16,34'10-2 mole) d'amino-2 tE=traméthylène-4,5 chloro-6
lo pyrimidine en suspension dans 600 ml de méthanol; on
ajoute alors 76,2 g (1.,5 équivalent) d'acide
métachloroperbenzoïque à 55~ en maintenant la
température à 5°C.
On laisse ensuite agiter 4 heures à l'ambiante
(25°C) .
Le milieu réactionnel est filtré et le précipité
isolé est lavé au méthanol froid, puis à l'éther
éthylique.
Masse obtenue= 28,5 g
2o Rendement= 87%
Analyses:
P. F.= 188°C
Analyse élémentaire pour C$HloC1N30; PM= 199, 5
C H N 0 Cl
Calculé 42,12 5,01. 21,05 8,02 17,79
Trouvé 48,07 5,0~~ 21,09 7,95 17,85
Les spectres de RMN 1H et de masse sont conformes
à la structure attendue.
CA 02285886 1999-09-28
48
4ème partie
Préparation de l'amino-2 tétraméthylène-4,5 pipé-
ridino-6 pyrimidine oxyde-3
0 O
H ( NH ~ NH
2 ~ 2
C1
Mode opératoire:
g (510-' mole) d'amino-2 tétraméthylène-4,5
chloro-6 pyrimidine oxyde-3 sont introduits dans 100 ml
de pipéridine; le milieu rèactionnel est chauffé à
reflux pendant 8 heures, re:Eroidi à l'ambiante, puis
lo filtré sur fritté. Le précipité obtenu est additionné
par portions solides à une solution réfrigérée de 30 cc
d'eau dans laquelle on a dissous 2 g de soude et 3 g de
chlorure de sodium. On agite 1 heure, on filtre, puis
on lave à l'eau jusqu'à neutralité; les cristaux blancs
sont recristallisés dans un mélange eau/éthanol
(50/50).
Masse obtenue= 5,4 g
Rendement= 43,5
Analyses:
P.F.= 178°C
Analyse élémentaire pour Cl3HZON40; 0, 3 H20 PM= 248
C H N 0
Calculé 61,56 5,.13 22,09 8,21
Trouvé 62,02 8,.11 22,19 8,24
CA 02285886 1999-09-28
49
Les spectres de RMN 1H et de masse sont conformes
à la structure attendue.
EXEMPLE: 3 5
Amino-2 tétraméthylène-4,5 butoxy-6 pyrimidine oxyde-3
Mode opératoire:
Dans un tricot, muni d'tzn réfrigérant, d' un ther-
momètre et d'une entrée d'argon, on ajoute 1,72 g
(7,5'10-2 m) de sodium dans 100 ml de butanol anhydre,
on agite pendant 3/4 d'heure en laissant se développer
l'exothermicité liée à la formation du butylate de
sodium. On additionne ensuite par portions solides,
10 g (510-2 m) d'amino-2 tétraméthylène-4,5 chloro-6
pyrimidine oxyde-3 puis on chauffe au reflux du butanol
durant 1 heure.
Après refroidissement d.u milieu réactionnel, on
filtre et on ajuste le filtrat à neutralité par
addition d'éthanol chlorhydrique; le chlorure de sodium
est éliminé, puis la phase organique est lavée avec
30 ml d'eau distillée, évaporée à sec et le résidu
2o huileux résultant est précipité par addition d'éther
éthylique. On agite dans un bain d'eau glacée durant
1/2 heure, puis on filtre.
La masse brute obtenue (9 g) est recristallisée
dans un mélange acétonitrile/éthanol (50/50), on
récupère ainsi 4,65 g du composé pur.
Rendement= 39~
Analyses:
P. F.= 166°C
Analyse élémentaire pour C12H19N302; PM - 237
C H N 0
Calculé 60,76 8,02 17,72 13,50
Trouvé 60,76 8,06 17,78 13,69
CA 02285886 1999-09-28
Les spectres de RMN 13C et de masse sont conformes
à la structure attendue.
EXEMPLE: 3 6
Amino-2 méthvl-4 anilino-6 pyrimidine oxyde-3
5 Dans un tricol, muni d' un réfrigérant, d' un ther-
momètre et d'une agitation magnétique, on place 20 g
d'amino-2 méthyl-4 chloro-6 pyrimidine oxyde-3, 25,65 g
d'aniline et 100 ml d'éthanol. Le milieu réactionnel
est porté à 55°C pendant 4 heures.
lo Après être revenu à température ambiante, on
filtre sur papier, puis on évapore à sec, l'huile est
reprise dans 10 m:l d'éthanol, puis amenée à pH = 4 par
addition d'éthanol chlorhydrique. On additionne 100 ml
d'éther éthylique. Un produit beige précipite. Ce
15 précipité est filtré, lavé par de l'éther éthylique,
séché sous vide, puis repris dans 50 ml de soude. Après
1 heure d'agitation, le précipité est filtré, lavé par
de l'eau jusqu'à neutralité, séché sous vide sur
pentoxyde de phosphore. On recristallise dans 120 ml de
2o diméthylformamide et on obtient 3,1 g d'amino-2 méthyl-
4 anilino-6 pyrimidine oxyde-3.
Rendement= 11,5
Analyses:
P. F.= 260°C
25 Analyse élémentaire pour C11Hi2N20; PM= 216
C H N O
Calcul 61,12 5,50 25,92 7,40
Trouv 61,12 5,50 25,82 7,62
Les spectres de masse et RMN 1H sont conformes
la structure attendue.
EXEMPLE 3 7
CA 02285886 1999-09-28
51
Amino-2 méthyl-4 (N-méthylphénéthylamino)-6 pyrimidine
oxyde-3
On suit le mode opératoire décrit à l' exemple 36,
en utilisant la N-méthylphénéthylamine.
Température= 40°C
Temps: 3 heures
Recristallisation dans acétonitrile
Rendement= 33~
P. F.= 170C
1o Analyse lmentaire pour C14H1gN9O;PM= 258
C ~ N O
Calcul 65,12 6,98 21,70 6,20
Trouv 64,82 6,96 21,50 6,64
Les spectres de masse et 1H sont conformes
RMN
la structure attendue.
EXEMPLE 38
Amino-2 méthyl-4 héxamét:nylèneimino-6 pyrimidine
oxyde-3
On suit le mode opératoire décrit à l'exemple 3,
en utilisant l'hexaméthylèneimine.
Température= 80°C
Temps: 3 heures
Recristallisation dans acétonitrile/ethanol
(70/30)
Rendement= l'7
P.F.= 218°C
Analyse élémentaire pour C11H18N40; PM= 222
C H N 0
Calculé 59,46 8,10 25,22 7,20
Trouvé 59,47 8,21 25,40 7,30
CA 02285886 1999-09-28
52
Les spectres de masse et RMN 1H sont conformes à
la structure attendue.
EXEMPLE: 3 9
Sel interne de l'hydroxyde de l'amino-2 tétraméthylène-
4,5 butoxy-6 sulfooxy-3 pyrimidinium
Ä une solution de 1,2 ml (0,007 m) de N,N-
diisopropyléthylamine dans 6 ml de chloroforme
refroidie dans la glace, est ajouté, sous agitation,
0,12 ml (0,003 m) d'acide chlorosulfonique. Après
1o attente de 30 minutes, on ,joute 0,237 g (0,001 m)
d'amino-2 tétramét=hylène-4,5 butoxy-6 pyrimidine oxyde-
3 et on maintient 2 heures entre 0° et 5°C, sous azote.
Le solvant est évaporé. Le :résidu est repris dans un
peu d'eau, on obtient un produit cristallin blanc que
l'on filtre. Après recristallisation dans un mélange de
diméthylformamide/eau, on obtient 0,13 g de cristaux
blancs qui se décomposent à 122°C.
Rendement= 41~
Analyse élémentaire pour C12H19N305S; 0, 21 HzO; PM= 317
C H N 0 S
Calcul 44,89 6,05 13,09 25,9 9,97
Trouv 44,89 6,08 13,09 26,02 9,93
Les spectres de masse et RMN 1H sont conformes
la structure attendue.
EXEMPLE 4 0
Sel interne de l'hydroxyde de l'amino-2 méthyl-4 N-
méthvlphénéthvlam:ino-6 sulfooxy-3 pyrimidinium
lère méthode:
CA 02285886 1999-09-28
53
C2H5
CH3 ~ _H3
\HC.-~- C: /\
CH3/ 0=S=0 CH3
NH2 NHZ -
yN /CH3 \ O ~ O /CH3
0 -0- ~ ld
O~N' ~ ~ CH -CH \ r \CH z-- CH 2
~\ /
H3 CH3
Ä une solution de 0,7'<? ml (0,0042 m) de N,N-
diisopropyléthylamine dans 6 ml de chloroforme
refroidie dans la glace, es~~~ ajouté, sous agitation,
0,133 ml (0,002 m) d'acidE: chlorosulfonique. Après
attente de 30 minutes, on ajoute 0,258 g (0,001 m)
d'amino-2 méthyl-4 N-méthylplzénéthylamino-6 pyrimidine
oxyde-3 et l' on maintient pendant 3 heures entre 0° et
5°C, sous azote. Le solvant est évaporé. On reprend le
1o résidu dans un peu d'eau, on obtient un produit
cristallin blanc que l'on filtre. Après
recristallisation dans un mé:Lange acétonitrile/eau, on
obtient 0,27 g de sel interne qui se décompose à 213°C.
Rendement= 80%
Analyse élémentaire pour C14H18N40qS; 0, 25 H20; PM= 338
C H N O S
Calculé 49, 05 5, 40 16, 35 19, 85 9, 34
Trouvé 48,98 5,2~~ 16,27 19,94 9,43
Les spectres de masse et RMN 1H sont conformes à
la structure attendue.
2ème méthode:
Dans une suspension de 0,258 g (0,001 m) d'amino-2
2o méthyl-4 N-méthy:Lphénéthylamino-6 pyrimidine oxyde-3
dans 3 ml de diméthylformamide est ajouté sous
agitation 0,32 g (0,002 m) cte complexe de trioxyde de
CA 02285886 1999-09-28
54
soufre/pyridine. Après 2 heL.res à 15-20°C, on ajoute
0,16 g (0,001 m) du complexe et laisse encore 1 heure à
15-20°C. On dilue la solution obtenue par 15 g d'eau
glacée. On filtre le précipité blanc obtenu, et on le
lave à l'eau glacée. Après recristallisation dans un
mélange acétonitrile/eau, on obtient 0,24 g de sulfate
interne qui se décompose à 213°C.
Rendement= 7 J.
EXEMPLE 41
lo Sel interne de l'hydroxydE: de l'amino-2 méthyl-4
anilino-6 sulfooxy-3 pyrimidinium
On suit le mode opératoure de la première méthode
décrit à l'exemple 40 en utilisant 0,216 g d'amino-2
méthyl-4 anilino-6 pyrimidine oxyde-3. Le produit
obtenu recristallisé dans un mélange acétonitrile/eau,
se décompose au-dessus de 260°C.
Rendement= 64~
Analyse élémentaire pour CllHiaN404S% PM= 296
C H N 0 S
Calculé 44,59 4,05 18,92 21,62 10,82
Trouvé 44,68 4,07 18,95 21,54 10,69
Les spectres de masse et RMN 1H sont conformes à
la structure attendue.
EXEMPLE 42
Sel interne de l'hydroxydE= de l'amino-2 méthyl-4
hexaméthvlèneimino-6 sulfooxy-3 pyrimidinium
On suit le mode opératoire de la première méthode
décrit à l'exemple 40 en utilisant 0,222 g d'amino-2
méthyl-4 hexaméthylèneimine-6 pyrimidine oxyde-3. Le
produit obtenu recristal_Lisé dans un mélange
acétonitrile/eau, se décompose au-dessus de 195°C.
CA 02285886 1999-09-28
Rendement= 46~
Analyse élémentaire pour CllHisN404S: PM= 302
C H N 0 S
Calculé 43,71 5,96 18,54 21,19 10,60
Trouvé 43,79 6,04 18,71 21,20 10,40
Les spectres de masse et RMN 1H sont conformes à
5 la structure attendue.
EXEMPLES DE FORMULATION
On prépare une lotion destinée au traitement de la
chute des cheveux, ayant la composition suivante:
Lotion 1
- Amino-2 méthyl-4 pipéridino-6
pyrimidine oxyde-3 (exemple 1) 5,0 g
- Propylèneglycol 23,0 g
- Ethanol 55,0 g
- Eau qsp 100,0 g
T .. ~ ~ .v .-.
- Amino-2 méthyl-4 pipéridino-6
pyrimidine oxyde-3 (exemple 1) 2,0 g
- Ethanol 49,0 g
- Eau qsp 49,0 g
T .-. i- s
- Amino-2 méthyl-4 morpholin~~-6
pyrimidine oxyde-3 (exemple 3) 2,0 g
- Propylèneglycol. 4,9 g
- Ethanol 93,1 g
Lotion 4
- Amino-2 méthyl-4 diméthylamino-6
pyrimidine oxyde-3 (exemple 7) 5,0 g
- Propylèneglycol. 23,0 g
- Ethanol 55,0 g
- Eau qsp 100,0 g
Lotion 5
- Amino-2 méthyl-4 diméthyla:mino-6
pyrimidine oxyde-3 (exemple 7) 2,0 g
- Propylèneglyco7_ 4,9 g
- Ethanol 93,1 g
T .~ 1- .~.
- Amino-2 méthyl-4 butyloxy-6
pyrimidine oxyde-3 (exemple 16) 8,0 g
CA 02285886 1999-09-28
56
- Propylèneglycol 23,0 g
- Ethanol 55,0 g
- Eau qsp 100,0 g
Lotion 7
- Amino-2 méthyl-4 méthoxy-6
pyrimidine oxyde-3 (exemple 14) 1,0 g
- Propylèneglycol 5,0 g
- Ethanol 94,0 g
T ~ 1 s
- Amino-2 méthyl-4 éthoxy-6 5,0 g
pyrimidine oxyde-3 (exemple 15)
- Ethanol 47,5 g
- Eau 47, 5 g
Lotion 9
- Amino-2 méthyl-4 pyrimidine
oxyde-3
(exemple 25) 3,0 g
- Ethanol 30,0 g
- Propylèneglycol 20,0 g
- Eau qsp 100,0 g
.... ~ n
- Amino-2 méthyl-4 pyrimidine
oxyde-3 (exemple 25) 2,0 g
- Propylèneglycol 4,9 g
- Ethanol 93,1 g
On applique 1 à 2 g de chacune de ces lotions sur
les zones alopéciques du cuir chevelu, à raison d'une
application par -jour pendant= 7 jours par semaine et
ceci pendant 3 mo=is.