Note: Descriptions are shown in the official language in which they were submitted.
CA 02298974 2007-06-21
1
THIAZOLOBENZOHETEROCYCLES, LEUR PREPARATION ET LES
MEDICAMENTS LES CONTENANT
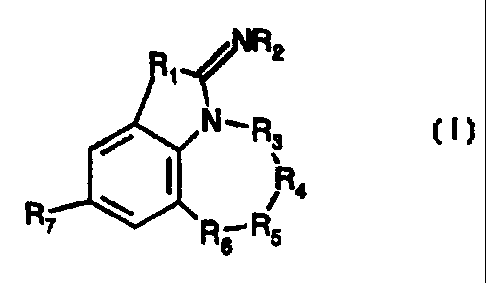
La présente invention concerne des composés de formule :
R2
Ri
N R3
(I)
Ra
R7 Rs R$
leurs isomères, racémiques ou énantiomères lorsque ces composés de formule
(I) comportent un ou plusieurs centres d'asymétrie, leurs sels
pharmaceutiquement acceptables, leurs procédés de préparation et les
compositions pharmaceutiques contenant ces composés en tant que principe
actif .
Dans la formule (I),
R, représente un atome de soufre ou de sélénium,
R2 représente un atome d'hydrogène ou un radical aikyle,
-R3-R4-R5-R6- représente une chaîne de formule -CH2-CH2-CH2-CH2-,
-CH2-CH2-CH2-CO-, -CH2-CH2-CH2-CH (R8)-, -CH2-CH2-CH2-Se-,
-CH2-CH2-Se-CH2-, -CH2-CH2-CH2-S-, -CH2-CH2-CH2-SO-,
-CH2-CHZ-CH2-S02-, -CH2-CH2-CH2-O-, -CH2-CHZ-CH2-N(R9)-,
-CH2-CH2-CO-CH2-, -CH2-CH2-CH(R8)-CH2-, -CH2-CH2-S-CH2-,
-CH2-CH2-SO-CH2-, -CH2-CH2-SO2-CH2-, -CH2-C(alk)(alk')-S-CH2,
-CH2-C(alk)(alk')-SO-CH2, -CH2-C(alk)(aik')-S02-CH2, -CH2-CH(R,o)-S-CH2-,
-CH2-CH(R,o)-SO-CH2-, -CH2-CH(R,a)-S02-CH2-, -CH2-CH2-O-CHZ-,
-CH2-CH2-N(R9)-CH2- ou -CH2-CO-N(R9)-CH2-, et
R7 représente un radical polyfluoroalkyle ou polyfluoroalcoxy,
avec
CA 02298974 2007-06-21
2
R8 représente un radical hydroxy,
R9 représente un atome d'hydrogène ou un radical alkyle ou benzyle,
R,o représente un radical alkyle, -CH2OH, -COOalk, -COOH ou -CONH2,
alk représente un radical alkyle, et
alk' représente un radical alkyle.
Dans les défi,~,itions qui pr ccedeni et ce!le5 yui seront citées ci-après,
saut
mention contraire, les radicaux et portions alkyle contiennent 1 à 6 atomes
de carbone en chaîne droite ou ramifiée.
Parmi les radicaux polyfluoroalkyle on peut citer les radicaux
trifluorométhyle,
2,2,2-trifluoroéthyle, 1,1,2,2-tétrafluoroéthyle, perfluoroéthyle, perfluo-
ropropyle, perfluorobutyle.
Parmi les radicaux polyfluoroalcoxy on peut citer les radicaux trifluoromé-
thoxy, perfluoroéthoxy, 2,2,2-trifluoroéthoxy, 1,1,2,2-tétrafluoroéthoxy,
2,2,3,3,3-pentafluoropropoxy, perfluoropropoxy, perfluorobutoxy.
Les radicaux polyfluoroalkyle et polyfluoroalcoxy préférés sont les radicaux
trifluorornéthyle, trifluorométhoxy et pentafluoroéthoxy.
L'invention concerne également les sels d'addition des composés de formule
(1) avec les acides minéraux ou organiques.
Les composés de formule (I) qui comportent un ou plusieurs centres asymé-
triques présentent des formes isomères, ces isomères et mélanges font par-
tie de l'invention. Les racémiques et les énantiomères de ces composés font
également partie de l'invention.
Les composés de formule (1) pour lesquels R, représente un atome de soufre
ou de sélénium, R2 représente un atome d'hydrogène, -R3-R4-R5-R6-
représente une chaîne de formule -CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CO-,
CA 02298974 2007-06-21
3
-CH2-CH2-CH2-CH(R8)-, -CH2-CH2-CH2-Se-, -CH2-CH2-Se-CH2-,
-CH2-CH2-CH2-S-, -CH2-CH2-CHZ-O-, -CH2-CH2-CH2-N(R9)-,
-CH2-CH2-CO-CH2-, -CH2-CH2-CH (R8)-CH2-, -CHZ-CH2-S-CH2-,
-CH2-C(alk)(aik')-S-CH2, -CH2-CH(R,o)-S-CH2-, -CH2-CH2-O-CH2-,
-CHZ-CH2-N(R9)-CH2- ou -CH2-CO-N(R5)-CH2-, R8 représente un radical hy-
droxy, R9 représente un atome d'hydrogène ou un radical alkyle ou benzyle
et R,o représente un radical alkyle, COOalk ou CONH2 peuvent être préparés
par action de thiocyanate de métal alcalin ou de sélénocyanate de métal al-
calin avPÇ: i in ciérlvé de formule :
b-R
/ 3 (II)
~ R4
\ ~
R7 R6 R5
dans laquelle R7 a les mêmes significations que dans la formule (I) et
-R3-R4-R5-R6- représente une chaîne de formule -CH2-CH2-CH2-CH2-,
-CH2-CH2-CH2-CO-, -CH2-CH2-CH2-CH(R8)-, -CHZ-CH2-CH2-Se-,
-CH2-CH2-Se-CH2-, -CH2-CH2-CH2-S-, -CH2-CHZ-CH2-0-,
-CH2-CH2-CH2-N(R9)-, -CH2-CH2-CO-CH2-, -CH2-CH2-CH(R8)-CH2-,
-CH2-CH2-S-CH2-, -CH2-C(alk)(alk')-S-CH2, -CH2-CH(R,o)-S-CH2-,
-CH2-CH2-O-CH2-, -CHZ-CH2-N(R9)-CHZ- ou -CH2-CO-N(R9)-CH2-, R8 repré-
sente un radical hydroxy, R9 représente un atome d'hydrogène ou un radical
alkyle ou benzyle et R,o représente un radical alkyle, COOalk ou CONH2, alk
et alk' représentent un radical alkyle. Le produit obtenu est ensuite isolé et
transformé éventuellement en un sel pharmaceutiquement acceptable.
Cette réaction s'effectue généralement en présence de brome, de chlore, de
chloramide ou de chlorure cuivrique, au sein d'un solvant organique tel que
l'acide acétique, à une température comprise entre 15 C et la température
d'ébullition du milieu réactionnel. Comme thiocyanate de métal alcalin ou
sélénocyanate de métal alcalin, il est préférable d'utiliser le thiocyanate de
potassium ou le sélénocyanate de potassium.
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
4
Les dérivés de formule (II) sont nouveaux et en tant que tels font partie de
l'invention.
Les composés de formule (I) pour lesquels R2 représente un radical alkyle
peuvent être préparés par alkylation d'un composé de formule (I) correspon-
dant pour lequel R2 représente un atome d'hydrogène.
Cette alkylation s'effectue par toute méthode permettant d'alkyler une fonc-
tion imine. De préférence, on opère au moyen d'un dérivé Ra-X dans lequel
Ra représente un radical alkyle et X représente un groupe réactif tel qu'un
atome d'halogène (de préférence chlore, brome ou iode) ou un radical tosy-
loxy, au sein d'un solvant organique inerte tel qu'un alcool aliphatique (1-
6C)
(éthanol, propanol, butanol par exemple), une cétone (acétone, méthyléthyl-
cétone par exemple) ou le diméthylformamide, en présence d'une base telle
qu'un carbonate de métal alcalin (carbonate de potassium par exemple), à
une température comprise entre 20 C et la température d'ébullition du milieu
réactionnel.
Les composés de formule (I) pour lesquels R2 représente un atome d'hydro-
gène ou un radical alkyle, -R3-R4-R5-R6- représente une chaîne de formule
-CH2-CH2-CH(R8)-CH2- ou -CH2-CH2-CH2-CH(R8)- et R8 représente un radical
hydroxy peuvent également être obtenus par réduction d'un composé de
formule (I) correspondant pour lequel R2 représente un atome d'hydrogène
ou un radical alkyle et -R3-R4-R5-R6- représente une chaîne de formule
-CH2-CH2-CO-CH2- ou -CH2-CH2-CH2-CO-.
Cette réaction s'effectue par toute méthode permettant de passer d'une cé-
tone à un alcool. On opère généralement au moyen de borohydrure de so-
dium, au sein d'un alcool tel que le méthanol ou l'éthanol, à une température
comprise entre 0 et 25 C.
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
Les composés de formule (I) pour lesquels R2 représente un atome d'hydro-
gène ou un radical aikyle et -R3-R4-R5-Rs- représente une chaîne de formule
-CH2-CH2-CH2-SO-, -CH2-CH2-CH2-SO2-, -CH2-CH2-SO-CH2-,
-CH2-CH2-SO2-CH2-, -CH2-C(alk)(alk')-SO-CH2, -CH2-C(alk)(alk')-S02-CH2,
5 -CH2-CH(R,o)-SO-CH2- ou -CH2-CH(R,o)-S02-CH2- peuvent être préparés par
oxydation d'un composé de formule (I) correspondant pour lequel la chaîne
-R3-R4-R5-Rs- représente une chaîne de formule -CH2-CH2-CH2-S-,
-CH2-CH2-S-CH2-, -CH2-C(alk)(alk')-S-CH2 ou -CH2-CH(R,o)-S-CH2-.
Cette oxydation s'effectue selon les méthodes connues d'oxydation des déri-
vés soufrés comme celles décrites par M. HUDLICKY, Oxidations in Organic
Chemistry, ACS Monograph, 186, 252-263 (1990). Par exemple, on opère
par action d'un peracide organique ou un sel d'un tel acide (acide percar-
boxylique ou persulfonique, notamment l'acide perbenzoique, l'acide
3-chloroperbenzoîque, l'acide 4-nitroperbenzoique, l'acide peracétique,
l'acide pertrifluoracétique, l'acide performique, l'acide monoperphtalique) ou
les peracides minéraux ou un sel d'un tel acide (par exemple l'acide periodi-
que ou persulfurique), au sein d'un solvant inerte tel qu'un solvant chloré
(chloroforme, dichlorométhane par exemple), à une température comprise
entre 0 et 25 C. On peut utiliser également le peroxyde d'hydrogène ou un
périodate (périodate de sodium par exemple), au sein d'un solvant inerte tel
qu'un alcool aliphatique inférieur, l'eau ou un mélange de ces solvants, à une
température comprise entre 0 et 20 C. Il est également possible d'opérer au
moyen de tertiobutylhydroperoxyde en présence de tétraisopropylate de ti-
tane ou d'oxoneR (peroxymonosulfate de potassium) au sein d'un alcool ali-
phatique inférieur ou un mélange eau-alcool, à une température voisine de
25 C.
Les composés de formule (I) pour lesquels R2 représente un atome d'hydro-
gène ou un radical alkyle, -R3-R4-R5-R6- représente une chaîne de formule
-CH2-CH(Rlo)-S-CH2 dans laquelle R,o représente un radical -CH2OH
peuvent être préparés par réduction d'un composé de formule (1) correspon-
dant pour lequel R2 représente un atome d'hydrogène ou un radical alkyle,
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
6
-R3-R4-Rb-Re- représente une chaîne de formule -CH2-CH(R,o)-S-CH2 dans
laquelle R,o représente un radical -COOalk.
Cette réaction s'effectue par toute méthode connue permettant d'obtenir un
alcool à partir de l'ester correspondant. De préférence, on opère au moyen
d'hydroborure de sodium, au sein d'un alcool tel que l'éthanol, à la tempéra-
ture d'ébullition du milieu réactionnel.
Les composés de formule (I) pour lesquels R2 représente un atome d'hydro-
gène ou un radical alkyle, -R3-R4-R5-R6- représente une chaîne de formule
-CH2-CH(R,a)-S-CH2 dans laquelle R,o représente un radical -COOH peuvent
être préparés par hydrolyse d'un composé de formule (I) correspondant pour
lesquels R2 représente un atome d'hydrogène ou un radical alkyle,
-R3-R4-R5-Rs- représente une chaîne de formule -CH2-CH(R,o)-S-CH2 dans
laquelle R,o représente un radical -COOalk.
Cette réaction s'effectue par toute méthode permettant de passer d'un ester
à l'acide correspondant. Généralement on opère au moyen d'un hydroxyde
de métal alcalin (soude par exemple), au sein d'un solvant inerte tel qu'un
alcool (méthanol, éthanol par exemple), à une température comprise entre
15 C et la température d'ébullition du milieu réactionnel.
Les dérivés de formule (II) pour lesquels la chaîne -R3-R4-R5-R6- représente
une chaîne de formule -CH2-CH2-CH2-CH2- et R7 représente un radical
polyfluoroalkyle ou polyfluoroalcoxy peuvent être obtenus par action de 1,4-
dihalogénobutane sur le lithien d'une 4-polyfluoroalkylaniline ou
4-polyfluoroalcoxyaniline dont la fonction amine est protégée, suivie de la
déprotection du NH.
Cette réaction s'effectue généralement au sein du tétrahydrofuranne, à une
température de -78 C. Il est préférable de protéger la fonction amine sous
forme d'un carbamate de tert-butyle; dans ce cas, la déprotection s'effectue
au moyen d'acide trifluoroacétique, au sein d'un solvant organique inerte tel
qu'un solvant chloré (chloroforme, dichlorométhane par exemple), à une
température voisine de 20 C. De préférence, on utilise le 1-chloro-4-iodobu-
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
7
tane. Le lithien est obtenu par action de tert-butyllithium dans le pentane
sur
une 4-polyfluoroalkylaniline ou 4-polyfluoroalcoxyaniline dont la fonction
amine est protégée, au sein du tétrahydrofuranne, à une température de
-78 C.
Les 4-polyfluoroalkylaniline et 4-polyfluoroalcoxyaniline sont commerciali-
sées ou peuvent être obtenues par application ou adaptation des méthodes
décrites dans J. Org. Chem., 29, 1 (1964), et dans les brevets US 3920444,
US 2436100, DE 2606982, EP 205821 et EP546391.
Les dérivés de formule (II) pour lesquels -R3-R4-R5-R6- représente une
chaîne de formule -CH2-CH2-CH2-S-, -CH2-CH2-CH2-Se-, -CH2-CH2-CH2-O-,
-CH2-CH2-CH2-N(Rg)-, -CH2-CH2-S-CH2-, -CH2-C(alk)(alk')-S-CH2,
-CH2-CH(R,o)-S-CH2- dans laquelle R,o représente un radical alkyle,
-CH2-CH2-Se-CH2-, -CH2-CH2-O-CH2-, -CH2-CH2-N(R9)-CH2- peuvent être
obtenus par réduction d'un dérivé de formule :
H
~ (III)
R4
R7 R6 R5
dans laquelle R7 a les mêmes significations que dans la formule (I) et
-R4-R5-R6- représente une chaîne de formule -CH2-CH2-S-, -CHZ-CH2-Se-,
-CH2-CH2-O-, -CH2-CH2-N(R9)-, -CH2-S-CH2-, -C(alk)(alk')-S-CH2,
-CH(R,o)-S-CH2- dans laquelle R,o représente un radical alkyle,
-CH2-Se-CH2-, -CH2-O-CH2-, -CH2-N(R9)-CH2- dans laquelle R9 a les mêmes
significations que dans la formule (1).
Cette réaction s'effectue généralement au moyen d'un agent réducteur tel
que le tétrahydroaluminate de lithium, au sein d'un solvant organique inerte
tei que le tétrahydrofuranne, à une température voisine de 20 C ou le com-
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98101638
8
plexe borane-diméthylsuifure, au sein d'un solvant inerte tel que le toluène,
à
la température d'ébullition du milieu réactionnel.
Les dérivés de formule (Iil) pour lesquels la chaîne -R4-R5-RB- représente
une chaîne de formule -CH2-S-CH2-, -C(alk)(alk')-S-CH2, -CH(R,o)-S-CH2-
dans laquelle R,o représente un radical alkyle ou -CH2-Se-CH2- peuvent être
obtenus par cyclisation d'un dérivé de forrnule :
H2
~ (IV)
R7 CH2 Rb-CRcRd-COORe
dans laquelle la fonction amino est éventuellement protégée et soit Rb re-
présente un atome de soufre, Rc, Rd et Re représentent chacun un atome
d'hydrogène ou un radical aikyle, et R7 a les mêmes significations que dans
la formule (I), soit Rb représente un atome de sélénium, Rc et Rd
représentent chacun un atome d'hydrogène et Re représente un radical
alkyle.
De préférence, la fonction amino est protégée sous forme de carbamate de
tert-butyle. Lorsque Re représente un radical alkyle, lacyclisation s'effec-
tuegénéralement au moyen d'acide trifluoroacétique, au sein d'un solvant
organique inerte tel qu'un solvant chloré (chloroforme, dichlorométhane par
exemple), à une température voisine de 20 C ou bien au moyen d'acide pa-
ratoluènesulfonique, au sein du toluène, à la température d'ébullition du mi-
lieu réactionnel. Lorsque Re représente un atome d'hydrogène, la cyclisation
s'effectue, de préférence, au sein du xylène, par chauffage à la température
d'ébullition du milieu réactionnel.
Les dérivés de formule (IV) pour lesquels Re représente un radical alkyle
peuvent être obtenus par action de soufre ou de sélénium puis d'un dérivé
Hal-CRcRd-COOalk pour lequel Hal représente un atome d'halogène, Rc et
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
9
Rd ont les mêmes significations que précédemment sur le lithien d'une 2-
méthyl-4-polyfluoroalkylaniline ou 2-méthyl-4-polyfluoroalcoxyaniline dont la
fonction amino est protégée, de préférence sous forme de carbamate de tert-
butyle, au sein du tétrahydrofuranne, à une température variant d'environ
-70 C à voisine de 20 C. Le lithien de la 2-méthyl-4-polyfluoroalkylaniline ou
2-méthyl-4-polyfluoroalcoxyaniline dont la fonction amino est protégée peut
être obtenu par action de tert-butyllithium sur une 2-méthyl-
4-polyfluoroalkylaniline ou 2-méthyl-4-polyfluoroalcoxyaniline dont la
fonction
amino est protégée, au sein du tétrahydrofuranne, à une température d'envi-
ron -70 C. Les dérivés de formule (IV) pour lesquels Re représente un atome
d'hydrogène peuvent être obtenus par hydrolyse d'un dérivé de formule (IV)
correspondant pour lequel Re représente un radical alkyle. Cette hydrolyse
s'effectue généralement au moyen de soude, au sein de l'éthanol, à une
température comprise entre 15 C et la tempéraure d'ébullition du milieu
réactionnel.
Les 2-méthyl-4-polyfluoroalkyianiline ou 2-méthyl-4-polyfluoroalcoxyaniline
dont la fonction amino est protégée peuvent être obtenues par action d'io-
dométhane sur le lithien d'une 4-polyfluoroalkylaniline ou
4-polyfluoroalcoxyaniline dont la fonction amino est protégée au sein du té-
trahydrofuranne, à une température variant d'environ -70 C à environ 20 C.
Les dérivés de formule (III) pour lesquels la chaîne -R4-R5-R6- représente
une chaîne de formule -CH2-N(R9)-CH2- et les dérivés de formule (I1) pour
lesquels -R3-R4-R5-R6- représente une chaîne -CH2-CO-N(R9)-CH2- peuvent
être obtenus par action de chlorure de chloracétyle sur une aniline de for-
muie :
H2
I M
R~ CH2NHR9
-----r------ __ _.
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
dans laquelle R, et R9 ont les mêmes significations que dans la formule (I),
et
séparation des 2 dérivés.
Cette réaction s'effectue généralement au sein d'un solvant organique inerte
tel qu'un éther (éther diéthylique par exemple), en présence d'hydrogénocar-
5 bonate de sodium, à une température voisine de 20 C.
Les anilines de formule (V) sont obtenues selon le schéma réactionnel sui-
vant :
BOC
NHBOC bummum / NHBOC a NH
R7 COz R' ~ COZH o~i, am~a~c CONHRa
/ CFCOOH
\ I NH2 eoaaur~rws \ NH2 iii
ciefflim
R CHzNHRe R7 CONHRy
7
Dans ces formules, R7 et R9 ont les mêmes significations que dans la formule
10 (I) et BOC représente le radical tert-butoxycarbonyle. Les conditions opéra-
toires sont définies plus en détail dans l'exemple 8.
Les dérivés de formule (III) pour lesquels la chaîne -R4-R5-R6- représente
une chaîne -CH2-O-CHr peuvent être obtenus par application ou adaptation
de la méthode décrite par E. TESTA et L. FONTANELLA, Il Farmaco, 1965,
20, 323-335 selon le schéma réactionnel suivant :
NHZ NaBH4 / NH2
/ I
~ CISiMei \
R \ C02H THF R7 CHZOH
'
i CICOCH2CI
triéthylamine
CH2CI2
H
N t-BuOK NHCOCHCI
tétra~ rofurame 2
R' 5 C R7 H2OH
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
11
Dans ces formules R7 a les mêmes significations que dans la formule (I), Me
représente un radical méthyle et Bu représente un radical butyle.
Les dérivés de formule (IIf) pour lesquels la chaîne -R4-R5-Re- représente
une chaîne de formule -CH2-CH2-S-, -CH2-CH2-Se-, -CH2-CH2-O-,
-CH2-CH2-N(R9)- peuvent être obtenus à partir d'un dérivé de formule :
H2
(VI)
R71 f
dans laquelle Rf représente un radical OH, SH, SeH ou NH(R9), R7 et R9 ont
les mêmes significations que dans la formule (I), par application ou adapta-
tion des méthodes décrites dans les exemples et par X. HUANG, Synthesis,
851-852 (1984), W.C. LUMMA et col[., J. Med. Chem., 24, 93-101 (1981) et
E.J. JACOBSEN et coll., J. Med. Chem., 39, 158-175 (1996).
Les dérivés de formule (VI) peuvent être obtenus par application ou adapta-
tion des méthodes décrites par R. BELCHER et coll., J. Chem. Soc., 3846
(1954); B.L. MYLARY, J. Med. Chem., 34, 108-122 (1991); D.W. COMBS et
coll., J. Med. Chem., 35, 172-176 (1992), W.C. LUMMA et coll., J. Med.
Chem., 24, 93-101 (1981) et A.V. ZEIGER et coll., J. Org. Chem., 42 (3), 542
(1977).
Les dérivés de formule (II) pour lesquels -R3-R4-R5-R6- représente un radical
-CH2-CH2-CH2-CO- peuvent être obtenus par décarboxylation puis déprotec-
tion d'un dérivé de formule :
Rg
N
R (VII)
0 CO2Et
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
12
dans laquelle R7 a les mêmes significations que dans la formule (I), Rg re-
présente un radical p-toluènesulfonyle et Et représente un radical éthyle.
Cette réaction s'effectue généralement au moyen d'acide chlorhydrique au
sein de l'acide acétique, à Ia température d'ébullition du milieu réactionnel.
La déprotection s'effectue généralement au moyen de tournures de magné-
sium, au sein d'un mélange tétrahydrofuranne et méthanol, à une tempéra-
ture voisine de 20 C.
Les dérivés de formule (VII) peuvent être obtenus selon le schéma réaction-
nel suivant :
~02tBu ÇO2tBu
~ NH CF3COOH INH (T..NH2
--
R terttutyrahium R COOEt R7 COOEt
7 Rg 7 /
/1CH3C6H4SO3H
1
i/ N Br-CHZ CH2-CH2 C02C2H5 I\ NHRg
R7 \ C02Et R7 / COOEt
COZEt
tert-butylate de potassium R9
1
i N
R7
0 CO2Et
Dans ces formules, R7 a les mêmes significations que dans la formule (I), Rg
représente un radical p-toluènesulfonyle, Et représente un radical éthyle et
tBu un radical tert-butyle. Les conditions opératoires sont définies plus en
détail dans I' exemple 1.
*rB
-.---~
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
13
Les dérivés de formule (II) pour lesquels -R3-R4-R5-Rg- représente un radical
-CH2-CH2-CH2-CH(R8)- ou -CH2-CH2-CH(R8)-CH2- et R8 représente un radical
hydroxy peuvent être obtenus par réduction d'un dérivé de formule (II) cor-
respondant pour lequel R2 représente un atome d'hydrogène ou un radical
alkyle et -R3-R4-R5-R6- représente une chaîne de formule -CH2-CH2-CO-CHr
ou -CH2-CH2-CH2-CO-.
Cette réaction s'effectue par toute méthode permettant de passer d'une cé-
tone à un alcool. On opère généralement au moyen de borohydrure de so-
dium, au sein d'un alcool tel que le méthanol ou l'éthanol, à une température
comprise entre 0 et 25 C.
Les dérivés de formule (II) pour lesquels -R3-R4-R5-Rg- représente un radical
-CH2-CH2-CO-CH2- peuvent être obtenus par décarboxylation-déprotection
d'un dérivé de formule :
i COOtBu
N
(VIII)
R7
EtOOC O
dans laquelle R7 a!es mêmes significations que dans la formule (I), tBu re-
présente un radical tert-butyle et Et représente un radical éthyle.
Cette réaction s'effectue généralement au moyen d'acide chlorhydrique au
sein de l'acide acétique, à la température d'ébullition du milieu réactionnel.
Les dérivés de formule (VIII) peuvent être obtenus selon le schéma réaction-
nel suivant :
-,------ _ _ -- --
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
14
CO2tBu
NH tertbutyllithium/Cul/THF (#NH-COOtBu
BrCH2COOEt COOEt
R R~
7
COOtBu Br-CH2-CH2-COZC2H6 eII~ HNa/DMF
N\R7 ~ (CH2)2-COOC2H5
COOEt
tert-butylate de potassiu ?OOtBU
Toluène/reflux N
R7
EtOOC O
Dans ces formules, R7 a les mêmes significations que dans la formule (I), Et
représente un radical éthyle et tBu un radical tert-butyle.
Les dérivés de formule (II) pour lesquels -R3-R4-R5-R6- représente un radical
-CH2-CH(R,a)-S-CH2- pour lequel R,o représente un radical -CONH2 peuvent
être obtenus par action d'ammoniac sur un dérivé de formule (II) correspon-
dant pour lequel -R3-R4-R5-R6- représente un radical -CH2-CH(R,o)-S-CH2-
pour lequel R,o représente un radical COOalk.
Cette réaction s'effectue généralement au sein d'un solvant inerte tel qu'un
alcool (éthanol par exemple), à une température voisine de 20 C.
Les dérivés de formule (II) pour lesquels -R3-R4-R5-Rg- représente un radical
-CH2-CH(R,o)-S-CH2- pour lequel R,o représente un radical -COOalk peuvent
être obtenus par réduction d'un dérivé de formule :
---T-------
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
H
N
C02alk (IX)
)
ccs
R7
dans laquelle R7 a les mêmes significations que dans la formule (I).
Cette réaction s'effectue de préférence au moyen de magnésium, au sein
d'un solvant inerte tel qu'un alcool aliphatique (1-6C) (méthanol par exem-
5 ple), à une température de 40 C.
Les dérivés de formule (IX) peuvent être obtenus selon le schéma réaction-
nel suivant :
MeZN NMe2 NHBOC
NHBOC tBu \
I /
SvCOOalk ' COOaIk
R~ dlméthoxyéthane S
reflux Me2N
acide trifluoroacétique / CHZCIZ
H 20 C
N
COaIk
OS,
R~
dans ces formules R7 a les mêmes significations que dans la formule (I), alk
10 représente un radical alkyle, BOC représente un radical tert-butoxycarbo-
nyle.
Il est entendu pour l'homme de métier que, pour la mise en oeuvre des pro-
cédés selon l'invention décrits précédemment, il peut être nécessaire d'intro-
duire des groupes protecteurs des fonctions amino afin d'éviter des réactions
15 secondaires. Notamment, on opère selon les méthodes décrites par T.W.
Greene, Protective Groups in Organic Synthesis, A. Wiley Interscience Pu-
blication (1981), ou par Mc Omie, Protective Groups in Organic Chemistry,
Plenum Press (1973). Les fonctions amino peuvent par exemple être proté-
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
16
gées par des radicaux méthoxycarbonyle, éthoxycarbonyle,
t.butoxycarbonyle, allyloxycarbonyle, vinyloxycarbonyle, trichloréthoxycarbo-
nyle, trichloracétyle, trifluoracétyle, chloracétyle, trityle, benzhydryle,
ben-
zyle, allyle, formyle, acétyle, benzyloxycarbonyle ou ses dérivés substitués
ou sous forme de carbamates de tert-butyle ou de méthyle puis régénérées
au moyen d'acide trifluoroacétique ou d'acide chlorhydrique dans le tétrahy-
drofuranne ou de carbamates de benzyle puis régénérées par hydrogénation
après avoir mis en oeuvre le procédé selon l'invention.
Les mélanges réactionnels obtenus par les divers procédés décrits précé-
demment sont traités suivant des méthodes classiques physiques
(évaporation, extraction, distillation, chromatographie, cristallisation par
exemple) ou chimiques (formation de sels par exemple).
Les énantiomères des composés de formule (I) contenant au moins un site
asymétrique peuvent être obtenus par synthèse à partir des précurseurs chi-
raux ou par dédoublement des racémiques par exemple par chromatographie
sur phase stationnaire chirale type (S,S) WHELCK-01 , Chiralcel OJ ou
colonne chirale selon W. H. PIRKLE et coil., asymetric synthesis, vol 1,
Academic Press (1983).
Les composés de formule (I) sous forme de base libre peuvent être éventuel-
lement transformés en sels d'addition avec un acide minéral ou organique,
par action d'un tel acide au sein d'un solvant organique tel qu'un alcool, une
cétone, un éther ou un solvant chloré.
Comme exemples de sels pharmaceutiquement acceptables, peuvent être
cités les sels d'addition avec les acides minéraux ou organiques tels que
acétate, propionate, succinate, benzoate, fumarate, maléate, oxalate, mé-
thanesulfonate, iséthionate, théophyllinacétate, saiicylate, méthylène-bis-(3-
oxynaphtoate, chlorhydrate, sulfate, nitrate et phosphate.
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
17
Les composés de formule (I) présentent des propriétés pharmacologiques
intéressantes. Ces composés sont des anticonvulsivants et interfèrent avec
la transmission glutamatergique et sont donc utiles pour traiter ou prévenir
toutes les ischémies (telles l'ischémie focale ou globale) consécutives à des
accidents vasculaires cérébraux tels que le stroke thromboembolique et hé-
morragique, un arrêt cardiaque, une hypotension artérielle, une intervention
chirurgicale cardiaque, vasculaire ou pulmonaire ou une hypoglycémie sé-
vére. Ils sont également utiles dans le traitement des effets dus à une
anoxie,
qu'elle soit périnatale ou consécutive à une noyade, une haute pression ou à
des lésions cérébro-spinales. Ces composés peuvent également être utilisés
pour traiter ou prévenir l'évolution de maladies neurodégénératives, de la
chorée d'HUNTINGTON, de la maladie d'ALZHEIMER et autres démences,
de la sclérose latérale amyotrophique ou d'autres maladies du motoneurone,
de l'atrophie olivo-pontocérébelleuse et de la maladie de PARKINSON. Ces
composés peuvent aussi être utilisés vis-à-vis des manifestations épilepto-
gènes (épilepsie) et/ou convulsives, pour le traitement des traumatismes cé-
rébraux ou spinaux, des traumatismes liés à la dégénérescence de l'oreille
interne (R. PUJOL et coil., Neuroreport, 3, 299-302 (1992) ou de la rétine
(J.L. MONSINGER et coll., Exp. Neurol., 113, 10-17 (1991), du tinnitus, de
l'anxiété (KEHNE et coli., Eur. J. Pharmacol., 193, 283 (1991)), de la dé-
pression (TRULLAS et coll.,Eur. J. Pharmacol., 185, 1(1990)), de la schizo-
phrénie (REYNOLDS, TIPS, 13, 116 (1992)), du syndrome de TOURETTE,
des encéphalopathies hépatiques, des troubles du sommeil, des désordres
du déficit attentionnel, des troubles des conditions hormonales (excès de la
sécrétion de HG ou HL, sécrétion de corticostérone), en tant qu'anaigésiques
(DICKENSON et coll., Neurosc. Letters, 121, 263 (1991)), antiinflammatoires
(SLUTA et coll., Neurosci. Letters, 149, 99-102 (1993)) antianorexiques
(SORRELS et coll., Brain Res., 572, 265 (1992)), antimigraineux, antiéméti-
ques et pour traiter les empoisonnements par des neurotoxines ou d'autres
substances agonistes du récepteur NMDA ou AMPA, ainsi que les troubles
neurologiques associés aux maladies virales telles que les méningites et en-
céphalites virales, le SIDA (LIPTON et coll., Neuron, 7, 111 (1991)), la rage,
la rougeole et le tétanos (BAGETTA et coll., Br. J. Pharmacol., 101, 776
(1990)). Ces composés sont aussi utiles pour la prévention, la tolérance et la
dépendance des symptômes d'abstinence aux drogues, à l'alcool et de l'in-
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
18
hibition de l'accoutumance et de la dépendance aux opiacés, barbituriques,
amphétamine et benzodiazépines. Ils peuvent également être utilisés dans le
traitement des déficits liés à des anomalies mitochondriales telles que la
myopathie mitochondriale, le syndrome de LEBER, l'encéphalopathie de
WERNICKE, le syndrome de RETT, l'homocystéinémie, l'hyperprolinémie,
l'hydroxybutirique-aminoacidurie, l'encéphalopathie saturnine (intoxication
chronique au plomb) et la déficience en sulfite oxydase.
L'activité de ces produits comme anticonvulsivant a été déterminée chez la
souris selon la méthode de l'électrochoc maximal. Des souris blanches CD1
sont traitées intraveineusement avec les composés à tester en milieu salin,
10 minutes avant d'être soumis à un choc électrique (75mA; durée 0,04 se-
conde) au moyen d'électrodes occulaires. Normalement ce choc produit une
convulsion tonique chez la souris non traitée, caractérisée par une extension
des membres. Si la convulsion tonique ne survient pas, l'animal est considéré
protégé. Dans ce test, les composés de formule (I) présentent une DE50
égale ou inférieure à 4 mg/kg.
L'activité de ces produits comme antiglutamate a été déterminée sur les con-
vulsions induites par le glutamate selon une technique inspirée de celle de I.
P. LAPIN, J. Neural. Transmission, 54, 229-238 (1982); l'injection du gluta-
mate par voie intracérébroventriculaire étant effectuée selon une technique
inspirée de celle de R. CHERMAT et P. SIMON, J. Pharmacol. (Paris), 6,
489-492 (1975). Leur DE50 est inférieure à 10 mg/kg.
Les composés de formule (I) présentent une toxicité faible. Leur DL50 est
supérieure à 15 mg/kg par voie IV chez la souris.
Pour l'emploi médicinal, il peut être fait usage des composés de formule (I)
tels quels ou à l'état de sels pharmaceutiquement acceptables, c'est-à-dire
non toxiques aux doses d'utilisation.
Sont particulièrement intéressants, les composés de formule (I) pour lesquels
R7 représente un radical trifluorométhoxy ou trifluorométhyle.
Les composés de formule (I) préférés sont ceux pour lesquels R, représente
un atome de soufre, R2 représente un atome d'hydrogène, -R3-R4-R5-R6-
CA 02298974 2007-06-21
19
représente une chaîne de formule -CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CO-,
-CH2-CH2-CH2-CH(R8)-, -CH2-CH2-CH2-Se-, -CH2-CH2-Se-CH2-,
-CH2-CH2-CH2-S-, -CH2-CH2-CH2-SO-, -CH2-CH2-CH2-SO2-,
-CH2-CH2-CH2-0-, -CH2-CH2-CH2-N(Rg)-, -CH2-CH2-CO-CH2-,
-CH2-CH2-CH(R8)-CH2-, -CH2-CH2-S-CH2-, -CH2-CH2-SO-CH2-,
-CH2-CH2-SO2-CH2-, -CH2-C(alk)(alk')-S-CH2, -CH2-C(alk)(alk')-SO-CH2,
-CH2-C(alk)(alk')-S02-CH2, -CH2-CH(R10)-S-CH2-, -CH2-CH(R10)-SO-CH2-,
-CH~-GH(~2~n1-SO~-CH~- -CH~-r_.H~-O-CH~- -CH~-Ç=H~-N(Rgl-CH2- OLI
~ =tvi ~ c+ ~ L ~+ L L i
-CH2-CO-N(Rg)-CH2-, R7 représente un radical trifluorométhyle ou
trifluorométhoxy, R8 représente un radical hydroxy, Rg représente un atome
d'hydrogène ou un radical alkyle ou benzyle, R10 représente un radical alkyle,
-CH2OH, -COOalk, -COOH ou -CONH2, alk représente un radical alkyle et alk'
représente un radical alkyle, leurs isomères, racémiques, énantiomères et
leurs
sels.
Plus spécialement intéressants sont les composés de formule (I) suivants :
- 2-imino-9-trifluorométhoxy-4,5,6,7-tétrahydro-2H-thiazolo[5,4,3-jk][1]benza-
zépine-7-ol,
- 2-imino-9-trifluorométhoxy-4,5,6-7-tétrahydro-2H-thiazolo[5,4,3-jk][1]benza-
zépine,
- 2-imino-9-trifluorométhyl-4,5,6,7-tétrahydro-2H-thiazolo[5,4,3-jk][1]benza-
zépine,
- 7,7-dioxyde de 2-imino-9-trifluorométhoxy-5,6-dihydro-2H,4H-thiazoio-
[3,4,5-ef][1,5]benzothiazépine,
- 7-oxyde de 2-imino-9-trifluorométhoxy-5,6-dihydro-2H,4H-thiazolo-[3,4,5-
ef][1,5]benzothiazépine,
- 2-imino-9-trifluorométhoxy-5,6-dihydro-2H,4H-thiazolo[3,4,5-ef][1,5]benzo-
thiazépine,
CA 02298974 2007-06-21
19a
6-benzyl-2-imino-9-trifluorométhoxy-6,7-d ihydro-4H-thiazolo[3,4,5-kj][1,4]
benzodiazépine-5-one,
- 6-benzyl-2-imino-9-trifluorométhoxy-4,5,6,7-tétrahydro-2H-thiazolo[3,4,5-
kj][1,4]benzodiazépine,
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
- 2-imino-9-trifluorométhoxy-4,5-dihydro-2H,7H-thiazolo[3,4,5-de][4,1 ]benzo-
thiazépine,
- 2-imino-9-trifluorométhyl-4,5-dihydro-2H,7H-thiazolo[3,4,5-de][4,1]benzo-
thiazépine,
5 - 6,6-dioxyde de 2-imino-9-trifluorométhyl-4,5-dihydro-2H,7H-thiazolo[3,4,5-
de][4,1 ]benzothiazépine,
- 7-oxyde de 2-imino-9-trifluorométhyl-5,6-dihydro-2H,4H-thiazolo[3,4,5-
efl[1,5]benzothiazépine,
- 6,6-dioxyde de 2-imino-9-trifluorométhyl-5,6-dihydro-2H,4H-thiazolo[3,4,5-
10 ef][1,5]benzothiazépine,
- 2-imino-9-trifluorométhyl-5,6-dihydro-2H,4H-thiazolo[3,4,5-ef][1,5]benzo-
thiazépine,
- 2-imino-9-trifluorométhyl-4,5,6,7-tétrahydro-2H-thiazolo[5,4,3-jk][1 ]benza-
zépine-7-ol,- 6,6-dioxyde de 2-imino-9-trifluorométhoxy-4,5-dihydro-2H,7H-
15 th iazolo[3,4,5-de][4,1 ]benzothiazépine,
- 6-oxyde de 2-imino-9-trifluorométhoxy-4,5-dihydro-2H,7H-thiazolo[3,4,5-
de][4,1 ]benzothiazépine,
- 6-benzyl-2-imino-9-trifluorométhyl-6,7-dihydro-4H-thiazolo[3,4,5-kj][1,4]
benzodiazépine-5-one,
20 - 6-benzyl-2-imino-9-trifluorométhyl-4,5,6,7-tétrahydro-2H-thiazolo[3,4,5-
kj][1,4]benzodiazépine,
- 2-imino-5-méthyl-9-trifluorométhyl-4,5-dihydro-2H,7H-thiazolo[3,4,5-de][4,1]
benzothiazépine,
- 5-carbamoyl-2-imino-9-trifluorométhyl-4,5-dihydro-2H,7H-thiazolo[3,4,5-de]
[4,1 ]benzothiazépine,
- 5,5-diméthyl-2-imino-9-trifluorométhyl-2H,4H,7H-thiazolo[3,4,5-de][4,1]ben-
zothiazépine,
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
21
- 5-hydroxyméthyl-2-imino-9-trifluorométhyl-4,5-dihydro-2H,7H-thiazolo[3,4,5-
de][4,1lbenzothiazépine,leurs isomères, racémiques, énantiomères et leurs
sels.
Encore plus particulièrement préférés sont les composés suivants :
- (R,S)-6-oxyde de 2-imino-9-trifluorométhyl-4,5-dihydro-2H,7H-
th iazolo[3,4,5-de][4,1 ]benzoth iazépine,
- (+)-6-oxyde de 2-imino-9-trifluorométhyl-4,5-dihydro-2H,7H-thiazolo[3,4,5-
de][4,1 ]benzoth iazépine,
- (-)-6-oxyde de 2-imino-9-trifluorométhyl-4,5-dihydro-2H,7H-thiazolo[3,4,5-
de][4,1lbenzothiazépine,
- (R,S)-2-imino-5-méthyl-9-trifluorométhyl-4,5-dihydro-2H,7H-thiazolo[3,4,5-
de][4,1 ]benzothiazépine,
- (+)-2-imino-5-méthyl-9-trifluorométhyl-4,5-dihydro-2H,7H-thiazolo[3,4,5-
de][4,1 ]benzothiazépine,
- (-)-2-imino-5-méthyl-9-trifluorométhyl-4,5-dihydro-2H,7H-thiazolo[3,4,5-
de][4,1 ]benzothiazépine
et leurs sels.
Les exemples suivants illustrent l'invention sans la limiter.
EXEMPLE 1
On ajoute goutte à goutte en 10 minutes, à une température voisine de 20 C,
1,2 g de brome dilué dans 10 ml d'acide acétique à une solution de 1,7 g de
thiocyanate de potassium et de 1,9 g de (R,S)-7-trifluorométhoxy-2,3,4,5-
tétrahydro-1 H-[llbenzazépine-5-ol dans 30 ml d'acide acétique. Le mélange
réactionnel est agité pendant 20 heures à la même température, versé sur de
la glace, alcalinisé par une solution d'ammoniaque à 20% et extrait par trois
fois 100 mi d'acétate d'éthyle. Les phases organiques sont réunies, lavées
par 100 ml d'eau distillée, séchées sur sulfate de magnésium et concentrées
à sec sous pression réduite (2 kPa) à 40 C. Le résidu (0,4 g) est chromato-
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
22
graphié sur gel de silice en éluant avec de l'acétate d'éthyle. Le produit
isolé
est repris dans un mélange de 4 ml d'éther isopropylique et d'éther de pé-
trole (50-50 en volumes) et on obtient ainsi 0,15 g de (R,S)-2-imino-9-trifluo-
rométhoxy-4,5,6,7-tétrahydro-2H-thiazolo[5,4,3-jk][1 ]benzazépine-7-ol sous
forme d'un solide crème fondant à 167 C [Analyse C12H11 F3N202S, % cal-
culé C : 47,37, H : 3,64, F: 18,73, N : 9,21, O: 10,52, S : 10,54, % trouvé
C: 47,6, H : 3,5, F: 18,4, N : 9,1, S: 10,6].
Le (R,S)-7-trifluorométhoxy-2,3,4,5-tétrahydro-1 H-[1 ]benzazépine-5-ol peut
être préparé de la manière suivante : 1,08 g de tournures de magnésium est
ajouté à une température voisine de 20 C à une solution de 3,6 g de (R,S)-1-
(toluène-4-sulfonyl)-7-trifluorométhoxy-2,3,4,5-tétrahydro-1 H-[1 ]benzazépine-
5-ol dans 30 ml de tétrahydrofuranne et 40 ml de méthanol. Le mélange
réactionnel est agité pendant 24 heures à la même température versé dans
de l'eau distillée et la masse gélatineuse formée, reprise par l'éther
éthylique,
est filtrée puis lavée à trois reprises par 40 ml d'éther éthylique. Le
filtrat
jaune pâle ainsi obtenu est séché sur sulfate de magnésium, puis évaporé
sous pression réduite à 50 C. On obtient ainsi 1,9 g de (R,S)-7-trifluoromé-
thoxy-2,3,4,5-tétrahydro-lH-[1]benzazépine-5-ol sous la forme d'un solide
crème fondant à 110 C.
Le (R,S)-1-(toluène-4-sulfonyl)-7-trifluorométhoxy-2,3,4,5-tétrahydro-1 H-
[1]benzazépine-5-ol peut être préparé de la manière suivante : à une solution
de 3,7 g de 1-(toluène-4-sulfonyl)-7-trifluorométhoxy-2,3-dihydro-1 H,4H-
[1]benzazépine-5-one dans 40 ml d'éthanol on ajoute par petites portions
0,7 g de borohydrure de sodium et laisse sous agitation pendant 2 heures à
une température voisine de 20 C. Après traitement habituel on obtient 3 g de
(R,S)-1-(toluène-4-sulfonyl)-7-trifluorométhoxy-2,3,4,5-tétrahydro-1 H-[1 jben-
zazépine-5-ol sous forme d'un solide beige fondant à 160 C. _ __------------_.-
_~ __._
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
23
La 1-(toluène-4-sulfonyi)-7-trifluorométhoxy-2,3-dihydro-1 H,4H-[1 ]benzazé-
pine-5-one peut être préparée de la manière suivante : à une solution de
2,2 g de 5-oxo-1-(toluène-4-sulfonyl)-7-trifluorométhoxy-2,3,4,5-tétrahydro-
1 H-[1]benzazépine-4-carboxylate d'éthyle dans 20 mi d'acide acétique on
ajoute 5 ml d'acide chlorhydrique. On observe la formation d'un précipité
blanc et le mélange réactionnel est maintenu 4 heures à reflux. On concentre
à sec sous pression réduite, reprend l'huile jaune obtenue par 300 ml d'éther
éthylique et lave par une solution saturée d'hydrogénocarbonate de sodium.
Après décantation, lavage à deux reprises par 50 ml d'eau distillée et par
une solution saturée de chlorure de sodium, la phase organique est séchée
sur du sulfate de magnésium, filtrée et concentrée à sec sous pression ré-
duite (2,2 kPa) à 60 C. On obtient ainsi 1,58 g de 1-(toluène-4-suifonyl)-7-
trifluorométhoxy-2,3-dihydro-1 H,4H-[1]benzazépine-5-one sous forme d'un
solide beige fondant à 96 C.
Le 5-oxo-1-(toluène-4-sulfonyl)-7-trifluorométhoxy-2,3,4,5-tétrahydro-1 H-
[1 ]benzazépine-4-carboxylate d'éthyle peut être préparé de la manière sui-
vante : à 275 ml de toluène anhydre porté à reflux on ajoute, sous atmo-
sphère d'argon, 9,97 g de tert-butylate de potassium, puis on introduit,
goutte
à goutte, une solution de 23 g de 2-[(3-éthoxycarbonylpropyl)-(toluène-4-
sulfonyl)amino]-5-trifluorométhoxybenzoate d'éthyle dans 300 ml de toluène
anhydre. L'addition terminée on poursuit le chauffage pendant une heure.
Après refroidissement on ajoute 90 ml d'une solution 1 N d'acide chlorhy-
drique, reprend à l'eau distillée et après décantation lave la phase organique
par une solution saturée de chlorure de sodium, sèche sur sulfate de ma-
gnésium, filtre et concentre à sec sous pression réduite (2,2 kPa) à 60 C. Le
résidu obtenu est dissous dans 100 ml de cyclohexane bouillant et après re-
froidissement le précipité apparu est séparé par filtration et séché à 40 C
sous pression réduite (70 Pa). On obtient ainsi 10,75 g de 5-oxo-1-(tofuène-
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
24
4-sulfonyl)-7-trifluorométhoxy-2,3,4,5-tétrahydro-1 H-[1 ]benzazépine-4-car-
boxylate d'éthyle sous forme d'une poudre beige fondant à 97 C.
Le 2-[(3-éthoxycarbonylpropyl)-(toluène-4-sulfonyl)amino]-5-trifluoromé-
thoxybenzoate d'éthyle peut être préparé de la manière suivante : on chauffe
à 80 C, pendant 17 heures, un mélange de 5,5 g de 2-(toluène-4-sulfo-
nyl)amino-5-trifluorométhoxybenzoate d'éthyle, 5,6 g de carbonate de potas-
sium, 3,18 g de 4-bromobutyrate d'éthyle dans 30 mi de dimethylformamide.
On concentre à sec sous pression réduite (2,2 kPa) à 60 C. L'huile brune
obtenue est dissoute dans de l'acétate d'éthyle et la solution est lavée par
de
l'eau distillée puis par une solution saturée de chlorure de sodium, séchée
sur sulfate de magnésium et ensuite concentrée à sec sous pression réduite
(2,2 kPa) à 50 C. On obtient ainsi 5,7 g de 2-[(3-éthoxycarbonylpropyl)-
(toiuène-4-sulfonyl)amino]-5-trifluorométhoxybenzoate d'éthyle sous forme
d'une huile jaune [RMN Spectre 1 H dans DMSO-d6, T_300K, S en ppm
(300 Mhz) : 1,10 (3H, t, J=6Hz, CH3), 1,30 (3H, t, J=6Hz. CH3), 1,65 (2H, m,
CH2), 2,40 (5H, m, COCH2 et PhCH3), 3,45 et 3,70 (1 H chacun, m, NCH2),
4,00 (2H, q, J=6Hz, OCH2), 4,25 (2H, q, J=6Hz, OCH2), 7,05 (1 H, d, J=8Hz,
CH arom.), 7,40 (4H, s, 4 CH. tosyl), 7,65 (1 H, dd, J= 8 et 2Hz, CH arom.),
7,70 (1 H, d, J=2Hz, CH arom.)].
Le 2-(toluène-4-sulfonyl)amino-5-trifluorométhoxybenzoate d'éthyle peut être
préparé de la manière suivante : à une solution de 17,5 g de 2-amino-5-
trifluorométhoxybenzoate d'éthyle dans 70 ml de pyridine on ajoute sous
agitation et à température voisine de 20 C 16,1 g de chlorure d'acide to-
luène-4-suifonique. Après 24 heures d'agitation, on concentre à sec sous
pression réduite (2,2 kPa) à 60 C. L'huile brune obtenue est dissoute dans
de l'acétate d'éthyle et la solution est lavée successivement par une solution
d'acide chlorhydrique (2 N), par de l'eau distillée et par une solution
saturée
de chlorure de sodium, puis séchée sur sulfate de magnésium et concentrée
à sec sous pression réduite (2,2 kPa) à 50 C. L'huile orange obtenue reprise
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
par l'éther de pétrole conduit à 27,8 g de 2-(toluène-4-sulfonyl)amino-5-tri-
fluorométhoxybenzoate d'éthyle sous forme d'une poudre blanche fondant à
76 C.
Le 2-amino-5-trifluorométhoxybenzoate d'éthyle peut être préparé de la ma-
5 nière suivante : à 21 g de 2-tert-butoxycarbonylamino-5-trifluorométhoxy-
benzoate d'éthyle dans 150 ml de dichlorométhane sont ajoutés 55 mi
d'acide trifluoroacétique. Après 4 heures à une température voisine de 20 C
la solution noire obtenue est concentrée à sec. Le résidu est traité par une
solution diluée d'hydrogénocarbonate de sodium et extrait par de l'éther de
10 pétrole. La phase organique est lavée par de l'eau distillée jusqu'à pH neu-
tre, séchée sur sulfate de magnésium et concentrée à sec sous pression ré-
duite (2,2 kPa) à 50 C. On obtient ainsi 14 g de 2-amino-5-trifluorométhoxy-
benzoate d'éthyle sous forme d'huile brune [RMN Spectre 1 H dans DMSO-
d6, T=300K, S en ppm (300 Mhz) : 1,30 (3H, t, J=6Hz, CH3), 4,30 (2H, q,
15 J=6Hz, OCH2), 6,85 (2H, s, NH2), 6,87 (1 H, d, J=8Hz, CH arom.), 7,30 (1 H,
dd, J=8 et 2Hz, CH arom.), 7,55 (1 H, d, J=2Hz, CH arom.)].
Le 2-tert-butoxycarbonylamino-5-trifluorométhoxybenzoate d'éthyle peut être
préparé de la manière suivante : sur une solution de 34,5 g de 4-trifluoro-
méthoxyphénylcarbamate de tert-butyle dans 430 ml de tétrahydrofuranne
20 anhydre, maintenue sous argon à-78 C, on coule en 1 heure 200 ml d'une
solution 1,5 M de tert-butyllithium dans le pentane. On laisse remonter la
température aux environs de -20 C et abandonne sous agitation 2,5 heures.
De nouveau le milieu réactionnel est refroidi vers -78 C et on coule en une
fois 75 ml de carbonate de diéthyle. Après 16 heures à une température voi-
25 sine de 20 C, on ajoute 100 ml d'une solution aqueuse saturée de chlorure
d'ammonium et 250 ml d'éther éthylique. Après décantation on extrait à nou-
veau la phase aqueuse par deux fois 200 ml d'éther éthylique. Les extraits
organiques sont réunis, lavés à l'eau distillée et par une solution aqueuse
saturée de chlorure de sodium, séchés sur sulfate de magnésium et concen-
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
26
trés à sec sous pression réduite. L'huile rouge obtenue est dissoute dans de
l'éther de pétrole et la solution est filtrée sur gel de silice en lavant avec
de
l'éther de pétrole. Le filtrat concentré à sec livre une huile rouge qui
cristal-
lise. Après recristallisation dans 50 ml d'hexane, on obtient 21,5 g de 2-tert-
butoxycarbonylamino-5-trifluorométhoxybenzoate d'éthyle sous forme d'un
solide crème fondant à 82 C.
Le 4-trifluorométhoxyphénylcarbamate de tert-butyle peut être préparé de la
manière suivante : on coule, en 10 minutes et à 0 C, une solution de 47 g de
di-tert-butyldicarbonate dans 100 ml de tétrahydrofuranne anhydre sur une
solution de 32,75 g de 4-trifluorométhoxyaniline dans 150 ml de tétrahydro-
furanne anhydre. Le milieu réactionnel est agité à 80 C pendant 3 heures,
puis concentré à sec. On obtient un produit cristallisé blanc qui est
redissous
dans 300 ml d'acétate d'éthyle. La solution est lavée trois fois par de l'eau
distillée, séchée sur sulfate de magnésium et concentrée à sec. Par tritura-
tion dans l'éther de pétrole, filtration et séchage sous pression réduite
(70 Pa) à 20 C, on obtient 35,5 g de 4-trifluorométhoxyphénylcarbamate de
tert-butyle sous forme d'un solide blanc fondant à 110 C.
EXEMPLE 2
On opère comme dans l'exemple 1 mais à partir de 0,7 g de brome dans 5 ml
d'acide acétique, 1 g de 7-trifluorométhoxy-2,3,4,5-tétrahydro-1 H-
[1]benzazépine et de 1,46 g de thiocyanate de potassium dans 15 ml d'acide
acétique. L'huile épaisse orange isolée est chromatographiée sur gel de si-
lice en éluant avec un mélange d'acétate d'éthyle et d'éther de pétrole (70-
en volumes). On obtient une huile jaune que l'on dissout dans l'éther iso-
25 propylique auquel on ajoute 0,45 ml d'une solution d'isopropanol chlorhy-
drique (environ 5 N). Le précipité blanc formé est filtré puis séché sous vide
(70 Pa) à une température de 40 C. On obtient ainsi 0,52 g de chlorhydrate
de 2-imino-9-trifluorométhoxy-4,5,6-7-tétrahydro-2H-thiazolo[5,4,3-jk][1 ]ben-
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
27
zazépine sous forme d'un solide blanc fondant à 270 C (avec décomposition)
[Analyse C12H12 CIF3N2OS, % calculé C : 44,38, H : 3,72, CI : 10,92,
F: 17,55, N : 8,63, O: 4,93, S : 9,87, % trouvé C : 44,3, H : 3,5, CI : 10,9,
F : 17,7, N : 9,1].
La 7-trifluorométhoxy-2,3,4,5-tétrahydro-1 H-[1 ]benzazépine peut être prépa-
rée de la manière suivante : sur une solution de 2,3 g de 7-trifluorométhoxy-
2,3,4,5-tétrahydro-1 H-[1 ]benzazépine-1-carboxylate de tert-butyle dans 25 ml
de dichlorométhane sont ajoutés 5 ml d'acide trifluoroacétique. Après
1 heure à température voisine de 20 C la solution rouge obtenue est concen-
trée à sec sous pression réduite. Le résidu est traité par une solution diluée
d'hydrogénocarbonate de sodium et extrait par de l'éther éthylique. La phase
organique est lavée par de l'eau distillée puis par une solution saturée de
chlorure de sodium, séchée sur sulfate de magnésium et concentrée à sec
sous pression réduite (2,2 kPa) à 50 C. On obtient ainsi 1,3 g d'huile brune
qui est chromatographiée sur gel de silice en éluant avec un mélange d'éther
de pétrole et de dichlorométhane (70-30 en volumes). Après évaporation
sous pression réduite on isole 1,14 g de 7-trifluorométhoxy-2,3,4,5 -tétrahy-
dro-1 H-[1]benzazépine sous forme d'un solide pâteux utilisé tel quel dans
l'étape suivante [RMN Spectre 1 H dans DMSO-d6, T=300K, S en ppm
(300 Mhz) : entre 1,50 et 1,70 (4H, m, 2 CH2), 2,60 (2H, m, PhCH2), 2,90 (2H,
m, NCH2), 5,40 (1 H, s, NH), entre 6,80 et 7,00 (3H, m, 3 CH arom.)].
Le 7-trifluorométhoxy-2,3,4,5-tétrahydro-1 H-[1 ]benzazépine-1-carboxylate de
tert-butyle peut être préparé de la manière suivante : à une solution, mainte-
nue sous atmosphère d'argon à-78 C, de 5,54 g de 4-trifluorométhoxy-
phénylcarbamate de tert-butyle dans 60 ml de tétrahydrofuranne anhydre, on
ajoute en 1 heure 32 ml d'une solution 1,5 M de tert-butyllithium dans le
pentane. Le mélange réactionnel est ensuite agité pendant 2,5 heures à une
température voisine de -20 C. II est de nouveau refroidi vers -78 C et on
coule, goutte à goutte en 15 minutes, 2,65 ml de 1-chloro-4-iodobutane. Le
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
28
mélange réactionnel est porté et maintenu à l'ébullition pendant 5 heures.
Après refroidissement on ajoute 50 ml d'une solution aqueuse saturée de
chlorure d'ammonium et extrait trois fois avec 200 ml au total d'éther
éthylique. Les extraits organiques sont réunis, lavés à l'eau distillée et par
une solution aqueuse saturée de chlorure de sodium, séchés sur sulfate de
magnésium, puis concentrés à sec sous pression réduite. L'huile obtenue
(6,65 g) est chromatographiée sur gel de silice en éluant avec un mélange
d'éther de pétrole et de dichlorométhane (50-50 en volumes). On obtient
ainsi 2,3 g de 7-trifluorométhoxy-2,3,4,5-tétrahydro-lH-[1]benzazépine-1-
carboxylate de tert-butyle sous la forme d'une huile jaune [RMN Spectre 1 H
dans DMSO-d6, T=393K, S en ppm (200 Mhz) : entre 1,65 et 1,90 (4H, m, 2
CH2), 2,70 (2H, m, PhCH2), 3,50 (2H, t, J=6Hz, NCH2), entre 7,05 et 7,35
(3H, m, 3 CH arom.)].
EXEMPLE 3
On opère comme dans l'exemple 1, mais à partir de 2,38 g de brome dans
5 ml d'acide acétique, 3,2 g de 7-trifluorométhyl-2,3,4,5-tétrahydro-1 H-
[llbenzazépine et de 5 g de thiocyanate de potassium dans 35 ml d'acide
acétique. L'huile jaune brun isolée est chromatographiée sur gel de silice en
éluant avec de l'acétate d'éthyle. On obtient une huile jaune, que l'on
dissout
dans 15 ml d'éther isopropylique auxquels est additionné 1 ml d'une solution
1,94 N d'acide méthanesulfonique dans I'isopropanol. Le précipité blanc
formé est filtré puis séché sous vide (70 Pa) à 50 C. On obtient ainsi 0,7 g
de
méthanesulfonate de 2-imino-9-trifluorométhyl-4,5,6,7-tétrahydro-2H-thia-
zolo[5,4,3-jk][llbenzazépine sous forme d'un solide blanc fondant à 226 C
[Analyse C13H15F3N2O3S, % calculé C : 42,38, H : 4,1, F: 15,2, N : 7,5,
O: 13,3, S: 17,41, % trouvé C : 42,4, H : 3,9, F: 15,2, N : 7,5, S:17,4].
La 7-trifluorométhyl-2,3,4,5-tétrahydro-1 H-[1 ]benzazépine peut être préparée
comme dans l'exemple 2, mais à partir de 5 g de 7-trifluorométhyl-2,3,4,5-
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
29
tétrahydro-lH-[1]benzazépine-1-carboxylate de tert-butyle dans 50 ml de
dichlorométhane et 5 ml d'acide trifluoroacétique. On obtient ainsi 3,3 g de
7-trifluorométhyl-2,3,4,5-tétrahydro-1 H-[1 ]benzazépine sous forme d'une
huile rouge utilisée telle quelle dans l'étape suivante [RMN Spectre 1 H dans
DMSO-d6, T=300K, S en ppm (300 Mhz) : entre 1,60 et 1,90 (4H, m, 2 CH2),
2,75 (2H, t, J=6Hz, PhCH2), 3,00 (2H, t, J=6Hz, NCH2), 5,90 (1 H, s large,
NH), 6,90 (1 H, d, J=8Hz, CH arom.), 7,28 (1 H, dd, J=2 et 8Hz, CH arom.),
7,33 (1 H, d, J=2Hz, CH arom.)].
Le 7-trifluorométhyl-2,3,4,5-tétrahydro-1 H-[1 ]benzazépine-1-carboxylate de
tert-butyle peut être préparé comme dans l'exemple 2, mais à partir de 26,1 g
de 4-trifluorométhylphénylcarbamate de tert-butyle dans 300 ml de tétrahy-
drofuranne anhydre, 160 ml d'une solution 1,5 M de tert-butyllithium et 24 g
de 1 -chloro-4-iodobutane. On obtient 36 g d'une huile brune qui est chroma-
tographiée sur gel de silice en éluant avec un mélange d'éther de pétrole et
de dichlorométhane (70-30 en volumes). On obtient ainsi 16,2 g de 7-trifluo-
rométhyl-2,3,4,5-tétrahydro-1 H-[1 ]benzazépine-1-carboxylate de tert-butyle
sous forme d'une huile verdâtre qui est utilisée telle quelle dans l'étape sui-
vante.
EXEMPLE 4
A une solution de 1 g de 2-imino-9-trifluorométhoxy-5,6-dihydro-2H,4H-thia-
zolo[3,4,5-ef][1,5]benzothiazépine dans 20 ml de dichlorométhane on ajoute,
goutte à goutte, en 15 minutes et à une température voisine de 20 C, une
solution de 1,55 g d'acide 3-chloroperbenzoïque (pureté 80%) dans 10 ml de
dichlorométhane, et le mélange est ensuite agité pendant 24 heures à la
même température. On ajoute ensuite 100 ml d'une solution aqueuse 1 M
d'hydrogénocarbonate de sodium et on agite 1 heure à la même température.
Après séparation des deux phases, on extrait la phase aqueuse deux fois par
50 ml de dichlorométhane et les extraits organiques réunis sont séchés sur
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
sulfate de magnésium et concentrés à sec sous pression réduite (2 kPa). Le
produit obtenu (1,4 g) est chromatographié sous pression d'azote (150 kPa)
sur 30 g de gel de silice 20-45 pm contenus dans une colonne de 2 cm de
diamètre, en éluant avec de l'acétate d'éthyle. Le produit obtenu (300 mg)
5 est dissous dans 35 mi d'éthanol absolu, auxquels on additionne 69 I
d'acide méthanesulfonique. Après agitation pendant 1 heure à une tempéra-
ture voisine de 20 C, la solution est concentrée à sec sous pression réduite
(2kPa). Le produit obtenu est mis en suspension dans l'isopropanol, séparé
par filtration, lavé avec de l'isopropanol et de l'éther isopropylique et
séché
10 sous pression réduite. On obtient ainsi 0,21 g de méthanesulfonate de
7,7-dioxyde de 2-imino-9-trifluorométhoxy-5,6-dihydro-2H,4H-thiazolo-[3,4,5-
ef][1,5]benzothiazépine, sous forme d'un solide blanc fondant à une tempé-
rature supérieure à 260 C [Analyse C12H13F3N206S3, % calculé C : 33,17,
H : 3,02, F : 13,12, N : 6,45, O: 22,10, S: 22,14, % trouvé C: 33,20,
15 H : 2,71, F: 12,7, N : 6,30, S : 22,1 ].
EXEMPLE 5
A une solution de 1 g de 2-imino-9-trifluorométhoxy-5,6-dihydro-2H,4H-thia-
zolo[3,4,5-ef][1,5]benzothiazépine dans 30 ml de dichlorométhane on ajoute,
goutte à goutte, en 15 minutes et à une température voisine de 0 C, une so-
20 lution de 770 mg d'acide 3-chloroperbenzoïque (pureté 80%) dans 5 ml de
dichlorométhane et le mélange est ensuite agité pendant 1 heure à la méme
température. On ajoute ensuite 35 ml d'une solution aqueuse 1 M
d'hydrogénocarbonate de sodium et on agite 1 heure à 20 C. Après sépara-
tion des deux phases, on extrait la phase aqueuse par 15 mi de dichloromé-
25 thane et les extraits organiques réunis sont séchés sur sulfate de
magnésium
et concentrés à sec sous pression réduite (2 kPa). Le produit obtenu est mis
en suspension dans 20 ml d'éther isopropylique, séparé par filtration, lavé
avec de l'éther isopropylique et séché sous pression réduite. Le produit ob-
tenu (716 mg) est dissous dans 70 ml d'éthanol absolu et la solution est fil-
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
31
trée, puis additionnée de 160 l d'acide méthanesuifonique. Après agitation
pendant 1 heure à une température voisine de 20 C, la solution est concen-
trée à sec sous pression réduite (2kPa). Le produit obtenu est mis en sus-
pension dans de l'isopropanol, séparé par filtration, lavé avec de
l'isopropanol et de l'éther isopropylique et séché sous pression réduite. On
obtient ainsi 0,70 g de méthanesulfonate de 7-oxyde de 2-imino-9-trifluoro-
méthoxy-5,6-dihydro-2H,4H-thiazolo-[3,4,5-ef][1,5]benzothiazépine sous
forme d'un solide crème fondant à une température supérieure à 260 C
[Analyse C12H13F3N205S3, % calculé C: 34,45, H 3,13, F 13,62,
N: 6,69, O: 19,12, S : 22,99, % trouvé C : 34,44, H 2,86, F 13,37,
N : 6,68, S : 22,8].
EXEMPLE 6
On opère comme à l'exemple 1, mais à partir de 0,4 ml de brome dans 5 ml
d'acide acétique, 2 g de 8-trifluorométhoxy-2,3,4,5-tétrahydro[1,5]benzothia-
zépine et 1,71 g de thiocyanate de potassium dans 24 ml d'acide acétique.
Le produit brut obtenu est chromatographié sous pression d'azote (150 kPa)
sur 40 g de gel de silice 20-45 pm contenus dans une colonne de 2,5 cm de
diamètre, en éluant avec un mélange d'acétate d'éthyle et de cyclohexane
(50-50 en volumes). On dissout 0,5 g du produit obtenu (sur 1,5 g obtenu au
total) dans 80 ml d'éthanol auxquels on ajoute 0,117 ml d'acide méthanesul-
fonique. Après 16 heures d'agitation à 20 C, la solution est concentrée à sec
sous pression réduite (2 kPa). Le produit obtenu est mis en suspension dans
20 ml d'éther isopropylique, séparé par filtration, lavé avec de l'éther
isopro-
pylique et séché sous pression réduite (2 kPa) à 20 C. On obtient ainsi
0,56 g de méthanesuifonate de 2-imino-9-trifluorométhoxy-5,6-dihydro-
2H,4H-thiazolo[3,4,5-ef][1,5]benzothiazépine, sous forme d'un solide beige
fondant à une température supérieure à 260 C [Analyse C12H13F3N204S3,
% calculé C : 35,82, H : 3,26, F: 14,16, N : 6,96, 0: 15,9, S : 23,9, % trouvé
C : 35,8, H : 3,0, F: 14,3, N : 7,00, S : 23,8].
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
32
La 8-trifluorométhoxy-2,3,4,5-tétrahydro-[1,5]benzothiazépine peut être pré-
parée de la manière suivante : à 21,4 ml d'une solution environ 0,5 M de té-
trahydroaluminate de lithium dans le tétrahydrofuranne, maintenue sous ar-
gon à 5 C, on ajoute goutte à goutte en 15 minutes, une solution de 2,5 g
8-trifluorométhoxy-2,3-dihydro-5H-[1,5]benzothiazépine-4-one dans 25 ml de
tétrahydrofuranne. Le mélange réactionnel est agité ensuite 2 heures à 20 C
et on ajoute successivement 500 ml d'eau distillée, 100 ml d'acétate d'éthyle
et 100 mi d'une solution saturée de chlorure de sodium. Après décantation,
la phase aqueuse est extraite trois fois avec 50 ml d'acétate d'éthyle. Les
extraits organiques sont réunis, séchés sur sulfate de magnésium et concen-
trés à sec sous pression réduite (2kPa). On obtient ainsi 2 g de
8-trifluorométhoxy-2,3,4,5-tétrahydro-[1,5]benzothiazépine sous forme d'une
huile jaune [Spectre 1 H dans DMSO-d6, T=300K, S en ppm (300 Mhz) : 1,95
(2H, m, CH2); 3,00 (2H, m, SCH2); 3,30 (2H, m, NCH2); 5,90 (1 H, m, NH);
6,85 (1 H, d, J=8Hz, CH arom.); 7,00 (1 H. d, J=8Hz, CH arom.); 7,12 (1 H, s,
CH arom.)].
La 8-trifluorométhoxy-2,3-dihydro-SH-[1,5]benzothiazépine-4-one peut être
préparée de la manière suivante : à une suspension de 11,5 g de 2-amino-6-
trifluorométhoxybenzothiazole dans 115 ml d'eau distillée, on ajoute 70 g de
potasse en pastilles par portions d'environ 10 g. Le mélange est ensuite
agité pendant 16 heures au reflux. Après refroidissement vers 20 C, on
ajoute 16,4 g de 3-bromopropionate d'éthyle puis 30 ml d'eau distillée et le
milieu est agité pendant 16 heures à la même température. Le mélange est
ensuite acidifié avec de l'acide chlorhydrique concentré à une température
voisine de 5 C, extrait trois fois avec 50 ml d'acétate d'éthyle. Les extraits
organiques sont réunis, lavés 3 fois avec de l'eau distillée, séchés sur
sulfate
de magnésium, et concentrés à sec sous pression réduite (2 kPa). Le produit
brut obtenu est chromatographié sous pression d'azote (150 kPa) sur 250 g
de gel de silice 20-45 pm contenus dans une colonne de 4 cm de diamètre,
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
33
en éluant avec un mélange d'acétate d'éthyle et de cyclohexane (75-25 en
volumes). On obtient ainsi 2,5 g d'un solide blanc qui est remis en suspen-
sion dans de l'éther isopropylique, séparé par filtration, lavé avec de
l'éther
isopropylique et séché sous pression réduite (2 kPa). On obtient ainsi 1,6 g
8-trifluorométhoxy-2,3-dihydro-5H-[1,5]benzothiazépine-4-one sous forme
d'un solide blanc fondant à 188 C.
Le 2-amino-6-trifluorométhoxybenzothiazole peut être obtenu par la méthode
décrite par L.M. YAGUPOL'SKII et coll., Zh. Obshch. Khim., 33 (7), 2301
(1963).
EXEMPLE 7
On opère comme à l'exemple 1 mais à partir de 1,2 g de brome dans 2 ml
d'acide acétique, 2,5 g de 4-benzyl-7-trifluorométhoxy-4,5-dihydro-1 H,2H-
[1,4]benzodiazépine-3-one et 1,6 g de thiocyanate de potassium dans 25 ml
d'acide acétique. Le produit obtenu est chromatographié sous pression
d'azote (150 kPa) sur 75 g de gel de silice 20-45 pm contenus dans une co-
lonne de 2,5 cm de diamètre, en éluant avec de l'acétate d'éthyle. On dissout
0,6 g du produit obtenu (sur 2,25 g obtenus au total) dans 45 ml d'éthanol,
auxquels on ajoute 0,1 ml d'acide méthanesulfonique. Après 3 heures
d'agitation à 20 C, la solution est concentrée à sec sous pression réduite
(2 kPa). Le produit obtenu est mis en suspension dans de l'éther éthylique,
séparé par filtration, lavé avec de l'éther éthylique et séché sous pression
ré-
duite (2 kPa) à 20 C. On obtient ainsi 0,74 g de méthanesuifonate de
6-benzyl-2-imino-9-trifluorométhoxy-6, 7-d ihydro-4H-thiazolo[3,4,5-kj][1,4]
benzodiazépine-5-one sous forme d'un solide crème fondant à une tempéra-
ture supérieure à 260 C [Analyse C19H18F3N305S2, % calculé C : 46,62,
H : 3,71, F : 11,64, N : 8,58, O: 16,34, S: 13,10, % trouvé C: 46,5, H : 3,4,
F : 11,3, N 8,5, S: 12,6].
-_,..-------____
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
34
EXEMPLE 8
On opère comme à l'exemple 1 mais en utilisant 4,15 g de brome dans 5 ml
d'acide acétique, 8,3 g de 4-benzyl-7-trifluorométhoxy-2,3,4,5-tétrahydro-1 H-
[1,4lbenzodiazépine dans 120 ml d'acide acétique et 10 g de thiocyanate de
potassium. On obtient 2,7 g d'une huile brune qui est chromatographiée suc-
cessivement sur du gel de silice puis sur de l'alumine neutre désactivée avec
10% d'eau, en éluant dans les deux cas avec un mélange d'acétate d'éthyle
et de cyclohexane (50-50 en volumes). On dissout le produit obtenu (0,68 g)
dans 45 ml d'éthanol, auxquels on ajoute 0,23 ml d'acide méthanesulfonique.
Après 2 heures d'agitation à 20 C, la solution est concentrée à sec sous
pression réduite (2 kPa). Le produit obtenu est mis en suspension dans de
l'éthanol, séparé par filtration, lavé avec de l'éthanol puis de l'éther
éthylique
et séché sous pression réduite (2 kPa) à 20 C. On obtient 0,32 g de dimé-
thanesulfonate de 6-benzyl-2-imino-9-trifluorométhoxy-4,5,6,7-tétrahydro-2H-
thiazolo[3,4,5-kj][1,4]benzodiazépine sous forme d'un solide beige fondant à
une température supérieure à 260 C [Analyse C20H24F3N3O7S3, % calculé
C : 42,02, H : 4,23, F: 9,97, N : 7,35, O: 19,59, S: 16,83, % trouvé C : 41,2,
H : 4,2, F: 9,3, N : 7,2, S: 16,51.
La 4-benzyl-7-trifluorométhoxy-2,3,4,5-tétrahydro-1 H-[1,4]benzodiazépine
peut être préparée comme à l'exemple 6, mais en utilisant 95 ml de solution
(environ 0,35 M) de tétrahydroaluminate de lithium dans le tétrahydrofuranne
et de 6 g de 4-benzyl-7-trifluorométhoxy-4,5-dihydro-1 H,3H-[1,4]benzodia-
zépine-2-one dans 40 mi de tétrahydrofuranne anhydre. On obtient 4,8 g de
4-benzyl-7-trifiuorométhoxy-2,3,4,5-tétrahydro-1 H-1,4-benzodiazépine sous
forme d'une huile incolore [RMN Spectre 1 H dans DMSO-d6, T=300K, S en
ppm (300 Mhz) : 2,75 (2H, m, NCH2); 3,00 (2H, m, NCH2); 3,58 (2H, s, CH2);
3,63 (2H, s, CH2); 5,65 (1 H, t, J=2Hz, NH); 6,80 (1 H, d, J=2Hz, CH); 6,90
(1 H, d, J=8Hz, CH); 7,00 (1 H, dd, J=8 et 2Hz, CH); 7,30 (5H, m, 5 CH aryl)].
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
La 4-benzyl-7-trifluorométhoxy-4,5-dihydro-1 H,3H-[1,4]benzodiazépine-2-one
et la 4-benzyl-7-trifluorométhoxy-4,5-dihydro-1 H,2H-[1,4]benzodiazépine-3-
one peuvent être préparées de la manière suivante : à une solution, mainte-
nue à une température voisine de 20 C, de 15,1 g de 2-benzylaminométhyl-
5 4-trifluorométhoxyaniline dans 350 ml d'éther éthylique, on ajoute 16,5 g de
chlorure de chloroacétyle puis 350 mi de solution aqueuse saturée
d'hydrogénocarbonate de sodium. Le mélange réactionnel est agité pendant
1 heure à la même température. L'insoluble est ensuite éliminé par filtration
et la phase organique séchée sur sulfate de magnésium, filtrée et concentrée
10 à sec sous vide (2kPa). Le résidu d'évaporation est mis en solution dans
300 ml d'un mélange tétrahydrofuranne/alcool isopropylique (50/50 en volu-
mes) auxquels on ajoute 17,6 g de tert-butoxyde de potassium et on agite
1 heure à une température voisine de 20 C. Après acidification avec 12 ml
d'acide acétique et dilution avec 350 ml d'eau distillée, on extrait deux fois
15 avec 100 ml d'acétate d'éthyle et les phases organiques réunies sont sé-
chées sur sulfate de magnésium, filtrées et concentrées à sec sous vide
(2 kPa). L'huile obtenue est reprise par 50 mi d'un mélange de cyclohexane
et d'acétate d'éthyle (75/25 en volumes) où un solide cristallise. Celui est
séparé par filtration, lavé avec 10 mi de ce même mélange et fournit 6,04 g
20 de 4-benzyl-7-trifluorométhoxy-4,5-dihydro-1 H,3H-[1,4]benzodiazépine-2-one
sous forme d'un solide blanc fondant à 178 C. Le filtrat est concentré à sec
sous vide (2 kPa) et le résidu est chromatographié sur 160 g de silice 20-45
pm contenus dans une colonne de 3,5 cm de diamètre, en éluant avec un
mélange acétate d'éthyle/cyclohexane (50150 en volumes). On obtient ainsi
25 5,72 g de 4-benzyl-7-trifluorométhoxy-4,5-dihydro-1 H,2H-[1,4]benzodiazé-
pine-3-one sous forme d'un solide blanc fondant à 124 C.
La 2-benzylarninométhyl-4-trifluorornéthoxyaniline peut être préparée de la
manière suivante : à 97 ml d'une solution 1 M de tétrahydroaluminate de li-
thium dans le tétrahydrofuranne, maintenus sous argon vers 20 C, on ajoute
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
36
100 ml de 1,4-dioxane anhydre, puis goutte à goutte une solution de 15 g de
N-benzyl-2-amino-5-trifluorométhoxybenzamide dans 70 ml de 1,4dioxane
anhydre et le mélange est agité pendant 24 heures à reflux. Après hydrolyse,
vers 5 C, par addition lente de 20 ml d'eau distillée, l'insoluble apparu est
séparé par filtration, lavé avec de l'eau distillée puis avec de l'acétate
d'éthyle et éliminé. Le filtrat est décanté et la phase organique est séchée
sur sulfate de magnésium et concentrée à sec sous pression réduite (2 kPa).
Le produit obtenu est chromatographié sous pression d'azote (150 kPa) sur
150 g de gel de silice 20-45 pm contenus dans une colonne de 3,5 cm de
diamètre, en éluant avec un mélange de cyclohexane et d'acétate d'éthyle
(75-25 en volumes). On obtient ainsi 7,39 g de 2-benzylaminométhyl-4-tri-
fluorométhoxyaniline, sous forme d'une huile incolore [RMN Spectre 1 H dans
DMSO-d6, T=300K, ô en ppm (300 Mhz) : 2,65 (1 H, s, NH), 3,65 (2H, s,
NCH2), 3,72 (2H, s, NCH2), 5,40 (2H, s, NH2), 6,70 (1 H, d, J=8Hz, CH
arom.), 6,98 (1 H, d, J=8Hz, CH arom.), 7,04 (1 H, s, CH arom.), entre 7,20 et
7,50 (5H, m, 5CH aromatiques)].
Le N-benzyl-2-amino-5-trifluorométhoxybenzamide peut être préparé de la
manière suivante : une solution de 5 g de N-benzyl-2-tert-butoxycarbonyla-
mino-5-triffuorom6thoxybenzamide dans 25 ml d'acide trifluoroacétique est
conservée pendant 16 heures à une température voisine de 20 C, puis con-
centrée à sec sous pression réduite (2kPa). Le produit obtenu est dissous
dans de l'acétate d'éthyle et la solution est lavée successivement avec deux
fois 15 mi d'eau distillée et 15 mi de solution aqueuse saturée
d'hydrogénocarbonate de sodium, puis concentrée à sec sous pression ré-
duite (2 kPa). Le produit obtenu est mis en suspension dans du pentane, sé-
paré par filtration et séché sous pression réduite (2 kPa). On obtient ainsi
3,55 g de N-benzyl-2-amino-5-trifluorométhoxybenzamide sous forme d'un
solide crème fondant à 143 C.
CA 02298974 2000-01-26
WO 99/05147 PCTIFR98/01638
37
Le N-benzyl-2-tert-butoxycarbonylamino-5-trifluorométhoxybenzamide peut
être préparé de la manière suivante : à une solution, maintenue sous atmo-
sphère d'argon à-10 C, de 20 g d'acide 2-tert butoxycarbonylamino-5-trifluo-
rométhoxybenzoique, 16,9 g de 1-hydroxybenzotriazole et 6,8 g de benzy-
lamine dans 400 ml de tétrahydrofuranne anhydre, on ajoute 12,9 g de
N,N'-dicyclohexylcarbodiimide. Le mélange est agité pendant 2 heures à la
même température puis pendant 16 heures à une température voisine de
20 C. Après refroidissement à 0 C, l'insoluble est séparé par filtration, lavé
avec de l'acétate d'éthyle et le filtrat est concentré à sec sous pression ré-
duite (2 kPa). Le produit obtenu est dissous dans 60 ml d'acétate d'éthyle et
la solution est lavée deux fois par 25 ml d'une solution aqueuse saturée
d'hydrogénocarbonate de sodium, séchée sur sulfate de magnésium, et con-
centrée à sec sous pression réduite (2kPa). Le produit obtenu est remis en
suspension dans un mélange d'éther de pétrole et de pentane (50-50 en vo-
lumes), séparé par filtration, lavé avec le mélange d'éther de pétrole et de
pentane et séché sous pression réduite (2 kPa). On obtient ainsi 21,7 g de
N-benzyl-2-tert-butoxycarbonylamino-5-trifluorométhoxybenzamide sous
forme d'un solide crème fondant à 144 C.
L'acide 2-tert butoxycarbonylamino-5-trifluorométhoxybenzoique peut être
préparé de la manière suivante : à une solution, maintenue à-70 C sous at-
mosphère d'argon, de 29 g de 4-trifluorométhoxy-phénylcarbamate de tert-
butyle dans 300 ml de tétrahydrofuranne anhydre, on ajoute, goutte à goutte
en 1 heure, 168 ml d'une solution 1,5 M de tert-butyllithium dans le pentane.
Le mélange est agité pendant 3 heures 30 minutes à-20 C, refroidi de nou-
veau vers -70 C et un excès de dioxyde de carbone solide séché sur tétra-
hydrofuranne anhydre est ajouté par petites quantités. Le mélange est agité
pendant 16 heures à une température voisine de 20 C puis on ajoute 500 ml
d'une solution aqueuse saturée en chlorure d'ammonium et 200 ml d'acétate
d'éthyle. La phase aqueuse est extraite deux fois par 200 mi d'acétate
CA 02298974 2000-01-26
WO 99/05147 PCTIF'R98/01638
38
d'éthyle et les extraits organiques sont réunis, séchés sur sulfate de magné-
sium et concentrés à sec sous pression réduite (2kPa). Le produit obtenu est
mis en suspension dans un mélange d'éther de pétrole et de pentane (50-
50 en volumes), séparé par filtration, lavé avec du pentane et séché sous
pression réduite (2 kPa). On obtient ainsi 31,7 g d'acide 2-tert-butoxycarbo-
nylamino-5-trif{uorométhoxybenzoique sous forme d'un solide crème fondant
entre 204 et 208 C.
EXEMPLE 9
On opère comme à l'exemple 1 mais à partir de 1,5 g de brome dans 5 ml
d'acide acétique, 2,34 g de 7-trifluorométhoxy-1,2,3,5-tétrahydro-
[4,11benzothiazépine, 2,5 g de thiocyanate de potassium et 20 ml d'acide
acétique. Le produit obtenu (3,42 g) est chromatographié sous pression
d'azote (150 kPa) sur 80 g de gel de silice 20-45 m contenus dans une co-
lonne de 2,5 cm de diamètre, en éluant avec un mélange d'acétate d'éthyle
et de cyclohexane (50-50 en volumes). Le produit obtenu est concrété par
trituration dans 5 ml d'éther de pétrole, séparé par filtration et séché sous
pression réduite (2 kPa). On dissout le produit obtenu (0,66 g) dans 30 ml
d'éthanol, auxquels on ajoute 0,15 ml d'acide méthanesulfonique. Après
16 heures d'agitation à 20 C, la solution est concentrée à sec sous pression
réduite (2 kPa). Le produit obtenu est recristallisé dans 10 ml d'un mélange
d'éthanol et d'éther isopropylique (75-25 en volumes). On obtient ainsi 0,28 g
de méthanesulfonate de 2-imino-9-trifluorométhoxy-4,5-dihydro-2H,7H-thia-
zolo[3,4,5-de][4,1]benzothiazépine sous forme d'un solide jaune fondant à
une température supérieure à 260 C [Analyse C12H13F3N2O4S3, % calculé
C : 35,82, H : 3,26, F: 14,16, N : 6,96, O: 15,9, S : 23,9, % trouvé C: 35,6,
H: 3,0, F:14,1, N: 6,9, S: 23,7].
La 7-trifluorométhoxy-1,2,3,5-tétrahydro-[4,11benzothiazépine peut être pré-
parée de la manière suivante : on opère comme à l'exemple 6, mais à partir
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
39
de 3,4 g 7-trifluorométhoxy-1,5-dihydro-3H-[4,1]benzothiazépine-2-one dans
25 ml de tétrahydrofuranne anhydre, de 15,5 ml d'une solution 1 M de tétra-
hydroaluminate de lithium dans le tétrahydrofuranne et 15 ml de 1,4-dioxane
anhydre. On obtient ainsi 2,34 g de 7-trifluorométhoxy-1,2,3,5-tétrahydro-
[4,1]benzothiazépine sous forme d'une huile jaunâtre [RMN Spectre 'H dans
DMSO-d6, T=300K, b en ppm (300 Mhz) : 2,80 (2H, m, SCH2), 3,25 (2H, m,
NCH2), 3,75 (2H, s, SCH2-aryl), 5,60 (1 H, t, J=5Hz, NH), 7,05 (2H, m, 2 CH
arom.), 7,20 (1 H, s, CH arom.)].
La 7-trifluorométhoxy-1,5-dihydro-3H-[4,1]benzothiazépine-2-one peut être
préparée de la manière suivante : à une solution, maintenue à-70 C sous
atmosphère d'argon, de 10,3 g de 2-méthyl-4-trifluorométhoxyphénylcarba-
mate de tert-butyle dans 150 ml de tétrahydrofuranne anhydre, on ajoute,
goutte à goutte en 1 heure, 47 ml d'une solution 1,5 M de tert-butyllithium
dans le pentane. Le mélange est agité pendant 2 heures à-20 C, refroidi
vers -70 C, additionné de 1,1 g de soufre, puis agité pendant 1 heure à
-20 C. Le mélange est refroidi vers -70 C, additionné de 5,4 g de bromoacé-
tate de méthyle, puis agité pendant 16 heures à une température voisine de
C. Après hydrolyse par 50 ml d'eau distillée, on extrait par trois fois 50 ml
d'acétate d'éthyle. Les extraits organiques réunis sont séchés sur sulfate de
20 magnésium et concentrés à sec sous pression réduite (2kPa). Le produit
obtenu est dissous dans 50 ml de dichlorométhane puis sont ajoutés 15 ml
d'acide trifluoroacétique. Après 2 heures d'agitation à une température voi-
sine de 20 C, le mélange est concentré à sec sous pression réduite (2 kPa).
Le produit obtenu est dissous dans 40 ml d'acétate d'éthyle et la solution est
lavée par 40 ml d'eau distillée, séchée sur sulfate de magnésium et concen-
trée à sec sous pression réduite (2 kPa). Le produit obtenu est mis en sus-
pension dans de l'éther isopropylique, séparé par filtration, lavé avec le
même solvant et séché sous pression réduite (2 kPa). On obtient ainsi 3,45 g
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
de 7-trifluorométhoxy-1,5-dihydro-3H-[4,1]benzothiazépine-2-one sous forme
d'un solide crème fondant à 190 C.
Le 2-méthyl-4-trifluorométhoxyphénylcarbamate de tert-butyle peut être pré-
paré de la manière suivante : à une solution, maintenue à-70 C sous atmo-
5 sphère d'argon, de 20 g de 4-trifluorométhoxyphénylcarbamate de tert-butyle
dans 250 ml de tétrahydrofuranne anhydre, on ajoute, goutte à goutte en
1 heure, 106 ml d'une solution 1,5 M de tert-butyllithium dans le pentane. Le
mélange est agité pendant 4 heures à-20 C, refroidi vers -70 C, additionné
de 10,3 g de iodométhane, puis agité pendant 16 heures à une température
10 voisine de 20 C. Après hydrolyse par 100 ml d'eau distillée, on extrait par
trois fois 60 ml d'acétate d'éthyle. Les extraits organiques réunis sont
séchés
sur sulfate de magnésium et concentrés à sec sous pression réduite (2 kPa).
Le produit obtenu est mis en suspension dans de l'éther de pétrole, séparé
par filtration, lavé avec le même solvant et séché sous pression réduite (2
15 kPa). On obtient ainsi 15,1 g de 2-méthyl-4-trifluorométhoxyphénylcarbamate
de tert-butyle sous forme d'un solide orange clair fondant à 98 C.
EXEMPLE 10
On opère comme à l'exemple 1 mais à partir de 1,6 g de brome dans 5 ml
d'acide acétique, 2,3 g de 7-trifluorométhyl-1,2,3,5-tétrahydro-
20 [4,1]benzothiazépine, 2,i g de thiocyanate de potassium et 30 ml d'acide
acétique. Après recristallisation dans l'éthanol absolu on obtient 1,15 g de
méthanesulfonate de 2-imino-9-trifluorométhyl-4,5-dihydro-2H,7H-thia-
zolo[3,4,5-de][4,1]benzothiazépine, sous forme d'un solide blanc fondant à
une température supérieure à 260 C [Analyse C12H13F3N203S3, % calculé
25 C: 37,3, H : 3,39, F: 14,75, N : 7,25, O: 12,42, S: 24,89, % trouvé C :
37,2,
H : 3,2, F: 14,4, N : 7,2, S : 24,6].
La 7-trifluorométhyl-1,2,3,5-tétrahydro-[4,1]benzothiazépine peut être prépa-
rée de la manière suivante : on opère comme à l'exemple 6, mais à partir de
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
41
3,6 g de 7-trifluorométhyl-1,5-dihydro-3H-[4,1]benzothiazépine-2-one dans
50 ml de tétrahydrofuranne anhydre et 50 ml de 1,4-dioxane anhydre et de
17,5 ml d'une solution 1 M de tétrahydroaluminate de lithium dans le tétrahy-
drofuranne. On obtient ainsi 2,4 g de 7-trifluorométhyl-1,2,3,5-tétrahydro-
[4,1]benzothiazépine sous forme d'un solide beige fondant à 94 C.
La 7-trifluorométhyl-1,5-dihydro-3H-[4,1]benzothiazépine-2-one peut être
préparée de la manière suivante : on agite pendant 3 heures 30 minutes, à
une température voisine de 20 C, un mélange de 14,3 g de (2-tert-butoxy-
carbonylamino-5-trifluorométhyl-benzylsulfanyl) acétate de méthyle dans
50 ml de dichlorométhane et de 15 rnl d'acide trifluoroacétique. Le mélange
est concentré à sec sous pression réduite (2 kPa) et le produit obtenu est
dissous dans 40 ml de N,N-diméthylformamide et porté au reflux pendant 3
heures. Le mélange est concentré à sec sous pression réduite (2kPa). Le
produit obtenu est dissous dans 50 ml d'acétate d'éthyle et la solution est
lavée par deux fois 100 ml d'eau distillée, séchée sur sulfate de magnésium
et concentrée à sec sous pression réduite (2 kPa). Le produit obtenu est mis
en suspension dans de l'éther isopropylique, séparé par filtration, lavé avec
un mélange d'acétate d'éthyle et de cyclohexane (50-50 en volumes) et sé-
ché sous pression réduite (2 kPa). On obtient 3,7 g de 7-trifluorométhyl-1,5-
dihydro-3H-[4,1]benzothiazépine-2-one sous forme d'un solide beige fondant
à 239 C.
Le (2-tert-butoxycarbonylamino-5-trifluorométhyl-benzylsulfanyl) acétate de
méthyle peut être préparé de la manière suivante : à une solution, maintenue
à-70 C sous atmosphère d'argon, de 13,7 g de 2-méthyl-4-trifluorométhyl-
phénylcarbamate de tert-butyle dans 180 ml de tétrahydrofuranne anhydre,
on ajoute, goutte à goutte en 1 heure 15 minutes, 67 ml d'une solution 1,5 M
de tert-butyllithium dans le pentane. Le mélange est agité pendant 3 heures
à-20 C, refroidi vers -70 C, additionné de 1,6 g de soufre, puis agité pen-
dant 1 heure à-20 C. Le mélange est refroidi vers -40 C, additionné de 7,6 g
CA 02298974 2007-06-21
42
de bromoacétate de méthyle, puis agité pendant 16 heures à une tempéra-
ture voisine de 20 C. Après hydrolyse par 300 ml d'eau distillée, on extrait
deux fois par 160 ml au total d'acétate d'éthyle. Les extraits organiques ré-
unis sont séchés sur sulfate de magnésium et concentrés à sec sous pres-
sion réduite (2kPa). Le produit obtenu est dissous dans de l'éther de pétrole
et la solution est filtrée puis concentrée à sec sous pression réduite (2
kPa).
On obtient 14,3 g de (2-tert-butoxycarbonylamino-5-trifluorométhylbenzyl-
sulfanyl) acétate de méthyle sous forme d'un solide jaune fondant à 54 C
[RMN Spectre'H dans DMSO-d6, T=300K, ô en ppm (300 Mhz) : 1,45 (9H, s,
(CH3)3), 3,25 (2H, s, SCH2CO), 3,60 (3H, s, O CH3), 4,00 (2H, s, SCH2-aryl),
7,60 (2H, m, 2 CH arom.), 7,85 (1 H, d, J=7Hz, CH arom.), 8,85 (1 H, s, NH)].
Le (2-tert-butoxycarbonylamino-5-trifluorométhyl-benzylsulfanyl) acétate de
méthyle peut également être préparé par la méthode suivante : sur une sus-
pension de 5,2 g d'hydrure de sodium (80% en dispersion dans l'huile de
vaselinel dans 59 ml de diméthylformamide, refroidie à 0 C et maintenue
sous atmosphère d'azote, on coule 14 g de thioglycolate de méthyle et on
agite ensuite 1 heure 30 mn à une température voisine de 20 C. On coule
ensuite une solution de 37,8 g de 2-bromométhyl-4-trifluorométhyl phényl-
carbamate de tert-butyle dans 30 ml de diméthylformamide et on agite ainsi
16 heures. Le milieu réactionnel est concentré à sec sous vide (2 kPa) et la
pâte obtenue est reprise avec 200 ml d'eau distillée et extraite trois fois
avec
50 ml d'acétate d'éthyle. Les phases organiques réunies sont séchées sur
sulfate de magnésium, filtrées et concentrées à sec sous vide (2 kPa). L'huile
( 32,6 g) est chromatographiée sur 360 g de silice 20-45 pm contenus dans
une colonne de 4 cm de diamètre, en éluant avec un mélange
cyclohexane/acétate d'éthyle (90/10 en volumes). On obtient ainsi 15,2 g de
(2-tert-butoxycarbonylamino-5-trifluorométhyl-benzylsulfanyi) acétate de
méthyle, sous forme d'un solide jaune fondant à 54 C.
* (marque de commerce)
CA 02298974 2007-06-21
43
Le 2-méthyl-4-trifluorométhylphénylcarbamate de tert-butyle est préparé de
la manière suivante : à une solution, maintenue à-70 C sous atmosphère
d'argon, de 30 g de 4-trifluorométhylphénylcarbamate de tert-butyle dans
390 ml de tétrahydrofuranne anhydre, on ajoute, goutte à goutte en 1 heure,
154 ml d'une solution 1,5 M de tert-butyllithium dans le pentane. Le mélange
est agité pendant 4 heures à-20 C, refroidi vers -70 C, additionné de 16,4 g
de iodométhane, puis agité pendant 16 heures à une température voisine de
20 C. Après hydrolyse par 300 ml d'eau distillée, on extrait par deux fois
160 ml au total d'acétate d'éthyle. Les extraits organiques réunis sont séchés
sur sulfate de magnésium et concentrés à sec sous pression réduite (2kPa).
Le produit obtenu est mis en suspension dans de l'éther de pétrole, séparé
par filtration, lavé avec le même solvant et séché sous pression réduite
(2 kPa). On obtient ainsi 20,5 g de 2-méthyl-4-trifluorométhylphénylcarba-
mate de tert-butyle sous forme d'un solide beige fondant à 101 C.
Le 2-bromométhyl-4-trifluorométhyl phénylcarbamate de tert-butyle peut être
préparé de la manière suivantre : on porte à ébullition un mélange de 40 g de
2-méthyl-4-trifluorométhyl phénylcarbamate de tert-butyle, 26 g de N-bro-
mosuccinimide et 1,5 g de peroxyde de benzoyle dans 290 ml de tétrachlo-
rure de carbone et on illumine avec une lampe Mazdasol*de 100 W pendant
4 heures. Le succinimide formé est éliminé par filtration et le filtrat est
suc-
cessivement lavé par 500 ml d'eau distillée, 200 ml de solution saturée en
hydrogénocarbonate de sodium puis 200 ml d'eau distillée, séché sur sulfate
de magnésium, filtré et concentré à sec sous vide (2 kPa). L'huile est reprise
avec de l'éther de pétrole et les cristaux obtenus sont séparés par
filtration.
On obtient ainsi 37,9 g de 2-bromométhyl-4-trifluorométhyl phénylcarbamate
de tert-butyle sous forme d'un solide blanc fondant à 98 C.
EXEMPLE 11
* (marque de commerce)
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
44
On opère comme à l'exemple 4 mais à partir de 6,35 g de 2-imino-9-trifluo-
rométhyl-4,5-dihydro-2H,7H-thiazolo[3,4,5-de][4,1]benzothiazépine et de
15,1 g d'acide 3-chloroperbenzoique (pureté 80%) dans 130 ml de dichioro-
méthane. On obtient ainsi 4,12 g de méthanesulfonate de 6,6-dioxyde de
2-imino-9-trifluorométhyl-4,5-dihydro-2H,7H-thiazolo[3,4,5-de][4,1]benzo-
thiazépine sous forme d'une poudre blanche fondant à une température su-
périeure à 260 C [Analyse C12H13F3N205S3, % calculé C: 34,45, H: 3,13,
F: 13,62, N: 6,69, S: 22,99, % trouvé C : 34,46, H : 2,94, F: 13,17, N: 6,71,
S : 23,111.
EXEMPLE 12
On opère comme à l'exemple 5 mais à partir de 230 mg de de 2-imino-9-tri-
fluorornéthyl-4,5-dihydro-2H,7H-thiazoto[3,4,5-de][4,1 ]benzothiazépine et de
198 mg d'acide 3-chloroperbenzoïque (pureté 80%) dans 8 ml de
dichlorométhane. On obtient ainsi 210 mg de méthanesulfonate de (R,S)
6-oxyde de 2-imino-9-trifluorométhyl-4,5-dihydro-2H,7H-thiazolo[3,4,5-
de][4,1]benzothiazépine sous forme d'une poudre blanche fondant à une
température supérieure à 260 C [Analyse C12H13F3N2O4S3, % calculé
C 35,82, H : 3,26, F: 14,16, N : 6,96, S : 23,9, % trouvé C : 36,2, H : 2,9,
F: 13,9, N: 7,0, S: 23,5].
EXEMPLE 13
On dissout 400 mg de (R,S) 6-oxyde de 2-imino-9-trifluorométhyl-4,5-dihy-
dro-2H,7H-thiazolo[3,4,5-de][4,1]benzothiazépine dans 160 ml de dichloro-
méthane et on injecte sur 700 g de phase stationnaire chirale type (S,S)
WHELCK-01 contenus dans une colonne de 60 mm de diamètre et de
400 mm de longueur, en éluant avec un mélange dichlorométhane/n-hep-
tane/méthanol (50/50/2 en volumes) avec un débit de 70 ml/mn. On obtient
200 mg de (+) 6-oxyde de 2-imino-9-trifluorornéthyl-4,5-dihydro-2H,7H-thia-
zolo[3,4,5-de][4,1]benzothiazépine ([a]o2 =+27,7 f1 c=0,2% méthanol) et
-~-------
CA 02298974 2000-01-26
WO 99/05147 PCTIFR98/01638
200 mg de (-)6-oxyde de 2-imino-9-trifluorométhyl-4,5-dihydro-2H,7H-thia-
zolo[3,4,5-de][4,1]benzothiazépine ([a]o20=-28,2 1 c=0,2% méthanol).
On dissout 200 mg de (+) 6-oxyde de 2-imino-9-trifluorométhyl-4,5-dihydro-
2H,7H-thiazolo[3,4,5-de][4,1]benzothiazépine dans 30 ml d'éthanol avec
5 70 mg d'acide méthanesuifonique et on agite 16 heures à une température
voisine de 20 C. Le milieu est ensuite concentré à sec sous vide (2 kPa) et la
laque incolore est reprise avec 10 ml d'acétone. Le solide est séparé par fil-
tration, lavé avec 2 fois 2 ml d'acétone. On obtient 240 mg de méthanesuifo-
nate de (+) 6-oxyde de 2-imino-9-trifluorométhyl-4,5-dihydro-2H,7H-thia-
10 zolo[3,4,5-de][4,1]benzothiazépine sous forme d'un solide blanc fondant à
230 C (fusion collante) [Analyse C12H13F3N204S3 % calculé C : 35,82, H:
3,26, F: 14,16, N : 6,96, S : 23,9, % trouvé C : 35,51, H : 2,78, F: 14,26, N:
6,75, S : 23,95; [a]ô =+73,1 t1,1 c=0,5% méthanol]
On dissout 200 mg de (-) 6-oxyde de 2-imino-9-trifluorométhyl-4,5-dihydro-
15 2H,7H-thiazolo[3,4,5-de][4,1]benzothiazépine dans 30 ml d'éthanol avec
70 mg d'acide méthanesulfonique et on agite 16 heures à une température
voisine de 20 C. Le milieu est ensuite concentré à sec sous vide (2 kPa) et la
laque incolore est reprise avec 10 ml d'acétone. Le solide est séparé par fil-
tration, lavé avec 2 fois 2 ml d'acétone, et on obtient 230 mg de méthanesul-
20 fonate de (-) 6-oxyde de 2-imino-9-trifluorométhyl-4,5-dihydro-2H,7H-thia-
zolo[3,4,5-de][4,1]benzothiazépine sous forme d'un solide blanc fondant à
235 C (fusion collante) [Analyse C12H13F3N204S3 % calculé C 35,82,
H : 3,26, F: 14,16, N : 6,96, S: 23,9, % trouvé C : 35,70, H : 3,14, F: 13,30,
N : 6,91, S : 24,23; [a]ô =-74,2 1,2 c=0,5% dans le méthanol].
25 EXEMPLE 14
A une solution, sous argon et refroidie à 0 C, de 1,2 g de 2-imino-9-trifluoro-
méthyl-5,6-dihydro-2H,4H-thiazolo[3,4,5-ef][1,5]benzothiazépine dans 20 ml
de dichlorométhane, on ajoute 0,92 g d'acide 3-chloroperbenzoïque (pureté
---,--.--.-._ __ _ _- ----
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
46
80%). Le mélange est agité pendant 1 heure 30 minutes à la même tempéra-
ture. Après chromatographie en éluant avec de l'acétate d'éthyle et traite-
ment par de l'acide méthanesulfonique, on obtient 0,88 g de méthanesulfo-
nate de 7-oxyde de 2-imino-9-trifluorométhyl-5,6-dihydro-2H,4H-thia-
zolo[3,4,5-ef][1,5]benzothiazépine sous forme d'un solide blanc fondant à
une température supérieure à 260 C [Analyse C12H13F3N204S3, % calculé
C: 35,82, H : 3,26, F: 14,16, N : 6,96, 0: 15,9, S : 23,9, % trouvé C: 35,7,
H : 3,3, F: 13,8, N : 6,9, S : 24,01.
EXEMPLE 15
On opère comme à l'exemple 4 mais à partir de 1 g de 2-imino-9-trifiuoromé-
thyl-5,6-dihydro-2H,4H-thiazolo[3,4,5-ef][1,5]benzothiazépine et de 2,2 g
d'acide 3-chloroperbenzoîque (pureté 80%) dans 20 ml de dichlorométhane.
On obtient ainsi 789 mg de méthanesulfonate de 6,6-dioxyde de 2-imino-9-
trifluorométhyl-5,6-dihydro-2H,4H-thiazolo[3,4,5-ef][1,5]benzothiazépine sous
forme d'une poudre blanche fondant à une température supérieure à 260 C.
[Analyse C12H13F3N205S3, % calculé C: 34,45 , H : 3,13, F 13,62,
N : 6,69, S : 22,99, % trouvé C : 34,16, H : 3,17, F : 13,56, N 6,75,
S : 23,23].
EXEMPLE 16
On opère comme à l'exemple 1 mais en utilisant 6,3 g de brome dans 20 ml
d'acide acétique, 9 g de trifluoroacétate de 8-trifluorométhyl-2,3,4,5-tétrahy-
dro-[1,5]benzothiazépine, 8,3 g de thiocyanate de potassium et 90 ml d'acide
acétique. Le produit obtenu (6,96 g) est chromatographié sous pression
d'azote (150 kPa) sur 90 g de gel de silice 20-45 m contenus dans une co-
lonne de 3 cm de diamètre, en éluant avec un mélange d'acétate d'éthyle et
de cyclohexane (50-50 en volumes). On dissout 4,4 g du produit obtenu (sur
5,7 g obtenus au total) dans 80 ml d'éthanol, auxquels on ajoute 1,5 ml
d'acide méthanesuifonique. On obtient ainsi 5 g de méthanesulfonate de
-,---r-- ----
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
47
2-imino-9-trifluorométhyl-5,6-dihydro-2H,4H-thiazolo[3,4,5-efl[1,5]benzothia-
zépine sous forme d'un solide blanc fondant à une température supérieure à
260 C [Analyse C12H13F3N203S3, % calculé C: 37,3, H : 3,39, F: 14,75,
N: 7,25, O: 12,42, S: 24,89, % trouvé C: 37,4, H : 3,0, F: 14,7, N : 7,3,
S : 25,31.
Le trifluoroacétate de 8-triffuorométhyl-2,3,4,5-tétrahydro-[1,5]benzothiazé-
pine peut être préparé de la manière suivante : à une solution de 13 g de
8-trifluorométhyl-2,3,4,5-tétrahydro-[1,5]benzothiazépine-5-carboxyiate de
tert-butyle dans 30 ml de dichlorométhane on ajoute une solution 15 ml
d'acide trifluoroacétique. Le mélange est agité 1 heure à une température
voisine de 20 C, puis concentré à sec sous pression réduite (2kPa). Le pro-
duit obtenu est dissous dans 60 ml d'acétate d'éthyle et la solution est lavée
par 100 ml d'eau distillée, séchée sur sulfate de magnésium et concentrée à
sec sous pression réduite (2kPa). Le produit obtenu (16,6 g) est chromato-
graphié sous pression d'azote (150 kPa) sur 160 g de gel de silice 20-45 m
contenus dans une colonne de 4 cm de diamètre, en éluant avec un mélange
de cyclohexane et d'acétate d'éthyle (75-25 en volumes). Le produit obtenu
est mis en suspension dans de l'éther de pétrole et séparé par filtration. On
obtient 9 g de trifluoroacétate de 8-trifluorométhyl-2,3,4,5-tétrahydro-
[1,5]benzothiazépine sous forme d'un solide orangé fondant à 60 C.
La 8-trifluorométhyl-2,3,4,5-tétrahydro-[1,5]benzothiazépine-5-carboxylate de
tert-butyle peut être préparée de la manière suivante : à une solution, main-
tenue à-70 C sous argon, de 20 g de 4-trifluorométhyl-phénylcarbamate de
tert-butyle dans 250 ml de tétrahydrofuranne anhydre, on ajoute, goutte à
goutte en 1 heure, 102 mi d'une solution 1,5 M de tert-butyllithium dans le
pentane. Le mélange est agité pendant 4 heures à-20 C, refroidi vers -60 C,
additionné de 2,5 g de soufre, puis agité pendant 45 minutes à-20 C. Le
mélange est refroidi vers -60 C, additionné de 15,6 g de 1-chloro-3-iodopro-
pane, puis agité pendant 16 heures à une température voisine de 20 C,
--~--- --. _.
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
48
chauffé pendant 7 heures au reflux, puis à une température voisine de 20 C
pendant 48 heures. Le mélange est hydrolysé avec 200 ml d'eau distillée et
extrait deux fois avec 180 ml au total d'acétate d'éthyle. Les extraits organi-
ques réunis sont séchés sur sulfate de magnésium et concentrés à sec sous
pression réduite (2kPa). Le produit obtenu est chromatographié sous pres-
sion d'azote (150 kPa) sur 450 g de gel de silice 20-45 pm contenus dans
une colonne de 6 cm de diamètre, en éluant avec un mélange de cyclo-
hexane et d'acétate d'éthyle (90-10 en volumes). On obtient ainsi 13 g de
8-trifluorométhyl-[1,5]benzothiazépine-5-carboxylate de tert-butyle sous
forme d'une huile jaune pâle [RMN Spectre'H dans DMSO-d6, T=300K, S en
ppm (300 MHz) : 1,50 (9H, s, (CH3)3), 1,95 (2H, m, CH2), 3,05 (2H, t, J=6Hz,
SCH2), 3,70 (2H, t, J=6Hz, CH2CI), 7,60 (1 H, dd, J=8 et 2 Hz, CH arom.),
7,75 (1 H, d, J=2Hz, CH arom.), 7,85 (1 H, d, J=8Hz, CH arom.), 8,60 (1 H, s,
NHCO)].
EXEMPLE 17
On opère comme à l'exemple 1 mais à partir de 0,660 g de brome dans 5 ml
d'acide acétique, 1 g de (R,S)-3-méthyl-7-trifluorométhyl-1,2,3,5-tétrahydro-
[4,1]benzothiazépine, 0,864 g de thiocyanate de potassium et 15 ml d'acide
acétique. Avant alcalinisation à l'ammoniaque, l'insoluble est éliminé par fil-
tration, rincé avec de l'acétate d'éthyle. Le produit obtenu est chromatogra-
phié sous pression d'azote (150 kPa) sur 40 g de gel de silice 20-45 m
contenus dans une colonne de 1,5 cm de diamètre, en éluant avec un mé-
lange d'acétate d'éthyle et de cyclohexane (50-50 en volumes). On dissout le
produit obtenu (730 mg) dans 10 ml d'éthanol, auxquels on ajoute 0,277 g
d'acide méthanesuifonique. Après 16 heures d'agitation à une température
voisine de 20 C, la solution est concentrée à sec sous pression réduite
(2 kPa). Le produit obtenu est trituré dans de l'acétone, filtré, rincé avec
de
l'acétone puis de l'éther isopropylique et séché 16 heures à l'air sous hotte
ventilée. On obtient ainsi 0,834 g de méthanesuifonate de (R,S)-2-imino-5-
--------
CA 02298974 2007-06-21
49
méthyl-9-trifluorométhyl-4,5-dihydro-2H,7H-thiazolo[3,4,5-de][4,1 ]benzothia-
zépine sous forme d'un solide blanc fondant à une température supérieure à
260 C [Analyse C13H15F3N203S3, % calculé C: 38,99, H : 3,78, F: 14,23,
N 7,00, O: 11,99, S : 24,02, % trouvé C : 39,05, H : 3,45, F : 13,94,
N 7,03, S : 24,37].
On dissout 425 mg de méthanesulfonate de (R,S)-2-imino-5-méthyl-9-trifluo-
rométhyl-4,5-dihydro-2H,7H-thiazolo[3,4,5-de][4,1]benzothiazépine dans un
~~élar e de 25 rnl d'ethanoI, 0,5 mi de triéthyiamine, et 200 ml de n-heptane
et on injecte sur 700 g de phase stationnaire CHIRALCEL*OJ (20 pm) conte-
nus dans une colonne de 60 mm de diamètre et de 400 mm de longueur, en
éluant avec un mélange de n-heptane/ isopropanol/ triéthylamine (90/10/0,1
en volumes) avec un débit de 90 ml/mn. On obtient 150 mg de (+)-2-imino-5-
méthyl-9-trifluorométhyl-4,5-dihydro-2H,7H-thiazolo[3,4,5-de][4,1 ]benzothia-
zépine sous forme d'un solide beige fondant à 102 C [([a]ô =+105,8 1,7
c=0,5% méthanol); Analyse C12H11 F3N2S2, % calculé C: 47,36, H: 3,64, F
: 18,73, N : 9,20, S: 21,07, % trouvé C: 47,59, H : 3,24, F: 18,44, N : 8,99,
S : 20,92] et 150 mg de (-)-2-imino-5-méthyl-9-trifluorométhyl-4,5-dihydro-
2H,7H-thiazolo[3,4,5-de][4,1]benzothiazépine sous forme d'un solide beige
fondant à 102 C [([a]p20= -103,1 1,6 c=0,5% méthanol); Analyse
C12H11 F3N2S2, % calculé C: 47,36, H: 3,64, F: 18,73, N :9,20, S: 21,07,
% trouvé C : 47,64, H : 3,24, F: 18,37, N : 8,97, S : 20,93].
La (R,S)-3-méthyl-7-trifluorométhyl-1,2,3,5-tétrahydro-[4,1 ]benzothiazépine
peut être préparée de la manière suivante : à une solution de 4,5 g de (R,S)-
3-méthyl-7-trifluorométhyl-1,2,3,5-tétrahydro-[4,1 ]benzothiazépin-2-one dans
120 ml de toluène on ajoute goutte à goutte 16,5 ml d'une solution 2 M du
complexe borane-diméthylsulfure dans le toluène et le tout est porté 1 heure
minutes au reflux. Après retour vers 20 C, le milieu est repris et agité
15 minutes avec une solution saturée de sodium hydrogénocarbonate puis
extrait deux fois avec de l'acétate d'éthyle. Les extraits organiques réunis
* (marque de commerce)
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
sont séchés sur sulfate de magnésium, filtrés et concentrés à sec sous
pression réduite (2 kPa). Le produit est chromatographié sous pression
d'azote (150 kPa) sur 55 g de gel de silice 20-45 pm contenus dans une
colonne de 2,5 cm de diamètre, en éluant avec un mélange de cyclohexane
5 et d'acétate d'éthyle (80-20 en volumes). On obtient ainsi 2,36 g de (R,S)-3-
méthyl-7-trifluorométhyl-1,2,3,5-tétrahydro-[4,1 lbenzothiazépine sous forme
d'une huile incolore qui cristallise sous forme de cristaux blancs fondant à
62 C.
La (R,S)-3-méthyl-7-trifluorométhyl-1,2,3,5-tétrahydro-[4,1 ]benzothiazépin-2-
10 one peut être préparée de la manière suivante : une solution de 13,6 g de
(R,S)-2-(2-amino-5-trifluorométhyl-benzylsulfanyi) propionate de méthyle, de
2 g d'acide toluènesuifonique-4 et de 200 ml de toluène est portée 48 heures
au reflux. Après retour à une température voisine de 20 C, on ajoute une
solution aqueuse saturée en sodium hydrogénocarbonate et on extrait deux
15 fois par de l'acétate d'éthyle. Les extraits organiques réunis sont séchés
sur
sulfate de magnésium, filtrés et concentrés à sec sous pression réduite
(2 kPa). Le produit obtenu est chromatographié sous pression d'azote
(150 kPa) sur 150 g de gel de silice 20-45 m contenus dans une colonne de
3,5 cm de diamètre, en éluant avec un mélange de cyclohexane et d'acétate
20 d'éthyle (50-50 en volumes) puis d'acétate d'éthyle pur. On obtient ainsi
4,5 g
de (R,S)-3-méthyl-7-trifluorométhyl-1,2,3,5-tétrahydro-[4,1 ]benzothiazépin-2-
one sous forme d'un solide beige fondant à 220 C.
Le (R,S)-2-(2-amino-5-trifluorométhyl-benzylsulfanyl) propionate de méthyle
peut être préparé de la manière suivante : à une solution de 17,3 g de (R,S)-
25 2-(2-tert-butoxycarbonylamino-5-trifluorométhyl-benzylsulfanyl) propionate
de
méthyle et de 200 ml de dichlorométhane, on ajoute en une fois 20 g d'acide
trifluoroacétique et on agite le tout 16 heures à une température voisine de
20 C. Après concentration à sec sous pression réduite (2 kPa) le résidu
d'évaporation est repris avec de l'acétate d'éthyle et une solution aqueuse
---r-,---- _-- .__
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
51
saturée en sodium hydrogénocarbonate. On réextrait une fois la phase alca-
line avec de l'acétate d'éthyle et les extraits organiques réunis sont séchés
sur sulfate de magnésium, filtrés et concentrés à sec sous pression réduite
(2 kPa). On obtient ainsi 13,6 g de (R,S)-2-(2-amino-5-trifluorométhyl-benzyl-
sulfanyl) propionate de méthyle sous forme d'une huile brune qui est utilisée
telle quelle.
Le (R,S)-2-(2-tert-butoxycarbonylamino-5-trifluorométhyl-benzylsulfanyl)
propionate de méthyle peut être préparé comme à l'exemple 10 mais à partir
de 15 g de 2-méthyl-4-trifluorométhyl-phénylcarbamate de tert-butyle dans
210 ml de tétrahydrofurane anhydre, 91 ml de solution de tert-butyllithium
1,5 M dans le pentane, 1,75 g de soufre et 11 g de (R,S)-2-bromo propionate
de méthyle. On obtient ainsi 17,3 g de (R,S)-2-(2-tert butoxycarbonylamino-
5-trifluorométhyl-benzylsulfanyl) propionate de méthyle sous forme d'une
huile jaune limpide qui est utilisée telle quelle.
EXEMPLE 18
On opère comme à l'exemple 1 mais à partir de 0,76 g de brome dans 6 ml
d'acide acétique, 1,3 g de (R,S)-3-carbamoyl-7-trifluorométhyl-1,2,3,5-tétra-
hydro-[4,llbenzothiazépine, 0,912 g de thiocyanate de potassium et 11 ml
d'acide acétique. Avant alcalinisation à l'ammoniaque, l'insoluble est éliminé
par filtration, rincé avec de l'acétate d'éthyle. Le produit obtenu est chroma-
tographié sous pression d'azote (150 kPa) sur 30 g de gel de silice 20-45 m
contenus dans une colonne de 2,5 cm de diamètre, en éluant avec un mé-
lange d'acétate d'éthyle et de cyclohexane (90-10 en volumes). Le produit
obtenu (560 mg) est recristallisé dans 5 ml d'acétonitrile et on isole ainsi
390 mg de (R,S)-5-carbamoyl-2-imino-9-trifluorométhyl-4,5-dihydro-2H,7H-
thiazolo[3,4,5-de][4,1]benzothiazépine sous forme d'un solide blanc fondant
vers 114 C [Analyse C12H10F3N3OS2, % calculé C : 43,43, H: 3,02,
--T---------
CA 02298974 2000-01-26
WO 99/05147 PCTIFR98/01638
52
F: 17,1, N : 12,61, O: 4,80, S: 19,24, % trouvé C : 42,83, H : 2,79,
F: 16,68, N: 12,3, S: 19,011.
La (R,S)-3-carbamoyi-7-trifluorométhyl-1,2,3,5-tétrahydro-[4,1]benzothiazé-
pine peut être préparée de la manière suivante : on dissout 3 g de (R,S)-7-
trifiuorométhyl-1,2,3,5-tétrahydro-[4,1]benzothiazépine-3-carboxylate de
méthyle dans 20 ml d'une solution environ 5,6 M d'ammoniac dans le
méthanol et on agite à une température voisine de 20 C pendant 16 heures.
Le milieu est concentré à sec sous pression réduite et l'extrait sec est
chromatographié sous pression d'azote (150 kPa) sur 35 g de gel de silice
20-45 m contenus dans une colonne de 2 cm de diamètre, en éluant avec
un mélange d'acétate d'éthyle et de cyclohexane (50-50 en volumes) puis
avec de l'acétate d'éthyle pur. On obtient ainsi 1,3 g(R,S)-3-carbamoyl-7-
trifluorométhyl-1,2,3,5-tëtrahydro-[4,1 ]benzothiazépine sous forme d'une
huile orange [RMN spectre'H dans DMSO-d6, T=300K, S en ppm (250 Mhz):
3,5 et 3,9 (1 H chacun, m, NCH2), 3,6 et 4,6 (1 H chacun, d, J-16Hz, SCH2),
3,6 (1 H, dd, J=4 et 12Hz, SCH), 6,4 (1 H, m, NH), 6,8 (1 H, d, J=7Hz, CH
arom.), 7,1 et 7,5 (1 H chacun, s, CONH2), 7,28 (1 H, d, J=7Hz, CH arom.),
7,32 (1 H, s, CH arom.)].
Le (R,S)-7-trifluorométhyl-1,2,3,5-tétrahydro-[4,1 ]benzothiazépine-3-carboxy-
late de méthyle peut être préparé de la manière suivante : on porte à envi-
rons 40 C un mélange de 4,7 g de 7-trifluorométhyl-1,5-dihydro-
[4,1]benzothiazépine-3-carboxylate de méthyle, de 15,55 g de magnésium en
tournures et de 150 ml de méthanol. Lorsque la réaction démarre, le bain est
retiré et la réaction entretient d'elle même le reflux. Après la fin du reflux
le
milieu est ramené à une température voisine de 0 C et on ajoute 270 mi
d'acide chlorhydrique 4 M. L'insoluble est éliminé par filtration, rincé avec
du
dichlorométhane et le filtrat est décanté. L'extrait organique est séché sur
du
sulfate de magnésium, filtré et concentré à sec sous pression réduite (2 kPa).
On obtient ainsi 3,07 g de (R,S)-7-triffuorométhyl-1,2,3,5-tétrahydro-
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
53
[4,1]benzothiazépine-3-carboxylate de méthyle sous forme d'une huile brune
[RMN spectre dans le DMSO-d6, T=300K, ô en ppm (250 Mhz): entre 3,6 et
4,1 (7H, m, NCH2+SCH+ 1h SCH2+OCH3), 4,4( 1 H, d, J=16Hz, lh SCH2), 6,5
(1 H, m, NH), 6,8 (1 H, d, J=7Hz, CH arom.), 7,28 (1 H, d, J=7Hz, CH arom.),
7,32 (1 H, s, CH arom.)].
Le 7-trifluorométhyl-1,5-dihydro-[4,1]benzothiazépine-3-carboxylate de mé-
thyle peut être préparé de la manière suivante : à une solution de 7,05 g de
3-d iméthylam ino-2-(2- tert-butoxycarbonylam ino-5-trifluorométhyl-benzylsu l-
fanyl) acrylate de méthyle et de 75 ml de dichlorométhane on ajoute lente-
ment 9,25 g d'acide trifluoroacétique et le tout est agité 24 heures à une
température voisine de 20 C. Le milieu est concentré à sec sous pression
réduite (2 kPa) et le résidu est repris par 100 ml d'une solution aqueuse satu-
rée en sodium hydrogénocarbonate et on extrait avec une fois 200 ml d'acé-
tate d'éthyle. L'extrait organique est séché sur du sulfate de magnésium,
filtré
et concentré à sec sous pression réduite (2 kPa). On obtient ainsi 6,1 g de
7-trifluorométhyl-1,5-dihydro-[4,1]benzothiazépine-3-carboxylate de méthyle
sous forme d'un solide orange fondant à 260 C.
Le 3-diméthylamino-2-(2-tert-butoxycarbonylamino-5-trifluorométhyl-benzyl-
sulfanyl) acrylate de méthyle peut être préparé de la manière suivante : à
une solution de 11,3 g de (2-tert-butoxycarbonylamino-5-trifluorométhyl-ben-
zylsulfanyl) acétate de méthyle et de 230 ml de diméthoxy-1,2-éthane anhy-
dre, on coule 15,6 g de tert butyloxy-bis-(diméthylamino) méthane. Le milieu
est porté 2 heures au reflux puis agité 48 heures à une température voisine
de 20 C. Le milieu est ensuite hydrolysé avec 150 ml d'une solution aqueuse
saturée en sodium hydrogénocarbonate et extrait par 200 ml d'acétate
d'éthyle. L'extrait organique est séché sur sulfate de magnésium, filtré et
concentré à sec sous pression réduite (2 kPa). Le résidu (12,1 g) est
chromatographié sous pression d'azote (150 kPa) sur 400 g de gel de silice
20-45 m contenus dans une colonne de 4,5 cm de diamètre, en éluant avec
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
54
avec un mélange de cyclohexane et d'acétate d'éthyle (80-20 en volumes).
On obtient ainsi 7,05 g de 3-diméthylamino-2-(2-tert-butoxycarbonylamino-5-
trifluorométhyl-benzylsulfanyl) acrylate de méthyle sous forme d'un solide
crème [RMN spectre'H dans DMSO-d6, T=300K, d en ppm (250 MHz): 1,50
(9H, s, (CH3)3), 2,95 (6H, s, N(CH3)z), 3,60 (3H, s, OCH3), 3,80 (2H, s,
SCH2),
7,30 (1 H, d, J=2Hz, CH arom.), 7,50 (1 H, dd, J=2 et 7Hz, CH arom.), 7,65
(1 H, s, CH ethylénique), 7,90 (1 H, d, J=7Hz, CH arom.), 8,90 (1 H, s, NH)].
EXEMPLE 19
On opère comme à l'exemple 1 mais à partir de 0,34 g de brome dans 3 ml
d'acide acétique, 0,55 g 3,3-diméthyl-7-trifluorométhyl-1,2-dihydro-5H-
[4,1]benzothiazépine, 0,45 g de thiocyanate de potassium et 10 ml d'acide
acétique. Le produit obtenu est chromatographié sous pression d'azote
(150 kPa) sur 40 g de gel de silice 20-45 pm contenus dans une colonne de
2,5 cm de diamètre, en éluant avec un mélange d'acétate d'éthyle et de cy-
clohexane (50-50 en volumes). On dissout le produit obtenu (610 mg) dans
10 ml d'éthanol, auxquels on ajoute 0,22 g d'acide méthanesuifonique. Après
16 heures d'agitation à une température voisine de 20 C, la solution est con-
centrée à sec sous pression réduite (2 kPa). Le produit obtenu est trituré
dans un mélange d'acétone et d'éther isopropylique(65-35 en volumes), filtré,
rincé avec de l'acétone puis de l'éther isopropylique et séché 16 heures à
l'air sous hotte ventilée. On obtient ainsi 0,595 g de méthanesulfonate de
5,5-diméthyl-2-imino-9-trifluorométhyl-2H,4H,7H-th iazolo[3,4,5-de][4,1 ]ben-
zothiazépine sous forme d'un solide blanc fondant à une température
supérieure à 260 C [Analyse C14H17F3N203S3, % calculé C 40,57,
H : 4,13, F 13,75, N : 6,76, O: 11,58, S : 23,21, % trouvé C 40,23,
H : 3,63, F: 13,46, N : 6,65, S : 23,61.
La 3,3-diméthyl-7-trifluorométhyl-1,2-dihydro-5H-[4,1]benzothiazépine peut
être préparée de la manière suivante : à une solution de 1,6 g de 3,3-dimé-
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
La 3,3-diméthyl-7-trifluorométhyl-1,2-dihydro-5H-[4,1]benzothiazépine peut
être préparée de la manière suivante : à une solution de 1,6 g de 3,3-dimé-
thyl-7-trifluorométhyl-1,5-dihydro-[4,1]benzothiazépin-2-one dans 80 ml de
toluène anhydre on ajoute goutte à goutte 7,3 ml d'une solution 2 M de com-
5 plexe borane-diméthylsulfure dans le toluène et le tout est porté 1 heure au
reflux. Après retour vers 20 C, le milieu est repris et agité 30 mn avec une
solution saturée de sodium hydrogénocarbonate puis extrait deux fois avec
de l'acétate d'éthyle. Les extraits organiques réunis sont séchés sur sulfate
de magnésium, filtrés et concentrés à sec sous pression réduite (2 kPa). Le
10 produit est chromatographié sous pression d'azote (150 kPa) sur 100 g de
gel de silice 20-45 pm contenus dans une colonne de 2,5 cm de diamètre, en
éluant avec un mélange de cyclohexane et d'acétate d'éthyle (80-20 en vo-
lumes). On obtient ainsi 0,55 g de 3,3-diméthyl-7-trifluorométhyl-1,2-dihydro-
5H-[4,llbenzothiazépine sous forme de cristaux blancs fondant à 142 C.
15 La 3,3-diméthyl-7-trifluorométhyl-1,5-dihydro-[4,11benzothiazépin-2-one
peut
être préparée de la manière suivante : on porte au reflux pendant 72 heures
une solution de 3,9 g d'acide 2-(2-amino-5-trifluorométhyl-benzylsulfanyl)-2-
méthyl propionique et 40 ml de xylène. Le milieu est ensuite concentré à sec
sous pression réduite (2 kPa) et le résidu est chromatographié sous pression
20 d'azote (150 kPa) sur 55 g de gel de silice 20-45 pm contenus dans une co-
lonne de 2,5 cm de diamètre, en éluant avec un mélange de cyclohexane et
d'acétate d'éthyle (75-25 en volumes). Le produit obtenu est repris et con-
crété avec de l'éther isopropylique et séparé par filtration puis rincé avec
de
l'éther isopropylique, séché sous pression réduite. On obtient ainsi 1,47 g de
25 3,3-diméthyl-7-trifluorométhy{-1,5-dihydro-[4,11benzothiazépin-2-one sous
forme d'un solide crème fondant à 210 C.
L'acide 2-(2-amino-5-trifluorométhyl-benzylsulfanyl)-2-méthyl propionique
peut être préparé de la manière suivante : on agite, à une température voi-
sine de 20 C pendant 5 jours, une solution de 2,55 g de 2-(2-amino-5-trifluo-
--,----~----
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
56
rométhyl-benzylsulfanyl)-2-méthyl propioniate de méthyle, 0,59 g de potas-
sium hydroxyde en pastilles (pureté 85%) et de 30 ml d'éthanol absolu. Le
milieu est ensuite acidifié par 18 ml d'une solution d'isopropanol chlorhy-
drique environ 5 M et le milieu est concentré à sec sous pression réduite
(2 kPa). Le résidu est repris par de l'acétate d'éthyle et l'insoluble est
éliminé
par filtration, rincé avec de l'acétate d'éthyle. Le filtrat est concentré à
sec
sous pression réduite (2 kPa) et le résidu obtenu est chromatographié sous
pression d'azote (150 kPa) sur 50 g de gel de silice 20-45 pm contenus dans
une colonne de 2 cm de diamètre, en éluant avec un mélange d'acétate
d'éthyle et de méthanol (95-5 en volumes). On isole un produit qui est repris
avec de l'éther de pétrole et le produit est séparé par filtration, rincé avec
de
l'éther de pétrole et séché. On obtient ainsi 2,2 g d'acide 2-(2-amino-5-
trifluo-
rométhyl-benzylsulfanyl)-2-méthyl propionique sous forme d'un solide crème
fondant à 113 C.
Le 2-(2-arnino-5-trifluorométhyl-benzylsulfanyl)-2-méthyl propioniate de mé-
thyle peut être préparé de la manière suivante : on agite, à une température
voisine de 20 C pendant 72 heures, une solution de 9,2 g 2-(2-tert-butoxy-
carbonylamino-5-trifluorométhyl-benzylsulfanyl)-2-méthyl propioniate de
méthyle, 10,3 g d'acide trifluoroacétique et de 100 ml de dichlorométhane. Le
milieu est concentré à sec sous pression réduite (2 kPa) et le résidu est re-
pris par 250 ml d'une solution aqueuse saturée en sodium hydrogénocarbo-
nate et extrait deux fois avec de l'acétate d'éthyle. Les extraits organiques
réunis sont séchés sur sulfate de magnésium, filtrés et concentrés à sec
sous pression réduite (2 kPa) pour fournir une huile qui est chromatogra-
phiée sous pression d'azote (150 kPa) sur 80 g de gel de silice 20-45 m
contenus dans une colonne de 3 cm de diamètre, en éluant avec un mélange
de cyclohexane et d'acétate d'éthyle (75-25 en volumes). On obtient ainsi 5 g
de 2-(2-amino-5-trifluorométhyl-benzylsulfanyl)-2-méthyl propioniate de mé-
thyle sous forme d'une huile jaune [RMN spectre 'H dans DMSO-d6,
CA 02298974 2000-01-26
WO 99105147 PCT/FR98/01638
57
T=300K, d en ppm (300 Mhz): 1,49 (6H, s, 2CH3), 3,6 (3H, s, OCH3), 3,8 (2H,
s, SCH2), 5,6 (2H, s, NHp), 6,75 (1 H, d, J=7Hz, CH arom.), 7,25 (1 H, d,
J=7Hz, CH arom.), 7,35 (1 H, s, CH arorn.)].
Le 2-(2-tert-butoxycarbonylamino-5-trifluorométhyl-benzylsulfanyl)-2-méthyl
propioniate de méthyle peut être préparé comme à l'exemple 10 mais à partir
de 15 g de 2-méthyl-4-trifluorométhyl-phénylcarbamate de tert-butyle dans
210 ml de tétrahydrofurane anhydre, 91 ml de solution de tert-butyllithium
1,5 M dans le pentane, 1,75 g de soufre et 11,9 g de 2-bromo-2-méthyl
propionate de méthyle. On obtient ainsi 9,2 g de 2-(2-tert-
butoxycarbonylamino-5-trifluorométhyl-benzylsulfanyl)-2-méthyl propionate
de méthyle sous forme d'une huile incolore [RMN spectre 'H dans DMSO-d6,
T=300K, d en ppm (250 Mhz): 1,56 (6H, s, 2 CH3), 1,57 (9H, s, (CH3)3), 3,6
(3H, s, OCH3), 4,0 (2H, s, SCH2), 7,65 (1 H, d, J=7Hz, CH arom.), 7,75 (2H,
m, 2CH arom.), 8,9 (1 H, s, NH)].
EXEMPLE 20
On prépare la (R,S)-5-hydroxyméthyl-2-imino-9-trifluorométhyl-4,5-dihydro-
2H,7H-thiazolo[3,4,5-de][4,1]benzothiazépine de la manière suivante : à une
solution de 2,5 g de (R,S)-2-imino-9-trifluorométhyl-4,5-dihydro-2H,7H-thia-
zolo[3,4,5-de][4,1]benzothiazépine-5-carboxyfate de méthyle dans 25 ml
d'éthanol absolu, maintenue sous argon, on ajoute 300 mg de sodium tétra-
hydruroborate et on porte le tout au reflux pendant 5 heures. Le milieu est
ensuite agité 16 heures à une température voisine de 20 C, puis hydrolysé
avec 50 ml d'eau distillée et extrait par 50 ml d'acétate d'éthyle. L'extrait
or-
ganique est séché sur sulfate de magnésium, filtré et concentré à sec sous
pression réduite (2 kPa). L'huile obtenue est chromatographiée sous pres-
sion d'azote (150 kPa) sur 30 g de gel de silice 20-45 pm contenus dans une
colonne de 2,5 cm de diamètre, en éluant avec un mélange de cyclohexane
et d'acétate d'éthyle (50-50 en volumes). Le solide obtenu est repris avec de
CA 02298974 2000-01-26
WO 99/05147 PCT/PR98/01638
58
l'éther isopropylique, séparé par filtration, séché sous pression réduite
(2 kPa). On obtient ainsi 40 mg de (R,S)-5-hydroxyméthyl-2-imino-9-
trifluorométhyl-4,5-dihydro-2H,7H-thiazolo[3,4,5-de][4,1 ]benzothiazépine,
sous forme d'un solide écru fondant à 167 C [Analyse C12H11 F3N20S2,
%calculé C : 44,99, H : 3,46, F : 17,79, N : 8,74, O: 4,99, S : 20,02,
% trouvé C: 44,41, H : 3,01, F: 16,84, N : 8,51, S: 20,41.
EXEMPLE 21
On opère comme à l'exemple 1 mais à partir de 1,66 g de brome dans 5 ml
d'acide acétique, 3 g (R,S)-7-trifluorométhyl-1,2,3,5-tétrahydro-[4,1 ]benzo-
thiazépine-3-carboxylate de méthyle, 2,2 g de thiocyanate de potassium et
30 ml d'acide acétique. Le produit obtenu est chromatographié sous pression
d'azote (150 kPa) sur 80 g de gel de silice 20-45 m contenus dans une
colonne de 3,5 cm de diamètre, en éluant avec un mélange d'acétate d'éthyle
et de cyclohexane (50-50 en volumes). On obtient ainsi 2,5 g de (R,S)-2-
imino-9-trifluorométhyl-4,5-dihydro-2H,7H-thiazolo[3,4,5-de][4,1 ]benzothia-
zépine-5-carboxylate de méthyle sous forme d'une huile.
EXEMPLE 22
On opère comme à l'exemple 1 mais à partir de 1,47 g de brome dans 5 ml
d'acide acétique, 2 g de 7-trifluorométhyl-1,2,3,5-tétrahydro-[4,1]benzoxa-
zépine, 3 g de thiocyanate de potassium et 50 ml d'acide acétique. Après
chromatographie sur gel de silice en éluant avec un mélange d'acétate
d'éthyle et de cyclohexane (50-50 en volumes) et traitement avec de l'acide
méthanesulfonique, on obtient 1,79 g de méthanesulfonate de 2-imino-9-
trifiuorométhyl-4,5-dihydro-2H,7H-thiazolo[3,4,5-de][4,1 ]benzoxazépine sous
forme d'un solide blanchétre fondant vers 258 C [Analyse
C12H13F3N204S2, % calculé C 38,92, H: 3,54, F 15,39, N: 7,56,
O: 17,28, S : 17,31, % trouvé C 38,67, H : 3,31, F 15,02, N : 7,69,
S : 17,47].
CA 02298974 2007-06-21 _
59
La 7-trifluorométhyl-1,2,3,5-tétrahydro-[4,1 ]benzoxazépine peut être
préparée de la manière suivante : à une suspension de 2,22 g de
7-trifluorométhyl-1,5-dihydro-3H-[4,1]benzoxazépin-2-one dans 100 ml de
toluène, on ajoute goutte à goutte, sous argon et à une température voisine
de 20 C, 15 ml d'une solution 2 N dans le tétrahydrofuranne du complexe
borane-méthylsulfure. Le milieu réactionnel est ensuite porté et maintenu à
l'ébullition pendant 1 heure 45 minutes. Après refroidissement vers 20 C, il
est hydrolysé avec 100 ml d'une solution saturée d'hydrogénocarbonate de
sodium, puis extrait par 2 fois 100 ml d'acétate d'éthyle. Les phases
organiques réunies sont séchées sur sulfate de magnésium, puis
concentrées au rotavapor*Après trituration du résidu dans l'éther de pétrole
on obtient 2 g de 7-trifluorométhyl-1,2,3,5-tétrahydro-[4,1 ]benzoxazépine
sous forme d'un solide jaunâtre fondant vers 85 C.
La 7-trifluorométhyl-1,5-dihydro-3H-[4,1 ]benzoxazépin-2-one peut être
préparée de la manière suivante : à une solution de 2,95 g de 2-chloro-N-(2-
hydroxyméthyl-4-trifluorométhylphényl)acétamide dans 330 mi de
tétrahydrofurane, on ajoute, sous argon et à une température voisine de 5 C,
2,9 g de t-butylate de potassium. Après 1 heure d'agitation à cette
température, le milieu réactionnel est hydrolysé par 30 ml d'une solution
saturée de chlorure d'ammonium, puis extrait par 150 ml d'acétate d'éthyle.
La phase organique est séchée sur sulfate de magnésium, puis concentrée
au rotavapor Après trituration du résidu dans un mélange d'éther éthylique
et d'éther de pétrole on obtient 2,2 g de 7-trifluorométhyl-1,5-dihydro-3H-
[4,1 ]benzoxazépin-2-one sous forme d'un solide blanc fondant vers 183 C.
Le 2-chloro-N-(2-hydroxyméthyl-4-trifluorométhylphényl)acétamide peut être
préparé de la manière suivante : à une solution de 5,54 g de 2-amino-5-
trifluorométhylphénylméthanol dans 100 ml de dichlorométhane et 6 ml de
triéthylamine, on ajoute, sous argon et à une température voisine de 5 C,
2,1 ml de chlorure de chloracétyle en solution dans 20 ml de
* (marques de commerce)
CA 02298974 2007-06-21
dichlorométhane. Le milieu réactionnel est agité 3 heures vers 5 C, puis
18 heures à température ambiante. Il est ensuite versé sur 100 ml d'une
solution saturée d'hydrogénocarbonate de sodium, puis extrait par 200 ml
d'éther éthylique. La phase organique est séchée sur sulfate de magnésium,
puis concentrée au rotavapor* Après chromatographie sur gel de silice en
éluant avec un mélange de cyclohexane et d'acétate d'éthyle (65-35 en
volumes) et trituration du résidu dans un mélange d'éther éthylique et d'éther
de pétrole, on obtient 4 g de 2-chloro-N-(2-hydroxyméthyl-4-
trifluorométhylphényl)acétamide sous forme d'un solide hlanchàtre fondant
10 vers 92 C.
Le 2-amino-5-trifluorométhylphénylméthanol peut être préparé de la manière
suivante : à une solution de 7,3 g d'acide 2-amino-5-trifluorométhylbenzoïque
dans 250 ml de tétrahydrofurane, on ajoute, sous argon et à une température
voisine de 5 C, 7,3 g d'hydruroborate de sodium, puis 24 ml de
chlorotriméthylsilane. Après 44 heures d'agitation à température ambiante, le
milieu réactionnel est refroidi vers 5 C, puis hydrolysé par 100 ml d'eau
distillée et extrait 2 fois par de l'éther éthylique (400 puis 150 ml). Les
phases organiques réunies sont lavées par 100 ml d'une solution 1 N
20 d'hydroxyde de sodium, puis séchées sur sulfate de magnésium et
concentrées au rotavapor* On obtient ainsi 7,9 g de 2-amino-5-
trifluorométhylphénylméthanol sous forme d'un solide blanc fondant à 70 C.
L'acide 2-amino-5-trifluorométhylbenzoïque peut être préparé selon la
méthode décrite par M. L. Carmellino et coll., Eur. J. Med. Chem. Chim.
Ther., 29 (10), 743 (1994).
Les médicaments ou les compositions pharmaceutiques comprennent en tant
que principes actifs selon l'invention un composé de formule (I) ou un sel
d'un
tel composé, à l'état pur ou sous forme d'une composition dans laquelle il est
30 associé à tout autre produit pharmaceutiquement compatible, pouvant être
inerte ou physiologiquement actif. Les médicaments
* (marques de commerce)
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
61
selon l'invention peuvent être employés par voie orale, parentérale, rectale
ou topique.
Comme compositions solides pour administration orale, peuvent être utilisés
des comprimés, des pilules, des poudres (capsules de gélatine, cachets) ou
des granulés. Dans ces compositions, le principe actif selon l'invention est
mélangé à un ou plusieurs diluants inertes, tels que amidon, cellulose, sac-
charose, lactose ou silice, sous courant d'argon. Ces compositions peuvent
également comprendre des substances autres que les diluants, par exemple
un ou plusieurs lubrifiants tels que le stéarate de magnésium ou le talc, un
colorant, un enrobage (dragées) ou un vernis.
Comme compositions liquides pour administration orale, on peut utiliser des
solutions, des suspensions, des émulsions, des sirops et des élixirs pharma-
ceutiquement acceptables contenant des diluants inertes tels que l'eau,
l'éthanol, le glycérol, les huiles végétales ou l'huile de paraffine. Ces com-
positions peuvent comprendre des substances autres que les diluants, par
exemple des produits mouillants, édulcorants, épaississants, aromatisants ou
stabilisants.
Les compositions stériles pour administration parentérale, peuvent être de
préférence des solutions aqueuses ou non aqueuses, des suspensions ou
des émulsions. Comme solvant ou véhicule, on peut employer l'eau, le pro-
pylèneglycol, un polyéthylèneglycol, des huiles végétales, en particulier
l'huile
d'olive, des esters organiques injectables, par exemple l'oléate d'éthyle ou
d'autres solvants organiques convenables. Ces compositions peuvent
également contenir des adjuvants, en particulier des agents mouillants, iso-
tonisants, émulsifiants, dispersants et stabilisants. La stérilisation peut se
faire de plusieurs façons, par exemple par fittration aseptisante, en incorpo-
rant à la composition des agents stérilisants, par irradiation ou par
chauffage.
Elles peuvent également être préparées sous forme de compositions solides
stériles qui peuvent être dissoutes au moment de l'emploi dans de l'eau
stérile ou tout autre milieu stérile injectable.
Les compositions pour administration rectale sont les suppositoires ou les
capsules rectales qui contiennent, outre le produit actif, des excipients tels
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
62
que le beurre de cacao, des glycérides semi-synthétiques ou des polyéthy-
lèneglycols.
Les compositions pour administration topique peuvent être par exemple des
crèmes, lotions, collyres, collutoires, gouttes nasales ou aérosols.
En thérapeutique humaine, les composés selon l'invention sont particulière-
ment utiles pour le traitement et/ou la prévention En thérapeutique humaine,
les composés selon l'invention sont particulièrement utiles pour le traitement
et/ou la prévention des convulsions et des maladies liées à la transmission
glutamatergique. Ils sont notamment utiles pour traiter et/ou prévenir toutes
les ischémies (telles l'ischémie focale ou globale) consécutives à des
accidents vasculaires cérébraux tels que le stroke thromboembolique et
hémorragique, un arrêt cardiaque, une hypotension artérielle, une
intervention chirurgicale cardiaque, vasculaire ou pulmonaire ou une
hypoglycémie sévére, dans le traitement des effets dus à une anoxie, qu'elle
soit périnatale ou consécutive à une noyade, une haute pression ou à des
lésions cérébro-spinales, pour traiter ou prévenir l'évolution de maladies
neurodégénératives, de la chorée d'HUNTINGTON, de la maladie
d'ALZHEIMER et autres démences, de la sclérose latérale amyotrophique ou
d'autres maladies du motoneurone, de l'atrophie olivo-pontocérébelleuse et
de la maladie de PARKINSON, vis-à-vis des manifestations épileptogènes
(épilepsie) et/ou convulsives, pour le traitement des traumatismes cérébraux
ou spinaux, des traumatismes liés à la dégénérescence de l'oreille interneou
de la rétine, du tinnitus, de l'anxiété, de la dépression, de la
schizophrénie,
du syndrome de TOURETTE, des encéphalopathies hépatiques, des troubles
du sommeil, des désordres du déficit attentionnel, des troubles des
conditions hormonales (excès de la sécrétion de HG ou HL, sécrétion de
corticostérone), en tant qu'analgésiques, antiinfiamrnatoires,
antianorexiques,
antimigraineux, antiémétiques et pour traiter les empoisonnements par des
neurotoxines ainsi que les troubles neurologiques associés aux maladies
virales telles que les méningites et encéphalites virales, le SIDA, la rage,
la
-~-------------
CA 02298974 2000-01-26
WO 99/05147 PCTIFR.98/01638
63
rougeole et le tétanos. Ces composés sont aussi utiles pour la prévention, la
tolérance et la dépendance des symptômes d'abstinence aux drogues, à
l'alcool et de l'inhibition de l'accoutumance et de la dépendance aux opiacés,
barbituriques, amphétamine et benzodiazépines. Ils peuvent également être
utilisés dans le traitement des déficits liés à des anomalies mitochondriales
telles que la myopathie mitochondriale, le syndrome de LEBER,
l'encéphalopathie de WERNICKE, le syndrome de RETT, l'homocystéinémie,
l'hyperprolinémie, l'hydroxybutirique-aminoacidurie, l'encéphalopathie
saturnine (intoxication chronique au plomb) et la déficience en suifite
oxydase.
Les doses dépendent de l'effet recherché, de la durée du traitement et de la
voie d'administration utilisée; elles sont généralement comprises entre 10 mg
et 100 mg par jour par voie orale pour un adulte avec des doses unitaires al-
lant de 5 mg à 50 mg de substance active.
D'une façon générale, le médecin déterminera la posologie appropriée en
fonction de l'âge, du poids et de tous les autres facteurs propres au sujet à
traiter.
Les exemples suivants illustrent des compositions selon l'invention :
EXEMPLE A
On prépare, selon la technique habituelle, des gélules dosées à 50 mg de
produit actif ayant la composition suivante :
- Composé de formule (I)
.............................................................. 50 mg
- Cellulose
...............................................................................
..... 18 mg
- Lactose
...............................................................................
....... 55 mg
- Silice colloidaie
.......................................................................... 1
mg
- Carboxyméthylamidon sodique
................................................. 10 mg
- Talc
...............................................................................
............. 10 mg
- Stéarate de magnésium
............................................................ 1 mg
EXEMPLE B
CA 02298974 2000-01-26
WO 99/05147 PCT/FR98/01638
64
On prépare selon la technique habituelle des comprimés dosés à 50 mg de
produit act'rf ayant la composition suivante :
- Composé de formule (I)
............................................................. 50 mg
- Lactose
...............................................................................
.......104 mg
- Cellulose
...............................................................................
..... 40 mg
- Po{yvidone
...............................................................................
.. 10 mg
- Carboxyméthylamidon sodique
................................................. 22 mg
- Talc
...............................................................................
............. 10 mg
- Stéarate de magnésium
............................................................ 2 mg
- Silice collo3daie
.......................................................................... 2
mg
- Mélange d'hydroxyméthylcellulose, glycérine, oxyde de
titane (72-3,5-24,5) q.s.p. 1 comprimé pelliculé terminé à 245 mg
EXEMPLE C
On prépare une solution injectable contenant 10 mg de produit actif ayant la
composition suivante :
- Composé de formule (I)
............................................................. 10 mg
- Acide benzoique
........................................................................ 80 mg
- Alcool benzylique
.......................................................................0,06 ml
- Benzoate de sodium
.................................................................. 80 mg
- Ethanol à 95 %
.......................................................................... 0,4
m1
- Hydroxyde de sodium
................................................................ 24 mg
- Propylène glycol
........................................................................ 1,6
ml
- Eau
...............................................................................
.q.s.p. 4 ml