Note: Descriptions are shown in the official language in which they were submitted.
CA 02299555 2000-02-02
1
COMPOSE CHIMIQUE COMPLEXE, SYNTHESE ET APPLICATIONS
DIVERSES DUDIT COMPOSE
La présente invention a pour objet un composé
chimique complexe, son procédé de synthèse ainsi que son
utilisation pour la synthèse de biopolymëres. Elle
concerne également l'utilisation des réactifs obtenus pour
entre autre l'amplification de détection et/ou de capture
de différentes cibles biologiques.
I1 est connu aujourd'hui d'utiliser des ligands,
par exemple des protéines, haptènes, peptides,
polypeptides, anticorps ou polynucléotides pour capturer
des molécules cibles ou anti-ligands (molécules
biologiques ou analogues), dans le but de détecter et/ou
de les doser, notamment dans la réalisation d'essais de
diagnostic.
On connaît la demande WO 91/08307 qui divulgue des
réactifs et un procédé pour amplifier la capture de
molécules cibles en utilisant des oligonucléotides
attachés de manière covalente à un polymère.
On connaît également la demande de brevet
FR2 707 010 qui divulgue des réactifs et un dispositif de
capture d'une molécule cible de type sandwich, comprenant
un support solide sur lequel est adsorbé un ligand, ledit
ligand étant constitué d'un conjugué résultant du couplage
covalent d'un polymère organique avec une pluralité de
biopolymères, ledit polymère organique étant un copolymère
de N-vinyl-pyrrolidone.
Le document EP-A-0 561 722 divulgue, dans un mode
d'exécution particulier, un composé chimique complexe, qui
comprend .
- un support solide, par exemple en polychlorure
de vinyle,
- des groupements chimiques surfaciques liés par
liaison covalence au support solide, appelés « agents de
fonctionnalisation complémentaire »,
FEUILLE MCDIFIEE
CA 02299555 2000-02-02
2
- un conjugué comprenant, d'une part un polymère
organique, à savoir un homopolymère ou copolymère modifié
d'anhydride maléfique, comportant des fonctions latérales
chimiques, appelées « agent de fonctionnalisation », liées
aux groupements surfaciques, et des restes chimiques
consistant en des fonctions anhydrides, et d'autre part
des molécules biologiques, par exemple des protéines
Ziées, par Liaison non covalence à un agent de
fonctionnalisation, par exemple haptène, ledit agent de
l0 fonctionnalisation étant lié par covalence aux fonctions
anhydride du polymère.
La demande de brevet WO 84/03053 divulgue un
support solide de type polysaccharides auquel est lié par
covalence un polymère de synthèse obtenu par
polymérisation de comonomères sur lequel est fixé
éventuellement par covalence un ou plusieurs ligands
d'affinité ou molécules biologiquement actives telles que
par exemple un inhibiteur, un cofacteur, un groupe
prosthétique, une enzyme, une hormone, un anticorps, un
acide nucléique.
La demande de brevet FR 2 605 237 divulgue un
support poreux, par exemple de silice, sur lequel est fixé
par adsorption un polymère dérivé de polyvinylimidazole
qui comporte des fonctions SH, et son utilisation pour
purifier ou séparer des protéines.
La demande de brevet EP 591 807 divulgue un
polymère sur lequel est greffé de manière covalente une ou
plusieurs molécules biologiquement actives de même nature.
Ces molécules peuvent être par exemple la biotine, la
digoxine, la digitoxigénine ou des oligonucléotides
comprenant de 1 à 80 unités nucléotidiques, de préférence
15 à 50, et en particulier 20 à 35.
La demande de brevet FR 2 019 083 divulgue un
système binaire polymère-enzyme soluble dans l'eau,
utilisé pour traiter par voie enzymatique des substrats,
de telle manière qu'après traitement, les produits de la
FEUILLE MCDIFIEE
CA 02299555 2000-02-02
3
réaction enzymatique soient séparés du produit
enzyme-polymère soluble par passage à travers une membrane
semi-perméable.
I1 est donc évident que ces polymères greffés à
plusieurs oligonucléotides présentent un grand intérêt
pour l'amplification dans les tests de détection.
Jusqu'à aujourd'hui, les ligands
oligonucléotides/polymères organiques sont obtenus par
greffage chimique par covalence, desdits oligonucléotides
l0 préalablement synthétisés, sur le polymère organique
réactif ou rendu réactif.
Ce greffage chimique constitue une étape délicate
à mettre en oeuvre en ce sens qu'elle ne permet pas
d'obtenir une orientation optimale des oligonucléotides et
qu'elle peut conduire à des composés agrégés dont
l'accessibilité des oligonucléotides est limitée
(Syntheses and Characterisation of Conjugates of Nucleic
Acid Probes and 6-Aminoglucose-based Polymers, Polymers
for Advanced Technologies, (1996) volume 8, pp.297-304).
La présente invention a donc pour objet un composé
chimique complexe susceptible de simplifier et d'améliorer
l'obtention des ligands selon l'art antérieur, tout en les
préservant.
Selon 1a présente invention, des biomonomères
amorceurs, éventuellement modifiés chimiquement, sont Liés
par covalence, d'un côté respectivement aux restes
chimiques dudit polymère organique, et de l'autre côté
chacun à un biopolymère.
Le composé chimique complexe selon l'invention,
pouvant constituer un réactif intermédiaire, permet de
synthétiser directement des ligands, liés quant à eux par
une liaison éventuellement clivable à un support solide.
Le clivage de la liaison polymère
organique/support solide restitue les biopolymères
synthétisés liés au polymère organique sous forme de
ligand. De préférence, la liaison des biomonomères
FEUI~! E '~~pCniFIFE
CA 02299555 2000-02-02
.:
. ... ..:
,~
.. ,
4
amorceurs au polymère organique n'est pas clivable dans
les conditions de clivage de la liaison polymêre
organique/support solide.
Les avantages de la présente invention sont
multiples puisqu'il est possible, après synthèse des
biopolymères, soit d'utiliser le composé selon l'invention
tel quel, soit de cliver les liaisons covalentes support
solide/polymère organique afin d'utiliser les ligands.
Dans le cas où on ne clive pas les liaisons covalentes, on
peut utiliser ce ligand pour l'amplification de détection
et de capture de molécules cibles ou d'autres
utilisations. L'avantage de ce type de ligand est que les
biopolymères du ligand sont orientés de manière correcte,
et ne présentent pas d'agrégats. Dans le cas ou l'on clive
la liaison covalente, on obtient des ligands utilisables
pour l'amplification de détection et de capture de
molécules cibles, lesdits ligands étant orientés de
manière correcte, et ne présentant pas d'agrégats. De
plus, ces différents ligands peuvent présenter des
biopolymères identiques ou différents, au moins de natures
mixtes, tels que oligonucléotides/peptides.
On entend par "support solide", tout matériau à
l'état natif relativement inerte, susceptible d'être
fonctionnalisé, sur lequel peut être lié un polymère
organique réactif tel que défini ci-dessous, et qui peut
être utilisé comme support dans des tests de détection, en
chromatographie d'affinité et dans des processus de
séparation. Des matériaux naturels, de synthèse, modifiés
ou non chimiquement, peuvent être utilisés comme support
solide, notamment les polysaccharides tels que les
matériaux à base de cellulose, par exemple du papier, des
dérivés de cellulose tels que l'acétate de cellulose et la
nitrocellulose, du dextran, des polymères tels que
polychlorure de vinyle, polyéthylène, polystyrène,
polyamide, ou copolymères à base de monomères vinyliques
et aromatiques, esters d'acides carboxyliques insaturés,
FEUILLE fviODIFIEE
CA 02299555 2000-02-02
~ ~ ..: ~...
chlorure de vinylidène, diènes ou composés présentant des
fonctions nitrile (acrylonitrile), des copolymères
chlorure de vinyle/propylène, ou chlorure de
vinyle/acétate de vinyle, des copolymères à base de
5 méthacrylate de glycidyle et d'éthylène diméthyl
méthacrylate, des copolymères à base de styrène ou de
dérivés substitués du styrène, des fibres naturelles
telles que le coton et des fibres synthétiques telles que
un polyamide, des matériaux inorganiques tels que la
silice, le verre, la céramique, le quartz, des latex,
c'est-à-dire des dispersions aqueuses colloïdales de
polymère insoluble dans l'eau, des particules magnétiques,
des dérivés métalliques.
Dans un mode de réalisation préféré selon
l'invention, le composé chimique complexe comprend en tant
que support solide fonctionnel, un support de type minéral
ou organique, de préférence encore de la silice activée ou
du polystyrène fonctionnalisé.
Le support solide peut être sans limitation sous
2o la forme d'une plaque de microtitration, d'une feuille,
d'un cône, d'un tube, d'un puits, de billes, de particules
ou analogues.
Par "fonctionnel", on entend la caractéristique
selon laquelle le support a été rendu chimiquement réactif
par toute méthode dite de "fonctionnalisation",
traditionnelle ou connue en soi par l'homme du métier, en
fonction de la nature chimique du support, et qui génère
lesdits groupements surfaciques.
Par "ligand", on entend un complexe formé d'un
polymère organique réactif couplé à une pluralité de
biopolymères, ledit ligand étant par exemple le composé
chimique complexe après synthèse des biopolymêres, avec ou
sans clivage de la liaison support solide/polymère
organique, ledit ligand étant susceptible de se lier à des
anti-ligands.
.''"'(JIL! ~ ';'nr.~~m~
J;, "-
CA 02299555 2000-02-02
.
~ ~. ...
6
Par "conjugué", on entend dans la présente
invention un polymère organique lié à une pluralité de
biomonomères amorceurs.
Par "biopolymères", on entend toutes molécules que
l'on peut synthétiser dans un synthétiseur automatique,
telles que enzymes, hormones, récepteurs, déterminants
antigéniques, anticorps, ADN, ARN, les peptides, les
glycopeptides, les oligosaccharides, et leurs dérivés et
analogues synthétiques.
Par "biomonomères", on entend toute unité de base
dont la polymérisation par addition de synthons conduit à
un biopolymère tels que défini précédemment ; notamment
des biomonomères chimiquement modifiés pour se lier au
polymère organique et jouer le rôle d'amorçage de la
polymérisation du biopolymère. On peut citer les acides
aminés, les nucléosides, les nucléotides, les saccharides,
et leurs dérivés ou analogues.
Par "synthon", on entend tout biomonomère
permettant la synthèse de biopolymères.
Par "liaison covalente clivable", on entend toute
liaison fixe chimiquement qui peut être clivée par une
réaction chimique, photochimique, thermique ou
enzymatique.
Dans un mode de réalisation préféré selon
l'invention, les biomonomères amorceurs, identiques ou
diffêrents, sont de type nucléotidiques et/ou peptidiques
et/ou saccharidiques. De préférence encore les
biomonomères sont de type nucléotidiques et peptidiques.
On entend par "polymère organique réactif", tout
polymère ou copolymère, naturel ou synthétique, avec un
squelette linéaire ou branché, statistique, alterné,
greffé ou séquencé, essentiellement carboné, portant une
fois activé des substituants permettant d'effectuer des
réactions covalentes avec le support solides et les
biomonomères amorceurs. De préférence, le polymère est un
copolymère. I1 porte les biopolymères en tant que
FEUILLE MODI~IEE
CA 02299555 2000-02-02
7
substituants latéraux liés au squelette polymère,
directement ou indirectement, par des liaisons covalentes,
grâce à des restes latéraux chimiques. I1 porte d'autres
substituants latéraux présents, identiques ou différents
des précédents, en tant que substituants latéraux liés au
support solide, directement ou indirectement, par des
liaisons covalentes clivables, grâce à des fonctions
latérales chimiques.
Les motifs de copolymères qui ne sont pas
impliqués dans l'établissement d'une liaison covalente
avec les biomonomères amorceurs ou le support solide
servent notamment à espacer, dans le copolymère, les
motifs portant les biomonomères amorceurs, et peuvent
ainsi servir à moduler, de façon connue, les propriétés du
copolymère, par exemple les propriétés de solubilité.
De préférence le polymère est un polymère portant
des fonctions réactives de type électrophile et/ou thiol
et/ou disulfure.
De préférence encore le polymère est un copolymère
linéaire d'anhydride maléfique tel que poly(anhydride
maléfique-a1t-méthyl vinyl éther), (anhydride maléfique-a1t
éthylène), (anhydride maléfique-a1t-stryrène) et (anhydride
maléfique-a1t-N-vinylpyrrolidone) et peut être aussi un
copolymère de (N-vinylpyrrolidone/N-acryloxysuccinimide).
Dans un mode de réalisation préféré selon
l'invention, le polymère ou copolymère organique réactif
selon l'invention a une masse moléculaire comprise entre
10000 et 1000000, de préférence encore entre 30000
et 70000.
Le copolymère provient par exemple de la
copolymérisation d'un monomère d'anhydride maléfique et
d'un deuxième monomère approprié par exemple le méthyl
vinyl éther, pour permettre l'établissement d'un couplage
covalent entre le copolymère et le support solide d'une
part, et le copolymère et les biomonomères amorceurs
d'autre part. Le monomère d'anhydride maléfique porte des
CA 02299555 2000-02-02
..
. . . ...
8
substituants carbonyles, qui peuvent réagir avec une
fonction hydroxyle du support solide pour former une
liaison covalente de type ester clivable dans des
conditions basiques prédéterminées, et pour d'autres
peuvent réagir avec une fonction amine primaire d'un
biomonomère amorceur pour former une liaison covalente de
type amide non clivable dans les conditions basiques
prédéterminées.
A titre d'exemple, le polymère organique réactif
est un copolymère linéaire d'anhydride maléfique-a1t-méthyl
vinyl éther.
Lorsque le support solide est lui-même un polymère
ou un copolymère, il doit étre entendu qu'il est dans ce
cas différent du polymère réactif, dans sa nature
chimique par exemple.
Le terme polymère organique "réactif" se rapporte
au fait que le polymère ou copolymère porte, avant ou
après activation , des substituants chimiques réactifs,
notamment de type électrophile et/ou thiol et/ou
disulfure. Ces substituants peuvent être par exemple les
groupements aldéhyde, époxy, halogénoalkyle, ester,
carbonyle, isocyanate, isothiocyanate, double liaison
carbone-carbone activée et maléimide, vinyl sulfone.
De manière générale, les termes "fonction
latérale", "groupement surfacique" et "reste latéral"
signifient fonction chimique réactive, permettant
d'effectuer toute liaison covalente, il s'agit par exemple
des radicaux électrophiles et/ou thiol et/ou disulfure
cités ci-dessus, ou tout autre groupement connu de l'homme
du métier, et choisi en fonction de la liaison covalente
recherchée.
On entend par "cibles" ou "molécules cibles" ou
"anti-ligands", toutes molécules susceptibles d'être liées
aux ligands par l'intermédiaire des biopolymères,
notamment les acides nucléiques tels qu'ADN ou ARN ou
leurs fragments, simples ou doubles brins, les antigènes,
CA 02299555 2000-02-02
._ ..
-: ,
... ...
.~
9
les haptènes, les peptides, les protéines, les
glycoprotéines, les hormones, les anticorps, les
oligosaccharides, les médicaments, leurs dérivés et
analogues synthétiques.
La réaction ligand /anti-ligand peut se faire de
manière directe ou indirecte.
Dans une réaction de type direct, le ligand est
spécifique de la molêcule cible. Le ligand est notamment
choisi pour être susceptible de former un duplex
l0 ligand/molécule cible. A titre d'exemple le duplex peut
notamment être représenté par tout couple
antigène/anticorps, anticorps/haptène, chélatant/molécule
chélatée, les hybrides polynucléotide/polynucléotide,
polynucléotide/acide nucléique, les hybrides
oligosaccharide/oligosaccharide, hormone/récepteur.
Dans une réaction de type indirect, le ligand est
capable de former un duplex avec un réactif bi-fonctionnel
comprenant un groupement "anti-ligand", responsable de la
formation du duplex avec le ligand, et dans lequel ledit
groupement anti-ligand est lié, notamment par covalence,
de façon connue, à un groupe partenaire de la cible. Le
groupe partenaire de la cible est un groupement capable de
se lier avec la cible (en formant un complexe
cible/partenaire) et est donc capable de capturer la
cible, dans des conditions de l'essai, par établissement
d'une liaison suffisamment forte pour assurer
l'interaction cible-partenaire, par exemple par covalence
et/ou par interactions ioniques et/ou par liaisons
hydrogènes et/ou par liaisons hydrophobes hydrophiles. Le
duplex ligand/anti-ligand peut être dans ce cas tout
couple mentionné ci-dessus pour la réaction de type
direct, ou encore un duplex biotine/streptavidine,
lectine/sucre ou analogues. En particulier le complexe
ligand/anti-ligand est un hybride
polynucléotide/polynucléotide. Le complexe
partenaire/cible est du méme type que le complexe
CA 02299555 2000-02-02
- ~.
_;
~ '. ~ ..:
ligand/cible mentionné ci-dessus pour la réaction de type
direct.
Un deuxième objet de l'invention est le procédé de
synthèse chimique d'un composé chimique complexe objet de
5 l'invention et tel que décrit ci-dessus, comprenant une
pluralité de biomonomëres, comprenant les étapes
suivantes .
a) on dispose d'un support fonctionnel comprenant
des groupements surfaciques ;
l0 b) on dispose d'au moins un polymère organique
réactif dont le squelette comporte d'une part des
fonctions latérales chimiques complémentaires des
groupements surfaciques du support solide, et d'autre part
des restes latéraux chimiques, ledit support solide étant
IS inerte vis-à-vis dudit polymère organique ;
c) on dispose de biomonomères amorceurs de
biopolymérisation, identiques ou différents, comprenant
d'un côté un substituant réactif et d'un autre côté un
groupement protecteur ;
d) on fait réagir au moins un polymère organique .
- soit avec le support solide, pour établir au
moins une liaison covalente entre un groupement surfacique
dudit support solide et une fonction latérale dudit
polymère organique, puis on fait réagir le polymère
organique lié au support solide avec une pluralité de
biomonomères amorceurs, pour greffer ces derniers par
covalence, directement ou indirectement, avec une
pluralité de restes latéraux dudit polymère organique ;
- soit avec une pluralité de biomonomëres
amorceurs, pour greffer ces derniers par covalence,
directement ou indirectement, avec une pluralité de
fonctions latérales dudit polymère organique, puis on fait
réagir le polymère organique lié aux biomonomères
amorceurs avec le support solide, pour établir au moins
une liaison covalente entre un groupement surfacique dudit
support solide et un reste dudit polymère organique.
CA 02299555 2000-02-02
~ _ ~ ..
_ v
. , '...
11
Le procédé de synthèse précédent s'effectue de
préférence en faisant réagir au moins un polymère
organique avec une pluralité de biomonomères amorceurs,
pour greffer ces derniers par covalence, directement ou
indirectement, avec une pluralité de restes latéraux dudit
polymère organique, puis on fait réagir le polymère
organique lié aux biomonomères amorceurs avec le support
solide, pour établir au moins une liaison covalente entre
un groupement surfacique dudit support solide et un reste
l0 dudit polymère organique.
Selon encore un autre mode de réalisation de
l'invention, le procédé comprend, après l'étape c et avant
l'étape d, l'étape .
c') on fait réagir le polymère organique avec un
réactif générateur de bras espaceurs, pour greffer sur une
pluralité de restes latéraux dudit polymère organique une
pluralité de bras espaceurs respectivement, comportant
chacun à leur extrémité libre une fonction réactive.
Par exemple, le bras espaceur peut être:
R-O-(CH2)n-NH2
dans lequel R est un groupement diméthoxytrityle,
tertiobutyldiméthysilyle ou un groupement photolabile.
Selon un autre mode préférentiel, le composé
chimique selon l'invention est caractérisé en ce que les
biomonomères amorceurs sont prolongés et polymérisés avec
des synthons, chacun selon une séquence prédéterminée pour
obtenir des biopolymères.
Selon un mode très préférentiel de l'invention, le
composé chimique selon l'invention est caractérisé en ce
que les biopolymères sont de type oligonucléotide, et/ou
peptide, et/ou oligonucléotide-peptide.
Selon un autre mode très préférentiel de
l'invention, le composé chimique est caractérisé en ce que
les biopolymères forment avec le polymère organique des
ligands susceptibles de se lier directement ou
indirectement à des anti-ligands.
CA 02299555 2000-02-02
.. ..
.>
.,. ~.
12
Un troisième objet de l'invention est
l'utilisation du composé chimique complexe selon
l'invention pour effectuer la synthèse des biopolymères,
comprenant les étapes de:
f) on dispose de synthons identiques ou
différents,
g) par cycles successifs de couplage/déprotection,
on fait croître les chaînes des biopolymères à partir des
biomonomères amorceurs respectivement, selon au moins une
même séquence prédéterminée de synthons.
Pour effectuer des synthèses de biopolymères
différents, que ce soit des
oligonucléotides/oligonucléotides ou peptides/peptides ou
lo oligonucléotides/peptides, l'homme du métier saura choisir
les biomonomëres amorceurs appropriés avec des groupements
protecteurs sensibles ou non aux réactions chimiques
effectuées. Ainsi, il est possible d'effectuer une
première synthèse d'un premier groupe de biopolymères tout
en gardant un deuxième groupe de biomonomères amorceurs
protégés, et ensuite d'effectuer une seconde synthèse de
biopolymères sur le deuxième groupe de biomonomères
amorceurs déprotégés.
Les avantages de la synthèse des biopolymères sur
le composé chimique complexe selon l'invention sont
multiples. Cette synthèse directement sur le polymère
réactif lié au support solide permet d'obtenir un
biopolymère bien défini et orienté de manière correcte
pour effectuer la détection et/ou la capture de molécules
cibles de nature identique. De plus, la synthèse permet
d'obtenir des biopolymères différents, tels que
oligonucléotides et peptides, sur le même polymère
réactif. I1 est également possible, par cette synthèse
facilitée, d'obtenir en plusieurs étapes des
dibiopolymères tels que oligonucléotides-peptides, pouvant
par exemple permettre de détecter dans un même échantillon
des matériels nucléiques et protéiques.
FEUILLE MOD!FIEE
CA 02299555 2000-02-02
13
Un quatrième objet de l'invention est le composé
complexe chimique obtenu par le procédé décrit
précédemment et son utilisation pour différentes
applications, notamment l'amplification de capture et/ou
de détection de cibles biologiques, sous différents
formats de bioessais (plaque de microtitrage,
chromatographie, bandes, etc.), le séquençage
d'oligonucléotides, la mutagénèse dirigée, en
thérapeutique et autres applications adaptées à
l'utilisation du composé chimique complexe selon
1 - 111VC111~1V11.
Dans la mesure où l'on ne clive pas les liaisons
covalentes liant le support aux polymères organiques, le
réactif obtenu peut être utilisé pour amplifier la capture
et la détection de cible biologiques.
Dans un mode de réalisation préféré selon
l'invention, on effectue la synthèse d'un composé chimique
complexe comprenant:
- un support solide fonctionnel comprenant des
groupements surfaciques chimiques,
- au moins un conjugué comprenant:
- un polymère organique réactif dont le squelette
comporte d'une part des fonctions latérales chimiques
réactives vis-à-vis des groupements surfaciques du support
solide liées â ces derniers par liaison covalente, et
d'autre part des restes latéraux chimiques,
- une pluralité de biomonomères amorceurs mixtes
branchés sur le polymère organique, liés respectivement
auxdits restes chimiques dudit polymère organique, par une
liaison covalente, caractérisé en ce que les biomonomères
amorceurs mixtes sont prolongés et polymérisés avec
d'autres synthons, chacun selon une séquence prédéterminée
desdits synthons pour obtenir des biopolymères mixtes,
tels que oligonucléotide et peptide.
Dans un autre mode de réalisation préféré selon
1 'invention, le composé chimique comprend des
FF_UILLE l',~0~!FIEE
CA 02299555 2000-02-02
~.
14
biopolymères de type oligonucléotide et peptide, ou
oligonucléotide-peptide.
Dans encore un autre mode de réalisation selon
l'invention, le composé chimique complexe comprend des
biopolymères formant avec le polymère organique auquel ils
sont liés des ligands susceptibles d'être liés directement
ou indirectement à des anti-ligands.
Dans la mesure où l'on clive les liaisons
covalentes liant le support aux polymères organiques, on
obtient des réactifs ou ligands, notamment des ligands
constitués d'un polymère organique lié à des biopolymères
de natures mixtes, par exemple peptides/oligonucléotides,
susceptibles d'être utilisés pour l'amplification de
capture et de détection de molécules cibles. Ces composés
complexes polymère/oligonucléotides/peptides peuvent
également être utilisés en thérapeutique. En effet, dans
la mesure ou l'oligonucléotide peut être un agent antisens
et le peptide être fusogène, on peut utiliser le composé
pour réguler l'expression génétique et optimiser
l'internalisation du complexe dans les cellules. S
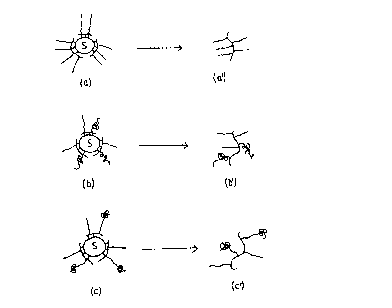
signifie "support" dans les figures 1 et 3. G signifie
"groupement photolabile" dans la figure 2.
Les figures qui sont jointes ont un but
d'illustration et ne limitent en rien l'étendue de la
protection de la présente invention.
La figure 1 représente différentes formes
possibles du composé chimique complexe selon 1 'invention,
et du ligand correspondant.
Figures 1(a) et 1(a') représentent ie composé
chimique complexe et le ligand correspondant dont les
biopolymères sont des oligonucléotides présentant la méme
séquence d'acides nucléiques.
Figures 1(b) et 1(b') représentent le composé
chimique complexe et le ligand correspondant dont les
biopolymères sont des oligonucléotides et des peptides.
-,' I~! i r_
'-~ L.:_ ~. . _~'I 'w
CA 02299555 2000-02-02
. .
...
Figures 1(c) et 1(c') représentent le composé
chimique complexe et le ligand correspondant dont les
biopolymères sont des oligonucléotides et des
oligonucléotide-peptides.
5 La figure 2 représente quatre exemples d'oligomère
amorceur.
Les radicaux R étant pour:
- le monomère I . diméthoxytrityle, ou
tertiobutyldiméthysilyle, ou un groupement photolabile,
l0 - le monomëre II . monométhoxytrityle,
fluorénylméthoxycarbonyle, t-Butoxycarbonyle, ou un
groupement photolabile,
La figure 3 représente le schéma général de
synthèse d'un composé chimique complexe selon l'exemple 1.
Exemple 1:
Synthèses d'oligonucléotides (séquence 26mer « HBV
Capture » et autres séquences utilisables pour le
diagnostic médical) sur un support poreux CPG 2000A
recouvert par le copolymère linéaire P(AMMVE) (Anhydride
Maléfique-a1t-Méthyl Vinyl Ether) (Masse moyenne en nombre
(Mn) 67000).
A) Matériels et procédés
On dispose de billes de silice Fluka (CPG,
controlled pore size glass) de diamêtre 2000A, de taille
de particules 40-85 ~~m et ayant une surface spécifique de
9,2 m2/g. Les billes de verre (100-150 ym) proviennent de
la société Polysciences, Inc.
Les spectres 1H-RMN ont été enregistrés sur un
spectromètre Bruker AM400 opérant dans un mode de
transformation de Fourier. Les déplacements chimiques 1H
ont été exprimés en ppm avec référence au TMS. Les
attributions des signaux 1H ont été effectuées par des
expériences RMN en deux dimensions 1H-1H en rapport
homonucléaire. Les analyses de masses ont été faites sur
__' ~!~ ~ ,sr~;c:,-
_i;~___ .. . _. .._
CA 02299555 2000-02-02
16
un spectromètre ZAB2-SEQ en FAB+, avec une matrice de
thio-glycérol.
Le polymère utilisé est un copolymère alterné
d'anhydride maléfique et de méthyl vinyl éther P(AMMVE)
fourni par Polysciences, Inc (Mn 67000g/mol).
Les synthèses d'oligodésoxyribonucléotides ont été
accomplies sur un appareil ABI 394 (Applied Biosystems,
San Francisco, USA) en utilisant la chimie standard de
synthèse ADN, du type cyanoéthyl N,N-diisopropylamino
phosphoramidite.
Des expériences SEC-MALLS ont été effectuées en
ligne avec le dispositif suivant de chromatographie haute
performance d'exclusion de taille. Deux colonnes associées
(Waters Ultra-Hydrogel 500 et 1000 ou Waters Ultra-
Hydrogel 1000 et 2000) et une pompe Waters 510 de
chromatographie liquide haute performance fonctionnaient
avec un tampon à base d'acide borique de pH 10, en tant
qu'éluant à une vitesse d'écoulement de 0,5 ml. min 1. Pour
la partie détection, on a utilisé en même temps un
détecteur d'absorbance Waters 484, un réfractomètre
différehtiel Waters 410 et un détecteur MINI DAWN F à
trois angles (WYATT Technology) fonctionnant à 690 nm.
B) Synthèse de la 3'-amino modifiée dT (5'-
Diméthoxytrityl-2'-déoxyThymidine,3'-(6-aminohéxyl)-
phosphate selon la formule (I) de la figure 2 (biomonomère
amorceur de polymérisation nucléotidique) ; cf. étape (B)
de la figure 3.
On a séché 200 mg (0,37 mmol) de 5'
diméthoxytrityl-2'-déoxy thymidine par coévaporations à
base de pyridine anhydre et d'acétonitrile anhydre, puis
on l'a ensuite dissoute dans 7,5 ml d'acétonitrile. On a
ajouté lentement de la 1H-tétrazole (0,55 mmol d'une
solution acétonitrile à 0,35M) et de la 6-
(trifluoroacétylamino)hexyl-(2-cyanoéthyl)-(N,N-
diisopropyl)-phophoramidite (0,44 mmol d'une solution
acétonitrile à 0,3M) par le septum et on a mélangé la
CA 02299555 2000-02-02
17
solution à température ambiante. Après une heure, on a
ajouté 4 ml d'une solution iodée (iode 100 mM dans H20 2%,
pyridine 20%, THF 75%) goutte à goutte en 5 mn et on a
agité le mélange pendant encore 10 mn avant de le
concentrer sous pression réduite. On a dissous le résidu
dans du CH2C12 et on a lavé le mélange organique une fois
avec du NaHC03 à 5%, deux fois à l'eau, séché sur Na2S04 et
évaporé jusqu'â l'état sec sous vide. Puis on a remis en
suspension le résidu dans une solution de 700 1 d' éthanol
et 6 ml (NHçOH à 30% aqueux) et on a réalisé la réaction
de déprotection en 16 h, à 60°C, dans un flacon
hermétique. Après concentration sous vide, on a soumis le
résidu à une chromatographie sur une colonne de gel de
silice dans (CH2CL2/TEA à 5%), avec élution par un gradient
de méthanol pour obtenir le composé (I) (rendement 46%).
1H RMN (DMSO-d6): 1,32 (m, 2H, C-CH2-C), 1,37-1,42 (m, 4H,
PO-CH2-CH2-CH2-C), 1,55 (t, 2H, C-CH2-CH2-NH2), 2,21-2,34
(m, 2H, H2'H2 "), 2,71 (t, 3H, C-CH2-NH2), 3,16-3,24 (m,
2H, H5'H5 "), 3,57 (t, 2H, PO-CH2-C), 3,71 (s, 6H, O-CH3),
4,07 (s, 1H, H4'), 4,-( (s, 1H, H3'), 6,16 (t, 1H, H1'),
7,21-7,36 (m, 13H, Har), 7,46 (s, 1H, H6), 7,8-8,6 (grand
pic, 2H, NH2). En spectrométrie de masse, la masse exacte
donnée par l'analyse est 724,3009 g/mol, ce qui correspond
à la masse calculée (724,2999 g/mol).
C) Fonctionnalisation des supports CPG ou des
billes de verre (support solide) ; cf. étape (C) de la
figure 3, le support solide étant référencé S.
On a adapté l'étape de fonctionnalisation à partir
d'une procédure antérieure publiée par Southern et Coll
(Maskos, U. and Southern, E.M. (1992) Nucleic Acids Res.,
20, 1679-1684). On a mis en suspension 3 g de CPG non
modifié et 5 g de bille de verre dans 6m1 d'une solution
d'acide chromique sulfurique (solution saturée en oxyde de
chrome (VI) dans de l'acide sulfurique â 95%) (Prolabo).
Après 3h d'activation à 110°C, la majorité des groupements
silane en surface étaient sous forme de groupements
CA 02299555 2000-02-02
18
silanol. On a filtré les supports et on les a lavés
minutieusement à l'eau. Après un lavage rapide avec de
l'acétone sèche, on a séché les supports sous vide pendant
une demi-heure et on les a immédiatement utilisés pour la
silanisation.
On a mis en suspension les billes activées dans
28 ml d'une solution (6,1 ml de 3-
glucidoxypropyltriméthoxysilane, 1,7 ml de triéthylamine,
20,2 ml de toluène sec). On a mélangé doucement les
lo supports toute la nuit à 90°C, puis on les a lavés
minutieusement avec de l'acétone anhydre et séchés 3h à
110°C.
Dans une deuxième étape, on a mis en suspension
les billes dans 10 ml d'hexaéthylène glycol avec 6 1
d'acide sulfurique (à plus de 95%). On a mélangé doucement
puis la réaction est effectuée toute la nuit à 90°C, puis
on a lavé les billes avec de l'acétone anhydre et séché
dans un dessicateur.
D) Procédure générale pour greffer le conjugué
P(AMMVE)-nucléotide (I)) sur les billes de silice ; cf.
étape (D) de la figure 3.
Le nucléotide amorceur de polymérisation
nucléotidique selon B) a été couplé sur les copolymères
P(AMMVE) suivant le principe réactionnel décrit dans la
figure 3.
15 mg (224 mmol) de copolymère ont été dissous
dans 1 ml de diméthylsulfoxyde anhydre (DMSO) à 37°C. En
parrallèle, 10 mg (13,8 mol) de (I) ont été dissous dans 1
ml du même solvant. On ajoute successivement à un volume
approprié de DMSO permettant un volume final de 1 ml pour
la réaction 20 nmol de copolymère, 2 mol de nucléotide (I)
et 1 mol de 4-diméthylaminopyridine (DMAP). Après avoir
remué à température ambiante pendant 1 heure, on ajoute 90
mg de billes de silice au mélange et on permet à la
réaction de greffage de s'effectuer toute la nuit. On
filtre ensuite les supports et on lave délicatement avec
CA 02299555 2000-02-02
19
du DMSO et de l' acétone anhydre avant de sécher sous vide
pendant plusieurs heures. La quantité de diméthoxytrityle
en surface a été estimée par un traitement acide de la
silice.
E) Synthèse oligonucléotidique ; Cf étape (E) de
la figure 3
La séquence choisie est une séquence de capture du
VHB (virus de l'hépatite B).
5'-TCA ATC TCG GGA ATC TCA ATG TTA GT-3'
l0 On a utilisé 0,1 mol ou 0,15 mol de support
fonctionnalisé pour la synthèse en utilisant un protocole
standard de cycle de couplage de 0,2 mol. Avant la
synthèse, on a expérimenté différents temps de blocage des
fonctions hydroxyles résiduelles du support solide
(capping). Au cours de la synthèse, on a déterminé de
manière automatique le rendement des étapes de la réaction
de couplage par des mesures de la quantité de cations de
type diméthoxytrityle relargée à chaque étape de
couplage/déprotection. On a appliqué différents
2o traitements basiques pour les étapes de clivage et de
déprotection. Après le dessalage (dans le cas de la
déprotection au NaOH) et concentration sous vide, les
distributions des masses molaires des conjugués
(copolymère-ODN) ont été analysés par SEC-MALLS. On
obtient des rendements par cycle de 98%.
Exemple 2:
Le même principe de synthèse que dans l'exemple 1
est mis en oeuvre mais en utilisant à titre de polymère
réactif organique d'autres copolymères d'anhydride
maléfique, tels que les copolymères (anhydride maléique-
alt-éthylène), (anhydride maléfique-alt-styrène),
(anhydride maléfique-alt-N-vinylpyrrolidone) ou des
P(AMMVE) d'une autre taille (MM10.000 à 1.000.000). 224
nmol de polymère ont été dissous dans 1 ml de DMSO anhydre
à 37°C. En parallèle, 10 mg (13,8 mol) du nucléotide (I) ,
FEUILLE MODIFIEE
CA 02299555 2000-02-02
modifié en 3' par un bras aminé, ont été dissous dans 1 ml
de DMSO. 20 nmol de copolymère, 2 mol de (I) et 1 mol de
diméthylaminopyridine (DMAP) - (solution à 10 mg/ml dans
du DMSO) sont mis en solution dans une quantité suffisante
5 de DMSO anhydride pour atteindre un volume f final de 1 ml .
La réaction est agitée à température ambiante pendant 1
heure, puis 90 mg de billes de silice CPG 2000A (Control
Pores Glass) ou 100 mg de billes de verre (Glass Beads)
fonctionnalisées par un espaceur hydroxyle sont ajoutées à
10 la solution. La réaction est poursuivie toute la nuit, à
température ambiante. Les supports sont alors filtrés et
lavés méticuleusement par du DMSO, de l'acétone anhydre
puis séchés sous vide en présence de chlorure de calcium.
Ces supports sont alors utilisés pour effectuer
15 des synthèses d'oligonucléotides comme décrit dans
l'exemple 1, une étape de capping de 11 minutes étant
nécessaire au préalable.
Exemple 3:
20 Même synthèse que dans l'exemple 2, en utilisant à
titre de polymëre organique réactif le copolymère linéaire
NVP-NAS (N-vinylpyrrolidone/N-acryloxy-succinimide) à la
place de P(AMMVE).
Exemple 4.
Même principe de synthêse que dans l'exemple 1, en
utilisant un support solide à base de polystyrène.
224 nmol de polymère ont été dissous dans 1 ml de
DMSO anhydre à 37°C. En parallèle, l0 mg (13,8 mol) du
nucléotide (I), modifié en 3' par un bras aminé, ont été
dissous dans 1 ml de DMSO. 20 nmol de copolymère, 2 mol de
(I) et 1 mol de diméthylaminopyridine (DMAP) - (solution à
10 mg/ml dans du DMSO) sont mis en solution dans une
quantité suffisante de DMSO anhydride pour atteindre un
volume final de 1 ml. La réaction est agitée à température
ambiante pendant 1 heure, puis 90 mg de particules à base
FEUILLE fVlODIFIEE
CA 02299555 2000-02-02
~ , " ~ ...
21
de polystyrène (résine de co-polystyrène-1%
divinylbenzène, classiquement appelée la résine de Wang)
fonctionnalisées par des extrémités 4-hydroxyméthyl-
phénoxyméthyles, ou 90 mg de particules de
co-polystyrène-divinylbenzène (support solide)
fonctionnalisées par des extrémités 4-hydroxyméthyl-
phénylacétamidométhyles (PAM résine), ou 90 mg de
particules d'un support composite à base de polyacrylamide
et d'une matrice inorganique (Kieselguhr),
l0 fonctionnalisées par des extrémités 4-hydroxyméthyl-
phénoxyacétyles (Novabiochem), ou 90 mg de particules d'un
support polystyrène fonctionnalisées par du polyéthylène
glycol terminé par une fonction hydroxyle ou p-oxybenzyl
alcool (Novabiochem), ou 90 mg de particules de toutes
résines à base de polystyrène fonctionnalisées par un bras
espaceur hydroxyle, sont ajoutés à la solution. La
réaction est agitée toute la nuit, à température ambiante.
Les supports sont alors filtrés et lavés méticuleusement
par du DMSO, de l'acétone anhydre, puis séchés sous vide
en présence de chlorure de calcium.
Ces supports sont alors utilisés pour effectuer
des synthèses d'oligonucléotides comme décrits dans
l'exemple 1, une étape de capping de 11 minutes étant
nécessaire au préalable.
Exemple 5:
Les supports à base de polystyrène sont
fonctionnalisés comme décrit précédemment avec P(AMMVE) et
le biomonomère de formule (I) selon la figure 2, et/ou le
monomère de formule (II) selon la figure 2, dans le but
d'amorcer une synthèse peptidique sur phase solide en
utilisant la chimie dite Fmoc.
Dans le cas des synthèses mixtes
oligonucléotides/peptides, les fragments d'acides
nucléiques seront synthétisés avant les peptides.
~~UILLE .'v?0~!~!E~
CA 02299555 2000-02-02
22
Exemple 6:
Des synthëses d'oligonucléotides ou de peptides
sont effectuées sur un support sphérique à base de silice
poreuse ou non poreuse, ou de polystyrène, fonctionnalisé
avec un copolymère linéaire d'anhydride maléfique relié au
support par un bras espaceur stable en milieu basique.
L'objectif est de ne pas décrocher le conjugué
(copolymère/biomolécules) après synthèse. Ces réactifs
pourront être utilisés pour la capture d'entités
l0 biologiques (fragments de gëne, antigène, anticorps)
directement à partir de milieux biologiques.
Le mode opératoire de la synthèse du support est
le même que celui décrit dans l'exemple 2 et dans
l'exemple 5, mais on utilise un support solide aminé et
non pas hydroxyle.
224 nmol de polymëre ont été dissous dans 1 ml de
DMSO anhydre à 37°C. En parallèle, 10 mg (13,8 mol) du
nucléotide (I), modifié en 3' par un bras aminé, ont été
dissous dans 1 ml de DMSO. 20 nmol de polymère, 2 mol de
(I) et 1 mol de diméthylaminopyridine (DMAP- solution à 10
mg/ml dans du DMSO) sont mis en solution dans une quantité
suffisante de DMSO anhydride pour atteindre un volume
final de lml. La réaction est agitée à température
ambiante pendant 1 heure, puis 90 mg de billes de silice
CPG 2000A (Control Pores Glass) ou 100 mg de billes de
verre (Glass Beads) ou 100 mg de billes de polystyrëne,
fonctionnalisées par un espaceur aminé sont ajoutées à la
solution. La réaction est poursuivie toute la nuit, à
température ambiante. Les supports sont alors filtrés et
lavés méticuleusement par du DMSO, de l'acétone anhydre
puis séchés sous vide en présence de Chlorure de Calcium.
Ces supports sont alors utilisés pour effectuer
des synthèses d'oligonucléotides comme décrits dans
l'exemple 1. Si le monomère (II), amorceur de synthèse
peptidique est couplé sur le polymère, des synthèses
__"i~L~ ~~,.w~=~~~
CA 02299555 2000-02-02
23
peptidiques peuvent ètre développées sur les supports, en
utilisant la chimie dite Fmoc.
Exemple 7:
Méme protocole de synthèse des supports sphériques
que dans l'exemple 1, ou dans l'exemple 6, en utilisant
des monomères amorceurs des synthèses oligonucléotidiques
de type (I), ou en utilisant des monomères amorceurs des
synthèses peptidiques de type (II) ou en utilisant des
l0 monomères amorceurs ayant la formule (III) selon la figure
2, ou ayant la formule (IV) selon la figure 3, possédant
un groupement (G) protecteur photolabile sur le site
d'initiation de la synthèse du biopolymère.
Le groupement photolabile (G) utilisé peut être
par exemple le 6-nitrovératryle, le 6-nitropipéronyle, le
méthyl-6-nitrovératryle, le nitrovératryloxycarbonyle, le
mêthyl-6-nitropipéronyle, le nitrobenzyle, le
nitrobenzyloxycarbonyle, le diméthyldiméthoxybenzyle, le
diméthyldiméthoxybenzyloxycarbonyle, le 5-bromo-7
nitroindolinyle, l'hydroxy-méthylcinnamoyle, le 2-
oxyméthylène anthraquinone, le pirénylméthoxycarbonyle.
L'amorce de la synthèse du biopolymère se fera par une
exposition du support à une gamme de longueur d'ondes
adaptée.
Exemple 8:
Même concept que dans l'exemple 7, en utilisant
des supports plans (wafer de silicium, micro plaque de
silice) silanisés en surface par un silane aminé, puis
recouverts par un polymère linéaire à base d'anhydride
maléfique. Les fonctions amines du bras espaceur vont
réagir avec les fonctions hydrophiles du polymère pour
créer une fonction amide stable en milieu basique. En
greffant sur le polymère le monomère (I) et/ou (II) et/ou
(III) et/ou (IV), des synthèses d'oligonucléotides et/ou
de peptides peuvent ètre amorcées d'une manière contrôlée.
FEUILLE MODIFIEE
CA 02299555 2000-02-02
24
Les plaques sont traitées au préalable en milieu acide ou
basique ou bien, si l'on utilise un système de masques
spécifiques, elles peuvent être exposées à des radiations
sur des zones délimitées de leur surface, afin d'éliminer
les groupements photolabiles. Les fonctions réactives
ainsi libérées, des synthèses de biopolymères peuvent être
développées en surface par les méthodes classiques de la
chimie sur support. Ces matrices fonctionnalisées peuvent
étre utilisées pour le séquençage de gènes ou le screening
lo d'anticorps.
FEUILLE MODIFlEE