Note: Descriptions are shown in the official language in which they were submitted.
CA 02325890 2000-11-10
1
Installation et procédé de dissolution électrolytique par oxydation
d'un métal.
L'invention concerne une installation de dissolution électrolytique par
oxydation d'un métal comprenant
- une cellule d'électrolyse dotée d'une anode soluble à base dudit métal à
dissoudre et d'une cathode insoluble sans membrane interposée,
- des moyens pour introduire dans ladite cellule du bain d'électrolyte à
enrichir en ions dudit métal oxydé et des moyens pour prélever de ladite
cellule
du bain enrichi en ions dudit métal oxydé, adaptés pour maintenir au moins
partiellement immergées ladite anode et ladite cathode dans ledit bain,
- des moyens pour faire circuler un courant électrique entre ladite anode
soluble et ladite cathode de manière à dissoudre dans ledit bain le métal de
ladite anode.
L'invention concerne également un procédé de production en continu de
solution d'un métal comprenant les étapes consistant à
- introduire, dans une cellule d'électro-dissolution dotée d'une anode
soluble à base dudit métal et d'une cathode insoluble sans membrane
interposée, du bain d'électrolyte à enrichir en ions dudit métal de manière à
maintenir au moins partiellement immergées ladite anode et ladite cathode,
- faire circuler un courant électrique d'électro-dissolution entre ladite
anode
soluble et ladite cathode de manière à dissoudre le métal dans ledit bain par
oxydation de ladite anode,
- prélever de ta cellule d'électro-dissolution du bain enrichi en ions dudit
métal constituant la solution dudit métal.
Les applications des installations et des procédés du type précités
concernent les métaux qui se dissolvent mal chimiquement ; une application
importante concerne l'enrichissement en ions stanneux (Sn2+) de solutions
usées d'électro-étamage ou la production de solutions d'électro-étamage à
partir d'électrolyte vierge.
Le document EP 0 550 002 décrit une installation et un procédé de ce
type, qui servent à alimenter en solution d'électro-étamage une cellule
d'électro-
déposition dotée d'une anode insoluble et d'un matériau à surface métallique
servant de cathode destiné à être revêtu d'étain ; la cellule d'électro-
dissolution
CA 02325890 2000-11-10
2
de l'installation de production de solution d'électro-étamage et la cellule
d'électro-déposition sont reliées en boucle fermée ou quasi-fermée de sorte
que
la solution d'électro-étamage enrichie est prélevée dans la cellule d'électro-
dissolution pour être amenée dans la cellule d'électro-déposition, et que, à
l'inverse, la solution d'électro-étamage à enrichir est prélevée dans la
cellule
d'électro-déposition pour être amenée dans la cellule d'électro-dissolution.
Pour éviter les inconvénients cités page 2, lignes 47 à 52 de ce document,
l'installation d'électro-dissolution ne comporte pas de membrane interposée
entre l'anode soluble et la cathode.
Selon le procédé décrit dans ce document, comme l'installation d'électro-
dissolution ne comporte pas de membrane, lorsque l'on fait circuler un courant
électrique d'électro-dissolution de ladite anode soluble vers ladite cathode,
une
partie de l'étain dissous à l'anode se dépose sur la cathode, ce qui nuit au
rendement global de dissolution de l'installation de production de solution
d'électro-étamage.
_ Selon une caractéristique essentielle du procédé d'électro-dissolution
décrit dans ce document, on contrôle la vitesse de dépôt d'étain sur la
cathode
à un niveau inférieur à la vitesse de dissolution d'étain à l'anode, en
renforçant
la réaction de production d'hydrogène sur cette cathode.
Selon la revendication 8 de ce document, un moyen pour renforcer la
réaction de production d'hydrogène sur cette cathode consiste à augmenter la
densité de courant au niveau de cette cathode, par exemple en diminuant la
surface de cette cathode en deçà de celle de l'anode soluble.
Selon ce document, cette installation et ce procédé permettent d'enrichir
des bains d'électrolyte très variés, comme par exemple des bains d'acide
sulfurique, des bains de ferrostannate, des bains de suifonate de méthane, des
bains de sulfonate de crésol, des bains d'halogénure, des bains de
fluosilicates,
et des bains de fluoborate.
Comme indiqué à la page 4, lignes 46 à 50 de ce document, au niveau de
l'anode, il est préférable de maintenir une densité de courant inférieure à la
densité de courant critique à laquelle commence à se former de l'oxygène, ce
qui permet d'éviter ou, à tout le moins, de limiter la formation de boues
d'oxyde
d'étain (Sn0).
CA 02325890 2000-11-10
3
Comme indiqué à la page 4, lignes 50 à 52 de ce document, le rendement
d'électro-dissolution est d'autant meilleur que la température du bain est
élevée
et que le bain est agité et homogène en composition.
L'invention a pour but d'améliorer sensiblement les rendements
d'électrodéposition des procédés et des installations du type précité.
A cet effet, l'invention a pour objet une installation de dissolution
électrolytique par oxydation d'un métal comprenant
- une cellule d'électrolyse dotée d'une anode soluble à base dudit métal à
dissoudre et d'une cathode insoluble sans membrane interposée,
- des moyens pour introduire dans ladite cellule du bain d'électrolyte à
enrichir en ions dudit métal oxydé et des moyens pour prélever dans ladite
cellule du bain enrichi en ions dudit métal oxydé, adaptés pour maintenir au
moins partiellement immergées ladite anode et ladite cathode dans lédit bain,
- des moyens pour faire circuler un courant électrique entre ladite anode
soluble et ladite cathode de maniëre à dissoudre dans ledit bain le métal de
ladite anode,
caractérisée en ce qu'elle comprend des moyens pour maintenir un
gradient de densité de bain dans ladite cellule adapté pour que, si D1 est la
densité du bain au voisinage de la cathode et si D2 est !a densité du bain au
voisinage de la partie la plus active de l'anode, D2 > D1 et (D2 - D1) z 100
gll.
Ces moyens pour maintenir un gradient de densité de bain ne sauraient
donc comprendre une membrane.
Dans le cas où la température du bain est approximativement homogène
dans la cellule, cette différence de densité correspond essentiellement à une
différence de concentration en ions du métal oxydé ; de préférence, si C1 est
la
concentration en ions de ce métal au voisinage de la cathode et si C2 est la
concentration en ions de ce métal au voisinage de (a partie la plus active
d'anode, C1 « 10 000 x C2 ; de préférence, C1 reste inférieur au seuil de
concentration au delà duquel un dépôt dudit métal se forme sur la cathode.
On définit « la partie la plus active d'anode » comme celle regroupant les
points de l'anode où les densités de courant sont les plus élevées et
représentent 90% du courant circulant entre anode et cathode ; cette précision
est importante dans le cas où l'anode est formée de granules dudit métal et où
CA 02325890 2000-11-10
4
seule une partie des granules immergés concourt directement à
l'électrodissolution.
Grâce à la séparation densitométrique, le métal dissous ne se redépose
pas (ou peu) sur la cathode et le rendement global de dissolution est amélioré
;
l'avantage principal de l'invention est que, comme la concentration en ions
métalliques reste faible au voisinage de la cathode, on évite ou du moins on
limite le dépôt de métal sur la cathode, ce qui améliore le rendement global
d'électro-dissolution de l'installation.
L'invention peut également présenter une ou plusieurs des
caractéristiques suivantes
~ les moyens pour maintenir ledit gradient de densité comprennent la
disposition de la cathode dans le bain à un niveau situé au dessus du
niveau moyen de la partie la plus active d'anode, la différence de niveau
entre celui de la cathode et celui de la partie la plus active d'anode étant
adaptée pour maintenir ledit gradient de densité.
Dans cette configuration, le dégagement d'hydrogène ne perturbe pas la
zone de bain comprise entre l'anode et la cathode, ce qui facilite le maintien
dudit gradient de densité.
~ les moyens pour maintenir ledit gradient de densité comprennent des
moyens pour maintenir un gradient de température dans ie bain adapté pour
que, si T1 est la température du bain au voisinage de la cathode et si T2 est
la température du bain au voisinage~de la partie la plus active de l'anode, T1
> T2 et la différence (T1 - T2) est adaptée pour maintenir ledit gradient de
densité ; de préférence, (T1 - T2) > 15°C. .
On renforce ainsi par des moyens thermiques le gradient de densité de
bain ; de préfërence, ces moyens comprennent des moyens de refroidissement
du bain au voisinage de la partie la plus active d'anode.
~ les moyens pour maintenir ledit gradient de densité comprennent
- la disposition des moyens d'introduction de bain à enrichir adaptée pour
introduire le bain au dessus du niveau de la cathode dans ladite cellule
d'électrodissolution,
- la disposition des moyens de prélèvement de bain enrichi adaptée pour
prélever le bain en dessous du niveau de la partie la plus active d'anode.
CA 02325890 2000-11-10
Ces dispositions concourent également au maintien du gradient de densité
de bain dans la cellule ; le bain à enrichir peut être du bain « usagé »
faiblement
concentré en métal oxydé et/ou du bain « neuf » ne contenant pas de métal
oxydé.
5 ~ ladite cellule comprend un compartiment cathodique séparé du reste du bain
par une cloison qui traverse la surface du bain et s'étend en profondeur
jusqu'au niveau de la cathode.
L'avantage est alors que le dégagement d'hydrogène est canalisé dans ce
compartiment et ne perturbe pas l'ensemble du bain, ce qui permet de
maintenir au mieux le gradient de densité.
~ les moyens d'introduction de bain à enrichir sont adaptés pour introduire du
bain « neuf » ne contenant pas d'ions du métal oxydé dans le compartiment
cathodique.
On entend par bain « neuf » ne contenant pas d'ions du métal oxydé, de
l'électrolyte « vierge » dans lequel aucune addition d'ions du métal oxydé n'a
été effectuée. _
Comme on introduit alors au voisinage de la cathode du bain ne contenant
pas d'ions métalliques, la concentration en ions métalliques au voisinage de
la
cathode est quasiment nulle, ce qui diminue d'autant le dépôt de métal sur la
cathode et améliore le rendement global d'électro-dissolution de
l'installation.
~ ladite cellule comprend au moins un compartiment anodique séparé du reste
du bain par une cloison qui traverse la surface du bain et s'étend en
profondeur jusqu'au dessus du niveau de la partie la plus active d'anode.
~ les moyens d'introduction de bain à enrichir sont adaptés pour introduire du
bain dans le compartiment anodique.
Dans cette configuration, l'introduction de bain ne perturbe pas la zone de
bain comprise entre l'anode et la cathode, ce qui facilite le maintien dudit
gradient de densité.
~ ladite anode est essentiellement formée de granules dudit métal.
Avantages : facilité de remplacement, grande surface de contact avec
l'électrolyte entraînant un abaissement de la densité de courant, ce qui
diminue
les risques de dégagement d'oxygène et de formation de boues.
CA 02325890 2000-11-10
6
L'invention a également pour objet un procédé de production de solution
d'un métal comprenant les étapes consistant à
- introduire, dans une cellule d'éiectro-dissolution dotée d'une anode
soluble à base dudit métal et d'une cathode insoluble sans membrane
interposée, du bain d'électrolyte à enrichir en ions dudit métal de manière à
maintenir au moins partiellement immergées ladite anode et ladite cathode,
- faire circuler un courant électrique d'électro-dissolution entre ladite
anode
soluble et ladite cathode de manière à dissoudre le métal dans ledit bain par
oxydation de ladite anode,
- prélever dans la cellule d'électro-dissolution du bain enrichi en ions dudit
métal constituant la solution dudit métal,
caractérisé en ce que, pendant ces étapes, on maintient dans le bain un
gradient de densité adapté pour que, si D1 est la densité du bain au voisinage
de la cathode et si D2 est la densité du bain du bain au voisinage de la
partie la
plus active de l'anode, D2 > D1 et (D2 - D1 ) _> 100 g/I.
L'invention peut également présenter une ou plusieurs des
caractéristiques suivantes
~ pendant ces étapes, on maintient dans le bain un gradient de température
adapté pour que, si T1 est la température du bain au voisinage de la
cathode et si T2 est la température du bain du bain au voisinage de la partie
la plus active de l'anode, T1 > T2 et la différence (T1 - T2) est adaptée pour
maintenir ledit gradient de densité ; de préférence, (T1 - T2) > 15°C.
~ pour mettre en ceuvre le procédé,
- on introduit le bain à enrichir au dessus du niveau de la cathode dans
ladite cellule d'électrodissolution,
- on prélève le bain enrichi en dessous du niveau de la partie active
d'anode,
- et, les débits d'introduction et de prélèvement étant approximativement
égaux pour maintenir un niveau approximativement constant de bain dans
ladite cellule et définissant le débit de renouvellement de bain,
ledit débit de renouvellement est adapté pour maintenir ledit gradient de
densité.
CA 02325890 2000-11-10
7
On prend alors en compte la différence entre la concentration en ions
métalliques dans le bain enrichi (sortant) et celle dans le bain à enrichir
(entrant).
~ ledit métal est à base d'étain.
~ ledit bain est choisi dans le groupe comprenant les bains à base d'alcanes
sulfoniques, d'aryl sulfonique, d'acide sulfonique, d'acide sulfurique, les
bains d'halogénure, les bains de fluosilicates, et les bains de fluoborate.
L'invention sera mieux comprise à la lecture de la description qui va
suivre, donnée à titre d'exemple non limitatif, et en référence aux figures
annexées sur lesquelles
- la figure 1 est un schéma de principe d'une installation de dissolution
électrolytique selon l'invention, sans membrane et sans agitation de
l'électrolyte, où la cathode est disposée au dessus de l'anode.
- la figure 2 représente un mode particulier de réalisation d'une installation
de dissolution électrolytique selon l'invention, avec deux _ compartiments
anodiques et un compartiment cathodique central.
- les figures 3 et 4 sont respectivement un schéma en coupe transversale
et un schéma en perspective d'un autre mode de réalisation d'une installation
de dissolution électrolytique selon l'invention, avec un compartiment anodique
latéral et un compartiment cathodique sur le côté opposé.
A titre d'exemple non limitatif, on va décrire l'invention dans la cas de son
application pour l'enrichissement en ions stanneux {Sn2+) de solutions usées
d'électro-étamage.
L'installation de dissolution électrolytique d'étain comprend une cellule 1
d'électrolyse dotée d'une anode soluble 2 d'étain et d'une cathode insoluble 3
;
aucune membrane n'est interposée entre l'anode 2 et la cathode 3 ; la cathode
3 est en matériau conducteur choisi de manière adaptée pour résister à
l'électrolyte et pour présenter une surtension de dégagement d'hydrogène aussi
faible que possible ; d'une manière classique, on prend ici une cathode en
acier
inoxydable.
Comme indiqué sur la figure 1, la cathode 3 est disposée dans la cellule
au dessus de l'anode 2.
CA 02325890 2000-11-10
ô
L'installation comporte une conduite de prélèvement de bain enrichi
débouchant dans le fond de la cellule, au niveau ou en dessous de l'anode (non
représentée sur la figure 1 ) ; de préférence, comme illustré aux figures 2 à
4, le
fond de la cellule présente une forme conique évasée vers le haut débouchant
vers le bas, au sommet du cône, dans la conduite de prélèvement de bain
enrichi.
L'installation comporte au moins une conduite d'introduction de bain à
enrichir ou d'électrolyte vierge débouchant dans la cellule au niveau ou au
dessus de la cathode (non représentée sur la figure 1 ).
L'installation comprend des moyens classiques 4 pour faire circuler un
courant électrique continu entre l'anode soluble 2 et la cathode 3, adaptés
pour
dissoudre l'étain de l'anode 2 en évitant sinon en limitant le dégagement
d'oxygène.
L'installation comprend des moyens pour réguler la température de la
cathode de manière à limiter son échauffement.
De préférence, l'installation comprend des moyens 5 pour refroidir le bain
au voisinage de l'anode à une température T2 inférieure à la température T1 du
bain au voisinage de la cathode ; sur la figure 1, ces moyens correspondent à
une double cuve contenant un liquide de refroidissement dans laquelle le fond
de la cellule 1 est plongé.
On va maintenant décrire la mise en ceuvre du procédé selon l'invention à
partir d'un bain d'électro-étamage à enrichir en ions stanneux Sn2+ .
Par la conduite d'introduction de bain, on introduit du bain d'électro-
étamage à enrichir en ions stanneux dans la cellule 1 jusqu'à immerger la
cathode 3.
A l'aide des moyens 4 pour faire circuler un courant électrique, on fait
passer un courant électrique continu entre anode 2 et cathode 3 de manière à
dissoudre l'étain de l'anode tout en évitant de dégager de l'oxygène à l'anode
;
ainsi, il convient que la densité de courant reste, en tout point de l'anode,
inférieure à la densité de courant limite (J1;~,.) au delà de laquelle, dans
les
conditions d'électro-dissolution, on commencerait à dégager de l'oxygène ; ces
conditions d'électro-dissolution comprennent notamment la concentration en
Sn2+, la température au voisinage de l'anode, et la composition du bain.
CA 02325890 2000-11-10
9
En maintenant la densité de courant en deçà de {J1;~.), on évite
- le dégagement d'oxygène qui perturberait le bain, l'agiterait au point
d'empêcher la formation du gradient de densité propre à l'invention,
- la formation de boues ,par réaction de l'oxygène naissant sur l'étain de
l'anode.
Le passage du courant provoque donc la formation d'ions Sn2+ au
voisinage de l'anode et le dégagement d'hydrogène à la cathode.
Par la conduite de prélèvement de bain, on prélève alors en continu du
bain au voisinage de l'anode (voir flèche pointant vers le bas partant du fond
de
cellule sur les figures 2 et 3) ; à cause de la formation des ions Sn2+, le
bain
prélevé est donc enrichi en ions Sn2+ de manière à être apte à servir
d'électrolyte pour une opération d'électro-étamage classique.
Par la conduite d'introduction de bain, on introduit en continu du bain
d'électro-étamage ou de l'électrolyte vierge à enrichir en ions stanneux dans
la
cellule à un débit correspondant approximativement à celui du débit de
prélèvement, de manière à maintenir le niveau du bain constant dans la cellule
1.
De préférence, à l'aide des moyens pour réguler la température de la
cathode et des moyens 5 pour refroidir le bain au voisinage de l'anode, on
maintient dans le bain un gradient de température adapté pour que, si T1 est
la
température du bain au voisinage de la cathode et si T2 est la température du
bain du bain au voisinage de la partie la plus active de l'anode, T1 > T2 ; de
préférence, T1-T2 > 15°C.
Ainsi, en régime permanent, comme le bain n'est pas agité dans la cellule
contrairement aux bains de l'art antérieur tels que décrits dans EP 550 002
déjà
cité, et comme la cathode est disposée au dessus de l'anode, comme le bain
pauvre en Sn2+ est introduit par le haut de la cellule alors que le bain
enrichi en
Sn2+ est prélevé par le bas, la concentration en ions Sn2+ reste plus élevée
au
niveau de l'anode 2 que de la cathode 3, et la densité du bain reste plus
élevée
au niveau de l'anode 2 qu'au niveau de la cathode 3.
Avantageusement, le gradient de température accentue encore ce
gradient de densité, puisque la température du bain est plus élevée au niveau
de la cathode (T1 ) que de l'anode (T2).
CA 02325890 2000-11-10
A titre indicatif, la concentration en ions Sn2+ au voisinage de l'anode 2
peuvent ëtre les suivantes
- dans un bain à base d'acide phénolsulfonique : 150 g/l ;
- dans un bain à base d'acide méthane sulfonique : 200 g/l ;
5 - dans un bain à base d'acide sulfonique : 100 gll ;
Selon l'invention, les conditions de fonctionnement de la cellule portant
notamment sur la distance verticale séparant l'anode de la cathode, sur les
débits de prélèvement et d'introduction de bain, sur le gradient de
température,
sont adaptées d'une manière connue en elle-même pour que la concentration
10 en ions Sn2+ au voisinage de la cathode 3 soit au moins 10 000 fois plus
faible
qu'au voisinage de l'anode.
Ainsi, il convient que la concentration en ions Sn2+ au voisinage de la
cathode reste inférieure à 10-Z g/l, de préférence de l'ordre de 10-6 g/l.
Comme la concentration en ions métalliques reste faible au voisinage de
la cathode 3, on évite ou du moins on limite le dépôt de métal sur la cathode,
ce
qui améliore le rendement global d'électro-dissolution du métal.
Ainsi, l'invention réside essentiellement dans l'établissement et le maintien
d'un gradient de concentration en ions métalliques entre la cathode et
l'anode,
à l'aide, notamment, des moyens suivants, utilisés seuls ou en combinaison
- disposition de la cathode dans le bain à un niveau situé au dessus du
niveau de la partie la plus active de l'anode ; la distance verticale entre
ces
deux niveaux doit être adaptée pour obtenir le gradient de concentration
requis
dans les conditions d'utilisation de l'installation.
- maintien et établissement d'un gradient de température (T1-T2) suffisant
pour le maintien du gradient de concentration, compte tenu de la distance
verticale entre l'anode et la cathode.
- prélèvement du bain enrichi par le fond de la cellule et introduction du
bain à enrichir par le haut de la cellule ; on adapte alors le débit de
renouvellement pour maintenir le gradient de concentration au dessus de la
valeur minimum requise, en prenant en compte la différence entre la
concentration en ions métalliques du bain prélevé et celle du bain introduit
(qui
peut ëtre de l'électrolyte vierge).
CA 02325890 2000-11-10
11
Selon une première variante de l'invention, on introduit dans la cellule à la
fois du bain « neuf » ne contenant pas d'ions métalliques Sn2+ (« électrolyte
vierge ») et du bain « usagé » appauvri en ions Sn2+, et on prévoit alors deux
conduites différentes d'introduction de bain, de maniëre à
- introduire le bain « neuf » au niveau ou au dessus de la cathode comme
précédemment, spécifiquement au voisinage immédiat de la cathode 3,
- introduire le bain « usagé » à un niveau intermédiaire du bain situé entre
la cathode et l'anode ; de préférence, sur ce niveau intermédiaire, on choisit
un
point éloigné de la cathode.
Selon cette première variante, comme on introduit au voisinage de la
cathode du bain ne contenant pas d'ions métalliques, la concentration en ions
métalliques au voisinage de la cathode est encore plus faible et quasiment
nulle, ce qui diminue d'autant le dépôt de métal sur la cathode et améliore
encore le rendement global d'électro-dissolution.
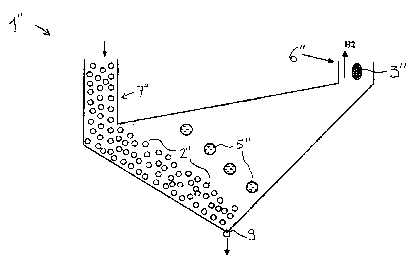
Une deuxième variante de l'invention est illustrée sur les figures 2 à 4
- la cellule 1', 1" comprend un compartiment cathodique 6', 6" séparé du
reste du bain par une cloison qui traverse la surface du bain et s'étend en
profondeur jusqu'au niveau de la cathode 3', 3" ; grâce à cette disposition,
le
dégagement d'hydrogène H2 (voir flèche vers le haut) est canalisé dans ce
compartiment et ne perturbe pas le gradient de densité dans la partie active
du
bain dans la cellule.
- la cellule comprend au moins un compartiment anodique 7'A, 7'B ; 7"
séparé du reste du bain par une cloison qui traverse la surface du bain et
s'étend en profondeur jusqu'au dessus du niveau de ia partie active de l'anode
2', 2" ; grâce à cette disposition, on peut amener le bain à enrichir par le
compartiment anodique (flèche vers le bas à l'entrée du compartiment 7" de la
figure 3) sans perturber le gradient de densité dans la partie active du bain
dans
la cellule.
Dans le cas où la cellule comprend à la fois un compartiment cathodique
et un compartiment anodique, et où l'on a à introduire dans la cellule à la
fois du
bain « neuf » ne contenant pas d'ions métalliques Sn2+ et du bain « usagé »
appauvri en ions Sn2+, on introduit alors le bain « neuf » dans le
compartiment
CA 02325890 2000-11-10
12
cathodique 6', 6" et le bain « usagé » dans le compartiment anodique 7'A, 7'B,
7"
Selon une autre variante de l'invention dans le cas où l'on prévoit au
moins un compartiment anodique 7'A, 7'B, 7", on utilise pour l'anode 2', 2"
des
granules d'étain, comme représenté sur les figures 2 et 3 ; au fur et à mesure
de la dissolution, on recomplète alors avantageusement en étain en versant les
granules dans le compartiment anodique ; cette forme d'anode en granules
apporte, outre la facilité de remplacement, une grande surface de contact avec
l'électrolyte, ce qui entraîne un abaissement de la densité de courant et
diminue
les risques de dégagement d'oxygène et de formation de boues.
Selon cette variante, le fond de la cellule est alors garni d'une grille 8' de
rétention des granules, pour éviter leur entraînement dans le bain prélevé.
Les exemples suivants illustrent l'invention.
Exemple 1
Les figures 3 et 4 représentent une cellule d'électro-dissolution utilisée,
selon l'invention, pour la dissolution d'étain ; l'anode 2" est formée de
granules
d'étain ; la cathode 3" est creuse pour permettre une circulation d'eau de
refroidissement ; il n'y a aucun diaphragme entre l'anode et la cathode.
Les dimensions de la cellule sont (figure 4) : hauteur h = 20 cm entre
niveau de la surface du bain et le fond de cellule ; largeur I = 30 cm,
profondeur
p = 40 cm ; en fonctionnement, la cellule contient alors 8 litres de bain.
La cellule présente un fond conique, le sommet du cône 9 correspondant
au point de prélèvement de bain ; au dessus du point de prélèvement, on
dispose une grille (non représentée) de maille adaptée pour empêcher
l'entraînement des granules d'étain de l'anode 2".
La cellule comporte un compartiment anodique latéral 7" dont la cloison
s'étend vers le bas jusqu'à q = 12 cm en dessous de la surface du bain.
La cellule comporte un compartiment cathodique latéral opposé 6" dont la
cloison s'étend vers le bas jusqu'immédiatement en dessous du niveau de la
cathode 3".
CA 02325890 2000-11-10
13
Les moyens de refroidissement du bain à proximité de la surface active 2"
de l'anode sont formés par des tuyaux 5" traversant le bain, refroidis par
circulation de liquide réfrigérant.
On fait fonctionner la cellule dans les conditions suivantes
- nature, composition du bain introduit dans la cellule : acide
phénolsulfonique dilué 2 fois ;
- débit de renouvellement de bain : 1,25 litres par heure ;
- intensité du courant d'électrodissolution : 80 A ;
- température du bain au niveau de la cathode : T1 = 70°C.
- température du bain au niveau de l'anode : T2 = 35°C.
- aucune agitation du bain.
On constate alors que
- la concentration en ions stanneux dans le bain prélevé à 1,25 litres par
heure est de 125 g/l ;
- le rendement d'électrodissolution est de 100 %.
Si C"1 est la concentration en ions Sn2+ au voisinage de la cathode et si
C"2 est la concentration en ions Sn2+ au voisinage de la partie la plus active
d'anode, il convient, en l'absence de différence de température (T1-T2), que
C"1 « 10 000 x C"2, ce qui permet d'empécher tout dépôt d'étain sur la
cathode.
En l'absence de différence de température, si D"°1 est la densité
(g/l) du
bain au voisinage de la cathode et si D"°2 est la densité (g/l) du bain
stanneux
au voisinage de la partie la plus active de l'anode, on aurait
- D"°1 - (concentration C"1 exprimée en g/l + densité de l'acide
phénolsulfonique dilué : 1160 gll ) ~ densité de l'acide phénolsulfonique
dilué =
1160 g/l ; cette approximation est possible car, selon l'invention, C"1 est
très
faible.
- D"°2 - (concentration C"2 exprimée en g/l + densité de l'acide
phénolsulfonique dilué : 1160 g/1 ).
On a donc : (D"°2 - D"°1 ) ~ (concentration C"2 exprimée en
g/l) = 125 gll.
En pratique, l'invention est applicable dès que (D"2 - D"1 ) >_ 100 gll
environ, que la différence de densité provienne de la différence de
CA 02325890 2000-11-10
14
concentration en ions Sn2+ ou, également comme c'est le cas ici, de la
différence de température (T1 - T2).
Exemple comparatif 1
Pour illustrer les résultats de l'invention, on fait fonctionner la même
cellule
dans les mêmes conditions que dans l'exemple 1, à la différence près que l'on
agite vigoureusement le bain de manière à maintenir le même niveau de
concentration en ions stanneux et le même niveau de température dans tout le
bain, contrairement à l'invention.
La température du bain au niveau de la cathode est alors identique à la
température du bain au niveau de l'anode : 50°C.
On constate alors que
- la concentration en ions stanneux dans le bain prélevé à 1,25 litres par
heure est de seulement 15 g/1 ;
- le rendement global d'électrodissolution est de 15% environ.