Note: Descriptions are shown in the official language in which they were submitted.
CA 02335724 2000-12-13
WO 99/65917 PGT/FR99/01422
Utilisation de diazépines pour la préparation de médicaments destinés à
traiter
les états pathologiques ou les maladies dans lesquels un des récepteurs
de la somatostatine est impliqué
La présente invention concerne l'utilisation de pyrido-thiéno-triazolo-
diazépines pour la
préparation d'un médicament destiné à traiter les états pathologiques ou les
maladies dans
lesquels un (ou plusieurs) des récepteurs de la somatostatine est (sont)
impliqué(s). L'invention
concerne également des nouvelles pyrido-thiéno-triazolo-diazépines et des
compositions
thérapeutiques les contenant.
La somatostatine (SST) est un tétradécapeptide cyclique qui a été isolé pour
la première fois de
(hypothalamus en tant que substance inhibitrice de (hormone de croissance
(Brazeau P. et al.,
Science 1973, 179, 77-79). Elle intervient également en tant que
neurotransmetteur dans le
cerveau (Reisine T. et al., Neuroscience 1995, 67, 777-790 ; Reisine et al.,
Endocrinology
1995, 16:427-442). Le cl8nage moléculaire a permis de montrer que la
bioactivité de la
somatostatine dépend directement d'une famille de cinq récepteurs.
Parmi les désordres pathologiques associés à la somatostatine (Moreau J.P. et
al., Life
Sciences, 1987, 40, 419 ; Harris A.G. et al., The European Journal of
Medicine, 1993, 2,
97-105), on peut citer par exemple : (acromégalie, les adénomes hypophysaires,
la maladie de
Cushing, les gonadotrophinomes et les prolactinomes, les effets secondaires
cataboliques des
glucocorticoïdes, le diabëte insulinodépendant,. la rétinopathie diabétique,
la néphropathie
diabétique, l'hyperthyroïdie, le gigantisme, les tumeurs
gastroentéropancréatiques
endocriniennes dont le syndrome carcinoïde, le VIPome, finsulinome, la
nésidioblastose,
l'hyperinsulinémie, le glucagonome, le gastrinome et le syndrome de Zollinger-
Ellison, le
GRFome ainsi que le saignement aigu des varices oesophagiennes, le reflux
gastrooesophagien,
le reflux gastroduodénal, la pancréatite, les fistules entérocutanées et
pancréatiques mais aussi
les diarrhées, les diarrhées réfractaires du syndrome d'immunodépression
acquise, la diarrhée
chronique sécrétoire, la diarrhée associée avec le syndrome de l'intestin
irrité, troubles liés au
peptide libérateur de gastrine, les pathologies secondaires aux greffes
intestinales,
l'hypertension portale ainsi que les hémorragies des varices chez des malades
avec cirrhose,
l'hémorragie gastro-intestinale, l'hémorragie de l'ulcère gastroduodénale, la
maladie de Crohn,
les scléroses systémiques, le dumping syndrome, le syndrome du petit intestin,
l'hypotension,
la sclérodermie et le carcinome thyroïdien médullaire, les maladies liées à
fhyperprolifération
cellulaire comme les cancers et plus particulièrement le cancer du sein, le
cancer de la prostate, le
cancer thyroïdien ainsi que le cancer pancréatique et le cancer colorectal,
les fibroses et plus
particulièrement la fibrose du rein, la fibrose du foie, la fibrose du poumon,
la fibrose de la
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99I01422
-2-
peau, également la fibrose du système nerveux central ainsi que celle du nez
et la fibrose induite
par la chimiothérapie, et d'autres domaines thérapeutiques comme, par exemple,
les céphalées y
compris les céphalées associées aux tumeurs hypophysaires, les douleurs, les
accès de panique,
la chimiothérapie, la cicatrisation des plaies, l'insuffisance reinale
résultant d'un retard de
croissance, l'obésité et retard de croissance lié à l'obésité, le retard de
croissance utérin , la
dysplasie du squelette, le syndrome de Noonan, le syndrome d' apnée du
sommeil, la maladie de
Graves, la maladie polykystiques des ovaires, les pseudokystes pancréatiques
et ascites, la
leucémie, le méningiome; la cachexie cancéreuse, l'inhibition des H pylori, le
psoriasis ainsi que
la maladie d'Alzheimer. On peut également citer (ostéoporose.
Dans le brevet FR 2645153, la déposante a décrit des diazépines qui
présentaient une activité
anti-PAF. La déposante a trouvé que ces produits et des produits apparentés de
ces composés
présentaient une affinité et une sélectivité pour les récepteurs de la
somatostatine. Comme la
somatostatine et ses analogues peptidiques ont souvent une mauvaise
biodisponibilité par voie
orale et une faible sélectivité (Robinson, C., Drags of the Future, 1994, 19,
992 ; Reubi, J.C. et
al., TIPS, 1995, 16, 110) ces composés, agonistes ou antagonistes non-
peptidiques de la
somatostatine, peuvent être avantageusement utilisés pour traiter les états
pathologiques ou les
maladies tels que présentés ci-dessus et dans lesquels un (ou plusieurs) des
récepteurs de la
somatostadne est(sont) impliqué(s). De manière préférentielle, ces composés
peuvent être
utilisés pour le traitement de l'acromégalie, des adénomes hypophysaires ou
les tumeurs
gastroentéropancréatiques endocriniennes dont le syndrome carcinoïde.
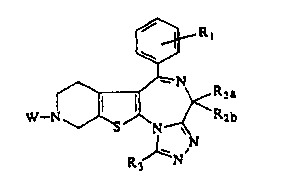
L'invention a ainsi pour objet l'utilisation d'un composé de formule générale
I
a
W- b
R ~N~
3 I
danslaquelle
W représente (atome d'hydrogène ou un radical de formule R-X-C(~- ;
R représente un radical aryle ou hétéroaryle, les radicaux aryle et
hétéroaryle étant
éventuellement substitués ;
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/0142Z
-3-
X représente un radical de formule -(CH2)n-Z dans laquelle Z représente une
liaison
covalente,.NH, O ou S et n un entier de 0 à 2 ;
Y représente O ou S ;
R~ représente un ou plusieurs groupes, identiques ou différents, choisis parmi
: l'atome
d'hydrogène, le radical hydroxy, halo, un radical alkyle inférieur, alkoxy
inférieur ;
R2a et R2b représentent, indépendamment, l'atome d'hydrogène un radical alkyle
inférieur, alkényle inférieur ou alkynyle inférieur, les radicaux alkyle,
alkényle et alkynyle
étant éventuellement substitué ; ou un radical R21Z21- dans lequel Z21
représente O,
C(O), OC(O), S, et R21 représente l'atome d'hydrogène, un radical alkyle
inférieur, aryle
ou arylalkyle ;
R3 représente (atome d'hydrogène, le radical halo, vitro ou cyano, un radical
alkyle de 1 à
10 atomes de carbone, alkényle inférieur, alkynyle inférieur, cycloalkyle,
cycloalkylalkyle, aryle, arylalkyle, aryloxyalkyle inférieur, hétéroaryle ou
hétéroarylalkyle, les radicaux alkyle, alkényle, alkynyle, cycloalkyle, aryle
et hétéroaryle
étant éventuellement substitués ; ou un radical R31Z31- dans lequel Z31
représente O,
C(O), OC(O), S, et R31 représente l'atome d'hydrogène, un radical alkyle
inférieur, aryle
ou arylalkyle inférieur ;
ou d'un sel de ce produit (lorsque la molécule contient un groupement
basique), pour la
préparation d'un médicament destiné à traiter les états pathologiques ou les
maladies dans
lesquels un (ou plusieurs) des récepteurs de la somatostatine est(sont)
impliqué(s).
L'invention a plus particulièrement pour objet (utilisation, pour la
préparation d'un médicament
destiné à traiter les états pathologiques ou les maladies dans lesquels un (ou
plusieurs) des
récepteurs de la somatostatine est(sont) impliqué(s), d'un composé de formule
générale I telle
que définie ci-dessus dans laquelle
W représente (atome d'hydrogène ou un radical de formule R-X-C(Y)- ;
R représente un radical aryle ou hétéroaryle, le radical aryle ou hétéroaryle
étant
éventuellement substitué par un ou plusieurs substituants, identiques ou
différents, choisis
parmi les radicaux suivants : alkyle inférieur, alkoxy inférieur, alkylthio
inférieur, alkoxy
inférieur carbonyle, alkyle inférieur sulfonyle, halo, trifluorométhyle,
trifluorométhyloxy,
hydroxy, vitro, cyano, aryle, aryloxy, cycloalkyle ou hétérocycloalkyle ;
R~ représente un ou plusieurs groupes, identiques ou différents, choisis parmi
: l'atome
d'hydrogène, le radical hydroxy, halo, un radical alkyle inférieur, alkoxy
inférieur, les
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
_4_
radicaux alkyle et alkoxy étant éventuellement substitués par un ou plusieurs
radicaux
identiques ou différents choisis parmi les radicaux suivants :
trifluorométhyle, alkoxy
inférieur, amino, alkyl inférieur amino et dialkyl inférieur amino ;
R~ et R2b représentent, indépendamment
l'atome d'hydrogène ;
un radical alkyle inférieur, alkényle inférieur ou alkynyle inférieur, les
radicaux
alkyle, alkényle et alkynyle étant éventuellement substitués par un ou
plusieurs
radicaux, identiques ou différents, choisis parmi
halo ; un radical -NR22R23 dans lequel R22 et R23 représentent,
indépendamment, l'atome d'hydrogène, un radical alkyle inférieur,
cycloalkyle, cycloalkylalkyle, aryle, arylalkyle, hétéroaryle,
hétéroarylalkyle,
alkylsulfonyle, cycloalkylsulfonyle, arylsulfonyle, alkoxy inférieur
carbonyle,
aryloxycarbonyle, alkylcarbonyle, arylcarbonyle ou cycloalkylcarbonyle ; ou
un radical -Z22R2a dans lequel Z22 représente O,S, C(O) OC(O) et R2a
représente un atome d'hydrogène, un radical alkyle inférieur, cycloalkyle,
cycloalkylalkyle, aryle, arylalkyle, hétéroaryle, hétéroarylalkyle,
alkylsulfonyle, cycloalkylsulfonyle ou arylsulfonyle ;
un radical R21Z21- dans lequel Z21 représente O, C(O), OC(O), S, et R21
représente
(atome d'h~~drogène, un radical alkyle inférieur, aryle ou arylalkyle ;
R3 représente
(atome d'hydrogène, le radical halo, vitro ou cyano ;
un radical alkyle de 1 à 10 atomes de carbone, alkényle inférieur; alkynyle
inférieur,
cycloalkyle, cycloalkylalkyle, aryle, arylalkyle inférieur, aryloxyalkyle
inférieur,
hétéroaryle ou hétéroarylalkyle inférieur, les radicaux alkyle, alkényle,
alkynyle
cycloalkyle, aryle et hétéroaryle étant éventuellement substitués par un ou
plusieurs
radicaux identiques ou différents choisis parmi
halo : aryle ; -NR32R33 dans lequel soit R32 et R33 représentent,
indépendamment, l'atome d'hydrogène, un radical alkyle inférieur, arylalkyle
ou alhylcarbonyle, soit R32 et R33 forment, avec l'atome d'azote sur lequel
ils
sont attachés, un hétérocycloalkyle ; ou -Z32-R34 dans lequel Z32 représente
O, C(O), OC(O), S, S(O) ou S02 et R34 représente l'atome d'hydrogène; un
radical alkyle inférieur, aryle ou arylalkyle inférieur ;
CA 02335724 2000-12-13
WO 99/b5917 ~CT/FR99/01422
-5~
un radical -Z31R31 dans lequel Z31 représente O, C(O), OC(O),'~,S, et R31
représente
(atome d'h~~drogène, un radical alkyie inférieur, aryle ou arylalkyle.
Dans les définitions indiquées ci-dessus, (expression halo représente le
radical fluoro, chloro,
bromo ou iodo, de préférence chloro, fluoro ou bromo. L'expression alkyle
inférieur représente
de préférence un radical alkyle ayant de 1 à 6 atomes de carbone, linéaire ou
ramifié, et en
particulier un radical alkyle ayant de 1 à 4 atomes de carbone tels que les
radicaux méthyle,
éthyle, propyle, isopropyle, butyle, isobutyle, sec-butyle et tert-butyle,
mais peut également
représenter un radical pentyle, isopentyle, hexyle ou isohexyle. Parmi les
radicaux alkyle
contenant de 1 à 10 atomes de carbone, on peut citer les alkyles inférieurs
tels que définis ci-
dessus mais également les radicaux heptyle, octyle, nonyle ou décyle.
Les radicaux alkoxy inférieurs peuvent correspondre aux radicaux alkyle
indiqués ci-dessus
comme par exemple les radicaux méthoxy, éthoxy, propyloxy ou isopropyloxy mais
également
butoxy linéaire, secondaire ou tertiaire. Le terme alkylthio inférieur désigne
de préférence les
radicaux dans lesquels le radical alkyle est tel que défini ci-dessus comme
par exemple
méthylthio, éthylthio.
L'expression alkényle inférieur représente de préférence un radical alkényle
ayant de 1 à 6
atomes de carbone, linéaire ou ramifié, comme par exemple vinyle, allyle,
propényle, butènyle
ou pentènyle. Le terme alkynyle inférieur représente de préférence un alkynyle
linéaire ou
ramifié, contenant de 1 à 6 atomes de carbone, et de préférence un radical
éthynyle, propargyle,
butynyle ou pentynyle.
Le terme cycloalkyle désigne de préférence les cycles cyclopropyle,
cyclobutyle, cyclopentyle
ou cyclohexyle. L'expression hétérocycloalkyle désigne un cycloalkyle saturé
contenant de 2 à
7 atomes de carbones et au moins un hétéroatome. Ce radical peut contenir
plusieurs
hétéroatomes identiques ou différents. De préférence, les hétéroatomes sont
choisis parmi
l'oxygène, le soufre ou l'azote. Comme exemples d'hétérocycloalkyle, on peut
citer le cycle
pyrrolidine, imidazolidine, pyrrazolidine, isothiazolidine, thiazolidine,
isoxazolidine,
oxazolidine ou un cycle de formule
n
E N
U
dans laquelle E représente CH2, O ou R4N dans lequel R4 représente
l'hydrogène, un radical
alkyle inférieur, arylalkyle, arylsulfonyle, aryle éventuellement substitué,
pouvant ainsi
représenter par exemple le cycle pipéridine, pipérazine ou morpholine.
L'expression aryle représente un radical aromatique, constitué d'un cycle ou
de cycles
condensés, comme par exemple le radical phényle ou naphtyle. Le terme aryloxy
désigne de
préférérence les radicaux dans lesquels le radical aryle est tel que défini ci-
dessus comme par
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
-6-
exemple le radical phénoxy. L'expression hétéroaryle désigne un radical
aromatique, constitué
d'un cycle ou .de cycles condensés, avec au moins un cycle contenant un ou
plusieurs
hétéroatomes identiques ou différents choisis parmi le soufre, l'azote oui
l'oxygène. Comme
exemple de radical hétéroaryle, on peut citer les radicaux thiényle, furyle,
pyrrolyle,
imidazolyle, pyrazolyle, isothiazolyle, thiazolyle, isoxazolyle, oxazolyle,
pyridyle, pyrazinyle,
pyrimidyle, benzothiényle, benzofuryle et indolyle.
Les radicaux arylalkyles inférieurs désignent les radicaux dans lesquels
respectivement les
radicaux aryle et alkyle inférieur sont tels que définis ci-dessus comme par
exemple benzyle,
phenéthyle ou naphtylinéthyle. Les radicaux hétéroarylalkyles inférieurs
désignent les radicaux
dans lesquels respectivement les radicaux hétéroaryle et alkyle inférieur sont
tels que définis ci-
dessus comme par exemple indolylméthyle, thiénylméthyle, furylméthyle. Le
terme
aryloxyalkyle désignent les radicaux dans lesquels respectivement les radicaux
aryloxy et alkyle
inférieur sont tels que définis ci-dessus.
Les termes alkyl inférieur amino et dialkyl inférieur amino désignent de
préférence les radicaux
dans lesquels les radicaux alkyle sont tels que définis ci-dessus, comme par
exemple
méthylamino, éthylamino, diméthylamino, diéthylamino ou (méthyl)(éthyl)an~ino.
Les termes alkylsulfonyle, cycloalkylsulfonyle, arylsulfonyle et
arylalkylsulfonyle désignent de
préférence les radicaux dans lesquels respectivement les radicaux alkyle,
cycloalkyle et aryle
sont tels que définis ci-dessus. De même, les termes alkylcarbonyle,
alkoxycarbonyle,
arylcarbonyle, aryloxycarbonyle désignent de préférence les radicaux dans
lesquels
respectivement les radicaux alkyle, alkoxy, aryle et aryloxy sont tels que
définis ci-dessus.
Lorsque les produits de formule I contiennent un groupement basique, ils
peuvent former des
sels d'addition avec les acides, en particulier les acides pharmacologiquement
acceptables.
Selon la définition des groupes variables, un composé de formule I tel que
défini ci-dessus peut
présenter un ou plusieurs carbones asymétriques. L'invention concerne
l'utilisation des
composés de formule I telle que définie ci-dessus, composés qui peuvent se
trouver sous forme
racémiques, énantiomères ou diastéréoisomères.
L'invention a plus particulièrement pour objet l'utilisation, pour la
préparation d'un médicament
destiné à traiter les états pathologiques ou les maladies dans lesquels un (ou
plusieurs) des
récepteurs de la somatostatine est(sont) impliqué(s), d'un composé de formule
générale I telle
que définie ci-dessus dans laquelle
W représente l'atome d'hydrogène ou un radical de formule R-X-C(Y)- ;
CA 02335724 2000-12-13
WO 99/65917 pGT/FR99/01422
_7_ -
R représente un radical aryle ou hétéroaryle, le radical aryle o~ hétéroaryle
étant
éventuellement substitué par un ou plusieurs substituants, identiques ôu
différents, choisis
parmi les radicaux suivants : alkyle inférieur, alkoxy inférieur, alkylthio
inférieur, alkoxy
inférieur carbon~~ie, alkyle inférieur sulfonyle, halo, trifluorométhyle,
trifluorométhyloxy,
hydroxy, vitro, cyano, aryle, aryloxy ou hétérocycloalkyle ;
R1 représente un ou plusieurs groupes, identiques ou différents, choisis parmi
: l'atome
d'hydrogène, un radical halo, alkyle inférieur ou alkoxy inférieur ;
Rza et R2b représentent, indépendamment L'atome d'hydrogène ou un radical
alkyle
inférieur ;
R3 représente l'atome d'hydrogène ; un radical alkyle de 1 à 10 atomes de
carbone,
cycloalkylalkyle. aryle, arylalkyle inférieur ou hétéroarylalkyle inférieur,
les radicaux
alkyle, cycloalkyle, aryle et hétéroaryle étant éventuellement substitués par
un ou plusieurs
radicaux identiques ou différents choisis parmi
aryle ; -NR32R33 dans lequel soit R32 et R33 représentent, indépendamment,
l'atome d'hydrogène ou un radical alkyle inférieur ; ou -Z32-R34 dans lequel
Z32
représente O et R34 représente (atome d'hydrogène ou un radical alkyle.
inférieur.
L'invention a plus particulièrement pour objet (utilisation, pour la
préparation d'un médicament
destiné à traiter les états pathologiques ou les maladies dans lesquels un (ou
plusieurs) des
récepteurs de la somatostatine est impliqué, d'un composé de formule I telle
que déimie
ci-dessus, caractérisée en ce que
W représente (atome d'hydrogène ou un radical de formule R-X-C(Y)- ;
R représente Ie radical phényle, napthyle, indolyle ou pyridyle, ces radicaux
étant
éventuellement substitué par un ou plusieurs substituants identiques ou
différents choisis
parmi les radicaux suivants : méthyle, éthyle, propyle, isopropyle, butyle,
ter-butyle,
méthoxy, éthoxy, méthylthio, éthylthio, méthoxycarbonyle, éthoxycarbonyle,
méthylsulfonyle, éthylsulfonyle, chloro, fluoro, bromo, trifluorométhyle,
trifluorométhyloty, hydroxy, vitro, cyano, phényle, phénoxy ou morpholino ;
X représente CHs, C2H4, CH2NH, NH, O, S ou une liaison covalente ;
Y représente O ou S ;
Ri représente un ou plusieurs groupes, identiques ou différents, choisis parmi
: l'atome
d'hydrogène, un radical chloro, méthyle ou méthoxy ;
CA 02335724 2000-12-13
WO 99/65917 PCT'/FR99/01422
_g_
R~ et R2b représentent, indépendamment, l'atome d'hydrogène ou un radical
méthyle ;
R3 représente l'atome d'hydrogène, méthyle, éthyle, propyle, butyle, pentyle,
hexyle,
heptyle, méthoxyéthyle, éthoxyéthyle, diméthylaminoéthyle, cyclohexylméthyle,
phényle,
diphényle, benzyle éventuellement substitué par le radical hydroxy ou méthoxy,
phénéthyle, naphtylméthyle ou indolylméthyle.
Plus particulièrement, (invention a pour objet (utilisation, pour la
préparation d'un médicament
destiné à traiter les états pathologiques ou les maladies dans lesquels un (ou
plusieurs) des
récepteurs de la somatostatine est impliqué, des composés décrits ci-après
dans les exemples, en
particulier les produits répondant aux formules suivantes
- 1-butyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-fj [1,2,4]
triazolo [4,3-a] [ 1,4] diazépine ;
1-benzyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4]
triazolo [4,3-a] [1,4] diazépine ;
- 1-méthyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4]
triazolo [4,3-a] [1,4] diazépine ;
6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno [3,2-f]
(1,2,4] triazolo
[4,3-a] [1,4] diazépine ;
- 1-éthyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4]
triazolo [4,3-a] [ 1,4] diazépine ;
- 1-propyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3 ;4,5] thiéno
[3,2-fj [1,2,4]
triazolo [4,3-a] [1,4] diazépine ;
- 1-phényl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4]
triazolo [4,3-a] [1,4] diazépine ;
- 1-pentyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-fj [1,2,4]
triazolo [4,3-a] [ 1,4] diazépine ;
- 1-hexyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3 ;4,5] thiéno
[3,2-fj [1,2,4]
triazolo [4,3-a] [1,4] diazépine ;
- 1-(4-hydroxybenzyl)-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-
pyrido[4',3';4,5] thiéno
[3,2-fj [1,2,4] triazolo [4,3-a] [1,4] diazépine ;
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
-9-
1-(4-méthoxybenzyl)-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-
pyrïdo[4',3';4,5] thiéno
[3,2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine ;
- 1-(1-naphtyl-méthyl)-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-
pyrido[4',3';4,5] thiéno
[3,2-fj [1,2,4] triazolo (4,3-a] [1,4] diazépine ;
- 1-(3-indolyl-méthyl)-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-
pyrido[4',3';4,5] thiéno
[3,2-fj (1,2,4] triazolo [4,3-a] [1,4] diazépine ;
- 1-phénéthyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5]
thiéno [3,2-fj
[1,2,4] triazolo [4,3-a] [1,4] diazépine ;
1-diphényl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f]
(1,2,4] triazolo [4,3-a] [1,4] diazépine ;
- 1-éthoxyéthyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5]
thiéno [3,2-f]
[1,2,4] triazolo [4,3-a] [1,4] diazépine ;
- 1-cyclohexylméthyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-
pyrido[4',3';4,5] thiéno
[3;2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine ;
- 1-(3-hydroxybenzyl)-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3
;4,5] thiéno
[3,2-fJ [1,2,4] triazolo [4,3-a] [1,4] diazépine ;
- 1-(diméthylaminoéthyl)-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-
pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine ;
- 1-méthyl-6-phényl-7,8,9,10-tétrahydro-4H-pyrido[4',3';4;5] thiéno [3,2-fj
[1,2,4] triazolo
[4,3-a] (1,4] diazépine ;
- 1-benzyl-6-(4-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-fj [1,2,4]
triazolo [4,3-a] [1,4] diazépine ;
- 1-benzyl-6-phényl-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno [3,2-fj
[1,2,4] triazolo
[4,3-a] [1,4] diazépine ;
- 1-méthyl-6-(4-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-fj [ 1,2,4]
triazolo [4,3-a] [1,4] diazépine ;
- 1-benzyl-6-(3-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-fj [1,2,4]
triazolo [4,3-a) [1,4] diazépine ;
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
-10-
- 1-méthyl-6-(3-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-fj [1,2,4]
triazolo [4,3-a] [i,4] diazépine ;
- 1-butyl-6-{2-méthylphényl)-7,8,9,10-tétrahydro-4H-pyrido[4';3';4,5] thiéno
[3,2-fj [1,2,4]
triazolo [4,3-a] [1,4] diazépine ;
- 1-benzyl-6-(2-méthylphényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4]
triazolo [4,3-a] [1,4] diazépine ;
- 1-butyl-6-(2-méthoxyphényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f]
[1,2,4] triazolo [4,3-a] [1,4] diazépine ;
- 1-heptyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4]
triazolo [4,3-a] [ 1,4] diazépine ;
1-hexyl-6-(4-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4]
triazolo [4,3-a] [1,4] diazépine ;
- 1-pentyl-6-(4-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4]
triazolo [4,3-a] [ 1,4J diazépine ;
- 6-{2-chlorophényl)-7,8,9,10-tétrahydro-1-méthyl-9-[2-(2-
trifluorométhylphényl)-1-
oxoéthyl]-4H-pyrido[4',3 ;4,5] thiéno [3,2-fJ [1,2,4J triazolo [4,3-a] [1,4]
diazépine ;
- 6-(2-chlorophényl)-7,8,9,10-tétrahydro-1-méthyl-9-[2-(2-
trifluorométhylphényl)-1-
thioxoéthyl]-4H-pyrido [4',3;4,5] thiéno [3,2-f] [1,2,4] triazolo [4,3-aJ
[1,4] diazépine ;
- 6-(2-chlorophényl)-7,10-dihydro-1-méthyl-N-(2-trifluorométhylphényl)-4H-
pyrido
[4',3 ;4,5] thiéno [3,2-fj [1,2,4] triazolo [4,3-a] [1,4] diazépine-9(8H)-
carbothioamide ;
- 6-(2-chlorophényl)-7,10-dihydro-1-méthyl-N-(2-trifluorométhylphényl)-4H-
pyrido
[4',3 ;4,5] thiéno [3,2-fj [1,2,4] triazolo [4,3-a] [1,4] diazépine-9(8H)-
carboxamide ;
- 6-(2-chlorophényl)-7.10-dihydro-1-méthyl-N-(2-trifluorométhylbenzyl)-4.H-
pyrido
[4',3';4,5] thiéno [3,2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine-9(8H)-
carbothioamide ;
- 6-(2-chlorophényl)-7,10-dihydro-1-méthyl-N-benzyl-4H-pyrido [4',3';4,5]
thiéno [3,2-f]
[1,2,4] triazolo [4,3-a] [I,4] diazépine -9(8H)-carboxamide ;
- ester phénylique de l'acide 6-(2-chlorophényl)-7,10-dihydro-4H-pyrido
[4',3';4,5] thiéno
[3,2-fj [1,2,4] triazolo [4,3-a] [1,4] diazépine -9(8H)-carboxylique ;
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
-11-
- 6-(2-chlorophényl)-7,10-dihydro-1,4-diméthyl-N-(2-trifluorométhylphén~l)-4H-
pyrido
[4',3';4,5] thiéno [3,2-f] [1,2,4] triazolo [4,3-a] (1,4] diazépine -9(8H)-
carbothioamide ;
- 1-benzyl-6-(2-chlorophényl)-7,10-dihydro-N-(2-trifluorométhylphényl)-4H-
pyrido
[4',3 ;4,5] thiéno [3,2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine -9(8H)-
carbothioamide ;
mais également des produits de formule I telle définie ci-dessus et dont les
substituants R, X, Y,
Rl~ R2a~ R2b et R3 sont respectivement les suivants
-2-Me0-Ph;NH;S;2-C1;H;H;Me;
-2-Me-Ph;NH;S;2-C1;H;H;Me;
- 2-isoPr-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
-2-NC-Ph;NH;S;2-C1;H;H;Me;
-2-F3C-Ph;NH;S;2-C1;H;H;Et;
-2-F3C-Ph;NH;S;2-CI;H;H;H;
- 2-terBu-Ph ; NH ; S; 2-Cl; H; H; Me ;
-1-naphtyl;NH;S;2-C1;H;H;Me;
-2-F3C0-Ph;NH;S;2-C1;H;H;Me;
-2-Cl-Ph;NH;S;2-C1;H;H;Me;
-2-F-Ph;NH;S;2-CI;H;H;Me;
-2-Et-Ph;NH;S;2-C1;H;H;Me;
-2-Ph0-Ph;NH;S;2-C1;H;H;Me;
-2-Pr-Ph;NH;S;2-C1;H;H;Me;
-2-Br-Ph;NH;S;2-C1;H;H;Me;
- 2-EtOC(O)-Ph ; NH : S ; 2-Cl ; H ; H ; Me ;
- 2-MeS-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-NOZ-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-Me0-5-Cl-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2,4-(Me0)-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-Cl-5-F3C-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-Me-S-Cl-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
-2,3-Cl-Ph;NH;S;2-CI;H;H;Me;
- 2,5-Me-Ph ; NH ; S : 2-Cl ; H ; H ; Me ;
- 2,5-Cl-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-Me-5-F-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
2-F3C-4-Br-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-4-Me-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-Me0-4-N02-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
-12-
-2,5-Br-Ph;NH;S;2-CI;H;H;Me;
- 2-Cl-5-N02-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-F3C-Ph ; NH ; S ; 2-Cl ; H ; H ; Pr ;
-2-F3C-Ph;NH;S;2-C1;H;H;Bu;
-2-F3C-Ph;NH;S;H;H;H;Me;
-2-F3C-Ph;NH;S;2-C1;H;H;Ph;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; Pr ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-CI ; H ; H ; Bu ;
- 2-MeS02-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-F3C-4-CI-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-4-Me0-Ph ; NH ; S ; 4-Cl ; H ; H ; Bz ;
- 2-F3C-Ph ; NH ; S ; 4-Cl ; H ; H ; Me ;
2-N02-4-Me0-Ph ; NH ; S ; 2-CI ; H ; H ; pentyl ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; hexyl ;
- 2-N02-4-Me0-Ph ; NH ; S ; 3-Cl ; H ; H ; Bz ;
- 2-N02-4-F-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-4-NC-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; 1-napthyl-méthyl ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; 3-indolyl-méthyl ;
- 2-MeS-5-F3C-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-4-Me0-Ph ; NH ; S ; 3-Cl ; H ; H ; Me ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-5-Cl-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-5-Me-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-4-Et0-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; 4-Me0-Bz ;
- 2-N02-4-Cl-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
2-Br-4-Me-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; 4-HO-Bz ;
- 2-F3C-4-N02-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-4-Me0-Ph ; NH ; S ; H ; H ; H ; Bz ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-CI ; H ; H ; Ph-C2H4 ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; EtOC2H4 ;
- 3-N02-2-pyridyl ; NH ; S ; 2-Cl ; H ; H ; Me ;
-2-F3C-Ph;-;0;2-C1;H;H;Me;
-Ph;-;S;2-C1;H;H;Me;
- 2-F3C-Ph ; CH2 ; S : 2-Cl ; H ; H ; Me ;
- 2-N02-4-Me0-Ph ; NH ; S ; 4-Cl ; H ; H ; Me ;
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
-13-
- 2-N02-Ph ; CH2 ; S : 2-Cl ; H ; H ; Me ;
- 2-N02-4-Me0-Ph ; I~'H ; S ; 2-Me0 ; H ; H ; Bu ;
- 2-N02-4-Me0-Ph ; T'H ; S ; 2-Me0 ; H ; H ; Bz ;
- 2-N02-4-Me0-Ph ; r'H ; S ; 2-Me ; H ; H ; Bu ;
- 2-N02-4-Me0-Ph ; r'H ; S ; 2-Me ; H ; H ; Bz ;
- 2-N02-4.-Me0-Ph ; h'H ; S ; 2-Cl ; H ; H ; Ph-Ph ;
- 2-N02-4-Me0-Ph ; r'H ; S ; 2-Cl ; H ; H ; cyclohexylméthyl ;
- 2-N02-4-Me0-Ph ; r'H ; S ; 2-Cl ; H ; H ; (Me)2NC2H4 ;
- 2-N02-4-Me0-Ph ; T'H ; S ; 2-Cl ; H ; H ; 3-HO-Bz ;
-Ph;S;S;2-CI;H;H;Me;
- 2-NOZ-4-Me0-Ph.; I~'H ; S ; 2-Cl ; H ; H ; heptyl,
ainsi que des sels de ces composés avec les acides minéraux ou organiques
lorsque la molécule
contient un groupement basique.
Parmi les composés de formule I, certains sont nouveaux. L'invention a donc
également pour
objet un composé de formule générale II
R2 a'
W'-r R'2 b'
11
dans laquelle
W' représente l'atome d'hydrogène ou un radical de formule R'-X'-C(Y')- ;
R' représente le radical phényle, napthyle, indolyle ou pyridyle, ces radicaux
étant
éventuellement substitué par un ou plusieurs substituants identiques ou
différents choisis
parmi les radicaux suivants : méthyle, éthyle, propyle, isopropyle, butyle,
ter-butyle,
méthoxy, éthoxy, méthylthio, éthylthio, méthoxycarbonyle, éthoxycarbonyle,
méthylsulfonyle, éthylsulfonyle, chloro, fluoro, bromo, trifluorométhyle,
trifluorométhyloxy, hydroxy, vitro, cyano, phényle, phénoxy ou morpholino ;
X' représente CH~, C2H4, CH2NH, NH, O, S ou une liaison covalente ;
Y' représente O ou S ;
CA 02335724 2000-12-13
WO 99/65917 PC'T/FR99/OI422
- 14 - jy _
R't représente un ou plusieurs groupes, identiques ou différents, c~oisis
parmi : l'atome
d'hydrogène, un radical chloro, méthyle ou méthoxy ;
R2a' et R2b' représentent, indépendamment, l'atome d'hydrogène, un radical
méthyle ;
R'3 représente l'atome d'hydrogène, méthyle, éthyle, propyle, butyle, pentyle,
hexyle,
heptyle,méthoxyéthyle, éthoxyéthyle, diméthylaminoéthyle, cyclohexylméthyle,
phényle,
diphényle, benzyle éventuellement substitué par le radical hydroxy ou méthoxy,
phénéthyle, naphtylméthyle ou indolylméthyle.
à (exclusion des composés de formule II dans laquelle
W' représente l'atome d'hydrogène, R'1 représente le radical chloro en
position ortho ; R2a'
représente l'atome d'hydrogène et R2b' représente l'atome d'hydrogéne ou le
radical méthyle ;
R'3 représente le radical méthyle et
W' représente un radical de formule R'-X'-C(Y')- et
- X' représente NH ; Y' représente O ; R'1 représente le radical chloro en
position
ortho ; Rza' et R2b~ représentent (atome d'hydrogène ; R'3 représente le
radical méthyle ;
R' représente le 4-terbutylphényle, 4-trifluorométhylphényle, 4-
méthoxyphényle,
3,4,5-triméthoxyphényle, 2,3-dichlorophényle, 2,4-(difluoro)phényle,
4-phénoxyphényle ; pyridile ; cyanophényle ;
- X' représente NH ; Y' représente S ; R'1 représente le radical chloro en
position ortho ;
R2a' et Rzb' représentent l'atome d'hydrogène ; R'3 représente le radical
méthyle ; R'
représente le 4-terbutylphényle, 2,4-diterbutylphényle, 2-
trifluorométhylphényle,
3-trifluorométhylphényle, 4-trifluorométhylphényle, 4-méthoxyphényle, 3,4,5-
trimé-
thoxyphényle, 4-fluorophényle, 4-(méthylsulfonyl)phényle ;
- X' représente CH2NH ; Y' représente O ; R'1 représente le radical chloro en
position
ortho ; R2a~ et R2b' représentent (atome d'hydrogène ; R'3 représente le
radical méthyle ;
R' représente phényle ;
- X' représente l'atome d'oxygène ou une liaison covalente ; Y' représente O ;
R' 1
représente le radical chloro en position ortho ; R2a~ et R2b' représentent
l'atome
d'hydrogène ; R'3 représente le radical méthyle ; R' représente pyridyle ou
cyanophényle ;
- X' représente CHZ ; Y' représente O ; R'~ représente le radical chloro en
position
ortho ; R2a' et R2b' représentent l'atome d'hydrogène ; R'3 représente le
radical méthyle :
R' représente phényle ou 4-fluorophényle ;
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
-15-
- X' représente C2H4 ; Y' représente O ; R'1 représente le radical chloro en
position
ortho ; R~~ et R2b~ représentent (atome d'hydrogène ; R'3 représente le
radical méthyle ;
R' représente phényle.
_ Plus particulièrement, (invention a pour objet un composé de formule
générale II dans laquelle
W' représente un radical de formule R'-X'-C(Y')- et les substituants R' , X',
Y', R'~, R2a',
R2b~ et R'3 représentent respectivement
- 2-F3C-Ph ; CH2 ; O ; 2-Cl ; H ; H ; Me ;
- 2-F3C-Ph ; CHZ ; S ; 2-Cl ; H ; H ; Me ;
-2-F3C-Ph;NH;0;2-CI;H;H;Me;
- 2-F3C-Ph ; CH2NH ; S ; 2-Cl ; H ; H ; Me ;
-Ph;0;0;2-C1;H;H;Me;
-2-F3C-Ph;NH;S;2-CI;Me;H;Me;
-2-F3C-Ph;NH;S;2-CI;H;H;Bz;
-3-F3C-Ph;NH;0;2-CI;H;H;Me;
-4-F3C-Ph;NH;0;2-C1;H;H;Me;
- 2-isoPr-Ph ; NH ; S ; 2-CI ; H ; H ; Me ;
-2-NC-Ph;NH;S;2-CI;H;H;Me;
- 2-F3C-Ph ; NH ; S ; 2-Cl ; H ; H ; Et ;
-2-F3C-Ph;NH;S;2-C1;H;H;H;
- 2-terBu-Ph ; NH ; S; 2-Cl; H; H; Me ;
-1-naphtyl;NH;S;2-CI;H;H;Me;
-2-Ph-Ph;NH;S;2-CI;H;H;Me;
- 2-F3C0-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
-2-Cl-Ph;NH;S;2-CI;H;H;Me;
-2-F-Ph;NH;S;2-C1;H;H;Me;
-2-Et-Ph;NH;S;2-C1;H;H;Me;
-2-Ph0-Ph;NH;S;2-CI;H;H;Me;
-2-Pr-Ph;NH;S;2-CI;H;H;Me;
- 2-Et0-Ph ; NH ; S ; 2-C1; H ; H ; Me ;
-Ph;NH;S;2-C1;H;H;Me;
-2-Br-Ph;NH;S;2-C1;H;H;Me;
- 2-EtOC(O)-Ph ; NH : S ; 2-Cl ; H ; H ; Me ;
- 2-MeS-Ph ; NH ; S : 2-Cl ; H ; H ; Me ;
- 2-morpholino-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
-2-N02-Ph;NH;S:2-C1;H;H;Me;
- 2,6-isoPr-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2,6-Me-Ph ; NH ; S : 2-Cl ; H ; H ; Me ;
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
- 16-
- 2,5-(Me0)-Ph ; NH ; O ; 2-Cl ; H ; H ; Me ;
- 2-Me0-5-Cl-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2,4-(Me0)-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-Cl-5-F3C-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
w 5 = 2-Me-5-Cl-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
-2;3-Cl-Ph;NH;S;2-C1;H;H;Me;
- 2,5-Me-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2,5-Cl-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-Cl-4-Me-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-Me-3-Cl-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-Me-5-F-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
2,3-Me-Ph ; NH ; S ; 2-CI ; H ; H ; Me ;
- 2-F3C-4-Br-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-4-Me-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-Me0-4-N02-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
-2,5-Br-Ph;NH;S;2-CI;H;H;Me;
- 2-Me0-5-N02-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-Cl-4-N02-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-Cl-5-N02-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
-2-F3C-Ph;NH;S;2-CI;H;H;Pr;
-2-F3C-Ph;NH;S;2-C1;H;H;Bu;
- 3-Ph-6-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
-2-F3C-Ph;NH;S;H;H;H;Me;
- 2-F3C-Ph ; NH ; S ; 2-CI ; H ; H ; Ph ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; Pr ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; Bu ;
- 2-NOZ-4-F3C-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
-2-MeS02-Ph;NH;S;2-C1;H;H;Me;
- 2-F3C-4-Cl-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-4-Me0-Ph ; NH ; S ; 4-Cl ; H ; H ; Bz ;
-2-F3C-Ph;NH;S;4-C1;H;H;Me;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; pentyl ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; hexyl ;
- 3,5-F3C-Ph ; NH ; S : 2-Cl ; H ; H ; Me ;
- 2-NOZ-4-Me0-Ph ; NH ; S ; 3-Cl ; H ; H ; Bz ;
- 2-N02-4-F-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-4-NC-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
CA 02335724 2000-12-13
WO 99/65917 pCT/FR99/01422
_17_ _ _
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; 1-napthyl-méthyl ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; 3-indolyl-méthyl ;
- 2-MeS-5-F3C-Ph ; r'H ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-4-Me0-Ph ; :VH ; S ; 3-Cl ; H ; H ; Me ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-4-HO-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-5-Cl-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-5-Me-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-4-Et0-Ph ; l~'H ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; 4-Me0-Bz ;
- 2-N02-4-Cl-Ph ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 2-Br-4-Me-Ph ; NH : S ; 2-CI ; H ; H ; Me ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; 4-HO-Bz ;
- 2-F3C-4-N02-Ph ; r'H ; S ; 2-Cl ; H ; H ; Me ;
- 2-N02-4-Me0-Ph ; NH ; S ; H ; H ; H ; Bz ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; Ph-CZH4 ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; EtOC2H4 ;
- 3-NOZ-2-pyridyl ; NH ; S ; 2-Cl ; H ; H ; Me ;
- 4-Me0-Ph ; CH2 ; O ; 2-Cl ; H ; H ; Me ;
- 2-indolyl ; - ; O ; 2-Cl ; H ; H ; Me ;
- 3-indolyl ; CH2 ; O ; 2-Cl ; H ; H ; Me ;
- 4-HO-Ph ; C2H4 ; O ; 2-Cl ; H ; H ; Me ;
-2-F3C-Ph;-;0;2-C1;H;H;Me;
-4-HO-Ph;CH2;0;2-C1;H;H;Me;
- 5-Me0-2-indolyl ; - : O ; 2-Cl ; H ; H ; Me ;
-Ph;-;0;2-C1;H:H;Me;
-Ph;-;S;2-C1;H;H;Me;
- 5-Me0-2-indolyl ; - : S ; 2-Cl ; H ; H ; Me ;
- 2-N02-Ph ; CH2 ; O ; 2-Cl ; H ; H ; Me ;
- 2-F3C-Ph ; CH2 ; S : 2-Cl ; H ; H ; Me ;
- 2-N02-4-Me0-Ph ; NH ; S ; 4-Cl ; H ; H ; Me ;
- 2-N02-Ph ; CH2 ; S : 2-Cl ; H ; H ; Me ;
- 2-N02-4-Me0-Ph ; ~~I-i ; S ; 2-Me0 ; H ; H ; Bu ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Me0 ; H ; H ; Bz ;
- 2-N02-4-Me0-Ph : NH ; S ; 2-Me ; H ; H ; Bu ;
- 2-N02-4-Me0-Ph : ?V~i ; S ; 2-Me ; H ; H ; Bz ;
- 2-N02-4-Me0-Ph ; '~1H ; S ; 2-Cl ; H ; H ; Ph-Ph ;
- 2-N02-4-Me0-Ph :1'Fi ; S ; 2-Cl ; H ; H ; cyclohexyl méthyl ;
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
_ 1g _
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; (Me)ZNC2H4 ;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; 3-HO-Bz ;
- 2-pyridyl ; NH ; S ; 2-CI ; H ; H ; Me ;
-Ph;S;S;2-C1;H;H;Me;
-Ph;O;S;2-C1;H;H;Me;
- 2-N02-4-Me0-Ph ; NH ; S ; 2-Cl ; H ; H ; heptyl,
mais également les composés de formule II dans laquelle W' représente l'atome
d'hydrogène et
les substituants R'1, R~~, R2b~ et R'3 représentent respectivement
- 2-Cl ; H ; H ; butyl ;
- 2-Cl ; H ; H; benzyl ;
-2-C1;H;H;H;
-2-CI;H;H;ethyl;
-2-C1;H;H;propyl;
-2-C1;H;H;Ph;
- 2-Cl ; H ; H ; pentyl ;
-2-CI;H;H;hexyl;
-2-CI;H;H;4-HO-Bz;
- 2-CI ; H ; H ; 4-Me0-Bz ;
- 2-Cl ; H ; H ; 1-naphtyl-méthyl ;
- 2-Cl ; H ; H ; 3-indolyl-méthyl ;
2-CI ; H ; H ; Ph-C2H4 ;
-2-CI;H;H;Ph-Ph;
- 2-Cl ; H ; H ; EtOC2H4 ;
- 2-Cl ; H ; H ; cyclohexylméthyl ;
- 2-Cl ; H ; H ; 3-OH-Bz ;
- 2-Cl ; H ; H ; (Me)2NCZH4 ;
-H;H;H;Me;
-4-CI;H;H;Bz;
-H;H;H;Bz;
-4-C1;H;H;Me;
- 3-CI ; H ; H ; benzyl ;
-3-CI;H;H;Me;
-2-Me;H;H;butyl;
- 2-Me ; H ; H ; benzyl ;
- 2-Me0 ; H ; H ; butyl ;
- 2-Cl ; H; H ; heptyl
-2-C1;H;H;hexyl:
- 2-Cl ; H ; H ; pentyl.
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/014Z2
_19_ _
Les composés de formule I selon l'invention et dans laquelle W représente 1$
radical R-X-C(Y)-,
peuvent être préparés selon le procédé qui consiste à faire réagir un composê
de formule (1)
Ri
iR2a
H r \R2b
N
R3 N
(1)
dans laquelle R~, Rte, R2b et R3 ont la signification indiquée ci-dessus,
avec, selon le produit
final choisi
A) soit un composé de formule (2)
R (CH2)n N =C -Y (2)
dans laquelle R, Y et n ont la signification indiquée ci-dessus, pour former
un composé de
formule I dans laquelle X représente le radical -(CH2)n NH- ;
B) soit un composé de formule (3)
Y
R-(CH2)n-Y"-C
A (3)
dans laquelle R, Y et n ont la signification indiquée ci-dessus, Y" représente
O ou S et A
représente un atome d'halogène, pour former un composé de formule I dans
laquelle X
représente le radical -(CH2)n-O- ou -(CH2)n-S- ;
C) soit un composé de formule (4)
O
R-(CH2)n-C;
OH (4)
dans laquelle R et n ont la signification indiquée ci-dessus, pour former un
composé de formule
I dans laquelle X représente le radical -(CH2)" et Y l'atome d'oxygène,
composé que l'on peut
éventuellement transformer en un composé de formule I dans laquelle X
représente le radical
-(CH2)n et Y l'atome de soufre.
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
-20-
Lors de la préparation selon la voie A), l'addition du composé de fornjnule
(2) telle définie
ci-dessus, avec un composé de formule ( 1 ) se fait aisément à une température
voisine de 20° C
dans un solvant chloré comme le dichlorométhane ou le 1,2-dichloroéthane.
Lors.de la préparation selon la voie B), la transformation du composé (1) en
un composé de
S formule I dans laquelle X représente le radical -(CH2)nY"-, par réaction
avec un composé de
formule (3), peut être mise en oeuvre à une température voisine de 20°
C dans un solvent inerte
tel que le dichlorométhane, et de préférence en présence d'un accepteur
d'acide tel que le
triéthylamine.
Lors de la préparation selon la voie C), le composé de formule ( I ) est
transformé en un composé
de formule I dans laquelle X représente le radical -(CH2)" et Y (atome
d'oxygène, par réaction
avec l'acide (4) dans des conditions d'activation similaires aux réactions de
couplage des
peptides. La réaction peut être mise en oeuvre à une température voisine de
20° C, dans un
solvant inerte tel que le diméthylformamide, le tétrahydrofuranne ou le
dichlorométhane, et
généralement en présence d'un acceptew d'acide tel qu'une amine tertiaire
comme par exemple,
la triéthylamine ou la düsopropyléthylamine. L'amide ainsi obtenue, peut être
transformée en un
composé de formule I dans laquelle X représente le radical -(CH2)n et Y (atome
de soufre, en
chauffant le milieu réactionnel à une température voisine de 90° C dans
un solvant polaire tel
que le toluène ou le cyclohexane, en présence d'un agent de thiation comme le
réactif de
Lawesson.
Le produit de départ de formule ( 1 ) correspond au produit de formule I dans
laquelle W
représente un atome d'hydrogène. Un tel composé peut être obtenu en faisant
réagir un composé
de formule (5)
R~
iR2a
R"i0 r R2b
S
(5)
dans laquelle RI, R2a et R2b ont la signification indiquée ci-dessus et R"
représente un radical
alkyle infériew ou ar<~lalkyle infériew, avec un composé de formule (6)
CA 02335724 2000-12-13
WO 99/65917 PCT/F'R99/01422
-21 -
O
R3/ _NH
I
NH2 (6)
dans laquelle R3 a la signification indiquée ci-dessus, pow obtenir le composé
(7)
R1
~R2a
R"~O r R2b
O ~ N
R3 N
composé qui est ensuite soumis à une réaction de déprotection du carbamate
pour obtenir le
produit ( 1 ).
Le composé de formule ( 1 ) peut également être préparé en faisant réagir un
composé de
formule (5) telle que définie ci-dessus avec fhydrazine pow obtenir un composé
de formule (8)
R1
iR2a
R"i R2b
tH
NH2
(8)
composé que l'on fait ensuite réagir avec un composé de type trialkyle
orthoalkanoate de
formule (9)
R80
Rg0 OR8
R3 (9)
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
-22-
dans laquelle R8 représente un groupement alkyl et R3 a la signification
indiquée ci-dessus, pour
donner le composé de formule (7) telle que définie ci-dessus qui est ensuite
déprotégé.
Selon la première méthode de préparation du composé 1, les composés de formule
(5) réagissent
sur les composés de formule (6} tels que le phényl acéthydrazide, le 4-
hydroxyphényl
acéthydrazide, en chauffant au reflux d'un solvant inerte comme le toluène et
dans certains cas
pour des raisons de solubilité au reflux de mélange de solvants polaires comme
le mélange
1,2-dichloroéthane/méthanol. De préférence, le composé (5) utilisé est tel que
R" représente le
radical éthyle ou ter-butyle. La réaction se fait en deux temps avec, dans une
première étape, la
formation de l'azide correspondant suivie d'une réaction de cyclisation
intramoléculaire
conduisant au composé de formule (7).
La déprotection du carbamate peut-être effectuée en chauffant en présence
d'une base minérale
comme l'hydroxyde de sodium~dans un alcool aliphatique inférieur comme
féthanol ou en
agitant à température ambiante en milieu fortement acide comme par exemple
l'acide
bromhydrique (33 % dans de l'acide acétique) pour conduire aux composés de
formule ( 1 ).
D'autres méthodes de coupure de carbamate telles que celles décrites dans
Protective Groups in
Organic Synthesis [T:W. Green, P.G.M. Wuts ; 2nd Édition, J. Wiley and sons
Inc., p. 364-6
( 1991 )] peuvent également étre utilisées dans la mesure où elles sont
compatibles avec les
substituants constituant le squelette pyrido thiéno triazolo diazépine des
composés de formule
générale (7).
Selon la deuxième méthode, le composé de formule (5) réagit avec fhydrazine en
solution dans
l'eau en chauffant au reflux d'un alcool aliphatique comme féthanol,
l'isopropanol. Ce composé
hydrazine intermédiaire réagi ensuite avec un composé trialkyle orthoalkanoate
de formule (9)
pour conduire à un composé de formule (7).
Le produit de formule (5) peut être préparé selon la méthode décrite dans le
brevet FR2645153
ou selon des méthodes analogues.
Certains des produits de formule (6) sont commerciaux ; les autres peuvent
être préparés en
faisant réagir au reflux de féthanol, (ester d'alkyle de l'acide R3-C02H sur
fhydrazine dilué à
359'o dans Peau. Les réactifs (9), (4) et (3) sont en général commercialisés
(par exemple par la
firme Acros ou Aldrich). Les produits de formule R-(CH2)"-N=C=Y sont
commerciaux pour la
plupart ou peuvent-être préparés en faisant réagir famine correspondante sur
le (thio)phosgène
selon des méthodes connues de (homme de fart.
Dans le cas o~l R2a et R2b ne représentent pas l'atome d'hydrogène, le produit
de formule ( 1 )
peut également être préparé de façon analogue à celle décrite dans le brevet
FR 2645153 avec,
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
-23-
par exemple, l'utilisation du bromure de 2-bromopropionyle à la place du
bromure de
bromoacétyle en deuxième étape de la synthèse du tétracycle.
Les composés I de la présente invention possèdent d'intéressantes propriétés
pharmacologiques.
C'est ainsi que l'on a découvert que les composés I de la présente invention
ont une haute
affinité pour un (ou plusieurs) des récepteurs de la somatostatine. Ils
peuvent être utilisés
comme agonistes ou antagonistes non-peptidiques de la somatostatine de manière
sélective ou
non.
Les composés de la présente invention peuvent ainsi être utilisés dans
différentes applications
thérapeutiques. Les composés peuvent avantageusement être utilisés pour
traiter les états
pathologiques ou les maladies tels que présentés ci-dessus et dans lesquels un
(ou plusieurs) des
récepteurs de la somatostatine est(sont) impliqué(s).
On trouvera ci-aprês, dans la partie expérimentale, une illustration des
propriétés
pharmacologiques des composés de l'invention.
Ces propriétés rendent les produits de formule I aptes à une utilisation
pharmaceutique. La
présente demande a également pour objet, à titre de médicaments, les produits
de formule II
telle que définie ci-dessus, ainsi que les sels d'addition avec les acides
minéraux ou organiques
pharmaceutiquement acceptables desdits produits de formule II, ainsi que les
compositions
pharmaceutiques contenant, à titre de principe actif, l'un au moins des
médicaments tels que
définis ci-dessus.
L'invention concerne ainsi des compositions pharmaceutiques contenant un
composé de formule
II selon f invention ou un sel additif d'acide pharmaceutiquement acceptable
de celui-ci, en
association avec un support pharmaceudquement acceptable. La composition
pharmaceutique
peut être sôus forme d'un solide, par exemple, des poudres, des granules, des
comprimés, des
gélules ou des suppositoires. Les supports solides appropriés peuvent être,
par exemple, le
phosphate de calcium, le stéarate de magnésium, le talc, les sucres, le
lactose, la dextrine,
l'amidon, la gélatine, la cellulose, la cellulose de méthyle, la cellulose
carboxyméthyle de
sodium, la polyvinylpynrolidine et la cire.
Les compositions pharmaceutiques contenant un composé de l'invention peuvent
aussi se
présenter sous forme liquide, par exemple, des solutions, des émulsions, des
suspensions ou
des sirops. Les supports liquides appropriés peuvent être, par exemple, l'eau,
les solvants
organiques tels que le glycérol ou les glycols, de même que leurs mélanges,
dans des
proportions variées, dans l'eau, additionnés à des huiles ou des graisses
pharmaceutiquement
acceptables. Les compositions liquides stériles peuvent être utilisées pour
les injections
CA 02335724 2000-12-13
WO 99/65917 PCT/I<'R99/01422
-24-
intramusculaires, intrapéritonéales ou sous-cutanées et les compositions
stériles peuvent
également être administrée par intraveineuse.
Les exemples suivants sont présentés pour illustrer les procédures ci-dessus
et ne doivent en
aucun cas être considérés comme une limite à la portée de l'invention.
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
-25-
Exemple 1
I-butyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4]
triazolo [4,3-a] [ 1,4] diazépine
lère éta~_e
5-(2-chlorophényl)-2-hydrazino-6,9-dihydro-3H-pyrido[4',3';4,5]thieno[2,3-
e][1,4]-diazépine-
8 (7H) carboxylate d'éthyle
On ajoute à température ambiante et sous argon, l'hydrazine à 35 % dans l'eau
(42 ml) à un
mélange contenant la 5-(2-chlorophényl)-8-(éthoxycarbonyl)-6,7,8,9-tétrahydro-
3H-pyrido
[4',3':4,5] thieno [3,2-e] [1,4] diazépine 2-thione (118,5 g, 0,282 mol) dans
1740 ml de
méthanol. On laisse agiter à cette température durant une heure. On filtre sur
fritté le précipité,
on le lave à l'éthanol (100 ml) et à l'éther (2 x 200 ml) puis on le sèche
sous vide (61,9 g).
Le solvant contenu dans le filtrat est évaporé. Le solide est filtré puis lavé
au méthanol et à
l'éther (44,1g). Le produit souhaité est sous forme d'un solide jaune
(rendement total : 106 g,
90 %). Point de fusion : 216° C.
RMN 1H ( 100 MHz, DMSO d6, b) : 1,15 (t, 3H) ; 1,62 (m, 2H) ; 3,34 (m, 2H) ;
4,00 (q,
2H) ; 4,40-4,60 (m, 4H) ; 7,34-7,41 (m, 4H) ; 9,13 (m, 1H)
IR (czri 1): VNH (hydrazine) : 2850-2950 ; V~=p (carbamate) : 1690 ; 1600 ;
1310 ; 1370 ;
1240 ; 1120 ; 1050 ; 760.
2ènze éta~~
1-butyl-6-(2-chlorophényl)-7,10-dihydro-4H-pyrido [4',3' ;4,5] thieno [3,2-f]
[1,2,4] triazolo
[4,3-a][1,4] diazépine-9(8H)-carboxylate d'éthyle
On chauffe au reflux un mélange conténant le 5-(2-chlorophényl)-2-hydrazino-
6,9-dihydro-3H-
pyrido[4',3';4,5] thieno [2,3-e] [1,4]-diazépine-8(7H) carboxylate d'éthyle
(3g, 7,2 mmol) et le
triméthyl orthovalérate (1,2 ml, 7,2 mol) dans 15 ml de butanol. On agite
douze heures à 20° C
jusqu'à précipitation du produit. Ce dernier est filtré sur fritté, lavé à
l'éthanol (15 ml); à
l' isopropanol ( i 5 ml), à l'éther isopropylique ( 15 ml) et à l' isopentane
( 15 ml) puis séché sous
vide pour obtenir un solide blanc (2 g, 58 %). Point de fusion : 190° C
RMN 1H (400 MHz, DMSO d6, b) : 0,85 (t, 3H) ; 1,14 (m, 3H) ; 1,3 (m, 2H) ;
1,47 (m,lH) ; 1,61 (m, 2H) ; 2,10 (d, 1H) ; 3,00 (t, 2H) ; 3,11 (m, 1H) ; 3,71
(m, IH) ;
4,02 (q, 2H) ; 4,24 (d, 1H) ; 4,43 (m, 1H) ; 4,82 (d, IH) ; 5,32 (d, 1H) ;
7,43-7,76 (m,
4H)
IR (cm 1 ) : V~=p (carbamate) : 1690 ; 1606 ; 1438 ; 1417 ; 1230 ; 1121 ; 761.
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
-26-
3èn~e étape
1-butyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido [4',3';4,5] thieno
[3,2-f] [1,2,4]
triazolo [4,3-a] [1,4] diazépine
On chauffe au reflux de l'éthanol et durant dix heures un mélange contenant le
1-butyl-
6-(2-chlorophényl)-7,10-dihydro-4H-pyrido [4',3';4,5] thieno[3,2-fj [1,2,4]
triazolo [4,3a]
[1,4] diazépine-9(8H)-carboxylate d'éthyle (1,98 g, 4,8 mmol) et l'hydroxyde
de potassium
(3 g, 0,052 mol) dans 40 ml d'éthanol. On refroidit à 22° C puis on
filtre sur fritté. Le fritté est
rincé avec 5 ml d'éthanol. On ajoute 80 ml d'eau dans le filtrat. On ajoute
cinq gouttes d'acide
acétique et la phase aqueuse est extraite au dichlorométhane (2 x 80 ml). La
phase organique
est séché sur sulfate de magnésium. Le solvant est évaporé au rotavapeur. Le
mélange
réactionnel est agité durant une heure dans un mélange de solvant éther
isopropylique-
isopentane-isopropanol (10-10-1 ml). On filtre sur fritté puis on lave à
l'éther isopropylique et à
l'isopentane. On sèche sous vide et on obtient un solide blanc (0,9 g, 46
°lo). Point de fusion
224° C.
RMN1H (400 MHz, DMSO d6, 8) : 0,85 (t, 3H) ; 1,28-1,40 (m, 3H) ; 1,59 (m, 2H)
;
1,94 (m, 1H) ; 2,55 (m, 1H) ; 2,78 (m, 1H) ; 2,99 (t, 2H) ; 3,84 (q, 2H) ;
4,22 (d, 1H) ;
5,30 (d, 1H) ; 7,43-7,47 (m, 4H)
IR (ciri 1) : VNg : 3268 ; 2930 ; 1600 ; 1430 ; 849 ; 747.
Exemple 2
1-benzyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido [4',3';4,5] thiéno
[3,2-f] [1,2,4]
triazolo [4,3-a] [1,4j diazépine
~~=éT
Ester éthylique de l'acide 1-benzyl-6-(2-chlorophényl)-7,10-dihydro-4H-pyrido
[4',3';4,5]
thieno [3,2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine-9(8H)-carboxylique
Un mélange contenant la 5-(2-chlorobenzoyl)-8-(éthoxycarbonyl)-b,7,8,9-
tétrahydro-3H-pyrido
(4',3':4,5] thiéno [3,2 - fj [1,4] diazépine 2-thione (3 g, 0,007 mol) et
l'hydrazide de l'acide
phénylacétique ( 1,18 g, 0,0077 mol) est chauffé au reflux dans du toluène
anhydre (40 ml)
durant 3 heures. Après refroidissement à température ambiante, le précipité
est filtré sur fritté
puis agité dans un mélange de solvant (éther
isopropylique/dichlorométhanelisopentane : 90/8/2)
durant 12 heures. Le solide est filtré sur fritté puis lavé à (éther
isopropylique, à fisopropanol
puis à fisopentane. Après séchage sous vide durant 12 heures, on obtient 2,8 g
(76 %) d'un
solide de couleur beige. Point de fusion : 192° C.
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
-27
RMNIH (400MHz CDCl3, 8) : 1,26 (t, 3H) ; 1,63-2,03 (m, 2H) ; 3,12 (m, 1H) ;
3,85 (m,
1H) ; 4,18 (m~, 3H) : 4,45 (s, 1H) ; 4,47 (q, 2H) ; 4,82 {m, 1H) ; 5,61 (d,
1H) ;
7,17-7,34 (m, 9H).
IR (cm-1): 1694 VC=O(carbamate); 1434; 1420; 1232; 1126; 758; 727.
2èm-
1-benzyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thieno
[3,2-f] [1,2,4]
triazolo [4,3-a] [1,4] diazépine
Un mélange contenant l'ester éthylique de l'acide 1-benzyl-6-(2-chlorophényl)-
7,10-dihydro-
4H-pyrido[4',3';4,5] thieno [3,2-fj [1,2,4] triazolo [4,3-a] [1,4] diazépine-
9(8H)-carboxilique
{3,69 g, 0,0071 mol) et de l'hydroxyde de potassium (4,4 g, 0,078 mol) est
chauffé au reflux
dans féthanol durant 6 heures puis on laisse sous agitation à température
ambiante durant
48 heures. Le solide est filtré sur fritté, lavé avec uwminimun d'éthanol.
Après ajout d'eau, on
extrait au dichlorométhane et sêche sur sulfate de magnésium. Le solvant est
évaporé et le
produit est purifié par cristallisation dans un mélange acétate
d'éthyle/isopropanol 50/50. On
laisse 48 heures au réfrigérateur puis on filtre sur fritté en lavant avec un
mélange de solvant:
acétate d'éthyl-isopropanol (50-50). On lave enfin à l'isopentane et on sèche
sous vide. On
obtient 2,46 g (77 %) du produit désiré sous la forme d'un solide de couleur
beige. Point de
fusion : 191-192° C.
RMN ~H (400MHz, CDCl3, S) : 1,30 (m, 1H) ; 1,89 (m, 1H) ; 2,51 (m, 1H) ; 2,50
{sé,
1H) ; 2,76 (m, 1H) : 3,82 (q, 2H) ; 4,23 {dd, 1H) ; 4,44 (m, 2H) ; 5,33 (dd,
1H) ;
7,13-7,44 (m, 9H)
IR (cm-1): 3422, 2928. 1602, 1427, 1419, 1045, 1033, 759, 725, 695.
Exemple 3
1-méthyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-fj (1,2,4]
triazolo [4,3-a] [1,4] diazépine
Il est obtenu selon la méthode telle que décrite dans l'exemple 1. Point de
fusion : 202° C.
Exemple 4
6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno [3,2-f]
[1,2,4] triazolo
[4,3-a] [ 1,4] diazépine
Il est obtenu selon la méthode telle que décrite dans l'exemple 2. Point de
fusion : 162° C.
CA 02335724 2000-12-13
WO 99/65917 PC1'/FR99/01422
Exemple 5
1-éthyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-fj [1,2,4]
triazolo [4,3-a] [1,4] diazépine
Il est obtenu selon la méthode telle que décrite dans l'exemple 1. Point de
fusion : 242° C.
Exemple 6
1-propyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-fj [I,2,4]
triazolo [4,3-a] [1,4] diazépine
Il est obtenu seion la méthode telle que décrite dans (exemple 1. Point de
fusion > 260° C.
Exemple 7
1-phényl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiëno
[3,2-fj [1,2,4]
triazolo [4,3-a] [1,4] diazépine
II est obtenu selon la méthode telle que décrite dans l'exemple 2. Point de
fusion = 262° C
Exemple 8
1-pentyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4]
triazolo [4,3-a] [1,4] diazépine
Il est obtenu selon la méthode telle que décrite dans (exemple 2. Point de
fusion = 174° C
Exemple 9
1-hexyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4]
triazolo [4,3-a] [1,4] diazépine
Il est obtenu selon la méthode telle que décrite dans l'exemple 2. Point de
fusion = 194-198° C
Exemple 10
1-(4-hydroxybenzyl)-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-
pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine
Il est obtenu selon la méthode telle que décrite dans (exemple 2. Point de
fusion = 220-230° C
Exemple 11
1-(4-méthoxybenzyl)-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido
[4',3';4,5] thiéno
[3,2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine
Il est obtenu selon la méthode telle que décrite dans l'exemple 2. Point de
fusion = 254-256° C
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
-29-
Exemple 12
1-(1-naphtyl-méthyl)-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-
pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine
Il est obtenu selon la méthode telle que décrite dans l'exemple 2. Point de
fusion = 185-190° C
S Exemple I3
1-(3-indolyl-méthyl)-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-
pyrido[4',3';4,5] thiéno
[3,2-fJ [1,2,4] triazolo (4,3-a] [1,4] diazépine
II est obtenu selon la méthode telle que décrite dans l'exemple 2. Point de
fusion = 196-200° C
Exemple 14
1-phénéthyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f]
[ 1,2,4] triazolo [4,3-a] [ 1,4] diazépine
Il est obtenu selon la méthode telle que décrite dans l'exemple 2. Point de
fusion = 216-218° C
Exemple 15
1-diphényl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4]
triazolo [4,3-a] [1,4] diazépine
Il est obtenu selon la méthode telle que décrite dans (exemple 2. Point de
fusion = 210-214° C
Exempte 16
1-éthoxyéthyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5]
thiéno [3,2-f]
[i,2,4] triazolo [4,3-a] [1,4] diazépine
Il est obtenu selon la méthode telle que décrite dans l'exemple 2. Point de
fusion = 152° C
Exemple 17
1-cyclohexylméthyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5]
thiéno
[3,2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine
Il est obtenu selon la méthode telle que décrite dans l'exemple 2. Point de
fusion =188-190° C
Exemple 18
1-(3-hydroxybenzyl)-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-
pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine
Il est obtenu selon la méthode telle que décrite dans l'exemple 2. Point de
fusion = 242-246° C
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
- 30 -
Exemple 19
1-(diméthylaminoéthyl)-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-
pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine
il est obtenu selon la méthode telle que décrite dans l'exemple 2. Point de
fusion = 143-147° C
Exempte 20
1-méthyl-6-phényl-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno [3,2-f]
[1,2,4] triazolo
[4,3-a] [1,4] diazépine
Il est obtenu selon la méthode telle que décrite dans (exemple 1. Point de
fusion = 240-244° C
Exemple 21
1-benzyl-6-(4-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4]
triazolo [4,3-a] [1,4] diazépine
ll est obtenu selon la méthode telle que décrite dans l'exemple 2. Point de
fusion = 238-242° C
Exemple 22
1-benzyl-6-phényl-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno [3,2-f]
[1,2,4] triazolo
[4,3-a] [1,4] diazépine
Il est obtenu selon la méthode telle que décrite dans (exemple 2. Point de
fusion = 214-218° C
Exemple 23
1-méthyl-6-(4-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4]
triazolo (4,3-a] [1,4] diazépine
Il est obtenu selon la méthode telle que décrite dans (exemple 1. Point de
fusion = 262° C
Exempte 24
1-benzyl-6-(3-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4]
triazolo [4,3-a] [1,4] diazépine
Il est obtenu selon la méthode telle que décrite dans (exemple 2. Point de
fusion = 170° C
Exemple 25
1-méthyl-6-(3-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-fj [1,2,4]
triazolo [4,3-a] [1,4] diazépine
D est obtenu selon la méthode telle que décrite dans (exemple 1. Point de
fusion = 160° C
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
-31-
Exemple 26
1-butyl-6-(2-mbthylphényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,SJ thiéno
(3,2-f] [1,2,4]
triazolo [4,3-a] [ 1,4] diazépine
II est obtenu selon la méthode telle que décrite dans l'exemple 1. Point de
fusion = 20b° C
Exemple 27
1-benzyl-6-(2-méthylphényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4]
triazolo [4,3-a] [ 1,4] diazépine
II est obtenu selon la méthode telle que décrite dans l'exemple 2. Point de
fusion = 110-120° C
Exemple 28
1-butyl-6-(2-méthoxyphényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3 ;4,5] thiéno
[3,2-f] [1,2,4]
triazolo [4,3-a] [1,4J diazépine
II est obtenu selon la méthode telle que décrite dans l'exemple 1. Point de
fusion = 190° C
Exemple 29
1-heptyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4]
triazolo [4,3-a] [1,4] diazépine
ll est obtenu selon la méthode telle que décrite dans l'exemple 1. Point de
fusion = 178-180° C
Exemple 30
1-hexyl-6-(4-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-f] [1,2,4]
triazolo [4,3-a] [1,4] diazépine
Il est obtenu selon la méthode telle que décrite dans l'exemple 1. Point de
fusion = 190-192° C
Exemple 31
1-pentyl-6-(4-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido[4',3';4,5] thiéno
[3,2-fj [1,2,4]
triazolo [4,3-a] [1,4] diazépine
Il est obtenu selon la méthode telle que décrite dans l'exemple 1. Point de
fusion >250° C
Exemple 32
6-(2-chlorophényl)-7,8.9,10-tétrahydro-1-méthyl-9-[2-(2-trifluorométhylphényl)-
1-oxoéthylJ-
4H-pyrido (4',3';4,5] thiéno [3,2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine
On agite à une température voisine de 20° C et durant 72 heures, un
mélange contenant le
6-(2-chlorophényl)-7,8,9,10-tétrahydro-1-méthyl-4H-pyrido [4',3';4,5] thiéno
[3,2-f]
1,2,4-triazolo [4,3-aJ 1,4-diazépine (2,22 g, 0,006 mol), l'acide 2-
trifluorométhylphényl
CA 02335724 2000-12-13
WO 99/6591 ~G"T/FR99/0142Z
-32-
acétique (1,35 g, 0,0066 mol), le chlorhydrate de 1-(3-diméthylaminopropyl)-
3-éthylcarbodümide (1,26 g, 0,0066 mol) et la triéthylamine (1 ml, 0,0066 mol)
dans 40 ml
de diméthylformamide anhydre. Le solvant est évaporé au rotavapeur en
l'entraînant avec du
toluéne. Le brut de réaction est repris avec 30 ml de dichlorométhane, laver à
l'eau et la phase
organique est séchée sur sulfate de magnésium et concentrée au rotavapeur. On
ajouter ensuite
environ 4 ml de dichlorométhane au mélange réactionnel puis on rajoute de
l'éther jusqu'à
précipitation. On agite quelques minutes puis on filtre sous vide en lavant le
précipité à l'éther.
On sèche le produit obtenu sous vide pour obtenir 2 g (61 %) du composé
attendu sous forme
d'un solide blanc. Point de fusion : 224-226° C
HPLC- Conditions
colonne: kromas~~l C 18 ( 150 x 4,6mm)
Phase mobile: Solution A: acide trifluoro acétique à 0,02 %
Solution B: acétonitrile
Gradient Tem s (min.)%A %B Courbe
:
0 90 10
5 90 10
14 30 70
15 10 90 linaire
25 10 90
25,5 90 10
55 90 10
Temps de rétention (min.) : 14,82
Masse : MH+ (exp.) : 556,1 ; MH+(théorie) : 556,12
Exemple 33
6-(2-chlorophényl)-7,8,9,10-tétrahydro- 1-méthyl-9-[2-(2-
trifluorométhylphényl)-
1-thioxoéthyl]-4H-pyrido [4',3 ;4,5] thiéno [3,2-f] [1,2,4] triazolo [4,3-a]
[1,4] diazépine
On chauffe durant 2 heures à une température proche de 80° C un mélange
contenant le
6-(2-chlorophényl)-7,8,9,10-tétrahydro-1-méthyl-9-[2-(2-trifluorométhylphényl)
-1-oxoéthyl]-
4H-pyrido [4',3';4,5] thiéno [3,2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine
(1 g, 0,0018 mol)
et le réactif de Lawesson (0,73 g, 0,0018 mol). On laisse agiter 14 heures à
une température
voisine de 20° C. On filtre le précipité sur fritté, lave avec 30 ml de
toluène et 30 ml d'acétone,
sèche sous vide. On isole le produit attendu par chromatographie flash sur
colonne de silice avec
un mélange dichlorométhane-méthanol (95-5) comme éluant
Solide blanc. Point de fusion: >260° C
HPLC- Conditions
colonne: kromas~~l C 18 ( 150 x 4,6mm)
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
-33-
Phase mobile: Solution A: acide trifluoro acétique à 0,02%
Solution B: acétonitrile
Gradient : Tem s (min.) %A %aB Courbe
0 90 10
90 10
25 10 90 linaire
30 10 90
31 90 10
60 90 10
Temps de rétention (min.) : 17,3
5 Masse : MH+ (exp.) : 572,1 ; MH+(théorie) : 572,09
Exemple 34
6-(2-chlorophényl)-7,10-dihydro-1-méthyl-N-(2-trifluorométhylphényl)-4H-pyrido
[4',3';4,5]
thiéno [3,2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine-9(8H)-carbothioamide
2-trifluorométhylphénylisothiocyanate
A une température voisine de' 20° C et sous atmosph8re d'argon, on
ajoute goutte à goutte le
2-trifluorométhylaniline {4,1 ml, 0,0325 mol) à un mélange contenant le
thiophosgène (2,5 ml,
0,0326 mol) dans 43 ml d'eau. On agite douze heures puis on rajoute 30 ml
d'acétate d'éthyle.
La phase organique est extraite à l'eau puis avec une solution en bicarbonate
de sodium à 10% et
enfin avec une solution de saumure. La phase organique est séchée sur sulfate
de magnésium et
le solvant est évaporé au rotavapeur. Le produit obtenu (6,85 g, 100 %) est
sous la forme
d'une huile marron qui est aussitôt utilisé pour la réaction suivante.
6-(2-chlorophényl)-7,10-dihydro-1-méthyl-N-{2-trifluorométhylphényl)-4H-pyrido
[4 ;3';4,5]
thiéno [3,2-f] [1,2,4] triazoio [4,3-a] [1,4] diazépine-9{8H)-carbothioamide
On agite durant 4 heures et à une température proche de 20° C, un
mélange contenant le
2-trifluorométhylphényl isothiocyanate (0,82 g, 0,004 mol) et le 6-(2-
chlorophényl)-
7,8,9,10-tétrahydro-I-méthyl-4H-pyrido 4',3';4,5] thiéno [3,2-fj [1,2,4]
triazolo [4,3-a] [1,4]
diazépine ( 1 g, 0,0027 mol) dans 30 ml de 1,2-dichloroéthane. On évapore la
moitié du solvant
au rotavapeur puis on ajoute 10 ml d'éther. On agite 20 minutes â une
température voisine de
20° C et on filtre sur fritté puis on lave avec 20 ml d'éther, 20 ml
d'éther isopropylique et 20 ml
d'isopentane.On sèche sous vide pour obtenir un solide de couleur crême (1,2i
g, 78 %).
Point de fusion: 190-192° C
CA 02335724 2000-12-13
WO 99/b5917 PCT/FR99/01422
-34-
RMN1H (400 MHz, DMSO d6, b): 1,72 (m, 1H) ; 2,23 (m,lH) ; 2,62 (s, 3H) ; 3,40
(m, 1H) ;
4,30 (m, 2H) ~ 4,84 (d, 1H) ; 5,35 (d, 1H) ; 5,68 (d, 1H) ; 7,31-7,70 (m, 8H)
; 9,30 (s, 1H).
IR: vNH(thiourée): 3250 cm-1; 1b07 cm-1; 1525 cm'~; 1381 cm-1; 1317 cm-1; 757
cm-~
Exemple 35
6-(2-chlorophényl)-7,10-dihydro-1-méthyl-N-(2-trifluorométhylphényl)-4H-pyrido
[4',3';4,5]
thiéno [3,2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine-9(8H)-carboxamide
On agite à température ambiante et durant 2 heures, un mélange contenant le
2-trifluorométhylphényle isocyanate (l,Sg, 0,008 mol) et le 6-(2-chlorophényl)-
7,8,9,10-tétrahydro-1-méthyl-4H-pyrido [4',3';4,5] thiéno [3,2-fj [1,2,4]
triazolo [4,3-a] [1,4]
diazépine (2,1 g, 0,0057 mol) dans 50 ml de 1,2-dichloroéthane. On évapore à
sec le mélange
réactionnel. L'huile résiduelle est précipitée par addition d'acétate
düsopropyle. Après filtration
sur fritté, on lave à l'éther et sèche Ie solide à 65°C toute une nuit
(2,2 g, 69 %). On obtient un
poudre beige. Point de fusion: 196-198° C.
RMN1H (400 MHz, DMSO d6, b): 1,63 (m, 1H) ; 2,12 (m,lH) ; 2,61(s, 3H) ; 3,20
(m, 1H) ;
3,90 (m, 1H) ; 4,27 (d, 1H) ; 4,38 (d, 1H) ; 4,98 (d, 1H) ; 5,34 (d, 1H) ;
7,32-7,68 (m, 8H) ;
8,39 (s, 1H)
IR: vNH(urée): 3333 cm-1 ; vC=O (carbonyle urée) : 1670 cm-1 ; 1520 cm-1 ;
1318 cm-1 ;
1112 cm-1 ; 764 cm-1.
Exemple 36
6-(2-chlorophényl)-7,10-dihydro-1-méthyl-N-(2-trifluorométhylbenzyl)-4H-pyrido
(4',3';4,5]
thiéno [3,2-fj [1,2,4] triazolo [4,3-a] [1,4] diazépine -9 (8H)-carbothioamide
1 ère étape
2-trifluorométhylbenzylisothiocyanate
Sur une heure à une température voisine de 20° C, on ajoute
simultanément à une solution de
thiophosgène (2,28 g, 0,02 mol) dans 15 ml de dichlorométhane, une solution
contenant le
2-trifluorométhylbenzylamine (3,50 g, 0,02 mol) dans 50 ml de dichlorométhane
et une
solution contenant du bicarbonate de sodium (3,4 g, 0,04 mol) dans 55 ml
d'eau. On agite
durant 30 minutes. Le mélange réactionnel est décanté et la phase organique
lavée avec 100 ml
d'eau puis avec 100 ml d'une solution de saumure. La phase organique est
séchée sur sulfate de
magnésium et le solvant est évaporé au rotavapeur. Le composé attendu est
obtenu sous forme
d'huile (3,50 g, 81 90). Compte tenu de sa réactivité, il est utilisé
immédiatement pour la
réaction suivante.
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
-35-
6-(2-chlorophényl)-7,10-dihydro-1-méthyl-N-(2-trifluorométhylbenzyl)-4H-pyrido
[4',3';4,5]
thiéno [3,2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine -9 {8H)-carbothioamide
On agite à une température voisine de 20° C et durant 1 heure, un
mélange contenant le
2-trifluorométhyibenzylisothiocyanate (18,0,0046 mol) et le 6-(2-chlorophényl)-
7,8,9,10-tétrahydro-1-méthyl-4H-pyrido [4',3 ;4,5] thiéno [3,2-fj [1,2,4]
triazolo [4,3-a] [1,4]
diazépine (1,22 g, 0,0033 mol) dans 20 ml de dichlorométhane. On évapore à sec
le mélange
réactionnel. A l'huile résiduelle est ajoutée 40 ml d'acétate d'éthyle. Après
séparation de
l'insoluble, le solvant est évaporé. On ajoute 40 ml d'éther isopropylique
jusqu'à précipitation
du produit puis on filtre sur fritté et on lave à l'éther isopropylique. On
sèche le solide obtenu
(1,2 g, 63 %) et fon obtient une poudre beige. Point de fusion : 178-
184° C.
RMN1H (400 MHz, DMSO d6, S): 1,68 (m, 1H) ; 2,21 (m,lH) ; 2,67 (s, 3H) ; 3,49
(m, 1H} ;
4,20 (m, 2H) ; 4,86 gym, 1H) ; 5,11 (m, 2H) ; 5,38 (m, 1H) ; 5,60 (m, 1H) ;
6,03 (t, 1H) ;
7,35-7,71 (m, 8H).
IR: vNH(thiourée): 3266 cm-1 ; 1607 cm-1 ; 1313 cm-1 ; 1117 cm-1 ; 761 cm-1
Exemple 37
6-(2-chlorophényl)-7,10-dihydro-1-méthyl-N-benzyl-4H-pyrido [4',3';4,5] thiéno
[3,2-f]
[1,2,4] triazolo [4,3-a] [1,4] diazépine-9(8H)-carboxamide
On agite à température ambiante et durant 2 heures et demie, un mélange
contenant le
benzylisocyanate ( 133 g, 0,01 mol) et le 6-(2-chlorophényl)- 7,8,9,10
tétrahydro-1-méthyl-4H-
pyrido [4',3';4,5] thiéno [3,2-fj [1,2,4] triazolo [4,3-a] [1,4] diazépine
(2,956 g, 0,008 mol)
dans 50 ml de benzène. Le précipité est filtré puis lavé à (éther puis
cristallisé dans un mélange
de solvant: éthanol-alcool isopropylique. On filtre à chaud puis on laisse
cristalliser à froid toute
la nuit. Après filtration des cristaux sur fritté, on lave à l'isopropanol
puis à l'éther, sèche sous
vide durant quatorze heures environ à une température voisine de 75° C
(2,5 g, 62,5 %). Point
de fusion: 146-149° C.
RMN1H (400 MHz, DMSO d6, 8): 1,77 (m, 1H) ; 2,11 (m,lH) ; 2,66 (s, 3H) ; 3,19
(m, 1H) ;
3,73 (m, 1H) ; 4,21 (d, 1H) ; 4,43 (t, 2H) ; 4,49 (d, 1H) ; 4,86 (d, 1H) ;
4,96 (t, 1H) ;
5,58 (d,lH) ; 7,27-7.35 (m, 9H).
IR: vNH (urée): 330? cm-t ; vC=O (carbonyle urée): 1653 cm-I ; 1550 cm-1 ;
1268 cm-~ ;
762 cm-1 ; 724 cm-1
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
-36-
Exemple 38
ester phénylique de l'acide 6-(2-chlorophényl)-7,10-dihydro-4H-pyrido [4',3
;4,5] thiéno
[3,2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine-9(8H)-carboxylique
A 0° C et sous atmosphère inerte, on ajoute goutte à goutte le
phénylchloroformate (0,19 ml,
0,0015 mol) et la triéthylamine (0,2 ml, 0015 mol) à un mélange contenant le
6-(2-chlorophényl)- 7,10-dihydro-1-méthyl-4H-pyrido [4',3';4,5] thiéno [3,2-f]
[1,2,4]
triazolo [4,3-a] [1,4] diazépine (0,37 g, 0,001 mol) dans 5 ml de
dichlorornéthane. On agite à
température ambiante durant deux heures. La phase organique est lavée à l'eau
et séchée sur
sulfate de magnésium. Après évaporation du solvant au rotavapeur, on reprend à
l'éther jusqu'à
précipitation. On purifie par chromatographie flash sur colonne de silice avec
dichlorométhane-
méthanol: 95-5 comme éluant et le filtrat de colonne est concentré au
rotavapeur. On reprend à
l'éther jusqu'à obtention d'un précipité blanc (0,15 g, 31 %).
Point de fusion: 218-?30° C
HPLC- Conditions
colonne: kromasyl C 18 ( 150 x 4,6mm)
Phase mobile: Solution A: acide trifluoro acétique à 0,02%
Solution B: acétonitrile
Gradient Tem s (min.)%A %B Courbe
:
5 90 10
25 30 70
30 30 70 linaire
31 90 10
45 90 10
Temps de rétention (min.) : 14,82
Masse : MH+ (exp.) : .190,07 ; MH+{théorie) : 490,11
Exemple 39
6-(2-chlorophényl)-7.10-dihydro- 1,4-diméthyl-N-(2-trifluorométhylphényl)-4H-
pyrido
[4',3';4,5] thiéno [3,2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine-9(8H)-
carbothioamide
On agite durant deux heures et à une température voisine de 20° C, un
mélange contenant le
2-trifluorométhylphénylisothiocyanate (0,3 ml, 0,0015 mol) et le 6-(2-
chlorophényl)-
7,8,9,10-tétrahydro-l..l-diméthyl-4H-pyrido [4',3';4,5] thiéno [3,2-f] [1,2,4]
triazolo [4,3-a]
[1,4] diazépine (0,383 mg, 0,001 mol) dans 10 ml de dichlorométhane anhydre.
Le mélange
réactionnel est évaporé à sec. On ajoute de l'acétate düsopropyle jusqu'à
précipitation. Après
filtration de l'insoluble, on évapore à sec. De l'éther est rajouté jusqu'à
précipitation. Le
CA 02335724 2000-12-13
WO 99/65917 PC1'/FR99/01422
précipité est filtré sur fritté et lavé à l'éther puis séché sous vide (0,35
g, 59 %) ce qui donne
une poudre jaune clair. Point de fusion: 210-213° C
RMN1H (400 MHz, DMSO d6, 8) : 1,73 (m, 1H) ; 1,89 (d,3H) ; 2,25 (d, 1H) ; 2,61
(s, 3H) ;
3,55 (m, 1H) ; 4,29-4,38 {m, 2H) ; 4,84 (d, 1H) ; 5,70 (d, 1H) ; 7,31-7,70 (m,
8H) ; 9,34 (s,
IH).
IR : vNH {thiourée) : 3408 cm-1 ; 1525 cm-1 ; 1319 cm-1 ; 759 cm-1
Exemple 40
I-benzyl-6-(2-chlorophényl)-7,10-dihydro-N-(2-trifluorométhylphényl)-4H-pyrido
[4',3';4,5]
thiéno [3,2-f] [1,2,4] triazolo [4,3-a] [1,4] diazépine-9(8H)-carbothioamide
On ajoute du trifluorométhylphénylisothiocyanate (0,56 g, 0,0027 mol) à un
mélange contenant
le 1-benzyl-6-(2-chlorophényl)-7,8,9,10-tétrahydro-4H-pyrido [4',3';4,5]
thieno [3,2-f]
[1,2,4] triazolo [4,3-a] [1,4] diazépine (0,8 g, 0,0018 mol) dans du 1,2-
dichoroéthane anhydre
(13 ml). On agite â température ambiante durant 12 heures. Le précipité est
filtré sur fritté puis
lavé à (éther isopropylique, à l'acétate d'éthyle puis à fisopentane et enfin
séché sous vide. On
obtient 0,28 g (24 %) de produit final sous forme d'un solide de couleur jaune
pâle. Point de
fusion : 239-240° C.
RMN1H (400 MHz, CDCl3, 8) : 1,72 (m,lH) ; 2,15 {m,IH) ; 3,50 (m, 1H) ; 4,12
(m, IH) ;
4,19 (d, 1H) ; 4,46 (q, 2H) ; 4,74 (d, 1H) ; 5,33 (d, 1H) ; 5,62 (d, 1H) ;
7,16-7,67 (m,
14H).
IR (cm-1) : 3349, 1527, 1318, 1128, 756.
HPLC (UV) : 95,8 %
Les produits décrits dans le tableau ci-dessous qui constituent les exemples
41 à 148, sont
obtenus selon les mêmes procédés que ceux décrits dans les exemples 32 à 40.
Les symboles
utilisés dans le tableau sont les suivants : Me = méthyl, Et = éthyl, Pr =
propyl, Bu = butyl,
Ph = phényl, Bz = benzyl, Pf = point de fusion.
Ex R X Y R~ R R R Pf (C
41 2-Me0-Ph NH S 2-Cl H H Me 165
42 2-Me-Ph NH S 2-Cl H H Me 165
43 3-F C-Ph NH O 2-Cl H H Me 222-223
44 4-F3C-Ph NH O 2-Cl H H Me 243-245
45 2-isoPr-Ph NH S 2-Cl H H lVle 212-213
46 2-NC-Ph NH S 2-Cl H H Me 232-236
47 2-F3C-Ph NH S 2-Cl H H Et 225-230
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
_38_
48 2-F C-Ph NH S 2-CI H H H 250-255
49 2-teiBu-Ph NH S 2-Cl H H Me 180-182
50 1-na h 1 NH S 2-CI H H Me 194-196
51 2-Ph-Ph NH S 2-Cl H H IV~ 165-170
52 2-F3C0-Ph NH S 2-Cl H H Me 220-223
53 2-Cl-Ph NH S 2-Cl H H Me 200-203
54 2-F-Ph NH S 2-C1 H H Me 206-208
55 2-Et-Ph NH S 2-Cl H H Me 178-180
56 2-Ph0-Ph NH S 2-CI H H Me 230-232
57 2-Pr-Ph NH S 2-Cl H H Me 190-195
58 2-Et0-Ph NH S 2-Cl H H Me 204-206
59 Ph NH S 2-Cl H H lVle 206-210
60 2-Br-Ph NH S 2-CI H H Me 190-195
6I 2-EtOC(O)-Ph NH S 2-Cl H H 1V~ 166-170
62 2-MeS-Ph NH S 2-CI H H Me 178-180
63 2-mo holino-PhNH S 2-Cl H H Me 242-246
64 2-NO -Ph NH S 2-Cl H H Me 190-192
65 2,6-isoPr-Ph NH S 2-Cl H H Me 160-165
66 2,6-Me-Ph NH S 2-Cl H H Me 198-201
67 2,5-(Me0)-Ph NH O 2-Cl H H Me 258-260
68 2-Me0-5-Cl-Ph NH S 2-Cl H H Me 203-206
69 2,4-(Me0)-Ph NH S 2-Cl H H Me 194-196
70 2-CI-5-F C-Ph NH S 2-Cl H H Me 218-220
71 2-Me-5-Cl-Ph NH S 2-Cl H H Me 236-240
72 2,3-Cl-Ph NH S 2-Cl H H Me 230-232
73 2,5-Me-Ph NH S 2-Cl H H N1e 192-196
74 2,5-Cl-Ph NH S 2-Cl H H Me 234-236
75 2-Cl-4-Me-Ph NH S 2-Cl H H Me 206-208
76 2-Me-3-CI-Ph NH S 2-Cl H H Me 248-252
77 2-Me-5-F-Ph NH S 2-Cl H H Me 202-204
78 2,3-Me-Ph NH S 2-Cl H H Me 225-228
79 2-F C-4Br-Ph NH S 2-Cl H H NIe 212-214
80 2-NO -4-Me0-PhNH S 2-Cl H H Me 248-250
81 2-NO -4-Me-Ph NH S 2-Cl H H Me 262-264
82 2-Me0-4-NO NH S 2-Cl H H Me 230-233
-Ph
83 2,5-Br-Ph NH S 2-CI H H Me 260-264
CA 02335724 2000-12-13
WO 99/65917 PCT/FIt99/01422
-39-
84 2-Me0-5-N -Ph NH S 2-Cl H H I Me 205-208
85 2-Cl-4-NO -Ph NH S 2-Cl H H ' Me 244-248
86 2-CI-5-NO -Ph NH S 2-Cl H H Me 252-254
87 2-F C-Ph NH S 2-C1 H H Pr 229-230
88 2-F C-Ph NH S 2-Cl H H Bu 216
89 3-Ph-6-Me0-Ph NH S 2-Cl H H Me 260-262
90 2-F3C-Ph NH S - H H Me 178-185
91 2-F C-Ph NH S 2-C1 H H Ph 190-194
92 2-N02-4-Me0-PhNH S 2-Cl H H Pr 255-260
93 2-N02-4-Me0-PhNH S 2-Cl H H Bu 197-200
94 2-NOZ-4-F3C-PhNH S 2-Cl H H Me 215-220
95 2-MeSO -Ph NH S 2-Cl H H Me 190-195
96 2-F C-4-Cl-Ph NH S 2-Cl H H IVIe 204-206
97 2-N -4-Me0-Ph NH S 4-Cl H H Bz 170-179
98 2-F C-Ph NH S 4-C1 H H Me 192-196
99 2-N02-4-Me0-PhNH S 2-Cl H H n I 202-204
100 2-N -4-Me0-Ph NH S 2-Cl H H hex I 103-105
101 3,5-F C-Ph NH S 2-CI H H Me >260
102 2-NO -4-Me0-PhNH S 3-Cl H H Bz 165-170
103 2-NO -4-F-Ph NH S 2-Cl H H M 176-180
104 2-N02-4-NC-Ph NH S 2-Cl H H Me 206-210
105 2-N02-4-Me0-PhNH S 2-Cl H H 1-napthyl215-218
-mth
I
106 2-N02-4-Me0-PhNH S 2-Cl H H 3-indolyl231-235
-mth
1
107 2-MeS-5-F;C-PhNH S 2-Cl H H Me 185-189
108 2-N02-4-Me0-PhNH S 3-Cl H H~ Me 192-196
109 2-N -4-Me0-Ph NH S 2-Cl H H Me 212-214
110 2-N -4-HO-Ph NH S 2-CI H H Me 225-230
111 2-N02-5-Cl-Ph NH S 2-Cl H H Me 196-200
112 2-NO -5-Me-Ph NH S 2-Cl H H Me 202-204
113 2-N02-4-Et0-PhNH S 2-Cl H H Me 213-215
114 2-N02-4-Me0-PhNH S 2-CI H H 4-Me0-Bz178-180
115 2-NO -4-Cl-Ph NH S 2-Cl H H Me 226-230
116 2-Br-4-Me-Ph NH S 2-CI H H Me 178-180
117 2-NO -4-Me0-PhNH S 2-Cl H H 4-HO-Bz 196-197
!
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
-40-
118 2-F3C-4-N02-PhNH S 2-Cl H H Nie 175-180
119 2-N02-4-Me0-PhNH S H H H Bz 201-202
120 2-N -4-MeO-Ph NH S 2-Cl H H Ph-C 165-170
H4
121 2-N -4-Me0-Ph NH S 2-CI H H EtOC 145-153
H4
122 3-NO - 'd 1 NH S 2-Cl H H Me 224-226
123 4-Me0-Ph CH2 O 2-Cl H H Me 178-180
124 2-indoi 1 - O 2-Cl H H Me > 260
125 3-indoll CH2 O 2-Cl H H Me 190-192
126 4-HO-Ph C H4 O 2-CT H H Me 175-180
127 2-F C-Ph - O 2-C1 H H Me 180-182
128 4-HO-Ph CH O 2-Cl H H Me 188-190
129 5-Me0-2-indol - O 2-Cl H H Me > 250
I
130 Ph - O 2-Cl H H lVle 246-248
131 Ph - S 2-Cl H H Me 200-202
132 5-Me0-2-indol - S 2-Cl H H 1V) > 260
1
133 2-NOZ-Ph CH O 2-Cl H H Me 204-206
134 2-F C-Ph CH S 2-Cl H H lV~ > 260
135 2-N02-4-Me0-PhNH S 4-Cl H H Me 185-190
136 2-N02-Ph CH S 2-CI H H Me 180-185
137 2-NOZ-4-Me0-PhNH S 2-Me0 H H Bu 220-224
138 2-N02-4-Me0-PhNH S 2 Me0 H H Bz 150-154
139 2-N -4-Me0-Ph NH S 2-Me H H Bu 191-193
140 2-N -4-Me0-Ph NH S 2-Me H H Bz 175
141 2-N -4-Me0-Ph NH S 2-Cl H H Ph-Ph 237-240
142 2-N02-4-Me0-PhNH S 2-Cl H H cyclohexyl204-206
mth 1
143 2-N02-4-Me0-PhNH S 2-Cl H H (Me)2N- 179-182
C H4
144 2-N02-4-Me0-PhNH S 2-Cl H H 3-HO-Bz 212-217
145 2- ridvl NH S 2-Cl H H Me 216-218
146 Ph S S 2-Cl H H Me 264-266
147 Ph O O 2-CI H H Me 178-180
148 2-NO -4-Me0-PhNH S 2-Cl H H he 1 198-200
CA 02335724 2000-12-13
WO 99/65917 PCT/FR99/01422
_41_
Etude pharmacologique
Etude de liaison aux récepteurs de la somatostatine
L'affinité des composés de l'invention sur les récepteurs humains de la
somatostatine, est
déterminée par la mesure de l'inhibition de la liaison de la somatostatine-14
marquée à
l'iode-125 ([125I-Tyrl l]SRIF-14) sur les récepteurs de cellules CHO-K11
transfectées.
Les gènes humains codant pour chacun des sous types de récepteurs de la
somatostatine, sstl,
sst2, sst3, sst4 et sst5, ont été isolés et sous-clonés (Proc. Natl. Acad.
Sci. USA 1992, 89,
251-255 ; J. Biol. Chem. 1992, 267, 20422-20428 ; Mol. Pharmacol. 1992, 42,
2136-2142 ;
Proc. Natl. Acad. Sci. USA 1993, 90, 4196-4200 ; Mol. Pharmacol. 1994, 46, 291-
298). Les
vecteurs d'expression ont été construits et des lignées cellulaires clonées
ont été obtenues par
transfection dans des cellules de mammifères CHO-K1. Le plasmide pRSV-neo a
été inclus
comme facteur de sélection.
Les cellules CHO-K1 qui expriment de façon stable les récepteurs humains de la
somatostatine
sont cultivées dans du milieu RPMI 1640 contenant 10% de sérum de veau foetal
et 0,4 mg/ml
de généticine. Les cellules sont collectées par de fEDTA à 0.5 mM et
centrifugées à 500 g
pendant 5 minutes à 4° C. Le culot est resuspendu dans du Tris 50 mM,
pH 7,4 et centrifugé
deux fois à 500 g pendant 5 minutes à 4° C. Les cellules sont lysées
par sonication puis
centrifugées à 39000 g pendant 10 minutes à 4° C. Le culot est
resuspendu dans le même
tampon et centrifugé à 50000 g pendant S minutés à 4° C. Les membranes
cellulaires obtenues
sont conservées à -80°C jusqu'au jour des expériences.
Les expériences d'inhibition compétitives de la liaison de [125I-Tyrl l]SRIF-
14 sont conduites
en duplicat dans des plaques 96 puits. Les membranes cellulaires à 10 (sst2 et
ss5) ou 20 (sstl,
sst3 et sst4) pg de protéines/puits, ont incubées avec [125I-Tyrl l]SRIF-14 à
0,05 nM (sst2)
ou 0,1 nM ( sstl, sst3, sst4 ou sst5) pendant 500 (sst3), 60 {sstl et sst2),
70 (sst5) ou
90 (sst4) minutes à 37°C dans du tampon HEPES 50 mM, pH 7,4, BSA 0,2 %,
MgCl2
5 mM, Trasylol 200 KIU/ml, bacitricin 0,02 mg/ml, flurorure de
phénylméthylsulphonyl
0,02 mg/ml.
Après la période d'incubation, [125I-Tyrll]SRIF-14 libre ou liée aux
récepteurs de la
somatostatine est séparée sur une unité de filtration (Filtermate 196,
Packard) avec des plaques
filtrantes Unifilter GF/C (Packard) prétraitées par du polyéthylènimine à 0,1
%. Après lavage
avec de I'HEPES SO mM, la radioactivité présente sur les filtres est mesurée
par un compteur
Top Count (Packard).
CA 02335724 2000-12-13
WO 99/65917 ~ PCT/FR99/01422
-42- _
La liaison spécifique obtenue en soustrayant la liaison non-spécifique
(déte~ninée en présence
de 0,1 N,M de somatostatine-14) de la liaison totale. Les résultats sont
analysés par régression
non-linéaire (MDL) et les constantes d'inhibition (Ki) déterminées sont
comprises entre 10 et
10000 nM