Note: Descriptions are shown in the official language in which they were submitted.
CA 02351664 2001-05-17
WO 00/31059 PCT/FR99/02861
2-ACYLAMINO-2-DEOXY-GLUCONO-I,5-LACTONES, PROCEDE D'OBTENTION, C OMPOS1TIONS
LES COM-
PORTANT ET UTILISATIONS
La présente invention concerne de nouveaux composés du type 2-
acyfamino-2-déoxy-glucono-1,5-lactone substitués, des compositions
comportant de tels composés, tensioactives etlou biologiquement actives,
des procédés d'obtention de ces composés ainsi que des composés
intermédiaires pour leur obtention.
Des exemples de tensioactifs glycosylés comportant une fonction
lactone sont cités dans la littérature. Pocaiyko et al. (1996) (5) et Kwoh et
al. (1995) (3) décrivent la synthèse enzymatique de la 6-O-dodecyl
gluconolactone, tandis que Kida et al. (1994) (1 ) passent par l'intermédiaire
de la fonction lactone afin de synthétiser des tensioactifs dégradabies en
milieu acide.
Toutefois, ces lactones ne comportent pas de motif N-acyl ou N-
acetyl-glucosamine ; ce motif est important pour la reconnaissance de
certaines enzymes.
Des exemples de synthèse d'inhibiteurs de N-acétyl
glucosaminidase ont été cités dans la littérature par Pokorny et al., 1974
(6); Wolk et al. (7), 1992; Knapp et al. (2), 1996; Panday et al., 1998 (4).
Ces inhibiteurs présentent des inconvénients majeurs notamment leur
faible constante de dissociation (entre 0,13 et 0,45 ~M) fait d'eux de
puissants inhibiteurs inutilisables dans le cadre d'une séparation par
affinité
car la récupération de l'enzyme nécessiterait des conditions opératoires qui
pourraient entraîner sa dénaturation. Aucune des molécules concernées
ne possède de propriétés tensioactives, et c'est le cas notamment pour la
2-acétamido-2-déoxy-glucono-1,5-lactone (Pokorny et al., 1974). Par
conséquent, leur caractère purement hydrophile ne leur permet pas
d'interagir avec des membranes biologiques en vue d'une éventuelle
pénétration ou désorganisation cellulaire, ou avec des amphiphiles
CA 02351664 2001-05-17
WO 00/31059 PCT/FR99/02861
2
organisés en micelles ou liposomes en vue d'une vectorisation ou d'une
séparation liquide/liquide.
On a maintenant mis en évidence qu'une nouvelle classe de
composés du type 2-acylamino-2-déoxy-glucono-1,5 lactone substitués
peuvent présenter l'avantage de posséder des propriétés dans le domaine
des tensioactifs, des propriétés de biodégradabilité et d'étre
biologiquement actifs.
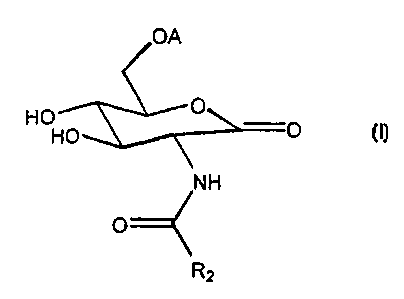
Ainsi, la présente invention concerne les composés de formule (I)
HO
F
NH
O
R2
dans laquelle A représente R, ou -C(O)R, où R, représente un groupement
alkyle comportant de 1 à 30 atomes de carbone, linéaire ou ramifié, saturé
ou insaturé, pouvant ëtre substitué partiellement ou totalement par -Hal où
Hal signifie -Ci, -Br-I ou -F, et pouvant étre interrompu par un ou plusieurs
motifs choisis parmi -O-, -S-, -C(O)-, -NR3C(O)-, -Ph(R,)~- et -(CHZ-CHZ-O)~.-
dans lesquels R3 représente -H ou -(CH2)~..-CH3 où n" vaut de 0 à 17,
R4 représente -H, -CH3, -C2H$, -C3H, et n vaut de 0 à 4 et n' vaut 1, 2 ou 3,
ou R, représente un radical cyclanique à racine diterpénique ou
triterpénique,
et R2 représente un groupement alkyle linéaire ou ramifié en C, à C".
Les composés de l'invention ont notamment les avantages des _
tensioactifs glycosylés à base de glucosamine comme la biodégradabilité.
CA 02351664 2001-05-17
WO OOI31059 PCT/FR99/02861
3
De plus, certains de ces composés peuvent présenter des propriétés
antimicrobiennes et antifongiques. Enfin, ces composés peuvent étre utiles
dans des processus d'inhibition enzymatique ou de reconnaissance
d'enzymes.
L'invention concerne également les procédés de prépa~~tion des
composés de formule I ci-dessus. Ces procédés comportent au moins les
étapes suivantes
a) acylation du chlorhydrate de gfucosamine par le chlorure d'acide
de formule R2C(O)CI ;
b) protection de l'hydroxyle en C1 par un groupe P,, en C3 et C4
par des groupes P2, et de l'hydroxyle en C6;
c) déprotection de l'hydroxyle protégé en C6 ;
d) 6-O-acylation par un composé de formule R,C(O)CI ou 6-O
alkylation par un composé de formule R,HaI pour obtenir le
composé de formule
P2 O
OP~
NH
O
R2
e) déprotection de l'hydroxyle protégé en C, pour obtenir le
composé de formule
CA 02351664 2001-05-17
WO 00/31059 PCT/FR99/02861
4
P2 O
OH
NH
O
R2
f) oxydation du composé obtenu en e) pour obtenir le composé de
formule
O
g) déprotection des groupements hydroxyle protégés en C3 et C,
du composé en f) pour obtenir le composé de formule I,
dans lesquelles A, RZ et Hal ont les mêmes significations que
précédemment, et P,, P2 sont des groupements protecteurs.
De plus, selon un autre aspect de l'invention, celle-ci concerne, à
titre de composés intermédiaires, les composés ayant les formules
suivantes
NH
O
R2
CA 02351664 2001-05-17
WO 00/31059 PCT/FR99/02861
P2 P
OP~
NH
O
R2
P2
OH
5
P2 P O
où A, R2, P, et PZ ont la même signification que précédemment.
En outre, la présente invention concerne les compositions
comportant au moins un ou plusieurs composés de l'invention, un ou
NH
O
R2
NH
O
R2
CA 02351664 2001-05-17
WO 00/31059 PCT/FR99/028G1
6
plusieurs composés obtenus par les procédés de l'invention ou produits
intermédiaires dans ces procédés.
Enfin, l'invention concerne les composés de formule I à titre de
tensioactifs ou de composés utiles dans un processus d'inhibition
enzymatique ou de reconnaissance d'enzyme.
La présente invention sera mieux comprise à la lecture de la
description détaillée et des exemples ci-après et au vu des figures
annexées.
La figure 1 représente la variation de la tension superficielle de
l'eau en fonction du logarithme de la concentration (en mol/I) du composé
de l'invention de formule I où A est C(O)C,H,S et R2 est CH3.
La figure 2 illustre l'effet inhibiteur de la 2-acétamido-2-déoxy-6-O-
octanoyl-glucono-1,5-lactone de formule I où A est C(O)C,H,S et R2 est CH3
sur la N-acétyl glucosaminidase bovine.
La figure 3 représente le diagramme de Dixon confirmant
l'inhibition compétitive de la N-acétyl glucosaminidase par le composé de
l'invention de formule I où A est C(O)C,H,S et R2 est CH3.
La figure 4 illustre l'effet inhibiteur du composé où A est C(O)C,H,S
et R2 est CH3 sur les chitinases de Serratia marcescens.
Parmi les composés de l'invention, sont préférés ceux pour
lesquels A représente -C(O)R, où R, représente un groupement
comportant de 1 à 21 atomes de carbone, de préférence un groupement
alkyle linéaire en C5 à C2,.
Parmi les composés de l'invention, sont également préférés ceux
pour lesquels R2 représente un groupement alkyle n-CpH2p" où p vaut de 1
à 7.
Un des composés préférés de l'invention est celui pour lequel A est
-C(O)-n-C7H,5 et R2 est CH3.
Dans le cas préféré de la 2-acétamido-2-déoxy-6-0-octanoyl
glucono-1,5-lactone une reconnaissance spécifique d'enzymes du type N
acétyl glucosaminidase a été mise en évidence et quantifiée.
CA 02351664 2001-05-17
WO 00/31059 PCT/FR99/02861
7
L'intérêt et l'originalité de cette molécule se résument en deux
points importants : d'abord, son caractère tensioactif, révélé par
l'abaissement de la tension superficielle de l'eau de 71 à 30 mNlm et par
sa concentration micellaire critique de l'ordre de 25 mM (exemple 2). Ces
données sont comparables à celle de tensioactifs glycosylés commerciaux
comme l'HECAMEG ou le n-octyl glucoside qui sont largement utilisés en
biochimie, par exemple pour la solubilisation de protéines membranaires, la
formation de liposomes ou la stabilisation de conjugués
immunoenzymatiques pour ELISA. La relativement grande CMC de cette
molécule (25 mM) la rend facilement éliminable par dialyse tandis que sa
structure lui permet d'être titrée par HPLC.
Ensuite, la structure lactone de cette molécule lui confère des
propriétés biologiques intéressantes comme la reconnaissance spécifique
des N-acétyl glucosaminidases {exemple 3). Comparée à celles des
inhibiteurs connus de ce type d'enzyme, sa constante d'inhibition Ki de
l'ordre de 3 ~.M la rend adéquate dans un contexte de séparation par
affinité. L'équilibre lactone (forme fermée) et acide gluconique (forme
ouverte) peut permettre une dissociation efficace du complexe
ligand/enzyme via le changement du pH par exemple.
En ce qui concerne les procédés selon l'invention, il s'agit de la
préparation d'une famille de tensioactifs glycosylés à partir d'une N-acyl
glucosamine.
Les composés de structure N-acyf glucosamine sont généralement
obtenus à partir de chlorhydrate de glucosamine -produit de l'hydrolyse
acide de la chitine et d'un chlorure d'acide. Ainsi, dans un mode de
réalisation préféré de la présente invention, le produit de départ est la N-
acétyl glucosamine (NAG).
Pour les étapes de protection, les groupements P, et P2 ci-dessus
sont des groupements protecteurs usuels convenables des groupes
hydroxyles des carbohydrates. Par exemple, on peut utiliser le groupement
protecteur allyle pour P, et le groupement protecteur benzyle pour P2, sans
CA 02351664 2001-05-17
WO 00/31059 PCT/FR99/02861
8
que d'autres groupes de protection convenables soient exclus.
De même, la protection en C6 peut être réalisée avec un
groupement trityle (Tr), sans exclure d'autres groupements protecteurs
convenables ; la déprotection de l'hydroxyie protégé par Tr en C6 est
réalisée en milieu acide, dans ce mode particulier de réalisation.
De préférence, la désallylation est mise en oeuvre dans des
conditions douces ; enfin, la déprotection des hydroxyles en C3 et C4 se
fait, dans un mode de réalisation particulier, par hydrogénation catalytique.
Dans le schéma réactionnel, Hal représente Cl, Br, 1 ou F, le chlore
et le brome étant préférés dans le mode de réalisation décrit ci-après.
Le procédé de synthèse consiste à
1 ) protéger par un groupement P" par exempte allyle l'hydroxyle en
C1,
2) protéger par un groupement protecteur, par exemple trityle (Tr)
l'hydroxyle en C6,
3) protéger par des groupements P2, par exemple benzyle les
hydroxyles en C3 et C4,
4) déprotéger l'hydroxyle en C6,
5) 6-O-acyler par un chlorure d'acide ou 6-O-alkyler par un
halogénure d'alkyle,
6) déprotéger en C1,
7) oxyder en C1 pour obtenir la lactone, et
8) déprotéger les hydroxyles en C3 et C4,
selon le schéma suivant
CA 02351664 2001-05-17
WO 00/31059 PCT/FR99/02861
9
OH
HO N-Acylation HO
h ~ f
OH OH
NHZ .HC1 NH
O
R2
OH OH
HO Allylation HO
OH
N H OAII
NH
O O
R2 R
2
OH OTr
HO Tritylation
I. --~ HO
NH OAII NH OAII
O O
R2 R2
CA 02351664 2001-05-17
WO OOI31059
PCT/FR99/02861
HO Benzylation B~O
Bi
OAII
NH NH OAII
O O
R2 R
2
OTr
BnB ô ~" Déprotection en C6 Bn0
' Br
NH OAII OAfI
NH
0
O
R2 R2
S-O-acylation
Bn0 6-O-alkylation Bn0
Br
Br
NH OAII NH OAII
O
O
R2 R . _.
CA 02351664 2001-05-17
WO 00!31059 PCT/F'R99/02861
11
Bn0 rotection en C1 Bn0
Br ~ Bi
OA11 OH
NH NH
O O
R2 R2
OA OA
Bn0 Oxydation Bn0
Bi ~ Br
OH
NH NH
O O
R2 R2
O Déprotection en C3 et
BnBnO O > HO
NH
NH
O
R2
R2
La structure et fa pureté des produits obtenus peuvent étre
CA 02351664 2001-05-17
WO 00/31059 PCT/FR99/02861
12
déterminées par spectrométrie de masse, par RMN ~ H et ~ 3C, et par
analyse élémentaire, comme cela apparaîtra dans les exemples.
Les propriétés tensioactives de cet exemple particulier ont été
déterminées par mesure de la tension superficielle de solutions de
S différentes concentrations. La concentration micellaire critique (CMC) a été
ainsi évaluée.
De plus, l'affinité de cette molécule pour différentes enzymes de
type glycosidase a été estimée par l'étude de l'inhibition de leur activité.
Les enzymes testées sont par exemple la N-acétyl glucosaminidase
bovine, les chitinases de S. marcescens ayant une activité chitobiase et le
lysozyme.
De plus, selon un autre aspect de l'invention, celle-ci concerne les
compositions comportant les composés de l'invention. En effet, les
composés ci-dessus peuvent être utilisés du tait des propriétés suivantes
etlou dans les applications suivantes
- ligand tensioactif pour une séparation liquide /liquide par affinité,
- effet bactéricide ou fongicide résultant de propriétés inhibitrices
en association avec une pénétration cellulaire facilitée,
- inclusion dans des vésicules ou liposomes pour transporter des
, enzymes ou des substances actives,
- incorporation possible dans des préparations cosmétiques ou
dermatologiques,
- activité biologique par inhibition d'enzymes, notamment des
enzymes réalisant des réactions impliquant la N-acétyiglucosamine, telles
que les chitinases et les N-acétyl glucosaminidases.
C'est pourquoi l'invention concerne les compositions comportant au
moins un ou plusieurs composés de l'invention, un ou plusieurs composés
obtenus par le procédé de l'invention ou un ou plusieurs composés
intermédiaires.
Ces compositions peuvent être prévues notamment pour un usage
cosmétique ou pharmaceutique et comporter alors un support acceptable
CA 02351664 2001-05-17
WO 00/31059 PCT/FR99/OZ861
13
pour ces applications. Elles peuvent aussi être envisagées pour une
application pesticide, antibactérienne, antifongique, insecticide ou
antivirale, et comporter alors un support acceptable pour ces applications.
Les compositions de l'invention peuvent aussi être des
compositions détergentes, par exemple destinées au milieu industriel.
Les compositions détergentes selon l'invention sont caractérisées
en ce qu'elles contiennent de 0,1 à 60% en poids d'un ou plusieurs
composés de l'invention, ainsi que 40 à 99,9% d'un support acceptable
pour cette application, par exemple une base détergente. La base
détergente est usuellement choisie parmi tes tensioactifs anioniques, non
ioniques, cationiques ou amphotères et les mélanges de ces composés.
L'adjuvant est usuellement choisi parmi les adjuvants ou les
mélanges d'adjuvants connus dans le domaine des lessives.
Les compositions cosmétiques selon l'invention sont caractérisées
en ce qu'elles contiennent de 0,1 à 50%, de préférence 5 à 35%, en poids
d'un ou plusieurs composés de l'invention et un excipient etlou une base
détergente et/ou un adjuvant.
Les compositions cosmétiques peuvent se présenter sous la forme
de savon liquide doux, shampooing, bain moussant, gel douche ou formule
de soins, notamment pommade, crème et lait, solution aqueuse ou
hydroalcoolique.
Lorsque la composition de l'invention est un savon liquide doux,
elle peut comporter de 5 à 35% en poids d'un composé de l'invention et de
70 à 95% en poids d'un excipient.
Certains excipients, bases détergentes et adjuvants sont
généralement choisis parmi les composés connus de l'homme du métier.
On peut citer notamment les composés décrits dans la demande de brevet
EP 769499.
Lorsqu'elles sont utilisées pour le traitement de la peau ou des
cheveux, elles peuvent se présenter sous forme de crème, de lait,
d'émulsion (eau dans l'huile ou huile dans l'eau), de gel, de solution
CA 02351664 2001-05-17
WO 00/31059 PCT/FR99/02861
14
aqueuse ou hydroalcoolique. Elles contiennent alors en plus des adjuvants
tels que les parfums, colorants, agents conservateurs, agents
épaississants et agents émulsifiants, tout autre produit usuel et connu dans
l'état de la technique et couramment utilisé pour formuler des compositions
de ce type.
Les compositions destinées au nettoyage des cheveux peuvent se
présenter sous la forme de solution aqueuse ou hydroalcoolique,
d'émulsion, de crème, de lait, de gel et éventuellement être conditionnées
sous forme d'aérosol avec un agent propulseur.
Lorsque les compositions sont prévues pour un usage
pharmaceutique, elles comportent un support pharmaceutiquement
acceptables et peuvent être sous forme de solution aqueuse,
hydroalcoolique, gel, crème, sirop ou aérosol et contenir des adjuvants
usuels et pharmaceutiquement acceptables pour l'application prévue.
Des formulations où les composés de l'invention sont sous forme
de micelles inverses peuvent être utiles, pour leur application à l'extraction
liquide-liquide de N-acétyl glucosaminidase notamment. On peut envisager
de préparer des solutions dans un solvant apolaire comme l'isoctane par
exemple, et comportant de 50 à 250 mM d'AOT (Dioctyle sulfosuccinate de
sodium), de 1 à 2,5 mM d'un ou plusieurs composés de l'invention, et de
0,5 à 6 M d'eau, éventuellement additionnée de sel, et comportant
éventuellement par exemple un tampon (90% KCI 0,1 M/10% tampon
phosphate 0,01 M pH 7), et éventuellement un ou plusieurs co-solvants
et/ou co-tensioactifs.
Pour certaines applications, il est possible de préparer des
liposomes unilamellaires comportant par exemple, en milieu aqueux, des
phospholipides et un ou plusieurs composés de l'invention.
De plus, les compositions de l'invention peuvent être utilisées pour
les propriétés biologiques des composés de l'invention, notamment dans
des processus d'inhibition enzymatique ou de reconnaissance d'enzyme.
Les exemples ci-après comportent de telles compositions. De façon
CA 02351664 2001-05-17
WO 00/31059 PCT/FR99/02861
générale, elles comportent outre un ou plusieurs composés de l'invention,
de l'eau, un tampon aqueux par exemple un tampon acétate pH 4,5 (0,2 M)
ou phosphate pH 6,6 (0,2 M) ; un support hydroalcoolique comportant un
ou plusieurs alcools et adjuvants usuels et convenables pour l'application
5 donnée.
Les compositions peuvent aussi être sous forme d'émulsions ou
pré-émulsions, comportant par exemple des émulsifiants, adjuvants et
épaississants usuels et convenables pour l'application envisagée, ou
encore sous forme de gel.
Matériel et méthodes
Détermination de la Concentration Micellaire Critique
La tension superficielle y du liquide au contact de l'air est mesurée
à 25°C par la méthode de la plaque de Wilhelmy (tensiomètre TENSIMAT
n3-Prolabo). Celle-ci consiste à plonger verticalement dans un liquide une
lame en platine (de largeur 19,54 mm), puis de la retirer progressivement
en suivant la tension exercée par le film liquide sur la lame. La valeur
maximale lue avant l'arrachement complet de la lame représente la tension
superficielle exprimée en mN/m. Après étalonnage de l'appareil
(étalonnage en deux points : la valeur zéro avec la lame à l'air et !a valeur
50,2 mN/m avec la lame lestée d'un poids de 200 mg), les tensions
superfcielles de solutions contenant des quantités croissantes du produit
tensioactif sont lues (mesures répétées trois fois). La concentration
micellaire critique est obtenue à partir des diagrammes classiques y = f(Log
C) où C représente la concentration exprimée en mol/l.
Étude de l'inhibition en~matioue
a) Cas de la N-acétylglucosaminidase (NaGase)
L'enzyme utilisée comme témoin est la ~-N-acétylglucosaminidase
(EC 3.2.1.52) de rein bovin (Sigma A-2415) et son substrat est le p-
CA 02351664 2001-05-17
WO 00/31059 PCT/FR99/02861
16
nitrophényl 2-acétamide-2-déoxy glucopyranoside (Acros 22941-1000)
(pNphNAG). L'enzyme commerciale, sous forme de suspension dans une
solution 3,2M de (NH4)2S04, est centrifugée à 13000 rpm pendant 5
minutes et le culot est repris dans 1 ml d'eau. La solution obtenue sera la
S solution enzymatique mère.
Protocole : 100 pl de la solution enzymatique diluée au 1/10 sont
mélangés à 100 ~I de tampon citrate pH 4,2 et à 300 pl de la solution
d'inhibiteur (ou d'eau pour la référence) et l'ensemble est incubé à
37°C
pendant 5 minutes dans une cuve de spectrophotomètre. Après addition de
500 ~I de substrat (à 5 mM ou à 2,5 mM), l'incubation est continuée
pendant 8 minutes à 37°C et la densité optique à 400 nm est suivie. La
quantité de p-nitrophénol libérée par la réaction enzymatique est
déterminée par la corrélation de la densité optique à une courbe étalon
D0400nm = f([p-nitrophénol]). L'unité d'activité N-acétylglucosaminidase
est définie par la quantité d'enzyme nécessaire pour libérer une mole de
p-nitrophénol par minute dans les conditions sus-citées.
b) Cas des chitinases de Serratia marcescens
On étudie ici l'activité chitobiase d'une solution de chitinases
partiellement purifiées sur une colonne échangeuse d'anions (Pharmacia)
Mono P 5/20. Le substrat utilisé dans ce cas est le pNphNAG à 5 mM.
Protocole : 100 ~I de la solution enzymatique diluée 4 fois sont
mélangés à 100 pl de tampon citrate pH 4,2 et à 300 ~I de solution
d'inhibiteur (ou d'eau pour la référence) dans une cuve de
spectrophotomètre. Après incubation pendant 5 minutes à 37°C, sont
ajoutés au mélange 500 ~I de la solution de pNphNAG à 5 mM. Les
cinétiques d'évolution de la densité optique à 400 nm sont suivies pendant
8 minutes. Les quantités de p-nitrophénol libérées sont comparées entre
les échantillons contenant des quantités croissantes d'inhibiteur.
CA 02351664 2001-05-17
WO 00/31059 PCT/FR99/02861
17
c) Cas du lysozyme
L'enzyme étudiée est le lysozyme de poule (Sigma, L-6876) à 0,5
g/I dans du tampon phosphate 100 mM pH 6,5 et le substrat est constitué
de parois de Micrococcus lysodeikticus (Sigma) à 17 mg/100 ml en
suspension dans le même tampon.
Protocole : 100 ~I de solution enzymatique sont dilués avec 400 pl
de la solution d'inhibiteur. L'ensemble est laissé à température ambiante
pendant 5 ou 10 minutes. Ensuite, 40 pl du mélange sont ajoutés à 3 ml de
la suspension de substrat dans une cuve de spectrophotomètre. La densité
optique est lue à 450 nm toutes les 10 secondes pendant 3 minutes.
On définit 150 comme la concentration de composé capable
d'inhibé r 50% de l'activité enzymatique dans les conditions du dosage.
Exemple 1 : Synthèse chimique de la 2-acétamido-2-déoxy-6-O-
octanoyl-glucono-1,5-lactone à partir de N-acétyl glucosamine (NAG).
L'étape 1 consiste en ta préparation de l'allyl 2-acétamido-2-déoxy-
glucopyranoside (b) à partir du NAG
35 g de NAG et 3,5 ml de BF3,Et20 ont été ajoutés sous Argon à
350 ml d'alcool allylique. L'ensemble a été porté à reflux pendant 3 h.
Après refroidissement, les solvants ont été évaporés pour donner un gel
solide de couleur jaune clair. Ce dernier a été lavé pendant une nuit dans
de l'éther puis recueilli par filtration. Après broyage et séchage des
agrégats, une poudre blanche a été obtenue : 40 g (Rendement 97%).
L'étape 2 consiste en la préparation de l'allyl 2-acétamido-2-déoxy-
6-O-trityl-glucopyranoside (c):
8,4 g de (b) ont été ajoutés à 90 ml de pyridine contenant 12 g de
chlorure de triphénylméthane (TrCI). Après 24 h de réaction à température
ambiante, le mélange réactionnel a été chauffé à 90°C pendant 1 h.
Après
refroidissement, ie mélange a été versé dans de l'eau glacée puis extrait
avec du chloroforme. Après lavage à l'eau, séchage, puis évaporation des
CA 02351664 2001-05-17
WO 00/31059 _ PCT/FR99/02861
18
solvants, on a obtenu une gomme épaisse. Cette demiére a été reprise
dans l'éthanol absolu puis reprécipitée dans de l'éther pour donner un
solide de couleur brune: 10,5 g (Rendement = 65%).
L'étape 3 consiste en la préparation de l'allyl 2-acétamido-2-déoxy-
6-O-trityl-3,4-O-dibenzyl-glucopyranoside (d)
g de (c), 12 g de KOH et 7 ml de bromure de benzyle dans 340
ml de toluène ont été portés à reflux pendant 3 h. La suspension obtenue a
été alors filtrée à chaud sur célite et les résidus solides ont été lavés au
toluène chaud. Les filtrats ont été rassemblés et lavés. Après séchage,
10 évaporation des solvants, un solide blanc jaune a été obtenu : 12 g
(Rendement = 88%).
L'étape 4 consiste en la préparation de l'allyl 2-acétamido-2-déoxy-
3,4-O-dibenzyl-glucopyranoside (e)
5 g de (d) ont été dissous dans 125 ml d'un mélange
méthanol/dichlorométhane (30 :70) contenant 4% (m/v) d'acide para
toluène sulfonique (APTS). L'ensemble a été agité à température ambiante
pendant 3 h. Le mélange réactionnel a été ensuite neutralisé, lavé à Peau
puis séché. Après évaporation des solvants, le produit brut obtenu a été
purifié sur silice pour donner un solide blanc : 2 g (Rendement = 62%).
L'étape 5 consiste en la préparation de l'allyl 2-acétamido-2-déoxy-
6-0-octanoyl-3,4-O-dibenzyl-glucopyranoside (f):
9,5 g de (e) et 5 g de chlorure d'octanoyle dans 150 ml de toluène
ont été portés à reflux à 90-95°C pendant 4 h. Après refroidissement,
le
mélange réactionnel a été versé dans 600 ml d'eau et extrait avec du
toluène. Les phases organiques ont été rassemblées, lavées au NaHC03
puis à l'eau. Finalement, après séchage et évaporation des solvants, le
produit brut a été purifié sur silice pour récupérer 8,6 g de (f) (Rendement =
70%).
L'étape 6 consiste en la préparation du 2-acétamido-2-déoxy-6-O-
octanoyl-3,4-O-dibenzyl-glucopyranose (g)
8 g de (f), 1,2 g de Diazabicyclooctane (DABCO) et 3 g de chlorure
CA 02351664 2001-05-17
WO 00/31059 PCT/FR99/02861
19
de Tris triphényl phosphine Rhodium (Rh(PPh3)3C1) dans 400 ml d'une
solution aqueuse de méthanol à 90% (v/v) ont été portés à reflux pendant 4
heures. Après filtration sur papier filtre et concentration, l'ensemble a été
repris dans 250 ml de chloroforme, lavé à l'acide citrique 5% (m/v) puis à
l'eau. Après séchage et évaporation des solvants, le mélange brut a été
repris dans 150 ml d'une solution aqueuse d'acétone à 90% (v/v). On y a
ajouté 3 g de HgCl2 et on a laissé l'ensemble sous agitation à température
ambiante pendant 60 minutes.
Les solvants ont été ensuite évaporés et les résidus ont été repris
dans du chloroforme. La phase organique a été lavée avec une solution
saturée de KI puis avec de l'eau. Après séchage, l'évaporation des
solvants a fourni une huile épaisse. La chromatographie sur cotonne de
silice a donné un produit pur : 5 g (Rendement = 67%).
L'étape 7 consiste en la préparation du 2-acétamido-2-déoxy-6-O-
octanoyl-3,4-O-dibenzyl-glucono-1,5-lactone (h)
Dans un tricot muni d'une ampoule à brome et d'une entrée / sortie
d'Argon, 5 ml de dichlorométhane (DCM) contenant 0,16 ml de chlorure
d'oxalyle ont été refroidis à -70°C. 0,26 ml de diméthylsulfoxide
dilués dans
4 ml de DCM ont été ajoutés goutte à goutte et le mélange a été laissé à -
70°C sous agitation pendant 10 minutes. 200 mg de (g) ont été dissous
dans du DCM puis ajoutés goutte à goutte au mélange. Après 45 minutes
de réaction, 1 rnl de triéthylamine (TEA) a été rajouté et l'ensemble a été
gardé à -70°C pendant 30 minutes. Le mélange a été amené à
température ambiante et lavé à l'eau. Les deux phases ont été séparées et
la phase aqueuse a été extraite 2 fois avec du DCM. Les phases
organiques ont été rassemblées et lavées avec une solution d'HCI 1 N, une
solution de NaHC03 5% puis trois fois à l'eau. La concentration de la
phase organique a .produit une huile claire de masse 187 mg.
Rendementt= 94%.
L'étape 8 consiste en la préparation du 2-acétamido-2-déoxy-6-O-
octanoyl-glucono-1,5-iactone (i)
CA 02351664 2001-05-17
WO 00/31059 PCTlFR99/02861
160 mg de (h) ont été dissous dans 10 ml de méthanol contenant
180 mg de Palladium sur charbon 10%. La suspension a été agitée sous
atmosphère d'hydrogène pendant une nuit. Le catalyseur a été enlevé par
filtration sur papier filtre et le filtrat a été refiltré sur coton.
L'évaporation du
5 solvant a fourni un gel solide de masse 92 'mg (rendement 87%).
Formule brute C16H27N07. Masse molaire : 345.
Spectrométrie de masse
[M+H]+ = 346
10 [M+NH4~+ = 363
RMN 1 H (solvant DMSO deutéré)
8(ppm) = 0,82 (t, 3H, CH3); 1,21 (m, 8H, CH2); 1,48 (m, 2H, CH2); 1,89 (s,
3H, CH3); 2,29 (t, 2H, CH2); 3,2-4,87 (m, 8H, OH, CH, CH2); 7,99 (d, 1 H,
15 NH).
RMN 13C (solvant DMSO deutéré)
8(ppm) = 14,0; 22,1; 22,5; 24,5; 28,5; 28,5; 31,2; 33,6; 55,8; 65,9; 68,5;
69,3; 71,6; 169,6; 171,4; 173,1.
Analyse élémentaire
Calculé : Trouvé
C : 55,6% C : 51,8%
H : 7,82% H : 7,72%
N : 4,05% N : 4,08%
Exemple 2 : Propriétés tensioactives. Détermination de la
concentration micellaire critique (CMC).
On a suivi l'évolution de la tension superficielle y(en mN/m) d'une
CA 02351664 2001-05-17
WO OOI31059 PCT/FR99/02861
21
solution aqueuse (volume = 10 ml) en fonction des quantités de produit (C
en Molll) (A = C(O)C,H,S et RZ = CH3) dissous. Les résultats obtenus sont
illustrés dans la figure 1. La concentration micellaire critique correspond à
la concentration au dessus de laquelle la tension superficielle devient
constante.
On note tout d'abord le caractère tensioactif de la molécule,
confirmé par l'abaissement de ia tension supeficielle de 71 à 30 mN/m
pour des concentrations allant de 0 à 25 mM (soit 8,6 g/l).
La CMC du 2-acétamido-2-déoxy-6-0-octanoyi glucono-1,5-lactone
est égale à 25 mM, et est du même ordre de grandeur que celles de
l'HECAMEG (22 mM) et de l'octyl glucoside (18 mM).
Exemple 3 : Propriétés biologiques : inhibitions enzymatiques.
On a testé l'affinité de la 2-acétamido-2-déoxy-6-O-octanoyl
glucono-1,5-lactone de l'exemple 2 pour trois sortes de gfycosidases, la N-
acétyl glucosaminidase bovine, les chitinases de Serratia marcescens et le
lysozyme de poule en évaluant le pouvoir inhibiteur de cette molécule sur
ces enzymes.
a) Cas de la N-acétyl glucosaminidase bovine
Nous avons suivi colorimétriquement les quantités de p-nitrophénol
libéré (en 10'3 ~mol/mn) par l'action de la N-acétyl glucosaminidase
(NaGase) sur le pNphNAG (à 2,5 mM) en présence de quantités
croissantes de (i) (concentration C en ~M). Les résultats illustrant
l'activité
NaGase obtenus sont montrés dans la figure 2.
L'inhibition de la N-acétyl glucosaminidase par (i) se trouve donc
démontrée. La 150 de (i) est de l'ordre de 7 ~M.
Pour déterminer la constante d'inhibition Ki, nous avons utilisé la
méthode graphique de Dixon qui consiste à tracer l'inverse de la vitesse
initiale (1/vo) de la réaction enzymatique en fonction de la concentration
CA 02351664 2001-05-17
- WO 00/31059 PCT/FR99/02861
22
d'inhibiteur (C en pM) pour deux concentrations différentes de substrat.
L'abscisse du point d'intersection des deux droites correspond à - Ki.
Avec fes deux concentrations de substrat 2,5 et 5 mM nous avons
obtenu les droites de la figure 3. Ces résultats confirment le caractère
d'inhibition compétitive de (i), propre aux analogues de l'état de transition,
et donnent une estimation de Ki de l'ordre de 3 pM.
b) Cas des chitinases de Serratia marcescens
De la mëme façon, les quantités de p-nitrophénol libérées par
l'activité chitobiase des chitinases de S. marcescens sur le p-nitrophényl-
NAG e;~ présence de concentrations (C en ~M) de (i) allant de 0 à 1,3 mM
ont été mesurées.
Les résultats représentés sur la figure 4 montrent que ta 2-
acétamide-2-déoxy-6-O-octanoyl-glucono-1,5-lactone a une affinité pour
certaines chitinases de Serratia marcescens puisque cette molécule peut
inhiber l'activité chitobiase d'un échantillon partiellement purifié de ces
enzymes.
La 150 dans ce cas est de l'ordre de 1,2 mM.
c) Cas du iysozyme
Aucune différence n'a été décelée entre l'activité d'une solution de
lysozyme à 0,1 mg/ml en présence ou non de (i) à une concentration égale
à 1,8 mM.
En résumé, on peut conclure que la 2-acétamide-2-déoxy-6-O-
octanoyl-glucono-1,5-lactone {i) est plus affine pour !a N-acétyl
giucosaminidase bovine que pour les chitinases de S. marcescens, et n'est
pas du tout affine pour le lysozyme.
CA 02351664 2001-05-17
WO 00/31059 PCT/FR99/02861
23
REFERENCES BIBL10GRAPHIQUES
(1) Kida T., Morishima N. Masuyama A; et Nakatsuji N. (1994) New
cleavable surfactants derived from glucono-1,5-lactone. J. Am. Oil
Chem. Soc. 71, (7), 705-710.
(2) Knapp S., Vocadlo D., Gao Z., Kirk B., Lou J. et Withers S. (1996)
NAG-Thiazoline, an N-acetyl-b-hexosaminidase inhibitor that implicates
acetamido participation. J. Am. Chem. Soc. 118, 6804-6805.
(3) Kwoh D., Pocalyko D., Carchi A., Harirchian B., Hargiss L. Et Wong T.
(1995) Regioselective synthesis and characterization of 6-O-
alkanoylgluconolactones, Carb. Res. 274, 111-121.
(4) Panday N., Granier T. et Vasella A. (1998) Synthesis and evaluation of
indolizine-type inhibitors of N-acetyl-b-D-glucosaminidases. Helv. Chim.
Acta 81, 475-490.
(5) Pocalyko D., Carchi A., Harirchian B. Et Vem~eer R. (1996) Straight
chain saturated C8-18 alkyl aldonolactone esters and an enzymic
process for their preparation. U.S. patent n° 5,505,938.
(6) Pokomy M., Zissis E., Fletcher H.G. et Pravdic N. (1974) The inhibitory
activity of 2-acetamido-2-deoxy-D-giuconolactones and their
isopropylidene derivatives on 2-acetamido-2-deoxy-b-D-glucosidase.
Carb. Res. 37, 321-329.
(7) Wolk D., Vasella A., Schweikart F. et Peter M. (1992) Synthesis and
enzyme-inhibition studies of phenyisemicarbazones derived from D-
glucono-1,5-lactone and 2-acetamido-2-deoxy-D-glucono-1,5-lactone.
Helv. Chim. Acta 75, 323-334.