Note: Descriptions are shown in the official language in which they were submitted.
CA 02408865 2002-11-13
WO 01/87995 PCT/FRO1/01473
1
POLYM~RES AYANT DES FONCTIONS HYDROXYLES SUR LES CHA¿NES
LATÉRALES
[Domaine de l'invention]
La présente invention concerne des polymères ayant des fonctions
hydroxyles sur les chaînes latérales et plus particulièrement ceux qui
résultent
de la réaction (i) d'un copolymère comprenant un époxyde insaturé sur une
chaîne latérale avec (ü) un réactif portant une fonction acide carboxylique et
éventuellement une ou plusieurs fonctions hydroxyles. La réaction peut
s'écrire
de la façon suivante, R1 désignant un groupement pouvant porter une ou
plusieurs fonctions hydroxyles:
C ,,~,~"M,"""""~ + O ~ / ~,~~M~,~,~~ C ,M
C
HC OH
HC \ R
1
H2C ~ H2C
O
O C
R1
Ces polymères sont utiles comme donneurs de protons par exemple
dans des mélanges avec d'autres polymères. Ces polymères peuvent aussi
être transformés en films qûi ont des propriétés de perméabilité à la vapeur
d'eau et d'imperméabilité à l'eau liquide (imperrespirants). Ces polymères
peuvent être aussi utilisés pour leur réactivité avec des polyisocyanates par
exemple pour faire des adhésifs réticulables à l'humidité.
[l'art antérieur et le problème technique]
CA 02408865 2002-11-13
WO 01/87995 PCT/FRO1/01473
2
Le brevet EP 600767 décrit des compositions constituées du produit de
réaction d'un copolymère éthylène-acétate de vinyle-(meth)acrylate
d'hydroxyéthyle avec un polyisocyanate en excès. Ces compositions sont des
adhésifs réticulables à l'humidité.
Le brevet EP 810247 décrit des compositions constituées du produit de
réaction d'un copolymère éthylène-(meth)acrylate d'alkyle-(meth)acrylate
d'hydroxyéthyle avec un polyisocyanate en excès. Ces compositions sont des
adhésifs réticulables à l'humidité.
Le brevet EP 538033 décrit des copolymères de l'éthylène et du
(meth)acrylate d'hydroxyéthyle. Ces polymères peuvent être transformés en
films qui ont des propriétés de perméabilité à la vapeur d'eau et
d'imperméabilité à l'eau liquide (imperrespirants).
On a maintenant trouvé des copolymères qui peuvent contenir beaucoup
plus de fonctions hydroxyles mais surtout qui peuvent contenir d'autres
fonctions en plus des fonctions hydroxyles. II suffit de partir par exemple
d'un
copolymère de l'éthylène et d'un époxyde insaturé et de faire réagir un
produit
portant une fonction acide carboxylique et éventuellement une ou plusieurs
fonctions hydroxyles. On utilise les fonctions époxyde insaturé, pourvu
qu'elles
soient en nombre suffisant, pour fixer d'autres fonctions sur le copolymère.
[Brève description de l'invention]
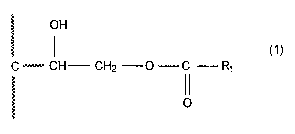
La présente invention concerne un polymère de formule (1 ) suivante
dans laquelle R1 dësigne un radical alkyle, cycloalkyle ou aromatique pouvant
porter une ou plusieurs fonctions hydroxyles.
OH
(1)
C ~~~~~~~ CH CH2 0 C R~
O
CA 02408865 2002-11-13
WO 01/87995 PCT/FRO1/01473
3
On peut obtenir ce polymère de formule générale (1 ) par réaction du
copolymère de formule générale (2) avec un réactif R1-COOH
C~~~~~~~ CH CH2 (2)
\ 0
Selon une première forme avantageuse de l'invention, le copolymère (2)
est un copolymère de l'éthylène et d'un époxyde insaturé.
Selon une deuxième forme avantageuse de l'invention, le réactif
R1 COOH est un acide carboxylique comprenant au moins une fonction alcool
sur son radical R1.
Selon une troisième forme avantageuse de l'invention, le polymère (1 )
peut porter des groupes R1. et des groupes R2 différents de R1, les groupes R2
étant branchés de la même manière que les groupes R1 décrits précédemment.
R2 désigne une quinone.
Ces produits sont utiles comme polymères donneurs de protons, pour
faire des films imperrespirants ou des produits réticulables par des
polyisocyanates en particulier des adhésifs réticulables à l'humidité.
[Description détaillée de l'invention]
A titre d'exemple de copolymère (2), on peut citer les polyoléfines, le
polystyrène, fe PMMA, les polyamides, les polymères fluorés, le polycarbonate,
les polyesters saturés tels que le PET ou le PBT, les polyuréthanes
thermoplastiques (TPU) et les polycétones, tous ces polymères étant greffés
par un époxyde insaturé tel que par exemple le (méth)acrylate de glycidyle.
Selon une première forme avantageuse de l'invention, le copolymère (2)
est choisi parmi les copolymères de l'éthylène et d'un époxyde insaturé. Ces
CA 02408865 2002-11-13
WO 01/87995 PCT/FRO1/01473
4
copolymères peuvent être des polyéthylènes greffés par un ëpoxyde insaturé
ou des copolymères de l'éthylène et d'un époxyde insaturé, copolymérisés, que
l'on obtient, par exemple, par polymérisation radicalaire.
A titre d'exemple d'époxydes insaturés, on peut citer
- les esters et éthers de glycidyle aliphatiques tels que l'allyl
glycidyléther, le vinyle glycidyléther, le maléate et l'itaconate de
glycidyle,
le (méth)acrylate de glycidyle, et
- les esters et éthers de glycidyle alicycliques tels que le 2-
cyclohexène-1-glycidyléther, le cyclohexène-4,5-diglycidyl carboxylate, le
cyclohexène-4-glycidyl carboxylate, le 5-norbornène-2-méthyl-2-glycidyl
carboxylate et l'endo cis-bicyclo(2,2,1 )-5-heptène-2,3-diglycidyl
dicarboxylate.
S'agissant des polyéthylènes sur lesquels on vient greffer l'époxyde insaturé,
on
entend par polyéthylène des homo- ou copolymères.
A titre de comonomères, on peut citer
- les alpha-oléfines, avantageusement celles ayant de 3 à 30 atomes de
carbone; à titre d'exemples d'alpha oléfines on peut citer le propylène, le 1-
butène, le 1-pentène, le 3-méthyl-1-butène, le 1-hexène, le 4-méthyl-1-
pentène,
le 3-méthyl-1-pentène, le 1-octène, le 1-décène, le 1-dodécène, le 1-
tétradécène, le 1-hexadécène, le 1-octadécène, le 1-eicocène, le 1-dococène,
le 1-tétracocène, le 1-hexacocène, le 1-octacocène, et le 1-triacontène; ces
alpha-oléfines peuvent être utilisées seules ou en mélange de deux ou de plus
de deux,
- les esters d'acides carboxyliques insaturés tels que par exemple les
(méth)acrylates d'alkyle, les alkyles pouvant avoir jusqu'à 24 atomes de
carbone, des exemples d'acrylate ou méthacryfate d'alkyle sont notamment le
méthacrylate de méthyle, l'acrylate d'éthyle, l'acrylate de n-butyle,
l'acrylate
d'isobutyle, l'acrylate de 2-éthylhexyle,
- les esters vinyliques d'acides carboxyliques saturés tels que par
exemple l'acétate ou le propionate de vinyle.
- les diènes tels que par exemple le 1,4-hexadiène.
CA 02408865 2002-11-13
WO 01/87995 PCT/FRO1/01473
- le polyethylene peut comprendre plusieurs des comonomères
précédents.
Avantageusement le polyéthylène qui peut être un mélange de
plusieurs polymères, comprend au moins 50% et de préférence 75% (en moles)
5 d'éthylène, sa densité peut être comprise entre 0,86 et 0,98 g/cm3. Le MFI
(indice de viscosité à 190°C, 2,16 kg) est compris avantageusement
entre 0,1
et 1000 g/10 min.
A titre d'exemple de polyéthylènes on peut citer
- le polyéthylène basse densité (LDPE)
- le polyéthylène haute densité (HDPE)
- le polyéthylëne linéaire basse densité (LLDPE)
- le polyéthylène très basse densité (VLDPE)
- le polyéthylène obtenu par catalyse métallocène, c'est-à-dire les
polymères obtenus par copolymérisation d'éthylène et d'alphaoléfine telle que
propylène, butène, héxène ou octène en présence d'un catalyseur monosite
constitué généralement d'un atome de zirconium ou de titane et de deux
molécules cycliques alkyles liées au métal. Plus spëcifiquement, les
catalyseurs
métallocènes sont habituellement composés de deux cycles
cyclopentadiéniques liés au métal. Ces catalyseurs sont fréquemment utilisés
avec des aluminoxanes comme cocatalyseurs ou activateurs, de prëférence le
méthylaluminoxane (MAO). Le hafnium peut aussi être utilisé comme métal
auquel le cyclopentadiène est fixé. D'autres métallocènes peuvent inclure des
métaux de transition des groupes IV A, V A, et VI A. Des métaux de la série
des lanthamides peuvent aussi être utilisés.
- les élastomères EPR (éthylène - propylène - rubber)
- les élastomères EPDM (éthylène - propylène - diène)
- les mélanges de polyéthylène avec un EPR ou un EPDM
- les copolymères éthylène-(méth)acrylate d'alkyle pouvant contenir
jusqu'à 60% en poids de (méth)acrylate et de préférence 2 à 40%.
Le greffage est une opération connue en soi.
S'agissant des copolymères de l'éthylène et de l'époxyde insaturé c'est-
à-dire ceux dans lesquels fépoxyde insaturé n'est pas greffé il s'agit des
CA 02408865 2002-11-13
WO 01/87995 PCT/FRO1/01473
6
copolymères de l'éthylène, de l'époxyde insaturé et éventuellement d'un autre
monomère pouvant être choisi parmi les comonomères qu'on a cité plus haut
pour les copolymères de l'éthylène destinés à être greffés.
Les copolymères de l'éthylène et d'un époxyde insaturé sont
avantageusement des copolymères ëthylènel(méth)acrylate d'alkyle/époxyde
insaturé obtenus par copolymérisation des monomères et non pas par greffage
de l'époxyde insaturé sur le polyéthylène, ils contiennent de 0 à 40% en poids
de (méth)acrylate d'alkyle, de préférence 5 à 35% et jusqu'à 10% en poids
d'époxyde insaturé, de préférence 0,1 à 8%.
L'époxyde est avantageusement le (méth)acrylate de glycidyle.
Avantageusement le (méth)acrylate d'alkyle est choisi parmi le (méth)acrylate
de méthyle, l'acrylate d'éthyle, l'acrylate de n-butyle, l'acrylate
d'isobutyle,
l'acrylate de 2-éthylhexyle. La quantité de (méth)acrylate d'alkyle est
avantageusement de 20 à 35%. Le MFI est avantageusement compris entre 5
et 100 (en g/10 min à 190°C sous 2,16 kg), la température de fusion est
comprise entre 60 et 110°C. Ce copolymère peut être obtenu par
polymérisation radicalaire des monomères.
Les formules (1-1 ) et (2-1 ), ci-dessous, sont des formules plus détaillées
des formules générales respectivement (1 ) et (2) précédentes.
Avantageusement le copolymère (2) est celui de formule (2-1 ) suivante
O
CH3 C C O CHI CH CH2
\o
CH2
(~_1)
Le tronc est constitué de motifs (méth)acrylate de glycidyle, éthylène et
(méth)acrylate d'alkyle. Le tronc de la formule (2-1 ) représente uniquement
un
motif (méth)acrylate de glycidyle, les motifs éthylène et (méth)acrylate
d'alkyle
n'étant pas représentës.
CA 02408865 2002-11-13
WO 01/87995 PCT/FRO1/01473
7
Après réaction de R1 COOH sur le polymère de formule (2-1 ), on obtient
donc un polymère selon l'invention de formule (1-1 ) suivante, où comme
précédemment seul un motif (méth)acrylate de glycidyle du tronc est
représenté, les motifs éthylène et (méth)acrylate d'alkyle n'étant pas
représentés
O OH
CH3 C C O CH2 CH CH2 O C R1
CHI O
(1-1)
Quant au réactif R1-COOH, on peut citer à titre d'exemple l'acide
acétique, l'acide propionique et l'acide benzoïque. Selon une deuxième forme
avantageuse de l'invention c'est un acide carboxylique comprenant au moins
une fonction alcool sur son radical R1.
Selon une forme préférée de l'invention, le réactif R1-COOH est le
produit de formule suivante : H02C-C(CH20H)2-CH3
qu'on appelle DMPA (abréviation de Acide Di Methylol Propionique) dans la
.suite du texte.
S'agissant de la réaction du copolymère (2) avec le réactif R1-COOH, on
peut ajouter le réactif dans les copolymères (2) à l'état fondu en effectuant
un
mélange intime. Le dispositif dans lequel on fiait ce mélange intime peut être
tout appareil utilisé pour le mélange des thermoplastiques tel qu'une
extrudeuse
mono ou double vis, un malaxeur ou un KO malaxeur BUSS~.
Selon la nature du réactif, solide ou liquide, on l'introduit tel quel dans
ces dispositifs mélangeurs à l'aide de trémies ou tout dispositif
d'introduction de
poudres ou de liquides. La granulométrie de ces poudres éventuelles peut être
très variable, plus elle est fine plus son incorporation dans le polymère
fondu
est homogène avantageusement elle est d'au plus 200 pm et de préférence
CA 02408865 2002-11-13
WO 01/87995 PCT/FRO1/01473
ô
comprise entre 10 et 150 pm. Le copolymère (1 ) contenant les fonctions
hydroxyles est à l'état fondu, on peut l'envoyer dans un dispositif pour le
mettre
en film ou l'injecter ou le refroidir et le récupérer sous forme de granulés
comme
la plupart des thermoplastiques puis le transformer ultérieurement.
La proportion de réactif R1-COOH à utiliser est d'une molécule par
fonction époxyde. Cependant on peut ne pas utiliser toutes les fonctions
époxydes disponibles et donc utiliser moins de molécules de réactif R1 COOH
que le nombre de fonctions époxy.
Selon une troisième forme avantageuse de l'invention, on utilise des
fonctions époxy non consommées dans la réaction par R1-COOH pour greffer
ultérieurement un réactif R2-COOH de la même manière que pour R1 COOH.
On peut aussi grefFer simultanément R1 COOH et R2COOH en faisant réagir le
copolymère (2) avec un mélange de .R1-COOH et R2-COOH. L'invention
concerne donc aussi des polymères de formule générale (1-2) suivante
OH
C ,~ CH CH2 O C R1
OH (1-2)
O
C ~ CH CH2 O C R2
' .
O
Avantageusement R2-COOH est une quinone carboxylée. A titre
d'exemple de quinone, on peut citer la benzoquinone, la naphtoquinone et
l'anthraquinone. La réaction de R2-COOH sur les groupes époxy se fait dans
les mêmes conditions que pour R1-COOH.
CA 02408865 2002-11-13
WO 01/87995 PCT/FRO1/01473
9
[Exemple]
Greffa e du DMPA acide Diméth lol ro ioni ue sur le LOTADER
AX8840~.
Le DMPA se présente sous la forme d'une poudre blanche et a un point
de fusion de 190°C.
Le LOTADER AX8840~ est un copolymère statistique
éthylènelméthacrylate de glycidyle (GMA), contenant 8% en poids de GMA et
ayant un MFI ëgal à 4 g/10min (à 190°C sous 2,16kg).
Le greffage est effectué à l'état fondu dans un malaxeur, mëlangeur interne de
laboratoire BRABENDER. La température du corps du malaxeur a été fixée à
220°C.
Le LOTADER AX8840~ et le DMPA sont introduits dans la chambre du
malaxeur et les réactifs sont malaxés pendant 4 min. Les proportions utilisées
sont : 93% de LOTADER AX8840~ / 7% de DMPA. La vitesse de rotation des
pales est fixée à 50 tr/min.
Le produit a été caractérisé par analyse infra rouge et RMN.
Le produit est ensuite mis en forme sous presse pour donner un film de 200
pm.