Note: Descriptions are shown in the official language in which they were submitted.
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
1
Procédé de traitement de matière végétale, compositions
comportant des dérivés du type N-acylglucosamine, utilisation de ces
composés en tant qu'agents bio-protecteurs, et matière végétale
traitée, notamment des semences.
s
La présente invention a pour objet un procédé de traitement de
matière végétale ainsi que -des composés dérivés d'une N-
acylglucosamine, des compositions comportant des dérivés de la N-
acylglucosamine et leur utilisation à titre phytosanitaire notamment. En
io particulier, la présente invention concerne un procédé de traitement des
semences de plantes, en vue d'assurer leur protection contre leur
détérioration au cours du vieillissement, et en particulier lors de leur
stockage.
De nombreux facteurs et notamment la température, l'humidité, les
1s châmpignons, les microorganismes et la pression en oxygèrié ont pour effet
de détériorer les semences, au cours de leur stockage. L'aptitude
germinative des semences peut elle-méme être affectée par ces facteurs.
II est connu de traiter les graines par enrobage, avant leur stockage
pour éviter leur détérioration. Par exemple, le document PCT/FR 96/00200
2o décrit des compositions comportant d'une part une substance filmogène et
d'autre part un antioxydant.
II existe toutefois un besoin pour des produits "bioprotecteurs" de la
matière végétale. Par bioprotecteur, on entend des composés ayant une
activité bénéfique pour la matière végétale, par exemple progerminatif,
~s antifongique, stabilisant au stockage, pour le cas des semences, ou encore
stimulant les défenses naturelles de la plante, tout en étant biodégradable.
Certains dérivés de la N-acétyl-glucosamine (NAG) sont connus.
La préparation de certains d'entre eux est décrite dans. Fernandez-Bolanos
et al., Anales de Quimica (1982) 423, et JP 49 20 763 (1974) : ce sont le 2
3o acétamido-2-déoxy-(6)O-octanoyl D-glucopyranose (C8-NAG) et le 2
acétamido-2-déoxy-(6)O-palmitoyl D-glucopyranose (C16-NAG).
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
2
La demanderesse a mis en évidence qu'il est possible de traiter la
matière végétale et par exemple les semences contre leur détérioration, en
particulier lors de leur stockage en les traitant avec au moins un composé
de formule I ou l' suivantes
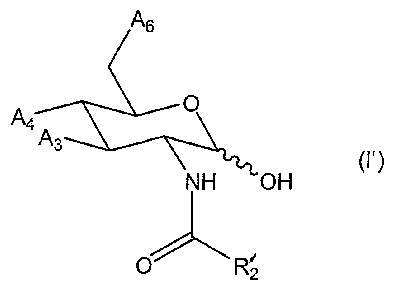
As
A O
a. A
3 \
\NH _0H
O~ ~ R'
2
S (I )
dans laquelle A6, A4 et A3, indépendamment l'un de l'autre, représentent
OH ou OR5 ou OC(O)R5 ou O-S02-R5 ou O-(CH2)"-NR6-CmH2m+~ ou
-NHC(O)R5 ou O-(CH2)"-NR6-C(O)-CmH2m+~ ou O-(CHa)~-S-CmH2m+~ ou S-
R6 ou NR6R~ ou NR6R~ R$+ X- où R5 représente une chaîne alkyle linéaire
1o ou ramifiée en C~ à C~8, n est compris entre 1 et 17 et m est compris entre
0 et 16 et n+m < 18, R6, R~ et Rg représentent, indépendamment l'un de
l'autre, H ou une chaîne alkyle linéaire ou ramifiée en C~ à C~2, et X- un
anion minéral ou organique, et dans laquelle R'2 représente une chaîne
alkyle linéaire ou ramifiée en C~ à C4 ou un groupement éthynyle ou NR'3
is R'4, où R'3 et R'4 représentent indépendamment l'un de l'autre C;H2;+~ t
allant de 0 à 4, l'hydroxyle du carbone anomérique étant en position a ou ~,
à (exception des composés où A6, A4 et A3 reprësentent OH,
H
NH OH
O~ ~R
2
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
3
dans laquelle R~ représente R ou CO-R où R représente une chaîne alkyle
linéaire ou ramifiée en C5 à C~$ et R2 représente une chaîne alkyle linéaire
ou ramifiée en C~ à C4 ou un groupement éthynyle ou -NR3R4 où R3
représente CpH2p+~, p allant de 0 à 4 et R4 représente CqH2q+~, q allant de 0
s à 4.
Par anion minéral ou organique, on entend tout anion acceptable
dans un tel procédé et notamment halogénure (chlorure, bromure, iodure),
phosphate, sulfate, acétate, carbonate, ou benzoate, par exemple.
De préférence, dans la formule I ou l' des composés selon
1o l'invention, les chaines alkyle(s) est (sont) linéaire(s).
De façon préférée, R5 représente une chaîne alkyle linéaire ou
ramifiée en C3 à C~3, Dans une variante préférée, dans la formule l', deux
parmi A3, A4 et A6 représentent, indépendamment l'un de l'autre, OC(O)R5
où R5 représente une chaîne alkyle linéaire ou ramifiée en C3 à C~3, et le
is troisième parmi A3, A4 et A6 représente OH. De façon plus préférée, R5
représente une chaîne alkyle linéaire ou ramifiée en C3 à C9. Dans une
autre variante préférëe, dans la formule l', deux parmi A3, A4 et A6
représentent OH et le troisième parmi A3, A4 et A6 représente OCORS où R5
représente une chaîne alkyle linéaire ou ramifiée en C3 à C~3. De façon plus
2o préférée, dans la formule l', R'2 représente CH3.
De façon préférée, R~ représente COR. De façon plus préférée, R~
représente CO-C7H~5, COC5H~~, COC9H~9 ou COC~~H23, et parmi ceux-ci,
en particulier COC~H~5 ou COCgH~g. De façon plus préférée, R2 représente
CH3.
2s Dans les formules précédentes, les deux formes anomères a et ~i
sont présentes. En phase aqueuse, les formes a et ~3 peuvent coexister.
Selon un de ses aspects, la présente demande vise à couvrir un
procédé de traitement de matière végétale. Dans une application
particulière, il peut s'agir d'un procédé de traitement de semences destiné
3o notamment à éviter leur détérioration au cours du vieillissement, en
particulier lors du stockage.
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
4
Dans le cas des semences, te procédé peut consister à enrober ou
pelliculer lesdites semences, préalablement à leur stockage, avec une
composition incorporant une quantité efficace d'au moins un composé de
l'invention.
s II existe de nombreuses compositions d'enrobage ou pelliculage
des semences sous forme de concentré, diluable ou de compositions
prétes à l'emploi. Ces compositions usuelles généralement aqueuses, sont
accessibles dans le commerce. Le Sepiret (dénomination de compositions
commercialisées par SEPPIC), et l'argile verte constituent de telles
1o compositions usuelles. Les composés actifs de l'invention sont incorporés
dans ces compositions usuelles. Les compositions de l'invention peuvent
se présenter sous forme de bouillie aqueuse. Toutefois, on a appliqué les
composés de l'invention en solution aqueuse ou hydroalcoolique.
Par matière végétale, on entend non seulement les semences, les
is graines mais aussi les plantes sur pied, les racines, les tubercules, les
oignons, et les cultures cellulaires végétales. De préférence, selon
l'invention, on traite des semences ou graines.
Dans le cas de l'enrobage, ce procédé permet la fixation d'une
quantité précise et juste suffisante d'agent actif au niveau de la semence. II
2o permet de mettre en pratique à grande échelle, de manière économique,
l'apport des composés actifs, antifongiques, progermatifs qui peut améliorer
ia conservation et/ou favoriser la germination des semences au moment de
leur semis et la levée des plantes.
Selon une caractéristique particulière de ce procédé, l'enrobage ou
2s le pelliculage précité des semences est réalisé soit par pulvérisation-
séchage, soit par barattage.
La pulvérisation-séchage est un procédé connu pour pelliculer des
formes solides par voie sèche.
II consiste ici à pulvériser sur les semences en mouvement, une
3o composition filmogène aqueuse telle que décrite précédemment tandis
qu'un flux d'air assure en permanence le séchage des graines.
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
s
La technique de barattage est un procédé également connu pour le
pelliculage ou l'enrobage de formes solides par voie humide et consiste ici
à agiter les semences à l'intérieur d'un mélangeur rotatif en présence d'une
composition filmogène telle que décrite précédemment.
s D'autres modes d'application que les modes d'enrobage prévus ci-
dessus peuvent être mis en oeuvre, notamment sur la matière végétale
différente des semences, et par e~cemple la pulvérisation, le traitement au
sol, l'épandage et l'arrosage.
Dans ce cas, les composés de l'invention sont incorporés dans les
io compositions usuelles de traitement par pulvérisation, traitement au sol,
épandage, ou arrosage.
De préférence, dans le procédé de l'invention, l'application est
réalisée à raison de 0,1 mg à 100 mg de composé de formule I ou l' par
gramme de semence, de préférence 1 mg à 5 mg.
1s De plus, lorsque l'application est réalisée à l'aide d'une bouillie
aqueuse, celle ci peut comporter 1 à 40, de préférence 5 à 20 mg de
composé de formule I/g de bouillie aqueuse, ou 1 à 40, de préférence 3,5 à
15 % d'au moins un composé de formule I ou l' dans la bouillie en poids
d'extrait sec.
2o Ainsi, la présente invention concerne également des compositions,
à usage phytosanitaire notamment, comportant au moins un composé de
l'invention à titre d'agent actif. Ainsi, la présente invention concerne des
compositions comportant au moins un composé de formule I ou l' ci-dessus
et un support acceptable pour son utilisation phytosanitaire.
2s De préférence, dans les compositions de l'invention, le composé de
formule I ou l' est présent dans des proportions allant de 1 à 97 % de
composé, en poids d'extrait sec dans la composition.
De plus, certains composés de l'invention sont nouveaux. La
présente invention concerne les composés de formule I à l'exception de
3o ceux pour lesquels R~ représente CO(CH2)6CH3 ou CO(CH2)~4CH3 et R2 est
CH3, et les composés de formule l' à l'exception de ceux pour lesquels A6,
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
6
A4 et A3 représentent OH, des composés où R'2 représente CH3, A3 et A4
représentent OH et A6 représente OC(O)(CH2)6CH3 ou OC(O)(CHz)~4CH3,
et des composés où R'2 représente CH3, A4 et A6 représentent OH et A3
représente OC(O)(CH2)6CH3 ou OC(O)(CH2)~oCH3 ou OC(O)(CH2)~4CH3.
s Les composés de formule I de l'invention peuvent être préparés
selon le schéma général suivant
Réaction : monoestérification sur le C6 du motif NAG
+ CH3-(CH2)n COCI
N t1 U t-1
NN OH
O CH3 O~ ~CH
3
NAG
illustré ici pour les produits où R2 est CH3 et R est COCn_~H~n+~ dont la mise
1o en oeuvre est à la portée de l'homme de l'art, ainsi que les variantes
permettant d'obtenir les autres dérivés ~de la NAG visés par la formule I.
Pour la purification, elle peut étre ainsi mise en oeuvre par les étapes
suivantes : hydrolyse du chlorure d'acyle n'ayant pas réagi, évaporation du
DMF par la pompe à palette à T=60°C, lavage à l'eau jusqu'à
neutralité afin
1s de faire passer dans la phase aqueuse l'acide carboxylique et le NAG
n'ayant pas réagi, trituration au pentane afin d'éliminer toute impureté
organique et éventuellement lavage à l'éther, notamment.
Certains composés de formule l', illustrés ici par le composé où R'2
est CH3 et A6 est OCO(CH2)nCH3 A3 et A4 sont OH selon l'invention
2o peuvent être préparés selon l'une des voies A ou B du schéma général
suivant
iCH2)n-CH3
\r~ -n
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
7
Voie A
+ CH - CH~ -COCI --
3 ( 2l_n
OH
NH OH
i3 O~ ~CI-i3
NAG
Voie B
CC~z)~ CHs
+ CH3-(CH2)p COCI
OP~ NH OP1
i3 O CH3
où P~ est un groupe protecteur, par exemple le groupement benzyle.
De façon générale, des procédés usuels sont à la portée de
s l'homme de l'art en ce qui concerne tous les composé de l'invention ; le
texte de la demande PCT/FR 99 02861, dans Fernandez-Boianos ~et al.,
Anales de Quimica (1982) 423 et Shulman et al. Garbohydrate Research
27(1973) 141-147, étant ici cités à titre de référence.
Ainsi, pour préparer les monoesters, on peut protéger le carbone
io C1 par un groupe approprié (par exemple benzyle pour l'ester), on procède
(CH2)n-CH3
\r =n
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
8
à l'estérification par le réactif correspondant (chlorure d'acide) puis on
déprotège. Pour l'éther, un groupe protecteur approprié est l'allyle. Pour les
diesters en C4 et C6, on procède de la méme façon avec une quantité plus
importante du réactif. Pour le triester, avec du réactif en excès.
s Pour préparer les monoesters en C3, on peut utiliser la méthode
décrite par Fernandez-Bolanos et al., Anales de Quimica (1982) 423.
Pour réaliser les monoesters en C4, on protège en C1 par exemple
par un benzyle, et en C6 (mésylation) on estérifie et on déprotège.
Pour réaliser les diesters en C3 et C4, après avoir protégé en
io C1,on protège en C6 par un groupe approprié (mésyle par exemple) on
estérifie en excès et on déprotège.
Pour réaliser les diesters en C3 et C6, on protège en C1, puis on
utilise par exemple de l'aldéhyde benzoïque ou de l'acétone pour protéger
C4 et C6, on estérifie en G3, on déprotège en C6, on estérifie et on
is déprotège en C1.
De façon usuelle, les réactifs correspondants sont des chlorure
d'acide pour préparer des esters, des halogénures, par exemple bromure
d'alkyle pour préparer les ethers, les chlorures d'alkylsulfonyle
correspondant (R5 S02 CI) pour préparer les composés où Agi, A4 ou A6
2o représentent OS02 R5.
Elle concerne également l'utilisation des composés plus
précisément à titre d'antifongique ou de germinatif.
A certaines concentrations, comme cela apparaîtra dans les
2s exemples, les composés de l'invention, incorporés dans une composition
de pelliculage, peuvent procurer à la fois une protection antifongique et une
promotion de la germination, de façon significative.
Les compositions de l'invention peuvent comporter au moins un
agent filmogène. Une substance filmogène appropriée dans le cadre de la
3o présente invention est généralement constituée d'un polymère permettant
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
9
la formation d'un film perméable aux échanges hydriques et gazeux,
biodégradable et sans effet phytotoxique pour le matériel végétal.
Comme polymère susceptible d'être utilisé à cette fin, on
mentionnera plus spécialement les dérivés cellulosiques, en particulier les
s esters ou éthers cellulosiques comme par exemple la méthylcellulose,
l'hydroxypropylcellulose, l'hydroxypropylméthylcellulose, l'acétophtalate de
cellulose, l'acétate de cellulose ou l'éthylcellulose ; les polysaccharides
naturels comme en particulier des amidons modifiés, des gommes comme
la gomme guar, la gomme xanthane ou la gomme arabique, des alginates,
1o des chitosans ; ainsi que des dérivés vinyliques ou acryliques.
D'autres agents actifs peuvent être incorporés dans les
compositions. Ainsi, comme agent antioxydant susceptible d'être utilisé
dans le cadre de la présente invention, on mentionnera plus spécialement
l'acide ascorbique et ses sels (en particulier de calcium et de sodium) ; les
1s tocophérols, en particulier la vitamine E ; les polyamines, comme par
exemple la spermine, la spermidine, la putréscine, l'agmatine, la
cadavérine ; les flavonoïdes comme par exemple la quercétine, la
myricétine, le Icaempferol, la catéchine, la lutéoline ; les caroténoïdes, en
particulier le ~-carotène ; des composés phénoliques comme par exemple
20 le thymol, le carvacrol, la zingerone, le 6-gingerol, l'hydroxytyrosol, le
butylhydroxyanisole, le butylhydroxytoluène ; les acides aminés tels que
l'arginine, l'histidine, la cystéine, le tryptophane, la lysine, la thréonine
et la
méthioninate de magnésium ; le squalène ou les monoterpènes comme par
exemple le limonène, la carvone, la dihydrocarvone, la pulégone,
2s l'isopulégol, l'isolimonène, ou leurs esters carbonylés en particulier le
limonate de méthyle, la pulégolactone, le limonone ; les substances à base
de zinc, comme par exemple le gluconate de zinc, le glycérophosphate de
zinc, l'aspartate de zinc, le glucoheptonate de zinc ; ou des substances à
base de sélénium, comme le séfénate de sodium, le sélénite de sodium.
3o Elles peuvent aussi contenir au moins un agent antioxydant par
exemple choisi parmi l'acide ascorbique et ses sels ; les polyamines et en
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
particulier la spermine ; les substances à base de zinc et en particulier le
gluconate de zinc ; ainsi que leurs mélanges.
De préférence, les compositions de l'invention sont aqueuses et
l'on choisira par conséquent de préférence des agents actifs, notamment
s des polymères filmogènes hydrosolubles notamment parmi ceux
mentionnés précédemment. .
Avantageusement, les compositions selon l'invention, peuvent
comprendre en outre au moins une substance plastifiante, en une quantité
en poids, exprimée par rapport à la matière sèche de la composition,
1o comprise entre 0 % et 50 %, de préférence entre 5 % et 30 %.
Ces substances plastifiantes permettent d'améliorer les qualités
d'étalement du film principal, ainsi que ses propriétés physiques.
Parmi les substances plastifiantes susceptibles d'être utilisées à cet
effet, on mentionnera plus spécialement le glycérol, le sorbitol, les glycols,
1s et leurs éthers ou esters aliphatiques ; les tensioactifs de préférence non
ioniques sous forme d'esters ou d'éthers de glucide ou de glycérol ou
encore les alcools et acides gras plus ou moins éthoxylés.
Comme les composés de l'invention peuvent prësenter des
propriétés tensioactives, notamment à titre de tensioactifs non ioniques,
l'incorporation de ces composés dans les compositions de l'invenfiion peut
permettre de réduire le taux de tensioactif usuel. Comme les composés de
l'invention sont biodégradables, cette réduction présente un avantage
certain du point de vue de la biodégradabilité des compositions appliquées.
Selon une caractéristique particulière, les compositions selon
2s l'invention, peuvent en outre comprendre un ou plusieurs additifs choisis
parmi les colorants et les charges habituellement utilisées pour modifier les
propriétés du matériau d'enrobage et la protection dudit matériau, en une
quantité en poids, exprimée par rapport à la matière sèche de la
composition, comprise entre 0 % et 90 %, de préférence entre 5 % et 70 %.
3o Parmi les colorants susceptibles d'être utilisés à cet effet, on
mentionnera par exemple les colorants suivants, sous forme soluble ou
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
11
sous forme de laques : le violet méthyl 2B, le rouge de cochenille, le jaune
orangé S, ainsi que les pigments comme par exemple le mica-titane, le
dioxyde de titane, l'oxyde de fer, l'oxyde de zinc, l'oxyde de magnésium, le
noir 7 ou bien encore les pâtes pigmentaires contenant par exemple du
s rouge 48, du rouge 112, du bleu 15, du vert 7 dispersés dans un solvant
adapté.
A titre d'exemple de chat-ge, on mentionnera en particulier les
agents opacifiants comme par exemple le talc, le mica, la cellulose ; les
hydrofugeants comme par exemple tes acides gras et leurs dérivés, les
1o polymères siliconés et les agents mouillants favorisant l'étalement de la
composition filmogène, et permettant donc d'améliorer la couverture et
l'aspect des semences pelliculées.
A titre d'exemple, les alkylphénols éthoxylés ou les esters
phosphoriques d'acide gras peuvent être utilisés comme mouillants.
1s Une composition phytosanitaire selon l'invention peut se présenter
soit sous forme liquide avec une teneur en matière sèche comprise entre
% et 70 %, de préférence entre 20 et 40 %, soit encore sous forme
sèche, c'est-à-dire sous forme dè poudres ou de granulës, de préférence
hydrodispersibles.
2o Une telle composition peut étre préparée par des procédés connus
largement décrits dans la littérature à laquelle l'homme de métier pourra se
reporter, et en particulier aux brevets FR-A2.548.675 et US-4.665.648.
Après une remise en solution des formes sèches ou une redilution
des formes liquides précitées, différentes matières actives, comme en
Zs particulier des fongicides, des insecticides, des herbicides, des
molluscides, des produits à effet rëpulsif ou des substances de croissance,
peuvent ëtre additionnées aux compositions phytosanitaires selon
l'invention.
Ces matières actives pourront être ajoutées en une quantité en
3o poids, exprimée par rapport à la matière sèche de la composition, comprise
entre 1 % et 50 %, de préférence entre 3 % et 30 %.
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
12
Dans un mode préféré particulier de réalisation des compositions
de l'invention, celles-ci sont donc constituées d'une composition d'enrobage
ou de pelliculage à laquelle on incorpore au moins un composé de formule I
ou l'.
s Avantageusement, la composition de l'invention est utilisée pour le
traitement de pelliculage précité en une quantité en poids comprise entre 2
et 50 exprimée en gramme de matière sèche par kilogramme de semence.
Dans le cas d'un traitement d'enrobage, la quantité de composition
utilisée peut être comprise entre 100 et 1 000 grammes de matières sèche
1o par kilogramme de semence.
Selon un autre aspect, la présente demande vise à couvrir les
semences traitées à l'aide des compositions phytosanitaires décrites
précédemment notamment au moyen des procédés ci-dessus.
L'invention sera mieux comprise à la lecture des exemples suivants
is qui sont donnés à titre purement illustratifs et ne sauraient par
conséquent
limiter la portée de l'invention.
Dans ces exemples, les pourcentages sont donnés en poids, sauf
indications contraires.
2o Exemple 1
2-acétamido-2-déoxy-(6)O-octanoyl D-glucopyranose (C8-NAG)
2,5 g de NAG ont été ajoutés à 30 ml (0,88 g) de pyridine dans le
solvant DMF (30 ml). A cette suspension agitée et refroidie par un bain de
glace et de sel, le chlorure d'octanoyle (2 ml) a été lentement incorporé
2s durant une heure. La solution obtenue a été laissée une nuit à température
ambiante puis 5 ml d'eau ont été introduits afin d'hydrolyser les restes de
chlorure d'alkyle n'ayant pas réagi. Une évaporation sous pression réduite
a ensuite été réalisée pour donner une gomme orange.
Après évaporation des solvants, la gomme orangée est reprise
3o dans de l'acétate d'éthyle. Cette phase organique est ensuite lavée à l'eau
basique (solution de Na2C03 saturée) puis à l'eau jusqu'à neutralité. Cette
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
13
extraction permet de faire passer en phase aqueuse l'acide octanoïque
(sous forme d'octanoate de sodium) et le NAG qui n'auraient pas réagi.
Après évaporation de l'acétate d'éthyle, une poudre très légèrement
colorée est obtenue. Le rendement est estimé à 40 % environ.
s Une recristallisation de ce produit dans un mélange
dichlorométhanelpentane permet d'obtenir le produit pur (poudre blanche
très fine) d'après la RMN donc à 5% près.
1 ) Spectre RMN 13C
Le solvant deutéré est le DMSO. Les déplacements chimiques sont
1o exprimés en ppm.
CCHa)s-CH3
1 \~ -n
N h1 V t1
1'
C
Ö ~ CH3
Déplacement (Carbone correspondant)
173,2 (C 1 "), 169,6 (C 1'), 91,0 (CH 1 ), 71,4 (CH 3), 70,6 ; 69,5 ; 64,0
1s (CH 4, CH 5, CH2 6), 54,4 (CH 2), 38,0 (CH2 2"), 33,7 (CH2 3"), 31,4 (CH2
4"), 28,7 (CH2 5"), 24,7 (CH2 6"), 22,9 (CH3 2'), 22,3 (CH2 7"), 14,2 (CH3
8").
2) Spectre RMN 1H
20 8 (ppm)= 0,86 (t; 3H; CH3 8"), 1,25 (m; 8H; CH2 de 7" à 4"), 1,52
(m; 2H; CH2 3"), 1,83 (s; 3H; CH32'), 2,29 (t; 2H; CH22"), 3,07 à 4,32 (m;
8H; CH; CH2; OH), 4,9 (m; 1 H; OH), 6,55 (d; 1 H; OH), 7,66 (d; 1 H; NH)
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
14
3) Spectre de masse
En mode ionisation chimique, les pics [M+H]+ et [M+H-H20j+ à
respectivement 348 et 330 confirment la masse moléculaire de 347 g/mol
s de C8-NAG.
4) Analyse élémentaire -
Les résultats, présentés dans le tableau ci-dessous, montrent que
le produit n'est pur qu'à 8 %.
Elment Pourcentage calcul Pourcentage trouv
Carbone 55,3 51,81
Hydrogne 8,35 7,66
Azote 4,03 3,77
1o
5) Détermination de la Concentration Micellaire Critique
La tension superficielle y du liquide au contact de l'air est mesurée
à 25°C par la méthode de la plaque de Wilhelmy (tensiomètre
digital Krüss
K10 ST). Celle-ci consiste à plonger verticalement dans un liquide une
1s lame en platine, puis à la retirer progressivement en suivant la tension
exercée par le film liquide sur la lame. La valeur maximale lue avant
l'arrachement complet de la lame représente la tension superficielle
exprimée en mN/m. Après étalonnage de l'appareil, les tensions
superficielles de solutions contenant des quantités croissantes du produit
20 ont été lues et les mesures répétées trois fois. La concentration
micellaire
critique est obtenue à partir des diagrammes classiques y = f(Log C) où C
représente la concentration exprimée en mol/I.
On a suivi l'évolution de la tension superficielle y (en mN/m) d'une
solution aqueuse (volume = 10 ml) en fonction des quantités de produit (C
2s en mol/I) dissous. Les résultats obtenus sont illustrés dans les figures 1.
La
concentration micellaire critique correspond à !a concentration au dessus
de laquelle la tension superficielle devient constante.
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
On note tout d'abord le caractère tensioactif des molécules,
confirmé par l'abaissement de la tension superficielle de 71 à 39 mN/m
pour des concentrations allant de 0 à 6 mM (soit 2,08 g/1).
Pour C8-NAG, CMC = 6.10-3 moUl et y - yo = 32 ~ 2 mN/m.
s y - yo désigne l'abaissement de la tension superficielle de l'eau (y0)
lorsque C = CMC.
Exemple 2
2-acétamido-2-déoxy-(6)O-stéaroyl D-glucopyranose (C18-NAG).
1o La synthèse de l'exemple 1 est adaptée pour obtenir le composé en
C~8, le 2-acétamido-2-déoxy-(6)O-stéaroyl D-glucopyranose. On a utilisé
3,8 ml de chlorure de stéaroyle.
Une nuit après l'addition du chlorure d'acyle dans les mémes
conditions que pour l'exemple 1, le milieu réactionnel est devenu blanc
1s laiteux. Les solvants ont été évaporés. Le séchage a été terminé par
lyophilisation et a permis de récupérer 3 g d'une poudre blanche très fine
dont le point de fusion est de l'ordre de 170°C.
Exemple 3
2o Synthèse du 2-acétamido-2-déoxy-(6)O-décanoyl D-glucopyranose (C10-
NAG).
On a procédé de la méme façon qu'aux exemples précédents.
L'addition du chlorure d'acyle (2,15 g de chlorure de décanoyle) sur
le NAG (2,5 g) a été faite pendant 1 à 2 heures sous agitation, en présence
2s de 0,88 g de pyridine dans 30 ml de DMF dans un bain de glace et de sel
(-10 à -20 °C), et sous atmosphère inerte (argon). La solution obtenue
a été
laissée une quinzaine d'heures à température ambiante, toujours sous
agitation et sous argon.
La solution, devenue limpide, a alors été hydrolysée avec 5 ml
3o d'eau et le solvant a été évaporé à la pompe à palette à T=60°C. 30
ml
d'eau ont été ajoutés à la gomme jaune-orangée. Après un temps d'attente
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
16
d'environ 1 h, une gélification a été observée. Les particules étant
colloïdales, le lavage à l'eau a été fait par centrifugations successives
(jusqu'à 5) à 4500 rpm pendant 30 minutes jusqu'à neutralité. Les culots
blancs ont été ensuite triturés au pentane, puis lavés à l'éther. Une fine
s poudre blanche a alors été obtenue.
Le rendement obtenu est de l'ordre de 35 à 40 %.
Ce faible rendement peut être attribué à la formation simultanée de
diester en C1 et C6, éliminé lors du lavage à l'éther.
Caractérisation
1o Le solvant deutéré utilisé est le DMSO. Les déplacements
chimiques sont exprimés en ppm.
NH OH
1'
C
Ö 2 CH3
1. Spectre RMN ~H
Le solvant utilisé est le DMSO deutéré.
1s â(ppm) =0,85 (t;3H;CH3 10"), 1,24 (s; 12H; CH2 de 9" à 4"), 1,51 (m; 2H;
CH2 3"), 1,82 (s; 3H; CH3 2'), 2,28 (t; 2H; CH2 2"), 3,05 à 4,31 (plusieurs m;
6H; 4 CH cycle; CH2 6), 4,76 (d; 1 H; OH), 4.89 (m; 1 H; CH cycle), 5,19
(d;1 H; OH), 6,57 (d;1 H; OH), 7,69 (d;1 H; NH)
2" à 9" 10"
(CH2)$-CH3
1" '
,C =O
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
17
2. Spectre RMN ~3C
Le solvant utilisé est le DMSO deutéré.
& (ppm) =14,21 (CH3 10"), 22,35 ( CH2 9"), 22,91 (CH3 2'), 24,73 (CH2 8"),
28,71 à 29,12 (CH2 7" à 5"), 31,53 (CH24"), 33,70 (CH2 3"), 36,14 (CH2 2"),
s 54,38 (CH 2), 64,02 à 70,52 (CH 4, 5, 6), 71,38 (CHOH 3), 90,94 (CHOH
1 ), 169,60 (CHO 1'), 173,19 (CHO 1 ")
3. Détermination de la Concentration Micellaire Critique
CMC = 8.10-5 mol/I et y-yo = 40 ~ 2 mN/m.
1o
Exemple 4
Synthèse du 2-acétamido-2-déoxy-(6)O-dodécanoyl D-glucopyranose
(C12-NAG)
1s On a procédé de la méme façon qu'aux exemples précédents.
L'addition du chlorure de lauroyle (2,47 g) dans le ballon de NAG
(2,5 g) et de pyridine (0,88 g) dans le DMF (30 ml) a été réalisée comme
pour l'exemple 3. La solution obtenue a étë laissëe une quinzaine d'heures
à température ambiante, toujours sous agitation et sous argon.
2o La solution, devenue limpide, a alors été hydrolysée avec 5 mL
d'eau et le solvant a été évaporé. 30 mL d'eau ont été ajoutés à la gomme
jaune-orangée. Après un temps d'attente d'environ 1 h, une gélification a été
observée : les particules sont telles que deux modes opératoires différents
pour le lavage à l'eau peuvent ëtre choisis. L'ensemble a été filtré sur
fritté
2s n°3, ou traité par la méthode par centrifugations successives comme
à
l'exemple 3.
Le solide blanc (obtenu quelle que soit la méthode) a été ensuite
trituré au pentane, puis lavé à l'éther. Une fine poudre blanche a été
obtenue.
3o Le rendement de cette réaction est de l'ordre de 35 à 40 %.
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
18
Caractérisation
2" à 11 " 12"
(CH2)10-CHg
11,
,C =O
6~
O
HO \
HO~~ ~~ 1
\NH ~'OH
1'
C
Ö 2 CH3
1. Spectre RMN 1H
s Le solvant utilisé est le DMSO deutéré.
~ (ppm) =0,83 (t;3H;CH3 12"), 1,12 (s; 16H; CH2 de 11" à 4"), 1,49 (m; 2H;
CHI 3"), 1,80 (s; 3H; CH3 2'), 2,26 (t; 2H; CH2 2"), 3,03 à 4,29 (plusieurs
m;.
6H; 4 CH cycle; CH2 6), 4,75 (d; 1 H; OH), 4,92 (m; 1 H; CH cycle), 5,17
(d;1 H; OH), 6,55 (d;1 H; OH), 7,68 (d;1 H; NH)
io 2. Spectre RMN 13C
â (ppm) =14,13 (CH3 12"), 22,28 (CH2 11"), 22,83 (CH3 2'),24,66 (CH2 10"),
28,65 à 29,19 (CH2 9" à 5"), 31,49 (CH24"), 33,62 (CH2 3"), 37,69 (CHZ 2"),
54,31 (CH 2), 63,95 à 70,44 (CH 4, 5, 6), 71,31 (CHOH 3), 90,86 (CHOH
1 ), 169,52 (CHO 1'), 173,11 (CHO 1 ")
is 3. Détermination de la Concentration Micellaire Critique
CMC = 10-6 mol/I et y-yo = 13 ~ 2 mN/m.
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
19
Exemple 5
Synthèse du 2-acétamido-2-déoxy-(6)O-myristoyl D-glucopyranose
G 14-NAG
On a procédé de façon similaire aux exemples précédents.
s L'addition du chlorure de myristoyle (2,79 g) a eu lieu dans un bain-
marie à T=40°C pendant 1 heure. Le ballon a été laissé à cette
température
pendant une quinzaine d'heures, toujours sous agitation et sous argon.
La solution, devenue limpide, a été alors hydrolysée avec 5 ml
d'eau, et le solvant a été évaporé. 30 ml d'eau ont été ajoutés à la gomme
1o jaune. Environ 1 heure après , une gélification a été observée : le lavage
à
l'eau a été réalisé par centrifugations successives (4 suffisent) à 4500 rpm
pendant 30 minutes. Le solide blanc a été ensuite trituré au pentane, puis
lavé à l'éther.
Le rendement de cette réaction se situe entre 35 et 40%.
1s Caractérisation
NH UH
1'
C
Ö 2 CH3
1. Spectre RMN 1H
Le solvant utilisé est le DMSO deutéré.
8 (ppm) =0,85 (t;3H;CH3 14"), 1,24 (s; 20H; CH2 de 13" à 4"), 1,51 (m; 2H;
2o CH2 3"), 1,82 (s; 3H; CH3 2'), 2,28 (t; 2H; CH2 2"), 3,09 à 4,31 (plusieurs
m;
2" à 13" 14"
~CHz)~2-CH3
1~~ r -n
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
6H; 4 CH cycle; CH2 6), 4,76 (d; 1 H; OH), 4,90 (m; 1 H; CH cycle), 5,19
(d;1 H; OH), 6,57(d;1 H; OH), 7,69 (d;1 H; NH).
2. Spectre RMN'3C
s ~ (ppm) =14,20 (CH3 14"), 22,35 ( CH2 13"), 22,90 (CH3 2'), 24,72 (CH2
12"), 28,72 à 29,27 (CHI 11" à 5"), 31,55 (CH24"), 33,69 (CH2 3"), 54,37
(CH 2), 63,99 à 70,52 (CH 4, 5, -6), 71,37 (CHOH 3), 90,94 (CHOH 1 ),
169,58 (CHO 1'), 173,17 (CHO 1")
1o Exempte 6
2-acétamido-2-déoxy-(6)O-hexanoyl D-glucopyranose (C6-NAG)
Mode opératoire
La réaction a été faite selon le même protocole que pour les
1s produits précédents avec 1,52 g de chlorure d'hexanoyle.
Après avoir hydrolysé la solution limpide avec 5 ml d'eau, le solvant
a été évaporé et 10 ml d'eau rajoutés afin d'obtenir la précipitation du
produit. L'ensemble a alors été filtré sur fritté n°3 puis lavé à l'eau
jusqu'à
neutralité. Le solide blanc a été ensuite trituré au pentane, puis lavé à
20 l'éther. Une poudre blanche est obtenue.
Caractërisation
N11 Uf1
I 1.
C
Ö 2 CH3
2" à 5" 6"
(C~~)4'CH3
1"
~ 'n
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
21
1. Spectre RMN ~H
Le solvant utilisé est le DMSO deutéré.
8 (ppm) =0,86 (t;3H;CH3 6"), 1,26 (s; 4H; CH2 5" et 4"), 1,52 (m; 2H; CH2
s 3"),1,82 (s; 3H; CH3 2'), 2,25 (t; 2H; CH2 2"), 3,13 à 4,32 (plusieurs m;
6H;
4CH cycle; CH2 6), 4,75 (d; 1 H; OH), 4,89 (m; 1 H; CH cycle), 5,19 (d;1 H;
OH), 6,57(d;1 H; OH), 7,69 (d;1 H; fvtH).
Exemple 7
l0 2-acétamido-2-déoxy-(6)O-hexanoyl D-glucopyranose (C6-NAG)
Afin d'obtenir une monoestérification régiosélective sur l'hydroxyle
porté en C6, l'hydroxyle porté en C1 est protégé par un groupe benzyle
avant d'estérifier.
1s Pour estérifier, une solution de 1,75 g de chlorure d'hexanoyle dans
2 mL de dichlorométhane a été additionnée goutte à goutte à température
ambiante pendant 2 heures à une solution de 3,11 g de benzyl NAG dans
50 mL de pyridine anhydre. La solution a été agitée à température
ambiante pendant 48h. Afin de stopper la réaction, le chlorure d'hexanoyle
2o n'ayant pas réagi a été hydrolysé avec 5 mL d'eau. La pyridine a été
évaporée. Le résidu huileux marron obtenu a été dissous dans 100 mL de
chloroforme. Cette phase organique a été lavée avec 20 mL d'eau afin de
faire passer le chlorure de pyridinium et la majeure partie du produit de
départ n'ayant pas réagi en phase aqueuse. La phase organique a ensuite
2s été lavée avec 20 mL d'une solution saturée d'hydrogenocarbonate de
sodium afin de faire passer en phase aqueuse l'acide hexanoïque sous
forme d'hexanoate de sodium. La phase organique a été séchée sur
MgS04 puis évaporée. L'huile marron résiduelle a été triturée dans du
pentane plusieurs fois jusqu'à obtention d'une poudre fine. La poudre a été
3o isolée par décantation, séchée sous vide puis dissoute dans 100 mL
d'éther. Le produit de départ et une partie du monomère n'ont pas été
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
22
solubles dans l'éther et ont formé un solide blanc qui a été recueilli par
filtration sous vide et séché. La phase éthérée a été évaporée. Le solide
obtenu a été recristallisé dans un mélange éther/pentane pour obtenir un
produit pur à 90% avec un rendement de 25% environ.
s Ce produit a ensuite été débenzylé par hydrogénation à pression
atmosphérique avec un catalyseur palladium sur charbon.
Spectre RMN ~H du 2-acétamido-2-déoxy-(6)O-hexanoyl D-
glucopyranose (C6-NAG)
1o Le solvant utilisé est le DMSO deutéré.
~ (ppm) =0,86 (t; 3H; CH3 6"), 1,26 (m; 4H; CH2 5" et 4"), 1,52 (m; 2H; CH2
3"), 1,82 (s; 3H; CH3 2'), 2,25 (t; 2H; CH2 2"), 3,13 à 4,32 (plusieurs m; 6H;
4CH cycle. CH2 6), 4,75 (d; 1 H; OH), 4,89 (m; 1 H; CH cycle), 5,19 (d; 1 H;
OH), 6,57 (d; 1 H; OH), 7,69 (d; 1 H; NH).
1s
Exemple 8
2-acétamido-2-déoxy-(6)O-butyryl D-glucopyranose (C6-NAG)
On a procédé de la même façon qu'à l'exemple 7, en employant 1,16 g de
chlorure de butyryle à la place du chlorure d'hexanoyle.
2o Spectre RMN ~H du 2-acétamido-2-déoxy-(6)O-butyryl D-
giucopyranose (C4-NAG)
Le solvant utilisé est le DMSO deutéré.
8 (ppm) =0,86 (t; 3H; CH3 4"), 1,52 (q; 2H; CH2 3"), 1,82 (s; 3H; CH3 2'),
2,25 (t; 2H; CH2 2"), 3,13 à 4,42 (plusieurs m; 6H; 4CH cycle. CH2 6), 4,75
2s (d; 1 H; OH), 4,89 (m; 1 H; CH cycle), 5,19 (d; 1 H; OH), 6,57 (d; 1 H;
OH),
7,69 (d; 1 H; NH).
Exemple 9
Diester en position C4 et position C6 : (C6)2-NAG
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
23
On procède de la même façon qu'à l'exemple 7, en employant 3,5 g de
chlorure d'hexanoyle. La séparation du diester et du monoester en C6 est
obtenue par extraction fractionnée dans les solvants (pentanelether).
s Exemple A
Pour le traitement (enrobage ou pelliculage) de graines de blé
Triticum aestivum avec une composition comportant un agent de
pelliculage Sepiret 7017~ Argent commercialisé par la société SEPPIC,
présenté sous la forme d'une suspension épaisse contenant 29 % de
io matière sèche, un additif selon l'invention et un diluant (eau) a été
utilisée.
Opération de Pelliculage : Une bouillie de pelliculage a été préparée en
diluant la préparation commerciale de Sepiret 7017 par de l'eau
déminéralisée dans les proportions suivantes : 15 g de suspension
commerciale pour 21 g d'eau. La bouillie ainsi préparée contenait entre
is 12 % et 14 % d'extrait sec.
Les préparations testées sur les graines étaient constituées de
cette bouillie à laquelle ont été ajoutées des quantités variées d'additif, de
manière à réaliser des préparations titrant entre 5 et 50 mg d'additif par
gramme.
2o Les additifs testés ont été : la N-acétylglucosamine (notée NAG), le
2-acétamido-2-déoxy-6-O-octanoyl-D-glucopyranose (C8-NAG), le 2-
acétamido-2-déoxy-6-O-stéaroyl-D-glucopyranose (C18-NAG) et le tensio-
actif glycosylé Hecameg~ : méthyl-6-O-(N-heptylcarbamoyl)-a-D-
glucopyranoside.
2s On a utilisé 4 g de préparation pour pelliculer 110 graines, soit
4,5 g de blé. L'application du pelliculage a été réalisée en brassant
ensemble les graines et la préparation. Le séchage a été réalisé sous
courant d'air chaud : durée : une heure ; température : 30 - 35°C.
Après
cette opération, les graines portaient entre 0,10 et 0,15 g de pelliculage sec
3o par gramme de blé.
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
24
Effets des additifs sur la germination des Graines et sur le développement
de champignons phytopathoaènes.
Des lots de 100 graines de blé contaminées naturellement par les
s champignons phytopathogènes Fusarium roseum et Microdochium nivale
ont été mis à incuber dans des boîtes de Pétri fermées avec du parafilm, à
raison de 5 graines par boîte, après pelliculage selon le protocole décrit ci-
dessus.
Le milieu gélosé était constitué de : en g/1 d'eau déminéralisée
io Extrait de levure 2, KH2P04 : 1,5 ; K2HP04 : 1,5 ; Mg(S04).7H20 : 0,3 ;
NaN03 : 3 et agar : 14. Température d'incubation : 16°C.
L'effet antifongique a été mesuré par l'inhibition de la croissance
des hyphes de champignons, après 7 jours d'incubation, par comparaison
avec les résultats obtenus avec des préparations pelliculantes ne
1s comportant pas les additifs (préparations références). On appelle graine
contaminée une graine ayant donné naissance à un développement
d'hyphes de champignon.
L'effet sur la germination a été mesuré par le décompte des graines
germées après 7 jours.
2o On définit, respectivement, la Différence de contamination Dc et
Différence de germination Dg, pour un lot de 100 graines, par
Dc = nbre de graines contaminées (essai) - nbre de graines contaminées
(réf.)
Dg = nbre de graines germées (essai) - nbre de graines germées
(référence)
On définit également le taux d'efficacité antifongique TEA par
3o TEA = (% Graines contaminées référence - % Graines contaminées essai~x100
(% graines contaminées référence)
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
et le taux d'efficacité germinative TEG par
TEG = ~% Graines Germées essai - % graines giermées référence)x100
s (% graines germées référence)
Les résultats sont rapportés dans le tableau 1 ci-dessous.
Dg TEG Dc TEA
NAG 50 mg/g -1 -2 % -14 +47
C8-NAG 50 -58 -97 % -27 +93
mg/g
C8-NAG 10 +16 +28 % -40 +78
mg/g
C8-NAG 5 mg/g +8 +19 % -17 +57
C18-NAG 10 -9 -16 % -3 +6
mg/g
Hecameg 5 mg/g-41 -72 % -34 +67
On considère comme significatifs les essais ayant conduit à des
1o différences Dg ou Dc supérieures, en valeur absolue, à.15 graines.
Le tableau montre une efficacité antifongique significative de la part
de C8-NAG aux trois concentrations testées : 5, 10 et 50 mg/g ainsi que
pour l'Hecameg (5mg/g). On observe en revanche une augmentation
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
26
significative de la germination pour une concentration moyenne de C8-NAG
(10 mg/g) alors que l'Hecameg la diminue.
Exemple B
s Pelliculage avec C12-NAG seul en solution ou en suspension
hydroalcoolique.
Des essais de pelliculage ont été réalisés en brassant, pendant
environ une minute, des graines de blé dans des suspensions ou solutions
1o hydroalcooliques de C12-NAG. Ces suspensions ou solutions ont été
réalisées en mélangeant 150 mg de C12-NAG avec 4 ml de solvant
hydroalcoolique.
Les solvants testés ont été l'eau pure, une solution aqueuse
d'éthanol à 50 % volumelvolume et une solution aqueuse d'éthanol à 95
is (v/v).
Des lots de 50 graines, soit environ 2 grammes, ont été utilisés.
Les graines pelliculées ont été ensuite séchées dans un courant d'air
chaud à environ 30 °C.
Des manipulations témoins, avec d'autres lots de graines, ont
2o consisté à réaliser le protocole décrit ci-dessus en utilisant des
solutions
hydroalcooliques de mêmes titres, sans composé actif, afin de contrôler
l'effet de la simple imprégnation des graines par les diluants. Les lots
témoins et les lots comportant C12-NAG ont été séchés simultanément
sous le même courant d'air chaud. Le séchage a été arrêté lorsque le lot
2s témoin a retrouvé son poids initial avant imprégnation.
Les propriétés physico-chimiques des composés C12-NAG
permettent le dépôt de quantités significatives du composé. Le tableau 1
résume ces résultats
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
27
Tableau 1 : Essais de pelliculage avec C12-NAG pur : masse sèche
déposée
Concentration de la Masse de C12-NAG
Nature du diluant suspension de pelliculagedpose par gramme de
bl
Ethanol 95 % v/v 37,5 g/1 2 mg /g
Ethanol 50 % v/v 37,5 g/1 2,2 mg/g
Ethanol 50 % v/v * 20 % masse/masse * 260 mg / g
Eau 37,5 g/1 5,2 mg/g
s * : Suspension dans le diluant éthanol 50%, puis évaporation avant
pelliculage
Exemple C
Traitement par pelliculage de lin et pois
1o On a procédé comme à l'exemple A.
L'agent de pelliculage est du Sepiret Argent 7017~,
Pour ie lin et les pois, 1,5 et 6 g de cette suspension de pelliculage
sont, respectivement, nécessaires pour pelliculer 110 graines.
Différents additifis peuvent étre ajoutés à cette préparation avant
Is que ne soient introduites les graines. Cette méthode est très rudimentaire
et offre toutefois l'avantage d'être facile à mettre en oeuvre notamment pour
tester une gamme de différentes compositions de pelliculages. Elle est
aussi peu coûteuse en graines. Elle permet de pelliculer en obtenant une
masse sèche très supérieure à ce que réalise une pelliculeuse de type
2o industrielle (plus de 30 fois plus).
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
2~
Exemple D
Effet vis-à-vis de la contamination graines de pois (Pisum sativum)
Des graines de pois contaminées par Bofrytis sp. et Ascochyfa
pinodes ont été pelliculées avec Sepiret Argent 7017° (référence) et
avec
s de la NAG et du C8-NAG introduits dans les pelliculages, dans les mêmes
conditions que ci-dessus.
Les graines de pois employées germant moins vite que celles de
blé, les résultats ont été relevés à 8 jours.
Les résultats sont présentés en pourcentage de graines germées
io ou contaminées : ces chiffres sont à comparer systématiquement aux
résultats obtenus sur le lot de graines servant de référence. Ainsi, nous
indiquons l'écart algébrique 0, en nombre de graines du lot testé par
rapport aux 100 graines de la référence. Parallèlement, on calcule l'effet
obtenu vis-à-vis de la contamination, off, exprimé en pourcentage de la
is façon suivante
Eff =(% de Graines contaminées - % de Graines contaminées de la référence, x
100
de graines contaminées de la référence
Ainsi, un effet antifongique correspond à une valeur négative de off.
NAG 50 mg/g : 0 contam. 8 j = + 30 ; off. contam. 8 j = +16
2o CBNAG 10 mg/g : ~ contam. 8 j = -7 ; off. contam. 8 j = -37
Exemple E
Germination de spores de champignons phytopathogènes en présence de
Cn-NAG.
2s Des solutions de Cn-NAG (n = 8, 10, 12 et 14) sont réalisées en
dissolvant 2 mg de Cn-NAG dans 0,4 ml d'éthanol à 95 %.
Chacune de ces solutions est introduite dans 40 ml de gélose
stérile maintenue liquide à 50°C.
La gélose est composée de glucose (10 g/1) et d'Agar-Agar
30 (12,5 g/I).
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
29
Après addition des solutions de Cn-NAG, la gélose est coulée dans
des boîtes de Pétri stériles. Les boîtes sont ensuite ensemencées par
0,3 ml de suspensions de spores de champignons contenant entre 2.105 et
4.105 sporeslml.
s Après incubation environ 20 heures à .19°C dans l'obscurité, on
évalue, par observation au microscope, la germination des spores et la
longueur des hyphes développées-par les champignons.
Le tableau suivant indique les résultats obtenus avec les
champignons Botrytis cinerea (souches A et B) et Fusarium roseum v.
io graminearum.
Résultats
On remarque une diminution significative de la longueur des
hyphes développées par tous les champignons en présence de Cn-NAG.
is L'effet le plus marqué étant observé avec C14-NAG : entre 60 et
70 % de diminution de longueur pour respectivement Botrytis et Fusarium.
On observe également une diminution relative du taux de germination des
spores (entre 35 et 50 %) pour Botrytis.
CA 02409135 2002-11-18
WO 01/87902 PCT/FRO1/01549
C9
a
V d0-N d0 M O
a
~. ~ ~
V chiM i.c~
a
p ~ ~. ~ ~
M r
~- o ~- o ~ o
~ ~
d D O c~ ~ tir
I- c- ~ f Lf~N
LLJ
N
d
L
L J ~ J ~ ~ ~ L
Ci 1- [- I-
Q.
V
tn a m
0
~n ca ~ ci
t ~ O .i0
O N ..
C~ 00 V ~ J i-
~
N
IL
~