Note: Descriptions are shown in the official language in which they were submitted.
CA 02416756 2008-12-12
85444-16
1
Dispositif pour l'amplification en chaîne thermo-dépendante de
séquences d'acides nucléiques cibles
La présente invention conceme le domaine de la génétique.
Plus précisément, la présente invention conceme un dispositif pour
l'amplification de séquences nucléiques cibles, des cartouches
réactionnelles utilisables dans ce dispositif, et des modes d'utilisation de
ce
dispositif.
La présente invention a notamment pour objectif de permettre la
détection et, le cas échéant, la quantification en temps réel, de séquences
d'acide nucléique cibles dans un ou plusieurs échantillons.
La détection de séquences nucléiques cibles est une technique de
plus en plus utilisée dans de nombreux domaines, et l'éventail des
applications de cette technique est appelé à s'étendre au fur et à mesure
qu'elle deviendra plus fiable, plus économique et plus rapide. Ainsi, en
santé humaine, la détection de certaines séquences d'acide nucléique
permet dans certains cas un diagnostic fiable et rapide d'infections virales
ou bactériennes. De même, la détection de certaines particularités
génétiques peut permettre d'identifier des susceptibilités à certaines
maladies, ou d'étabiir un diagnostic précoce de maladies génétiques ou
néoplasiques. La détection de séquences nucléiques cibles est aussi
utilisée dans l'industrie agroalimentaire, notamment pour assurer la
traçabilité des produits, pour détecter la présence d'organismes
génétiquement modifiés et les identifier, ou pour effectuer un contrôle
sanitaire des aliments.
Les procédés de détection basés sur les acides nucléiques font
quasi systématiqiaement intervenir une réaction d'hybridation moléculaire
entre une séquence nucléique cible et une ou plusieurs séquences
CA 02416756 2003-01-20
WO 02/09877 PCT/FRO1/02385
2
nucléiques complémentaires de ladite séquence cible. Ces procédés
présentent de nombreuses variantes comme les techniques connues de
l'homme de métier sous les expressions "techniques de transfert" (blot, dot
blot, Southem blot, Restriction Fragment Length Polymorphism, etc.), ou
encore comme les systèmes miniaturisés sur lesquels sont préfixées les
séquences complémentaires des séquences cibles ("biopuces"). Dans le
cadre de ces techniques, les séquences nucléiques complémentaires sont
généralement appelées sondes. Une autre variante, qui peut constituer en
soi la base d'un procédé de diagnostic ou . n'être qu'une étape
supplémentaire dans une des techniques mentionnées ci-dessus (afin
notamment d'augmenter la concentration de la séquence cible et donc la
sensibilité du diagnostic), consiste à amplifier la séquence d'acide
nucléique ciblée. Plusieurs techniques permettant l'amplification spécifique
d'une séquence d'acide nucléique ont été décrites, dont la plus utilisée est
l'Amplification en Chaîne par Polymérase (ACP), ou Polymerase Chain
Reaction (PCR). Dans le cadre de cette dernière technique, des séquences
nucléiques complémentaires des séquences cibles, appelées amorces,
sont utilisées pour amplifier lesdites séquences cibles.
Les réactions de PCR impliquent une répétition de cycles, dont le
nombre varie généralement de 20 à 50, et qui sont composés chacun de
trois phases successives, à savoir : dénaturation, hybridation, élongation.
Respectivement, la première phase correspond à la transformation des
acides nucléiques bicaténaires en acides nucléiques monocaténaires, la
seconde phase à l'hybridation moléculaire entre la séquence cible et les
amorces complémentaires de ladite séquence, et la troisième phase à
l'élongation des amorces complémentaires hybridées à la séquence cible,
par une ADN polymérase. Ces phases sont menées à des températures
spécifiques : généralement 95 C pour la dénaturation, 72 C pour
l'élongation, et entre 30 C et 65 C pour l'hybridation, selon la température
d'hybridation (Tm) des amorces utilisées. II est aussi possible d'effectuer
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
3
les étapes d'hybridation et d'élongation à la même température
(généralement 60 C).
Une réaction de PCR consiste donc en un enchaînement de cycles
thermiques répétitifs au cours duquel le nombre de molécules d'ADN cible
servant de matrice est théoriquement doublé à chaque cycle. En réalité, le
rendement de la PCR est inférieur à 100%, si bien que la quantité de
produit Xn obtenu après n cycles est :
Xn = Xn-1 (1 + rn), OU
Xn-1 est la quantité de produit obtenu au cycle précédent, et rõ le
rendement de la PCR au cycle n (0 < rn < 1).
En considérant le rendement constant, c'est-à-dire identique pour
chaque cycle, la quantité de produit Xn obtenu après n cycles à partir d'une
quantité initia(e Xo est afors :
Xn=Xo(1 +r)n (A)
En réalité, le rendement r diminue au cours de la réaction de PCR,
du fait de plusieurs facteurs, tel qu'une quantité limitante d'au moins un des
réactifs nécessaires à l'amplification, l'inactivation de la polymérase par
ses
passages répétés à 95 C, ou son inhibition par les pyrophosphates produits
par la réaction.
Du fait de cette diminution du rendement, la cinétique d'une
réaction de PCR présente d'abord une phase exponentielle (tant que r est
constant), qui évolue ensuite vers une phase de plateau lorsque r diminue..
Au cours de la phase exponentielle, l'équation (A) ci-dessus est
valable, et peut aussi s'écrire :
log (Xn) = log (Xo) + n log (1 + r)
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
4
Ainsi, dans la phase exponentielle de la PCR, la courbe présentant
la quantité de produit, en échelle logarithmique, en fonction du nombre de
cycles, et une droite de pente (1 + r) et qui coupe l'axe des ordonnées à
une valeur égale au logarithme de la concentration initiale.
La mesure en temps réel, de la quantité de produit obtenu, peut
donc permettre de connaître la concentration initiale de matrice, ce qui est
particulièrement utile dans un grand nombre d'applications, par exemple
pour mesurer la charge virale d'un malade, ou encore pour connaître la
variabilité d'un transcriptome.
Généralement, les PCR impliquent des volumes réactionnels allant
de 2 à 50 pl et sont effectuées dans des tubes, des microtubes, des
capillaires ou des systèmes connus de l'homme de l'art sous le terme
"microplaques" (en fait des ensembles de micro tubes solidarisés). Chaque
lot de tubes ou de contenants équivalents doit donc être successivement
porté aux trois températures correspondant aux différentes phases de la
PCR, et ce autant de fois que de cycles désirés.
L'utilisation de tubes ou de systèmes s'y approchant oblige
l'utilisateur à effectuer de multiples manipulations pour préparer autant de
tubes et de solutions (connues de l'homme de l'art sous l'expression "mix
PCR") que de séquences cibles qu'il souhaite amplifier même à partir d'un
échantillon unique d'acides nucléiques, à l'exception _ des procédés
d'amplification "multiplex", qui permettent l'amplification de plusieurs
séquences cibles simultanément dans le même contenant, soit par
l'utilisation d'amorces dites peu spécifiques qui peuvent s'hybrider avec
plusieurs séquences cibles comme par exemple la technique RAPD -
Random Amplified Pôlymorphism DNA, soit par l'utilisation d'amorces
spécifiques mais en nombre plus important, chaque couple d'amorces
utilisé permettant l'amplification d'une séquence cible. Ces amplifications
multiplex correspondent à des cas particuliers et ne sont pas la norme. De
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
surcroît, elles ne garantissent pas l'absence d'interactions d'une réaction
d'amplification sur une autre, et pour des raisons notamment de possibles
hybridations entre les amorces, ne peuvent qu'être très limitées dans le
nombre de séquences cibles amplifiées par contenant.
5 Ces différentes manipulations impliquent de nombreux
inconvénients.
En premier lieu, elles sont consommatrices de temps. En second
lieu, elles ne sont pas sans risques du point de vue des éventuelles
contaminations d'un tube à l'autre ou depuis l'environnement extérieur
(poussière, bactérie, aérosol ou tout autre contaminant susceptible de
contenir des molécules d'acides nucléiques ou des molécules susceptibles
d'influer sur l'efficacité de la réaction d'amplification). De plus, elles
n'assurent pas une homogénéité de volume et de concentration en réactifs
d'un tube à l'autre. Enfin, elles imposent l'utilisation de volumes
manipulables manuellement, généralement supérieurs à 1 pl, ce qui a une
incidence sur les coûts liés à la réalisation des PCR, les réactifs utilisés
étant chers.
L'utilisation de dispositifs conçus pour automatiser au moins
partiellement de telles manipulations permet de pallier certains de ces
inconvénients. Toutefois, de tels automates sont relativement chers et leur
utilisation ne se trouve donc généralement économiquement justifiée que
dans le cas des PCR en grandes séries, par exemple pour le séquençage
des génomes.
11 existe aussi certains automates permettant de réaliser des
réactions de PCR cinétiques. Comme il a été vu plus haut, la réalisation
d'une PCR cinétique nécessite de quantifier en temps réel, et de façon
spécifique, la séquence cible amplifiée. L'utilisation d'un intercalant
fluorescent dans le mélange réactionnel permet de mesurer l'augmentation
de la quantité totale d'ADN double brin dans ledit mélange. Toutefois, cette
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
6
méthode ne permet pas de discriminer l'amplification de la séquence cible
par rapport au bruit de fond ou à une éventuelle amplification non
spécifique. Plusieurs systèmes de sondes ont été décrits récemment pour
permettre de mesurer spécifiquement l'amplification d'une séquence cible
déterminée. Ils sont basés sur des oligonucléotides complémentaires de
ladite séquence, et liés à des couples de groupements de fluorophores ou
fluorophores/quenchers, de telle sorte que l'hybridation de la sonde à sa
cible et les cycles d'amplification successifs entraînent, suivant les cas,
une
augmentation ou une diminution de la fluorescence totale du mélange,
proportionnellement à l'amplification de la séquence cible.
A titre d'exemples de sondes utilisables pour réaliser des PCR
cinétiques, on peut citer le système TaqManTM (ABI ), fe système
AmpliSensorTM (InGen), et le système SunriseTM (Oncore, Appligène ).
Le système le plus utilisé actuellement est le système Taq Man7M.
Ce procédé associe les activités ADN polymérase et 5'-->3'
nucléase de la Taq polymérase au cours de la PCR. Son principe en est le
suivant : en sus des deux amorces de séquence complémentaire de celle
de la cible à quantifier, une sonde, appelée sonde reporter, est ajoutée
dans le milieu réactionnel. Elle a la capacité de s'hybrider à la cible dans
le
corps de la séquence amplifiée, mais ne peut être amplifiée elle-même. En
effet, un groupe phosphoryle ajouté à l'extrémité 3' de la sonde empêche
son extension par la Taq polymérase. Un dérivé de la fluorescéine et un
dérivé de la rhodamine sont incorporés dans la sonde, respectivement aux
extrémités 5' et 3'. La sonde est de petite taille, aussi le dérivé de la
rhodamine, situé à proximité de la fluorescéine, absorbe-t-il l'énergie émise
par la fluorescéine soumise à une source d'excitation (phénomène de
quenching).
Une fois les amorces hybridées à la cible, au cours de la réaction
d'extension, la Taq ADN polymérase attaque la sonde par son activité 5'
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
7
nucléase, libérant le groupement quencher et rétablissant ainsi l'émission
de fluorescence. L'intensité de la fluorescence émise est alors
proportionnelle à la quantité de produits de PCR formés, ce qui permet
d'obtenir un résultat quantitatif. La fluorescence émise est proportionnelle
au nombre de molécules cibles de départ. La cinétique de développement
de la fluorescence peut être suivie en temps réel au cours de la réaction
d'amplification.
Cette technique présente l'avantage d'être facilement
automatisable. Un appareil permettant de réaliser cette technique, l'ABI
Prism 7700TM, est commercialisé par la société Perkin-Elmer. Cet appareil
combine un thermocycleur et un fluorimètre. Il est capable de détecter
l'augmentation de fluorescence générée au cours d'un test de quantification
selon le procédé TaqManTM, ceci grâce à des fibres optiques situées au-
dessous de chaque tube et reliées à une caméra CCD qui détecte, en
temps réel, le signal émis par les groupes fluorescents libérés au cours de
la PCR. Les données quantitatives sont déduites à partir de la
détermination du cycle auquel le signal du produit d'amplification atteint un
certain seuil déterminé par l'utilisateur. Plusieurs études ont en effet
montré
que ce nombre de cycles était proportionnel à la quantité de matériel initial
(Gibson, Heid et al. 1996; Heid, Stevens et al. 1996; Williams, Giles et al.
1998).
Le nombre d'applications potentielles d'un tel appareil est
considérable, tant en santé humaine qu'en agroalimentaire et en contrôle
qualité. Malheureusement, l'ABI Prism 7700TM et les quelques autres
appareils concurrents commercialisés actuellement sont extrêmement
chers. De plus, ils ne peuvent être utilisés que par un manipulateur qualifié.
En pratique, de tels appareils ne sont donc utilisés que dans certaines
structures très spécialisées.
CA 02416756 2008-12-12
85444-16
8
Il existe donc aujourd'hui un réel besoin pour
un système d'amplification d'acides nucléiques, le cas
échéant mesurée en temps réel, et qui ne présente pas les
inconvénients cités ci-dessus de l'état de la technique.
L'objectif de la présente invention est de
proposer un tel système qui permette de diminuer
considérablement le nombre de manipulations nécessaires à
la mise en oeuvre d'une méthode d'amplification sur une
pluralité de séquences cibles et, en conséquence, de
diminuer le temps nécessaire à cette opération.
Un autre objectif de la présente invention est
une cartouche réactionnelle comportant plusieurs chambres
réactionnelles closes et au moins un réservoir, et
présentant les caractéristiques suivantes: chaque chambre
réactionnelle est reliée au réservoir par un canal ayant une
section droite comprise dans un cercle de diamètre inférieur
à 3 mm, la capacité du réservoir est inférieure à 10 ml et
la disposition des chambres réactionnelles et des canaux par
rapport au réservoir permet de répartir un fluide de façon
homogène dans les chambres réactionnelles, à partir du
réservoir.
Un autre objective de la présente invention est
une dispositif pour effectuer des réactions enzymatiques
et/ou de biologie moléculaire nécessitant au moins deux
températures d'incubation différentes, comprenant: au moins
une cartouche présentant une pluralité de chambres
réactionnelles closes et un réservoir, les chambres
réactionnelles étant reliées au réservoir par des canaux; au
moins une platine de chauffage présentant au moins deux
zones distinctes pouvant être portées à au moins deux
températures différentes et des moyens de déplacement
relatif entre la cartouche et la platine, permettant une
CA 02416756 2008-12-12
85444-16
8a
variation cyclique de la température des chambres
réactionnelles.
Un autre objectif de la présente invention est un
procédé d'amplification d'acide nucléique grâce à un
dispositif tel que défini ci-dessus, comportant les étapes
suivantes: remplir au moins partiellement le réservoir avec
un fluide contenant un échantillon d'acides nucléiques à
analyser, ainsi que tout le nécessaire à une réaction
d'amplification à l'exception des amorces et, le cas
échéant, un intercalant fluorescent des acides nucléiques;
repartir le fluide dans les chambres réactionnelles de la
cartouche, dans lesquelles sont prédéposées des amorces et,
le cas échéant, une ou plusieurs sondes marquées et mettre
en oeuvre les moyens de déplacement relatif entre la
cartouche et la platine chauffante pour amener
successivement et autant de fois que désiré le contenu de
chaque chambre réactionnelle aux deux, trois ou davantage
températures définies par les deux, trois ou davantage zones
de la platine de chauffage.
Un autre objectif de la présente invention est
de proposer un tel système qui minimise les risques de
contamination d'un contenant à l'autre.
Un autre objectif de la présente invention est
de proposer un tel système qui réduise les volumes de
réactifs mis en jeu et donc les coûts.
Un autre objectif de la présente invention est de
proposer un tel système qui optimise une répartition
homogène en volume et en concentration des réactifs
nécessaires à la PCR dans les contenants.
CA 02416756 2008-12-12
85444-16
8b
Un autre objectif est de fournir à tous les
utilisateurs potentiels, notamment aux centres
hospitaliers, aux laboratoires d'analyses médicales, aux
industriels de l'agroalimentaire et aux laboratoires de
contrôle sanitaire, un appareil d'utilisation et de
maintenance aisées, pour effectuer en routine des
amplifications d'acides nucléiques quantifiées en temps
réel.
Dans cette demande, plusieurs termes sont
employés, dont la signification est la suivante:
Une "réaction d'amplification d'acides
nucléiques" fait référence à n'importe quelle méthode
d'amplification d'acides nucléiques connue de l'homme du
métier. On peut citer, à titre d'exemples et de façon non
restrictive, l'Amplification en Chaîne par Polymérase
(ACP), plus
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
9
souvent désignée par l'homme du métier sous son acronyme anglophone,
PCR (Polymerase Chain Reaction), la TMA (transcription mediated
amplification), la NASBA (nucleic acid sequence based amplification), la
3SR (self sustained sequence replication), l'amplification par déplacement
de brin, ou SDA (strand displacement amplification) et la LCR (ligase chain
reaction).
La matrice initiale de l'amplification peut être n'importe quel type
d'acide nucléique, ADN ou ARN, génomique, plasmidique, recombinant,
ADNc, ARNm, ARN ribosomal, ARN virai ou autre. Lorsque la matrice
initiale est un ARN, une première étape de transcription réverse est en
général réalisée pour obtenir une matrice ADN. Cette étape ne sera en
général pas mentionnée dans ce -texte, car l'homme du métier sait
exactement quand et comment la réaliser. Il est bien entendu que les
dispositifs de l'invention sont utilisables pour amplifier et éventuellement
quantifier spécifiquement des séquences d'ARN aussi bien que d'ADN.
Dans la suite du texte, le terme "PCR" sera donc le terme générique utilisé
pour désigner aussi bien la PCR proprement dite que la RT-PCR (Reverse
Ttranscription - Polymerase Chain Reaction).
= Parmi les réactions d'amplification citées ci-dessus, certaines
sont isothermes. D'autres, notamment la PCR et la LCR, impliquent de
porter le mélange réactionnel à différentes températures au cours du
temps, de façon cyclique. De telles réactions sont appelées ici "réactions
d'amplification d'acides nucléiques thermo-dépendantes". Dans la suite de
ce texte, le dispositif de l'invention sera principalement décrit dans son
application à la PCR. Toutefois, il est bien évident que ce dispositif n'est
pas limité à cette technique, et qu'il peut être utilisé aussi pour n'importe
quelle réaction d'amplification d'acides nucléiques, voire pour d'autres
réactions enzymatiques et/ou de biologie moléculaire. Ce dispositif est
particulièrement adapté aux réactions qui nécessitent des volumes faibles
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
et le passage cyclique du mélange réactionnel à plusieurs températures,
comme cela apparaîtra clairement dans la suite.
= Un des objectifs de la présente invention est de fournir un
nouveau dispositif pour effectuer des réactions d'amplification dites
5 "quantitatives", c'est-à-dire permettant de déterminer la concentration de
séquence cible initialement présente dans le mélange réactionnel.
Plusieurs types de réactions d'amplification quantitatives ont été décrits. On
peut distinguer les amplifications quantitatives basées sur l'emploi d'un
standard externe, les amplifications compétitives, utilisant un standard
10 interne, et enfin les amplifications cinétiques, dont le principe a été
évoqué
plus haut, et qui consistent à mesurer en temps réel, l'augmentation de la
quantité de la séquence cible. Ce type d'amplification sera désigné ici
indifféremment sous les termes "amplification cinétique (d'acides
nucléiques)" "PCR cinétique", "amplification (d'acides nucléiques)
quantifiée en temps réel", ou encore "PCR en temps réel". Les termes entre
parenthèses sont parfois omis.
= Dans cette demande, le terme "réactif' doit être compris au
sens large, comme désignant n'importe quel élément nécessaire soit à la
réaction d'amplification proprement dite, soit à sa détection. Suivant cette
définition, les sels, les dNTP, les amorces ou encore la polymérase, sont
des réactifs nécessaires à la PCR. De même, un intercalant fluorescent, ou
une sonde, sont ici considérés comme des réactifs participant à la détection
des produits amplifiés, bien qu'ils ne réagissent pas au sens littéral.
D'autres termes désignant certains éléments du dispositif de
l'invention seront définis plus loin dans la description détaillée de
l'invention.
Certains éléments du dispositif sont numérotés en référence aux
dessins, qui illustrent quelques modes et variantes non limitatifs de
réalisation l'invention, et dans lesquels :
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
11
= la figure 1 représente une vue latérale d'une réalisation
simplifiée du dispositif selon la présente invention ;
= la figure 2 représente une vue supérieure de la platine
chauffante, dans le cas où les blocs (21 à 23) sont des secteurs de disque
(figure 2A), et dans le cas où ils sont constitués de secteurs de couronne
(figure 2B);
= la figure 3 représente une vue en perspective d'un premier
exemple de réalisation de la cartouche (1), pourvue des chambres
réactionnelles et d'une partie des moyens de déplacement ;
lo = la figure 4 représente une vue en coupe de cette cartouche
selon la ligne AA ;
= la figure 5 représente une vue supérieure de la partie inférieure
(socle) d'un deuxième mode de réalisation particulier de la cartouche selon
l'invention. Les cotes sont données à titre purement indicatif, et ne sont en
aucun cas limitatives ;
= la figure 6 représente une vue en coupe de cette cartouche
inférieure, selon la ligne AA de la figure 5;
= la figure 7 représente une vue supérieure de la partie
supérieure (couvercie) de la cartouche représentée aux figures 5 et 6;
= la figure 8 représente une vue en coupe de cette cartouche
supérieure, suivant la ligne BB de la figure 7;
= la figure 9 représente une cartouche complète, constituée du
socle représenté aux figures 5 et 6 (traits pleins), et du couvercle
représenté aux figures 7 et 8 (traits discontinus) ;
= la figure 10 montre trois modélisations de la cartouche de la
figure 9, au-dessus de laquelle se trouvent les moyens d'excitation/mesure
de.la fluorescence (5) ;
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
12
la figure 11 illustre une cartouche rectangulaire et deux modes
d'utilisation d'une telle cartouche. La figure 11A représente une cartouche
(1) comportant 8 sous-réservoirs (111 à 118) et 40 chambres réactionnelles
Seùls les 5 canaux reliés au sous-réservoir 111 sont représentés, ainsi que
les chambres réactionnelles (13) correspondantes. La figure 11 B illustre un
dispositif de l'invention comportant une cartouche (1) rectangulaire et une
platine chauffante (2) constituée de trois éléments parallèles (21 à 23).
Dans la figure 11C, l'élément (22) est décalé par rapport aux autres ; la
cartouche doit donc se déplacer suivant un triangle pour effectuer les
cycles de PCR;
= la figure 12 montre une coupe schématique d'un canal (12)
possédant un dispositif de "perte de charge".
L'invention concerne en premier lieu tout dispositif pour effectuer des
réactions enzymatiques et/ou de biologie moléculaire nécessitant au moins
deux températures d'incubation différentes, caractérisé en ce qu'il
comprend :
- au moins une plaque ou cartouche (1) présentant une pluralité
de chambres réactionnelles (13) et un réservoir (11), lesdites chambres
réactionnelles étant reliées au réservoir par des canaux (12) ;
- au moins une platine de chauffage- (2) présentant au moins
deux zones distinctes pouvant être portées à au moins deux températures
différentes;
- des moyens (3) de déplacement relatif entre ladite cartouche
et ladite platine, permettant une variation cyclique de la température des
chambres réactionnelles.
La température de chaque zone de la platine peut être homogène
ou, le cas échéant, cette température peut varier suivant un gradient.
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
13
Plusieurs types de réactions de biologie moléculaire nécessitent de
placer le mélange réactionnel à différentes températures en fonction du
temps. Ceci est le cas par exemple lorsqu'on souhaite inactiver une
enzyme après l'avoir utilisée (par exemple, une nucléase de restriction), ou
pour tester la stabilité d'un complexe. Dans ce dernier cas, on peut
envisager de placer un complexe (par exemple, un complexe
antigène/anticorps, ou récepteur/ligand), dont l'un des éléments est couplé
à un fluorophore et l'autre à un quencher de fluorescence, dans une des
chambres réactionnelles du dispositif. La platine est alors programmée
pour présenter plusieurs températures dans un ordre croissant, le cas
échéant sous forme d'un gradient. La stabilité du complexe est alors testée
en déplaçant la cartouche sur la platine, de façon à ce que la température
de la chambre réactionnelle s'élève progressivement, et en observant
l'augmentation de la fluorescence, à l'aide de moyens d'excitation / mesure
de la fluorescence placés en regard de la chambre réactionnelle.
L'augmentation de la fluorescence traduit alors la dissociation du complexe.
Le dispositif de l'invention est particulièrement adapté à des
réactions nécessitant une variation cyclique de la température des
chambres réactionnelles, ce qui est le cas pour certaines réactions
d'amplifications d'acides nucléiques, par exemple pour l'amplification en
chaîne par polymérase (PCR), ou pour la réaction en chaîne par ligase
(LCR).
L'invention porte donc en particulier sur un dispositif pour
l'amplification en chaîne thermo-dépendante de séquences d'acides
nucléiques cibles, caractérisé en ce qu'il comprend :
- au moins une cartouche (1) présentant une pluralité de
chambres réactionnel{es (13) et un réservoir (11), lesdites chambres
réactionnelles étant reliées au réservoir par des canaux (12) ;
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
14
- au moins une platine de chauffage (2) présentant au moins
deux zones distinctes pouvant être portées à au moins deux températures
différentes, correspondant aux phases des cycles d'amplification desdits
acides nucléiques cibles ;
- des moyens (3) de déplacement relatif entre ladite cartouche
et ladite platine, permettant une variation cyclique de la température des
chambres réactionnelles.
Un tel système selon l'invention est moins complexe que les
systèmes de l'art antérieur, dans la mesure où les températures
nécessaires aux cycles de l'amplification en chaîne sont assurées par des
zones distinctes de températures constantes et non par une platine dont on
doit faire varier la température.
Il est important de noter que les réactions d'amplification en chaîne
thermo-dépendantes nécessitent le passage des échantillons à au moins
deux températures. Par exemple, la LCR nécessite à chaque cycle une
phase à environ 95 C pour dénaturer l'ADN cible, puis une phase entre 55
et 65 C (en fonction du Tm des sondes), pour donner lieu à l'hybridation /
ligation. En ce qui concerne la PCR, chaque cycle se décompose en
général en trois phases, à savoir la dénaturation à environ 95 C,
l'hybridation dont la température dépend du Tm des sondes, et l'élongation,
habituellement réalisée à 72 C. II est cependant possible de réaliser des
PCR ayant des cycles simplifiés, dans lesquels l'hybridation et l'élongation
se font à la même température, si bien que chaque cycle nécessite
seulement deux températures différentes.
II pourra être envisagé différentes variantes du dispositif décrit ci-
dessus. Selon une variante préférentielle de l'invention, le système
comprend les caractéristiques suivantes :
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
- des amorces spécifiques de séquences cibles à amplifier sont pré-réparties
dans les chambres réactionnelles (13),
- le réservoir (11) est destiné à recevoir un fluide composé
notamment d'un échantillon d'acides nucléiques à analyser et des réactifs
5 nécessaires à une réaction d'amplification en chaîne par polymérase, à
l'exception des amorces,
- la platine de chauffage (2) présente trois zones distinctes
pouvant être portées à trois températures différentes, correspondant aux
trois phases des cycles d'amplification en chaîne par polymérase.
10 Selon cette variante préférentielle, il est possible de distribuer, à
partir d'un réservoir, un fluide contenant un échantillon d'acides nucléiques
à analyser et les réactifs nécessaires à la PCR dans une pluralité de
chambres réactionne(les contenant des amorces spécifiques de séquences
cibles d'acides nucléiques à amplifier, et~ d'autoriser le processus
15 d'amplification en soumettant le contenu des chambres successivement à
différentes températures (à savoir celles nécessaires à la dénaturation,
l'hybridation et l'élongation) une multitude de fois grâce à un mouvement
relatif entre la cartouche incluant lesdites chambres réactionnelles et ladite
platine de chauffage présentant deux ou trois zones distinctes pouvant être
portées à des températures différentes.
Le cas échéant, les chambres réactionnelles (13) peuvent contenir
des réactifs nécessaires à une réaction de PCR en temps réel autres que
les amorces mentionnées ci-dessus. Dans une réalisation préférée du
dispositif de l'invention, les chambres réactionnelles comportent également,
en plus des amorces, une ou plusieurs sonde(s) spécifique(s) de la
séquence à amplifier. La distribution des sondes dans les chambres
réactionnelles peut aussi être telle que certaines chambres comportent des
sondes spécifiques des séquences à amplifier et d'autres chambres
comportent des sondes contrôles, ne reconnaissant pas a priori la
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
16
séquence à amplifier. Ces sondes peuvent être marquées et, si plusieurs
sondes sont présentes dans une même chambre réactionnelle (par
exemple une sonde spécifique de la séquence à amplifier et une sonde
contrôle), ces sondes seront de préférence marquées par des fluorophores
différents.
Dans une autre variante du dispositif, des réactifs supplémentaires,
tels que les dNTP ou des sels, sont initialement déposés dans les
chambres réactionnelles. Ces réactifs seront alors absents, ou présents en
moindre quantité, dans le fluide déposé dans le réservoir (11). Dans le cas
extrême, tous les réactifs nécessaires à la réaction de PCR, à l'exception
de la matrice, sont déposés dans les chambres réactionnelles (13), et le
fluide déposé dans le réservoir (11) comprendra alors uniquement
l'échantillon d'ADN (ou d'ARN) à amplifier.
Les variantes décrites ci-dessus supposent que plusieurs réactions
soient réalisées en parallèle, avec des amorces et/ou des sondes
différentes, sur un même échantillon. II s'agit donc de la caractérisation
d'un échantillon unique (ou dé quelques échantillons si le réservoir est
divisé en quelques sous-réservoirs) suivant plusieurs critères. Dans
certaines applications, on souhaite au contraire caractériser une multitude
d'échantillons suivant un critère unique ou un faible nombre de critères.
Ceci est le cas par exemple en recherche, lorsqu'on souhaite cribler une
banque de phages ou de bactéries pour la présence d'un gène donné. II est
dans ce cas nécessaire d'effectuer une PCR sur un grand nombre
d'échantillons, à partir d'un couple d'amorces donné. Le dispositif de
l'invention est adapté aussi à ce type de manipulations. Pour cela, les
échantillons sont déposés dans les chambres réactionnelles (13). Les
amorces peuvent être introduites dans le fluide déposé dans le réservoir
(11), avec les autres réactifs nécessaires à la PCR. Bien entendu, cette
configuration n'exclut pas non plus que certains réactifs autres que
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
17
l'échantillon à analyser soient pré-déposés dans les chambres
réactionnelles (13).
Quelle que soit la variante du dispositif choisie, et quels que soient
les réactifs déposés dans les chambres réactionnelles (13), ils peuvent y
être déposés avantageusement par un simple dépôt liquide, suivi d'un
séchage. L'arrivée du fluide en provenance du réservoir (11) permet
ensuite la remise en solution de ces réactifs. La quantité de chaque réactif
déposée est calculée en fonction du volume de fluide qui pénètrera dans
chaque chambre réactionnelle (13), de telle sorte qùe la remise en solution
des réactifs aboutisse à la concentration finale souhaitée pour chacun
d'entre eux. Des cartouches telles que décrites ci-dessus, dans lesquelles
au moins une partie des chambres réactionnelles (13) comportent des
réactifs qui y ont été chargés par un dépôt liquide, suivi d'un séchage, de
telle sorte que ces réactifs soient remis en solution par l'arrivée d'un
fluide
dans ces chambres réactionnelles, sont également partie intégrante de
l'invention.
Le dispositif décrit ci-dessus présente l'avantage d'autoriser un
remplissage concomitant de toutes les chambres réactionnelles, ce qui
diminue le temps de préparation et les risques de contamination d'une
chambre à l'autre. Ce dispositif présente également l'avantage de pouvoir
être miniaturisé et d'impliquer l'utilisation de volumes de réactifs plus
faibles
que dans l'état de la technique.
Enfin on notera aussi que, grâce à la platine de chauffage
spécifique qu'elle préconise, l'invention permet d'accélérer les cycles de
PCR, puisqu'il n'est pas nécessaire pour effectuer les différentes phases
(dénaturation, hybridation, élongation) de faire varier Ia température de la
platine chauffante ou de l'atmosphère comme dans l'état de la technique, le
mouvement relatif entre la cartouche et la platine permettant de soumettre
rapidement et successivement le contenu de chacune des chambres
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
18
réactionnelles à trois températures distinctes dédiées à chacune de ces
phases. L'utilisation de faibles volumes réactionnels, et d'un plancher de
faible épaisseur pour la cartouche (1), permettent aussi de limiter l'inertie
thermique au niveau des chambres réactionnelles, et contribuent donc à la
rapidité de la réaction.
L'invention porte également sur un dispositif pour l'amplification en
chaîne thermo-dépendante de séquences d'acides nucléiques cibles,
mesurée en temps réel, caractérisé en ce qu'il comprend les mêmes
éléments que l'un quelconque des dispositifs décrits ci-dessus, et
comportant en outre des moyens optiques (5) d'excitation / mesure de la
fluorescence, disposés de manière à exciter et mesurer à chaque cycle la
fluorescence du contenu des chambres réactionnelles.
Un des éléments particulièrement originaux des dispositifs décrits ci-
dessus est l'élément appelé indifféremment plaque ou cartouche
réactionnelle (1). Cet élément peut être recyclable ou, de façon préférée,
consommable, et constitue en soi un aspect de la présente invention. Ainsi,
l'invention porte également sur une cartouche réactionnelle comportant
plusieurs chambres réactionnelles (13) et au moins un réservoir (11) et
présentant les caractéristiques suivantes :
- chaque chambre réactionnelle est reliée au réservoir par un
canal (12) ayant une section droite comprise dans un cercle de diamètre
inférieur à 3 mm,
- la capacité du réservoir est inférieure à 10 ml,
- la disposition des chambres réactionnelles et des canaux par
rapport au réservoir permet de répartir un fluide de façon homogène dans
les chambres réactionnelles, à partir du réservoir.
Le diamètre des canaux sera préférentiellement choisi
suffisamment faible pour ne pas autoriser une distribution par gravité du
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
19
fluide présent dans le réservoir dans les chambres réactionnelles, ceci de
façon à éviter un remplissage non reproductible de ces chambres. Ce
diamètre sera ainsi préférentiellement inférieur ou égal à environ 0,2 mm.
Au sujet de ce diamètre, on notera que la section des canaux sera
préférentiellement circulaire mais qu'elle pourra être également de toute
autre forme et notamment polygonale, le "diamètre" des canaux visant
alors leur plus grande largeur en section.
Le réservoir destiné à recevoir l'échantillon d'acides nucléiques et
les réactifs nécessaires à la PCR pourra présenter une capacité variable,
comprise par exemple entre environ 0,1 ml et environ,1 ml.
La cartouche comprend de préférence entre environ 20 et environ
500 chambres réactionnelles et, de manière encore préférée, entre 60 et
100 chambres réactionnelles.
Le volume de ces chambres pourra également varier selon les
modes de réalisation. Avantageusement, ces chambres présentent un
volume compris entre environ 0,2 et 50 pI, de préférence entre 1 NI et 10 pi.
Dans les cartouches de l'invention, la jonction entre les canaux (12)
et le réservoir (11) se fait de préférence à la périphérie du réservoir, et le
fond dudit réservoir est incliné et/ou convexe, de façon à assurer la
répartition d'un fluide contenu dans le réservoir au niveau de l'entrée des
canaux.
On notera qu'une cartouche selon l'invention peut présenter de
multiples formes. Toutefois, selon une variante préférentielle de l'invention,
cette cartouche présente une forme circulaire, le réservoir étant alors prévu
sensiblement au centre de la cartouche, les chambres réactionnelles étant
réparties en cercle autour du réservoir, et les canaux reliant le réservoir
aux
chambres étant prévus essentiellement radialement. Une telle architecture
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
permet d'optimiser le remplissage des chambres réactionnelles à partir du
réservoir central.
Dans une réalisation particulière des cartouches circulaires de
l'invention, le fond du réservoir (11) est conique.
5 Egalement préférentiellement, lesdites chambres réactionnelles
sont prévues relativement à la périphérie de ladite cartôuche. Ainsi, il est
possible d'optimiser le nombre de chambres réactionnelles pouvant être
prévues sur la cartouche et remplies à partir du réservoir central.
Selon une variante de l'invention, une telle cartouche comprend
10 autant de canaux que de chambres réactionnelles. Toutefois, dans certains
modes de réalisation, on pourra prévoir des tronçons de canaux communs
à plusieurs chambres réactionnelles.
L'un des avantages de la présente invention est d'autoriser une
miniaturisation du dispositif qu'elle propose. Ainsi, avantageusement, la
15 cartouche, lorsqu'elle a une géométrie de révolution, présente de
préférence un diamètre compris entre environ 1 et 10 cm.
Alternativement, une cartouche selon l'invention peut posséder une
géométrie de translation, dans laquelle le réservoir (11) est placé sur un
côté de ladite cartouche, les chambres réactionnelles (13) sont alignées de
20 l'autre côté de la cartouche, et les canaux (12) reliant leréservoir aux
chambres sont essentiellement parallèles les uns aux autres. La forme
générale d'une telle cartouche est alors essentiellement rectangulaire, mis
à part certaines protubérances et/ou creux destinés à relier la cartouche à
des moyens capables de la mettre en mouvement. Un exemple d'une telle
cartouche est représenté à la figure 11A. Dans le cas d'une telle cartouche,
le fond du réservoir (11) est de préférence un plan incliné, qui permet de
diriger le fluide réactionnel vers l'entrée des canaux (12).
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
21
Une variante des cartouches de l'invention décrites ci-dessus, quelle
que soit leur géométrie, consiste à diviser le réservoir (11) en 2 à 20, de
préférence 2 à 8 sous-réservoirs, permettant d'analyser simultanément
plusieurs échantillons sur une même cartouche. Dans ce cas, chacune des
chambres réactionnelles (13) est reliée à un seul de ces sous-réservoirs
par un canal (12). Un exemple de cette variante est représenté à!a figure
11A. La cartouche représentée sur cette figure comporte huit sous-
réservoirs numérotés 111 à 118, chacun de ces sous-réservoirs étant relié
à cinq chambres réactionnelles (13) via cinq canaux.(12). Dans cette figure,
seuls les canaux reliés au sous-réservoir 111 sont représentés. Il est
important de noter ici que dans tout ce qui précède et ce qui suit, le
"réservoir (11)" désigne aussi bien le réservoir (11) dans sa globalité qu'un
sous-réservoir.
La profondeur des chambres réactionnelles (par rapport aux
canaux) peut aussi varier en fonction des modes de réalisation de
l'invention. Selon une variante préférentielle, ces chambres présentent une
profondeur comprise entre environ 0,5 mm et 1,5 mm.
On notera par ailleurs que l'épaisseur de la cartouche dépend de
plusieurs facteurs et notamment du matériau la constituant. En pratique,
cette cartouche est préférentiellement constituée en matière plastique, de
préférence en polycarbonate, dont les propriétés physiques, optiques et
thermiques, sont appropriées pour la réalisation de la présente invention.
L'épaisseur des cartouches de l'invention est de préférence comprise entre
0,5 et 5 mm.
Afin de faciliter les échanges thermiques entre le contenu des
chambres réactionnelles et la platine, l'épaisseur du "plancher" de celles-ci
devra être préférentiellement aussi faible que possible. Cette épaisseur
dépend du matériau utilisé pour réaliser la cartouche. Préférentiellement,
elle est comprise entre 0,05 et 0,5 mm, par exemple environ 0,25 mm.
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
22
Les chambres réactionnelles des cartouches de l'invention sont de
préférence fermées par une paroi supérieure transparente (17), par
exemple en plastique transparent, afin de permettre l'excitation et la
mesure de la fluorescence du fluide réactionnel, dans des bonnes
conditiôns.
Dans une réalisation particulière de l'invention, les chambres sont
pourvues d'évents (système ouvert), permettant à l'air qu'elles contiennent
de s'échapper lors de leur remplissage par le fluide provenant du réservoir.
Dans le cas ci-dessus, où les chambres (13) sont pourvues
d'évents (14), les canaux (12) sont préférentiellement constitués d'au moins
deux parties de diamètres différents (121 et 122), le diamètre de la
deuxième partie (122) étant inférieur à celui de la première partie (121), de
façon à créer une perte de charge dans le canal (12). Ainsi, si un canal se
remplit plus vite qu'un autre sous l'effet de la pression, le phénomène de
perte de charge permet d'arrêter la progression du fluide dans le ou les
canaux dont la première partie (121) est remplie, jusqu'à ce que tous les
canaux soient remplis de la même façon. Ceci permet de pré-calibrer
les volumes pour chaque canal, afin d'assurer un remplissage homogène
des différentes chambres réactionnelles. La deuxième partie du canal (122)
peut être constituée par exemple d'un capillaire de verre, de diamètre
beaucoup plus faible que la première partie (121), ledit capillaire étant
inclus dans une cartouche en plastique.
Il est aussi possible de prévoir des enceintes (15) dans lesquelles
débouchent les évents (14) des chambres réactionnelles. Ces enceintes
possèdent une ouverture (16) vers l'extérieur de la cartouche (système
ouvert), et présentent l'intérêt, d'une part, de récupérer sans pollution les
éventuels surplus de fluide qui sortiraient des chambres réactionnelles par
les évents (14) et, d'autre part, de pouvoir se fermer après le remplissage
des chambres réactionnelles. Cette fermeture peut se faire par exemple en
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
23
utilisant une bande adhésive, et permet de passer en système clos pour
effectuer l'amplification proprement dite. Ceci permet d'éviter ou au moins
limiter l'évaporation du fluide contenu dans la cartouche (1). Cette
réalisation de l'invention est détaillée dans l'exemple 3 et illustrée aux
figures 11A et 12.
Alternativement, il est possible de travailler en système clos dès le
remplissage des chambres réactionnelles, en provoquant dans la cartouche
une dépression suivie d'un rétablissement de la pression, comme cela sera
détaillé plus loin. Des cartouches dans lesquelles les chambres
réactionnelles ne possèdent pas d'autre ouverture que l'arrivée du canal
(12) (chambres réactionnelles dites "closes") font donc également partie de
l'invention.
Les cartouches décrites ci-dessus, prévues soit pour un usage en
système ouvert, soit pour un usage en système fermé, comportent de
préférence une ouverture adaptable à des moyens (4) de modulation de la
pression dans le réservoir (11), permettant de déplacer le fluide présent
dans le réservoir vers les chambres réactionnelles.
L'invention porte également sur un procédé de remplissage en
système clos des chambres réactionnelles (13) d'une cartouche (1) telle
que décrite au paragraphe précédent, dans la variante où les chambres
réactionnelles sont closes, lequel procédé comporte les étapes suivantes :
- remplir au moins partiellement le réservoir (11) avec un fluide,
- connecter la cartouche (1) aux moyens (4) de modulation de la
pression,
- appliquer une dépression à l'intérieur de la cartouche, puis
rétablir la pression.
Dans une variante des cartouches de l'invention, chaque canal (12)
est équipé d'une cavité anti-reflux (123) au niveau de sa jonction avec le
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
24
réservoir (11), ladite cavité anti-reflux étant constituée d'une portion de
canal sensiblement verticale, d'un diamètre supérieur ou égal à celui du
canal (12). Cette variante présente deux principaux avantages. D'une part,
ces cavités anti-reflux permettent de prévenir les contaminations croisées
en cas de retour intempestif de fluide vers le réservoir (11), ou au cas où
tout le fluide ne se serait pas engagé dans les canaux. D'autre part, ces
cavités permettent de prévoir, dans les dispositifs de l'invention, un
bouchon dont les dentelures viennent épouser ces entrées verticales, afin
de boucher les canaux après l'adressage du fluide réactionnel mais avant
la réaction d'amplification. Ceci permet de travailler en système
parfaitement clos, et donc d'éviter tout risque de contamination et
d'évaporation. Toutefois, il est important de noter que les cavités anti-
reflux,
et l'utilisation d'un bouchon au niveau du réservoir pour boucher l'entrée
des canaux du côté du réservoir, peuvent être employées aussi dans le cas
de systèmes ouverts tels que décrits ci-dessus, où les chambres
réactionnelles sont pourvues d'évents.
Dans une réalisation préférée des cartouches de l'invention, une
partie au moins des chambres réactionnelles (13) comporte des
oligonucléotides. De façon encore préférée, chacune des chambres
réactionnelles (13) comporte deux amorces spécifiques d'une séquence
d'acide nucléique à amplifier et, facultativement, une ou plusieurs sonde(s)
marquée(s) spécifique(s) de ladite séquence. Une telle sonde peut être
marquée de façon à ce que sont signal augmente lorsqu'elle s'hybride à sa
séquence cible (système SunriseTM), ou de façon à ce que l'élongation à
partir d'un brin sur laquelle elle est hybridée entraîne une diminution ou une
augmentation du signal (système AmpliSensorTM ou système TaqManTM
respectivement). La présence de telles sondes dans les chambres
réactionnelles permet de réaliser des amplifications quantifiées en temps
réel, avec un dispositif de l'invention disposant de moyens (5) d'excitation /
mesure de la fluorescence, tel que décrit plus haut. Des sondes contrôles,
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
non spécifiques de la séquence à amplifier, et marquées d'une façon
différente des sondes spécifiques, peuvent aussi être utilisées, pour
détecter d'éventuelles contaminations.
Dans la réalisation de l'invention décrite ci-dessus, où les chambres
5 réactionneiles comportent des amorces et, facultativement une ou plusieurs
sonde(s), ces différentes sondes et amorces seront choisies de préférence
de telle sorte que leurs températures de fusion (Tm) respectives soient
proches. En particulier, le Tm des différentes amorces sera de préférence
compris dans un même intervalle d'environ 5 C. De même, les différentes
10 sondes auront de préférence un Tm compris dans un même intervalle de
5 C, qui peut être différent de l'intervalle des Tm des amorces. Dans ce
cas, les sondes seront choisies de telle sorte que leur Tm soit supérieur à
celui des amorces, la différence entre de Tm des différentes catégories
d'oligonucléotides étant alors de préférence de l'ordre de 5 C. La
15 température d'hybridation retenue pour effectuer l'amplification correspond
alors à la plus basse des températures de fusion des amorces.
Les chambres réactionnelles (13) des cartouches de l'invention
peuvent aussi comporter, outre les amorces et les sondes éventuelles, un
ou plusieurs autres réactifs nécessaires à la réaction de PCR ou à la
20 mesure de l'amplification. Il peut s'agir, par exemple, de sels, de dNTP,
ou
d'un intercalant fluorescent de l'ADN double brin, de type SybrGreen
(marque déposée). Comme mentionné plus haut, tous ces réactifs sont
avantageusement déposés au niveau des chambres réactionnelles (13) par
le dépôt d'une solution liquide, suivi d'un séchage.
25 Selon un mode de réalisation alternatif des cartouches de l'invention,
les cartouches sont prévues pour le criblage d'un grand nombre
d'échantillons suivant un faible nombre de critères. Ceci implique que
l'utilisateur de ces cartouches puisse facilement déposer ses échantillons
dans chacune des chambres réactionnelles (13). Pour cela, la cartouche
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
26
peut par exemple posséder un couvercle amovible qui, lorsqu'il est enlevé,
donne accès directement aux chambres réactionnelles. De telles
cartouches peuvent aussi être pré-chargées et comporter, au niveau des
chambres réactionnelles (13), un ou plusieurs réactifs nécessaire(s) à
l'amplification et / ou à sa détection.
Bien entendu, les dispositifs de l'invention mentionnés plus haut
peuvent comprendre une ou plusieurs cartouches correspondant à
n'importe laquelle des cartouches décrites ci-dessus.
Dans la réalisation particulière du dispositif de l'invention, où la
cartouche est circulaire, les zones distinctes de chauffage de la platine de
chauffage (2) sont préférentiellement réparties selon des portions de disque
(figure 2A) ou de couronne (figure 2B). Chaque portion peut être chauffée à
une température distincte pour porter successivement le contenu des
chambres réactionnelles aux températures distinctes souhaitées, grâce aux
moyens de déplacement (3) relatifs entre la cartouche (1) et la platine
chauffante (2). Afin de limiter les problèmes d'évaporation et de
condensation dans la cartouche (1), les thermoblocs sont de préférence
suffisamment larges pour chauffer aussi une partie des canaux, comme
cela est représenté par exemple à la figure 11, dans le cadre d'une
cartouche rectangulaire.
Il est important de noter que le nombre de zones de chauffage
distinctes peut être égal à deux, trois, ou davantage. Par exemple, dans le
cas d'une PCR à deux températures, la platine pourra présenter une zone
à 95 C pour la dénaturation des acides nucléiques double brin, et une zone
à 60 C pour l'hybridation des amorces et l'élongation. Dans le cas d'une
PCR à trois températures, la platine présentera une zone à 95 C
(dénaturation), une zone entre 40 et 70 C (hybridation des amorces), et
une zone à 72 C (élongation). Enfin, la platine peut présenter un nombre
de zones supérieur à trois, par exemple pour bloquer provisoirement la
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
27
réaction à un moment donné de chaque cycle. La platine peut aussi
présenter un nombre de zones qui soit un multiple de deux ou trois, de telle
façon qu'un tour de la cartouche corresponde à plusieurs cycles PCR.
Enfin, il est important de noter que la taille relative des différentes zones
de
chauffage est avantageusement choisie proportionnellement à la durée
d'incubation désirée pour le fluide réactionnel à la température de ladite
zone. Ainsi, dans la platine représentée à a figure 2B, le thermobloc 21,
dédié à l'étape de dénaturation, a une surface deux fois moindre que celle
des thermoblocs destinés au étapes d'hybridation et d'élongation (blocs 22
et 23, respectivement). En choisissant une vitesse de rotation relative de la
cartouche sur la platine telle qu'une rotation de 3600 est effectuée en 150
secondes, on obtient donc des cycles dans lesquels la dénaturation dure
30 secondes, l'hybridation 1 minute et l'élongation 1 minute.
Au sujet des moyens de déplacement on notera que, selon un
mode préférentiel de réalisation de l'invention, la platine (2) est fixe et la
cartouche (1) est mue grâce aux moyens de déplacement (3).
Toutefois, dans d'autres modes de réalisation, on pourra également
prévoir une cartouche fixe et une platine de chauffage mise en mouvement
grâce audits moyens de déplacement.
Dans le mode de réalisation particulièrement préféré de l'invention,
selon lequel la cartouche est circulaire, les moyens de déplacement (3)
autorisent la mise en rotation de ladite cartouche et/ou de ladite platine.
On peut prévoir un élément conducteur entre la cartouche et la
platine chauffante. Toutefois, selon une variante préférentielle de
l'invention, ladite cartouche est en contact direct avec ladite platine
chauffante. Dans ce cas, ladite platine est avantageusement pourvue d'un
revétement favorisant le déplacement entre ladite cartouche et ladite
platine. Un tel revêtement peut par exemple être constitué, en Téflon
(marque déposée).
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
28
Comme indiqué ci-dessus, la platine de chauffage du système peut
présenter au moins deux ou trois zones pouvant être portées à des
températures distinctes. Préférentiellement, cette platine est constituée de
deux ou trois blocs thermiques indépendants ("thermoblocs") distincts reliés
à des moyens de programmation de leur température. Dans le cas où la
platine comporte trois thermoblocs (21 à 23), le premier de ces thermoblocs
(21) est chauffé à la température de dénaturation, le deuxième (22) à la
température d'hybridation, le troisième (23) à la température d'élongation.
L'utilisation de tels thermoblocs de température constante simplifie la
réalisation de la platine chauffante.
Les moyens de déplacement relatif de la cartouche par rapport à la
platine pourront être réalisés sous de multiples formes. Selon un mode de
réalisation préféré, illustré à(a figure 10, la cartouche (1) présente sur le
dessous une partie saillante centrale (181) comportant une encoche (182),
de telle sorte que la partie saillante (181) s'encastre dans la platine
chauffante (2) et relie la cartouche (1) avec les moyens de déplacement (3)
au niveau d'un taquet ou axe (32) mis en mouvement par un micromoteur
(31). La partie saillante (181) permet donc d'une part, de positionner la
cartouche par rapport à une platine (2) telle que celle représentée à la
figure 2B, et d'autre part, d'assurer sa liaison avec les moyens de mise en
mouvement (3).
Selon un mode de réalisation alternatif, représenté aux figures 1 et
3, la cartouche présente au moins une oreille (183) et les moyens de
déplacement (3) incluent au moins un axe (32) coopérant avec ladite oreille
pour inculquer à ladite cartouche un mouvement rotatif.
Le mode de déplacement relatif entre la platine et la cartouche
pourra varier selon les modes de réalisation. Il pourra s'agir d'un
déplacement à vitesse continu ou par à-coups. La vitesse de déplacement
pourra être constante ou varier dans le temps.
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
29
Dans le cas d'une cartouche rectangulaire, le déplacement de la
cartouche par rapport à la platine (2) se fait de préférence par translation,
comme cela est décrit à l'exemple 3 et illustré à la figure 11.
Avantageusement, le système selon l'invention comprend
également des moyens optiques d'excitation/mesure de la fluorescence,
prévus par exemple au-dessus ou sur le côté de ladite cartouche. Selon
une variante préférentielle de l'invention, ces moyens constitueront un
système unique et fixe. Un avantage d'une variante préférentielle de
l'invention selon laquelle la cartouche est circulâire et mue selon un
déplacement rotatif est de pouvoir amener successivement chaque
chambre réactionnelle sous ledit système optique, réduisant ainsi sa
complexité. Un système de repérage, situé par exemple sur la cartouche
(1), permet de déterminer à chaque instant quelle chambre réactionnelle
est située en regard du système optique.
Les moyens d'amenée du fluide présent dans ledit réservoir vers
lesdites chambres réactionnelles peuvent être réalisés sous différentes
formes. Comme cela a été décrit plus haut, on peut distinguer deux
catégories de modes d'adressage du fluide vers les chambres
réactionnelles : l'adressage en système ouvert, qui suppose une
augmentation de pression au niveau du réservoir et la présence d'évents
(14) au niveau des chambres réactionnelles, et l'adressage en système
clos, qui débute au contraire par l'établissement d'une dépression dans la
cartouche (1), suivi d'un rétablissement de cette pression.
Les moyens (4) d'amenée du fluide dans les chambre
réactionnelles diffèrent suivant le mode de réalisation choisi. Ainsi, en
système ouvert, le flûide contenu dans le réservoir est distribué -sous
pression dans les chambres réactionnelles de façon à permettre un
remplissage uniforme de ces chambres. Dans ce cas, les moyens
d'amenée (4) incluent préférentiellement un dispositif à piston (41) dont la
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
vitesse de pénétration dans le réservoir sera ca(culée-pour favoriser le bon
remplissage des chambres réactionnelles. Alternativement, ces moyens
d'amenée incluent une pompe branchée de façon à augmenter la pression
dans le réservoir (11).
5 Comme il a été vu plus haut, une autre variante préférée de
l'invention implique de travailier en système clos. Le fluide contenu dans le
réservoir est alors distribué dans les chambres réactionnelles de la façon
suivante : dans un premier temps, une dépression est créée à l'intérieur de
la cartouche, le cas échéant par un dispositif à piston ou une pompe (42),
10 branchée cette fois de manière à diminuer la pression dans la cartouche
(1). La pression est ensuite rétablie, ce qui permet au fluide de s'engager
dans les canaux et de remplir les chambres réactionnelles périphériques.
L'invention concerne également tout procédé d'amplification d'acide
nucléique grâce à un système tel que décrit ci-dessus, caractérisé en ce
15 qu'il comprend les étapes consistant à:
- remplir au moins partiellement le réservoir (11) avec un fluide
contenant un échantillon d'acides nucléiques à analyser ainsi que tout le
nécessaire à une réaction d'amplification, à l'exception des amorces, et
facultativement, un intercalant fluorescent des acides nucléiques ;
20 - répartir ledit fluide dans les chambres réactionnelles (13)
prévues dans la cartouche (1), dans lesquelles sont pré-réparties des
amorces et, facultativement, une ou plusieurs sondes marquées
spécifiques de la séquence nucléique cible ;
- mettre en oauvre les moyens de déplacement relatif entre la
25 cartouche_ et .la_.platine chauffante pour, amener successivement, et
autant
de fois que désiré, le contenu de chaque chambre aux températures
définies par les deux, trois ou davantage zones de ladite platine de
chauffage.
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
31
Dans une variante du procédé ci-dessus, des réactifs nécessaires à
la réaction d'amplification et/ou à la détection des produits de
l'amplification, et distincts des amorces et des sondes, sont pré-répartis
dans les chambres réactionnelles (13) de la cartouche (1). Le fluide
introduit dans le réservoir (11) ne contient alors pas ces réactifs.
L'étape de répartition du fluide dans les chambres réactionnelles
(13) est effectuée soit en appliquant une dépression à l'intérieur de la
cartouche, puis en rétablissant la pression (système clos), soit en
augmentant la pression au niveau du réservoir (11), à condition que les
chambres réactionnelles soient pourvues d'évents (système ouvert).
L'invention, ainsi que les différents avantages qu'elle présente,
seront mieux compris grâce à la description qui va suivre de quelques
modes non limitatifs de réalisation de celle-ci, illustrés dans les figures.
Exemple 1: mode de réalisation simplifié du dispositif de
l'invention.
Le système de détection et de quantification de séquences
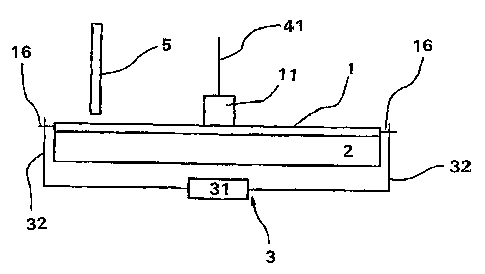
nucléiques cibles représentés à la figure 1 comprend une cartouche
circulaire en matière plastique de 2 mm d'épaisseur présentant un diamètre
de 5 cm. Cette cartouché (1) est pourvue d'un réservoir central (11) et sera
décrite plus en détails en référence ci-après aux figures 3 et 4. La capacité
du réservoir est, dans le cadre du présent mode de réalisation, de 400 pI.
Son plancher est plat mais on notera que dans d'autres modes de
réalisation il pourra être bombé pour faciliter le passage du flLtide vers les
chambres sans formation de bulles d'air, notamment en fin d'adressage
lorsque le réservoir est quasiment vide.
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
32
Le système comprend par ailleurs une platine chauffante (2) en
contact direct avec la face inférieure de la cartouche (1) et des moyens de
déplacement (3) de la cartouche (1) par rapport à la platine chauffante (2).
Ces moyens de déplacement incluent un micromoteur (31) relié à deux
axes (32) qui coopèrent avec deux oreilles (183) de la cartouche (1) pour
inculquer à celle-ci un mouvement rotatif sur la platine chauffante (2), celle-
ci restant quant à elle fixe.
Le système décrit comprend également un piston (41) destiné à
coopérer avec ledit réservoir (11) ainsi qu'un 'dispositif optique (5)
d'excitation/mesure de fluorescence (source émettrice permettant une
excitation à une longueur d'onde donnée et programmable et récepteur de
la fluorescence émise) fixe et placé au dessus de la cartouche (1) et de la
platine chauffante (2).
Comme on peut le voir sur la figure 2A, la platine chauffante (2) est
constituée de trois blocs métalliques (21, 22 et 23) (ci-après dénommés
thermoblocs) en forme de portions de disques. On notera que dans ce
mode de réalisation, ces thermoblocs présentent sensiblement la même
taille mais que, dans d'autres modes de réalisation, ils pourront présenter
une taille différente, la taille étant entendue comme la surface angulaire
occupée en vue de dessus. Chaque thermobloc (21, 22 et 23) est conçu
pour pouvoir être amené à une température constante et programmable,
correspondant à l'une des phases (dénaturation, hybridation ou élongation)
des cycles d'amplification (PCR), soit généralement respectivement 94 C
pour la dénaturation, 72 C pour l'élongation, et entre 30-40 et 65-70 C pour
l'hybridation selon le Tm (température d'hybridation) des amorces utilisées.
Les températures des thermoblocs pourront être contrôlées par tous
moyens connus de l'homme de l'art.
En référence à la figure 3, la cartouche (1) est pourvue d'un
réservoir central (11) de capacité 400 pl relié à 36 chambres réactionnelles
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
33
(13) par autant de canaux (12), réparties uniformément sur toute la
périphérie de la cartouche (sur la figure 3, on n'a pas représenté l'ensemble
des canaux et des chambres mais seulement certains d'entre eux). Ces
chambres réactionnelles (13) sont par ailleurs pourvues d'évents (14)
abouchant sur le bord de la cartouche (1). Dans le présent mode de
réalisation, les canaux présentent un diamètre de 0,2 mm et le volume des
chambres réactionnelles est de 2,5 microlitres. Dans d'autres modes de
réalisation, ce diamètre et ce volume pourront bien sûr être différents.
Comme déjà précisé, cette cartouche (1) est également pourvue de
deux oreilles (183) percées chacune d'un orifice pour laisser passer un axe
(32) relié au micromoteur (31).
Selon la figure 4, les chambres réactionnelles présentent une
profondeur de 1 mm. Leur plancher présente une épaisseur de 0,2 mm
environ. Cette épaisseur est suffisamment faible pour faciliter de bons
échanges thermiques entre les chambres (13) et les thermoblocs (21, 22 et
23). Les chambres réactionnelles (13) sont fermées dans leur partie
supérieure par une paroi (17) transparente, formant également la paroi du
réservoir (11).
L'utilisation du dispositif représenté est la suivante :
Le réservoir central (11) est destiné à recevoir l'échantillon d'acides
nucléiques à analyser ainsi que tout le nécessaire à une réaction
d'amplification, et facultativement un intercalant fluorescent des acides
nucléiques (l'ensemble est ci-après dénommé fluide), à l'exception des
amorces préréparties dans chaque chambre réactionnelle périphérique 10.
Dans le cadre du présent mode de réalisation, l'utilisateur place
dans le réservoir central 90 taI (c'est-à-dire"36 fois 2,5 pl) de fluide, dont
75
ng d'acides nucléiques. Les concentrations en réactifs dudit fluide sont les
suivantes :
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
34
dNTP : 200 pM
Tampon Taq : 1 x
MgCI2 : 1,5 mM
Taq : 4U
SybrGreen (marque déposée) : 1 x
H20 : qsp
Chaque chambre 10, sauf quelques-unes à des fins de témoins
négatifs, contient deux amorces spécifiques d'une séquence cible à
amplifier, et facultativement une ou plusieurs sondes marquées, permettant
une mesure spécifique ultérieure de fluorescence. Dans le présent mode
de réalisation, ont été répartis 10 ng de chaque amorce dans chaque
chambre sauf dans celles servant de témoin négatif.
Après avoir rempli partiellement le réservoir (11) avec le fluide dont
le volume est égal à la somme des volumes des chambres (le volume d'une
chambre est défini comme étant le produit de sa surface de "plancher" par
sa profondeur), le piston (41) est actionné pour distribuer ce fluide dans la
pluralité de chambres réactionnelles (13). Ce piston permet *d'augmenter la
pression au sein du réservoir (11) et permet le passage du fluide dans les
canaux vers les chambres. La vitesse de déplacement du piston dans le
réservoir est d'environ 1 mm par seconde et ledit déplacement est stoppé à
un niveau qui dépend du volume de fluide à adresser dans les chambres.
Le faible diamètre des canaux (12) permet d'empêcher la diffusion
du fluide depuis le réservoir (11) vers les canaux (12) et les chambres (13)
sous l'effet de la gravité (à cette échelle, les processus habituellement
négligeables comme les forces de capillarité deviennent prégnants, et dans
le cas présent suffisent à maintenir le fluide dans le réservoir). Grâce aux
évents (14), l'air présent dans les chambres (13) est évacué, ce qui assure
le remplissage de celles-ci.
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
Les thermoblocs (21, 22, 23) sont portés aux trois températures
correspondant aux trois températures des phases de la PCR (ou à des
températures légèrement supérieures compte tenu des éventuelles
déperditions thermiques entre la platine chauffante (2) et la cartouche 1) et
5 les moyens de déplacement (3) sont mis en oeuvre de façon à animer d'un
mouvement giratoire la cartouche (1) pour faire passer successivement et
autant de fois que désiré chaque chambre réactionnelle au-dessus des
trois thermoblocs.
Plus précisément, le bloc (21) est porté à la température
10 correspondant à la phase de dénaturation (94 C), le thermobloc (22) est
porté à la température correspondant à la phase d'hybridation (36 C) et le
thermobloc (23) est porté à la température correspondant à la phase
d'élongation (72 C).
Dans le présent mode de réalisation, le micromoteur (31) des
15 moyens de déplacement (3) est conçu pour inculquer une rotation de 10
degrés toutes les 2,5 secondes à la cartouche (1) (soit un cycle de PCR en
1,5 mn). Toutefois, dans d'autres modes de réalisation, ce mouvement
pourra présenter une vitesse différente et être continu au lieu d'être
saccadé.
20 On notera que le dispositif optique (5) est prévu au dessus du bloc
correspondant 23 porté à une température correspondant à la température
d'élongation, et plus particulièrement à un emplacement qui correspond à la
fin de la phase d'élongation. Bien entendu, le dispositif optique (5) peut
être
placé à un emplacement différent, choisi notamment en fonction de la
25 chimie utilisée. Par exemple, en utilisant la chimie TaqManTM ou de la
fluorescence non spécifique, il est logique d'effectuer'la mesure à la fin de
la phase d'élongation, comme décrit ci-dessus. En revanche, l'utilisation
d'une chimie du type Molecular BeaconsTM implique que la mesure se
fasse plutôt au moment de l'hybridation.
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
36
Le système présenté permet de remplir rapidement et de façon
reproductible une grande quantité de chambres réactionnelles et d'effectuer
sur le contenu de celles-ci une PCR et des mesures de fluorescence à
chaque cycle de la PCR.
Le mode de réalisation ici décrit n'a pas pour objet de réduire la
portée de l'invention. Il pourra donc y être apporté de nombreuses
modifications sans sortir du cadre de celle-ci.
Exemple 2: Cartouche circulaire améliorée
Les figures 5 à 10 représentent un exemple de cartouche circulaire
présentant certaines modifications par rapport à la cartouche de
l'exemple 1.
Cette cartouche est prévue pour une utilisation en système clos,
c'est-à-dire que les chambres réactionnelles (13) n'ont pas d'autre
ouverture que l'arrivée du canal (12). La cartouche est constituée de deux
éléments qui s'emboîtent l'un dans l'autre : la partie inférieure, ou socle,
est
représentée aux figures 5 et 6, et la partie supérieure, ou couvercle, est
représentée aux figures 7 et 8. L'assemblage des deux est illustré aux
figures 9 et 10.
Le chargement de cette cartouche s'effectue de la façon suivante :
L'utilisateur place dans le réservoir -central l'extrait d'acides
nucléiques à analyser. Il place le consommable dans l'automate. Ce dernier
crée une dépression à l'intérieur de la cartouche (P = 0,05 bar
approximativement), par exemple par l'utilisation d'une pompe (42). La
pression est ensuite rétablie , ce qui permet aux fluides de s'engager dans
les canaux et de remplir les chambres réactionnelles périphériques. Ainsi,
par rapport au dispositif de l'exemple 1, le fluide n'est plus adressé par une
augmentation de la pression mais par dépression, ce qui présente
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
37
l'avantage de ne pas nécessiter d'évent et donc de travailler en système
clos.
Le cas échéant, on peut prévoir plusieurs sous-réservoirs et non
plus un réservoir unique, ce qui présente l'avantage de traiter
simultanément plusieurs échantillons.
Le fond du réservoir a une forme conique permettant au fluide de
se répartir à sa périphérie, c'est-à-dire près de l'entrée des canaux.
A la jonction entre ies canaux et le réservoir, se trouve un système
anti-reflux, constitué par une portion de canal vertical (123), ce qui, d'une
part, prévient les contaminations croisées en cas de retour intempestif de
fluide vers la partie centrale ou au cas où tout le fluide ne se serait pas
engagé dans le canal et, d'autre part, permet une fois l'adressage effectué
mais avant la PCR, de venir boucher les canaux au moyen d'un bouchon
dont les dentelures viennent épouser ces entrées verticales, afin de
travailler en système clos (pas de contamination, pas d'évaporation).
La cartouche est en plastique, préférentiellement en polycarbonate
car ce polymère présente des caractéristiques physiques, optiques et de
comportement thermique intéressantes.
La taille des canaux est par exemple de 0,4 x 0,2 mm (demi-lune)
en section.
La taille du consommable est par exemple de 100 mm (diamètre),
le nombre de chambres est de 80, le nombre de sous-réservoirs est
compris entre 1 et 8.
Comme illustré à la figure 10, la cartouche (1) présente sur le
dessous une partie saillante centrale (181) comportant une encoche (182),
de telle sorte que la partie saillante (181) s'encastre dans la platine
chauffante (2) et relie la cartouche (1) avec les moyens de déplacement (3)
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
38
au niveau d'un taquet ou axe (32) mis en mouvement par un micromoteur
(31). La partie saillante (181) permet donc d'une part, de positionner la
cartouche par rapport à une platine (2) telle que celle représentée à la
figure 2B, et d'autre part, d'assurer sa liaison avec les moyens de mise en
mouvement (3).
Les chambres réactionnelles sont chargées avec des amorces
spécifiques de séquences cibles et, le cas échéant, avec des sondes de
type TaqManTM ou autre spécifiques desdites cibles. Suivant les
applications, les cibles seront des gènes viraux ou bactériens, des jonctions
entre un transgène et le génome d'une plante pour.détecter et/ou identifier
certains OGM, etc.
Une variante de la cartouche décrite ci-dessus, comportant 36
chambres réactionnelles d'un volume de 8 IaI et des canaux d'un diamètre
de 0,3 mm, a été utilisée pour effectuer un test de détection de bactéries
Salmonelles. 288 pI (soit 36 fois 8 pi) de la solution suivante ont été placés
dans le réservoir central
DUTP 400 pM
dNTP : 200 pM
Tampon Taq : 1 x
MgC12 : 3 mM
Taq:15U
TWEEN (marque déposée) : 0,007 %
SybrGreen (marque déposée) : 0,1 x
, ADN génomique de Salmonella enteritidis : 1 ng
H20: qsp
1,6 picomole des amorces FinAl et FinA2 décrites dans Cohen,
Mechanda et al. 1996 ont été déposées dans les chambres réactionnelles.
Cette expérience a donné des résultats positifs, comme attendu.
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
39
Exemple 3: Cartouche rectangulaire
Dans cet exemple, illustré à la figure 11, le réservoir n'est plus
central mais "sur le côté", et le mouvement de la cartouche n'est plus
nécessairement rotatif, mais peut être translationnel.
Le mode d'adressage et de fermeture peut être tout à fait !e. même
que dans le cas du mode circulaire décrit à l'exemple 2.
Alternativement, les fluides sont adressés par augmentation de la
pression. Ils entrent dans la première partie du canal (121) dont la somme
des volumes est prévue pour être légèrement inférieure au volume
d'échantillon à analyser (d'extrait d'acides nucléiques). La deuxième partie
du canal (122) est constituée par un capillaire de verre, de diamètre
beaucoup plus faible, inclus dans le système plastique, comme illustré à la
figure 12. Son intérêt est de créer un phénomène dit de perte de charge,
permettant un remplissage homogène de la première partie des canaux (si
un canal se remplit plus vite qu'un autre lors de l'augmentation de la
pression, ce phénomène permet d'arrêter la progression du fluide dans le
ou les canaux remplis jusqu'à ce que les autres le soient à leur tour). Ceci
permet de "précafibrer" les volumes pour chaque canal et donc d'assurer
un remplissage homogène des différentes chambres (13) plus en aval. A
l'extrémité des chambres se trouvent des évents, débouchant eux-mêmes
dans des enceintes (15) trouées sur le dessus dont l'intérêt est, d'une part,
de récupérer sans pollution les éventuels surplus de fluide qui sortiraient
par lesdits évents et, d'autre part, de pouvoir se fermer par une bande
adhésive afin d'empêcher l'évaporation. Le volume (et la forme) des
chambres est égal à celui de la première partie des canaux.
La taille des canaux est de 0,4 mm de diamètre, soit 1 canal par
mm si l'espace entre deux canaux est de 0,6 mm. Ainsi, une cartouche de
longueur 8 cm comporte 80 chambres.
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
Deux possibilités peuvent être envisagées pour fermer le canal au
niveau du réservoir :
La première possibilité consiste à utiliser, comme à l'exemple 2, un
bouchon dentelé. Le piston qui augmente la pression et ledit bouchon sont
5 alors confondus. Dans ce cas, il faut prévoir une ouverture du piston
(creux) entre l'étape d'adressage des fluides par pression et cette étape de
fermeture, afin que la fermeture n'engendre pas une nouvelle augmentation
de la pression qui amènerait le fluide au-delà des chambres).
La deuxième possibilité consiste à disposer de l'huile (en excès)
10 au-dessus des fluides. Ainsi, une fois les chambres remplies, les canaux
(121) sont remplis au moins partiellement d'huile, empêchant contamination
et évaporation.
CA 02416756 2003-01-20
WO 02/09877 PCT/FR01/02385
41
BIBLIOGRAPHIE
Cohen, H. J., S. M. Mechanda, et al. (1996). "PCR amplification of the fimA
gene sequence of Salmonella typhimurium, a specific method for
detection of Salmonella spp." Appl Environ Microbiol 62(12): 4303-8.
Gibson, U. E., C. A. Heid, et al. (1996). "A novel method for real time
quantitative RT-PCR." Genome Res 6(10): 995-1001.
Heid, C. A., J. Stevens, et aI. (1996). "Reai time quantitative PCR."
Genome Res 6(10): 986-94.
Williams, P. M., T. Giles, et aI. (1998). "Development and application of
real-time quantitative PCR." In F; Ferré (Ed.), Gene Quantification.
Birkhâuser, Boston.