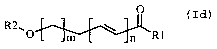Note: Descriptions are shown in the official language in which they were submitted.
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
1
PROCÉDÉ DE PRÉPARATION DES HYDROXY-ACIDES GRAS
INSATURÉS ET DE LEURS ESTERS, LEUR UTILISATION DANS DES
PRÉPARATIONS PHARMACEUTIQUES ET/OU COSMÉTIQUES
La présente invention se rapporte au
domaine des procédés chimiques et à l'utilisation des
produits obtenus par ces procédés chimiques.
La présente invention se rapporte plus
particulièrement à un procédé de préparation des
hydroxy-acides gras insaturés et de leurs esters
répondant à la formule générale suivante (Id) .
Formule (Id)
O
~~O m ~ n _R1
avec n= 1 à 4
m = 2 à 16
Rl= OH, Cl, Br, OR3 où R3 représente un
radical alkyl, alcényl, alcynyl, linéaire ou ramifié de
1 à 16 carbones ou esters du glycérol, éventuellement
substitué par un ou plusieurs atomes de carbone,
d'azote, de soufre ou d'halogènes tels que fluor,
chlore, brome et iode,
RZ= H, SiR' 1R' 2R' 3 où R' 1, R' 2, R' 3 identiques
ou différents les uns des autres, représentent un
radical alkyl, alcényl, alcynyl, linéaire ou ramifié de
1 à 16 carbones ou esters du glycérol, éventuellement
substitué par un ou plusieurs atomes de carbone,
d'azote, de soufre ou d'halogènes tels que fluor,
chlore, brome et iode,
ou Rz= C-Ar3 avec Ar représentant un radical
aryl éventuellement substitué par un ou plusieurs
atomes de carbone, d'azote, de soufre ou d'halogènes
tels que fluor, chlore, brome et iode,
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
2
ou Rz= le tétrahydropyranyl de formule .
oJ
et à l'utilisation desdits produits comme
agent anti-collagénase, agent lipolytique ou agent
anti-acnéique dans une préparation médicamenteuse et/ou
cosmétique.
Les produits répondant à la formule
générale (Id) sont connus et décrits dans la
littérature pour leurs propriétés biologiques et plus
particulièrement pour leurs propriétés cosmétiques et
pharmacologiques. D'ailleurs, le principal constituant
lipidique de la gelée royale des abeilles qui est
l'acide hydroxy-10-décène-2(trans)oïque (ou DHA) répond
à la formule générale (Id) dans laquelle R1= OH, R~= H,
n= 1 et m= 3.
Différents documents de l'état de la
technique rapportent des procédés de préparation des
hydroxy-acides gras insaturés et de leurs esters (Lee
et al., 1993, J. Org. Chem., vol. 58, pages 2918-2919 ;
Hurd et Saunders, 1952, J. Am. Chem. Soc., vol. 74,
pages 5324-5328 ; I~rishnamurthy et al., 1989, Indian J.
Chem. Sect. A, vol. 28, pages 288-291 ; Plettner et
al., 1995, J. Chem. Ecol., vol. 21, pages 1017-1030).
Les procédés déjà connus dans l'état de la technique
présentent une étape d'oxydation durant laquelle des
sels métalliques comme les sels de chrome ou de
manganèse sont employés. Or, l'utilisation de sels
métalliques présente un certain nombre d'inconvénients.
D'une part, au niveau des produits obtenus par lesdits
procédés, ces derniers peuvent être contaminés par les
sels métalliques et donc leur application cosmétique
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
3
et/ou pharmacologique est limitée du fait de cette
contamination. D'autre part, l'utilisation de sels
métalliques entraîne une contamination de
l'environnement des industries dans lesquelles la
synthèse est effectuée.
Le procédé de préparation vise donc à
résoudre les problèmes cités ci-dessus en proposant une
nouvelle voie de synthèse originale permettant une
transposition industrielle.
De plus, le procédé de l'invention est
remarquable en ce qu'il permet d'obtenir une méthode de
synthèse plus rapide avec de meilleurs rendements que
les procédés déjà connus de l'art antérieur. En effet,
le procédé de l'invention permet d'éviter, dans les
premières étapes dudit procédé, les chromatographies
qui ne sont pas des techniques industrielles de
purification.
25
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
4
Le schéma général de synthèse est le
suivant .
HBr
HO~~OH ~ HO~Br HO~~CHO
II III IV
R ô'0 O
~ R1
I
R4 C=n-1
O
O
HO m \ . n R1
HO m n OH
Ib la
O O
R2~0 m \ n OH R2~0 m ~ n R1
Ic Id
O
HO m \ n _R1
le
où R1, R~, m et n ont la même signification
que dans la formule (Id) .
La première étape de cette synthèse est une
bromation, le composé de départ de la réactïon est un
diol de formule (II). De nombreuses techniques
permettant une bromation sont connues dans l'état de la
technique et sont utilisables par l'homme du métier à
cette étape. Cette bromation nécessite l'utilisation
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
d'un solvant qui peut notamment être le toluène, le
benzène, le diméthylformamide, le tétrahydrofuran, le
cyclohexane, l'heptane, l'éther de pétrole, etc... Le
réactif utilisé dans cette étape de bromation peut être
5 le HBr aqueux ou non, le Ph3P, Bra, le tétrabromide de
carbone triphénylphosphine, l'acide hydrobromique. A
titre d'exemple, on peut citer les conditions
expérimentales de bromation utilisant du HBr aqueux
décrites dans Geresh et al., Tetrahedron Asymmery,
1998, vol. 9, pages 89-96.
La seconde étape est une oxydation en
aldéhyde de formule (IV) en présence d'un N-oxyde
d'amine tertiaire cyclique ou non cyclique, anhydre ou
non anhydre en présence de DMSO. En fin de réaction, le
bromydrate de l'amine tertiaire correspondante est
éliminé par simple filtration. De façon avantageuse,
les N-oxydes d'amine tertiaire cycliques ou non
cycliques, anhydres ou non anhydres présents à la
seconde étape sont choisis parmi le N méthyl morpholine
oxyde, le triméthylamine oxyde ou le triéthylamine
oxyde ou mélange de ceux-ci. L'art antérieur connaît
d'autres techniques permettant de synthétiser les
aldéhydes de formule générale IV. Cependant, l'étape 2
du procédé de l'invention permet de résoudre les
inconvénients des techniques déjà connues dans l'état
de la technique. A titre d'exemple, on peut citer la
réaction d'oxydation en présence de sels de manganèse
des alcènes cycliques correspondant (Lee et al., 1993,
J. Org. Chem., vol. 10, pages 2918-2919). L'étape 2 du
procédé objet de l'invention permet donc d'éviter une
étape en présence de sels métalliques. L'article de
Guindon et al., de 1984 (J. Org. Chem., vol. 49, pages
3912-3920) décrit la synthèse de 8-hydroxy-octanal à
partir de 1,1-diméthoxy-8-méthoxyméthoxy-octane.
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
6
Cependant le rendement de synthèse de 8-hydroxy-octanal
est relativement faible (36%) alors que l'étape 2 de
l'invention permet d'obtenir des rendements plus
élevés. Les autres techniques connues dans l'art
antérieur permettant de synthétiser les aldéhydes de
formule générale IV sont des méthodes de synthèse
longues présentant plus de 4 étapes.
L'étape 3 du procédé de l'invention est une
réaction de Witting-Horner. Cette réaction est une
réaction connue de l'homme du métier (Modem Synthetic
Reaction, Second edition, Herbet O. House, Wittig
Horner reaction pages 682 à 709) et toute condition
expérimentale décrite dans l'état de la technique peut
être utilisée dans le cadre de la présente invention. A
titre d'exemple, la réaction de Witting-Horner peut
être réalisée en présence de triéthylphosphonoacétate
et de carbonate de potassium.
L'étape 4 du procédé de l'invention est une
étape de saponification. Aucune condition expérimentale
particulière n'est mise en oeuvre dans le procédé de
l'invention. L'homme du métier sera à même de trouver
les conditions expérimentales adéquates à utiliser pour
cette étape.
L'étape 5 du procédé est une étape de
protection spécifique de la fonction alcool du composé
de formule générale Ib obtenu à l'étape 4. Cette
réaction s'effectue dans tout éther d'énol en présence
d'un catalyseur acide. De façon avantageuse, la
réaction s'effectue dans le dihydropyrane en présence
d'APTS (Acide para toluène sulfonique) . Le produit de
formule générale Ic obtenu après l'étape 5 est purifié
par simple lavage aqueux et séchage sur sulfate.
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
7
L'étape 2 et l'étape 5 du procédé de l'invention sont
non décrites dans l'état de la technique. Elles
permettent de résoudre les problèmes techniques décrits
ci-dessus tout en augmentant le rendement et la
rapidité du procédé de synthèse des composês de formule
générale I.
Le produit de formule (Id) obtenu à l'étape
5 du procédé de l'invention peut subir une déprotection
finale afin d'obtenir le composé de formule générale
(Ie). Cette déprotection est réalisée dans une solution
de méthanol contenant un catalyseur acide. Tout
catalyseur acide peut étre utilisé dans l'invention. De
façon avantageuse, le catalyseur acide utilisé est
l' ATPS .
Le produit de formule (Id) obtenu à l'étape
5 du procédé de l'invention peut être utilisé dans une
réaction d'estérification du glycérol. Suivant les
quantités relatives de glycérol utilisées, peuvent être
obtenus des monoesters (2 isomères possibles . en
position 1 et 2), des diesters (2 isomères possibles .
diesters 1,1 et 1,2) et des triesters. Après l'étape
d'estérification. du glycérol, le composé obtenu peut
subir une déprotection finale dans des conditions
expérimentales identiques aux conditions de
déprotection du produit de formule (Id) citées Ci-
dessus.
Les produits obtenus par 1e procédé objet
de l'invention en instance sont, comme indiqué
précédemment, utilisés dans le domaine Cosmétologique
et/ou pharmaceutique. Cependant, les travaux de la
Demanderesse ont permis de mettre en évidence que les
produits obtenus par le procédé de l'invention suivi
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
8
d'une étape de déprotection finale présentent une
activité anti-collagénase.
Le collagène est la protéine la plus
abondante et la plus importante du corps humain et de
la peau. Cette scléroprotéine représente notamment 75%
des protéines du derme auquel elle assure solidité. Le
fibroblaste fabrique à partir des acides aminés
(hydroxyproline, Iysine, proline) des molécules de
procollagène qui se transforment en présence de
vitamine C en molécules de collagène. Pour former un
réseau de fibrilles, le collagène doit créer des
liaisons entre ces différentes molécules.
Le renouvellement du collagène change avec
l'âge. Le collagène soluble qui donne souplesse et
résistance à la peau et aux muqueuses se dégrade de
plus en plus rapidement sous l' influence d' une enzyme
protéolytique qu'est la collagénase, ce qui entraîne,
au niveau du derme, un vieillissement de la structure
fibreuse des protéines. En outre, le collagène
insoluble qui entraîne une perte d'élasticité se
rigidifie en se polymérisant avec des molécules de
glucose grâce à des liaisons multiples difficilement
réversibles (phénomène de glycation). Ces liaisons
rendent le collagène plus résistant à l'attaque par les
collagénases ce qui entraîne une rigidité croissante
des fibres de collagène. Ce phénomène de durcissement,
caractéristique des tissus cutanés âgés, doit être
combattu le plus tôt possible car il augmente la
destruction des fibroblastes par les radicaux libres
mais aussi la dénaturation des protéines du derme.
Les collagénases sont des enzymes
faiblement exprimées dans les conditions physiologiques
normales. Leur surexpression lors au vieillissement et
en particulier lors de la ménopause chez la femme
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
9
entraîne une dénaturation plus importante des protéines
fibreuses du derme.
Cependant, la destruction des fibres de
collagène peut survenir lors d'autres circonstances que
le vieillissement. En effet, lors d'une infection
bactérienne, les collagénases bactériennes peuvent
détruire les fibres de collagène de l'hôte infecté.
De plus, l'invasion tumorale nécessite une
dégradation de la membrane basale et de la matrice
extra-cellulaire et de toutes les protéines de
structure de ces composants parmi lesquelles se trouve
le collagène. Ainsi, il a été montré une très nette
relation entre le pouvoir invasif des tumeurs et la
présence d'activité collagénase dans les tumeurs
humaines. On retrouve les collagénases au niveau des
cellules tumorales, mais aussi dans les fibroblastes
entourant la tumeur. Les cellules épithéliales normales
sécrètent un taux très faible de collagénases, alors
que ces protéines sont surexprimées par les cellules
tumorales invasives ou métastatiques.
D'autres maladies dégénératives présentent
une dégénérescence fibrinoïde du collagène et sont
également appelées « maladies du collagène ».
L'invention concerne donc l'utilisation des
produits susceptibles d'être obtenus par le procédé de
l'invention comme agent actif anti-collagénase. Les
travaux de la Demanderesse ont plus particulièrement
permis de mettre en évidence l'activité anti-
collagénase de l'acide hydroxy-10-décène-2(trans)oîque
(DHA) et du glycérol ester de l'acide hydroxy-10-
décène-2(trans)oîque (monoester du glycérol en position
1). L'invention concerne également l'utilisation de
l'acide hydroxy-10-décène-2(trans)oïque (DHA) ou du
glycérol ester de l'acide hydroxy-10-décène-
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
2(trans)oïque comme agent actif anti-collagénase dans
une préparation pharmaceutique et/ou cosmétique.
L'invention concerne l'utilisation de
5 l'acide hydroxy-10-décène-2(trans)oïque (DHA) et/ou du
glycérol ester de l'acide hydroxy-10-décène-
2(trans)oïque pour la préparation d'un médicament
destiné à prévenir ou à guérir la dégradation du
collagène. Ce médicament est tout particulièrement
10 destiné à prévenir ou à guérir la dégradation du
collagène par les collagénases bactériennes lors d'une
infection bactérienne.
L'invention concerne également
l'utilisation de l'acide hydroxy-10-décène-
2 (trans) oïque (DHA) et/ou du glycérol ester de l' acide
hydroxy-10-décène-2(trans)oïque pour la préparation
d'un médicament destiné à la régénérescence de la peau
et des ligaments.
L'invention Concerne aussi l'utilisation de
l'acide hydroxy-10-décène-2(trans)oïque (DHA) et/ou du
glycérol ester de l'acide hydroxy-10-décêne
2(trans)oïque pour la préparation d'un médicament
destiné à prévenir ou à guérir l'invasion tumorale.
L'invention concerne aussi l'utilisation de
l'acide hydroxy-10-décène-2(trans)oïque (DHA) et/ou du
glycérol ester de l'acide hydroxy-10-décêne-
2(trans)oïque pour la préparation d'un médicament
destiné à prévenir ou à guérir des maladies
dégénératives présentant une dégénérescence fibrinoïde
du collagène et également appelées « maladies du
collagène ».
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
11
Les produits obtenus par le procédé obj et
de l'invention en instance sont, comme indiqué
précédemment, utilisés dans le domaine cosmétologique
et/ou pharmaceutique. Les travaux de la Demanderesse
ont permis de mettre en évidence que les produits
obtenus par le procédé de l'invention suivi d'une étape
de déprotection finale et, plus particulièrement,
l'acide hydroxy-10-décène-2(trans)oïque (DHA)
présentent une activité lipolytique. Par conséquent,
les produits obtenus par le procédé de l'invention
suivi d'une étape de déprotection finale et, plus
particulièrement, le DHA peuvent, notamment, être
utilisés dans les traitements amincissants et dans
tout traitement connu pour nécessiter une activité
lipolytique.
Les produits obtenus par le procédé obj et
de l'invention en instance sont, comme indiqué
précédemment, utilisés dans le domaine cosmétologique
et/ou pharmaceutique. Les travaux de la Demanderesse
ont permis de mettre en évidence que les produits
obtenus par le procédé de l'invention suivi d'une étape
de déprotection finale et, plus particulièrement,
l'acide hydroxy-10-décène-2(trans)oique (DHA)
présentent une activité anti-acnéique.
Le traitement de l'acné nécessite le
traitement de deux problèmes majeurs que sont, d'une
part, l'hyperséborrhée et, d'autre part, la
prolifération bactérienne responsable de l'inflammation
cutanée. Les travaux de la Demanderesse ont permis de
mettre en évidence que les produits obtenus par le
procédé de l'invention suivi d'une étape de
déprotection finale et, plus particulièrement, le DHA
présentent à la fois une activité sébo-régulatrice et
une activité anti-bactérienne.
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
12
En effet, le DHA est capable d' inhiber la
5-alpha réductase cutanée, enzyme responsable de la
production de la di-hydro-testostérone. Un traitement
avec 0,1~ de DHA et un traitement avec 0,5% de DHA
réduisent respectivement d'environ 70% et d'environ 90%
l'activité de la 5-alpha-réductase par rapport à un
contrôle non traité. Cette inhibition entraîne une
réduction considérable du taux de sébum.
De plus, 0,5% de DHA présentent, après 14
ou 28 jours de traitement, un effet bactéricide
d'environ 95 à 100% testé sur Propionibacterium acnes,
Staphylococcus aureus et Malassezia furfur.
D'autres avantages et caractéristiques de
l'invention apparaîtront des exemples qui suivent
concernant, d'une part, des procédés de synthèse de
l'invention, et d'autre part, des propriétés anti
collagénase et lipolytique des produits susceptibles
d'être obtenus par les procédés de synthèse de
l'invention.
Exemple 1 Mode opératoire pour la
synthèse de Ia (n=1, m=6, R1=OEt) et Ie (triester de
glycérol).
1. Etape 1 de Bromation.
H HBr / toluène
HO HO
_Hx0
M=146.23 M=209.13
4388 (3mo1) de 1,8-octanediol sont mis en
solution dans 31 de toluène. 375m1 (3.3mo1) d'HBr
aqueux 48~ sont ensuite ajoutés. Le milieu est ensuite
chauffé pour éliminer l'eau présente et l'eau formée
lors de la réaction par distillation azéotropique.
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
13
Après 13.5h de contact, le milieu est refroidi et
repris par une solution saturée de NaHC03. La phase
organique est séparée et lavée par une solution saturée
de NaCl. Après séchage sur MgS04, le milieu est
concentré pour donner un brut de 672g.
Le 8-broïnooctanol est purifié par
distillation sous pression réduite, à 96°C sous
P<lmbar, m=5758 (92%).
Caractérisation .
- CCM . Rf = 0,8 (heptane/éther iso 8/2)
- RMN 1H (200Mhz, CDC13) . 3.65 (t, 2H,
J--6.4Hz) ; 3.43 (t, 2H, J=6.8Hz) ; 1.87 (m, 2H) ; 1.36
1.69 (m, 10H) .
2. Étape d'oxydation en aldéhyde.
3éq C\
Br ô_
HO DMSO HO
2o M =209.13 M =144.22
708 g (5.87, 3éq) de N-Oxyde de N-
Methylmorpholine anhydre sont mis en solution, sous N2,
dans 31 de DMSO. 410g (1,96 mol) de 8-bromooctanol
dissous dans 11 de DMSO sont ensuite additionnés en
30min. Le milieu devient limpide., Le bromure d'ammonium
de la N-Methylmorpholine précipite. Après 65h
d'agitation à température ambiante, ce sel est filtré
et le milieu est repris par 4 1 d'une solution saturée
de NaCl. Après extraction par 4 x 11 d'acétate d'éthyle
et séchage, 320 g de brut, constitués à 74~ d'aldéhyde
(R=83%) et 26% de 1.8-octanediol.
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
14
Caractérisation .
- CCM . Rf - 0,6 (heptane/acétate d'éthyle
8/2)
- RMN ''H (400Mhz, CDC13) . 9.74 (t, 1H,
J=l.7Hz) ; 3.61 (t, 2H, J=6.6Hz) ; 2.41 (dt, 2H, J--1.7
et 7.3Hz) ; 1.51-1.65 (m, 4H) ; 1.24 -1.37 (m, 6H).
3. Etape 3 Réaction de Witting-Horner.
1) /,~,~OJ
O O O HO \ OOEt
HO K2COa H20
M=144.22 2)sapo M=214.31
Le brut précédent (3208) est placé en
solution dans 31 d'eau. 800m1 (4.2mo1, 2.léq) de
triethylphosphonoacétate sont ensuite ajoutés suivis de
8308 (6mol) de carbonate de potassium. Après 20h
d'agitation, la réaction est terminée. Le milieu est
extrait par 4 x 11 d'éther isopropylique. Après séchage
sur MgS04, les phases organiques sont évaporées pour
conduire à 6508 de brut.
Le produit est purifié soit par
distillation E=120°C sous P<lmbar.
Dans ce cas, on récupère 2808 d'un liquide
incolore conforme par RMN (R=80% à partir de l'aldéhyde
ou 66% à partir du dérivé bromé) soit par
chromatographie avec une élution heptane/acétate
d'éthyle 8/2 dans ce cas 119.68 de produits sont
obtenus (28% à partir du dérivé bromé).
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
Caractérisation .
- CCM . Rf - 0,8 (heptane/acétate d'éthyle
8/2)
- RMN 1H (400Mhz, CDC13) . 6.91-6.99 (m,
5 1H) ; 5.78-5.82 (dt, 1H, J=1.4 et 15.6Hz) ; 4.17 (q,
2H, J=7.lHz ) ; 3.63 (t, 2H, J=6.6Hz) ; 2.18 (dq, 2H,
J-1.2 et 7.3Hz) ; 1.22 -1.65 (m, 11H).
10 4. Etape 4 Réaction de saponification.
g0 \ COOEt K~ HO \ COOH
EtOH / Hi0
M =214.31 M =186.25
119.68 (0.56mo1) d'hydroxyester est dissous
dans 600m1 d'éthanol et 400m1 d'une solution 4.6N de
15 KOH sont additionnés. Le milieu est agité 8h. Le
milieu est extrait par de l'éther isopropylique. La
phase aqueuse est acidifiée à pH=1 et extraite à
l'acétate d'éthyle. Après séchage et évaporation ,
99.68 de solide rose sont obtenus. Recristallisé dans
un mélange éther isopropylique / éther de pétrole, le
produit est obtenu sous forme d'un solide blanc (868,
83 ~) .
Caractérisation .
2,5 CCM . Rf - 0 , 2 (heptane/acétate d' éthyle
7/3)
Point de fusion . F=61.3°C
RMN ''H (400Mhz, CDC13) . 7.06 (dt, 1H,
J=15.6 et 7Hz) ; 5.81 (dt, 1H, J=1.5 et 15.6Hz) ; 3.64
(t, 2H, J=6.6Hz) ; 2.22 (dq, 2H, J=1.2 et 7.3Hz) ;
1.52-1.58 (m, 2H) ; 1.45 -1.48 (m, 2H) ; 1.33 -1.3765
(m, 6H) .
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
16
5. Etape 5 Réaction de protection.
Ho ~ cooH ~ o o ~ cooH
EtoH / HIo
M =214.31 M =186.25
86g (0.46mo1) d'hydroxyacide sont placés en
solution avec 45m1 (0.48mo1) de 3,4-dihydro-2H-pyranne
dans 500m1 de THF. 1m1 d'HCl concentré est ajouté et le
milieu est agité 24h.
Le THF est ensuite concentré, le brut est
repris dans de l'acétate d'éthyle et lavé avec une
solution de NaCl saturée jusqu'à pH neutre. Après
séchage sur MgS04, 132g de produit brut sont obtenus
(>100%) .
Caractérisati~n .
CCM . Rf - 0,4 (heptane/acétate d'éthyle
7/3)
RMN 1H (400Mhz, CDC13) . 7.06 (dt, 1H,
J=15.6 et 7Hz) ; 5.81 (dd, 1H, J=1.6 et 15.6Hz) ; 4.58
(t, 1H, J=2.8Hz) ; 3.82-3.91 (m, 1H) ; 3.71-3.73 (m,
1H) ; 3.51 -3.52 (m, 1H) ; 3.36 -3.39 (m, 1H) ; 2.20
(m, 2H) ; 1.33 -1.89 (m, 16H).
glycérol.
6. Etape 6 réaction d'estérification du
u o~~~ao" °
Ho OH ~ M =186.25 ° ~ oII
o~~
DCC, DMAP ~ o
M=92.10 ~o
M=849.17
8.4g (0.091mo1) de glycérol sont placés en
solution dans 500m1 de dichlorométhane. Le brut
précédent (0.46mo1), après élimination des traces d'eau
par distillation azéotropique, est dissous dans 500m1
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
17
de dichlorométhane et ajouté au milieu. 56.8g (0.46mo1)
de diméthylaminopyridine sont ensuite ajouté suivis de
97g (0.46mo1) de dicyclohexylcarbodiimide. Le milieu
est agité 78h. Un précipité apparaît qui est filtré.
Le milieu est concentré et repris dans de
l'éther isopropylique. Après filtration et
concentration, 1568 de brut sont obtenus et purifiés
par chromatographie et avec une élution heptane/acétate
d 'éthyle 7/3.
99g d'une fraction contenant 2/3 de produit
et 1/3 d'acylurée sont obtenus.
Caractérisation .
CCM . Rf - 0.7 (heptane/acétate d'éthyle
7/3)
RML~ ~H (400Mhz, CDC13) . 6.96 (m, 3H) ; 5.80
(dd, 3H, J=1.6 et 15.6Hz) ; 5.29-5.31 (m, 1H) ; 4.54-
4.57 (m, 3H) ; 4.20-4.39 (m, 4H) ; 3.81-3.89 (m, 3H) ;
3.68 -3.72 (m, 3H) ; 3.41-3.49 (m, 3H) ; 3.34-3.39 (m,
3H) ; 2.25-2.18 (m, 6H) ; 1.33 -1.99 (m, 48H).
7. Etape 7 Déprotection finale.
0 0
oH
O / 0 AP'CS 0 / O
L ~ OH
O / MeOH i 0 /
\ ~O d \ OH
'O
M=&19.17 ~ M=596.81
99g (0.136mo1) du mélange précédent est
solubilïsé dans 11 de méthanol avec 9.9g d'APTS. Le
milieu est agité 14h. La réaction est terminée, le
milieu est alors concentré. L'huile obtenue est alors
reprise dans H20 et amenée à pH=6 avec une solution
saturée de NaHC03. La phase aqueuse est extraite avec
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
18
du dichlorométhane. Après séchage de la phase organique
et évaporation, 77g d'une huile jaune sont obtenus.
Le produit est purifié par chromatographie
sur silice CH2C1~/acétone 9/1 à 1/1 et CHZC12/méthanol
95/5.
27 g de produit sont obtenus sous forme
d'une huile qui cristallise sous forme d'un solide
blanc jaune amorphe de pureté entre 85-90%.
Caractérisation .
CCM . Rf = 0.2 (CHZC12/acétone 9/1)
RMN 1H (400Mhz, CDC13) . 6.94-7.01 (m, 3H) ;
5.78-5.84 (m,3H) ; 5.29-5.31 (m, 1H) ; 4.20-4.34 (m,
4H) ; 3.60 -3.65 (m, 6H) ; 2.16 -2.22 (m, 6H) ; 1.33
1.99 (m, 30H) .
Exemple 2 Mode opératoire pour la
synthèse de:
°
° ~ OH
M=300.52
1. Etape 1 Protection du 8-bromooctanol.
Br ~Si~ Br
HO O
M =209.13 M =323.39
21 g (0,1 mol) de 8-bromooctanol sont
dissous dans 200m1 de dichlorométhane. 16 g (0,104 mol)
de chlorure de terbutyldimethylsilyle sont ensuite
ajouté à 0°C, suivis de 7,5 g (0,11 mol) d'imidazole.
Un précipité se forme instantanément. Après 3h
d'agitation, le milieu est filtré, concentré et le brut
est distillé.
25, 8 g de produit sont ainsi isolés à 99-
104°C sous P <1 mbar (82%).
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
19
Caractérisation .
RMN 1H (400Mhz, CDC13) . 3.59 (t, 2H, J-
6.6Hz) ; 3.39 (t, 2H, J= 6.9Hz) ; 1.82-1.89 (m, 2H) ;
1.30-1.50 (m, 10H) ; 0.88 (t, 9H, J= 2.7Hz) ; 0.04 (s,
6H) .
2. Etape 2 Oxydation en aldéhyde.
0~
3éq CN.J
Br ô-
TBDMSO DMSO TBDMSO
1 O M =323.39 M = 258.48
20 g (61 mmol) de dérivé silylé sont mis en
solution dans 200m1 de DMSO. 21,7 g (0,18 mol) de N-
oxyde de N-methylmorpholine sont ensuite ajoutés. Le
milieu est agité 72h. Un précipité apparait. Le milieu
est dilué avec NaCl saturé puis extrait avec de l'éther
isopropylique. Après séchage et évaporation, 15,3 g de
brut sont obtenus.
Le produit est purifié par distillation à
81°C sous P<lmbar ( 9g, 57%).
Caractérisation .
RMN ''H (400Mhz, CDC13) . 9.76 (t, 1H, J-
l.9Hz) ; 3.59 (t, 2H, J= 6.6Hz) ; 2.42 (dt, 2H, J= 1.8
et 7.2Hz) ; 1.49-1.68 (m, 4H) ; 1.30-1.32 (m, 6H) ;
0.88 (t, 9H, J-- 2.7Hz) ; 0.04 (t, 6H, J-- 2.9Hz).
3. Etape 3 Réaction de Witting.
o ~ °.'
TBDMSO ~ ~~~ - TBDMSO ~ COOEt
NaH
M=258.48
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
835 mg (21 mmol) de NaH sont mis en
solution avec 5 ml de THF et refroidis à T<°C. 4, 2 ml
(22 mmol) de triéthylphosphonoacétate sont ajoutés
goutte à goutte. Après 3h d'agitation à température
5 ambiante, 5 g (19 mmol) d'aldéhyde sont ajoutés à froid
et l'agitation est maintenue 17 h. Après hydrolyse avec
H20, extraction à l'acétate d'éthyle, séchage et
évaporation, 6,7 g de brut sont obtenus.
3,7 g de produits sont obtenus par
10 purification sur gel de silice (élution heptane/acétate
d'éthyle 8/2) (60%).
Caractérisation .
CCM . Rf= 0.6 (heptane /acétate d'éthyle
15 s/2)
RMN 1H (400Mhz, CDC13) . 6.95 (dt, 1H, J=
8.6 et 15.6Hz) ; 5.79 (dt, 1H, J-- 1.4 et 15.6Hz) ; 4.17
(q, 2H, J= 7.lHz ) ; 3.58 ( dt, 2H, J= 6.6 et 9.8Hz) ;
2.15-2.21 (m, 2H) ; 1.46 -1.51 (m, 4H) ; 1.24 -1.42 (m,
20 9H) ; 0.88 (t, 9H, J-- 2.7Hz) ; 0.04 (t, 6H, J= 2.9Hz).
4. Etape 4 Saponification.
TBDMSO \ COOEt KOH TBDMSO \ COOH
EtOH / HZO
2 g (6 mmol) d'ester sont dissous dans 10
ml d'éthanol et 5 ml d'une solution de NaOH 3,8 N sont
ajoutés. La réaction est terminée en 4h. Le milieu est
acidifié à pH=1 et extrait à l'acétate d'éthyle. Le
produit est ainsi obtenu sans autre purification (1,5
g, 83%) .
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
21
Caractérisation .
CCM : 0.2 (heptane/acétate d'éthyle 7/3)
RMN 1H (400Mhz, CDC13) . 7.07 (dt, 1H, J=
8.6 et 15.6Hz) ; 5.81 (dt, 1H, J-- 1.4 et 15.6Hz) ; 3.59
( dt, 2H, J= 6.6 et 9.8Hz) ; 2.21 -2.27 (m, 2H) ; 1.46
-1.51 (m, 4H) ; 1.24 -1.42 (m, 6H) ; 0.89 (t, 9H, J=
2.7Hz) ; 0.04 (t, 6H, J-- 2.9Hz) .
Exemple 3 Evaluation de l'activité anti
collagénase de produits obtenus par le procédé de
l'invention sur coupes congelées de peau humaine.
1. Mode opératoire.
Cette étude est réalisée sur différentes
solutions à la concentration de 1 % et 2 ~ de principes
actifs en comparaison avec l'excipient seul, les
témoins tampon et collagénase. Les principes actifs
utilisés sont le DHA, le 2-diméthylamino éthyl ester de
l'acide hydroxy-10-décène-2(trans)oïque (ML40) et le
glycérol ester de l'acide hydroxy-10-décène-
2 (trans) oïque (GM) . Le tableau 1 résume les différentes
solutions testées.
Tableau 1
Solution 1 2 3 4 5 6 7 8 9 10 11 12 13
DHA 2% 1~ 2% 1~
ML40 2% 1~ 2% 1~
GM 2% 1% 2% 1~
Collagnase 30 30 30 30 30 30 30
(U/ml)
Des coupes congelées de 5 ~.zm, provenant
d'une plastie mammaire d'une femme de 54 ans, sont
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
22
placées sur des lames histologiques (4 coupes par
lame). Chaque solution est testée sur une lame.
Les coupes sont recouvertes des solutions à
tester puis mises à incuber pendant 2 heures à 37°C en
chambre humide. Les solutions sont éliminées par
rinçages répétitifs et les coupes sont colorées au
picrosirius. L'examen microscopique est réalisé à
l'objectif de 2,5 et les photographies papier sont
prises avec un film Kodak Gold 100 ASA.
2. Résultats.
Le tableau 2 résume les résultats de
l'altération de la structure collagénique en fonction
de la solution testée. Une absence d'altération de la
structure collagénique est indiquée par 0 alors qu'une
structure collagénique moyennement ou nettement à très
fortement altérée est indiquée respectivement par 1 ou
2.
Tal~lPau 2
Solution 1 2 3 4 5 6 7 8 9 10 11 12 13
DHA 2% 1% 2~ 1%
ML40 2~ 1% 2% 1%
GM 2~ 1% 2% 1~
Collagnase 30 30 30 30 30 30 30
(U/ml)
Altration de 0 0 0 0 0 0 0 1 1 0 2 2 2
la structure
collagnique
De plus, l'application du témoin tampon
Tris ou de l'excipient n'induit aucune altération de la
structure collagénique.
Par conséquent, le produit DHA à 1 et à 2
inhibe totalement l'activité de la collagénase, alors
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
23
que les produits ML40 et GM à 2% inhibe légèrement
l'activité de la Collagénase.
Exemple 4 Evaluation de l'activité anti
Collagénase du GM obtenu par le procédé de l'invention
sur expiants de peau humaine maintenue en survie.
1. Mode opératoire.
L'étude est faite sur un produit à 5% de GM
en comparaison avec de l'excipient (hydrocérine), un
contrôle positif et un témoin en présence de la
collagénase à 100 U/ml.
L'hydrocérine est utilisé comme excipient
pour la préparation du produit à appliquer. Cette étude
a été réalisée deux fois. Dans la première étude, il a
été constaté que l'action de la Collagénase à J2 reste
très limitée et non significative. Dans la deuxième
étude, le temps d'application est prolongé et le
prélèvement des expiants est effectué à J2 et à J4.
25 Tableau 3
J2 J4
Tmoin 3 expiants 3 expiants
Excipient 3 expiants 3 expiants
Produit 5% GM 3 expiants 3 expiants
Contrle positif 3 expiants 3 expiants
Tmoin collagnase 3 expiants 3 expiants
+
Excipient+ collagnase 3 expiants 3 expiants
Produit 5% GM + collagnase 3 expiants 3 expiants
Contrle positif + collagnase 3 expiants 3 expiants
a. Préparation des expiants.
Des expiants de peau humaine préparés et
répartis en 16 lots de trois expiants chacun sont mis
en survie selon le tableau 3.
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
24
b. Application du produit à 5% de GM.
Le produit est appliqué à JO et à J2 à
raison de 20 mg par explant et la collagénase est
incorporée dans les milieux de culture des 24 derniers
lots.
c. Histologie.
Trois explants de chaque lot sont prélevés
à J2 et à J4 fixés au Bouin ordinaire et traités en
histologie.
L'étude histologique comprend .
imprégnation en paraffine,
coupes,
coloration au rouge Sirius F3B
mesures colorimétriques du collagène par
analyse d'images
rapport avec photos.
2. Résultats.
Les prélèvements réalisés à J2 ne montrent
aucune activité significative de la collagénase quelque
soit le lot examiné. Pour cette raison, la survie, le
contact et l'application sont prolongés jusqu'à J4.
L'action de la collagénase est notée de 2 manières .
intensité de la coloration du réseau de collagène et
épaisseur de la structure dermique. Avec cette étude,
sont corrélées la pénétration du principe actif et son
activité inhibitrice vis-à-vis de la collagénase. Les
résultats obtenus sont les suivants .
- pour les témoins sans collagénase, le
derme présente une structure normale, avec des
faisceaux de collagène réguliers dans tous les
compartiments,
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
- pour les témoins avec collagénase, les
faisceaux de collagène sont très fortement dégradés et
l'épaisseur du derme a diminué de moitié,
- pour les explants avec excipient et
5 collagénase, les faisceaux de collagène sont fortement
dégradés, l'altération étant inférieure à celle
observée sur les témoins avec collagénase, et
l'épaisseur du derme a diminué de presque moitié,
- pour les explants avec produit à 5~ de GM
10 et collagénase, les faisceaux de collagène sont très
légèrement dégradés et l'épaisseur du derme a
légèrement diminué,
- pour les explants avec contrôle positif
(phénanthroline) et collagénase, la structure dermique
15 est identique à celle des témoins sans collagénase.
Dans ces conditions expérimentales, le
produit GM montre une nette activité anti-collagénase.
Exemple 5 Evaluation de l'activité anti
20 lipolytiaue du DHA obtenu par le procédé de l'invention
sur des explants de tissus adipeux ex vivo.
1. Mode opératoire.
Le DHA est incorporé dans le milieu de
25 culture à la concentration finale de 0, 25 et de 0, 5 % .
Après un contact de 8 jours, l'activité est évaluée par
dosage des lipides relargués dans le milieu de culture.
a. Préparation des explants.
Douze explants de tissus adipeux (plastie
P202-AB31) sont préparés et mis en survie en milieu BEM
(BIO-EC's Explants Medium). Les explants sont répartis
en 4 lots de 3 explants .
un lot Témoin,
un lot Témoin Positif (caféine à 0,1%),
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
26
deux lots produit (DHA à 0,25 et 0,5~).
b. Application des produits.
A J0, les expiants sont mis en survie dans
2 ml de milieu de culture, dans lequel le produit à
tester est incorporé.
Ce traitement est renouvelé à J2, J4 et J6.
c. Prélèvements.
A J2, J4, J6 et J8, le milieu de culture
est prélevé. Pour chaque expiant, les milieux prélevés
à J2, J4, J6 et J8 sont regroupés dans un même tube et
conservé à -20°C en vue du dosage des lipides.
A J8, les expiants de tissus adipeux sont
prélevés et fixés dans du Bouin ordinaire en vue de
l'étude histologique.
d. Histologie.
Les expiants de tissus adipeux fixés sont
déshydratés, imprégnés en paraffine, mis en bloc,
coupés et colorés au trichrome de Masson.
e. Dosage des Lipides.
Après extraction du milieu de culture, les
lipides sont séparés et dosés par CCM.
2. Résultats.
La viabilité et la morphologie des
adipocytes est contrôlée par l'étude histologique.
L'activité lipolytique est évaluée par
l'analyse des proportions de monoglycérides,
diglycérides, triglycérides et acides gras libres.
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
27
a. Histologie.
Après 8 jours de maintien en survie, les
explants témoins et traités ne présentent pas
d'altérations visibles, ni de nécroses cellulaires.
b. Dosaae des lipides.
Les résultats obtenus sont regroupés dans
le tableau 4 ci-dessous. Les résultats sont exprimés en
masse (~.zg) de chaque catégorie de lipides libérés dans
le milieu de culture, pendant les 8 jours de
traitement.
Tableau 4
Mono-Glycrides Di-Glycrides Acides Gras Tri-
Glycrides
~.~.g MoyenneEcart TypeMoyenneEcart MoyenneEcart MoyenneEcart
Type Type Type
Tmoin 4,58 2,15 0,04 0,04 0,97 0,09 106,07 9,90
~
Cafine 1,22 0,44 0,02 0,01 27,99 4,24 197,34 15,17
0,1%
DHA/JLB 3,64 0,12 0,00 0,00 11,42 1,12 156,15 10,65
0.25
DHA/JLB 7,06 2,68 0,00 0,00 11,53 1,09 202,56 45,32
0.5%
Le tableau 5 ci-dessous représente
l'analyse statistique par le test de Student des
résultats du dosage des acides gras libérés dans le
milieu de culture, pendant les 8 jours de traitement.
CA 02459760 2004-03-11
WO 03/022787 PCT/FR02/03094
28
Tableau 5
Tmoin Cafine DHA 0,25% DHA 0,5%
1,10 33,89 9,95 12,81
0,94 24,10 11,67 11,64
0,87 25,97 12,66 10,14
Moyenne 0,97 27,99 11,42 11,53
Ecart-type0, 1 4, 2 1, 1 1, 1
2780,6 1075,6 1086,8
d'augmentation/Tmoin
Probabilit 0,012 0,005 0,005
p
Le paramètre essentiel dans cette étude est
la variation de la quantité et le pourcentage des
acides gras libérés dans le milieu de culture après la
période de traitement.
Par rapport au Témoin non traité, une
augmentation d'un facteur d'environ 29 (2780%) pour le
témoin positif (caféine à 0,1~) est observée.
Le DHA à 0,25 et 0,50% entraine une
augmentation significative respectivement de 1075 et
1087%. L'augmentation de la concentration utilisée
n'engendre pas des effets sur l'efficacité. I1 semble
que la dose maximale efficace soit de l'ordre de 0,25%.
Dans les conditions opératoires décrites
ci-dessus et selon le test de Student, le DHA appliqué
à 0,25 et à 0,5% présente une activité lipolytique
significative en comparaison avec celle de la caféine.