Note: Descriptions are shown in the official language in which they were submitted.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
1
NOUVELLES PYRAZOLO[1,5A]-1,3,5-TRIAZINES SUBSTITUEES ET
LEURS ANALOGUES, COMPOSITIONS PHARMACEUTIQUES LES
CONTENANT, UTILISATION A TITRE DE MEDICAMENT ET PROCEDES
POUR LEUR PREPARATION
L'invention a pour objet de nouveaux dérivés capables notamment
d'augmenter la synthèse et/ou la libération de facteurs neurotrophiques donc
aptes à
être utilisés à titre de médicament humain ou vétérinaire, leurs procédés de
préparation ainsi que les intermédiaires nécessaires à la synthèse.
Dans les conditions physiologiques, les neurites (dendrites et axones)
permettent aux neurones d'effectuer un grand nombre de comiections avec des
neurones voisins. Ces neurones au travers des synapses, peuvent transmettre
des
messages par l'intermédiaire de messagers ou de neurotransmetteurs tels que
les
catécholamines, des aminoacides ou des peptides. Lorsque ces connections entre
neurones se réduisent, suite à une mort cellulaire ou à une dégénérescence due
à
l'âge, à des maladies, des désordres ou des traumatismes, les capacités
mentales du
sujet peuvent gravement être altérées.
Le monoxyde de carbone qui est notamment produit par une enzyme, la hème
oxygénase, fonctionne comme un neurotransmetteur et est capable d'induire,
après
diffusion dans une cellule, la production d'un second messager cellulaire : le
guanosine monophosphate cyclique (GMPc). Cette induction de GMPc est réalisée
par l'intermédiaire d'une guanylate cyclase dépendante du monoxyde de carbone.
Par ailleurs, le GMPc, tout comme l'AMPc, est dégradé par une famille
d'enzymes,
les phosphodiestérases (PDE), divisée en au moins 11 groupes. Les inhibiteurs
de
PDE, en ralentissant la dégradation du GMPc et de l'AMPc, augmentent ou
maintiennent le taux de GMPc et d'AMPc dans les cellules et en prolongent
leurs
effets biologiques.
Il est établi que l'augmentation des taux intracellulaires de GMPc entraîne
une modification de nombreuses activités cellulaires, et notamment de la
synthèse et
de la libération de plusieurs facteurs neurotrophiques endogènes
(neurotrophine et
pléiotrophine) ainsi que d'autres facteurs neuronaux qui peuvent induire,
favoriser ou
modifier une grande variété de fonctions cellulaires nota ment la croissance
et la
communication cellulaire.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
2
Les facteurs neurotrophiques sont des molécules qui exercent une très grande
variété d'effets biologiques et stimulent le développement et la
différenciation des
neurones, le maintien de l'intégrité cellulaire et qui sont nécessaires à la
survie et au
développement des neurones. Plus particulièrement, les facteurs
neurotrophiques
permettent de prévenir la mort neuronale et de stimuler la croissance des
neurites
ainsi que de diminuer les potentiels de membrane, rendant le neurone plus
réceptif
aux signaux cellulaires. Les facteurs de croissance peuvent également changer
la
potentialisation à long terme des neurones induisant une augmentation de la
plasticité
neuronale et permettant d'augmenter les facultés cognitives et mentales.
Dans certains états ou certaines maladies centrales ou périphériques, les
fonctions neuronales sont altérées. Parmi ces états ou maladies résultant le
plus
souvent d'une mort neuronale excessive, on peut notamment citer à titre non
limitatif : la vieillesse, la maladie d'Alzheimer, la maladie >de Parkinson,
la sclérose
amyotrophique latérale, les scléroses multiples, la maladie de Huntington, les
accidents vasculaires cérébraux, les neuropathies périphériques, les
rétinopathies
(notamment la rétinite pigmentaire), les maladies à prions (notamment les
encéphalopathies spongiformes de type maladie de Creutzfeldt-Jakob), les
traumatismes (accidents au niveau de la colonne vertébrale, compression du
nerf
optique suite à un glaucome, ...) ou encore les troubles neuronaux causés par
l'action
de produits chimiques, ainsi que les troubles associés à ces états ou maladies
qui
peuvent être des troubles secondaires à la pathologie primaire. Dans de
nombreux cas
cités, c'est le plus souvent la mort progressive de motoneurones qui sera à
l'origine
des troubles observés et les traitements conventionnels font appel à
l'administration
d'agents anti-inflammatoires pour éviter la survenue de troubles secondaires.
L'un des moyens de prévenir de telles altérations et/ou de rétablir une
fonction neuronale endommagée est de régénérer des neurites entre les
différentes
cellules nerveuses, par exemple, en augmentant les concentrations locales d'un
ou de
plusieurs facteurs de croissance. Les traitements faisant appel à de petites
molécules
capables d'augmenter la synthèse et/ou la sécrétion de facteurs de croissance
et qui
agissent préférentiellement par voie orale ou injectable seront préférés à
ceux
utilisant des facteurs de croissances naturels qui sont des molécules de
grande taille,
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
3
inactives par voie orale et incapables de pénétrer le système nerveux central.
Ces
petites molécules en induisant la sécrétion et/ou la synthèse de facteurs de
croissance
sont également capables de changer la potentialisation à long terme des
neurones,
induisant, notamment au niveau de l'hippocampe, une augmentation de la
plasticité
neuronale, ce qui aura pour conséquence d'augmenter les facultés cognitives et
mentales.
D'autre part, les inhibiteurs des phosphodiestérases de type 2 et 4 (PDE2 et
PDE4) sont capables, en augmentant la concentration intracellulaire d'AMPc,
d'exercer un effet cytoprotecteur et d'augmenter notamment la survie des
neurones
dopaminergiques (Pérez-Torres, 'S. et al. J. Chem. Neuroanatomy, 2000, 20, 349-
374). Il a également été rapporté que l'AMPc intervient dans la transduction
de
nombreux neurotransmetteurs et hormones et peut ainsi notamment moduler
l'effet
de facteurs de croissance. Un inhibiteur de PDE4 ou de PDE2, en ralentissant
la
dégradation de l'AMPc peut, par conséquent, produire un effet neurologique
et/ou
neuroprotecteur. Il est par -ailleurs connu que les inhibiteurs de PDE4
représentent
des traitements potentiels de nombreuses maladies centrales ou périphériques,
notamment des maladies autoimmunes et inflammatoires. Le domaine d'application
des inhibiteurs de PDE4 recouvre notamment le traitement et la prévention de
l'inflammation et du manque de relaxation bronchique, et plus particulièrement
de
l'asthme et des bronchopathies chroniques obstructives, mais également
d'autres
affections comme les rhinites, le syndrôme de détresse respiratoire aiguë, les
allergies, les dermatites, le psoriasis, l'arthrite rhumatoïde, les scléroses
multiples
(notamment la sclérose en plaques), les dyskinésies, les glomérulonéphrites,
l'ostéoarthrite, le cancer, le choc septique, le sida, la maladie de Crohn,
l'ostéoporose, l'arthrite rhumatoïde ou l'obésité. Les IPDE4 sont également
pourvus
d'effets centraux particulièrement avantageux pour le traitement de la
dépression, de
l'anxiété, de la schizophrénie, du désordre bipolaire, des défauts de
l'attention, de la
fibromyalgie, des maladies de Parkinson et d'Alzheimer, de la sclérose
amyotrophique, des scléroses multiples, des démences des corps de Lewy et
d'autres
désordres psychiatriques.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
4
La demande internationale WO 99/67247 décrit des pyrazolotriazines,
antagonistes du CRF, répondant à la formule générale:
X
(R
NRa
N~-k N-N
Ra
R N
R3
dans laquelle l'atome d'azote hexocyclique en position 4 porte obligatoirement
un
groupement aromatique phényle ou pyridyle. La demande internationale WO
99/67247 ne dévoile donc pas de pyrazolo[1,5-a]-1,3,5-triazines identiques à
celles
revendiquées dans la présente invention.
La demande internationale WO 99/38868 décrit des pyrazolotriazines,
antagonistes du CRF, répondant à la formule générale:
'R3
NN-
R
1 N
Ar
dans laquelle le substituant en position 8 est obligatoirement un groupement
aromatique pyridyle ou phényle. La demande internationale WO 99/38868 ne
dévoile
donc pas de pyrazolo[1,5-a]-1,3,5-triazines identiques à celles revendiquées
dans la
présente invention.
D'autres pyrazolotriazines antagonistes du CRF sont décrites dans la
demande internationale WO 9803510 et répondent à la formule générale :
R3
NN_N
Ri N
Ar
dans laquelle le groupement en position 8 est obligatoirement aromatique et
est
choisi parmi phényle, naphthyle, pyridyle, pyrimidyle, triazinyle, furanyle,
thiényle,
benzothiényle, benzofuranyle, 2,3-dihydrobenzofuranyle, 2,3-
dihydrobenzothiényle,
indanyle, 1,2-benzopyranyle, 3,4-dihydro-1,2-benzopyranyle, tétralinyle. La
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
demande internationale WO 9803510 ne dévoile donc pas de pyrazolo[1,5-a]-1,3,5-
triazines identiques à celles revendiquées dans la présente invention.
Le brevet US 4,183,930 décrit des pyrazolotriazines répondant à la formule
générale:
N
HRZ
il,
N NON
R3
RIHN N
5 R4
dans laquelle le substituant en position 2 est obligatoirement un groupement
NHRZ,
R1 étant un atome d'hydrogène ou un radical (C1_4) alkyle, alors R4 est un
atome
d'hydrogène ou un groupement C1_4 alkyle. Ces composés sont notamment doués de
propriétés bronchodilatatrices, antiallergiques, neurologiques, mais sont
également
doués de propriétés hypotensives qui peuvent être préjudiciables. En outre, le
brevet
US 4,183;930 ne dévoile pas de ,pyrazold[1,5-a]-1,3,5-triazines identiques à
celles
revendiquées dans la présente invention.
La demande EP 515 107 décrit des composés répondant à la 'formule
générale:
NHR'
NN'N
R~N A O
dans laquelle le substituant en position 7 est obligatoirement un groupement 2-
furyle
et A représente soit un atome d'azote soit un groupement CT où T est un atome
d'hydrogène ou un groupement (C1_4)alkyle. Ces composés antagonisent l'effet
de
l'adénosine. La demande EP 515 107 ne dévoile donc pas de pyrazolo[1,5-a]-
1,3,5-
triazines identiques à celles revendiquées dans la présente invention.
La demande internationale WO 00/59907 décrit des antagonistes du CRF,
répondant à la formule générale:
R
B
ADN Ri
R
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
6
dans laquelle le composé est une pyrazolo[1,5-a]-1,3,5-triazine, lorsque A
représente
CR5 et B représente N. Les composés décrits se limitent cependant aux
pyrazolo[1,5-
a]-1,3,5-triazines dans lesquelles R3 est obligatoirement un groupement aryle
ou
hétéroaryle. La demande internationale WO 00/59907 ne dévoile donc pas de
pyrazolo[1,5-a]-1,3,5-triazines identiques à celles revendiquées dans la
présente
invention.
La demande FR 2 818 278 et la demande internationale WO 02/50079
décrivent des pyrazolo[1,5-a]-1,3,5-triazines, inhibitrices des kinases
dépendantes
des cyclines (CDK), répondant à la formule générale:
Ar
1
Y ,z
N N-N
XN
A
dans 'laquelle Y représente NH ou O; Z représente une liaison ou un
,groupement
alkyle ~ou thioalkyle et Ar représente un radical aryle carbocyclique
éventuellement
substitué. Les demandes FR 2 818 278 et WO 02/50079 ne dévoilent donc pas de
pyrazolo[1,5-a]-1,3,5-triazines identiques à celles revendiquées dans la
présente
invention.
La demande EP 0269859 décrit des pyrazolo[1,5-a]-1,3,5-triazines,
inhibitrices de xanthine oxidase, répondant à la formule générale:
R1
NN-N
RN
R3
dans laquelle R1 est obligatoirement un hydroxy ou un groupement C1-C6
alkanoyloxy et R2 est obligatoirement un hydrogène, et R3 est un hétérocycle
insaturé. La demande EP 0269859 ne dévoile donc pas de pyrazolo[1,5-a]-1,3,5-
triazines identiques à celles revendiquées dans la présente invention.
Le brevet US 3,910,907 décrit des pyrazolo[1,5-a]-1,3,5-triazines,
inhibitrices
de l'AMPc phosphodiestérase, répondant à la formule générale:
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
7
zI
N/~N,N
~ Y
R1 N
X
dans laquelle RI est obligatoirement un groupement CH3, C2H5, ou C6H5; X est
choisi parmi H, C6H5, (m)CH3C6H4, CN, COOEt, Cl, I ou Br ; Y représente H,
C6H5,
(o)CH3C6H4, (p)CH3OC6H4 et Z représente H, OH, CH3, C2H5, C6H5, n-C3H7, iso-
C3H7, SH, SCH3, NH(n-C4H9) ou N(C2H5)2. Ces inhibiteurs de phosphodiestérase
sont donc différents de ceux reportés dans la présente invention.
Le brevet US 3,995,039 décrit d'autres pyrazolo[1,5-a]-1,3,5-
triazines, inhibitrices de l'AMPc phosphodiestérase, répondant à la formule
générale:
R2" N ~R3
NN-N
RN
R
dans laquelle R est obligatoirement un hétérocycle directement attaché à la
position 8
du cycle pyrazolotriazine, Rl et R2 représentent alkyle ou hydrogène, et R3
est choisi
parmi un atome d'hydrogène, un groupement alkyle, alcanoyle, carbamoyle, ou N
alkylcarbamoyle. Ces inhibiteurs de phosphodiestérase sont donc différents de
ceux
reportés dans la présente invention et possèdent en outre, à côté d'une
activité
bronchodilatatrice, des propriétés hypotensives qui peuvent être
préjudiciables à leur
utilisation en thérapeutique humaine. Par ailleurs, aucune sélectivité vis-à-
vis des
phosphodiestérases de type 2 et de type 4 n'a été rapportée pour ces composés.
D'autres pyrazolo[1,5-a]-1,3,5-triazines inhibitrices de phosphodiestérase
sont décrites dans l'article suivant J.Med.Chenz. 1982, 25, 243-249 et
répondent à la
formule générale:
R2
N/_1N,N
R3
R(N
R4
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
8
dans laquelle R4 représente Br ou H, R1 est choisi parmi H, CH3 ou SCH3, R4
égal à
C6H5 ou H, et R2 représente SCH3, NH(n-Pr), NH(n-Bu), N(Et)2, pipéridyle, OH,
SH,
0(i-Pr), CH3, SEt, OCH3, 0(n-Pr). Ces inhibiteurs de PDE sont donc également
différents de ceux dévoilés dans la présente invention. Par ailleurs, aucune
sélectivité
vis-à-vis des phosphodiestérases de type 2 et de type 4 n'a été rapportée pour
ces
composés.
D'autres inhibiteurs de PDE4 à structure pyrazolo[1,5-a]-1,3,5-triazine sont
décrits dans une thèse de l'Université de Strasbourg I: Pierre Raboisson,
"Développement d'inhibiteurs de Phosphodiestérase 4 et conception
d'antagonistes
purinergiques P2Y1 à partir de dérivés de l'adénine et de leurs analogues
structuraux"
27 novembre 2000. Bien que des inhibiteurs puissants aient été développés
envers la
PDE4 bovine, aucune donnée concernant : (i) l'activité de ces molécules sur la
PDE4
humaine, (ii) l'absence d'effet émétique de ces composés sur un modèle animal
ou
(iii) une preuve d'efficacité sur un modèle d'asthme ou autre modèle de
maladie
inflammatoire ou autoimmune, (iv) la sélectivité de ces composés vis-à-vis de
la
PDE6, n'a été rapportée. De plus, les composés décrits dans cette thèse ont
montré
un effet limité sur la sécrétion de TNFa (seulement quatre composés testés
avec une
IC50 qui est supérieur à 100nM) et aucun parallélisme entre l'inhibition de la
PDE4 et
la diminution de sécrétion de TNFa n'a été observé, laissant suggérer que ces
composés puissent agir sur une autre cible biologique que la PDE4. Par
ailleurs,
aucun effet neurotrophique n'a été observé avec ces composés. En outre, ces
composés sont différents de ceux divulgués dans la présente invention.
La demanderesse a maintenant mis en évidence que les composés selon
l'invention sont capables d'augmenter la synthèse et/ou la libération d'un ou
de
plusieurs facteurs neurotrophiques endogènes. Certains composés selon
l'invention
sont en outre doués de propriétés inhibitrices de PDE2 ou de PDE4.
L'invention a en conséquence pour objet des composés répondant la formule
générale (I)
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
9
Rs
R1---'j>C6.D -R6
I l I; (I)
R- !,B C4,C,~R7
2' 1 17
R5 R3
dans laquelle:
A représente C ou N,
B et D identiques ou différents sont choisis parmi N ou C, sous réserve que A
et B ne
représentent pas simultanément un atome d'azote,
R1 représente
- soit un atome d'hydrogène,
- soit un groupe (C1-C12)alkyle, (C3-C6)cycloalkyle, (C6-C18)aryle,
(C6-C1â)aryl(C1-C4)alkyle, ou (CI-C12)alkyl(C6-C18)aryle, (C2_C8)alcényle,
(C2_C8)alcynyle, {(C.1-C8)alcoxy, hydroxy.
- soit un hétérocycle en (C5-C18), aromatique ou non, comportant de 1 à 3
hétéroatomes, et étant rattaché directement à l'atome d'azote en position 1
par une liaison simple ou par un groupement (C1-C6)alkyle, (C2-C6)alcényle,
ou (C2-C6)alcynyle,
- soit un groupe NR'R" ou NHCOR'R", R' et R", indépendamment l'un de
l'autre, étant choisis parmi l'atome d'hydrogène et les groupes (C1-C6)alkyle,
(C3-C6)cycloalkyle, (C6-C12)aryle, et les hétérocycles en (C5-C12),
aromatiques ou non, comportant de 1 à 3 hétéroatomes;
R2 et R3 identiques ou différents représentent chacun
- soit un atome d'hydrogène,
- soit un atome d'halogène,
- soit un groupe (C1-C6)alcoxy, (C1-C10)alkyle, (C1-C6)alkyl000H, (C1-
C6)alkyl000Na, perfluoro(C1-C6)alkyle, (C3-C6)cycloalkyle, acyle,
(C2-C6)alcényle, (C2-C6)alcynyle, (C6-C18)aryle, (C6-C18)arylCOOH, (C6-
C18)arylCOONa, (C6-C18)aryl(C1_C4)alkyle, (Cl_C6)alkyl(C6-C18)aryle,
(C5-C18)hétéroaryle, (C1-C6)alkyl(C5-Cig)hétéroaryle, (C2-C6)alcényle
(C5-C18)hétéroaryle, (C2-C6)alcynyl(C5-C18)hétéroaryle, CH(OH)(C6-
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
C18)aryle, CO(C6-Cis)-aryle, (CH2)1CONH-(CH2)m-(C6-Cis)aryle,
(CI2)õSO2NH-(CH2)m (C6-C18)aryle, (CH2)"CONH-CH(COOH)-(CH2)p-(C6-
C18)aryle avec n = 1 à 4, m = 0 à 3 et p = 0 à 2, dans lesquels un ou
plusieurs
groupements -CH2- peuvent être éventuellement remplacés par -0-, -S-, -
5 S(O)-, -S(O)2- ou -NH- et peuvent éventuellement être substitués par un ou
plusieurs radicaux choisis parmi les radicaux (Ci-C6)alkyle, hydroxy, oxo,
(C6-Cis)aryi(Ci-C8)alkyle, (C6-C18)aryle, halogène, cyano, phosphate,
alkylphosphate, nitro, alkoxy, (C5-C18)hétéroaryle, (C5-C18)hétéroaryl(Ci-
C6)alkyle, COOH, CONRXRy, NRXCONHRy, OR, SRX, SORX, S02RX, CORX,
10 COORX, NRXS02Ry ou NRXRy dans lesquels (i) RX et Ry, indépendamment
l'un de l'autre, sont choisis parmi l'atome d'hydrogène, les groupes
(Ci-C6)alkyle, (C3-C6)cycloalkyle, (C6-C18)aryle, (C6-C13) aryl(Ci-C4)alkyle,
(Ci-C1L)alkyl(C6-C18)aryle, (C3-C6)cycloalkyl(C6-C12) aryle, (Ci_
C6)alcoxy(C1_C6)alkyle, (C5-C12)hétéroaryle comportant 1 à 3 hétéroatomes,
'OR', NR'R" et NHCOR'R", R' et R", indépendamment l'un de l'autre,
étant choisis parmi l'atome d'hydrogène et les groupes (C1-C6) alkyle,
(C3-C6)cycloalkyle, (C6-C12)aryle, et les hétérocycles en (C5-C12),
aromatiques ou non, comportant 1 à 3 hétéroatomes ou (ii) RX et Ry forment
ensemble une chaîne hydrocarbonée linéaire ou ramifiée ayant de 2 à 6
atomes de carbone, comportant éventuellement une ou plusieurs doubles
liaisons et/ou éventuellement interrompues par un atome d'oxygène, de
soufre ou d'azote,
- soit un groupe nitro, cyano, ORX, SRX, SORX, S02RX, CORX, CONRXRy,
COORX, NRXCORy, NRS02Ry ou NR,XRy dans lesquels RX et Ry sont tels que
définis précédemment,
- étant entendu que dans la définition des groupements R2 et R3, les
groupements "aryles" peuvent être remplacés par des "hétérocycles" en C4-
Clo, aromatique ou non, comportant de 1 à 3 hétéroatomes ;
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
11
R5 représente
- soit un atome d'hydrogène,
- soit un groupe (C1-C6)alkyle, (C3-C6)cycloalkyle (C6-C12)aryle,
(C5-C12)hétéroaryle comportant 1 à 3 hétéroatomes,
R6 et R7 forment ensemble avec les atomes qui les portent un cycle à 5 ou 6
chaînons
qui peut contenir un autre hétéroatome choisi dans le groupe constitué par N,
O et S,
et dans laquelle
si la liaison entre N1 et C6 est une liaison simple, alors la liaison entre C6
et R8 est
une double liaison et R8 = X, où X représente soit un atome d'oxygène ou de
soufre,
soit un groupe NRX dans lequel RX est tel que défini ci-dessus,
si la liaison entre N1 et C6 est une double liaison, alors la liaison entre C6
et R8 est
une liaison simple et R8 = Y où Y représente soit un atome d'halogène, soit un
groupe (C1-C6)alkyle, (C2-C6)alcényle, (C2-C6)alcynyie, (C1-C6)alcoxy,
(C3-C6)cycloalkyle, OR, SR, SORX, SO2R,{, NRXCORy, NRXSO2Ry ou NRXRy dans
lequel RX et Ry sont tels que définis ci-dessus et R1 n' est pas présent,
si la liaison entre A et B est une liaison simple, alors la liaison entre A et
R2 est une
double liaison et R2 X où X est tel que défini ci-dessus, et
si la liaison entre A et B est une double liaison, alors la liaison entre A et
R2 est une
liaison simple, R2 est tel que défini précédemment et R5 n'est pas présent,
si la liaison entre C4 et D est une liaison simple, alors la liaison entre C4
et C7 est une
double liaison,
si la liaison entre C4 et D est une double liaison, alors la liaison entre C4
et C7 est une
liaison simple, et D est un atome de carbone, ou bien D est un atome d'azote
et R6
n'est pas présent,
leurs formes tautomères, leurs isomères, diastéréoisomères et énantiomères,
leurs
prodrogues, leurs bioprécurseurs et leurs sels d'addition basiques ou acides
pharmaceutiquement acceptables, sous réserve que lorsque les composés
répondent à
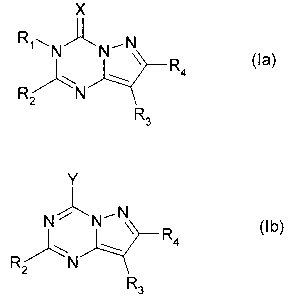
la formule (la)
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
12
X
R1 '~, NÅN-- N
4 (la)
RÇN
2
R3
ou (Ib)
Y
N~k, N-- N
~\ \ R4 (Ib)
R/ N
2
R3
alors
- Lorsque Y dans la formule (Ib) représente OR, alors RX est obligatoirement
différent d' aryle et aralkyle.
- Lorsque, simultanément dans la formule (Ib) Y représente NRRy et que R7,
représente H, alors Ry est obligatoirement différent d'aryle et ara'lkyle.
- Lorsque Y dans la formule (Ib) représente un groupement NR,XRy dans lequel
au
moins l'un des groupements R;t ou Ry est choisi parmi les groupements phényle
ou pyridyle, éventuellement substitués, alors R3 est différent d'un groupement
(C1_
Clo)alkyle, (C2_C10)alcényle, (C2_Clo)alcynyle, (C3_C8)cycloalkyle et (C3_
C6)cycloalkyl)(C1_C4)alkyle, ces derniers pouvant être éventuellement
substitués.
- Lorsque R3 dans la formule (Ib) représente un groupement phényle ou
pyridyle,
éventuellement substitué, alors y est différent de:
NHCH(CH2CH2OMe)(CH2OMe), NHCH(Et)2, 2-éthylpipérid-1-yle,
cyclobutylamino, N(Me)CH2CH=CH2, N(Et)CH2CH=CH2, N(Me)CH2cPr,
N(Et)CH2cPr, N(Pr)CH2cPr, N(Me)Pr, N(Me)Et, N(Me)Bu, N(Me)propargyle,
N(Et)propargyle, NHCH(CH3)CH(CH3)CH3, N(CH2CH2OMe)CH2CH=CH2,
N(CH2CH2OMe)Me, N(CH2CH2OMe)Et, N(CH2CH2OMe)Pr,
N(CH2CH2OMe)CH2cPr, NHCH(CH3)CH2CH3, NHCH(cPr)2, N(CH2CH2OMe)2,
N(Et)2, cyclobutylamino.
- Lorsque R3 dans la formule (Ib) représente un groupement phényle, naphthyle,
pyridyle, pyrimidyle, triazinyle, furanyle, thiényle, benzothiényle,
benzofuranyle,
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
13
2,3-dihydrobenzofuranyle, 2,3-dihydrobenzothiényle, indanyle, 1,2-
benzopyranyle, 3,4-dihydro-1,2-benzopyranyle, tétralinyle, alors R1 dans la
formule (la) est différent de H.
- Lorsque simultanément, dans la formule (Ib), R3 représente un hétérocycle
directement attaché à la position 8 du cycle pyrazolotriazine, que R2
représente
alkyle ou hydrogène, et que Y représente un groupement NRXRy, RX étant choisi
parmi un atome d'hydrogène ou un groupement alkyle, alors Ry est différent de
H
ou d'un groupement alkyle, alcanoyle, carbamoyle ou N-alkylcarbamoyle.
- Lorsque NRXRy dans la formule (Ib) représente un groupement NH2 ou un
groupement NH(C1_C4)alkyle, alors R4 est différent d'un atome d'hydrogène ou
un groupement C1_C4 alkyle.
- Lorsque simultanément, dans la formule (lb), Y représente NHCH3, que e2
représente CH3 et que R4 représente un atome d'hydrogène, alors R3 est
différent
de benzyle, phényle, naphthyle, (2-naphthyl)méthyle, pentyle, benzoyle,
propyne,
pentén-1-yle, 2-furyle, 2-thiényle, 2-chlorophényle, 3-acétylphényle, 3-
nitrophényle, 3-trifluorométhylphényle, 2-benzo[b]fur le, 2-benzo[b]thiényle,
2-
chlorobenzoyle, 2-méthylaminobenzoyle, 4-méthoxybenzoyle, 3-
trifluorométhylbenzoyle, furfuryle, (3-furyl)méthyle, (2-thiényl)méthyle, 2-
hydroxypropyle, iodo, nitro, acétylamino, benzoylamino, et
diéthylaminocarbonyle.
- Lorsque simultanément, dans la formule (Ib), Y représente NHCH3, que R4
représente H, et que R3 représente benzoyle ou iodo, alors R2 est différent de
méthyle, éthyle, n-propyle, n-butyle, thiométhyle, méthoxyméthyle, phényle, et
2-
furyle.
- Lorsque simultanément, dans la formule (Ib), Y représente NHCH3, que R4
représente H, et que R3 représente benzyle ou 2-méthoxybenzyle, alors R2 est
différent de méthyle, n-propyle, trifluorométhyle.
- Lorsque simultanément, dans la formule (1b), Y représente un groupement
méthylamino, benzylamino, pyrrolidinyle, diméthylamino ou 1-pipérazinyle, et
que R2 représente méthyle ou n-propyle, alors R3 est différent de iodo et
benzoyle.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
14
- Lorsque R4 dans la formule (Ib) est un groupement 2-furyle, alors R3 est
différent d'un atome d'hydrogène ou d'un groupement (Cr_C4)alkyle.
-Lorsque simultanément, dans les formules (la) et (Ib), RI est un atome
d'hydrogène avec R2 choisi parmi CH3, C2H5, ou C6H5; que R3 est choisi parmi
H, C6H5, (m)CH3C6H4, CN, COOEt, Cl, I, ou Br ; et que R4 représente H, C6H5,
(o)CH3C6H4, (p)CH3OC6H4, alors Y est différent de H, OH, CH3, C2H5, C6H5, n-
C3H7, iso-C3H7, SH, SCH3, NH(n-C4H9) ou N(C2H5)2 et X est différent de O.
- Lorsque simultanément, dans la formule (Ib), Ri représente H, R3 représente
Br
ou H et que R2 est choisi parmi H, CH3 ou SCH3 avec R4 égal à C6H5 ou H, alors
Y est différent de SCH3, NH(n-Pr), NH(n-Bu), N(Et)2, pipéridyle, OH, SH, 0(i-
Pr), CH3, SEt, OCH3, 0(n-Pr).
- Lorsque simultanément, dans la formule (Ib), R2 représente CF3, CH3OCH2-,
Ph,
Et, n-Pr, CH3, que Y représente NHCH3, N(CH3)2, N(CH3)Ph, et que R4 = H ou
CH3, alors R3 est différent de ;(3-D-glycéro-pentofùran-3'-ulos-l'-yl, 2'-
déoxy-0-
D-ribofuranosyl, 2'-déoxy-f3-D-xylofuranosyl, 2'-déoxy-(3-D-rbofuranosyl-3',5'-
bis(phosphate de dibenzyle), 2'-déoxy-,(3-D-xylofuranosyl-3',5'-phosphate de
benzyle cyclique, 2'-déoxy-f3-D-ribofuranosyl-3',5'-bisphosphate, 2'-déoxy-(3-
D-
xylofuranosyl-3',5' -phosphate cyclique.
Avantageusement les composés répondent à la formule (I) dans laquelle A est
un atome de carbone, et B et D des atomes d'azote, l'hétérocycle à 6 maillons
ainsi
formé étant une 1,3,5-triazine. ,
Si A et D représentent des atomes de carbone et que B est un atome d'azote,
alors l'hétérocycle à 6 maillons est une pyrimidine, par exemple un dérivé
d'uracile
ou de cytosine.
Etant entendu que dans la formule (I) l'atome de carbone C4 peut être
avantageusement remplacé par un atome d'azote dans le cas suivant : lorsque
les
composés répondent à la formule (I) dans laquelle A est un atome de carbone et
B est
un atome d'azote. Ainsi, l'hétérocycle à 6 maillons ainsi formé est une 1,2,4-
triazine.
Ces composés sont particulièrement intéressants lorsque le cycle fusionné à 5
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
maillons est un imidazole. Dans ce cas le bicycle de formule (I) sera une
imidazotriazine.
De manière très avantageuse, les composés selon l'invention répondent plus
particulièrement à la formule (la)
X
N N-- N
~\ R4 (la)
R2 N
5 R3
ou à la formule (Ib)
Y
`NON
\ R4 (lb)
R2 N
R3
dans lesquelles:
R1, R2, R3, X et Y sont tels que définis précédemment, et
10 R4 représente :
- soit un atome d'hydrogène, un groupe (C1-C12)alkyle, (C3-C6)cycloalkyle, (C6-
C18)aryle, (C6-C18)aryl(C1-C4)alkyle, (C1-C12)alkyl(C6-C18)aryle, un
hétérocycle en
(C5-C18), aromatique ou non, comportant 1 à 3 hétéroatomes, dans lesquels un
ou
plusieurs groupements -CH2- peuvent être éventuellement remplacés par -0-, -S-
,
15 -S(O)-, -S(O)2- ou -NH- et peuvent éventuellement être substitués par un ou
plusieurs
radicaux choisis parmi les radicaux (C1-C6)alkyle, hydroxy, oxo, halogène,
cyano,
nitro, alkoxy,
- soit un groupe NR'R" ou NHCOR'R", R' et R", indépendamment l'un de l'autre,
étant choisis parmi l'atome d'hydrogène, un groupe (C1-C6)alkyle, (C3-
C6)cycloalkyle, (C6-C12)aryle, et un hétérocycle en (C5-C12), aromatique ou
non,
comportant 1 à 3 hétéroatomes, lesdites formules (la) et (Ib) pouvant être
entre elles
des formes tautomères selon la définition de R1, de X et de Y sous réserve que
:
- Lorsque Y dans la formule (Ib) représente OR,,, alors RX est obligatoirement
différent d'aryle et aralkyle.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
16
- Lorsque, simultanément dans la formule (Ib) Y représente NR,,Ry et que R,,
représente H, alors Ry est obligatoirement différent d'aryle et aralkyle.
- Lorsque Y dans la formule (Ib) représente un groupement NR,XRy dans lequel
au
moins l'un des groupements R,, ou Ry est choisi parmi les groupements phényle
ou pyridyle, éventuellement substitués, alors R3 est différent d'un groupement
(C1_
C10)alkyle, (C2.C10)alcényle, (C2_C10)alcynyle, (C3_Cs)cycloalkyle et (C3_
C6)cycloalkyl)(C1_C4)alkyle, ces derniers pouvant être éventuellement
substitués.
- Lorsque R3 dans la formule (Ib) représente un groupement phényle ou
pyridyle,
éventuellement substitué, alors y est différent de:
NHCH(CH2CH2OMe)(CH2OMe), NHCH(Et)2, 2-éthylpipérid- 1 -yle,
cyclobutylamino, N(Me)CH2CH=CH2, N(Et)CH2CH=CH2, N(Me)CH2cPr,
N(Et)CH2cPr, N(Pr)CH2cPr, N(Me)Pr, N(Me)Et, N(Me)Bu, N(Me)propargyle,
N(Et)propargyle, NHCH(CH3)CH(CH3)CH3, N(CH2CH2OMe)CH2CH=CH2,
N(CH2CH2OMe)Me, N(CH2CH2OMe)Et, N(CH2CH2OMe)Pr,
N(CH2CH2OMe)CH2cPr, NHCH(CH3)CH2CH3, NHCH(ePr)2, N(CH2CH2OMe)2,
N(Et)2, cyclobutylamino.
- Lorsque R3 dans la formule (Ib) représente un groupement phényle, naphthyle,
pyridyle, pyrimidyle, triazinyle, furanyle, thiényle, benzothiényle,
benzofuranyle,
2,3-dihydrobenzof iranyle, 2,3-dihydrobenzothiényle, indanyle, 1,2-
benzopyranyle, 3,4-dihydro-1,2-benzopyranyle, tétralinyle, alors R1 dans la
formule (la) est différent de H.
- Lorsque simultanément, dans la formule (Ib), R3 représente un hétérocycle
directement attaché à la position 8 du cycle pyrazolotriazine, que R2
représente
alkyle ou hydrogène, et que Y représente un groupement NR,XRy, R,, étant
choisi
parmi un atome d'hydrogène ou un groupement alkyle, alors Ry est différent de
H
ou d'un groupement alkyle, alcanoyle, carbamoyle ou N-alkylcarbamoyle.
- Lorsque NR,,Ry dans la formule (Ib) représente un groupement NH2 ou un
groupement NH(C1_C4)alkyle, alors R4 est différent d'un atome d'hydrogène ou
un groupement CI -C4 alkyle.
- Lorsque simultanément, dans la formule (Ib), Y représente NHCH3, que R2
représente CH3 et que R4 représente un atome d'hydrogène, alors R3 est
différent
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
17
de benzyle, phényle, naphthyle, (2-naphthyl)méthyle, pentyle, benzoyle,
propyne,
pentén-1-yle, 2-furyle, 2-thiényle, 2-chlorophényle, 3-acétylphényle, 3-
nitrophényle, 3-trifluorométhylphényle, 2-benzo[b]furyle, 2-benzo[b]thiényle,
2-
chlorobenzoyle, 2-méthylaminobenzoyle, 4-méthoxybenzoyle, 3-
trifluorométhylbenzoyle, furfuryle, (3-furyl)méthyle, (2-thiényl)méthyle, 2-
hydroxypropyle, iodo, nitro, acétylamino, benzoylamino, et
diéthylaminocarbonyle.
- Lorsque simultanément, dans la formule (Ib), Y représente NHCH3, que R4
représente H, et que R3 représente benzoyle ou iode, alors R2 est différent de
méthyle, éthyle, n-propyle, n-butyle, thiométhyle, méthométhyle, phényle, et 2-
furyle.
- Lorsque simultanément, dans la formule (Ib), Y représente NHCH3, que R4
représente H, et que R3 représente benzyle ou 2-méthoxybenzyle, alors R2 est
différent de méthyle, n-propyle, trifluorométhyle.
- Lorsque simultanément, dans la formule (lb), Y représente un groupement
méthylamino, benzylamino, pyrrolidinyle, diméthylamino ou 1-pipérazinyle, et
que R2 représente méthyle ou n-propyle, alors R3 est différent de iodo et
benzoyle.
- Lorsque simultanément, dans la formule (Ib), Y représente un groupement
méthylamino, benzylamino, pyrrolidinyle, diméthylamino ou 1-pipérazinyle, et
que R2 représente méthyle ou n-propyle, alors R3 est différent de iodo et
benzoyle.
- Lorsque R4 dans la formule (Ib) est un groupement 2-furyle, alors R3 est
différent d'un atome d'hydrogène ou d'un groupement (CI_C4)alkyle.
-Lorsque simultanément, dans les formules (la) et (Ib), RI est un atome
d'hydrogène avec R2 choisi parmi CH3, C2H5, ou C6H5; que R3 est choisi parmi
H, C6H5, (m)CH3C6H4, CN, COOEt, Cl, I, ou Br ; et que R4 représente H, C6H5,
(o)CH3C6H4, (p)CH3OC6H4, alors Y est différent de H, OH, CH3, C2H5, C6H5, n-
C3H7, iso-C3H7, SH, SCH3, NH(n-C4H9) ou N(C2H5)2 et X est différent de O.
- Lorsque simultanément, dans la formule (lb), RI représente H, R3 représente
Br
ou H et que R2 est choisi parmi H, CH3 ou SCH3 avec R4 égal à C6H5 ou H, alors
Y est différent de SCH3, NH(n-Pr), NH(n-Bu), N(Et)2, pipéridyle, OH, SH, 0(i-
Pr), CH3, SEt, OCH3, 0(n-Pr).
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
18
- Lorsque simultanément, dans la formule (Ib), R2 représente CF3, CH3OCH2-,
Ph,
Et, n-Pr, CH3, que Y représente NHCH3, N(CH3)2, N(CH3)Ph, et que R4 = H ou
CH3, alors R3 est différent de (3-D-glycéro-pentofuran-3'-ulos-l'-yl, 2'-déoxy-
j3-
D-ribofuranosyl, 2'-déoxy-f3-D-xylofuranosyl, 2'-déoxy-f3-D-ribofuranosyl-
3',5'-
bis(phosphate de dibenzyle), 2'-déoxy-(3-D-xylofuranosyl-3',5'-phosphate de
benzyle cyclique, 2'-déoxy-j3-D-ribofuranosyl-3',5'-bisphosphate, 2' -déoxy-(3-
D-
xylofurano syl-3' , 5' -phosphate cyclique.
Dans un mode particulièrement avantageux de réalisation de l'invention,
RI représente soit un atome d'hydrogène, soit un groupe (CI-C12) alkyle,
R2 représente soit un atome d'hydrogène ou de soufre, soit un groupe (CI-
C6)alkyle,
soit un groupe trifluoro(C 1 -C6)alkyle, soit un groupe amino, soit un groupe
SRX où RX
est tel que défini précédemment,
R3 représente soit un atome d'hydrogène, soit un atome d'halogène, soit un
groupe
nitro, (C1-C6)alkyle, trifluoro(CI-C6)alkyle, acyle, (C2-C6)alcényle, (C2-
C6)alcynyle,
'15 {C6-C18)aryle, (CH2)õCONH-(CH2),,,aryle, (CH2)õ SO2NH-(CH2),aryle,
(CH2),;CONH-CH(COOH)-(CH2)paryle avec n = 1 à 4, m= 0 à 3 et
p = 0 à 2, NR'R" et NHCOR'R", R' et R", indépendamment l'un de l'autre, étant
choisis parmi l'atome d'hydrogène et les groupes (Ci-C6)alkyle, (C3-
C6)cycloalkyle,
(C6-C12)aryle, et les hétérocycles en (C5-C12), aromatiques ou non, comportant
1 à 3
hétéroatomes,
R4 représente un atome d'hydrogène,
X représente un atome d'oxygène ou de soufre, et
Y représente soit un atome d'halogène, soit un groupe (CI-C6)alkyle,
(C2-C6)alcynyle, phényle, ORX, SRX ou NRXRy dans lequel RX et Ry sont tels que
définis ci-dessus.
De manière encore plus avantageuse,
RI représente un atome d'hydrogène ou un groupe méthyle,
R2 représente un atome d'hydrogène ou de soufre, un groupe méthyle, propyle,
trifluorométhyle, amino ou thiométhyle,
R3 représente un atome d'iode, un groupe amino, nitro, acylamino, benzyle, 2-
méthoxybenzyle, furfuryle, 3-furylméthyle, 2-thienylméthyle, 3-thienylméthyle,
2-
CA 02493402 2010-09-16
19
pyridylméthyle, 2-chlorobenzoyle -CH2CH2OO0H, CH2CH2COONa, C6H4000H,
C6H4000Na, C6H4CO002H5, benzoate d'éthyle, benzoate de sodium
CH2=CHCOOC2H5, propyn-1-yle, (CH2)2CONH-C6H4COONa, (CH2)CONH-
(CH2)2-indole, (CH2)2CONH-CH(COOH)(CH2)indole, (CH2)CONH-(CH2)2C6H4OH
ou (CH2)2CONH-CH2C6H4OH,
X représente un atome d'oxygène et
Y représente un groupe OH, SH, N-méthyl-N-phénylamino (NPhCH3), N-méthyl-N-
(4-acylaminophényl)amino ou triazole.
Dans un mode particulièrement avantageux de réalisation de l'invention,
celle-ci a pour objet les composés répondant aux formules (ICI) et (Ic2)
j0~OH
,HNÅ,N.-N NJi,N,N
N 'R__4
N
i(C,H2)n \ (OH2)n \
NH ,NH
(CH2)m {CH2)m
COOH COOH
(1c1) (Ic2)
dans lesquelles n = 1 à 4, et m = 0 à 2,
ainsi que leurs prodrogues, leurs bioprécurseurs et leurs sels d'addition
basique ou
acide pharmaceutiquement acceptables.
De manière encore plus avantageuse, dans les composés de formule (Ici) et
(Ic2), R2 représente un atome d'hydrogène, n = 1 à 2 et m = 0.
Ces composés se sont avérés de puissants stimulateurs de la croissance
neuronale. Le composé 4-[[1-(oxo)-3-(4-oxopyrazolo[1,5-a]-1,3,5-triazin-8-
yl)propyllamino]benzoate de sodium (Ia5) répondant aux formules Ici et Ic2
dans
lesquelles R2 = H, n = 2 et m _ 0 est particulièrement préféré.
D'autres composés particulièrement intéressants au sens de l'invention sont
ceux répondant à la structure générale (Ib) dans laquelle Y représente un
groupement
méthylamino ou çyclopropylamino, R2 représente un atome d'iode ou de soufre,
un
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
groupe méthyle, propyle, cyclopropyle, perfluoroéthyle, perfluoropropyle,
trifluorométhyle, allyle, trifluorométhylvinyle, vinyle, 1 -propynyle ou
éthynyle, et R4
représente un atome d'hydrogène ou de fluor. Ces composés sont de très
puissants et
très sélectifs inhibiteurs de PDE4. Dans ce cas et de manière avantageuse, R3
sera par
5 exemple choisi pan-ni un atome d'iode, un groupe benzyle, 2-méthoxybenzyle,
2-
fluorobenzyle, 2-bromobenzoyle, furfuryle, 2-furylcarbonyle, 3-furylméthyle, 2-
thiénylméthyle, 3-thiénylméthyle, 2-pyridylméthyle, 2-chlorobenzoyle,
cyclopentyle,
et cyclohexyle.
D'autres composés avantageux au sens de l'invention sont ceux répondant
10 aux structures (Ta) et (Ib) dans lesquels X représente un atome d'oxygène,
Y
représente un groupement OH ou NH2, RI représente un atome d'hydrogène ou
éventuellement un groupement alkyle de 1 à 3 carbones, R3 représente un atome
d'hydrogène ou un groupement benzyle substitué, et R4 représente un atome
d'hydrogène ou de fluor. Ces composés sont alors de puissants inhibiteurs de
PDE2.
15 De manière très avantageuse, les composés sont choisis dans le groupe
constitué par les composés suivants:
8-Iodo-4-(N-méthyl-N-phénylamino)pyrazolo [1,5-a]-1,3,5-triazine.
8-Iodo-4-,[N-méthyl-N-(4-nitrophényl)amino]pyrazolo[ 1,5-a]-1,3,5-triazine.
8-Iodo-4-(triazol-4-yl)pyrazolo[ 1,5-a]-1,3,5-triazine.
20 8-Acétamido-2-méthylpyrazolo[1,5-a]-1,3,5-triazin-4-one.
4-[(Hydroxy) [4-(N-méthyl-N-phénylamino)pyrazolo[ 1,5-a]-1,3,5-triazin-8-yl]
méthyl]benzoate de méthyle.
8-[(2-Chlorophényl)(hydroxy)méthyl]-4-(N-méthyl-N-phénylamino)-2-n-propyl
pyrazolo[1,5-a]-1,3,5-triazine.
8-(2-Chlorobenzoyl)-4-(N-méthyl-N-phénylamino)-2-n propylpyrazolo[1,5-a]-1,3,5-
triazine.
8-(2-Chlorobenzoyl)-4-(N-méthylamino)-2-n-propylpyrazolo [ 1,5-a]-1,3,5-
triazine.
3-[4-(N-Méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazin-8-yl]acrylate
d'éthyle.
3-[4-(N-Méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazin-8-yl]propionate
d'éthyle.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
21
Acide 3-[4-(N-méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazin-8-yl]
propionique.
4-[[1-Oxo-3-[4-(N-méthyl-N-phénylamino)pyrazolo[ 1,5-a]-1,3,5-triazin-8-
yl]propyl]amino] benzoate de méthyle.
4-(Cyclopropylamino)-8-(2-fluorobenzoyl)-2-méthylpyrazolo[1,5-a]-1,3,5-
triazine.
4-(N-méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazine-8-carboxylate
d'éthyle.
3-[4-(N-Méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazin-8-yl]acrylate de
tert-
butyle.
3-[4-(N-Méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazin-8-yl]propionate de
tert-butyle.
4-(N-Méthyl-N phénylamino)-8-phénylpyrazolo'[1,5-a]-1,3,5-triazine.
4-(N-Méthyl-N-phénylamino)-8-((3-D-glycéro-pentofuran-3'-ulos-1 ' -yl)pyrazolo
[ 1,5-
a]-1,3,5-triazine.
8-,[(3 -Furyl) (hydroxy)méthyl] -4-(N-méthyl-N-phénylamino)-2 -n-
,propylpyrazolo
[1,5-a]-1,3,5-triazine.
8-(3-Furylméthyl)-2-n-propyl-4-(N-méthyl-N-phénylainino)pyrazolo[ 1,5-a]-1,3,5-
triazine.
2-Trifluorométhyl-8-(3-furylméthyl)-4-(cyclopropylamino)pyrazolo [ 1,5-a]-
1,3,5-
triazine.
2-Thiométhyl-8-(3-furylméthyl)-4-(N-méthylamino)pyrazolo[1,5-a]-1,3,5-
triazine.
8 -(3 -Furylméthyl)-4- (N-méthylamino)-2 -n-propyl-pyrazo l o [ 1, 5 -a] -1,
3, 5 -triazine.
2-Trifluorométhyl-8-cyclopentyl-4-(N-méthylamino)pyrazolo [ 1,5-a]-1,3,5-
triazine.
2-Pentafluoroéthyl-8-(2-méthoxybenzyl)-4-(N-méthylamino)pyrazolo[ 1,5-a]-1,3,5-
triazine.
4-(N-Cyclopropylamino)-2-trifluorométhyl-8-(2-méthoxybenzyl)pyrazolo[1,5-a]-
1,3,5-triazine.
4-(N-Cyclopropylamino)-8-(2-méthoxybenzyl)-2-n-propylpyrazolo [ 1,5-a]-1,3,5-
triazine.
2-Iodo-8-(2-méthoxybenzyl)-4-(N-méthylamino)pyrazolo [ 1,5-a]-1,3,5-triazine.
2-Bromo-8-(2-méthoxybenzyl)-4-(N-méthylamino)pyrazolo[1,5-a]-1,3,5-triazine.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
22
8-= [(Hydroxy)(2-thiényl)méthyl]-4-(N-méthyl-N-phénylamino)-2-n-propylpyrazolo
[1,5-a]-1,3,5-triazine.
8-(2-Chlorobenzoyl)-2-trifluorométhyl-4-(N-méthylamino)pyrazolo[ 1,5-a]-1,3,5-
triazine.
8-(2-Chlorobenzoyl)-2-pentafluoroéthyl-4-(N-méthylamino)pyrazolo[1,5-a]-1,3,5-
triazine.
8-(2-Chlorobenzoyl)-2-trifluorométhyl-4-(N-cyclopropylamino)pyrazolo [ 1,5-a]-
1,3,5-triazine.
4-(N-Méthyl-N-phénylamino)-2-n-propyl-8-(2-thiénylméthyl)pyrazolo[ 1,5-a]-
1,3,5-
triazine.
4-(N-Méthylamino)-2-n-propyl-8-;[(2-thiényl)méthyl]pyrazolo,[ 1,5-a]-1,3,5-
triazine.
4-(N-Méthylarnino)-2-trifluorométhyl-8-[(2-thiényl)méthyl]pyrazolo [ 1,5-a] -
1,3,5-
triazine.
4-(N-Cycloprop lamino)-2-trifluorométhyl-8-[(2-thién l)méthyl]pyrazolo[ 1,5-a]-
1,3,5-triazine.
N-[2-(3,4-Dihydroxyphényl)éthyl]-3 .[4-(N-méthyl-N-phén lamino)pyrazolo[ 1,5-
a]-
1,3,5-triazin-8-yl]propionamide.
3 - [4 - (N-Méthyl-N-ph ényl amino)pyr azo l o [ 1, 5 -a] -1, 3 , 5 -tri azin-
8 -yl) -N- [ 3 - (2 -
oxopyrrolidin-1-yl)propyl]propionamide.
N-[2-Hydroxy-2-(3,4-dihydroxyphényl)éthyl]-3-[4-(N-méthyl-N-
phénylamino)pyrazolo[ 1,5-a]-1,3,5-triazin-8-yl]propionamide.
Acide 3-(4-oxopyrazolo[1,5-a]-1,3,5-triazin-8-yl)propionique.
3-[4-Oxopyrazolo[1,5-a]-1,3,5-triazin-8-yl]acrylate d'éthyle.
4-[(Hydroxy)[4-oxopyrazolo[1,5-a]-1,3,5-triazin-8-yl]méthyl]benzoate de
sodium.
4-[[1-(Oxo)-3-(4-oxopyrazolo[1,5-a]-1,3,5-triazin-8-yl)propyl]amino]benzoate
de
sodium.
4-[2-(4-Oxopyrazolo[1,5-a]-1,3,5-triazin-8-yl)éthylsulfonylamino]benzoate de
sodium.
4-[ 1-Oxo-3-(2-amino-4-oxopyrazolo [ 1,5-a]-1,3,5-triazin-8-
yl)propylamino]benzoate
de sodium.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
23
4-[ 1-Oxo-3-(2-n-propyl-4-oxopyrazolo[1,5-a]-1,3,5-triazin-8-yl)propylamino]
benzoate de sodium.
4- [ 1-Oxo-3 -(2-trifluorométhyl-4-oxopyrazolo [ 1, 5-a] -1,3, 5 -triazin-8-
yl)propylamino]
benzoate de sodium.
N-[2-(lndol-3-yl)éthyl]-3-(4-oxopyrazolo[1,5-a]-1,3,5-triazin-8-
yl)propanamide.
N-[2-(Indol-3-yl)éthyl]-3-(2-amino-4-oxopyrazolo[1,5-a]-1,3,5-triazin-8-
yl)propanamide.
N-[1-(Carboxyl)-2-(indol-3-yl)éthyl]-3-(4-oxopyrazolo[ 1,5-a]-1,3,5-triazin-8-
yl)propanamide.
N-[2-(4-Hydroxyphényl)éthyl]-3-(4-oxopyrazoio[1,5-a]-1,3,5-triazin-8-
yl)propanamide.
N-[2-(4-Hydroxyphényl)éthyl]-3-(2-amino-4-oxopyrazolo,[1,5-a]-1,3,5-triazin-8-
yl)propanamide.
N [2-(4-Hydroxyphényl)éthyl]-3-(2-trifluorométhyl-4-oxopyrazolo;[1,5-a]-1,3,5-
triazin-8-yl)propanamide.
N-[ 1-(Carboxyl)-2-(4-hydroxyphényl)éthyl]-3-(4-oxopyrazolo[ 1,5-a]-1,3,5-
triazin-8-
yl)propanamide.
4-(N-Méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazine.
2-(4-Méthylbenzyl)-8-(2-oxohept-3-yl)pyrazolo[ 1,5-a]-1,3,5-triazin-4-one.
8-(2-Hydroxy-6-phénylhex-3-yl)-2-(3,4-diméthoxybenzyl)pyrazolo[1,5-a]-1,3,5-
triazin-4-one.
Erythro-8-(2-hydroxy-3-nonyl)pyrazolo[ 1,5-a]-1,3,5-triazin-4-one.
Erythro -4-amino- 8 -(2-hydroxy-3 -nonyl)pyrazo lo [ 1, 5 -a] -1, 3 , 5 -
triazine.
4- [ [3 -(1-Méthyl-4-oxopyrazolo [ 1, 5 -a] -1, 3, 5 -tri azin- 8 -yl)-1-
(Oxo)propyl] amino]
benzoate de sodium.
8-Benzoyl-2-cyclopropylpyrazolo [ 1, 5 -a] -1,3, 5 -triazin-4-one.
N-[2-(3,4-Dihydroxyphényl)éthyl]-3-(4-oxopyrazolo[ 1,5-a]-1,3,5-triazin-8-
yl)propionamide.
3-[4-Oxopyrazolo[ 1,5-a]-1,3,5-triazin-8-yl)-N-[3-(2-oxopyrrolidin-1-
yl)propyl]
propionamide.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
24
N--[2-Hydroxy-2-(3,4-dihydroxyphényl)éthyl]-3-[4-oxopyrazolo[ 1,5-a]-1,3,5-
triazin-
8-yl]propionamide.
8-(2'-Déoxy-(3-D-ribofuranosyl)-4-(N-méthyl-N-phénylamino)pyrazolo[ 1,5-a]-
1,3,5-
triazine.
8-(2'-Déoxy-p-D-ribofuranosyl)-4-[N-méthyl-N-(4-nitrophénylamino)]pyrazolo[1,5-
a]-1,3,5-triazine.
8-(2' -Déoxy-(3-D-xylofurano syl)-4-(N-méthyl-N-phénylamino)pyrazolo [ 1, 5-a]
-1,3, 5-
triazine.
8-(2' -D éoxy-(3-D-xylofuranosyl)-4-[(N-méthyl-N-(4-nitrophénylamino)]pyrazolo
[1,5-a]-1,3,5-triazine.
4-Amino-8-(2' -déoxy-J3-D-ribofuranosyl)pyrazolo[ 1,5-a]-1,3,5-triazine.
8-(2'-Déoxy-(3-D-ribofuranosyl)pyrazolo [ 1, 5-a]-1,3,5-triazin-4-one.
4-Amino-8-(2' -déoxy-[3-D-xylofuranosyl)pyrazolo[1,5-a]-1,3,5-triazine.
8-(2'-Déoxy-.(3-D-xylofuranosyl)pyrazolo,[ 1,5-a]-1,3,5-triazin-4-one.
4-amino-2-fluoro-8-[trans-2,trans-3-dihydroxy-4-(hydroxymethyl)cyclopent-4-
enyl]
pyrazolô [ 1,5-a]-1,3,5-triazine.
4-amino-8-[trans-2,trans-3-dihydroxy-4-(hydroxymethyl)cyclopent-4-enyl]
pyrazolo [ 1, 5 -a] -1, 3 , 5 -triazine.
2-fluoro-8-[trans-2,trans-3-dihydroxy-4-(hydroxyrnethyl)cyclopent-4-enyl]
pyrazolo
[1,5-a]-1,3,5-triazin-4-one.
8-[trans-2,trans-3-dihydroxy-4-(hydroxymethyl)cyclopent-4-enyl] pyrazolo[1,5-
a]-
1,3,5-triazin-4-one.
(1 S,4R)-2-amino-4-(cyclopropylamino)-8-[4-(hydroxyméthyl)cyclopent-2-èn-1-
yl]pyrazolo[ 1,5-a]-1,3,5-triazine.
cis-2-amino-4-(cyclopropylaniino)-8-[4-(hydroxyméthyl)cyclopent-2-èn-1-
yl] pyrazo lo [ 1, 5 -a] -1, 3 , 5 -triazine.
4-amino-7-chloro-8-((3-D-ribofuranosyl)pyrazolo[ 1,5-a]-1,3,5-triazine-3',5'-
cyclophosphate.
[2-[2-amino-4-(4-méthoxyphénylthio)pyrazolo[ 1,5-a]-1,3,5-triazin-8-
yl]ethoxy]methylphosphonate de bis-(2,2,2-trifluoroethyl).
4-amino-8-(3' -déoxy-(3-D-ribofuranosyl)pyrazolo [ 1,5-a]-1,3,5-triazine.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
8-(3' -déoxy-(i-D-ribofuranosyl)pyrazolo [1,5-a]-1,3,5-triazin-4-one.
2-amino-8-(3' -déoxy-(3-D-ribofuranosyl)pyrazolo [ 1,5-a]-1,3,5-triazin-4-one.
4-amino-2-chloro-8-(2'-déoxy-(3-D-ribofuranosyl)pyrazolo[ 1,5-a]-1,3,5-
triazine.
cis-2-amino-4-(cyclopropylamino)-8- [2-(hydroxymethyl)- 1,3 -dioxolan-4-
5 yl]pyrazolo[1,5-a]-1,3,5-triazine.
4-amino-8-(2',3'-didéoxy-2'-fluoro-(3-D-ribofuranosyl)pyrazolo[1,5-a]-1,3,5-
triazine.
4-amino-8-(2',3' -didéoxy-2'-fluoro-arabinosyl)pyrazolo[1,5-a]-1,3,5-triazine.
2-amino-8-[4-acétyloxy-3 -(acétyloxyméthyl)butyl]pyrazolo[1,5-a]-1,3,5-
triazine.
10 4-amino-2-chloro-8-(2'-déoxy-2'-fluoro-(3-D-ribofuranosyl)pyrazolo[1,5-a]-
1,3,5-
triazine.
4-amino-8-(2'-déoxy-2'-fluoro-(3-D-ribofuranosyl)pyrazolo[1,5-a]-1,3,5-
triazine.
8-(2'-déoxy-2' fluoro-,[3-D-ribofuranosyl)pyrazolo[1,5-a]-1,3,5-triazin-4-one.
S -.[[4-amino-8-(5'-deoxy '(3-D-ribofuranosyl)pyrazolo;[1,5-a]-1,3,5-triazine]-
5'-
15 yl]methionine (bioisostere de la S-adenosylmethionine).
2-amino-4-[(4-bromo-2-thiényl)méthoxy]pyrazolo[ 1,5-a]-1,3,5-triazine.
(R)-4-benzylamino-2-[1-(hydroxyméthyl)propylamino]-8-isopropylpyrazolo[ 1,5-a]-
1,3,5-triazine.
(S)-4-benzylamino-2- [ 1-(hydroxyméthyl)propyl amino] -8-isopropylpyrazolo,[
1,5 -a] -
20 1,3,5-triazine.
2'-(butyryl)-4-(N-butyrylamino)-8-((3-D-ribofuranosyl)pyrazolo[ 1,5-a]-1,3,5-
tri azine-3', 5' -cycl ophosphate.
cis-2,4-diamino-8 -[2-(hydroxymethyl)-1,3 -dioxolan-4-yl]pyrazolo [ 1,5 -a] -
1,3 ,5 -
triazine.
25 cis-2-amino-8-[2-(hydroxymethyl)-1,3-dioxolan-4-yl]pyrazolo[1,5-a]-1,3,5-
triazin-4-
one.
cis-8-[2-(hydroxymethyl)-1,3 -dioxolan-4-yl]pyrazolo[1,5-a]-1,3,5-triazin-4-
one.
cis-4-amino-8- [2-(hydroxymethyl)-1,3-dioxolan-4-yl]pyrazolo [1,5-a]-1,3,5-
triazine.
(1'S,2'R)-2-amino-8-[[ l',2'-bis(hydroxymethyl)cycloprop-1'-
yl]methyl]pyrazolo[ 1,5-
a]-1,3,5-triazin-4-one.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
26
(1'S,2'R)-8-[[l',2'- bis(hydroxymethyl)cycloprop-l'-yl]methyl]pyrazolo[1,5-a]-
1,3,5-
triazin-4-one.
(1'S,2'R)-4-amino-8-[[l',2'- bis(hydroxymethyl)cycloprop-l'-
yl]methyl]pyrazolo[1,5-
a]-1,3,5-triazine.
2-amino-8-[(2-hydroxyéthoxy)méthyl]pyrazolo[1,5-a]-1,3,5-triazin-4-one.
8-[(2-hydroxyéthoxy)méthyl]pyrazolo [ 1,5-a] -1,3,5-triazin-4-one.
4-amino-8-[(2-hydroxyéthoxy)méthyl]pyrazolo [ 1, 5-a]-1,3,5-triazine.
2-amino-8-[4-hydroxy-3-(hydroxymethyl)butyl]pyrazolo [1,5-a]-1,3,5-triazin-4-
one.
4-amino-8-[4-hydroxy-3-(hydroxymethyl)butyl]pyrazolo[ 1,5-a]-1,3,5-triazine.
'10 8-[4-hydroxy-3-(hydroxymethyl)butyl]pyrazolo[1,5-a]-1,3,5-triazin-4-one.
2-amino-8-[2-hydroxy-1-(hydroxymethyl)éthoxyméthyl]pyrazolô[ 1,5-a]-1,3,5-
triazin-4-one.
8-[2-hydroxy- 1 -(hydroxymethyl)éthoxyméthyl]pyrazolo'[ 1,5-a]-1,3,5-triazin-4-
.one.
4-amino-8-,[2-hydroxy-1-(hydroxymethyl)éthoxyméthyl]pyrazolo[ 1,5-a]-1,3,5-
triazine.
valinate de 2-[(2-amino-4-oxopyrazolo[1,5-a]-1,3,5-triazin-'8-
yl)méthoxy]éthyl.
8-(2',3'-didéoxy-(3-D-ribofuranosyl)pyrazolo [ 1,5-a]-1,3,5-triazin-4-one.
8-(2',3' -didéoxy-2',2'-difluoro-(3-D-ribofuranosyl)pyrazolo[ 1,5-a]-1,3,5-
triazin-4-
one.
8-(2'-déoxy-(3-D-ribofuranosyl)pyrazolo[1,5-a]-1,3,5-triazin-4-one.
[2-(4-aminopyrazolo[1,5-a]-1,3,5-triazin-8-yl)ethoxy]znethylphosphonate de bis-
(pivaloyloxymethyl).
[2-(4-aminopyrazolo[1,5-a]-1,3,5-triazin-8-yl)ethoxy]methylphosphonate de
sodium.
4-Amino-8-[2-[[bis(pivaloyloxymethyl)phosphonyl]methoxy]ethyl]pyrazolo[ 1,5-a]-
1,3,5-triazine.
cis-8-[2-(hydroxymethyl)-1,3-oxathiolan-5-yl]pyrazolo[1,5-a]-1,3,5-triazin-4-
one.
cis-8-[2-(hydroxymethyl)-1,3-oxathiolan-5-yl]-2-oxopyrazolo[ 1,5-a]-1,3,5-
triazin-4-
one.
cis-8-[2-(hydroxymethyl)-1,3-oxathiolan-5-yl]-2-thioxopyrazolo[ 1,5-a]-1,3,5-
triazin-
4-one.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
27
cis-2-amino-8-[2-(hydroxymethyl)- 1,3 -oxathiolan-5-yl]pyrazolo [ 1,5-a]-
1,3,5-triazin-
4-one.
cis-4-amino-8-[2-(hydroxymethyl)-1,3-oxathiolan-5-yl]pyrazolo[ 1,5-a]-1,3,5-
triazine.
8-[[(3R,4R)-3-hydroxy-4-(hydroxyméthyl)pyrrolidin-1-yl]méthyl]pyrazolo[1,5-a]-
1,3,5-triazin-4-one.
4-amino-8-[[(3R,4R)-3-hydroxy-4-(hydroxyméthyl)pyrrolidin-1-
yl] méthyl] pyrazo lo [ 1, 5 -a] -1, 3 , 5 -triazine.
Les composés de l'invention peuvent être sous forme de sels, notamment de
sels d'addition basique ou acide, préférentiellement compatibles avec un usage
pharmaceutique. Parmi les acides pharmaceutiquement acceptables, on peut
citer, à
titre non limitatif, les acides chlorhydrique, bromhydrique, sulfurique,
phosphorique,
acétique, trifluoroacétique, lactique, pyruvique, malonique, succinique,
glutarique,
furnarique, tartrique, maléique, citrique, ascorbique, méthane ou
éthanesulfonique,
camphorique, etc. Parmi les bases pharmaceutiquement acceptables, on peut
citer à
titre non limitatif, l'hydroxyde de sodium, l'hydroxyde de potassium, la
triéthylamine, la tert-butylamine, etc.
Les composés de l'invention peuvent également posséder un ou plusieurs
centre(s) asymétrique(s) et peuvent être isolés sous forme optiquement active
ou sous
forme de leur mélange racémique. Les méthodes permettant d'obtenir des formes
optiquement actives, par exemple par résolution d'une forme racémique ou par
synthèse utilisant des produits de départ racémiques sont bien connues par
l'homme
de l'art. De même, les isomères géométriques des oléfines ou des liaisons
doubles de
type C=N peuvent être isolés et caractérisés sous forme cis ou trans ou
peuvent être
utilisés sous forme de mixture cis et trans.
Selon l'invention, au moins un des atomes des molécules décrites peut être
remplacé par un isotope (atome qui possède le même nombre atomique mais une
masse différente). A titre non limitatif, on peut citer l'exemple des isotopes
de
l'atome d'hydrogène, tritium et deutérium, ainsi que ceux du carbone, C-13 et
C-14.
Selon l'invention, le terme "alkyle" désigne un radical hydrocarboné linéaire
ou ramifié ayant avantageusement de 1 à 6 atomes de carbone, tels que méthyle,
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
28
éthyle, propyle, isopropyle, butyle, isobutyle, tert-butyle, pentyle,
néopentyle, n-
hexyle. Les groupes en C1-C4 sont préférés. Les groupes alkyles peuvent être
substitués par un groupe aryle tel que défini ci-après, auquel cas on parle de
groupe
arylalkyle. Des exemples de groupes arylalkyles sont notamment benzyle et
phénéthyle.
Le terme cycloalkyle désigne un système hydrocarboné cyclique, pouvant
comprendre avantageusement de 3 à 6 atomes de carbone et être mono- ou poly-
cyclique. On peut citer notamment les groupes cyclopropyle et cyclohexyle.
Les groupes alcényles sont des radicaux hydrocarbonés linéaires, ramifiés
ou cyclique comportant une ou plusieurs double-liaisons. Ils comportent
avantageusement de 2 à 6 atomes de carbone et, préférentiellement, une ou deux
double-liaisons. Les groupes alcényles peuvent être substitués par un groupe
aryle tel
que défini ci-après, auquel cas on parle de groupe arylalcényle.
Les groupes alcynyles sont des radicaux hydrocarbonés linéaires ou
ramifiés comportant une ou plusieurs triple-liaisons. Ils comportent
avantageusement
de 2 à 6 atomes de carbone et, préférentiellement, une ou deux triples-
liaisons. Les
groupes alcynyles peuvent être substitués par un groupe aryle tel que défini
ci-après,
auquel cas on parle de groupe arylalcynyle.
Les groupes alcoxy correspondent aux groupes alkyles et cycloalkyles
définis ci-dessus reliés au noyau par l'intermédiaire d'une liaison -O-
(éther). On
préfère tout particulièrement les groupes méthoxy, éthoxy, n-propyloxy, i-
propyloxy,
n-butoxy, s-butoxy, t-butoxy, n-pentoxy, et s-pentoxy.
Les groupes acyles correspondent aux groupes alkyles, cycloalkyles et
aryles définis ci-dessus reliés au noyau par l'intermédiaire d'une liaison -
CO. Comme
exemple de groupes acyles, on peut notamment citer les groupes acétyle,
propionyle,
cyclohexylcarbonyle et benzoyle.
Les groupes aryles sont des systèmes hydrocarbonés aromatiques mono-,
bi- ou tri-cycliques, préférentiellement des systèmes hydrocarbonés
aromatiques
monocycliques ou bi-cycliques ayant de 6 à 18 atomes de carbone, encore plus
préférentiellement 6 atomes de carbone. On peut citer par exemple les groupes
phényle, naphthyle et bi-phényle.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
29
Les groupes hétéroaryles désignent des systèmes hydrocarbonés
aromatiques tels que définis ci-dessus comprenant un ou plusieurs hétéroatomes
cycliques. Il s'agit préférentiellement de systèmes hydrocarbonés aromatiques
cycliques comportant de 5 à 18 atomes de carbone et un ou plusieurs
hétéroatomes
cycliques, notamment de 1 à 4 hétéroatomes cycliques choisis parmi N, O ou S.
Parmi les groupes hétéroaryles préférés, on peut citer notamment les groupes
benzothiényle, benzofuryle, pyrrolidinyle, thiazolyle, thiényle, furyle,
pyranyle,
pyrrolyle, 2H-pyrrolyle, imidazolyle, benzymidazolyle, pyrazolyle,
isothiazolyle,
isoxazolyle et indolyle, cette liste n'étant pas limitative.
Les groupes aryles et hétéroaryles peuvent être substitués par un groupe
alkyle, alcényle ou alcynyle tels que définis ci-dessus. Dans le cas, d'un
aryle ou
d'un hétéroaryle substitué par un groupe alkyle on parie de groupe alkylaryle.
Des
exemples de groupe alkylaryle sont notamment tolyle, mésythyle et xylyle. Dans
le
cas d'un aryle ou d'un hétéroaryle substitué par un groupe alcényle on parle
de
groupe âlcénylaryle. Des exemples de groupe alcénylaryle sont notamment le
groupe
cinnamyle. Dans le cas d'un aryle ou d'un hétéroaryle substitué par un groupe
alkynyle on parle de groupe alcynylaryle.
Les hétérocycles désignent des systèmes hydrocarbonés aromatiques ou non
comprenant un ou plusieurs hétéroatomes cycliques. Il s'agit
préférentiellement de
systèmes hydrocarbonés cycliques comportant de 5 à 18 atomes de carbone et un
ou
plusieurs hétéroatomes cycliques, notamment de 1 à 4 hétéroatomes cycliques
choisis
parmi N, O ou S. Parmi les hétérocycles préférés, on peut citer notamment la
morpholine, la pipérazine, la pipéridine, le tétrahydrofurane, l'oxazolidine,
l'isoxazoline, cette liste n'étant pas limitative.
Par halogène , on entend un atome de fluor, de chlore, de brome ou d'iode.
Par hétéroatome on entend un atome choisi parmi O, N et S.
Les composés selon l'invention sont capables notamment d'augmenter la
synthèse et/ou la libération de facteurs neurotrophiques
Parmi les facteurs de croissance induits par l'administration de ces nouveaux
dérivés, on peut notamment citer à titre non limitatif : le NGF (nerve growth
factor),
le NT-3, le BDNF (brain-derived neurotrophique factor), le facteur
neurotrophique
CA 02493402 2010-09-16
ciliaire (CNTF), le bFGF (basic fibroblast growth factor), la neurotrophin-3,
la
protéine S-100 béta (Rathbone, M.P. et al. Prog. Neurobiol. (1999), 59, 663-
690),
ainsi que d'autres facteurs neurotrophiques impliqués dans la survie et dans
la
régénération de neurones sensitifs ou moteurs. Cette augmentation de la
synthèse
5 et/ou de la libération de facteur(s) neurotrophique(s) est la conséquence
d'une
modulation de la guanylate cyclase dépendante du monoxyde de carbone et/ou de
l'inhibition d'une phosphodiestérase. Dans les deux cas, une augmentation des
taux
intracellulaires de GMPc sera observée.
Les composés selon l'invention peuvent agir sur l'une ou l'autre enzyme
10 (guanylate cyclase ou phosphodiestérase) ou combiner une action simultanée
sur ces
deux cibles. Dans ce dernier cas, une action synergique sera obtenue et se
traduira
par une forte augmentation intracellulaire de GMPc éventuellement associée à
une
augmentation d'AMPc. Pour certains états ou certaines pathologies, un
inhibiteur
mixte -de phosphodiesterase, c'est-à-dire un inhibiteur agissant à la fois sur
au moins
15 deux familles différentes de phosphodiestérase (notamment les PDE2 et PDE4)
sera
préféré. Par exemple, un inhibiteur de phosphodiestérase de type 4 (PDE4)
permettra
de traiter la composante inflammatoire relative aux états ou pathologies
ciblés. Cet
effet anti-inflammatoire est notamment la conséquence d'une forte diminution
dose
dépendante de la production de facteur nécrosant des tumeurs de type alpha
(TNF-a)
20 par les cellules pro-inflammatoires. Par ailleurs, un inhibiteur de PDE4
permettra
également de traiter la dépression, la démence ou encore l'anxiété.
Les composés de l'invention sont aussi utiles pour la préparation d'un
médicament destiné à augmenter la sécrétion d'un ou de plusieurs facteurs
neurotrophiques pour traiter ou prévenir des pathologies impliquant une
25 dégénérescence neuronale.
Certaines molécules selon l'invention sont des inhibiteurs puissants et
sélectifs de la phosphodiestérase de type 4 (PDE4), pouvant agir simultanément
ou
non, sur l'augmentation de la synthèse et de la libération d'un ou de
plusieurs
facteurs neurotophiques. Ces inhibiteurs de PDE4 ont démontré un effet anti-
30 inflammatoire marqué pouvant avantageusement être mis en oeuvre pour le
traitement et la prévention de maladies inflammatoires et auto-immunes. Les
CA 02493402 2010-09-16
30a
inhibiteurs de PDE4 (IPDE4) sont particulièrement intéressants pour le
traitement
de l'asthme et des bronchopathies chroniques obstructives, mais également
d'autres affections comme les rhinites, le syndrome de détresse respiratoire
aiguë, les
allergies, les dermatites, le psoriasis, l'arthrite rhumatoïde, les scléroses
multiples
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
31
(notamment la sclérose en plaques), les dyskinésies, les glomérulonéphrites,
l'ostéoarthrite, le cancer, le choc septique, le sida, la maladie de Crohn,
l'ostéoporose ou de l'arthrite rhumatoïde, ou l'obésité. Les IPDE4 sont
également
pourvus d'effets centraux particulièrement avantageux pour le traitement de la
dépression, de l'anxiété, de la schizophrénie, du désordre bipolaire, des
défauts de
l'attention, de la fibromyalgie, des maladies de Parkinson et d'Alzheimer, de
la
sclérose amyotrophique, des scléroses multiples, des démences des corps de
Lewy et
d'autres désordres psychiatriques. Les nouveaux inhibiteurs de PDE4 sont
avantageusement dépourvus d'effet émétique et hypotenseur.
Certains composés de l'invention sont avantageusement doués d'effets anti-
inflammatoires, de propriétés immunomodulatrices, neurologiques,
antimicrobiens,
antiviraux ou encore d'effets cardiovasculaires. Ces propriétés associées à
l'activité
principale peuvent être dues à un pharmacophore différent de celui permettant
d'engendrer la propriété principale. L'association de ces deux propriétés au
sein
d'une même molécule est particulièrement avantageuse pour le traitement des
maladies d'Alzheimer et de Parkinson, du Sida, du diabète, ainsi que des
troubles de
la mémoire, notamment ceux liés à la sénescence. Dans certains cas, une
propriété
inhibitrice de PDE, des kinases dépendantes des =cyclines, de la
monoaminooxygénase ou du transporteur `multidrogue' permettra d'obtenir ces
propriétés associées.
Les composés selon l'invention sont en outre avantageusement doués d'un
excellent tropisme central et avantageusement dénué d'effet hyperalgique et
pro-
inflammatoire. D'autres composés sont avantageusement dénués d'effets centraux
et
pénètrent de manière très faible le système nerveux central.
L'invention concerne également les procédés de préparation des composés de
formule (I).
Les composés de l'invention peuvent être préparés à partir de produits du
commerce, en mettant en oeuvre une combinaison de réactions chimiques connues
de
l'homme du métier.
A cet égard, selon un premier procédé, les composés de formule générale (Ib)
selon l'invention dans lesquels Y est différent de chlore et de brome peuvent
être
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
32
obtenus à partir d'un composé de formule (lb) dans laquelle Y est un atome de
chlore
ou de brome en mettant en oeuvre les méthodes suivantes :
1. lorsque Y dans la formule du produit final (Ib) est un groupe NR,XRy, par
réaction
avec une amine de formule HNR,,Ry, dans un solvant organique à température
ambiante. Comme solvant, on peut citer en particulier le dichlorométhane ou le
diméthylformamide.
2. lorsque Y dans la formule du produit final (Ib) est un groupe (C1-C6)
alkyle, par
réaction avec un composé de formule YLi, dans un solvant anhydre à une
température comprise entre -80 et -20 C, de préférence aux alentours de -78
C.
Comme solvant, on peut citer les éthers, notamment le tétrahydrofurane.
3. lorsque Y dans la formule du produit final (Ib) est un groupe (Cl-C6) alcyn-
l-yle,
par réaction avec un composé de formule YH, dans lequel Y est un acétylénique
vrai,
en présence d'iodure de cuivre, de chlorure de palladium, de triphényl
phosphine et
d'une base, par exemple la triéthylamine. Comme solvant, on peut utiliser
notamment l'acétonitrile; la réaction est effectuée de préférence à
température
ambiante
4. lorsque Y dans la formule du produit final (Ib) est un groupe (C6-
C12)aryle, par
réaction avec un composé aromatique, par exemple la N,N-diméthylaniline à une
température comprise entre 80 et 130 C, de préférence aux environs de 120 C
et en
tube scellé. Comme solvant, on préfère utiliser un solvant aprotique polaire,
par
exemple le chloroforme. Ces composés peuvent être obtenus par un couplage au
palladium en utilisant par exemple un acide boronique en présence d'une base,
par
exemple le bicarbonate de sodium.
5. lorsque Y dans la formule du produit final (Ib) est un groupe OR,,, par
réaction
avec un alcool de formule HOR,, à température ambiante. Si R,t est égal à OH,
l'alcool sera remplacé dans cette réaction par de l'eau ou un hydroxyde, par
exemple
l'hydroxyde de sodium.
6. lorsque Y dans la formule du produit final (Ib) est un groupe SR,,, par
réaction
avec un thiol de formule R,XSH. Comme solvant on peut citer notamment le
tétrahydrofurane.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
33
7. les composés où Y dans la formule du produit final (Ib) est un groupe SH
peuvent
être obtenus directement en traitant les composés où Y est un groupe OH par le
réactif de Lawesson.
Les composés de formule générale (Ib) selon l'invention dans lesquels Y est
différent de chlore peuvent également être obtenus à partir d'un composé de
formule
(Ib) dans laquelle Y est un groupement NRXRy particulier par exemple, un
groupement N-méthyl-N-phénylamino, N-méthyl-N-(4-nitrophényl)amino, N-méthyl-
N-(4-acylaminophényl)amino ou triazole en mettant en oeuvre les méthodes
suivantes:
1. Lorsque Y dans la formule du produit final est un groupe NRXRy, par
réaction avec
une amine de formule HNRXRy, dans un solvant protique à une température
comprise
entre 10 C et 130 C, de préférence autour de 90 C dans un tube scellé. Comme
solvant, on peut citer en particulier le méthanol ou l' éthanol.
2. lorsque Y dans la formule du .produit f nal (Ib) est un groupement
hydroxyle (OH),
par réaction avec un 'hydroxyde, par exemple l'hydroxyde de sodium, dans un
solvant protique à une température comprise entre -10 et 100 C, de préférence
aux
alentours de 25 C. Comme solvant, on peut citer les alcools, ou les mélanges
alcool-
eau notamment l'éthanol ou le mélange éthanol-eau.
Les composés de formule générale (I) selon l'invention dans lequel RI
représente
un groupe (CI-C12) alkyle peuvent être préparés à partir des composés de
formule
générale (I) où R1 est égal à H, par une réaction d'alkylation utilisant une
base, et un
agent alkylant. Comme base on peut notamment citer le carbonate de potassium
et
l'hydrure de sodium. Les agents alkylants préférés sont les halogénures ou les
époxydes. La présence d'un catalyseur de transfert de phase permet; selon les
cas,
d'améliorer les rendements de réaction.
Les composés de formule générale (I) dans laquelle X = S selon l'invention
peuvent être obtenus à partir d'un composé de formule (I) dans laquelle X = O
par
une réaction utilisant le réactif de Lawesson dans un solvant organique, par
exemple
le toluène.
Les composés de formule générale (Ia) et (lb) selon l'invention dans
lesquelles
R1=H peuvent être préparés par un procédé comprenant les étapes suivantes:
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
34
a) réaction d'un composé de formule générale (V)
HN,1 N R4
H2N R3
(V)
dans laquelle R3 et R4 sont tels que définis précédemment;
avec un composé comprenant un groupe de formule R2C(GP)=NH, dans laquelle
R2 est tel que défini précédemment et GP représente un groupement partant, par
exemple un atome d'halogène, un groupement (C1-C4)alcoxy ou un groupement
thio(C1-C4)alkyle, pour obtenir un composé de formule (VI)
HN~ N R4
HN
N R3
R2 H (VI)
dans laquelle R2, R3, et R4 sont tels que définis précédemment ;
b) réaction du composé de formule (VI) avec un diélectrophile, par exemple le
carbonate de diéthyle ou un orthoester, pour obtenir un composé de formule
(la) ou
(Ib) dans lesquelles R2, R3, R4, X et Y sont tels que définis précédemment et
RI est
égal à H.
Le composé comprenant un groupe de formule R2C(GP)=NH de l'étape a) est
de préférence un imidate de formule R2(OMe)=NH.HCI, dans lequel R2 est tel que
défini précédemment. La réaction est avantageusement effectuée en présence
d'une
base, par exemple l'acétate de sodium, dans un solvant inerte à température
ambiante. On peut citer comme solvant l'acétonitrile. En fin de réaction, le
produit
est obtenu dans ce cas sous forme d'acétate.
L'étape b) est effectuée avantageusement en présence d'une base, par
exemple l'éthanolate de sodium, à une température comprise entre 20 et 150 C
de
préférence aux alentours de 100 C, lorsque le diélectrophile utilisé est le
carbonate
d'éthyle, pendant une durée comprise entre 3 et 48 heures, de préférence
autour de
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
24 heures. Dans ce cas, un composé de formule générale (VII) est obtenu, dans
laquelle R2, R3 et R4 sont tels que définis précédemment.
O
HN N--N
~\ \ R4
R/ 'N \
2
(VII) R3
Selon une autre variante de l'invention, les composés de formule générale
5 (Ib) selon l'invention peuvent être obtenus à partir d'un composé de formule
(VII),
dans laquelle R2, R3 et R4 sont tels que définis ci-avant, en mettant en
oeuvre les
méthodes suivantes :
1. lorsque Y dans la formule du produit final est un groupe NRXRY, par
réaction avec de l'oxychlorure de phosphore (POC13) et une amine tertiaire,
par
10 exemple la NN-diméthylaniline dans un solvant aprotique à -une température
comprise entre 60 C et 140 C pour obtenir un composé de formule (VIII)
Cl
N/\N.-N
R4
R2 N
(VIII) R3
dans laquelle R2, R3 et R4 sont tels que définis précédemment. Ce composé
(VIII)
peut être isolé ou directement converti en un composé de formule générale (Ib)
dans
15 laquelle Y est un groupe NR,rRy, par réaction avec une amine de formule
HNRXRy, à
température ambiante.
2. lorsque Y dans la formule du produit final est un groupe NPhCH3, par
réaction avec de l'oxychlorure de phosphore (POCl3) et de la N,N-
diméthylaniline
dans un solvant aprotique à une température comprise entre 60 C et 140 C pour
20 obtenir un composé de formule (IX)
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
36
\ I
H3C,, N
NN--N
\ ~ R4
R/ 'N
2
(IX) R3
dans laquelle R2, R3 et R4 sont tels que définis précédemment.
3. lorsque Y dans la formule du produit final (Ib) est un groupe SH, par
réaction
avec le réactif de Lawesson dans un solvant aprotique.
Selon une autre variante de l'invention, les composés de formule générale
(Ib) selon l'invention peuvent être obtenus à partir d'un composé de formule
(IX) en
mettant en oeuvre les méthodes suivantes :
1. lorsque Y dans la formule du produit final (Ib) est un groupe NRXRy, par
réaction avec une amine de formule HNRXRy, dans un solvant protique, à une
température comprise entre 20 C et 130 C, de préférence autour de 100 C. Comme
solvant on peut citer l'éthanol.
2. lorsque Y dans la formule du produit final (lb) est un groupe OH, par
réaction
avec un hydroxyde, par exemple l'hydroxyde de sodium, dans un solvant
protique, à
une température comprise entre 20 C et 130 C, de préférence autour de 100 C.
Comme solvant on peut citer l' éthanol.
3. lorsque R3 dans la formule du produit final (Ib) est un groupe acyle, par
réaction d'un chlorure d'acide, de préférence en présence d'un acide de Lewis,
à une
température comprise entre 20 C et 80 C, de préférence autour de 60 C avec un
composé de formule (IX) dans laquelle R3 est un atome d'hydrogène. Cette
réaction
est avantageusement conduite en l'absence de solvant. Parmi les acides de
Lewis on
peut notamment citer le chlorure d'étain (IV).
4. lorsque R3 dans la formule du produit final (Ib) est un groupe nitro, par
réaction de l'acide nitrique, de préférence dans un milieu protique. Dans ce
cas un
produit de formule générale (X) est obtenu de manière majoritaire
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
37
N O2
H3CI,
N
Nj\N--N
R4
R2 N
(X) NO dans laquelle R2 et R4 sont tels que définis précédemment.
Selon une autre variante de l'invention, les composés de formule générale (Ib)
selon l'invention peuvent être obtenus à partir d'un composé de formule (X)
par un
procédé comprenant les étapes suivantes:
1. l'hydrogénation catalytique, par exemple en présence de palladium sur
charbon.
Un composé de formule générale (XI) est alors obtenu
NI-12
'H3CI1N, A
N/\N-- N
R2 N >- R4
(XI) NH2
dans laquelle R2 et R4 sont tels que définis précédemment.
2. l'acylation d'un composé de structure générale (XI) en utilisant un agent
acylant,
de formule générale Acyl-GP où GP a les mêmes significations que précédemment.
Comme agent acylant on peut citer les chlorures d'acide. Cette réaction est
avantageusement conduite dans un solvant organique en présence d'une base.
Comme base on peut citer la triéthylamine et comme solvant le dichlorométhane.
Un
composé de formule générale (XII) est alors obtenu
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
38
H
~. N
~Acyl
H3Cll N
NN
~\ \ R4
RJ
2 N
(XII) H,Acyl
dans laquelle R2 et R4 sont tels que définis précédemment.
3. le composé de formule générale (XII) est transformé en composés de formule
générale (Ib) selon l'invention par action d'un nucléophile de formule
générale YH
ou Y-, dans laquelle Y est tel que défini précédemment. Y peut par exemple
être une
aminé de type HNRXRy ou l'anion hydroxyde.
Selon une autre variante de l'invention, les composés de formule générale
(Ib) selon l'invention peuvent être obtenus à partir d'un composé de formule
(XIII)
RXI-1 N,'Ry
N--N
R4
Rz "-41
N
(XIII) Hal
dans laquelle RX, Ry, R2 et R4 sont tels que définis précédemment et Hal
représente
un atome d'halogène, de préférence un atome d'iode, en mettant en oeuvre les
méthodes suivantes :
1. une réaction de couplage au palladium en présence d'un acide boronique ou
d'un
alcène ou d'un alcyne ou de tout autre réactif classiquement utilisé dans ce
type de
réaction de couplage, à une température comprise entre 10 et 130 C.
2. par action d'une base forte, par exemple le n-butyllithium à une
température
comprise entre -20 C et -80 C, de préférence à -78 C. Un carbanion est alors
obtenu en position 8 de la pyrazolo[1,5-a]-1,3,5-triazine. Ce carbanion peut
ensuite
être couplé avec différents agents électrophiles. Comme agents électrophiles
les
aldéhydes seront préférés.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
39
Selon une autre variante de l'invention, les composés de formule générale (la)
ou
(Ib) où R3 est un groupement acyle peuvent être obtenus selon l'invention à
partir
d'un composé de formule (la) ou (Ib) dans lesquelles R3 est un atome
d'hydrogène,
par réaction d'un chlorure d'acide, de préférence en présence d'un acide de
Lewis, à
une température comprise entre 20 C et 80 C, de préférence autour de 60 C avec
un
composé de formule (IX) dans laquelle R3 est un atome d'hydrogène. Cette
réaction
est avantageusement conduite en l'absence de solvant. Parmi les acides de
Lewis on
peut notamment citer le chlorure d'étain (IV).
Les composés de formule générale (VII) peuvent être préparés par réaction d'un
composé de formule générale (XIV)
O
N
R4
H2N
H2N 'R3
(XIV)
dans laquelle R3 et R4 sont tels que définis précédemment, avec un composé
comprenant un agent électrophile, par exemple un orthoester, à une température
comprise entre 10 et 140 C, de préférence autour de 100 C.
L'invention a également pour objet une composition pharmaceutique
comprenant au moins un composé de formule (I) et un véhicule ou un excipient
acceptable sur le plan pharmaceutique.
L'invention a également pour objet l'utilisation d'au moins un composé de
formule (I) pour la fabrication d'un médicament destiné à traiter ou à
prévenir une
maladie humaine ou animale pour laquelle une augmentation de la synthèse et/ou
la
libération de facteurs neurotrophiques est recherchée.
L'invention a également pour objet l'utilisation d'au moins un composé de
formule (I), pour la fabrication d'un médicament destiné à traiter ou à
prévenir une
maladie humaine ou animale pour laquelle une inhibition d'au moins une
phosphodiestérase des nucléotides cycliques choisis parmi PDE2 et PDE4 est
recherchée. Les inhibiteurs de PDE4 sont avantageusement dépourvus d'effet
émétique et peuvent avantageusement être sélectifs vis-à-vis d'un sous-type de
PDE4
choisi parmi PDE4A-D.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
L'invention concerne plus particulièrement l'utilisation des composés de
formule (I) pour la fabrication d'un médicament destiné à traiter ou à
prévenir des
pathologies impliquant une dégénérescence neuronale.
Ainsi les compositions pharmaceutiques contenant les composés selon
5 l'invention, notamment les pyrazolo[1,5-a]-1,3,5-triazines substituées
peuvent être
utilisées dans le traitement de troubles neurodégénératifs ou neurologiques
des
systèmes central et périphérique, y compris les troubles cognitifs liés à
l'âge, tels que
la sénilité et la maladie d'Alzheimer, les lésions des nerfs, les maladies à
prions
(notamment les encéphalopathies spongiformes de type maladie de Creutzfeldt-
10 Jakob), les neuropathies périphériques, y compris les neuropathies
associées à
l'administration de médicaments (oncolytiques...), le syndrome de Down, les
accidents vasculaires cérébraux et les affections avec spasmes telles que
l'épilepsie.
Les composés selon l'invention sont particulièrement intéressants dans le
traitement
de pathologies ou d'états dans lesquels les fonctions neuronales centrales ou
15 périphériques, sont altérées, et plus particulièrement dans des états ou
maladies
résultant d'une mort neuronale excessive comme les troubles neurodégénératifs
ou
neurologiques des systèmes centraux et périphériques de nature chronique ou
aiguë.
On peut notamment citer à titre non limitatif les troubles cognitifs et
mentaux liés à
l'âge (notamment la sénilité), la maladie d'Alzheimer, la maladie de
Parkinson, la
20 sclérose amyotrophique latérale, le syndrome de Down, les scléroses
multiples, la
maladie de Huntington's, les accidents vasculaires cérébraux, les neuropathies
périphériques (y compris les neuropathies associées à la prise de médicaments
ou au
diabète), les rétinopathies (notamment la rétinite pigmentaire), les
traumatismes
(accidents au niveau de la colonne vertébrale, compression du nerf optique
suite à un
25 glaucome et de manière générale toute lésion de nerfs centraux ou
périphériques...),
ou encore les troubles neuronaux causés par l'action de produits chimiques,
ainsi que
les troubles associés à ces états ou maladies qui peuvent être des troubles
secondaires
à la pathologie primaire. Dans de nombreux cas cités, c'est le plus souvent la
mort
progressive de motoneurones et/ou neurones sensitifs qui seront à l'origine
des
30 troubles observés. Dans certains cas, les compositions pharmaceutiques
contenant les
composés selon l'invention, notamment les pyrazolotriazines substituées,
peuvent
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
41
être dénuées d'effet neurotrophique mais agir fortement comme inhibiteur de
PDE2
ou de PDE4 ou combiner une action simultanée sur ces deux enzymes (inhibiteur
de
PDE2/PDE4 mixte). Ces composés sont particulièrement intéressants pour le
traitement des maladies inflammatoires et autoimmunes.
Ce traitement peut également être administré à titre préventif, à des patients
risquant de développer ces mêmes maladies.
Certains composés de l'invention présentent des effets anti-inflammatoires,
des propriétés immunomodulatrices, neurologiques, antimicrobiennes,
antivirales ou
encore des effets cardiovasculaires. L'association de ces deux propriétés au
sein
d'une même molécule est particulièrement avantageuse pour le traitement des
maladies d'Alzheimer et de Parkinson, du Sida, ainsi que des troubles de la
mémoire,
notamment ceux liés à la sénescence.
Les composés de l'invention sont également particulièrement intéressants
pour le traitement de pathologies du système nerveux central, telles que plus
spécifiquement la dépression, la schizophrénie, ,le désordre bipolaire, les
désordres de
défaut d'attention, les affections avec spasmes telle que l'épilepsie la
fibromyalgie, la
démence des corps de Lewy (< Lewy body dementia ).
Au sens de l'invention, le terme traitement désigne aussi bien un traitement
préventif que curatif, qui peut être utilisé seul ou en combinaison avec
d'autres
agents ou traitements. En outre, il peut s'agir d'un traitement de troubles
chroniques
ou aigus.
Les composés ou compositions selon l'invention peuvent être administrés de
différentes manières et sous différentes formes. Ainsi, ils peuvent être
administrés
par voie injectable ou orale, comme par exemple par voie intraveineuse,
intramusculaire, sous-cutanée, trans-dermique, intra-artérielle, etc., les
voies
intraveineuse, intramusculaire, sous-cutanée et orale étant préférées. Pour
les
injections, les composés sont généralement conditionnés sous forme de
suspensions
liquides, qui peuvent être injectées au moyen de seringues ou de perfusions,
par
exemple. A cet égard, les composés sont généralement dissous dans des
solutions
salines, physiologiques, isotoniques, tamponnées, etc., compatibles avec un
usage
pharmaceutique et sont connues de l'homme du métier. Ainsi, les compositions
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
42
peuvent contenir un ou plusieurs agents ou véhicules choisis parmi les
dispersants,
solubilisants, stabilisants, conservateurs, etc. Des agents ou véhicules
utilisables dans
des formulations liquides et/ou injectables sont notamment la méthylcellulose,
l'hydroxyméthylcellulose, la carboxyméthylcellulose, le polysorbate 80, le
mannitol,
la gélatine, le lactose, des huiles végétales, l'acacia, etc.
Les composés peuvent également être administrés sous forme de gels, huiles,
comprimés, collyres, suppositoires, poudres, gélules, capsules, etc.,
éventuellement
au moyen de formes galéniques ou de dispositifs assurant une libération
prolongée
et/ou retardée. Pour ce type de formulation, on utilise avantageusement un
agent tel
que la cellulose, des carbonates ou des amidons.
Il est entendu que le débit et/ou la dose injectée peuvent être adaptés par
l'homme du métier en fonction du patient, de la pathologie concernée, du mode
d' administration, ,etc.
Typiquement, les composés sont administrés à des doses pouvant varier entre
0,1 pg et 100 mg/kg de poids corporel, plus généralement de 0,01 à 50 mg/kg,
typiquement entre 0,1 et 50 mg/kg. En outre, des injections répétées peuvent
être
réalisées, le cas échéant. D'autre part, pour des traitements chroniques, des
systèmes
retard ou prolongés peuvent être avantageux.
L'invention est illustrée par les exemples et la figure qui suivent, qui
doivent
être considérés comme illustratifs et non limitatifs.
Les exemples 1 à 3 concernent la synthèse chimique et les exemples 4-7
illustrent l'activité pharmacologique des composés de l'invention.
La figure 1 représente l'effet de la molécule Ia5 sur les neurones en culture.
Les neurones sont mis en culture dans le milieu Neurobasal à partir du cortex
cérébral de rat foetal selon le mode opératoire décrit dans l'exemple 4 et
sont
photographiés sans coloration 17 jours après la mise en culture. La culture A
est une
culture témoin sans composé. La molécule Ia5 a été ajoutée à la culture B au
Sème
jour après la mise en culture à la concentration de 50 M.
EXEMPLE 1 : SYNTHESE DES COMPOSES DE FORMULE VI-XIII
(intermédiaires de synthèse)
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
43
Les produits de départ sont disponibles dans le commerce ou peuvent être
synthétisés par des méthodes classiques connues de l'homme du métier.
Acétate de N-(pyrazol-3-yl)acétamidine.NaC1 (VIa). Ajouter sous argon à une
solution de 500 mg de 3-aminopyrazole et de 692 mg de chlorhydrate
d'iminoacétate
de méthyle dans 10 mL de CH3CN, 516 mg d'AcONa. Laisser sous agitation à
température ambiante pendant 12 heures. Filtrer et laver 2 fois avec 2 mL de
CH3CN
et 2 fois avec 5 mL d'Et2O. On obtient 1,34 g d'une poudre blanche, Rdt : 92%.
Pf :
159 C. 1H-RMN (300MHz, DMSO-d6) : 1,89 (s, 3H, CH3)1 1,98 (s, 3H, CH3), 5,86
(s, 1H pyrazole), 7,54 (s, 1H pyrazole).
Acétate de N-(pyrazol-3-yl)trifluoroacétamidine (VIb). Ajouter sous argon à
une
solution de 1,18 g de 3-aminopyrazole dans 15 mL de CH3CN, 3,4 g .de S-p-
chlorophényltrifluorothioacétimidate. Après 5 minutes, ajouter 812 L d'AcOH
au
goutte à goutte. Après 8 heures, évaporer à sec. Ajouter 5 mL d'Et2O et 30 mL
d'hexane. Laisser sous agitation vigoureuse pendant 30 minutes. Filtrer. Laver
2 fois
avec 5 mL d'hexane, puis 2 fois avec 5 mL d'H20. M : 178,12. Rdt = 93%. Pf :
132 C.1H-RMN (200MHz, CDC13) : 6,38 (d, J= 2,4, 1H pyrazole), 7,51 (d, J= 2,4,
IH pyrazole).
Pyrazolo[1,5-a]-1,3,5-triazin-4-one (VIIa). Chauffer à reflux pendant 36
heures une
solution de 1,0 g de 5-amino-2-pyrazolecarboxamide et de 3,0 mL
d'orthoformiate
de triméthyle dans 50 mL de CH3CN. Laisser revenir à température ambiante.
Laisser cristalliser pendant 2 jours. Filtrer les cristaux. Recristalliser
dans CH3CN.
On obtient le produit titre sous forme de cristaux incolores.
2-Méthylpyrazolo[1,5-a]-1,3,5-triazin-4-one (VIIb). Ajouter 125 mg de Na à 10
mL d'EtOH anhydre. Lorsque le Na est entièrement consommé, ajouter sous
atmosphère inerte à cette solution, 200 mg d'acétate de N-(pyrazol-3-
yl)acétamidine.NaC1 (VIa) et 605 gL de carbonate de diéthyle. Chauffer à
reflux
pendant 5 heures. Evaporer à sec. Reprendre dans 10 mL d'eau glacée. Ajouter
une
solution d'HCl O,1N jusqu'à pH = 7 (contrôle au papier pH). Evaporer à sec.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
44
Reprendre dans 7 mL d'eau glacée. Laisser cristalliser pendant 2 heures.
Filtrer.
Recristalliser dans EtOH/Et2O. On obtient 110 mg du produit titre sous forme
de
cristaux incolores. M : 150,14. Rdt : 89%. Pf : 268 C. 1H-RMN (300MHz, CDC13)
:
2,32 (s, 3H, CH3), 6,38 (d, J= 1,8, H8 pyrazole), 8,01 (d, J= 1,8, H7
pyrazole), 12,48
(s large, 1H échangeable, NH).
2-Thioxo-1,2,3,4-tétrahydropyrazolo [1,5-a]-1,3,5-triazin-4-one (VIIe).
Ajouter
par petites fractions 676 mg de Na dans 20 mL d'EtOH absolu. Lorsque le Na est
entièrement consommé, ajouter 900 mg de N-éthoxycarbonyl-N'-(pyrazol-3-
yl)thiourée. Laisser sous agitation à température ambiante pendant 20 minutes.
Evaporer à sec. Ajouter 10 mL d'H2O glacée et laisser sous agitation
vigoureuse
pendant 20 minutes à 0 C. Filtrer. Laver 2 fois avec 5 mL d'EtOH puis 2 fois
avec
10 mL d'Et2O. On obtient 671 mg de produit titre sous forme d'une poudre
blanche.
Rdt : 95'%. Pf : 295 C. 1H-RMN (200MHz, DMSO-d6+ lgtte de D20) : 5,51 (d, J
1,5, H8 pyrazole), 7,48 (d, J=1,5, H7 pyrazole).
2-Thiométhylpyrazolo[1,5-a]-1,3,5-triazin-4-one (VIId). Ajouter au goutte à
goutte 222 L de MeI à une solution de 600 mg de 2-thioxo-1,2,3,4-
tétrahydropyrazolo[1,5-a]-1,3,5-triazin-4-one (VIII) dans 20 mL d'EtOH, 3 mL
d'H2O et 3 mL de lessive de soude. Laisser sous agitation à température
ambiante
pendant 20 minutes. Filtrer les cristaux blancs du produit titre (sel de Na).
Reprendre
les cristaux dans 10 mL d'H20 et ajuster le pH à 8 (contrôle au papier pH).
Filtrer et
laver 2 fois avec 2 mL d'H20. On obtient 429 mg du produit titre sous forme
d'une
poudre blanche. M : 182,21. Rdt : 66%. Pf : 257 C. 1H-RMN (200MHz, 1 goutte de
DMSO-d6 + CDC13): 2,25 (s, 3H, CH3), 5,92 (d, J= 2,0, 1H, H8 pyrazole), 7,53
(d, J
= 2,0, 1H, H7 pyrazole).
4-(N-Méthyl N phénylamino)pyrazolo[1,5-a]-1,3,5-triazine (IXa). Chauffer à
reflux un mélange de 1,0 g de pyrazolo[1,5-a]-1,3,5-triazin-4-one (Vila) dans
3 mL
de diméthylaniline et 8 mL de POC13 pendant 2 heures. Evaporer le POC13.
Sécher à
la pompe (lheure). Ajouter 50 mL de CH2C12 et au goutte à goutte 3 mL de
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
méthylaniline et 6 mL de triéthylamine. Après 1 heure à température ambiante,
évaporer à sec et ajouter 30 mL d'eau glacée. Extraire 2 fois avec 30 ml
d'Et2O,
sécher les fractions organiques sur Na2S04 et évaporer à sec. Purifier par
chromatographie sur silice (AcOEtl/Hexane2 puis AcOEtl/Hexane1).
Recristalliser
5 dans l'hexane. Rdt : 88%. 1H-RMN (300MHz, CDC13) : 4,10 (s, 3H, CH3), 6,64
(d,
1H, 1H pyrazole), 7,44-7,72 (m, 5H, 5H Ar), 8,03 (d, 1H, 1H pyrazole), 8,48
(s, 1H,
2-H).
2-Méthyl-4-(N-méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazine (IXb). En
10 remplaçant dans l'exemple IXa la pyrazolo[1,5-a]-1,3,5-triazin-4-one (VIIa)
par la 2-
méthylpyrazolo,[1,5-a]-1,3,5-triazin-4-one (VIIb), on obtient de la même
manière le
produit titre (Rdt : 92%). Pf : 116 C.
2-Méthyl-4-,[N-:méthyl N (4-nitrop'hényl)amino]-8-nitro,pyrazolo[1,5-a]-1,3,5-
15 triazine (Xa). Ajouter 2,3 g de 2-méthyl-4-(N-méthyl-N-
phénylamino)pyrazolo:[1,5-
a]-1,3,5-triazine (IXb) à 18 mL d'HNO3 fumant à 0 C. Le milieu réactionnel se
colore en rouge foncé. Après 10 minutes à 0 C, ajouter 300 mL d'un mélange
H20/glace. Un précipité vert se forme. Filtrer et laver 2 fois avec 20 mL
d'H20, 2
fois avec 6 mL de MeOH et 2 fois avec 10 mL d'Et20. Purifier par
chromatographie
20 (CH2CI2 50/Et2O 50). Triturer dans 15 mL d'Et2O. Filtrer et laver avec 2
fois 5 mL
d'Et2O. On obtient 2,7 g du produit titre sous forme d'une poudre crème (Rdt :
85%).
Pf : 256 C. 'H-RMN (300MHz, CDC13) : 2,74 (s, 3H, CH3), 3,83 (s, 3H, NCH3)1
7,85 (système AB, Ad = 0,94, JAB = 8,7, 4H, NO2Ph), 8,28 (s, H7 pyrazole).
25 8-Amino-4-[N-(4-aminophényl)-N-méthylamino]-2-méthylpyrazolo[1,5-a]-1,3,5-
triazine (Ma). Hydrogéner à pression atmosphérique une solution/suspension de
60
mg de 2-méthyl-4-[N-méthyl-N-(4-nitrophényl)amino]-8-nitropyrazolo[1,5-a]-
1,3,5-
triazine (Xa), 60 mg de Palladium sur charbon dans 30 mL de MeOH pendant 2
heures. Filtrer sur célite. Laver 2 fois avec 10 mL de MeOH. Evaporer à sec.
Purifier
30 par chromatographie (CH2C12 50/EtOH 10/AcOEt 40) puis (CH2C12 40/EtOH
20/AcOEt 40). On obtient une huile jaune, qui cristallise lorsqu'on la triture
dans un
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
46
minimum d'Et2O (Rdt : 68%). Pf : 166 C. 1H-RMN (200MHz, CDC13) : 2,54 (s, 3H,
CH3), 3,66 (s, 3H, NCH3), 6,83 (système AB, Ad = 0,29, J= 8,6, 4H, NH2Ph),
7,50
(s, H7 pyrazole).
8-Acétamido-4-[N-(4-acétamidophényl)-N-méthylamino]-2-méthylpyrazolo[1,5-
a]-1,3,5-triazine (XIIa). Ajouter goutte à goutte à 0 C, 47 L de chlorure
d'acétyle
à une solution de 80 mg de 8-amino-4-[N-(4-aminophényl)-N-méthylamino]-2-
méthylpyrazolo[ 1,5-a]-1,3,5-triazine (XIa) dans 7 mL de CH2C12 anhydre.
Ajouter
goutte à goutte 96 L de triéthylamine. Laisser revenir à température
ambiante.
Evaporer à sec. Ajouter 15 mL d'H20 et extraire 3 fois avec 10 mL de CH2C12.
Sécher sur Na2SO4. Evaporer à sec. Purifier par chromatographie (CH2C12 50/
AcOEt
40/EtOH 10) puis (CH2C12 40/AcOEt 40/EtOH 20). Evaporer à sec. Triturer dans
10
mL d'Et2O. On obtient 88 mg du produit titre sous forme d'une poudre blanche
(Rdt
: 84%). Pf : 158 C. 'H-RMN (200MHz, CDC13) : 2,21 (s, 6H, 2 x CH3CO), 2,56
(s,
3H, CH3), 3,74 (s, 3H, NCH3), 7,53 (système AB, Ad = 0,41, J = 8,8, 4H,
CONHPh), 7,60 (s large, 2H, 2 NH échangeables), 8,35 (s, H7 pyrazole).
8-Iodo-4-(N-méthyl-N-phénylamino)pyrazolo[1,5-al-1,3,5-triazine (XIIIa).
Ajouter 140 mg de NIS à une solution de 100 mg de 4-(N-méthyl-N-
phénylamino)pyrazolo[1,5-a]-1,3,5-triazine (IXa) dans 10 mL de CHC13. Chauffer
à
reflux 30 minutes. Evaporer à sec. Purifier par chromatographie (AcOEt/Hexane,
1 :3). Recristalliser dans EtOH. On obtient le produit titre sous forme de
cristaux
incolores. Rdt : 91%. Pf : 193 C. 1H-RMN (300MHz, CDC13) : 3,82 (s, 3H,
NCH3),
7,19-7,44 (m, 5H, Ph), 7,77 (s, 1H, H7 pyrazole), 8,3 (s, 1H, H2 pyrazole).
8-Iodo-2-méthyl-4-(N-méthyl-N-phénylamino)pyrazolo [1,5-a] -1,3,5-triazine
(XIIIb). En remplaçant dans l'exemple XIIIa la 4-(N-méthyl-N-
phénylamino)pyrazolo[1,5-a]-1,3,5-triazine (IXa) par la 2-méthyl-4-(N-méthyl-N-
phénylamino)pyrazolo[ 1,5-a]-1,3,5-triazine (IXb) on obtient de la même
manière le
produit titre (Rdt : 78%).
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
47
EXEMPLE 2: SYNTHESE DES COMPOSES DE FORMULE lb
4-[(Hydroxy)[4-(NV méthyl-N-phénylamino)pyrazolo[l,5-a]-1,3,5-triazin-8-
yl]méthyl]benzoate de méthyle (Ibl) Ajouter à -78 C et sous argon à une
solution
de 160 mg de 8-iodo-4-(N-méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazine
(XIIla) dans 25m1 de THF anhydre, 220 L de n-BuLi à 15% dans l'hexane. Après
5
minutes à -78 C ajouter 115 mg de 4-formylbenzoate de méthyle. Laisser revenir
à
température ambiante. Evaporer à sec. Ajouter 30m1 d'H20 et extraire 3 fois
avec 30
mL de CH2C12. Sécher sur Na2SO4 et filtrer. Evaporer à sec. Purifier par
chromatographie (AcOEtl/Hexanel). Recristalliser dans Et20/Hexane. On obtient
le
produit titre sous forme de cristaux incolores (Rdt = 93%). Pf : 68 C. 1H-RMN
(300
MHz, CDC13) : 3,80 (s, 3H, CH3), 3,91 (s, 3H, CH3), 6,22 (s, 1H, CH), 7,17-
7,55 (m,
8H,'8 ArH), 8,01 (d, J= 8,2, 2H, 2 CH), 8,21 (s, 1H, 1 ArH).
8-,[(2-Chloro,phényl)(hydroxy)méthyl]-4-(1V-méthyl-N-,phénylamino)-2-n-pro,pyl
pyrazolo,[1,5-a]-1,3,5-triazine (Ib2). Ajouter sous atmosphère inerte et à -78
C à
une solution de 8-iodo-4-(N-méthyl-N-phénylamino)-2-n-propylpyrazolo[1,5-a]-
1,3,5-triazin (500 mg, 1,27 mmol) dans 30 mL de THF, 640 L (1,52 mmol, 1,2
éq)
de n-butyl lithium (2.37 M dans l'heptane). Le mélange réactionnel est agité à
-78
pendant 5 min. Une solution de 2-chlorobenzaldéhyde (0,17 mL, 1,52 mmol, 1,2
éq)
dans 5 mL de THF est alors additionnée goutte à goutte et le milieu
réactionnel est
agité à -78 C pendant 1 h additionnelle, puis est hydrolysé par addition d'eau
et
concentré sous pression réduite. Le résidu huileux obtenu est partagé entre de
l'acétate d'éthyle et de l'eau. La phase organique est lavée par une solution
saturée
de chlorure de sodium, séchée (Na2SO4) et évaporée. Le résidu est purifié par
chromatographie flash sur gel de silice (éluant: éther de pétrole/AcOEt 8:2)
pour
donner le produit titre (383 mg, 74%) sous forme d'un solide incolore : Pf =
153-
155 C (méthanol); 1H-RMN (300 MHz, CDC13) d 1,01 (t, 3H, J = 7.3 Hz, CH3),
1.78-1.91 (m, 2H, CH2), 2,73 (t, 2H, J = 7.3 Hz, CH2), 3,71 (s, 3H, CH3), 4,63
(d,
1H, J= 4,3 Hz, OH), 6,49 (d, 1H, J= 4,3 Hz, CH), 7,13-7,20 (m, 3H, H Ar), 7,28-
7,38 (m, 6H, H Ar), 7,74-7.78 (m, 1H, H Ar); 13C-RMN (75 MHz, CDC13) d 14,0
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
48
(CH3), 21,2 (CH2), 40,6 (CH2), 42,1 (CH3), 65,0 (CH), 109,4 (C), 126,3 (2 CH),
127,1 (CH), 127,2 (CH), 127,8 (CH), 128,5 (CH), 129,0 (2 CH), 129,3 (CH),
132,0
(C), 141,2(C), 143,6 (CH), 144,6 (C), 148,6 (C), 149,1 (C), 165,6 (C); SM (IS)
m/z
390 (M++1, 35C1), 392 (M++1, 37C1).
8-(2-Chlorobenzoyl)-4-(N-méthyl N phénylamino)-2-n-propylpyrazolo[1,5-a]-
1,3,5-triazine (Ib3). Ajouter sous atmosphère inerte, 700 mg (8,05 mmol, 8 éq)
de
dioxyde de manganèse à une solution de 8-[(2-chlorophényl)(hydroxy)méthyl]-4-
(N-
méthyl-N-phénylamino)-2-n-propylpyrazolo[1,5-a]-1,3,5-triazine (Ib2) (380 mg,
0,93 mmol) dans 20 ml de CH2C12. Le mélange est agité pendant une nuit à
température ambiante, puis filtré sur célite et évaporé. Le résidu est purifié
par
colonne de chromatographie sur gel de silice (éther de pétrole/AcOEt: 8/2)
pour
conduire au composé titre (346 mg, 90%) sous forme d'un solide incolore: Pf =
149-
151 C (méthanol); 1H-RMN (300 MHz, CDC13) d 0,93 (t, 3H, J = 7.3 Hz, CH3),
1.65-1.75 (m, 2H, CH2), 2,73 (t, 2H, J= 7.3 Hz, CH2), 3,74 (s, 3H, CH3), 7,15-
7,19
(m, 2H, H Ar), 7,29-7,40 (m, 7H, H Ar), 7,95 (s, 1H, H Ar); 13C-RMN (75 MHz,
CDC13) d 13,9 (CH-3), 20,4 (CH2), 40,8 (CH2), 42,3 (CH3), 109,1 (C), 126,2 (2
CH),
126,5 (CH), 127,5 (CH), 129,1 (2 CH), 129,6 (CH), 130,5 (CH), 130,9 (C), 132,0
(C), 140,2 (C), 144,3 (C), 146,9 (CH), 149,2 (C), 152,3 (C), 170,2 (C), 187,3
(CO);
SM (IS) mlz 406 (M}+1, 35C1), 408 (M++1, 37C1).
8-(2-Chlorobenzoyl)-4-(N-méthylamino)-2-n-propylpyrazolo [1,5-a]-1,3,5-
triazine (Ib4). Une solution de 8-(2-chlorobenzoyl)-4-(N-méthyl-N-phénylamino)-
2-
n-propylpyrazolo[1,5-a]-1,3,5-triazine (Ib3) (320 mg, 0,79 mmol) et de
méthylamine
(33% wt. dans l'éthanol, 0,2 mL, 1,6 mmol, 2 éq) dans 10 mL d'éthanol est
agitée en
tube scellé pendant une nuit à 70 C. Après refroidissement, l'éthanol est
évaporé. Le
résidu est purifié par colonne de chromatographie sur gel de silice (éluant:
CH2CI2/AcOEt 9,5/0,5) pour conduire au composé titre (172 mg, 66%) sous forme
d'un solide incolore: Pf = 116-118 C (méthanol). 1H-RMN (300 MHz, CDC13) d
0,91 (t, 3H, J= 7.3 Hz, CH3), 1.,62-1.72 (m, 2H, CH2), 2,71 (t, 2H, J= 7.3 Hz,
CH2),
3,24 (d, 3H, J= 5,1 Hz, CH3), 6,54 (s large, 1H, NH), 7,31-7,45 (m, 4H, H Ar),
8,26
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
49
(s, 1H, H Ar); 13C-RMN (75 MHz, CDC13) d 13,9 (CH3), 20,6 (CH2), 27,4 (CH2),
41,1 (CH3), 110,6 (C), 126,7 (CH), 128,8 (CH), 129,8 (CH), 130,7 (CH), 131,1
(CH),
140,1 (C), 147,6 (CH), 149,4 (C), 149,7 (C), 171,3 (C), 187,5 (CO); SM (IS)
m/z
330 (M++1, 35C1), 332 (M++l, 37C1); HRMS (IC) pour C16H17CJN50; calculé:
330,1121; trouvé: 330,1123.
3- [4-(N-Méthyl-N-phénylamino)pyrazolo [1,5-a] -1,3,5-triazin-8-yl] acrylate
d'éthyle (1b5). Chauffer à 55 C pendant 3 heures et sous atmosphère inerte un
mélange de 1,0 g de 8-iodo-4-(N-méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-
triazine (XIIIa), 2,5 mL d'acrylate de méthyle, 450 mg de PdC12(dppf) et de
2,0,g
d'iodure de tétrabutylanunonium dans un mélange de DMF :H20 :TEA (25 :5 :5).
Evaporer à sec. Reprendre le résidu dans 200 mL d'AcOEt et laver deux fois
avec
100 mL d'H20. Sécher les fractions organiques sur Na2SO4. Evaporer à sec.
Purifier
le résidu par chromatographie sur silice (AcOEt/Hexane, 1 :3). Recristalliser
dans
Et20/hexane. 'On obtient 790 mg de produit titre sous forme de cristaux
incolores.
Pf : 139 C. 'H-RMN (75 MHz, CDCl3): 1,32 (t, J= 7,1 Hz, 3H, CH3), 3,82 (s,
3H,
NCH3), 4,24 (m, J= 7,1 Hz, 2H, CH2), 6,63 (d, J= 15,9 Hz, 1H, CH), 7,20-7,46
(m,
5H, 5 ArH), 7,78 (d, J= 15,9 Hz, 1H, CH), 7,90 (s, 1H, CH), 8.31 (s, 1H, CH).
13C-
RMN (300 MHz, CDC13): 16,0, 44,1, 61,7, 107,3, 118,3, 127,8, 129,2, 130,8,
134,6,
145,8, 151,0, 151,6, 155,6, 169,0.
3- [4-(N-Méthyl-N-phénylamino) pyrazolo [1,5-a]-1,3,5-triazin-8-yl] propionate
d'éthyle (1b6). Hydrogéner à température ambiante et à pression atmosphérique
pendant 6 heures une suspension de 1,2 g de 3-[4-(N-méthyl-N-
phénylamino)pyrazolo[1,5-a]-1,3,5-triazin-8-yl]acrylate d'éthyle (Ib5) et de
500 mg
de Pd/C (10%) dans 80 mL de méthanol. Filtrer sur papier filtre.
Recristalliser dans
.Et2O/Hexane. On obtient 1,1 g du produit titre sous forme de cristaux
incolores. Pf =
74 C. 1H-RMN (75 MHz, CDC13): 1,27 (t, J= 7,2 Hz, 3H, CH3), 2,66 (t, J= 7,4
Hz,
2H, CH2), 2,99 (t, J = 7,4 Hz, 2H, CH2), 3,80 (s, 3H, NCH3), 4,11 (m, J = 7,2
Hz,
2H, CH2), 7,17-7,41 (m, 5H, 5 ArH), 7,68 (s, 1H, CH), 8,19 (s, 1H, CH). 13C-
RMN
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
(300 MHz, CDC13): 15,8, 19,8, 36,2, 43,8, 61,9, 109,1, 127,7, 128,8, 130,6,
146,2,
149,6, 151,6, 153,2, 174,4.
Acide 3-[4-(N-méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazin-8-yl]
5 propionique (1b7). Laisser sous agitation à température ambiante pendant 24
heures,
une solution équimolaire de 3-[4-(N-méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-
triazin-8-yl]propionate d'éthyle Ib6 et de NaOH dans un mélange H20/EtOH, 1:9.
Filtrer le précipité et reprendre dans un minimum d'eau, puis ramener le pH à
3-4 à
l'aide d'HCl 1N. Filtrer le précipité. On obtient le produit titre sous forme
de cristaux
10 incolores. 'H-RMN (300 MHz, CDC13): 2,73 (t, J= 7,1 Hz, 2H, CH2), 3,01 (t,
J= 7,1
Hz, 2H, CH2), 3,80 (s, 3H, CH3), 7,18-7,41 (m, 5H, 5 ArH), 7,69 (s, 1H, 1
ArH),
8,20 (s, I H, 1 ArH).
4-[[1-Oxo-3-;[4-(N méthyiN-,phénylamino)pyrazo'lo[1,5-a]-1,3,5-triazin-8-y1]
15 propyl]amino]benzoate de méthyle (Ib8). Laisser sous agitation à
température
ambiante pendant une heure une solution de 380 mg de O-Benzotriazol-1-yl-
N,N,N,N'-tétraméthyluronium (HBTU), 400 L de N-méthylmorpholine, et de 297
mg d'acide 3-[4-(N-méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazin-8-
yl]propionique (Ib7) dans 4 mL de DMF anhydre. Ajouter 152 mg de 4-
20 aminobenzoate de méthyle, et laisser sous agitation pendant 48 heures. Le
milieu
réactionnel est alors dilué avec 100 mL d'AcOEt, et laver deux fois avec 20 mL
d'eau. Sécher les fractions organiques (Na2S04). Evaporer à sec. Purifier par
chromatographie sur silice (AcOEt/Hexane, 1 :1 puis AcOEt). Recristalliser
dans
EtOH/Et2O. On obtient le produit titre sous forme d'une poudre blanche (Rdt =
78
25 %). 'H-RMN (300 MHz, CDC13): 2,83 (t, J= 7,0 Hz, 2H, CH2), 3,12 (t, J= 7,0
Hz,
2H, CH2), 3,83 (s, 3H, CH3), 3,91 (s, 3H, CH3), 7,18-7,21 (m, 2H, 2 ArH), 7,37-
7,46
(m, 3H, 3 ArH), 7,59 (d, J= 8,5 Hz, 2H, 2 CH), 7,71 (s, 1H, 1 ArH), 7,99 (d,
J= 8,5
Hz, 2H, 2 CH), 8,17 (sl, 1H, NH), 8,23 (s, 1H, 1 ArH).
30 8-Benzoyl-2-méthyl-4-(N-méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazine
(1b9). Ajouter sous argon 580 L de chlorure de benzoyle à 227 mg de 2-méthyl-
4-
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
51
(N rra.éthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazine (IXb). Ajouter au
goutte à
goutte 588 L de SnC14. Chauffer à 60 C pendant 12 heures. Le milieu
réactionnel se
colore en noir. Verser dans 40 mL d'H20 et extraire 3 fois avec 40 mL d'AcOEt.
Sécher sur Na2SO4 et filtrer. Evaporer à sec. Purifier par chromatographie
(AcOEtl/Hexane2). On obtient 292 mg d'une huile qui cristallise lentement. Rdt
:
85%. Pf : 121-C. 'H-RMN (200MHz, CDC13) : 2,68 (s, 3H, CH3), 3,79 (s, 3H,
NCH3), 7,20-7,60 (m, 8H Ar), 7,84-7,90 (m, 2H Ar), 8,05 (s, H7 pyrazole).
2-Méthyl-4-(N-méthyl-N-phénylamino)pyrazolo [1,5-a]-1,3,5-triazine-6-
carboxylate d'éthyle (Ib10). Remplacer dans l'exemple Ib9 le chlorure de
benzoyle
par le chlorure d'oxalyle puis évaporer à sec en fin de réaction. Ajouter 20
mL
d'EtOH absolu et chauffer à reflux pendant 4 heures. Evaporer à sec. Ajouter
40 mL
d'un mélange H2O/glace. Extraire 3 fois avec 30 mL d'AcOEt. Sécher sur Na2SO4.
Purifier partiellement par chromatographie (AcOEtl/Hexl). Recristalliser dans
EtOH. Pf : 202 C. SM (FAB, M + H+) : 312.'H-RMN (300MHz, DMSO-d6),: 1,36
(t, J= 7,1, 3H, CH2CH3), 2,66 (s, 3H, CH3), 3,74 (s, 3H, NCH3), 4,36 (q, J=
7,1, 2H,
CH2CH3), 7,14-7,18 (m, 2H Ar), 7,35-7,41 (m, 3H Ar), 8,06 (s, H7 pyrazole).
3-[4-(N-Méthyl Nv phénylamino)pyrazolo[1,5-a]-1,3,5-triazin-8-yl]acrylate de
tert-butyle (Ib11). En remplaçant dans l'exemple Ib5 l'acrylate d'éthyle par
l'acrylate de tert-butyle, on obtient de la même manière le produit titre
(87%) sous
forme d'un solide incolore.
3-[4-(N-Méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazin-8-yl]propionate de
tert-butyle (Ib12). En remplaçant dans l'exemple Ib6 le 3-[4-(N-méthyl-N-
phénylamino)pyrazolo[ 1,5-a]-1,3,5-triazin-8-yl]acrylate d'éthyle (Ib5) par le
3-[4-
(N-Méthyl-N-phénylanzino)pyrazolo[1,5-a]-1,3,5-triazin-8-yl]acrylate de tert-
butyle
(Ibl1), on obtient de la même manière le produit titre (76%) sous forme d'un
solide
incolore. Ce produit peut être transformé en acide 3-[4-(N-méthyl N
phénylamino)pyrazolo[1,5-a]-1,3,5-triazin-8-yl] propionique (Ib7) par simple
clivage
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
52
de l'ester tert-butylique en utilisant de l'acide trifluoroacétique dans le
dichlorométhane (Rdt : 95%).
4-(N-méthyl-N-phénylamino)-8-phénylpyrazolo[1,5-a]-1,3,5-triazine (Ib13).
Dissoudre 80 mg de 8-iodo-4-(N-méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-
triazine (XIIIb) dans 6 mL de toluène dégazé. Ajouter 25 mg de
tétrakistriphénylphosphine palladium(0), 210 L de Na2CO3 2M dans H2O et 30 mg
d'acide benzèneboronique en solution dans 30 L d'EtOH. Chauffer à 90 C
pendant
heures sous argon. Evaporer à sec. Purifier par chromatographie (AcOEt
10 50/Hexane 50). On obtient 40 mg du produit titre sous forme d'une poudre
crème.
Rdt : 78%.
4-(Nméthyl-N-phénylamino)-8-(4-fluorophényl)pyrazolo[1,5-a]-1,3,5-triazine
(Ib14). En remplaçant dans l'exemple .Ib13 l'acide benzèneboronique par
l'acide 4-
15 fluorobenzène boronique on obtient de la même manière le produit titre
(78%) sous
forme d'un solide incolore.
8- [(3-Furyl) (hydroxy)méthyl] -4-(N-méthyl-N-phénylamino)-2-n-,propylpyrazolo
[1,5-a]-1,3,5-triazine (Ib15). En remplaçant dans l'exemple Ib2 le 2-
chlorobenzaldéhyde par le 3-furaldéhyde on obtient de la même manière le
produit
titre (65%) sous forme d'un solide incolore. Pf = 142-144 C (méthanol); 'H-RMN
(300 MHz, CDC13) d 1,02 (t, 3H, J= 7.3 Hz, CH3), 1.79-1.92 (m, 2H, CH2), 2,75
(t,
2H, J= 7.3 Hz, CH2), 3,70 (d, 1H, J= 4,5 Hz, OH), 3,73 (s, 3H, CH3), 6,08 (d,
1H, J
= 4,5 Hz, CH), 6,43 (s large, I H, H Ar), 7,15-7,18 (m, 2H, H Ar), 7,32-7.41
(m, 5H,
H Ar), 7,54 (m, 1H, H Ar); 13C -RMN (75 MHz, CDC13) d 14,0 (CH3), 21,2 (CH2),
40,6 (CH2), 42,0 (CH3), 60,8 (CH), 109,4 (CH), 110,3 (C), 126,2 (2 CH), 127,1
(CH), 128,4 (C), 129,0 (2 CH), 139,5 (CH), 143,2 (CH), 143,4 (CH), 144,6 (C),
148,3 (C), 149,1 (C), 165,5 (C); SM (IS) mlz 364 (M++1).
8-(3-Furylméthyl)-2-nt-propyl-4-(N-méthyl-N-phénylamino)pyrazolo[1,5-a]-
1,3,5-triazine (Ib16). Ajouter à 0 C et sous atmosphère inerte, 312 mg (8,25
mmol,
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
53
9 éq) de borohydrure de sodium à 2 mL d'acide trifluoroacétique. A ce mélange
et à
15 C, est ajoutée goutte à goutte une solution de 8-[(3-furyl)(hydroxy)méthyl]-
4-(N-
méthyl-N-phénylamino)-2-n-propylpyrazolo[1,5-a]-1,3,5-triazine (Ib15) (333 mg,
0,92 mmol) dans le dichlorométhane (5 mL). La solution est alors agitée à
température ambiante pendant 2 h, puis diluée par addition d'eau et basifiée
par ajout
d'hydroxyde de sodium. Le produit est extrait par le dichlorométhane, séché
(MgSO4) et évaporé sous pression réduite. Le résidu est purifié par colonne de
chromatographie sur gel-de silice (éluant: EP/AcOEt: 8/2) pour conduire au
composé
titre (286 mg, 90%) sous forme d'une huile incolore. 'H-RMN (300 MHz, CDC13) d
1,03 (t, 3H, J= 7.3 Hz, CH3), 1.81-1.94 (m, 2H, CH2), 2,77 (t, 2H, J= 7,3 Hz,
CH2),
3,73 (s, 3H, CH3), 3,80 (s, 2H, CH2), 6,31 (s large, 1H, H Ar), 7,15-7,18 (m,
2H, H
Ar), 7,22 (s large, IH, H Ar), 7,30-7,40 (m, 4H, H Ar), 7,56 (s, 1H, H Ar);
13C-RMN
(75 MHz, CDC13) d 14,1 (CH3), 18,4 (CH2), 21,4 (CH2), 41,0 (CH2), 42,0 (CH2),
106,5 (C), 111,4 (CH), 124,1 (C), 126,1:(2 CH), 126,8 (CH), 128,9 (2 CH),
139,4
(CH), 142,9 (CH), 144,9 (CH), 145,0 (C), 148,5 (C), 149,4 (C), 164,9 (C); SM
(IS)
rnlz 348 (M++1).
8-(3-Furylméthyl)-2-n-propyl-4-(N-mhthylamino)pyrazolo [1,5-a] -1,3,5-triazine
(1'b17). En remplaçant dans l'exemple Ib4 le 8-(2-chlorobenzoyl)-4-(N-méthyl-N-
phénylamino)-2-n-propylpyrazolo[1,5-a]-1,3,5-triazine (Ib3) par le 8-(3-
furylméthyl)-2-n-propyl-4-(N-méthyl-N-phénylamino)pyrazolo [ 1,5-a]-1,3,5-
triazine
(Ib16) on obtient de la même manière le produit titre (90%) sous forme d'une
huile
incolore. 1H-RMN (300 MHz, CDC13) d 1,02 (t, 3H, J= 7.3 Hz, CH3), 1.80-1.93
(m,
2H, CH2), 2,74 (t, 2H, J = 7,3 Hz, CH2), 3,20 (d, 3H, J = 5,1 Hz, CH3), 3,84
(s, 2H,
CH2), 6,34 (s large, IH, H Ar), 6,49 (s large, IH, NH), 7,26 (s large, 1H, H
Ar), 7,34
(s large, 1H, H Ar), 7,74 (s, 1H, H Ar); 13C-RMN (75 MHz, CDC13) d 14,1 (CH3),
18,4 (CH2), 21,7 (CH2), 27,3 (CH3), 41,4.(CH2), 107,8 (C), 111,4 (CH), 124,2
(C),
139,5 (CH), 143,0 (CH), 145,0 (CH), 146,3 (C), 149,4 (C), 166,2 (C); SM (IS)
m/z
272 (M++1); HRMS (IC) Pour C14H18N50; calculé: 272,1511; trouvé: 272,1513.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
54
8-[(Hydroxy)(2-thiényl)méthyl]-4-(N-méthyl-N-phénylamino)-2-n-propyl
pyrazolo[1,5-al-1,3,5-triazine (Ibis). En remplaçant dans l'exemple Ib2 le 2-
chlorobenzaldéhyde par le 2-thiophènecarboxaldéhyde, on obtient de la même
manière le produit titre (68%) sous forme d'un solide incolore: Pf = 150-152 C
(méthanol). 1H-RMN (300 MHz, CDC13) d 1,02 (t, 3H, J= 7,3 Hz, CH3), 1.79-1.91
(m, 2H, CH2), 2,75 (t, 2H, J = 7,3 Hz, CH2), 3,74 (s, 3H, CH3), 4,15 (d, 1 H,
J = 4,5
Hz, OH), 6,35 (d, 1H, J= 4,5 Hz, CH), 6,91-6,97 (m, 2H, H Ar), 7,15-7,19 (m,
2H,
H Ar), 7,23 (dd, 1H, J= 1,3, 4,9 Hz, H Ar), 7,32-7,40 (m, 3H, H Ar), 7,56 (s,
1H, H
Ar), 13C-RMN (75 MHz, CDC13) d 14,0 (CH3), 21,2 (CH2), 40,6 (CH2), 42,1 (CH3),
64,5 (CH), 110,3 (C), 124,3 (CH), 124,9 (CH), 126,3 (2 CH), 126,6 (CH), 127,2
(CH), 129,0 (2 CH), 143,4 (CH), 144;6 (C), 148,0 (C), 148,4 (C), 149,1 (C),
165,7
(C); SM (IS) m/z 380 (M++1).
4-(N Méthyl-N-phénylamino)-2-n-propyl-8-(2-thiénylméthyl)pyrazolo[1,5-a]-
1,3,5-triazine (Ib19). En remplaçant dans l'exemple Ib16 le 8-f(3-
furyl)(hydroxy)méthyl]-4-(N-méthyl-N-phénylamino)-2-n-propylpyrazo'lo [ 1,5-a]-
1,3,5-triazine (Ib15) par le 8-[(hydroxy)(2-thiényl)méthyl]-4-(N-méthyl-N-
phénylainino)-2-n-propylpyrazolo[1,5-a]-1,3,5-triazine (Ib18), on obtient de
la même
manière le produit titre (90%) sous forme d'une huile incolore: 'H-RMN (300
MHz,
CDCI3) d 1,03 (t, 3H, J= 7.3 Hz, CH3), 1.81-1.93 (m, 2H, CH2), 2,77 (t, 2H, J=
7.3
Hz, CH2), 3,73 (s, 3H, CH3), 4,21 (s, 2H, CH2), 6,83-6,89 (m, 2H, H Ar), 7,09
(dd,
1H, J= 1,1, 5,1 Hz, H Ar), 7,15-7,18 (m, 2H, H Ar), 7,28-7,40 (m, 3H, H Ar),
7,60
(s, 1H, H Ar); 13C-RMN (75 MHz, CDC13) d 14,1 (CH3), 21,4 (CH2), 23,1 (CH2),
40,9 (CH2), 42,0 (CH3), 106,6 (C), 123,5 (CH), 124,8 (CH), 126,1 (2 CH), 126,8
(CH), 126,9 (CH), 128,9 (2 CH), 143,9 (C), 144,9 (CH), 145,0 (C), 148,5 (C),
149,3
(C), 165,1 (C); SM (IS) miz 364 (M++1).
4-(N-méthylN-phénylamino)-2-n-propyl-8-(2-thiénylméthyl)pyrazolo [1,5-a]-
1,3,5-triazine (Ib19). En remplaçant dans l'exemple lb4 le 8-(2-chlorobenzoyl)-
4-
(N-méthyl-N-phénylamino)-2-n-propylpyrazolo[l,5-a]-1,3,5-triazine (Ib3) par le
4-
(N-méthyl-N-phénylamino)-2-n-propyl-8-(2-thiénylméthyl)pyrazolo [ 1,5-a]-1,3,5-
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
triazine (lb 19), on obtient de la même manière le produit titre (92%) sous
forme d'un
solide incolore. Pf = 53-55 C; 1H-RMN (300 MHz, CDC13) d 1,02 (t, 3H, J= 7.3
Hz, CH3), 1.81-1,93 (m, 2H, CH2), 2,75 (t, 2H, J= 7.3 Hz, CH2), 3,20 (d, 3H,
J= 5,1
Hz, CH3), 4,25 (s, 2H, CH2), 6,57 (s large, 1H, NH), 6,87-6,92 (m, 2H, HA,),
7,11
5 (dd, 1H, J= 1,1, 5,1 Hz, HA,), 7,80 (s, 1H, HA,); 13C-RMN (75 MHz, CDC13) d
14,1
(CH3), 21,7 (CH2), 23,2 (CH2), 27,3 (CH3), 41,4 (CH2), 107,9 (C), 123,7 (CH),
124,9
(CH), 126,9 (CH), 144,0 (C), 145,1 (CH), 146,3 (C), 149,4 (C), 166,4 (C); SM
(IS)
m/z 288 (M++1).
10 4-(N-cyclo,propylamino)-2-n-propyl-8-[(2-thiényl)méthyl]pyrazolo[1,5-a]-
1,3,5-
triazine (Ib21). En remplaçant dans l'exemple Ib4 8-(2-chlorobenzoyl)-4-(N-
méthyl-N-phénylamino)-2-n-propylpyrazolo[1,5-a]-1,3,5-triazine (Ib3) par le 4-
(N-
méthyl-N-phénylamino)-2-n-propyl-8-[(2-thiénylméthyl]pyrazolo [1,5-aj-1,3,5-
triazine (lb 19) et la méthylarnine par la cyclopropylarnine, on obtient de la
même
15 manière le produit titre (80%) sous forme d'un solide incolore. Pf = 52-53
C; 1H-
RMN (300 MHz, CDC13) d 0,71-0,76 (m, 2H, CH2), 0,91=0,98 (m, 2H, CH2)11,03 (t,
3H, J= 7.3 Hz, CH3), 1.82-1,94 (m, 2H, CH2), 2,78 (t, 2H, J= 7.3 Hz, CH2),
2,99-
3,07 (m, 1H, CH), 4,24 (s, 2H, CH2), 6,55 (s large, 1H, NH), 6,86-6,92 (m, 2H,
HA,),
7,11 (dd, 1H, J= 1,1, 5,1 Hz, HA,), 7,83 (s, 1H, HA,); 13C-RMN (75 MHz, CDC13)
d
20 7,2 (2 CH2), 14,1 (CH3), 21,7 (CH2), 23,2 (CH2), 23,4 (CH), 41,4 (CH2),
108,0 (C),
123,7 (CH), 124,9 (CH), 126,9 (CH), 144,0 (C), 145,0 (CH), 146,2 (C), 149,7
(C),
166,5 (C); SM (IE) m/z 313 (M).
N-[2-(3,4-Dihydroxyphényl)éthyl]-3-[4-(N-méthyl-N-phénylamino)pyrazolo[1,5-
25 a]-1,3,5-triazin-8-yl]propionamide (Ib22). En remplaçant dans l'exemple
Ib8le 4-
aminobenzoate de méthyle par la 2-(3,4-dihydroxyphényl)éthylamine on obtient
de
la même manière le produit titre (22%) sous forme d'un solide incolore: SM
(IS) m/z
433 (M++1).
30 3-[4-(N-méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazin-8-yl)-N-[3-(2-
oxopyrrolidin-1-yl)propyl]propionamide (Ib23). Ajouter à 0 C et sous argon,
(41
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
56
nmg, 0,34 mmol) de DMAP à une solution de N-(3-aminopropyl)-2-pyrrolidinone
(0,071 mL, 0,50 mmol) dans le dichlorométhane (8 mL). L'acide 3-[4-(N-méthyl-N-
phénylamino)pyrazolo[ 1,5-a]-1,3,5-triazin-8-yl]propionique (Ib7) (100 mg,
0,34
mmol), puis 1'EDCI (78 mg, 0,40 mmol) sont successivement additionnés au
milieu
réactionnel. La solution finale est agitée une nuit à température ambiante.
Après
addition d'eau et extraction, la phase organique est lavée par une solution
saturée de
chlorure de sodium. Après séchage et évaporation de la phase organique, le
produit
brut est purifié par chromatographie flash sur gel de silice (éluant:
CH2C12/MeOH
92:8) pour donner le produit titre (132 mg, 93%, gomme). 1H-RMN (300 MHz,
CDC13) d 1,58-1,67 (m, 2H, CH2), 1,97-2,07 (m, 2H, CH2), 2,38 (t, 2H, J = 7,9
Hz,
CH2), 2,54 (t, 2H, J= 7,5 Hz, CH2), 3,01 (t, 2H, J= 7,5 Hz, CH2), 3,15 (q
large, 2H,
J= 6,2 Hz, CH2), 3,26 (t, 2H, J= 7,2 Hz, CH2), 3,36 (t, 2H, J= 7,2 Hz, CH2),
3,79
(s, 3H, CH3), 6,73 (t large, 1H, J= 5,9 Hz, NH), 7,16-7,19 (m, 2H, HAr), 7,30-
7,42
(m, 3H, HA,), 7,67 (s, 1H, HA,), 8,16 (s, 1H, HAr); 13C-RMN (75 MHz, CDC13) d
17,7
(CH2), 18,8 (CH2), 26,4.(CH2), 30,7 (CH2), 35,6 (CH2), 36,7 (CH2), 39,4 (CH2),
42,1
(CH3), 47,1 (CH2), 107,7 (C), 126,0 (2 CH), 127,0 (CH), 128,9 (2 CH), 144,5
(C),
144,6 (CH), 147,7 (C), 149,9 (C), 151,4 (CH), 172,1 (CO), 175,5 (CO); SM (IS)
m/z
422 (M++1).
N-[2-Hydroxy-2-(3,4-dihydroxyphényl)éthyl]-3-[4-(NV méthyl-N-phénylamino)
pyrazolo[1,5-a]-1,3,5-triazin-8-yl]propionamide (Ib24). En remplaçant dans
l'exemple Ib8 le 4-aminobenzoate de méthyle par la 2-(hydroxy)-2-(3,4-
dihydroxyphényl)éthylamine on obtient de la même manière le produit titre
(22%)
sous forme d'un solide incolore: SM (IS) m/z 449 (M++1).
4-(N-Méthyl-N-phénylamino)-8-(j3-D glycéro-pentofuran-3'-ulos-l'-yl)pyrazolo
[1,5-a]-1,3,5-triazine (Ib25). Agiter pendant 15 minutes sous atmosphère
inerte un
mélange de 62 mg de bis(dibenzylidènacétone)Pd(0) et de 66 mg de
triphénylarsine
dans 5 mL d'acétonitrile anhydre. Transférer ce complexe à l'aide d'une
seringue
dans une solution de 500 mg de 8-iodo-4-(N-méthyl-N-phénylamino)pyrazolo[1,5-
a]-1,3,5-triazine (XIIla), 200 mg de 1,4-anhydro-2-déoxy-D-érythro-pent-1-
énitol et
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
57
380 L de tri-n-butylamine dans 15 mL d'acétonitrile anhydre. Chauffer à 60 C
pendant 12 heures. Evaporer à sec. Purifier par chromatographie (AcOEt 50/Hex
50)
puis AcOEt. Recristalliser dans AcOEt/Hex. On obtient 327 mg de produit titre
sous
forme de cristaux incolores: SM (IS) m/z 340 (M++1).
4- [N-Méthyl-N-(4-nitrophényl)amino]-8-(P-D-glycéro-pentofuran-3'-ulos-l'-
yl)pyrazolo [1,5-a]-1,3,5-triazine (1b26). En remplaçant dans l'exemple (Ib25)
la 8-
iodo-4-(N-méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazine par la 8-iodo-4-
[N-
méthyl-N-(4-nitrophényl)amino]pyrazolo[1,5-a]-1,3,5-triazine on obtient de la
même
manière le produit titre (Rdt : 61 %).
8-(2'-Déoxy-(3-D-ribofuranosyl)-4-(N-méthyl-N-phénylamino)pyrazolo [1,5-a]-
1,3,5-triazine (Ib2'7). Ajouter sous argon à une solution de 165 mg de 4-(N-
méthyl-
N-phénylamino)-8-(,(3-D-glycérro-pentofuran-3'-ulos-1 '-yl)pyrazolo,[ 1,5-a]-
1,3,5-
triazine (1b25) dans 15 mL de CH3CN anhydre, 500 mg de triacétoxyborohydrure
de
sodium. Après 25 minutes, évaporer à sec et purifier par chromatographie
(AcOEt
puis AcOEt 9/EtOH 1). Après recristallisation (EtOH/Et20), on obtient 120 mg
de
produit titre sous forme de cristaux incolores: SM (IS) m/z 342 (M++1).
8-(2'-Déoxy-ji-D-xylofuranosyl)-4-(N-méthyl N phénylamino)pyrazolo[1,5-a]-
1,3,5-triazine (Ib28). Ajouter goutte à goutte, sous atmosphère inerte et à -
78 C à
une solution de 550 ing de 4-(N-méthyl-N-phénylamino)-8-((3-D-glycéro-
pentofuran-
3'-ulos-l'-yl)pyrazolo [l,5-a]-1,3,5-triazine (Ib25) dans 100 mL de THF
anhydre,
3.0 mL de KB[CH(CH3)C2H5]3H (K-selectride ). Laisser sous agitation à -78 C
pendant 30 minutes. Ajouter 100 L d'acide acétique et ramener à température
ambiante. Après purification par chromatographie (CH2C12 90/EtOH 10) et
recristallisation dans EtOH/Et20, on obtient 324 mg du produit titre: SM (IS)
m/z.
342 (M++1).
4-Amino-8-(2'-déoxy-(3-D-ribofuranosyl)pyrazolo[1,5-a]-1,3,5-triazine (Ib29).
En
remplaçant dans l'exemple (Ib4) la 8-(2-chlorobenzoyl)-4-(N-méthyl-N-
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
58
phénylamino)-2-n-propylpyrazolo[1,5-a]-1,3,5-triazine (Ib3) par la 8-(2'-déoxy-
(3-D-
ribofuranosyl)-4-(N-méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazine (Ib27)
et
la méthylamine par une solution d'éthanol saturée en ammoniac, on obtient de
la
même manière le produit titre sous forme d `une poudre blanche (Rdt : 63%).
4-Amino-8-(2'-déoxy-i3-D-xylofuranosyl)pyrazolo[1,5-a]-1,3,5-triazine (Ib30).
En
remplaçant dans l'exemple (Ib29) la 8-(2'-déoxy-f3-D-ribofuranosyl)-4-(N-
méthyl-N-
phénylamino)pyrazolo[ 1,5-a]-1,3,5-triazine (Ib27) par la 8-(2'-déoxy-J3-D-
xylofuranosyl)-4-(N-méthyl-N-phénylamino)pyrazolo[ 1,5-a]-1,3,5-triazine
(Ib28) on
obtient de la même manière le produit titre sous forme d `une poudre blanche
(Rdt :
56%).
EXEMPLE 3: SYNTHESE DES COMPOSES DE FORMULE la
8-Benzyil-2-.méthylpyrazo`lo[1,5-a]-1,3,5-triazin-4-one (lal). Laisser sous
agitation
à température ambiante pendant 12 heures, une solution de 300 mg de 8-benzyl-2-
méthyl-4-(N-méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazine, 100 mg de
NaOH dans 10 mL d'un mélange H20/EtOH (2 :8). Evaporer à sec. Ajouter 3 mL
d'H20, neutraliser à l'aide d'HCI 1N (pH = 6-7). Filtrer et laver avec un
minimum
d'H20. On obtient le produit titre sous forme de cristaux incolores (Rdt :
68%). Pf :
225 C. 'H-RMN (200MHz, DMSO-d6) : 2,35 (s, 3H, CH3), 3,90 (s, 2H, CH2), 7,14-
7,34 (m, 5H, Ph), 7,91 (s, H7 pyrazole), 12,39 (s large, 1H échangeable, NH).
Acide 3-(4-oxopyrazolo[l,5-a]-1,3,5-triazin-8-yl)propionique (Ia2). Chauffer à
reflux pendant 15 minutes une solution de 700 mg de 3-[4-(N-méthyl-N-
phénylamino)pyrazolo[1,5-a]-1,3,5-triazin-8-yl]propionate d'éthyle (Ib6), 300
mg de
soude dans un mélange de 700 gL d'H20 et de 6 mL d'éthanol. Refroidire le
milieu
réactionnel à 0 C. Filtrer les cristaux obtenus. Dissoudre dans 7 mL d'H20 et
acidifier à pH 2 avec de l'acide chlorhydrique concentré. Laisser sous
agitation à 0
C pendant 5 minutes. Filtrer les cristaux formés. Laver deux fois avec 1 mL
d'H20,
une fois avec 1 mL d'EtOH et deux fois avec 10 mL d'Et2O. Recristalliser dans
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
59
EtOH/Et2O. On obtient 480 mg du produit titre sous forme de cristaux
incolores. Pf =
277 C. 'H-RMN (300 MHz, DMSO-d6): 2,6 (t, J= 7,5 Hz, 2H, CH2), 2,80 (t, J=
7,5
Hz, 2H, CH2), 7,97 (s, 2H, 2 CH), 12,1 (sl, 1 H, OH), 12,4 (sl, 1 H, OH).
3-[4-Oxopyrazolo[1,5-a]-1,3,5-triazin-8-yl]acrylate d'éthyle (1a3). Chauffer à
50 C pendant 10 minutes une solution. de 3-[4-(N-méthyl-N-
phénylamino)pyrazolo[ 1,5-a]-1,3,5-triazin-8-yl]acrylate d'éthyle (Ib5, 200
mg) et de
60 mg de NaOH dans un mélange H20/EtOH, 1 :9. Evaporer à sec. Ajouter 15 mL
d'H20 et ramener le pH,à 7-8 à l'aide d'une solution d'HCl 0,1 N. Extraire 3
fois
avec 30 mL d'AcOEt. Purifier par chromatographie sur silice (AcOEt 4, CH2Cl2
4,
EtOH 1). Recristalliser dans EtOH/Et2O. On obtient le produit titre sous forme
de
cristaux incolores (Rdt : 27%). Pf : 253 C. 1H-RMN (300 MHz, DMSO-d6): 1,23
(t,
J= 7,1, 3H, CH3), 4,15 (q, J='7,1, 2H, CH2), 6;65 (d, J=16,1, 1H, CH), 7,60
(d, J
16,1, 1 H, CH), 8,1T(s, 1 H, CH), 8.49 (s, 1 H, CH).
4-.[(liydroxy)[4-oxopyrazolo[1,5-a]-1,3;5-triazin-8-yljméthyl]benzoate de
sodium
(Ia4). En remplaçant dans l'exemple Ia2 le 3-[4-(N-méthyl-N-
phénylamino)pyrazolo[1,5-a]-1,3,5-triazin-8-yl]propionate d'éthyle (Ib6) par
le 4-
[(hydroxy) [4-(N-méthyl-N-phénylamino)]pyrazolo[ 1,5-a]-1,3,5-triazin-8-
yl]méthyl]
benzoate de méthyle (Ib 1) on obtient, après salification de la fonction acide
carboxylique par la soude, le produit titre (Rdt : 82%). Pf > 300 C. 'H-RMN
(300MHz, DMSO-d6) : 5,42 (sl, 1H, NH), 5,84 (s, 1H, CH), 7,27-7,47 (m, 3H, 3
ArH), 7,71-7,79 (m, 3H, 3 CH).
4-[[1-(Oxo)-3-(4-oxopyrazolo[1,5-aj-1,3,5-triazin-8-yI)propyljaminojbenzoate
de
sodium (la5). En remplaçant dans l'exemple Ia2 le 3-[4-(N-méthyl-N-
phénylamino)pyrazolo[ 1,5-a]-1,3,5-triazin-8-yl]propionate d'éthyle (Ib6) par
le 4-
[[ 1-oxo-3-[4-(N-méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazin-8-
yl]propyl]
amino]benzoate de méthyle (Ib8) on obtient de la même manière le produit titre
(Rdt
= 82%). 1H-RMN (300MHz, D20) : 2,98 (t, J= 7,2, 2H, CH2), 3,30 (t, J = 7,2,
2H,
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
CH2), 7,60 (d, J = 8,50, 2H, 2 ArH), 8,08 (d, J = 8,50, 2H, 2 ArH), 8,13 (s,
IH, 1
ArH), 8,17 (s, 1H, 1 ArH). MS : 328 (M+H)+
8-Benzoyl-2-méthylpyrazolo[1,5-a]-1,3,5-triazin-4-one (1a6). En remplaçant
dans
5 l'exemple Ia2 l'acide 8-benzoyl-2-méthyl-4-(N-méthyl-N-
phénylamino)pyrazolo[ 1,5-a]-1,3,5-triazine (Ib9) par 3-[4-(N-méthyl-N-
phénylamino)pyrazolo[1,5- a]-1,3,5-triazin-8-yl]propionate d'éthyle (Ib6) on
obtient
de la même manière le produit titre (Rdt = 92%).
10 N-[2-(3,4-Dihydroxyphényl)éthyl]-3-(4-oxopyrazolo[1,5-a]-1,3,5-triazin-8-
yl)propionannide (1a7). En remplaçant dans l'exemple Ia3 le 3-[4-(N-méthyl-N-
phénylamino)pyrazolo,[ 1,5-a]-1,3,5-triazin-8-yl]acrylate d'éthyle (Ib5) par
le N-[2-
(3,4-dihydroxyphényl)éthyl]-3-[4-(N-méthyl-N-phénylamino)pyrazolo[ 1,5-,a]-
1,3,5-
triazin-,8-y1]propionamide (Ib22) on obtient de la même manière le produit
titre (Rdt
15 = 91%): SM (IS) m/z 344 (M++l).
3-[4-oxopyrazolo [1,5-a]-1,3,5-triazin-8-yl)-N-[3-(2-oxopyrrolidin-1-
yl)propyl]
propionamide (1:a8). Une solution de NaOH 5N (0,28 mL, 1,42 mmol) est ajoutée
à
une solution de 3-[4-(N-méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazin-8-
yl)-
20 N-[3-(2-oxopyrrolidin-1-yl)propyl]propionamide (Ib23) (120 mg, 0,28 mmol)
dans
l'éthanol (10 mL). La solution est agitée pendant 5 h à température ambiante.
Les
solvants sont évaporés. Le résidu obtenu est purifié par colonne de
chromatographie
sur gel de silice (éluant: CH2C12/MeOH 85:15) pour conduire au composé titre
(62
mg, 66%, solide); PF = 180-181 C (méthanol). 1H-RMN (300 MHz, DMSO-d6) d
25 1,50-1,57 (m, 2H, CH2), 1,84-1,94 (m, 2H, CH2), 2,19 (t, 2H, J= 7,9 Hz,
CH2), 2,38
(t, 2H, J= 7,6 Hz, CH2), 2,78 (t, 2H, J= 7,6 Hz, CH2), 2,99 (q large, 2H, J=
6,4 Hz,
CH2), 3,10 (t, 2H, J= 7,1 Hz, CH2), 3,28 (t, 2H, J= 7,1 Hz, CH2), 7,80 6,73 (t
large,
1H, J = 5,9 Hz, NH), 7,88 (s, 1H, HA,), 7,93 (s, 1H, HA,.); 13C-RMN (75 MHz,
DMSO-d6) d 17,5 (CH2), 18,5 (CH2), 26,9 (CH2), 30,4 (CH2), 35,7 (CH2), 36,2
30 (CH2), 39,5 (CH2), 46,3 (CH2), 111,3 (C), 145,1 (CH), 145,8 (C), 171,1 (2
CO),
173,8 (CO); SM (IS) m/z 333 (M++1).
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
61
IUT--[2-Hydroxy-2-(3,4-dihydroxyphényl)éthyl]-3-[4-oxopyrazolo [1,5-a]-1,3,5-
triazin-8-yl]propionamide (Ia9). En remplaçant dans l'exemple Ia3 le 3-[4-(N-
méthyl-N-phénylamino)pyrazolo[1,5-a]-1,3,5-triazin-8-yl]acrylate d'éthyle
(Ib5) par
le N-[2-hydroxy-2-(3,4-dihydroxyphényl)éthyl]-3-[4-(N-méthyl-N-phénylamino)
pyrazolo[1,5-a]-1,3,5-triazin-8-yl]propionamide (lb24) on obtient de la. même
manière le produit titre (Rdt _ 83%): SM (IS) mlz 360 (M++1).
EXEMPLE 4: ACTIVITE PHARMACOLOGIQUE: STIMULATION DE LA
SYNTHESE DE FACTEURS NEUROTROPHIQUES
Des composés selon l'invention ont été évalués pour leurs propriétés
neurotrophiques. L'idée est donc d'observer le comportement d'une culture
cellulaire
de neurones en absence et présence de telles molécules. La molécule nommée Ia5
utilisée au cours de cet exemple est une molécule de structure générale Ici,
où n = 2
et rn = ;0 sous forme de sel de sodium.
Préparation des Neurones.
Des rats de souche Sprague Dawley sont élevés dans le Laboratoire jusqu'à
l'âge
adulte, soit trois mois après leur naissance. Ils sont nourris ad libitum dans
des salles
à une température de 22 2 C et où le cycle de lumière est de 12 heures
d'éclairage
(journée) et 12 heures d'obscurité.
Les animaux adultes sont mis en accouplement et les rates sont séparées le
lendemain. Au bout de 16 jours, les rates gestantes subissent une césarienne
et les
foetus sont mis dans une boîte de Petri de 100 mm de diamètre. Ils sont
transférés
dans la hotte à flux laminaire, en milieu stérile. Les foetus sont isolés par
unités et
sont disséqués sous une loupe binoculaire en milieu stérile. Le cortex
cérébral est
isolé et mis dans un tube contenant du milieu Neurobasal sans antibiotique. Le
tissu
est dissocié par aspirations-refoulement en cellules unitaires dans un volume
de 2 ml.
La suspension cellulaire est ensuite délicatement déposée sur 2 ml de sérum de
veau
foetal inactivé. Le tube est centrifugé à basse gravité (800 g) pendant 5 min
à
température ambiante. Le culot cellulaire est récupéré et les cellules sont
remises en
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
62
suspension dans du milieu Neurobasal complet. Les cellules sont comptées à
l'hématimètre de Mallassez en présence de bleu trypan pour déterminer la
viabilité
cellulaire. La mise en culture a lieu par addition de 800.000 cellules à des
boîtes de
Petri de 60 mm de diamètre contenant le milieu Neurobasal complet
préalablement
préchauffé et équilibré dans un incubateur à C02. Ces boîtes on été
préalablement
recouvertes d'une couche de polylysine la veille de la manipulation. La
température
de l'incubateur est réglée à 37 C, le taux de C02 à 5 % et l'humidité est
saturante.
Les boîtes de Pétri contenant les cellules sont ensuite mises dans
l'incubateur.
Environ deux heures après la mise en culture, les cellules qui étaient
réfringentes
aussitôt après l'ensemencement deviennent noires, signe d'une adhésion au fond
de
la boîte de Pétri. Vingt quatre heures après la mise en culture, les neurites
commencent à pousser. La croissance se poursuit pendant une dizaine de jours,
puis,
des signes de sénescence commencent à apparaître. Ces cultures constituent des
cultures de neurones primaires.
Traitements des Neurones.
Les cultures de neurones telles que préparées ci-dessus servent de témoins. 5
boîtes
seront utilisées afin d'avoir une approche statistique.
Dans les autres boîtes, la molécule à tester est ajoutée à différentes
concentration :
0,1 mol/l, 1 gmol/1 et 10 mol/l. Dans chaque cas, la manipulation est
répétée 5
fois.
Les neurones sont examinés au microscope inversé à contraste de phase (Zeiss
Axiovert 135) tous les jours après ensemencement.
Les neurones sont photographiés à divers grossissements à l'aide d'un appareil
photographique et comparés entre séries.
Résultats
La présence de la molécule Ia5 sur les neurones se traduit par un
développement des neurites plus important que dans les cellules servant de
contrôle.
On observe un épaississement et un allongement des neurites en B par rapport
au
témoin A (figure 1).
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
63
On note également que le fait de rajouter du surnageant de culture
d'astrocytes
contribue à augmenter la densité des neurites en présence de la molécule,
comparativement au témoin.
EXEMPLE 5 : INHIBITION DES PHOSPHODIESTERASES DES
NUCLEOTIDES CYCLIQUES.
Détermination de l'inhibition de la PDE4.
Cette nouvelle famille de composés a été testée comme inhibiteur de
phosphodiestérase de type 4 humaine (source: cellules U-937) en suivant le
procédé
décrit par Torphy, T. J., Zhou, H. L. et Cieslinski, L. B. (J. Pharmacol. Exp.
Ther.,
1992, 263, 1195-1205). La concentration de substance qui inhibe de 50%
l'activité
enzymatique (CI50) a été déterminée à une concentration de substrat ([3H]AMPe
+
AMPc) égale à 1 M, le temps d'incubation étant de 30 minutes à 30 C. Une
mesure
quantitative du produit d'hydrolyse [3H]-5'-AMP a été déterminée par
scintillation.
Les composés sont comparés au témoin rolipram, qui dans ce test présente une
CI50
de 0,39 M. Les composés les plus puissants selon l'invention possèdent une
CI50
comprise entre 20 nM et 0,01 nM.
Détermination de l'inhibition de la PDE2.
Cette nouvelle famille de composés a été testée comme inhibiteur de
phosphodiestérase de type 2 humaine (source: cellules U-937) en suivant le
procédé
décrit par Torphy, T. J., Zhou, H. L. et Cieslinski, L. B. (J. Pharinacol.
Exp. Ther.,
1992, 263, 1195-1205). La concentration de substance qui inhibe de 50%
l'activité
enzymatique (CI50) a été déterminée à une concentration de substrat ([3H]AMPc
+
AMPc) égale à 1 M, le temps d'incubation étant de 30 minutes à 30 C. Une
mesure
quantitative du produit d'hydrolyse [3H]-5'-AMP a été déterminée par
scintillation.
Les composés sont comparés au témoin EHNA, qui dans ce test présente une CI50
de
2,1 M. Les composés les plus puissants selon l'invention possèdent une CI50
comprise entre 5 M et 1nM.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
64
Détermination de la sélectivité vis-à-vis des PDEI, 3, 5 et 6.
Les composés les plus actifs sur la PDE2 et/ou PDE4 ont été testés pour leur
sélectivité vis-à-vis des phosphodiestérases des nucléotides cycliques
suivantes :
PDE 1 (bovine), PDE3 (humaine), PDE5 (humaine) et PDE6 (bovine) en suivant les
procédés respectivement décrits par : (i, PDEI) Nicholson C. D., JACKMAN S. A.
et
WILKE R. (Brit. J. Pharmacol. 1989, 97, 889-897) ; (ii, PDE3 et PDE5)
Weishaar,
R.E., Burrows, S. D., Kobylarz, D. C., Quade, M. M. and Evans, D. B. (Biochem.
Pharmacol., 1986, 35, 787-800); (iii, PDE6) Ballard, A. S., Gingell, C. J.,
Tang, K.,
Turner, L. A., PRICE, M. E. (J Urol, 1998, 159, 2164-2171). La concentration
de
substance qui inhibe de 50% l'activité enzymatique (CI50) a été déterminée
pour les
PDEI et PDE3 à une concentration de substrat ([3H]AMPc + AMPc) égale à 1 M,
le temps d'incubation étant de 30 minutes à 30 C. Dans le cas des PDE 5 et 6,
le
substrat utilisé est le ([3H]GMPe + GMPc) à une concentration de 1 1V1 pour
la PDE5
et 2 M pour la PDE6. Une mesure quantitative des produits d'hydrolyse '[3HJ-5'-
AMP et,[3HJ-5'-GMP a été déterminée par scintillation. Les composés sont
comparés
aux témoins suivants : 8-méthoxy-IBMX (C150 = 2,9 pM) pour la PDEI, milrinone
(CI50 = 0,25 M) pour la PDE3, dipyridamole (CI50 = 0,5 M) pour la PDE5,
zaprinast (CI50 = 0,38 M) pour la PDE6.
Les molécules préférées selon l'invention présentent un excellent profil de
puissance
et de sélectivité vis-à-vis de la phosphodiestérase de type 4 ou de la
phosphodiestérase de type 2, dans la mesure où ces composés inhibent de
manière
plus faible les autres PDE, notamment la PDE3. Le coefficient de sélectivité
est, pour
les composés les plus puissants, supérieur à 100. Idéalement, ce coefficient
est
supérieur à 1000 ou 10000 pour les composés de l'invention les plus puissants.
Dans
certains cas, des molécules possédant des activités proches pour la PDE2 et la
PDE4
ont été obtenues. Ces composés sont en revanche sélectifs vis-à-vis des autres
types
de PDE (PDE1, 3, 5, et 6).
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
EXEMPLE 7 PROPRIETES ANTI-INFLAMMATOIRES DES
COMPOSES DE L'INVENTION
Les composés selon l'invention ont été évalués pour leurs propriétés anti-
5 inflammatoires sur des cellules mononucléées de sang veineux (PBMC). Plus
particulièrement, les cellules ont été incubées durant 24 heures en présence
de la
molécule testée, après activation par du lipopolysaccharide (LPS) (1 g/ml) en
suivant le protocole décrit par Schindler, R., Mancilla, J., Endres, S.,
Ghorbani, R.,
Clark, S. C. et Dinarello, C. A. (Blood, 1990, 75, 40-47). Après incubation,
les
10 concentrations de TNFa ont été mesurées dans les surnageants de culture par
méthode EIA. Les composés sont comparés au témoin dexaméthasone, qui dans ce
test présente une CI50 de 4,6 M. Les composés les plus puissants selon
l'invention
possèdent une C150 inférieure à 1 M, c'est-à-dire qu'ils sont notablement plus
actifs
que la dexaméthasone. Certains composés de l'invention possèdent une CI50
15 comprise entre 100 nM et 1 nM sur ce test.
EXEMPLE 8 : EFFET NEUROPROTECTEUR SUR MODELES
D'APOPTOSE INDUITE.
20 Effet neuroprotecteur sur un modèle d'apoptose induite par la suppression
de
BDNF.
Ce test a été réalisé en suivant le protocole décrit par Estevez A. G. et al.
(J.
Neurosci. 1998, 18(3), 923-931). Brièvement, lorsque des cultures primaires de
cellules embryonnaires de motoneurones de rat sont privées du "brain-derived
25 neurotrophic factor" (BDNF), une induction de la "nitric oxide synthase"
neuronale
(NOS) a été observée, entraînant la mort progressive des neurones par apoptose
:
entre 18 et 24 heures après avoir réalisé la préparation biologique, plus de
60% des
neurones meurent. Dans ce modèle d'apoptose induite, le composé 4-[[1-(oxo)-3-
(4-
oxopyrazolo[1,5-a]-1,3,5-triazin-8-yl)propyl]amino]benzoate de sodium (Ia5)
30 protège les neurones à plus de 70% à une concentration de 1 mM.
CA 02493402 2005-01-26
WO 2004/011464 PCT/FR2003/002354
66
Effet neuroprotecteur sur un modèle d'apoptose de rnotoneurones induite par le
peroxynitrite.
Ce test a été réalisé en suivant le protocole décrit par Cassina P. et al.
(J..
Neurosci. Res. 2002 67(l):21-9). Brièvement, le stress oxydatif médié par
l'oxyde
nitrique et son métabolite toxique, le peroxynitrite, a été associé à la
dégénérescence
des neurones moteurs, notamment dans la sclérose amyotrophique latérale. Les
astrocytes de la moëlle épinière répondent aux concentrations extracellulaires
de
peroxynitrite en adoptant un phénotype qui est cytotoxique pour les neurones
moteurs. Dans ce modèle d'apoptose induite par le peroxynitrite, le composé 4-
[[1-
(oxo)-3-(4-oxopyrazolo[1,5-a]-1,3,5-triazin-8-yl)propyl]amino]benzoate de
sodium
(la5) protège les neurones à plus de 60% à une concentration de 1 mM.