Note: Descriptions are shown in the official language in which they were submitted.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
1
DIPHOSPHINES, LEUR PREPARATION ET LEURS UTILISATIONS.
La présente invention a pour objet de nouvelles diphosphines notamment
sous leur forme optiquement active ainsi que le procédé permettant de les
obtenir.
L'invention vise également leurs utilisations comme ligands bidentés dans
la synthèse de catalyseurs à base de métaux de transition destinés à la
catalyse
asymétrique.
L'invention vise également leurs utilisations comme produits intermédiaires
dans la préparation de ligands sous forme insoluble. Plus particulièrement,
l'invention réside dans un polymère optiquement actif dans lequel l'un des
motifs
polymériques est constitué par une diphosphine chirale.
L'invention vise également l'utilisation dudit polymère comme ligand dans la
préparation de complexes métalliques destinés à la catalyse asymétrique.
La production de composés optiquement actifs purs est un problème qui se
pose dans de nombreux domaines techniques tels que par exemple, la
pharmacie, l'agrochimie, l'industrie alimentaire (additifs alimentaires,
arômes) et
également dans l'industrie de la parfumerie.
On s'attend à ce que ce problème prenne une importance croissante car de
plus en plus, on constate que dans une application donnée, seul l'un des
stéréomères présente la propriété recherchée.
La catalyse asymétrique a connu ces dernières années un essor
considérable. Elle présente l'avantage de conduire directement à la
préparation
d'isomères optiquement purs ou optiquement enrichis par induction asymétrique
sans qu'il soit nécessaire de procéder au dédoublement de mélanges
racémiques.
Le 2,2'-bis(diphénylphosphino)-1,1'-binaphtyle (BINAP) est un exemple de
ligand disphosporé utilisé couramment pour la préparation de complexes
métalliques pour la catalyse asymétrique des réactions d'hydrogénation, de
carbonylation, d'hydrosilylation, de formation de liaisons C-C (telles que les
substitutions allyliques ou les couplages croisés de Grignard) ou même
d'isomérisation asymétrique d'allylamines.
Les complexes utilisés sont dérivés des sels de palladium, de ruthénium,
de rhodium et d'iridium.
La mise au point de nouveaux ligands chiraux est souhaitable pour
plusieurs raisons.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
2
On recherche des ligands susceptibles d'améliorer l'énantiosélectivité des
réactions.
On a également besoin de ligands facilement accessibles d'un point de vue
industriel.
Ainsi, on a décrit dans WO 00/49028, une diphosphine qui est un dérivé du
BINAP dont les deux groupes naphtyle portent un substituant en position 6 et
6'.
II s'agit plus précisément de 6,6'-diaminométhyIBINAP.
Or la préparation de cette phosphine n'est pas aisément réalisable
industriellement car elle comporte de nombreuses étapes
\ \ Br \ \
s i
~OH bromation ~ ~ OH
\ \ ~H \ \ OH
Br
protection ,
Br \ \ NC I \ \
OTf ~Yanation ~ ~ OTf
\ \ OTf \ \ OTf
Br NC
Iphosphination
N ~YC
PPh~
PPh2
PPh2
. . __ PPh2 _
Poursuivant ses recherches, la demanderesse a trouvé qu'il était possible
de préparer des diphosphines susceptibles d'être préparées beaucoup plus
réduction
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
3
aisément à l'échelle industrielle car elles dérivent d'un produit commercial à
savoir le 2,2'-bis(diphénylphosphino)-1,1'-binaphthyle ou BINAP.
Un premier objet de l'invention sont des diphosphines dont les groupes
naphtyle sont substitués en position 5,5'.
Un autre objet de l'invention sont les produits intermédiaires qui sont des
diphosphines sous forme de dioxyde et ayant des substituants en position 5,5'.
L'invention vise aussi bien le mélange racémique que les formes
optiquement actives desdites diphosphines.
D'autres objets de l'invention sont les procédés de préparation desdites
diphosphines ainsi que leurs utilisations en catalyse asymétrique.
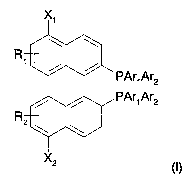
La présente invention fournit donc une diphosphine susceptible d'étre
utilisée comme ligands dans des catalyseurs chiraux et répondant à la formule
X,
R
PArlAr2
PAr1 Ar2
R
(I)
dans ladite formule
- R1, R2, identiques ou différents représentent un atome d'hydrogène ou un
substituant,
- Ari et Ar2 représentent indépendamment un groupe alkyle, alcényle,
cycloalkyle, aryle, arylalkyle,
- X1, X2, identiques ou différents, représentent
. un groupe R, alkyle, alcényle, alcynyle, cycloalkyle, aryle, arylalkyle,
. un groupe alkyle substitué par un ou plusieurs atomes d'halogène, de
préférence le fluor ou par des groupes nitro ou amino,
. un atome d'halogène choisi parmi le brome, le chlore ou l'iode,
. un groupe -OH,
. un groupe -O-Ra,
. un groupe -O-CORa,
. un groupe -S-Ra,
~ . un groupe -CN,
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
. un groupe dérivé du groupe nitrite tel que
. un groupe -CH2-NH2,
. un groupe -COOH,
. un groupe dérivé du groupe carboxylique tel que
. un groupe -COORa,
. un groupe -CH20H,
. un groupe -CO-NH-Rb,
. un groupe dérivé du groupe aminométhyle tel que
. un groupe -CH2-NH-CO-Rb,
. un groupe -CH2-NH-CO-NH-Rb,
. un groupe -CH2-N=CH-Ra,
. un groupe -CH2-N=C=O,
. un groupe -CH2-NH~+,
. un groupe comprenant un atome d'azote tel que
. un groupe -NHRa,
. un groupe -N(Ra)2,
. un groupe -N=CH-Ra,
. un groupe -NH-NH2,
. un groupe -N=N+=N-,
. un groupe -N=C=O,
. un atome de magnésium ou de lithium,
dans les différentes formules, Ra représente un groupe alkyle,
cycloalkyle, arylalkyle, phényle et Rb a la signification donnée pour Ra
et représente également un groupe naptyle.
La présente invention vise également les produits intermédiaires à savoir la
diphosphine sous forme de dioxyde, sous forme racémique ou sous forme
chirale et qui répond à la formule suivante
~1
R1
POArIAr2
s / POArIAr2
R~ ~~~J
01
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
~'Ve~~ eo ~ ~
dans ladite formule (II), R1, R2, Ari, Ar2, X1, X2 ont la signification donnée
pour la
formule (I).
Parmi les diphosphines répondant à la formule générale (I), un groupe
5 particulièrement intéressant de diphosphines est celui constitué par les
diphosphines qui répondent à la formule (l') et qui sont susceptibles d'étre
utilisées comme produits intermédiaires pour la préparation de polymères
insolubles en tant que constituants de l'un des motifs polymériques
X.
R
PArlAr2
PArlAr2
R
X2 (I s)
dans ladite formule
- R1, R2, identiques ou différents représentent un atome d'hydrogène ou un
substituant,
- Ari et Ar2 représentent indépendamment un groupe alkyle, alcényle,
cycloalkyle, aryle, arylalkyle,
- Xi, X~, identiques, représentent
. un groupe -OH,
. un groupe -CH20H,
. un groupe -CH2-NH2,
. un groupe -COOH,
, un groupe -COORa dans lequel Ra représente un groupe alkyle,
cycloalkyle, arylalkyle, phényle ,
. un groupe -N=C=O,
. un groupe -CH2-N=C=O.
La caractérisque des diphosphines de formule (l') est de porter deux
groupes fonctionnels susce_ ptibles de réagir avec un ou plusieurs monomères
polymérisables conduisant à un polymère qui, lorsqu'il est obtenu à partir
d'une
diphosphine chirale est optiquement actif et est donc susceptible d'être
utilisé
comme ligand dans des complexes métalliques mis en oeuvre en catalyse
asymétrique.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
ô ~6D1~ U'~ 2~ ~ A 4f~
6
On rappelle ci-après la définition de certains termes utilisés dans le présent
texte.
Le terme « chiral » se réfère à une entité moléculaire, non superposable à
son image dans un miroir.
Un composé est racémique s'il est le mélange équimolaire de ses 2 formes
énantiomères. Le terme « énantiomères » désigne des entités moléculaires qui
sont images l'une de l'autre dans un miroir et qui ne sont pas superposables.
Un composé est optiquement actif s'il est capable de faire tourner le plan
de polarisation d'un faisceau transmis de lumière polarisée plane. Un composé
optiquement actif est nécessairement chiral.
Dans le cadre de l'invention, on entend par « alkyle », une chaîne
hydrocarbonée linéaire ou ramifiée ayant de 1 à 15 atomes de carbone et de
préférence de 1 ou 2 à 10 atomes de carbone.
Des exemples de groupes alkyle préférés sont notamment méthyle, éthyle,
propyle, isopropyle, butyle, isobutyle, t-butyle.
Par « alcényle », on entend un groupe hydrocarboné, linéaire ou ramifié
ayant de 2 à~ 15 atomes de carbône, comprenant une ou plûsieurs doubles
- liaisons, de préférence, 1 à 2 doubles liaisons.
Par « alcynyle », on entend un groupe hydrocarboné, linéaire ou ramifié
ayant de 2 à 15 atomes de carbone, comprenant une ou plusieurs triples
liaisons, de préférence, 1 triple liaison.
Par « cycloalkyle », on entend un groupe hydrocarboné cyclique,
monocyclique comprenant de 3 à 8 atomes de carbone, de préférence, un
groupe cyclopentyle ou cyclohexyle ou polycyclique (bi- ou tricyclique)
comprenant de 4 à 18 atomes de carbone, notamment adamantyle ou
norbornyle.
Par « aryle », on entend un groupe mono- ou polycyclique aromatique, de
préférence, mono- ou bicyclique comprenant de 6 à 20 atomes de carbone, de
préférence, phényle ou naphtyle. Lorsque le groupe est polycyclique c'est-à-
dire
qu'il comprend plus d'un noyau cyclique, les noyaux cycliques peuvent être
condensés deux à deux ou rattachés deux à deux par des liaisons a.
Des exemples de groupes (C6-Ci$)aryle sont notamment phényle, naphtyle,
anthryle et_phénanthryle.. . .
Par « arylalkyle », on entend un groupe hydrocarboné, linéaire ou ramifié
porteur d'un cycle aromatique monocyclique et comprenant de '7 à 12 atomes de
carbone, de préférence, ben~yle.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
7
Dans la formule (I), (l') ou (II), les groupes carbocycliques Ari et Ar2
peuvent porter des substituants qui sont tels qu'ils n'interfèrent pas avec la
complexation du ligand au métal lors de la préparation du catalyseur.
Des exemples de substituants sont les groupes alkyle, alkoxy, thioalkoxy,
alkoxyalkyle, thioalkoxyalkyle, polyoxyalkylène, -S03H, -S03M où M est un
cation métallique ou ammonium, -P03H2, -P03HM ou -P03M2 où M est tel que
défini ci-dessus.
De préférence, M est un cation de métal alcalin tel que Na, Li ou K.
II est souhaitable que les substituants n'interfèrent pas avec les réactions
mises en oeuvre dans la préparation des composés (I) et (l') à partir des
précurseurs dont ils sont issus. Toutefois, des étapes de protection et
déprotection peuvent être envisagées, le cas échéant. L'Homme du Métier
pourra se reporter à l'ouvrage suivant Protective Gr~ups in Organic Synthesis,
Greene T.W. et Wuts P.G.M., ed. John Wiley et Sons, 1991 en vue de réaliser la
protection de fonctions organiques particulières
Dans les groupes alkyle, alkoxy, thioalkoxy, alkoxyalkyle et
thioalkoxyalkyle, , les parties alkyle sont des groupes hydrocarbonés saturés,
linéaires ou ramifiés, comprenant notamment jusqu'à 25 atomes de carbone, et,
par exemple de 1 à 12 atomes de carbone, mieux encore de 1 à 6 atomes de
carbone.
Des exemples de groupes alkyle sont les groupes méthyle, éthyle, propyle,
isopropyle, butyle, isobutyle, t-butyle, pentyle, isopentyle, néopentyle, 2-
méthylbutyle, 1-éthylpropyle, hexyle, isohexyle, néohexyle, 1-méthylpentyle, 3-
méthylpentyle, 1,1-diméthylbutyle, 1,3-diméthylbutyle, 2-éthylbutyle, 1-methyl-
1-
éthylpropyle, heptyle, 1-méthylhexyle, 1-propylbutyle, 4,4-diméthylpentyle,
octyle, 1-méthylheptyle, 2-éthylhexyle, 5,5-diméthylhexyle, nonyle, décyle, 1-
méthylnonyle, 3,7-diméthyloctyle et 7,7-diméthyloctyle.
De façon préférée, les substituants sont des groupes alkyle ou alkoxy ayant
de préférence de 1 à 6 atomes de carbone.
Conformément à la présente invention, les ligands préférés et leurs
intermédiaires répondent respectivement aux formules (I), (l') ou (II) dans
lesquelles Arl, Ar2 représentent indépendamment un groupe (C1-C6)alkyle ; un
.groupe phényle éventuellement substitué par un ou plusieurs (Ci-C6)alkyle ou
(Ci-C6)alkoxy ; ou un groupe (C~.-Cs)cycloalkyle éventuellement substitué par
un
ou plusieurs groupes (C1-C6)alkyle.
Parmi les composés de formule (I), (l') ou (II) préférés, on compte ceux
pour lesquels Ari et Ar2 sont indépendamment un groupe (Ci-C~.)alkyle ; un
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
ô
groupe phényle éventuellement substitué par méthyle ou tertiobutyle ; ou un
groupe (C5-C6)cycloalkyle éventuellement substitué par méthyle ou
tertiobutyle.
On préfère tout particulièrement les composés de formule (I), (l') ou (II)
dans lesquels Ar1 et Ar2 sont identiques et représentent préférentiellement un
groupe phényle.
Les groupes carbocycliques Ari et Ar2 peuvent porter des substituants qui
sont tels qu'ils n'interfèrent pas avec les réactions mises en jeu dans le
procédé
de l'invention. Ces substituants sont inertes dans les conditions mises en jeu
dans les réactions d'halogénation (étape i), de cyanation (étape ü), de
réduction
(étape iii et iv). Ainsi, l'invention n'exclut pas la présence d'autres
substituants
autre que Ri et R2.
Les groupes naphtyle peuvent également porter un substituant représenté
par Ri ou R~ qui peuvent être de même nature que ceux que l'on vient de
préciser.
De façon préférée, les substituants sont des groupes alkyle ou alkoxy ayant
de préférence de 1 à 6 atomes de carbone.
Dans les formules (I), (l') et (II), Ri, R2 représentent préférentiellement un
atome d'hydrogène, un ou plusieurs groupes choisis parmi (Ci-C4)alkyle et (C1-
C4)alkoxy.
Les composés (I), (l') et (II) préférés ne portent pas de substituant ce qui
signifie que Ri et R2 représentent un atome d'hydrogène.
Pour ce qui est des groupements Xi et X2 préférés, Ra représente un
groupe alkyle ayant de 1 à 4 atomes de carbone, un groupe cyclohexyle, un
groupe phényle et un groupe ben~yle et Rb a la signification donnée pour R~ et
représente également un groupe naphtyle.
Les groupes fonctionnels préférés situés en position 5 et 5' dans les
composés de formule (I), (l') et (II) sont les suivants
. un atome d'halogène, de préférence un atome de brome ou de chlore,
. un groupe alkyle substitué par un ou plusieurs atomes de fluor,
. un groupe -CN,
un groupe -CH2-NH2,
un groupe -COOH.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
9
Parmi les composés de formule (I), on distingue notamment les composés
de formule suivante
X
R
PArlAr2
PAri Ar2
R
X
(la,)
dans ladite formule
- X représente un atome de chlore, de brome ou d'iode,
- Ri, R2, Ari et Are ont la signification donnée précédemment.
Un premier objet de l'invention réside dans un procédé de préparation de la
diphosphine de formule (lai) caractérisé par le fait qu'il comprend les étapes
suivantes : a
i) réaliser l'halogénation en position 5,5' d'un composé de formule (III)
\ \
R1
POArIAr2
POArIAr2
R2
\ \
(III)
dans ladite formule
- Ri, R2, Ari et Ar2 ont la signification donnée précédemment,
au moyen d'un halogène et en présence de fer de façon à obtenir le dihalogéné
correspondant de formule
X
R
POArIAr2
__ . POArIAr2 _ . _
R
X (Ilai)
dans ladite formule
- X représente un atome de chlore, de brome ou d'iode,
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
- R1, R2, Ar1 et Ar2 ont la signification donnée précédemment.
ü) réaliser la réduction de la diphosphine sous forme de dioxyde et
dihalogénée en position 5,5' de formule (Ilai), en diphosphine de formule
(la1)
X
R
PArlAr2
PArlAr2
R
X
(la1)
5 dans ladite formule
- X représente un atome de chlore, de brome ou d'iode,
- Ri, R2, Ar1 et Ar2 ont la signification donnée précédemment.
La diphosphine sous forme dioxyde de formule (III) est connue. Elle peut
10 être obtenue par oxydation de la diphosphine de formule (I~ .:
PAr1 Ar2
PAri Ar2
(I~
dans ladite formule
- Ri, R2, Ar1 et Ar2 ont la signification donnée précédemment.
La diphosphine sous forme d'oxyde de formule (III) est obtenue par
oxydation à l'aide d'un agent oxydant de la diphosphine de formule (I~.
Bien que l'on puisse utiliser n'importe quel type d'agents oxydants, un
oxydant chimique, par exemple le permanganate de potassium ou bien l'oxygène
moléculaire ou un , gaz en contenant, on , préfère faire appel au peroxyde-
d'hydrogène, de préférence, sous forme de solution aqueuse.
La concentration de la solution de peroxyde d'hydrogène est
avantageusement comprise entre 10 % et 35 % en poids.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
11
La quantité d'agent oxydant mise en oeuvre peut varier largement de la
quantité stoechiométrique jusqu'à un excès de 100 % par rapport à la
stcechiométrie.
On fait appel à un solvant organique qui solubilise la diphosphine. Le
solvant peut être choisi parmi les hydrocarbures aliphatiques,
cycloaliphatiques
ou aromatiques, chlorés ou non. Comme exemples, on peut citer le
dichlorométhane, le chloroforme, le tétrachlorure de carbone, le 1,2
dichloroéthane.
La concentration de la diphosphine dans le solvant réactionnel est de
préférence, entre 0,1 et 50 g/I.
On met donc en contact la diphosphine dissous généralement dans un
solvant adéquat, en contact avec l'agent oxydant.
La réaction est conduite avantageusement à la température ambiante, le
plus souvent entre -5°C et 25°C.
La durée de la réaction se situe généralement entre 30 min et 6 h.
On récupère la diphosphine sous forme de dioxyde dans la phase
organique.
On sépare les phases aqueuse et organique.
On effectue un traitement classique des phases.
Ainsi, la~ phase organique est lavée avec du bisulfite de sodium ce qui
permet d'éliminer dans la phase aqueuse l'excès d'agent oxydant (peroxyde) qui
n'a pas réagi.
On effectue préférentiellement une opération de séchage habituel, sur
desséchant par exemple sulfate de sodium ou de magnésium.
On obtient une diphosphine sous forme de dioxyde répondant à la formule
(III) et désigné dans la suite du texte par « diphosphine (PO) ».
Conformément à la présente invention, on effectue la réaction
d'halogénation du noyau naphtyle qui est une réaction électrophile réalisée
par
action d'un halogène, chlore, brome ou iode sur la diphosphine sous forme de
dioxyde et en présence d'un catalyseur.
Cette réaction peut être mise en ceuvre en présence d'un catalyseur qui est
à base de_fer. ..On fait appel de préférence à de la tournure ou de la
limaille de
fer.
La quantité de fer mise en oeuvre est telle que le rapport entre le nombre
de moles de fer et le nombre de moles de composé de formule (III) varie
entre 15 et 30 et plus particulièrement aux environs de 20.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
12
Selon un mode de réalisation préféré de l'invention, l'halogénation a lieu
dans un solvant aprotique inerte.
Ledit solvant doit avoir un point d'ébullition supérieur à 60°C. On
fait appel
tout particulièrement aux hydrocarbures halogénés, chlorés ou bromés et
préférentiellement au chloroforme, au tétrachlorure de carbone ou 1,2
dichloroéthane.
A titre de solvant préféré, on peut citer le 1,2-dichloroéthane.
De manière préférée, le rapport molaire de l'agent d'halogénation à la
diphosphine (PO) varie entre 15 et 30 de préférence aux environs de 20.
Lorsqu'on travaille en solution, la concentration des réactifs peut varier
très
largement entre 0,01 et 10 mol/I, par exemple entre 0,05 et 1 mol/I.
La réaction d'halogénation, de préférence de bromation est conduite entre
20°C et 100°C et d'une manière avantageuse, à l'abri de la
lumière afin d'éviter
les réactions radicalaires parasites.
On obtient ainsi une diphosphine (PO) dihalogénée répondant à la formule
(Ila1).
On la récupère d'une manière classique : neutralisation de l'excès de
brome par le bisulfite de sodium, traitement par une base (carbonate ou
hydrogénocarbonate de sodium), séparation des phases aqueuse et organique
puis récupération de la diphosphine (PO) dihalogénée à partir de la phase
organique qui est séchée puis élimination du solvant organique.
A l'étape (ü), l'atome de phosphore sous forme oxydé (PO) est réduit et l'on
obtient la diphosphine de formule (lai).
Dans une étape suivante, on effectue la réduction de la diphosphine sous
forme de dioxyde.
Cette étape consiste à soumettre cette dernière à une réduction effectuée à
l'aide d'un hydrogénosilane.
Ce dernier peut être représenté par la formule suivante
HSIRaRsRs (Fa)
dans ladite formule
- Ra, R~, Rs, identiques ou différents, représentent, un atome d'hydrogène,
un groupe alkyle ayant de 1 à 6 atomes de çarbone, un groupe phényle.
ou un atome de chlore,
- au plus deux des groupes Ra, R~, Rs, représentent un atome d'hydrogène.
Les agents réducteurs préférés répondent à la formule (Fa) dans laquelle
Ra, R~, Rs, représentent un atome d'hydrogène, un groupe méthyle, un groupe
phényle ou un atome de chlore.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
13
Comme exemples de réducteurs, on peut mentionner plus
particulièrement
- AIH3,
- PhSiH3,
- HSiCl3,
- (CH2)2HSiCl,
- CH3HSiCl
- PMHS ou polyméthylhydrosiloxane.
L'invention n'exclut pas tout autre type de composé organosilicié
comprenant un groupe SiH.
La quantité d'agent réducteur est le plus souvent en grand excès
staechiométrique.
Ainsi, le rapport entre le nombre de moles d'agent réducteur et le nombre
de moles de diphosphine (PO) varie entre 10 et 70.
Parmi les agents réducteurs précités, on utilise un mélange de PhSiH3 (ou
PMHS) et de HSiCl3.
Dans ce cas, la quantité de PhSiH3 est telle que le rapport entre le nombre
de moles de PhSiH3 et de moles de diphosphine (PO) varie entre 50 et 70.
Pour ce qui est de la quantité de HSiCl3, le rapport entre le nombre de
moles de HSiCl3 et le nombre de moles de diphosphine (PO) varie entre 10 et
40.
La réaction de réduction est conduite à une température avantageusement
choisie entre 80°C et 130°C.
En fin de réaction, on effectue le refroidissement du milieu jusqu'à
température ambiante et l'on récupère le produit sous forme solide après
évaporation.
On peut effectuer un ou plusieurs lavages du produit à l'aide d'un solvant
organique, de préférence un hydrocarbure aliphatique, cycloaliphatique ou
aromatique, halogéné ou non. Comme solvants préférés, on peut citer le
pentane, fhexane ou le cyclohexane.
On obtient une diphosphine répondant à la formule (lai).
La- présente - invention fournit également le procédé d'obtention d'une -
diphosphine répondant à la formule (la2)
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
14
R
PAri Ar2
PArlAr2
R
(la2)
dans laquelle Ri, R2, Ari et Ar2 sont tels que définis ci-dessus.
Le procédé de l'invention d'obtention de la diphosphine de formule (la2)
comprend plus précisément les étapes suivantes
i) réaliser la substitution des deux atomes d'halogène, de préférence de
brome par des groupes cyano par réaction de la diphosphine sous forme de
dioxyde et dihalogénée en position 5,5' de formule (Ilai)
X
\ \
R1
~ POArIAr2
POArIAr2
R
X (Ila1)
dans ladite formule
- X, R1, R2, Ari et Ar2 ont la signification donnée précédemment,
au moyen d'un agent nucléophile approprié de façon à obtenir le dicyané
correspondant (Ila2),
R
POAr1 Ar2
POArIAr2
R
CN (Ila2)
dans ladite formule
- R1, R2, Ari et Ar2 ~nt la signification donnée précédemment,
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
ü) réaliser la réduction de la diphosphine sous forme de dioxyde et dicyanée
en
position 5,5' de formule (Ila2), en diphosphine de formule (la2)
R
PArlAr2
PAri Are
R
CN (la2)
dans ladite formule
5 - Ri, R2, Ari et Ar2 ont la signification donnée précédemment.
Au départ d'une diphosphine sous forme de dioxyde et dihalogénée de
formule (Ilai), l'étape suivante est une réaction de cyanation qui est une
substitution nucléophile. Les deux àtomes d'halogène portés par les noyaux
10 naphtyle sont déplacés par des groupes cyano par action d'un agent
nucléophile
approprié.
De façon à réaliser cette substitution, l'homme du métier pourra utiliser
l'une quelconque des méthodes connues dans la technique.
Selon un mode de réalisation préféré de l'invention, l'agent nucléophile
15 utilisé est le cyanure de cuivre (I) ou (II).
Le rapport molaire du cyanure de cuivre au composé de formule (Ilai) est
de préférence supérieur à 2, il peut varier avantageusement entre 2 et 4,
préférablement entre 2 et 3.
La réaction est de préférence mise en oeuvre dans un solvant. Comme
exemple de solvants, on peut citer les amides tels que le diméthylformamide,
la
N-méthyl-2-pyrrolidinone et l'hexaméthylphosphorylamide. Le diméthylformamide
est nettement préféré. La pyridine est également un solvant approprié.
La température de la réaction est maintenue avantageusement entre
50°C
et 200°C, de préférence entre 100°C et 190° C.
La concentration des réactifs dans le milieu réactionnel oscille
généralement entre 0,1 et 10 mol/I, par exemple entre 2 et 7 mol/I.
L'isolement du nitrite implique la décomposition du complexe intermédiaire
formé et le piégeage de l'excès de cyanure.
L'hydrolyse du complexe intermédiaire pourra être réalisée soit par action
de chlorure de fer hydraté, soit par action d'éthylènediamine aqueux.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
16
Dans le premier cas, on verse le milieu réactionnel dans une solution
aqueuse de chlorure de fer à 50-80 % (g/ml) contenant de l'acide chlorhydrique
concentré. La solution résultante est chauffée à 40-80°C jusqu'à
décomposition
complète du complexe. Puis le milieu est décanté et extrait de façon
conventionnelle.
Dans le second cas, le milieu réactionnel est versé dans une solution
aqueuse d'éthylènediamine (éthylènediamine/eau : 1/5 - 1/1 (v/v), par exemple
1/3) puis l'ensemble est agité vigoureusement. Le milieu est alors décanté et
extrait de façon connue en soi.
L'homme du métier pourra s'inspirer des travaux de L. Friedman et al.
publiés dans J.O.C. 1961, 26, 1522, pour isoler le nitrite.
Au départ de la diphosphine (PO) dicyanée de formule (Ila2), on obtient le
composé de formule (la2) par réduction de la diphosphine sous forme de dioxyde
telle que précédemment décrite.
La présente invention fournit par ailleurs un procédé de transformation des
composés de~,formule (la2) (lesquels présentent deux fonctiôns cyano) en
composés diaminométhylés correspondants.
Ainsi, selon un autre de ses aspects, l'invention concerne un procédé
comprenant en plus des étapes (i) et (ü) définies ci-dessus pour la
préparation de
la diphosphine de formule (la2), une étape supplémentaire de réduction de la
fonction nitrite du composé de formule (la2) par action d'un agent réducteur
de
façon à obtenir un composé de formule (lai)
ÇH2-NH2
\ \
R1
/ ~ pArlAr2
/ / PAri Ar2
R2\~\~
(lai)
. dans ladite formule : _ _
- R1, R2, Ar1 et Ar2 ont la signification donnée précédemment.
Dans une étape suivante, on effectue la réduction du groupe cyano.
Un agent réducteur approprié est l'hydrure de lithium et aluminium (LiAIH4).
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
17
L'invention n'entend pas se limiter à l'utilisation de cet agent réducteur
particulier.
La réaction est préférablement mise en osuvre dans un solvant ou un
mélange de solvants.
Lorsque l'agent réducteur est LiAIH4, le solvant comprend de façon
avantageuse un ou plusieurs hydrocarbures aromatiques (tels que le benzène, le
toluène et le xylène) en mélange avec un ou plusieurs éthers.
A titre d'éthers, on peut citer les éthers d'alkyle en C1-C6 (éther
diéthylique
et düsopropylique), les éthers cycliques (dioxane, tétrahydrofurane), le
diméthoxyéthane et l'éther diméthylique de diéthylèneglycol.
On préfère les éthers cycliques du type du tétrahydrofurane.
Lorsque l'agent réducteur est LiAIH4, on optera plus préférablement pour un
mélange de toluène et de tétrahydrofurane dans des proportions variant entre
(v/v) 70-50/30-50 : toluène/tétrahydrofurane (par exemple 60/40 :
toluène/THF).
La réduction peut être conduite à une température comprise entre
20°C et
100°C, de préférence entre 40°C et 80°C.
Habituellement, on utilise un large excès de l'agent réducteur. Ainsi, le
rapport molaire de l'agent réducteur au composé de formule (la2) varie
généralement entre 1 et 30, par exemple entre 2 et 20, notamment entre 5 et
18.
La concentration des réactifs dans le milieu est variable ; elle peut être
maintenue entre 0,005 et 1 mol/I.
On obtient un composé de formule (lai) qui peut être récupéré d'une
manière classique, notamment par traitement avec une base (soude) pour
éliminer les aluminates suivi d'une filtration, d'un séchage et d'une
évaporation.
Les composés de formule (lai) obtenus selon le procédé de l'invention sont
nouveaux et forment un autre objet de l'invention.
Parmi ces composés, on préfère ceux pour lesquels dans laquelle Ar1 et
Ar2 sont choisis un groupe (Ci-C4)all~rle parmi phényle éventuellement
substitué
par méthyle ou tertiobutyle ; et (C5-C6)cycloalkyle éventuellement substitué
par
méthyle ou tertiobutyle.
On choisit plus préférentiellement ceux de formule (lai) dans laquelle Ari et
Ar2 sont identiques et représentent un groupe phényle.
En variante, _ il est possible de transformer les deux fonctions .cyano _des
._
composés de formule (la2) en fonctions acide carboxylique, imine,
hydroxyméthyle ou amide.
Les produits résultant de ces transformations sont autant de ligands
utilisables en catalyse asymétrique.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
18
En variante, l'invention fournit un procédé comprenant en plus des étapes
(i) et (ü) définies ci-dessus, l'étape consistant à traiter en milieu acide ou
en
milieu basique, le composé de formule (la2), de façon à obtenir l'acide
carboxylique correspondant de formule (la4)
wY W
~ pArlAr2
s / PArlAr2
R2 ~ _
COOH (laa.)
dans ladite formule
- R1, R2, Ari et Ar2 ont la signification donnée précédemment.
La transformation d'une fonction nitrite en fonction acide carboxylique est
décrite dans les ouvrages de base de la chimie organique. Aussi, l'homme du
métier pourra facilement déterminer les conditions réactionnelles appropriées.
Une façon simple de procéder consiste à utiliser en tant qu'agent
d'hydrolyse, de l'hydroxyde de sodium aqueux.
En variante, il est possible de transformer les deux fonctions carboxylique
des composés de formule (la4) en fonctions ester, hydroxyméthyle ou amide.
Une diphosphine de formule (las) qui correspond à la formule (I) ou (l')
dans laquelle Xi et X2 représentent un groupe -COORa est obtenue par
estérification directe du composé de formule (la4) réalisée classiquement en
milieu basique.
Une diphosphine de formule (la6) qui correspond à la formule (I) ou (l')
dans laquelle Xi et X2 représentent un groupe -CH20H est obtenue par
réduction du composé de formule (la4) à l'aide par exemple de LiAIH4 ou de NaH
[Gaylord, N.G. Reduction vVith complex metals hydride ; Wiley : NY, 1986
p.322].
Une diphosphine de formule (la,) qui correspond à la formule (I) ou (l')
dans laquelle Xi et X2 représentent un groupe -CO-NH-Rb est obtenue par
25- réaction du-composé d~-formule (Ia4) âvec-une amine Rb-NH2 en présence
d'un
agent de couplage comme par exemple le DCC (dicylohexylcarbamate)
(Klausner Y.S., Bodansky M., Synthesis, 1972, 453).
En variante, il est possible de transformer les deux fonctions aminométhyle
des composés de formule (lai) en fonctions amide ou urée.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
19
Une diphosphine de formule (la8) qui correspond à la formule (I) ou (l')
dans laquelle X1 et X2 représentent un groupe -CH2-NH-CO-Rb est obtenue par
réaction du composé de formule (lai) avec un acide Rb-COOH en présence d'un
agent de couplage comme par exemple le DCC (Klausner Y.S., Bodansky M.,
Synthesis, 1972, 453).
Une diphosphine de formule (lag) qui correspond à la formule (I) ou (l')
dans laquelle Xi et X2 représente un groupe -CH2-NH-CO-NH-Rb, est obtenue
par réaction du composé de formule (lai) avec un isocyanate Rb-NCO
généralement en milieu solvant [Rob Ter Halle, Benoit Colasson, Emanuelle
Schulz, Michel Spagnol, Marc Lemaire, Tetrahedron Letters, 2000, (41 ) 643-
646] .
Une diphosphine de formule (lalo) qui correspond à la formule (I) ou (l')
dans laquelle X1 et X2 représentent un groupe -CHI-N=CH-Ra est obtenue par
réaction du composé de formule (lai) avec un aldéhyde Ra-CHO (Farrar W.V.,
Rec. Chem. Prog, 1968, 29, 85).
Une diphosphine de formule (1a11) qui correspond à la formule (I) ou (l')
dans laquelle Xi et X2 représentent un groupe -CH2--N=C=O est obtenue par
réaction du composé de formule (lai) avec le phosgène effectuée selon
l'enseignement de la littérature notamment par Jerry MARCH, Advanced Organic
Chemistry, 5eme édition, John Wiley and Sons, p. 507.
Une diphosphine de formule (1a12) qui correspond à la formule (I) ou (l')
dans laquelle X1 et X2 représentent un groupe -CHz--NH4+ est obtenue par mise
en présence du composé de formule (lai) avec un acide, de préférence, l'acide
bromhydrique, à température ambiante, dans un solvant approprié capable de
solubiliser le composé de formule (la3). Un solvant approprié est par exemple
un
solvant aprotique tel qu'un hydrocarbure aliphatique halogéné (du type du
dichlorométhane ou du trichloréthylène) ou aromatique éventuellement halogéné
tel que le toluène ou le toluène halogéné. On récupère la diphosphine de
formule
(1a12) en phase aqueuse.
Des diphosphines de formule (1a13) ou (1a14) qui correspondent à la formule
(I) ou (l') dans laquelle Xi et X2 représentent respectivement un groupe -NHRa
ou un groupe -N(Ra)2 sont obtenues par réaction respectivement de la
diphosphine -sous forme de dioxyde et dihalogénée de formule (Ilai) et d'une
amine RaNH2 ou (Ra)2NH (Kazankov M.V., Ginodman L.G., J. ~rg. Chem,
USSR, 1975, 11, 451 ) suivie par une réduction de la diphosphine sous forme de
dioxyde telle que précédemment décrite.
Une diphosphine de formule (1a15) qui correspond à la formule (I) ou (l')
dans laquelle X1 et X2 représentent un groupe -N=CH-Ra est obtenue par
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
réaction de l'ammoniac avec la diphosphine sous forme de dioxyde et
dihalogénée de formule (Ila~) puis réaction du groupe amino avec un composé
de type Ra-CHO suivie par une réduction de la diphosphine sous forme de
dioxyde telle que précédemment décrite.
5 Une diphosphine de formule (lais) qui correspond à la formule (I) ou (l')
dans laquelle X1 et X2 représentent un groupe -NH-NH2 est obtenue par réaction
de l'hydrazine avec la diphosphine sous forme de dioxyde et dihalogénée de
formule (Ilai) (Ka~ankov M.V., Ginodman L.G., J. Org. Chem, USSR, 1975, 11,
451 ) suivie par une réduction de la diphosphine sous forme de dioxyde telle
que
10 précédemment décrite.
Une diphosphine de formule (lais) qui correspond à la formule (I) ou (l')
dans laquelle Xi et X2 représentent un groupe -N=N+=N- est obtenue par
réaction de HN3 ou NaN3 avec la diphosphine sous forme de dioxyde et
dihalogénée de formule (Ilai) (Scriven E.F.V, Turnbull K., Chem.Rev, 1988, 88,
15 297) suivie par une réduction de la diphosphine sous forme de dioxyde telle
que
précédemment décrite.
Une diphosphine de formule (lais) qui correspond à la formule (I) ou (l')
dans laquelle X1 et X2 représentent un groupe -N=C=O est obtenue par réaction
du composé de formule (1a13) avec le phosgène effectuée selon l'enseignement
20 de la littérature notamment pâr Jerry MARCH, Advanced Organic Chemistry,
5eme édition, John Wiley and Sons, p. 507.
En variante, l'invention fournit également une diphosphine de formule (lai9)
dans laquelle X~ et X2 représentent un groupe hydrocarboné R choisi parmi les
groupes alkyle, alcényle, alcynyle, cycloalkyle, aryle, arylalkyle et qui est
obtenue
en préparant le réactif magnésien correspondant à la diphosphine dihalogénée
(Ilai) sous forme de dioxyde par réaction de cette dernière avec le magnésium
puis réaction du réactif obtenu avec l'hydrocarbure halogéné R-Xo (Xo = Br ou
CI)
(Kharasch M.S., Reinmuth O., Grignard reactions of nonmetallic substances ;
Prentice-hall :Englewood Cliffs, NJ, 1954, 5). On fait ensuite une réduction
de la
diphosphine sous forme de dioxyde telle que précédemment décrite.
En variante, l'invention fournit également une diphosphine de formule (la2o)
dans laquelle Xi et X2 représentent un groupe alkyle substitué par un ou
plusieurs. atomes d'halogène, notamment. par des atomes de fluor. II s'agit
préférentiellement d'un groupe perfluoroalkyle de type -(CH2)PFq dans lequel p
est compris entre 1 et 15, de préférence entre 6 et 10 et q est compris entre
3 et
21, de préférence entre 13 et 25.
L'obtention d'une telle diphosphine est obtenue en faisant réagir la
diphosphine sous forme de dioxyde et dihalogénée de formule (Ila1) avec
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
21
l'espèce iodée correspondante 1(CH2)PFq, p et q ayant les significations
données
précédemment, en présence de cuivre, éventuellement d'une base et d'un
solvant polaire.
Le rapport entre le nombre de moles de diphosphine de formule (Ila1) et le
nombre de moles de composé iodoperfluoré varie entre 1 et 5, de préférence
entre 1 et 3.
Le rapport entre le nombre de moles de cuivre et le nombre de moles de
diphosphine dibromée varie entre 5 et 10.
Pour ce qui est de la base, on fait appel à une base piégeante telle que
notamment celles mentionnées ci-dessus, en particulier la bipyridine.
Le rapport entre le nombre de moles de base et le nombre de moles de
diphosphine dibromée varie entre 0,1 et 1.
La réaction a lieu avantageusement dans un solvant polaire tel que par
exemple, le diméthylsulfoxyde, le diméthylformamide, le fluorobenzène.
La réaction a lieu entre 60°C et 100°C, de préférence entre
70°C et 80°C.
La réaction dure entre 24 et 36 heures.-
En fin de°_ réaction, on dilue par un solvant (par exemple
dichlorométhane),
on sépare le cuivre par filtration et l'on récupère la phase organique qui est
lavée
classiquement à l'eau, puis avec une solution diluée d'acide (par exemple HCI
1 N) puis à l'aide de l'hydrogénocarbonate de .sodium.
La phase organique est séchée puis le solvant éliminé par évaporation.
On récupère la diphosphine sous forme de dioxyde présentant des groupes
perfluoroalkyle en position 5 et 5'. On fait ensuite une réduction de la
diphosphine sous forme de dioxyde telle que précédemment décrite.
En variante, l'invention fournit également une diphosphine de formule (1a21)
dans laquelle X1 et X2 représentent un groupe hydroxyle. Elle est obtenue à
partir de la diphosphine sous forme de dioxyde et dihalogénée de formule
(Ilai),
selon une réaction de substitution nucléophile aromatique par OH- [Fyfe, C.A.
in
Patai The Chemistry of the hydroxyl group, pt 1, Wiley : NY, 1971, p. 83]. On
fait
ensuite une réduction de la diphosphine sous forme de dioxyde telle que
précédemment décrite.
L'invention fournit également une diphosphine de formule (1a22) dans
laquelle Xi et X2 représentent un groupe -OCORa. Elle est. obtenue à partir de
la
diphosphine de formule (1a17) par réaction avec l'acide carboxylique RaCOOH ou
dérivé (halogénure ou anhydride), selon une réaction classique
d'estérification.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
22
Le procédé de l'invention peut être mis en oeuvre au départ d'un composé
de formule (I~ optiquement actif avec conservation de la chiralité d'un bout à
l'autre de la synthèse.
Ainsi, en partant du (S)-BINAP, on obtient le (S)-5,5'-diaminométhyl-2,2'
bis(diphénylphosphino)-1,1'-binaphtyle. Au départ du (R)-BINAP, on obtient le
(R)-5,5'-diaminométhyl-2,2'-bis(diphénylphosphino)-1,1'-binaphtyle.
Selon un autre aspect de l'invention, l'invention concerne l'utilisation de la
diphosphine dont les groupes naphtyle sont substitués en position 5,5' par
deux
groupes fonctionnels identiques capables de réagir avec de monomères
polymérisables conduisant à un polymère racémique ou optiquement actif.
Les diphosphines mises en oeuvre répondent à la formule (l').
Dans la formule (l'), Xi, représente un groupe aminométhyle -CH2-NH2, un
groupe hydroxy -OH, un groupe hydroxyméthyle -CH2-OH, un groupe
carboxylique ou ester -COORa (Ra représente un atome d'hydrogène ou un
groupe alkyle, cycloalkyle, arylalkyle, phényle plus préférentiellement un
atome
d'hydrogène ou un groupe alkyle Ci-C2), un groupe isocyanato -N=C=O, un
groupe isocyanatométhyle -CH2-N=C=O.
Avantageusement, il s'agit des diphosphines répondant aux formules (1a21),
(la3), (Ia4), (la5), (las), (lais), (laie).
Un autre objet de l'invention réside donc dans les polymères optiquement
actifs comprenant la diphosphine chirale de formule (l') comme motifs
polymériques.
Un autre objet de l'invention est constitué par l'utilisation du polymère
optiquement actif, comme ligand dans la préparation de complexes métalliques
destinés à la catalyse asymétrique.
Le polymère de l'invention est constitué d'un enchaînement de deux types
de motifs.
Le premier type de motif est le reste de la diphosphine chirale répondant à
la formule (l') et portant deux groupes fonctionnels identiques
polymérisables.
Le second type de motif est le reste d'un monomère polymérisable avec
lesdits groupes.fonctionnels, c'est-à-dire un monomère comprenant au_ moins
deux groupes fonctionnels identiques capables de réagir avec les groupes
fonctionnels de la diphosphine chirale.
Le monomère préféré est difonctionnel et il peut être représenté par la
formule (~ suivante
Yi - M - Yi
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
23
dans laquelle
- M représente un groupe divalent hydrocarboné à caractère aliphatique,
alicyclique et/ou aromatique,
- Yi représente un groupe fonctionnel, de préférence un groupe
carboxylique, ester, hydroxy, amino, isocyanato, aldéhyde, cétone.
La taille du groupe M sera ajustée par l'homme du métier en fonction de
l'utilisation finale du ligand et notamment en fonction de la réaction que
doit
catalyser le complexe métallique formé à partir de ce ligand polymère.
Des significations préférées seront données ultérieurement pour les réactifs
choisis préférentiellement.
On précisera que les monomères les plus souvent utilisés répondent à la
formule (~ dans laquelle M représente une chaîne alkylène C1-C12, de
préférence en Ci-C6 ; un groupe cycloalkylène, de préférence cyclohexylène ;
un
groupe arylène, de préférence phénylène, tolylène ou naphtalène.
Ainsi, le polymère optiquement actif résultant de la polymérisation de la
diphosphine de formule (l') et du monomère de formule (X) comprend le motif
récurrent suivant
R
PArlAr2
PAri Ar2
R
F1 _ M _ F1 (P)
dans lequel
- R1, R2, identiques ou différents représentent un atome d'hydrogène ou un
substituant,
- Ar1 et Ar2 représentent indépendamment un groupe alkyle, alcényle,
cycloalkyle, aryle, arylalkyle,
- M représente un groupe divalent hydrocarboné à caractère aliphatiqûe,
alicyclique et/ou aromatique ;
- F1 représente le groupe fonctionnel résultant de la réaction
. du groupe X1 choisi parmi les groupes : aminométhyle, hydroxy,
hydroxyméthyle, carboxylique, ester, isocyanato, isocyanatométhyle,
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
24
. et du groupe Y1 choisi parmi les groupes carboxylique, ester,
hydroxy, amino, isocyanato, aldéhyde, cétone,
- le degré de polymérisation est préférablement compris entre 2 et 100,
mieux encore entre 2 et 50.
Le choix de ces fonctions, combiné au choix des monomères
polymérisables, détermine la nature du polymère résultant.
Ainsi, Fi représente plus particulièrement
- un groupe urée (F1) résultant de la réaction d'un groupe aminométhyle
(Xi) avec un groupe isocyanato (Yi) ou un groupe isocyanato ou
isocyanatométhyle (Xi) avec un groupe amino (Yi),
- un groupe uréthane (Fi) résultant de la réaction d'un groupe isocyanato
ou isocyanatométhyle (Xi) avec un groupe hydroxy (Y1) ou un groupe
hydroxy ou hydroxyméthyle (Xi) avec un groupe isocyanato (Yi),
- un groupe ester (F1) résultant de la réaction d'un groupe carboxylique ou
ester (X1) avec un groupe hydroxy (Yi) ou un groupe hydroxy ou
hydroxyméthyle (Xi) avec un groupe carboxylique ou ester (Yi),
- un groupe amide (Fi) résultat de la réaction d'un groupe carboxylique
()Ci) avec un groupe amino (Yi) ou un groupe aminométhyle (Xi) avec un
groupe carboxylique (Yi),
- un groupe imine (F1) résultant de la réaction d'un groupe aminométhyle
(Xi) avec un groupe aldéhyde ou cétone (Yi).
La présente invention englobe tous les types de polymères et notamment
les polymères linéaires, ramifiés ou réticulés. On peut citer des polymères
tels
que les polyester, polyuréthane, polyamide, polyurée, polyimine, polyimide.
Les polymères préférés sont des polymères linéaires mais l'invention
n'exclut pas des polymères réticulés obtenus en mettant en oeuvre une
monomère polymérisable comprenant plus de deux groupes fonctionnels, par
exemple trois groupes.
Le choix des monomères mis en présence sera fonction de leur facilité
d'accès.
Ainsi, l'invention privilégie le corps chiral portant en position 5, 5' deux
groupes aminométhyle.
Les composés mis en oeuvre -préférentiellement, -répondant -à la--formule
(lai) dans laquelle Ar1 et Ar2 sont choisis indépendamment parmi un groupe (Ci-
C4)alkyle, phényle éventuellement substitué par méthyle ou tertiobutyle ; et
(C5-
C~)cycloalkyle éventuellement substitué par méthyle ou tertiobutyle.
On choisit plus préférentiellement ceux de formule (lai) dans laquelle Ari et
Ar2 sont identiques et représentent un groupe phényle.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
Conformément à l'invention, on fait réagir l'une des diphosphines répondant
à l'une des formules (l') avec un monomère polymérisable. On choisit
préférentiellement de ne mettre en oeuvre qu'un seul monomère polymérisable.
5 Comme classes de monomères, on peut mentionner notamment, les
diacides, les diesters, les diols, les düsocyanates, les dialdéhydes, ou les
dicétones.
Bien que l'invention n'entende pas s'y limiter spécifiquement, les
polyamides, polyurées et polyimides, vont faire l'objet d'une description plus
10 détaillée.
Les polyurées, polyamides et polyimides de l'invention peuvent être
préparés au départ d'une diphosphine chirale constitué d'un corps chiral
portant,
à titre de groupes fonctionnels, deux groupes aminométhyle et qui correspond
aux formules (la3).
Polyurées.
Lorsque le po¿ymère visé est ûne polyurée, celle-ci peut être synthétisée
par polymérisation d'une diphosphine portant deux groupes -CH2-NH2 avec un
ou plusieurs di- ou polyisocyanates.
La naturé du composé isàcyanate n'est pas critique en soi.
De manière préférée, le düsocyanate est un düsocyanate de formule (Xa)
O=C=N - J - N=C=O (~Ca)
dans laquelle
- J représente un groupe divalent hydrocarboné à caractère aliphatique,
alicyclique et/ou aromatique,
La taille du groupe J sera ajustée par l'homme du métier en fonction de
l'utilisation finale du ligand et notamment en fonction de la réaction que
doit
catalyser le complexe métallique formé à partir de ce ligand polymère.
Les sites catalytiques du polymère de l'invention sont situés au niveau des
motifs issus de la diphosphine. La taille du groupe J détermine donc
l'espacement des sites catalytiques.
Le groupe J est par exemple une chaîne alkylène en Ci-C16, de préférence
Ci-C12, -éventuellement.interrompue par_ un ou plusieurs.:(de préférence 1 à
4, _
mieux encore 1 à 2) hétéroatomes choisis parmi O, N et S, ladite chaîne
comprenant éventuellement une ou plusieurs insaturations (de préférence 1 à 4,
mieux encore 1 à 2) ; un groupe -(CH2)a-K-(CH2)b- où a et b sont
indépendamment un nombre entier de 0 à â et K représente (C6-
C8)cycloallcylène ; un groupe -(CH2)à L-(CH2)b- où a et b sont tels que
définis ci-
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
26
dessus et L représente (C6-Cio)arylène ; un groupe -(CH~)a-Vo-(CH2)b- où a et
b
sont tels que définis ci-dessus et Vo représente hétéroarylène de 5 à 8
chaînons
comprenant 1 à 3 hétéroatomes choisi parmi O, N et S ; ou bien encore un
groupe -Mo-Q-Mo- dans lequel Mo est choisi parmi (C3-C$)cycloal4cylène et (C6-
C1o)arylène et Q représente une liaison, un atome de soufre, un atome
d'oxygène, alkylène en (Ci-C4), -SO-, -S02- ou -CO-.
Lorsque J contient une chaîne alleylène, celle-ci est linéaire ou ramifiée et
comporte de préférence 1 à 6 atomes de carbone. Lorsque cette chaîne alkylène
comprend un atome d'azote, celui-ci porte un groupe (Ci-C6)alkyle ou un atome
d'hydrogène.
Lorsque J contient cycloalkylène, on préfère que J soit cyclohexylène.
Lorsque J contient arylène, on préfère que J soit phénylène ou naphtalène.
Lorsque J représente -(CN2)a-L-(CH2)b-, -(CH2)a-IC-(CH2)b- ou -(CH2)a-V0-
(CI'12)b-, on préfère que a et b soient identiques.
Par hétéroarylène, on entend un groupe bivalent correspondant à un
hétérocycle dans lequel deux atomes d'hydrogène ont été remplacés par deux
liaisons.
On préfère les hétéroarylènes dérivés des hétérocycles : furanne,
thiophène, pyrrole, oxazole, thiazole, imidazole, pyrrazole, isoxazole,
isothiazole,
pyridine, pyridazine, pyrimidine, pyrazine, indolizine, indole, isoindole,
benzofuranne, benzothiophène, benzimidazole, benzothiazole, quinoléine,
isoquinoléine, cinnoline, phtalazine, quinazoline, naphtyridine et ptéridine.
De
façon très avantageuse, hétéroarylène est dérivé de imidazole, benzimidazole,
pyrimidine ou quinazoline.
Lorsque J représente -Mo-Q-Mo-, on préfère que Q soit (Ci-C2)alkylène,
une liaison, et Mo soit cyclohexylène ou phénylène.
Le groupe J tel que défini ci-dessus peut porter un ou plusieurs substituants
choisis parmi un atome d'halogène, un groupe alleyle en C~-C6, un groupe
alcoxy
en C1-C6 , un groupe oxo et un groupe di(Ci-C6)alkylamino.
Des exemples de düsocyanates particulièrement appropriés sont
- le 1,2-düsocyanatopropane,
- le 1,4-düsocyanatobutane,
-1e.2,6-düsocyanatotoluène, _ _ .
- le 1,12- düsocyanatododécane,
- le trans-1,4-cyclohexanedüsocyanate,
- le 4,4'- düsocyanatodiphénylméthane,
- le 4,4'-düsocyanato-3,3'-diméthyldiphénylméthane,
- le 1,5-düsocyanatonaphtalène.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
27
La condensation du düsocyanate avec la diphosphine est mise en oeuvre
dans des conditions appropriées qui sont facilement déterminées par l'homme
du métier.
Ces conditions de polymérisation sont préférablement ajustées de façon à
obtenir un polymère présentant un degré de polymérisation de 2 à 100, de
préférence de 5 à 100, par exemple de 2 à 50, mieux encore de 4 à 25.
Des polyurées d'un degré de polymérisation de 3 à 8 conviennent
particulièrement bien.
L'Homme du Métier choisira le degré de polymérisation de façon à ce que
le polymère résultant soit insoluble dans le solvant ou mélanges de solvants
utilisés dans la réaction asymétrique devant être catalysée.
Le choix de la méthode de polymérisation n'est pas critique selon
l'invention.
Une méthode particulièrement approprie est la polymérisation en solution.
Le solvant est généralement un solvant polaire aprotique choisi parmi un
hydrocarbure aliphatique éventuellement halogéné, par exemple le chlorure de
méthylène, le chloroforme, le tétrachlorure de carbone ou le 1,2-
dichloroéthane ;
un hydrocarbure aromatique éventuellement halogéné, par exemple le
chlorobenzène ou le dichlorobenzène ; un éther tel que l'éther de diéthyle,
l'éther
de düsopropyle, le tétrahydrofuranne, le dioxanne, l'éther diméthylique de
diéthylèneglycol, les glymes et notammnent le 1,2-diméthoxyéthane ; un amide
tel que le formamide, le diméthylformamide, le diméthylacétamide, la N-méthyl-
2-
pyrrolidinone ou l'hexaméthylphosphorylamide ; un nitrite tel que
l'acétonitrile ou
l'isobutyronitrile ; et le diméthylsulfoxyde.
La concentration des réactifs dans la solution varie très largement en
fonction de la solubilité des réactifs. Elle est généralement comprise entre
0,05
et 1 mol/I, de préférence entre 0,01 et 1 mol/I, par exemple 0,1 mol/I.
De manière préférée, le düsocyanate est utilisé en léger excès par rapport
à la diphosphine, bien qu'en toute rigueur un rapport stoechiométrique de ces
deux composés puisse convenir.
Ainsi, le rapport molaire du düsocyanate à la diphosphine est généralement
fixé entre 1 et 1,5, par exemple entre 1 et 1,3.
_ . La température à laquelle est mise en oeuvre . la polymérisation est
déterminée en fonction de la réactivité des différents réactifs et du degré de
polymérisation souhaité. A titre d'indication, la température varie entre -
20°C et
100°C, de préférence entre la température ambiante et 100°C, par
exemple
entre 15 et 100°C, mieux encore entre 15 et 40°C.
Avantageusement, elle est de
20°C.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
28
La polymérisation est mise en oeuvre de façon conventionnelle par
solubilisation des réactifs dans le solvant, mélange, éventuellement chauffage
du
milieu réactionnel, puis isolement du polymère, par exemple par filtration du
milieu réactionnel. On notera qu'il peut être nécessaire, avant isolement du
polymère, de désactiver les extrémités de la chaîne polymère, et notamment les
fonctions isocyanates n'ayant pas réagi, par addition d'un alcanol en C,-C~,
par
exemple du propanol, de l'isopropanol, du méthanol, de l'éthanol ou même de
l'alcool tert-butylique.
Un exemple de polymère particulièrement préféré est un polymère
présentant comme motif récurrent
R
PArlAr2
PArlAr2
R
NH-(~U-HN-J-NH-(~U-NH (Pi)
dans lequel
- Ri, R2, identiques ou différents représentent un atome d'hydrogène ou un
substituant,
- Ari et Ar2 représentent indépendamment un groupe alkyle, alcényle,
cycloalleyle, aryle, arylalkyle,
- J a la signification donnée précédemment.
- le degré de polymérisation est préférablement compris entre 2 et 100,
mieux encore entre 2 et 50.
Polyamides.
Lorsque le polymère est un polyamide, celui-ci peut être préparé par
condensation d'une diphosphine chirale portant deux fonctions aminométhyle
avec un ou plusieurs acides dicarboxyliques ou dérivés activés de ceux-ci.
L'acide dicarboxylique répond avantageusement à la formule (Xb) suivante
HOOC - W - COOH (Xb)
dans laquelle W est tel que défini pour J ci-dessus.
Les significations préférées de J indiquées ci-dessus sont également des
significations préférées de W.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
29
Le groupe W peut être substitué par un ou plusieurs atomes d'halogène ou
groupes oxo, (Ci-C6)alkyle, (Ci-C6)alcoxy ou di(Ci-C6)alkylamino.
Parmi ces acides dicarboxyliques, on préfère ceux-ci ::
- les acides aliphatiques choisis parmi
- l'acide malonique,
- l'acide succinique,
- l'acide glutarique,
- l'acide adipique,
- l'acide 2,4-diméthyladipique,
- l'acide pimélique,
- l'acide subérique,
- l'acide azélaïque,
- l'acide sébacique,
- l'acide dodécanedioïque,
- l'acide fumarique,
- l'acide maléfique,
- l'acide méthyliminodiacétique, °~
- l'acide 3-diméthylaminohexanedioïque,
- les acides cycloalcanedicarboxyliques et notamment
- l'acide 1,4-cyclohexanedicarboxylique,
- les acides aromatiques dicarboxyliques choisis parmi
- l'acide phtalique,
- l'acide isophtalique,
- l'acide téraphtalique,
- l'acide phénylènediacétique,
- l'acide 1,5-naphtalènedicarboxylique,
- l'acide 4,4'-diphényldicarboxylique,
- l'acide 3,3'-diphényldicarboxylique,
- la 4,4'-dicarboxydiphénylsulfone,
- la 3,3'-dicarboxydiphénylsulfone.
Un groupe particulièrement préféré d'acides dicarboxyliques est constitué
des acides suivants
--l'acide succiniqûe, - -
- l'acide adipique,
- l'acide fumarique,
- l'acide isophtalique,
- l'acide téréphtalique,
- l'acide 1,5-naphtalènedicarboxylique,
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
- l'acide 4,4'-diphényldicarboxylique,
- l'acide 3,3'-diphényldicarboxylique.
Le dérivé activé de l'acide dicarboxylique désigne plus généralement le
composé acide dicarboxylique dans lequel une ou deux des fonctions
5 carboxyliques ont été modifiées de façon à accroître leur réactivité.
Des dérivés activés d'acide dicarboxylique sont par exemple obtenus par
formation d'une liaison anhydride ou d'un groupe -COY où Y est un atome
d'halogène tel que brome ou chlore.
D'autres dérivés activés des acides dicarboxyliques sont ceux portant en
10 lieu et place des fonctions carboxyliques, des groupes -COT où T désigne un
groupe azide, imidazolide, p-nitrophénoxy, 1-benzotriazole, N-O-succinimide,
acyloxy (tel que pivaloyloxy), (alcoxy en Ci-C4)carbonyloxy, dialkyl- ou
dicycloalleyl-O-uréide.
La condensation de la diphosphine avec l'acide dicarboxylique ou son
15 dérivé activé est généralement mise en oeuvre dans un solvant.
Lorsque l'acide dicarboxylique est utilisé en tant que tel, il peut être
avantageux de réaliser la conderisation en présence d'un catalyseur, par
exemple un acide fort tel que l'acide chlorhydrique ou sulfurique ou bien en
présence d'un agent de condensation tel que ceux couramment utilisés en
20 synthèse peptidique.
Parmi les agents de condensation connus, on peut citer les dérivés N-
hydroxylés tels que le N-hydroxysuccinimide et le 1-hydroxybenzotriazole ; les
disulfures tels que le 2,2'-disulfure de dipyridyle ; les dérivés d'acide
succinique
tels que le carbonate de N,N'-disuccinimidyle ; les chlorures phosphiniques
tels
25 que le chlorure N,N'-bis-(2-oxo-3-oxazolidinyl)phosphinique ; les oxalates
tels
que l'oxalate de N,N'-disuccinimidyle (DSO), le N,N'-oxalate de diphtalimide
(DPO), l'oxalate de N,N'-bis(norbornénylsuccinimidyle) (BNO), l'oxalate de
1,1'-
bis(benzotriazolyle) (BBTO), foxalate de 1,1'-bis(6-chlorobenzotriazolyle)
(BCTO) ou l'oxalate de 1,1'-bis(6-trifluorométhylbenzotriazolyle) (BTBO) ; les
30 triarylphosphines telles que la triphénylphosphine ; une association d'un
azodicarboxylate de di(alkyle inférieur) et d'une triarylphosphine, telle
qu'une
association d'azodicarboxylate de diéthyle et de triphénylphosphine ; les N-
(alkyle inférieur)-5-aryl-isoxazolium-3'-sulfonates tels que _le N-éthyl-5-
phényl-
isoxazolium-3'-sulfonate ; les dérivés de carbodümide, incluant des N',N'-
dicycloalkylcarbodümides tels que le N',N'-dicyclohexylcarbodümide (DCC) ou le
1-éthyl-3-(3-diméthylaminopropyl)carbodümide (EDAPC) ; les diséléniures de
dihétéroaryle tels que le diséléniure de di-2-pyridyle ; les
arylsulfonyltriazolides
tels que le p-nitrobenzène-sulfonyltriazolide ; les halogénures de 2-halogéno-
1-
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
31
(alkyle inférieur)pyridinium tels que l'iodure de 2-chloro-1-méthylpyridinium
; les
diarylphosphorylazides tels que le diphénylphosphorylazide (DPPA) ; les
dérivés
d'imidazole tels que le 1,1'-oxalyldümidazole ou le N,N'-carbonyldümidazole ;
les
dérivés de benzotriazole tels que le 1-hydroxybenzotriazole (HOB'l~ ; et les
dérivés de dicarboximide tels que le N-hydroxy-5-norbornène-2,3-dicarboximide
(HONB). Parmi ceux-ci, on préfère les dérivés de carbodümides.
La réaction peut avoir lieu dans un large intervalle de température.
Suivant la réactivité des réactifs mis en présence, la température
réactionnelle oscille entre -20°C et 100°C.
Lorsque la polymérisation implique la réaction d'un dérivé activé de l'acide
dicarboxylique sur une diphosphine, une température relativement basse,
préférablement comprise entre 0°C et 40°C, est suffisante.
A l'inverse, lorsque I"acide dicarboxylique en tant que tel est mis en jeu
dans la réaction, la température est préférablement comprise entre 50 et
80°C.
La concentration des réactifs dans le milieu réactionnel n'est pas
déterminante selon l'invention. Elle peut varier entre 0,05 et 1 mol/I.
De façon générale, le rapport molaire de l'acide dicarboxylique ou de son
dérivé activé à la diphosphine varie entre 0,8 et 1,5, de préférence entre 0,9
et
1,2.
Un mode opératoire typique, illustrant la préparation d'un polyamide au
départ d'un chlorure d'acide carboxylique, est le suivant.
A une solution de 4,16 mmol de diphosphine dans 5 ml de N,N-
diméthylacétamide, on ajoute 3,75 mmol du chlorure d'acide carboxylique. Le
mélange réactionnel est maintenu une nuit sous agitation à température
ambiante (18 à 30°C). Puis le polyamide est précipité dans 150 ml d'eau
distillée.
Le polymère est filtré sur verre fritté, lavé à l'eau puis à l'isopropanol.
Les conditions générales de mise en oeuvre de la polymérisation et
d'isolement du polymère seront facilement déterminées par l'homme du métier,
étant entendu que les polyamides préférés de l'invention présentent un degré
de
polymérisation compris entre 2 et 100, par exemple entre 5 et 100, de
préférence entre 2 et 50, mieux encore, entre 4 et 25.
L'homme du métier choisira le degré de polymérisation de façon à ce que le
polymère_ résultant soit_ insoluble dans le solvant ou mélanges de solvants
utilisés dans la réaction asymétrique devant être catalysée.
Un exemple de polymère préféré est un polymère présentant comme motif
récurrent
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
32
R
PArlAr2
PArlAr2
R
NH-C~U-W-C~U-HN (P2)
dans lequel
- Ri, R2, identiques ou différents représentent un atome d'hydrogène ou un
substituant,
- Ar1 et Ar2 représentent indépendamment un groupe alkyle, alcényle,
cycloalkyle, aryle, arylalkyle,
- W a la signification donnée pour J,
- le degré de polymérisation est préférablement compris entre 2 et 100,
mieux encore entre 2 et 50.
Polyimides.
Lorsque le polymère est un polyimide, celui-ci peut être préparé par
condensation d'une diphosphine portant deux fonctions aminométhyle avec un
ou plusieurs acides tétracarboxyliques ou dianhydrides d'acide
tétracarboxylique.
Pour la préparation de ces polyimides, l'homme du métier pourra s'inspirer
de D.C. Sherrington, Chem. Commun, 1998, 2275-2286.
De manière avantageuse, les polyimides sont préparés en deux étapes.
Dans une première étape, on forme un polyamide. Cette étape est, par
exemple, conduite à une température comprise entre 15 et 50°C, de
préférence
comprise entre 20 et 30°C, dans un solvant aprotique polaire (tel qu'un
amide du
type du formamide, du diméthylacétamide, de la N-méthyl-2-pyrrolidinone,
préférablement du diméthylacétamide).
Dans une deuxième étape, on forme le polyimide. Cette deuxième étape
peut être réalisée par traitement avec un mélange d'anhydride acétique et de
pyridine à_, une température comprise entre -100°C et 10°C, de
préférence
comprise entre -78 et -50°C.
Selon une autre variante de l'invention, le polymère peut être un
polyuréthane.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
.. r s .. ~ -
33
Polyuréthanes
Lorsque le polymère est un polyuréthane, celui-ci peut être préparé par
condensation d'une diphosphine chirale portant deux groupes hydroxyle ou
hydroxyméthyle avec un monomère de type düsocyanate.
Dans ce cas, une catalyse au sel d'étain est souvent nécessaire. On peut
se référer notamment à l'article de M. Lemaire et all. J. Mol. Cat. A. 2002,
Vol.
182-183, 239-247.
Selon un de ses aspects, l'invention concerne donc un procédé pour la
préparation d'un polymère de l'invention comprenant la polymérisation d'une
diphosphine chirale de formule (l'), avec un ou plusieurs monomères
polymérisables, de préférence de formule (?~ ; ladite phosphine chirale étant
constituée d'un corps chiral portant deux groupes fonctionnels identiques
capables de réagir avec lesdits monomères polymérisables.
L'invention concerne également le polymère racémique correspondant au
polymère optiquement actif de l'invention.
Ce polymère peut être préparé simplement par polymérisation de la
diphosphine appropriée avec un ou plusieurs monomères polymérisables, ladite
diphosphine portant deux groupes fonctionnels identiques capables de réagir
avec lesdits monomères polymérisables.
De manière préférée, les diphosphines utilisées dans cette réaction sont les
diphosphines racémiques correspondant aux diphosphines chirales préférées
définies ci-dessus. Ainsi, selon un mode de réalisation préféré de
l'invention, la
diphosphine racémique est constituée d'un squelette de base racémique de
formule (l') portant deux groupes fonctionnels identiques.
De même, les monomères polymérisables préférablement utilisés pour
cette polymérisation sont ceux décrits ci-dessus pour la préparation des
polymères optiquement actifs.
Les conditions opératoires de cette polymérisation seront facilement
déterminées par l'homme du métier par analogie à celles proposées pour la
réaction de polymérisation conduisant au polymère optiquement actif.
-- Les- diphosphines obtenues selon les procédés de l'invention ainsi-- que
celles qui sont insolublisées sous forme d'un polymère tel que précédemment
décrit sont utilisables comme ligands dans la préparation de complexes
métalliques destinés à la catalyse asymétrique des réactions d'hydrogénation,
d'hydrosilylation, d'hydroboration de composés insaturés, d'époxydation
d'alcools
allyliques, d'hydroxylation vicinale, d'hydrovinylation, d'hydroformylation,
de
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
34
cyclopropanation, d'isomérisation d'oléfines, de polymérisation du propylène,
d'addition de composés organométalliques à des aldéhydes, d'alkylation
allylique, des réactions de type aldol, des réactions de Diels-Alder et, de
façon
généralé, des réactions de formation de liaisons C-C (telles que les
substitutions
allyliques ou les couplages croisés de Grignard).
Selon un mode de réalisation préféré de l'invention, les complexes sont
utilisés pour l'hydrogénation des liaisons C=O, C=C et C=N.
Un objet de l'invention est donc de nouveaux complexes comprenant la
diphosphine chirale de l'invention ou le polymère optiquement actif tel que
précédemment défini et un métal de transition.
Comme exemples de métaux de transition capables de former des
complexes, on peut citer notamment les métaux tels le rhodium, le ruthénium,
le
rhénium, l'iridium, le cobalt, le nickel, le platine, le palladium.
Parmi les métaux précités, le rhodium, le ruthénium et l'iridium sont
préférés.
Ainsi, selon un autre de ses aspects, l'invention concerne l'utilisation du de
la diphosphine éventuellement sous ~ forme insoluble pour la préparation d'un
complexe métallique d'un métal de transition destiné à la catalyse
asymétrique,
et plus spécialement d'un complexe du ruthénium, de l'iridium ou du rhodium.
Des exemples spécifiques desdits complexes de la présente invention sont
donnés ci-après, sans caractère limitatif.
Dans les formules suivantes, P représente un ligand selon l'invention à
savoir la diphosphine ou la diphosphine insolubilisée sous la forme d'un
polymère.
~ Un groupe préféré des complexes du rhodium et de l'iridium est défini par la
formule
[MeLig2P]Y, (F1)
dans laquelle
- P représente un ligand selon l'invention ;
- Yi représente un ligand anionique coordinant ;
- Me représente l'iridium ou le rhodium ; et
- Lig représente un ligand neutre.
Parmi ces composés, les ligands particulièrement préférés sont ceux dans - -
lesquels
- Lig représente une oléfine ayant de 2 à l2 atomes de carbone ;
- Y, représente un anion PF~ , PCI6 , BF~ , BCI4 , SbF6 , SbCh, BPh4 , CI04 ,
CN-, CF3SO3 , halogène, de préférence CI- ou Br , un anion 1,3-
dicétonate, alkylcarboxylate, halogénoalkylcarboxylate avec un groupe
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
alkyle inférieure (de préférence en Ci-C6), un anion phénylcarboxylate ou
phénolate dont le cycle benzénique peut être substitué par des groupes
alkyle inférieurs (de préférence en Ci-C6) et/ou des atomes d'halogène.
Dans la formule (Fi), Lige peut représenter deux ligands Lig tels que définis
5 ci-dessus ou un ligand bidente tel que ligand bidente, linéaire ou cyclique,
polyinsaturé et comprenant au moins deux insaturations.
On préfère selon l'invention que Lige représente le 1,5-cyclooctadiène, le
norbornadiène ou bien que Lig représente l'éthylène.
Par groupes alkyle inférieurs, on entend généralement un groupe alkyle
10 linéaire ou ramifié ayant de 1 à 4 atomes de carbone.
D'autres complexes d'iridium sont ceux de formule
[IrLigP]Yi (F2)
dans laquelle Lig, P et Y, sont teks que définis pour la formule (Fi).
Un groupe préféré de complexes du ruthénium est constitué des composés
15 de formule :
[RuYiIY,2P] (F3)
dans laquelle
- P représente un ligand selon l'invention ;
- Y,' et Yi2, identiques ou différents, représentent un anion PF6 ,PCI6 , BF4
,
20 BCI4 , SbF6 , SbCl6 , BPh4 , CI04 , CF3S03 , un atome d'halogène, plus
particulièrement chlore ou brome ou un anion carboxylate,
préférentiellement acétate, trifluoroacétate.
D'autres complexes du ruthénium sont ceux répondant à la formule XIV
suivante
25 [RuYi3arPY,'~ (F4)
dans laquelle
- P représente un ligand selon l'invention ;
- ar représente le benzène, le p-méthylisopropylbenzène ou
l'hexaméthylbenzène ;
30 - Y,3 représente un atome d'halogène, de préférence chlore ou brome ;
- Y,4 représente un anion, de préférence un anion PF6 ,PCI6 , BF4 , BCI4 ,
SbF6 , SbCl6 , BPh4 , CI04 , CF3S03 .
II- est également possible de mettre en oeuvre dans le- procédé de.
l'invention des complexes à base de palladium et de platine.
35 Comme exemples plus spécifiques desdits complexes, on peut mentionner
entre autres Pd(hal)2P et Pt(hal)2P où P représente un ligand selon
l'invention et
hal représente halogène tel que, par exemple, le chlore.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
36
Les complexes comprenant un ligand selon l'invention et le métal de
transition peuvent être préparés selon les procédés connus décrits dans la
littérature.
Les complexes sont généralement préparés à partir d'un précatalyseur dont
la nature varie suivant le métal de transition sélectionné.
Dans le cas des complexes du rhodium, le précatalyseur est par exemple
l'un des composés suivants : [Rh~(CO)2CI]2 ; [Rh~(COD)CI]2 où COD désigne le
cyclooctadiène ; ou le Rh~(acac)(CO)2 où acac désigne l'acétylacétonate.
Dans le cas des complexes du ruthénium, des précatalyseurs convenant
particulièrement bien sont le bis-(2-méthylallyl)-cycloocta-1,5-diène
ruthénium et
le [RuCl2(benzène)]2. On peut citer également le Ru(COD)(~3-(CH2)2CHCH3)2.
A titre d'exemple, au départ du bis-(2-méthylallyl)-cycloocta-1,5-diène
ruthénium, on prépare une solution ou suspension contenant le précatalyseur
métallique, un ligand et un solvant parfaitement dégazé tel que l'acétone (la
concentration en ligand de la solution ou suspension variant entre 0,001 et 1
mol/I), à laquelle on ajoute une solution méthanolique d'acide bromhydrique.
Le
rapport du ruthénium au brome varie avantageusement entre 1:1 et 1:4, de
préférence entre 1:2 et 1:3. Le rapport molaire du ligand au métal de
transition
est quant à lui d'environ 1. II peut être compris entre 0,8 et 1,2.
Lorsque le précatalyseur est [RuCl2(benzène)]2, le complexe est préparé
par mélange du précatalyseur, du ligand et d'un solvant organique et
éventuellement maintien à une température comprise entre 15 et 150° C
pendant 1 minute à 24 heures, de préférence 30 à 120° C pendant 10
minutes à
5 heures.
A titre de solvant, on peut mentionner les hydrocarbures aromatiques (tels
que benzène, toluène et xylêne), les amides (tels que le formamide, le
diméthylformamide, le diméthylacétamide, la N-méthyl-2-pyrrolidinone ou
l'hexaméthylphosphorylamide), les alcools (tels que l'éthanol, le méthanol, le
n-
propanol et fisopropanol) et leurs mélanges.
De manière préférée, lorsque le solvant est un amide, notamment le
diméthylformamide, on chauffe le mélange du ligand, du précatalyseur et du
solvant entre 80 et 120° C.
En variante, .lorsque le solvant est un mélange d'un hydrocarbure
aromatique (tel que le benzène) avec un alcool (tel que l'éthanol), on chauffe
le
milieu réactionnel à une température comprise entre 30 et 70° C.
Le catalyseur est alors récupéré selon les techniques classiques (filtration
ou cristallisation) et utilisé dans des réactions asymétriques. Néanmoins, la
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
37
réaction devant être catalysée par le complexe ainsi préparé peut être mise en
oeuvre sans isolement intermédiaire du complexe catalyseur.
Dans la suite, le cas de l'hydrogénation est exposé en détail.
Le substrat insaturé, en solution dans un solvant comprenant le catalyseur,
est placé sous pression d'hydrogène.
L'hydrogénation est par exemple effectuée à une pression variant entre 1,5
et 100 bar, et à une température comprise entre 20°C et 100°C.
Les conditions exactes de mise en oeuvre dépendent de la nature du
substrat devant être hydrogéné. Néanmoins, dans le cas général, une pression
de 20 à 80 bars, de préférence de 40 à 60 bars, et une température de 30 à
70°C, conviennent particulièrement bien.
Le milieu réactionnel peut être constitué du milieu réactionnel dans lequel a
été obtenu le catalyseur. La réaction d'hydrogénation a alors lieu in situ.
En variante, le catalyseur est isolé du milieu réactionnel dans lequel il a
été
obtenu. Dans ce cas, le milieu réactionnel de la réaction d'hydrogénation est
constitué d'un ou plusieurs solvants, notamment choisis parmi les alcools
aliphatiques en C1-C5, tels que le méthanol ou le propanol, et un amide tel
que
défini ci-dessus, de préférence le diméthylformamide, éventuellement en
mélange avec du benzène.
Lorsque la réaction d'hydrogénation a lieu in situ, il est souhaitable
d'ajouter
au milieu réactionnel un ou plusieurs solvants choisis parmi ceux mentionnés
ci-
dessus, et plus particulièrement un ou plusieurs alcools aliphatiques.
Selon un mode de réalisation préféré, on ajoute, au milieu réactionnel
contenant le complexe, du méthanol parfaitement dégazé et le substrat. La
quantité de méthanol, ou plus généralement de solvant, pouvant être ajoutée
est
telle que la concentration du substrat dans le milieu réactionnel
d'hydrogénation
est comprise entre 1.10-3 et 10 mol/I, de préférence entre 0,01 et 1 mol/I.
Le rapport molaire du substrat au catalyseur varie généralement de 1/100 à
1 /100 000, de préférence de 1 /20 à 1 /2000. Ce rapport est par exemple de
1 /1000.
L'élimination du catalyseur du milieu réactionnel est facilitée losque le
ligand mis en oeuvre est sous la forme d'un polymère.
Le .catalyseur est séparé du milieu . réactionnel par nanofiltration ou
ultrafiltration.
La technique de nanofiltration est plus particulièrement appropriée au cas
des catalyseurs de type polymérique. L'application de cette technique est par
exemple illustrée dans Tetrahedron : Asymmetry, vol. 8, n° 12, 1975-
1977, 1997.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
38
Un avantage du procédé de l'invention est que le catalyseur récupéré peut
être aisément recyclé sans perte d'activité.
Les complexes du ruthénium, du rhodium et d'iridium préparés à partir des
ligands de l'invention sont plus spécialement appropriés à la catalyse
asymétrique des réactions d'hydrogénation asymétrique.
Les complexes du ruthénium préparés à partir des ligands de l'invention
sont plus spécialement appropriés à la catalyse asymétrique des réactions
d'hydrogénation de liaisons C=O, de liaisons C=N. des liaisons C=C et
préférentiellement des liaisons C=C d'acides carboxyliques a,~i-éthyléniques.
Pour ce qui est de l'hydrogénation de doubles liaisons, les substrats
appropriés sont de type acide carboxylique a,~i-insaturé et/ou dérivés d'acide
carboxylique a,~i-insaturé. Ces substrats sont décrits dans EP 95943260Ø
L'acide carboxylique a,~i-insaturé et/ou son dérivé répond plus
particulièrement à la formule A
Ri COOR4
R2 . Rs (A)
dans laquelle
- Ri, R2, R3 et R4, représentent un atome d'hydrogène ou n'importe quel
groupe hydrocarboné, dans la mesure où
. si R1 est différent de R2 et différent d'un atome d'hydrogène alors R3 peut
être n'importe quel groupe hydrocarboné ou fonctionnel désigné par R,
. si Ri ou R2 représente un atome d'hydrogène et si Ri est différent de R2,
alors R3 est différent d'un atome d'hydrogène et différent de -COOR4,
. si R1 est identique à R2 et représente n'importe quel groupe hydrocarboné
ou fonctionnel désigné par R, alors R3 est différent de -CH-(R)2 et différent
de -COOR4
- l'un des groupes R1, R2 et R3 pouvant représenter un groupe fonctionnel.
Comme exemple spécifique, on peut mentionner entre autres, l'acide 2-
méthyl-2-buténoïque.
Un . premier . groupe de substrats préférés. est formé par les acides. _
acryliques substitués précurseurs d'aminoacides et/ou dérivés.
Sous le terme acides acryliques substitués, on entend l'ensemble des
composés dont la formule dérive de celle de l'acide acrylique par substitution
d'au plus deux des atomes d'hydrogène portés par les atomes de carbone
éthylénique par un groupe hydrocarboné ou par un groupe fonctionnel.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
39
Ils peuvent être symbolisés par la formule chimique suivante
COORio
R$ NR9R'9 ~Ai)
dans laquelle
- R9, R'9, identiques ou différents représentent un atome d'hydrogène, un
groupe alkyle, linéaire ou ramifié ayant de 1 à 12 atomes de carbone, un
groupe phényle ou un groupe acyle ayant de 2 à 12 atomes de carbone
de préférence, un groupe acétyle ou benzoyle,
- R8 représente un atome d'hydrogène, un groupe alkyle ayant de 1 à 12
atomes de carbone, un groupe cycloalkyle ayant de 3 à 8 atomes de
carbone, un groupe arylalkyle ayant de 6 à 12 atomes de carbone, un
groupe aryle ayant de 6 à 12 atomes de carbone, un groupe
hétérocyclique ayant de 4 à 7 atomes de carbone,
- Rio représente un atome d'hydrogène ou un groupe alkyle linéaire ou
ramifié, ayant de 1 à 4 atomes de carbone.
On peut citer plus particulièremënt
- l'a-acétamidocinnamate de méthyle,
- l'acétamidoacrylate de méthyle,
- l'acide benzamidocinnamique,
- l'acide a-acétamidocinnamique.
Un second groupe préféré de substrats est constitué de l'acide itaconique
et de ses dérivés de formule
R COORio
11
R COOR'io
12 ~A2)
dans laquelle
- R11 ~ R12~ identiques ou différents représentent un atome d'hydrogène, un
groupe alkyle linéaire ou ramifié ayant de 1 à 12 atomes de carbone, un
groupe cycloalkyle ayant de 3 à 8 atomes de carbone, un groupe
arylalkyle ayant de 6 à 12 atomes de carbone, un groupe aryle ayant de 6
à 12, atomes de-carbone, un groupe hétérocyçlique ayant de 4 à ï atomes
de carbone.
- Rio, R'io, identiques ou différents représentent un atome d'hydrogène ou
un groupe alkyle linéaire ou ramifié, ayant de 1 à 4 atomes de carbone.
Comme exemples plus particuliers, on peut mentionner notamment l'acide
itaconique et l'itaconate de diméthyle.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
Un troisième groupe préféré de substrats est défini par la formule (~)
COORio
Ri~
dans laquelle
- R"io représente un atome d'hydrogène ou un groupe allcyle linéaire ou
5 ramifié, ayant de 1 à 4 atomes de carbone.
- R13 représente un groupe phényle ou naphtyle, éventuellement porteur
d'un ou plusieurs substituants.
Comme exemples spécifiques, on peut citer les substrats conduisant par
hydrogénation à l'acide 2-(3-benzoylphényl)propionique (Kétoprofène~), l'acide
10 2-(4-isobutylphényl)propionique (Ibuprofène~), l'acide 2-(5-méthoxynaphtyl
propionique (Naproxène~).
Pour ce qui est de l'hydrogénation de liaisons carbonyle, les complexes du
ruthénium sont plus particulièrement appropriés à la catalyse asymétrique des
15 réactions d'hydrogénation des liaisons C=O de ~i-cétoesters, de a-
cétoesters ou
de cétones.
Les substrats appropriés de type cétonique répondent plus préférablement
à la formule (B)
O
I~~ 'R*
'94 15 (B)
20 dans laquelle
- R14 est différent de R15,
- R14 et R15 représentent un groupe hydrocarboné ayant de 1 à 30 atomes
de carbone comprenant éventuellement un ou alusieurs arouoes
fonctionnels,
25 - R14 et R15 peuvent former un cycle comprenant éventuellement un autre
hétéroatome.
Ces composés sont précisément décrits dans FR 96 03 060 et EP
97930607.3.
Un groupe préféré de composés cétôriiqûes répond à la formule (B) dâns
30 laquelle Ri~ et R15 représentent indépendamment l'un de l'autre
- une chaîne alkyle, de préférence en Ci à Cio, éventuellement interrompue
par un ou plusieurs atomes) d'oxygène ou de soufre ou fonctions)
carbonyle et éventuellement substituée par un ou plusieurs atomes
d'halogène ou groupes carbonyle,
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
41
- une chaîne alcényle ou alcynyle, de préférence en C2 à Clo,
éventuellement interrompue par un ou plusieurs atomes) d'oxygène ou
de soufre ou fonctions) carbonyle et éventuellement substituée par un ou
plusieurs atomes) d'halogène ou groupes) carboxyle ;
- un groupe aryle, de préférence en C6 à C12, éventuellement substitué par
un ou plusieurs atomes) d'halogène ou groupes) alkyle ou alcényle ;
- un groupe arylalkyle, de préférence en C~ à C15, éventuellement substitué
par un ou plusieurs atomes) d'halogène ;
- un groupe arylalcényle, de préférence en C$ à C15, éventuellement
substitué par un ou plusieurs atomes) d'halogène ; et
- * indique la présence éventuelle dans R15 d'un centre d'asymétrie situé en
position a de la fonction carbonyle.
A titre représentatif des substituants R15 possédant un centre d'asymétrie,
on peut particulièrement mentionner les groupes R15 dont l'atome de carbone
portant le centre d'asymétrie est substitué par une fonction amine mono- ou di
substituée et par une fonction ester.
Selon un mode de réalisation particulièrement préféré de l'invention, le
substrat est un ~-cétoester (tel que l'acétoacétate d'éthyle ou le 3-
oxovalérate de
méthyle), un a-cétoester (tel que le benzoylformiate de méthyle ou le pyruvate
de méthyle), une cétone (telle que l'acétophénone), ou un acide carboxylique
a,~i-éthylénique (tel que l'acide itaconique) ou un aminoacide insaturé ou un
de
ses dérivés (tels que le 2-acétamidoacrylate de méthyle).
L'invention concerne par ailleurs l'utilisation de l'association d'une
diphosphine chirale ou d'un polymère optiquement actif selon l'invention avec
une diamine, chirale ou non, pour la réduction sélective de cétones.
De manière avantageuse, on utilise dans cette association une diamine
chirale.
Les diamines utilisables à cet effet sont les diamines optiquement actives
décrites dans WO 97/20789 et les diamines racémiques correspondantes.
Selon un mode de réalisation particulièrement préféré de l'invention, la
diamine est le 1,2-diamino-1,2-diphényléthane ; le 1,1-bis(p-méthoxyphényl)-2-
méthyl-1,2-diaminoéthane ; le 1,1-bis(p-méthoxyphényl)-2-isobutyl-1,2-
diaminoéthane ;.ou le 1,1-bis(p-méthoxyphényl)-2-isopropyl-1,2-diaminoéthaneï
Des exemples de diamines chirales sont plus particulièrement celles de
formule
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
42
/~ ~\
\ NH2 /
CH30 ~ ~ NH2
NH
/ O NH2
4
dans laquelle G4 est alkyle, par exemple méthyle, isobutyle ou isopropyle.
On citera plus particulièrement l'éthylènediamine non chirale et le 1,2
diamino-1,2-diphényl-éthane non chiral ou chiral, tel que le R,R-1,2-diamino-
1,2
diphényléthane.
Les cétones pouvant étre réduites selon ce procédé sont celles décrites ci-
dessus.
Les conditions de mise en oeuvre de la réduction sont celles généralement
décrites ci-dessus.
L'invention concerne en outre l'utilisation de l'association d'une diphosphine
non chirale ou d'un polymère racémique, selon l'invention avec une diamine
chirale, pour la réduction sélective de cétones.
La diamine chirale utilisable est telle que décrit dans WO 97/20789, les
cétones et les conditions opératoires étant telles que définies ci-dessus.
Les complexes du rhodium préparés à partir des ligands de l'invention sont
plus spécialement appropriés à la catalyse asymétrique des réactions
d'isomérisation d'oléfines.
L'utilisation d'un ligand de formule (lai) ou les polymères en dérivant tels
que polyurée, polyamide ou polyimine destiné à la catalyse asymétrique des
réactions d'hydrogénation , forme un objet préféré de l'invention.
Les exemples qui suivent illustrent plus précisément l'invention.
On donne ci-après la signification des abréviations utilisées.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
43
Nom du ligand Formule
BINAPO \
\
~POPhPh
POPhPh
\
\
5,5'-dibromoBINAPO Br
\
\
~ POPhPh
POPhPh
\
\
Br
5,5'-dicyanoBINAPO CN
\
\
POPhPh
POPhPh
CN
5,5'-dicyanoBINAP CN
\
\
~PPhPh
PPhPh
\
\
CN
5,5'-diaminomthyIBINAP CH2
NH2
5,5'-diamBINAP
_ ~ PPhPh
~
PPhPh
\
\
CH2
NH2
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
44
Les exemples qui suivent illustrent plus précisément l'invention.
Exemple 1
Préparation du 5,5'-dibromoBINAPO
Préparation du BINAPO
Dans un ballon de 250 mL on place le (S)- ou (R)-BINAP (2,2'-
bis(diphénylphosphino)-1,1'-binaphthyle) (3 g , 4,81 mmol, 1 éq.) dissous dans
100 mL de CH~CI2.
On refroidit à 0°C et on ajoute 10 mL d'eau oxygénée à 35 % en
poids.
On agite en laissant revenir à température ambiante pendant 4 heures.
On ajoute alors 100 mL d'eau.
On sépare la phase organique et on extrait la phase aqueuse avec CH2CI2.
Les phases organiques réunies sont lavées avec du bisulfite de sodium
saturé.
On vérifie l'absence de peroxyde puis on sèche sur sulfate de sodium et
l'on évapore.
On obtient un solide blanc (m = 3,14 g, 4,8 mmol, soit un rendement
quantitatif). -
La caractérisation de la diphosphine sous forme de dioxyde (BINAPO) est
la suivante
- RMN'H (300 MH~, CDCI3) : 6,80 (d, 4H, J=3,7), 7,2-7,3 (m, 8H), 7,3-7,5
(m, 12H), 7,6-7,7 (m, 4H), 7,8-7,9 (m, 4H)
- RMN 3'P (81 MHz, CDCI3) : 28,67
- Point de fusion : 256-258°C.
Préparation du 5,5'-dibromoBINAPQ
Dans un ballon de 100 mL sec muni d'un réfrigérant et d'une garde à
CaCl2, on place de la limaille de fer ( 622 mg, 11,1 mmol, 1,5 éq.), 65 mL de
CCI4 et (7,6 mL, 148 mmol, 20 éq.) de dibrome.
On chauffe à 70°C, puis on ajoute par portions le BINAPO (4,8 g,
7,4 mmol,
1 éq.) en solution dans 45 mL de CCh..
-. - On laisse agiter à 70°C pendant 3 heures.
Après avoir vérifié par chromatographie sur couches minces que la réaction
est finie, le mélange est transféré dans une ampoule à décanter. lavé avec de
l'eau, du bisulfite de sodium, du bicarbonate de sodium puis de la saumure.
On sèche sur sulfate de sodium, puis l'on filtre sur silice et on élue avec
l'acétate d'éthyle.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
On évapore sous pression réduite (environ 8 mm de mercure).
On obtient un solide blanc (m = 4,85 g, 6 mmol soit un rendement de
80,7 %).
La caractérisation de la diphosphine (PO) sous forme dibrom~e est la
5 suivante
- RMN iH (200 MHz, CDCI3) : 6,62 (t, 2H, J=15,0), 6,72 (d, 2H, J=9,0), 7,2-
7,5 (m, 22H), 7,55 (dd, 2H, J=3,0 ; 21,0), 7,6-7,8 (m, 4H), 8,3 (dd, 2H, J=1,7
;
9,0)
- RMN 31P (81 MHZ, CDC13) : 29,20
10 - Point de fusion >300°C
Exemple 2
Préparation du 5,5'-dicyanoBINAPO
Sous atmosphère inerte dans un ballon de 250 mL muni d'un réfrigérant, on
15 place le 5,5'-dibromoBINAPO (4,7 g, 5,8 mmol, 1 éq.) et du c~anure de
cuivre
(1,04 g, 16,24 mmol, 2,8 éq.).
On dissout le mélange dans 70 i~nL de DMF et on chauffe à reflux pendant
la nuit.
On refroidit le mélange puis on le traite avec une solution
20 d'éthylènediarnine (25 mL) et d'eau (25 mL).
On agite pendant 2 minutes, puis l'on ajoute 100 mL d'eau et 200 mL de
toluène.
On agite pendant 5 minutes puis on extrait la phase aqueuse une fois avec
du toluène.
25 Les phases organiques réunies sont lavées successivement avec 1 fois de
l'eau, 4 fois de l'HCI, 1 fois de la saumure, puis 1 fois du bicarbonate de
sodium.
Le produit est alors séché sur sulfate de sodium, puis évaporé sous
pression réduite (environ 8 mm de mercure). (m = 3,71 g, 5,5 mmol soit un
rendement de 90,8 %).
30 Le produit est purifié sur colonne de gel de silice avec comme éluant
acétate d'éthyle/ cyclohexane (4/6).
On obtient 2,52 g, 3,75 mmol. soit un rendement de 61,7 % de produit
_ blanc et. pur.
La caractérisation de la diphosphine (PO) sous forme dicyanée est la
35 suivante
- RMN 'H (200 MHz, CDCI3) : 6,85 (dd, 2H, J=7,0 ; 7,1), 6,97 (d, 2H,
J=9,0), 7,2-7,5 (m, 24H), 7,6-7,7 (m, 6H), 7,8 (dd, 2H, J=1,1 ; 6,1), 8,33
(dd, 2H,
J=1,9 ; 7,1)
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
4~
- RMN 3'P (81 MHz, CDC13) : 29,1
- Masse ESI+ : MH+=705
- Point de fusion > 300°C
Exemple 3
Préparation du 5,5'-dicyanoBINAP
Sous atmosphère inerte dans un ballon de 25 mL sec muni d'un réfrigérant,
on place le 5,5'-dicyanoBINAPO (420 mg, 0,6 mmol).
On ajoute (8 mL, 64,8 mmol) de phénylsilane et on dégaze la suspension
sous pression réduite (environ 8 mm de mercure) et l'on introduit de l'argon
On chauffe à 130°C puis on ajoute en 3 portions (3 x 1 mL) le
trichlorosilane après 1 h, 3 h puis 15 heures ; on agite alors encore 2
heures.
On refroidit puis on évapore le produit jusqu'à obtenir un solide blanc.
On lave ce solide avec du cyclohexane, on filtre sur millipore puis on sèche
sous pression réduite (environ 8 mm de mercure).
On obtient les produits purs (S) ou (R) avec des rendements quantitatifs.
La caractérisation de la diphosphine sous forme dicyanée est la suivante
- RMN 1H (300 MHz, CDCI3) : 6,63-6,81 (m, 4H), 7,04- 7,30 (m, 20H), 7,42
(d, 2H, J=7,14), 7,56 (d, 2H, J=8,85), 8,33 (d, 2H, J=9,03).
- RMN 31P (81 MHz, CDCI3) : -13.99.
Exemple 4
Préparation de 5,5'-diaminométhyIBINAP
Dans un ballon de 100 mL sous atmosphère d'argon, on place le 5,5'-
dicyanoBINAP (400 mg, 0,6 mmol).
On dissout le produit dans un mélange (1:1 ) de 22,5 mL de THF et 22,5 mL
de toluène.
On ajoute alors LiAIH4 (227,7 mg, 6 mmol) par portions.
On chauffe à 105°C pendant 2 heures.
On refroidit puis on ajoute 0,5 mL d'eau et 0,5 mL d'une solution de soude
(15 % massique).
Après 3 minutes d'agitation on ajoute 1,5 g de célite.
Après 5 minutes; le mélange est alors filtré et le résidu est lavé. avec du
dichlorométhane.
Le filtrat est évaporé puis séché sous pression réduite (environ 8 mm de
mercure) pour obtenir un solide blanc jaune.
Le produit est obtenu avec un rendement quantitatif.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
47
La caractérisation de la diphosphine sous forme diaminométhylée est la
suivante
- RMN'H (200 MHz, CDCI3) : 1,62 (s, 4H), 4,37 (s, 4H), 6,8-7,0 (m, 4H),
7,1-7,3 (m, 20H), 7,36 (d, 2H, J= 6,58), 7,51 (d, 2H, J=8,82), 8,15 (d, 2H, J=
8,82)
- RMN 3~P (81 MHz, CDCI3) : -15,50
- RMN '3C (50 MHz, CDCI3) : 44,30 ; 122,92 ; 125,61 ; 125,93 ; 127,32 ;
128,12 ; 128,30 ; 128,44 ; 128,71 ; 129,02 ; 129,31 ; 130,04 ; 132,57 ;
132,88 ;133,18 133,81 ; 135,23 ; 139,42
- ap (c=1, DM~ : -100,3 pour le (S)
- ao (c=1, DM~ : +101,4 pour le (R)
Exemple 5
1 - Test d'hydrogénation
On donne ci-après le protocole opératoire qui est ensuite repris.
Dans un vial de 5mL sous atmosphère inerte, on place (17,5 mg,
0,0235 mmol, 1 éq.) de 5,5'-diamBINAP dissous dans 1 mL de
dichlorométhane,on ajoute (7,5 mg, 0,0235 mmol, 1 éq.) de complexe bis-(2-
méthylallyl)cycloocta-1,5-diène ruthénium (II) et on agite pendant 30 minutes.
On évapore alors le solvant.
On ajoute 1 ml de méthanol (ou l'éthanol) puis le substrat et on place dans
un autoclave sous 40 bars de pression d'hydrogène à 50°C et on agite
pendant
15 heures.
L'autoclave est alors refroidi et dépressurisé.
La solution est filtrée sur célite puis analysée par chromatographie phase
gazeuse.
2 - Hydrogénation de l'acétoacétate d'éthyle ou de méthyle.
Elle est effectuée comme décrit ci-dessus avec un rapport substrat/
catalyseur égal à 1000.
Les résultats obtenus sont les suivants
Substrat Conversion ee*
(%) (~)
Actoactate d'thyle 100 > 99
Actoactate de mthyle 100 > 99
(R) - % (s)
*ee=
(R) + % (s)
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
48
Ces résultats sont confirmés que l'on met en oeuvre le 5,5'-diamBINAP
sous forme (S) ou (R).
La configuration de l'alcool correspondant obtenu dépend de la chiralité du
ligand employé.
_Exemples 6 et 7
Préparation de (R)-5,5'-perfluorohexyIBINAPO et de (R)-5,5'-
perfluorooctyIBINAPO.
Sous atmosphère d'argon, on place dans un ballon de 250 mL le 5,5'
dibromoBINAPO (2,46 mmol, 1 eq), la poudre de cuivre (14,76 mmol, 6 eq),
l'iodoperfluorure d'alleyle (7,38 mmol, 3 eq) à savoir d'hexyle dans l'exemple
6 et
d'octyle dans l'exemple 7.
On dissout dans 40 mL de DMSO et on chauffe à 80°C pendant 3
jours.
Le mélange est alors refroidi et on ajoute 20 mL d'eau et 40 mL de
dichlorométhane.
On filtre et on récupère la phase organique.
Celle-ci est lavée avec 10 mL d'eau, 20 mL d'acide chlorhydrique 15 mL de
bicarbonate de sodium.
La solution est séchée et évaporée pour obtenir 2,33 mmol d'une poudre
blanche crème (94,7%).
La caractérisation de la diphosphine (R)-5,5'-perfluorohexyIBINAPO est la
suivante
- RMN 1H ((300 MHz, CDCI3) : 6,73-6,91 (m, 4H), 7,17-7,41 (m, 18H), 7,51 (dd,
2H, J=9,4, 11,x, 7,63-7,72 (m, 4H), 8,27 (d, 2H, J=8,3)
- RMN 13C (75 MHz, CDCI3) : 116, 3, 120, 2, 124, 5, 124, 8, 125, 3, 126, 5,
128, 4,
128, 5, 128, 6, 128, 7, 128, 9, 129, 4, 129, 7, 130,1, 130, 3, 130, 4, 131,1,
131, 4,
131, 6, 132,1, 132, 2, 132, 3, 132, 7, 132, 8, 133,1
- RMN 3'P (81 MHZ, CDCI3) : 28,33
- RMN 19F (282 MH~, CDCI~): -126,37(s, 4F), -123,01 (s, 4F), -121,79 (s, 4F),
-120,64 (s, 4F), -105,21 (s, 4F), -81,15 (s, 6H)
- [ap]2~: +72,1 (c=1, DMF)
- ESI+: MH+ = 1291,24.
- Point de fusion : >300°C. Calcd. C 52,11, H 2;34, F 38;27; trouvé C
52;02-; H -
2,47, F 38,45
La caractérisation de la diphosphine (R)-5,5'-perfluorooctyIBINAPO est la
suivante
- RMN 1H (300 MHz, CDCI3) : 6,75-6,96 (m, 4H), 7,19-7,40 (m, 18H), 7,56 (dd,
2H, J=9,4, 11,7), 7,65-7,73 (m, 4H), 8,28 (d, 2H, J=8,6)
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
49
- RM N 13C (75 M Hz, CDCI~) : 124, 5, 124, 9, 125, 2, 126, 7, 128, 4, 128, 5,
128, 6,
128, 7, 128, 8, 129, 3, 129, 7, 130,1, 130, 2, 130, 4, 130, 9, 131, 5, 131, 6,
132, 0,
132, 2, 132, 3, 132, 7, 132, 8, 132, 9
- RMN 3'P (81 MHZ, CDCI3) : 28,58
- RMN'9F (282 MHz, CDCI3): -126,54(s, 4F), -123,09 (s, 4F), -122,26 (s, 8F), -
121,64 (s, 4F), -120,19 (s, 4F), -104,35 (s, 4F), -81,18 (s, 6F)
- [apj25: +73,4 (c=1, DMF).
- ESI+: MH+ = 1491,54.
- Point de fusion : >300°C. Calcd. C 48,34, H 2,03, F 43,33; trouvé C
48,91, H
1,88, F 43,67
Exemples 8 et 9
Préparation de (R)-5,5'-perfluorohexyIBINAP et de (R)-5,5'-
perfluorooctyIBINAP.
Dans un ballon de 25 mL sous atmosphère inerte, on place le (R)-5,5'-
perfluoroaIkyIBINAPO (0,6 mmol, 1 eq).
On ajoute du phénylsilane deg~zé (8 mL). On chauffe le mélange à
130°C
et on ajoute le trichlorosilane en 3 fois (3x1 mL) après 1, 3 puis 15 heures.
Après la dernière addition, la solution est encore agitée 2 heures puis
refroidie et évaporée jusqu'à ce qu'un solid blanc soit obtenu.
Ce résidu est lavé avec du cyclohexane (5 mL), filtré sur un millipore puis le
solvant restant est évaporé pour obtenir un solide blanc cristallin avec 95 %
de
rendement.
La caractérisation de la diphosphine (R)-5,5'-perfluorohexyIBINAP est la
suivante
- RMN'H (200 MHz, CDCI3) : 6,78-6,98 (m, 4H), 7,13-7,47 (m, 18H), 7,50-7,61
(m, 2H), 7,65-7,78 (m, 4H), 8,29 (d, 2H, J=7,3)
- RMN ~3C (75 MHz, CDCI3) : 123,1, 123,3, 124,5, 124,6, 124,8, 125,6, 126,5,
127,1, 127,3, 128,1, 128,2, 128,4, 128,5, 128,7, 130,0, 131,4, 131,8, 132,1,
132,2, 132,4, 132,8, 132,9, 133,2, 133,4, 133,6, 134,4, 134,5, 135,0, 135,4,
135,7, 138,1, 138,4, 143,9, 144,2, 144,7, 145,1
- RMN 3~P (81 MHZ, CDCI3) : -13,27
-- - RMN i9F (282 MHz,- CDCI3): -126,37(s, 4F), -123,01. (s, 4F), -121-,79 (s,
4F),
-120,64 (s, 4F), -105,21 (s, 4F), -81,15 (s, 6H)
- [ap]25: +35,7 (c=1, DCM)
- Point de fusion: >300°C
- HRLSIMS: MH+. talc. 1259,1408, trouvé 1259,1398
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
La caractérisation de la diphosphine (R)-5,5'-perfluorooctyIBINAPO est la
suivante
- RMN 'H (300 MHz, CDCI3) : 6,77-6,96 (m, 4H), 7,02-7,10 (m, 4H), 7,26-7,42
(m, 14H), 7,55-7,61 (m, 6H), 8,29 (d, 2H, J=8,9)
5 - RMN 13C (75 MHz, CDCI~) : 124, 4, 125, 4, 126, 6, 128, 3, 128, 4, 128, 4,
128, 5,
128, 6, 128, 6, 128, 7, 128, 8, 128, 8, 128, 9, 129, 3, 129, 5, 130, 8, 132,
0, 132, 2,
133, 0, 133, 2, 133, 3, 133, 4, 133, 6, 133, 7, 134, 4, 134, 5, 134, 9, 135,
2, 135, 4,
135, 8, 137, 0, 137, 4, 137, 5, 138, 2, 144, 0, 144, 3, 144, 6
- RMN 3'P (81 MHZ, CDCI3) : -13,18
10 - RMN'9F (282 MHz, CDCI3): -126,59 (s, 4F), -123,17 (s, 4F), -122,29 (s,
8F), -
121,72 (s, 4~, -120,35 (s, 4F), -104,46 (s, 4F), -81,27 (s, 6H)
- [ocp]25: +35, 5 (c=1, DCM)
- Point de fusion : >300°C
- HRLSIMS: MH+. calc. 1459,1280, trouvé 1459,1271
Exemples 10 et 11
Test d'hydrogénation
Afin d'évaluer les activités de ces nouveaux ligands et l'influence des
chaines perfluorés les complexes métalliques correspondant ont été préparés
par réaction avec [RuCl2 (bertzene)]2 en accord avec la procédure générale
décrite par Noyori et al [Kitamura, M.; Tokunaga, M. ; Ohkuma, T. ; Noyori, R.
Tetrahedron Leü. 1991, 32, 4163].
Les complexes ont été testés pour l'hydrogénation catalytique de plusieurs
[i-céto-esters.
H2 (40 bar)
catalyst OH O
Me OR Me' v 'OR
MeOH or EtOH
50°C; 15 hours
Les résultats sont consignés dans le tableau suivant
Ref. LigandComplexe R Substrat/Conversion e.e
ex. catalyseur(%) (%)
en mol
10 ex [RuCl2 (benzne)]2Me 1000 100 99
8
- 11 ex-8 [RuCl2 (benzne)]2Et 2000 100 99
-
Exemple 12
Préparation d'une polyurée au départ du (S)-5,5'-diaminométhyIBINAP
(diamBINAP).
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
51
Dans un ballon de lOmL, on place le diamBINAP de départ (200 mg, 0,29
mmol) préparé selon le mode opératoire décrit dans les exemples 1 à 4.
Celui-ci est dissous dans 2 mL de dichlorométhane anhydre dégazé.
Le 2,6-düsocyanatotoluène (51 mg, 0,29 mmol) est ajouté sous argon.
La solution est agitée 12 heures puis 2 mL d'isopropanol dégazé sont
ajoutés.
Le solide est filtré puis lavé à l'isopropanol.
On obtient 240 mg de polymère (poudre jaune) soit un rendement de 96%.
La caractérisation du 5,5'-polyNAP obtenue est la suivante
- (agi]= -103° (c= 0,356 DM~
- RMN 1 H (DMSO, 200 MHz) : 1,03 (d, CH3); 1,22 (d, CH3); 2,03 (m, CH3
tolyle); 3,34 (s, CH2); 6,67 (d, CH); 6,70-7,50 (m); 7,73 (s, CH); 8,25 (d,
CH).
- RMN 31P (DMSO, 81 MHz) : -16,53.
Exemple 13 ..
Préparation d'un catalyseur au ruthénium au départ du polymère préparé à
l'exemple 12.
Dans un réacteur en verre à fond conique de 5 mL sec maintenu sous
atmosphere inerte et muni d'un agitateur on pèse le polymère et le
précatalyseur
métallique, le bis-(2-méthylallyl)cycloocta-1,5-dièse ruthénium, dans un
rapport
molaire polymère/métal 1 :1.
On ajoute 2 mL d'acétone anhydre et dégazé et on agite la suspension 30
min.
On ajoute alors une solution d'acide bromhydrique à 48 % en poids dans
un rapport Ru/Br de 1/2,3).
La solution se teinte alors en orange foncé.
Cette solution est agitée 1 heure puis évaporée.
On obtient alors le catalyseur sous l'aspect d'un solide marron.
Exemple 14
Hydrogénation de l'acétoacétate d'éthyle à l'aide du catalyseur préparé
dans l'exemple 13.
De l'éthanol anhydre et dégazé est ajouté dans le réacteur ou le catalyseur
vient d'être préparé.
Le substrat est alors ajouté (dans un rapport catalyseur/substrat défini).
Le réacteur est placé dans un autoclave sous 40 bars de pression
d'hydrogène et à 50°C.
CA 02509911 2005-06-13
WO 2004/056483 PCT/FR2003/003782
52
L'agitation est maintenue pendant la nuit.
Le réacteur est récupéré puis centrifugé.
La solution surnageante est récupérée puis analysée par chromatographie
en phase gazeuse.
La détermination des excès énantiomériques est effectuée par
chromatographie en phase gazeuse chirale sur une colonne Lipodex A 25m x
0,25 mm.
Les résultats obtenus sont rapportés dans le tableau suivant
Catalyseur Substrat / CatalyseurConversion (%) e.e.
(5,5'-polyNAP) en mol (%)
5,5' 1000 100 83
5,5' 500 100 85
5,5'(recycl) 500 100 90
L'hydrogénation de l'acétoacétate d'éthyle conduit au 3-hydroxybutyrate
d'éthyle.
Exemple 14
Hvdroaénation du 2-méthvlacétamidoacrvlate à l'aide du catalvseur aréaaré
dans l'exemple 13.
De l'éthanol anhydre et dégazé est ajouté dans le réacteur ou le catalyseur
vient d'être préparé.
Le substrat est alors ajouté (dans un rapport catalyseur/substrat défini).
Le réacteur est placé dans un autoclave sous 40 bars de pression
d'hydrogène et à 50°C.
L'agitation est maintenue pendant 6 heures.
Le réacteur est récupéré puis centrifugé.
La solution surnageante est récupérée puis analysée par chromatographie
en phase gazeuse.
La détermination des excès énantiomériques est effectuée par
chromatographie en phase gazeuse chirale sur une colonne (3-dex A 60m x 0,25
mm.
Les résultats obtenus sont raaoortés dans le tableau suivant
Catalyseur Substrat / CatalyseurConversion (%) e.e.
(5,5'-polyNAP) en mol (%)
5,5' 300 100 70