Note: Descriptions are shown in the official language in which they were submitted.
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
1
Application à titre de médicaments de dérivés de cholest-4-èn-3-
one compositions pharmaceutiques les renfermant, nouveaux dérivés et leur
procédé de préparation.
La présente invention concerne l'application à titre de médicaments
de dérivés de cholest-4-èn-3-one, notamment comme neuroprotecteurs par
exemple dans les pathologies et les traumatismes liés à la dégénérescence ou
à la mort des motoneurones, les compositions pharmaceutiques les renfermant,
de nouveaux dérivés et leur procédé de préparation.
Les processus neurodégénératifs sont caractérisés par le
dysfonctionnement et la mort des neurones entraînant la perte des fonctions
neurologiques médiées par le cerveau (système nerveux central, SNC), la
moelle épinière et le système nerveux périphérique (SNP). Ils peuvent
résulter,
entre autres, de situations pathologiques regroupées sous le terme de
maladies ou affections neurodégénératives, de traumatisme, ou d'exposition à
des toxines.
Les pathologies les plus importantes qui sont caractérisées par un
processus dégénératif sont :
- les maladies chroniques neurodégénératives,
héréditaires ou sporadiques, notamment la maladie d'Alzheimer, la
maladie de Huntington, la maladie de Parkinson, la sclérose latérale
amyotrophique, les amyotrophies spinales, la maladie de Creutzfeldt-
Jakob, la sclérose en plaque, l'adrénoleucodystrophie, l'épilepsie, les
démences, la schizophrénie, et les syndromes neurologiques associés
au SIDA;
- les lésions neuronales liées au vieillissement ;
- les neuropathies périphériques héréditaires ou
lésionnelles, comme les maladies de Fabry, de Charcot-Marie-Tooth,
de Krabbe, les leucodystrophies, les neuropathies diabétiques et
celles induites par les traitements anti-cancéreux ;
- les traumatismes du cerveau, des nerfs
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
2
périphériques ou de la moelle épinière;
- les ischémies du cerveau ou de la moelle épinière
suite à un accident cérébro-vasculaire, ou induites par un manque
d'irrigation sanguine ;
- les dégénérescences, héréditaires, lésionnelles ou
liées au vieillissement des neurones sensoriels de la vision, comme les
dégénérescences maculeires, les rétinites pigmentaires, ou les
dégénérescences du nerf optique induites par les glaucomes ;
- les dégénérescences, héréditaires, traumatiques ou
liées au vieillissement des neurones sensoriels de l'ouïe entraînant
une diminution ou une perte de l'audition.
Une partie des voies de signalisation affectées dans ces
pathologies sont communes à un grand nombre de maladies
neurodégénératives. La maladie d'Alzheimer est la démence la plus fréquente.
Elle fait apparaître une atrophie du cerveau, une perte neuronale prédominante
dans la corne d'Ammon et elle touche aussi les neurones cholinergiques.
D'autres pathologies, comme les atrophies ~lobaïres (maladie de Pick, la
maladie de Creutzfeld-Jakob), la démence avec corps de Lewy, les démences
vasculaires, la maladie de Parkinson sont associées à une mort neuronale
2 0 importante à l'origine des symptômes de ces démences.
Il n'existe pas actuellement de traitement efficace pour enrayer les
dégénérescences neuronales. Une approche thérapeutique pour protéger les
neurones de la mort est l'apport de protéines neurotrophiques.
Ces protéines, telles que BDNF (brain-derived neurotrophic
factor), CNTF (ciliary neurotrophic factor), NGF (nerve growth factor), GDNF
(glia-derived neurotrophic factor) sont synthétisées au cours du développement
embryonnaire ou après lésion chez l'adulte. Ces facteurs de croissance
favorisent la survie, la maturation et la différentiation des cellules
neuronales.
De plus, ils inhibent les mécanismes apoptotiques, activent de multiples voies
de survie et protègent un grand nombre de populations neuronales. Leur
utilisation est proposée dans la plupart des dégénérescences neuronales.
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
3
Des composés qui activeraient l'expression de facteurs
neurotrophiques ou qui mimeraient l'action de ces facteurs ont un potentiel
thérapeutique pour le traitement des syndromes neurodégénératifs.
En particulier, l'apport de molécules neurotrophiques pour le
traitement des dégénérescences neuronales vise trois objectifs :
- compenser une carence potentielle en facteurs
neurotrophiques liée à un défaut d'apport par les cibles périphériques
ou centrales des neurones et/ou un trouble du transport rétrograde de
ces facteurs;
- intervenir de façon non spécifique sur des voies
biochimiques impliquées dans la cascade dégénérative;
- favoriser les phénomènes compensateurs naturels
de croissance dendritique et d'arborisation des terminaisons
nerveuses.
Ces composés présenteraient donc un effet bénéfique dans un
grand nombre de pathologies en particulier dans les pathologies touchant les
systèmes nerveux périphérique et central.
Par ailleurs, dans le cadre ci-dessus, les motoneurones sont des
neurones notamment présents dans la moelle épinière et le tronc cérébral. Leur
dégénérescence ou leur mort peut conduire à une faiblesse progressive des
muscles des membres, puis à une atrophie et éventuellement à une spasticité
(c'est à dire une contraction permanente) du muscle.
Les pathologies les plus importantes qui résultent de la
dégénérescence et de la mort des motoneurones spinaux et/ou bulbaires sont
la sclérose latérale amyotrophique, également connue sous le nom de maladie
de Charcot ou encore maladie de Lou Gehrig, et les amyotrophies spinales
infantiles, également connues sous les noms de maladie de Werdnig-Hoffmann
ou maladie de Kugelberg-Welander.
En outre, on observe une dégénérescence des motoneurones
dans les cas de traumatismes avec écrasement et/ou section de la moelle
épinière ou des nerfs moteurs périphériques.
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
4
Plus généralement, on parle d'amyotrophies spinales pour les
maladies où est impliquée la dégénérescence ou la mort des motoneurones de
la moelle épinière.
La sclérose latérale amyotrophique, (SLA ou ALS pour
Amyotrophic Lateral Scierosis) est une maladie neurodégénérative associée à
différents types d'inclusions tels les corps de Lewis et caractérisée par une
dégénérescence des motoneurones spinaux et corticaux dont l'issue fatale est
parfois associée à une démence frontale. Au cours du développement de
l'ALS, les phénomènes dégénératifs se produisent non seulement dans le
cerveau mais également dans la moelle épinière et en conséquence dans le
muscle, par défaut d'innervation.
On recherche toujours des composés actifs pour lutter contre les
affections évoquées ci-dessus.
Or la demanderesse a découvert que des dérivés de la 4-
cholestèn-3-one et notamment l'oxime de cholest-4-èn-3-one étaient doués de
remarquables propriétés neuroprotectrices, particulièrement vis à vis des
motoneurones, des neurones du système nerveux central, des nerfs moteurs et
périphériques, et donc étaient utiles comme médicaments et que certains
d'entre eux étaient en outre doués de remarquables propriétés inhibitrices de
l'effet de modulateurs allostériques positifs des récepteurs GABAA (gamma
amino butyrique acide de type A).
C'est pourquoi la présente invention a pour objet les composés
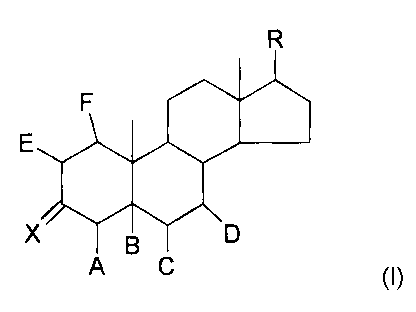
répondant à la formule 1
R
F
E
A C (I)
CA 02517893 2011-07-08
R représente un groupement choisi parmi
Ri
R2 =
R3 =
R4 = \
R6 =
et
R5=
A représente un atome d'hydrogène ou ensemble avec B une
liaison carbone-carbone,
B représente un atome d'hydrogène, un groupement hydroxy ou
ensemble avec A une liaison carbone-carbone,
C représente un atome d'hydrogène ou ensemble avec D une
liaison carbone-carbone,
D représente un atome d'hydrogène ou ensemble avec C une
liaison carbone-carbone,
E représente un atome d'hydrogène ou ensemble avec F une
liaison carbone-carbone,
F représente un atome d'hydrogène ou ensemble avec E une
liaison carbone-carbone,
ainsi que leurs sels d'addition avec les acides pharmaceutiquement
acceptables.
CA 02517893 2011-07-08
6
Les sels d'addition avec les acides pharraceutiquement
acceptables peuvent être par exemple des sels formés avec les acides
chlorhydrique, bromhydrique, nitrique, sulfurique, phosphorique acétique,
formique, propionique, benzoïque, maléique, fumarique, succinique, tartrique,
citrique, oxalique, glyoxylique, aspartique, alcane sulfoniques tels que les
acides
méthane ou éthane sulfoniques, arylsulfoniques, tels que les acides benzène ou
paratoluène sulfoniques, ou carboxyliques.
On retient plus particulièrement les composés pharmaceutiques
selon l'invention pour lesquels:
- A représente ensemble avec B une liaison carbone-carbone, C, D,
représentent un atome d'hydrogène, E, F représentent un atome d'hydrogène
ou ensemble une liaison carbone-carbone et R a la signification R1,
- A représente ensemble avec B une liaison carbone-carbone, C et D
représentent un atome d'hydrogène, E et F représentent un atome
d'hydrogène et R a la signification R2 ou R3 ou R4,
- A représente ensemble avec B une double liaison, C représente ensemble
avec D une liaison carbone-carbone, E et F représentent un atome
d'hydrogène et R a la signification R1 ou R6,
- A représente ensemble avec B une double liaison, C représente ensemble
avec D une liaison carbone-carbone, E représente ensemble avec F une
liaison carbone-carbone et R a la signification R1,
- X représente un groupement = N-OH, E représente ensemble avec F une
double liaison, C, D, A, B représentent un atome d'hydrogène et R a la
signification R1,
ainsi que leurs sels d'addition avec les acides pharmaceutiquement
acceptables.
Parmi lés composés de l'invention on peut citer de plus:
- la 5p-hydroxy-cholestan-3-one, et
- l'oxime de cholestan-3-one
ainsi que leurs sels d'addition avec les acides pharmaceutiquement
acceptables.
CA 02517893 2011-07-08
7
On retient tout particulièrement:
- l'oxime de chloest-4-èn-3-one, et
- l'oxime de 1,4-cholestadièn-3-one,
ainsi que leurs sels d'addition avec les acides pharmaceutiquement
acceptables.
Les composés objet de la présente invention possèdent de très
intéressantes propriétés pharmacologiques. Ils sont doués notamment de
remarquables propriétés neuroprotectrices, particulièrement vis à vis des
motoneurones.
Ces propriétés sont illustrées ci-après dans la partie expérimentale.
Elles justifient l'utilisation des composés ci-dessus décrits ainsi que de
leurs sels
d'addition avec les acides pharmaceutiquement acceptables à titre de
médicament.
Les médicaments selon la présente invention trouvent leur emploi
en raison de leurs propriétés neuroprotectrices par exemple dans le traitement
ou à la prévention des affections neurodégénératives, comme par exemple la
maladie de Huntington, les maladies chroniques neurodégénératives,
héréditaires ou sporadiques, les lésions neuronales liées au vieillissement,
les
neuropathies périphériques héréditaires ou lésionnelles, la maladie de Charcot-
Marie-Tooth, les neuropathies diabétiques ou induites par les traitement
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
8
anticancéreux, les traumatismes du cerveau, des nerfs périphériques ou de la
moelle épinière, les ischémies du cerveau ou de la moelle épinière, les
dégénérescences héréditaires, lésionnelles ou liées au vieillissement des
neurones sensoriels de la vision ou les dégénérescences du nerf optique, les
dégénérescences héréditaires, traumatiques ou liées au vieillissement des
neurones sensoriels de l'ouïe, les atrophies lobaires et les démences
vasculaires, et notamment les amyotrophies spinales, la sclérose latérale
amyotrophique et les pathologies dues aux traumatismes de la moelle épinière
ou des nerfs moteurs périphériques.
Dans le contexte de l'invention, le terme traitement désigne le
traitement préventif, curatif, palliatif, ainsi que la prise en charge des
patients
(réduction de la souffrance, amélioration de la durée de vie, ralentissement
de
la progression de la maladie), etc. Le traitement peut en outre être réalisé
en
combinaison avec d'autres ingrédients ou traitements, tels que notamment
d'autres composés actifs pour traiter les pathologies ou traumatismes
spécifiés
dans la présente demande.
Ils présentent aussi des propriétés inhibitrices de l'effet de
modulateurs allostériques positifs des récepteurs GABAA (gamma amino
butyrique acide de type A). Des exemples de modulateurs allostériques positifs
sont : l'alloprégnanolone ou 3a-hydroxy-5a-prégnan-20-one ou 3a,5a-TH-
PROG ou la tétrahydrodéoxycorticostérone = 3a,20-dihydroxy-5a-pregnan-20-
one = 3a,5a-TH-DOC, qui sont des neurostéroïdes endogènes du système
nerveux central. Ces propriétés particulières justifient que les composés de
l'invention trouvent aussi leur emploi dans le traitement de différentes
situations
physio-pathologiques où ces neurostéroïdes ont été décrits pour jouer un rôle
important, comme par exemple,
- le comportement sexuel
- la mort subite du nouveau-né, et notamment
- la sensibilité douloureuse ou les douleurs neuropathiques chroniques
- l'anxiété ou la dépression
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
9
- les lésions traumatiques du système nerveux
- les épilepsies sensibles aux stéroïdes, les troubles du sommeil ou
l'intoxication alcoolique
- l'apprentissage cognitif ou les troubles de la mémoire.
Us trouvent notamment en raison de leurs propriétés
neuroprotectrices vis à vis des motoneurones, leur emploi particulièrement
dans
le traitement des amyotrophies spinales, notamment de la sclérose latérale
amyotrophique ou des amyotrophies spinales infantiles, et dans le traitement
des traumatismes de la moelle épinière ou des nerfs moteurs périphériques
comme évoqué ci-dessus.
En général la dose journalière du composé sera la dose minimum
pour obtenir l'effet thérapeutique. Cette dose dépendra des différents
facteurs
cités auparavant. Les doses des composés de ci-dessus décrits et par exemple
de l'oxime de cholest-4-èn-3-one seront en général comprises entre 0,001 à
100 mg par kilo par jour pour l'homme.
Si nécessaire, la dose journalière peut être administrée en deux,
trois, quatre, cinq, six ou plus, prises par jour ou par sous-doses multiples
administrées par intervalles appropriés pendant la journée.
La quantité choisie dépendra de multiples facteurs, en particulier
de la voie d'administration, de la durée d'administration, du moment de
l'administration, de la vitesse d'élimination du composé, du ou des différents
produits utilisés en combinaison avec le composé, de l'âge, du poids et de la
condition physique du patient, ainsi que de son histoire médicale, et de
toutes
autres informations connues en médecine.
La prescription du médecin traitant pourra commencer à des
doses inférieures à celles généralement utilisées, puis ces doses seront
progressivement augmentées afin de mieux maîtriser l'apparition d'éventuels
effets secondaires.
L'invention a aussi pour objet les compositions pharmaceutiques
qui renferment au moins un composé précité ou un de ses sels d'addition avec
les acides pharmaceutiquement acceptables, à titre de principe actif.
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
Dans ces compositions, le principe actif est avantageusement
présent à des doses physiologiquement efficaces ; les compositions précitées
renferment notamment une dose neuroprotectrice efficace d'au moins un
principe actif ci-dessus.
5 A titre de médicaments, les composés répondant à la formule I
ainsi que leurs sels d'addition avec les acides pharmaceutiquement~
acceptables
peuvent être incorporés dans des compositions pharmaceutiques destinées à la
voie digestive ou parentérale.
Les compositions pharmaceutiques selon l'invention peuvent
1o comprendre en outre au moins un autre ingrédient thérapeutiquement actif,
pour une utilisation simultanée, séparée ou étalée dans le temps, notamment
lors d'un traitement chez un sujet atteint d'une pathologie ou d'un
traumatisme
lié à la dégénérescence ou à la mort des motoneurones tel que défini ci-
dessus.
Les compositions pharmaceutiques ou médicaments selon
l'invention comprennent avantageusement un ou plusieurs excipients ou
véhicules inertes, c'est à dire pharmaceutiquement inactifs et non toxiques.
On
peut citer par exemple des solutions salines, physiologiques, isotoniques,
tamponnées, etc., compatibles avec un usage pharmaceutique et connues de
l'homme du métier.. Les compositions peuvent contenir un ou plusieurs agents
ou véhicules choisis parmi les dispersants, solubilisants, stabilisants,
conservateurs, etc. Des agents ou véhicules utilisables dans des formulations
(liquides et/ou injectables et/ou solides) sont notamment la méthylcellulose,
l'hydroxyméthylcellulose, la carboxyméthylcellulose, les cyclodextrines, le
polysorbate 80, le mannitol, la gélatine, le lactose, des huiles végétales ou
animales, l'acacia, etc. Les compositions peuvent être formulées sous forme de
suspension injectable, de gels, huiles, comprimés, suppositoires, poudres,
gélules, capsules, etc., éventuellement au moyen de formes galéniques ou de
dispositifs assurant une libération prolongée et/ou retardée. Pour ce type de
formulation, on utilise avantageusement un agent tel que la cellulose, des
carbonates ou des amidons.
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
11
L'administration peut être réalisée par toute méthode connue de
l'homme du métier, de préférence par voie orale ou par injection, typiquement
par voie intra-péritonéale, intra-cérébrale, intra-thécale, intra-veineuse,
intra-
artérielle ou intra-musculaire. L'administration par voie orale est préférée.
S'agissant d'un traitement à long terme, la voie d'administration préférée
sera
sublinguale, orale ou transcutanée.
Pour les injections, les composés sont généralement conditionnés
sous forme de suspensions liquides, qui peuvent être injectées au moyen de
seringues ou de perfusions, par exemple. Il est entendu que le débit et/ou la
dose injectée, ou de manière générale la dose à administrer, peuvent être
adaptés par l'homme du métier en fonction du patient, de la pathologie, du
mode d'administration, etc.. Il est entendu que des administrations répétées
peuvent être réalisées, éventuellement en combinaison avec d'autres
ingrédients actifs ou tout véhicule acceptable sur le plan pharmaceutique
(tampons, solutions saline, isotonique, en présence d'agents stabilisants,
etc.).
L'invention est utilisable chez les mammifères, notamment chez
l'être humain.
La présente invention a encore pour objet un procédé de
préparation d'une composition ci-dessus décrite, caractérisé en ce que l'on
mélange, selon des méthodes connues en elles mêmes, le ou les principes actifs
avec des excipients acceptables, notamment pharmaceutiquement acceptables.
Les composés de formule I tels que définis ci-dessus sont connus
ou peuvent être préparés selon des procédés décrits dans la littérature.
Certains
dérivés de formule I sont des produits nouveaux.
C'est pourquoi la présente demande a aussi pour objet les
composés nouveaux répondant à la formule 1
CA 02517893 2011-07-08
12
R
E
X B D
A C
dans laquelle X représente un radical =N-OH et
- A représente ensemble avec B une liaison carbone-carbone, C et D
représentent un atome d'hydrogène, E représente ensemble avec F une
liaison carbone-carbone et R a la signification R1;
- A représente ensemble avec B une liaison carbone-carbone, C et D
représentent un atome d'hydrogène, E et F représentent un atome
d'hydrogène et R a la signification R2 ou R4; et
- A représente ensemble avec B une liaison carbone-carbone, C représente
ensemble avec D une liaison carbone-carbone, E et F représentent un atome
d'hydrogène et R a la signification R6; ou
- A représente ensemble avec B une liaison carbone-carbone, C représente
ensemble avec D une liaison carbone-carbone, E représente ensemble avec
F une liaison carbone-carbone et R a la signification R1; R1, R2, R3, R4 et
R6 étant tels que définis dans la revendication 1,
ainsi que ses sels d'addition avec les acides minéraux ou organiques.
La présente invention a également pour objet un procédé de
préparation des nouveaux composés de formule 1 tels que définis ci-dessus
ainsi
que de leurs sels, caractérisé en ce que l'on fait réagir un composé de
formule Il
CA 02517893 2011-07-08
12a
R
E
eBD
O A
dans laquelle
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
13
- A représente ensemble avec B une liaison carbone-carbone, C, D
représentent un atome d'hydrogène, E représente ensemble avec F une liaison
carbone-carbone et R a la signification RI,
- A représente ensemble avec B une liaison carbone-carbone, C D
représentent un atome d'hydrogène, E, F représentent un atome d'hydrogène et
R a la signification R2 ou R3 ou R4,
- A représente ensemble avec B une liaison carbone-carbone, C représente
ensemble avec D une liaison carbone-carbone, E, F représentent un atome
d'hydrogène et R a la signification R6,
- A représente ensemble avec B une liaison carbone-carbone, C représente
ensemble avec D une liaison carbone-carbone, E représente ensemble avec F
une liaison carbone-carbone et R a la signification RI,
, avec un halogénure d'hydroxylamine comme le chlorhydrate d'hydroxylamine,
pour obtenir le composé de formule I attendu que l'on isole et si désiré
salifie.
Dans des conditions préférentielles de mise en oeuvre du procédé
ci-dessus décrit,
- on solubilise le produit de départ dans un minimum d'un solvant adapté
comme la pyridine
- si une autre fonction cétone est présente, elle est bloquée
spécifiquement par un groupement protecteur adapté comme - des
acétals cycliques,
- on utilise un excès, par exemple 2 équivalents, d'halogénure
d'hydroxylamine.
- on opère sous agitation pendant environ 24h à température ambiante.
Les composés de formule Il sont des dérivés connus, décrits dans
la littérature, et sont accessibles commercialement.
L'invention a encore pour objet l'utilisation d'un composé de
formule 1
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
14
2rR
B
A C (I)
dans laquelle X représente un atome d'oxygène ou un groupement = N-OH,
R représente un groupement choisi parmi
RI =
R2 = \
R3 =
R4 = \
R6
R5=
A représente un atome d'hydrogène ou ensemble avec B une
liaison carbone-carbone
B représente un atome d'hydrogène, un groupement hydroxy ou
ensemble avec A une liaison carbone-carbone,
C représente un atome d'hydrogène ou ensemble avec D une
liaison carbone-carbone,
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
D représente un atome d'hydrogène ou ensemble avec C une
liaison carbone-carbone,
E représente un atome d'hydrogène ou ensemble avec F une
liaison carbone-carbone,
5 F représente un atome d'hydrogène ou ensemble avec E une
liaison carbone-carbone,
ainsi que de la cholest-4,24-dièn-3-one, de la 24-méthylcholest-4,6,22-trièn-3-
one, ou de l'oxime de cholest-5-èn-3-one ou de l'un de ses sels d'addition
avec
les acides pharmaceutiquement acceptables, pour l'obtention d'un médicament
10 neuroprotecteur, notamment destiné au traitement des maladies
neurodégénératives comme par exemple la maladie de Huntington, les
maladies chroniques neurodégénératives, héréditaires ou sporadiques, les
lésions neuronales liées au vieillissement, les neuropathies périphériques
héréditaires ou lésionnelles, la maladie de Charcot-Marie-Tooth, les
15 neuropathies diabétiques ou induites par les traitement anticancéreux, les
traumatismes du cerveau, des nerfs périphériques ou de la moelle épinière, les
ischémies du cerveau ou de la moelle épinière, les dégénérescences
héréditaires, lésionnelles ou liées au vieillissement des neurones sensoriels
de
la vision ou les dégénérescences du nerf optique, les dégénérescences
héréditaires, traumatiques ou liées au vieillissement des neurones sensoriels
de l'ouïe, les atrophies lobaires et les démences vasculaires, les maladies et
traumatismes liés à la dégénérescence des motoneurones et plus
particulièrement les amyotrophies spinales particulièrement infantiles, la
sclérose latérale amyotrophique, la sclérose en plaques et les traumatismes de
la moelle épinière ou des nerfs moteurs périphériques.
L'invention a particulièrement pour objet l'utilisation d'un composé
de formule I ci-dessus pour l'obtention d'un médicament neuroprotecteur,
notamment destiné au traitement de pathologies ou traumatismes liés à la
dégénérescence ou à la mort des neurones, chez des mammifères (en général
3 0 des patients) atteints de telles pathologies ou traumatismes.
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
16
L'invention a plus particulièrement pour objet l'utilisation d'un
composé de formule I pour l'obtention d'un médicament destiné au traitement
des amyotrophies spinales infantiles et les scléroses latérales
amyotrophiques.
L'invention a encore pour objet l'utilisation d'un composé de
formule I ci-dessus pour l'obtention d'un médicament destiné au traitement des
pathologies où la suractivation des récepteurs GABAA, (par exemple du fait de
la présence de neurostéroïdes comme l'alloprégnanolone et/ou la
tétrahydrodéoxycorticostérone), peut avoir un effet néfaste comme les
épilepsies sensibles aux stéroïdes, l'intoxication alcoolique, l'apprentissage
cognitif, la sensibilité douloureuse ou les troubles du sommeil. Cette
suractivation des récepteurs GABAA, peut se caractériser par des effets
inhibiteurs ou des effets excitateurs.
La mise en oeuvre de ces médicaments comprend habituellement
l'administration à ces mammifères d'une quantité thérapeutiquement efficace
d'un composé de formule I et notamment de l'oxime de cholest-4-èn-3-one, en
particulier pour augmenter la survie des neurones ou favoriser la croissance
axonale.
L'invention a tout autant pour objet une méthode de traitement des
maladies, notamment neurodégénératives, précitées et notamment une
méthode de traitement de pathologies ou traumatismes liés à la
dégénérescence ou à la mort des neurones, chez des mammifères (en général
des patients) atteints de telles pathologies ou traumatismes, comprenant
l'administration à ces mammifères d'une quantité thérapeutiquement efficace
de l'oxime de cholest-4-èn-3-one, en particulier pour augmenter la survie des
neurones ou favoriser la croissance axonale.
L'invention a de plus pour objet une méthode de traitement d'une
des affections ci-dessus décrites et notamment des pathologies ou
traumatismes liés à la dégénérescence ou à la mort des motoneurones, chez
des mammifères (en général des patients) atteints de tels pathologies ou
traumatismes, comprenant l'administration à ces mammifères d'une quantité
thérapeutiquement efficace d'un composé de formule I, en particulier pour
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
17
augmenter la survie des neurones. Plus spécifiquement, les pathologies liées à
la dégénérescence ou à la mort des motoneurones sont la sclérose latérale
amyotrophique ou les amyotrophies spinales infantiles.
L'invention a pour objet tout autant la mise à disposition de
nouveaux dérivés de la 4-cholestèn-3-one que d'autres dérivés de la 4-
cholestèn-3-one que ceux pouvant avoir été décrits dans l'état de la
technique.
Sont donc exclus ceux décrits dans la littérature.
Les conditions préférentielles ci-dessus décrites de mise en oeuvre
des médicaments de formule I s'appliquent également aux autres objets de
l'invention visés ci-dessus, notamment aux compositions, nouveaux dérivés,
utilisations et méthodes de traitement et inversement.
Les exemples qui suivent illustrent la présente demande.
EXEMPLE 1
On a préparé une suspension répondant à la formule
Oxime de cholest-4-èn-3-one 20 mg par ml
Excipient : Emulsion huileuse
EXEMPLE 2
On a préparé des gélules molles répondant à la formule
Oxime de cholest-4-èn-3-one 250 mg
Excipient : quantité suffisante pour une gélule terminée à 750 mg
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
18
EXEMPLE 3: Oxime de 1, 4-cholestadièn-3-one (R = R1)
Dans un ballon de 100 ml, on solubilise 5 g de 1, 4-cholestadièn-
3-one (13 mmol) dans 50 ml de pyridine, puis on ajoute 5 g de chlorhydrate
d'hydroxylamine. L'agitation est maintenue pendant 24h à température
ambiante, et on évapore le solvant sous pression réduite. On ajoute de l'eau,
puis de l'acétate d'éthyle afin d'effectuer une extraction. La phase organique
est lavée avec une solution aqueuse acidifiée (HCI 1%). L'acétate d'éthyle est
évaporé sous pression réduite. On obtient une poudre blanche avec un
rendement supérieur à 50%.
Analyse
- Chromatographie Liquide / Spectrométrie de Masse (Electrospray )
-Conditions de la chromatographie liquide haute performance :
Colonne : Macherey-Nagel - Nucleosil 300-6 C4 - 150x4,6 mm
Gradient : eau (+0.05% TFA) / acétonitrile (+0,05% acide trifluoroacétique)
t= 0 min : 60% acétonitrile, 40% H20
t= 6 min : 100% acétonitrile, 0% H20
Puis on reste 5 min à 100% d'acétonitrile
Temps de rétention : 5 min 60 secondes
Pic détecté en spectrométrie de masse : {M+H}+ = 398
EXEMPLE 4: Oxime de 4, 24-cholestadièn-3-one (R = R 2)
Dans un ballon de 10 ml, on solubilise 100 mg de 4, 24-
cholestadièn-3-one (0,26 mmol) dans 5 ml de pyridine, puis on ajoute 100 mg
de chlorhydrate d'hydroxylamine. L'agitation est maintenue pendant 24h à
température ambiante, et on évapore le solvant sous pression réduite. On
ajoute de l'eau, puis de l'acétate d'éthyle afin d'effectuer une extraction.
Puis la
phase organique est lavée avec une solution aqueuse acidifiée (HCI 1%).
L'acétate d'éthyle est évaporé sous pression réduite. On obtient une poudre
blanche avec un rendement supérieur à 50%.
Analyse
- Chromatographie Liquide / Spectrométrie de Masse (Electrospray(D)
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
19
Pic détecté en spectrométrie de masse : {M+H}+ =398
EXEMPLE 5: Oxime de 4, 22-cholestadién-3-one (R = R 4)
Dans un ballon de 10 ml, on solubilise 10 mg de 4, 22-
cholestadièn-3-one (0,026 mmol) dans 5 ml de pyridine, puis on ajoute 100 mg
de chlorhydrate d'hydroxylamine. L'agitation est maintenue pendant 24h à
température ambiante, et on évapore le solvant sous pression réduite. On
ajoute de l'eau, puis de l'acétate d'éthyle afin d'effectuer une extraction.
Puis la
phase organique est lavée avec une solution aqueuse acidifiée (HCI 1%).
L'acétate d'éthyle est évaporé sous pression réduite. On obtient une poudre
blanche avec un rendement supérieur à 50%.
Analyse
- Chromatographie Liquide I Spectrométrie de Masse (Electrospray )
Pic détecté en spectrométrie de masse : {M+H}+ =398
EXEMPLE 6: Oxime de 4-stigmasta-ène-3-one (R = R 3)
Dans un ballon de 50 ml, on solubilise 100 mg de 4-stigmasta-
ène-3-one (0,24 mmol) dans 10 ml de pyridine, puis on ajoute 100 mg de
chlorhydrate d'hydroxylamine. L'agitation est maintenue pendant 24h à
température ambiante, et on évapore le solvant sous pression réduite. On
ajoute de l'eau, puis de l'acétate d'éthyle afin d'effectuer une extraction.
Puis la
phase organique est lavée avec une solution aqueuse acidifiée (HCI 1 %).
L'acétate d'éthyle est évaporé sous pression réduite. On obtient une poudre
blanche avec un rendement supérieur à 50%.
Analyse
- Chromatographie Liquide / Spectrométrie de Masse (Electrospray )
- Pic détecté en spectrométrie de masse : {M+H}+ =428
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
EXEMPLE 7: Oxime de 4,6, 22-Ergosta-trièn-3-one (R = R 6)
Dans un ballon de 50 ml, on solubilise 100 mg de 4,6, 22-Ergosta-
trièn-3-one (0,25 mmol) dans 10 ml de pyridine, puis on ajoute 100 mg de
chlorhydrate d'hydroxxylamine. L'agitation est maintenue pendant 24h à
5 température ambiante, et on évapore le solvant sous pression réduite. On
ajoute de l'eau, puis de l'acétate d'éthyle afin d'effectuer une extraction.
Puis la
phase organique est lavée avec une solution aqueuse acidifiée (HCI 1%).
L'acétate d'éthyle est évaporé sous pression réduite. On obtient une poudre
blanche avec un rendement supérieur à 50%.
10 Analyse
- Chromatographie Liquide / Spectrométrie de Masse (Electrospray(D)
- Pic détecté en spectrométrie de masse : {M+H}+ =410
EXEMPLE 8: Oxime de 1,4, 6-Cholesta-trièn-3-one (R = R 1)
15 Dans un ballon de 50 ml, on solubilise 100 mg de 1,4, 6-Cholesta-
trièn-3-one (0,26 mmol) dans 10 ml de pyridine, puis on ajoute 100 mg de
chlorhydrate d'hydroxylamine. L'agitation est maintenue pendant 24h à
température ambiante, et on évapore le solvant sous pression réduite. On
ajoute de l'eau, puis de l'acétate d'éthyle afin d'effectuer une extraction,
puis la
20 phase organique est lavée avec une solution aqueuse acidifiée (HCI 1%).
L'acétate d'éthyle est'évaporé sous pression réduite. On obtient une poudre
blanche avec un rendement supérieur à 50%.
Analyse
- Chromatographie Liquide / Spectrométrie de Masse (Electrospray )
- Pic détecté en spectrométrie de masse : {M+H}+ =396
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
21
ETUDE PHARMACOLOGIQUE
On a testé les composés de formule I suivants :
Composé N
1 Oxime de cholest-4-èn-3-one décrite dans Gamma irradiation of
cholestenone oximes. Uenseren, Envare. Cekmece Nucl. Res. Train.
Cent., Istanbul, Turk. Avail. INIS. Report (1976), (CNAEM-R-157),
21 pp. From: INIS Atomindex 1977, 8(6), Abstr. No. 295540.
2 Composé de l'exemple 3
3 Oxime de cholestan-3-one disponible commercialement chez Sigma-
Aldrich
4 Cholest-4,24-dien-3-one décrite dans Chemical synthesis of cholest-
5,7,24-trien-3béta-ol and demonstration of its conversion to
cholesterol in the rat. Scallen, Terence J. Univ. of Minnesota,
Minneapolis, Biochemical and Biophysical Research
Communications (1965), 21(2), 149-55.
4,22-cholest-dièn-3-one. décrit dans 3-Keto-A4-steroids from 3-
hydroxy-ène-4 (or ène-5)-steroids. Yamanaka, Toru; Imai, Takashi.
(Takasago Perfumery Co., Ltd., Japan). JP 52116456 19770929
Showa. . Application: JP 76-32979 19760325. CAN 88:136852 AN
1978:136852
6 Composé de l'exemple 4
7 Composé de l'exemple 5
8 Composé de l'exemple 6
9 5-béta-hydroxy-cholestan-3-one disponible commercialement chez
Sigma-Aldrich
5-alpha-hydroxy-cholestan-3-one disponible commercialement chez
Sigma-Aldrich
11 5-alpha-cholest-6-èn-3-one disponible commercialement chez Sigma-
Aldrich
12 24-méthylcholest-4,6,22-trièn-3-one décrite dans Preparation of
3-béta-hydroxy-(24R)-methylcholest-5-ene. Khripach, V. A.;
Zhabinskii, V. M.; Zhernosek, E. V.; Lakhvich, F. A. (Institute of
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
22
Bioorganic Chemistry, Academy of Sciences, Belorussian S.S.R.,
USSR). U.S.S.R. (1990), et SU 1594181 19900923 : SU 88-
4612746 19881201. CAN 114:102558 AN 1991:102558
13 Oxime de cholest-5-èn-3-one-décrit dans Gamma irradiation of
cholestenone oximes. Uenseren, Envare. Cekmece Nucl. Res. Train.
Cent., Istanbul, Turk. Avait. INIS. Report (1976), (CNAEM-R-157),
21 pp.
14 Oxime de cholest-4,6-dièn-3-one décrit dans Azasteroid from
cholesta-4,6-dien-3-one. Ahmad, Mohammed S.; Siddiqui, A. H.;
Shafiullah; Logani, S. C. Aligarh Muslim Univ., Aligarh, Indic.
Australian Journal of Chemistry (1969), 22(1), 271-4.
15 Composé de l'exemple 7
16 Oxime de 5- alpha-cholest-1-èn-3-one décrite dans Polyphosphoric
acid-catalyzed Beckmann rearrangement of 3-keto-steroid oximes.
Kobayashi, Masaru; Shimizu, Yuzuru; Mitsuhashi, Hiroshi. Fac.
Pharm. Sc!., Hokkaido Univ., Sapporo, Japan. Chemical &
Pharmaceutical Bulletin (1969), 17(6), 1255-60.
17 Composé de l'exemple 8
1. Effets des composés de formule I sur la survie des
motoneurones
Pour mettre en évidence l'action neuroprotectrice des composés
de formule I, la demanderesse a étudié leur activité sur un modèle in vitro de
privation trophique de motoneurones de rats. On pourra se référer utilement à
la demande de brevet WO 0142784 de la demanderesse sur la mise en culture
des motoneurones de moelle épinière.
La moelle épinière d'embryons E14 de rat est disséquée et la
partie ventrale est dissociée par trituration après trypsination. Les
motoneurones sont séparés des autres cellules spinales par une méthode
connue (Camu et al, 1993, Purification of spinal motoneurons from chicken and
rat embryos by immunopanning. In Immunoselection Strategies for Neural cell
culture , Neuroprotocols : A companion to Methods in Neurosciences 2, 191-
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
23
199 ; Henderson et al., 1993, Neutrophins promote motor neuron survival and
are present in embryonic limb bud. Nature 363 (6426) :266-70). Les cellules
sont centrifugées sur un gradient de densité. Les motoneurones sont enrichis
dans la fraction des grandes cellules (les moins denses). Les cellules de
cette
fraction sont incubées avec un anticorps anti-p75, un antigène de surface
présent sur les motoneurones. Des anticorps secondaires couplés à des billes
magnétiques sont ajoutés et le mélange de cellules est passé à travers une
colonne dans un aiment (Arce et et, 1999). Seuls les motoneurones sont
retenus : leur pureté est de l'ordre de 90%.
Les motoneurones sont ensemencés à faible densité dans des
puits de culture sur un substrat de polyornithine-laminine dans un milieu
neurobasal supplémenté selon Raoul et al, 1999, Programmed cell death of
embryonic motoneurons triggered through the Fas death receptor. J Cell Biol
147(5) :1049-62. Des contrôles négatifs (absence de facteurs trophiques) et
positifs (en présence de BDNF (Brain-Derived Neurotrophic Factor) à 1 ng/ml,
GDNF (Glial-Derived Neurotrophic Factor) à 1 ng/ml et CNTF (Ciliary
Neurotrophic Factor) à 10 ng/mI, commercialisés par la société américaine
PEPROTECH, Inc. et la société Sigma-Aldrich, sont inclus dans chaque série.
Les composés à tester sont ajoutés 60 minutes après
l'ensemencement et les cultures sont maintenues à 37 C sous 5% de C02
pendant 3 jours.
Les motoneurones ont une tendance spontanée à mourir en
l'absence de facteurs neurotrophiques (Pettmann et Henderson, 1998,
Neuronal cell death. Neuron 20(4) :633-47). Après 3 jours, la survie est
évaluée
par une mesure de fluorescence après incubation des cellules en présence de
calcéine qui devient fluorescente dans les cellules vivantes.
Après 3 jours en culture à 37 C, sous 5% de C02 et en humidité
saturante, jusqu'à 50% des motoneurones ensemencés initialement survivent
dans le milieu supplémenté en facteurs neurotrophiques, alors que moins de
15% des motoneurones survivent en milieu basal seul.
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
24
L'activité des composés à tester a été évaluée par leur capacité à
empêcher la mort des motoneurones quand ils sont additionnés au milieu
neurobasal en comparaison avec la survie des motoneurones en milieu
supplémenté avec des facteurs neurotrophiques.
Les composés de formule I selon l'invention ont montré une
activité à une concentration capable de permettre un meilleurs taux de survie
des motoneurones dans le milieu basal. Ce taux de survie est exprimé par un
chiffre, le ratio. Si le ratio est supérieur à 0, l'effet des composés est
positif sur
la survie des motoneurones.
Les résultats obtenus sont les suivants :
Composé n Concentration en M Ratio
1 5 1
2 5 0,6
6 5 0,5
7 6 0,25
8 10 0,3
5 0,2
17 5 0,3
9 1 0,5
De par leur effet trophique sur les motoneurones spinaux, les
composés de formule I selon l'invention se montrent donc utiles comme
15 médicament, notamment dans le traitement des amyotrophies, en particulier
dans le traitement de la sclérose latérale amyotrophique ou des amyotrophies
spinales infantiles, et dans le traitement des traumatismes de la moelle
épinière.
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
2. Effets des composés de formule I sur la neuroprotection
Une axotomie du nerf facial est pratiquée sur des ratons
nouveaux-nés âgés de 2-3 jours. Les animaux reçoivent l'oxime de cholest-4-
èn-3-one 4 heures avant la section unilatérale du nerf puis quotidiennement
5 pendant 5 jours par voie sous-cutanée. Sept jours après la section du nerf,
les
animaux sont anesthésiés, puis fixés par perfusion intra-cardiaque de
paraformaldéhyde. Le cerveau est alors prélevé, inclus en paraffine. L'analyse
histologique de coupes sériées de 7pm du noyau facial, colorées au cresyl
violet, permet de compter le nombre de motoneurones du côté intact ainsi que
10 du côté du nerf sectionné (Casanovas et al., Prevention by lamotrigine, MK-
801
and N omega-nitro-L-arginine methyl ester of motoneuron cell death after
neonatal axotomy, Neuroscience, 1996, 71, 313-325).
Les résultats obtenus sont les suivants :
La survie des motoneurones du noyau facial chez des rats
15 nouveaux-nés axotomisés et traités par l'oxime de cholest-4-èn-3-one est
augmentée jusqu'à 40 % à une dose comprise entre 3 et 100 mg/kg, selon la
voie d'administration, par comparaison au nerf non sectionné.
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
26
3. Effets des composés de formule I sur la neuroprotection
Un écrasement du nerf sciatique est pratiqué sur des souris
adultes selon la méthode décrite par Azzouz et al.,Enhancement of mouse
sciatic nerve regeneration by the long chain fatty alcohol,N--hexacosanol,
Exp.Neurol.,1996,133 :189-97). Les animaux reçoivent les composés à tester le
jour de l'écrasement puis chaque jour pendant 4 semaines et par voie sous-
cutanée. Chaque semaine les animaux sont anesthésiés pour réaliser un
enregistrement électromyographique dans le muscle du mollet après
stimulation supramaximale du nerf sciatique. L'amplitude, la durée et la
latence
des potentiels d'action évoqués (CMAP) sont ainsi mesurées. Quatre semaines
après l'écrasement du nerf, les animaux sont sacrifiés par injection d'une
dose
mortelle d'anesthésique et un segment de nerf lésé est prélevé, fixé en
glutaraldéhyde 4 % et inclus en résine. L'analyse histologique de coupes
sériées, colorées au bleu de toluidine, permet un comptage semi-automatisé
des fibres dégénérées et non-dégénérées, ainsi qu'une mesure de la taille des
axones et de l'épaisseur de la gaine de myéline des fibres non-dégénérées.
Les résultats obtenus sont les suivants :
L'administration de l'oxime de cholest-4-èn-3-one réduit de 20 à
40 % le nombre de fibres dégénérées par comparaison aux animaux non
traités. De manière encore plus spectaculaire, la régénération des fibres
nerveuses est stimulée fortement par les composés à tester dès la deuxième
semaine après l'écrasement, avec un effet maximum observé quatre semaines
après l'écrasement. Ainsi quatre semaines après l'écrasement, l'amplitude des
CMAP chez les souris traitées par les composés à tester à une dose entre 0.3
et 30 mg/kg/jour, selon la voie d'administration, est augmentée de 40 à 70 %
et
la vitesse de conduction nerveuse améliorée de 30 à 50 % par comparaison
aux souris non traitées.
4. Effets des composés de formule I sur la protection des neurones
striataux de la mort induite par la surexpression d'une forme mutée de la
huntingtine
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
27
Des cultures primaires de neurones striataux sont préparées
comme décrit dans la littérature (Primary striatal neuronal culture, Mao L. et
al.,
Methods Mol Med., 2003, 79:379-86). Les cellules sont électroporées d'après
la procédure décrite par Raoul et al., (Motoneuron death triggered by a
specific
pathway downstream of Fas. potentietion by ALS-linked SOD1 mutations
Neuron, 2002, 35:1067-83) avant l'ensemencement avec un vecteur ou
plasmide d'expression contenant un élément promoteur suivi de l'ADN codant
pour une forme tronquée de la huntingtine qui comprend les 480 premiers
amino acides et 68 CAG (Saudou et al., Huntingtin acts in the nucleus to
induce apoptosis but death does not correlate with the formation of
intranuclear
inclusions, Cell, 1998, - 95:55-66). Un second vecteur d'expression contenant
l'ADN codant la green fluorescent protein (GFP) est également électroporé et
sert de gène rapporteur. L'ADN du plasmide codant la huntingtine a été
préparé par purification au chlorure de césium. Le plasmide contenant la
séquence GFP a été préparée sur colonnes Qiagen. L'intégrité des séquences
d'ADN est vérifiée par séquençage, transfection et western blotting. Les
cellules qui survivent à l'électroporation sont ensemencées à une densité de
4000 cellules par puits de plaques 96 puits. La culture se fait dans du milieu
Neurobasal (GIBCO) complémenté avec du pyruvate et du B-27 (Beckton
Dickinson). Les cellules sont maintenues en culture pendant 7 jours sans
changer le milieu.
Les traitements avec les composés à tester se font juste après
l'ensemencement à une concentration finale de 1 pM dans 0.5% de
diméthylsulfoxyde (DMSO). Les contrôles positifs se font par adjonction de
BDNF à 5 ng/ml final. Les contrôles négatifs ne reçoivent que 0.5% de DMSO.
La mort cellulaire est évaluée après les 7 jours par comptage du
nombre de cellules vivantes exprimant la GFP.
L'activité des composés à tester a été évaluée par leur capacité à
empêcher la mort des neurones striataux cultivés dans le milieu neurobasal en
comparaison avec la survie des neurones striataux en milieu supplémenté avec
du BDNF (Brain-Derived Neurotrophic Factor) .
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
28
Les résultats obtenus sont les suivants
Composé n Concentrations en pM Ratio
1 1 0,3
4. 1 0,2
9 1 0,5
11 1 0,3
12 1 0,3
A la concentration de 10-6 M, les composés à tester montrent un
effet protecteur de la mort cellulaire induite par la huntingtine mutée
jusqu'à 60
% par comparaison aux cellules traitées par le BDNF.
De par leur effet neuroprotecteur, les composés de formule 1
selon l'invention se montrent donc utiles comme médicaments destiné au
traitement ou à la prévention des affections neurodégénératives, notamment
dans le traitement des amyotrophies spinale, de la sclérose latérale
amyotrophique, dans le traitement des traumatismes de la moelle épinière et
des nerfs périphériques et dans le traitement de la maladie de Huntington.
5. Effets des composés de formule I sur la potentialisation des
récepteurs GABAA par les stéroïdes
Des expériences électrophysiologiques ont été réalisées in vitro
avec des neurones de rat (tranches d'hippocampe, neurones sensitifs en
culture), comme suit :
Les expériences sont réalisées avec des hippocampes prélevés sur des
rats de souche Sprague Dawley âgés de 10 à 21 jours. Les animaux sont
sacrifiés par décapitation, et leur cerveau est rapidement transféré dans de
l'ACSF (Artificial Cerebro-Spinal. Fluid) sans sodium (composition : KCI 2 mM,
NaH2PO4 1.2 mM, MgC12 2 mM, CaC12 0.5 mM, NaHCO3 26 mM, glucose 11
mM, saccharose 250 mM), maintenu à une température de 4= C et bullé avec
du carbogène (mélange 95% 02, 5% C02). Les hippocampes sont extraits de
CA 02517893 2005-09-01
PCT/FR2004/000532
WO 2004/082581
29
chaque hémisphère cérébral puis débités en tranches de 300 pM d'épaisseur
par un tissue chopper . Les tranches sont mises à reposer dans du milieu
ACSF (composition : NaCl 126 mM, KCM 2 mM, NaH2PO4 1.2 mM, MgCl2 2 mM,
CRCl2 0.5 mM, NaHC 3 26 mM, glucose 11 midi) à température ambiante, au
moins une heure avant enregistrement. Une tranche est ensuite déposée à
l'aide d'une pipette sur un système d'enregistrement multi-électrode (MEA,
MultiChannel SystemsTm, Germany) et positionnée de façon à couvrir les 64
électrodes. Pour éviter toute modification de positionnement par le flux de
perfusion, une grille lestée par un U en platine est positionnée sur la
tranche. Le MEA est alors rapidement inséré dans le système d'enregistrement
et la chambre perfusée avec de IACSF bullé au carbogène; le milieu de la
chambre est relié à la terre. L'ACSF perfusé ainsi que le MEA sont maintenus à
une température de 37 C. Une des 60 électrodes est sélectionnée comme
électrode de stimulation. Un courant de stimulation biphasique et d'une
intensité de 300 A durant 0,1 ms est généré à partir de cette électrode à
raison d'une stimulation toutes les 30 secondes. Les réponses évoquées sont
visualisées simultanément au niveau des 59 autres électrodes du MEA. Les
axones des collatérales de Schaeffer sont stimulés en CA3. Dans la région
CA1, 6 à 12 électrodes sont sélectionnées pour enregistrer les potentiels de
champ qui correspondent à la somme des variations des potentiels
postsynaptiques des neurones situés au voisinage de chaque électrode. Les
molécules testées sont dissoutes dans le milieu ACSF (la concentration finale
en DMSQ est <_ 0,1%) et amenées sur la tranche grâce au système de
perfusion.
Les neurones sensitifs de rat sont cultivés 1 à 2 jours et ensuite
enregistrés avec la technique de patch-clamp comme décrit dans De Roo M. et
al. (Dehydroepiandrosterone potentiates native ionotropic ATP receptors
containing the P2X2 subunit in rat sensory neurones, J Physiol, 2003, 552:59-
71).
Les résultats obtenus sont les suivants :
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
Sur les tranches d'hippocampe, une petite fraction des potentiels
post-synaptiques de champ enregistrés dans la région CA1 correspond à une
transmission GABAA excitatrice: elle est bloquée par des antagonistes
classiques des récepteurs GABAA (20 pM bicuculline ou 50 pM picrotoxine) et
5 potentialisée par des modulateurs allostériques positifs des récepteurs
GABAA:
benzodiazépine (1-10 pM de Diazepam) et stéroïdes (10-1000 nM
alloprégnanolone ou tétrahydrodéoxycorticostérone). L'effet potentialisateur
des stéroïdes disparaît lorsque les récepteurs GABAA sont désensibilisés par
l'ajout d'une concentration saturante de GABA (10 mM). L'effet excitateur du
10 GABA est lié au passage des ions hydrogénocarbonates (HC03-) à travers les
récepteurs GABAA.
Dans les neurones sensitifs enregistrés en patch-clamp, des
courants sont évoqués en ouvrant sélectivement les récepteurs GABAA de ces
neurones par, application rapide d'un agoniste GABAA-sélectif, l'isoguvacine.
15 Les courants chlore ainsi évoqués sont bloqués par la bucuculline et
potentialisés par l'alloprégnanolone.
Les résultats montrent que l'oxime de cholest-4-èn-3-one (testé
seul jusqu'à 10 pM) n'a pas d'effet sur les récepteurs GABAA (tranche
d'hippocampe ou neurones sensitifs). Par contre, l'oxime de cholest-4-èn-3-one
20 est capable de bloquer l'effet de modulateurs allostériques positifs
(alloprégnanolone ou tétrahydrodéoxycorticostérone) des récepteurs GABAA et
ceci de manière dose-dépendante et pour des concentrations équivalentes à
celles où sont observés les effets neurotrophiques in vitro.
Les composés de formule I ont donc un effet "protecteur" dans
25 toutes les pathologies où la suractivation des récepteurs GABAA, du fait de
la
présence d'alloprégnanolone et/ou de tétrahydrodéoxycorticostérone, peut
avoir un effet néfaste, que ce soit pour des effets inhibiteurs ou sur des
effets
excitateurs médiés par les récepteurs GABAA.
CA 02517893 2005-09-01
WO 2004/082581 PCT/FR2004/000532
31
Etude toxicologique
L'administration chez la souris, en particulier de l'oxime de la
cholest-4-èn-3-one, par les voies orale, sous-cutanée, intra-péritonéale et
intra-
veineuse, à des doses allant jusqu'à 300 mg/kg/ jour, par traitement avec
administration quotidienne pouvant aller jusqu'à 28 jours, n 'a pas montré de
toxicité significative.
Chez le singe, l'administration par voie orale de doses croissantes
journalières jusqu'à I500mg/l:g sur une période de 10 jours n'a révélé aucune
toxicité.