Note: Descriptions are shown in the official language in which they were submitted.
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
1
ANALYSE AUTOMATIQUE D'ECHANTILLONS CELLULAIRES
La présente invention concerne un procédé d'analyse d'un échantillon
cellulaire.
L'invention concerne aussi un procédé d'analyse d'une image numérique d'un
échantillon
cellulaire apte à être mis en oeuvre par un logiciel. L'invention concerne
encore un dispositif
d'analyse d'échantillons cellulaires.
Les applications industrielles et cognitives des cellules en culture sont
toujours
croissantes. Sans être exhaustif, on peut citer les applications suivantes
- cellules pour la production de protéines recombinantes,
io - cellules pour cribler des molécules pharmacologiques,
- cellules peur des tests diagnostiques,
- cellules pour construire une toxicologie prédictive,
- cellules pour la thérapie cellulaire de réparation de reconstruction et
régénération.
De nombreux facteurs rendent encore difficiles la pleine exploitation du
potentiel des
cellules en culture. Ces facteurs sont entre autres
- le caractère manuel de trop nombreuses opérations techniques rendant la
notion
de savoir-faire extrêmement critique,
- l'utilisation de nombreux facteurs indéfinis entrant dans les milieux de
culture, et
- la pauvreté qualitative et quantitative de systèmes cellulaires les plus
diffusés.
2o Ces raisons expliquent qu'à l'heure actuelle les techniques de culture
cellulaire sont plus
proches d'une somme de savoir-faire que d'une technologie pouvant être
industrialisée.
La quantification du nombre de cellules et de leur analyse morphologique est
un
élément critique pour le suivi cellulaire. Actuellement, pour une grande part,
cette activité est
manuelle et dépendant d'un savoir-faire de l'opérateur. Par ailleurs, les
méthodes usuelles
pour déterminer le nombre de cellules attachées, sont associées à des étapes
de détachement
ou de lyse cellulaire. Ces techniques font, de ce fait, disparaitre toutes
notions
morphologiques et conduisant à des pertes d'informations importantes.
Ainsi, il existe un besoin de faciliter et d'accélérer l'analyse quantitative
etlou
qualitative - telle que l'analyse de morphologie ou de répartition - des
noyaux dans les
3o échantillons cellulaires. Lesdits échantillons cellulaires pouvant être
soit des échantillons de
tissu provenant d'une biopsie, soit des cultures primaires de cellules soit
des cultures de
lignées cellulaires et ne se limitent pas à une provenance particulière.
L'invention a pour but
de contribuer à satisfaire ce besoin et vise notamment à automatiser au moins
partiellement
cette analyse tout en permettant une procédure simple et économe en temps et
en moyens.
A cette fin, la présente invention propose un procédé d'analyse d'un
échantillon
cellulaire, comprenant les étapes de
a) coloration des noyaux des cellules de l' échantillon ;
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
2
b) acquisition d'au moins une image numérique de l'échantillon ;
c) analyse numérique de ladite image.
Suivant des modes de réalisation préférés, le procédé comprend une ou
plusieurs des
caractéristiques suivantes
- l'étape a) de coloration comprend une coloration cytochimique
- l'étape a) de coloration comprend l'ûtilisation d'une technique
immunoenzymatique avec au moins un anticorps ;
- l'étape a) de coloration comprend l'utilisation d'une technique
d'immunoperoxidase avec au moins un anticorps ;
lo - l'étape a) de coloration des noyaux des cellules est une coloration non
spécifique
àl'ADN;
- entre les étapes b) et c), le procédé comprend une étape de décomposition de
l'image suivant une couleur donnée ;
- l'étape de décomposition de l'image est faite suivant soit la couleur de la
coloration, soit suivant la couleur complémentaire à la coloration ;
- l'étape de décomposition est faite suivant une des couleurs primaires de
l'espace
normalisé de colorimétrie Nrgb ;
- la coloration est magenta, l'étape de décomposition étant réalisée suivant
la
composante verte de l'espace normalisé de colorimétrie ;
- préalablement à l'étape c), le procède comprend une étape de binarisation
des
pixels de l'image pour faire ressortir les noyaux des cellules sur un fond ;
- l'étape de binarisation est effectuée par application de l'âlgorithme de
Ridler sur
l'image décomposée suivant ladite couleur donnée ;
- préalablement à l'étape c), le procédé comprend une étape d'élimination dans
l'image binarisée d'au moins un objet ayant iin nombre de pixels inférieur à
un premier seuil
prédéterminé ;
- préalablement à l'étape c), le procédé comprend une étape de division, dans
l'image binarisée, d'au moins un objet présentant un nombre de pixels
supérieur à un deuxiéme
seuil prédéterminé, en autant d'objets que de noyaux de cellules correspondant
à cet objet ;
- l'étape de division comprend l'érosion ultime dudit au moins un objet pour
fournir des germes, puis croissance desdits germes pour déterminer des lignes
de division
pour l'objet par application de la méthode dite ligne de séparation des eaux ;
- l'étape c) comprend le comptage des objets de l'image.
Selon un autre aspect, l'invention propose aussi un procédé d'analyse d'une
image
numérique d'un échantillon cellulaire apte à être mis en oeuvre par un
logiciel, chaque pixel
de l'image étant défini par un niveau d'intensité d'au moins une composante de
couleur ou
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
3
noir et blanc pazmi un nombre de niveaux d'intensité possibles supérieurs à
deux, le procédé
comprenant les étapes de
- binarisation des pixels de l'image pour faire ressortir les noyaux des
cellules sur
un fond ; et
- analyse de l'image binarisée.
Suivant des modes de réalisation préféré, le procédé comprend une ou plusieurs
des
caractéristiques suivantes
- chaque pixel de l'image numérique est défini par un niveau d'intensité de
trois
composantes de couleur différente, le procédé comprenant préalablement à
l'étape de
io binarisation, une étape de décomposition de l'image suivant une couleur
donnée associant à
chaque pixel de l'image un niveau d'intensité parmi un nombre de niveaux
possibles
supérieur à 2 ;
- la décomposition est faite suivant une des couleurs primaires de l'espace
normalisé de colorimétrie Nrgb ;
- l'étape de décomposition est réalisée suivant la composante verte de
l'espace
normalisé de colorimétrie ;
- l'étape de binarisation est effectuée par application de l'algorithme de
Ridler sur
l'image décomposée selon une couleur donnée ;
- le procédé comprend, préalablement à l'étape d'analyse, une étape
d'élimination
2o dans l'image binarisée d'au moins un objet ayant un nombre de pixels
inférieur à un premier
seuil prédéterminé ;
- le procédé comprend, préalablement à l'étape d'analyse, une étape de
division,
dans l'image binariséé, d'au moins un objet présentant un nombre de pixels
supérieur à un
deuxième seuil prédéterminé, en autant d'objets que de noyaux de cellules
correspondant à cet
objet ;
- l'étape de division comprend l'érosion ultime dudit au moins un objet pour
fournir des germes, puis croissance desdits germes pour déterminer des lignes
de division
pour l'objet par application de la méthode dite ligne de séparation des eaux
- l'étape d'analyse comprend le comptage des objets de l'image.
3o Selon encore un autre aspect, l'invention propose un dispositif d'analyse
d'échantillons
cellulaires, comprenant
- une platine~de réception d'une boîte multipuits d'échantillons à analyser ;
- un microscope ;
- une caméra numérique associée au microscope, la caméra fournissant des
images
sous forme de pixels, chaque pixel étant défini par un niveau d'intensité d'au
moins une
composante de couleur ou noir et blanc parmi un nombre de niveaux d'intensité
possibles
supérieurs à deux ;
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
4
- un système de déplacement de la boite placée dans la platine relativement au
microscope ;
- un ordinateur commandant le système de déplacement et la caméra et recevant
des images numériques fournies par la caméra, l'ordinateur comprenant en outre
un logiciel
mettant en oeuvre le procédé d'analyse d'une image numérique d'un échantillon
cellulaire
selon l'invention précédemment décrite.
Selon un mode de réalisation préféré, l'ordinateur est programmé pour acquérir
un
nombre donné d'images pour au moins un puits de la boîte placée dans la
platine par
commande du système de déplacement et de la caméra, et pour analyser lesdites
images par
application dudit logiciel.
Selon un autre aspect, l'invention propose aussi un procédé de sélection d'un
milieu de
culture caractérisé en ce qu'il comprend les ëtapes de culture de plusieurs
échantillons
cellulaires chacun dans un milieu de culture différent puis une analyse comme
précédemment
décrit.
is L'invention propose selon un autre aspect un procédé de mesure de la
toxicité d'une
substance caractérisé en ce qu'il comprend les étapes de culture d'un
échantillon cellulaire en
présence de la substance puis une analyse comme précédemment décrit.
Selon encore un autre aspect, l'invention propose aussi un procédé de mesure
des
caractéristiques cytopathologiques d'un virus caractérisé en ce qu'il comprend
les étapes de
culture d'un échantillon cellulaire en présence du virus puis une analyse
comme
précédemment décrit.
L'invention propose aussi un procédé de sélection de substances
pharmacologiques
intervenant dans les maladies du surpoids ou de l'obésité caractérisé en ce
qu'il comprend les
étapes de culture de cellules én prés~nce des substances à tester, la
coloration des acides gras
intracellulaires, puis l'acquisition d'au moins' une image numérique de
l'échantillon et
l'analyse numérique de ladite image.
L'invention propose finalement un procédé de sélection de substances
pharmacologiques intervenant dans l'ostëoporose caractérisé en ce qu'il
comprend les étapes
de culture de cellules en présence des substances à tester, la coloration des
cellules, puis
l'acquisition d'au moins une image numérique de l'échantillon et l'analyse
numérique de
ladite image.
D'autres caractéristiques et avantages de l'invention apparaîtront à la
lecture de la
description qui suit d'un mode de réalisation préféré de (invention, donnée à
titre d'exemple
et en référence au dessin annexé.
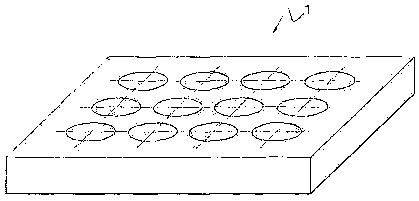
La fïgure 1 illustre une boîte multipuits. pour échantillon cellulaire
utilisée avec le
dispositif selon l'invention de la figure 2.
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
La figure 2 illustre schématiquement la partie matérielle d'un dispositif
selon
l' invention.
La figure 3 illustre un exemple d'image selon la composante verte de l'espace
normalisé
RGB d'un échantillon cellulaire coloré en magenta.
5 La figure 4 représente la répartition des pixels d'une image suivant leur
intensité.
Les figures 5a et 5b illustrent les images obtenues à partir de l'image de la
figure 3
après binarisation et sélection des objets de petite taille dans la première
et de grande taille
dans la deuxième.
La figure 6 illustre l'image des germes obtenue après érosion des objets de
l'image de la
1o figure Sb.
La figure 7 illustre le résultat de la croissance de région à partir des
germes de la figure
6, en montrant également les objets initiaux de la figure Sb.
La figure 8 illustre l'image finale obtenue par combinaison des images des
figures 5a et
Sb après scission des noyaux accolés.
La figure 9 illustre les résultats d'un test de toxicité effectué selon un
procédé
revendiqué par l'invention.
La figure 10 illustre les résultats d'une mesure de densité de lipides
effectuée selon un
procédé revendiqué par l'invention.
2o La figure 2 illustre schématiquement 1a partie matérielle d'un dispositif
selon
l'invention. Il comprend un ordinateur (non représenté), un microscope 2
couplé à une caméra
3, un système d'éclairage 4 et une platine 5 pour recevoir une boîte
multipuits 1 contenant des
échantillons cellulaires à analyser.
La boîte multipuits 1 peut être d'un type connu en soi. Généralement, les
puits d'une
boîte 1 ont tous une méme section. Un exemple de boîte multipuits 1 présentant
12 puits est
illustré par la figure 1. Les puits sont, dans ce cas, disposés régulièrement
suivant quatre
colonnes présentant chacune trois puits. Alternativement, il peut s'agir d'une
boîte multipuits
1 présentant 96 puits auquel cas les puits ont une section inférieure et sont
disposés
régulièrement suivant 12 colonnes présentant chacune 8 puits.
3o Chaque puits est prévu pour recevoir un échantillon cellulaire à analyser.
Le microscope 2 peut être un microscope optique connu en soï.
Le dispositif comprend une motorisation permettant de positionner l'objectif
2a du
microscope 2 devant n'importe lequel des puits de la boite et donc d'observer
l'échantillon
contenu dans le puits correspondant. Elle permet aussi de décaler l'objectif
2a devant un
même puits dans le cas où il est souhaitable d'observer successivement une
pluralité de zones
distinctes de l'échantillon d'un même puits, le .champ d'observation du
microscope 2 ne
couvrant qu'une petite partie de 1a surface d'un puits. Préférentiellement, le
microscope 2 est
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
6
fixe horizontalement et son axe d'observation est vertical - axe z - tandis
que la platine 5 est
motorisée pour déplacer la boîte 1 dans un plan horizontal x-y devant
l'objectif 2a du
microscope 2.
Le dispositif comprend également une motorisation permettant la mise au point
focale
du microscope 2 sur l'échantillon dans le puits sélectionné.
Préférentiellement, la platine 5 est
fixe verticalement alors que l'objectif 2a est motorisé pour être déplacé
verticalement suivant
l'axe z.
Par ailleurs, le microscope 2 est préférentiellement du type inversé.
Autrement dit,
l'objectif 2a du microscope 2 est placé sous la boîte 1 et observe
l'échantillon contenu dans le
io puits placé devant son objectif 2a à travers le fond de la boîte 1. Pour
cela, la boîte 1 est fait
dans un matériau transparent qui peut avantageusement être une matière
plastique.
L'utilisation d'un microscope 2 de type inversé permet le respect de la
distance focale pour la
mise au point du microscope sur l'échantillon contenu dans le puits. Au
contraire, dans le cas
de l'observation par le dessus de la boîte, le respect de la distance focale
peut nécessiter la
pénétration de l'objectif 2a du microscope 2 dans le puits, ce qui est
généralement exclu en
raison de la taille de l'objectif 2a.
La.caméra 3 permet d'acquérir sous forme numérique l'image de l'échantillon
fournie
par le microscope 2. La caméra 3 fournit l'image numérique à l'ordinateur via
une liaison 3a
quelconque adéquate.
2o La caméra 3 est préférentiellement de type couleur codant poux chaque pixel
trois
couleurs primaires sur un certain nombre de niveaux d'intensité, de préférence
au moins 16
niveaux pour chaque composante pour que les noyaux des cellules se distinguent
suffisamment du fond et du cytoplasme.
En fait, la caméra 3 peut avantageusement être du type CCD ou tri-CCD
fournissant une
image numérique en couleur, par exemple du type classique fournissant les
composantes R, V
et B de chaque pixel avec l'intensité de cY~aque composânte codée sur 256
niveaux, et
permettant donc de coder 2563 couleurs.
Le système d'éclairage 4 éclaire le puits de la boîte 1 situé devant
l'objectif 2a du
microscope 2. En l'occurrence, l'éclairage est réalisé par le dessus de la
boîte 1. Autrement
3o dit, le microscope 2 observe les échantillons contenus dans la boîte 1 en
lumière transmise. Le
système d'éclairage 4 peut avantageusement comprendre des filtres permettant
de sélectionner
un type de lumière donné en fonction de la nature de l'échantillon à analyser.
Similairement,
l'intensité de l'éclairage peut être réglable pour sélectionner une intensité
donnée en fonction
de la nature de l'échantillon à analyser.
Le temps de pose et l'ouverture de diaphragme de la caméra 3 pour acquérir une
image
. fournie par le microscope 2 peuvent également être. variables et
sélectionnés en fonction de la
nature de l'échantillon à analyser.
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
7
Pour une automatisation complète du dispositif, il est avantageux que
l'ordinateur
commande tous les éléments décrits grâce à un logiciel de pilotage adéquat.
Ainsi,
l'ordinateur peut commander le déplacement de la platine 5, la mise au point
focale et le
grossissement du microscope 2 et la caméra 3. Concernant la caméra 3,
l'ordinateur commande
le déclenchement de la prise de vue ainsi que les réglages du temps de pose et
de diaphragme_
Le réglage du système d'éclairage 4 est éventuellement manuel. car l'intensité
d'éclairage et le ou les filtres sélectionnés sont généralement les mêmes pour
tous les puits
d'une même boîte 1 et ne nécessitent donc pas d'intervention au cours de
l'analyse successive
de l'ensemble des puits de la boîte. Néanmoins, le système d'éclairage 4 peut
l0 avantageusement être piloté par l'ordinateur, ce qui permet une
automatisation plus complète
et évite d'éventuelles erreurs de réglage manuel concernant l'intensité
lumineuse ou le ou les
filtres sélectionnés.
A titre d'exemple, il peut être utilisé le matériel disponible dans le
commerce suivant
- microscope 2 : Nikon TE 2000-E avec une plaiine 5 motorisée x-y du type
PRIOR ;
- caméra 3 CCD : Nikon DMX 120Ø
L'ordinateur peut être d'un type classique tel qu'un compatible PC muni des
interfaces
entrées/sorties requises pour commander le dispositif et recevoir les images
numériques de la
caméra 3. De façon classique, il comprend aussi des interfaces utilisateurs
telles que clavier et
écran d' affichage.
Le logiciel de pilotage du microscope 2, de la caméra 3, du système
d'éclairage 4 et de
la platine 5 peut être le logiciel LUCIA-G de la société Laboratory Imaging
(République
Tchèque).
Nous allons maintenant décrire la préparation des échantillons cellulaires à
analyser qui
sont placés dans les puits d'une boîte multipuits 1.
Des cellules sont cultivées dans les puits de la boîte multipuits 1 dans
différentes
conditions de culture pour analyser les conséquences de ces conditions
expérimentales par
exemple sur la croissance cellulaire, sur des paramètres de cycle cellulaire
ou sur la fréquence
de différenciation. A la fin du temps expérimental, les cellules sont colorées
et éventuellement
fixées, l'analyse pouvant être pratiquée au choix sur des cellules vivantes ou
fixées. Si les
cellules sont fixées, on procède préférentiellement à leur fixation avant de
procéder à leur
coloration.
La fixation des cellules stoppe l'évolution cellulaire des échantillons afin
d'assurer que
le temps expérimental défini soit respecté notamment dans le cas où l'analyse
de l'échantillon
n'intervient pas immédiatement à l'issue de ce temps. Par ailleurs, la
fixation des cellules
permet aussi de figer leur répartition dans l'échantillon dans un souci de
fiabilité de l'analyse
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
ô
dans le cas où des zones distinctes de l'échantillon sont observées
successivement au
microscope 2.
Les cellules sont colorées pour révéler les noyaux naturellement translucides.
A cette
fin, s'agissant des colorations , il est avantageux de recourir à une
coloration de cytochirnie
notamment après avoir recouru à une fixation alcoolique. Les colorants de
cytochirnie
présentent l'avantage de la simplicité de mise en couvre, de la robustesse,
d'un bon rapport
signal sur bruit et de la très bonne conservation. De plus, les analyses
peuvent se faire
simplement en lumière blanche. Quant à la fixation alcoolique, elle est
avantageuse car elle
constitue une forme de fixation rapide, qui n'interfère pas avec les
techniques de coloration.
Le fait de révéler les noyaux permet au dispositif de l'invention d'acquérir
des images
de l'échantillon et traiter automatiquement celles-ci pour déterminer par
exemple le nombre
de noyaux de l'échantillon, leur morphologie et caractériser leur
distribution. Par voie de
conséquence, il permet aussi de quantifier le nombre de cellules dans
l'échantillon à partir du
nombre de noyaux observés. La majorité des cellules de mammifères ne possèdent
qu'un seul
noyau.
Pour une analyse plus fiable, plusieurs puits de la boîte 1 peuvent contenir
des
échantillons cultivés dans des conditions identiques. Äinsi, il peut être tenu
compte des
variations intrinsèques aux systèmes biologiques et expérimentales entre
échantillons de
2o même condition. Cela de permet notamment de moyenner les analyses faites
sur ces puits et
donc d'avoir un résultat plus fiable. De façon simple, il peut être convenu
que chaque colonne
de puits de la boîte 1 soit dédiée à une même condition de culture. Le nombre
de puits
contenant des échantillons d'une même condition - autrement dit, le nombre de
puits
effectivement utilisés dans chaque colonne dans notre exemple - peut être
choisi en fonction
du taux d'erreur admissible pour le résultat de l'analyse, ce taux diminuant
avec
l' augmentation du nombre d~ puits avec une même condition de culture.
Nous allons maintenant décrire 1e procédé d'analyse mis en ouvre par un
logiciel de
commande et d'analyse exécuté par l'ordinateur du dispositif selon l'invention
décrit
3o précédemment. Ce logiciel de commande et d'analyse commande 1a partie
matérielle du
dispositif par le biais du logiciel de pilotage précité et réalise l'analyse
des images numériques
fournies par la caméra 3. Avant de lancer l'analyse d'échantillons par
l'ordinateur, un
opérateur place dans la platine 5 une boîte multipuits 1 contenant des
échantihons cellulaires à
analyser dans ses puits.
Dans une première étape, l'ordinateur sollicite L'opérateur pour que celui-ci
indique le
type des échantillons cellulaires à analyser. Cela peut être réalisé par choix
de l'opérateur
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
9
dans un catalogue prédéfini de types proposé par l'ordinateur. Le type
d'échantillon prend en
compte à la fois le type de cellules à analyser et le type de colorations
histologiques
appliquées à celles-ci.
Dans le cas où le dispositif est prévu pour fonctionner avec différents types
prédéterminés de boîtes multipuits 1 tels que les boîtes 12 puits et 96 puits
précités,
l'ordinateur sollicite l'opérateur pour que celui-ci indique le type de boite
1 placé dans la
platine 5. Alternativement, i1 peut être prévu une reconnaissance automatique
du type de boîte
1 par le dispositifpar exemple à l'aide d'une marque de couleur spécifique au
type de la boîte
et placé à un endroit prédéterminé de celle-ci. L'ordinateur pilote la platine
5 pour faire
observer la marque au microscope 2 et fournir l'image numérique correspondante
à
l'ordinateur par le biais de la caméra 3. En déterminant la couleur de la
marque, l'ordinateur
détermine le type de boîte 1 concerné.
Comme indiqué, il peut être prévu que la boîte 1 ait, pour chaque condition de
culture,
un nombre de puits donné présentant des échantillons de cette condition de
culture. Ce
nombre peut être laissé au choix de l'opérateur pour lui permettre de
sélectionner le taux
d'erreur d'analyse acceptable. Dans ce cas, l'ordinateur sollicite l'opérateur
pour qu'il lui
indique ce nombre. La topologie de répartition des échantillons de même
condition dans les
puits de la boîte 1 est préférentiellement prédéfmie pour éviter à l'opérateur
de devoir la
fournir à l'ordinateur.
Dans une deuxiéme étape, si le dispositif le permet, l'ordinateur règle
l'éclairage du
système d'éclairage 4 en fonction du type d'échantillons cellulaires
précédemment
sélectionné par l'opérateur. A défaut, c'est l'opérateur qui règle le système
d'éclairage 4 si
celui-ci n'est pas commandé par l'ordinateur. Dans ce cas, l'ordinateur peut
évenh~ellement
0
lui indiquer les réglages à faire.
Dans une variante simplifiée, le systéme d'éclairage 4 ne comprend pas de
filtres
sélectionnables et/ou de réglage d'intensité. En particulier, il peut être
prévu que l'éclairage
soit toujours le même quel que soit 1e type d'échantillon concerné, par
exemple de la lumière
blanche.
Dans une troisième étape, l'ordinateur procède à l'acquisition d'images des
échantillons
à analyser. Pour cela, il place successivement les puits de la boîte 1
contenant les échantillons
devant l'objectif 2a du microscope 2 en commandant la platine 5.
Pour chaque puits, l'ordinateur fait prendre un nombre prédéterminé N d'images
distinctes de l'échantillon par la caméra 3 en décalant à chaque fois le puits
devant l'objectif
2a pax commande de la platine 5. L'ordinateur commande la mise au point focal
du
microscope 2. Il procède aussi au réglage du diaphragme et du temps de pose de
la caméra 3
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
ainsi qu'au grossissement du microscope 2, ces réglages peuvent être fonction
du type
d'échantillon sélectionné.
Ces images numériques sont transmises à l'ordinateur au fur et à mesure de
leur
acquisition. Dans l'exemple d'une caméra CCD ou tri-CCD classique à 2563
couleurs,
5 l'ordinateur reçoit les valeurs des composantes R, V et B pour chaque pixel
d'une image,
l'intensité de chacune étant codée sur ~ bits et fournissant donc 256 niveaux
d'intensité pour
chaque composante. L'ordinateur stocke ces images de préférencé sur son disque
dur.
Les N images sont de préférence inscrites à l'intérieur du puits afin d'éviter
que les
images ne comprennent des parties extérieures au puits. A défaut, l'analyse
des images
10 nécessiterait des traitements supplémentaires pour distinguer l'intérieur
du puits de l'extérieur.
Les N images peuvent être prises en des positions prédéterminées de
l'échantillon ou en
des positions aléatoires.
Préférentiellement, chaque image couvre une zone de l'échantillon qui lui est
spécifique
et qui ne recouvre pas tout ou partie d'autres images de façon à éviter la
redondance qui
viendrait diminuer la représentativité des images acquises par rapport à
l'ensemble de
l'échantillon.
Dans une quatrième étape,1'ordinateur décompose chaque image couleur en une
image
suivant une couleur unique donnée qui fournit une bonne distinctivité entre
les objets à
2o analyser - les noyaux - et le fond de l'image.
La couleur unique dans laquelle chaque image est décomposée est fonction du
type
d'échantillon à analyser, et plus particulièrement de la coloration
histologique effectuée.
Typiquement, pour fournir une bonne distinctivité, la décomposition de l'image
peut se faire
soit suivant la couleur de la coloration histologique, soit suivant la couleur
complémentaire à
Y
celle-ci.
Dans le cas d'une coloration de cytochimie en magenta, il est avantageux que
l'ordinateur décompose chaque image couleur en une image suivant la composante
verte de
l'espace RGB normalisé (noté classiquement Nrgb). En effet, ~ le vert est la
couleur
complémentaire du magenta. De plus, l'espace RGB normalisé fournit une
meilleure
discrimination en comparaison des composantes R, V, B fournies pax la caméra
du fait que
l'espace normalisé est moins sensible aux variations de luminosité. Ainsi,
pour chaque pixel
d'une image acquise, l'ordinateur calcule le niveau d'intensité de la
composante verte 'g' de
l'espace RGB normalisé comme suit
g=G/(R+G+B)
avec R, G et B les valeurs des composantes rouge, verte et bleue fournies par
la caméra 3.
La figure 3 illustre un exemple d'image selon la composante verte de
l'espace.normalisé
RGB d'un échantillon cellulaire coloré en magenta. Plus le niveau d'intensité
est faible, plus
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
11
la représentation du pixel est sombre. Äinsi, les pixels des noyaux présentent
un niveau
d'intensité nettement plus faible en comparaison des pixels du fond qui
présentent un niveau
d'intensité élevé.
Dans une variante simple, au lieu de décomposer chaque image suivant une
composante
d'un autre espace colorimétrique, l'ordinateur peur retenir chaque image
suivant l'une des
composantes R, V, B fournie par la caméra 3, par exemple l'image suivant la
composante V
dans le cas d'une coloration de cytochimie en magenta, bien que la
distinctivité soit moindre.
Dans une variante encore plus simple, la caméra 3 fournit des images en noir
et blanc au
lieu d'être en couleur auquel cas cette quatrième étape est omise.
Dans une cinquième étape, l'ordinateur fournit une version binarisée de chaque
image
issue de la quatrième étape discriminant les noyaux et le fond. Pour cela, un
seuil d'intensité
est défini pour discriminer les pixels considérés comme appartenant aux noyaux
des pixels
considérés comme appartenant au fond. En d'autres ternies, l'ordinateur
compare l'intensité
de chaque pixel de l'image issue de la quatrième étape à ce seuil et lui
attribue une première
valeur - 0 - ou une deuxième valeur - 1 - en fonction du résultat de la
comparaison. Dans la
suite, nous considérons que la valeur '1' correspond aux pixels de noyaux et
'0' au reste.
Dans un souci de fiabilité de l'analyse, il est préférable pour l'ordinateur
de déterminer
à chaque fois ce seuil plutôt que d'appliquer une valeur fixe prédéterminée de
ce seuil pour un
2o type de coloration de cytochimie donnée, étant donné la variabilité de la
coloration des
. noyaux. Autrement dit, il est préférable que l'ordinateur détermine ce seuil
spécifiquement
pour chaque image.
Pour déterminer le seuil à appliquer, l'ordinateur peut mettre en oeuvre une
technique
quelconque adéquate connue en soi pour déterminer automatiquement un tel
seuil.
La technique appliquée pax l'ordinateur peut être fonction du type de
l'échantillon.
Dans ce but, l'ordinateur peut notamment appliquer à l'image issue de la
quatrième
étape un algorithme mettant en ceuvre la méthode itérative de Ridler qui est
connu en soi. Cet
algorithme procure un excellent résultat dans le cas d'un histogramme de
répartition bi-modale
des pixels suivant leur intensité. La répartition est bi-modale dans le cas où
seuls les noyaux des
3o cellules sont colorés par la coloration histologique. La figure 4
représente un tel histogramme
pour l'image de l'échantillon cellulaire de la figure 3. L'axe des abscisses
représente l'intensité
lumineuse codée en 256 niveaux et l'axe des ordonnées le nombre de pixels.
Dans certains cas, la répartition est tri-modale. Ce peut être le cas lorsque
le cytoplasme
des cellules se colore également, mais à un degré moindre que les noyaux, lors
de la
coloration histologique. Dans ce cas, le seuil peut être déterminée par deux
applications
successives de l'algorithme de Ridler. La première application fournit le
seuil permettant de
discriminer le fond du reste : noyau et cytoplasme dans notre exemple. Une
deuxième
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
12
application de l'algorithme à la partie de l'histogramme comprenant seulement
le reste, c'est-
à-dire la partie de l'histogramme limitée à ce seuil, permet de fournir un
second seuil
permettant de discriminer les noyaux de tout le reste : à la fois du fond et
du cytoplasme dans
notre exemple.
Le fait pour l' ordinateur d' appliquer une fois ou deux fois l'algorithme de
Ridler p eut
être fonction du type des échantillons. Mais il est préférable que
l'ordinateur détermine 1ui-
même - de façon connue en soi - si une image présente une répartition bi-
modale ou rtri-
modale afm d' appliquer soit une fois soit deux fois l' algorithme de Ridler.
Comme mentionné, il est préférable que l'ordinateur détermine ce seuil pour
chaque
lo image. Dans une variante simplifiée, l'ordinateur détermine ce seuil pour
une seule image
d'un puits et l'utiliser aussi pour les autres images de ce puits, voire
encore pour les images
des autres puits présentant des échantillons d'une même condition, voire en
définitive pour
l'ensemble des images relatives aux puits d'une même boîte 1.
Il est préférable que, dans une sixième étape, l'ordinateur élimine de l'image
binarisée
les objets de petite taille car ils correspondent non pas à des noyaux, mais à
des artéfacts. Pour
cela, l'ordinateur peut simplement compter le nombre de pixels de chaque objet
et l'éliminer
dans le cas où ce nombre est inférieur à un nombre prédéterminé de façon
expérimentale, par
exemple 50 pixels pour un grossissement de 150 fois du microscope 2. Ce nombre
2o prédéterminé est avantageusement fonction du type d'échantillons
cellulaires. Dans notre
exemple, éliminer un objet consiste à placer la valeur des pixels de l'objet à
'O'.
Dans une septième étape, l'ordinateur peut avantageusement effectuer un
traitement sur
l'image pour distinguer d'éventuels noyaux accolés de gros noyaux.
Pour cela, l'ordinateur peut crier deux images distinctes à partir de l'image
binarisée
issue de 1a sixième étape. L'ordinateur retient dans la première image tous
les objets de
l'image binarisée correspondant chacun à un noyau isolé en raison de la petite
taille de l'objet.
Au contraire, l'ordinateur retient dans la deuxième image les objets plus
grands qui peuvent
en fait correspondre soit à un gros noyau isolé, soit à plusieurs noyaux
accolés. Pour cela,
, l'ordinateur place dans la première image uniquement les objets présentant
une taille
inférieure à une valeur prédéterminée, par exemple 450 pixels pour un
grossissement de 150
fois du microscope 2, et il place dans la deuxiéme image les autres objets. Là
encore, dans notre
exemple, les pixels des objets non repris dans une de ces images sont placées
à la valeur '0'.
Cette valeur prédéterminée peut être déterminée expérimentalement. Elle peut
être
fonction du type des échantillons cellulaires. Les figures 5a et 5b illustrent
respectivement la
première image et la deuxième image obtenues dans le cas de l'image
d'échantillon de la
figure 3.
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
13
L'ordinateur traite ensuite la deuxième image pour diviser les objets
correspondant à
plusieurs noyaux. Un tel objet est divisé en autant de parties que de noyaux
qu'il représente.
A cette fin, l'ordinateur peut avantageusement mettre en oeuvre la méthode
connue en soi dite
ligne de partage des eaux (ou « watershed » en anglais). Pour cela, à partir
d'une copie de la
deuxième image, l'ordinateur effectue une érosion ultime de chaque objet pour
en fournir son
ou ses germes. Chaque germe correspond à un noyau de cellule. La figure 6
illustre l'image
des germes obtenue après érosion des objets de l'image de la figure Sb.
L'ordinateur procède ensuite à une croissance de région à partir des germes,
la
croissance étant stoppée lorsque deux régions se rencontrent. La figure 7
illustre le résultat de
la croissance de région en montrant les objets initiaux de la figure Sb. Les
frontières entre
régions servent ensuite à segmenter les objets de la deuxième image. A cet
effet, l'ordinateur
place les pixels des frontières à la valeur du fond dans la deuxième image ;
dans notre
exemple, il affecte la valeur '0' à ces pixels. Par conséquent, les objets
sont scindés en
conséquence en autant de parties que de germes obtenus par érosion ultime.
La deuxième image après scission des noyaux le cas échéant est combinée avec
la
première image qui contient les objets de petites tailles réputés correspondre
chacun à un
noyau isolé. Il en résulte une image qui montre tous les noyaux de
l'échantillon et qui sont
chacun séparés des autres. La figure ~ illustre l'image résultante obtenue
pour l'image
d'échantillon de la figure 3 avec les flèches référencées 'S' qui pointent
quelques
segmentations résultant de la septième étape.
Dans une huitième étape, l'ordinateur procède à l'analyse des objets contenus
dans
l'image issue de la septième étape par des techniques d'analyse d'image
connues en soi.
En particulier, il compte le nombre d'objets contenus dans l'image, ce qui
fournit le
nombre de noyaux contenus dans l'échantillon puisque chaque objet correspond à
un noyau.
A titre d'exemple non limitatif, l'ordinateur peut également déterminer pour
chaque
noyau l'une ou plusieurs des informations suivantes
- la surface du noyau ;
- le périmètre du noyau ;
- la direction principale ;
- les coordonnées dans l'image ;
- la longueur du petit axe et du grand axe de l'ellipse qui modélise le mieux
l'objet.
L'ordinateur peut bien évidemment sauvegarder ces résultats dans un fichier.
Dans une neuvième étape, l'ordinateur peut déterminer des informations
relatives à
l'échantillon complet d'un puits à partir des données obtenues .pour
l'ensemble des images de
ce puits. Ainsi, il peut estimer le nombre total de noyaux contenus dans le
puits en fonction du
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
14
nombre de noyaux contenus dans les N images acquises de ce puits au vu du
rapport
prédéterminé entre la surface partielle du puits couverte par les N images et
la surface totale du
puits. Il est aussi possible de déterminer la densité cellulaire en calculant
le nombre de noyaux
présents comme précédemment décrit et en divisant ce nombre par la surface de
l'image.
L'ordinateur peut également établir des statistiques sur chaque puits
concernant les
autres caractéristiques déterminées, notamment celles listées précédemment.
Dans le cas d'une pluralité de puits contenant des échantillons d'une même
condition,
l'ordinateur peut moyenner les informations relatives à ces puits pour
diminuer le taux d'erreur.
A partir de là, l'ordinateur peut aussi calculer le nombre de divisions
cellulaires et le
io temps nécessaire pour que le nombre de cellules double si l'opérateur lui
fournit le nombre de
cellules ensemencés à l'origine dans les puits de la boîte 1 et le temps de
culture en
considérant que la croissance des cellules est exponentielle.
Bien entendu, l'ordinateur peut stocker, par exemple sous forme de fichiers,
les résultats
de l'analyse ainsi que les images acquises et/ou obtenues après traitement
suivant les
différentes étapes du procédé.
Pour chaque type de cellules considéré, il peut être déterminé
expérimentalement les
choix et paramètres procurant les meilleures résultats d'analyse qui sont
ensuite mis en oeuvre
de façon automatique par le procédé de l'invention. Ainsi, le procédé peut
être rnis en ouvre
2o avec des colorants cytochimies autres que 1e magenta. Pour chaque type de
cellules, il peut
être déterminé expérimentalement le colorant fournissant une bonne
distinctivité des noyaux
par rapport au reste. De même, le réglage de l'éclairage s'il est prévu et les
réglages de la
caméra - temps de pose et ouverture du diaphragme - prise de vue peuvent
également être
déterminés expérimentalement pour chaque type d'échantillons afin de fournir
des images
présentant un bon contraste des noyaux par rapport au fond.
Dans la troisième étape, le nombre N d'images prises pour l'échantillon d'un
puits est
au moins un. Mais, bien entendu, plus le nombre N est grand, plus la surface
de l'échantillon
couverte par les images est grande et plus les informations estimées par
l'ordinateur pour un
puits donné prësenteront un taux d'erreur faible. Ce nombre N peut être
déterminé de façon
3o expérimentale pour obtenir un taux d'erreur acceptable d'analyse. A titre
d'exemple, il est
acquis 300 images distinctes de chaque puits d'une boîte 1 à 12 puits - chaque
puits ayant un
diamètre de 2.159 cm pour 1 puits et une aire de 3.66 cm2 avec un
grossissement de 150 fois
du microscope 2. Ces 300 images couvrent alors environ 90 % de la surface
totale du puît.
A titre d'exemple, le procédé de l'invention peut être mis en eeuvre sur la
base du
logiciel Image J~ mis à disposition par le National Institute of Health aux
Etats-Unis.
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
Le recours aux noyaux marqués par des colorants histologiques permet
avantageusement d'analyser avec le dispositif de l'invention de manière
sensible et
quantitative les conséquences des différentes conditions de culture sur la
densité cellulaire et
donc sur la croissance cellulaire. A ces résultats quantitatifs, il peut être
associé une image
5 numérisée des échantillons cellulaires fournie par le dispositif ainsi
obtenue qui constitue
alors un document d'archive et de référence. Cette manière de procéder permet
de paramétxer
les approches expérimentales et donc d'en augmenter la traçabilité. Un mode de
réalisation
avantageux utilise un colorant nucléaire tel que le Giemsa. permettant une
coloration du
noyau cellulaire qui n'est pas une coloration de l'AIDN. D'autres réactifs
nucléaires non-
io spécifiques à l'ADN peuvent être utilisés et sont bien connus de (homme du
métier, tels que
les Carmin d'Orth, Cresyl violet, Safrinine Q, Vert de malachite, Violet
crystal,
Hematoxyline, Eosine, Colorant de Wright, Methyl green ou le Thionin. Il
en~résulte une plus
grande homogénéité du signal provenant du noyau et une absence de variation de
l'intensité
du signal en fonction des étapes de réplication de l'ADN durant le cycle
cellulaire.
15 Il est également possible d'utiliser le dispositif de l'invention et le
procédé mis en
oeuvre avec des techniques de coloration autres que les colorations de
cytochirnie.
Ainsi, il peut être recouru à des colorations spécifiques des cellules auquel
cas il est
avantageux de recourir aux techniques innmunoenzymatiques avec des anticorps
caractérisés
du fait de leur spécificité et de l'existence d'un grand choix d'anticorps
spécifiques. En
2o particulier, il peut être recouru aux techniques d'immunoperoxidase dont
les résultats sont
observables sous lumière blanche. L'emploi de ces colorations spécifiques
permet notamment
d'analyser avec le dispositif de l'invention, soit des paramètres de cycle
cellulaire, soit des
paramètres de différenciation. A titre d'exemple, le nombre de cellules en
phase S peut être
déterminé après marquage des cellules par du BrdU et reconnaissance des noyaux
positifs à
l'aide d'un anticorps dirigé contre le BrdU. Des anticorps dirigés contre
différentes protéines
impliquées dans le contrôle du cycle cellulaire, comme PGNA, P21, F16 et la
cycline A, sont
aussi utilisables. L'analyse de la différenciation peut être effectuée en
utilisant des anticorps
dirigés contre des facteurs de transcription spécifique d'un état de
différenciation particulier. A
titre d'exemple, pour la différenciation musculaire, il est recouru à des
anticorps dirigés contre
3o les facteurs de transcription spécifique du tissu musculaire, les protéines
de la famille MyoD.
La coloration des cellules peut également être obtenue par l'emploi de
marqueurs
fluorescents. Les colorants vitaux comme le bisbenzimide qui se lient avec une
affinité
importante à l'ADN permettent de suivre la croissance sur des cellules
vivantes et d'analyser
des modifications de l'organisation de l'ADN nucléaire qui sont associés à
l'apoptose. Les
marqueurs fluorescents associés à des anticorps dirigés contres des protéines
membranaires
permet de dénombrer les cellules possédant ce marqueurs.
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
16
Bien entendu, la présente invention n'est pas limitée aux exemples et au mode
de
réalisation décrits et représentés, mais elle est susceptible de nombreuses
variantes accessibles
à (homme de fart. En particulier, les images acquises peuvent être traitées
chacune
complètement selon les étapes quatre à huit avant de passer au traitement
complet de l'image
acquise suivante. Par ailleurs, il n'est pas nécessaire d'attendre que toutes
les N images aient
été acquises dans la troisième étape pour commencer le traitement de celles
déjà acquises.
Concernant la méthode itérative de Ridler, l'on peut se référer à l'article de
Ridler,
Calvard, « Picture Thresholding Using an Interative Selection Method », IEEE
transactions on
Systems, Man and Cybernetics, 1978.
lo Concernant plus généralement la détermination de seuil (en anglais «
thresholding »),
l'on peut notamment se référer à
- T. Pun, « A new method for gray level picture thresholding using the entropy
of
the histogram », Signal Processing, 1980, vol. 2, p. 223-237 ;
N. Otsu, « A threshold selection method from gray level histograms », IEEE
Transactions on systems, man, and cybernetics, vol. 9, p. 62-66 .
Concernant la méthode dite ligne de partage des eaux, l'on peut se référer à
- R. Gonzales, R. Woods, « Digital Image Processing », Addison Wesley, 1993,
p.
443-45 8 ;
- O. Lezoray, « Histogram and watershed based segmentation of color images »,
2o Proceedings of CGIV'2002, avril 2002, p. 358-362.
L'ensemble des documents précités sont incorporés par référence dans la
présente
description.
Le dispositif de l'invention et le procédé mis en oeuvre reçoivent diverses
applications.
Un premier exemple concerne la construction de test cellulaire de toxicité
prédictive
mise en oeuvre sous forme d'une machine de criblage à haut débit. Au niveau
cellulaire, les
conséquences de la toxicité sont multiples. Les plus fréquentes sont des
modifications des
paramètres de la croissance cellulaire, la mort cellulaire par apoptose ou par
nécrose, des
modifications morphologiques et fonctionnelles. La culture, puis l'analyse
automatisée selon
l'invention de cellules cultivées dans des plaques multiples de par exemple 96
puits - qui
permet de multiplier le nombre d'analyses - permet de fournir des systèmes
toxicologiques
prédictifs à haut débit. Par l'analyse d'image, il est possible d'extraire des
données
quantitatives sur la croissance cellulaire, sur la mort cellulaire, la
morphologie et les fonctions
cellulaires. Les systèmes de cultures ex vivo permettent de contrôler
l'environnement
cellulaire et d'utiliser des cellules spécifiques. Ainsi, l'utilisation de
cellules provenant des
différents tissus - tels que foie, muscle, .peau, système nerveux, vaisseaux -
de l'organisme
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
17
permet de tester la toxicité de molécules sur ces différents tissus et donc de
construire des
tests toxicologiques spécifiques.
Différent modes de réalisation de la présente invention appliqués à des tests
cellulaires sont
décrites ci-dessous.
I Comptage cellulaire par analyse d'image pour la détermination de la densité
cellulaire afin de sélectionner un milieu de culture
1o La croissance cellulaire est dépendante de combinaisons de facteurs qui
composent des
codes de croissance spécifiques. La grande majorité des éléments nécessaires
pour 1a culture
cellulaire ex vivo est â la fois connue et facile d'accès. La question est de
définir les
combinaisons de ces éléments, qui constituent ces codes.
L'approche décrite permet de construire un système simple et versatile pour
analyser la
densité cellulaire de manière quantitative et la fréquence d'expression d'un
marqueur et pour
stocker des images cellulaires. Les méthodes usuelles pour déterminer le
nombre de cellules
sont associées à des étapes de détachement cellulaire (Coulter) ou à des
étapes de lyse
cellulaire (MTT). Ces techniques font, de ce fait, disparaître toute notion
morphologique et
2o résultent en une perte d'informations importantes.
Le procédé selon l'invention permet d'analyser le rôle de la présence de
facteur de
croissance sur la densité cellulaire et sur la morphologie nucléaire.
Les étapes sont les suivantes. Les différents types cellulaires sont cultivés
sur des
multipuits de 12 à 96 puits dans différentes conditions de culture pour
analyser les
conséquences de ces conditions expérimentales, soit sur la croissance
cellulaire, soit sur des
paramètres de cycle cellulaire et soit sur la fréquence de différenciation. A
la fin du temps
expérimental, les cellules sont Fxées, puis colorées. Pour les colorations
cytochimiques, nous
utilisons les colorants histologiques nucléaires tel que le Giemsa après une
fixation
3o alcoolique. D'autres colorants histologiques pouvant être utilisés sont les
Carmin d'Orth,
Cresyl violet, Safrinine Q, Vert de malachite, Violet crystal, Hematoxyline,
Eosine, Colôrant
de Wright, Methyl green ou Thionin.
Les cellules ainsi colorées sont observées â l'aide du dispositif et procédé
d'analyse
selon l'invention, et plus particulièrement avec le matériel donné en exemple.
Avec ce procédé simple, robuste, versatile et d'un bon rapport signal bruit
nous pouvons
analyser de manière sensible et quantitative les conséquences des différentes
conditions de .
culture sur la densité cellulaire et donc sur la croissance cellulaire. A ces
résultats quantitatifs,
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
ls
nous associerons une image digitalisée de cellules ainsi obtenues qui
constituera un document
d'archives et de référence. Cette manière de procéder nous permettra de
paramétrer nos
approches expérimentales et donc d'en augmenter la traçâbilité, gage de
qualité.
Dans cette expérience les cellules utilisées sont des cellules musculaires
humaines.
Dans un premier temps, les cellules sont amplifiées en culture en présence de
sérum
humain (laboratoire PAA) puis ensemencées dans les différentes conditions
décrites. Des
facteurs de croissance peuvent être ajoutés au milieu de culture afin de
promouvoir la
croissance cellulaire. Les cellules sont ensemencées sur des multiples de 12.
Le substrat
utilisé est la gélatine et la densité d'ensemencement est 5000 cellules par
puits.
Conditions de l'expérimentation
- type de boîte : 2 multipuits de 12 (TPP)
- substrat : Gélatine
- densité : 5 000 cellules/puits
Changement de milieu : 24/05/02 27/05/02 29105/02 31/05/02
Temps de culture : 7 jours
Coloration Giemsa
Après aspiration du milieu de culture, les cellules sont lavées avec du PBS
puis fixées
avec de l'ëthanol â 100%. 10 minutes plus tard les cellules sont lavées â
l'eau puis colorées
avec une solution de Giemsa à 10% pendant 10 minutes. L'étape finale est un
lavage â l'eau.
Prise de vue
3o Les images sont obtenues avec le dispositif selon l'invention, plus
particulièrement avec
le matériel donné en exemple.
Les résultats de cette étude sont présentés dans la table 1.
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
19
NumroNombreNombreSurfacePrimtre EllipseEllipseAngle Noyaux
de de de mo mo en my~tiemoyennemo par Compacit
uit kotosno enne Y L I ~
P P aux Y y photographie
Y
11 33 4428 407,3281,15 28,6816,9592,22 134,18 5,G
13 24 2516 428,7883,99 29,0317,5487,11 104,83 5,1
15 22 2859 327,3476,66 27,9214,0589,64 129,95 4,2
17 38 4473 413,9682,25 28,617,2394,59 117,71 5,0
21 28 222 650,14115,07 36,5820,8285,44 7,93 5,6
23 21 197 531,5792,14 30,9320,5890,56 9,38 5,7
25 26 2007 327,0174,93 27,5614,1788,63 77,19 4,3
27 24 2644 338,1278,03 28,1314,42100,38110,17 4,3.
Numro
de composants
uit
11 DME/F12+1%Human serum+Ins+ composant
X4
13 DME/F12+1%Human serum+Ins +composant
X3
15 DME/F12+1%Human senun+Ins+ composant
X2
17 DME/F12+1%Human serum+composant
X1
21 DME/F 12+1 %Human serum
23 DME/F12+1%Human serum+Ins
25 DME/F12+1%Human serum+FGF
27 DME/F12+1%Humanserum+Ins+FGF
Table 1 : résultats de la sélection de milieux
Xl, X2, X3 et X4 sont différents additifs basés sur des mélanges de facteurs
de croissance.
II Analyse d'image et tests toxicologiques
Définir le profil toxicologique d'une molécule est une étape indispensable
pour
lo envisager une application thérapeutique. Les systèmes de cellules
fournissent de bons outils
dans cette perspective. o
Les accidents mortels avec les inhibiteurs de la synthèse du cholestérol de la
famille des
statines ont remis le tissu musculaire au premier plan comme cible
toxicologique. La
mauvaise évaluation de ce risque connu par Bayer pour la Cerivistatin au eu
des conséquences
humaines et économiques considérables.
De très nombreuses drogues sont susceptibles d'entraîner des myopathies. Dans
les cas
aigus et graves, on assiste â une l~se importante du tissu musculaire
(rhabdomyolyse) dont le
mécanisme est encore mal connu. Plusieurs hypothèses ont été émises. Certaines
invoquent une
augmentation de la perméabilité membranaire et d'autres des anomalies au
niveau des
mitochondries.
Dans la grande majorité des cas, il s'agit d'accidents survenant dans un
contexte de poly
chimiothérapie suggérant le rôle d'interactions médicamenteuses (macrolides,
immunosuppresseurs, anticancéreux, fibrates, cocaïne, antiprotéases du HIV,
anesthésiques...).
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
Parmi les nombreux acteurs impliqués : les cytochromes P450, les molécules
impliquées dans l'apoptose comme BCL2, les antioxydants, les protéines du
complexe NFKb,
les PPARs ou les interventions chirurgicales.
Ä l'exception des accidents aigus, menaçant le pronostic vital
(rhabdomyolyse), les
5 signes cliniques d'une atteinte musculaire sont frustres, douleurs
musculaires (myalgies),
fatigabilité, crampes et les signes biologiques en dehors des accidents aigus
les CPK sont txës
fréquemment normaux. Dans les cas des statines, des données récentes indiquent
que les
sujets présentant des atteintes musculaires ne montrent ni de corrélations
entre le niveau
plasmatique de cet agent pharmacologique et l'atteinte toxique, ni d'élévation
des CPK. Dans
io ces cas l'histologie révèle dans le tissu musculaire des modifications des
mitochondries
(gonflement) et des accumulations de gouttelettes lipidiques.
La multiplicité des hypothèses, le rôle des interactions médicamenteuses, la
pauvreté
des signes cliniques et des signes biologiques obligent à la création de
nouveaux outils
15 permettant de prévoir et comprendre la toxicité au niveau du tissu
musculaire.
Dans ce cas, les modèles animaux sont lourds et donc difficiles à mettre en
oeuvre. Pour
résoudre ces questions nous avons construit des modèles cellulaires prédictifs
de la toxicité
musculaire.
2o Dans cette expérience, nous avons utilisé des cellules musculaires humaines
normales
pour tester la toxicité des statines commerciales ;
Conditions de l'expérimentation
- type de boîte : 2 multipuits de 96 (TPP)
- densité : 2 500 cellules/puit
- milieu de culture standard contenant des doses croissantes de Lovastatine,
Cerivistatine, Atorvastatine, Pravastatine, Fluvastatine ou Simvastatine à des
concentrations
3o de 0, 0,01, 0,05, 0,1, 0,5 et 1 p,M
Suivi de l'expérimentation
- 11/07 : Changement des milieux
- 13/07 : Coloration. Temps de culture : S jours
Coloration Giemsa
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
21
Après aspiration du milieu de culture, les cellules sont lavées avec du PBS
puis fixées
avec de féthanol à 100%. 10 minutes plus tard les cellules sont lavées à l'eau
puis colorées
avec une solution de Giemsa à 10% pendant 10 minutes. L'étape finale est un
lavage à l'eau.
Prise de vue
Les images sont prises par un dispositif selon l'invention, et plus
particulièrement avec
le matériel donné en exemple.
L'exploitation numérique est présenté sur la figure 9. Cette figure révèle la
toxicité
élevée de la Cérivisatine. Cette molécule de la classe des statines a provoqué
un très grand
1 o nombre d' accident toxique musculaire.
Cette expérimentation montre que l'association de type cellulaire adapté avec
des
systèmes d'analyse automatisée permet de développer des tests de toxicologique
spécifique.
Les expériences étant menées en plaque multipuits de 96 puits permettent le
développement
d'analyse à haut débit.
III Analyse d'image et tests virologiques.
La fonctionnalité des virus est détectée par leur capacité cytopathologique
sur des
2o cellules cibles spécifiques. Une des conséquences de l'infection virale est
la lyse cellulaire.
Cette propriété est utilisée pour un test qui permet de détecter le nombre de
virus fonctionnel.
Brièvement les différentes étapes de ce test sont
- la culture en micro plaque de 6 puits des cellules cibles
- l'infection virale par des croissante de virus dans la gélose. Cette étape
peut
durer plusieurs jours
- la révélation des plages de lyse après fixation et coloration
- le comptage manuel de ces plages de lyse.
Les principales limitations de ce test sont la complexité des différentes
étapes
dépendantes de savoir-faire. Comme pour les tests de toxicologie nous
utilisons la culture en
micro plaque de 96 associé à l'analyse d'image pour dénombrer les cellules et
ainsi quantifier
les résultats. Brièvement les différentes étapes de ce test sont
- la culture des cellules cible en micro plaque de 96 puits
- l'infection virale directe (sans gélose) par des quantité croissante de
virus
- la fixation (alcoolique) et la coloration au Giemsa (ou alternativement les
Carmin d'Orth, Cresyl violet, Safrinine Q, Vert de malachite, Violet crystal,
Hematoxyline,
Eosine, Giemsa, Colorant de Wright, Methyl green ou Thionin).
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
22
- l'analyse des cultures avec le dispositif et procédé d'analyse selon
l'invention, et
plus particulièrement avec le matériel donné en exemple.
Les avantages de ce test sont la simplification des étapes biologiques,
l'automatisation
de la lecture des résultats. De cette manière il est possible de construire
des automates dédiés
à la lecture de ce type de test.
IV Analyse d'image pour la détermination de l'accumulation cellulaire de
lipides
1o Le métabolisme des lipides est une source d'énergie vitale et ce
particulièrement pour le
tissu musculaire ou les mesures d'oxydations qui sont basées sur 1a production
de CO~
peuvent se pratiquer directement sur du tissu musculaire ou sur les cellules
musculaires
isolées et cultivées.
Les déficits oxydatifs des acides gras ne sont pas limités aux pathologies
monogéniques.
Ces anomalies sont aussi observées dans des maladies de surcharge comme
l'obésité. La
réduction des capacités d'oxydation des acides gras, par les tissus
périphériques comme le
muscle, est associée â certaines formes de surcharge pondérale.
Dans ces conditions de dëséquïlibre de la balance énergétique, les .acides
gras non
métabolisés en excès sont alors stockés par les adipocytes et par d'autres
types cellulaires.
Non oxydés, les acides gras servent aussi de substrats pour la formation de
molécules comme
les céramides impliquées dans l'apoptose. Cette lipoapoptose a pour cibles les
cellules B-
Langerhans du pancréas et les cellules cardiaques et est l'un des mécanismes
physiopathologiques de l'insuffisance cardiaque et pancréatique observés dans
l'obésité et le
diabète de type 2.
L'utilisation de colorant de cytochimie spécifique des lipides comme l'Huile
Rouge
permet de visualiser au niveau cellulaire l'accumulation intracytoplasmique
des acides gras.
3o Ce procédé permet de rendre ce type. de coloration quantitative.
L'acquisition numérique des images observées au microscope avec le dispositif
selon
l'invention permet ensuite leur analyse pour extraire des données
quantifiables ; de telles
données sont présentées sur la figure 10.
Ce type d'approche combinant des cellules cibles, des colorations
histologiques
spécifiques et des procédés d'analyses automatisables permet de développer des
tests
CA 02544706 2006-05-03
WO 2005/047896 PCT/FR2004/002854
23
cellulaires pour le criblage d'agents pharmacologiques intervenants dans
l'obésité ou les
maladies de surcharge.
En changeant de cellules cibles (cellules adhérentes de la moelle osseuse) et
de
coloration histologique (Von Kossa) ce test cellulaire permet de cribler des
agents
pharmacologiques intervenant dans la formation osseuse (ostéoporose).