Note: Descriptions are shown in the official language in which they were submitted.
DEMANDES OU BREVETS VOLUMINEUX
LA PRÉSENTE PARTIE I)E CETTE DEMANDE OU CE BREVETS
COMPREND PLUS D'UN TOME.
CECI EST LE TOME DE _2
NOTE: Pour les tomes additionels, veillez contacter le Bureau Canadien des
Brevets.
JUMBO APPLICATIONS / PATENTS
THIS SECTION OF THE APPLICATION / PATENT CONTAINS MORE
THAN ONE VOLUME.
THIS IS VOLUME 1 OF 2
NOTE: For additional volumes please contact the Canadian Patent Office.
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
1
Procédé d'amélioration des plantes
La présente invention concerne un procédé pour augmenter la taille des
grains d'amidon produits dans les plantes et/ou pour augmenter la teneur des
plantes en amidon.
L'amidon est le polyoside de stockage énergétique chez les végétaux. Il
constitue le principal apport calorique de l'alimentation animale et humaine
et
est également une source majeure de matière première végétale pour des
utilisations non alimentaires. L'amidon est composé de deux fractions
polysaccharidiques distinctes : l'amylose et l'amylopectine. L'amylose, qui
représente la fraction minoritaire de l'amidon, est constitué de résidus
glucose
unis par des liaisons a-1,4, et présente moins de 1% de ramifications.
L'amylopectine, qui représente la fraction majoritaire de l'amidon, est
constituée de résidus glucose unis par des liaisons a-1,4, et présente environ
5% de ramifications, constituées par des résidus de glucose liés au polymère
principal par une liaison a-1,6. La distribution asymétrique de la
ramification de
l'amylopectine est responsable de la croissance illimitée des molécules
d'amidon et par conséquent des grains d'amidon, et rend également compte de
la plupart des propriétés physico-chimiques de l'amidon.
La biosynthèse de l'amidon dépend d'une voie métabolique dont les
étapes biochimiques principales sont la synthèse d'ADP-glucose suivie par le
transfert de ce précurseur en position a-1,4 sur un glucane par des (ADP-
glucose :1,4-a-D-glucane 4-(x-D-glucosyl)transférases, le polymère formé étant
ramifié par l'action des enzymes dites de ramification ou de branchement :
les 1,4-a-D-glucane 6-a-D-(1,4-a-D-glucano)-transférases.
La dégradation de l'amidon implique plusieurs enzymes, dont l'a-
amylase (endoamylase), la R-amylase (exoamylase), I'amyloglucosidase, et
l'alpha-glucane phosphorylase (amidon phosphorylase).
Le rôle de ces diverses enzymes de dégradation de l'amidon n'est pas
clairement établi. Par exemple, il a été rapporté qu'une expression réduite
d'une phosphorylase dans les feuilles, par répression par antisens, n'avait
pas
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
2
d'influence significative sur l'accumulation d'amidon, chez la pomme de terre
(Sonnewald et al., 1995).
Puisque la répression par antisens de l'activité a-glucane phosphorylase
n'avait pas d'influence significative sur l'accumulation d'amidon dans les
feuilles de pommes de terre transgéniques, les auteurs en ont conclu que la
rupture de l'amidon n'était pas catalysée par les phosphorylases.
Le brevet US 5,998,701 divulgue que la réduction de la teneur en
phosphorylase dans les tubercules de pomme de terre a pour conséquence
une diminution substantielle de l'accumulation des sucres, ce qui peut être
mis
à profit pour allonger les durées de stockage des tubercules.
Le brevet US 6,353,154 propose, quant à lui, de modifier les activités de
l'amidon phosphorylase chez les plantes, en particulier le maïs, dans le but
d'obtenir une synthèse d'amidon qui serait modifié dans sa structure.
Les inventeurs ont maintenant mis en évidence que l'inactivation du
gène codant pour une amidon phosphorylase induit une augmentation
significative de la taille des grains d'amidon produits dans les plantes,
ainsi que
de la quantité d'amidon accumulé.
Sur cette base, la présente invention fournit un procédé pour augmenter
la taille des grains d'amidon d'une plante ou d'une partie de plante, dans
lequel
on inactive le gène d'une amidon phosphorylase dans les cellules de la plante.
Ce procédé est particulièrement avantageux pour augmenter les
rendements lors de l'extraction et de la purification de l'amidon à l'échelle
industrielle. En effet, les grains d'amidon les plus petits sont généralement
perdus au cours des lavages lors des processus d'extraction et de
purification.
Une augmentation de la taille des grains permet d'éviter la perte d'une partie
des grains d'amidon.
La présente invention fournit également un procédé pour augmenter la
teneur en amidon d'une plante ou partie de plante, dans lequel on inactive le
gène d'une amidon phosphorylase dans les cellules de la plante.
Il faut comprendre que l'augmentation de la taille des grains d'amidon et
l'augmentation de la teneur en amidon ne sont pas nécessairement liées, à
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
3
savoir qu'a priori l'augmentation de la teneur en amidon n'implique pas
obligatoirement une augmentation de la taille des grains d'amidon, et vice
versa.
La présente demande montre l'existence d'une interaction entre
l'amidon phosphorylase, l'amidon synthase, et les enzymes de branchement.
La phosphorylase, le cas échéant en interaction avec une glycogénine
(WO 03/014365), amorcerait l'initiation de l'amidon en fournissant l'amorce
appropriée vis à vis des enzymes de branchement et de l'amidon synthase.
Sans pour autant être liés par cette théorie, on peut émettre une
hypothèse pour expliquer l'augmentation de la taille moyenne des grains
d'amidon dans les plantes dans lesquelles l'amidon phosphorylase est
inactivée. Selon cette théorie, du fait de l'inactivation de la phosphorylase,
seule l'amidon synthase (notamment SS 5 chez Arabidopis, SS I chez le maïs)
pourrait interagir avec la glycogénine et initier la synthèse d'amidon.
L'interaction plus faible avec la glycogénine, voire également une expression
plus tardive, résulterait en un retard dans l'initiation de la synthèse de
l'amidon,
et donc du nombre de granules produits (initiés). Comme le nombre de
molécules d'amidon initiées est moins important mais que les substrats
nécessaires à la synthèse de l'amidon sont présents au même niveau, on
obtient des grains plus gros car utilisant la même quantité de substrat pour
un
nombre réduit de granules.
L'invention fournit également un procédé pour l'obtention de plantes ou
parties de plante produisant des grains d'amidon de taille accrue, ledit
procédé
comprenant l'inactivation du gène d'une amidon phosphorylase dans les
cellules de la plante.
L'invention fournit par ailleurs un procédé pour l'obtention de plantes, de
tissus de plante ou parties de plante à teneur élevée en amidon, ledit procédé
comprenant l'inactivation du gène d'une amidon phosphorylase dans les
cellules de la plante.
Le terme "tissu de plante" fait référence à n'importe quel tissu d'une
plante, dans une plante ou dans une culture. Ce terme inclut des plantes
entières, des cellules de plantes, des organes de plantes, des graines de
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
4
plantes, des protopiastes, des cals, des cultures de cellules et toutes autres
cellules de plantes organisées en tant qu'unité fonctionnelle et/ou
structurelle.
L'invention concerne aussi tout tissu de plante susceptible d'être obtenu
par le procédé selon l'invention ainsi que les plantes transgéniques le
comprenant.
De plus, les graines issues des plantes obtenues selon l'un des
procédés mentionnés selon l'invention caractérisées en ce qu'elles ont une
taille accrue, et/ou une teneur en amidon modifiée rentrent dans le cadre de
la
présente invention.
Les amidon phosphorylases , également connues sous le nom de
alpha-glucane phosphorylases , ont été décrites dans, de nombreuses
plantes, par exemple la fève, la pomme de terre (Swissprot P04045), la
betterave, l'épinard, le maïs (WO 98/40503), le petit pois ainsi que le riz
(EMBL
n d'accès D23280 ou Q9AUV8), et le blé (EMBL AAQ73181).
La séquence génomique (locus désigné AtPHO-1) codant pour l'amidon
phosphorylase d'Arabidopsis thaliana est présentée en annexe (SEQ ID N 1).
L'amidon phosphorylase est soumise à un adressage vers le plaste de
la cellule.
L'homme du métier sait comment identifier les phosphorylases à
inactiver par exemple par comparaison de séquences entre SEQ ID N 1 avec
des séquences d'autres espèces en utilisant un programme informatique de
comparaison de séquence tel que Blast (www.ncbi.nim.nih.gov) et le
programme FastDB avec les paramètres par défauts., Ces algorithmes sont
présentés dans Current Methods in Sequencing and synthesis Methods and
Applications, pages 127-149, 1988, Ala. R. Liss, Inc, incorporé dans la
description par référence. Une autre méthode possible repose par exemple sur
l'hybridation sélective dans des conditions de fortes stringence telles que
définies dans Sambrook et al. Molecular Cloning A Laboratory Manual (Cold
Spring Harbor Press, 1989) aux paragraphes 11.1 à 11.61. En particulier il
peut s'agir plus particulièrement de formes alléliques des enzymes citées ci-
dessus. Les phosphorylases à inactiver sont de préférence adressées au
plaste, c'est-à-dire dirigées vers le plaste. L'homme du métier est capable
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
d'identifier sur la séquence le motif correspondant au peptide d'adressage au
plaste. Pour ce faire, il peut utiliser par exemple le logiciel
Génopiante Predotar (Small I. et al., 2004, Proteomics, vol 4.(6) 1581-1590 et
accessible sur le site http://www.genoplante.com).
5 L'expression teneur élevée en amidon signifie que la plante
transgénique obtenue fournit une quantité d'amidon supérieure à une plante de
même espèce, non transformée.
L'inactivation du gène de l'amidon phosphorylase signifie que le
gène est rendu non fonctionnel, c'est-à-dire qu'il ne permet plus ou
pratiquement plus l'expression d'une protéine amidon phosphorylase active, la
protéine n'étant plus ou pratiquement plus exprimée, ou alors sous une forme
mutée non fonctionnelle, incapable d'exercer ses propriétés enzymatiques.
L'inactivation du gène peut être réalisée par tout moyen de l'homme du
métier (voir Torneycroft et al., 2001), en particulier par interruption du
gène, ou
extinction de l'expression génique ( gene silencing ).
Selon un mode de réalisation préféré, on introduit une mutation dans le
gène codant pour l'amidon phosphorylase, qui rend ce gène non fonctionnel, à
savoir qu'il devient incapable d'exprimer l'enzyme, ou que l'enzyme produite
est inactive.
En particulier, la mutation peut consister en une insertion de
nucléotide(s), par exemple entre l'exon 6 et l'intron 6 du gène de l'amidon
phosphorylase.
L'extinction du gène peut ainsi être réalisée par insertion d'ADN-T.
La séquence SEQ ID N 2 montre ainsi le gène de l'amidon
phosphorylase d'Arabidopsis thaliana dans lequel une séquence ADN-T est
insérée.
L'invention se rapporte également à l'utilisation de la séquence
polynucléotidique SEQ ID N 2 pour la fabrication d'une plante avec une taille
des grains d'amidon et/ou la teneur en amidon modifié. La plante obtenue
selon l'invention est choisie parmi la pomme de terre, la fève, la betterave,
l'épinard, le petit pois, le blé, le maïs ou le riz.
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
6
L'ADN-T a été utilisé comme mutagène dès la fin des années 80. Chez
Arabidopsis, qui ne possède pas de transposons endogènes ayant une activité
permettant de faire de la mutagenèse insertionnelle, il a été utilisé
préférentiellement aux transposons. La bactérie du sol Agrobacterium a la
capacité de transférer un morceau de son ADN, l'ADN-T, dans le génome
nucléaire des cellules de plantes. Cette propriété est très utile pour
inactiver
des gènes par mutagenèse d'insertion. Les seuls éléments nécessaires sont
des répétitions de 24 paires de base, les séquences bordures, qui délimitent
la
région à transférer. L'accroissement de l'efficacité des méthodes de
transformation a facilité le développement de la génétique inverse.
L'infiltration sous vide de plantes entières a permis d'augmenter
l'efficacité de transformation (4 à 5 transformants par plante traitée) de
même
que la reproductibilité. Récemment, la méthode a encore été simplifiée avec
l'apparition du floral dip . Les inflorescences sont simplement trempées
dans une suspension d'Agrobacterium en présence d'un surfactant, le Silwet L-
77 et de saccharose. Avec ces différentes méthodes, tous les transformants
obtenus sont hémizygotes pour l'ADN-T, ce qui suggère une transformation
tardive au cours du développement floral. La cible de transformation a été
identifiée comme étant l'ovule en développement. Les mutations létales à
l'état
homozygote sont maintenues dans la population sous forme de plantes
hétérozygotes. On obtient en moyenne une à deux insertions par plante. Les
analyses de ségrégation montrent que 57 % des transformants contiennent 1
locus d'insertion, 25 % 2 locus, 8 l0 3 locus et 2 % plus de 3. Une analyse
moléculaire des mutants étiquetés montrent que ces insertions se font au
hasard, sont stables, maintenues dans la descendance et qu'il y a peu de biais
d'insertions.
L'inactivation du gène de l'amidon phosphorylase endogène peut
également être obtenue par mutagenèse des cellules de plante, par exemple
par irradiation U.V, par un agent mutagène chimique, ou par insertion de
transposons.
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
7
Les éléments transposables ont la capacité de perturber l'expression de
gènes dans lesquels ils sont insérés et de générer des délétions,
réarrangements, et mutations au locus cible.
Les transposons ont été les premiers agents insertionnels mutagènes
utilisés chez le maïs puis chez le pétunia et Anthirrhinum. Contrairement à
l'ADN-T, le transposon peut être excisé du gène disrupté en présence d'une
transposase. La haute fréquence de réversion de la mutation qui en résulte
permet de confirmer qu'elle est induite par le transposon. La remobilisation
des
transposons permet aussi de générer des mosaïques : un mutant homozygote
qui porte une transposase active aura des secteurs somatiques qui ont perdu
le transposon Ds et restauré la fonction du gène. Ceci permet de déterminer le
site d'action d'un gène en combinaison avec son patron d'expression. D'autre
part, pour les transposons de type Ac/Ds, la plupart des événements de
transposition se produisent à des sites génétiquement liés. S'il existe un
élément transposable près d'un gène d'intérêt, il pourra donc être remobilisé
pour se réinsérer dans le gène ou à proximité (Ito et aI, 1999). II est ainsi
possible de faire de la mutagenèse locale dans une région d'intérêt
particulier.
Une technique de mutagenèse par transposons qui peut être
avantageusement utilisée est la mutagenèse par transposon Mutator confirmée
par un criblage en génétique inverse (Bensen et al., 1995 ; Das et al., 1995).
Cette technique met en oruvre les étapes consistant à croiser une lignée
"Mutator" avec des hybrides des plantes d'intérêt puis à cribler les plantes
F1
obtenues par PCR avec une amorce spécifique des transposons et une
amorce spécifique de la séquence nucléotidique codant pour l'amidon
phosphorylase. Les graines F2 obtenues à partir des plantes criblées F1
permettent d'obtenir des plantes dont le phénotype est alors analysé.
Une autre méthode pour inactiver le gène de l'amidon phosphorylase est
l'injection locale d'ARN double brin (RNA interference : RNAi) (Fire, 1999).
Les
ARN double-brin sont clivés en petits ARN sens et antisens de 22 nucléotides
environ qui vont cibler la dégradation des ARNm endogènes homologues
(Zamore et al., 2000). L'expression constitutive d'ARN double brin par un
transgène mettant en jeu des séquences inversées répétées placées sous le
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
8
contrôle du promoteur 35S permet d'obtenir une inactivation efficace dans
l'ensemble de la plante, y compris dans le méristème (Waterhouse et al.,
1998). Cette stratégie est très efficace tout au long du développement des
plantes.
L'inactivation du gène d'une amidon phosphorylase endogène peut être
par ailleurs réalisée selon le procédé comprenant les étapes consistant à:
a) fournir un vecteur d'expression comprenant une séquence
nucléotidique antisens du gène codant pour ladite amidon phosphorylase
endogène;
b) transformer une cellule de plante avec ledit vecteur d'expression ;
c) régénérer la plante à partir de la cellule transformée à l'étape b,
ladite plante transgénique ainsi obtenue présentant des grains d'amidon de
taille accrue, d'une teneur en amidon élevée.
Une autre possibilité pour réduire l'activité de l'amidon phosphorylase
dans les cellules des plantes est d'exprimer des ribozymes qui sont des
molécules d'ARN qui agissent comme des enzymes catalysant spécifiquement
le clivage des transcrits codant pour l'amidon phosphorylase, par des
techniques connues de l'homme du métier (EP 321 021).
Il est également possible d'obtenir une plante présentant une altération
de l'expression d'amidon phosphorylase par le procédé dit "transwitch" décrit
dans W090/12084.
L'inactivation du gène de l'amidon phosphorylase peut également être
obtenue en infectant les plantes par des virus recombinants dans lesquels une
partie de la séquence codante ou du promoteur du gène à inactiver a été
introduite (virus-induced gene silencing ou VIGS) (Ratcliff et al., 2001).
Pour
expliquer ce phénomène, on pense que les molécules virales de polarités
positives et négatives produites au cours du cycle de réplication du virus
sont
reconnus comme des ARN double brin et dégradées en petits ARN sens et
antisens de 22 nucléotides qui vont à leur tour déclencher la dégradation des
ARNm endogènes homologues. Toutefois, seuls les ARNm endogènes sont
totalement dégradés alors que les ARN viraux restent détectables. La présence
de petits ARN de 22 nucléotides dérivés des ARN viraux, suggère que les virus
qui induisent le VIGS sont également capables d'y résister. Les avantages de
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
9
cette méthode sont avant tout sa simplicité et la rapidité de sa mise en
oeuvre.
De plus, il suffit de cloner 23 paires de base d'un gène dans le virus pour
cibler
spécifiquement son inactivation.
La construction des vecteurs d'expression utilisés (portant par exemple
une séquence antisens du gène de l'amidon phosphorylase endogène) ou des
ARNi est à la portée de l'homme du métier suivant les techniques standard.
La transformation de cellules végétales peut être réalisée par transfert
des vecteurs ou des acides nucléiques dans les protopiastes, notamment
après incubation de ces derniers dans une solution de polyéthylèneglycol en
présence de cations divalents (Ca2+).
La transformation des cellules végétales peut également être réalisée
par électroporation notamment selon la méthode décrite dans l'article de
Fromm et al., 1986.
La transformation des cellules végétales peut également être réalisée
par utilisation d'un canon à gène permettant la projection, à très grande
vitesse, de particules métalliques recouvertes des séquences d'ADN d'intérêt,
délivrant ainsi des gènes à l'intérieur du noyau cellulaire, notamment selon
la
technique décrite dans l'article de Sanford, (1988).
Une autre méthode de transformation des cellules végétales, est celle
de la micro-injection cytoplasmique ou nucléaire.
Selon un mode de réalisation particulièrement préféré du procédé de
l'invention, les cellules végétales sont transformées par biolistique, c'est-à-
dire
par projection, au moyen d'un canon à particules, de microparticules
recouvertes des séquences nucléotidiques à transférer (J. Finner, 1992).
Selon un autre mode de réalisation du procédé de l'invention, les
cellules végétales sont transformées par un vecteur selon l'invention, ledit
hôte
cellulaire étant susceptible d'infecter lesdites cellules végétales en
permettant
l'intégration dans le génome de ces dernières, des séquences d'ADN d'intérêt
initialement contenues dans le génome du vecteur susmentionné.
Avantageusement, l'hôte cellulaire susmentionné utilisé est
Agrobacterium tumefaciens, notamment selon la méthode décrite dans l'article
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
d'An et al., 1986, ou encore Agrobacterium rhizogenes, notamment selon la
méthode décrite dans l'article de Jouanin et al., 1987.
De manière préférentielle, la transformation des cellules végétales est
réalisée par le transfert de la région T du plasmide circulaire extra-
5 chromosomique inducteur de tumeurs Ti d'Agrobacterium tumefaciens, en
utilisant un système binaire (Watson et al.).
Pour ce faire, deux vecteurs sont construits. Dans un de ces vecteurs,
la région d'ADN-T a été éliminée par délétion, à l'exception des bords droit
et
gauche, un gène marqueur étant inséré entre eux pour permettre la sélection
10 dans les cellules de plantes. L'autre partenaire du système binaire est un
plasmide Ti auxiliaire, plasmide modifié qui n'a plus d'ADN-T mais contient
toujours les gènes de virulence vir, nécessaires à la transformation de la
cellule
végétale. Ce plasmide est maintenu dans Agrobacterium.
Parmi les terminateurs de transcription pouvant être utilisés, on peut
citer le terminateur polyA 35S du virus de la mosaïque du chou-fleur (CaMV),
décrit dans l'article de Franck et al., (1980), ou le terminateur polyA NOS,
qui
correspond à la région en 3' non codante du gène de la nopaline synthase du
plasmide Ti d'Agrobacterium tumefaciens souche à nopaline (Depicker et al.,
1982).
Parmi les promoteurs de transcription pouvant être utilisés, on peut citer
notamment :
- le promoteur 35S, ou avantageusement le promoteur constitutif double
35S (pd35S) du CaMV, décrits dans l'article de Kay et al., 1987 ;
- le promoteur PCRU du gène de la cruciférine de radis permettant
l'expression des séquences associées uniquement dans les semences (ou
graines) de la plante transgénique obtenue ;
- les promoteurs PGEA1 et PGEA6 correspondant à la région 5' non
codante des gènes de la protéine de réserve de graines, GEAI et GEA6,
respectivement, d'Arabidopsis thaliana (Gaubier et al., 1993) et permettant
une
expression spécifique dans les graines ;
- le promoteur chimérique super-promoteur PSP (Ni M et al., 1995),
constitué de la fusion d'une triple répétition d'un élément activateur
transcriptionnel du promoteur du gène de l'octopine synthase d'Agrobacterium
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
11
tumefaciens, d'un élément activateur transcriptionnel du promoteur du gène de
mannopine synthase et du promoteur mannopine synthase d'Agrobacterium
tumefaciens ;
- le promoteur actine du riz suivi de l'intron actine de riz (PAR-IAR)
contenu dans le plasmide pActl-F4 décrit par Mc Elroy et ai., 1991 ;
- le promoteur HMGW (High Molecular Weight Glutenine) d'orge ;
- le promoteur du gène de yzéine de maïs (Pyzéine) contenu dans le
plasmide py63, et permettant l'expression dans l'albumen des semences de
maïs.
Parmi les cellules végétales susceptibles d'être transformées
conformément à la présente invention, on peut citer celles de la pomme de
terre, la fève, la betterave, l'épinard, le petit pois, le blé, le maïs ou le
riz.
La présente invention permet aussi d'obtenir une plante ou partie de
plante telle que notamment la pomme de terre, le blé, le maïs ou le riz,
produisant des grains d'amidons de taille accrue, ou une teneur élevée en
amidon.
Par partie de plante , on entend notamment les organes de réserve
naturellement riches en amidon, tels que les graines ou les tubercules. Par
partie de plante , on entend également les cellules de ladite plante.
L'extraction de l'amidon produit peut être réalisée selon les techniques
standard connues de l'homme du métier. La solubilisation de l'amidon est
également connue de l'homme du métier et peut être réalisée par trempage et
fractionnement du grain d'amidon, ou par exemple par chauffage. De manière
alternative, on peut utiliser des enzymes déstructurent l'amidon, telles que
les
amylases.
L'amidon produit peut également être utilisé dans de nombreuses
industries : industrie du papier et du carton, industrie des adhésifs,
industrie
textile, industrie pharmaceutique (pour la formulation des médicaments), etc.
L'amidon produit peut également subir d'autres modifications, en
particulier des modifications chimiques telles qu'un traitement acide, une
oxydation, une estérification, etc avant son utilisation.
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
12
Cet amidon peut être utilisé pour la préparation de produits dérivés,
notamment de produits alimentaires.
Les figures et exemples suivants illustrent l'invention sans en limiter la
portée.
LEGENDE DES FIGURES :
La fi ug re 1 est un schéma représentant le génome d'Arabidopsis
thaliana.
La figure 2 est un graphe montrant les niveaux relatifs d'accumulation
d'amidon dans la lignée mutante par rapport à la lignée sauvage de référence
(WS).
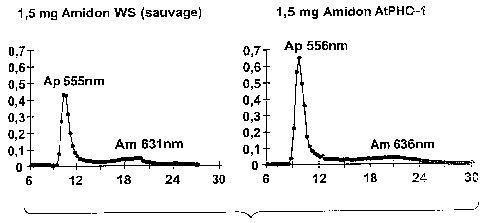
La figure 3 est une comparaison de profils d'analyse spectro-
photométrique d'amidon des lignées sauvage et mutante après
chromatographie d'exclusion stérique sur matrice de sépharose CL-2B.
La figure 4 est une comparaison de photographies de vues au
microscope électronique à transmission, de grains d'amidon (agrandissement
x3000).
EXEMPLES:
1. Description de la lignée mutante:
Les inventeurs ont étudié les phénotypes d'une lignée mutante
d'Arabidopsis thaliana, produit par interruption d'un gène de l'amidon
phosphorylase (Iocus désigné AtPHO-1).
Cette lignée (DDS72) est l'une des 50 000 lignées mutantes produites
par insertion aléatoire d'ADN-T, comme décrit par Balzuergue et al., 2001.
La lignée mutante DDS72 d'Arabidopsis thaliana étudiée présente une
insertion d'ADN-T à la jonction de l'exon 6 et de I'intron 6 (cf figure 1 et
SEQ ID
N 2).
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
13
2. Analyse enzymologique de la lignée mutante :
Afin de déterminer l'impact de l'insertion de l'ADN-T au locus AtPHO-1
sur l'activité des amidon-phosphorylases, les inventeurs ont effectué des
zymogrammes à partir d'extraits cellulaires de diverses lignées mutantes et
sauvages (WS). Les zymogrammes ont été réalisés dans deux conditions
différentes.
- Extraction des protéines des feuilles
Les feuilles sont broyées à 4 C à l'aide du Polytron Biender dans le
tampon suivant : 50 mM NaHZPO400,5 M NaCi. Le broyat est centrifugé 5
minutes à 13000 rpm à 4 C et on récupère le surnageant contenant les
protéines solubles.
- Electrophorèse en gel de polyacrylamide
Les gels sont réalisés avec les chambres d'électrophorèse MiniProtean
Il commercialisés par BioRAD (Richmond, CA, USA). Les gels ont une
épaisseur de 1,5 mm. La concentration finale en monomère est de 7,5% (p/v)
pour le gel de séparation, il contient également 0,45% de glycogène de foie de
lapin ou 0,2% d'amidon de pomme de terre. Il est tamponné par le Tris/HCI
llOmM pH 7,2. Le gel de concentration à 2,5% final en monomère est
tamponné par le Tris/H3P04 60mM pH 7,3. Le tampon de migration utilisé pour
l'électrophorèse est le Glycine/Tris 40mM pH 8,5.
A 100 pg d'extrait protéique, sont ajoutés 10 pI de Tris/H3P04 60mM pH
7,3 et 20 pl de tampon de chargement : saccharose 25% (p/v), bleu de
bromophénol 0,001 %.
La migration se déroule à 4 C durant 2h30 à 15mA et 250V. A l'issue de
celle-ci, le gel est équilibré dans le Citrate/NaOH 100mM pH 7,0 pendant 10
minutes avant d'être incubé toute la nuit à température ambiante dans le
citrate/NaOH 100mM pH 7,0, Glucose-1 -phosphate 50 mM.
A cette concentration, les phosphorylase fonctionnent dans le sens de la
synthèse des polysaccharides en ajoutant un résidu de glucose en extrémité
non-réductrice des glycanes disponibles par l'intermédiaire d'une liaison a-
1,4.
L'activité est ensuite révélée par coloration du gel à l'iode.
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
14
C'est la forme de migration rapide (sur glycogène ou amidon) qui
disparaît totalement dans le mutant au locus AtPHO-1.
3. Impact de la mutation sur le polysaccharide de réserve :
- Extraction d'amidon des feuilles d'Arabidopsis thaliana
Les feuilles d'A. thaliana sont prélevées en fin de photopériode puis
rincées deux fois dans un grand volume d'eau désionisée (afin de retirer les
débris non désirés). Dans la glace, on broie le matériel dans 15-25 mi de
tampon d'extraction (MOPS 100 mM pH 7.2, EDTA 5 mM, Ethylène glycol
10%) à l'aide du Polytron Blender (broyeur de tissus) jusqu'à obtenir un
extrait
bien homogène sans aucun tissu intact. On passe l'extrait 4 x 15 secondes au
sonicateur continu et entre chaque sonication, on plonge le tube dans la
glace. Centrifuger 15 minutes à 3200 g à 4 C. Le culot est repris dans 20 ml
de Percoll (Amersham Biosciences) à 90% et centrifugé 40 minutes à 10000 g
dans un 'tube en verre de type Corex. On retire les débris en surface et le
surnageant. Le culot d'amidon est rincé cinq fois par de l'eau désionisée
avant
son analyse.
- Dosage de l'amidon
L'amidon est dosé à l'aide du kit Enzytec commercialisé par Diffchamb
(Lyon, France). Les glucanes sont digérés par une amyloglucosidase qui
hydrolyse les liaisons 0-glycosidiques a-1,4 et a-1,6. Les molécules de
glucose ainsi libérées sont ensuite phosphorylées en position 6 par une
hexokinase. Le glucose-6-phosphate produit est ensuite oxydé en gluconate-6-
P par une G6P déshydrogénase en réduisant le NADP en NADPH. Cette
dernière réaction est suivie au spectrophotomètre à 365 nm.
La quantité d'amidon dosée est présente au tableau 1
Tableau 1 :
Lignée Quantité d'amidon (en mg/g de feuilles)
WS (lignée sauvage) 1,16
AtPHO-1 (lignée DDS72) 2,78
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
La figure 2 présente les niveaux relatifs d'accumulation d'amidon dans
les différentes lignées par rapport à la lignée sauvage de référence (WS).
. La structure de l'amidon est ensuite analysée par chromatographie
d'exclusion stérique sur matrice de sépharose CL-2B.
5 - Fractionnement de l'amidon
Le fractionnement est réalisé par chromatographie d'exclusion stérique
sur matrice de sépharose CL-2B (Amersham-Biosciences, Suède).
La colonne possède un diamètre interne de 0,5 cm et une hauteur de 65
cm. Equilibrée dans la soude 10 mM, son débit est de 12 ml/heure. La
10 préparation de l'échantillon d'amidon est effectuée comme suit : on dissout
1,5mg d'amidon natif dans 200 pI de DMSO 100% à 100 C pendant 10
minutes. Le polysaccharide est ensuite précipité par 4 volumes d'éthanol pur à
-20 C pendant 30 min. Après centrifugation à 5000 g pendant 5 minutes, le
culot d'amidon est dissous dans 500 pI de soude 10 mM puis déposé sur la
15 colonne. Les fractions de 300 pI sont analysées par spectrophotométrie à
l'iode.
- Détermination de la Ama du complexe iode-polysaccharide :
La longueur du maximum d'absorbance du complexe formé par l'iode
avec les polysaccharides est déterminée par spectrophotométrie. 100 pg
d'amidon sont dissous dans le DiMéthylSulfOxyde (DMSO) 100% durant 10
minutes à 100 C. Cette solution est ensuite ramenée à 10% en DMSO. A 400
pI de cette solution, sont rajoutés 100 pI d'une solution d'iode 0,02% 12 et
0,2%
KI. Le spectre d'absorption est réalisé entre 400 et 700 nm.
On peut également déterminer les quantités de polysaccharides
présentes dans chaque fraction à l'aide du kit de dosage Enzytec.
Il ne semble pas y avoir de modification particuiière de la structure de
l'amidon de la lignée mutante AtPHO-1 si on fait la comparaison entre les deux
profils présentés à la figure 3.
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
16
4. Analyse de la structure de l'amidon accumulé par la lignée
AtPHO-1 par microscopie électronique :
- Préparation des échantillons pour la microscopie électronique à
transmission
Les échantillons sont inclus dans I'agar à 3% dans l'eau. Ils sont ensuite
traités au PATAg : acide périodique-thiosemicarbazide-argent avec un temps
d'incubation de 20 minutes dans l'acide périodique. On réalise ensuite une
inclusion dans une résine hydrophile (nanopiast) pendant 10 jours avant de
consolider la préparation par une inclusion dans une résine LR-White Hard
grade. Les coupes sont effectuées à l'ultramicrotome (microme MT-7000) avec
une épaisseur de 60 à 100 nm. Les observations sont effectuées au MET (Jeol
100S) à 80keV fi ure 4).
Les images obtenues ont été analysées en repérant les paramètres
suivants :
- surface totale,
- diamètre équivalent,
- rapport des différentes longueurs..
Les valeurs sont traitées grain par grain.
S'agissant de la lignée sauvage, les tailles sont très variées : on note la
présence importante d'assez gros grains mais aussi de quelques très petits.
Sur 556 grains analysés, le diamètre équivalent moyen est de 1.27 pm. Les
grains de forme allongée semblent majoritaires.
S'agissant de la lignée mutante, les grains sont de grosse taille et de
formes plus arrondies (convexes) avec une présence de grains anguleux. 256
grains ont été analysés.
L'analyse statistique montre que les grains d'amidon de la lignée
mutante au locus AtPHO-1 sont en moyenne plus gros que ceux de la lignée
sauvage.
Ainsi, deux modifications majeures sont observées en ce qui concerne
l'amidon dans la lignée mutante au locus AtPHO-1 chez A. thaliana :
1) une augmentation de la taille moyenne des grains d'amidon dans la
lignée mutante,
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
17
2) une augmentation significative de la quantité d'amidon accumulée
dans les feuilles.
5. Interaction entre l'amidon phosphorylase, l'amidon synthase,
et les enzymes de branchement :
La phosphorylase est l'une des premières enzymes impliquées dans la
biosynthèse de l'amidon ; qui apparaît dans les amyloplastes de I'endosperme
du maïs. L'enzyme continue à présente tout au long du processus de
biosynthèse de l'amidon et est la seconde enzyme la plus abondante dans ce
processus (après l'enzyme llb de branchement). Des études de zymogrammes
sur gels natifs ont permis d'identifier une zone où trois activités
différentes sont
présentes (amidon synthase soluble SSS ou SS ; enzymes de branchement
SBE, et phosphorylase), suggérant l'existence d'un complexe incluant les
enzymes responsables de ces activités. De plus le fractionnement enzymatique
~ couplé à des zymogrammes a montré une interaction entre l'amidon
phosphorylase et les enzymes de branchement.
Ces zymogrammes ont fait appel aux conditions suivantes :
Le principe des zymogrammes est de soumettre les enzymes à une
séparation par électrophorèse, les gels d'électrophorèse étant ensuite trempés
dans une solution déclenchant la réaction enzymatique là où l'enzyme a migré.
Pour révéler l'amidon phosphorylase, la solution mise en contact avec
le gel contient du glucose 1-phosphate, substrat de l'enzyme. La réaction
enzymatique produit la génération et l'élongation de glucane linéaire. Les
bandes bleues apparaissent là où l'enzyme a migré.
Pour révéler l'amidon synthase, la solution mise en contact avec le gel
contient de l'amylopectine et de l'ADP-glucose, substrats de l'enzyme. La
réaction enzymatique produit l'élongation des chaînes d'amylopectine avec
l'ADP-glucose. Les bandes bleues apparaissent là où l'enzyme a migré.
Pour révéler les enzymes de branchement (SBE), la solution mise en
contact avec le gel contient du glucose 1-phosphate, substrat de l'enzyme, et
une phosphorylase b exogène (de lapin). La réaction enzymatique produit la
génération et l'élongation de glucanes linéaires avec le glucose 1-phosphate,
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
18
glucanes qui sont branchés par les SBE. Des bandes brunes apparaissent là
où l'enzyme a migré.
D'autres études chez des mutants du maïs et des maïs doubles
transgéniques (a/aSBE2b et a/s SSI) ont montré que le domaine des activités
enzymatiques multiples observé sur les gels natifs était composé d'au moins la
SSI, SBE2b et la phosphorylase. Sans être liés par cette théorie, il est
probable
au vu de l'interaction de la phosphorylase avec les enzymes directement
impliquées dans la biosynthèse d'amidon, que l'amidon phosphorylase est
impliquée également dans la biosynthèse de l'amidon.
En raison de l'existence de ce complexe et parce que la
phosphorylase apparaît de manière précoce par rapport à I'AGPase ou la SSI
dans l'endosperme de maïs, on peut émettre l'hypothèse que l'amidon
phosphorylase, en utilisant la glucose 1-phosphate, génère une chaîne
naissante de polymère de glucose qui agirait comme amorce pour les activités
des enzymes SBE2b et SSI dans I'amyloplaste du maïs.
6. Vérification de la compartimentation subcellulaire de PHOI Il existe, outre
PHOI, une deuxième phosphorylase chez Arabidopsis
thaliana : PHO2.
D'après les prédictions bioinformatiques, la localisation subcellulaire
de PHO2 serait restreinte au cytosol de la cellule, tandis que PHO1 serait
dirigée vers le chloroplaste. Pour confirmer la localisation subcellulaire de
PHO1, les inventeurs ont procédé à une purification des chloroplastes, suivie
d'un zymogramme des activités phosphorolytiques, c'est-à-dire en suivant
l'activité d'une forme cytosolique de P-amylase (Zeeman et al., 1998)
correspondant au gène At4g15210 (gène ram-1 décrit dans Laby et al., 2001).
a) purification des chloroplastes :
La purification des chloroplastes a été réalisée en suivant un protocole
standard :
Des plantes âgées de trois à quatre semaines ont été laissées dans le
noir complet à 4 C pendant 48 heures. Les feuilles (10 g) ont été recueillies
à
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
19
4 C et homogénéisées dans 200 ml de sorbitol 330 mM, MES 25 mM, pH 6,5,
MgCi2 5 mM, isoascorbate 2 mM. (tampon de purification). L'homogénat a été
filtré à travers trois couches de Miracloth et centrifugé 3 minutes à 2500 g à
4 C. Le supernageant correspond à la fraction enrichie en cytosol (CytoEF). Le
culot (contenant les chloroplastes) a été resuspendu dans 500 l du même
tampon et chargé sur un gradient discontinu de Percoll : 2 ml de Percoll 65%
(fond du tube), 2 ml de Percoll 45%, 2 ml de Percoll 20% (haut du tube).
L'échantillon a été centrifugé pendant 30 minutes à 4200 g et 4 C. Le culot
formé à l'interface entre les couches de Percoll à 45% et 65% a été recueilli
et
dilué dans deux volumes du tampon de purification puis centrifugé à 1800 g à
4 C pendant 2 minutes. Le culot a ensuite été lavé deux fois dans le même
tampon et resuspendu dans 200 l du tampon de purification.
b) Zymogramme :
Le gel de polyacrylamide (7,5%) contient du glycogène de foie de lapin
(0,6%). Les puits ont été chargés avec 100 pg de protéines et l'extrait a été
soumis à une migration à 4 C en conditions natives à raison de 15 mA/gel
pendant 2 heures. Le gel a ensuite été incubé pendant une nuit à température
ambiante dans un milieu tamponné (Citrate de sodium 100 mM pH 7,0 +
Glucose 1-phosphate 20 mM). Le gel a enfin été immergé dans une solution
d'iode qui permet de révéler les zones où des activités enzymatiques ont
modifié la structure de l'amidon (les zones non soumises à l'action d'enzymes
de modification se colorent en orange).
Les résultats confirment que PHO1 est localisée dans le stroma du
chloroplaste tandis que PHO2 est une protéine exclusivement cytosolique.
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
BIBLIOGRAPHIE
- An G. (1986), Plant Physiol. 81 : 86-91
5 - Balzergue et al. (2001) Bio Techniques, Vol 30, 496-504
- Bensen et aI. (1995), The Plant Cell, Vol. 7, 75-84
- Das et al. (March 1995), The Plant Cell, Vol. 7, 287-294
- Depicker et al. (1982) J. Mol. Appl. Genet., 1, 561-573
- Finner J. et al. (1992), Plant Cell Reports, 11, 323-328
- Fire et al. (1998) Nature 391, 806-811
- Franck et al. (1980) Cell. 21,285-294
- Fromm et al. (1986) Nature, vol. 319, 791-793 -
- Gaubier et al. (1993) Mol. Gen., 238, 409-418
- Ito et al. (1999) Plant J., Vol 17, 433-44.
- Jouanin (1987) Plant. Sci., 53, 53-63
- Kay (1987) Science, 236, 1299-1302
- Laby et al., (2001) Plant Physiol., 127(4) :1798-807
- Mc Elroy (1991) Mol. Gen. Genet. 231 : 150-160
- Ni et ai. (1995) Plant J., 7, 661-676
CA 02560655 2006-09-21
WO 2005/097999 PCT/FR2005/000753
21
- Ratcliff et al. (2001) Plant J. 25, 237-245
- Ruiz et al. (1998) Plant Celi 10, 937-946
- Sanford J.C., (1988) Trends in Biotechnology, 6, 299-302
- Sonnewald et al., (1995) Plant. Mol. Biol. 27, 567-576
- Thorneycroft et al., (2001) Journal of Experimental Botany, 52, 361 :1593-
1601
- Waterhouse et al. (1998) Proc. Natl. Acad. Sci. U.S.A. 95, 13959-13964
- Watson et al. ADN recombinant, Ed. De Boeck Université, p 273-292
- Zamore et al., (2000) Ceil 101, 25-33 Ecole thématique Biologie végétale -
2001
- Zeeman et al., (1998) Plant. Cell., 10(10) :1699-712
DEMANDES OU BREVETS VOLUMINEUX
LA PRÉSENTE PARTIE DE CETTE DEMANDE OU CE BREVETS
COMPREND PLUS D'UN TOME.
CECI EST LE TOME 1 DE 2
NOTE: Pour les tomes additionels, veillez contacter le Bureau Canadien des
Brevets.
JUMBO APPLICATIONS / PATENTS
THIS SECTION OF THE APPLICATION / PATENT CONTAINS MORE
THAN ONE VOLUME.
THIS IS VOLUME 1 OF 2
NOTE: For additional volumes please contact the Canadian Patent Office.