Note: Descriptions are shown in the official language in which they were submitted.
CA 02565120 2006-10-23
1
MÉTHODE POUR CONSTRUIRE UN MODELE CINÉTIQUE PERMETTANT
D'ESTIMER LA NIASSE D'HYDROGENE SULFURÉ PRODUITE PAR
AQUATHERNIOLYSE
La présente invention concerne une méthode pour construire un modèle cinétique
permettant d'estimer la masse d'hydrogène sulfuré produite par aquathennolyse
au sein
d'une roche contenant de l'huile brute.
L'aquathennolyse est définie comme un ensemble de réactions physico-chimiques
entre une huile brute et de la vapeur d'eau, à des températures entre 200 C et
300 C. Une
définition est donnée dans le document suivant :
Hyne J.B. ci al., 1984, "Aquathennolysis of heavy oils", 2nd Int. Conf., The
Future of Heavy Crude and Tar Sands, McGraw Hill, New York, Chapter 45,
p. 404-411.
En particulier, la présente invention concerne une méthode pour prédire les
masses
d'hydrogène sulfuré (EUS) qui peuvent être générées pendant l'injection de
vapeur d'eau,
dans des gisements pétroliers, pour la récupération des pétroles bruts.
Dans ce cadre de récupération assisté d'huiles brutes, la méthode permet alors
de
vérifier si les émissions d'HiS restent sous la teneur maximale légale (selon
les pays autour
de 10 à 20vol.ppm), et d'en déduire les conditions d'injection de vapeur ou de
dimensionner les procédés de réinjection d'H2S et les unités de traitement des
gaz acides en
tête de puits, ou bien encore, de choisir des matériaux de production
suffisamment
résistants.
CA 02565120 2006-10-23
2
Présentation de l'art antérieur
Les documents suivants, que l'on va citer dans le cours de la description ci-
après,
illustrent l'état de la technique :
- Attar A., Villoria A.;Verona D., Parisi S., 1984, "Sulfur funetional groups
in
heavy oils and their transformations in stearn injected enhanced ou l
recovery.", Symposium
on the chemistry of enhanced ou l recovery, American Chemical Society, y 29, n
4, p 1212-
1222
- Belgrave J.D.M., Moore R.G., Ursenbach R.G, 1997, "Comprehensive kinetic
models for the aquathermolysis of heavy oils", Journal of Canadian Petroleum
Technology,
v 36, n 4, p 38-44.
- Chakma A., 2000, "Kinetics and Mechanisms of Asphltenes cracking during
petroleum recovery and processing operations", Asphaltenes and asphalts. 2.
Developments in Petroleum Science, 40B, Elsevier, pp.129-148.
- Gillis K.A., Palmgren Claes, thimm H.F., 2000, "Simulation of Gas Production
in
SAGD", SPE/Petroleum Society of CIM, 65500.
- Hayashitami M. et al., 1978, "Thermal cracking models for Athabasca oit
sands
oils", SPE 7549,SPE annual technical conference and exhibition, Hourin, pp1-4.
- Koseoglu and Phillips, 1987; "Kinetics of non-catalytic hydrocracking of
Athabasca bitumen", Fuel, n 66, 741.
- Thimm H.F., 2000, "A general theory of gas production in SAGD operations",
Canadian International Petroleum Conference Proceedings, 2000-17.
L'hydrogène sulfuré (H,S) est un gaz à la fois extrêmement corrosif et très
toxique,
voire létal au delà d'une certaine concentration. Or, ce gaz peut être généré
dans divers
types de conditions naturelles : Thermo Réduction des Sulfates (TSR),
Réduction
Bactérienne des Sulfates (BSR), craquage des composés organo-soufrés, etc. Il
peut être
aussi généré dans des conditions créées par l'homme, comme l'injection de
vapeur dans les
réservoirs de bruts lourds, ces derniers contenant des teneurs en soufre
souvent élevées
(Thimm, 2000 ; Gillis et al., 2000). Aussi, prévoir la concentration en 1-I2S
du gaz produit
CA 02565120 2006-10-23
3
lors de la récupération assistée par injection de vapeur aide, d'une part, à
réduire les coûts
de production en adaptant les procédés de récupération et de traitement, et
d'autre part, à
éviter des émissions dangereuses pour l'homme et l'environnement.
Un problème technique est la prédiction de la quantité d'1-12S générée selon
la qualité
du brut, les conditions de réservoir et les conditions d'injection de vapeur.
Si l'on veut
prédire le risque de production d'H,S grâce à un modèle de réservoir (utilisé
par les
simulateurs d'écoulements), un modèle cinétique de genèse de l'H,S est
obligatoire. Des
modèles de ce type ont déjà été proposés dans la littérature.
On connaît par Attar et al. (1984), un modèle cinétique de genèse de l'US qui
décrit
la transformation cinétique de groupes soufrés pour la genèse d'H,S en
condition
d'injection de vapeur. Ce modèle, bien que prédictif, nécessite en contre
partie la
détermination complexe de la valeur de ses nombreux paramètres.
On connaît également par Belgrave et al. (1997) un modèle cinétique de
formation
d'HiS dans les conditions d'injection de vapeur. D'une part, ce modèle décrit
l'évolution
des fractions de l'huile (et non l'évolution du soufre dans ces fractions). Ce
modèle n'est
d'ailleurs pas dédié à la genèse de l'H,S uniquement. D'autre part, ce modèle
est construit à
partir de résultats de pyrolyses de bruts lourds sans eau. Or comme le
soulignent Belgrave
et al., l'eau a un effet non négligeable sur les produits de pyrolyse. De
plus, Kiiseoglu et
Phillips (1987) (dans Chal(ma, 2000) ont opéré des expériences de pyrolyse
avec de l'eau et
en ont déduit que la présence d'eau influait sur les valeurs des paramètres
cinétiques. Enfin,
dans ce modèle, les gaz non hydrocarbures, et en particulier l'HiS, sont
supposés provenir
des asphaltènes uniquement.
Outre les modèles cinétiques, on connaît des modèles de réservoirs permettant
de
calculer l'H,S produit lors de l'injection de vapeur dans un réservoir :
Thimm (2000) a proposé un modèle de réservoir calculant très simplement la
production d'H,S dans les conditions d'injection de vapeur. Ce modèle ne
calcule pas la
quantité d'H,S dans le réservoir, mais la présuppose à partir de mesures de
production
d'H,S dans certains champs. Son modèle est par conséquent non prédictif et non
généralisable.
Gillis et al. (2000) ont publié leurs premiers résultats de simulation de
production
d'HiS, en conditions de récupération par SAGD (Stcam Assisted Gravity
Drainage:
méthode d'injection de vapeur), avec le modèle de réservoir STARS (CMG,
Canada). Pour
CA 02565120 2013-06-12
4
cela, ils tiennent compte du comportement thermodynamique de l'H2S, et les
quantités
d'H,S présentes dans le réservoir sont présupposées selon la théorie de Thimm,
cité plus
haut. 11 n'y a donc pas de modèle de genèse de l'H2S et leur modélisation
n'est ni
généralisable ni prédictive.
Connexes à la méthode selon l'invention, il existe également des méthodes de
détermination des paramètres de modèles cinétiques, à partir d'expériences de
pyrolyse sur
des bitumes.
Hayashitani et al. (1978) proposent un modèle de craquage thermique des
bitumes de
l'Athabasca. Ce modèle décrit la production de gaz à partir des asphaltènes
mais ne détaille
pas les composants gazeux (112S en particulier). De plus il ne tient pas
compte de l'effet de
l'eau sur les réactions et est basé sur des expériences de craquage à trop
hautes
températures (360 C-422 C) pour représenter les températures d'aquathennolyse
(2000-
300 ).
1(.6seoglu et Phillips (1987) (in Chakma, 2000) ont pris en compte l'effet de
l'eau sur
le craquage de bitumes de l'Athabasca et ont proposé un modèle cinétique où
les gaz sont
générés à partir des maltènes (saturés + aromatiques + résines) et non des
asphaltènes.
Cependant, ils ne précisent rien sur l'H2S. Ces méthodes ne permettent donc
pas d'estimer
précisément la quantité d'H,S formée car elles ne distinguent pas l'H2S des
autres
composants gazeux.
La méthode selon l'invention permet de construire un modèle cinétique pour
estimer
la masse d'hydrogène sulfuré produite par aquathennolyse d'une roche contenant
de
l'huile brute, en décrivant l'évolution de la répartition du soufre dans les
fractions de
l'huile et la fraction des insolubles.
CA 02565120 2013-06-12
La méthode selon l'invention
L'invention concerne une méthode pour estimer la masse d'hydrogène
sulfuré produite par un gisement pétrolier au cours d'une récupération d'huile
brute
par injection de vapeur d'eau dans ledit gisement par construction d'un modèle
cinétique permettant d'estimer la masse d'hydrogène sulfuré produite par une
roche
contenant l'huile brute et soumise à un contact avec de la vapeur d'eau à une
température T pendant un temps de contact t, donnant lieu à une réaction
d'aquathermolyse, caractérisée en ce que la méthode comporte les étapes
suivantes :
a) on décrit la roche, l'huile brute et l'hydrogène sulfuré produit selon une
caractérisation par fractions de composés chimiques comportant au moins les
fractions suivantes :
- les fractions des NSO, des aromatiques et des résines pour décrire
l'huile ;
- la fraction des insolubles contenant des composés insolubles dans
le dichlorométhane et le n-pentane, pour décrire la roche ;
- la fraction de l'hydrogène sulfuré pour décrire l'hydrogène sulfuré ;
b) on définit un modèle cinétique décrivant, à partir de paramètres
cinétiques, la masse d'hydrogène sulfuré produite en fonction dudit temps de
contact t, en fonction de ladite température T, et en fonction de l'évolution
de la
distribution du soufre dans lesdites fractions de composés chimiques, dans
lequel :
- au moins une partie du soufre contenu dans ladite fraction des NSO
produit de l'hydrogène sulfuré et au moins une autre partie s'incorpore dans
lesdites fractions des insolubles et des aromatiques ;
- au moins une partie du soufre contenu dans ladite fraction des
résines produit de l'hydrogène sulfuré et au moins une autre partie
s'incorpore dans
lesdites fractions des insolubles et des aromatiques ;
CA 02565120 2013-06-12
6
- tout le soufre initialement contenu dans l'huile et la roche est
entièrement dispersé dans au moins une desdites fractions de composés
chimiques au cours de ('aquathermolyse;
c) on calibre lesdits paramètres cinétiques à partir d'expériences de
pyrolyses aqueuses, réalisées sur au moins un échantillon de ladite roche ;
et en ce qu'on estime la masse d'hydrogène sulfuré produite par ledit
gisement pétrolier au cours de ladite récupération d'huile brute par injection
de
vapeur d'eau dans ledit gisement, en réalisant les étapes suivantes :
- on calibre lesdits paramètres à partir d'échantillons de roche dudit
gisement ;
- on estime ladite masse d'hydrogène sulfuré produite par ledit gisement à
tout instant, à l'aide d'un modèle de réservoir et à partir dudit modèle
cinétique.
On peut alors vérifier que la masse d'hydrogène sulfuré produite par ledit
gisement
pétrolier reste sous la teneur maximale légale, déterminer des conditions
d'injection de
vapeur nécessaires pour réduire les émissions d'H2S, dimensionner des procédés
de
réinjection d'H,S dans le réservoir et/ou dimensionner des unités de
traitement des gaz
acides en tête de puits.
Selon l'invention, il peut être nécessaire de réaliser au moins autant
d'expériences de
pyrolyse qu'il y a de paramètres cinétiques à calibrer, ces expériences de
pyrolyses
aqueuses pouvant être réalisées pour différentes températures et différents
temps de
contact.
Dans ce cas, les différentes températures peuvent être choisies dans une gamme
où
l'aquathennolyse a des effets notables, c'est-à-dire que les différentes
températures
peuvent être supérieures à 200 C et/ou inférieures à 300 C.
CA 02565120 2013-06-12
6a
A la suite desdites expériences de pyrolyses, on peut mesurer :
- la masse d'hydrogène sulfuré produite pour chaque température et chaque
temps
de contact entre la vapeur d'eau et l'huile ;
- la distribution massique de soufre dans chacune desdites fractions.
La distribution massique en soufre de chaque fraction peut être mesurée par
extraction et séparation des fractions à l'aide de solvants, puis par pesée et
analyse
élémentaire des fractions. La masse d'hydrogène sulfuré produite à la suite
desdites
expériences de pyrolyses peut être mesurée par chromatographie gazeuse.
Les conditions initiales dudit modèle cinétique peuvent être détenninées à
partir
d'échantillons de roche en séparant, avant pyrolyse, lesdites fractions à
l'aide de solvants
et en réalisant des analyses élémentaires desdites fractions ainsi séparées.
Les paramètres cinétiques du modèle peuvent être calibrer à l'aide d'une
technique
d'inversion.
D'autres caractéristiques et avantages de la méthode selon l'invention,
apparaîtront à
la lecture de la description ci-après d'exemples non limitatifs de
réalisations, en se référant
aux figures annexées et décrites ci-après.
CA 02565120 2006-10-23
7
Présentation sommaire des figures
- les
figures 1A, 1B montrent l'évolution de la distribution du soufre dans les
différentes
fractions d'une huile et d'une roche à partir d'expériences de pyrolyse
aqueuse en milieu
inerte et fermé à différentes températures : 260 C (Fig. 1A) et 320 C (fig.
1B).
- la
figure 2 présente une comparaison entre les distributions massiques de soufre
dans
chacune des fractions calculées avec le modèle cinétique et mesurées.
- la figure 3A présente l'évolution de la distribution de la masse de soufre
dans les
différentes fractions (RMS) pour un temps de contact (te) de 24h
- la figure 3B présente l'évolution de la distribution de la masse de soufre
dans les
différentes fractions (RMS) pour un temps de contact (te) de 203h.
Description détaillée de la méthode
La méthode selon l'invention permet d'estimer la masse d'hydrogène sulfuré
produite par aquathennolyse au sein d'une roche contenant de l'huile brute.
L'aquathermolyse est définie comme la somme des réactions chimiques entre une
huile
lourde et de la vapeur d'eau (Flyne et al., 1984).
Dans un premier temps, la méthode comporte la définition d'un modèle cinétique
décrivant la genèse d'hydrogène sulfuré (1-11S) en fonction de l'évolution de
la répartition
du soufre dans lesdites fractions de composés chimiques. Puis, un ensemble
d'expériences
de pyrolyse est réalisé sur la roche pour calibrer ce modèle cinétique. Enfin,
à partir de ce
modèle cinétique calibré, l'on peut déterminer la quantité d'hydrogène sulfuré
produite par
la roche soumise à un contact avec de la vapeur d'eau pendant une durée I à
une
température /
Caractérisation chimique de l'huile brute contenue dans la roche
Une caractérisation par classes de composés chimiques commune dans l'industrie
est
la caractérisation S.A.R.A., décrite par exemple dans le document suivant :
F.Leyssale, 1991, "Étude de la pyrolyse d'alkylpolvaromatiques appliquée aux
30 procédés
de conversion des produits lourds du pétrole. Influence du noyau
CA 02565120 2006-10-23
8
aromatique sur le comportement thermique", Thèse de l'Université Paris VI, Réf
IFO
n 39 363.
Elle consiste à décrire l'huile brute en quatre fractions : les saturés, les
aromatiques,
les résines et les asphaltènes.
A la suite d'expériences d'aquathennolyse menées en laboratoire sur des
échantillons
de roche, on observe, comme illustré sur les figures 1A, 1B, que la fraction
insoluble dans
le n-pentane et le dichloromethane, fraction principalement constituée de
minéral, joue un
rôle important dans l'évolution de la répartition du soufre au cours de la
genèse de sulfure
hydrogéné.
C'est pourquoi, selon l'invention, on décrit non pas l'huile brute seule, mais
l'ensemble constitué de l'huile brute et de la partie minérale, que l'on
décompose selon les
cinq fractions suivantes :
Une fraction correspondant aux composés de l'huile insolubles dans le pentane
:
1- Les composés NSO : les NSO correspondent aux composés insolubles dans le n-
pentane à 43 C mais solubles dans le dichlorométhane à 43 C, riches en azote
(N),
soufre (S), oxygène (0) et métaux. Ces composés son principalement constitués
d'asphaltènes, mais ils comportent également un peu de résines.
Trois fractions correspondant aux composés de l'huile solubles dans le n-
pentane à 43 C,
les maltènes:
2- Les composés saturés : maltènes à chaînes hydrocarbonées saturées.
3- Les composés aromatiques : maltènes à chaînes hydrocarbonées comportant un
ou
plusieurs noyaux aromatiques.
4- Les résines : maltènes comportant de la matière asphaltique (la seconde
fraction la
plus lourde de l'huile).
Ces trois fractions sont séparées les unes des autres par chromatographie
liquide par
adsorption de type MPLC (Medium Pressure Liquid Chromatography).
Une fraction correspondant aux composés de l'huile insolubles dans le n-
pentane et le
di chlorométhane :
CA 02565120 2006-10-23
9
5- Les insolubles : cette fraction est composée principalement de solide
minéral et
peut contenir une partie organique.
Définition d'un modèle cinétique
L'effet de l'aquathermolyse dépend principalement de deux variables :
- Le temps de contact entre la vapeur d'eau et la roche, noté t.
- La température à laquelle ont lieu les réactions chimiques, noté T.
La définition d'un modèle cinétique décrivant la genèse d'hydrogène sulfuré (1-
12S)
consiste donc à définir un système d'équations permettant de déterminer la
quantité (la
niasse par exemple) d'hydrogène sulfuré produite à tout instant t, et pour une
température
T donnée.
La méthodologie selon l'invention, permettant de définir un tel modèle
cinétique,
décrit d'une part, que le soufre contenu dans la fraction des NSO donne
naissance à de
l'hydrogène sulfuré et s'incorpore en partie dans les fractions des insolubles
et des
aromatiques, et d'autre part, et de façon identique, que le soufre contenu
dans la fraction
des résines donne naissance à de l'hydrogène sulfuré et s'incorpore en partie
dans les
fractions des insolubles et des aromatiques. On suppose en outre que le soufre
dans les
asphaltènes et le soufre dans les résines n'interagissent pas. De plus, on
considère que
plusieurs réactions coexistent en parallèle au sein de chaque fraction, ces
réactions étant
caractérisées par des constantes de temps différentes (kui, kaõ. 41,
lqõõ). Enfin
on estime que la fraction des saturés ne contient pas de soufre. Le modèle
s'écrit alors :
sNSO ai. kai(1) cti1s1125+ alisINS ct13sARO
sNSO a2, k.12(T) a 1' cli2S+ a 2-
õ. ,s1NS ÇARO
2
sNSO an, kan(T) a ÇFIlS eINS sARO
nl" u n3
, et >0 (I)
RES h1, kbl(T) isH25+ piisINS+ pusARO
REs 1.,t2(T)
p,1sH2S+ p,isINS+ {323sARO
RES hm, k hm (1 )
pin1s1125+ rillosARO
CA 02565120 2006-10-23
avec :
eso
: la distribution massique de soufre dans la fraction des NSO
Sn 's : la distribution massique de soufre dans la fraction de
l'hydrogène sulfuré
s1 VS
: la distribution massique de soufre dans la fraction des
insolubles
0
s1R
5 : la distribution massique de soufre dans la fraction des
aromatiques
sRES : la distribution massique de soufre dans la fraction des
résines
: la température
n et in : les nombres nécessaires d'équations parallèles de transformation du
soufre, respectivement des NSO et des résines pour décrire les données
expérimentales.
10 an, al2, an, ..., aõ1, aõ2, aõ3 : des coefficients stoechiométriques
põ,,g,õ,g,3,..., flõ,i, flõ,3 : des coefficients stoechiométriques
a1, aõ : des coefficients de répartition
bh 63, bõ, : des coefficients de répartition
Ces quatre derniers groupes de coefficients sont des paramètres du modèle
cinétique
à définir. Ils vérifient les équations de fermeture suivantes:
al I +0.12 +C./13 =1
021+0.22 C123=1
an1+a112+a n3 =1
1311+Pl/ +P13=1
(2)
1321-1-P22+1323-1
13õ,i+13,,,,+13m3=1
b1+ b, =I
ai (respectivement bi) : représentent la proportion de soufre de la
fraction des
NSO (respectivement des résines) réagissant selon l'équation caractérisée par
la constante
de temps kõ1 (respectivement k1õ).
kõ1, kõ2, k, k1,1, kh2, kh,õ : les constantes de temps ; elles
sont supposées
dépendre uniquement de la température T:
CA 02565120 2006-10-23
11
Eid
ka, (T) = Aul exp( ____________
R.T )
( E
k. (T)= A. exP _______________ an
R.T
, VT 20 C (3)
km(T) = Am exp( Ehl
R.T
( E
kbm(T) = A exP bu'
R.T
R étant la constante des gaz parfaits (R = 8.314 J.K-1.mo1-i)
Aõ2, Aõõ, AH, A1,2, ................................ A1,,, les
facteurs préexponentiels et Eõ1, Ea2 , Eõõ.
Eb2, ..... Eh,, les énergies d'activation, sont à calibrer expérimentalement.
La méthodologie selon l'invention, permettant de définir le modèle cinétique,
décrit
également que tout le soufre initialement dans l'huile est entièrement
retrouvé dans
l'ensemble des fractions choisies. En d'autres termes, le modèle respecte le
principe de
conservation de la masse du soufre. Ainsi, un troisième système d'équation
complète le
modèle cinétique :
s Nso +s //2.s. s Lys s ARO + RES =
, Vt > 0 (4)
Un schéma cinétique du premier ordre, dérivé des systèmes (1) et (3), et
contraint par
le système (2) et l'équation de conservation de la masse (4), ainsi que par
les conditions
initiales ( soms s(/),v.s et S(;te0), permet de calculer l'évolution de la
répartition du
soufre dans les différentes fractions comme une fonction du temps et de la
température. Ce
schéma cinétique est constitué de l'ensemble des lois de vitesse, supposées
d'ordre I et des
réactions prises en compte dans le processus affectant le soufre pendant
l'aquathermolyse :
CA 02565120 2006-10-23
1-)
d i , \ d I , \
= La ¨ la ) avec : -- 1.) Aso i =
di - = " ,, ' dt = " ' di
dc I li d d ( (., \
di
¨ .3 RES = lb .¨(-S. REs); avec :¨v.' (SE i j = ¨it: hj(S RES) j I dt
di
i=1
= (S , . ). -1 ig b ¨d(S .- ,)
, V I ?... 0
di ,\ so , ii i dt RL., ,
di -=
d , n d i r m
L d c., \
¨d tj iss =---a i2 a ¨l3 vw)i -13.2,-, -(J.);
i=1 ' di ' ' -1- 1 d I
H
¨dS ARõ = -cr13 a' ¨d(S - ) - "113 . b I-(SRL's ...)
di di j
/ =I
'
En intégrant de manière simultanée l'ensemble de ces lois de vitesse en
fonction du
temps et de la température, on montre que les teneurs en différentes fractions
soufrées
peuvent être calculées au moyen du système (5) de fonctions suivant, défini Vt
?. O:
S 'vs (t, T)= .. [s(0(I) , a 1. A, , E ai , , a õ..,4õõ , E õõ ,t ,T]
sRES (t.,
T)= CD 2 [SORLS , bi.A,,,, Eh, i bõ,=At,õõ Eh,,, t,1]
_
S(,\I") , S ers ,ai.A.I,E õ1,.., a õ,Aaõ, E,,,, , 1)1,A hi ,
E1,1,..,bõ,./11,õõ E hm,
Sn's(t,T)= I',(5)
ai 1 --, ao ,J811,-, Aerl ,t, T _
5 1 ss (1, n = s (1),,s , pi vs l'Es a .
[S 0 ,S 0 , 1. A01 ,
Eal '=", a, .A. , E 0,, , bi. 41,1, E bl l= = lb m.11 En: 1 E hm '
- cei2,--cen2,P12,---,13 ,2,t,T
S'vs ,S,REs , a , A,,1, E ,,..,a A ,Eõõb, Ah!, Eii,.., b Ah 1,E h ,
S
AR() (t ,T)= s 0,A RO 1)3 0 ) , . .. ,,,, , . ,
Ill . H ,,,
[
avec :
St,XS() : la distribution massique de soufre dans la fraction des NSO à t = 0
soRFs : la distribution massique de soufre dans la fraction des résines à t =
0
S (I)NS : la distribution massique de soufre dans la fraction des
insolubles à t = 0
SARI) .
. la distribution massique de soufre dans la fraction des aromatiques à t -
0
La forme des fonctions ah, (1)2, 'Pl, 9'2, et 1P3 dépend de l'histoire
thermique imposée
au cours de l'aquathermolyse. Par exemple, dans le cas particulier d'un régime
thermique
isotherme, ces fonctions sont de la forme :
CA 02565120 2006-10-23
13
une fonction de la forme : 2 exp(¨k,1.t)+ ...+ A exp(¨k1õ1)
(I)) : une fonction de la forme : Xexp(¨kb,õt), et 0
tp : une fonction de la forme :
Xi{1¨ exp(¨kalt)}+...+ 2 {1 ¨ exp(¨kõõt)}
+ ¨ exp(¨kbit)1+ ... +un, {1
¨ et
: une fonction de la forme
2.1{1¨ exp(-1(alt)}-... + {1 ¨ exp(-1<õõt)}
+ {1 ¨ exp(¨kbit)}+ ...+uiõ {1 ¨ exp(-1(t)}, et 0
1,3 : une fonction de la forme :
exp(¨kalt)}+...+ 2 {1 ¨ exp(¨kt)}
+ {1 ¨ exp(--k bi + ... Am {1 ¨ exp(¨kb,õ0}, et
La quantité d'hydrogène sulfuré générée au cours de l'aquathennolyse, en
fonction
du temps et de la température, est alors proportionnelle à l'évolution du
soufre contenu
dans l'hydrogène sulfuré :
Mti,s
H ,S(1,T)=- - x 111s X SinS (i,T), V t ?_ 0 (6)
Ms
avec :
H ,S(t ,T) : la masse d'1-12S produite à la température T et pendant un temps
de
= contact t.
Mil.s
: le rapport entre la masse moléculaire de l'hydrogène sulfuré et la
masse moléculaire du soufre
ms : la masse totale de soufre dans la roche
Il est alors nécessaire de déterminer, d'une part les conditions initiales
(S,;',SõREs,
S',/fs et ) et d'autre part les paramètres inconnus du modèles :
CA 02565120 2006-10-23
14
- les facteurs préexponentiels : Aõ1, Aõ2, Aõõ, AH, /11,2,
..., Ab,õ
- les énergies d'activation : Ea2, = = = , Eau, EN, Eh2, = = =
, Etuu
- les coefficients stoechiométriques : a,1,al', an, ..., aõi, aõ2,
aõ3
pll, /8,2, 1313, = = = , An2,
- les coefficients de répartition : al, a2,...,aõ et bi, b,,...,bõ,
Calibraize du modèle
Pour calibrer les paramètres du modèle cinétique, on réalise des expériences
de
pyrolyse aqueuse (aquathen-nolyse en laboratoire) sur des échantillons de
roches à la suite
desquelles on détermine la masse de soufre contenue dans chaque fraction de
l'échantillon.
On en déduit les distributions (répartitions) massiques de soufre des
différentes fractions
(masse de soufre contenue dans une fraction divisée par la masse de soufre
totale contenue
dans l'échantillon). Ces expériences sont réalisées pour différentes
températures et
différent temps de contact tc.
Puis à l'aide d'une technique d'inversion, on détermine les paramètres du
modèle.
L'inversion, technique bien connue des spécialistes, consiste à définir une
fonction d'erreur
quadratique à minimiser pour que les résultats du modèle soient les plus
proches possible
des résultats effectivement mesurés. Selon la méthode, la fonction d'erreur
quadratique est
définie entre les valeurs de distribution massique mesurées et les valeurs de
distribution
massique calculées. Toute méthode d'inversion peut convenir.
Un exemple d'un protocole expérimental est décrit ci-après, dans le cadre de
l'étude
d'une roche réservoir dans lequel on injecte de la vapeur d'eau pour assister
la récupération
d'huile lourde.
Expériences d'aqualhermolyse
Pour évaluer la quantité d'FI,S générée par une roche en contact avec de la
vapeur
d'eau, on réalise des pyrolyses aqueuses (aquathermolyse) en milieu fermé à la
suite
desquelles on quantifie l'HiS formé. Les pyrolyses aqueuses consistent à
chauffer un
échantillon de roche avec de la vapeur d'eau, sous une pression de 100 bars, à
une
CA 02565120 2006-10-23
température constante T. Cette température est choisie pour être la plus
représentative
possible des conditions in situ de la roche, compte tenu des contraintes de
durée
d'expérimentation. Cette température est choisie dans la gamme de température
où
l'aquathennolyse à des effets notables. Par exemple, la température
d'injection dans les
5 réservoirs est comprise entre 200 C et 300 C. La température de la vapeur
dans la chambre
de vapeur du réservoir varie entre la température de la formation (10 C-100 C)
et la
température d'injection (200 C-300 C). Sachant que les réactions
d'aquathermolyse ont des
effets significatifs au dessus de 200 C pour des durées classiques de
production (Hyne et
al., 1984), les températures critiques pour Paquathermolyse in-situ sont
supérieures à
10 200 C et ne peuvent dépasser 300 C. Ainsi, les températures
d'expériences, dans le cadre
de l'injection de vapeur dans un réservoir, peuvent se situer dans la gamme
200 C à
300 C.
Les réactifs sont la roche réservoir homogénéisée par broyage et de l'eau
déionisée.
La quantité d'eau ajoutée est calculée de sorte d'avoir les mêmes volumes
d'huile et d'eau
15 compte tenu de la quantité d'eau de formation déjà présente dans la
roche. Les réactifs sont
enfermés dans un tube en or de diamètre intérieur de 10min, de diamètre
extérieur de
11 mm et de hauteur 5 à 6 cm. Ce tube en or est scellé dans une atmosphère
neutre, par
ultrasons. Cette technique de soudage est ultra-rapide et peu exothermique :
l'or est chauffé
à moins de 80 C pendant moins d'une seconde, ce qui évite de chauffer les
réactifs avant le
début de l'aquathennolyse. Puis le tube est placé dans un autoclave qui régule
la pression et
la température. La pression est fixée à 100 bars.
Pour évaluer les paramètres du modèle cinétique en fonction de la température,
il est
nécessaire de réaliser plusieurs aquathennolyses à des températures
différentes, toutes dans
la gamme où l'aquathennolyse à des effets notables (200 C-300 C). Il est clair
que plus
l'on réalise d'essais à des températures différentes, plus le modèle est
précis.
Selon un exemple de réalisation, quatre températures ont été choisies dans la
gamme
sensible (200 C-300 C), et une un peu au delà de cette gamme, afin de couvrir
une plus
grande gamme de conversion du soufre en EUS sans trop augmenter les durées
d'expérimentation. Ainsi, selon un exemple de mode opératoire, les expériences
d'aquathennolyse ont été réalisées aux températures Ti, suivantes : 240 C, 260
C, 280 C,
300 C, et 320 C. Toujours selon ce mode de réalisation, pour chacune des
pyrolyses
effectuées à des températures différentes, on réalise les mesures pour deux
temps de
contact t, différents : /c=24h et tc=20311.
CA 02565120 2006-10-23
16
Mesures des quantités d'H,S générées
Après une aquathennolyse de durée t, à une température 7,õ le tube en or est
ouvert
dans une ligne vide connectée à une pompe Toepler, bien connue de l'homme du
métier.
Ce dispositif permet de récupérer tous les gaz contenus dans le tube en or et
de les
quantifier. Les gaz sont ensuite stockés dans une ampoule en verre pour en
analyser la
composition moléculaire sur un chromatographe en phase gazeuse. On en déduit
le nombre
de moles d'H,S qui ont été formées au cours de l'aquathennolyse.
On obtient donc la masse d'HiS produite à la température Tp et correspondant à
un
temps de contact t, entre la vapeur d'eau et l'huile : H,S(1,,T
Mesure de la distribution du soufre dans les fractions de l'huile et de la
roche
Associés à ce gaz FIS, les produits lourds sont également récupérés et pesés:
les
C14+ maltènes, solubles dans du n-pentane, les NSO, insolubles dans le n-
pentane mais
solubles dans du dichlorométhane, et le résidu, insoluble à la fois dans le
dichlorométhane
et le n-pentane. On suppose que les hydrocarbures C6-C1.4 (hydrocarbures ayant
entre 6 et
14 atomes de carbones), ainsi que l'eau, sont en quantité négligeable : on ne
les quantifie
donc pas.
On ajoute environ 60 ml de solvant par gramme de roche réservoir, en
conservant la
même quantité de solvant pour toutes les expériences de même durée. Par
exemple, on
ajoute 60m1 de solvant pour des tubes chauffés pendant tc= 203h et 200m1 de
solvant pour
des tubes chauffés pendant te= 24h, qui contiennent d'avantage de roche. Pour
solubiliser
les maltènes C14+, le tube en or est tout d'abord agité avec le n-pentane à 44
C à reflux
pendant 1 heure. Puis la solution est filtrée pour séparer les NSO et les
insolubles des
maltènes C14+ solubilisés dans le n-pentane. Ces derniers sont ensuite séparés
en saturés,
aromatiques et résines par chromatographie liquide par adsorption de type MPLC
(Medium
Pressure Liquid Chromatography). La partie insoluble au n-pentane (NSO et
insolubles) est
ensuite mélangée avec le dichlorométhane à 44 C à reflux pendant 1 heure. Puis
la solution
est filtrée : le soluté constitue les NSO tandis que la partie insoluble
correspond à la
fraction des insolubles .
CA 02565120 2006-10-23
17
Toutes les fractions ainsi séparées (NSO, Aromatiques, Saturés, Résines,
Insolubles)
sont pesées. On vérifie que la somme des masses des fractions atteint au moins
95% de la
masse de l'échantillon initialement introduit dans le tube en or. La teneur
massique en
soufre atomique est mesurée dans chaque fraction par analyse élémentaire,
technique bien
connue de l'homme du métier. On peut alors calculer la masse de soufre dans
chacune des
fractions et en déduire la répartition du soufre total dans ces fractions et
dans le gaz. La
Figure 1A illustre l'évolution, en fonction du temps t, de la distribution
massique de soufre
(RMS) dans chaque fraction, pour une température de 260 C, avant
aquathennolyse (tc=0),
et pour deux temps de contact : i=2411 et ic=20311. Une courbe interpolant ces
trois valeurs
est également représentée sur cette figure. La figure 1B illustre également
l'évolution de la
distribution massique de soufre dans chaque fraction, pour les même temps de
contact,
mais pour une température de 320 C.
On en déduit également la masse totale de soufre ms présente dans
l'échantillon en
sommant la masse de soufre contenue dans chacune des fractions.
On obtient donc :
- la distribution massique de soufre dans la fraction des NSO pour un temps de
contact
tc et une température d'aquathennolyse Tp (Sys()).
- la distribution massique de soufre dans la fraction des insolubles pour un
temps de
contact t, et une température d'aquathermolyse 4 (Srs)
/13 - la
distribution massique de soufre dans la fraction des aromatiques pour un temps
de
contact t, et une température d'aquathermolyse T (S-un
- la distribution massique de soufre dans la fraction des résines pour un
temps de
contact t, et une température d'aquathennolyse Tp (ers)
On en déduit également la distribution massique de soufre dans la fraction
FI,S
(SH2s) pour un temps de contact tc et une température d'aquathennolyse Tp, à
l'aide des
distributions des différentes fractions et de l'équations de conservation de
la masse
(équation (4)).
Calibrage des paramètres du modèle d'évolution de la distribution du soufre
dans les
fractions et dans l'H,S
CA 02565120 2006-10-23
18
Comme précisé précédemment, pour évaluer les paramètres du modèle cinétique en
fonction de la température, il est nécessaire de réaliser plusieurs
expériences
d'aquathermolyse à des températures différentes, toutes dans la gamme où
l'aquathermolyse à des effets notables (200 C-300 C), à l'échelle de temps de
la
production du pétrole brut. La procédure expérimentale d'aquathennolyse,
décrite ci-
dessus, doit être reproduite au moins autant de fois qu'il y a de paramètres à
calibrer, à
différents temps de contact et différentes températures.
L'état initial est également calibré par détermination expérimentale de la
répartition
du soufre dans la roche initiale : extractions et séparations des fractions,
pesées et analyse
élémentaires. On en déduit ainsi la distribution massique de soufre dans la
fraction des
NSO à /õ. = 0 ( .5',;v50 ), la distribution massique de soufre dans la
fraction des résines à tc. =-- 0
(som)
s , s la distribution massique de soufre dans la fraction des insolubles à tc.
= 0 (es), et
la distribution massique de soufre dans la fraction des aromatiques à tc = 0 (
Sole ).
S 'vs (t = 0) =
s RES (1 = 0) = s (R)ES
S " 2S (t = 0) = 0
S LVS (t = 0) ¨ S oLVS
s ARO (t _ 0) =
Afin de calibrer les paramètres du système d'équations définissant le modèle
cinétique, on utilise l'état initial ainsi que toutes les mesures effectuées
au cours des
aquathermolyses en laboratoire, dans un moteur d'inversion. L'inversion est
une technique
bien connue des spécialistes. Dans la méthode selon l'invention, cette
technique va
permettre d'optimiser les paramètres inconnus du modèles pour que les sorties
du modèles
(les distributions massiques de soufre dans chaque fraction modélisées)
coïncident au
mieux avec les données mesurées en laboratoire (les distributions massiques de
soufre dans
chaque fraction mesurées). Pour ce faire, on définit une fonction évaluant
l'écart entre les
données mesurées et les données modélisées. On peut par exemple utiliser une
fonction
définie comme la somme des erreurs quadratique entre la valeur mesurée et la
valeur
calculée de chaque variable S' (SLys , glRa SREs , ...). L'inversion consiste
alors à rechercher
le minimum de cette fonction par rapport à chacun des paramètres cinétiques :
Aõ,, Aõ2, ...,
Aall, Abh A,,2, = = =, A,,,,, et Euh E,,1, = = =, Ean, Ehl, Eb2, = = =, Eh,,,
et a11, ar2, a/3, = = =, ao, an2, ao
et p ,,, 13,2, fl13, = = ., 13õ,,, ,0õ,,, Pm] et ah a2, ..., aõ et b,, 62,
..., bõ,.
CA 02565120 2006-10-23
19
Les distributions massiques de soufre dans chaque fraction sont modélisées à
partir
du schéma cinétique du premier ordre (5) définissant le modèle cinétique,
dérivé des
systèmes (1) et (3), et contraint par le système (2) et l'équation de
conservation de la masse
(4), ainsi que par les conditions initiales (So'vs s, ou Ss s
et Sr ). En revanche,
l'équation (6) du modèle cinétique permet, après calibrage de ce modèle, de
déterminer la
quantité d'hydrogène sulfuré générée au cours de l'aquathermolyse, en fonction
du temps
et de la température.
Estimation de la masse d'hydrogène sulfuré produite par un gisement pétrolier
La méthode selon l'invention peut être appliquée dans le cadre de l'injection
de
vapeur dans un gisement pétrolier pour la récupération assistée des huiles
lourdes. En effet,
au cours d'une telle récupération assistée, au-delà de 200 C, les réactions
chimiques
d'aquathermolyse entre la vapeur d'eau et la roche réservoir ont des effets
significatifs à
l'échelle de temps de la production d'huile.
Dans ce cadre d'application, le modèle cinétique est destiné à être utilisé
dans un
modèle de réservoir pour simuler numériquement, via un simulateur
d'écoulements, la
production d'huile par injection de vapeur et la production afférente d'H,S.
Le modèle de
réservoir doit pouvoir calculer les températures, tenir compte de 111-11S et
de la matrice
minérale (représentant la fraction des insolubles) comme des inconnues et
décrire le brut
avec au moins trois pseudo-composants : les NSO, les aromatiques C14+ et les
résines
C 14+.
L'évaluation de la production d'hydrogène sulfurée peut se faire à tout
instant t. En
fait, le temps de contact t, est le temps t, et la température de réactions
est définie pour tout
temps t par un simulateur d'écoulement bien connu de l'homme du métier, tel
que FIRST-
RS (IFP, France) par exemple. En effet un simulateur d'écoulement permet, au
travers d'un
modèle de réservoir, de prendre en compte les conditions de réservoir
(pression,
température, porosité, quantité de soufre initialement dans le brut), ainsi
que les conditions
d'injection de vapeur (pression, débit, température, durée).
Pour réaliser la calibration du modèle cinétique, on travaille alors sur des
échantillons de roches issus du réservoir tels que des carottes.
CA 02565120 2006-10-23
Les paramètres nécessaires au calcul de la production d'hydrogène sulfurée à
partir
de l'équation (6) sont tous définis :
- les paramètres du modèle cinétique sont déterminés à partir d'expériences
de pyrolyses aqueuses en milieu inerte et fermé ;
5 - les
conditions initiales sont déterminées à partir d'extractions et de
séparations des fractions par solvants, puis à l'aide de pesées et d'analyses
élémentaires ;
- la masse de soufre contenue dans la roche est estimée en laboratoire ;
- la température au sein du gisement est estimée par le simulateur
10 d'écoulement à chaque instant t.
En appliquant la méthode à des échantillons de roche du gisement (carottes,
...), il
est possible de prédire de façon quantitative la production d'hydrogène
sulfuré (H,S)
lorsque l'on récupère des bruts lourds par injection de vapeur d'eau dans un
réservoir
15
pétrolier. Il est alors possible de limiter les risques en vérifiant que les
émissions d'H,S
restent sous la teneur maximale légale (selon les pays 10 à 20vol.ppm). On
peut alors
déterminer les conditions d'injection de vapeur nécessaire pour réduire les
émissions d'El,S,
ou dimensionner des procédés de réinjection d'EllS dans le réservoir. Il est
également
possible, à partir de cette estimation des émissions d'EliS de dimensionner
les unités de
20
traitement des gaz acides en tête de puits, ou encore, de définir des
matériaux de
production adaptés pour résister aux gaz FI,S.
Résultat d'une mise en oeuvre de la méthode
La méthode selon l'invention est appliquée dans le cadre de l'injection de
vapeur
dans un gisement pétrolier pour la récupération assistée des huiles lourdes.
Selon l'exemple de réalisation décrit précédemment, quatre températures sont
choisies dans la gamine sensible (200 C-300 C), et une un peu au delà de cette
gamme :
240 C, 260 C, 280 C, 300 C, et 320 C. Toujours selon ce mode de réalisation,
pour
chacune des pyrolyses effectuées à des températures différentes, on réalise
les mesures
pour deux temps de contact t, différents : t(=2411 et tc=203h.
CA 02565120 2006-10-23
21
On suppose que seulement deux réactions parallèles pour le soufre dans les NSO
(n=2) et deux réactions parallèles pour le soufre dans les résines (rn=2),
permettent de
décrire les données expérimentales obtenues :
S''''s "Lk"'(T) > aIls"2s+ a12 s'''s + a13 Sie
s.vso a 2. Å, (T)
> a,,S"'s + a22SI=vs + a, S-1"
.3
, ei > 0
SRL-5 I'L k',(1 ) > fi S"+ p12 sLys + p13s-te,
sREs __ h2.1('HT) > ie21 s",s + p22SLVS+ /323 SAR"
avec S'ys()+S"2s+ S' +S AR() S IOES = 1 , e i > 0
On considère (lune deux constantes de temps pour la dégradation du soufre des
NSO:
{kõ,(T)= Aõ, exp(---nj-E j
R.T
\IT > 20 C
kµ,2(T)=-- A,,, exP an
R.T )
Et l'on considère également deux constantes de temps pour la dégradation du
soufre
des résines:
kbi(T)= Ahl exP ---1-
R.T j
( F \
kb2 (T)= Ah. exp
R.],,
On mesure de plus qu'il n'y a pas de soufre initialement dans la fraction des
insolubles de la roche.
S 'vs (t = 0) = 5 .1:5
S RES (I = 0) = S ile,ES
slI25 (i = 0) =0
S I'VS (t =- 0) = 0
S'IR (t = 0) =
Compte tenu des inconnues du modèle cinétique défini, il y a 24 paramètres à
calibrer :
CA 02565120 2006-10-23
ar2, an a2l, a22, a23
P13 132 I fi22,P23,
al, a, b1, h,
A,11, Aa2 Abl, A1,2
Eõ1, Eõ, E1,1, Eb2
En tenant compte des six équations de fermeture (2), on réduit le nombre des
inconnues à 18.
On peut encore réduire le nombre de degrés de liberté, en fixant les facteurs
préexponentiels à une valeur arbitraire mais réaliste :
10,,,14 -I
Aai = Aa2 = Ahi = lu s
On réduit ainsi le nombre de degré de liberté du modèle à 14.
Pour déterminer la valeur de ces 14 paramètres inconnus, on a réalisé dix
expériences
d'aquathermolyses qui ont fourni 55 valeurs expérimentales (5 fractions x 5
températures x
2 temps de contact + 5 valeurs à t=0). Ainsi le système est bien contraint.
Les résultats
expérimentaux sont décrits dans le tableau 1, dans lequel wt /0 signifie
pourcentage en
masse (et non en volume) :
CA 02565120 2006-10-23
23
Température Temps de
d'aquathermolyse contact t, sAP (wt%) SPes (wt%) es (wt%) Sns (wl%) s'in
(yvm) Somme
T ( C) (h)
0 17% 45% 38% 0% 0% 100%
320 C 24 19% 32% 23 /e 200/o 6% 100%
203 27% 25% 15% 20% 13% 100%
0 17% 45% 38% 0% 0% 100%
300 C 24 18% 34% 27% 18% 2% 100%
203 23% 33% 23% 18% 4% 100%
0 17% 45% 38 A 0% 0% 1000/.
280 C 24 21% 430/0 36% 0% 0% 100%
203 22% 38% 25% 15% 1% 100%
0 17% 45% 38% 0% 0% 100%
260`C 24 20% 44 /,, 36% 0% 0% 100%
203 20% 39% 28% 13% 1% 100%
0 17% 45% 38% 0% 0,0% 100%
240 C 24 18% 43% 39% 0% 0,1% 100%
203 20% 46% 34% 0% 0,1% 100%
Tableau 1
Par ailleurs les conditions initiales mesurées sont les suivantes :
Sõ\-" = 38% Sõ"-` = 45%
es = 0% S;110 = 17%
Suites à ces valeurs expérimentales, on utilise une technique d'inversion pour
déterminer les paramètres inccmnus. Dans cet exemple, on utilise un algorithme
de
Levenberg-Marquardt étendu sous contrainte. Cet algorithme est décrit par
exemple dans
les documents suivants :
- Levenberg, K. "A
Method for the Solution of Certain Problems in Least
Squares." Quart. Appl. Math. 2, 164-168, 1944.
- Marquardt, D. "An Algorithm for Least-Squares Estimation of Nonlinear
Parameters." SLIM J. Appl. Math. Il, 431-441, 1963.
L'inversion donne alors les résultats suivants :
100'Vo a/2-0%
a2/-33% a"--60%
fiti=40'!"0 /112=38'!'0
CA 02565120 2006-10-23
24
/f2/..= /0(M; pu=t1'!'n
a , =33"i, a 2=6 7''i;
h 1= 2'!", 1,2=
Eõ1= 48.5 kcal/mol Eõ2= 54.6 kcaUmol
EH ¨ 48.8 kcal/mol Eb2 = 55.2 kcal/mol
A.0 1,2
A1,1 =¨ A= 1014 S-1
Ainsi on en déduit le schéma cinétique suivant :
33% ¨* 100% sINS
E=48.5 kcal/mol
SNs A= le s-1
67% 33% SINs + 60% s ARO
+ 7% S12s E=54.6 kcal/mol
A= le s
22% 40% SiNs + 38% sARO + 22% S H2S
E=48.8 kcal/mol
sRES A= s)
78% 100% sH2S
E=55.2 kcal/mol
A= le s-')
La ligure 2 présente une comparaison entre les résultats numériques et les
résultats
expérimentaux. L'axe des ordonnées représente les distributions des masses de
soufre dans
chacune des fractions (S. \ 51), Sfus, SIRO, S'L's et S 1" ) calculées à
partir de la méthode
(RMSC). et l'axe des abscisses représente les distributions mesurées des
niasses de soufre
dans chacune des fractions (RMSM).
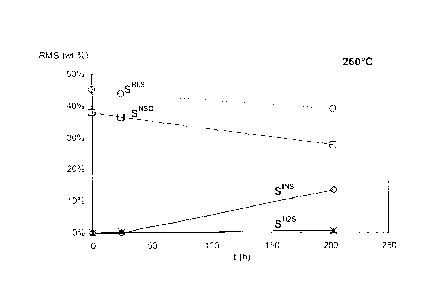
La ligure 3A présente l'évolution, en fonction de la température T, de la
distribution
de la niasse de soufre (RMS) dans les différentes fractions pour un temps de
contact (1õ) de
24h, pour les cinq températures expérimentales choisies ( Tr). Les points
évidés sont les
mesures, tandis que les courbes sont les résultats du modèle cinétique.
La ligure 3B présente l'évolution, en fonction de la température T, de la
distribution
de la masse de soufre (RMS) dans les différentes fractions pour un temps de
contact (t,) dc
203h, pour les cinq températures expérimentales choisies (7;,). Les points
évidés sont les
mesures, tandis que les courbes sont les résultats du modèle cinétique.
CA 02565120 2006-10-23
La méthode selon l'invention permet donc de déterminer et calibrer un modèle
cinétique fin, décrivant l'évolution, non pas des fractions du brut (NSO,
aromatiques,
résines), mais de la répartition du soufre dans ces fractions, en pouvant
faire abstraction de
5 la fraction "Saturés" du brut, car le soufre ne s'y associe pas, mais en
tenant compte de la
fraction "insolubles", qui englobe le minéral et parfois une petite proportion
d'organique.
De plus, la méthode permet de respecter le principe de conservation de la
masse de soufre
dans les différentes fractions au cours du contact avec la vapeur d'eau.
La méthode est ainsi très précise pour évaluer la masse d'hydrogène sulfuré
(H,S)
10 produite par aquathermolyse au sein d'une roche contenant de l'huile
brute. La méthode
peut alors être utilisée pour prédire de façon quantitative la production
d'hydrogène sulfuré
(H,S) lorsque l'on récupère des bruts lourds par injection de vapeur d'eau
dans un réservoir
pétrolier. La méthode permet alors de vérifier si les émissions dl-12S restent
sous la teneur
maximale légale (selon les pays autour de 10 à 20vol.ppm), et d'en déduire les
conditions
15 d'injection de vapeur ou de dimensionner les procédés de réinjection
d'H,S et les unités de
traitement des gaz acides en tète de puits, ou bien encore, de choisir des
matériaux de
production suffisamment résistants.