Note: Descriptions are shown in the official language in which they were submitted.
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
1
NOUVEAUX DERIVES SOUFRES D'UREE CYCLIQUE, LEUR
PREPARATION ET LEUR UTILISATION PHARMACEUTIQUE COMME
INHIBITEURS DE KINASES
La présente invention concerne de nouveaux dérivés
soufrés d'urée cyclique, leur procédé de préparation,
leur application comme médicaments, les compositions
pharmaceutiques les renfermant et l'utilisation
pharmaceutique de tels dérivés pour la prévention et le
traitement d'affections capables d'être modulées par
l'inhibition de l'activité de protéines kinases.
La présente invention concerne de nouveaux dérivés
d'urée cyclique possédant des effets inhibiteurs pour des
protéines kinases.
Les produits de la présente invention peuvent ainsi
notamment être utilisés pour la prévention ou le
traitement d'affections capables d'être modulées par
l'inhibition de l'activité de protéines kinases.
L'inhibition et la régulation de protéines kinases
constituent notamment un nouveau puissant mécanisme
d'action pour le traitement d'un grand nombre de tumeurs
solides ou liquides.
De telles affections que peuvent traiter les
produits de la présente demande sont donc tout
particulièrement les tumeurs solides ou liquides.
De telles protéines kinases appartiennent notamment
au groupe suivant: EGFR, Fak, FLK-1, FGFR1, FGFR2, FGFR3,
FGFR4, FGFR5, flt-1, IGF-1R, KDR, PLK,PDGFR, tie2, VEGFR,
AKT, Raf.
On indique tout particulièrement la protéine kinase
IGF1-R (Insulin Growth Factor-1 Receptor).
La présente invention concerne ainsi
particulièrement de nouveaux inhibiteurs du récepteur
IGF-1R qui peuvent être utilisés pour des traitements en
oncologie.
Le cancer reste une maladie pour laquelle les
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
2
traitements existants sont clairement insuffisants.
Certaines protéines kinases dont notamment IGF-1R
(Insulin Growth Factor 1 Receptor) jouent un rôle
important dans de nombreux cancers. L'inhibition de
telles protéines kinases est potentiellement importante
dans la chimiothérapie de cancers notamment pour
supprimer la croissance ou la survie de tumeurs. La
présente invention concerne donc l'identification de
nouveaux produits qui inhibent de telles protéines
kinases.
Les protéines kinases participent aux évènements de
signalisation qui contrôlent l'activation, la croissance
et la différentiation des cellules en réponse, soit à des
médiateurs extracellulaires, soit à des changements de
l'environnement. En générale, ces kinases appartiennent à
deux groupes: celles qui phosphorylent préférentiellement
les résidus sérines et/ou thréonine et celles qui
phosphorylent préférentiellement les résidus tyrosines
[S.K.Hanks and T.Hunter, FASEB. J., 1995, 9, pages 576-
5961. Les sérine/thréonine kinases sont par exemple, les
isoformes des protéines kinases C [A.C.Newton, J. Biol.
Chem., 1995, 270, pages 28495-28498] et un groupe de
kinases dépendantes des cyclines, comme cdc2 [J.Pines,
Trends in Biochemical Sciences, 1995, 18, pages 195-1971.
Les tyrosine kinases comprennent les récepteurs aux
facteurs de croissance comme le récepteur au facteur de
croissance épidermal (EGF) [S.Iwashita and M.Kobayashi,
Cellular Signalling, 1992, 4, pages 123-132], et des
kinases cytosoliques comme p56tck, p59fYn, ZAP-70 et les
kinases csk [C. Chan et. al., Ann. Rev. Immunol., 1994,
12, pages 555-592].
Des niveaux anormalement élevés d'activité protéine
kinase ont été impliqués dans de nombreuses maladies,
résultant de fonctions cellulaires anormales. Ceci peut
provenir soit directement soit indirectement, d'un
disfonctionnement dans les mécanismes de contrôle de
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
3
l'activité kinase, lié par exemple à une mutation, une
sur-expression ou une activation inapproprié de l'enzyme,
ou par une sur- ou sous-production de cytokines ou des
facteurs de croissance, également impliqués dans la
transduction des signaux en amont ou en aval des kinases.
Dans tous ces cas, une inhibition sélective de l'action
des kinases laisse espérer un effet bénéfique.
Le récepteur de type 1 pour l'insulin-like growth
factor (IGF-I-R) est un récepteur transmembranaire à
activité tyrosine kinase qui se lie en premier lieu à
l'IGFI mais aussi à l'IGFII et à l'insuline avec une plus
faible affinité. La liaison de l'IGF1 à son récepteur
entraîne une oligomérisation du récepteur, l'activation
de la tyrosine kinase, l'autophosphorylation
intermoléculaire et la phosphorylation de substrats
cellulaires (principaux substrats IRS1 et Shc). Le
récepteur activé par son ligand induit une activité
mitogènique dans les cellules normales. Cependant IGF-I-R
joue un rôle important dans la croissance dite anormale.
Plusieurs rapports cliniques soulignent le rôle
important de la voie IGF-I dans le développement des
cancers humains :
IGF-I-R est souvent trouvé sur-exprimé dans de
nombreux types tumoraux (sein, colon, poumon, sarcome,
prostate, myelome multiple) et sa présence est souvent
associée à un phénotype plus agressif.
De fortes concentrations d'IGF1 circulant sont
fortement corrélées à un risque de cancer de la prostate,
poumon et sein.
De plus, il a été largement documenté que IGF-I-R
est nécessaire à l'établissement et au maintient du
phénotype transformé in vitro comme in vivo[Baserga R,
Exp. Cell. Res., 1999, 253, pages 1-6]. L'activité kinase
d'IGF-I-R est essentielle à l'activité de transformation
de plusieurs oncogènes: EGFR, PDGFR, l'antigène grand T
du virus SV40, Ras activé, Raf, et v-Src. L'expression
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
4
d'IGF-I-R dans des fibroblastes normaux induit un
phénotype néoplasique, qui peut ensuite entraîner la
formation de tumeur in vivo. L'expression d'IGF-I-R joue
un rôle important dans la croissance indépendante du
substrat. IGF-I-R a également été montré comme un
protecteur dans l'apoptose induite par chimiothérapie-,
radiation-, et l'apoptose induite par des cytokines. De
plus, l'inhibition d'IGF-I-R endogène par un dominant
négatif, la formation de triple hélice ou l'expression
d'un antisens provoque une suppression de l'activité
transformante in vitro et la diminution de la croissance
de tumeurs dans les modèles animaux.
Parmi les kinases pour lesquelles une modulation de
l'activité est recherchée, FAK (Focal Adhesion Kinase)
est également une kinase préférée.
FAK est une tyrosine kinase cytoplasmique jouant un
rôle important dans la transduction du signal transmis
par les intégrines, famille de récepteurs
hétérodimériques de l'adhésion cellulaire. FAK et les
intégrines sont colocalisés dans des structures
périmembranaires appelées plaques d'adhérence. Il a été
montré dans de nombreux types cellulaires que
l'activation de FAK ainsi que sa phosphorylation sur des
résidus tyrosine et en particulier son
autophosphorylation sur la tyrosine 397 étaient
dépendantes de la liaison des intégrines à leurs ligands
extracellulaires et donc induites lors de l'adhésion
cellulaire [Kornberg L, et al. J. Biol. Chem. 267(33) .
23439-442 (1992)]. L'autophosphorylation sur la tyrosine
397 de FAK représente un site de liaison pour une autre
tyrosine kinase, Src, via son domaine SH2 [Schaller et
al. Mol. Cell. Biol. 14 : 1680-1688 1994; Xing et al.
Mol. Cell. Biol. 5 413-421 1994]. Src peut alors
phosphoryler FAK sur la tyrosine 925, recrutant ainsi la
protéine adaptatrice Grb2 et induisant dans certaines
cellules l'activation de la voie ras et MAP Kinase
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
impliquée dans le contrôle de la prolifération cellulaire
[Schlaepfer et al. Nature; 372 : 786-791 1994; Schlaepfer
et al. Prog. Biophy. Mol. Biol. 71 : 435-478 1999;
Schlaepfer and Hunter, J. Biol. Chem. 272 : 13189-13195
5 19971.
L'activation de FAK peut aussi induire la voie de
signalisation jun NH2-terminal kinase (JNK) et résulter
dans la progression des cellules vers la phase Gi du
cycle cellulaire [Oktay et al., J. Cell. Biol.145 : 1461-
1469 1999]. Phosphatidylinositol-3-OH kinase (P13-kinase)
se lie aussi à FAK sur la tyrosine 397 et cette
interaction pourrait être nécessaire à l'activation de
P13-kinase [Chen and Guan, Proc. Nat. Acad. Sci. USA. 91
: 10148-10152 1994; Ling et al. J. Cell. Biochem. 73 :
533-544 1999]. Le complexe FAK/Src phosphoryle différents
substrats comme la paxilline et p130CAS dans les
fibroblastes [Vuori et al. Mol. Cell. Biol. 16 : 2606-
2613 1996].
Les résultats de nombreuses études soutiennent
l'hypothèse que les inhibiteurs de FAK pourraient être
utiles dans le traitement du cancer. Des études ont
suggéré que FAK pourrait jouer un rôle important dans la
prolifération et/ou la survie cellulaire in vitro. Par
exemple, dans les cellules CHO, certains auteurs ont
démontré que la surexpression de p125FAK conduit à une
accélération de la transition G1 à S, suggérant que
p125FAK favorise la prolifération cellulaire [Zhao J.-H
et al. J. Cell Biol. 143 1997-2008 1998]. D'autres
auteurs ont montré que des cellules tumorales traitées
avec des oligonucléotides anti-sens de FAK perdent leur
adhésion et entrent en apoptose (Xu et al, Cell Growth
Differ. 4: 413-418 1996). Il a également été démontré
que FAK promeut la migration des cellules in vitro.
Ainsi, des fibroblastes déficients pour l'expression de
FAK (souris knockout pour FAK) présentent une
morphologie arrondie, des déficiences de migration
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
6
cellulaire en réponse à des signaux chimiotactiques et
ces défauts sont supprimés par une réexpression de FAK
[DJ. Sieg et al., J. Cell Science. 112 : 2677-91 1999].
La surexpression du domaine C-terminal de FAK (FRNK)
bloque l'étirement des cellules adhérentes et réduit la
migration cellulaire in vitro [Richardson A. and Parsons
J.T. Nature. 380 : 538-540 1996]. La surexpression de FAK
dans des cellules CHO, COS ou dans des cellules
d'astrocytome humain favorise la migration des cellules.
L'implication de FAK dans la promotion de la
prolifération et de la migration des cellules dans de
nombreux types cellulaires in vitro, suggère le rôle
potentiel de FAK dans les processus néoplasiques. Une
étude récente a effectivement démontré l'augmentation de
la prolifération des cellules tumorales in vivo après
induction de l'expression de FAK dans des cellules
d'astrocytome humain [Cary L.A. et al. J. Cell Sci. 109 :
1787-94 1996; Tnlang D et al. J. Cell Sci. 113 : 4221-4230
2000]. De plus, des études immunohistochimiques de
biopsies humaines ont démontré que FAK était surexprimé
dans les cancers de la prostate, du sein, de la thyroïde,
du colon, du mélanome, du cerveau et du poumon, le niveau
d'expression de FAK étant directement corrélé aux tumeurs
présentant le phénotype le plus agressif [Weiner TM, et
al. Lancet. 342 (8878) : 1024-1025 1993; Owens et al.
Cancer Research. 55 : 2752-2755 1995; Maung K. et al.
Oncogene 18 : 6824-6828 1999; Wang D et al. J. Cell Sci.
113 : 4221-4230 20001.
La protéine kinase AKT (également connue sous le nom
de PKB) et la phosphoinositide 3-kinase (PI3K) sont
impliqués dans une voie de signalisation cellulaire qui
transmet des signaux venant de facteurs de croissance
activant des récepteurs membranaires.
Cette voie de transduction est impliquée dans de
multiples fonctions cellulaires: régulation de
l'apoptose, contrôle de la transcription et de la
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
7
traduction, métabolisme du glucose, angiogénèse et
intégrité mitochondriale. Identifié d'abord comme un
acteur important dans les voies de signalisation
insulino-dépendantes régulant des réponses métaboliques,
la sérine/thréonine kinase AKT a ensuite été identifiée
comme un médiateur jouant un rôle clé dans la survie
induite par des facteurs de croissance. Il a été montré
qu'AKT pouvait inhiber la mort par apoptose induite par
des stimuli variés, dans un certain nombre de types
cellulaires et de cellules tumorales. En accord avec ces
constatations, il a été montré qu'AKT pouvait, par
phosphorylation de résidus sérine donnés, inactiver BAD,
GSK3(3, caspase-9, le facteur de transcription Forkhead et
activer IKKalpha et e-NOS. Il est intéressant de noter
que la protéine BAD est retrouvée hyper-phosphorylée dans
11 lignées cellulaires humaines tumorales sur 41
étudiées. De plus, il a été montré que l'hypoxie modulait
l'induction du VEGF dans des cellules transformées par
Ha-ras en activant la voie PI3K/AKT et en impliquant la
séquence de fixation du facteur de transcription HIF-1
(hypoxia inducible factor-1) appelé HRE pour hypoxy-
responsive-element .
AKT joue un rôle très important dans les pathologies
cancéreuses. L'amplification et/ou la surexpression d'AKT
a été rapportée dans de nombreuses tumeurs humaines comme
le carcinome gastrique (amplification d'AKT1), les
carcinomes de l'ovaire, du sein ou du pancréas
(amplification et surexpression d'AKT2) et les carcinomes
du sein déficients en récepteurs aux oestrogènes ainsi
que les carcinomes de la prostate indépendants des
androgènes (surexpression d'AKT3). De plus, AKT est
activée constitutivement dans toutes les tumeurs PTEN
(-/-), la phosphatase PTEN étant délétée ou inactivée par
des mutations dans de nombreux types de tumeurs comme les
carcinomes de l'ovaire, de la prostate, de l'endomètre,
les glioblastomes et les mélanomes. AKT est également
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
8
impliqué dans l'activation oncogénique de bcr-abl
(Références : Khawaja A., Nature 1999, 401, 33-34;
Cardone et al. Nature 1998, 282, 1318-1321; Kitada S. et
al., Am J Pathol 1998 Jan; 152 (1) : 51-61; Mazure NM et
al. Blood 1997, 90, 3322-3331; Zhong H. et al. Cancer
Res. 2000, 60, 1541-1545).
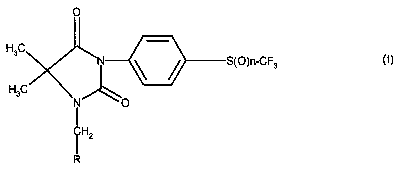
La présente invention a pour objet les produits de
formule générale (I):
0
Ra
N \ / S(O)n-CF3
Rb
O
HZ (I)
R
dans laquelle:
n représente l'entier 0 ou 2
Ra et Rb représentent CH3 ou forment ensemble avec
l'atome de carbone auxquels ils sont liés un radical
cycloalkyle,
R représente un radical pyridyle ou pyrimidinyle
substitués par un radical NR1R2,
NR1R2 étant tel que :
l'un de R1 et R2 représente un atome d'hydrogène ou un
radical alkyle, et l'autre de R1 et R2 est choisi parmi
l'atome d'hydrogène et les radicaux alkyle éventuellement
substitués par un radical choisi parmi les radicaux
hydroxyle, alcoxy, aziridyle, azétidinyle, pyrrolidinyle,
pipéridyle, morpholinyle, et pipérazinyle lui-même
éventuellement substitué sur son deuxième atome d'azote
par un radical alkyle; les radicaux cycloalkyle,
hétérocycloalkyle, aryle et hétéroaryle éventuellement
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
9
substitués; et le radical CO-R3 avec R3 choisi parmi
NR4R5 et les radicaux alcoxy, hétérocycloalkyle, aryle,
aryloxy et hétéroaryle, éventuellement substitués;
R4 et R5, identiques ou différents de R1 et R2, sont tels
que .
soit l'un de R4 et R5 représente un atome d'hydrogène ou
un radical aikyle, et l'autre de R4 et R5 est choisi
parmi l'atome d'hydrogène et les radicaux alkyle
éventuellement substitués par un radical choisi parmi les
radicaux hydroxyle, alcoxy, aziridyle, azétidinyle,
pyrrolidinyle, pipéridyle, morpholinyle, et pipérazinyle
lui-même éventuellement substitué sur son deuxième atome
d'azote par un radical alkyle; les radicaux cycloalkyle,
hétérocycloalkyle, aryle et hétéroaryle éventuellement
substitués;
soit R4 et R5 forment, avec l'atome d'azote auquel ils
sont attachés, une amine cyclique renfermant
éventuellement un autre hétéroatome choisi parmi N et O,
éventuellement substituée,
tous les radicaux ci-dessus aryle, phényle, aryloxy, et
hétéroaryle ainsi que l'amine cyclique NR4R5, étant
éventuellement substitués par un à trois radicaux
identiques ou différents choisis parmi les atomes
d'halogène, les radicaux aikyle, phényle, NH2, NH.Alk,
N(Alk)2, CO-NHAAlk et CO-N(Alk)2;
lesdits produits de formule (I) étant sous toutes les
formes isomères possibles racémiques, énantiomères et
diastéréo-isomères, ainsi que les sels d'addition avec
les acides minéraux et organiques ou avec les bases
minérales et organiques desdits produits de formule (I).
On peut noter que lorsque Ra et Rb forment ensemble avec
l'atome de carbone auxquels ils sont liés un radical
cycloalkyle, ce radical est notamment cyclopropyle.
La présente invention a ainsi pour objet les produits de
formule (I) tels que définis ci-dessus:
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
O
H3'i
N -S(O)n-CF3
5
H3C
N O
H2 (~)
R
dans laquelle:
n représente l'entier 0 ou 2,
Ra et Rb représentent CH3,
R représente un radical pyridyle ou pyrimidinyle
substitués par un radical NR.1R2,
N.R.1R2 étant tel que :
l'un de R1 et R2 représente un atome d'hydrogène ou un
radical alkyle, et l'autre de R1 et R2 est choisi parmi
l'atome d'hydrogène et les radicaux alkyle éventuellement
substitués par un radical choisi parmi les radicaux
hydroxyle, alcoxy, aziridyle,azétidinyle, pyrrolidinyle,
pipéridyle, morpholinyle, ou pipérazinyle lui-même
éventuellement substitué sur son deuxième atome d'azote
par un radical alkyle; les radicaux cycloalkyle,
hétérocycloalkyle, phényle, pyrimidinyle et pyridyle,
éventuellement substitués; et le radical CO-R3 avec R3
choisi parmi NR4R5 et les radicaux alcoxy, pipéridyle,
phényle,et phénoxy éventuellement substitués;
R4 et R5, identiques ou différents de R1 et R2, sont tels
que :
soit l'un de R4 et R5 représente un atome d'hydrogène ou
un radical alkyle, et l'autre de R4 et R5 est choisi
parmi l'atome d'hydrogène et les radicaux alkyle
éventuellement substitués par un radical choisi parmi les
radicaux hydroxyle, alcoxy, aziridyle,azétidinyle,
pyrrolidinyle, pipéridyle, morpholinyle, ou pipérazinyle
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
11
lui-même éventuellement substitué sur son deuxième atome
d'azote par un radical alkyle; les radicaux cycloalkyle,
hétérocycloalkyle, phényle, pyrimidinyle et pyridyle,
éventuellement substitués; soit R4 et R5 forment, avec
l'atome d'azote auquel ils sont attachés, une amine
cyclique renfermant éventuellement un autre hétéroatome
choisi parmi N et 0, éventuellement substituée,
tous les radicaux phényle, pyrimidinyle et pyridyle ci-
dessus, étant éventuellement substitués par un à trois
radicaux identiques ou différents choisis parmi les
atomes d'halogène, les radicaux alkyle, phényle, NH2,
NHAlk, N(Alk)2, CO-NHAlk et CO-N(Alk)2;
lesdits produits de formule (I) étant sous toutes les
formes isomères possibles racémiques, énantiomères et
diastéréo-isomères, ainsi que les sels d'addition avec
les acides minéraux et organiques ou avec les bases
minérales et organiques desdits produits de formule (I).
Dans les produits de formule (I) et dans ce qui
suit, les termes indiqués ont les significations qui
suivent :
- le terme 'Hal', "Halo ou halogène désigne les
atomes de fluor, de chlore, de brome ou d'iode et de
préférence fluor et chlore
- le terme radical alkyle ou alk désigne un radical
linéaire ou ramifié renfermant au plus 12 atomes de
carbone choisi parmi les radicaux méthyle, éthyle,
propyle, isopropyle, butyle, isobutyle, sec-butyle, tert-
butyle, pentyle, isopentyle, sec-pentyle, tert-pentyle,
néo-pentyle, hexyle, isohexyle, sec-hexyle, tert-hexyle
et également heptyle, octyle, nonyle, décyle, undécyle et
dodécyle, ainsi que leurs isomères de position linéaires
ou ramifiés,
On cite plus particulièrement les radicaux alkyle
ayant au plus 6 atomes de carbone et notamment les
radicaux méthyle, éthyle, propyle, isopropyle, n-butyle,
isobutyle, terbutyle, pentyle linéaire ou ramifié, hexyle
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
12
linéaires ou ramifiés.
- le terme radical alcoxy désigne un radical
linéaire ou ramifié renfermant au plus 12 atomes de
carbone et préférentiellement 6 atomes de carbone choisi
par exemple parmi les radicaux méthoxy, éthoxy, propoxy,
isopropoxy, butoxy linéaire, secondaire ou tertiaire,
pentoxy, hexoxy et heptoxy ainsi que leurs isomères de
position linéaires ou ramifiés.
- le terme radical cycloalkyle désigne un radical
carbocyclique monocyclique ou bicyclique renfermant de 3
à 10 chaînons et désigne notamment les radicaux cyclo-
propyle, cyclobutyle, cyclopentyle et cyclohexyle,
- Le terme radical acyle ou -CO-r désigne un radical
linéaire ou ramifié renfermant au plus 12 atomes de
carbone dans lequel le radical r représente un radical
alkyle, cycloalkyle, hétérocycloalkyle, aryle ou
hétéroaryle, ces radicaux ayant les valeurs indiquées ci-
dessus et étant éventuellement substitués comme indiqué
ci-dessus: on cite par exemple les radicaux formyle,
acétyle, propionyle, butyryle ou benzoyle, ou encore
valéryle, hexanoyle, acryloyle, crotonoyle ou carbamoyle.
On note que le radical CO-R3 peut notamment prendre les
valeurs définies ci-dessus pour -CO-r.
- le terme radical aryle désigne les radicaux
insaturés, monocycliques ou constitués de cycles
condensés, carbocycliques. Comme exemples de tel radical
aryle, on peut citer les radicaux phényle ou naphtyle,
On cite plus particuliêrement le radical phényle.
Le radical aryloxy désigne un radical 0-aryle dans
lequel le radical aryle a la signification indiquée ci-
dessus.
Le terme radical hétérocycloalkyle désigne un
radical carbocylique saturé constitué au plus de 7
chaînons interrompus par un ou plusieurs hétéroatomes,
identiques ou différents, choisis parmi les atomes
d'oxygène, d'azote ou de soufre : comme radicaux
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
13
hétérocycloalkyles, on peut citer notamment les radicaux
dioxolane, dioxane, dithiolane, thiooxolane, thiooxane,
oxirannyle, oxolannyle, dioxolannyle, pipérazinyle,
pipéridinyle, pyrrolidinyle, imidazolidinyle,
pyrazolidinyle, morpholinyle ou encore tétrahydrofuryle,
tétrahydrothiényle, chromanyle, dihydrobenzofuranyle,
indolinyle, pipéridinyle, perhydropyranyle,
pyrindolinyle, tétrahydroquinoléinyle,
tétrahydroisoquinoléinyle ou thioazolidinyle, tous ces
radicaux étant éventuellement substitués.
Parmi les radicaux hétérocycloalkyles, on peut citer
plus particulièrement les radicaux pipérazinyle
éventuellement substitué, pipéridinyle éventuellement
substitué, pyrrolidinyle éventuellement substitué,
imidazolidinyle, pyrazolidinyle, morpholinyle ou
thioazolidinyle.
Le terme radical hétéroaryle désigne un radical
carbocylique partiellement ou totalement insaturé
constitué au plus de 7 chaînons interrompus par un ou
plusieurs hétéroatomes, identiques ou différents, choisis
parmi les atomes d'oxygène, d'azote ou de soufre : parmi
les radicaux hétéroaryles à 5 chaînons on peut citer les
radicaux furyle tel que 2-furyle, thiényle tel que 2-
thiényle et 3-thiényle, pyrrolyle, diazolyle, thiazolyle,
thiadiazolyle, thiatriazolyle, isothiazolyle, oxazolyle
oxadiazolyle, 3- ou 4-isoxazolyle, imidazolyle,
pyrazolyle, isoxazolyle. Parmi les radicaux hétéroaryles
à 6 chaînons on peut citer notamment les radicaux
pyridyle tel que 2-pyridyle, 3-pyridyle et 4-pyridyle,
pyrimidyle, pyrimidinyle, pyridazinyle, pyrazinyle et
tétrazolyle.
- Comme radicaux hétéroaryles condensés contenant au
moins un hétéroatome choisi parmi le soufre, l'azote et
l'oxygène, on peut citer par exemple benzothiényle tel
que 3-benzothiényle, benzofuryle, benzofurannyle,
benzopyrrolyle, benzimidazolyle, benzoxazolyle,
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
14
thionaphtyle, indolyle, purinyle, quinoléinyle,
isoquinoléinyle et naphtyridinyle.
Parmi les radicaux hétéroaryles condensés, on peut
citer plus particulièrement les radicaux benzothiényle,
benzofurannyle, indolyle ou quinoléinyle,
benzimidazolyle, benzothiazolyle, furyle, imidazolyle,
indolizinyle, isoxazolyle, isoquinolinyle, isothiazolyle,
oxadiazolyle, pyrazinyle, pyridazinyle, pyrazolyle,
pyridyle, pyrimidinyle, pyrrolyle, quinazolinyle, 1,3,4-
thiadiazolyle, thiazolyle, thiényle et groupes
triazolyle, ces radicaux étant éventuellement substitués
comme indiqué pour les radicaux hétéroaryles.
Le terme patient désigne les êtres humains mais
aussi les autres mammifères.
Le terme "Prodrug" désigne un produit qui peut être
transformé in vivo par des mécanismes métaboliques (tel
que l'hydrolyse) en un produit de formule (I). Par
exemple, un ester d'un produit de formule (I) contenant
un groupe hydroxyle peut être converti par hydrolyse in
vivo en sa molécule mère. ou encore un ester d'un produit
de formule (I) contenant un groupe carboxy peut être
converti par hydrolyse in vivo en sa molécule mère.
On peut citer à titre d'exemples des esters de
produits de formule (I) contenant un groupe hydroxyle
tels que les acétates, citrates, lactates, tartrates,
malonates, oxalates, salicylates, propionates,
succinates, fumarates, maléates, méthylene-bis-b-
hydroxynaphthoates, gentisates, iséthionates, di-p-
toluoyltartrates, méthanesulfonates, éthanesulfonates,
benzenesulfonates, p-toluènesulfonates,
cyclohexylsulfamates et quinates.
Des esters de produits de formule (I)
particulièrement utiles contenant un groupe hydroxyle
peuvent être préparés à partir de restes acides tels que
ceux décrits par Bundgaard et. al., J. Med. Chem., 1989,
32, page 2503-2507: ces esters incluent notamment des
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
(aminométhyl)-benzoates substitués, dialkylamino-
méthylbenzoates dans lesquels les deux groupements alkyle
peuvent être liés ensemble ou peuvent être interrompus
par un atome d'oxygène ou par un atome d'azote
5 éventuellement substitué soit un atome d'azote alkylé ou
encore des morpholino-méthyl)benzoates, e.g. 3- ou 4-
(morpholinométhyl)-benzoates, et (4-alkylpiperazin-1-
yl)benzoates, e.g. 3- ou 4-(4-alkylpiperazin-1-
yl)benzoates.
10 Le ou les radicaux carboxy des produits de formule
(I) peuvent être salifiés ou estérifiés par les
groupements divers connus de l'homme du métier parmi
lesquels on peut citer, à titre d'exemples non
limitatifs, les composés suivants.
15 - parmi les composés de salification, des bases
minérales telles que, par exemple, un équivalent de
sodium, de potassium, de lithium, de calcium, de
magnésium ou d'ammonium ou des bases organiques telles
que, par exemple, la méthylamine, la propylamine, la
triméthylamine, la diéthylamine, la triéthylamine, la
N,N-diméthyléthanolamine, le tris (hydroxyméthyl) amino
méthane, l'éthanolamine, la pyridine, la picoline, la
dicyclohexylamine, la morpholine, la benzylamine, la
procaine, la lysine, l'arginine, l'histidine, la N-
méthylglucamine,
- parmi les composés d'estérification, les radicaux
alkyle pour former des groupes alcoxy carbonyle tel que,
par exemple, méthoxycarbonyle, éthoxycarbonyle, tert-
butoxy-carbonyle ou benzyloxycarbonyle, ces. radicaux
alkyles pouvant être substitués par des radicaux choisis
par exemple parmi les atomes d'halogène, les radicaux
hydroxyle, alcoxy, acyle, acyloxy, alkylthio, amino ou
aryle comme, par exemple, dans les groupements
chlorométhyle, hydroxypropyle, méthoxy-méthyle,
propionyloxyméthyle, méthylthiométhyle, . diméthyl-
aminoéthyle, benzyle ou phénéthyle.
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
16
Par carboxy estérifié on entend par exemple les
radicaux tels que les radicaux alkyloxycarbonyle par
exemple méthoxycarbonyle, éthoxycarbonyle,
propoxycarbonyle, butyl ou tert-butyloxycarbonyle,
cyclobutyloxycarbonyle, cyclopentyloxycarbonyle ou
cyclohexyloxycarbonyle.
On peut également citer des radicaux formés avec les
restes esters facilement clivables tels que les radicaux
méthoxyméthyle, éthoxyméthyle; les radicaux acyloxyalkyle
tels que pivaloyloxyméthyle, pivaloyloxyéthyle, acétoxy-
méthyle ou acétoxyéthyle; les radicaux
alkyloxycarbonyloxy alkyle tels que les radicaux
méthoxycarbonyloxy méthyle ou éthyle, les radicaux
isopropyloxycarbonyloxy méthyle ou éthyle.
Une liste de tels radicaux esters peut-être trouvée
par exemple dans le brevet européen EP 0 034 536.
Par carboxy amidifié on entend les radicaux du type
-CONR4R5 dans lesquels les radicaux R4 et R5 ont les
significations indiquées ci-dessus.
Par radical alkylamino NHalk, on entend les radicaux
méthylamino, éthylamino, propylamino ou butylamino,
pentylamino ou hexylamino, linéaires ou ramifiés. On
préfère les radicaux alkyle ayant au plus 4 atomes de
carbone, les radicaux alkyle peuvent être choisis parmi
les radicaux alkyle cités ci-dessus.
Par radical dialkylamino N(alk)2, on entend les
radicaux dans lesquels alk prend les valeurs définis ci-
dessus : comme précédemment on préfère les radicaux
alkyle ayant au plus 4 atomes de carbone choisis dans la
liste indiquée ci-dessus. On peut citer par exemple lés
radicaux diméthylamino, diéthylamino, méthyléthylamino.
Le terme amine cyclique désigne un radical cycloalkyle
renferma.nt de 3 à 8 chaînons dans lequel un atome de
carbone est remplacé par un atome d'azote, le radical
cycloalkyle ayant la signification indiquée ci-dessus et
pouvant renfermer aussi un ou plusieurs autres
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
17
hétéroatomes choisi parmi O, S, S02, N ou NR3 avec R3 tel
que défini ci-dessus : comme exemples de telles amines
cycliques, on peut citer par exemple les radicaux
aziridyle, azétidinyle, pyrrolidinyle, pipéridinyle,
morpholinyle, pipérazinyle, indolinyle, pyrindolinyle ou
tétrahydroquinoléinyle, éventuellement substitués : on
cite plus particulièreemnt les radicaux pyrrolidinyle,
pipéridinyle et morpholinyle.
Par carboxy salifié on entend les sels formés par
exemple avec un équivalent de sodium, de potassium, de
lithium, de calcium, de magnésium ou d'ammonium. On peut
également citer les sels formés avec les bases organiques
telles que la méthylamine, la propylamine, la
triméthylamine, la diéthylamine, la triéthylamine. On
préfère le sel de sodium.
Lorsque les produits de formule (I) comportent un
radical amino salifiable par un acide il est bien entendu
que ces sels d'acides font également partie de
l'invention. On peut citer les sels fournis avec les
acides chlorhydrique ou méthanesulfonique par exemple.
Les sels d'addition avec les acides minéraux ou
organi-ques des produits de formule (I) peuvent être, par
exemple, les sels formés avec les acides chlorhydrique,
bromhydrique, iodhydrique, nitrique, sulfurique,
phosphorique, propionique, acétique, trifluoroacétique,
formique, benzoïque, maléique, fumarique, succinique,
tartrique, citrique, oxalique, glyoxylique, aspartique,
ascorbique, les acides alcoylmonosulfoniques tels que par
exemple l'acide méthanesulfonique, l'acide
éthanesulfonique, l'acide propanesulfonique, les acides
alcoyldisulfoniques tels que par exemple l'acide
méthanedisulfonique, l'acide alpha, bêta-
éthanedisulfonique, les acides arylmonosulfoniques tels
que l'acide benzènesulfonique et les acides
aryldisulfoniques.
On peut rappeler que la stéréoisomérie peut étre
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
18
définie dans son sens large comme l'isomérie de composés
ayant mêmes formules développées, mais dont les
différents groupes sont disposés différemment dans
l'espace, tels que notamment dans des cyclohexanes
monosubstitués dont le substituant peut être en position
axiale ou équatoriale, et les différentes conformations
rotationnelles possibles des dérivés de l'éthane.
Cependant, il existe un autre type de stéréoisomérie, dû
aux arrangements spatiaux différents de substituants
fixés, soit sur des doubles liaisons, soit sur des
cycles, que l'on appelle souvent isomérie géométrique ou
isomérie cis-trans. Le terme stéréoisomère est utilisé
dans la présente demande dans son sens le plus large et
concerne donc l'ensemble des composés indiqués ci-dessus.
L'invention a notamment pour objet les produits de
formule (I) telle que définie ci-dessus dans laquelle
n représente l'entier 0 ou 2
R représente un radical pyridyle ou pyrimidinyle
substitués par un radical NR1R2,
NR1R2 étant tel que Rl représente un atome d'hydrogène ou
un radical alkyle, et R2 est choisi parmi l'atome
d'hydrogène et les radicaux alkyle éventuellement
substitué par un radical hydroxyle, aziridyle,
azétidinyle, pyrrolidinyle, pipéridyle, morpholinyle, ou
pipérazinyle lui-même éventuellement substitué sur son
deuxième atome d'azote par un radical alkyle; les
radicaux cycloalkyle renfermant 3 à 6 chaînons; le
radical phényle éventuellement substitué; le radical
pyrimidinyle; le radical pyridyle éventuellement
substitué par un atome d'halogène; et le radical CO-R3
avec R3 choisi parmi NR4R5 et les radicaux alcoxy,
pipéridyle et phényle éventuellement substitué;
R4 et R5, identiques ou différents de R1 et R2, sont tels
que .
soit l'un de R4 et R5 représente un atome d'hydrogène ou
un radical alkyle, et l'autre de R4 et R5 est choisi
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
19
l'atome d'hydrogène et les radicaux aikyle éventuellement
substitués par un radical hydroxyle, aziridyle,
azétidinyle, pyrrolidinyle, pipéridyle, morpholinyle, ou
pipérazinyle lui-même éventuellement substitué sur son
deuxième atome d'azote par un radical alkyle; les
radicaux cycloalkyle renfermant 3 à 6 chaînons; le
radical phényle éventuellement substitué; le radical
pyrimidinyle; le radical pyridyle éventuellement
substitué par un atome d'halogène;
soit R4 et R5 forment avec l'atome d'azote auquel ils
sont liés un radical aziridyle, azétidinyle,
pyrrolidinyle, pipéridyle, morpholinyle, ou pipérazinyle
lui-même éventuellement substitué sur son deuxième atome
d'azote par un radical alkyle,
tous les radicaux phényle étant éventuellement substitué
par un à trois radicaux identiques ou différents choisis
parmi les atomes d'halogène, les radicaux alkyle et les
radicaux CO-NHAlk et CO-N(Alk)2;
lesdits produits de formule (I) étant sous toutes les
formes isomères possibles racémiques, énantiomères et
diastéréo-isomères, ainsi que les sels d'addition avec
les acides minéraux et organiques ou avec les bases
minérales et organiques desdits produits de formule (I).
L'invention a notamment pour objet les produits de
formule (I) telle que définie ci-dessus dans laquelle
n représente l'entier 0 ou 2
R représente un radical pyridyle ou pyrimidinyle
substitués par un radical NR1R2,
NR1R2 étant tel que R1 représente un atome d'hydrogène ou
un radical alkyle renfermant un ou deux atomes de
carbone, et R2 est choisi parmi les radicaux alkyle
renfermant 1 à 4 atomes de carbone éventuellement
substitué par un radical hydroxyle; le radical phényle
éventuellement substitué; le radical pyrimidinyle; le
radical pyridyle éventuellement substitué par un atome
d'halogène; et le radical CO-R3 avec R3 choisi parmi
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
pipéridyle, phényle éventuellement substitué, NH(alk) et
N(alk)2; tous les radicaux phényle étant éventuellement
substitués par un à trois radicaux identiques ou
différents choisis parmi les atomes d'halogène, les
5 radicaux alkyle et les radicaux CO-NHAAlk et CO-N(Alk)2;
lesdits produits de formule (I) étant sous toutes les
formes isomères possibles racémiques, énantiomères et
diastéréo-isomères, ainsi que les sels d'addition avec
les acides minéraux et organiques ou avec les bases
10 minérales et organiques desdits produits de formule (I).
L'invention a notamment pour objet les produits de
formule (I) telle que définie ci-dessus dans laquelle
n représente l'entier 0 ou 2
R représente un radical pyridyle ou pyrimidinyle
15 substitués par un radical NR1R2,
dans lequel R1 représente un atome d'hydrogène et R2
représente un radical isopropyle substitué par un radical
hydroxyle; un radical phényle éventuellement substitué;
un radical pyrimidinyle; un radical pyridyle
20 éventuellement substitué par un atome de fluor; ou un
radical CO-R3 avec R3 choisi parmi pipéridyle, phényle
éventuellement substitué, NHCH3 et N(CH3)2; tous les
radicaux phényle étant éventuellement substitués par un à
trois radicaux identiques ou différents choisis parmi les
atomes de chlore et de fluor, le radical méthyle et le
radical CO-N(CH3)2;
lesdits produits de formule (I) étant sous toutes les
formes isomères possibles racémiques, énantioméres et
diastéréo-isomères, ainsi que les sels d'addition avec
les acides minéraux et organiques ou avec les bases
minérales et organiques desdits produits de formule (I).
L'invention a notamment pour objet les produits de
formule (I) tels que définis ci-dessus dans laquelle
n,Ra, Rb et R ont les significations indiquées à l'une
quelconque des revendications précédentes,
dans lesquelles les radicaux NR1R2 ou NR4R5 ou bien NR1R2
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
21
et NR4R5 sont choisis parmi les radicaux suivants nommés
ex 18 à ex 40:
H N ~ N
a H2N~ H N N H2N
a
ex 18 ex 19 ex 20 ex 21
H2N H2N N HZN
~ --0 H
ex 22 ex 23 ex 24 ex 25
H
N N
N HN
U E '-' ~ % ~
C~ O N
ex 26 ex 27 ex 28 ex 29 ex 30
~N
O
HZN"~N HZN- ~N H N
2
ex 31 ex 32 ex 33
HN HN HN H 2 N
ex34 ex35 ex36 ex37
H 2 N~~N\ H2N~~N/ H2N N\
(
ex 38 ex 39 ex 40
lesdits produits de formule (I) étant sous toutes les
formes isomères possibles racémiques, énantiomères et
diastéréo-isomères, ainsi que les sels d'addition avec
les acides minéraux et organiques ou avec les bases
minérales et organiques desdits produits de formule (I)..
La présente invention a notamment pour objet les produits
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
22
de formule (I)appartenant à la formule (I) tels que
définis ci-dessus dans laquelle le radical NR1R2 est
choisi parmi les valeurs ex 18 à ex 40 :
La présente invention a notamment pour objet les produits
de formule (I) telle que définie ci-dessus appartenant à
la formule (Ia):
FF
F~ S(O) n
N~O
O N
O
NOk NR4
H 1
R5
(la)
dans laquelle n et NR4R5 ont les définitions indiquées
ci-dessus et notamment NR4R5 est choisi parmi les valeurs
ex 18 à ex 40 définies ci-dessus,
lesdits produits de formule (Ia) étant sous toutes les
formes isomères possibles racémiques, énantiomères et
diastéréo-isomères, ainsi que les sels d'addition avec
les acides minéraux et organiques ou avec les bases
minérales et organiques desdits produits de formule (Ia).
Parmi les produits préférés de l'invention, on peut citer
plus précisément les produits de formule (I) telle que
définie ci-dessus dont les noms suivent :
- le 1-({2-[(2,5-dichlorophényl)amino]pyridin-4-
yl}méthyl)-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
- le N-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-i-
yl)méthyl]pyridin-2-yl}pipéridine-l-carboxamide
- le 3,4-dichloro-N-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
23
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}benzamide
- le i-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-3-méthylurée
- le 1-({2-[(2,5-difluorophényl)amino]pyridin-4-
yl}méthyl)-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
- le 3,5-dichloro-N-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}benzamide
- le 2-chloro-N-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-l-
yl)méthyl]pyridin-2-yl}-6-fluoro-3-méthylbenzamide
- le 3-({4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}amino)-N,N-diméthylbenzamide
- le 1- [ (2-{ [ (1R) -2-hydroxy-l-
méthyléthyl]amino}pyrimidin-4-yl)méthyl]-5,5-diméthyl-3-
{4-[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-
dione
- le 3-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyrimidin-2-yl}-1,1-diméthylurée
- le 5,5-diméthyl-l-{[2-(pyridin-3-ylamino)pyrimidin-4-
yl]méthyl}-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
- le 3-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidin-1-
yl)méthyl]pyrimidin-2-yl}-1,1-diméthylurée
- le 5,5-diméthyl-1-{[2-(pyrimidin-5-ylamino)pyridin-4-
yl]méthyl}-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
- le 5,5-diméthyl-l-{[2-(pyrimidin-5-ylamino)pyridin-4-
yl]méthyl}-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
24
- le 5,5-diméthyl-l-{[2-(pyrimidin-5-ylamino)pyrimidin-4-
yl]méthyl}-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
- le 5,5-diméthyl-1-{[2-(pyrimidin-5-ylamino)pyrimidin-4-
yl]méthyl}-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
- le 1-({2-[(5-fluoropyridin-3-yl)amino]pyridin-4-
yl}méthyl)-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
lesdits produits de formule (I) étant sous toutes les
formes isomères possibles racémiques, énantiomères et
diastéréo-isomères, ainsi que les sels d'addition avec
les acides minéraux et organiques ou avec les bases
minérales et organiques desdits produits de formule (I).
Les produits de formule (I) selon la présente invention
peuvent être préparés selon les méthodes usuelles connues
de l'homme du métier.
Les produits de formule (I) selon la présente invention
peuvent être préparés par l'application ou l'adaptation
de méthodes connues et notamment des méthodes décrites
dans la littérature comme par exemple celles décrites par
R.C.Larock dans: Comprehensive Organic Transformations,
VCH publishers, 1989.
Les produits selon la présente invention peuvent
notamment être préparés comme indiqué dans le Schéma
Général 1, le Schéma Général 2 et le Schéma Général 3 ci-
dessous.
Les préparations des exemples de la présente invention
donnent des illustrations des Schémas ci-dessous.
De tels schémas de synthèse font partie de la présente
invention : la présente invention a ainsi également pour
objet les procédés de préparation des produits de formule
(I) tels que définis dans le Schéma Général 1, constitué
du Schéma Général 1A et du Schéma Général 1B, le Schéma
Général 2 et le Schéma Général 3 ci-dessus.
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
Schéma Général 1A:
O H HO
, N NaBH4 ~H (O)nCF3
N~~ I
sociz B o~o
R2-Br N
Ci (O)nCF3 (O)nCF3 (O)nCF3 ~
)nCF3 N G ~ I I Pd NN-R2
O~~O mCPBA O~O NHaOH OyNy O ~ H
N N N T\ N R4N=C=O
O N O NaH, DMF CH2CI2, MeOH ~N Dioxane i-~. )nCF3
N
H Q NH
F O 1 1-i 1S'O z
O~~yO
~NHZ G
RZ HZ N
(O)nCF3 diphosgene (O)nCF3 (O)nCF3
(1, /r O
HN-R4
N NHz O N~O
K
0 D BH3 N
E Q
NH
R2
L
5
Dans le Schéma Général 1A
L'alcool B peut être obtenu par le traitement de
l'aldéhyde A par un agent réducteur tel que le borhydrure
de sodium, dans un solvant tel que le méthanol à une
10 température comprise entre 0 C et 60 C comme par exemple
dans les conditions décrites par Wang, E. et coll.
(Heterocycles 2002, 57(11), 2021-2033.).
Le produit chloré C peut être obtenu à partir de
L'alcohol B, comme dans les conditions décrites par
15 Fucase K. et coll. (Tetrahedron Lett, 1991, 32(32), 4019-
4022) par traitement avec du chlorure de thionyle en
présence du DMF dans un solvant tel que le
dichlorométhane à une température comprise entre 0 C et
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
26
20 C.
L'isocyanate E peut être obtenu à partir des anilines D
par traitement avec le diphosgene dans un solvent tel que
le dioxane ou le toluène comme par exemple dans les
conditions décrites par Francis, J. E et coll. (J.
Med. Chem. (1991), 34(1), 281-90)
L'hydantoine F peut être obtenue à partir de l'isocyanate
E par réaction avec le methyl 2,2-dimethyl glycinate dans
un solvent tel que le toluene ou le N,N-diméthylformamide
à une température comprise entre 20 C et le reflux du
solvent comme décrit par exemple par Brana M. F. (J. Het.
Chem. (2002), 39(2), 417-420.
Le produit G peut être préparé par réaction des produits
F et C avec de l'hydrure de sodium dans le
terahydrofurane ou le N,N-dimethylformamide à une
température comprise entre 0 C et 60 C tel que décrit
par Johnson T. A. et coll. (J. Am. Chem. Soc. (2002),
124, 11689-11698)
Le produit de formule générale H peut être préparé soit
par réaction de G avec de l'acide metachloro perbenzoic
dans des solvents tels que un mélange dichloromethane
methanol (90 :10; v/v) ou le dichloro-1,2-ethane à des
températures comprises entre 0 C et 60 c tel que décrit
par Jeong, I. H. et coil. (Buil Korean Chem Soc (2002),
23 (12), 1823-1826).
Soit par réaction de F avec P (schéma général 1B) en
présence d'hydrure de sodium dans le terahydrofurane ou
le N,N-dimethylformamide à une température comprise entre
0 C et 60 C tel que décrit pour la préparation du composé
G.
Les produits de formule générale I et L peuvent être
préparés par réaction de H avec de l'ammoniac en solution
dans l'eau et/ou le dioxane ou avec une amine (RNH2) en
solution dans le dioxane en tube scelle au micro-onde ou
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
27
en chauffant à des températures comprises entre 40 C et
150 C ou tel que décrit par Font, Det coll.(Synthesis
(2002), (13), 1833-1842).
Les produits de formule J peuvent être préparés à partir
de I par réaction avec un bromure d'aryle ou
d'héteroaryle (R2-Br) en présence d'un catalyseur à base
de palladium tel que l'acétate de palladium et d'un
ligand tel que le Xantphos (9,9-diméthyl-4,5-
bis(diphénylphosphino)xanthene) dans un solvent tel que
le toluene, le dioxane ou le tert-butanol comme par
exemple dans les conditions décrites par BUCHWALD, S. L.
et coll. (J. Org. Chem. 2001, 66 (8), 2560-2565).
Les produits de formule générale K peuvent être obtenus
par réaction de I avec un isocyanate (R4-N=C=O) en
utilisant les méthodes usuelles connues de l'homme du
métier.
Schéma Général iB:
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
28
HO OTHP OTHP HO
mCPBA
1 0 ~O ~e- N1 ~-
N m g
ci )nCF, )nCF, (O)nCF3
~
)nCF,
p N~.O O NYO ::: H O N~O R2-Br O N O
O~y O NaH, DMF e Pd
N
~2
F H N O NjHZ
)nCF3 NL2
H H
H2N-R2
~
R4=N=C=O N
)nCF3
(O
i-2j
O
N
N H~H-R4
N
L K
Nj -~N-R2
H
Dans le Schéma Général IB
Les intermédiaires H pour lesquels n = 2 peuvent être
préparés tels que décrits dans le schéma général 1A et
les intermédiaires H pour lesquels n = 0 peuvent être
préparés tels que décrits dans le schéma général 1B
Le produit M peut être obtenu par traitement de l'alcool
B avec du 3,4-dihydro-2H-pyrane dans le dichlorométhane
en présence d'acide para-toluene sulfonique à une
température de 20 C tel que décrit par Greene T. W. et
coll. (protective groups in organic chemistry, John Wiley
& sons 1991, second edition).
Le produit N peut être préparé par oxydation du sulfur en
suivant les conditions décrites pour le produit H.
Le produit O peut être préparé par déprotection du
produit N tel que décrit par Greene T. W. et coll.
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
29
(protective groups in organic chemistry, John Wiley &
sons 1991, second edition)
Le produit P peut être préparé par halogénation de
l'alcool O tel que décrit dans la préparation du produit
C.
Schéma Général 2:
(O)nCF3 (O)nCF3
N CI R4
H2N O, R, O Ny O HN.R5 ON~O
NBS Q O N N
Br )nCF3 Pd micro-onde
N~u N-~,,î
)nCF3
H O_R' H N-R4
R N CI O N O T R5
O N'r O
NaH, DMF f~O Pd
H HZN~I
N N-R5
F Ci (O)nCF3 R4
~ R2-NH2
Pd O~N O
N~-R2
H
~
Dans le Schéma Général 2:
R' représente alkyle ou aryle tel que défini dans R3
Le produit R peut être préparé par bromation du produit Q
en présence de N-bromosuccinimide dans un solvent tel que
le tétrachlorure de carbone comme décrit par Brown, D.
J.et coll. (Aust J Chem (1974), 2251).
Le produit S peut être préparé à partir des produits R et
F tel que décrit dans la préparation du produit G.
Le produit T peut être préparé à partir de S par réaction
avec un carbamate (NH2COOR') en présence d'un catalyseur
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
à base de palladium tel que décrit dans la préparation de
J.
Le produit U peut être préparé soit par réaction du
carbamate T avec une amine dans un solvent tel que le N-
5 méthylpyrrolidinone ou le toluène à une température
comprise entre 50 C et la température de reflux du
solvent ou en micro-onde tel que décrit par Manov-
Yuvenskii V. I et coll. (Zh. Prikl. Khim. (1993), 66 (6),
1319-1327).
10 Soit à partir de S par réaction avec une urée
(NH2CONR4R5) en présence d'un catalyseur à base de
palladium tel que décrit dans la préparation de J.
Le produit J peunt être préparé à partir de S par
réaction avec une amine (R2-NH2) en présence d'un
15 catalyseur à base de palladium tel que l'acétate de
palladium et d'un ligand tel que le Xantphos dans un
solvent tel que le toluene, le dioxane ou le tert-butanol
comme par exemple dans les conditions décrites par
BUCHWALD, S. L. et coll. (J. Org. Chem. 2001, 66 (8),
20 2560-2565).
Schéma Général 3:
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
31
(O)nCF3 (O)nCF3
NaBHa p Np HN,R5 O~~ N N
?N~Cl R4
N Ci micro-onde
~ d\N/ ~
v SOCIZ HZNI,O.R, O N/N~
H
p OR~ e1-/~ N-R5
H
z R4
CI )nCF3 Pd
)nCF3 Pd
R5
X N CI p N'r p H2N~N=R4
O N O - :~ N O
r NaH, DMF
H R2-NH2 )nCF3
F y Ci
Pd
R3-CONH2 p Np
Cul N
)nCF3
N
N-R2
O N7--O H
~-N AB
~
N / R3 AC'.
N--~
H O
Dans le schéma Général 3
R' représente alkyl ou aryl tel que défini dans R3
L'alcool W peut étre préparé par réduction de l'ester V
avec un agent de réduction tel que le borohydrure de
sodium dans un solvent tel que l'ethanol à une
température comprise entre 20 C et la température de
reflux du solvent comme décrit para Zanka, A.et coll.
(Synlett (1999), (10), 1636-1638).
Le produit X est préparé par chloration de l'alcool W tel
que décrit dans la préparation de C.
Le produit Y peut être préparé à partir des produits F et
X en utilisant les conditions décrites pour la
préparation de G
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
32
Le produit z peut être préparé à partir du produit y et
du carbamate (NH2COOR') en utilisant les conditions
décrites pour la préparation de J
Le produit AA peut être préparé soit par réaction du
produit Z avec une amine (NHR4R5) comme dans les
conditions décrites pour le produit U
Soit par réaction du produit Y avec une urée (NH2CON'.R.4R5)
comme dans les conditions décrites pour le produit J
Le produit AB peut être préparé à partir du produit Y et
de l'amine (NH2R2) comme dans les conditions décrites
pour la préparation du produit J.
Le produit AC peut être préparé à partir du produit Y et
de l'amide (NH2COR3) en présence d'un catalyseur de
cuivre comme décrit par Buchwald S. L. et coll. (J. Am.
Chem. Soc. (2001), 123, 7727-7729)
Dans de telles préparations des produits de formule (I)
selon la présente invention, les produits de départ, les
intermédiaires et les produits de formule (I), qui
peuvent être sous forme protégée, peuvent être soumis ,
si nécessaire ou si désiré, à l'une ou plusieurs des
réactions de transformations suivantes, dans un ordre
quelconque :
a) une réaction d'estérification de fonction acide,
b) une réaction de saponification de fonction ester en
fonction acide,
c) une réaction d'oxydation de groupement alkylthio en
sulfoxyde ou sulfone correspondant,
d) une réaction de transformation de fonction cétone en
fonction oxime,
e) une réaction de réduction de la fonction carboxy libre
ou estérifié en fonction alcool,
f) une réaction de transformation de fonction alcoxy en
fonction hydroxyle, ou encore de fonction hydroxyle en
fonction alcoxy,
g) une réaction d'oxydation de fonction alcool en
fonction aldéhyde, acide ou cétone,
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
33
h) une réaction de transformation de radical nitrile en
tétrazolyle,
i) une réaction de réduction des composés nitrés èn
composés aminés,
j) une réaction d'élimination des groupements protecteurs
que peuvent porter les fonctions réactives protégées,
k) une réaction de salification par un acide minéral ou
organique ou par une base pour obtenir le sel
correspondant,
1) une réaction de dédoublement des formes racémiques en
produits dédoublés,
lesdits produits de formule (I) ainsi obtenus étant sous
toutes les formes isomères possibles racémiques,
énantiomères et diastéréoisomères.
On peut noter que de telles réactions de transformation
de substituants en d'autres substituants peuvent
également être effectuées sur les produits de départ
ainsi que sur les intermédiaires tels que définis ci-
dessus avant de poursuivre la synthèse selon les
réactions indiquées dans le procédé décrit ci-dessus.
Dans les réactions décrites ci-après, il peut être
nécessaire de protéger des groupes fonctionnels réactifs
tels que par exemple des groupements hydroxy, acyle,
carboxy libres ou encore amino et monoalkylamino, imino,
thio, .. qui peuvent donc être protégés par les
groupements protecteurs appropriés.
On peut utiliser des groupes protecteurs conventionnels
en accord avec les pratiques usuelles standard comme ceux
décrits par exemple par T.W. Greene and P.G.M.Wuts dans
"Protective Groups in Organic Chemistry" John Wiley and
Sons, 1991.
La liste suivante, non exhaustive, d'exemples de
protection de fonctions réactives peut être citée :
- les groupements hydroxyle peuvent être protégés par
exemple par les radicaux alkyle tels que tert-butyle,
triméthyl-silyle, tert-butyldiméthylsilyle,
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
34
méthoxyméthyle, tétrahydro-pyrannyle, benzyle ou acétyle,
- les groupements amino peuvent être protégés par exemple
par les radicaux acétyle, trityle, benzyle, tert-
butoxycarbonyle, benzyloxycarbonyle, phtalimido ou
d'autres radicaux connus dans la chimie des peptides,
- les groupements acyles tel que le groupement formyle
peuvent être protégés par exemple sous forme de cétals ou
de thiocétals cycliques ou non cycliques tels que le
diméthyl ou diéthylcétal ou l'éthylène dioxycétal, ou le
diéthylthiocétal ou l'éthylènedithiocétal,
- les fonctions acides des produits décrits ci-dessus
peuvent être, si désiré, amidifiées par une amine
primaire ou secondaire par exemple dans du chlorure de
méthylène en présence, par exemple, de chlorhydrate de 1-
éthyl-3-(diméthylaminopropyl) carbodiimide à la
température ambiante:
- les fonctions acides peuvent être protégées par exemple
sous forme d'esters formés avec les esters facilement
clivables tels que les esters benzyliques ou
terbutyliques ou des esters connus dans la chimie des
peptides.
Ces réactions a) à k) indiquées ci-dessus peuvent
être réalisées, par exemple, comme indiqué ci-après.
a) Les produits décrits ci-dessus peuvent, si désiré,
faire l'objet, sur les éventuelles fonctions carboxy, de
réactions d'estérification qui peuvent être réalisées
selon les méthodes usuelles connues de l'homme du métier.
b) Les éventuelles transformations de fonctions ester en
fonction acide des produits décrits ci-dessus peuvent
être, si désiré, réalisées dans les conditions usuelles
connues de l'homme du métier notamment par hydrolyse
acide ou alcaline par exemple par de la soude ou de la
potasse en milieu alcoolique tel que, par exemple, dans
du méthanol ou encore par de l'acide chlorhydrique ou
sulfurique.
c) Les éventuels groupements alkylthio des produits
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
décrits ci-dessus, dans lesquels le radical aikyle est
éventuellement substitué par un ou plusieurs atomes
d'halogène, notamment de fluor, peuvent être, si désiré,
transformés en les fonctions sulfoxyde ou sulfone
5 correspondantes dans les conditions usuelles connues de
l'homme du métier telles que par exemple par les
peracides comme par exemple l'acide peracétique ou
l'acide métachloroperbenzoïque ou encore par l'ozone,
l'oxone, le périodate de sodium dans un solvant tel que
10 par exemple le chlorure de méthylène ou le dioxanne à la
température ambiante.
L'obtention de la fonction sulfoxyde peut être
favorisée par un mélange équimolaire du produit
renfermant un groupement alkylthio et du réactif tel que
15 notamment un peracide.
L'obtention de la fonction sulfone peut être
favorisée par un mélange du produit renfermant un
groupement alkylthio avec un excès du réactif tel que
notamment un peracide.
20 d) La réaction de transformation d'une fonction cétone en
oxime peut être réalisée dans les conditions usuelles
connues de l'homme de métier, telle que notamment une
action en présence d'une hydroxylamine éventuellement O-
substituée dans un alcool tel que par exemple l'éthanol,
25 à température ambiante ou en chauffant.
e) Les éventûelles fonctions carboxy libre ou estérifié
des produits décrits ci-dessus peuvent être, si désiré,
réduites en fonction alcool par les méthodes connues de
l'homme de métier : les éventuelles fonctions carboxy
30 estérifié peuvent être, si désiré, réduites en fonction
alcool par les méthodes connues de l'homme du métier et
notamment par de l'hydrure de lithium et d'aluminium dans
un solvant tel que par exemple le tétrahydrofuranne ou
encore le dioxane ou l'éther éthylique.
35 Les éventuelles fonctions carboxy libre des produits
décrits ci-dessus peuvent être, si désiré, réduites en
CA 02631506 2008-05-28
WO 2008/000922 _ PCT/FR2007/000080
36
fonction alcool notamment par de l'hydrure de bore.
f) Les éventuelles fonctions alcoxy telles que notamment
méthoxy des produits décrits ci-dessus peuvent être, si
désiré, transformées en fonction hydroxyle dans les
conditions usuelles connues de l'homme du métier par
exemple par du tribromure de bore dans un solvant tel que
par exemple le chlorure de méthylène, par du bromhydrate
ou chlorhydrate de pyridine ou encore par de l'acide
bromhydrique ou chlorhy-drique dans de l'eau ou de
l'acide trifluoroacétique au reflux.
g) Les éventuelles fonctions alcool des produits décrits
ci-dessus peuvent être, si désiré, transformées en
fonction aldéhyde ou acide par oxydation dans les
conditions usuelles connues de l'homme du métier telles
que par exemple par action de l'oxyde de manganèse pour
obtenir les aldéhydes ou du réactif de Jones pour accéder
aux acides.
h) Les éventuelles fonctions nitrile des produits décrits
ci-dessus peuvent être, si désiré, transformées en
tétrazolyle dans les conditions usuelles connues de
l'homme du métier telles que par exemple par
cycloaddition d'un azidure métallique tel que par exemple
l'azidure de sodium ou un azidure de trialkylétain sur la
fonction nitrile ainsi qu'il est indiqué dans la méthode
décrite dans l'article référencé comme suit :
J. Organometallic Chemistry., 33, 337 (1971) KOZIMA S.&
coll.
On peut noter que la réaction de transformation d'un
carbamate en urée et notamment d'un sulfonylcarbamate en
sulfonylurée, peut être réalisée par exemple au reflux
d'un solvant comme par exemple le toluène en présence de
l'amine adéquate.
Il est entendu que les réactions décrites ci-dessus
peuvent être effectuées comme indiqué ou encore, le cas
échéant, selon d'autres méthodes usuelles connues de
l'homme du métier.
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
37
i) L'élimination de groupements protecteurs tels que par
exemple ceux indiqués ci-dessus peut être effectuée dans
les conditions usuelles connues de l'homme de métier
notamment par une hydrolyse acide effectuée avec un acide
tel que l'acide chlorhydrique, benzène sulfonique ou
para-toluène sulfonique, formique ou trifluoroacétique ou
encore par une hydrogénation catalytique.
Le groupement phtalimido peut être éliminé par
l'hydrazine.
On trouvera une liste de différents groupements
protec-teurs utilisables par exemple dans le brevet BF 2
499 995.
j) Les produits décrits ci-dessus peuvent, si désiré,
faire l'objet de réactions de salification par exemple
par un acide minéral ou organique ou par une base
minérale ou organique selon les méthodes usuelles connues
de l'homme du métier.
k) Les éventuelles formes optiquement actives des
produits décrits ci-dessus peuvent être préparées par
dédoublement des racémiques selon les méthodes usuelles
connues de l'homme du métier.
Les éventuelles fonctions réactives qui sont
éventuellement protégées sont notamment les fonctions
hydroxy ou amino. On utilise pour protéger ces fonctions
des groupements protecteurs usuels. On peut citer par
exemples les groupements protecteurs suivants du radical
amino . tert-butyle, tert-amyle, trichloroacétyle,
chloroacétyle, benzhydryle, trityle, formyle,
benzyloxycarbonyle.
Comme groupement protecteur du radical hydroxy on
peut citer les radicaux tels que formyle, chloroacétyle,
tétrahydropyrannyle, triméthylsilyle, tert-butyl
diméthylsilyle.
Il est bien entendu que la liste ci-dessus n'est pas
limitative et que d'autres groupements protecteurs, par
exemple connus dans la chimie des peptides peuvent être
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
38
utilisés. Une liste de tels groupements protecteurs se
trouve par exemple dans le brevet français BF 2.499.995
dont le contenu est incorporé ici par référence.
Les réactions éventuelles d'élimination des
groupements protecteurs sont effectuées comme indiqué
dans ledit brevet BF 2.499.995. Le mode préféré
d'élimination est l'hydrolyse acide à l'aide des acides
choisis parmi les acides chlorhydrique, benzène
sulfonique ou para toluène sulfonique, formique ou
trifluoroacétique. On préfère l'acide chlorhydrique.
La réaction éventuelle d'hydrolyse du groupement
>C=NH en groupement cétone est également effectuée de
préférence à l'aide d'un acide tel que l'acide
chlorhydrique aqueux par exemple au reflux.
Un exemple d'élimination du groupement
terbutyldiméthylsilyle au moyen de l'acide chlorhydrique
est donné ci-après dans les exemples.
- L'estérification éventuelle d'un radical OH libre est
effectuée dans des conditions classiques. On peut
utiliser par exemple un acide ou un dérivé fonctionnel,
par exemple un anhydride tel que l'anhydride acétique en
présence d'une base telle que la pyridine.
L'estérification ou la salification éventuelle d'un
groupement COOH est effectuée dans les conditions
classiques connues de l'homme du métier.
L'amidification éventuelle d'un radical COOH est
effectuée dans des conditions classiques. On peut
utiliser une amine primaire ou secondaire sur un dérivé
fonctionnel de l'acide par exemple un anhydride
symétrique ou mixte.
Les produits de départ utilisés pour préparer les
produits de formule (I) selon la présente invention
peuvent être connus et disponibles dans le commerce ou
peuvent être préparés selon des méthodes connues de
l'homme de métier.
Les produits objet de la présente invention sont doués de
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
39
propriétés pharmacologiques intéressantes: on a constaté
qu'ils possédaient notamment des propriétés inhibitrices
de protéines kinases.
Parmi ces protéines kinases, on cite notamment
IGF1R.
Des tests donnés dans la partie expérimentale ci-
après illustrent l'activité inhibitrice de produits de la
présente invention vis-à-vis de telles protéines kinases.
Ces propriétés rendent donc les produits de formule
générale (I) de la présente invention utilisables comme
médicaments pour le traitement de tumeurs malignes.
Les produits de formule (I) peuvent également être
utilisés dans le domaine vétérinaire.
L'invention a donc pour objet l'application, à titre
de médicaments, des produits de formule générale (I)
pharmaceutiquement acceptables.
L'invention a particulièrement pour objet
l'application à titre de médicaments, des produits dont
les noms suivent :
- le 1-({2-[(2,5-dichlorophényl)amino]pyridin-4-
yl}méthyl)-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
- le N-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}pipéridine-1-carboxamide
- le 3,4-dichloro-N-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}benzamide
- le 1-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-3-méthylurée
- le 1-({2-[(2,5-difluorophényl)amino]pyridin-4-
yl}méthyl)-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
- le 3,5-dichloro-N-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
yl)méthyl]pyridin-2-yl}benzamide
- le 2-chloro-N-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
y1)méthyl]pyridin-2-yl}-6-fluoro-3-méthylbenzamide
5 - le 3-({4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}amino)-N,N-diméthylbenzamide
- le 1-[(2-{[(1R)-2-hydroxy-l-
méthyléthyl]amino}pyrimidin-4-yl)méthyl]-5,5-diméthyl-3--
10 {4-[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-
dione
- le 3-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyrimidin-2-yl}-1,1-diméthylurée
15 - le 5,5-diméthyl-l-{[2-(pyridin-3-ylamino)pyrimidin-4-
yl]méthyl}-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
- le 3-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidin-1-
20 yl)méthyl]pyrimidin-2-yl}-1,1-diméthylurée
- le 5,5-diméthyl-l-{[2-(pyrimidin-5-ylamino)pyridin-4-
yl]méthyl}-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
- le 5,5-diméthyl-l-{[2-(pyrimidin-5-ylamino)pyridin-4-
25 yl]méthyl}-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
- le 5,5-diméthyl-l-{[2-(pyrimidin-5-ylamino)pyrimidin-4-
yl]méthyl}-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
30 - le 5,5-diméthyl-l-{[2-(pyrimidin-5-ylamino)pyrimidin-4-
yl]méthyl}-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
- le 1-({2-[(5-fluoropyridin-3-yl)amino]pyridin-4-
yi}méthyl)-5,5-diméthyl-3-{4-
35 [(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
lesdits produits de formule (I) étant sous toutes les
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
41
formes isomères possibles racémiques, énantiomères et
diastéréo-isomères, ainsi que les sels d'addition avec
les acides minéraux et organiques ou avec les bases
minérales et organiques pharmaceutiquement acceptables
desdits produits de formule (I).
Les produits peuvent être administrés par voie
parentérale, buccale, perlinguale, rectale ou topique.
L'invention a aussi pour objet les compositions
pharmaceutiques, caractérisées en ce qu'elles renferment,
à titre de principe actif, un au moins des médicaments de
formule générale (I).
Ces compositions peuvent être présentées sous forme
de solutions ou de suspensions injectables, de comprimés,
de comprimés enrobés, de capsules, de sirops, de
suppositoires, de crèmes, de pommades et de lotions. Ces
formes pharmaceutiques sont préparées selon les méthodes
usuelles. Le principe actif peut être incorporé à des
excipients habituellement employés dans ces compositions,
tels que les véhicules aqueux ou non, le talc, la gomme
arabique, le lactose, l'amidon, le stéarate de magnésium,
le beurre de cacao, les corps gras d'origine animale ou
végétale, les dérivés paraffiniques, les glycols, les
divers agents mouillants, dispersants ou émulsifiants,
les conservateurs.
La dose usuelle, variable selon le sujet traité et
l'affection en cause, peut être, par exemple, de 10 mg à
500 mg par jour chez l'homme, par voie orale.
La présente invention concerne ainsi l'utilisation
de produits de formule (I) tels que définis ci -dessus ou
de sels pharmaceutiquement acceptables desdits produits
de formule (I) pour la préparation de médicaments
destinés à inhiber l'activité de protéines kinases et
notamment d'une protéine kinase.
La présente invention concerne ainsi 1' utilisation
de produits de formule (I) telle que définie ci-dessus ou
de sels pharmaceutiquement acceptables desdits produits
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
42
de formule (I) dans laquelle la protéine kinase est une
protéine tyrosine kinase.
La présente invention concerne ainsi l'utilisation
de produits de formule (I) telle que définie ci-dessus ou
de sels pharmaceutiquement acceptables desdits produits
de formule (I) dans laquelle la protéine kinase est
choisie dans le groupe suivant: EGFR, Fak, FLK-1, FGFR1,
FGFR2, FGFR3, FGFR4, FGFR5, flt-1, IGF-1R, KDR, PDGFR,
tie2, VEGFR, AKT, Raf.
La présente invention concerne ainsi
particulièrement l'utilisation de produits de formule (I)
telle que définie ci-dessus ou de sels pharmaceutiquement
acceptables desdits produits de formule (I) dans laquelle
la protéine kinase est IGF1R.
La présente invention concerne également
l'utilisation de produits de formule (I) telle que
définie ci-dessus ou de sels pharmaceutiquement
acceptables desdits produits de formule (I) dans laquelle
la protéine kinase est dans une culture cellulaire et
également cette utilisation dans un mammifère.
La présente invention concerne ainsi l'utilisation
de produits de formule (I) telle que définie ci-dessus ou
de sels pharmaceutiquement acceptables desdits produits
de formule (I) pour la préparation d'un médicament
destiné à prévenir ou traiter une maladie caractérisée
par le dérèglement de l'activité d'une protéine kinase et
notamment une telle maladie chez un mammifère.
La présente invention concerne l'utilisation de
produits de formule (I) telle que définie ci-dessus ou de
sels pharmaceutiquement acceptables desdits produits de
formule (I) pour la préparation d'un médicament destiné à
prévenir ou traiter une maladie appartenant au groupe
suivant: désordres de la prolifération de vaisseaux
sanguins, désordres fibrotiques, désordres de la
prolifération de cellules mésangiales, désordres
métaboliques, allergies, asthme, thromboses, maladies du
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
43
système nerveux, rétinopathies, psoriasis, arthrite
rhumatoïde, diabètes, dégénération musculaire, maladies
en oncologie, cancers.
La présente invention concerne ainsi l'utilisation
de produits de formule (I) telle que définie ci-dessus ou
de sels pharmaceutiquement acceptables desdits produits
de formule (I) pour la préparation d'un médicament
destiné à traiter des maladies en oncologie.
La présente invention concerne particulièrement
l'utilisation de produits de formule (I) telle que
définie ci-dessus ou de sels pharmaceutiquement
acceptables desdits produits de formule (I) pour la
préparation d'un médicament destiné à traiter des
cancers.
Parmi ces cancers, la présente invention s'intéresse
tout particulièrement au traitement des tumeurs solides
et au traitement de cancers résistants aux agents
cytotoxiques
Parmi ces cancers, la présente invention concerne
tout particulièrement le traitement du cancer du sein, de
l'estomac, du colon, des poumons, des ovaires, de
l'utérus, du cerveau, du rein, du larynx, du système
lymphatique, de la thyroïde, du tractus uro-génital, du
tractus incluant vésicule et prostate, du cancer des os,
du pancréas, les mélanomes.
La présente invention s'intéresse encore plus
particulièrement au traitement du cancer du sein, du
colon et des poumons.
La présente invention concerne aussi l'utilisation
de produits de formule (I) telle que définie ci-dessus ou
de sels pharma.ceutiquement acceptables desdits produits
de formule (I) pour la préparation d'un médicament
destiné à la chimiothérapie de cancers.
A titre de médicaments selon la présente invention
destinés à la chimiothérapie de cancers, les produits de
formule (I) selon la présente invention peuvent être
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
44
utilisés seuls ou en association avec chimiothérapie ou
radiothérapie ou alternativement en association avec
d'autres agents thérapeutiques.
La présente invention concerne ainsi notamment les
compositions pharmaceutiques telles que définies ci-
dessus contenant en plus, des principes actifs d'autres
médicaments de chimiothérapie contre le cancer.
De tels agents thérapeutiques peuvent être des
agents anti-tumoraux utilisés communément.
Comme exemples d'inhibiteurs connus de protéines
kinases, on peut citer notamment la butyrolactone, le
flavopiridol, la 2-(2-hydroxyéthylamino)-6-benzylamino-9-
méthylpurine, l'olomucine, le Glivec ainsi que l'Iressa.
Les produits de formule (I) selon la présente
invention peuvent ainsi également être avantageusement
utilisés en combinaison avec des agents anti-
prolifératifs : à titre d'exemples de tels agents anti-
prolifératifs mais sans toutefois se limiter à cette
liste, on peut citer les inhibiteurs d'aromatase, les
antiestrogènes, les inhibiteurs de topoisomérase I, les
inhibiteurs de topoisomérase II, les agents actifs sur
les microtubules, les agents d'alkylation, les
inhibiteurs d'histone désacétylase, les inhibiteurs de
farnésyl transférase, les inhibiteurs de COX-2, les
inhibiteurs de MMP, les inhibiteurs de mTOR , les
antimétabolites antinéoplastique, les composés du
platine, les composés faisant décroître l'activité des
protéines kinases et également les composés anti-
angiogéniques, les agonistes de la gonadoréline, les
anti-androgènes, les bengamides, les biphophonates et le
trastuzumab.
On peut citer ainsi à titre d'exemples, des agents
anti-microtubules comme les taxoides, vinka-alkaloides,
des agents d'alkylation tels que cyclophosphamide, des
agents DNA-intercalant comme le cis-platinum, des agents
interactifs sur topoisomérase comme la camptothécine et
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
dérivés, les anthracyclines comme l'adriamycine, des
antimétabolites comme le 5-fluorouracile et dérivés et
analogues.
La présente invention concerne donc des produits de
5 formule (I) comme inhibiteurs de protéines kinases,
lesdits produits de formule (I) étant sous toutes les
formes isomères possibles racémiques, énantiomères et
diastéréo-isomères, ainsi que les sels d'addition avec
les acides minéraux et organiques ou avec les bases
10 minérales et organiques pharma.ceutiquement acceptables
desdits produits de formule (I) ainsi que leurs prodrugs.
La présente invention concerne particulièrement des
produits de formule (I) tels que définis ci-dessus comme
inhibiteurs de IGF1R.
15 La présente invention concerne plus particulièrement
les produits de formule (I) tels que définis ci-dessus
comme inhibiteurs de IGF1R.
Les spectres de RMN lH sont enregistrés sur des
20 spectromètres BRUKER à 400 MHz (AVANCE DRX-400) ou à 300
MHz (BRUKER AVANCE DPX-300). Les déplacements chimiques
sont donnés en ppm (8 en ppm) - dans le solvant
diméthylsulfoxide - d6 (DMSO-d6) référencé à 2,50 ppm à
la température de 303K.
25 Les spectres de Masse ont été réalisés, soit en
électrospray (ES) sur appareil Q-Tof-2 (Micromass), ZQ
(Micromass) et Quattro Premier (Micromass), soit en
impact électronique (IE); 70eV; appareil Micromass GCTof
Premier, soit en ionisation chimique (IC); gaz réactant
30 ammoniac; appareil Micromass GCTof.
La LCMS est réalisée sur Colonne Hypersil Gold C18 3x50
mm de diamètre particules : 3 m
Conditions initiales :
Solvant A : Eau à 0,05 0-o TFA 95%
35 Solvant B: Acétonitrile à 0,05 % TFA 50-.
Débit 0,9 ml Pression à to : 145b volume injecté : 5 .l
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
46
GR.ADIENT sur 7mn
Temps %-A B
0 95 5
5 95
5 5,5 5 95
6,5 95 5
7 95 5
Détecteur U.V. DAD : 200<;~<400 nm, la masses est mesurée
par électrospray (ES+) sur appareil Q-Tof-2 (Micromass)
Les exemples dont la préparation suit illustrent la
présente invention sans toutefois la limiter.
Exemple 1 : 1-({2-[(2,5-dichlorophényl)amino]pyridin-4-
yl}méthyl)-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
SCF3
O N-rO
~N
~
-
N / HCI\ /
CI
Stade e) : 1-({2-[(2,5-dichlorophényl)amino]pyridin-4-
yl}méthyl)-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
A une solution de 0,8 g de 1-[(2-chloropyridin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade d) ci-dessous, de 80 cm3 de toluène et
de 0,45 g de 2,5-dichloroaniline, sous atmosphère inerte
d'argon à une température voisine de 20 C, sont ajoutés
0,17 g d'acétate de palladium, 0,48 g de 9,9-diméthyl-
4,5-bis(diphénylphosphino)xanthene et 2,4 g de carbonate
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
47
de césium. Le milieu réactionnel est chauffé à reflux
pendant 18 heures. Après refroidissement, le milieu
réactionnel est concentré sous pression réduite. Le
résidu obtenu est purifié par flash-chromatographie
(Si02, dichlorométhane comme éluant). Les fractions
contenant le produit sont concentrées sous pression
réduite. On obtient ainsi 0,46 g de 1-({2-[(2,5-
dichlorophényl)amino]pyridin-4-yl}méthyl)-5,5-diméthyl-3-
{4-[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 1,45 (s, 6H); 4,58 (s, 2H);
6,92 (d large, J = 5,5 Hz, 1H) ; 7,03 (dd, J = 2,5 et 8,5
Hz, 1H); 7,13 (s large, 1H); 7,47 (d, J = 8,5 Hz, 1H)-;
7, 69 (d, J = 9, 0 Hz, 2H) ; 7, 88 (d, J = 9, 0 Hz, 2H) ; 8, 15
(d, J = 5, 5 Hz, 1H) ; 8, 36 (d, J = 2, 5 Hz, 1H) ; 8, 46 (s,
1H)
Spectre de Masse (ES): m/z=555 [M+H]+ pic de base
Stade d) : 1-[(2-chloropyridin-4-yl)méthyl]-5,5-diméthyl-
3-{4-[(trifluorométhyl)thio]phényl}imidazolidine-2,4-
dione
A une solution de 5 g de 5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade c) ci-dessous dans 220 ml de THF
anhydre, sous atmosphère inerte d'argon à une température
voisine de 20 C, est ajouté 0,9 g d'hydrure de sodium,
l'agitation est maintenue à cette température pendant 30
minutes, est ajouté une solution de 3 g de 2-chloro-4-
(chlorométhyl)pyridine obtenu au stade b) ci-dessous
dans 10 ml de THF anhydre. Le milieu réactionnel est
chauffé à 60 C pendant 48 heures. Le milieu réactionnel
est versé sur de la glace puis extrait à l'acétate
d'éthyle. La phase organique est séchée sur sulfate de
magnésium, filtrée, concentrée sous vide, puis purifiée
par chromatographie sur silice 40-60 m (éluents
dichlorométhane/acétate d'éthyle 97/03 en volume). Les
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
48
fractions contenant le produit sont concentrées sous
pression réduite. On obtient ainsi 1,17 g de 1-[(2-
chloropyridin-4-yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
sous forme de poudre blanche dont les caractéristiques
sont les suivantes
PF 111 C
Spectre de Masse (IC) : m/z=447 MNH4+, m/z=430 [M+H] + pic
de base
Stade c) : 5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
A une solution de 4 g de 4-(trifluorométhyl)thio-phényl
isocyanate dans 40 ml de toluène, sous atmosphère inerte
d'argon à une température voisine de 20 C, est ajouté
5,12 ml de triéthylamine et 2,8 g de chlorhydrate de
l'ester méthylique de l'acide a-aminoisobutyrique. Le
mélange ainsi obtenu est porté au reflux pendant
24 heures puis refroidi à température ambiante. Le
mélange réactionnel est concentré à sec sous pression
réduite, le résidu obtenu est repris par de l'éther
éthylique et filtré. Le solide ainsi obtenu est repris
par du dichlorométhane puis lavé à l'eau pour donner 2,76
g 5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes :
Spectre RMN 1H à 300 MHz : 1,44 (s : 6H); 7,62 (d large,
J = 8,5 Hz : 2H); 7,85 (d large, J 8,5 Hz : 2H); 8,72
(mf : 1H).
Spectre de Mass (IC) : m/z=322 MNH4+
Stade b): 2-chloro-4-(chlorométhyl)pyridine
CI
N CI
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
49
A une solution de 11.3 g de (2-chloropyridin-4-
yl)méthanol obtenu au stade a) ci-dessous dans 200mL de
dichlorométhane sont ajoutés 6.896mL de chlorure de
thionyle puis 2.lmL de diméthylformamide, la mélange
réactionnel est agité pendant 3h puis 5OmL d'eau sont
ajoutés goutte à goutte. La solution est séchée sur
sulfate de magnésium, filtrée et concentrée sous vide
pour donner 12.8 g(100ô) de produit sous forme d'un
liquide ambré utilisé tel quel sans autre purification.
RfCCM silice = 0,44 (éluent dichlorométhane).
Stade a): (2-Chloro-pyridin-4-yl)-methanol
HO
N CI
A une solution de 14,85 g d'ester éthylique d'acide 2-
chloroisonicotinique dans 300mL d'éthanol sont ajoutés
sous argon, 9,08 g de borohydrure de sodium par petites
portions à 40 C pendant 45min. Après addition, le mélange
réactionnel est agité pendant 15 minutes puis la
température est augmentée graduellement jusqu'au reflux
qui est maintenu pendant 4h. Après retour à température
ambiante, 50mL d'une solution saturée de chlorure
d'ammonium sont ajoutés et les solvants évaporés sous
pression réduite. Le résidu est repris dans 200mL d'eau
et extrait avec 3x100mL d'acétate d'éthyle, la phase
organique est lavée avec 2x100mL de solution saturée de
chlorure de sodium, séchée sur sulfate de sodium et
filtrée. Après évaporation sous pression réduite, le
produit est obtenu sous forme de solide blanc 11,4 g.
RfCCM silice = 0,38 (éluent dichlorométhane/méthanol
90/10).
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
Exemple 2 : N-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}pipéridine-1-carboxamide
SCF3
O Ny,-O
N
N N~
5 H O
Le produit est préparé en suivant le mode opératoire
décrit à l'exemple 1 à partir de 0,4 g du 1-[(2-
chloropyridin-4-yl)méthyl]-5,5-diméthyl-3-{4-
10 [(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade d) de l'exemple 1 et de 0,18 g du 1-
pipéridinecarboxamide au lieu du 2,5-dichloroaniline
utilisé à l'exemple 1. Après purification par flash-pack
chromatographie (Si02, dichlorométhane/méthanol 98/ 02 én
15 volumes comme éluants), on obtient 0,21 g du N-{4-[(5,5-
diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}pipéridine-l-carboxamide dont les
caractéristiques sont les suivantes :
20 Spectre RMN 1H à 400 MHz : de 1,39 à 1,60 (m, 6H) ; 1,41
(s, 6H); 3,42 (m, 4H); 4,59 (s, 2H); 7,01 (dd, J = 1,0 et
5,5 Hz, 1H); 7,67 (d, J = 8,5 Hz, 2H); 7,82 (s large,
1H); 7,86 (d, J= 8,5 Hz, 2H); 8,16 (d, J = 5,5 Hz, 1H);
9,05 (s, 1H) .
25 Spectre de Masse (ES) : m/z=522 [M+H]+ pic de base
Exemple 3 : 3,4-dichloro-N-{4-[(5,5-diméthyl-2,4-dioxo-3-
{4-[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}benzamide
CA 02631506 2008-05-28
WO 2008/000922 PÇT/FR2007/000080
51
SCF3
O N~,- O
N CI
d~ ~ CI
N
N
H O
A une solution de 0,7 g de 1-[(2-chloropyridin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade d) de l'exemple 1, de 70 cm3 de dioxane
et de 0,63 g de 3,4-dichlorobenzamide, sous atmosphère
inerte d'argon à une température voisine de 20 C, sont
ajoutés 0,16 g d'iodure de cuivre, 0,11 g de bis-
methylcyclohexanediamine et 0,665 g de carbonate de
potassium. Le milieu réactionnel est chauffé à reflux
pendant 18 heures. Après refroidissement, le milieu
réactionnel est concentré sous pression réduite. Le
résidu obtenu est purifié par flash-chromatographie
(Si02, dichlorométhane/acétate d'éthyle 95/05 en volume
comme éluants). Les fractions contenant le produit sont
concentrées sous pression réduite. On obtient ainsi 0,49
g de 3,4-dichloro-N-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}benzamide dont les
caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 1,45 (s, 6H); 4,69 (s, 2H);
7,25 (dd, J = 1,5 et 5,5 Hz, 1H); 7,67 (d, J = 8,5 Hz,
2H) ; 7, 79 (d, J = 8, 5 Hz, 1H) ; 7, 87 (d, J = 8, 5 Hz, 2H) ;
7,98 (dd, J 2,0 et 8,5 Hz, 1H); 8,21 (s large, 1H);
8,28 (d, J = 2,0 Hz, 1H); 8,36 (d, J = 5,5 Hz, 1H);
11,05 (s, 1H)
Spectre de Masse (ES) m/z=583 [M+H]+ pic de base
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
52
Exemple 4 : 1-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidin-l-
yl)méthyl]pyridin-2-yl}-3-méthylurée.
FF
,J~ ~
F z
O N'r O
N
N
~ ~ -
N N--~
H O
Stade c) : 1-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-3-méthylurée.
A une solution de 0.69 g de 1-[(2-chloropyridin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
obtenu au stade b) ci-dessus dans 20mL de dioxanne sont
ajoutés successivement sous argon, 0,166 g de méthyl
urée, 1.85 g de carbonate de césium, 0,104 g de 9,9-
diméthyl-4,5-bis(diphénylphosphino)xanthene et 0.33 g
d'acétate de palladium. Le mélange réactionnel est
chauffé au reflux pendant 2,5 heures puis concentré sous
pression réduite et le résidu purifié par chromatographie
sur colonne de silice en éluant par un mélange de
cyclohexane et d'acétate d'éthyle (20/80 en volumes) pour
donner 0,11 g de 1-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-3-méthylurée dont les
caractéristiques sont les suivantes :
Spectre RNN 1H à 400 MHz : 1,44 (s, 6H) ; 2,73 (d, J = 5,0
Hz, 3H) ; 4,60 (s, 2H) ; 6,97 (dd, J = 2,0 et 5,5 Hz, 1H) ;
7,30 (s large, 1H); 8,04 (d, J 9,0 Hz, 2H); 8,12 (d, J
= 5, 5 Hz, 1H) ; 8, 17 (q large, J 5, 0 Hz, 1H) ; 8, 31 (d, J
= 9,0 Hz, 2H) ; 9,18 (s, 1H) .
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
53
Spectre de Masse (ES) m/z=500 [M+H]+ pic de base
Stade b : 1-[(2-chloropyridin-4-yl)méthyl]-5,5-diméthyl-
3-{4-[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-
dione
F
F
F',V,~S'O
1
O NO
N
N
CI
A une solution de 5 g de 3-(4-trifluorométhanesulfonyl-
phényl)-5,5-diméthyl-imidazolidine-2,4-dione obtenu au
stade a) ci-dessous dans 180mL de tétrahydrofuranne sont
ajoutés successivement sous argon, 0,88 g d'hydrure de
sodium à 60% et 3,61 g de 2-chloro-4-chlorométhyl-
pyridine. La solution est chauffée au reflux pendant 24h.
Le mélange réactionnel refroidi est versé sur de l'eau
distillée puis extrait à l'acétate d éthyle, séché sur
sulfate de magnésium, filtré et concentré sous vide. Le
résidu est purifié par chromatographie sur colonne de
silice en éluant par un mélange de cyclohexane et
d'acétate d'éthyle (70/30 en volumes) pour donner 2,29 g
de 1-[(2-chloropyridin-4-yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 1,44 (s, 6H); 4,68 (s, 2H);
7, 49 (d large, J = 5, 5 Hz, 1H) ; 7, 42 (s large, 1H) ; 8, 07
(d, J = 9,0 Hz, 2H); 8,31 (d, J = 9,0 Hz, 2H); 8,37 (d, J
= 5,5 Hz, 1H) .
Spectre de Masse (ES) m/z=462 [M+H]+ pic de base
Stade a) 5,5-diméthyl-3-{4-
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
54
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
FF
Fx =O
I ~ .
O N-r- O
~-N
H
A une solution de 9,56mL de diphosgène dans le toluène
sont ajoutés successivement sous argon et à-20 C, 2,4 g
de noir animal (noir 3S) puis 16,2 g de 4-
trifluorosulfonylaniline dans 150mL de toluène suivi par
200mL de toluène. Le mélange réactionnel est chauffé à
reflux pendant 2 heures puis refroidi à température
ambiante. 13,26 g d'ester méthylique de 2,2-méthyle
glycine dans 15omL de toluène sont ensuite ajoutés suivis
par 50,55 mL de triéthylamine. Le mélange réactionnel est
chauffé au reflux pendant 15h, refroidi à température
ambiante puis filtré. La phase organique est lavée
successivement à l'eau et avec une solution saturée de
chlorure de sodium, séchée sur sulfate de magnésium,
filtrée et concentrée sous pression réduite. Le résidu
est repris à l'éther diéthylique et le solide formé
filtré et séché pour donner 14,5 g de 5,5-diméthyl-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 1,44 (s, 6H); 7,99 (d, J = 9,0
Hz, 2H); 8,27 (d, J = 9,0 Hz, 2H); 8,81 (s large, 1H)
Spectre de Masse (ES) : m/z=337 [M+H]+ pic de base
Exemple 5: 1-({2-[(2,5-difluorophényl)amino]pyridin-4-
yl}méthyl)-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
F
F F
F O
'N ~ NH
F -e S / \ '&'
N
~,~
iN
O
A une solution de 42,9 mg de 1-[(2-chloropyridin-4-yl)
méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
5 obtenu au stade d) de l'exemplel et de 19,2 mg de 2,5-
difluoroaniline dans 5 mL de dioxane, sous atmosphère
inerte d'argon, sont ajoutés 2,2 mg d'acétate de
palladium, 6,9 mg de 9,9-diméthyl-4,5-
bis(diphénylphosphino)xanthene et 123 mg de carbonate de
10 césium. Le milieu réactionnel est chauffé à 120 C pendant
12 heures, refroidi à température ambiante, et concentré
sous pression réduite. Le résidu obtenu est purifié par
chromatographie préparative HPLC (colonne C18 phase
inverse, élution avec un gradient eau/acétonitrile
15 contenant 0.10-0 d'acide trifluoracétique). Après
évaporaton sous pression résuite des solvents on obtient
26,4 mg de 1-({2-[(2,5-difluorophényl)amino]pyridin-4-
yl}méthyl)-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
20 dont les caractéristiques sont les suivantes
LCMS: m/Z=523,27 [M+H]+; RT: 1,95 min
Exemple 6: 3,5-dichloro-N-{4-[(5,5-diméthyl-2,4-dioxo-3-
25 {4-[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}benzamide
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
56
CI
F Ci O
F~ O NH
S N
N
iN
O
A une solution de 42,9 mg de 1-[(2-chloropyridin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade d) de l'exemple 1, et de 28,2 mg de
3,5-dichlorobenzamide dans 5 mL de dioxane, sous
atmosphère inerte d'argon, sont ajoutés 2,2 mg d'acétate
de palladium, 6,9 mg de 9,9-diméthyl-4,5-
bis(diphénylphosphino)xanthene et 123 mg de carbonate de
césium. Le milieu réactionnel est chauffé à 120 C pendant
12 heures, refroidi à température ambiante, et concentré
sous pression réduite. Le résidu obtenu est purifié par
chromatographie préparative HPLC (colonne C18 phase
inverse, élution avec un gradient eau/acétonitrile
contenant 0.1 -O> d'acide trifluoracétique). Après
évaporation sous pression résuite des solvants on obtient
22,6 mg de 3,5-dichloro-N-{4-[(5,5-diméthyl-2,4-dioxo-3-
{4-[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}benzamide dont les
caractéristiques sont les suivantes
LCMS : TR = 2,40 min m/Z=583,30 [M+H]+
Exemple 7: 2-chloro-N-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-6-fluoro-3-méthylbenzamide
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
57
F
o
F
F O
F NH CI
~N ~
S N I
~~ ,N
O
A une solution de 42,9 mg de 1-[(2-chloropyridin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade d) de l'exemple 1, et de 27,9 mg de 2-
Chloro-6-fluoro-3-méthyl-benzamide dans 5 mL de dioxane,
sous atmosphère inerte d'argon, sont ajoutés 2,2 mg
d'acétate de palladium, 6,9 mg de 9,9-diméthyl-4,5-
bis(diphénylphosphino)xanthene et 123 mg de carbonate de
césium. Le milieu réactionnel est chauffé à 120 C pendant
12 heures, refroidi à température ambiante, et concentré
sous pression réduite. Le résidu obtenu est purifié par
chromatographie préparative HPLC (colonne C18 phase
inverse, élution avec un gradient eau/acétonitrile
contenant 0.1 -01 d'acide trifluoracétique). Après
évaporaton sous pression résuite des solvents on obtient
18,2 mg de 2-chloro-N-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-6-fluoro-3-méthylbenzamide dont
les caractéristiques sont les suivantes :
LCMS: m/Z=581,31 [M+H]+; RT: 2,28 min
Exemple 8: 3-({4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}amino)-N,N-diméthylbenzamide
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
58
O
F
~F O
F NH
N ~
S
N ~
N
O
A une solution de 42,9 mg de 1-[(2-chloropyridin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade d) de l'exemple 1, et de 24,4 mg de 3-
Amino-N,N-diméthyl-benzamide dans 5 mL de dioxane, sous
atmosphère inerte d'argon, sont ajoutés 2,2 mg d'acétate
de palladium, 6,9 mg de 9,9-diméthyl-4,5-
bis(diphénylphosphino)xanthene et 123 mg de carbonate de
césium. Le milieu réactionnel est chauffé à 120 C pendant
12 heures, refroidi à température ambiante, et concentré
sous pression réduite. Le résidu obtenu est purifié par
chromatographie préparative HPLC (colonne C18 phase
inverse, élution avec un gradient eau/acétonitrile
contenant 0.10-0 d'acide trifluoracétique). Aprês
évaporaton sous pression résuite des solvents on obtient
33,2 mg de 3-({4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}amino)-N,N-diméthylbenzamide dont
les caractéristiques sont les suivantes
LCMS: m/Z=558,23 [M+H]+; RT: 1,46 min
Exemple 9 : 1-[(2-{[(1R)-2-hydroxy-1-
méthyléthyl]amino}pyrimidin-4-yl)méthyl]-5,5-diméthyl-3-
{4-[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-
dione
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
59
F O
F l'
S=O
F
( HO
O Ny O NH
N N=~
N
n
Stade d) : 1- [ (2- { [ (1R) -2-hydroxy-1-
méthyléthyl]amino}pyrimidin-4-yl)méthyl]-5,5-diméthyl-3-
{4-[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-
dione
Une solution de 100 mg de 5,5-diméthyl-l-{[2-
(méthylsulfonyl)pyrimidin-4-yl]méthyl}-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
obtenu au stade c) ci-dessous et de 44.5 mg de (R) 2-
amino-1-propanol dans 2 ml de dioxane est versée dans un
tube et scéllée avec un septum en téflon. Le tube est mis
dans un four micro-onde(Emrys Optimizer, Personal
Chemistry) et la solution est agitée à 120 C pendant 1
heure. Après refroidissement à température ambiante, le
solvent est évaporé sous pression réduite et le résidu
purifié par chromatographie préparative HPLC (colonne C18
phase inverse, élution avec un gradient eau/acétonitrile
contenant 0.190, d'acide trifluoracétique). Après
lyophilisation de la solution un solide blanc est obtenu
qui est traité avec une solution saturée
d'hydrogénocarbonate de sodium et extrait à l'acétate
d'éthyle. La phase organique est séchée sur sulfate de
sodium anhydre et évaporée pour donner 49,7 mg de 1- [( 2-
{[(1R)-2-hydroxy-1-méthyléthyl]amino}pyrimidin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes :
Spectre RNN 1H à 400 MHz : d = 8.32 (d, 2H) ; 8.22 (ci,
1H); 8.05 (d, 2H); 6.80 (d, 1H); 6.67 (d, 1H); 4.65 (t,
5 1H); 4.46 (s, 2H); 3.93 (m, 1H); 3.44 (m, 1H); 1.48 (s,
6H); 1.09 (s, 3H)
Spectre de Masse (ES) m/z=502 [M+H]+
Stade c) : 5,5-diméthyl-l-{[2-(méthylsulfonyl)pyrimidin-
10 4-yl]méthyl}-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
F O
F 11
S=0
F
1 \
/
O Ny O
N
N
N~ / 0
î=O
A une solution de 4.90 g de 5,5-diméthyl-1-{[2-
15 (méthylthio)pyrimidin-4-yl]méthyl}-3-{4-
[(trifiuorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade b) ci-dessous dans 80 ml de
dichloroéthane sont ajoutés 16,37 g d'acide 3-
chloroperbenzoique (à 70%). Le mélange réactionnel est
20 agité pendant 16 heures à température ambiante et 2,73 g
d'acide 3-chloro-perbenzoique (à 70%) sont rajoutés et le
mélange réactionnel chauffé& à 40 C pendant 2 heures. La
solution est ensuite lavée deux fois avec une solution
saturée d'hydrogénocarbonate de sodium. La phase
25 organique est séchée sur sulfate de sodium anhydre,
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
61
filtrée et le solvent est évaporé sous pression réduite.
Le résidu est purifié par chromatographie sur colonne de
silice en éluant par un gradient d'heptane et d'acétate
d'éthyle pour donner 4,30 g de 5,5-diméthyl-l-{[2-
(méthylsulfonyl)pyrimidin-4-yl]méthyl}-3-{4-
[(trifluorométhyl)suifonyl]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz: d = 9.06 (d, 1H); 8.32 (d, 2H);
8.03 (m, 3H); 4.89 (s, 2H); 3.43 (s, 3H); 1.51 (s, 6H)
Spectre de Masse (ES) : m/z=508 [M+H]+
Stade b): 5,5-diméthyl-l-{[2-(méthylthio)pyrimidin-4-
yl]méthyl}-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
F
F+S
F
1 \
/
O N y O
N/
%,-Op 14. N
~ 1
N ~S
A une solution de 1,00 g de 5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade c) de l'exemple 1 dans 10 ml de N,N-
diméthylformamide sont ajoutés 0,087 g d'hydrure de
sodium à 0 C. Après agitation pendant 10 minutes, 2.88 g
d'une solution à 40ô de 4-bromométhyl-2-méthylthio-
pyrimidine dans l'héxane sont ajoutés et le mélange est
agité pendant 4 heures à température ambiante. Le solvent
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
62
est ensuite évaporé sous pression réduite et le résidu
purifié par HPLC préparative (colonne C18 phase inverse,
en éluant avec un gradient eau/acétonitrile contenant
0,1% d'acide trifluoroacetique). Après lyophilisation des
fractions, on obtient 1,12 g de 5,5-diméthyl-l-{[2-
(méthylthio)pyrimidin-4-yl]méthyl}-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 8.59 (d, 1H); 7.86 (d, 2H);
7.65 (d, 2H); 7.32 (d, 1H); 4.65 (s, 2H); 2.55-2.45 (s,
3H); 1.45 (s, 6H)
Spectre de Masse (ES) m/z=443 [M+H]+
Les exemples 10 à 17 dont les noms et structures sont
décrits ci-après, sont préparés comme indiqué ci-dessus
dans les Schémas généraux.
Structure Nom
~F
F
3-{4-[(5,5-di méthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yI)méthyl]pyrimidin-2-yl}-1,1-diméthylurée
ex 10
F4F
5,5-diméthyl-1-{[2-(pyridin-3-ylamino)pyrimidin-
~ 4-yI]méthyl}-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-
dione
N~N
HN~a
N
~
11'
ex 11
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
63
OM~,_F
O F
N 3-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidin-1-
yI)méthyl]pyrimidin-2-yl}-1,1-diméthylurée
ex 12
F
Or F
5,5-di méthyl-1-{[2-(pyrimidin-5-ylamino)pyridin-
o~~0 4-yI]méthyl}-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-
2,4-dione
H ~N
ex 13
F
5,5-di méthyl -1 -{[2-(pyri mi di n -5-yl a mi no)pyridin-
4-yI]méthyl}-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-
dione
N
H~N
ex 14
IF
F
~ 5,5-diméthyl-l-{[2-(pyri midin-5-
ylamino)pyrimidin-4-yl]méthyl}-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-
dione
ex 15
F
Oa
O
i 5,5-diméthyl-1-{[2-(pyri midi n-5-
N'ro ylamino)pyrimidin-4-yl]méthyl}-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-
2,4-dione
., ~
H N
ex 16
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
64
F,f
F/~L_
/ 1-({2-[(5-fluoropyridin-3-yl)amino]pyridin-4-
yI}méthyl)-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-
N
dione
N
I N
N
ex 17
Exemple 10: 3-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyrimidin-2-yl}-1,1-diméthylurée
F
F
F
o N
''p O
N N--~
H j~-
/
Stade i) : 3-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyrimidin-2-yl}-1,1-diméthylurée
A une solution de 90 mg de {4-[(5,5-diméthyl-2,4-dioxo-3-
{4-[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyrimidin-2-yl}darbamate de phényle obtenu au
stade h) ci-dessous dans 4 mL de tétrahydrofuranne sont
ajoutés 0,85 mL d'une solution 2M de diméthylamine dans
le tétrahydrofuranne sous argon. Le mélange réactionnel
est agité pendant 15 heures à température ambiante et
concentré sous pression réduite. Le résidu est purifié
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
par chromatographie sur colonne de silice en éluant par
un mélange de dichlorométhane et de méthanol (98/2 en
volumes) pour donner 30 mg de =3-{4-[(5,5-diméthyl-2,4-
dioxo-3-{4-[(trifluorométhyl)thio]phényl}imidazolidin-1-
5 yl)méthyl]pyrimidin-2-yl}-1,1-diméthylurée dont les
caractéristiques sont les suivantes
Spectre RNN 1H à 400 MHz : 1,45 (s, 6H) ; 2,90 (s, 6H) ;
4,57 (s, 2H); 7,09 (d, J 5,5 Hz, 1H); 7,67 (d, J = 8,5
Hz, 2H); 7,86 (d, J = 8,5 Hz, 2H); 8,48 (d, J = 5,5 Hz,
10 1H) ; 9,25 (S, 1H) .
Spectre de Masse (ES) : m/z=483 [M+H]+
Stade h) : {4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-l-
15 yl)méthyl]pyrimidin-2-yl}carbamate de phényle
F
)< F
F
N
~
O
A une solution de 0,8 g de 1-[(2-aminopyrimidin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
20 obtenu au stade g) ci-dessous dans 40 mL de
tétrahydrofuranne sont ajoutés successivement à 0 C sous
argon, 0,257 mL de pyridine et 0,34 mL de chloroformate
de phényl puis la solution est agitée pendant 15 heures à
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
66
température ambiante. Le mélange réactionnel est repris
dans de l'acétate d'éthyle, lavé successivement avec de
l'acide chlorhydrique concentré, de l'eau, une solution
saturée d'hydrogéno carbonate de sodium, une solution
saturée de chlorure de sodium et séché sur sulfate de
magnésium. Après filtration la solution est concentrée
sous pression réduite et le résidu purifié par
chromatographie sur colonne de silice en éluant par un
mélange d'acétate d'éthyle et de cyclohexane (65/35 en
volumes) pour donner 0,68 g de {4-[(5,5-diméthyl-2,4-
dioxo-3-{4-[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyrimidin-2-yl}carbamate de phényle dont les
caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 1,46 (s, 6H); 4,67 (s, 2H);
6,75 (m, 3H); de 7,02 à 7,50 (m, 3H); 7,60 (d, J = 8,5
Hz, 2H); 7,82 (d, J = 8,5 Hz, 2H); 8,61 (d, J = 5,5 Hz,
1H) ; 9,30 (s, 1H) .
Spectre de Masse (ES) : m/z= 532 [M+H]+
Stade g) 1-[(2-aminopyrimidin-4-yl)méthyl]-5,5-
diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
F
~F
F
/
N NH2
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
67
A une solution de 0,49 g de 5,5-diméthyl-l-{[2-
(méthylsulfonyl)pyrimidin-4-yl]méthyl}-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade f) ci-dessous dans 2,2 mL de dioxanne
sont ajoutés 2,2 mL d'ammoniaque concentré. Le mélange
réactionnel est chauffé au microonde à 120 C pendant 1
heure, laissé à température ambiante pendant 15 heures
puis concentré sous pression réduite. Le résidu est
purifié par chromatographie sur colonne de silice en
éluant par un mélange d'acétate d'éthyle et de
cyclohexane (75/25 en volumes) pour donner 0,31 g de 1-
[(2-aminopyrimidin-4-yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz 1,43 (s, 6H); 4,41 (s, 2H);
6, 59 (s, 2H) ; 6, 66 (d, J 5, 5 Hz, 1H) ; 7, 66 (d, J = 8, 5
Hz, 2H); 7,86 (d, J 8,5 Hz, 2H); 8,19 (d, J = 5,5 Hz,
1H).
Spectre de Masse (IE) : m/z=411 : [M]+ (pic de base)
m/z=396 : [M] + - CH3
m/z=303 : [M]+ - C6H6N3
m/z=109 [C5H6N3]+
Stade f) : 5,5-diméthyl-1-{[2-(méthylsulfonyl)pyrimidin-
4-yl]méthyl}-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
68
F
)<F
F
O N
N S
ei *
O
1,32 g de 5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade c) de l'exemple 1 sont ajoutés sous argon
à une suspension de 0,26 g d'hydrure de sodium dans 30 mL
de diméthylformamide. Après agitation à température
ambiante pendant 1,5 heure on ajoute une solution de 1,35
g de 4- (chlorométhyl) -2- (méthylsulf onyl) pyrimidine obtenu
au stade e) ci-dessous dans 5 mL de diméthylformamide. Le
mélange réactionnel est agité pendant 15 heures à
température ambiante puis versé sur de l'eau distillée et
extrait avec de l'acétate d'éthyle. La phase aqueuse est
lavée successivement avec de l'eau, une solution saturée
de chlorure de sodium, séchée sur sulfate de magnésium,
filtrée et concentrée sous pression réduite. Le résidu
est purifié par chromatographie sur colonne de silice en
éluant par un mélange d'acétate d'éthyle et de
cyclohexane (65/35 en volumes) pour donner 0,35 g de 5,5-
diméthyl-l-{[2-(méthylsulfonyl)pyrimidin-4-yl]méthyl}-3-
{4-[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 1, 49 (s, 6H) ; 3, 41 (s, 3H) ;
4, 88 (s, 2H) ; 7, 66 (d, J 8, 5 Hz, 2H) ; 7, 86 (d, J = 8, 5
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
69
Hz, 2H); 7,99 (d, J = 5,5 Hz, 1H); 9,04 (d, J = 5,5 Hz,
1H) .
Spectre de Masse (ES): m/z=475 [M+H]+
m/z=473 [M-H]-
Stade e) : 4-(chlorométhyl)-2-(méthylsulfonyl)pyrimidine
ci
N e S ~~
O O
A une solution de 1,2 g de [2-(méthylsulfonyl)pyrimidin-
4-yllméthanol obtenu au stade d) ci-dessous dans 28 mL de
dichiorométhane sont ajoutés successivement 2,28 mL de
diméthylformamide et 0,56 mL de chlorure de thionyl. Le
mélange réactionnel est agité à température ambiante
pendant 2 heures puis concentré sous pression réduite
pour donner 1,3 g de 4-(chlorométhyl)-2-
(méthylsulfonyl) pyrimidine dont les caractéristiques sont
les suivantes :
Spectre RMN 1H à 400 MHz : 3,42 (s, 3H); 4,95 (s, 2H);
7,99 (d, J = 5,5 Hz, 1H); 9,12 (d, J = 5,5 Hz, 1H)
Spectre de Masse (IE) : m/z=206 : [M]+
m/z=191 : [M] + - CH3
m/z=142 : [M] + - S02
m/z=127 : [M]+ - S02CH3 (pic de base)
Stade d) : [2-(méthylsulfonyl)pyrimidin-4-yl]méthanol
HO
/
N LJLS~~.
~*
0
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
A une solution de 2,66 g de 2-(méthylsulfonyl)-4-
[(tétrahydro-2H-pyran-2-yloxy)méthyl]pyrimidine obtenu â.u
stade c) ci-dessous dans 244 mL d'éthanol sont ajoutés
0,8 mL d'acide chlorhydrique concentré. Le mélange
5 réactionnel est agité à température ambiante pendant 1
heure puis concentré sous pression réduite pour donner
1,2 g de [2-(méthylsulfonyl)pyrimidin-4-yl]méthanol dont
les caractéristiques sont les suivantes :
Spectre RMN 1H à 300 MHz : 3,40 (s, 3H); 4,68 (d, J = 5,5
10 Hz, 2H); 5,87 (t, J = 5,5 Hz, 1H); 7,85 (d, J = 5,5 Hz,
1H); 9,02 (d, J = 5,5 Hz, 1H) .
Spectre de Masse (IE) : m/z=188 : [M]+
m/z=158 : [M]+ - CH2O
m/z=124 : [M]+ - S02
15 m/z=109 :[M]+ - SO2CH3 (pic de base)
Stade c) : 2-(méthylsulfonyl)-4-[(tétrahydro-2H-pyran-2-
yloxy)méthyl]pyrimidine
Q
O
/ ~
~
N e S *
O
20 A une solution de 2,63 g de 2-(méthylthio)-4-
[(tétrahydro-2H-pyran-2-yloxy)méthyl]pyrimidine obtenu au
stade b) ci-dessous dans 79 mL de dichlorométhane et 8,8
mL de méthanol sont ajoutés 8,3 g d'acide méta-
chloroperbenzoique. Le mélange réactionnel est agité à
25 température ambiante pendant 5 heures. La phase organique
est ensuite lavée successivement avec une solution
saturée de bisulfite de sodium, une solution saturée de
bicarbonate de sodium, une solution saturée de chlorure
de sodium, séchée sur sulfate de magnésium et filtrée. Le
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
71
solvent est ensuite distillé sous pression réduite pour
donner 3,02 g de 2-(méthylsulfonyl)-4-[(tétrahydro-2H-
pyran-2-yloxy)méthyl]pyrimidine dont les caractéristiques
sont les suivantes :
Spectre RMN 1H à 400 MHz : de 1,40 à 1,87 (m, 6H) ; 3,40
(s, 3H); 3,49 (m, 1H); 3,79 (m, 1H); 4,74 (d, J = 16,0
Hz, 1H) ; 4,80 (t, J= 3,0 Hz, 1H) ; 4,83 (d, J= 16,0 Hz,
1H) ; 7,86 (d, J = 5,5 Hz, 1H) ; 9,05 (d, J = 5,5 Hz, 1H)
Spectre de Masse (ES): m/z=273 [M+H]+ (pic de base)
m/z=189 [M+H]+ -C5H90 ( pic de base )
Stade b) : 2-(méthylthio)-4-[(tétrahydro-2H-pyran-2-
yloxy)méthyl]pyrimidine
O
O
N ~
S
A une solution de 3,4 g de [2-(méthylthio)pyrimidin-4-
yl]méthanol obtenu au stade a) ci-dessous dans 60 mL de
dichlorométhane sont ajoutés 2,197 g de 3,4-dihydropyrane
et 0,414 g d'acide para-toluènesulfonique. Le mélange
réactionnel est agité à température ambiante pendant 15
heures puis porté au reflux pendant 1 heure et refroidi
dans un bain de glace. La phase organique est ensuite
lavée successivement avec une solution saturée de
bicarbonate de sodium, de l'eau, une solution saturée de
chlorure de sodium, séchée sur sulfate de magnésium,
filtrée et concentrée sous pression réduite. Le résidu
est purifié par chromatographie sur colonne de silice en
éluant par un mélange d'acétate d'éthyle et de
cyclohexane (10/90 en volumes) pour donner 4,75 g de 2-
(méthylthio)-4-[(tétrahydro-2H-pyran-2-
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
72
yloacy)méthyl]pyrimidine dont les caractéristiques sont
les suivantes :
Spectre RMN1H à 300 MHz : de 1,40 à 1,87 (m, 6H); 2,50
(s masqué, 3H) ; 3,48 (m, 1H) ; 3,78 (m, 1H) ; 4,51 (d, J =
15,0 Hz, 1H) ; 4,65 (d, J = 15,0 Hz, 1H) ; 4,74 (t, J = 3,0
Hz, 1H) ; 7, 23 (d, J 5, 5 Hz, 1H) ; 8, 61 (d, J = 5, 5 Hz,
1H).
Spectre de Masse (IE) m/z=240; [M]+
m/z=140 : [M]+ - C5H902
Spectre de Masse (IC) : m/z=241 [M+H] +
Stade a) : [2-(méthylthio)pyrimidin-4-yl]méthanol
HO
N S
A une solution de 10 g de 4-formyl-2-
(méthylthio)pyrimidine dans 200 mL de méthanol sont
ajoutés sous argon, par portions, 4,9 g de borohydrure de
sodium. Le mélange réactionnel est agité à température
ambiante pendant 15 heures puis concentré sous pression
réduite. Le résidu est repris dans du dichlorométhane,
lavé successivement avec de l'eau, une solution saturée
de chlorure de sodium, séché sur sulfate de magnésium,
filtré et concentré sous pression réduite. Le résidu est
trituré dans de l'éther di-isopropylique pour donner 5,4
g de [2-(méthylthio)pyrimidin-4-yl]méthanol dont les
caractéristiques sont les suivantes :
Spectre RMN 1H à 300 MHz : 2,49 (s, 3H); 4,49 (d, J = 5,5
Hz, 2H) ; 5, 60 (t, J = 5, 5 Hz, 1H) ; 7, 24 (d, J= 5, 5 Hz,
1H); 8,60 (d, J = 5,5 Hz, 1H) .
Spectre de Masse (IE) : m/z=156 : [M]+
m/z=138 : [M]+ - H20
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
73
Exemple 11: 5,5-diméthyl-1-{[2-(pyridin-3-
ylamino)pyrimidin-4-yl]méthyl}-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
F
)< F
F
N~
ÇiCtt
N
H
A une solution de 0,13 g de 1-[(2-aminopyrimidin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade g) de l'exemple 10 dans 10 mL de
dioxanne, sont ajoutés successivement sous argon, 0,1 g
de 3-bromopyridine, 0,39 g de carbonate de césium, 0,044
g de 9,9-diméthyl-4,5-bis(diphenylphosphino)xanthene
(Xantphos) et 0,015 g d'acétate de palladium. Le mélange
réactionnel est chauffé à 100 C pendant 15 heures puis
concentré sous pression réduite. Le résidu est purifié
par chromatographie sur colonne de silice en éluant par
un mélange de dichlorométhane, d'acétonitrile et de
méthanol (98/1/1 en volumes) pour donner 0,0264 g de 5,5-
diméthyl-l-{[2-(pyridin-3-ylamino)pyrimidin-4-yl]méthyl}-
3-{4-[(trifluorométhyl)thio]phényl}imidazolidine-2,4-
dione dont les caractéristiques sont les suivantes :
Spectre RNIIS 1H à 400 MHz : 1,45 (s, 6H) ; 4,61 (s, 2H) ;
7,00 (d, J = 5,5 Hz, 1H); 7,21 (dd, J = 5,0 et 8,0 Hz,
1H) ; 7,70 (d, J = 8,5 Hz, 2H) ; 7,87 (d, J = 8,5 Hz, 2H) ;
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
74
8,14 (d large, J= 5,5 Hz, 1H); 8,19 (d large, J = 8,0
Hz, 1H); 8,48 (d, J = 5,5 Hz, 1H); 8,92 (d large, J = 5,0
Hz, 1H); 9,80 (S, 1H) .
Spectre de Masse (ES): m/z=489 [M+H]+
m/z=487 [M-H] -
Exemple 12: 3-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidin-1-
yl)méthyl]pyrimidin-2-yl}-1,1-diméthylurée
F
F
F
'~01%
/
O N
~ ~ =
N H 1
Stade c) : 3-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidin-1-
yl)méthyl]pyrimidin-2-yl}-1,1-diméthylurée
A une solution de 0,12 g de {4-[(5,5-diméthyl-2,4-dioxo-
3-{4-[(trifluorométhyl)sulfonyl]phényl}imidazolidin-1-
yl)méthyl]pyrimidin-2-yl}carbamate de phényle obtenu â.u
stade b) ci-dessous dans 4 mL de tétrahydrofuranne sont
ajoutés 1,06 mL d'une solution 2M de diméthylamine dans
le tétrahydrofuranne. Le mélange réactionnel est agité à
température ambiante sous argon pendant trois heures puis
concentré sous pression réduite. Le résidu est purifié
par chromatographie sur colonne de silice en éluant par
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
un mélange de dichlorométhane et de méthanol (98/2 en
volumes) pour donner 0,06 g de 3-{4-[(5,5-diméthyl-2,4-
dioxo-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidin-1-
5 yl)méthyl]pyrimidin-2-yl}-1,1-diméthylurée dont les
caractéristiques sont les suivantes
Spectre RMN 1H à 400 MHz : 1,48 (s, 6H); 2,89 (s, 6H);
4, 59 (s, 2H) ; 7,11 (d, J= 5, 5 Hz, 1H) ; 8, 03 (d, J = 8, 5
Hz, 2H) ; 8,30 (d, J = 8,5 Hz, 2H) ; 8,48 (d, J = 5,5 Hz,
10 1H) ; 9,27 (s, 1H) .
Spectre de Masse (ES): m/z=515 [M+H]+
m/z=513 [M-H] -
Stade b) : {4-[(5,5-diméthyl-2,4-dioxo-3-{4-
15 [(trifluorométhyl)suifonyl]phényl}imidazolidin-1-
yl)méthyl]pyrimidin-2-yl}carbamate de phényle
F
~~)< F
% F
O N
N N
H
A une solution de 0,8 g de 1-[(2-aminopyrimidin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
20 [(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
obtenu au stade a) ci-dessous dans 40 mL de
tétrahydrofuranne sont ajoutés successivement à 0 C sous
argon, 0,184 mL de pyridine et 0,23 mL de chloroformate
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
76
de phényle puis la solution est agitée pendant 15 heures
à température ambiante. Le mélange réactionnel est repris
dans de l'acétate d'éthyle et lavé successivement avec de
l'acide chlorhydrique concentré, de l'eau, une solution
saturée d'hydrogénocarbonate de sodium, une solution
saturée de chlorure de sodium et séché sur sulfate de
magnésium. Après filtration la solution est concentrée
sous pression réduite et le résidu purifié par
chromatographie sur colonne de silice en éluant par un
mélange d'acétate d'éthyle et de cyclohexane (65/35 en
volumes) pour donner 0,68 g de {4-[(5,5-diméthyl-2,4-
dioxo-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidin-1-
yl)méthyl]pyrimidin-2-yl}carbamate de phényle dont les
caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 1,43 (s, 6H) ; 4, 55 (s, 2H) ;
7, 01 (d, J = 5, 5 Hz, 1H) ; 7, 08 (d, J 7,5 Hz, 2H) ; 7,28
(t partiellement masqué, J = 7,5 Hz, 1H); 7,31 (t, J =
7,5 Hz, 2H); 7,84 (s, 1H); 7,86 (d, J 8,5 Hz, 2H); 7,97
(d, J = 8,5 Hz, 2H); 8,50 (d, J = 5,5 Hz, 1H).
Spectre de Masse (ES) : m/z=563 [M+H]+
Stade a) : 1- [ (2-aminopyrimidin-4-yl)méthyl] -5, 5-
diméthyl-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
77
F
)<~
Q%
O N
=~
N NH2
A une solution de 0,91 g de 1-(2-méthanesulfonyl-
pyrimidin-4-ylméthyl)-5,5-diméthyl-3-(4-
trifluorométhylsulfonyl-phenyl)-imidazolidine-2,4-dione
obtenu au stade c) de l'exemple 9 dans 5 mL de dioxanne
sont ajoutés 5 mL d'ammoniaque concentré. Le mélange
réactionnel est chauffé au microonde à 120 C pendant 1
heure, laissé à température ambiante pendant 15 heures
puis concentré sous pression réduite. Le résidu est
purifié par chromatographie sur colonne de silice en
éluant par un mélange d'acétate d'éthyle et de
cyclohexane (70/30 en volumes) pour donner 0,54 g de 1-
[(2-aminopyrimidin-4-yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes :
Spectre RNNN 1H à 400 MHz : 1,46 (s, 6H); 4,43 (s, 2H);
6,59 (s large, 2H); 6,69 (d, J = 5,5 Hz, 1H); 8,03 (d, J
= 8,5 Hz, 2H) ; 8,19 (d, J = 5,5 Hz, 1H) ; 8,30 (d, J = 8,5
Hz, 2H) .
Spectre de Masse (ES) m/z=444 [M+H]*
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
78
Exemple 13: 5,5-diméthyl-1-{[2-(pyrimidin-5-
ylamino)pyridin-4-yl]méthyl}-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
F
0% F Oi% F
I '
/
o N
~ ~II
N N N
H
Stade c) : 5,5-diméthyl-l-{[2-(pyrimidin-5-
ylamino)pyridin-4-yl]méthyl}-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
A une solution de 0,36 g de 1-[(2-aminopyridin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
obtenu au stade b) ci-dessous dans 20 mL de dioxanne sont
ajoutés successivement sous argon, 0,19 g de 5-
bromopyrimidine, 0,056 g de 9,9-diméthyl-4,5-
bis(diphenylphosphino)xanthene (Xantphos), 0,027 g
d'acétate de palladium et 1 g de carbonate de césium. Le
mélange réactionnel est chauffé à 90 C pendant 3
heurespuis filtré et concentré sous pression réduite. Le
résidu est purifié par chromatographie sur colonne de
silice en éluant par un mélange de dichlorométhane et de
méthanol (98/2 en volumes) pour donner 0.15 g de 5,5-
diméthyl-l-{[2-(pyrimidin-5-ylamino)pyridin-4-yl]méthyl}-
3-{4-[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-
dione dont les caractéristiques sont les suivantes :
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
79
Spectre RMN 1H à 400 MHz : 1,48 (s, 6H); 4,61 (s, 2H);
6, 90 (s large, 1H) ; 6, 94 (d large, J = 5, 5 Hz, 1H) ; 8, 07
(d, J = 8, 5 Hz, 2H) ; 8,19 (d, J = 5, 5 Hz, 1H) ; 8, 31 (d, J
= 8,5 Hz, 2H); 8,70 (s, 1H); 9,12 (s, 2H); 9,38 (s, 1H)
Spectre de Masse (ES) : m/z=521 [M+H] +
m/z=519 [M-H] -
Stade b) : 1-[(2-a.minopyridin-4-yl)méthyl]-5,5-diméthyl-
3-{4-[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-
dione
j<F
O%% F
O~
O N
N
=
JL
N NH2
A une solution de 1,5 g de N-{4-[(5,5-diméthyl-2,4-dioxo-
3-{4-[(trifluorométhyl)sulfonyl]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}acétamide obtenu au stade a) ci-
dessous dans 25 mL de méthanol sont ajoutés 0,62 mL
d'une solution d'hydroxyde de sodium à 30% dans l'eau. Le
mélange réactionnel est chauffé à 50 C pendant 24 heures
puis concentré sous pression réduite. Le résidu est
purifié par chromatographie sur colonne de silice en
éluant par un mélange d'acétate d'éthyle et de
cyclohexane (85/15 en volumes) pour donner 0.4 g de 1-
[(2-aminopyridin-4-yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes :
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
Spectre RMN 1H à 400 MHz : 1,50 (s, 6H); 3,41 (s, 3H);
4, 89 (s, 2H) ; 8, 00 (d, J 7, 0 Hz, 1H) ; 8, 03 (d, J = 8,5
Hz, 2H) ; 8,30 (d, J = 8,5 Hz, 2H) ; 9,05 (d, J= 7,0 Hz,
1H) .
5 Spectre de Masse (ES) m/z=443 [M+H]+
Stade a) : N-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}acétamide
j<F
0, F
O N 0
N N
10 H
A une solution de 3 g de 1-(2-Chloro-pyridin-4-ylmethyl)-
5,5-dimethyl-3-(4-trifluoromethanesulfonyl-phenyl)-
imidazolidine-2,4-dione obtenu au stade b) de l'exemple 4
dans 60 mL de dioxanne sont ajoutés successivement sous
15 argon, 0,96 g d'acetamide, 0,45 g de 9,9-diméthyl-4,5-
bis(diphenylphosphino)xanthene (Xantphos), 0,146 g
d'acétate de palladium et 7,4 g de carbonate de césium.
Le mélange réactionnel est chauffé au reflux pendant 5
heures puis filtré et concentré sous pression réduite. Le
20 résidu est purifié par chromatographie sur colonne de
silice en éluant par un mélange d'acétate d'éthyle et de
cyclohexane (60/40 en volumes) pour donner 1,5 g de N-{4-
[(5,5-diméthyl-2,4-dioxo-3-{4-
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
81
[(trifluorométhyl)sulfonyl]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}acétamide dont les
caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 1,43 (s, 6H); 2,07 (s, 3H);
4,63 (s, 2H) ; 7,15 (dd, J 1,5 et 5,5 Hz, 1H) ; 8,03 (d,
J = 8,5 Hz, 2H); 8,11 (s large, 1H); 8,24 (d, J= 5,5 Hz,
1H); 8,30 (d, J = 8,5 Hz, 2H); 10,5 (s large, 1H).
Spectre de Masse (ES) : m/z=485 [M+H]+
m/z=483 [M-H] -
Exemple 14: 5,5-diméthyl-1-{[2-(pyrimidin-5-
ylamino)pyridin-4-yl]méthyl}-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
F
<F
F
N~O
JN
Nf IIN
H
Stade c) : 5,5-diméthyl-l-{[2-(pyrimidin-5-
ylamino)pyridin-4-yl]méthyl}-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
A une solution de 0,2 g de 1-[(2-aminopyridin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade b) ci-dessous dans 5 mL de dioxanne sont
ajoutés successivement sous argon, 0,1 g de 5-
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
82
bromopyrimidine, 0,025 g de 9,9-diméthyl-4,5-
bis(diphenylphosphino)xanthene (Xantphos), 0,01 g
d'acétate de palladium et 0,55 g de carbonate de césium.
Le mélange réactionnel est chauffé au reflux pendant 15
heures puis filtré et concentré sous pression réduite. Le
résidu est purifié par chromatographie sur colonne de
silice en éluant par un mélange de dichlorométhane, de
méthanol et d'ammoniaque (93/6/1 en volumes) pour donner
0.02 g de 5,5-diméthyl-l-{[2-(pyrimidin-5-
ylamino)pyridin-4-yl]méthyl}-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes :
Spectre RMN 1H à 300 MHz : 1,45 (s, 6H); 4,59 (s, 2H);
6,90 (s large, 1H); 6,92 (d large, J = 5,5 Hz, 1H); 7,69
(d, J = 8,5 Hz, 2H) ; 7,87 (d, J = 8,5 Hz, 2H) ; 8,18 (d, J
= 5,5 Hz, 1H) ; 8,70 (s, 1H) ; 9,13 (s, 2H) ; 9,40 (s, 1H) .
Spectre de Masse (ES) : m/z=489 [M+H]+
m/z=487 [M-H] -
Stade b) : 1-[(2-aminopyridin-4-yl)méthyl]-5,5-diméthyl-
3-{4-[(trifluorométhyl)thio]phényl}imidazolidine-2,4-
dione
F
F
F
o N
J
N NH2
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
83
A une solution de 1,54 g de N-{4-[(5,5-diméthyl-2,4-
dioxo-3-{4-[(trifluorométhyl)thio]phényl}imidazolidin-l-
yl)méthyl]pyridin-2-y1}acétamide obtenu au stade a) ci-
dessous dans 25 mL de méthanol sont ajoutés 0,68 mL
d'une solution d'hydroxyde de sodium à 30%- dans l'eau. Le
mélange réactionnel est chauffé à 50 C pendant 8 heures
puis concentré sous pression réduite. Le résidu est
purifié par chromatographie sur colonne de silice en
éluant par un mélange de dichlorométhane et de méthanol
(98/2 en volumes) pour donner 0.77 g de 1-[(2-
aminopyridin-4-yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes :
Spectre RNNN 1H à 400 MHz : 1,40 (s, 6H); 4,44 (s, 2H);
5,88 (s large, 2H); 6,42 (s large, 1H); 6,50 (dd, J = 1,5
et 5,5 Hz, 1H); 7,67 (d, J = 8,5 Hz, 2H); 7,83 (d, J
5,5 Hz, 1H); 7,88 (d, J = 8,5 Hz, 2H)
Spectre de Masse (ES) : m/z=411 [M+H]+
Stade a) : N-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}acétamide
F
~F
F
N
/ I .
N N
H
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
84
A une solution de 3 g de 1-[(2-chloropyridin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade d) de l'exemple 1 dans 60 mL de dioxanne
sont ajoutés successivement sous argon, 1,03 g
d'acetamide, 0,484 g de 9,9-diméthyl-4,5-
bis(diphenylphosphino)xanthene (Xantphos), 0,156 g
d'acétate de palladium et 7,96 g de carbonate de césium.
Le mélange réactionnel est chauffé à 90 C pendant 5
heures puis filtré et concentré sous pression réduite. Le
résidu est purifié par chromatographie sur colonne de
silice en éluant par un mélange d'acétate d'éthyle et de
cyclohexane (50/50 en volumes) pour donner 2,85 g de N-
{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}acétamide dont les
caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 1,41 (s, 6H); 2,09 (s, 3H);
4,63 (s, 2H) ; 7,13 (dd, J 1,5 et 5,5 Hz, 1H) ; 7,66 (d,
J = 8,5 Hz, 2H); 7,88 (d, J = 8,5 Hz, 2H); 8,11 (s large,
1H); 8,24 (d, J = 5,5 Hz, 1H); 10,5 (s large, 1H).
Spectre de Masse (ES) : m/z=453 [M+H]+
m/z=451 [M-H] -
Exemple 15: 5,5-diméthyl-l-{[2-(pyrimidin-5-
ylamino)pyrimidin-4-yl]méthyl}-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
F
)< F
F
O N~O
~
f N
N N
H
A une solution de 0,13 g de 1-[(2-aminopyrimidin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
5 obtenu au stade g) de l'exemple 10 dans 10 mL de
dioxanne sont ajoutés successivement sous argon, 0,075 g
de 5-bromopyrimidine, 0,02 g de 9,9-diméthyl-4,5-
bis(diphenylphosphino)xanthene (xantphos), 0,007 g
d'acétate de palladium et 0,39 g de carbonate de césium.
10 Le mélange réactionnel est chauffé au reflux pendant 15
heures puis filtré et concentré sous pression réduite. Le
résidu est purifié par chromatographie sur colonne de
silice en éluant par un mélange de dichlorométhane et de
méthanol (98/2 en volumes) pour donner 0.043 g de 5,5-
15 diméthyl-l-{[2-(pyrimidin-5-ylamino)pyrimidin-4-
yl]méthyl}-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 1,45 (s, 6H); 4,64 (s, 2H);
20 7, 06 (d, J = 5, 5 Hz, 1H) ; 7, 71 (d, J = 8, 5 Hz, 2H) ; 7, 86
(d, J = 8,5 Hz, 2H); 8,52 (d, J = 5,5 Hz, 1H); 8,76 (s,
1H) ; 9,18 (S, 2H) ; 10, 0(s, 1H).
Spectre de Masse (ES) : m/z=490 [M+H]+
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
86
m/z=488 [M-H] -
Exemple 16: 5,5-diméthyl-l-{[2-(pyrimidin-5-
ylamino)pyrimidin-4-yl]méthyl}-3-{4-
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
F
j< F
F
~ ' .
/
N
/ H
A une solution de 0,36 g de 1-[(2-aminopyrimidin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade g) de l'exemple 10 dans 20 mL de dioxanne
sont ajoutés successivement sous argon, 0,19 g de 5-
bromopyrimidine, 0,055 g de 9,9-diméthyl-4,5-
bis(diphenylphosphino)xanthene (Xantphos), 0,018 g
d'acétate de palladium et 1 g de carbonate de césium. Le
mélange réactionnel est chauffé au reflux pendant 15
heurespuis filtré et concentré sous pression réduite. Le
résidu est purifié par chromatographie sur colonne de
silice en éluant par un mélange de dichlorométhane et de
méthanol (98/2 en volumes) pour donner 0.16 g de 5,5-
diméthyl-l-{[2-(pyrimidin-5-ylamino)pyrimidin-4-
yl]méthyl}-3-{4-
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
87
[(trifluorométhyl)sulfonyl]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 1,48 (s, 6H); 4,67 (s, 2H);
7, 10 (d, J = 5, 5 Hz, 1H) ; 8, 08 (d, J = 8, 5 Hz, 2H) ; 8, 30
(d, J = 8,5 Hz, 2H); 8,52 (d, J= 5,5 Hz, 1H); 8,76 (s,
1H); 9,19 (s, 2H); 10,0 (s, 1H).
Spectre de Masse (ES) : m/z=522 [M+H]+
m/z=520 [M-H] -
Exemple 17: 1-({2-[(5-fluoropyridin-3-yl)amino]pyridin-4-
yl}méthyl)-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
F
~F
F
Q N
F
N N N
H
A une solution de 0,2 g de 1-[(2-aminopyridin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade b) de l'exemple 14 dans 5 mL de dioxanne
sont ajoutés successivement sous argon, 0,087 g de 5-
bromo-3-fluoropyridine, 0,025 g de 9,9-diméthyl-4,5-
bis(diphenylphosphino)xanthene (Xantphos), 0,010 g
d'acétate de palladium et 0,7 g de carbonate de césium.
Le mélange réactionnel est chauffé au reflux pendant 3,5
heurespuis filtré et concentré sous pression réduite. Le
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
88
résidu est purifié par chromatographie sur colonne de
silice en éluant par un gradient d'acétone dans le
dichlorométhane pour donner 0.17 g de 1-({2-[(5-
fluoropyridin-3-yl)amino]pyridin-4-yl}méthyl)-5,5-
diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 1,45 (s, 6H); 4,59 (s, 2H);
6190 (s large, 1H) ; 6,92 (d large, J = 5,5 Hz, 1H) ; 7,69
(d, J = 8,5 Hz, 2H); 7,88 (d, J = 8,5 Hz, 2H); 8,05 (d,-J
= 2,5 Hz, 1H); 8,20 (d, J = 5,5 Hz, 1H); 8,38 (td, J =
2,5 et 12,5 Hz, 1H); 8,50 (t, J = 2,5 Hz, 1H); 9,55 (m
large, 1H) .
Spectre de Masse (ES) : m/z=506 [M+H]+
La présente invention comprend notamment les
produits de formule (I) appartenant à la formule (Ia)
suivante
F F
FSO n
0
N
O N
O
NWkN'R4
H 1
R5
(la)
dans laquelle n et NR4R5 ont les significations
indiquées ci-dessus.
Les produits de f omule (Ia) peuvent notamment être
préparés comme indiqué sur le schéma général 3 en deux
stades (composés Z et AA).
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
89
Les produits de formule (Ia) telle que définie ci-
dessus dans lesquels le radical NR.4R5 a les valeurs
indiquées ci-dessus numérotées en ex 18 à ex 40
correspondent respectivement aux exemples 18 à 403- qui
appartiennent à la présente invention : la préparation du
produit de l'exemple 18 est décrite ci-après et les
produits des exemples 19 à 43 sont préparés comme indiqué
pour le produit de l'exemple 18 en remplaçant au stade B)
la 3-Pyrrolidin-l-yl-propylamine par l'intermédiaire
correspondant approprié de formule HNR4R5.
Des exemples de produits ayant différents radicaux
NR4R5 selon la présente invention sont indiqués ci-
après :
N~N N ~ ND
H2N~ H2N~~ N H2N
ex 18 ex 19 ex 20 ex 21
Exemple 18 : 1-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-3-(3-pyrrolidin-1-ylpropyl)urée
Stade b) : 1-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-3-(3-pyrrolidin-1-ylpropyl)urée
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
F F
'S
F
O
O
N N)~N~~N
H H
A une solution de 0.15 g de {{4-[(5,5-diméthyl-2,4-dioxo-
3-{4-[(trifluorométhyl)thio]phényl}imidazolidin-i-
yl)méthyl]pyridin-2-yl}carbamate d'éthyle obtenu au stade
5 a) ci-dessous dans 2 mL de N-méthyl pyrrilidinone sont
ajoutés 0.316 mL de 3-Pyrrolidin-1-yl-propylamine. La
solution est chauffée à 130 C au micro-onde pendant 1
heure. Le mélange réactionnel est ensuite dilué avec 10
mL d'eau distillée et extrait avec 3 fois 30 mL
10 d'acétate d'éthyle. Les phases organiques réunies sont
concentrées sous pression réduite et le résidu purifié
par chromatographies sur colonne de silice (en éluant
avec un gradient de dichlorométhane et un mélange de
méthanol et d'ammoniaque 85/15 en volume) pour donner
15 0.072 g de 1-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-3-(3-pyrrolidin-l-ylpropyl)urée
dont les caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 1,42 (s, 6H); 1,61 (m, 2H);
20 1,67 (m, 4H); 2,41 (m, 6H); 3,20 (q, J = 6,5 Hz, 2H);
4,56 (s, 2H); 6,94 (d large, J = 5,5 Hz, 1H); 7,32 (s
large, 1H); 7,67 (d, J = 9,0 Hz, 2H); 7,87 (d, J = 9,0
Hz, 2H); 8,11 (d, J = 5,5 Hz, 1H); 8,27 (m, 1H); 9,11 (s,
1H) .
25 Spectre de Masse (ES) : m/z=565, [M+H]+ pic de base
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
91
Stade a) : {4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-l-
yl)méthyl]pyridin-2-yl}carbamate d'éthyle
F F
)~S
F
0 ~ /
N fO
O N
O
N N~O
H
A une solution de 4.3 g de 1-[(2-chloropyridin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade d) de l'exemple 1 dans 105 mL de dioxane
sont ajouté successivement sous argon, 1.36 g de
carbamate d'éthyle, 12.38 g carbonate de césium, 0.22 g
d'acétate de palladium et 0.58 g de 9,9-diméthyl-4,5-
bis(diphénylphosphino)xanthene. Le mélange réactionnel
est chauffé au reflux pendant 2 heures, filtré et
concentré sous pression réduite. Le résidu est trituré
avec de l'éther diéthylique pour donner 3.56 de {{4-
[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}carbamate d'éthyle dont les
caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 1,23 (t, J = 7,5 Hz, 3H) ; 1,42
(s, 6H); 4,14 (q, J = 7,5 Hz, 2H); 4,62 (s, 2H); 7,09
(dd, J = 1,5 et 5,5 Hz, 1H); 7,66 (d, J = 8,5 Hz, 2H);
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
92
7,86 (m, 3H); 8,20 (d, J = 5,5 Hz, 1H); 10,1 (s large,
1H) .
Spectre de Masse (IE) : m/z=482 M+. pic de base
m/z=467 (M -CH3)+
m/z=410 (M -C02C2H5)+.
Exemple 19 : 1-cyclopentyl-3-{4-[(5,5-diméthyl-2,4-dioxo-
3-{4-[(trifluorométhyl)thio]phényl}imidazolidin-l-
yl)méthyl]pyridin-2-yl}urée
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3-Pyrrolidin-1-yl-propylamine par la
cyclopentylamine et la N-méthylpyrrolidinone par le
tétrahydrofuranne, en chauffant pendant 2 heures à 140 C,
pour donner 97 mg de 1-cyclopentyl-3-{4-[(5,5-diméthyl-
2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}urée dont les caractéristiques
sont les suivantes
Spectre RMN 1H à 400 MHz : 1,39 (m partiellement masqué,
2H) ; 1,42 (s, 6H) ; de 1,50 à 1,72 (m, 4 H) ; 1,86 (m, 2H) ;
4,00 (m, 1H); 4,58 (s, 2H); 6,94 (d large, J = 5,5 Hz,
1H); 7,36 (s large, 1H); 7,65 (d, J = 8,5 Hz, 2H); 7,87
(d, J = 8,5 Hz, 2H); 8,11 (d, J = 5,5 Hz, 1H); 8,20 (d
large, J = 7,5 Hz, 1H); 9,02 (s, 1H).
Spectre de Masse (ES) : m/Z= 522 [M+H]+
m/Z= = 520; [M-H] -
Exemple 20 : 1-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-3-(2-pyrrolidin-1-yléthyl)urée
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3-Pyrrolidin-1-yl-propylamine par la N-(2-
aminoéthyl) pyrrolidine pour donner 93 mg de 1-{4-[(5,5-
diméthyl-2,4-dioxo-3-{4-
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
93
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-3-(2-pyrrolidin-1-yléthyl)urée
dont les caractéristiques sont les suivantes :
Spectre RNN 1H à 400 MHz : 1,42 (s, 6H); 1,69 (m, 4H);
2,47 (m, 4H); 2,52 (t partiellement masqué, J = 6,5 Hz,
2H); 3,27 (q, J = 6,5 Hz, 2H); 4,58 (s, 2H); 6,94 (d
large, J = 5,5 Hz, 1H) ; 7,36 (s large, 1H) ; 7,67 (d, J=
9,0 Hz, 2H) ; 7,87 (d, J = 9,0 Hz, 2H) ; 8,10 (d, J = 5,5
Hz, 1H) ; 8,25 (m large, 1H) ; 9,17 (s, 1H)
Spectre de Masse (ES) : m/z=551 [M+H]+
m/z=411; [MH -C7H12N20] +
m/z=141; C7H13N20+ pic de base
Exemple 21 . 1-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-3-(4-pyrrolidin-1-ylbutyl)urée
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3-Pyrrolidin-l-yl-propylamine par la 1-
(4aminobutyl)pyrrolidine pour donner 100 mg de 1-{4-
[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-3-(4-pyrrolidin-1-ylbutyl)urée
dont les caractéristiques sont les suivantes :
Spectre RNN 1H à 400 MHz : 1,42 (s, 6H); 1,47 (m, 4H);
1,65 (m, 4H); 2,38 (m, 6H); 3,17 (q, J = 6,5 Hz, 2H);
4,58 (s, 2H); 6,95 (d large, J = 5,5 Hz, 1H); 7,32 (s
large, 1H); 7,67 (d, J = 9,0 Hz, 2H); 7,87 (d, J = 9,0
Hz, 2H); 8,12 (d, J 5,5 Hz, 1H); 8,26 (m large, 1H);
9, 12 (s, 1H)
Spectre de Masse (ES) : m/z=579 [M+H] +
m/z=290; [M+2H] 2+/2 pic de base
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
94
\
H2N--4 H2N-0 H H2N
ex 22 ex 23 ex 24 ex 25
Exemple 22 : 1-cyclopropyl-3-{4-[(5,5-diméthyl-2,4-dioxo-
3-{4-[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}urée
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3-Pyrrolidin-1-yl-propylamine par la
cyclopropylamine et la N-méthylpyrrolidinone par le
tétrahydrofuranne, en chauffant pendant 2 heures à 140 C,
pour donner 110 mg de 1-cyclopropyl-3-{4-[(5,5-diméthyl-
2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}urée dont les caractéristiques
sont les suivantes :
Spectre RMN 1H 400 MHz : 0,44 (m, 2H); 0,66 (m, 2H); 1,42
(s, 6H) ; 2,60 (m, 1 H); 4, 56 (s, 2H) ; 6,95 (dd, J = 1,5 Hz,
1H); 7,37 (s large, 1H); 7,67 (d, J= 8,5 Hz, 2H); 7,87
(d, J = 8,5 Hz, 2H); 8,11 (d, J = 5,5 Hz, 1H); 8,23 (m
large, 1H); 9,06 (s, 1H).
Spectre de Masse (ES) : m/z=494 [M+H]+
m/z=492; [M-H] -
m/z=538; MH- + HCO2H
m/z=409 [M+H]+ - C4H6NO
Exemple 23 : 1-cyclobutyl-3-{4-[(5,5-diméthyl-2,4-dioxo-
3-{4-[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}urée
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3-Pyrrolidin-1-yl-propylamine par la
cyclobutylamine et la N-méthylpyrrolidinone par le
méthanol, pour donner 50 mg de 1-cyclobutyl-3-{4-[(5,5-
diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
yl)méthyl]pyridin-2-yl}urée dont les caractéristiques
sont les suivantes :
Spectre de RNN 1H 400 MHz : 1, 42 (s, 6H) ; de 1, 55 à 1, 70
(m, 2H); de 1,81 à 1,94 (m, 2H); de 2,18 à 2,27 (m , 2H);
5 4,18 (m, 1H) ; 4,58 (s, 2H) ; 6,96 (dd, J = 1,5 et 5,5 Hz,
1H); 7,37 (s large, 1H); 7,66 (d, J= 9,0 Hz , 2H); 7,87
(d, J = 9,0 Hz, 2H); 8,13 (d, J = 5,5 Hz, 1H); 8,36 (d
large, J = 7,5 Hz, 1H) ; 9,06 (s, 1H) .
Spectre de Masse (ES) : m/z=508 [M+H]+
10 m/z=506; [M-H] -
Exemple 24 : 1-cyclopentyl-3-{4-[(5,5-diméthyl-2,4-dioxo-
3-{4-[(trifluorométhyl)thio]phényl}imidazolidin-1-
15 yl)méthyl]pyridin-2-yl}-i-méthylurée
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3-Pyrrolidin-1-yl-propylamine par la N-
methylcyclopentylamine et la N-méthylpyrrolidinone par
le tétrahydrofuranne, pour donner 56 mg de 1-cyclopentyl-
20 3-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-l-
yl)méthyl]pyridin-2-yl}-1-méthylurée dont les
caractéristiques sont les suivantes :
Spectre RNIIN 1H à 400 MHz : 1,41 (s, 6H) ; de 1,45 à 1,80
25 (m, 8H); 2,81 (s, 3H); 4,60 (s, 2H); 4,61 (m, 1H); 7,01
(d large, J = 5,5 Hz, 1H); 7,68 (d, J = 8,5 Hz, 2H); 7,86
(m, 3H); 8,18 (d, J = 5,5 Hz, 1H); 8,73 (s, 1H).
Spectre de Masse (ES) : m/z=536 [M+H]+
m/z=534 [M-H] -
Exemple 25 . 1-cyclohexyl-3-{4-[(5,5-diméthyl-2,4-dioxo-
3-{4-[(trifluorométhyl)thio]phényl}imidazolidin-l-
yl)méthyl]pyridin-2-yl}urée
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3-Pyrrolidin-1-yl-propylamine par la
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
96
cycloxexylamine et la N-méthylpyrrolidinone par le
tétrahydrofuranne, pour donner 90 mg de 1-cyclohexyl-3-
{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-l-
yl)méthyl]pyridin-2-yl}urée dont les caractéristiques
sont les suivantes
Spectre RMN 1H à 400 MHz : De 1,16 à 1,39 (m, 5H) ; 1,42
(s, 6H); 1,53 (m, 1H); 1,65 (m, 2H); 1,82 (m, 2H); 3,56
(m, 1H); 4,58 (s, 2H); 6,94 (d large, J = 5,5 Hz, 1H);
7,33 (s large, 1H); 7,67 (d, J= 8,5 Hz, 2H); 7,87 (d, J
=8,5 Hz, 2H) ; 8,12 (d, J = 5,5 Hz, 1H) ; 8,23 (d large, J
= 7,5 Hz, 1H); 9,06 (s, 1H).
Spectre de Masse (ES) : m/z=536 [M+H]+
m/z=534; [M-H] -
MH- + HCO2H = 580-
H N
Li ""E o (o)
N
1 ex 26 ex 27 ex 28 ex 29 ex 30
Exemple 26 : N-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}aziridine-1-carboxamide
Exemple 27 : N-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}azétidine-1-carboxamide
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3-Pyrrolidin-1-yl-propylamine par
l'azétidine et la N-méthylpyrrolidinone par le
tétrahydrofuranne, pour donner 65 mg de N-{4-[(5,5-
diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}azétidine-1-carboxamide dont les
caractéristiques sont les suivantes
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
97
Spectre RMN 1H à 400 MHz : 1,42 (s, 6H); 2,15 (m, 2H);
3,98 (t, J = 7,5 Hz, 4H) ; 4,59 (s, 2H) ; 7,01 (d large, J
= 5,5 Hz, 1H); 7,66 (d, J = 8,5 Hz, 2H); 7,86 (d, J = 8,5
Hz, 2H); 7,95 (s large, 1H); 8,16 (d, J = 5,5 Hz, 1H);
8,97 (s, 1H).
Spectre de Masse (ES) : m/z=494 [M+H]+
[M-H] - = 492- m/z=492; [M-H] -
Exemple 28 : N-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}pyrrolidine-1-carboxamide
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3-Pyrrolidin-1-yl-propylamine par la
pyrrolidine pour donner 40 mg de N-{4-[(5,5-diméthyl-2,4-
dioxo-3-{4-[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}pyrrolidine-1-carboxamide dont les
caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 1,42 (s, 6H); 1,83 (m, 4H);
3,39 (m, 4H); 4,59 (s, 2H); 7,01 (dd, J = 1,5 et 5,0 Hz,
1H) ; 7, 67 (d, J = 9, 0 Hz, 2H) ; 7, 86 (d, J = 9, 0 Hz, 2H) ;
7,96 (s large, 1H); 8,16 (d, J = 5,0 Hz, 1H); 8,60 (s,
1H) .
Spectre de Masse (ES) : m/z=508 [M+H]+
Exemple 29 : N-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}morpholine-4-carboxamide
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3-Pyrrolidin-1-yl-propylamine par la
morpholine et la N-méthylpyrrolidinone par le
tétrahydrofuranne, pour donner 84 mg de N-{4-[(5,5-
diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}morpholine-4-carboxamide dont les
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
98
caractéristiques sont les suivantes
Spectre RMN 1H à 400 MHz : 1,42 (s, 6H); 3,45 (m, 4H);
3,58 (m, 4H); 4,60 (s, 2H); 7,03 (d large, J = 5,5 Hz,
1H); 7,67 (d, J = 8,5 Hz, 2H); 7,84 (s large, 1H); 7,86
(d, J = 8,5 Hz, 2H); 8,18 (d, J = 5,5 Hz, 1H); 9,19 (s,
1H)
Spectre de Masse (ES) : m/z= 524 [M+H]+
m/z= 522; [M-H] -
Exemple 30 : N-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-4-méthylpipérazine-1-carboxamide
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3-Pyrrolidin-1-yl-propylamine par la N-
methylpiperazine et la N-méthylpyrrolidinone par le
tétrahydrofuranne, pour donner 50 mg de N-{4-[(5,5-
diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-4-méthylpipérazine-1-carboxamide
dont les caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 1,41 (s, 6H); 2,18 (s, 3H);
2,29 (m, 4H); 3,45 (m, 4H); 4,59 (s, 2H); 7,02 (d large,
J = 5,5 Hz, 1H) ; 7,66 (d, J = 8,5 Hz, 2H) ; 7,82 (s large,
1H) ; 7, 86 (d, J = 8, 5 Hz, 2H) ; 8, 17 (d, J = 5, 5 Hz, 1H) ;
9,12 (s, 1H)
Spectre de Masse (ES) : m/z=537 [M+H]+
m/z=535; [M-H] -
m/z=437 [M+H]+ - C5H11N2
~N~ 0
rD NI_ J
H2N H2N HzN ~~ v
ex 31 ex 32 ex 33
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
99
Exemple 31 : 1-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-3-(2-pipéridin-1-yléthyl)urée
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3 -Pyrrol idin- 1 -yl -propylamine par la 1-(2-
aminoéthyl)pipéridine et la N-méthylpyrrolidinone par le
tétrahydrofuranne, pour donner 88 mg de 1-{4-[(5,5-
diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-3-(2-pipéridin-1-yléthyl)urée
dont les caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : De 1, 35 à 1, 55 (m, 6H) ; 1, 42
(s, 6H); 2,36 (m, 6H); 3,26 (m partiellement masqué, 2H);
4,58 (s, 2H); 6,94 (dd, J = 1,5 et 5,5 Hz, 1H); 7,30 (s
large, 1H); 7,67 (d, J= 8,5 Hz, 2H); 7,87 (d, J= 8,5
Hz, 2H); 8,11 (d, J = 5,5 Hz, 1H); 8,42 (m large, 1H);
9,20 (s, 1H).
Spectre de Masse (ES) m/z= 565 [M+H]+
m/z=563; [M-H] -
Exemple 32 : 1-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-3-[2-(4-méthylpipérazin-1-
yl) éthyl] urée
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3 -Pyrrol idin- 1 -yl -propylamine par la 1-(2-
aminoéthyl)-4-méthyl pipérazine et la N-
méthylpyrrolidinone par le tétrahydrofuranne, pour
donner 60 mg de 1-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-3-[2-(4-méthylpipérazin-1-
yl)éthyl]urée dont les caractéristiques sont les
suivantes :
Spectre RNN 1H à 400 MHz : 1,42 (s, 6H) ; de 2,35 à 2,42
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
100
(m, 6H); 3,27 (m partiellement masqué, 2H); 3,59 (m, 4H);
4,58 (s, 2H); 6,95 (dd, J = 1,5 et 5,5 Hz, 1H); 7,30 (s
large, 1H); 7,66 (d, J= 8,5 Hz , 2H); 7,87 (d, J= 8,5
Hz, 2H); 8,12 (d, J = 5,5 Hz, 1H); 8,44 (m large, 1H);
9,21 (s, 1H) .
Spectre de Masse (ES) m/z=567 [M+H]+
Exemple 33 : 1-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-3-(2-morpholin-4-yléthyl)urée
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3-Pyrrolidin-1-yl-propylamine par la 1-(2-
aminoéthyl)morpholine et la N-méthylpyrrolidinone par le
tétrahydrofuranne, pour donner 110 mg de 1-{4-[(5,5-
diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-3-(2-morpholin-4-yléthyl)urée
dont les caractéristiques sont les suivantes :
Spectre RMDT 1H à 400 MHz : 1,42 (s, 6H) ; 2,15 (s, 3H) ; de
2,25 à 2,44 (m, 10H); 3,26 (m partiellement masqué, 2H);
4,57 (s, 2H); 6,95 (d large, J = 5,5 Hz , 1H); 7,29 (s
large, 1H); 7,67 (d, J= 8,5 Hz, 2H); 7,87 (d, J= 8,5
Hz, 2H); 8,11 (d, J 5,5 Hz, 1H); 8,44 (m large, 1H);
9,20 (s, 1H)
Spectre de Masse (ES) : m/z=580 [M+H]+
HNHNHN H2N
ex 34 ex 35 ex 36 ex 37
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
101
Exemple 34 : 3-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-1-éthyl-1-méthylurée
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3-Pyrrolidin-1-yl-propylamine par la N-
éthyl méthylamine et la N-méthylpyrrolidinone par le
tétrahydrofuranne, pour donner 101 mg de 3-{4-[(5,5-
diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-1-éthyl-1-méthylurée dont les
caractéristiques sont les suivantes
Spectre RMN 1H à 400 MHz : 1,06 (t, J = 7,0 Hz, 3H); 1,42
(s, 6H); 2,94 (s, 3H); 3,36 (d, J 7,0 Hz, 2H); 4,59 (s,
2H); 7,02 (dd, J = 1,5 et 5,5 Hz, 1H); 7,67 (d, J = 8,5
Hz, 2H); 7,85 (d, J = 8,5 Hz, 2H); 7,87 (s masque, 1H);
8,17 (d, J = 5,5 Hz, 1H); 8,72 (s, 1H).
Spectre de Masse (ES) : m/z=496 [M+H]+
m/z=494; [M-H] -
Exemple 35 : 3-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-1-méthyl-1-propylurée
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3-Pyrrolidin-1-yl-propylamine par la N-
méthyl-N-propylamine et la N-méthylpyrrolidinone par le
tétrahydrofuranne, pour donner 100 mg de 3-{4-[(5,5-
diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-1-méthyl-1-propylurée dont les
caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 0,85 (t, J = 7,0 Hz, 3H); 1,41
(s, 6H) ; 1,51 (m, 2H) ; 2,95 (s, 3H) ; 3,28 (m masqué, 2H) ;
4,59 (s, 2H) ; 7,01 (dd, J = 1,5 Hz et 5,5 Hz, 1H) ; 7,67
(d, J = 8,5 Hz, 2H); 7,85 (d, J = 8,5 Hz, 2H); 7,87 (s
masqué, 1H); 8,17 (d, J = 5,5 Hz, 1H); 8,72 (s, 1H).
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
102
Spectre de Masse (ES) : m/z=510 [M+H]+
m/z=510; [M-H]-
Exemple 36 : 1-butyl-3-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-1-méthylurée
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3-Pyrrolidin-1-yl-propylamine par la N-
méthyl-N-butylamine pour donner 40 mg de 1-butyl-3-{4-
[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-1-méthylurée dont les
caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 0,89 (t, J = 7,0 Hz, 3H); 1,27
(m, 2H); 1,42 (s, 6H); 1,47 (m, 2H); 2,94 (s, 3H); 3,30
(m masque, 2H) ; 4,59 (s, 2H) ; 7,01 (d large, J = 5,5 Hz,
1H) ; 7,69 (d, J = 8,5 Hz, 2H) ; 7,85 (d, J = 8,5 Hz, 2H) ;
7,86 (s, 1H) ; 8,17 (d, J = 5,5 Hz, 1H) ; 8,72 (t large, J
= 6,5 Hz, 1H).
Spectre de Masse (ES) : m/z=524 [M+H]+
m/z=522; [M-H] -
Exemple 37 : 1-butyl-3-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}urée
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3-Pyrrolidin-1-yl-propylamine par la N-
butylamine pour donner 40 mg de 1-butyl-3-{4-[(5,5-
diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}urée dont les caractéristiques
sont les suivantes :
Spectre RNIIV' 1H à 400 MHz : 0,90 (t, J= 7,0 Hz, 3H); 1,31
(m, 2H) ; 1,42 (s, 6H) ; 1,44 (m, 2H) ; 3,17 (q, J = 7,0 Hz,
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
103
2H); 4,58 (s, 2H); 6,94 (dd, J = 1,5 et 5,5 Hz, 1H); 7,31
(s large, 1H); 7,67 (d, J = 8,5 Hz, 2H); 7,87 (d, J 8,5
Hz, 2H) ; 8,12 (d, J = 5,5 Hz, 1H) ; 8,25 (t large, J 7,0
Hz, 1H) ; 9, 11 (S, 1H) .
Spectre de Masse (ES) : m/z=510 [M+H]
m/z=508; [M - H] -
I ~
H N~\~N\ H2N*'~~NwOe H N
2 I 2
ex38 ex 39 ex 40
Exemple 38 : 1-[3-(diméthylamino)propyl]-3-{4-[(5,5-
diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}urée
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3-Pyrrolidin-1-yl-propylamine par la N,N-
diméthyléthylènediamine et la N-méthylpyrrolidinone par
le tétrahydrofuranne, pour donner 54 mg de 1-[3-
(diméthylamino)propyl]-3-{4-[(5,5-diméthyl-2,4-dioxo-3-
{4-[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}urée dont les caractéristiques
sont les suivantes
Spectre RMN 1H à 400 MHz : 1,42 (s,6H); 2,17 (s, 6H);
2,34 (t, J= 6,5 Hz, 2H); 3,24 (q, J = 6,5 Hz, 2H); 4,58
(s, 2H); 6,94 (d large, J = 5,5 Hz, 1H); 7,37 (s large,
1H) ; 7,67 (d, J = 8,5 Hz, 2H) ; 7, 87 (d, J = 8, 5 Hz, 2H) ;
8,11 (d, J = 5,5 Hz, 1H) ; 8,17 (t large, J=6, 5 Hz, 1H) ;
9,17 (s, 1H)
Spectre de Masse (ES) : m/z=525 [M+H]+
m/z=523; [M-H] -
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
104
Exemple 39 : 1-[3-(diméthylamino)propyl]-3-{4-[(5,5-
diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}urée
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3 -Pyrrol idin- 1 -yl -propylamine par la N,N-
diméthyl-1,3-propanediamine pour donner 106 mg de 1-[3-
(diméthylamino)propyl]-3-{4-[(5,5-diméthyl-2,4-dioxo-3-
{4-[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}urée dont les caractéristiques
sont les suivantes :
Spectre RNIIA' 1H à 400 MHz 1,42 (s, 6H); 1,59 (m, 2H);
2,12 (s, 6H); 2,23 (t, J 6,5 Hz, 2H); 3,18 (q, J = 6,5
Hz, 2H); 4,58 (s, 2H); 6,95 (d large, J = 5,5 Hz, 1H);
7,31 (s, large, 1H) ; 7,67 (d, J = 8,5 Hz, 2H) ; 7,87 (d, J
= 8,5 Hz, 2H); 8,11 (d, J = 5,5 Hz, 1H); 8,31 (t large, J
= 6,5 Hz, 1H) ; 9,13 (s, 1H).
Spectre de Masse (ES) : m/z=539 [M+H]+
m/z=537 [M-H] -
Exemple 40 : 1-[4-(diméthylamino)butyl]-3-{4-[(5,5-
diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}urée
A été préparé comme au stade b) de l'exemple 18 en
remplaçant la 3-Pyrrolidin-1-yl-propylamine par la N,N-
diméthylaminobutylamine et la N-méthylpyrrolidinone par
le tétrahydrofuranne, pour donner 60 mg de 1-[4-
(diméthylamino)butyl]-3-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}urée dont les caractéristiques
sont les suivantes :
Spectre RMN 1H à 400 MHz : De 1,36 à 1,50 (m, 4H) ; 1,42
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
105
(s, 6H); 2,10 (s, 6H); 2,19 (t, J = 6,5 Hz, 2H); 3,17 (q,
J= 6,5 Hz, 2H); 4,58 (s, 2H); 6,94 (d large, J 5,5 Hz,
1H); 7,31 (s large, 1H); 7,66 (d, J= 8,5 Hz, 2H); 7,87
(d, J = 8,5 Hz, 2H); 8,11 (d, J = 5,5 Hz, 1H); 8,26 (t
large, J = 6,5 Hz, 1H); 9,12 (s, 1H)
Spectre de Masse (ES) : m/z=553 [M+H]+
m/z=551; [M-H] -
Exemple 40A : 1-({2-[(5-fluoropyridin-3-yl)amino]pyridin-
4-yl}méthyl)-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
F
)<F
F
O N
=
N H N NH2
Le produit été préparé en utilisant la méthode générale
de l'Exemple 18 stade b) ci-dessus en remplaçant la 3-
pyrrolidin-l-yl-propylamine et la N-méthylpyrrolidinone
par une solution 7N d'ammoniac dans le methanol. Le 1-
({2-[(5-fluoropyridin-3-yl)amino]pyridin-4-yl}méthyl)-
5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione est
obtenu sous forme d'un solide dont les dont les
caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 1,42 (s, 6H); 4,58 (s, 2H);
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
106
6, 95 (d large, J = 5, 5 Hz, 1H) ; 7, 07 (m três étalé, 2H) ;
7,38 (s large, 1H) ; 7,66 (d, J= 8, 5 Hz, 2H) ; 7,87 (d, J
= 8,5 Hz , 2H); 8,12 (d, J = 5,5 Hz, 1H); 9,08 (s, 1H)
Spectre de Masse (ES) : m/z=454 [M+H]+
m/z=452; [M-H] -
Exemple 40B : 1-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-3-[3-(pyrrolidin-1-
ylméthyl)cyclobutyl]urée
F
~F
F
O N
' I N
N N N
H H
Stade c) : 1-{4-[(5,5-diméthyl-2,4-dïoxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}-3-[3-(pyrrolidin-1-
ylméthyl)cyclobutyl]urée
A une solution de 22 mg de méthanesulfonate de {3-[({4-
[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}carbamoyl)amino]cyclobutyl}méthyle
obtenu au stade b) ci-dessous dans 0,8 mL de
tétrahydrofuranne sont ajoutés 15 L de pyrrolidine. Le
mélange réactionnel est chauffé au microonde à 130 C
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
107
pendant 1 heure puis concentré sous pression réduite. Le
résidu est purifié par HPLC (gradient eau-acétonitrile
contenant 0,1%- d'acide formique) pour donner 7 mg de 1-
{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-l-
yl)méthyl]pyridin-2-yl}-3-[3-(pyrrolidin-1-
ylméthyl)cyclobutyl]urée dont les dont les
caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz (mélange 609.- - 40%- d'isomères
Cis et Trans) : 1,42 (s, 6H) ; 1,52 (m, 1H) ; 1,65 (m, 4H).;
de 1,95 à 2,57 (m partiellement masqué, 10H); 4,03 (m,
0,6H); 4,22 (m, 0,4H); 4,57 (s, 2H); 6,96 (d large, J =
5,5 Hz, 1H); 7,37 (s large, 1H); 7,67 (d, J= 8,5 Hz,
2H); 7,87 (d, J = 8,5 Hz, 2H); 8,13 (m, 1H); 8,24 (s,
1H); 8,27 (m large, 0,6H); 8,38 (m large, 0.4H); 9,02 (s,
0, 6H) ; 9,04 (s, 0,4H).
Spectre de Masse : m/z=591 [M+H]+
Stade b) : méthanesulfonate de {3-[({4-[(5,5-diméthyl-
2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl ) méthyl ] pyridin- 2 -
yl}carbamoyl)amino]cyclobutyl}méthyle.
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
108
F
LF
~F
N%rO
N rLr00
A une solution de 120 mg de 1-{4-[(5,5-diméthyl-2,4-
dioxo-3-{4-[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl) méthyl] pyridin-2-yl } -3 - [3 -
5(hydroxyméthyl)cyclobutyl]urée obtenu au stade a) ci-
dessous dans 10 mL de dichlorométhane sont ajoutés
successivement, sous argon à 0 C, 2,7 mg de 4-N,N-
diméthylamino pyridine, 46 L de triéthylamine et 26 L de
chlorure d'acide méthane sulfonique. Le mélange
réactionnel est maintenu sous agitation pendant 1 heure à
cette température, puis le bain de glace est retiré et 20
mL d'une solution saturée d'hydrogénocarbonate de sodium
sont ajoutés et la phase aqueuse extraite avec 2 fois 50
mL d'acétate d'éthyle. Les phases organiques réunies sont
lavées avec une solution saturée de chlorure de sodium,
séchées sur sulfate de magnésium, filtrées et concentrées
sous pression réduite. Le résidu est purifié par
chromatographie sur colonne de silice en éluant par un
mélange d'acétate d'éthyle et de dichlorométhane (90/10
en volumes) pour donner 95 mg de méthanesulfonate de {3-
[({4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
109
yl)méthyl]pyridin-2-yl}carbamoyl)amino]cyclobutyl}méthyle
dont les caractéristiques sont les suivantes :
Spectre RNN 1H à 400 MHz (mélange 60% - 40%- d'isomêres
Cis et Trans) : 1,41 (s, 6H) ; de 1,65 à 2,43 (m, 5H) ; 3,18
5(s, 1,8H); 3,20 (s, 1,2H); 4,12 (m, 0,6H); 4,20 (d, J =
6,0 Hz, 0,4H); 4,29 (d, J= 6,0 Hz, 0,4H); 4,32 (m,
0,4H); 4,59 (s, 2H); 6,98 (d large, J = 5,5 Hz, 1H); 7,35
(s large, 0,4H); 7,38 (s large, 0,6H); 7,68 (d, J = 8,5
Hz, 2H) ; 7, 89 (d, J = 8, 5 Hz, 2H) ; 8, 14 (m, 1H) ; 8, 32 (d
large, J = 8,0 Hz, 0,6H); 8,48 (d large, J = 0,4H); 9,09
(s, 0,6H); 9,11 (s, 0,4H)
Spectre de Masse : m/z=616 [M+H]+
m/z=614 [M-H]-
Stade a) : 1-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl] pyridin-2-yl} -3- [3-
(hydroxyméthyl)cyclobutyl]urée
F
~F
F
O NYO
/
H
N H H
A une solution de 650 mg de {4-[(5,5-diméthyl-2,4-dioxo-
3-{4-[(trifluorométhyl)thio]phényl}imidazolidin-l-
yl)méthyl]pyridin-2-yl}carbamate d'éthyle obtenu au stade
a) de l'exemple 18 dans 3 mL de tétrahydrofuranne sont
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
110
ajoutés 409 mg de (3-Amino-cyclobutyl) -méthanol obtenu
d'après la référence de la littérature : Maruyama, T. et
Coli. Chem. Pharm. Bull. (1990), 38(10),p2719-2725. Le
mélange réactionnel est chauffé au microonde à 130 C
pendant 3 heures puis concentré sous pression réduite. Le
résidu est purifié par HPLC (colonne C18 phase inverse,
élution avec un gradient eau/acétonitrile contenant 0.1%
d'acide formique) pour donner 122 mg de 1-{4-[(5,5-
diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl ) méthyl ] pyridin- 2 -yl } - 3 - [ 3 -
(hydroxyméthyl)cyclobutyl]urée dont les caractéristiques
sont les suivantes :
Spectre RMN 1H à 400 MHz (mélange 600-o - 409,; d'isomères
cis-trans) : 1,42 (s, 6H); 1,62 (m, 1H); de 1,85 à 2,32
(m, 4H); de 3,30 à 3,47 (m partiellement masqué, 2H);
4,04 (m, 0,6H); 4,21 (m, 0,4H); 4,49 (t, J = 5,5 Hz,
0, 6H) ; 4,56 (t, J = 5,5 Hz, 0, 4H) ; 4,58 (s, 2H) ; 6,96 (d
large, J = 5,5 Hz, 1H); 7,35 (s large, 0,4H); 7,39 (s
large, 0,6H); 7,68 (d, J= 8,5 Hz, 2H); 7,88 (d, J= 8,5
Hz, 2H); 8,14 (m, 1H); 8,21 (d large, J = 8,0 Hz, 0,6H);
8,39 (d large, J = 8,0 Hz, 0,4H); 9,00 (s, 0,6H); 9,04
(s, 0,4H).
Spectre de Masse : m/z= 538 [M+H]+
m/z= 536 [M-H]-
Exemple 40C : 1-({2-[(3-fluorophényl)amino]pyridin-4-
yl}méthyl)-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
111
F
F
F
O NY-I.- O
F
N N S
H
A une solution de 520 mg de 1-[(2-chloropyridin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade d) de l'exemple 1 dans 15 mL de dioxanne
sont ajoutés successivement sous argon, 27 mg de
diacétate de palladium, 84 mg de (9,9-diméthyl-9H-
xanthène-3,6-diyl)bis(diphénylphosphine)(Xantphos), 1,5 g
de carbonate de césium et de 269 mg de 3-fluoroaniline.
Le mélange réactionnel est chauffé à 100 C pendant 1,5
heure puis filtré et le filtrat est concentré sous
pression réduite. Le résidu est purifié par
chromatographie sur colonne de silice en éluant par un
mélange d'éther de pétrole et d'acétate d'éthyle (70/30
en volumes) pour donner 404 mg de 1-({2-[(3-
fluorophényl)amino]pyridin-4-yl}méthyl)-5,5-diméthyl-3-
{4-[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 1,44 (s, 6H) ; 4,57 (s , 2H) ;
6,66 (m, 1H) ; 6,85 (m, 2H) ; de 7,20 à 7,31 (m, 2H) ; 7,69
(d, J = 8,5 Hz, 2H); 7,83 (td, J = 1,5 et 12,0 Hz, 1H);
7,88 (d, J = 8,5 Hz, 2H) ; 8,15 (d, J = 5,5 Hz, 1H) ; 9,25
(s, 1H) .
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
112
Spectre de Masse (ES) : m/z=505 [M+H]+
Exemple 40D : 1-{[2-(cyclopropylamino)pyridin-4-
yl]méthyl}-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
F
~kF
F
O NYØO
al
N N
H
700 mg de 1-[(2-chloropyridin-4-yl)méthyl]-5,5-diméthyl-
3-{4-[(trifluorométhyl)thio]phényl}imidazolidine-2,4-
dione obtenu au stade d) de l'exemple 1 et 1,6 mL de
cyclopropylamine sont chauffés au microonde à 150 C
pendant 12 heures puis concnetré sous presison réduite.
Le résidu est purifié par chromatographie sur colonne de
silice en éluant par un mélange d'éther de pétrole et
d'acétate d'éthyle (50/50 en volumes) pour donner 65 mg
de 1-{[2-(cyclopropylamino)pyridin-4-yl]méthyl}-5,5-
diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 0,40 (m, 2H); 0,68 (m, 2H);
1,41 (s, 6H); 2,50 (m masqué, 1H); 4,49 (s, 2H); 6,58 (m,
2H) ; 6,70 (d, J = 2,0 Hz, 1H) ; 7,65 (d, J = 8,5 Hz, 2H) ;
7,87 (d, J = 8,5 Hz, 2H); 7,92 (d, J = 5,5 Hz, 1H).
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
113
Spectre de masse (ES) : m/z=451 [M+H]+
Exemple 40E : 1-({2-[(2-chloropyridin-3-yl)amino]pyridin-
4-y1}méthyl)-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
F
F
F
Nek
= J 1 N N N
H CI
A une solution de 600 mg de 1-[(2-aminopyridin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade b) de l'exemple 14 dans 50 mL de dioxanne
sont ajoutés successivement sous argon, 33 mg de
diacétate de palladium, 100 mg de (9,9-diméthyl-9H-
xanthène-3,6-diyl)bis(diphénylphosphine)(Xantphos), 1,81
g de carbonate de césium et de 0,42 g de 2-chloro-3-
iodopyridine. Le mélange réactionnel est chauffé à 90 C
pendant 5 heures puis filtré et le filtrat est concentré
sous pression réduite. Le résidu est purifié par
chromatographie sur colonne de silice en éluant par un
mélange de cyclohexane et d'acétate d'éthyle (70/30 en
volumes) pour donner 0,47 g de 1-({2-[(2-chloropyridin-3-
yl)amino]pyridin-4-yl}méthyl)-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
114
Spectre RMN 1H à 400 MHz : 1,46 (s, 6H); 4,58 (s, 2H);
6,90 (d large, J = 5, 5 Hz, 1H) ; 7, 12 (s large, 1H) ; 7, 35
(dd, J = 5, 5 et 8, 5 Hz, 1H) ; 7, 69 (d, J = 8,5 Hz, 2H) ;
7,88 (d, J = 8,5 Hz, 2H); 8,00 (dd, J = 2,0 et 5,5 Hz,
1H) ; 8, 10 (d, J= 5, 5 Hz, 1H) ; 8, 47 (s, 1H ); 8,56 (dd, J
= 2,0 et 8,5 Hz, 1H) .
Spectre de masse (ES) m/z=522 [M+H]+
m/z=520 [M-H] -
Exemple 40F : 1-({2-[(6-chloropyridin-3-yl)amino]pyridin-
4-yl}méthyl)-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
F
F
F
NNro
CI
J N
N N
H
A une solution de 400 mg de 1-[(2-aminopyridin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade b) de l'exemple 14 dans 30 mL de dioxanne
sont ajoutés successivement sous argon, 22 mg de
diacétate de palladium, 67 mg de (9,9-diméthyl-9H-
xanthène-3,6-diyl)bis(diphénylphosphine)(Xantphos), 1,2 g
de carbonate de césium et de 0,28 g de 2-chloro-5-
iodopyridine. Le mélange réactionnel est chauffé à 90 C
pendant 3 heures puis filtré et le filtrat est concentré
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
115
sous pression réduite. Le résidu est purifié par
chromatographie sur colonne de silice en éluant par un
mélange de cyclohexane et d'acétate d'éthyle (70/30 en
volumes) pour donner 0,38 g de 1-({2-[(6-chloropyridin-3-
yl)amino]pyridin-4-yl}méthyl)-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes :
Spectre RMN 1H à 400 MHz : 1,43 (s, 6H); 4,59 (s, 2H);
6, 86 (s large, 1H) ; 6, 89 (d large, J = 5, 5 Hz, 1H) ; 7, 38
(d, J = 8,5 Hz, 1H) ; 7,69 (d, J = 8,5 Hz, 2H) ; 7,88 (d, J
= 8,5 Hz, 2H) ; 8,14 (d, J = 5,5 Hz, 1H) ; 8,27 (dd, J =
2,5 et 8,5 Hz, 1H); 8,64 (d, J = 2,5 Hz, 1H); 9,38 (s,
1H) .
Spectre de masse (ES) : m/z=522 [M+H]+
Exemple 40G : 1-({2-[(6-hydroxypyridin-3-
yl)amino]pyridin-4-yl}méthyl)-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
F
~F
F
O N~O
OH J N N
N
woj::
H
A une solution de 500 mg de 1-[(2-chloropyridin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade d) de 1 ' exemple 1 dans 15 mL de dioxanne
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
116
sont ajoutés successivement sous argon, 52 mg de
diacétate de palladium, 160 mg de (9,9-diméthyl-9H-
xanthène-3,6-diyl)bis(diphénylphosphine)(Xantphos), 1,74
g de carbonate de césium et de 320 mg de 5-amino-2-
hydroxypyridine. Le mélange réactionnel est chauffé à
refux pendant 5 heures puis filtré et le filtrat est
concentré sous pression réduite. Le résidu est purifié
par chromatographie sur colonne de silice en éluant par
un mélange de dichlorométhane et de méthanol (98/2 en
volumes) pour donner 11 mg de 1-({2-[(6-hydroxypyridin-3-
yl)amino]pyridin-4-yl}méthyl)-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes
Spectre RNRV' 1H à 400 MHz : 1,45 (s, 6H); 4,58 (s, 2H);
6,40 (d, J = 10,0 Hz, 1H) ; 6,80 (m, 2H) ; 7,48 (d large, J
= 10,0 Hz, 1H) ; 7,67 (d, J = 8,5 Hz, 2H) ; 7,88 (m, 3H) ;
7,99 (d, J = 5,0 Hz, 1H); 9,00 (m étalé, 1H).
Spectre de masse (ES) : m/z=504 [M+H]+
m/z=502 [M-H]-
Exemple 40H : 5,5-diméthyl-l-[(2-{[5-(pyrrolidin-1-
ylméthyl)pyridin-3-yl]amino}pyridin-4-yl)méthyl]-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
117
F
)~F
F
N%rO
/ .~
N N
H
Stade b) : 5,5-diméthyl-l-[(2-{[5-(pyrrolidin-1-
ylméthyl)pyridin-3-yl]amino}pyridin-4-yl)méthyl]-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
A une solution de 360 mg de 1-[(2-aminopyridin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade b) de l'exemple 14 dans 25 mL de dioxanne
sont ajoutés successivement sous argon, 29 mg de
diacétate de palladium, 61 mg de (9,9-diméthyl-9H-
xanthène-3,6-diyl)bis(diphénylphosphine)(Xantphos), 1,1 g
de carbonate de césium et de 0,25 g de 3-Bromo-5-
pyrrolidin-1-ylméthyl-pyridine obtenu au stade a) ci-
dessous. Le mélange réactionnel est chauffé au reflux
pendant 5 heures puis filtré et le filtrat est concentré
sous pression réduite. Le résidu est purifié par
chromatographie sur colonne de silice en éluant par un
mélange de dichlorométhane et de méthanol (96/4 en
volumes) pour donner 56 mg de 5,5-diméthyl-1-[(2-{[5-
(pyrrolidin-1-ylméthyl)pyridin-3-yl]amino}pyridin-4-
yl)méthyl] -3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
118
Spectre RMN 1H à 400 MHz : 1,44 (s, 6H); 1,69 (m, 4H);
2,43 (m, 4H); 3,54 (s, 2H); 4,57 (s, 2H); 6,83 (m, 2H);
7,69 (d, J = 8,5 Hz, 2H); 7,88 (d, J = 8,5 Hz, 2H); 8,00
(d, J = 2,5 Hz, 1H); 8,07 (t, J = 2,5 Hz, 1H); 8,14 (d, J
= 5,5 Hz, 1H); 8,73 (d, J= 2,5 Hz, 1H); 9,15 (s, 1H)
Spectre de masse (ES) : m/z=571 [M+H]+
m/z=569 [M-H] -
Stade a) : 3-Bromo-5-pyrrolidin-1-ylméthyl-pyridine
O>N
N
B
A une solution de 5-bromo-3-pyridine carboxaldéhyde dans
mL de dichloro-1, 2 -éthane sont ajouté successivement
sous argon, 4,55 g de triacétoxyborohydrure de sodium et
0,94 mL de pyrrolidine. Le mélange réactionnel est agité
15 à température ambiante pendant 3 heures puis lavé avec
une solution saturée d'hydrogénocarbonate de sodium, de
l'eau, une solution saturée de chlorure de sodium, séché
sur sulfate de magnésium, filtré et concentré sous
pression réduite. Le résidu est purifié par
20 chromatographie sur colonne de silice en éluant par un
mélange d'acétate d'éthyle et de cyclohexane (80/20 en
volumes) pour donner 1,4 g de 3-Bromo-5-pyrrolidin-l-
ylméthyl-pyridine sous forme d'une huile jaune pâle.
Spectre de Masse (ES) : m/z=241 [M+H]+
m/z=161 [M+H]+ - Br ( pic de base )
Exemple 401: 5,5-diméthyl-l-[(2-{[6-(pyrrolidin-1-
ylméthyl)pyridin-3-yl]amino}pyridin-4-yl)méthyl]-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
119
F
LF
~F
/
O NY
04eoN
N
~ I
N N
H
Stade b) : 5,5-diméthyl-l-[(2-{[6-(pyrrolidin-l-
ylméthyl)pyridin-3-yl]amino}pyridin-4-yl)méthyl]-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
A une solution de 0,5 g de 1-[(2-aminopyridin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade b) de l'exemple 14 dans 15 mL de dioxanne
sont ajoutés successivement sous argon, 0,32 g de 5-
Bromo-2-pyrrolidin-l-ylmethyl-pyridine obtenu au stade a)
ci-dessous, 77 mg de 9,9-diméthyl-4,5-
bis(diphenylphosphino)xanthene (Xantphos), 38 mg
d'acétate de palladium et 1,75 g de carbonate de césium.
Le mélange réactionnel est chauffé au reflux pendant 6
heures puis filtré et concentré sous pression réduite. Le
résidu est purifié par chroma.tographie sur colonne de
silice en éluant par un mélange de dichlorométhane et de
méthanol (96/4 en volumes) pour donner 0.1 g de 5,5-
diméthyl-l-[(2-{[6-(pyrrolidin-1-ylméthyl)pyridin-3-
yl] amino}pyridin-4-yl)méthyl] -3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
dont les caractéristiques sont les suivantes
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
120
Spectre RMN 1H à 400 MHz : 1,43 (s, 6H); 1,70 (m, 4H);
2,46 (m, 4H); 3,60 (s, 2H); 4,56 (s, 2H); 6,82 (m, 2H);
7,29 (d, J = 8,5 Hz, 1H); 769 (d, J= 8,5 Hz, 2H); 7,88
(d, J = 8, 5 Hz, 2H) ; 8, 11 (d, J = 5, 5 Hz, 1H) ; 8, 15 (dd,
J= 2,5 et 8,5 Hz, 1H); 8,64 (d, J= 2,5 Hz, 1H); 9,12
(s, 1H) .
Spectre de Masse (ES) : m/z=571 [M+H]+
m/z=569 [M-H] -
Stade a): 5-Bromo-2-pyrrolidin-1-ylmethyl-pyridine
~ N
~ I
Br'o
A une solution de 2 g de 5-bromo-2-formylpyridine dans 20
mL de dichloro-1,2-éthane sont ajoutés successivement
sous argon, 4,55 g de triacétoxyborohydrure de sodium et
0,94 mL de pyrrolidine. Le mélange réactionnel est agité
à température ambiante pendant 1 heure puis dilué avec du
dichlorométhane et la phase organique est lavée avec une
solution saturée d'hydrogénocarbonate de sodium, de
l'eau, une solution saturée de chlorure de sodium, séchée
sur sulfate de magnésium, filtrée et concentrée sous
pression réduite. Le résidu est purifié par
chromatographie sur colonne de silice en éluant par un
mélange de dichlorométhane et de méthanol (98/2 en
volumes) pour donner 0.93 g de 5-bromo-2-pyrrolidin-1-
ylmethyl-pyridine dont les caractéristiques sont les
suivantes :
Spectre RMN 1H à 400 MHz : 1,70 (m, 4H); 2,48 (m, 4H);
3,69 (s, 2H); 7,40 (d, J = 8,5 Hz, 1H); 7,99 (dd, J = 2;5
et 8,5 Hz, 1H); 8,59 (d, J = 2,5 Hz, 1H).
Spectre de Masse (ES) : m/z=241 [M+H]+
Exemple 40J: 1-[3-(azétidin-1-ylméthyl)cyclobutyl]-3-{4-
[(5,5-diméthyl-2,4-dioxo-3-{4-
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
121
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}urée
F
F
~ F
I ' .
N~O
N N C N
H
A une solution de 0,6 g de 1-[(2-chloropyridin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade d) de l' exemple 1 dans 15 mL de dioxanne
sont ajoutés successivement sous argon, 0,2 g de 4-
aminopyridazine, 1,73 g de carbonate de césium, 97 mg de
(9,9-diméthyl-9H-xanthène-3,6-diyl)bis(diphénylphosphine)
(Xantphos) et 62 mg de diacétate de palladium. Le mélange
réactionnel est chauffé au reflux pendant 5 heures,
filtré et concentré sous pression réduite. Le résidu est
purifié par chromatographie sur colonne de silice en
éluant par un mélange de dichlorométhane et de méthanol
(98/2 en volumes) pour donner 50 mg de 1- [3- (azétidin-1-
ylméthyl)cyclobutyl]-3-{4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-l-
yl)méthyl]pyridin-2-yl}urée dont les caractéristiques
sont les suivantes :
Spectre RMN 1H à 400 MHz : 1,43 (s, 6H); 4,61 (s, 2H);
6,99 (s large, 1H); 7,03 (dd, J = 1,5 et 5,5 Hz, 1H);
7, 69 (d, J = 8, 5 Hz, 2H) ; 7, 88 (d, J = 8, 5 Hz, 2H) ; 8,12
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
122
(dd, J = 2,0 et 6,0 Hz, 1H); 8,28 (d, J = 5,5 Hz, 1H);
8, 82 (d, J = 6, 0 Hz, 1H) ; 9, 26 (d, J = 2, 0 Hz, 1H) ; 9, 80
(s, 1H) .
Spectre de Masse (ES) : m/z=489 [M+HI+
m/z=487 [M-H] -
Exemple 40k: 1-[3-(azétidin-1-ylméthyl)cyclobutyl]-3-{4-
[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thiolphényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}urée
F
F
F
O N )<
/ I N
= ~
N H H
A une solution de 22 mg de méthanesulfonate de {3-[({4-
[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}carbamoyl)amino]cyclobutyl}méthyle
obtenu au stade b) de l'exemple 40B dans 0,8 mL de
tétrahydrofuranne sont ajoutés 12 L d'azétidine. Le
mélange réactionnel est chauffé au microonde à 130 C
pendant 1 heure puis concentré sous pression réduite. Le
résidu est purifié par HPLC (gradient eau-acétonitrile
contenant 0,11% d'acide formique) pour donner 4 mg de 1-
[3-(azétidin-1-ylméthyl)cyclobutyl]-3-{4-[(5,5-diméthyl-
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
123
2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-y1}urée dont les dont les
caractéristiques sont les suivantes :
LCMS : TR= 3,54 min; m/Z=577 [M+H]+; m/z=575 [M-H]-
Exemple 40L : {4-[(5,5-diméthyl-2,4-dioxo-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidin-l-
yl)méthyl]pyridin-2-yl}carbamate de méthyle
F F
)~S
F
0N---f0
0 N
1 O
N N
H
A une solution de 0,5 g de 1-[(2-chloropyridin-4-
yl)méthyl]-5,5-diméthyl-3-{4-
[(trifluorométhyl)thio]phényl}imidazolidine-2,4-dione
obtenu au stade d) de l'exemple 1 dans 15 mL de dioxane
sont ajouté successivement sous argon, 131 mg de
carbamate de méthyle, 1,44 g de carbonate de césium, 26
mg d'acétate de palladium et 67 mg de 9,9-diméthyl-4,5-
bis (diphénylphosphino)xanthene. Le mélange réactionnel
est chauffé au reflux pendant 1 heure, filtré et
concentré sous pression réduite. Le résidu est purifié
par chromatographie sur colonne de silice en éluant par
un gradient de dichlorométhane et d'acétate d'éthyle (de
100/0 à 80/20 en volumes) pour donner 243 mg de {4-[(5,5-
diméthyl-2,4-dioxo-3-{4-
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
124
[(trifluorométhyl)thio]phényl}imidazolidin-1-
yl)méthyl]pyridin-2-yl}carbamate de méthyle dont les
caractéristiques sont les suivantes :
RMN : Spectre RMN 1H à 400 MHz 1,42 (s, 6H); 3,67 (s,
3H); 4,62 (s, 2H); 7,09 (dd, J 1,5 et 5,5 Hz, 1H); 7,66
(d, J = 8,5 Hz, 2H); 7,86 (m, 3H); 8,20 (d, J = 5,5 Hz,
1H); 10,1 (s large, 1H) .
Spectre de Masse (IE) : m/z=467 M+. pic de base
Tests biologiques in vitro
A) Protocole expérimental pour le test kinase IGF-1R
L'activité inhibitrice des composés sur IGF1R est
déterminée par une mesure de l'inhibition de
l'autophosphorylation de l'enzyme en utilisant un test de
fluorescence résolue dans le temps (HTRF). Le domaine
cytoplasmique humain d'IGF-1R a été cloné en fusion avec
la glutathione S-transferase (GST) dans le vecteur
d'expression baculovirus pFastBac-GST. La protéine est
exprimée dans les cellules SF21 et purifiée à environ 80%
d'homogénéité. Pour le test enzymatique, le composé à
tester 10 mM en solution dans le DMSO est dilué par
étapes 1/3 dans un tampon 5OmM Hepes, pH 7.5, 5mM MnCl2,
5OmM NaCl, 3s Glycerol, 0.0250-, Tween 20, Pour la mesure
de l'inhibition, les dilutions successives du composé
sont préincubées 30 min et 90 min en présence de 5 nM
d'enzyme, la concentration finale de DMSO n'excédant pas
1%. La réaction enzymatique est initiée pour avoir 120 M
d'ATP final et stoppée après 5 min par addition de tampon
100 mM Hepes, pH 7.0, contenant 0.4 M de fluorure de
potassium, 133 mM EDTA, BSA 0.1%, 1' anticorps anti-GST
marqué avec XL665 et 1' anticorps anti-phosphotyrosine
conjugé au cryptate d'europium Eu-K (Cis-Bio Int.). Les
caractéristiques des deux fluorophores, XL-665 and Eu-K,
sont disponibles dans G. Mathis et al., Anticancer
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
125
Research, 1997, 17, pages 3011-3014. Le transfert
d'énergie entre le cryptate d'europium excité vers le
XL665 accepteur est proportionnel au degré
d'autophosphorylation de IGF-1R. Le signal de longue
durée spécifique de XL-665 est mesuré dans un compteur de
plaques GENios Pro TECAN. L'inhibition de
l'autophosphorylation de IGF-1R au temps 30 min et 90 min
avec les composés testés de l'invention sont calculés par
rapport à un contrôle Mr DMSO, dont l'activité est
mesurée en l'absence de composé. Une courbe représentant
le % d'inhibition en fonction du log de la concentration
est établie pour déterminer la concentration
correspondante à 50% d'inhibition (ICSo)-
B) Mesure de l'autophosphorylation d'IGF-1R dans les
cellules MCF7 après stimulation par IGF-1
Culture cellulaire et réalisation de l'essai
L'autophosphorylation d'IGFlR dans les cellules induites
par IGF1 est évaluée par une technique d'ELISA (Enzyme
Linked ImmunoSorbent Assay). Les cellules MCF-7 sont
ensemencées à 60,000 cellules par puits dans des plaques
6 puits et incubées à 37 C, 5% C02 dans du milieu
contenant 10% de serum. Après une nuit en 10% sérum, les
cellules sont déprivées en sérum pendant 24 heures. Les
composés sont ajoutés au milieu 1 heure avant la
stimulation par IGF1. Après 10 minutes de stimulation par
IGF1, les cellules sont lysées avec un tampon (Hepes 50
mM pH 7.6, Triton X100 1%-, Orthovanadate 2 mM, coktail
d'inhibiteurs de protéases). Les lysats cellulaires sont
incubés sur une plaque 96-puits pre-coatée avec un
anticorps anti-IGF1R, suivie d'une incubation avec un
anticorps anti-phosphotyrosine couplé à l'enzyme
peroxydase. Le niveau de l'activité peroxydase (measuré
par DO avec un substrat luminescent) reflète le status de
phosphorylation du recepteur.
Calcul des résultats :
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
126
(i) Les essais sont effectués en double exemplaire et la
moyenne des deux essais est calculée.
(ii) La valeur du signal de la réponse maximum est
calculée à partir du contrôl positif : cellules stimulées
par IGF1 sans composé.
(iii) La valeur du signal de la réponse minimum est
calculée à partir du contrôl négatif: cellules
nonstimulées par IGF1 sans composé.
(iv) En utilisant ces valeurs comme maximum (100%) et
minimum (0%) respectivement, les données ont été
normalisées de façon à donner un pourcentage de la
réponse maximum.
(v) Une courbe de dose réponse est tracée et l'IC50 (la
concentration à laquelle le composé induit une diminution
de 501-o' du signal) du composé est calculée par analyse en
regression non-inéaire.
C) Mesure de la prolifération/viabilité des MEF-IGF1R
Culture cellulaire : les cellules MEF-IGF1R (clone stable
de cellules transfectées par le récepteur hIGF-1R) sont
mises en culture à 37 C sous 5% de C02 dans un milieu
EMEM contenant 10% de SVF.
Procédure du test: Les cellules sont ensemencées à 5,000
cellules par puits dans des plaques Cytostar 96 puits
(Amersham) avec 0.2 mL de milieu de culture EMEM à 37 C
pendant 18 heures. Les cellules sont ensuite lavées deux
fois avec du milieu EMEM et laissées en culture sans
sérum pendant 24 heures. Les composés sont ensuite
ajoutés à différentes concentrations en présence de
rhIGF1 (100ng/ mL) et 0.1 Ci de Thymidine [14C] (activité
spécifique - 50 mCi/mmol) pour donner 0.2 mL de volume
par puits. Après une incubation de 72 heures en présence
du composé, à 37 C sous 5% C02, l'incorporation de
Thymidine [~4C] est mesurée par comptage de la
radioactivité sur un compteur Microbeta trilux (Perkin-
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
127
elmer). La détermination de l'IC50 est réalisée à partir
de 10 concentrations croissantes du composé.
Calcul des résultats :
(i) Les essais sont effectués en double exemplaire et la
moyenne des deux essais est calculée.
(ii) La valeur du signal de la réponse maximum est
calculée à partir du contrôle positif : cellules
stimulées par IGF1 sans composé.
(iii) La valeur du signal de la réponse minimum est
calculée à partir du contrôle négatif: cellules non
stimulées par IGF1 sans composé.
(iv) En utilisant ces valeurs comme maximum (100%) et
minimum (0ô) respectivement, les données ont été
normalisées de façon à donner un pourcentage de la
réponse maximum.
(v) Une courbe de dose réponse est tracée et l'IC50 (la
concentration à laquelle le composé induit une diminution
de 50% du signal) du composé est calculée par analyse en
régression non-linéaire.
Le tableau suivant donne les activités de certains
exemples de la présente invention dans les 3 tests A, B
et C décrits ci-dessus :
Test A*
Exemples 30. 90. Test B Test C
Exemple 1 + + + ++
Exemple 2 ++ ++ +++ ++
Exemple 3 + + + ++
Exemple 4 + ++ +++ ++
Exemple 5 ++ + ++
Exemple 6 + + +++
Exemple 7 + ++ + ++
Exemple 8 ++ +++ +++ ++
Exemple 9 + ++ + ++
Exemple 10 + +
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
128
Exemple 11 ++ +++ +++ +++
Exemple 12 + + +
Exemple 14 + + + +
Exemple 15 ++ ++ ++ +
Exemple 16 ++ ++ ++ +
Exemple 17 + ++ +
Exemple 18 ++ ++ ++ +
Exemple 18
++ ++ ++ ++
Stade a)
Exemple 19 ++ ++ +++ ++
Exemple 20 + + + +
Exemple 21 ++ ++ ++ +
Exemple 22 ++ ++ ++ ++
Exemple 23 ++ ++ ++ ++
Exemple 25 + ++ +
Exemple 27 ++ ++ ++ +++
Exemple 28 ++ ++ +++ ++
Exemple 29 ++ ++ ++ ++
Exemple 30 ++ +++ ++ +
Exemple 31 + ++ +
Exemple 32 ++ ++ +
Exemple 33 ++ ++ +
Exemple 34 ++ ++ ++ ++
Exemple 35 ++ ++ ++ ++
Exemple 36 ++ ++ ++ ++
Exemple 37 + ++ ++
Exemple 38 ++ ++ +
Exemple 39 ++ ++ + +
Exemple 40 ++ +++ +
Exemple 40A ++ +++ +++ ++
Exemple 40B
++ +++
Stade a)
Exemple 40C + ++ ++ ++
Exemple 40D ++ ++ ++ +
Exemple 40E ++ ++ ++ ++
CA 02631506 2008-05-28
WO 2008/000922 PCT/FR2007/000080
129
Exemple 40F + ++ + +
Exemple 40G ++ ++ ++ +
Exemple 40K
Exemple 40L ++ +++ ++ +
* Pour les tests A, B et C les IC5o (nM) sont répartis
comme suit
+ > 100nM
10nM < ++ < 100 nM
+++ < 10 nM
Les exemples de compositions pharmaceutiques suivants
font partie de la présente invention : on peut noter que
font également partie de la présente invention les
compositions pharmaceutiques préparées avec les autres
produits de formule (I), leurs sels ou leur prodrugs
selon la présente invention.
EXEMPLE 41 : COMPOSITION PHAItMACEUTIQUE :
n a préparé des comprimés répondant à la formule
suivante :
Produit de l'exemple 1 ....................... 0,2 g
Excipient pour un comprimé terminé à .......... 1 g
(détail de l'excipient : lactose, talc, amidon,
stéarate de magnésium).
EXEMPLE 42 : COMPOSITION PHAItMACEUTIQUE :
On a préparé des comprimés répondant à la formule
suivante :
Produit de l'exemple 9 ........................ 0,2 g
Excipient pour un comprimé terminé à .......... 1 g
(détail de l'excipient : lactose, talc, amidon,
stéarate de magnésium)