Note: Descriptions are shown in the official language in which they were submitted.
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 1 -
COMPOSÉS DE TYPE 1,4-NAPHTOQUINONES, COMPOSITIONS LES
COMPRENANT ET UTILISATION DE CES COMPOSÉS EN TANT QU'AGENTS
ANTI-CANCÉREUX
Priorité
La présente invention revendique le droit de priorité à
la demande de brevet français N 06/51461 déposée le 25
avril 2006. Cette demande est incorporée, par la présente,
par référence, dans son intégralité.
DESCRIPTION
Domaine technique
La présente invention concerne le domaine de la
prévention et du traitement de maladies impliquant une
prolifération cellulaire anormale.
Elle concerne plus précisément des composés de type
1,4-naphtoquinones, notamment à titre de médicament, et
l'utilisation de tels compo. sés dans la préparation de
compositions pharmaceutiques. Ces compositions
pharmaceutiques peuvent notamment être destinées à prévenir
ou à traiter des maladies impliquant une prolifération
cellulaire anormale, notamment le cancer. L'invention
concerne également des compositions pro-apoptotiques et/ou
anti-prolifératives comprenant des composés de ce type, ou
encore l'utilisation de ce type de composés en tant
qu'agent pro-apoptotique et/ou anti-prolifératif.
Etat de la technique
Le cancer est l'une des causes de mortalité les plus
importantes et par conséquent l'un des problèmes de santé
publique les plus graves dans le monde d'aujourd'hui. De
nombreux médicaments ont été et sont développés. Cependant,
ces médicaments ne permettent pas de traiter tous les cas
avec succès. D'autre part, les drogues utilisées dans le
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 2 -
cadre des chimiothérapies peuvent présenter des effets
secondaires indésirables, une efficacité et/ou une
spécificité d'action vis-à-vis des cellules cancéreuses
insuffisante.
Parmi les agents utilisés dans des thérapies anti-
cancéreuses on peut citer un certain nombre d'agents qui
sont inducteurs de l'apoptose. En effet, les cellules
cancéreuses sont fréquemment résistantes à l'apoptose, ce
phénomène de mort cellulaire programmée étant inhibé.
L'apoptose ou mort cellulaire programmée est un
processus physiologique indispensable au maintien de
l'homéostasie tissulaire, c'est le mécanisme par lequel
l'organisme régule la quantité de cellules nécessaires à
son bien-être et à son développement.
Ce processus est particulièrement intéressant car,
contrairement à la nécrose, il ne présente pas de
libération de médiateurs de l'inflammation dans le milieu
extracellulaire. Ainsi, dans le cadre d'une application en
thérapie anti-cancer, il peut permettre d'induire une
cc mort propre , par comparaison avec la nécrose, au niveau
des cellules tumorales.
Parmi les composés pro-apoptotiques, on peut citer les
peptides de SMAC (second mitochondria activator of
caspases). Cependant, les fragments peptidiques de SMAC
peuvent poser de multiples problèmes lors d'une utilisation
in vivo, par exemple une faible biodisponibilité, une
dégradation trop rapide et/ou une immunogénicité trop
forte.
Il subsiste un besoin pour de nouveaux composés
présentant une activité anti-cancéreuse, en particulier
présentant une très bonne spécificité d'action envers les
cellules malignes, une efficacité améliorée, au moins dans
certains types de cancers, et/ou dont les effets
secondaires sont réduits.
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 3 -
Description de l'invention
Les inventeurs ont maintenant découvert que les
composés tels que définis ci-dessous présentent une
activité anticancéreuse, notamment reliée à une activité
pro-apoptotique et/ou antiproliférative, tout en résolvant
au moins en partie les problèmes évoqués ci-dessus.
Sans vouloir être lié par aucune hypothèse, il est
possible que le mode d'action des molécules selon
l'invention soit lié au fait que ces molécules miment au
moins une partie essentielle de SMAC.
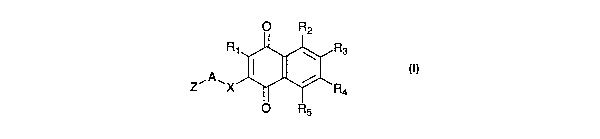
Ainsi, selon un premier aspect, l'invention a pour
objet les composés isolés répondant à la formule (I)
suivante ou un de ses sels pharmaceutiquement acceptables,
à titre de médicament :
O R2
Rs
R1 #R4
,A, z x O R5
Formule (I)
dans laquelle :
- R1 représente un atome d'hydrogène ; un atome
d'halogène ; une fonction hydroxyle, éventuellement
substituée ; un radical alkyle, alcène ou alcyne,
comprenant de 1 ou 2, à 18 atomes de carbone,
éventuellement substitué, notamment par un ou plusieurs
groupements amino, acide carboxylique, dérivé d'acide
carboxylique, alkoxy, aryle ou hydroxy ; un radical aryle,
éventuellement substitué, notamment par un ou plusieurs
groupements amino, acide carboxylique, dérivé d'acide
carboxylique, alkoxy, aryle ou hydroxy ; un radical
arylalkyle ou alkylaryle, éventuellement substitué,
notamment par un ou plusieurs groupements amino, acide
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 4 -
carboxylique, dérivé d'acide carboxylique, alkoxy, aryle ou
hydroxy ; une fonction nitro ; ou une fonction -X'-A'-Z'
dans laquelle :
(i) X' représente un radical divalent, notamment choisi
parmi les alkyles, alcènes, ou alcynes, linéaires, ramifiés
ou cycliques, substitués ou non, chiral ou non-chiral,
éventuellement interrompu par un hétéroatome,
(ii) A' est -0-, -S-, NY'-, -S02-, -C(=S)-, -Co- ou
une fonction chimique telle que Z' et X' sont liés par une
liaison bioisostère de la fonction amide , où Y' représente
un atome d'hydrogène ou un groupement protecteur, notamment
choisi parmi ceux décrits dans l'ouvrage Protective
Groups in Organic Synthesis de T. W. Greene, P. G. M.
Wuts, Wiley-Interscience, New York, 4th edition, 2007, et
(iii) Z' représente un résidu acide aminé, notamment D
ou L, naturel ou synthétique, en particulier un résidu
acide aminé a, (3 ou y, la fonction amine ou carboxyle
terminale (i.e., non liée à X') ainsi que les éventuelles
fonctions chimiques latérales de Z' étant protégées ou non,
où Z' est lié au radical X' via une liaison amide, une
liaison rétro-inverso amide, une liaison ester, ou une
liaison sulfonamide, une liaison thioester ou une liaison
thioamide, ou bien une liaison bioisostère de la liaison
amide, résultant du couplage de X' avec une fonction
aldéhyde ou alcool terminale de Z' résultant de la
réduction de la fonction carboxyle terminale du résidu
acide aminé Z';
- R2, R3, R4 et R5 représentent indépendamment les uns
des autres un atome d'hydrogène ; un atome d'halogène ; une
fonction hydroxyle, éventuellement substituée ; un radical
alkyle, alcène ou alcyne, comprenant de 1 ou 2, à 18 atomes
de carbone, éventuellement substitué, notamment par un ou
plusieurs groupements amino, acide carboxylique, dérivé
d'acide carboxylique, alkoxy, aryle ou hydroxy ; un radical
aryle, éventuellement substitué, notamment par un ou
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 5 -
plusieurs groupements amino, acide carboxylique, dérivé
d'acide carboxylique, alkoxy, aryle ou hydroxy ; un radical
arylalkyle ou alkylaryle, éventuellement substitué,
notamment par un ou plusieurs groupements amino, acide
carboxylique, dérivé d'acide carboxylique, alkoxy, aryle ou
hydroxy ; ou une fonction nitro ;
ou R2 et R3, R3 et R4 et/ou R4 et R5 forment ensemble
un cycle ou un hétérocycle, éventuellement substitué,
- X représente un radical divalent, notamment choisi
parmi les alkyles, alcènes, ou alcynes, linéaires, ramifiés
ou cycliques, substitués ou non, chiral ou non-chiral,
éventuellement interrompu par,un hétéroatome,
- A est -0-, -S-, -NY'-, -S02-, -C(=S)-, -CO- ou une
fonction chimique telle que Z' et X' sont liés par une
liaison bioisostère de la fonction amide, où Y représente
un atome d'hydrogène ou un groupement protecteur, notamment
choisi parmi ceux décrits dans l'ouvrage Protective
Groups in Organic Synthesis de T. W. Greene, P. G. M.
Wuts, Wiley-Interscience, New York, 4th edition, 2007, et
- Z représente un résidu acide aminé, notamment D ou L,
naturel ou synthétique, en particulier un résidu acide
aminé a, (3 ou y, la fonction amine ou carboxyle terminale
(i.e., non liée à X) ainsi que les éventuelles fonctions
chimiques latérales de Z étant protégées ou non, où Z est
lié au radical X via une liaison amide, une liaison rétro-
inverso amide, une liaison ester, ou une liaison
sulfonamide, une liaison thioester ou une liaison
thioamide, ou bien une liaison bioisostère de la liaison
amide, résultant du couplage de X avec une fonction
aldéhyde ou alcool terminale de Z résultant de la réduction
de la fonction carboxyle terminale du résidu acide aminé
Z ;
notamment X et X' sont, indépendamment l'un de l'autre,
éventuellement substitués par une ou plusieurs fonctions
chimiques telles que une chaîne latérale d'un acide aminé
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 6 -
naturel ; C1_6alkyle; C2_6alcène; Ca_6alcyne; C3_8cycloalkyle;
C1_6hétéroalkyle; C1_6haloalkyle; C6_10aryle; C3_10hétéroaryle ;
C5_20hétérocyclique; C1_6alky1C6_10aryle ; C1_6alkylC3_
1ohétéroaryle ; C1_6alkoxy ; C6_loaryloxy ; C3_1ohétéroalkoxy ;
C3_10hétéroaryloxy ; C1_6hétéroalkylthio ; C6_1oarylthio ; C1_
6hétéroalkylthio ; C3_1ohétéroarylthio ; F ; Cl ; Br; I; -
NO2; -CN ; -CF3 ; -CH2CF3 ; -CHC12 ; -CHZOH ; -CH2CHaOH ; -
CH2NH2 ;-CH2SOZCH3 ; ou une fonction -GRGl dans laquelle G
est -0-, -S-, -NRG2-, -C(=O)-, -S(=0)-, -S02-, -C(=O)O-, -
C ( =O ) NRGZ-, -OC ( =O ) -, -NRG2C ( =0 ) -, -OC ( =O ) O-, -OC ( =O ) NRGa-
,
-NRG2C ( =0 ) O-, -NRGZC ( =O ) NRGa-, -C ( =S ) -, -C ( =S ) S-, -SC ( =S ) -
,
SC ( =S ) S-, -C ( =NRGa ) -, -C ( =NRGZ ) O-, -C (=NRG2 ) NRG3-, -OC ( =NRGZ
) -,
-NRGZC ( =NRG3 ) -, -NRG2SOZ-, -NRG2 SO2NRG3-, -NRG2C ( =S ) -, -
SC ( =S ) NRGZ-, -NRG2C (=S ) S-, -NRGaC (=S ) NRGZ-, -SC ( =NRG2 ) -, -
C ( =S ) NRGZ-, -OC ( =S ) NRGa-, -NRGZC ( =S ) O-, -SC ( =0 ) NRc2_
NRG2C(=O)S-, -C(=O)S-, -SC(=O)-, -SC(=O)S-, -C(=S)O-, -
OC(=S)-, -OC(=S)O- ou -SOaNRGZ-, où chaque occurrence de
R", R1Z et RG3 est indépendamment des autres occurrences de
RG1 un atome d'hydrogène ; un atome d'halogène ; ou une
fonction alkyle, hétéroalkyle, alcène ou alcyne, linéaire,
ramifiée ou cyclique, éventuellement substituée ; ou un
groupe aryle, hétéroaryle, hétérocycle, alkylaryle ou
alkylhétéroaryle dans lequel le radical aryle, hétéroaryle
ou hétérocyclique est éventuellement substitué ; ou bien,
lorsque G représente -NRGa-, RG1 et RG2 conjointement avec
l'atome d'azote auquel ils sont liés forment un hétérocycle
ou un hétéroaryle éventuellement substitué,
notamment, ladite liaison bioisostère de la liaison
amide est selon les exemples cités dans les articles
suivants:
(1) Giannis, A.; Kolter, T. Peptidomimetics for
Receptor Ligands Discovery, Development and Medicinal
Perspectives, Angew. Chem., int. Ed. Eng., 1993,
32, 1244-1267 ;
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 7 -
(2) Roark, W.; Roth, B.; Holmes, A.; Trivedi, B.;
Kieft, K.; Essenburg, A.; Krausse, B.; Stanfield,
R. Inhibitors of Acyl-CoA:Cholesterol Acyltransferase
(ACAT) - 2. Modification of Fatty Acid Anilide ACAT
Inhibitors: Bioisosteric Replacement of the Amide Bond,
J. Med. Chem., 1993, 36, 1662-1668.
Ces définitions ne sont pas limitatives, et l'on peut
considérer, par exemple, une amine substituée (secondaire,
tertiaire) comme un isostère de la liaison amide par
exemple.
Dans un mode de réalisation particulier, Z est lié au
radical X via sa fonction carboxyle terminale, et A est -0-
,-S- ou -NY- où le groupe Y représente un atome
d'hydrogène ou un groupement protecteur, notamment choisi
parmi ceux décrits dans l'ouvrage Protective Groups in
Organic Synthesis de T. W. Greene, P. G. M. Wuts, Wiley-
Interscience, New York, 4th edition, 2007. La fonction
amine terminale de Z, et/ou les éventuelles fonctions
chimiques latérales de Z sont libres ou éventuellement
protégées.
Dans un mode de réalisation particulier, Z est lié au
radical X via sa fonction amine terminale, et A est -SO2-1
-C(=S)- ou -CO-. La fonction carboxyle terminale de Z,
et/ou les éventuelles fonctions chimiques latérales de Z
sont libres ou éventuellement protégées.
Lorsque Z est lié au radical X via sa fonction
carboxyle terminale, la fonction amine terminale de Z peut
être sous la forme d'un sel d'amine quaternaire tel qu'un
chlorhydrate, un bromhydrate, un trifluoroacétate (etc...).
Lorsque Z est lié au radical X via sa fonction carboxyle
terminale, la fonction amine terminale de Z, ainsi que les
éventuelles fonctions portées par la chaîne latérale du
résidu acide aminé Z (hydroxyle, amine, guanidine, etc...),
peuvent être protégées par un groupement protecteur de
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 8 -
ladite fonction tel que ceux décrits dans l'ouvrage
"Protective Groups in Organic Synthesis" de TW Greene et
PGM Wuts, Wiley-Interscience, New York, 4th edition 2007.
La fonction amine terminale de Z, et/ou les éventuelles
fonctions chimiques latérales de Z sont libres ou
éventuellement protégées.
Lorsque Z est lié au radical X via sa fonction amine
terminale, la fonction carboxyle terminale de Z peut être
sous la forme d'un sel tel qu'un sel de sodium ou de
potassium. Lorsque Z est lié au radical X via sa fonction
amine terminale, la fonction carboxyle terminale de Z,
ainsi que les éventuelles fonctions portées par la chaîne
latérale du résidu acide aminé Z (hydroxyle, amine,
guanidine, etc...), peuvent être protégées par un
groupement protecteur de ladite fonction tel que ceux
décrits dans l'ouvrage "Protective Groups in Organic
Synthesis" de TW Greene et PGM Wuts, Wiley-Interscience,
New York, 4th edition 2007. La fonction carboxyle terminale
de Z, et/ou les éventuelles fonctions chimiques latérales
de Z sont libres ou éventuellement protégées.
Plus particulièrement, le groupe X représente un
radical divalent du type -(CHa)n- dans lequel n est un
nombre entier allant de 1 à 10, notamment dé 2 à 8.
Plus particulièrement, le groupe X représente un
radical divalent ramifié répondant à la formule -(CHZ)P-
CHR,- ( CH2) q- dans lequel p et q sont indépendamment l'un de
l'autre un nombre entier allant de 0 à 12, et la somme p+q
est un nombre entier allant de 1 à 12, notamment de 1 à 7,
et RX est une chaîne latérale d'un acide aminé naturel ; C.
6alkyle; C1_6hétéroalkyle; C1_6haloalkyle; C6_1oaryle; C3_
1ohétéroaryle ; C1_6alkylC6_loaryle ; C1_6alkylC3_
lohétéroaryle ; C1_6alkoxy ; C6_loaryloxy ; C3_lohétéroalkoxy ;
C3_1ohétéroaryloxy ; C1_6hétéroalkylthio ; C6_loarylthio ; C1_
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 9 -
6hétéroalkylthio ; C3_lohétéroarylthio ; F ; C1 ; Br; I; -
NOZ ; -CN ; -CF3 ; -CH2CF3 ; -CHC12 ; -CHZOH ; -CH2CH2OH ; -
CH2NH2 ;-CH2SOZCH3 ;- ou une fonction -GRGl dans laquelle G
est -0-, -S-, -NRGZ-, -C(=O)-, -S(=0)-, -S02-1 -C(=0)O-, -
C(=O)NRG2-, -OC(=O)-, -Ne2C(=0)-, -OC(=O)O-, -OC(=O)NRG2-, -
NRGZC(=O)O-, -NRGaC(=0)NRGZ-, -C(=S)-, -C(=S)S-, -SC(=S)-, -
SC ( =S ) S-, -C ( =NRGZ ) -, -C ( =NRGZ ) O-, -C ( =NRGa ) NRG3-, -OC ( =NRGa
) -,
-NRGZC ( =NRG3 ) -, -NRG2SOa-, -NRGZSO2NRG3-, -NRG2C (=S ) -, -
SC ( =S ) NRGZ-, -NRGZC ( =S ) S-, -NRGZC (=S ) NRG2-, -SC ( =NRc2 ) _ r _
C ( =S ) NRGZ-, -OC ( =S ) NRG2-, -NRG2C (=S ) O-, -SC ( =O ) NRGZ-, -
NRG2C(=0)S-, -C(=O)S-, -SC(=O)-, -SC(=O)S-, -C(=S)0-, -
OC (=S )-, -OC (=S ) O- ou -SO2NRG2-, où chaque occurrence de RG1,
RG2 et RG3 e s t i ndépe ndamment des autres oc c urre nc e s de RG1
un atome d'hydrogène ; un atome d'halogène ; ou une
fonction alkyle, hétéroalkyle, alcène ou alcyne, linéaire,
ramifiée ou cyclique, éventuellement substituée ; ou un
groupe aryle, hétéroaryle, alkylaryle ou alkylhétéroaryle
dans lequel le radical aryle ou hétéroaryle est
éventuellement substitué ; ou bien, lorsque G représente -
NRG2-, RGl et R G2 conjointement avec l'atome d'azote auquel
ils sont liés forment un hétérocycle ou un hétéroaryle
éventuellement substitué.
Dans un mode de réalisation particulier, X représente
un radical divalent ramifié répondant à la formule -(CHa)P-
CHR,-(CHZ)q- dans lequel p et q sont indépendamment l'un de
l' autre un nombre entier allant de 0 à 7, et la somme p+q
est un nombre entier allant de 1 à 7, et R. est C1_6alkyle,
linéaire, ramifié ou cyclique; C1_6alkyleC6_10aryl ; C1_
6alkyloxy; une chaîne latérale d'un acide aminé naturel ;
ou -ORGl ; -C(=O ) ORGl ; -NRG1RGZ ou -SO3H, où RGl et RG2 sont
indépendamment l'un de l'autre un atome d'hydrogène ou un
groupe C1_6alkyle éventuellement substitué, ou bien RG1 et
RG2 conjointement avec l'atome d'azote auquel ils sont liés
forment un hétérocycle ou un hétéroaryle éventuellement
substitué.
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 10 -
Selon un mode de réalisation particulier, A est -NY-,
et le résidu acide aminé Z est lié au radical X via uné
liaison amide, en particulier répondant à la formule
Z'CONYX, dans laquelle le radical Z'CO- représente le
résidu acide aminé Z, et X et Z sont tels que définis ci-
dessus.
Selon un mode de réalisation particulier, A est -CO-,
et le résidu acide aminé Z est lié au radical X via une
liaison rétro-inverso amide, en particulier répondant à la
formule Z'NYCOX, dans laquelle le radical Z'NY- représente
le résidu acide aminé Z, et X et Z sont tels que définis
ci-dessus.
Selon un mode de réalisation particulier, A est -0-, et
le résidu acide aminé Z est lié au radical X via une
liaison ester, en particulier répondant à la formule
Z'COOX, dans laquelle le radical Z'CO- représente le résidu
acide aminé Z, et X et Z sont tels que définis ci-dessus.
Selon un mode de réalisation particulier, A est -SO2-1
et le résidu acide aminé Z est lié au radical X via une
liaison sulfonamide, en particulier répondant à la formule
Z'NYSOzX, dans laquelle le radical Z'NY- représente le
résidu acide aminé Z, et X et Z sont tels que définis ci-
dessus.
Selon un mode de réalisation particulier, A est -C(=S)-
et le résidu acide aminé Z est lié au radical X via une
liaison thioamide, en particulier répondant à la formule
Z'NYC(S=O)X, dans laquelle le radical Z'NY- représente le
résidu acide aminé Z, et X et Z sont tels que définis ci-
dessus.
Selon un mode de réalisation particulier, A est -S-et
le résidu acide aminé Z est lié au radical X via une
liaison thioester, en particulier répondant à la formule
Z'C(=O)SX, dans laquelle le radical Z'C(=O)- représente le
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 11 -
résidu acide aminé Z, et X et Z sont tels que définis ci-
dessus.
Selon un mode de réalisation particulier, le groupe Y,
dans les formules Z'CONYX, Z'NYCOX, Z'NYC(S=O)X et Z'NYSO2X
précitées, représente un atome d'hydrogène ou un groupement
protecteur, notamment choisi parmi ceux décrits dans
l'ouvrage Protective Groups in Organic Synthesis de T.
W. Greene, P. G. M. Wuts, Wiley-Interscience, New York, 4th
edition, 2007.
Les composés décrits dans la présente peuvent être
substitués par des substituants ou fonctions chimiques, qui
peuvent être aussi nombreux et variés que la valence
chimique du composé le permet. En général, le terme
substitué , précédé ou non du terme éventuellement ,
et les substituants décrits dans les formules de la
présente, désignent le remplacement d'un radical hydrogène
dans une structure donnée avec le radical d'un substituant
spécifié. Lorsque plus d'une position dans une structure
donnée peut être substituée avec plus d'un substituant
sélectionné parmi un groupe spécifié, les substituants
peuvent être les mêmes ou différents à chaque position. Le
terme substitué couvre tous les substituants des
composés organiques possibles et envisageables par l'homme
du métier. Selon un aspect, les substituants envisagés
incluent tout substituant carbone ou hétéroatome de
composés organiques, qu'ils soient cycliques ou non,
linéaires ou ramifiés, hétérocycliques ou carbocycliques,
aromatiques ou non. Pour ce qui concerne la présente
invention, les hétéroatomes, tels que l'atome d'azote,
peuvent porter des atomes d'hydrogène et/ou tout
substituant permissible de composés organiques décrits dans
la présente, qui satisfont la valence chimique desdits
hétéroatomes. De plus, l'invention telle que décrite dans
la présente ne doit en aucun cas être interprétée comme
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 12 -
étant limitée par les substituants permissibles des
composés organiques. Les combinaisons de substituants et de
groupes chimiques envisagés dans la présente invention sont
de préférence ceux qui résultent en la formation de
composés stables et utilisables pour le traitement et la
prévention de maladies, troubles et affections, tels que
ceux décrits dans la présente. Les substituants incluent,
de manière non limitative, alkyle; alcène, alcyne,
cycloalkyle, cycloalcène, cycloalcyne, hétéroalkyle;
haloalkyle; aryle; hétéroaryle ; hétérocycle ; alkylaryle
alkylhétéroaryle ; alkoxy ; aryloxy ; hétéroalkoxy
hétéroaryloxy ; hétéroalkylthio ; arylthio
hétéroalkylthio ; hétéroarylthio ; F ; Cl ; Br; I; -NO2 ; -
CN ; -CF3 ; -CH2CF3 ; -CHC12 ; -CHaOH ; -CH2CHZOH ; -CH2NH2 ; -
CH2SO2CH3 ; ou une fonction -GR" dans laquelle G est -0-,
-S-, -NRG2-, -C(=O)-, -S(=O)-, -S02-, -C(=0)O-1 -C(=O)NRG2-,
-OC ( =O ) -, -NRGaC ( =O ) -, -OC ( =O ) O-, -OC ( =O ) NRG2-, -NRGaC ( =O )
O-,
-NRG2C(=O)NRG2-, -C(=S)-, -C(=S)S-, -SC(=S)-, -SC(=S)S-, -
C ( =NRGa ) - , -C ( =NRGZ ) O- , -C ( =NRG2 ) NRG3- , -OC ( =NRGa ) - , -
NRGaC ( =NR03) -, -NRGaSOa-, -NRG2 SO2NRG3-, -NRGaC ( =S ) -, -
SC ( =S ) NRG2-, -NRG2C (=S ) S-, -NRGZC ( =S ) NRGZ-, -SC ( =NRG2) -, -
C ( =S ) NRGa-, -OC ( =S ) NRG2-, -NRGaC (=S ) O-, -SC ( =O ) NRG2-, -
NRGaC(=O)S-, -C(=O)S-, -SC(=O)-, -SC(=O)S-, -C(=S)O-, -
OC (=S )-, -OC (=S ) O- ou -SOZNRGZ-, où chaque occurrence de RGl,
RG2 et RG3 est indépendamment des autres occurrences de RGl
un atome d'hydrogène ; un atome d'halogène ; ou une
fonction alkyle, hétéroalkyle, alcène ou alcyne, linéaire,
ramifiée ou cyclique, éventuellement substituée ; ou un
groupe aryle, hétéroaryle, hétérocycle, alkylaryle ou
alkylhétéroaryle dans lequel le radical aryle, hétéroaryle
ou hétérocylique est éventuellement substitué ; ou bien,
1 o r s que G repré s e nte -NRGa -, RG1 et R G2 c on j o i nteme nt avec
l'atome d'azote auquel ils sont liés forment un hétérocycle
ou un hétéroaryle éventuellement substitué.
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 13 -
D'autres exemples de substituants généralement
acceptables pour la mise en oeuvre de l'invention pourront
apparaître à l'homme du métier à la lecture des exemples
ci-dessous, donnés à titre illustratif.
Le terme stable désigne de préférence des composés
qui sont suffisamment stables pour permettre leur
préparation, et dont l'intégrité est maintenue pendant une
durée suffisante pour permettre leur détection, et de
préférence pendant une durée suffisante pour être
utilisables pour les objectifs détaillés dans la présente.
Par atome d'halogène, on désigne un atome choisi parmi
le fluor, le chlore, le brome et l'iode.
Les radicaux alkyles peuvent comprendre de 1 à 18
atomes de carbones, notamment de 1 à 12 atomes de carbones,
et en particulier de 1 à 6 atomes de carbone.
Les radicaux alcènes peuvent comprendre de 2 à 18
atomes de carbones, notamment de 2 à 12 atomes de carbones,
et en particulier de 2 à 6 atomes de carbone. Ils peuvent
en outre comprendre une ou plusieurs double liaison(s).
Les radicaux alcynes peuvent comprendre de 2 à 18
atomes de carbones, notamment de 2 à 12 atomes de carbones,
et en particulier de 2 à 6 atomes de carbone. Ils peuvent
en outre comprendre une ou plusieurs triple liaison(s).
Sauf mention contraire, les radicaux alkyles, alcènes
et alcynes peuvent être linéaires, ramifiés ou cycliques.
Le terme hétéroalkyle désigne un radical alkyle
dans lequel au moins un atome de carbone dans la chaîne
principale a été remplacé par un hétéroatome. Ainsi, un
hétéroalkyle désigne un radical alkyle comprenant, dans sa
chaîne principale, au moins un hétéroatome sélectionné
parmi les atomes d'azote, soufre, phosphore, silicium,
oxygène ou sélénium à la place d'un atome de carbone.
Ainsi, un radical C1_6hétéroalkyle désigne un radical
comprenant 1 à 6 atomes de carbone et au moins un
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 14 -
hétéroatome sélectionné parmi les atomes d'azote, soufre,
phosphore, silicium, oxygène ou sélénium.
Le terme aryle désigne un système hydrocarbure
mono-, bi- ou tricyclique comprenant un, deux ou trois
cycles satisfaisant la règle d'aromaticité de Hückel. Par
exemple, un radical aryle peut être un groupe phényle,
naphthyle, tétrahydronaphthyle, indanyle, indényle et
radicaux similaires. Les radicaux aryles peuvent comprendre
de 6 à 14 atomes de carbone et notamment de 6 à 10 atomes
de carbone.
Le terme hétéroaryle désigne un système
hétérocyclique insaturé comprenant au moins un cycle
aromatique, et de 5 à 14 chaînons, parmi lesquels au moins
un chaînon du système cyclique est séléctionné parmi S, O
et N ; zéro, un ou deux chaînons du système cyclique sont
des hétéroatomes additionnels sélectionnés indépendamment
les uns des autres parmi S, O et N; le reste des chaînons
du système cyclique étant des atomes de carbone ; le
radical hétéroaryle étant lié au reste de la molécule via
l'un quelconque des chaînons du système cyclique (qu'il
s'agisse d'un atome de carbone ou d'un hétéroatome). Par
exemple, un radical hétéroaryle peut être un radical
pyridyle, pyrazinyle, pyrimidinyle, pyrrolyle, pyrazolyle,
imidazolyle, thiazolyle, oxazolyle, isooxazolyle,
thiadiazolyle, oxadiazolyle, thiophenyle, furanyle,
quinolinyle, isoquinolinyle, et radicaux similaires.
Les radicaux arylalkyles et alkylaryles peuvent
comprendre de 7 à 25 atomes de carbones, notamment de 7 à
20 atomes de carbone et en particulier de 7 à 15 atomes de
carbone. Tout particulièrement le radical alkylaryle peut
représenter un benzyle.
Les radicaux hétéroarylalkyles et alkylhétéroaryles
peuvent comprendre de 7 à 25 atomes de carbones, notamment
de 7 à 20 atomes de carbone et en particulier de 7 à 15
atomes de carbone.
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 15 -
Lorsque R2 et R3, R3 et R4 et/ou R4 et R5 forment
ensemble un cycle ou un hétérocycle, celui-ci peut
présenter de 4 à 10 chaînons, et notamment de 6 à 8
chaînons.
Le terme hétérocycle désigne un système cyclique
mono- ou polycyclique saturé ou insaturé et non-aromatique
comprenant de 5 à 20 chaînons, et comprenant éventuellement
un ou plusieurs cycles à 5 ou 6 chaînons ayant entre 1 et 3
hétéroatomes sélectionnés indépendamment les uns des autres
parmi S, O, N, P, Se et Si dans lesquels (i) chaque cycle à
5 chaînons a de 0 à 2 double liaisons, et chaque cycle à 6
chaînons a de 0 à 2 double liaisons, (ii) les atomes de
soufre et/ou d'azote sont éventuellement oxydés, et (iii)
les atomes d'azote sont éventuellement sous forme de sel
quaternaires. Par exemple, un radical hétérocyclique peut
être un groupe pyrrolidinyle, pyrazolinyle, pyrazolidinyle,
imidazolinyle, imidazolidinyle, piperidinyle, piperazinyle,
oxazolidinyle, isoxazolidinyle, morpholinyle,
thiazolidinyle, isothiazolidinyle, ou tetrahydrofuryle.
Un hétérocycle comprend dans son système cyclique outre
des atomes de carbone au moins un hétéroatome, notamment
choisi parmi l'oxygène, l'azote, le soufre, le phosphore,
le sélénium et le silicium.
Le terme amine ou amino désigne un radical
répondant à la formule N(R)2 dans laquelle chaque
occurrence de R est indépendamment l'une de l'autre un
atome d'hydrogène ; un radical alkyle, hétéroalkyle,
alcène, alcyne, aryle, hétéroaryle, arylalkyle, alkylaryle,
hétéroarylalkyle, alkylhétéroaryle, éventuellement
substitué ; ou dans laquelle les groupes R forment, avec
l'atome d'azote auquel ils sont liés, un hétérocycle ou
hétéroaryle éventuellement substitué. La fonction amine
peut éventuellement être sous la forme d'un sel d'amine
quaternaire.
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 16 -
Le terme dérivé d'acide carboxylique désigne un
radical répondant à la formule -C(=O)R dans laquelle R est
un atome d'hydrogène ; un halogène ; un radical alkyle,
hétéroalkyle, alcène, alcyne, aryle, hétéroaryle,
arylalkyle, alkylaryle, hétéroarylalkyle, alkylhétéroaryle,
éventuellement substitué ; ou une fonction -GRO1 dans
laquelle G est -O- ou -NRG2-, où RG2 est indépendamment de
R'1 un atome d'hydrogène ; ou une fonction alkyle,
hétéroalkyle, alcène ou alcyne, linéaire, ramifiée ou
cyclique, éventuellement substituée ; ou un groupe aryle,
hétéroaryle, hétérocycle, alkylaryle ou alkylhétéroaryle
dans lequel le radical aryle, hétéroaryle ou hétérocyclique
est éventuellement substitué, ou bien RG1 et R G2
conjointement avec l'atome d'azote auquel ils sont liés
forment un hétérocycle ou un hétéroaryle éventuellement
substitué.
Les résidus d'acides aminés peuvent être des résidus
d'acides aminés naturels ou d'acides aminés synthétiques,
notamment d'acides (3, y ou cu aminés. Les résidus d'acides
aminés peuvent se présenter sous forme racémique ou sous
forme énantiomériquement enrichie, voire pure, en forme D
ou L. La fonction amine ou carboxyle terminale (i.e., non
liée à X ou X') ainsi que les éventuelles fonctions
chimiques latérales des résidus d'acides aminés peuvent
être protégées ou non.
D'une manière générale, tous le résidus acide a-, (3-
et y-aminés, naturels (L) ou non (D, ou synthétiques),
peuvent être utilisés. Par exemple, les acides a- aminés
comme l'ornithine ou la norleucine, les acides (3-aminés
comme la (3-alanine, les acides y-aminés comme la statine,
ou des structures plus exotiques utilisées en synthèse de
peptidomimétiques comme par exemple le Tic (acide 1,2,3,4-
tétrahydroisoquinoline-3-carboxylique), peuvent être
employés.
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 17 -
Ceci ne constitue pas une liste exhaustive.
Les résidus d'acides aminés peuvent par exemple être
choisis dans le groupe comprenant :
- les résidus d'acides aminés naturels, notamment
Glycine, Alanine, Valine, Leucine, Isoleucine,
Phénylalanine, Tyrosine, Tryptophane, Acide
Glutamique, Glutamine, Acide Aspartique, Asparagine,
Sérine, Thréonine, Méthionine, Cystéine, Lysine,
Arginine, Histidine, Proline,
- les résidus d'acides aminés rares , notamment
hydroxyproline, hydroxylysine, allo-hydroxylysine,
6-N-méthylysine, N-éthylglycine, N-méthylglycine, N-
éthylasparagine, allo-isoleucine, N-
méthylisoleucine, N-méthylvaline, pyroglutamine,
acide aminobutyrique,
- les résidus d'acides aminés synthétiques, notamment
ornithine, norleucine, la norvaline, cyclohexyl-
alanine,
- statine, et
- tic (acide 1,2,3,4-tétrahydroisoquinoline-3-
carboxylique),
Ces résidus peuvent se présenter sous forme racémique
ou sous forme D ou L.
Le terme isolé , lorsqu'il est utilisé pour
caractériser les composés de l'invention, désigne des
composés qui sont (i) séparés d'au moins un composé avec
lequel ils sont associés dans la nature, et/ou (ii)
produits, préparés ou fabriqués par les soins de l'homme.
Selon une première définition de l'invention, les
composés répondent à la formule (I) telle que définie ci-
dessus, de laquelle les composés suivants sont exclus :
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 18 -
OH O OH O
I \ I I \ I
OH O HN\ NHAc OH O HN\ ^NHAc
~IOI(^ ~IOIf
OH O OH O
I \ I I \ I
OH O HN OH O HN
~NHAc '~"CNHAc
O O
Selon une deuxième définition de l'invention, les composés
répondent à la formule (I) suivante, ou un de ses sels
pharmaceutiquement acceptables:
O R2
R7 R3
,A, ~
Z X R4
O R5
Formule (I)
dans laquelle
A est -0-, -S-, -SO2-1 -C(=S)-, -CO- ou une fonction chimique
telle que Z' et X' sont liés par une liaison bioisostère de la
fonction amide
- R1 représente un atome d'hydrogène ; un atome d'halogène ;
une fonction hydroxyle, éventuellement substituée ; un
radical alkyle, alcène ou alcyne, comprenant de 1 ou 2, à 18
atomes de carbone, éventuellement substitué, notamment par un
ou plusieurs groupements amino, acide carboxylique, dérivé
d'acide carboxylique, alkoxy, aryle ou hydroxy ; un radical
aryle, éventuellement substitué, notamment par un ou plusieurs
groupements amino, acide carboxylique, dérivé d'acide
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 19 -
carboxylique, alkoxy, aryle ou hydroxy ; un radical arylalkyle
ou alkylaryle, éventuellement substitué, notamment par un ou
plusieurs groupements amino, acide carboxylique, dérivé
d'acide carboxylique, alkoxy, aryle ou hydroxy ; une fonction
nitro ; ou une fonction -X'-A'-Z' dans laquelle
(i) X' représente un radical divalent, notamment choisi parmi
les alkyles, alcènes, ou alcynes, linéaires, ramifiés ou
cycliques, substitués ou non, chiral ou non-chiral,
éventuellement interrompu par un hétéroatome,
(ii) A' est -0-, -S-, -NY'-, -SOz-, -C(=S)-, -CO- ou une
fonction chimique telle que Z' et X' sont liés par une liaison
bioisostère de la fonction amide, où Y' représente un atome
d'hydrogène ou un groupement protecteur, notamment choisi
parmi ceux décrits dans l'ouvrage Protective Groups in
Organic Synthesis de T. W. Greene, P. G. M. Wuts, Wiley-
Interscience, New York, 4th edition, 2007, et
(i.ii) Z' représente un résidu acide aminé, notamment D ou
L, naturel ou synthétique, en particulier un résidu acide
aminé a, (3 ou y, la fonction amine ou carboxyle terminale
(i.e., non liée à X') ainsi que les éventuelles fonctions
chimiques latérales de Z' étant protégées ou non, où Z' est
lié au radical X' via une liaison amide, une liaison rétro-
inverso amide, une liaison ester, ou une liaison sulfonamide,
une liaison thioester ou une liaison thioamide, ou bien une
liaison bioisostère de la liaison amide, résultant du couplage
de X' avec une fonction aldéhyde ou alcool terminale de Z'
résultant de la réduction de la fonction carboxyle terminale
du résidu acide aminé Z';
- R2, R3, R4 et R5 représentent indépendamment les uns des
autres un atome d'hydrogène ; un atome d'halogène ; une
fonction hydroxyle, éventuellement substituée ; un radical
alkyle, alcène ou alcyne, comprenant de 1 ou 2, à 18 atomes de
carbone, éventuellement substitué, notamment par un ou
plusieurs groupements amino, acide carboxylique, dérivé
d'acide carboxylique, alkoxy, aryle ou hydroxy ; un radical
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 20 -
aryle, éventuellement substitué, notamment par un ou plusieurs
groupements amino, acide carboxylique, dérivé d'acide
carboxylique, alkoxy, aryle ou hydroxy ; un radical arylalkyle
ou alkylaryle, éventuellement substitué, notamment par un ou
plusieurs groupements amino, acide carboxylique, dérivé
d'acide carboxylique, alkoxy, aryle ou hydroxy ; ou une
fonction nitro ;
ou R2 et R3, R3 et R4 et/ou R4 et R5 forment ensemble un cycle
ou un hétérocycle, éventuellement substitué,
- X représente un radical divalent, notamment choisi parmi les
alkyles, alcènes, ou alcynes, linéaires, ramifiés ou
cycliques, substitués ou non, chiral ou non-chiral,
éventuellement interrompu par un hétéroatome, et
- Z représente un résidu acide aminé, notamment D ou L,
naturel ou synthétique, en particulier un résidu acide aminé
a, (3 ou y, la fonction amine ou carboxyle terminale (i.e., non
liée à X) ainsi que les éventuelles fonctions chimiques
latérales de Z étant protégées ou non, où Z est lié au radical
X via une liaison rétro-inverso amide, une liaison ester, ou
une liaison sulfonamide, une liaison thioester ou une liaison
thioamide, ou bien une liaison bioisostère de la liaison
amide, résultant du couplage de X avec une fonction aldéhyde
ou alcool terminale de Z résultant de la réduction de la
fonction carboxyle terminale du résidu acide aminé Z;
ou dans laquelle
A est-NY- ; et
(a)
- R1 représente un atome d'hydrogène ; un atome d'halogène ;
une fonction hydroxyle, éventuellement substituée ; un
radical alkyle, alcène ou alcyne, comprenant de 1 ou 2, à 18
atomes de carbone, éventuellement substitué, notamment par un
ou plusieurs groupements amino, acide carboxylique, dérivé
d'acide carboxylique, alkoxy, aryle ou hydroxy ; un radical
aryle, éventuellement substitué, notamment par un ou plusieurs
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 21 -
groupements amino, acide carboxylique, dérivé d'acide
carboxylique, alkoxy, aryle ou hydroxy ; un radical arylalkyle
ou alkylaryle, éventuellement substitué, notamment par un ou
plusieurs groupements amino, acide carboxylique, dérivé
d'acide carboxylique, alkoxy, aryle ou hydroxy ; une fonction
nitro ; ou une fonction -X'-A'-Z' dans laquelle :
(i) X' représente un radical divalent, notamment choisi parmi
les alkyles, alcènes, ou alcynes, linéaires, ramifiés ou
cycliques, substitués ou non, chiral ou non-chiral,
éventuellement interrompu par un hétéroatome,
(ii) A' est -0-, -S-, -NY'-, -S02-, -C(=S)-, -CO- ou une
fonction chimique telle que Z' et X' sont liés par une liaison
bioisostère de la fonction amide, où Y' représente un atome
d'hydrogène ou un groupement protecteur, notamment choisi
parmi ceux décrits dans l'ouvrage Protective Groups in
Organic Synthesis de T. W. Greene, P. G. M. Wuts, Wiley-
Interscience, New York, 4th edition, 2007, et
(iii) Z' représente un résidu acide aminé, notamment D ou L,
naturel ou synthétique, en particulier un résidu acide aminé
ct, (3 ou y, la fonction amine ou carboxyle terminale (i.e., non
liée à X') ainsi que les éventuelles fonctions chimiques
latérales de Z étant protégées ou non, où Z' est lié au
radical X' via une liaison amide, une liaison rétro-inverso
amide, une liaison ester, ou une liaison sulfonamide, une
liaison thioester ou une liaison thioamide, ou bien une
liaison bioisostère de la liaison amide, résultant du couplage
de X' avec une fonction aldéhyde ou alcool terminale de Z'
résultant de la réduction de la fonction carboxyle terminale
du résidu acide aminé Z';
- R3, R4 et R5 représentent indépendamment les uns des autres
un atome d'hydrogène ; un atome d'halogène ; une fonction
hydroxyle, éventuellement substituée ; un radical aikyle,
alcène ou alcyne, comprenant de 1 ou 2, à 18 atomes de
carbone, éventuellement substitué, notamment par un ou
plusieurs groupements amino, acide carboxylique, dérivé
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 22 -
d'acide carboxylique, alkoxy, aryle ou hydroxy ; un radical
aryle, éventuellement substitué, notamment par un ou plusieurs
groupements amino, acide carboxylique, dérivé d'acide
carboxylique, alkoxy, aryle ou hydroxy ; un radical arylalkyle
ou alkylaryle, éventuellement substitué, notamment par un ou
plusieurs groupements amino, acide carboxylique, dérivé
d'acide carboxylique, alkoxy, aryle ou hydroxy ; ou une
fonction nitro ;
- R2 représente indépendamment de R1, R3, R4 et R5 un atome
d'hydrogène ; un atome d'halogène ; une fonction hydroxyle
substitué ; un radical alkyle, alcène ou alcyne, comprenant de
1 ou 2, à 18 atomes de carbone, éventuellement substitué,
notamment par un ou plusieurs groupements amino, acide
carboxylique, dérivé d'acide carboxylique, alkoxy, aryle ou
hydroxy ; un radical aryle, éventuellement substitué,
notamment par un ou plusieurs groupements amino, acide
carboxylique, dérivé d'acide carboxylique, alkoxy, aryle ou
hydroxy ; un radical arylalkyle ou alkylaryle, éventuellement
substitué, notamment par un ou" plusieurs groupements amino,
acide carboxylique, dérivé d'acide carboxylique, alkoxy, aryle
ou hydroxy ; ou une fonction nitro;
ou R2 et R3, R3 et R4 et/ou R4 et R5 forment ensemble un cycle
ou un hétérocycle, éventuellement substitué,
- X représente un radical divalent, notamment choisi parmi les
alkyles, alcènes, ou alcynes, linéaires, ramifiés ou
cycliques, substitués ou non, éventuellement interrompu par un
hétéroatome,
- Y représente un atome d'hydrogène ou un groupement
protecteur, notamment choisi parmi ceux décrits dans l'ouvrage
Protective Groups in Organic Synthesis de T. W. Greene,
P. G. M. Wuts, Wiley-Interscience, New York, 4th edition,
2007, et
- Z représente un résidu acide aminé, notamment D ou L,
naturel ou synthétique, en particulier un résidu acide aminé
a, (3 ou y, la fonction amine terminale (i.e., non liée à X)
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 23 -
ainsi que les éventuelles fonctions chimiques latérales de Z
étant protégées ou non, où Z est lié au radical X via une
liaison amide;
(b)
- R1 représente un atome d'hydrogène ; un atome d'halogène ;
une fonction hydroxyle, éventuellement substituée ; un radical
alkyle, alcène ou alcyne, comprenant de 1 ou 2, à 18 atomes de
carbone, éventuellement substitué, notamment par un ou
plusieurs groupements amino, acide carboxylique, dérivé
d'acide carboxylique, alkoxy, aryle ou hydroxy ; un radical
aryle, éventuellement substitué, notamment par un ou plusieurs
groupements amino, acide carboxylique, dérivé d'acide
carboxylique, alkoxy, aryle ou hydroxy ; un radical arylalkyle
ou alkylaryle, éventuellement substitué, notamment par un ou
plusieurs groupements amino, acide carboxylique, dérivé
d'acide carboxylique, alkoxy, aryle ou hydroxy ; une fonction
nitro ; ou une fonction -X'-A'-Z' dans laquelle
(i) Xh représente un radical divalent, notamment choisi parmi
les aikyles, alcènes, ou alcynes, linéaires, ramifiés ou
cycliques, substitués ou non, chiral ou non-chiral,
éventuellement interrompu par un hétéroatome,
(ii) A' est -0-, -S-, -NY'-, -SOa-, -C(=S)-, -CO- ou une
fonction chimique telle que Z' et X' sont liés par une liaison
bioisostère de la fonction amide, où Y' représente un atome
d'hydrogène ou un groupement protecteur, notamment choisi
parmi ceux décrits dans l'ouvrage Protective Groups in
Organic Synthesis de T. W. Greene, P. G. M. Wuts, Wiley-
Interscience, New York, 4th edition, 2007, et
(iii) Z' représente un résidu acide aminé, notamment D ou L,
naturel ou synthétique, en particulier un résidu acide aminé
a, (3 ou y, la fonction amine ou carboxyle terminale (i.e., non
liée à X') ainsi que les éventuelles fonctions chimiques
latérales de Z étant protégées ou non, où Z' est lié au
radical X' via une liaison amide, une liaison rétro-inverso
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 24 -
amide, une liaison ester, ou une liaison sulfonamide, une
liaison thioester ou une liaison thioamide, ou bien une
liaison bioisostère de la liaison amide, résultant du couplage
de X' avec une fonction aldéhyde ou alcool terminale de Z'
résultant de la réduction de la fonction carboxyle terminale
du résidu acide aminé Z';
- R3, R4 et R5 représentent indépendamment les uns des autres
un atome d'hydrogène ; un atome d'halogène ; une fonction
hydroxyle, éventuellement substituée ; un radical alkyle,
alcène ou alcyne, comprenant de 1 ou 2, à 18 atomes de
carbone, éventuellement substitué, notamment par un ou
plusieurs groupements amino, acide carboxylique, dérivé
d'acide carboxylique, alkoxy, aryle ou hydroxy ; un radical
aryle, éventuellement substitué, notamment par un ou plusieurs
groupements amino, acide carboxylique, dérivé d'acide
carboxylique, alkoxy, aryle ou hydroxy ; un radical arylalkyle
ou alkylaryle, éventuellement substitué, notamment par un ou
plusieurs groupements amino, acide carboxylique, dérivé
d'acide carboxylique, alkoxy, aryle ou hydroxy ; ou une
fonction nitro ;
- R2 représente une fonction hydroxyle;
ou R3 et R4 et/ou R4 et R5 forment ensemble un cycle ou un
hétérocycle, éventuellement substitué,
- X représente un radical divalent, notamment choisi parmi les
alkyles, alcènes, ou alcynes, linéaires ou cycliques, non
substitués, éventuellement interrompu par un hétéroatome,
- Y représente un atome d'hydrogène ou un groupement
protecteur, notamment choisi parmi ceux décrits dans l'ouvrage
Protective Groups in Organic Synthesis de T. W. Greene,
P. G. M. Wuts, Wiley-Interscience, New York, 4th edition,
2007, et
- Z représente un résidu acide aminé, notamment D ou L,
naturel ou synthétique, en particulier un résidu acide aminé
a, (3 ou y, la fonction amine terminale (i.e., non liée à X)
ainsi que les éventuelles fonctions chimiques latérales de Z
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 25 -
étant protégées ou non, où Z est lié au radical X via une
liaison amide ;
ou dans laquelle:
(c)
- R1 représente un atome d'halogène ; une fonction hydroxyle,
éventuellement substituée ; un radical alkyle, alcène ou
alcyne, comprenant de 1 ou 2, à 18 atomes de carbone,
éventuellement substitué, notamment par un ou plusieurs
groupements amino, acide carboxylique, dérivé d'acide
carboxylique, alkoxy, aryle ou hydroxy ; un radical aryle,
éventuellement substitué, notamment par un ou plusieurs
groupements amino, acide carboxylique, dérivé d'acide
carboxylique, alkoxy, aryle ou hydroxy ; un radical arylalkyle
ou alkylaryle, éventuellement substitué, notamment par un ou
plusieurs groupements amino, acide carboxylique, dérivé
d'acide carboxylique, alkoxy, aryle ou hydroxy ; une fonction
nitro ; ou une fonction -X'-A'-Z' dans laquelle
(i) X' représente un radical divalent, notamment choisi parmi
les alkyles, alcènes, ou alcynes, linéaires, ramifiés ou
cycliques, substitués ou non, chiral ou non-chiral,
éventuellement interrompu par un hétéroatome,
(ii) A' est -0-, -S-, -NY'-, -SOZ-, -C(=S)-, -CO- ou une
fonction chimique telle que Z' et X' sont liés par une liaison
bioisostère de la fonction amide, où Y' représente un atome
d'hydrogène ou un groupement protecteur, notamment choisi
parmi ceux décrits dans l'ouvrage Protective Groups in
Organic Synthesis de T. W. Greene, P. G. M. Wuts, Wiley-
Interscience, New York, 4th edition, 2007, et
(iii) Z' représente un résidu acide aminé, notamment D ou L,
naturel ou synthétique, en particulier un résidu acide aminé
a, (3 ou y, la fonction amine ou carboxyle terminale (i.e., non
liée à X') ainsi que les éventuelles fonctions chimiques
latérales de Z étant protégées ou non, où Z' est lié au
radical X' via une liaison amide, une liaison rétro-inverso
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 26 -
amide, une liaison ester, ou une liaison sulfonamide, une
liaison thioester ou une liaison thioamide, ou bien une
liaison bioisostère de la liaison amide, résultant du couplage
de X' avec une fonction aldéhyde ou alcool terminale de Z'
résultant de la réduction de la fonction carboxyle terminale
du résidu acide aminé Z';
- R2 représente une fonction hydroxyle;
- R3, R4 et R5 représentent indépendamment les uns des autres
un atome d'hydrogène ; un atome d'halogène ; une fonction
hydroxyle, éventuellement substituée ; un radical alkyle,
alcène ou alcyne, comprenant de 1 ou 2, à 18 atomes de
carbone, éventuellement substitué, notamment par un ou
plusieurs groupements amino, acide carboxylique, dérivé
d'acide carboxylique, alkoxy, aryle ou hydroxy ; un radical
aryle, éventuellement substitué, notamment par un ou plusieurs
groupements amino, acide carboxylique, dérivé d'acide
carboxylique, alkoxy, aryle ou hydroxy ; un radical arylalkyle
ou alkylaryle, éventuellement substitué, notamment par un ou
plusieurs groupements amino, acide carboxylique, dérivé
d'acide carboxylique, alkoxy, aryle ou hydroxy ; ou une
fonction nitro;
ou R3 et R4 et/ou R4 et R5 forment ensemble un cycle ou un
hétérocycle, éventuellement substitué,
- X représente un radical divalent, notamment choisi parmi les
alkyles, alcènes, ou alcynes, linéaires, ramifiés ou
cycliques, substitués ou non, éventuellement interrompu par un
hétéroatome,
- Y représente un atome d'hydrogène ou un groupement
protecteur, et
- Z représente un résidu acide aminé, notamment D ou L,
naturel ou synthétique, en particulier un résidu acide aminé
a, (3 ou y, la fonction amine terminale (i.e., non liée à X)
ainsi que les éventuelles fonctions chimiques latérales de Z
étant protégées ou non, où z est lié au radical X via une
liaison amide,
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 27 -
notamment, pour les composés décrits dans les parties (a),
(b) et (c) ci-dessus, et pour les composés de formule (I) ci-
dessus où A est -0-, -S-, -S0Z-, -C(=S)-, -CO- ou une fonction
chimique telle que Z' et X' sont liés par une liaison
bioisostère de la fonction amide, X et X' sont, indépendamment
l'un de l'autre, éventuellement substitués par une ou
plusieurs fonctions chimiques telles que une chaîne latérale
d'un acide aminé naturel ; C1_6alkyle; C2_6alcène; C2_6alcyne; C3_
ecycloalkyle; C1_6hétéroalkyle; C1_6haloalkyle; C6_loaryle; C3_
10hétéroaryle ; CS_20hétérocyclique; C1_6alky1C6_10aryle ; C1_
6alky1C3_10hétéroaryle ; C1_6alkoxy ; C6_loaryloxy ; C3_
lohétéroalkoxy ; C3_1ohétéroaryloxy ; C1_6hétéroalkylthio ; C6_
loarylthio ; C1_6hétéroalkylthio ; C3_1ohétéroarylthio ; F Cl ;
Br; I; -NOZ ; -CN ; -CF3 ; -CH2CF3 ; -CHC12 ; -CH2OH ; -CH2CHaOH ;
-CH2NH2 ;-CHZSO2CH3 ; ou une fonction -GRGl dans laquelle G est
-0-, -S-, -NRGZ-, -C(=O)-, -S(=O)-, -S0Z-, -C(=O)O-, -C(=O)NRG2-,
-OC ( =O ) - , -NRG2C ( =O ) - , -OC ( =O ) O- , -OC ( =0 ) NRG2-, -NRGZC ( =0
) O- , -
NRG2C(=0)NRG2-, -C(=S)-, -C(=S)S-, -SC(=S)-, -SC(=S)S-, -
C (=NRGZ -C ( =NRGa ) O-, -C ( =NRG2 ) NRG3-, -OC ( =NRGZ ) -, -NRG2C ( =NRG3
) -,
-NRG2 S02-1 -NRG2 SO2NRG3-, -NRGZC (=S ) -, -SC ( =S ) NRG2-, -NRGZC ( =S ) S-
, -
NRGZC (=S ) NRG2-, -SC ( =NRG2 ) -, -C ( =S ) NRG2-, -OC ( =S ) NRG2-, -
NRG2C(=S)O-, -SC(=O)NRGZ-, -NRG2C(=O)S-, -C(=0)S-, -SC(=0)-, -
SC(=O)S-, -C(=S)O-1 -OC(=S)-, -OC(=S)O- ou -SO2NRG2-, où chaque
occurrence de RGl, RG2 et RG3 est indépendamment des autres
occurrences de RG1 un atome d'hydrogène ; un atome
d'halogène ; ou une fonction alkyle, hétéroalkyle, alcène ou
alcyne, linéaire, ramifiée ou cyclique, éventuellement
substituée ; ou un groupe aryle, hétéroaryle, hétérocycle,
alkylaryle ou alkylhétéroaryle dans lequel le radical aryle,
hétéroaryle ou hétérocyclique est éventuellement substitué ;
ou bien, lorsque G représente -NRGZ-, RG1 et R G2 conjointement
avec l'atome d'azote auquel ils sont liés forment un
hétérocycle ou un hétéroaryle éventuellement substitué.
Selon un mode de réalisation particulier, les composés
répondent à l'une des formules suivantes :
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 28 -
O O
H H
~ \
.N~ ~N~ /
Z (CH2)n Z (CH2)n
O , O
O O
H ( \ H
~ \
.NI ~N' /
~ (CH2)n ~ (CH2)n
O OH , O OH ou
O OH
\
~NI I /
~ (CH2)n
O OH , dans laquelle n est un nombre entier
allant de 1 à 12, notamment de 2 à 8 ; et Z représente un
résidu acide aminé, notamment D ou L, naturel ou
synthétique, en particulier un résidu acide aminé a, (3 ou
y, la fonction amine terminale (i.e., non liée à -NH-)
ainsi que les éventuelles fonctions chimiques latérales de
Z étant protégées ou non, où Z est lié au radical -NH- via
une liaison amide.
Selon un mode de réalisation particulier, les composés
répondent à l'une des formules suivantes :
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 29 -
O O
R1 R1
Rx I \
Z / (CH2)q
N~ Z,
H (CH2)p
O ' H Rx O -
O O
R1 R1
Rx
Z\ (CH2)q
NI~ Z",1>1
H (CH2)p H R O OH
O OH ou x dans
la uelle Z est tel '
q que défini ci-dessus ; p et q sont
indépendamment l'un de l'autre des entiers allant de 0 à
12, notamment de 0 à 7 ; R1 est tel que défini auparavant ;
et RX est une chaîne latérale d'un acide aminé naturel ; C1_
6alkyle; C1_6hétéroalkyle; C1_6haloalkyle; C6_loaryle; C3_
1ohétéroaryle ; C1_6alkylC6_10aryle ; C1_6alkylC3_
lohétéroaryle ; C1_6alkoxy ; C6_loaryloxy ; C3_10hétéroalkoxy
C3_1ohétéroaryloxy ; C1_6hétéroalkylthio ; C6_10ar lthio ; C1_
6hétéroalkylthio ; C3_lohétéroarylthio ; F ; Cl ; Br; I; -
NO2 ; -CN ; -CF3 ; -CH2CF3 ; -CHC12 ; -CH2OH ; -CHaCHZOH ; -
CH2NH2 ;-CH2SO2CH3 ; - ou une fonction -GRGl dans laquelle G
est -0-, -S-, -NR12-, -C(=O)-, -S(=O)-, -SOz-, -C(=O)O-1
-
C(=O)NR G2_, -OC(=O)-, -NRGaC(=O)-, -OC(=O)O-, -OC(=O)NRG2-,
NRG2C(=O)O-, -NRGZC(=O)NRGa-, -C(=S)-, -C(=S)S-, -SC(=S)-, -
SC ( =S ) S-, -C ( =NRGZ ) -, -C ( =NRG2 ) O-, -C ( =NRGZ ) NRG3-, -OC ( =NRG2
)
-NRG2C ( =NRG3 ) -, -NRGZSOZ-, -NRG2 SO2NRG3-, -NRGaC (=S ) - -
'
SC ( =S ) NRG2-, -NRG2C (=S ) S-, -NRG2C (=S ) NRG2-, -SC ( =NRG2 -
)-~
C ( =S ) NRGa-, -OC ( =S ) NRG2-, -NRGZC (=S ) O-, -SC ( =O ) NRG2-, -
NRGZC(=O)S-, -C(=O)S-, -SC(=O)-, -SC(=O)S-, -C(=S)O-, -
OC (=S )-, -OC (=S ) O- ou -SOZNRGa-, où chaque occurrence de R",
R G2 et RG3 est indépendamment des autres occurrences de RGi
un atome d'hydrogène ; un atome d'halogène ; ou une
fonction alkyle, hétéroalkyle, alcène ou alcyne, linéaire,
ramifiée ou cyclique, éventuellement substituée ; ou un
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 30 -
groupe aryle, hétéroaryle, alkylaryle ou alkylhétéroaryle
dans lequel le radical aryle ou hétéroaryle est
éventuellement substitué.
Selon un mode de réalisation particulier, les composés
répondent à l'une des formules suivantes :
O OH O OH
RX
z\N~
Ri ;#~..
Z\N j H2)q H (CH2)p
O OH ou H RX O
dans laquelle Z est tel que défini ci-dessus ; p et q sont
indépendamment l'un de l'autre des entiers allant de 0 à
12, notamment de 0 à 7 ; sauf lorsque R1 est un atome
d'hydrogène, auquel cas p et q sont indépendamment l'un de
l'autre des entiers allant de 1 à 12, notamment de 1 à 7;
R1 est tel que défini auparavant ; et R. est une chaîne
latérale d'un acide aminé naturel ; C1_6alkyle; Cl_
6hétéroalkyle; C1_6haloalkyle; C6_loaryle; C3_1ohétéroaryle ;
C1_6a1ky1C6_1oaryle ; C1_6alky1C3_10hétéroaryle ; C1_6alkoxy ; C6_
ioaryloxy ; C3_10hétéroalkoxy ; C3_lohétéroaryloxy ; C1_
6hétéroalkylthio ; C6_loarylthio ; C1_6hétéroalkylthio ; C3_
lohétéroarylthio ; F ; Cl ; Br; I; -NO2 ; -CN ; -CF3 ; -
CH2CF3 ; -CHC12 ; -CHZOH ; -CH2CHZOH ; -CH2NH2 ; -CHZSO2CH3 ; -
ou une fonction -GR" dans laquelle G est -0-, -S-, -NRG2-,
-C(=O)-, -S(=O)-, -SOz-, -C(=O)O-, -C(=O)NR0Z-, -OC(=O)-, -
NRGZC ( =O ) -, -OC ( =O ) O-, -OC ( =O ) NRGZ-, -NRG2C ( =0 ) O-, -
NR02C(=O)NRG2-, -C(=S)-, -C(=S)S-, -SC(=S)-, -SC(=S)S-, -
C ( =NRG2 ) -, -C ( =NRG2) O-, -C ( =NRG2 ) NRG3-, -OC ( =NRG2 ) -, -
NRG2C ( =NRG3 ) -, -NRGZSO2-, -NRGaSO2NRG3-, -NRG2C (=S ) -, -
SC ( =S ) NRGa-, -NRGaC (=S ) S-, -NRGZC (=S ) NRG2-, -SC ( =NRG2) -, -
C ( =S ) NRG2-, -OC ( =S ) NRGZ-, -NRG2C (=S ) O-, -SC ( =O ) NRG2-, -
NRG2C(=O)S-, -C(=O)S-, -SC(=O)-, -SC(=O)S-, -C(=S)O-, -
OC (=S )-, -OC (=S ) O- ou -SO,NRGa-, où chaque occurrence de RGl,
R G2 et RG3 est indépendamment des autres occurrences de RG1
un atome d'hydrogène ; un atome d'halogène ; ou une
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 31 -
fonction alkyle, hétéroalkyle, alcène ou alcyne, linéaire,
ramifiée ou cyclique, éventuellement substituée ; ou un
groupe aryle, hétéroaryle, alkylaryle ou alkylhétéroaryle
dans lequel le radical aryle ou hétéroaryle est
éventuellement substitué.
Selon un mode de réalisation particulier, les composés
répondent à l'une des formules suivantes
O O
Rx
Z ( (CH2)q
~Ni~ Z~N/ Y
H (CH2)p H R
O , x
O O
Rx ~
~ / (CH2)q
Z
.N~ Z~N/
H ( H2)P H R O OH
0 OH ou x , dans
laquelle Z est tel que défini ci-dessus ; p et q sont
indépendamment l'un de l'autre des entiers allant de 0 à
12, notamment de 0 à 7 et RX est une chaîne latérale d'un
acide aminé naturel ; C1_6alkyle; C1_6hétéroalkyle; C1_
6haloalkyle; C6_loaryle; C3_lohétéroaryle ; C1_6alkylC6_1oaryle ;
C1_6alkylC3_10hétéroaryle ; C1_6alkoxy ; C6_loaryloxy ; C3_
lohétéroalkoxy ; C3_lohétéroaryloxy ; C1_6hétéroalkylthio ; C6_
loarylthio ; C1_6hétéroalkylthio ; C3_1ohétéroarylthio ; F
Cl ; Br; I; -NO2 ; -CN ; -CF3 ; -CH2CF3 ; -CHC12 ; -CHaOH ; -
CHZCH2OH ;-CH2NHZ ;-CH2SO2CH3 ;- ou une fonction -GRGl dans
laquelle G est -0-, -S-, -NRGa-, -C ( =0 ) -, -S ( =O ) -, -S0Z-, -
C(=0)0-, -C(=O)NRGa-, -OC(=O)-, -NRG2C(=O)-, -OC(=O)0-, -
OC ( =O ) NR12 -, -NRGZC ( =O ) O- , -NRG2C ( =O ) NRG2-, -C ( =S ) -, -C ( =S
) S-,
-SC(=S)-, -SC(=S)S-, -C(=NRGZ)-, -C(=NRG2)O-, -C(=NRGZ)NRG3-,
-OC ( =NRGZ ) -, -NRGZC ( =NRG3 ) -, -NRGZSOZ-, -NRGaSOZNRG3-, -
NRGaC (=S ) -, -SC ( =S ) NRGZ-, -NRG2C ( =S ) S-, -NRGZC ( =S ) NRc2_ ~ _
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 32 -
SC ( =NRGZ ) -, -C ( =S ) NRGZ-, -OC ( =S ) NRGZ-, -NRGZC ( =S ) O-, -
SC(=O)NRGZ-, -NRGZC(=O)S-, -C(=O)S-, -SC(=O)-, -SC(=O)S-, -
C(=S)O-, -OC(=S)-, -OC(=S)O- ou -SO2NRG2-, où chaque
occurrence de RGl, RG2 et RG3 est indépendamment des autres
occurrences de RG1 un atome d'hydrogène ; un atome
d'halogène ; ou une fonction alkyle, hétéroalkyle, alcène
ou alcyne, linéaire, ramifiée ou cyclique, éventuellement
substituée ; ou un groupe aryle, hétéroaryle, alkylaryle ou
alkylhétéroaryle dans lequel le radical aryle ou
hétéroaryle est éventuellement substitué.
Selon un mode de réalisation particulier, les composés
répondent à l'une des formules suivantes
O OH O OH
Rx I \ I \
z\N 1 / z\ (CH2)q
H (CH2)p H OH
O OH ou Rx
dans laquelle Z est tel que défini ci-dessus ; p et q sont
indépendamment l'un de l'autre des entiers allant de 1 à
12, notamment de 1 à 7 ; et R. une chaîne latérale d'un
acide aminé naturel ; est C1_6alkyle; C1_6hétéroalkyle; C1_
6haloalkyle; C6_10aryle; C3_10hétéroaryle ; C1_6alkylC6_loaryle ;
C1_6alkylC3_10hétéroaryle ; Cl_6alkoxy ; C6_1oaryloxy ; C3_
lohétéroalkoxy ; C3_lohétéroaryloxy ; C1_6hétéroalkylthio ; C6_
loarylthio ; C1_6hétéroalkylthio ; C3_1ohétéroarylthio ; F
Cl ; Br; I; -NO2 ; -CN ; -CF3 ; -CHZCF3 ; -CHC12 ; -CHaOH ; -
CHZCHaOH ; -CH2NH2 ; -CH2SO2CH3 ; - ou une fonction -GRGl dans
laquelle G est -0-, -S-, -NRG2-, -C(=O)-1 -S(=0)-, -SOz-, -
C(=O)O-, -C(=O)NRGZ-, -OC(=O)-, -NRGZC(=O)-, -OC(=0)O-, -
OC ( =O ) NRGZ-, -NRGZC ( =0 ) O-, -NRGZC ( =0 ) NRGZ-, -C ( =S ) -, -C ( =S )
S-,
-SC(=S)-, -SC(=S)S-, -C(=NRGZ)-, -C(=NRGZ)O-, -C(=NRGZ)NRG3-,
-OC ( =NRGZ ) -NRGZC ( =NRG3 ) -, -NRGZSOz-, -NRGZSOzNRG3-, -
NRGZC ( =S ) -, -SC ( =S ) NRGZ-, -NRGZC ( =S ) S-, -NRGZC (=S ) NRGZ-, -
SC ( =NRGZ ) -, -C ( =S ) NRGZ-, -OC ( =S ) NRGZ-, -NRGZC ( =S ) O-, -
SC(=O)NRGZ-, -NRGZC(=0)S-, -C(=0)S-, -SC(=O)-, -SC(=O)S-, -
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 33 -
C(=S)O-1 -OC(=S)-, -OC(=S)O- ou -SOaNRIZ-, où chaque
occurrence de RGl, RG2 et RG3 est indépendamment des autres
occurrences de RG1 un atome d'hydrogène ; un atome
d'halogène ; ou une fonction alkyle, hétéroalkyle, alcène
ou alcyne, linéaire, ramifiée ou cyclique, éventuellement
substituée ; ou un groupe aryle, hétéroaryle, alkylaryle ou
alkylhétéroaryle dans lequel le radical aryle ou
hétéroaryle est éventuellement substitué.
Selon un mode de réalisation particulier, les composés
répondent à l'une des formules suivantes
O O
Rx \
Z I / (CH2)q
"
H (CH2)p O H RX O
-
O O
R \
Z X I / (CH2)a
" z~
H (CH2)p N
O OH H RX O OH
,
O OH O OH
R \
X I / ~ (CHZ)q
Z
~N~ H .N
H (C 2)p
O OH ou H RX O OH ~ dans
laquelle Z est tel que défini ci-dessus ; p et q sont
indépendamment l'un de l'autre des entiers allant de 0 à
12, notamment de 0 à 7 et RX est une chaîne latérale d'un
acide aminé naturel ; C1_6alkyle; C1_6hétéroalkyle; C1_
6haloalkyle; C6_10aryle; C3_10hétéroaryle ; C1_6alkylC6_1oaryle ;
C1_6alkylC3_1ohétéroaryle ; C1_6alkoxy ; C6_loaryloxy ; C3_
lohétéroalkoxy ; C3_1ohétéroaryloxy ; C1_6hétéroalkylthio ; C6_
1oarylthio ; C1_6hétéroalkylthio ; C3_1ohétéroarylthio ; F ;
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 34 -
Cl ; Br; I; -NOa ; -CN ; -CF3 ; -CH2CF3 ; -CHC12 ; -CHaOH ; -
CH2CH2OH ; -CH2NH2 ; -CH2SOZCH3 ; - ou une fonction -GRGl dans
laquelle G est -0-, -S-, -NRGa-, -C ( =0 ) -, -S ( =O ) -, -S0Z-, -
C(=O)O-, -C(=O)NRG2-, -OC(=O)-, -NRG2C(=0)-, -OC(=O)O-, -
OC ( =O ) NRGa-, -NRGZC ( =O ) O-, -NRGZC ( =O ) NRGa-, -C ( =S ) -, -C ( =S )
S-,
-SC(=S)-, -SC(=S)S-, -C(=NRGa)-, -C(=NRGZ)O-, -C(=NRG2)NRG3-,
-OC ( =NRGa ) -, -NRG2C ( =NRG3 ) -, -NRG2SOZ-, -NRG2SOZNRG3-, -
NRGZC (=S ) -, -SC ( =S ) NRG2-, -NRGaC (=S ) S-, -NRG2C ( =S ) NRG2-, -
SC ( =NR0Z ) -, -C ( =S ) NRGZ-, -OC ( =S ) NRGZ-, -NRG2C ( =S ) O-, -
SC(=O)NRG2-, -NRGZC(=O)S-, -C(=O)S-, -SC(=O)-, -SC(=O)S-, -
C(=S)O-, -OC(=S)-, -OC(=S)0- ou -SOZNRGZ-, où chaque
occurrence de RGl, R G2 et RG3 est indépendamment des autres
occurrences de RG1 un atome d'hydrogène ; un atome
d'halogène ; ou une fonction alkyle, hétéroalkyle, alcène
ou alcyne, linéaire, ramifiée ou cyclique, éventuellement
substituée ; ou un groupe aryle, hétéroaryle, alkylaryle ou
alkylhétéroaryle dans lequel le radical aryle ou
hétéroaryle est éventuellement substitué.
Selon un mode de réalisation particulier, les composés
répondent à l'une des formules suivantes :
Zi",N (CH2)ni O Zl,."N (CH2)m O
H H I \
N ~ N ~
Z~ (CH2)n O Z (CH2)n O OH
ou
O OH
Zi~N (CH2)n1
H
H
Z~N~
(CH2)n O OH
, dans laquelle n et nl sont
indépendamment l'un de l'autre des entiers allant de 1 à
12, notamment de 1 à 5 ; et Z et Z' sont indépendamment
l'un de l'autre un résidu acide aminé, notamment D ou L,
naturel ou synthétique, en particulier un résidu acide
aminé a, (3 ou y, la fonction amine terminale (i.e., non
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 35 -
liée à-NH-) ainsi que les éventuelles fonctions chimiques
latérales de Z/Z' étant protégées ou non, où Z et Z' sont
liés au radical -NH- via une liaison amide.
Plus particulièrement, les composés selon l'invention
peuvent répondre à la formule (II) suivante ou à un de ses
sels pharmaceutiquement acceptables :
O
Y R1
Z'N~1 X /
O R5
Formule (II)
dans laquelle
- R1 représente un atome d'hydrogène, un radical alkyle
comprenant de 1 à 6 atomes de carbone, ou un groupement -
(CH2)nl-NY'-Z', où
- nl représente un nombre entier allant de 1 à 12,
notamment de 1 à 6, plus particulièrement de 1 à 5, et en
particulier de 1 à 2, et
- Y et Y' représentent indépendamment l'un de l'autre
un atome d'hydrogène ou un groupement protecteur, et
Z et Z' représentent indépendamment l'un de l'autre un
résidu acide aminé, notamment D ou L, naturel ou
synthétique, en particulier un résidu acide aminé a, (3 ou
y, la fonction amine terminale (i.e., non liée à -NY- ou -
NY'-) ainsi que les éventuelles fonctions chimiques
latérales de Z et Z' étant protégées ou non, où Z et Z'
sont liés au radical -NY- ou -NY'-, respectivement, via
une liaison amide;
- X représente un groupement -(CHZ)n-, n représente un
nombre entier allant de 1 à 12, notamment de 1 à 6, plus
particulièrement de 1 à 5, et en particulier de 1 à 2, et
- R5 représente un atome d'hydrogène, un atome
d'halogène, ou une fonction hydroxyle éventuellement
substituée.
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 36 -
Selon un premier mode de réalisation, le composé selon
l'invention répond à la formule (II) dans laquelle Rl
représente un radical alkyle comprenant de 1 à 6 atomes de
carbone, notamment de 1 à 4 atomes de carbone, en
particulier de 1 à 2 atomes de carbone, voire est le
radical méthyle.
Selon une première variante, ces composés appartiennent
à la famille des Plumbagones, ils répondent alors à la
formule (II) dans laquelle R1 représente un radical
méthyle, et R5 représente une fonction hydroxyle.
Selon une deuxième variante, ces composés appartiennent
à la famille des Ménadiones, ils répondent alors à la
formule (II) dans laquelle Ri représente un radical
méthyle, et R5 représente un atome d'hydrogène.
Selon un deuxième mode de réalisation, le composé selon
l'invention répond à la formule (II) dans laquelle Rl
représente un atome d'hydrogène.
Tout particulièrement ces composés appartiennent à la
famille des Juglones à simple substitution, lorsqu'ils
répondent à la formule (II) dans laquelle R1 représente un
atome d'hydrogène et R5 représente une fonction hydroxyle.
Selon un troisième mode de réalisation, le composé
selon l'invention répond à la formule (II) dans laquelle R1
représente un groupement -(CH2)nl-NY'-COCHRNH2, où
-COCHRNHa représente un résidu d'acide aminé naturel ou
synthétique, D ou L, dans lequel R désigne la chaîne
latérale dudit résidu acide aminé,
-nl représente un nombre entier allant de 1 à 5, et en
particulier de 1 à 2, et
-Y' représente un atome d'hydrogène ou un groupement
protecteur, notamment choisi parmi ceux décrits dans
l'ouvrage Protective Groups in Organic Synthesis de T.
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 37 -
W. Greene, P. G. M. Wuts, Wiley-Interscience, New York, 4th
edition, 2007.
Tout particulièrement, ces composés appartiennent à la
famille des Juglones à double substitution lorsqu'ils
répondent à la formule (II) dans laquelle Ri représente un
groupement -(CHZ)nl-NY'-COCHRNHa et R5 représente une
fonction hydroxyle.
Les composés de formule (I) ou (II) peuvent le cas
échéant être sous forme solvatée, de sel, ou d'autres
dérivées physiologiquement acceptables. Les sels et les
solvants qui sont acceptables pour une utilisation
pharmaceutique sont généralement ceux dans lesquels le
contre ion ou le solvant associé est pharmaceutiquement
acceptable.
Les sels utilisables peuvent être des acides ou des
bases organiques ou minérales. Parmi les sels d'addition
acides acceptables, on peut citer ceux formés à partir
d'acide chlorhydrique, bromhydrique, sulfurique, citrique,
tartrique, phosphorique, lactique, pyruvique, acétique,
trifluoroacétique, phénylacétique, triphénylacétique.
On peut également citer parmi les sels basiques
acceptables, les sels de métaux alcalins, tels que le
sodium ou le potassium, les sels de métaux alcalino-
terreux, tels que le calcium et le magnésium, et les sels
formés à partir de bases organiques, tels que les amines
mono-, di- ou tri-substituées.
Selon un autre de ses aspects, l'invention a pour objet
une composition pharmaceutique comprenant à titre d'agent
actif au moins un composé tel que défini ci-dessus dans un
support pharmaceutiquement acceptable.
En particulier, la composition peut être anticancéreuse
et/ou pro-apoptotique et/ou antiproliférative.
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 38 -
Dans la composition pharmaceutique, les composés sont
employés en quantité efficace. Celle-ci sera déterminée par
l'homme du métier, selon différents paramètres, en
particulier par rapport à la substance utilisée, l'âge, le
poids, et l'état physique du patient, le mode
d'administration, et le régime requis. L'Homme du Métier
sera à même de déterminer le mode d'administration et le
dosage pour chaque patient.
Tout particulièrement, le composé selon l'invention
peut être administré à une dose allant de 0,1 à 5 000 mg
par jour et par patient.
La composition pharmaceutique peut comprendre une
quantité en composé selon l'invention allant de 0,1 mg à 5
g=
La composition pharmaceutique peut être administrée
sous toute forme, topique ou systémique, notamment sous
forme parentérale ou entérale.
Lorsque la composition ou le médicament sont
administrés par voie entérale, elle peut se présenter sous
forme de comprimés, de gélules, de dragées, de sirops, de
suspensions, de solutions, de poudres, de granulés,
d'émulsions, de microsphères.
Dans le cas d'une administration par voie parentérale,
la composition peut se présenter sous forme de solutions ou
de suspensions pour perfusion ou pour injection.
La composition peut comprendre en outre au moins un
additif, choisi notamment parmi les agents de couleur, de
saveur, et les conservateurs. Bien entendu, l'homme du
métier veillera à choisir le ou les additif(s) de manière à
ce que les propriétés avantageuses attachées
intrinsèquement à l'invention ne soient pas, ou
substantiellement pas, altérées par l'addition envisagée.
Selon un mode de réalisation particulier La composition
selon l'invention peut comprendre en outre un autre composé
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 39 -
destiné à traiter le cancer. Parmi les composés utilisables
selon l'invention, on peut citer la doxorubicine, dont la
dénomination commerciale est l'adriamycine , l'épothilone,
le paclitaxel, dont la dénomination commerciale est le
taxol et le cis-platine.
Selon encore un autre de ses aspects, l'invention à
pour objet l'utilisation d'au moins un composé tel que
défini ci-dessus pour la préparation d'une composition
pharmaceutique destinée à traiter et/ou à prévenir une
prolifération anormale des cellules.
Ladite composition peut être destinée à la médecine
humaine et/ou vétérinaire, et en particulier elle peut être
destinée à traiter ou à prévenir au moins un cancer choisi
parmi le cancer du pancréas, les cancers de l'oro-pharynx,
le cancer de l'estomac, le cancer de l'oesophage, le cancer
du colon et rectal, le cancer du cerveau, notamment les
gliomes, le cancer des ovaires, le cancer du foie, le
cancer du rein, le cancer du larynx, le cancer de la
thyroïde, le cancer du poumon, le cancer des os, les
myélomes multiples, les mésothéliomes et les mélanomes, le
cancer de la peau, le cancer du sein, le cancer de la
prostate, le cancer de la vessie, le cancer de l'utérus, le
cancer des testicules, les lymphomes non-Hodgkinien, la
leucémie, la maladie de Hodgkin, et des cancers des tissus
mous, ainsi que des localisations secondaires métastatiques
des cancers cités précédemment.
Par prolifération anormale , on entend une
prolifération qui est indépendante des mécanismes de
régulations normaux, par exemple l'arrêt de prolifération
cellulaire dû à la mise en jeu de l'apoptose (mort
cellulaire programmée).
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 40 -
Selon un autre de ses aspects, l'invention à également
pour objet une composition pro-apoptotique et/ou anti-
proliférative comprenant au moins un composé tel que défini
ci-dessus.
Selon encore un autre de ses aspects, l'invention a
pour objet l'utilisation d'au moins un composé tel que
défini ci-dessus en tant qu'agent pro-apoptotique et/ou
antiprolifératif.
Les exemples 'suivants sont donnés à titre indicatif et
sans aucun caractère limitatif de l'invention.
Des avantages autres que ceux décrits dans la présente
demande pourront encore apparaître à l'homme du métier à la
lecture des exemples ci-dessous donnés à titre illustratif.
EXEMPLES
Dans les exemples, les abréviations suivantes sont
utilisées.
AcOEt = acétate d'éthyle
AgNO3 = nitrate d'argent
BocZO = carbonate de di-tert-(butyloxy) carbonyle
CHzCl2 = dichlorométhane
CH3CN = acétonitrile
DCHA = dicyclohexylamine
DIEA = diisopropyléthylamine
H20 = eau
HBTU = hexafluorophosphate de O-benzotriazolyl-
N,N,N,N'-tétraméthyluronium
HOBt = N-hydroxybenzotriazole
MgSO4 = sulfate de magnésium
mL = millilitre
mmol = millimoles
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 41 -
NaCl = chlorure de sodium
NaOH = hydroxyde de sodium
( NH4 ) 2S208 = persulfate d'ammonium
TFA = acide trifluoroacétique
Les acides aminés protégés proviennent de chez
Novabiochem, notamment Boc-L-Ala-OH, Boc-L-Ser(OtBu)-OH,
Boc-L-Thr(OtBu)-OH, Boc-D-Val-OH, Boc-D-Trp-OH, Boc-L-
Thr(OBn)-OH et Boc-D-Tyr(OBn)-OH.
Tous les autres composés chimiques utilisés proviennent
de chez Aldrich, Fluka ou Acros et sont de qualité
standard.
Les solvants sont distillés avant utilisation.
Exemple 1 : Synthèse de l'acide N-tert-butyloxycarbonyle-2-
aminoacétique (Boc-N-glycine)
Dans un ballon de 500 mL, on introduit
O~N~COOH 4,002 g de glycine (1 éq. ; 53 mmol ), on
~ O verse 150 mL d'un mélange dioxane : eau
(rapport 2 :1), soit 100 mL de dioxane et 50 mL d'eau puis
on ajoute une solution aqueuse préparée à partir de 2g de
NaOH pour 50 mL d'eau. On refroidit à l'aide d'un bain de
glace et on ajoute 12,72g de carbonate di-tert-butyloxy
carbonyle (1,1 éq. ; 58 mmol). Le milieu réactionnel est
agité toute la nuit à température ambiante. On évapore le
dioxane et l'eau, puis on ajoute 40 mL d'acétate d'éthyle,
et on fait un lavage à l'aide d'acide citrique 5% puis de
chlorure de sodium saturé, et on réalise une extraction des
phases aqueuse au dichlorométhane. On rassemble les phases
organiques, qui sont séchées sur MgSO4 et on évapore. On
obtient 7,705g d'un solide blanc (Rdt = 83%). Le produit
obtenu ne nécessite pas de purification supplémentaire
avant son utilisation.
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 42 -
Exemple 2 : Synthèse de l'acide N-tert-butyloxycarbonyle-4-
aminobutanoïque
H Dans un ballon de 250 mL, contenant
O N ~~COOH
~ O 3,004 g d'acide 4-aminobutanoïque (1
éq. ; 29 mmol), on ajoute 75 mL d'un
mélange dioxane : eau (rapport 2 :1) soit 50 mL de dioxane
et 25 mL d'eau. On additionne une solution diluée d'une
solution de NaOH (1 g de NaOH pour 25 mL d' eau ). On place
le ballon, dans un bain de glace et on additionne 6,984 g
de BocZO (carbonate di-tert-butyloxy carbonyle 1,1 eq. ; 32
mmol), puis on laisse le mélange sous agitation toute la
nuit à température ambiante. Une fois la réaction terminée,
on évapore le dioxane et l'eau, et on reprend le milieu
réactionnel avec 30 mL d'AcOEt, on lave avec de l'acide
citrique aqueux 5% (2 fois 10 mL), puis avec du NaCl
saturée. Les phases organiques sont réextraites au CH2Clz ,
assemblées puis séchées sur MgSO4 et évaporées. On obtient
5,182 g d'une huile visqueuse incolore (Rdt = 88%). Le
produit obtenu ne nécessite pas de purification
supplémentaire avant son utilisation.
Exemple 3 Synthèse du 2-méthyl-3-(N'-tert-
butyloxycarbonyl-aminométhyl)-1,4-naphtoquinone
o Dans un ballon de 25 mL,
contenant 1,200 g de
ménadione commerciale
I I N O
(Aldrich Co. 1 éq. 6,9
mmol), on introduit 3,660 g
0 0
du composé de l'exemple 1 (3
éq. ; 20 mmol), et 0,355 g de nitrate d'argent (0,3 éq. ;
2,07 mmol) on ajoute un mélange acétonitrile/eau (rapport
7 : 3), soit 12 mL de CH3CN et 6 mL d' H20, la température
du mélange est portée à 65 C. Dans une ampoule à addition,
on prépare 0,822 g de peroxodisulfate d'ammonium (1,3 éq. ;
3,6 mmol) dissout dans 7 mL d'un mélange CH3CN : HZO
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 43 -
(rapport 7 3). L'addition est réalisée pendant deux
heures, le mélange est maintenu sous agitation une heure de
plus à 65 C. On extrait ensuite trois fois au CH2C121 on
lave les phases organiques une fois à l'eau puis elles sont
séchées sur MgSO4 et évaporées. Le produit est ensuite
purifié grâce à une chromatographie sur colonne avec comme
éluant 10% AcOEt : 90% Cyclohexane. On obtient 0,961 g d'un
solide orange (38%). On peut consulter pour plus de
précisions l'article de Anderson J.M. and Kochi J.K. dans
J. Am. Chem. Soc. 1970, 92(6), 1651-1659.
Exemple 4 . Synthèse du 2-méthyl-3-(N'-tert-
butyloxycarbonyl-2-aminoéthyl)-1,4-naphtoquinone
Dans un ballon de 50 mL, on
0
pèse 0,500 g de ménadione
I \ ( (léq. ; 2,9 mmol), 1,648 g (3
éq. ; 8,71 mmol) de Boc/3Ala
H (Aldrich Co.), et 0,147 g de
AgNO3 (0,3 éq. ; 0,447 mmol).
On additionne le mélange acétonitrile : eau (rapport 7 :3),
soit 5,0 mL de CH3CN et 2,5 mL d' H2O et la température du
mélange est portée à 65 C. L'addition de 0,861 g de
(NH4 ) S208 (1,3 éq. ; 1,93 mmol) dissout dans 3 mL d'un
mélange CH3CN : H20, se fait pendant 2 heures. Le milieu
réactionnel est alors maintenu sous agitation pendant une
heure à 65 C puis on extrait au CHZC1Z trois fois et on lave
une seule fois avec H2O les phases éthérées. On sèche les
phases organiques sur MgSO4 et on évapore. Le produit est
purifié par chromatographie sur colonne avec comme éluant
10% AcOEt : 90% Cyclohexane: et on obtient 0,420 g d'une
huile orange (Rdt= 46% ).
Exemple 5. Synthèse du trifluoroacétate de 2-méthyl-3-
(méthyl ammonium)-1,4-naphtoquinone
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 44 -
o Dans un ballon 25 mL ; plongé dans un
bain de glace 1,277 g(1 éq. ; 4,23
CCFCO()- mmol) du composé de l'exemple 3 est
NH3 dissout dans un mélange acide
trifluoroacétique : dichlorométhane
(rapport 1 : 1) soit 8,5 mL de chaque
solvant. Le milieu réactionnel est agité pendant six heures
sous azote et à température ambiante. On évapore ensuite le
TFA et le CH2ClZ et on reprend dans du toluène pour enlever
l'excès de TFA. Le ballon est placé sous vide pendant deux
jours, et on obtient 1,300g d'un solide brun (Rdt = 97%).
Exemple 6. Synthèse du trifluoroacétate de 2-méthyl-3-
(éthyl ammonium)-1,4-naphtoquinone
o Selon le protocole opératoire
précédemment décrit pour le composé
cF3coo- de l'exemple 5 dans un ballon de 25
mL on introduit 0,881 g du composé
N H3
de l'exemple 4 soit (1 éq. ; 2,79
0
mmol), et on additionne 5,5 mL de
CH2C12 et 5,5 mL de TFA (dans un bain de glace). Lors de
l'évaporation on reprend plusieurs fois le milieu dans du
toluène, on récupère 0,916g d'un solide brun ( Rdt = 99 %
Exemple 7 . Synthèse du 2-méthyl-3-(N'-tert-
butyloxycarbonyl-L-alaninyl-aminométhyl)-1,4-naphtoquinone
o Dans un ballon de 10 mL,
on pèse 0,037 g de
H BocAlaOH (1,2 éq.
N N 0,388mmo1), 0,183 g de
HBTU soit (1,5 éq. ;
0 0
0,484 mmol), et 0,052 g
de HOBt (1,2 éq. ; 0,388
mmol). On ajoute 3 mL de CH2C12 distillé, ainsi que 0,339
mL de DIEA (5éq. ; 1,94 mmol). On agite le mélange
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 45 -
réactionnel sous azote pendant deux heures pour activer
l'acide. On ajoute ensuite 0,102 g (léq. ; 0,323 mmol) du
composé de l'exemple 5, puis on laisse sous agitation
pendant deux heures. On évapore le CHaCla, on reprend le
milieu dans 30 mL d'AcOEt et on effectue trois lavages à
l'eau. On sèche la phase organique sur MgSO4 et on évapore.
Le produit est ensuite purifié sur colonne de
chromatographie avec comme éluant 40% AcOEt : 60% Cyclo et
on obtient 0,030 g d'un solide jaune (Rdt = 25%).
Exemple 8 . Synthèse du 2-méthyl-3-(N'-tert-
butyloxycarbonyl-L-sérinyl(OtBu)-aminométhyl)-1,4-
naphtoquinone
Dans un premier temps
o avant de faire le
o couplage, on doit
~ I o
H déprotéger la fonction
" N o acide carboxylique de la
sérine commerciale. Pour
H 0 0
cela dans une petite
ampoule à décanter on introduit 0,170 g de
BocSer(tBu)OH.DCHA soit (0,38 mmol), auquel on ajoute 3 mL
d'AcOEt , 3 mL d'eau et 0,4 mL de H2SO4 (2M). On extrait la
phase aqueuse avec AcOEt une fois et on lave 3 fois la
25 phase organique à l'eau. On évapore et on obtient 0,077 g
d'une huile incolore qui est le résidu sérine sous forme
acide carboxylique. Cette huile (1,2 éq. ; 0,294 mmol) est
additionné comme décrit précédemment pour le composé de
l'exemple 7 avec 0,139 g de HBTU (1,5 éq. ; 0,368 mmol),
30 0,039 g de HOBt (1,2 éq. ; 0,294 mmol), 3 mL de CH2C12 et
0,213 mL de DIEA. Après deux heures d'activation, on ajoute
ensuite 0,102 g du composé (5) soit (léq. ; 0,323 mmol)
puis on laisse sous agitation pendant deux heures. Après
lavage avec de l'eau, le produit est purifié sur colonne de
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 46 -
chromatographie avec 30% AcOEt ; 70% Cyclo et on obtient
0,080 g d'une huile orange (Rdt = 62%).
Exemple 9 . Synthèse du 2-méthyl-3-(N'-tert-
butyloxycarbonyl-D-valinyl-aminométhyl)-1,4-naphtoquinone
Selon la procédure de
couplage décrite pour le
0 0
composé de l'exemple 7 on
HN o utilise 0,084 g de
N BocDValOH (1,2 éq. ; 0,376
T mmol), 0,183 g de HBTU (1,5
0 o éq. ; 0,484 mmol), 0,052 g
de HOBt (1,2 éq. ; 0,376 mmol), 3 mL de CHaCl2, et 0,339 mL
de DIEA. On laisse l'activation agir pendant deux heures
sous azote. On ajoute ensuite 0,100 g du composé de
l'exemple 5 et aprés lavage et purification du produit à
40% AcOEt; 60% Cyclo on obtient 0,080 g d'une huile orange
(Rdt = 62%).
Exemple 10 . Synthèse du 2-méthyl-3-(N'-tert-
butyloxycarbonyl-L-thréoninyl(OtBu)-aminométhyl)-1,4-
naphtoquinone
Selon la procédure de couplage
0
décrite pour le composé de
I ~ ( HN O
l'exemple 7 on utilise 0,106 g
de BocThr(tBu)OH (1,2 éq. ;
0,384 mmol), 0,183 g de HBTU
(1,5 éq. ; 0,482 mmol), 0,052 g de HOBt (1,2 éq. ; 0,388
mmol), 3 mL de CHaCl2, et 0,338 mL de DIEA. On agite deux
heures soûs azote puis on additionne 0,100 g du composé de
l'exemple 5 et après lavage et purification réalisée à 40%
AcOEt ; 60% Cyclo, on obtient 0,127 g d'une huile orange
(Rdt = 86%).
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 47 -
Exemple 11 . Synthèse du 2-méthyl-3-(N'-tert-
butyloxycarbonyl-glycinyl-aminométhyl)-1,4-naphtoquinone
O
I~ I O Selon la procédure de
N / ~ J~\ couplage décrite pour le
~H O composé de l'exemple 7 on
O O
utilise 0,066g de BocGlyOH
(1,2 éq. ; 0,308 mmol), 0,183 g de HBTU (1,5 éq. ; 0,485
mmol), 0,052 g de HOBt (1,2 éq. ; 0,388 mmol), 3 mL de
CHZCla1 et 0,338 mL de DIEA. On agite deux heures sous
azote puis on introduit 0,100 g du composé de l'exemple 5
et après purification à 50% AcOEt ; 50% Cyclo, on obtient
0,080g d'une huile orange (Rdt = 71%).
Exemple 12 . Synthèse du 2-méthyl-3-(N'-tert-
butyloxycarbonyl-L-alaninyl-aminoéthyl)-1,4-naphtoquinone
o Selon la procédure de couplage
NY 0 décrite pour le composé de
l'exemple 7, dans un ballon de 10
o mL, on pèse 0,035 g de BocAlaOH
(1,2 éq. ; 0,18 mmol), 0,090 g de HBTU soit (1,5 éq. ; 0,22
mmol), et 0,025 g de HOBt (1,2 éq. ; 0,18 mmol). On ajoute
3 mL de CHzCla distillé, ainsi que 0,135 mL de DIEA (5éq. ;
0,76 mmol). On agite le mélange réactionnel sous azote
pendant deux heures pour activer l'acide. On ajoute ensuite
0, 50 g (léq. ; 0,15 mmol ) du composé de l'exemple 6 puis
on laisse sous agitation pendant deux heures. On évapore
CH2ClZ et on reprend le milieu dans 30 mL d'AcOEt, et on
effectue trois lavages à l'eau. On sèche la phase organique
sur MgSO4 et on évapore. Le produit est ensuite purifié sur
colonne de chromatographie avec comme éluant 50% AcOEt
50% Cyclo et on obtient 0,030 g d'une huile jaune (Rdt =
52%).
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 48 -
Exemple 13 . Synthèse du 2-méthyl-3-(N'-tert-
butyloxycarbon l-L-sérinyl(OtBu)-aminoéthyl)-1,4-
naphtoquinone
Comme pour le composé de
l'exemple 8, le sel de DCHA
O O
H permettant la cristallisation du
NyO résidu sérine doit être
0 O hydrolysé: pour cela dans une
I/ I
H petite ampoule à décanter on
O
introduit 0,075 g de BocSer(tBu)OH.DCHA soit (0,17 mmol),
auquel on ajoute 2 mL d'AcOEt , 2 mL d'eau et 0,2 mL de
H2SO4 (2M). On extrait la phase aqueuse avec AcOEt une fois
et on lave 3 fois la phase organique à l'eau. On évapore et
on obtient 0,045 g d'une huile incolore qui est le résidu
sérine sous forme acide carboxylique. Cette huile (1,2 éq.
; 0,17 mmol) est additionné comme décrit précédemment pour
le composé de l'exemple 7 avec 0,087 g de HBTU (1,5 éq. ;
0,23 mmol), 0,020 g de HOBt (1,2 éq. ; 0,15 mmol), 3 mL de
CH2C12et 0,135 mL de DIEA. Après deux heures d'activation,
on ajoute ensuite 0,050 g du composé de l'exemple 6 soit
(léq.; 0,15 mmol) puis on laisse sous agitation pendant
deux heures. Après lavage avec de l'eau, le produit est
purifié sur colonne de chromatographie avec 30% ACOEt ; 70%
Cyclo et on obtient 0,040 g d'un solide orange (Rdt = 58%).
Exemple 14 . Synthèse du 2-méthyl-3-(N'-tert-
butyloxycarbonyl-D-valinyl-aminoéthyl)-1,4-naphtoquinone
Selon la procédure de couplage
décrite pour le composé de
O Oy 0 l'exemple 7 on utilise 0,037 g de
HN Boc-D-ValOH (1,2 éq. ; 0,17 mmol),
I\ I 0,087 g de HBTU (1,5 éq. ; 0,23
H 0 mmol), 0,020 g de HOBt (1,2 éq. ;
ND O 0,15 mmol) , 3 mL de CH2C12, et 0,135
mL de DIEA. On laisse l'activation agir pendant deux heures
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 49 -
sous azote. On ajoute ensuite 0,050 g du composé de
l'exemple 6, et aprés lavage et purification du produit sur
colonne de chromatographie avec 25% AcOEt; 75% Cyclo on
obtient 0,034 g d'un solide jaune (Rdt = 55%).
Exemple 15 . Synthèse du 2-méthyl-3-(N'-tert-
butyloxycarbonyl-L-thréoninyl(OtSu)-méthyl)-1,4-
naphtoquinone
Selon la procédure de couplage
décrite pour le composé de
OO
O y l'exemple 7 on utilise 0,042 g
HN Ok de BocThr(tBu)OH (1,2 éq. ;
0,17 mmol), 0,087 g de HBTU
H O (1,5 éq. ; 0,23 mmol), 0,020 g
O
de HOBt (1,2 éq. ; 0,15 mmol),
3 mL de CHZCl21 et 0, 135 mL de DIEA. On agite deux heures
sous azote puis on additionne 0,050 g du produit de
l'exemple 6, et après lavage et purification réalisée à 20%
AcOEt ; 80% Cyclo, on obtient 0,043 g d'une huile jaune
20 (Rdt = 61%).
Exemple 16 . Synthèse du 2-méthyl-3-(N'-tert-
butyloxycarbonyl-glycinyl-aminoéthyl)-1,4-naphtoquinone
O H Selon la procédure de couplage
I~ I Ny O décrite pour le composé de
N O O l'exemple 7 on utilise 0,040g
O H y de BocGlyOH (1,5 éq. ; 0,23
mmol), 0,098 g de HBTU (1,5
éq. ; 0,23 mmol), 0,021 g de HOBt (1,2 éq. ; 0,15 mmol), 3
30 mL de CHZClZ, et 0,135 mL de DIEA. On agite deux heures
sous azote puis on introduit 0,050 g du composé de
l'exemple 6 et après purification à 40% AcOEt ; 60% Cyclo,
on obtient 0,035 g d'une huile orange (Rdt = 63%).
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 50 -
Exemple 17 . Synthèse du chlorhydrate de 2-méthyl-3-(L-
alaninyl-aminométhyl)-1,4-naphtoquinone
o Selon le protocole opératoire
précédemment décrit pour le
composé de l'exemple 5, dans un
N ballon de 10 mL on introduit
NH00,030 g du composé de l'exemple
0 CI-
7(1 éq. ; 0,080 mmol ), et on
additionne 2 mL de CHaC1z et 2 mL de TFA (dans un bain de
glace). Lors de l'évaporation on reprend plusieurs fois le
milieu dans du toluène, puis le solide brun obtenu est
repris dans une solution d'HCl 1M dans Et2O pendant 30
minutes. On évapore le solvant et on répète l'opération
avec la solution d'acide chlorhydrique dans l'éther deux
fois. Après évaporation et séchage on récupère 0,022 g d'un
solide jaune-orangé ( Rdt = 89 ô).
Exemple 18 : Synthèse du chlorhydrate de 2-méthyl-3-(L-
sérinyl-aminométhyl)-1,4-naphtoquinone
o Selon le protocole opératoire
HO précédemment décrit pour le
composé de l'exemple 5, dans un
N ballon de 10 mL on introduit
N H3
CI_ 0,030 g du composé de l'exemple
0 0
8soit (1 éq. ; 0,067 mmol), et
on additionne 2 mL de CHZClz et 2 mL de TFA (dans un bain
de glace). Lors de l'évaporation on reprend plusieurs fois
le milieu dans du toluène, puis le solide brun obtenu est
repris dans une solution d'HCl 1M dans EtZO pendant 30
30 minutes. On évapore le solvant et on répète l'opération
avec la solution d'acide chlorhydrique dans l'éther deux
fois. Après évaporation et séchage on récupère 0,020 g d'un
).
solide orange ( Rdt = 91 %
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 51 -
Exemple 19 : Synthèse du chlorhydrate de 2-méthyl-3-(D-
valinyl-aminométhyl)-1,4-naphtoquinone
Selon le protocole opératoire
0
ci- précédemment décrit pour le
I \ I NH3 composé de l'exemple 5, dans
H un ballon de 10 mL on
N
introduit 0,030 g du composé
0 o de l'exemple 9 soit (1 éq.;
0,075 mmol), et on additionne 2 mL de CHaClZ et 2 mL de TFA
(dans un bain de glace). Lors de l'évaporation on reprend
plusieurs fois le milieu dans du toluène, puis le solide
brun obtenu est repris dans une solution d'HCl 1M dans EtzO
pendant 30 minutes. On évapore le solvant et on répète
l'opération avec la solution d'acide chlorhydrique dans
l'éther deux fois. Après évaporation et séchage on récupère
0,023 g d'un solide jaune ( Rdt = 91 % ).
Exemple 20 : Synthèse du chlorhydrate de 2-méthyl-3-(L-
thréoninyl-aminométhyl)-1,4-naphtoquinone
Selon le protocole opératoire
0
précédemment décrit pour le
NH3 cl composé de l'exemple 5, dans
I l un ballon de 10 mL on
N OH
introduit 0,030 g du composé
0 de l'exemple 10 soit (1 éq. ;
0,065 mmol), et on additionne 2 mL de CHZC12 et 2 mL de TFA
(dans un bain de glace). Lors de l'évaporation on reprend
plusieurs fois le milieu dans du toluène, puis le solide
brun obtenu est repris dans une solution d'HCl 1M dans Et2O
30 pendant 30 minutes. On évapore le solvant et on répète
l'opération avec la solution d'acide chlorhydrique dans
l'éther deux fois. Après évaporation et séchage on récupère
0,021 g d'un solide orange-brun ( Rdt = 95 %
).
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 52 -
Exemple 21 . Synthèse du chlorhydrate de 2-méthyl-3-
(glycinyl-aminométhyl)-1,4-naphtoquinone
o Selon le protocole
opératoire précédemment
décrit pour le composé de
N +NH3 Cl' l'exemple 5, dans un ballon
de 10 mL on introduit 0,030
0 0
g du composé de l'exemple 11
soit ( 1 éq. ; 0,084 mmol), et on additionne 2 mL de CH2ClZ
et 2 mL de TFA (dans un bain de glace). Lors de
l'évaporation on reprend plusieurs fois le milieu dans du
toluène, puis le solide brun obtenu est repris dans une
solution d' HC1 1M dans Et2O pendant 30 minutes. On évapore
le solvant et on répète l'opération avec la solution
d'acide chlorhydrique dans l'éther deux fois. Après
évaporation et séchage on récupère 0,022 g d'un solide
orange-brun ( Rdt = 89 % ).
Exemple 22 . Synthèse du chlorhydrate de 2-méthyl-3-(L-
alaninyl-aminoéthyl)-1,4-naphtoquinone
Selon le protocole
+ opératoire précédemment
NH, Cl'
décrit pour le composé de
l'exemple 5, dans un ballon
N 0
H de 10 mL on introduit 0,030
g du composé de l'exemple 12
soit ( 1 éq. ; 0,077 mmol), et on additionne 2 mL de CHZC12
et 2 mL de TFA (dans un bain de glace). Lors de
l'évaporation on reprend plusieurs fois le milieu dans du
toluène, puis le solide brun obtenu est repris dans une
solution d'HCl 1M dans EtaO pendant 30 minutes. On évapore
le solvant et on répète l'opération avec la solution
d'acide chlorhydrique dans l'éther deux fois. Après
évaporation et séchage on récupère 0,023 g d'un solide
orange-brun ( Rdt = 92 ô).
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 53 -
Exemple 23 : Synthèse du chlorhydrate de 2-méthyl-3-(L-
sérinyl-aminoéthyl)-1,4-naphtoquinone
0 OH Selon le protocole
NH, ci- opératoire précédemment
décrit pour le composé de
N o l'exemple 5, dans un ballon
H de 10 mL on introduit 0,030
0
g du composé de l'exemple 13
soit ( 1 éq. ; 0,077 mmol ), et on additionne 2 mL de CH2C12
et 2 mL de TFA (dans un bain de glace). Lors de
l'évaporation on reprend plusieurs fois le milieu dans du
toluène, puis le solide brun obtenu est repris dans une
solution d'HCl 1M dans Et2O pendant 30 minutes. On évapore
le solvant et on répète l'opération avec la solution
d'acide chlorhydrique dans l'éther deux fois. Après
évaporation et séchage on récupère 0,023 g d'un solide
orange-brun ( Rdt = 92 % ).
Exemple 24 . Synthèse du chlorhydrate de 2-méthyl-3-(D-
valinyl-aminoéthyl)-1,4-naphtoquinone
o Selon le protocole opératoire
HN précédemment décrit pour le
~ I composé de l'exemple 5, dans un
/ ballon de 10 mL on introduit
N 0
H 0,030 g du composé de l'exemple
0
14 soit (1 éq. ; 0,077 mmol),
et on additionne 2 mL de CH2C12 et 2 mL de TFA (dans un
bain de glace). Lors de l'évaporation on reprend plusieurs
fois le milieu dans du toluène, puis le solide brun obtenu
est repris dans une solution d'HCl 1M dans Et20 pendant 30
minutes. On évapore le solvant et on répète l'opération
avec la solution d'acide chlorhydrique dans l'éther deux
fois. Après évaporation et séchage on récupère 0,023 g d'un
solide brun (Rdt = 91 % ).
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 54 -
Exemple 25 : Synthèse du chlorhydrate de 2-méthyl-3-(L-
thréoninyl-méthyl)-1,4-naphtoquinone
o cr Selon le protocole opératoire
H,N OH précédemment décrit pour le
I ~ ~
composé de l'exemple 5, dans
/ N o un ballon de 10 mL on
H introduit 0,030 g du composé
0
de l'exemple 15 soit (1 éq. ;
0,077 mmol), et on additionne 2 mL de CHzCl2 et 2 mL de TFA
(dans un bain de glace). Lors de l'évaporation on reprend
plusieurs fois le milieu dans du toluène, puis le solide
brun obtenu est repris dans une solution d'HCl 1M dans EtaO
pendant 30 minutes. On évapore le solvant et on répète
l'opération avec la solution d'acide chlorhydrique dans
l'éther deux fois. Après évaporation et séchage on récupère
0,020 g d'un solide brun ( Rdt = 89 %).
Exemple 26 . Synthèse du chlorhydrate de 2-méthyl-3-
(glycinyl-aminoéthyl)-1,4-naphtoquinone
o Selon le protocole
NH3 c1- opératoire précédemment
I \ ~ décrit pour le composé de
N O l'exemple 5, dans un ballon
H de 10 mL on introduit 0,030
0
g du composé de l'exemple 16
soit (1 éq. ; 0,077 mmol ), et on additionne 2 mL de CHZClZ
et 2 mL de TFA (dans un bain de glace). Lors de
l'évaporation on reprend plusieurs fois le milieu dans du
toluène, puis le solide brun obtenu est repris dans une
solution d'HCl 1M dans Et2O pendant 30 minutes. On évapore
le solvant et on répète l'opération avec la solution
d'acide chlorhydrique dans l'éther deux fois. Après
évaporation et séchage on récupère 0,021 g d'un solide
orange ( Rdt = 84 % ).
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 55 -
Exemple 27 : Synthèse du 2-méthyl-3-(N'-tert-
butyloxycarbonyl-D-tryptophanyl-aminométhyl)-1,4-
naphtoquinone
~
H Selon la procédure de couplage
décrite pour le composé de l'exemple
NHBoc 7, on utilise 0,116 g de Boc-D-TrpOH
O O (1,2 éq. ; 0,38 mmol), 0,189 g de HBTU
15 (1,5 éq. ; 0,50 mmol), 0,054 g de HOBt (1.2 éq. ; 0,40
mmol), 3 mL de CHZCl2 et 0,300 mL de DIEA. On ajoute
ensuite 0,100 g du composé de l'exemple 5, et après lavage
et purification du produit sur colonne de chromatographie
avec AcOEt : Cyclohexane (20 : 80) on obtient 0,109 g d'un
20 solide orange (Rdt = 70%).
Exemple 28 : Synthèse du 2-méthyl-3-(N'-tert-
butyloxycarbonyl-L-thréoninyl(OBn)-aminoéthyl)-1,4-
naphtoquinone
Selon la procédure de couplage
5,.,NHBoc décrite pour le composé de l'exemple
0 7, on utilise 0,118 g de Boc-L-
Thr(Bn)OH (1,27 éq. ; 0,38 mmol),
0,180 g de HBTU 1,6 éq. ( ; 0,47
mmol), 0,052 g de HOBt (1.3 éq. ;
0,38 mmol), 3 mL de CH2Clz et 0,28 mL de DIEA. On laisse
l'activation agir pendant deux heures sous azote. On ajoute
ensuite 0,100 g du composé de l'exemple 6, et après lavage
et purification du produit sur colonne de chromatographie
avec AcOEt : Cyclohexane (20 : 80) on obtient 0,070 g d'un
solide orange (Rdt = 45%).
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
- 56 -
Exemple 29 : Synthèse du 2-méthyl-3-(N'-tert-
butyloxycarbonyl-D-tyrosinyl(OBn)-aminométhyl)-1,4-
naphtoquinone
Selon la procédure de couplage
- - décrite pour le composé de
l'exemple 7, on utilise 0,141 g
-~ IV NHBoc
de Boc-D-Tyr(Bn)OH (1,20 éq. ;
O O
0,38 mmol), 0,189 g de HBTU (1,57
éq. ; 0,50 mmol), 0,054 g de HOBt (1,26 éq. ; 0,40 mmol), 3
mL de CHaCl2 et 0,30 mL de DIEA. On laisse l'activation
agir pendant deux heures sous azote. On ajoute ensuite
0.100 g du composé de l'exemple 6, et après lavage et
purification du produit sur colonne de chromatographie avec
AcOEt : Cyclohexane (20 : 80) on obtient 0,065 g d'un
solide orange (Rdt = 37%).
Exemple 30 : Synthèse du chlorhydrate de 2-méthyl-3-(D-
tyrosinyl(OBn)-aminométhyl)-1,4-naphtoquinone
Selon le protocole opératoire
- - précédemment décrit pour le
I~ I composé de l'exemple 5, dans un
~ ~ NH3+CI ballon de 10 mL on introduit
0 0 0,060 g du composé de l'exemple
29 (1 éq. ; 0,110 mmol), et on additionne 1 mL de CHzClz et
1 mL de TFA (dans un bain de glace). Lors de l'évaporation,
on reprend plusieurs fois le milieu dans du toluène puis le
solide brun obtenu est repris dans une solution d'HCl 1M
dans EtZO pendant 30 minutes. On évapore le solvant et on
répète l'opération avec la solution d'acide chlorhydrique
dans l'éther deux fois. Après évaporation et séchage, on
récupère 0,050 g d'un solide orangé (Rdt = 92%).
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
57
Exemple 31 : Synthèse du chlorhydrate de 2-méthyl-3-(D-
tryptophanyl-aminométhyl)-1,4-naphtoquinone
Selon le protocole opératoire
précédemment décrit pour le
~ `- composé de l'exemple 5, dans un
ballon de 10 mL on introduit
~ ~ 0,104 g du composé de l'exemple
27 (1 éq. ; 0,213 mmol), et on additionne 1 mL de CHzClz et
1 mL de TFA (dans un bain de glace). Lors de l'évaporation,
on reprend plusieurs fois le milieu dans du toluène puis le
solide brun obtenu est repris dans une solution d'HCl 1M
dans EtzO pendant 30 minutes. On évapore le solvant et on
répète l'opération avec la solution d'acide chlorhydrique
dans l'éther deux fois. Après évaporation et séchage, on
récupère 0.084 g d'un solide orangé (Rdt = 93%).
Exemple 32 : Synthèse du chlorhydrate de 2-méthyl-3-
(thréoninyl-aminoéthyl)-1,4-naphtoquinone
.to 0 Selon le protocole opératoire
O précédemment décrit pour le
I/ I NI~NH3+CI- composé de l'exemple 5, dans un
p H~0 ballon de 10 mL on introduit 0,065
g du composé de l'exemple 28 (1
i~ç éq. ; 0,128 mmol), et on
additionne 0, 5 mL de CH2ClZ et 0, 5 mL de TFA (dans un bain
de glace). Lors de l'évaporation, on reprend plusieurs fois
le milieu dans du toluène puis le solide brun obtenu est
repris dans une solution d'HCl 1M dans EtzO pendant 30
30 minutes. On évapore le solvant et on répète l'opération
avec la solution d'acide chlorhydrique dans l'éther deux
fois. Après évaporation et séchage, on récupère 0.051 g
d'un solide orangé (Rdt = 90%).
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
58
Exemple 33 : Synthèse du O-Trichloroéthoxycarbonyl-
plumbagone
0 A une solution de 0,200 g de plumbagone (1
e éq., 1,060 mmol ) dans 5 mL de CHZClz à 0 C
sous argon, est ajoutée goutte à goutte
0y 0 0 0,25 mL de pyridine (3 éq., 3,100 mmol).
C13Cv0 Le mélange initialement orange est agité
~ b 10 min et devient brun. 0,18 mL de chloroformiate de 2,2,2-
trichloroéthyle (1,25 éq., 1,300 mmol) est ajouté et le
mélange orange foncé devient rapidement jaune trouble.
Après 2h, le mélange est dilué dans H20 et extrait par
AcOEt, séché sur MgSO4, filtré sur célite et concentré sous
~lS pression réduite. On obtient 0,338 g de produit sous forme
de cristaux jaune pâle (Rdt = 87%).
Exemple 34 : Synthèse du 3-(N'-tert-butyloxycarbonyl-2-
aminoéthyl)-O-trichloroéthoxycarbonyl-plumbagone
O Dans un ballon de 10 mL, contenant
I j I 0,100 g du composé de l'exemple 33
NHBoc soit (1 éq. ; 0,28 mmol), on
0y 0 O introduit 0,156
g de Boc-(3Ala
CI3C~0 (Aldrich Co.) soit (3 éq. ; 0,84
mmol) et 0,014 g d'AgNO3 (0,3 éq. ; 0,082 mmol). On
additionne le mélange CH3CN : eau (2 : 1), soit 2,0 mL de
CH3CN et 1,0 mL d'H20 et la température du mélange est
portée à 65 C. L'addition de 0,082 g de (NH4)2S208 (1,3 éq. ;
3o 0,360 mmol) dissout dans 1,5 mL d'un mélange CH3CN : H201
se fait pendant 2 heures. Le milieu réactionnel est alors
maintenu sous agitation pendant une heure à 65 C, puis on
extrait au CHZCl2 trois fois et on lave une seule fois avec
H20 les phases organiques. On sèche les phases organiques
3Sr sur MgSO4 puis on les évapore. Le produit est purifié par
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
59
chromatographie sur colonne avec éluant AcOEt : Cyclohexane
(10 : 90) et on récupère 0,044 g d'une huile orange (Rdt =
31%).
Exemple 35 : Synthèse du 3-(N'-tert-butyloxycarbonyl-2-
aminoéthyl)-plumbagone
O Dans un ballon de 10 mL, contenant
I/ I 0,200 g de plumbagone (Aldrich Co.)
NHBoc soit (1 éq. ; 1,06 mmol), on introduit
OH O 0,603 g de Boc-(3Ala (Aldrich Co.) soit
(3 éq. ; 3,19 mmol) et 0,054 g d'AgNO3 (0,3 éq. ; 0,032
mmol). On additionne le mélange CH3CN : eau (2 : 1), soit
2,0 mL de CH3CN et 1,0 mL d'H20 et la température du
mélange est portée à 65 C. L'addition de 0,315 g de
(NH4)2S208 (1,3 éq. ; 1,38 mmol) dissout dans 1,5 mL d'un
mélange CH3CN : H201 se fait pendant 2 heures. Le milieu
réactionnel est alors maintenu sous agitation pendant une
heure à 65 C, puis on extrait au CH2Cla trois fois et on
lave une seule fois avec H2O les phases organiques. On
sèche les phases organiques sur MgSO4 puis on les évapore.
Le produit est purifié par chromatographie sur colonne avec
éluant AcOEt : Cyclohexane (de 0: 100 à 20 : 80) et on
récupère 0,153 g d'une huile orange (Rdt = 43%).
Exemple 36 : Synthèse du 3-(N'-tert-butyloxycarbonyl-2-
aminoéthyl)-O-acétyl-plumbagone
0 Dans un ballon de 10 mL, on dissout 0,183
g du composé de l'exemple 35 soit (1
I~ I NHBoc eq= ; 0,55 mmol) dans 5,5 mL de CH2Clz
OAc O sous argon. 0,3 mL de Et3N (3,9 éq.;
2,16 mmol) est ajouté et le mélange est agité pendant 10
min à température ambiante. 0,2 mL de chlorure d'acétyle (5
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
éq. ; 2,80 mmol) est ajouté lentement à 0 C et le mélange
est agité pendant 3 h à température ambiante. Le milieu
réactionnel est lavé avec de la saumure puis extrait par
CH2ClZ. Les phases organiques rassemblées sont séchées sur
5 MgSO41 filtrées sur Célite et concentrées sous pression
réduite. 0,194 g de produit est obtenu sous forme d'un
solide brun (Rdt = 94%).
Exemple 37 : Synthèse du chlorhydrate de 3-aminoéthyl-O-
10 acétyl-plumbagone
O Selon le protocole opératoire
I~ I précédemment décrit pour le composé de
~ NH3+CI' l'exemple 5, dans un ballon de 10 mL on
OAc O introduit 0,190 g du composé de
15 l'exemple 36 soit (1 éq. ; 0,509 mmol), et on additionne 2
mL de CH2ClZ et 2 mL de TFA (dans un bain de glace). Lors
de l'évaporation on reprend plusieurs fois le milieu dans
du toluène, puis le solide brun obtenu est repris dans une
solution d'HCl 1M dans Et2O pendant 30 minutes. On évapore
20 le solvant et on répète l'opération avec la solution
d'acide chlorhydrique dans l'éther deux fois. Après
évaporation et séchage on récupère 0,113 g d'un solide brun
(Rdt = 83 %).
Après transformations synthétiques adéquates similaires à
25 celles décrites pour la série de composés des exemples 1 à
26 ci-dessus, et qui deviendront apparentes à l'homme du
métier à la lecture de la présente, cet intermédiaire peut
donner lieu à un composé de formule I où Z est lié au
radical X via une liaison amide, par couplage avec un acide
30 aminé approprié. Le composé obtenu répondrait par exemple à
la formule suivante si l'intermédiaire précité est couplé
avec un a-acide aminé:
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
61
O O
O O
( ~ I N~/NH3+CI I/ I N NH3+CI-
H T H~
OH O R ou OAc O R (R
désignant la chaîne latérale de l'acide aminé).
Exemple 38 : Synthèse des 2-(N'-tert-butyloxycarbonyl-
aminoéthyl)-5-hydroxy-1,4-naphtoquinone et 3-(N'-tert-
butyloxycarbonyl-aminoéthyl)-5-hydroxy-1,4-naphtoquinone
O Dans un ballon de 25 mL, contenant 0,348 g
-NHBoc de juglone (Aldrich Co.) soit (1 éq. ;
i
' 2,00 mmol), on introduit 1,135 g de Boc-
ar, OH O (3Ala (Aldrich Co.) soit (3 éq. ; 6,00
mmol) et 0,102 g d'AgNO3 (0,3 éq. ; 0,66 mmol). On
additionne le mélange CH3CN : eau (2 : 1), soit 5,0 mL de
CH3CN et 2,5 mL d'H20 et la température du mélange est
portée à 65 C. L'addition de 0,593 g de (NH4)2S208 (1,3 éq. ;
2,60 mmol) dissout dans 3,0 mL d'un mélange CH3CN : H20, se
fait pendant 2 heures. Le milieu réactionnel est alors
maintenu sous agitation pendant une heure à 65 C, puis on
extrait au CH2C12 trois fois et on lave une seule fois avec
H20 les phases organiques. On sèche les phases organiques
sur MgSO4 puis on les évapore. Le produit est purifié par
chromatographie sur colonne avec éluant CH2ClZ et on
récupère 0,123 g d'un mélange de deux régioisomères dans un
rapport 3 : 1 sous la forme d'une huile orange (Rdt = 19%).
Après transformations synthétiques adéquates, similaires à
celles décrites pour la série de composés des exemples 1 à
26 ci-dessus, et qui deviendront apparentes à l'homme du
métier à la lecture de la présente, cet intermédiaire peut
donner lieu à un composé de formule I où Z est lié au
radical X via une liaison amide, par couplage avec un acide
aminé approprié. Le composé obtenu répondrait par exemple à
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
62
la formule suivante si l'intermédiaire précité est couplé
avec un a-acide aminé:
O O O O
'Ni`NH3+CI NJtyNH3+CI
H T H
R R
OH O ou OAc O (R
désignant la chaîne latérale de l'acide aminé).
~
Exemple 39 : Synthèse du 2,3-bis-(N'-tert-butyloxycarbonyl-
aminoéthyl)-5-hydroxy-1,4-naphtoquinone
O Dans un ballon de 5 mL, contenant 0,100 g
I NHBoc du mélange de composés de l'exemple 38
NHBoc soit (1 éq.; 0,315 mmol), on introduit
OH 0 0,179 g de Boc-(3Ala (Aldrich Co.) soit (3
éq. ; 0,95 mmol) et 0,016 g d'AgNO3 (0,3 éq. ; 0,095 mmol).
On additionne le mélange CH3CN : eau (2 : 1), soit 1,0 mL
de CH3CN et 0,5 mL d'H20 et la température du mélange est
portée à 65 C . L'addition de 0,094 g de ( NH4 ) 2S208 (1,3 éq. ;
0,41 mmol) dissout dans 1,0 mL d'un mélange CH3CN : H2O1 se
fait pendant 2 heures. Le milieu réactionnel est alors
maintenu sous agitation pendant une heure à 65 C, puis on
extrait au CH2ClZ trois fois et on lave une seule fois avec
HaO les phases organiques. On sèche les phases organiques
sur MgSO4 puis on les évapore. Le produit est purifié par
chromatographie sur colonne avec éluant CH2Clz et on
récupère 0,067 g d'une huile orange (Rdt = 46%).
Exemple 40 : Synthèse du 2-méthyl-(N'-acétyl-l'-méthyl-
aminométhyl)-1,4-naphtoquinone
O Dans un ballon de 10 mL, contenant 0,200 g
e0--r de ménadione soit (1 éq.; 1,16 mmol), on
NHAc introduit 0,456 g de N-Ac-D,L-Ala (Aldrich
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
63
Co.) soit (3 éq. ; 3,48 mmol) et 0,059 g d'AgNO3 (0,3 éq. ;
0,035 mmol). On additionne le mélange CH3CN : eau (2 : 1),
soit 3, 0 mL de CH3CN et 1, 5 mL d'H20 et la température du
mélange est portée à 65 C. L'addition de 0,344 g de
(NH4)ZSZO8 (1,3 éq. ; 1,51 mmol) dissout dans 3,0 mL d'un
mélange CH3CN : HZ0, se fait pendant 2 heures. Le milieu
réactionnel est alors maintenu sous agitation pendant une
heure à 65 C, puis on extrait au CHZCl2 trois fois et on
lave une seule fois avec H20 les phases organiques. On
sèche les phases organiques sur MgSO4 puis on les évapore.
Le produit est purifié par chromatographie sur colonne avec
éluant CH3OH : CHZClz (de 0: 100 à 5 : 95) et on récupère
0,048 g d'une huile orange (Rdt = 17%).
Après transformations synthétiques adéquates, similaires à
celles décrites pour la série de composés des exemples 1 à
26 ci-dessus, et qui deviendront apparentes à l'homme du
métier à la lecture de la présente, cet intermédiaire peut
donner lieu à un composé de formule I où Z est lié au
radical X via une liaison amide, par couplage avec un acide
aminé approprié. Le composé obtenu répondrait par exemple à
la formule suivante si l'intermédiaire précité est couplé
avec un a-acide aminé:
0
H R
NY--,- NH3+CI-
0 0 (R désignant la chaîne latérale de
l'acide aminé).
Exemple 41 : Synthèse du 2-méthyl-(N'-acétyl-l'-benzyl-
aminométhyl)-1,4-naphtoquinone
0 Dans un ballon de 10 mL, contenant 0,200 g
H de ménadione soit (1 éq.; 1,16 mmol), on
Ny
0 0
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
64
introduit 0,722 g de N-Ac-L-Phe (Aldrich Co.) soit (3 éq. ;
3,48 mmol) et 0,065 g d'AgNO3 (0,3 éq. ; 0,038 mmol). On
additionne le mélange CH3CN : eau (2 : 1), soit 3,0 mL de
CH3CN et 1,5 mL d'Ha0 et la température du mélange est
portée à 65 C. L'addition de 0,375 g de (NH4)2SZ08 (1,3 éq. ;
1,64 mmol) dissout dans 3,0 mL d'un mélange CH3CN : H20, se
fait pendant 2 heures. Le milieu réactionnel est alors
maintenu sous agitation pendant une heure à 65 C, puis on
extrait au CHaC12 trois fois et on lave une seule fois avec
H20 les phases organiques. On sèche les phases organiques
sur MgSO4 puis on les évapore. Le produit est purifié par
chromatographie sur colonne avec éluant CH3OH : CH2C12 (de
0: 100 à 5 : 95) et on récupère 0,387 g d'une huile orange
(Rdt = 22%).
Après transformations synthétiques adéquates, similaires à
celles décrites pour la série de composés des exemples 1 à
26 ci-dessus, et qui deviendront apparentes à l'homme du
métier à la lecture de la présente, cet intermédiaire peut
donner lieu à un composé de formule I où Z est lié au
radical X via une liaison amide, par couplage avec un acide
aminé approprié. Le composé obtenu répondrait par exemple à
la formule suivante si l'intermédiaire précité est couplé
avec un a-acide aminé:
O
H R
I ~ I N_U~ NH3+CI
O O
- (R désignant la chaîne latérale de
l'acide aminé).
Exemple 42 : Synthèse du 3-propanoate de méthyle de 2-
méthyl-l,4-naphtoquinone
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
O Dans un ballon de 100 mL, contenant
I~ I 1,000 g de ménadione (Aldrich Co.) soit
C02Me (1 éq. ; 5,81 mmol), on introduit 2,300
O g du monoester méthylique de l'acide
5 succinique (Aldrich Co.) soit (3 éq. ; 17,40 mmol) et 0,300
g d'AgNO3 (0,3 éq. ; 1,80 mmol). On additionne le mélange
CH3CN : eau (2 : 1), soit 30,0 mL de CH3CN et 15,0 mL d'H20
et la température du mélange est portée à 65 C. L'addition
de 1,730 g de (NH4) ZSZ0$ (1,3 éq. ; 7,60 mmol ) dissout dans
10 30,0 mL d'un mélange CH3CN : H201 se fait pendant 2 heures.
Le milieu réactionnel est alors maintenu sous agitation
pendant une heure à 65 C, puïs on extrait au CHaCl2 trois
fois et on lave une seule fois avec H20 les phases
organiques. On sèche les phases organiques sur MgSO4 puis
15 on les évapore. Le produit est purifié par chromatographie
sur colonne avec éluant CH3OH : CHZClZ (gradient de 0: 100
à 5 : 95) et on récupère 0,875 g d'une huile orange (Rdt =
58%).
20 Exemple 43 : Synthèse du 3-propanoate de méthyle de 1,4-
naphtoquinone
0 Dans un ballon de 10 mL, contenant 0,097
I~ I g de 1,4-naphtoquinone (Acros Co.) soit
C02Me (1 éq. ; 0,61 mmol), on introduit 0,242
25~ 0 g du monoester méthylique de l'acide
succinique (Aldrich Co.) soit (3 éq. ; 1,83 mmol) et 0,031
g d'AgNO3 (0,3 éq. ; 0,18 mmol). On additionne le mélange
CH3CN : eau (2 : 1), soit 3,0 mL de CH3CN et 1,5 mL d'H20 et
la température du mélange est portée à 65 C. L'addition de
30 0,181 g de (NH4)2S208 (1,3 éq. ; 0,79 mmol) dissout dans 3,0
mL d'un mélange CH3CN : H2O, se fait pendant 2 heures. Le
milieu réactionnel est alors maintenu sous agitation
pendant une heure à 65 C, puis on extrait au CH2Cl2 trois
fois et on lave une seule fois avec H2O les phases
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
66
organiques. On sèche les phases organiques sur MgSO4 puis
on les évapore. Le produit est purifié par chromatographie
sur colonne avec éluant CH3OH : CH2Cla (gradient de 0: 100
à 5 : 95) et on récupère 0,042 g d'une huile orange (Rdt =
28%).
Exemple 44 : Synthèse du 2-méthyl-3-propanoyl-l,4-
naphtoquinone
0 Dans un ballon de 5 mL, on pèse 0,120 g du
composé de l'exemple 42 (1 éq. ; 0,46
CO2H mmol). On ajoute 0,5 mL d'une solution
O aqueuse de HCl 1M (1,1 éq. ; 0,5 mmol). Le
milieu réactionnel est agité à température ambiante pendant
une nuit. Après addition de CHaCl2 et extraction de la
phase aqueuse par CH2C12, les phases organiques rassemblées
sont séchées sur MgSO41 filtrées et concentrées sous
pression réduite. Le produit est purifié par
chromatographie sur colonne avec éluant CH3OH : CHaCla
(gradient de 0: 100 à 10 : 90) et on récupère 0,053 g
d'une huile jaune (Rdt = 46%).
~
Exemple 45 : Synthèse du 3-propanoyl-1,4-naphtoquinone
0 Dans un ballon de 5 mL, on pèse 0,120 g
du composé de l'exemple 43 (1 éq. ; 0,49
I CO2H mmol). On ajoute 0,55 mL d'une solution
O aqueuse de HCl 1M (1,1 éq. ; 0,55 mmol).
Le milieu réactionnel est agité à température ambiante
pendant une nuit. Après addition de CH2C12 et extraction de
la phase aqueuse par CHaCl21 les phases organiques
rassemblées sont séchées sur MgSO4, filtrées et concentrées
30 sous pression réduite. Le produit est purifié par
chromatographie sur colonne avec éluant CH3OH : CH2C12
(gradient de 0: 100 à 10 : 90) et on récupère 0,048 g
d'une huile jaune (Rdt = 42%).
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
67
Après transformations synthétiques adéquates, et qui
deviendront apparentes à l'homme du métier à la lecture de
la présente, les intermédiaires des exemples 44 et 45
peuvent donner lieu à des composés de formule I où Z est
lié au radical X via une liaison rétro-inverso amide, par
couplage avec un acide aminé approprié. Les composés
obtenus répondraient par exemple aux formules suivantes si
les intermédiaires précités étaient couplés avec un a-
acide aminé:
O O
I/ I N COà Na+ I/ I N C02 Na+
O O R ou O O R (R
désignant la chaîne latérale de l'acide aminé).
Exemple 46 : Synthèse du 2-méthyl-3-propanol-1,4-
naphtoquinone
O Dans un ballon de 10 mL, on pèse 0,100 g
~ du composé de l'exemple 42 (1 éq. ; 0,39
OH mmol) que l'on dissout dans 5 mL
O d'éthanol. On ajoute 0,100 g de
borohydrure de sodium (6,7 éq. ; 2,6 mmol) à 0 C et le
mélange est agité à reflux pendant 7h. Le milieu
réactionnel est refroidi à température ambiante avant
d'être versé dans 10 mL d'eau glacée, puis acidifié par une
solution aqueuse d'acide sulfurique à 1% et extrait par
CHC13. Les phases organiques rassemblées sont séchées sur
Na2SO4, filtrées et concentrées sous pression réduite.
0,043 g de produit est obtenu sous la forme d'une huile
jaune pâle (Rdt = 48%)
Exemple 47 : Synthèse du 3-propanol-1,4-naphtoquinone
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
68
O Dans un ballon de 10 mL, on pèse 0,100
g du composé de l'exemple 43 (1 éq. ;
OH 0,41 mmol) que l'on dissout dans 5 mL
O d'éthanol. On ajoute 0,100 g de
borohydrure de sodium (6,7 éq. ; 2,6 mmol) à 0 C et le
mélange est agité à reflux pendant 7h. Le milieu
réactionnel est refroidi à température ambiante avant
d'être versé dans 10 mL d'eau glacée, puis acidifié par une
solution aqueuse d'acide sulfurique à 1% et extrait par
CHC13. Les phases organiques rassemblées sont séchées sur
Na2SO41 filtrées et concentrées sous pression réduite.
0,040 g de produit est obtenu sous la forme d'une huile
jaune pâle (Rdt = 45%).
Après transformations synthétiques adéquates, et qui
deviendront apparentes à l'homme du métier à la lecture de
la présente, les intermédiaires des exemples 46 et 47
peuvent donner lieu à des composés de formule I où Z est
lié au radical X via une liaison ester, par couplage avec
un acide aminé approprié. Les composés obtenus répondraient
par exemple aux formules suivantes si les intermédiaires
précités étaient couplés avec un a-acide aminé:
0
~ II R R
0 0
NH5cl ~ NH3 CI
0 0 0
(R désignant la chaîne latérale de l'acide aminé).
Exemple 48 : Synthèse du 3-(N'-tert-butyloxycarbonyl-2-
aminométhyl)-1,4-naphtoquinone
O Dans un ballon de 100 mL, on pèse 0,950
g de 1,4-naphtoquinone (léq. ; 6,0
NHBoc mmol), 3,150 g (3 éq. ; 18,0 mmol) de
0 Boc-Gly (Aldrich Co.), et 0,306 g de
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
69
AgNO3 (0,3 éq. ; 1,8 mmol). On additionne le mélange
acétonitrile : eau (rapport 7 :3), soit 30,0 mL de CH3CN et
15,0 mL d'H20 et la température du mélange est portée à
65 C. L'addition de 1,78 g de (NH4 ) Sa0s (1,3 éq. ; 7,8 mmol )
dissout dans 15 mL d'un mélange CH3CN : H201 se fait
pendant 2 heures. Le milieu réactionnel est alors maintenu
sous agitation pendant une heure à 65 C puis on extrait au
CH2C12 trois fois et on lave une seule fois avec H20 les
phases éthérées. On sèche les phases organiques sur MgSO4
et on évapore. Le produit est purifié par chromatographie
sur colonne avec comme éluant CH3OH : CH2Cla (de 0: 100 à
5 : 95) et on obtient 0,812 g d'une huile orange (Rdt= 47%
)=
Exemple 49 : Synthèse du 3-(N'-tert-butyloxycarbonyl-2-
aminoéthyl)-1,4-naphtoquinone
0 Dans un ballon de 100 mL, on pèse 0,950
g de 1,4-naphtoquinone (léq. ; 6,0
NHBoc mmol), 3,410 g (3 éq. ; 18,0 mmol) de
J-0 0 - Boc-(3A1a (Aldrich Co.), et 0,306 g de
AgNO3 (0,3 éq. ; 1,8 mmol). On additionne le mélange
acétonitrile : eau (rapport 7 :3), soit 30,0 mL de CH3CN et
15,0 mL d'H20 et la température du mélange est portée à
65 C. L'addition de 1,78 g de (NH4)S208 (1,3 éq. ; 7,8 mmol)
dissout dans 15 mL d'un mélange CH3CN : H20, se fait
pendant 2 heures. Le milieu réactionnel est alors maintenu
sous agitation pendant une heure à 65 C puis on extrait au
CH2C12 trois fois et on lave une seule fois avec H20 les
phases éthérées. On sèche les phases organiques sur MgSO4
et on évapore. Le produit est purifié par chromatographie
sur colonne avec comme éluant CH3OH : CHaCl2 (de 0: 100 à
5 : 95) et on obtient 0,488 g d'une huile orange (Rdt= 27%
)=
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
Exemple 50 : Synthèse du 2,3-bis-(N'-tert-butyloxycarbonyl-
2-aminométhyl)-1,4-naphtoquinone
Méthode A : Dans un ballon de 100 mL, on
O
~ pèse 0,475 g de 1,4-naphtoquinone (léq. ;
NHBoc
NHBoc 3,0 mmol), 1,580 g (3 éq. ; 9,0 mmol) de
O Boc-Gly (Aldrich Co.), et 0,153 g de
AgNO3 (0,3 éq. ; 0,9 mmol). On additionne le mélange
acétonitrile : eau (rapport 7 :3), soit 20,0 mL de CH3CN et
10 10,0 mL d'H20 et la température du mélange est portée à
65 C. L'addition de 0,890 g de (NH4)S208 (1,3 éq. ; 3,9
mmol) dissout dans 15 mL d'un mélange CH3CN : H201 se fait
pendant 2 heures. Le milieu réactionnel est alors maintenu
sous agitation pendant une heure à 65 C puis on extrait au
15 CH2C12 trois fois et on lave une seule fois avec H2O les
phases éthérées. On sèche les phases organiques sur MgSO4
et on évapore. Le produit est purifié par chromatographie
sur colônne avec comme éluant AcOEt : Cyclohexane (de 0:
100 à 30 : 70) et on obtient 0,240 g d'une huile orange
20 (Rdt= 19%).
Méthode B : Dans un ballon de 25 mL, on pèse 0,300 g du
composé de l'exemple 48 soit (léq. ; 1,04 mmol), 0,549 g (3
éq. ; 3,13 mmol) de Boc-Gly (Aldrich Co.), et 0,053 g de
AgNO3 (0,3 éq. ; 0,31 mmol). On additionne le mélange
25 acétonitrile : eau (rapport 7 :3), soit 7,0 mL de CH3CN et
3,0 mL d'H20 et la température du mélange est portée à
65 C. L'addition de 0,310 g de (NH4)S208 (1,3 éq. ; 1,36
mmol) dissout dans 5 mL d'un mélange CH3CN : H2O, se fait
pendant 2 heures. Le milieu réactionnel est alors maintenu
30 sous agitation pendant une heure à 65 C puis on extrait au
CH2Cla trois fois et on lave une seule fois avec H20 les
phases éthérées. On sèche les phases organiques sur MgSO4
et on évapore. Le produit est purifié par chromatographie
sur colonne avec comme éluant AcOEt : Cyclohexane (de 0:
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
71
100 à 30 : 70) et on obtient 0,292 g d'une huile orange
(Rdt= 67%).
Exemple 51 : Synthèse du 2-(N'-tert-butyloxycarbonyl-2-
aminométhyl)-3-(N'-tert-butyloxycarbonyl-2-aminoéthyl)-1,4-
naphtoquinone
0 Dans un ballon de 25 mL, on pèse 0,287 g
I~ I NHBoc du composé de l'exemple 48 soit (léq. ; 1-1 NHBoc 1,0 mmol), 0,568
g (3 éq. ; 3,0 mmol) de
,,{o 0 Boc-(3Ala (Aldrich Co.), et 0,051 g de
AgNO3 (0,3 éq.; 0,30 mmol). On additionne le mélange
acétonitrile : eau (rapport 7 :3), soit 5, 0 mL de CH3CN et
2,5 mL d'H20 et la température du mélange est portée à
65 C. L'addition de 0,297 g de (NH4 ) Sz08 (1,3 éq. ; 1,30
mmol) dissout dans 4,5 mL d'un mélange CH3CN : HZ0, se fait
pendant 2 heures. Le milieu réactionnel est alors maintenu
sous agitation pendant une heure à 65 C puis on extrait au
CHaCl2 trois fois et on lave une seule fois avec H2O les
phases éthérées. On sèche les phases organiques sur MgSO4
et on évapore. Le produit est purifié par chromatographie
sur colonne avec comme éluant AcOEt : Cyclohexane (de 10 :
90 à 70 : 30) et on obtient 0,330 g d'une huile orange
(Rdt= 76%).
Exemple 52 : Synthèse du 2,3-bis-(N'-tert-butyloxycarbonyl-
2-aminoéthyl)-1,4-naphtoquinone
O Méthode A : Dans un ballon de 100 mL, on
NHBoc pèse 0,475 g de 1,4-naphtoquinone (léq. ;
~/ 3,0 mmol), 1,703 g (3 éq. ; 9,0 mmol) de
3c O NHBoc Boc-(3Ala (Aldrich Co.), et 0,153 g de
AgNO3 (0,3 éq. ; 0,9 mmol). On additionne le mélange
acétonitrile : eau (rapport 7 :3), soit 20,0 mL de CH3CN et
10,0 mL* d'H20 et la température du mélange est portée à
65 C. L'addition de 0,890 g de (NH4)S208 (1,3 éq. ; 3,9
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
72
mmol) dissout dans 15 mL d'un mélange CH3CN : H2O1 se fait
pendant 2 heures. Le milieu réactionnel est alors maintenu
sous agitation pendant une heure à 65 C puis on extrait au
CH2ClZ trois fois et on lave une seule fois avec H20 les
phases éthérées. On sèche les phases organiques sur MgSO4
et on évapore. Le produit est purifié par chromatographie
sur colonne avec comme éluant AcOEt : Cyclohexane (de 0:
100 à 30 : 70) et on obtient 0,160 g d'une huile orange
(Rdt= 12%).
Méthode B : Dans un ballon de 25 mL, on pèse 0,300 g du
composé de l'exemple 49 soit (léq. ; 0,99 mmol), 0,565 g (3
éq. ; 2,99 mmol) de Boc-(3Ala (Aldrich Co.), et 0,051 g de
AgNO3 (0,3 éq. ; 0,30 mmol). On additionne le mélange
acétonitrile : eau (rapport 7 :3), soit 7,0 mL de CH3CN et
3,0 mL d'Hz0 et la température du mélange est portée à
65 C. L'addition de 0,295 g de (NH4)S208 (1,3 éq. ; 1,29
mmol) dissout dans 5 mL d'un mélange CH3CN : H20, se fait
pendant 2 heures. Le milieu réactionnel est alors mainteiiu
sous agitation pendant une heure à 65 C puis on extrait au
CHaClz trois fois et on lave une seule fois avec HzO les
phases éthérées. On sèche les phases organiques sur MgSO4
et on évapore. Le produit est purifié par chromatographie
sur colonne avec comme éluant AcOEt : Cyclohexane (de 0:
100 à 30 : 70) et on obtient 0,208 g d'une huile orange
(Rdt= 47%).
Exemple 53 : Synthèse du 2-(N'-tert-butyloxycarbonyl-3-
aminopropyl)-1,4-naphtoquinone
O Dans un ballon de 50 mL, on pèse 0,545
g de 1,4-naphtoquinone soit (léq. ;
NHBoc 3,45 mmol), 2,10 g de l'acide 1V-Boc-4-
O aminobutyrique soit (3 éq. ; 10,3
mmol), et 0,176 g de AgNO3 (0,3 éq.; 1,04 mmol). On
additionne le mélange acétonitrile : eau (rapport 7:3),
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
73
soit 16,0 mL de CH3CN et 8,0 mL d'H20 et la température du
mélange est portée à 65 C. L'addition de 1,020 g de
(NH4)S208 (1,3 éq. ; 4,47 mmol ) dissout dans 12,0 mL d'un
mélange CH3CN : H20, se fait pendant 2 heures. Le milieu
réactionnel est alors maintenu sous agitation pendant une
heure à 65 C puis on extrait au CH2Cla trois fois et on lave
une seule fois avec H20 les phases éthérées. On sèche les
phases organiques sur MgSO4 et on évapore. Le produit est
purifié par chromatographie sur colonne avec comme éluant
AcOEt : Cyclohexane (de 10 : 90 à 70 : 30) et on obtient
0,142 g d'une huile orange (Rdt= 13%).
Exemple 54 : Synthèse du 2-(N'-tert-butyloxycarbonyl-2-
aminoéthyl)-3-(N'-tert-butyloxycarbonyl-3-aminopropyl)-1,4-
naphtoquinone
A 0 Dans un ballon de 10 mL, on pèse 0,071 g
NHBoc du composé de l'exemple 53 soit (léq. ;
I/ I NHBoc 0,23 mmol), 0,128 g (3 éq. ; 0,68 mmol)
=O de Boc-(3Ala (Aldrich Co.), et 0,012 g de
AgNO3 (0,3 éq.; 0,071 mmol). On additionne le mélange
acétonitrile : eau (rapport 7 :3), soit 2, 0 mL de CH3CN et
1,0 mL d'Ha0 et la température du mélange est portée à
65 C. L'addition de 0,067 g de (NH4)S208 (1,3 éq. ; 0,29
mmol) dissout dans 1,5 mL d'un mélange CH3CN : H20, se fait
pendant 2 heures. Le milieu réactionnel est alors maintenu
sous agitation pendant une heure à 65 C puis on extrait au
CH2C12 trois fois et on lave une seule fois avec H20 les
phases éthérées. On sèche les phases organiques sur MgSO4
et on évapore. Le produit est purifié par chromatographie
sur colonne avec comme éluant AcOEt : Cyclohexane (de 10 :
90 à 70 : 30) et on obtient 0,045 g d'une huile orange
(Rdt= 43%).
Exemple 55 : Synthèse du chlorhydrate de 2-aminométhyl-1,4-
naphtoquinone
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
74
O Selon le protocole opératoire précédemment
I~ I décrit pour le composé de l'exemple 5,
NH3+C1' dans un ballon de 10 mL on introduit 0,100
O g du composé de l'exemple 48 (1 éq. ;
0,348 mmol), et on additionne 1 mL de CH2C12 et 1 mL de TFA
(dans un bain de glace). Lors de l'évaporation, on reprend
plusieurs fois le milieu dans du toluène puis le solide
brun obtenu est repris dans une solution d'HC1 1M dans EtZO
pendant 30 minutes. On évapore le solvant et on répète
l'opération avec la solution d'acide chlorhydrique dans
l'éther deux fois. Après évaporation et séchage, on
récupère 0.074 g d'un solide orangé (Rdt = 94%).
Exemple 56 : Synthèse du chlorhydrate de 2-aminoéthyl-1,4-
naphtoquinone
O Selon le protocole opératoire
précédemment décrit pour le composé de
NH3+CI- l'exemple 5, dans un ballon de 10 mL on
O introduit 0,100 g du composé de
l'exemple 49 (1 éq. ; 0,332 mmol), et on additionne 1 mL de
CH2Cla et 1 mL de TFA (dans un bain de glace). Lors de
l'évaporation, on reprend plusieurs fois le milieu dans du
toluène puis le solide brun obtenu est repris dans une
solution d'HCl 1M dans EtZO pendant 30 minutes. On évapore
le solvant et on répète l'opération avec la solution
d'acide chlorhydrique dans l'éther deux fois. Après
évaporation et séchage, on récupère 0.073 g d'un solide
orangé (Rdt = 92%).
Exemple 57 : Synthèse de sulfonamides
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
R2 O Ra O
R3 Rl R6-SOZCI R3 Ri
Bâ9C I I N O
/ /NH 2 R4 X ~S~
R4 X /~ \R
s
0
5
RS O
RZ 0 R 2 0
R3 R1 R 3 R 1
O
I I SH I I \\'"~s
R4 ~ X R4 ~ X~ \
0
R5 O R5 O
La liaison sulfonamide est intéressante car isostère de
l'amide.
5
Comme illustré ci-dessus, la formation de la liaison
sulfonamide, peut être réalisée en utilisant une
naphtoquinone fonctionnalisée sous la forme d'une amine
terminale (ou sous forme de sel d'ammonium) comme les
10 composés des exemples 5-6 ou 55-56, qui peut réagir avec un
chlorure de sulfonyle pour conduire à un sulfonamide.
On peut également envisager une liaison inverse dans
laquelle la naphtoquinone serait fonctionnalisée par un
15 thiol, lui-même provenant soit d'une fonction alcool (comme
les composés des exemples 46-47, soit d'une fonction amine.
Ce thiol peut être oxydé pour conduire à un acide
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
76
sulfonique, qui peut alors être activé sous la forme d'un
chlorure de sulfonyle avant de réagir avec une amine
convenablement fonctionnalisée.
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
77
Exemple 58 : Synthèse de liaisons amides rétro-inverso,
d'esters
RZ 0
R3 Rt
0
R2 O II I I I Rs
R60H ~ / ~~
Ra X
Rg , R1
O R5 0
~ III
R
O
a X~C~OH RZ
R5 O Rs R
R6NH2 O
II
X~ N
Ra H
RS 0
Parmi les isostères de la liaison amide, la liaison rétro-
inverso contient les mêmes groupes fonctionnels, et demeure
'donc très semblable à l'amide classique.
Le composé naphtoquinone est fonctionnalisé sous la forme
d'un acide carboxylique (comme dans les exemples 44 ou 45),
qui peut être activé selon la procédure décrite pour
l'exemple 7, puis être mis en présence d'une amine
convenablement fonctionnalisée, ou d'un acide aminé protégé
sur sa fonction carboxylique pour conduire à une amide
rétro-inverso. Par exemple, si cet acide aminé est une
alanine, dans le schéma ci-dessus R. est CH-CO2GP, où GP
est un groupe protecteur de la fonction acide carboxylique,
la liaison amide est inversée par rapport au composé de
l'exemple 7.
A partir des composés des exemples 44 ou 45, on peut selon
la même procédure décrite ci-dessus, réaliser des esters,
en faisant réagir l'acide carboxylique activé avec un
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
78
composé comportant une fonction alcool. R60H peut être la
chaîne latérale d'un acide aminé comme la Ser ou la Thr
dont les fonctions amine et acide carboxylique seraient
protégées, ou bien R. pourrait être du type CH-NHGP, et
serait donc un dérivé d'acide aminé préalablement réduit.
On peut également réaliser des carbonates à partir des
composés tels que ceux des exemples 46 ou 47, en utilisant
un alcool R6OH comme décrit précédemment, R. pourrait être
un dérivé d'acide aminé (ou autre chose), selon la formule
Naphtoquinone-espaceur-O-(CO)-O-R6.
On peut imaginer de réaliser des liaisons thioesters,
thioamides selon les procédés décrit ci-dessus.
Exemple 59 : Synthèse de thioamides et de thioesters
R2 0 RZ O
R3 R1 S R3 R,
I P
I 2 5
H
Ra X 1__~ N~~\ ~~/R6 Ra x .1_~ N yR6
RS 0 p R5 O S
Comme illustré ci-dessus, la formation de la liaison
thioamide, peut être réalisée par la transformation d'une
liaison amide (ou rétro-inverso amide) en présence de
pentasulfure de soufre. On peut également réaliser ce même
type de liaison selon d'autres procédés, par exemple en
générant un thioaldéhyde en présence d'une amine
convenablement substituée (un acide aminé protégé sur sa
fonction carboxylique, et sur sa chaîne latérale par
exemple).
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
79
R2 O R2 O
R3 R, R3 R,
1 P2S5 I X
/O R6 ou thiourée R4 I--, O Y"*6
R4 X
RS O O R5 O 8
On peut envisager la transformation d'une liaison ester
selon le même procédé ou bien en présence de thiourée. Dans
ce cas également, de nombreuses procédures différentes
existent, comme la réaction entre un alcool convenablement
substitué (qui peut être un dérivé d'acide aminé par
exemple) et un thioamide dans lequel le groupe amine (un
aromatique nitré par exemple) tient lieu de groupe partant
qui sera déplacé par l'alcool pré-cité.
Les diverses transformations chimiques permettant la
préparation de composés illustrés dans les exemples qui
précèdent apparaîtront à l'homme du métier à la lecture du
texte de la demande, et à la lumière de l'ensemble des
connaissances qui lui sont disponibles dans le domaine de
la chimie organique en général, et plus particulièrement
des transformations synthétiques, telles que répertoriées
dans de nombreux ouvrages de référence, comme par exemple:
1. "Advanced Organic Chemistry - Reactions, mechanisms and
structure", Jerry March, John Wiley & Sons, 5th edition,
2001;
2. "Comprehensive Organic Transformations, a guide to
functional group preparations", Richard C. Larock, VCH
publishers, 2nd edition, 1999 ;
3. Benzotriazole-Assisted Thioacylation Katritzky, A.
R.; Witek, R. M.; Rodriguez-Garcia, V.; Mohapatra, P. P.;
Rogers, J. W.; Cusido, J.; Abdel-Fattah, A. A. A.; Steel,
P. J., J. Org. Chem., 2005, 70(20):7866-7881.
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
Exemple 60: tests biologiques
Les tests biologiques d'activité (Sub-Gl) portent sur la
mesure de l'apoptose. Pour cela, un traceur fluorescent,
intercalant de l'ADN, permet de visualiser la fragmentation
5 de l'ADN. Cette fragmentation de l'ADN résulte de
l'induction du phénomène apoptotique dans les cellules. Les
cellules sont incubées en présence de différentes
concentrations des composés présentés ci-dessus. La mesure
de l'apoptose dans les cellules est suivie grâce à la
10 mesure de la fluorescence, permettant ainsi de déterminer
l'activité des composés en microMolaires (pM). Les tests
d'activités (Sub-Gi) de certains composés sont présentés
ci-dessous.
Composé Activité (sub-G1) M
1 Composé de l'exemple 17 13.3
2 Composé de l'exemple 18 11.8
3 Composé de l'exemple 19 12
4 Composé de l'exemple 20 12.2
Ces tests biologiques montrent que les composés répondant à
la formule (I) (entrées 1, 2, 3, 4) présentent une activité
pro-apoptotique.
Exemple 61: tests biologiques
Les activités sont mesurées par des tests multiplexés en
cytométrie en flux, par un couplage de la mesure de
l'apoptose et de la prolifération cellulaire. La mesure de
la prolifération cellulaire est réalisée grâce au suivi de
la dilution d'un traceur fluorescent spécifique au cours
des divisions cellulaires :
- les cellules sont incubées en présence de plusieurs
concentrations de composés, puis
CA 02650480 2008-10-22
WO 2007/125196 PCT/FR2007/000703
81
- les mesures d'apoptose et de prolifération cellulaire
sont effectuées simultanément par la technique de
cytométrie en flux ; des courbes de type dose / réponse de
l'action des composés sur l'apoptose et sur la
prolifération cellulaire sont obtenues.
il est donc possible de mettre en évidence l'action des
composés sur les phénomènes d'apoptose et de prolifération
cellulaire, et de déterminer l'activité des composés en
microMolaires (pM).
Les mesures des activités de certains composés sont
présentées ci-dessous.
Activité Activité
Composé (prolif. à 24h) (sub-G1)
M MM
5 Composé de l'exemple 22 11.5 22.8
6 Composé de l'exemple 23 11.1 12.1
7 Composé de l'exemple 25 6.5 13
8 Composé de l'exemple 26 12.3 11.8
Ces tests biologiques montrent clairement que les composés
répondant à la formule (I) (entrées 5, 6, 7, 8) présentent
une activité pro-apoptotique et antiproliférative.