Note: Descriptions are shown in the official language in which they were submitted.
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
1
DÉRIVÉS D'UREES DE PIPERIDINE OU PYRROLIDINE, LEUR PRÉPARATION
ET LEUR APPLICATION EN THÉRAPEUTIQUE
La présente invention se rapporte à des dérivés d'urée de pipéridine ou
pyrrolidine, à leur préparation et à leur application en thérapeutique. Les
présents
composés modulent l'activité de la 11 R-hydroxystéroïde déhydrogénase type 1
(11RHSD1) et sont utiles pour le traitement des pathologies dans lesquelles
une telle
modulation est bénéfique, comme dans le cas du syndrome métabolique ou du
diabète
de type 2 non insulino dépendant.
La 11 R-hydroxystéroïde déhydrogénase type 1 (11 RHSD1) catalyse localement la
conversion de glucocorticoïdes inactifs (cortisone chez l'homme) en
glucocorticoïdes
actifs (cortisol chez l'homme) dans différents tissus et organes,
principalement le foie et
le tissu adipeux, mais aussi dans les muscles, les os, le pancréas,
l'endothélium, le tissu
oculaire et dans certaines parties du système nerveux central. La 11 RHSD1
agit comme
un régulateur de l'action des glucocorticoïdes dans les tissus et organes où
elle est
exprimée (Tomiinson et al., Endocrine Reviews 25(5), 831-866 (2004), Davani et
al., J.
Biol. Chem. 275, 34841 (2000) ; Moisan et al., Endocrinology, 127, 1450 (1990)
).
Les pathologies les plus importantes dans lesquelles interviennent les
glucocorticoïdes et l'inhibition de la 11 PHSD1 sont indiquées ci-après.
A. Obésité, diabète de type 2 et syndrome métabolique
Le rôle de la 11 RHSD1 dans l'obésité, le diabète de type 2 et le syndrome
métabolique
(aussi connu sous le nom de syndrome X ou syndrome de résistance à l'insuline)
où les
symptômes incluent l'obésité viscérale, l'intolérance au glucose, la
résistance à
l'insuline, l'hypertension, le diabète de type 2 et l'hyperlipidémie (Reaven
Ann. Rev. Med
44, 121 (1993)) est décrit dans de nombreuses publications. Chez l'homme, le
traitement par la carbenoxolone (un inhibiteur non spécifique de la 11RHSD1)
améliore
la sensibilité à l'insuline chez des patients volontaires minces et chez des
diabétiques de
type 2 (Andrews et al., J. Clin. Endocrinoi. Metab. 88, 285 (2003)). De plus,
les souris
dont le gène de la 11 RHSD1 a été éteint sont résistantes à l'hyperglycémie
induite par le
stress et l'obésité, montrent une atténuation de l'induction d'enzymes
hépatiques de la
néoglucogenèse (PEPCK et G6P) et présentent une augmentation de la sensibilité
à
l'insuline dans le tissu adipeux (Kotelevstev et al., Proc. Nat Acad. Sci. 94,
14924
(1997) ; Morton et al., J. Biol. Chem. 276, 41293 (2001)). Par ailleurs, les
souris
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
2
transgéniques où le gène de la 11 RHSD1 a été surexprimé dans les tissus
adipeux
présentent un phénotype similaire à celui du syndrome métabolique humain
(Masuzaki
et al., Science 294, 2166 (2001)). Il est à noter que le phénotype observé
existe sans
une augmentation du total des glucocorticoïdes circulants, mais est induit par
l'augmentation spécifique de glucocorticoïdes actifs dans les dépôts adipeux.
Par ailleurs, de nouvelles classes d'inhibiteurs spécifiques de la 11 PHSD1
sont
apparues récemment :
- des arylsulfonamidothiazoles ont montré qu'ils amélioraient la sensibilité à
l'insuline et réduisaient le niveau de glucose dans le sang de souris
présentant
une hyperglycémie (Barf et al., J. Med. Chem. 45, 3813 (2002)). De plus, dans
une étude récente, il a été montré que ce type de composés réduisait la prise
de
nourriture ainsi que la prise de poids chez des souris obèses (Wang et Coll.
Diabetologia 49, 1333 (2006)).
- des triazoles ont montré qu'ils amélioraient le syndrome métabolique et
ralentissaient la progression de l'athérosclérose chez des souris (Hermanowski-
Vosatka
et al., J. Exp. Med. 202, 517 (2005)).
B. Cognition et démence
Les problèmes cognitifs légers sont des phénomènes communs chez les personnes
âgées et peuvent conduire finalement à la progression de la démence. Autant
dans le
cas d'animaux que d'humains âgés, les différences inter-individuelles pour les
fonctions
cognitives générales ont été reliées aux différences d'exposition à long terme
aux
glucocorticoïdes (Lupien et al., Nat. Neurosci. 1, 69, (1998)). Par ailleurs,
la dérégulation
de l'axe HPA (hypothalamo-hypophysio-surrénalien)) résultant dans l'exposition
chronique aux glucocorticoïdes de certaines sous-régions du cerveau a été
proposée
comme contribuant au déclin des fonctions cognitives (Mc Ewen et al., Curr.
Opin.
Neurobiol. 5, 205, 1995). La 11 PHSD1 est abondante dans le cerveau et est
exprimée
dans de nombreuses sous régions incluant l'hypothalamus, le cortex frontal et
le
cerebellum (Sandeep et al., Proc. Nati. Acad. Sci. 101, 6734 (2004)). Les
souris
déficientes en 11 PHSD1 sont protégées contre les dysfonctionnements de
l'hypothalamus associés aux glucocorticoïdes qui sont rattachés à la
vieillesse (Yau et
al., Proc. Nati. Acad. Sci. 98, 4716, (2001)). De plus, dans des études chez
l'homme, il a
été montré que l'administration de la carbenoxolone améliore la fluidité
verbale et la
mémoire verbale chez les personnes âgées (Yau et al., Proc. Nati. Acad. Sci.
98, 4716
(2001), Sandeep et al., Proc. Nati. Acad. Sci. 101, 6734 (2004)). Finalement,
l'utilisation
d'inhibiteurs sélectifs de la 11 RHSD1 de type triazole a montré qu'ils
prolongeaient la
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
3
rétention de la mémoire chez des souris âgées (Rocha et al., Abstract 231 ACS
meeting, Atlanta, 26-30 Mars 2006).
C. Pression intra-oculaire
Les glucocorticoïdes peuvent être utilisés par voies topique ou systémique
pour une
grande variété de pathologies de l'ophtalmologie clinique. Une complication
particulière
de ces traitements est le glaucome induit par l'utilisation de
corticostéroïdes. Cette
pathologie est caractérisée par l'augmentation de la pression intra-oculaire
(PIO). Dans
les cas les plus graves et pour les formes non traitées, la PIO peut conduire
à une perte
de champ de vision partielle et éventuellement à une perte totale de la
vision. La PIO
est le résultat d'un déséquilibre entre la production d'humeur aqueuse et son
drainage.
L'humeur aqueuse est produite dans les cellules épithéliales non-pigmentées et
le
drainage est réalisé au travers des cellules du réseau trabéculaire. La
11(3HSD1 est
localisée dans les cellules épithéliales non-pigmentées et sa fonction est
clairement
l'amplification de l'activité des glucocorticoïdes dans ces cellules (Stokes
et al., lnvest.
Ophthalmol. Vis. Sci. 41, 1629 (2000)). Cette notion est confirmée par
l'observation que
la concentration en cortisol libre est fortement excédentaire par rapport à la
cortisone
dans l'humeur aqueuse (ratio 14/1) . L'activité fonctionnelle de la 11RHSD1
dans les
yeux a été évaluée en étudiant l'action de la carbenoxolone chez des
volontaires sains.
Après sept jours de traitement à la carbenoxolone, la PIO est réduite de 18%
(Rauz et
al., Invest. Ophtamol. Vis. Sci. 42, 2037 (2001)). L'inhibition de la 11 RHSD1
dans les
yeux est donc prédite comme réduisant la concentration locale en
glucocorticoïdes et la
PIO, produisant un effet bénéfique dans le traitement du glaucome et d'autres
désordres
de la vision.
D. Hypertension
Les substances hypertensives issues des adipocytes comme la leptine et
l'angiotensinogène ont été proposées comme étant des éléments clés dans les
pathologies d'hypertension reliées à l'obésité (Wajchenberg et al., Endocr.
Rev. 21, 697
(2000)). La leptine qui est secrétée en excès chez les souris aP2-11 RHSD1
transgéniques (Masuzaki et al., J. Clinical lnvest. 112, 83 (2003)), peut
activer'différents
réseaux de systèmes neuronaux sympathiques, incluant ceux qui régulent la
pression
artérielle (Matsuzawa et al., Acad. Sci. 892, 146 (1999)). De plus, le système
rénine-
angiotensine (SRA) a été identifié comme étant une voie déterminante dans la
variation
de la pression artérielle. L'angiotensinogène, qui est produit dans le foie et
le tissu
adipeux, est un substrat-clé pour la rénine et est à l'origine de l'activation
du SRA. Le
niveau plasmatique en angiotensiogène est significativement élevé dans les
souris aP2-
11(3HSD1 transgéniques, comme le sont ceux de I'angiotensine Il et de
l'aldostérone
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
4
(Masuzaki et al., J. Clinical lnvest. 112, 83 (2003)) ; ces éléments
conduisent à
l'élévation de la pression artérielle. Le traitement de ces souris par de
faibles doses d'un
antagoniste dû récepteur de l'angiotensine Il abolit cette hypertension
(Masuzaki et al.,
J. Clinical lnvest. 112, 83 (2003)). Ces informations illustrent l'importance
de l'activation
locale des glucocorticoïdes dans le tissu adipeux et le foie, et suggère que
cette
hypertension puisse être causée ou exacerbée par l'activité de la 11 PHSD1
dans ces
tissus. L'inhibition de la 11 RHSD1 et la réduction du niveau de
glucocorticoïdes dans le
tissu adipeux et/ou dans le foie est donc prédit comme ayant un rôle bénéfique
pour le
traitement de l'hypertension et des pathologies cardiovasculaires associées.
E. Ostéoporose
Le développement du squelette et les fonctions osseuses sont aussi régulées
par
l'action des glucocorticoïdes. La 11(3HSD1 est présente dans les ostéociastes
et
ostéoblastes. Le traitement de volontaires sains par la carbenoxolone a montré
une
diminution des marqueurs de résorption osseuse sans changement dans les
marqueurs
de formation des os (Cooper et al., Bone, 27, 375 (2000)). L'inhibition de la
11 j3HSD1 et
la réduction du niveau de glucocorticoïdes dans les os pourraient donc être
utilisées
comme un mécanisme de protection dans le traitement de l'ostéoporose.
On a maintenant trouvé des dérivés d'urée de pipéridine ou pyrrolidine qui
modulent l'activité de la 11 PHSD1.
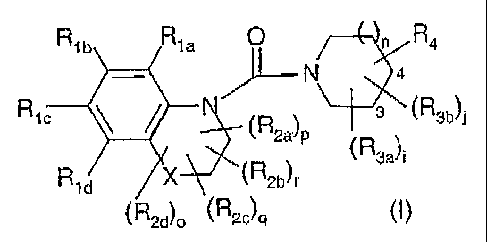
La présente invention a pour objet des composés répondant à la formule (I) :
R1b R1a 0 n R4
- ~-N 4
Rl7R N (R2a)p 3 (R3b)1
(R3a)i
/X(R2b)r
(R2d)u (R2c)q (~)
dans laquelle :
X représente soit un atome de carbone, d'oxygène, de soufre ou d'azote soit le
groupe
o\,S,,o
- Rla.b,c,d et R2a,b,c,d identiques ou différents, représentent chacun un
atome
d'hydrogène ou d'halogène, un groupe (C1-C5) alkyle, (C1-C5) alcoxy, (C1-
C5) halogénoalkyle, hydroxy, hydroxy- (C1-C5) alkyle, cyano, un groupe -COOR5,
c~.Vf11tIS 2101 ~~i,) îi-~
Printed:22/07/2008 DESCPAMD FR2007001069
CA 02652852 2008-11-19
un groupe -NR6R7, un groupe COOTt5-(CI-C5) alkyle, tui 9Vpüpc Np k7- (CI-CS)
alkyle, un
groupe -CONfi,iR7, un groupe CC~rCI~~I~~ (C~ Cs)alkyle, un groupe -S02NR(R7,
un groupU-
C0175, un groupe aryle ou hétéroaryle, aryl (Cl-Cs) alkyle, hétéroaryl (G~ C;)
slk}>le,
hétérocycloalkyl (Ci C;) all.~Yle, tous les groupes aryle, hétéroaryle pouvant
étre
5 ' éventuellenient s ubstitués par 1$~ s ubstituants clioisis parmi les
groupes eyano, COU1LS,
CGNP.rRy, SOzlts, (Ci-C5) alcoxy, . OCH4CC]rTR6R7 , un atome d'halogène, (CI-
Cs) btil.ogénoatkSrle et seul un groupe aryl (Ci-CS) alliylG peut.
6verltuelleit7ent ctre substitué
par un groupe hétéroaryle,
ou (.lt2:~) o u( R2a)' peuvent é galement iorzner avec l'atome de o arbone
auquel i ls s ont
rattachés un ÉToupe C 0, C=Cp'~,,
ou (1t2à etlau (R2b) peuvent égalenleat fonner aVeG IG oü les atomes
aux.qttels ils sont
rattachés un groupc (C}-Cô) cycloalkyle, ces cycles pouvant être spiro quand
ils sont
portés par le même atome de carbone et être éventuellement substitués par un â
trois
~ttomes d'halogènes,
ou (RIJ) et (R2pj peuvent également fonnir avec les atorrtes auxquGls ils sont
rattachcs un
groupe (Ca-C7) oycloalkyle ;
- les groupes R3s,b représentent chaiün, un atoine d'hydrogène, un atome de
fluor ou un groupe
(CI-CS) aLk.yle, (Cr-Cs) alcoxy, alcoxy- (Ci-C$) alkyle, hydroxy, hydroky- (CI-
C.s) alkyle, (Ci-
CS) hslogénoalk_y1e, c yano, u n g roupe -COOI?.S, u n L; roupe -NRGR7, un g
roupe COORj-(Cr-
CS) alkyle, un groupe NRup.7-(C,-Cs) alkyle, un groupe -CONIL6R?, un groupe
CON=17,UR7-( C1-
C;) alkyle,
- R4 représerlte ~
o un groupe (C i-CS) alkyle 7
o un groupe (C~-Cd) cycloalkyle ;
o un groupe hétérocycloalkyle, o un groupe arVle mono- ou bi-cyclique ayant de
5 à 10 atomes de carbone ;
o un groupe hétéroaryle mono o*u bicyclique ayant di, 2 à 9 atomes de cafbone
;
quand R..t est un grnupe uryle ou hétéroaryle ou hétérocycloalkylc, il peut
éta-c éventuellement
substitué par 1à 4 sübstituants choisis parmi les atarnes d'halo(;éne, les
groupes (CI-C5)
alkyle, (C1-CS) alcoxy, (CI-Ci) halpgénoalkyle, hydroxy, hydrox_y-(Ci-C5)
aikyle, (CI-C5)
alco"~sr-(C]-C5) alkyle, cyano, phényle uventuelIernent substitué, benzyle
éventuellement
substitué, -- COORs, NPel`.7, wi groupe COORS- (Cj-C5) alkyle, un ,groupe
NR6);.7-=(C,-
Ci) a11C.ylea un groupe -CONR6R7, un groupe - SC12Nl'~{R7a
i 1 ved atthe EPO on Apr 24, 2008 09:29:54. Pa AMENDED SHEET 24/04/2008
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
6
- où R3a,b et R4 sont, soit portés par des atomes de carbone différents, soit
portés
par un même atome de carbone et, lorsqu'ils sont portés par le même atome de
carbone, peuvent former ensemble un cycle en position spiro, en particulier un
cycle de formules a), b), c) ou d)
O R8
)t )t
Y
Rzse s s
R8
R$ R8 >0
a) b) c) d)
dans lesquelles :
- la liaison en pointillés est une liaison simple ou une liaison double ;
- s est un nombre entier égal à 0, 1, 2 ou 3;
- t est un nombre entier égal à 0, 1, 2 ou 3, s et t ne pouvant pas être
égaux en même temps à 0;
- R8 représente un atome d'hydrogène ou d'halogène, un groupe (C1-C5)
alkyle, (C1-C5) alcoxy, trifluorométhyle, hydroxy, hydroxyméthyle, cyano,
un groupe -COOR5, un groupe -NR6R, ;
- R9 représente un atome d'hydrogène ou un groupe (C1-C5) alkyle,
hyd roxy ;
- Y représente une liaison ou un atome de carbone ou d'azote ;
- n est un nombre entier égal à 0 ou 1
- o, p, q et r, identiques ou différents, sont des nombres entiers égaux à 0,
1 ou 2;
- i et j sont des nombres entiers égaux à 0, 1, 2, 3 ou 4;
- R5 représente un atome d'hydrogène, un groupe (C,-C5) alkyle, un groupe (C3-
C6)
cycloalkyle, halogéno(C,-C5)alkyle.
- Rs et R7, identiques ou différents, représentent chacun un atome
d'hydrogène, un
groupe (C1-C5) alkyle, un groupe (C3-C6) cycloalkyle, (C1-C5) alkylcarbonyle,
hydroxyméthyl (C1-C5) alkyle, (C,-C5)alcoxyméthyl (C1-C5) alkyle, un groupe
aryle,
un groupe hétérocycloalkyle éventuellement substitué, un groupe -SO2R5 ou
peuvent former ensemble avec l'atome d'azote auquel ils sont rattachés un
hétérocycloalkyle éventuellement substitué,
étant entendu que lorsque X=CH2, n=0, R,a,b,,,a=H, R2a,b,c,d= H, R3a,b=H alors
le groupe R4
doit être différent de phényl éventuellement substitué par un atome d'halogène
ou un
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
7
groupe (C,-C5)alkyle, trifluorométhyle, (C,-C5)alcoxy.
Les composés de formule (I) peuvent comporter un ou plusieurs atomes de
carbone asymétriques. Ils peuvent donc exister sous forme d'énantiomères ou de
diastéréoisomères. Ces énantiomères, diastéréoisomères, ainsi que leurs
mélanges, y
compris les mélanges racémiques, font partie de l'invention.
Les composés de formule (I) peuvent exister à l'état de bases ou salifiés par
des
acides ou des bases, notamment des acides ou des bases pharmaceutiquement
acceptables. De tels sels d'addition font partie de l'invention.
Ces sels sont avantageusement préparés avec des acides pharmaceutiquement
acceptables, mais les sels d'autres acides utiles, par exemple, pour la
purification ou
l'isolement des composés de formule (I), font également partie de l'invention.
Les composés de formule (I) peuvent également exister sous forme d'hydrates
ou de solvats, à savoir sous forme d'associations ou de combinaisons avec une
ou
plusieurs molécules d'eau ou avec d'un solvant. De tels hydrates et solvats
font
également partie de l'invention.
Dans le cadre de la présente invention, et sauf mention différente dans le
texte,
on entend par :
- atome d'halogène : un fluor, un chlore, un brome ou un iode ;
- un groupe (C1-C5) alkyle : un groupe aliphatique saturé linéaire ou ramifié
ayant de 1 à 5 atomes de carbone successifs. A titre d'exemples, on peut citer
les
groupes méthyle, éthyle, propyle, isopropyle, butyle, isobutyle, tertbutyle,
pentyle, etc ;
- un groupe (C3-Cs) cycloalkyle : un groupe alkyle cyclique ayant de 3 à 6
atomes de carbone. A titre d'exemples, on peut citer les groupes cyclopropyle,
méthylcyclopropyle, cyclobutyle, cyclopentyle, cyclohexyle, etc ;
- un groupe (C1-C5) alcoxy : un radical -O-(C1-C5) alkyle où le groupe (C1-C5)
alkyle est tel que précédemment défini ;
- un groupe aryle : un groupe aromatique mono ou bicyclique comprenant entre
5 à 10 atomes de carbone. A titre d'exemples de groupes aryles, on peut citer
le groupe
phényle, le groupe thiophène, le groupe furane ou le groupe naphtalène ;
- un groupe hétéroaryle : un groupe aromatique mono ou bicyclique
comprenant entre 5 et 9 atomes de carbone et comprenant entre 1 et 3
hétéroatomes,
tels que l'azote, l'oxygène ou le soufre. A titre d'exemples de groupes
hétéroaryles, on
peut citer les groupes :
- pyridine
- pyrazine
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
8
- pyrimidine
- pyrazole
- oxadiazole
- thiazole
- imidazole ;
- un groupe (C1-C5) halogénoalkyle : un groupe (C1-C5) alkyle tel que défini
ci-
dessus substitué par 1 à 5 atomes d'halogène. On citera par exemple les
groupes
fluorométhyle, difluorométhyle, trifluorométhyle, trichlorométhyle ou encore
pentafluoroéthyle ;
- un groupe hétérocycloalkyle : un cycle éventuellement fusionné ou ponté
comportant de 4 à 9 atomes dont un au moins est choisi parmi les atomes
d'oxygène,
d'azote ou de soufre. A titre d'exemples, on peut citer les groupes
morpholine,
pipéridine, pyrrolidine, pipérazine ;
- un groupe " phényle éventuellement substitué ", " benzyle éventuellement
substitué ": un groupe phényle ou benzyle qui est éventuellement substitué par
un ou
plusieurs des groupes ci-après : les atomes d'halogène, les groupes (C1-C5)
alkyle,
(C1-C5) alcoxy, (C1-C5) halogénoalkyle, hydroxy, hydroxy-(C1-C5) alkyle, (C1-
C5)
alcoxy-(C1-C5) alkyle, cyano, phényle, benzyle, -COOR5, -NRsR7, -COOR5-(C,-C5)
alkyle, NR6R7-(C1-C5) alkyle, -CONR6R7, -SO2NR6R7, CONR6R7(C,-C5)alkyle,
- R,a,b,c,a désigne les groupes R,a, R,b, R,c et R,d ; R2a,b,c,d désigne les
groupes
R2a, R2b, R2c et RZa ; R3a,b désigne les groupes R3a, R3b,
-(R2a)P désigne un nombre p de groupes R2a portés par un même atome ou par
des atomes différents, (R2b), désigne un nombre r de groupes R2b portés par un
même
atome ou par des atomes différents, (R2c)q désigne un nombre q de groupes R2C
portés
par un même atome ou par des atomes différents, (R2d)o désigne un nombre o de
groupes R2d portés par un même atome ou par des atomes différents, (R3a);
désigne un
nombre i de groupes R3a portés par un même atome ou par des atomes différents,
(R3b)i
désigne un nombre j de groupes R3b portés par un même atome ou par des atomes
différents,
- un groupe de type groupement fonctionnel-(C,-C5) alkyle tel que alcoxy-
(C,-C5) alkyle, hydroxy- (C1-C5) alkyle, COOR5-(C,-C5) alkyle, NR6R7-(C1-C5)
aikyle ou
CONR6R7(C,-C5)alkyle ou aryl (C1-C5) alkyle, hétéroaryl (C1-C5) alkyle,
hétérocycloalkyl-
(C,-C5) alkyle désigne un groupe possédant un groupe alkylène linéaire ou
ramifié ayant
de 1 à 5 atomes de carbone successifs soit, respectivement -(CH2)k-(Cl-
C5)alcoxy, -
(CH2)k-OH, -(CH2)k-COOR5, -(CH2)k-COOR5, -(CH2)k-NR6R7, -(CH2)k-CONR6R7, -
(CH2)k-
aryle, -(CH2)k-hétéroaryle, -(CH2)k-hétérocycloalkyle avec k est un nombre
entier de 1 à
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
9
5.
Parmi les composés de formule (I) selon l'invention, on peut citer les
composés
pour lesquels :
X représente soit un atome de carbone, d'oxygène, de soufre ou d'azote soit le
groupe
o\,S,,o
- Ria,b,c,a et R2a,b,c,d identiques ou différents, représentent chacun un
atome
d'hydrogène ou d'halogène, un groupe (C,-C5) alkyle, (C,-C5) alcoxy, (C1-
C5) halogénoalkyle, hydroxy, hydroxy- (C1-C5) alkyle, cyano, un groupe -COOR5,
un groupe -NR6R7, un groupe -COOR5-(C,-C5) alkyle, un groupe -NR6R,- (C1-
C5) alkyle, un groupe -CONR6R7, un groupe -CONR6R7-(C,-C5)alkyle, un groupe -
SO2NR6R,, un groupe -COR5,un groupe aryle ou hétéroaryle, aryl (C1-C5) alkyle,
hétéroaryl (C1-C5) alkyle, hétérocycloalkyl-(C,-C5) alkyle, tous les groupes
aryle,
hétéroaryle pouvant être éventuellement substitués par les groupes cyano,
COOR5, CONR6R7,
ou (R2a) ou (R2b) peuvent également former avec l'atome de carbone auquel
ils sont rattachés un groupe C=O,
ou (R2a) et/ou (R2b) peuvent également former avec le ou les atomes
auxquels ils sont rattachés un groupe (C3-C6) cycloalkyle, ces cycles
pouvant être spiro quand ils sont portés par le même atome de carbone,
ou (Rld) et (R2a) peuvent également former avec les atomes auxquels ils sont
rattachés un groupe (C3-C7) cycloalkyle ;
- les groupes R3a,b représentent chacun, un atome d'hydrogène, un atome de
fluor
ou un groupe (C1-C5) alkyle, (C1-C5) alcoxy, alcoxy- (C1-C5) alkyle, hydroxy,
hydroxy- (C1-C5) alkyle, (C1-C5) halogénoalkyle, cyano, un groupe -COOR5, un
groupe -NR6R7, ùn groupe -COOR5 -(C1-C5) alkyle, un groupe -NR6R7-(C,-C5)
alkyle, un groupe -CONR6R,, un groupe -CONR6R7-( C1-C5) alkyle,
- R4 représente :
o un groupe (C1-C5) alkyle ;
o un groupe (C3-C6) cycloalkyle ;
o un groupe aryle mono- ou bi-cyclique ayant de 5 à 10 atomes de
carbone ;
o un groupe hétéroaryle mono ou bicyclique ayant de 2 à 9 atomes de
carbone ;
2u san~?i a.ventis N" 21~)1
Printed:22/07/2008 DESCPAMD FR2007001069
1 c-
qusnd Rd est un group'e. aryle au hétéroaryle, il peut être éventuellement
substitué par 1 à 4
substituenYg QhoiSiS pdfi111 les fltoYnes 4'11i.ilogCne, les groupe.s (Cl-CS)
alkyle, (C1-CS) alcoxy,
(Ci-C:S) halogénoalkylc;, hydroxy, hydroxy-(Ci-Cs) alkyle, (Ci-CS) alcoxy-(Ct-
C5) alkyle,
cyano, phényle éveituelleinent substitué, benzyle éventuellement substituè, -
CQQ.Its, -
NRGR,, un groupe CUOR5- (Ci-CS) a1k.yle, un groupe NR6R7-(C1-Cs) Alkyde, un
groupe -
Cf,l1VR6R?, Ym groupe - 802NR.tsR7,
- où R35G et R4 sont, soit portes par des a.tonles de carbone différents, soit
portés par un rnêine
atome (lG Cfarbbne et, lorsqu'ils sont portés par le méme atQrr-e de carbone,
peuvent forner
ensemble uti cycle en positioir spiro, en particulier un cycle de formules a),
b), a) ou d)
R8
Rlâ
t t
R8
R5 R$ ~z
b) c) ti)
dans lesquclles ;
- la liaison en pointillés est une liaison silnple ou une liaison double. ;
- s est un nombre entier ëgal à U, 1, 2 ou 3 â
- t est un nombre entier éga1 à 0, 1, 2 ou 3, s et t ne potxvant pas être
égaux en inême
temps à 0 ;
- Rb représente ui3 atome d'hydrogène ou d'halogêne, un groupe (C~-Cs) alkyle,
(CI-C'S)
aleo,xy, ttifltroroinéthyle, hydroxy, hydroxyrnéthyle, cyano, un groupe -
CO0Tt5, un
groupe -NR..~,R7;
- Fts represente un atome= d'hydrogène ou un groupe (Ci-Cs) alkyle, hydroxy;
- Y reprC=sente une liaison ou un atome de carbone ou d'aaote ;
- n est un nontbrc entier égal à 0 au 1 7
- o, p, q et r, identiques ou diffzrents, sont des nombres entiers égaux à 0,
], ou 2;
i et j sont des notnbres entit:rs égai7x â 0, 1, :, 3 ou 4;
- R5 YepréSente un atoine d'hydi'ogène, un groupe (CI-Cs) alkyle, un groupe
cyeloal~yle ;
- RG et R7, identiques ou différents, représentent chacun un atome
d'hydrogène, un
CA 02652852 2008-11-19
2 ved atthe EPO on Apr 24, 2008 09:29:54. Pa=AMENDED SHEET 24/04/2008
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
11
groupe (C1-C5) alkyle, un groupe (C3-C6) cycloalkyle, (C1-C5) alkylcarbonyle,
hydroxyméthyl (C1-C5) alkyle, (C,-C5)alcoxyméthyl (C1-C5) alkyle, un groupe
aryle,
un groupe -S02R5 ou peuvent former ensemble avec l'atome d'azote auquel ils
sont rattachés un hétérocycloalkyle,
étant entendu que lorsque X=CH2, n=0, R,a,b,c,a=H, R2a,b,c,d= H, Rsa,n=H alors
le groupe R4
doit être différent de phényl éventuellement substitué par un atome d'halogène
ou un
groupe (C,-C5)alkyle, trifluorométhyle, (C,-C5)alcoxy.
Parmi les composés de formule (I) selon l'invention, on peut citer les
composés
pour lesquels :
X représente soit un atome de carbone, d'oxygène, de soufre ou d'azote ;
- R,a,b,c,d et R2a,b,c,d identiques ou différents, représentent chacun un
atome
d'hydrogène ou d'halogène, un groupe (C1-C5) alkyle, (C1-C5) alcoxy, (C,-
C5) halogénoalkyle, hydroxy, un groupe -COOR5, un groupe -CONR6R,, un
groupe -SO2NR6R,, un groupe -COR5 un groupe aryle ou hétéroaryle, aryl (C1-
C5) alkyle, hétéroaryl (C1-C5) alkyle, hétérocycloalkyl-(C,-C5) alkyle, tous
les
groupes aryle, hétéroaryle pouvant être éventuellement substitués par 1 à 3
substituants choisis parmi les groupes cyano, COOR5, CONR6R7, S02R5, (C,-
C5) alcoxy, OCH2CONR6R,, un atome d'halogène, (C1-C5) halogénoalkyle et seul
un groupe aryl (C1-C5) alkyle peut éventuellement être substitué par un groupe
hétéroaryle,
ou (R2a) ou (R2b) peuvent également former avec l'atome de carbone auquel
ils sont rattachés un groupe C=O, C=CF2,
ou (R2a) et/ou (R2b) peuvent également former avec le ou les atomes
auxquels ils sont rattachés un groupe (C3-C6) cycloalkyle, ces cycles
pouvant être spiro quand ils sont portés par le même atome de carbone et
être éventuellement substitués par un à trois atomes d'halogènes,
- les groupes R3a,b représentent chacun, un atome d'hydrogène, hydroxy, cyano,
- R4 représente :
o un groupe (C1-C5) alkyle ;
o un groupe (C3-C6) cycloalkyle ;
o un groupe hétérocycloalkyle
o un groupe aryle monocyclique ayant de 5 à 6 atomes de carbone ;
o un groupe hétéroaryle monocyclique ayant de 2 à 5 atomes de carbone ;
quand R4 est un groupe aryle ou hétéroaryle ou hétérocycloalkyle, il peut être
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
12
éventuellement substitué par 1 à 4 substituants choisis parmi les atomes
d'halogène, les groupes (C1-C5) alkyle, (C1-C5) alcoxy, (C1-C5)
halogénoalkyle,
hydroxy, cyano, phényle éventuellement substitué, benzyle, - COORSi un
groupe -CONR6R7,
- où R3a,b et R4 sont, soit portés par des atomes de carbone différents, soit
portés
par un même atome de carbone et, lorsqu'ils sont portés par le même atome de
carbone, peuvent former ensemble un cycle en position spiro, en particulier un
cycle de formules a), b), c) ou d) :
O R$
~ t )t
Rze s s
R$
Ra R8 >0
a) b) c) d)
dans lesquelles :
- la liaison en pointillés est une liaison simple ou une liaison double ;
- s est un nombre entier égal à 0, 1;
- t est un nombre entier égal à 0, 1, s et t ne pouvant pas être égaux en
même temps à 0;
- R8 représente un atome d'hydrogène ou un groupe hydroxy;
- R9 représente un atome d'hydrogène ou un groupe (C1-C5) alkyle ;
- Y représente une liaison ou un atome de carbone ou d'azote ;
- n est un nombre entier égal à 0 ou 1;
- o, p, q et r, identiques ou différents, sont des nombres entiers égaux à 0
ou 1
- i et j sont des nombres entiers égaux à 0 ou 1;
- R5 représente un atome d'hydrogène, un groupe (C1-C5) alkyle, un groupe (C3-
C6)
cycloalkyle, halogéno(C,-C5)alkyle, phényle éventuellement substitué ;
- R6 et R7, identiques ou différents, représentent chacun un atome
d'hydrogène, un
groupe (C1-C5) alkyle, un groupe (C3-C6) cycloalkyle, un groupe
hétérocycloalkyle
éventuellement substitué ou peuvent former ensemble avec l'atome d'azote
auquel ils sont rattachés un hétérocycloalkyle éventuellement substitué,
étant entendu que lorsque X=CH2, n=0, R,a,b,c,d=H, R2a,b,c,a= H, Raa,b=H alors
le groupe R4
doit être différent d'un groupe phényle éventuellement substitué par un atome
d'halogène ou un groupe (C,-C5)alkyle, trifluorométhyle, (C,-C5)alcoxy.
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
13
Parmi les composés de formule (I) selon l'invention, on peut citer les
composés
de formule (la) dans laquelle :
- X représente soit un atome de carbone, d'oxygène, de soufre ou d'azote soit
le
o\,,,o
groupe S
- Ria,b,c,d et R2a,b,c,a identiques ou différents, représentent chacun un
atome
d'hydrogène ou d'halogène, un groupe (C1-C5) alkyle, (C1-C5) alcoxy, (C1-
C5) halogénoalkyle, hydroxy, hydroxy- (C1-C5) alkyle, cyano, un groupe -COOR5,
un groupe -NR6R,, un groupe COOR5-(C,-C5) alkyle, un groupe NR6R,- (C,-
C5) alkyle, un groupe -CONR6R,, un groupe CONR6R,-(C,-C5)alkyle, un groupe -
SO2NR6R7, un groupe -COR5 un groupe aryle ou hétéroaryle, aryl (C1-C5) alkyle,
hétéroaryl (C1-C5) alkyle, hétérocycloalkyl-(C,-C5) alkyle, tous les groupes
aryle,
hétéroaryle pouvant être éventuellement substitués par 1 à 3 substituants
choisis
parmi les groupes cyano, COOR5, CONR6R7, S02R5, (C1-C5) alcoxy,
OCH2CONR6R7, un atome d'halogène, (C1-C5) halogénoalkyle et seul un groupe
aryl (C1-C5) alkyle peut éventuellement être substitué par un groupe
hétéroaryle,
ou (R2a) ou (R2b) peuvent également former avec l'atome de carbone auquel
ils sont rattachés un groupe C=O, C=CF2,
ou (R2a) et/ou (R2b) peuvent également former avec le ou les atomes
auxquels ils sont rattachés un groupe (C3-C6) cycloalkyle, ces cycles
pouvant être spiro quand ils sont portés par le même atome de carbone et
être éventuellement substitués par un à trois atomes d'halogènes,
ou (Rld) et (R2a) peuvent également former avec les atomes auxquels ils sont
rattachés un groupe (C3-C7) cycloalkyle ;
- les groupes R3a,b représentent chacun, un atome.d'hydrogène, un atome de
fluor
ou un groupe (C1-C5) alkyle, (C1-C5) alcoxy, alcoxy- (C1-C5) alkyle, hydroxy,
hydroxy- (C1-C5) alkyle, (C1-C5) halogénoalkyle, cyano, un groupe -COOR5, un
groupe -NR6R7, un groupe COOR5-(C,-C5) alkyle, un groupe NR6R7-(C,-C5)
alkyle, un groupe -CONR6R,, un groupe CONRsR,-( C1-C5) alkyle,
- R4 représente :
o un groupe (C1-C5) alkyle ;
o un groupe (C3-C6) cycloalkyle ;
o un groupe hétérocycloalkyle,
o un groupe aryle mono- ou bi-cyclique ayant de 5 à 10 atomes de
carbone ;
o un groupe hétéroaryle mono ou bicyclique ayant de 2 à 9 atomes de
~~ ~ ~!nr~h n;26 sanoTi aventi~ N 2101
P rinted: 22/07/2008 DESC PAM D FR2007001069
~ . .
CA 02652852 2008-11-19
14
ctubone ;
quand R4 est un groupe aiyle ou hétéroaryle ou hétérocyuloa.tkyle, il peut
être é'ventuClleme t
substitué par 1 à 4 substituants choisis pArnli les atoines d'halogène, les
groupes (C!-C5)
alkyle, (Ci-CS) alcoxy, (C,-C5) halogénoalkyle, hydroxy, hydroxy-(C,-CS)
alkYle, (C1-Cs)
alcoxy-(C,-C5) alkyle, oyano, pYrcnyle éventuelle.ment substitué, benzyle
éventuellement
suhstitué, - CooRS, un groupe CUOh.;-(C1-C5) alk:yle, un groupe N'RGfi?-(C,-
Cf,) alltyle, uu groupe -CONR6R,, un groape - SO2NTtcR'7,
1Z3e,r et R4a0nt pprtés par des atonles de carbone différents
- 11 est un nombre entier égal à 0(7u 1;
- o, p, q et r, identiques ou différents, sont des nomfires éntiers égaux à U,
1 ou 2;
- i et j sont des nomlares entiers égaux à 0, 1, 2, 3 ou 4;
- If,.s repr6sernteun atoine d'hydrogène, un groupe (Ci-C$) alkyle, un -groupo
(Q%-C6) Cs+cloall~yle,
llalobéno(Cr-t.5)alkylc, phézlyle ~ventuellement substitué ;
- R6 et. R7, identiques ou différents, représent4nt chaCUn uzr atome
d'hydrogëne, un groupe (C,-
CS) a.lkyle, un g;=oupe (C3-Cé) cycloalkyle, (C1-C5) a l1ÇylCerboily1c,
liy'droxvyinéthyl (Cl-Cs)
alkyle, (Ci-C5)aleox.ymétliyl (C,-CS) alkyle, un groupe aryle, LIrJ grbüper
hétéroCyCloSlkyle
(pour SARI 10239) éventuellement substitué, un groupe -SO2115 ou peuvent
former ensemble
avec 1.'aXarne d'azote auquel ils sont rattachés un hétérocycloaikyle
éventuellement substitué,
étant entcnciu que lorsque lt=CH2i n=Q, Rts,h,.,d=H, Rze,b,C.,ti= H, R3ià,b=H
alors le groupe R4 doit
étre différent de phényl ëventuellement substitué par un atome d'halogène ou
un groupe
(C1-Cs)alkyle, trifiuorométhyle, (Cy-C5)alcoxy_
T'ai711i les con-posés de formule (1) selon l'invention, on peut citer les
composés de formule
(YU) dans laquGlte :
X reprr`.,6nte soitaun atome dé carbone, d'a~:j>gGne, de soufre ou d'azote
soit le groupe
f
- Rle,b,c.d et R2s,b,c,d identiques ou différerits, représentent chacun un
atome
d'hydrogène ou d'halogène, un groupe alkyle, alcoxy, (Cl-
C5) halogénonikyle, hydroxy, hydroxy- (Cr-Gs) alkyle, cyano, un groupe -COORs,
un
groupe -NR6R7, un groupe COORs-(Cl-Cs) aikyle, un groupe NRcR7- (C~-C5)
alkyle,
un groupe -CONR6R7, un groupe CONRsR7-(C,-C5)afkyle, un groupe -S02NRgR7i un
groupe -CORs un groupe aryle ou hétéroaryle, ary! (G,-C$) alkyle,
3 ved at the EPO on Apr 24, 2008 09:29:54_ Pa AMENDED SHEET 24/04/2008
n,27 sa fi avent11~ PJ 21Q1
Printed: 22/07/2008 DESCPAMD FR2007001069
hété'roaryl (Ci-Cs) alkyle, hëtérocycloallcyl-(Ci-CS) alkyle, tous les groupes
aryle, hétéroaryle
pouvant ëtre éventuellement substitués par 1 à 3 sub'stituants choisis parmi
les groupes cyano, .
COOI1..5, CONP.6R,, S4,Rs, (C1-CS) alcoxy, OCH2CONRGR,, un atomc d'halogcne,
(C1-
CS) ha) agénqalkyle et seul tui groupe aryl (C,-Cs) alkyle peut
é~~entuclleinent ~trc sub5titüG par
5 un groupe hétéroaryle,
ou (I2.20 a u( 112b) peuvent é galement f ormer aVec l'atoMe dt c gtrbonc
sucluel i ls s ont
rattachés un groupe C=O, C=CF-,,
ou (1~,à et/ou (R2a) peuvent égalemrnt former avec le ou les etomes au!cr~uels
ils sont
rzttacfiés un grqupe (C3-Cs) c~rcloalkyle, ces cycles pou~rarit êttc spiro
quand ils sont
10 portés par le niàne atome de carbone et être éventuelleanent subsCitucs par
un à trois
atomes d'halogènes,
ou (R.,,,) et (R:2,,) peuvent également foniier avec les atomes auxquels ils
sont rattachés un
graupe (C3-C7) cycloalkyle à
- les gCOupes R3,,~r rc:prêsentent chacun, un atome d'hydrogcno, un atome de
fluor ou un groupe
i5 (C1-CS) ali,.yle, (CI-Cj) alcoxy, alcoxy- (C1-C5) alkyle, hydroxy, hydroxy-
(C,-C5) alk.yle, (C,-
C5) ha logénoalkyle, c yano, u n g roupe -COORS, un groupe NR,,R,, un g roupe
COOR<-(Ci-
C5) alkyle, un 8xoupe N116R7-(C,-Cs) alkyle, un groupe -CONP4R7, un groupe
CORTR6Pty-( C1-
CS) aikyle,
- R4 représente
o un groupe (Q-C5) alkyle ;
o un ge=oupe (C}-C6) cycloallcyle ;
ô un groupe hétérocycloalkyle
o un gtoupe aryle mono- ou bi-cyclique ayant de 5 à 10 atomes de earbone ;
ô un groupe hétéroaryle mono ou bicyeliquc: a,'yant do 2 à 9 atomes dcs
oarbone ;
quand R4 est Lur groupe atyle ou hétéroaryle ou hétérocyclon.lkyle, il
péut=être éventuellement
substitué par 1à 4 gubstituants choisis parnù les atoines d'halog;ène, les
groupes (Cr-C3)
alkyle, (CI-Cs) atcorty, (CI-C5) halogénoall.~rle, hydroxv, ~iqdtoxy-(C,-CS}
alkyle, (C,-Cs)
,alcax.y-(C,-Cs) alkyle, cyano, phényle éventuellemént substitué, benzyle
éventuellement
sübstitué,.- COORs, NR6I1.7, un groupe COO12.5- (C,-CS) alkyle, un groupe
NRsR7-(Ci-
C,) alkyIe, un gtoupe -CONR6R,, un groupe - SO,~NR.6R7,
- R*;,e et R,} sont portés par le méme atome cle carbone, mais nc forment pas
tyn groupe spiro ;
n est un nombrG entier é=ga] à 0 oU.1 ;
CA 02652852 2008-11-19
~ ved at the EPO on Apr 24,2008 09:29:54. Pa AMENDED SHEET 24/04/2008
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
16
- o, p, q et r, identiques ou différents, sont des nombres entiers égaux à 0,
1 ou 2;
- i et j sont des nombres entiers égaux à 0, 1, 2, 3 ou 4;
- R5 représente un atome d'hydrogène, un groupe (C1-C5) alkyle, un groupe (C3-
C6)
cycloalkyle, halogéno(C,-C5)alkyle, phényle éventuellement substitué ;
- R6 et R7, identiques ou différents, représentent chacun un atome
d'hydrogène, un
groupe (C1-C5) alkyle, un groupe (C3-C6) cycloalkyle, (C1-C5) alkylcarbonyle,
hydroxyméthyl (C1-C5) alkyle, (C,-C5)alcoxyméthyl (C1-C5) alkyle, un groupe
aryle,
un groupe hétérocycloalkyle éventuellement substitué, un groupe -S02R5 ou
peuvent former ensemble avec l'atome d'azote auquel ils sont rattachés un
hétérocycloalkyle,
étant entendu que lorsque X=CH2, n=0, R,a,b,,:,a=H, R2a,b,c,a= H, Rsa,b=H
alors le groupe R4
doit être différent d'un groupe phényle éventuellement substitué par un atome
d'halogène ou un groupe (C,-C5)alkyle, trifluorométhyle, (C,-C5)alcoxy.
Parmi les composés de formule (I), (la) ou (Ib) selon l'invention, on peut
citer les
composés dans lesquels :
- X représente soit un atome de carbone, d'oxygène, de soufre ou d'azote ;
- Rla,b,c,d et R2a,b,c,d identiques ou différents, représentent chacun un
atome
d'hydrogène ou d'halogène, un groupe (C1-C5) alkyle, (C1-C5) alcoxy, (C,-
C5) halogénoalkyle, hydroxy, hydroxy- (C,-CS) alkyle, un groupe -COOR5, , un
groupe -CONR6R,, , un groupe -SO2NRsR,, un groupe -COR5 un groupe aryle ou
hétéroaryle, aryl (C1-C5) aikyle, hétéroaryl (C1 -C5) alkyle, hétérocycloalkyl-
(C,-
C5) alkyle, tous les groupes aryle, hétéroaryle pouvant être éventuellement
substitués par 1 à 3 substituants choisis parmi les groupes cyano, COOR5,
CONR6R7, S02R5, (C1-C5) alcoxy, OCH2CONR6R7, un atome d'halogène, (C1-
C5) halogénoalkyle et seul un groupe aryl (C1-C5) alkyle peut éventuellement
être
substitué par un groupe hétéroaryle,
ou (R2a) ou (R2b) peuvent également former avec l'atome de carbone auquel
ils sont rattachés un groupe C=O, C=CF2,
ou (RZa) et/ou (R2b) peuvent également former avec le ou les atomes
auxquels ils sont rattachés un groupe (C3-C6) cycloalkyle, ces cycles
pouvant être spiro quand ils sont portés par le même atome de carbone et
être éventuellement substitués par un à trois atomes d'halogènes,
- les groupes R3a,b représentent chacun, un atome d'hydrogène,
- R4 représente :
o un groupe (C,-C5) alkyle ;
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
17
o un groupe (C3-C6) cycloalkyle ;
o un groupe hétérocycloalkyle,
o un groupe aryle monocyclique ayant de 5 à 6 atomes de carbone ;
o un groupe hétéroaryle monocyclique ayant de 2 à 5 atomes de carbone ;
quand R4 est un groupe aryle ou hétéroaryle ou hétérocycloalkyle, il peut être
éventuellement substitué par 1 à 2 substituants choisis parmi les atomes
d'halogène, les groupes (C1-C5) alkyle, (C1-C5) alcoxy, (C1-C5)
halogénoalkyle,
hydroxy, cyano, phényle éventuellement substitué, benzyle, un groupe -CONR6R7,
- n est un nombre entier égal à 0 ou 1;
- o, p, q et r, identiques ou différents, sont des nombres entiers égaux à 0
ou 1
- i et j sont des nombres entiers égaux à 0 ou 1;
- R5 représente un atome d'hydrogène, un groupe (C1-C5) alkyle, phényle
éventuellement substitué ;
- R6 et R7, identiques ou différents, représentent chacun un atome
d'hydrogène, un
groupe (C1-C5) alkyle, un groupe (C3-C6) cycloalkyle, un groupe
hétérocycloalkyle
ou peuvent former ensemble avec l'atome d'azote auquel ils sont rattachés un
hétérocycloalkyle éventuellement substitué,
étant entendu que lorsque X=CH2, n=0, R,a,b,c,d=H, R2a,b,c,d= H, R3a,b=H alors
le groupe R4
doit être différent de phényl éventuellement substitué par un atome d'halogène
ou un
groupe (C,-C5)alkyle, trifluorométhyle, (C,-C5)alcoxy.
Parmi les composés de formule (Ib) selon l'invention, on peut citer les
composés dans
lesquels :
- X représente soit un atome de carbone, d'oxygène, de soufre ou d'azote ;
- Rla,b,c,d et R2a,b,c,d identiques ou différents, représentent chacun un
atome
d'hydrogène ou d'halogène, un groupe (C1-C5) alkyle, (C1-C5) alcoxy, (C1-
C5) halogénoalkyle, hydroxy, hydroxy- (C1-C5) alkyle, un groupe -COOR5, , un
groupe -CONR6R7, , un groupe -SOZNR6R,, un groupe -COR5 un groupe aryle ou
hétéroaryle, aryl (C1-C5) alkyle, hétéroaryl (C1-C5) alkyle, hétérocycloalkyl-
(C,-
C5) alkyle, tous les groupes aryle, hétéroaryle pouvant être éventuellement
substitués par 1 à 3 substituants choisis parmi les groupes cyano, COOR5,
CONR6R7, S02R5, (C1-C5) alcoxy, OCH2CONR6R7, un atome d'halogène, (C1-
C5) halogénoalkyle et seul un groupe aryl (C,-CS) alkyle peut éventuellement
être
substitué par un groupe hétéroaryle,
ou (RZa) ou (R2b) peuvent également former avec l'atome de carbone auquel
ils sont rattachés un groupe C=O, C=CF2,
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
18
ou (R2a) et/ou (R2b) peuvent également former avec le ou les atomes
auxquels ils sont rattachés un groupe (C3-C6) cycloalkyle, ces cycles
pouvant être spiro quand ils sont portés par le même atome de carbone et
être éventuellement substitués par un à trois atomes d'halogènes,
- les groupes R3a,b représentent chacun, un atome d'hydrogène ou un groupe
hydroxy,
- R4 représente :
o un groupe (C1-C5) alkyle ;
o un groupe (C3-C6) cycloalkyle ;
o un groupe hétérocycloalkyle,
o un groupe aryle monocyclique ayant de 5 à 6 atomes de carbone ;
o un groupe hétéroaryle monocyclique ayant de 2 à 5 atomes de carbone ;
quand R4 est un groupe aryle ou hétéroaryle ou hétérocycloalkyle, il peut être
éventuellement substitué par 1 à 2 substituants choisis parmi les atomes
d'halogène, les groupes (C1-C5) alkyle, (C1-C5) alcoxy, (C1-C5)
halogénoalkyle,
hydroxy, cyano, phényle éventuellement substitué, benzyle, un groupe -CONRsR,,
- n est un nombre entier égal à 0 ou 1;
- o, p, q et r, identiques ou différents, sont des nombres entiers égaux à 0
ou 1
- i et j sont des nombres entiers égaux à 0 ou 1;
- R5 représente un atome d'hydrogène, un groupe (C1-C5) alkyle, phényle
éventuellement substitué ;
- R6 et R7, identiques ou différents, représentent chacun un atome
d'hydrogène, un
groupe (C1-C5) alkyle, un groupe (C3-C6) cycloalkyle, un groupe
hétérocycloalkyle
ou peuvent former ensemble avec l'atome d'azote auquel ils sont rattachés un
hétérocycloalkyle événtuellement substitué,
étant entendu que lorsque X=CHZ, n=0, R,a,n,c,a=H, Rza,n,c.a= H, Raa,b=H alors
le groupe R4
doit être différent de phényl éventuellement substitué par un atome d'halogène
ou un
groupe (C,-C5)alkyle, trifluorométhyle, (C,-C5)alcoxy.
Parmi les composés de formules (I), (la) ou (Ib) selon l'invention, on peut
citer un
sous-groupe de composés dans lesquels X est le carbone, l'oxygène ou l'azote,
R,a,n,c,a,
Rza.b.c,d, Raa,n à R9, Y, i, j, n, o, p, q, r, s, t étant tels que définis ci-
dessus.
Parmi ces derniers composés, des composés de l'invention sont des composés
de formule (I), (la) ou (Ib) dans lesquels:
p et r représentent 1;
o et q représentent 0;
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
19
i et j représentent 1 ou 2
n représente 0 ou 1;
R,a,b,c,a représentent l'hydrogène, ou l'un des groupes R,a,b,c,d est un
halogène et
les autres sont l'hydrogène ;
R2a,b représentent l'hydrogène ou l'un des groupes R2a,b est un groupe (C1-C5)
alkyle, de préférence le méthyle et l'autre groupe R2a,b est l'hydrogène ;
R3a,b représentent l'hydrogène ;
R4 en position 4 est choisi parmi les hétéroaryles suivants :
- pyridine
- pyrazine
- pyrazole
- oxadiazole
- thiazole
- imidazole.
Un autre groupe de composés au sens de l'invention correspond aux dérivés de
formules (I), (la) ou (Ib) dans lesquelles X représente l'atome de carbone ou
d'oxygène, n représente 1 et R4 en position 4 est un imidazole, un pyrazole ou
une
pyridine, R,a,b,c,a, R2a,b,c,d, R3a,b, R5 à R7, i, j, o, p, q et r étant tels
que définis ci-dessus.
Un autre groupe de composés au sens de l'invention correspond aux dérivés de
formules (I), (la) ou (Ib) dans lesquelles X représente l'atome de carbone ou
d'oxygène,
n représente 0 et R4 en position 4 est un imidazole, un pyrazole ou une
pyridine, R,a,b,c,d,
Rza,b,c,d, Rsa,b, R5 à R7, i, j, o, p, q et r étant tels que définis ci-
dessus.
Un autre groupe de composés au sens de l'invention correspond aux dérivés de
formules (I), (la) ou (Ib) dans lesquelles X représente l'atome d'azote, n
représente 0 et
R4 en position 4 est un pyrazole ou une pyridine, R,a,b,c,d, R2a,n,c,a. R3a,b,
R5 à R7, i, j, o, p,
q et r étant tels que définis ci-dessus.
Un autre groupe de composés au sens de l'invention correspond aux dérivés de
formules (I), (la) ou (Ib) dans lesquelles X représente l'atome de carbone ou
l'atome
d'oxygène, n représente 0, p représente 1, r représente 1, les deux groupes
R2a et R2b
portés par le même atome de carbone formant un groupe spiro et R4 en position
4 est
un pyrazole ou une pyridine, R,a,b,c,a, R2c,d, R3a,b, R5 à R7, i, j, o, et q
étant tels que définis
ci-dessus.
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
Un autre groupe de composés selon l'invention correspondent aux composés de
formule (I) ou (Ib) dans laquelle X représente l'atome de carbone , d'oxygène
ou d'azote,
n représente 0 ou 1, i représente 1, R3a et R4 sont rattachés au même atome de
carbone
en position 4 et R3a est un groupe cyano ou (C1-C5) alcoxy, R,a,b,c,a,
R2a,b,c,d, R3b, R5 à R7,
5 j, o, p, q et r étant tels que définis ci-dessus.
Un autre groupe de composés de l'invention est constitué par les composés de
formule (I) dans laquelle :
- X est un atome de carbone, d'oxygène, d'azote,
10 - Rla,b,c,d, R2a,b,c,a sont l'hydrogène ;
- i représente 1 ;
- R3a et R4 ensemble avec l'atome de carbone auquel ils sont fixés forment
l'un des groupes ci-après en position spiro éventuellement substitués:
~
~ ~ \ ~
~ ~
~ 4 ~
4 /
4
O O
~ \
4
~
4 ,,N 4r
R3b, R5 à R7, j, n, o, p, q et r étant définis comme dans la formule (I) ci-
dessus.
Un autre groupe de composés de l'invention est constitué par les composés de
formule (I) dans laquelle :
- X est le carbone ;
- R,a,b,c,d, R2a,b,c,d sont l'hydrogène
- i représente 1 ;
- R3a et R4 ensemble avec l'atome de carbone auquel ils sont fixés forment
l'un des groupes ci-après en position spiro éventuellement substitués:
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
21
e
4 R3b, R5 à R7, j, n, o, p, q et r étant définis comme dans la formule (I) ci-
dessus.
Un autre groupe de composés de l'invention est constitué par les composés de
formule (I) ou (Ic) dans laquelle :
- X est l'oxygène ;
- R,a,n,c,d, R2a,b,c,d sont l'hydrogène
- i représente 1 ;
- R3a et R4 ensemble avec l'atome de carbone auquel ils sont fixés forment: >0
R3b, R5 à R7, j, n, o, p, q et r étant définis comme dans la formule (I) ci-
dessus.
Un autre groupe de composés au sens de l'invention correspond aux dérivés de
formules (I), (la) ou (Ib) dans lesquelles X représente l'atome d'azote, n
représente 0, p
représente 1, r, q, o représentent 0, R2a porté par X est un groupe aryle
éventuellement
substitué par un groupe CONR6R7 ou un groupe OCH2CONR6R7, R4 en position 4 est
un
pyrazole ou une pyridine, R,a,b,c,a, R2b,c,d, R3a,b, R5 à R7, i et j étant
tels que définis ci-
dessus.
Parmi les composés de formule (I), (la) ou (Ib) selon l'invention, on peut
mentionner :
(3,4-Dihydro-2H-quinolin-1-yl)-[4-(1 H-imidazol-4-yl)-piperidin-1-yl]-
methanone
[4-(1 H-Imidazol-4-yl)-piperidin-1-yl]-(3-methyl-2,3-dihydro-benzo[1,4]oxazin-
4-yl)-
methanone
(6-Chloro-2,3-dihydro-benzo[1,4]oxazin-4-yl)-[4-(1 H-imidazol-4-yl)-piperidin-
l-yl]-
methanone
(3,4-Dihydro-2H-quinolin-1 -yl)-(3,4,5,6-tetrahydro-2H-[4,4']bipyridinyl-l-yl)-
methanone
(3,4-Dihydro-2H-quinolin-1 -yl)-(3',4',5',6'-tetrahydro-2'H-[3,4']bipyridinyl-
1'-yl)-
methanone
[4-(1-Benzyl-1 H-imidazol-4-yl)-piperidin-1-yl]-(3,4-dihydro-2H-quinolin-1-yl)-
methanone
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
22
(2-Methyl-3,4-dihydro-2H-quinolin-1-yl)-[4-(1-methyl-1 H-imidazol-4-yl)-
piperidin-1-
yI]-methanone
(2-Methyl-3,4-dihydro-2H-q uinolin-1-yl)-(4-phenyl-piperidin-1-yl)-methanone
[4-(1 H-Imidazol-4-yl)-piperidin-1-yl]-(2-methyl-3,4-dihydro-2H-quinolin-1-yl)-
methanone
1-(2-Methyl-3,4-dihydro-2H-quinoline-1 -carbonyl)-4-phenyl-piperidine-4-
carbonitrile
(3,4-Dihydro-2H-quinolin-1-yl)-[4-(2-methoxy-phenyl)-piperidin-l-yl]-methanone
(2-Methyl-3,4-dihydro-2H-quinolin-1 -yl)-(3,4,5,6-tetrahydro-2H-
[4,4']bipyridinyl-l-
yI)-methanone
(3,4-Dihydro-2H-quinolin-1-yl)-[4-(1 H-pyrazol-4-yl)-piperidin-1-yl]-methanone
(3,4-Dihydro-2H-quinolin-1 -yl)-(4-pyrazin-2-yl-piperidin-1 -yl)-methanone
1'-(3,4-dihydroquinolin-1(2H)-ylcarbonyl)spiro[indene-1,4'-piperidine]
1'-(3,4-dihydroquinolin-1(2H)-ylcarbonyl)-1,3-dihydrospiro[indene-2,4'-
piperidine]
1-(3,4-Dihydro-2H-quinoline-1-carbonyl)-4-phenyl-piperidine-4-carbonitrile
1'-(3,4-dihydroquinolin-1(2H)-ylcarbonyl)-3,4-dihydro-2H-spiro[naphthalene-
1,4'-
piperidine]
(3,4-Dihydro-2H-quinolin-1-yl)-(3-pyridin-3-yl-pyrrolid in-1-yl)-methanone
(3,4-Dihydro-2H-quinolin-1 -yl)-(3-pyridin-4-yl-pyrrolidin-1 -yl)-methanone
(6-Fluoro-2,3-dihydro-benzo[1,4]oxazin-4-yl)-(3',4',5',6'-tetrahydro-2'H-
[3,4']bipyridinyl-1'-yI)-methanone
(3,4-Dihydro-2H-quinolin-1 -yl)-[4-(4-phenyl-thiazol-2-yl)-piperidin-1 -yl]-
methanone
(3,4-Dihydro-2H-quinolin-1 -yl)-(4-[1,2,4]oxadiazol-3-yl-piperidin-1-yl)-
methanone
(3,4-Dihydro-2H-q uinolin-1-yl)-(4-thiazol-2-yl-piperidin-1-yl)-methanone
{4-[3-(2,6-Dichloro-phenyl)-[1,2,4]oxadiazol-5-yl]-piperidin-1-yl}-(3,4-
dihydro-2H-
quinolin-1-yl)-methanone
(2,3-Dihydro-benzo[1,4]oxazin-4-yl)-(3-pyridin-3-yl-pyrrolidin-1-yl)-methanone
(3,4-Dihydro-2H-quinolin-1 -yl)-[3-(5-fluoro-pyridin-3-yl)-pyrrolidin-1 -yl]-
methanone
4-Cyclohexyl-1 -(3,4-dihydro-2H-quinoline-1-carbonyl)-piperidine-4-
carbonitrile
1-(3,4-Dihydro-2H-quinoline-1-carbonyl)-4-methyl-piperidine-4-carbonitrile
1-(3,4-Dihydro-2H-quinoline-1-carbonyl)-4-ethyl-piperidine-4-carbonitrile
(3,4-Dihydro-2H-q uinolin-1-yl)-[3-(2H-pyrazol-3-yl)-pyrrolidin-l-yl]-
methanone
(3,4-Dihydro-2H-quinolin-1-yl)-[3-(2H-pyrazol-3-yi)-pyrrolidin-1-yl]-methanone
(7-Chloro-2, 3-dihydro-benzo[1,4]oxazin-4-yl)-[4-(2H-pyrazol-3-yl)-piperidin-l-
yl]-
methanone
1'-(3,4-dihydroquinolin-1(2H)-ylcarbonyl)-2-methylspiro[indole-3,4'-
piperidine]
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
23
1'-(3,4-dihydroquinolin-1(2H)-ylcarbonyl)spiro[indene-1,4'-piperidin]-3(2H)-
one
1'-(3,4-dihydroquinolin-1(2H)-ylcarbonyl)spiro[indene-1,4'-piperidin]-2(3H)-
one
(6-Fluoro-2, 3-dihydro-benzo[1,4]oxazin-4-yl)-(3',4', 5',6'-tetrahydro-2'H-
[3,4']bipyridinyl-1'-yI)-methanone
(6-Fluoro-2,3-dihydro-benzo[1,4]oxazin-4-yl)-(3-pyridin-3-yl-pyrrolidin-1-yl)-
methanone
(7-Chloro-2, 3-dihydro-benzo[1,4]oxazin-4-yl)-(3',4', 5',6'-tetrahydro-2'H-
[3,4']bipyridinyl-1'-yl)-methanone
(2,3-Dihydro-benzo[1,4]thiazin-4-yl)-(3-pyridin-3-yl-pyrrolidin-l-yl)-
methanone
(6-Methoxy-2,3-dihydro-benzo[1,4]oxazin-4-yl)-(3-pyridin-3-yl-pyrrolidin-1-yl)-
methanone
(7-Fluoro-2,3-dihydro-benzo[1,4]oxazin-4-yl)-(3-pyridin-3-yl-pyrrolidin-l-yl)-
methanone
(3,4-Dihydro-2H-quinolin-1-yl)-[3-(1 H-pyrazol-4-yl)-pyrrolidin-1 -yl]-
methanone
1'-(3,4-dihydroquinolin-1(2H)-ylcarbonyl)-2,3-dihydrospiro[indene-1,4'-
piperidin]-
3-ol
(2, 3-Dihyd ro-benzo[ 1,4]oxazin-4-yl)-(6-hyd roxy-3',4', 5', 6'-tetrahyd ro-
2' H-
[3,4']bipyridinyl-1'-yl)-methanone
(2,3-Dihydro-benzo[1,4]oxazin-4-yl)-[4-(1 H-pyrazol-4-yl)-piperidin-1-yl]-
methanone
(3,4-Dihydro-2H-q uinolin-1-yl)-[3-(6-fluoro-pyridin-3-yl)-pyrrolidin-1-yl]-
methanone
(3,4-Dihydro-2H-q uinolin-1-yl)-[4-(2H-pyrazol-3-yl)-piperidin-1-yl]-methanone
(3,4-Dihyd ro-2H-q uinolin-1-yl)-[4-(1-methyl-1 H-pyrazol-4-yl)-piperidin-1-
yl]-
methanone
(3,4-Dihydro-2H-quinolin-1-yl)-(3,4,5,6-tetrahydro-2H-[3,3']bipyridinyl-l-yl)-
methanone
(3,4-Dihydro-2H-q uinolin-1-yl)-(3-pyridin-2-yl-pyrrolidin-1-yl)-methanone
(3,4-Dihydro-2H-quinolin-1 -yl)-(3-hydroxy-3-pyridin-3-yl-pyrrolidin-1 -yl)-
methanone
(3,4-Dihydro-2H-quinolin-1 -yl)-[3-(6-hydroxy-pyridin-3-yl)-pyrrolidin-1 -yl]-
methanone
1'-(3,4-dihydroquinolin-1(2H)-ylcarbonyl)-2,3-dihydrospiro[indene-1,4'-
piperidin]-
3-ol
(3,4-Dihydro-2H-q uinolin-1-yl)-[3-(6-methoxy-pyrid in-3-yl)-pyrrolidin-1-yl]-
methanone
(6-Chloro-2,3-dihydro-benzo[1,4]oxazin-4-yl)-(3-pyridin-3-yl-pyrrolidin-l-yl)-
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
24
methanone
(3,4-Dihydro-2H-quinoxalin-1 -yl)-(3-pyridin-3-yl-pyrrolidin-1 -yl)-methanone
[3-(2-Chloro-phenyl)-pyrrolidin-1-yl]-(3,4-dihydro-2H-quinolin-1-yl)-methanone
(3,4-Dihyd ro-2H-q uinolin-1-yl)-[3-(2-fluoro-phenyl)-pyrrolidin-1-yl]-
methanone
(6-Methyl-3,4-dihydro-2H-quinolin-1 -yl)-(3-pyridin-3-yl-pyrrolidin-1 -yl)-
methanone
1'-(3,4-dihydroquinolin-1(2H)-ylcarbonyl)-3,4-dihydro-2H-spiro[naphthalene-
1,3'-
pyrrolidine]
[3-(4-Chloro-phenyl)-pyrrolidin-1 -yl]-(3,4-dihydro-2H-quinolin-1 -yl)-
methanone
(4-Methyl-3,4-dihydro-2H-q uinoxalin-1-yl)-(3-pyridin-3-yl-pyrrolidin-1-yl)-
methanone
(6,7-Difluoro-2,3-dihydro-benzo[1,4]oxazin-4-yl)-(3-pyridin-3-yl-pyrrolidin-1-
yl)-
methanone
[3-(3-Chloro-phenyl)-pyrrolidin-1 -yl]-(3,4-dihydro-2H-quinolin-1 -yl)-
methanone
(3,4-Dihydro-2H-quinolin-1-yl)-[3-(3-fluoro-phenyl)-pyrrolidin-1-yl]-methanone
(3-Pyridin-3-yl-pyrrolidin-1-yl)-(7-trifluoromethyl-3,4-dihydro-2H-quinolin-l-
yl)-
methanone
(6-Bromo-3,4-dihydro-2H-quinolin-1 -yl)-(3-pyridin-3-yl-pyrrolidin-1 -yl)-
methanone
(2, 3-Dihydro-benzo[1,4]thiazin-4-yl)-(3',4', 5',6'-tetrahydro-2'H-
[3,4']bipyridinyl-1'-
yI)-methanone
(3,4-Dihydro-2H-quinolin-1 -yl)-[3-(5-methyl-pyridin-3-yl)-pyrrolidin-1 -yl]-
methanone
(6-Methoxy-3,4-dihydro-2H-quinolin-1 -yl)-(3-pyridin-3-yl-pyrrolidin-1 -yl)-
methanone
1-(3-Pyridin-3-yl-pyrrolidine-1-carbonyl)-1,2,3,4-tetrahydro-quinoline-6-
carboxylic
acid methyl ester
(3,4-Dihydro-2H-quinolin-1 -yl)-(2-pyridin-4-yl-pyrrolidin-1 -yl)-methanone
1-(3-Pyridin-3-yl-pyrrolidine-1-carbonyl)-2,3-dihydro-1 H-quinolin-4-one
1-(3-Pyridin-3-yl-pyrrolidine-1-carbonyl)-1,2,3,4-tetrahydro-quinoline-6-
sulfonic
acid methylamide
4-(3-Pyridin-3-yl-pyrroiidine-1-carbonyl)-3,4-dihydro-2H-benzo[1,4]oxazine-6-
carboxylic acid methyl ester
(8-Hydroxy-3,4-dihydro-2H-q uinolin-1-yl)-(3-pyridin-3-yl-pyrrolidin-1-yl)-
methanone
(6-Chloro-2,3-dihydro-benzo[1,4]oxazin-4-yl)-[3-(1 H-pyrazol-4-yl)-pyrrolidin-
1-yl]-
methanone
1-(3-Pyridin-3-yl-pyrrolidine-1-carbonyl)-1,2,3,4-tetrahydro-quinoline-6-
carboxylic
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
acid
(2,3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-(1 H-pyrazol-4-yl)-pyrrolidin-1-yl]-
methanone
(6-Fluoro-2,3-dihydro-benzo[1,4]oxazin-4-yl)-[3-(1 H-pyrazol-4-yi)-pyrrolidin-
1-yl]-
5 methanone
(6-Hydroxymethyl-2, 3-dihydro-benzo[1,4]oxazin-4-yl)-(3-pyridin-3-yi-
pyrrolidin-1-
yi)-methanone
2-[1-(2,3-Dihydro-benzo[1,4]oxazine-4-carbonyl)-pyrrolidin-3-yi]-benzamide
(4-Amino-3,4-dihydro-2H-quinolin-1 -yl)-(3-pyridin-3-yl-pyrrolidin-1 -yl)-
methanone
10 (3,4-Dihydro-2H-quinolin-1-yl)-(3-pyrazin-2-yl-pyrrolidin-1-yi)-methànone
[3-(5-Chloro-pyridin-3-yi)-pyrrolidin-1 -yi]-(3,4-dihydro-2H-quinolin-1-yl)-
methanone
(3,4-Dihydro-2H-q uinolin-1-yl)-((S)-3-pyridin-4-yl-pyrrolidin-1-yl)-methanone
(3,4-Dihydro-2H-q uinolin-1-yl)-((R)-3-pyridin-4-yl-pyrrolid in-1-yl)-
methanone
15 (2,3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-(2-fluoro-phenyl)-pyrrolidin-l-yl]-
methanone
[3-(2-Chloro-phenyl)-pyrrolidin-1 -yl]-(2,3-dihydro-benzo[1,4]oxazin-4-yl)-
methanone
[3-(3-Chloro-phenyl)-pyrrolidin-1 -yl]-(2,3-dihydro-benzo[1,4]oxazin-4-yl)-
20 methanone
1'-(2, 3-dihyd ro-4H-1,4-benzoxazin-4-ylcarbonyl)-3,4-dihydro-2H-
spiro[naphthalene-1,3'-pyrrolidine]
[3-(4-Chloro-phenyl)-pyrrolidin-1 -yl]-(2,3-dihydro-benzo[1,4]oxazin-4-yl)-
methanone
25 (2,3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-(4-methoxy-phenyl)-pyrrolidin-l-yi]-
methanone
(2, 3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-(3-trifluoromethyl-phenyl)-pyrrolidin-
l-yi]-
methanone
(2,3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-(2-methoxy-phenyl)-pyrrolidin-1-yl]-
methanone
(2,3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-(3-fluoro-phenyl)-pyrrolidin-1-yl]-
methanone
(2, 3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-(4-fluoro-phenyl)-pyrrolidin-1-yl]-
methanone
1-(3-Pyridin-3-yi-pyrrolidine-1-carbonyl)-1,2,3,4-tetrahydro-quinoline-6-
sulfonic
acid dimethylamide
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
26
(4-Ethyl-3,4-dihydro-2H-quinoxalin-1 -yl)-(3-pyridin-3-yl-pyrrolidin-1 -yl)-
methanone
(4-Propyl-3,4-dihydro-2H-q uinoxalin-1-yl)-(3-pyridin-3-yl-pyrrolidin-1-yl)-
methanone
3-[1-(2, 3-Dihydro-benzo[1,4]oxazine-4-carbonyl)-pyrrolidin-3-yl]-pyridine-2-
carbonitrile
(2,3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-(2-fluoro-pyridin-3-yl)-pyrrolidin-l-
yl]-
methanone
[3-(2,3-Difluoro-phenyl)-pyrrolidin-1-yl]-(2,3-dihydro-benzo[1,4]oxazin-4-yl)-
methanone
(4,4-Dimethyl-3,4-dihydro-2H-quinolin-1 -yl)-(3-pyridin-3-yl-pyrrolidin-1 -yl)-
methanone
(4,4-Dimethyl-3,4-dihydro-2H-quinolin-1-yl)-[3-(1 H-pyrazol-4-yl)-pyrrolidin-1-
yl]-
methanone
1-(2,3-Dihydro-benzo[1,4]oxazine-4-carbonyl)-3-pyridin-3-yl-pyrrolidine-3-
carbonitrile
1-(2, 3-Dihyd ro-benzo[ 1,4]oxazi ne-4-ca rbonyl)-3-pyrid i n-3-yl-pyrrol id
ine-3-
carbonitrile
1-(3,4-Dihydro-2H-quinoline-1-carbonyl)-3-pyridin-3-yl-pyrrolidine-3-
carbonitrile
4-(3-Pyridin-3-yl-pyrrolidine-1 -carbonyl)-3,4-dihydro-2H-quinoxaline-1 -
carboxylic
acid dimethylamide
(2,3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-(1 H-imidazol-4-yl)-pyrrolidin-1-yl]-
methanone
(3,4-Dihydro-2H-quinolin-1-yl)-[3-(1 H-imidazol-4-yl)-pyrrolidin-1-yl]-
methanone
[3-(2-Chloro-pyridin-3-yl)-pyrrolidin-1 -yl]-(2,3-dihydro-benzo[1,4]oxazin-4-
yl)-
methanone
(2,3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-(2-methyl-pyridin-3-yl)-pyrrolidin-1-
yl]-
methanone
(2,3-Dihydro-benzo[1,4]oxazin-4-yl)-(3-pyrazin-2-yl-pyrrolidin-1-yl)-methanone
[3-(2,3-Difluoro-phenyl)-pyrrolidin-1-yl]-(2,3-dihydro-benzo[1,4]oxazin-4-yl)-
methanone
(4-Hydroxy-3,4-dihydro-2H-q uinolin-1-yl)-(3-pyridin-3-yl-pyrrolidin-1-yl)-
methanone
4-(3-Pyridin-3-yl-pyrrolidine-1 -carbonyl)-3,4-dihydro-2H-quinoxaline-1 -
carboxylic
acid methyl ester
(4-Butyl-3,4-dihydro-2H-quinoxalin-1-yl)-(3-pyridin-3-yi-pyrrolidin-1-yl)-
methanone
1-[4-(3-Pyridin-3-yl-pyrrolidine-1 -carbonyl)-3,4-dihydro-2H-quinoxalin-1-yl]-
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
27
ethanone
(4-Benzyl-3,4-dihydro-2H-quinoxalin-1 -yl)-(3-pyridin-3-yl-pyrrolidin-1 -yl)-
methanone
(4-Methyl-3,4-dihydro-2H-q uinoxalin-1-yl)-[3-(1 H-pyrazol-4-yl)-pyrrolidin-1-
yl]-
methanone
(4-Methyl-3,4-dihydro-2H-quinoxalin-1 -yl)-(3-pyridin-3-yl-pyrrolidin-1 -yl)-
methanone
(6-Chloro-2,3-dihydro-benzo[1,4]oxazin-4-yl)-[3-(2-chloro-phenyl)-pyrrolidin-l-
yl]-
methanone
(6-Chloro-2,3-dihydro-benzo[1,4]oxazin-4-yl)-[3-(3-chloro-phenyl)-pyrrolidin-l-
yl]-
methanone
(6-Chloro-2,3-dihydro-benzo[1,4]oxazin-4-yl)-[3-(2-fluoro-phenyl)-pyrrolidin-l-
yl]-
methanone
(6-Chloro-2,3-dihydro-benzo[1,4]oxazin-4-yl)-[3-(3-fluoro-phenyl)-pyrrolidin-l-
yi]-
methanone
(6-Chloro-2,3-dihydro-benzo[1,4]oxazin-4-yl)-[3-(2-trifluoromethyl-phenyl)-
pyrrolidin-1-yl]-methanone
1'-[(6-chloro-2,3-dihydro-4H-1,4-benzoxazin-4-yl)carbonyl]-3,4-dihydro-2H-
spiro[naphthalene-1,3'-pyrrolidine]
(7-Chloro-4,4-dimethyl-3,4-dihydro-2H-quinolin-1-yl)-[3-(1H-pyrazol-4-yl)-
pyrrolidin-1-yl]-methanone
(6,7-Difluoro-4,4-dimethyl-3,4-dihydro-2H-quinolin-1-yl)-[3-(1 H-pyrazol-4-yl)-
pyrrolidin-1-yl]-methanone
(6,7-Difluoro-4,4-dimethyl-3,4-dihydro-2H-quinolin-1-yl)-(3-pyridin-3-yl-
pyrrolidin-
1-yI)-methanone
4-{4-[3-(1 H-Pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-1-
yl}-
benzonitrile
(6-Methoxy-4,4-dimethyl-3,4-dihydro-2H-quinolin-1-yl)-[3-(1 H-pyrazol-4-yl)-
pyrrolidin-1-yl]-methanone
1-(3-Fluoro-benzyl)-5-trifluoromethyl-1 H-pyrrolo[2,3-b]pyridine-2-carboxylic
acid
(6-methylamino-pyridin-3-yl)-amide
[3-(2-Chloro-phenyl)-pyrrolidin-1 -yl]-(4,4-dimethyl-3,4-dihydro-2H-quinolin-l
-yl)-
methanone
2-[1-(2,3-Dihydro-benzo[1,4]oxazine-4-carbonyl)-pyrrolidin-3-yl]-benzoic acid
methyl ester
(3,4-Dihyd ro-2H-q uinolin-1-yl)-(3-methoxy-3-pyridin-3-yl-pyrrolidin-l-yl)-
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
28
methanone
(2, 3-Dihydro-benzo[ 1,4]oxazin-4-yl)-[3-(2-methoxy-pyridin-3-yl)-pyrrolidin-l-
yl]-
methanone
4-{4-[3-(1 H-Pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-
quinoxalin-1-ylmethyl}-benzonitrile
1'-{[3-(1 H-pyrazol-4-yl)pyrrolidin-1-yl]carbonyl}-2',3'-dihydro-1'H-
spiro[cyclopentane-1,4'-quinoline]
(6-Chloro-4,4-dimethyl-3,4-dihydro-2H-quinolin-1-yl)-[3-(1 H-pyrazol-4-yl)-
pyrrolidin-1-yl]-methanone
[3-(1 H-Pyrazol-4-yl)-pyrrolidin-1 -yl]-(6-trifluoromethyl-2,3-dihydro-
benzo[ 1,4]oxazi n-4-yl)-meth anone
(6-Trifluoromethyl-2,3-dihydro-benzo[1,4]oxazin-4-yl)-[3-(2-trifluoromethyl-
phenyl)-pyrrolidin-1-yl]-methanone
5-[1-(3,4-Dihydro-2H-quinoline-1-carbonyl)-piperidin-4-yl]-2,4-dihydro-pyrazol-
3-
one
(4,4-Dimethyl-3,4-dihydro-2H-q uinolin-1-yl)-(3-pyridazin-4-yl-pyrrolidin-1-
yl)-
methanone
(5-Chloro-4,4-dimethyl-3,4-dihydro-2H-quinolin-1-yi)-[3-(1 H-pyrazol-4-yl)-
pyrrolidin-1-yl]-methanone
(3,4-Dihydro-2H-quinoxalin-1-yl)-[3-(1H-pyrazol-4-yl)-pyrrolidin-1-yi]-
methanone
(2-Aza-spiro[4.5]dec-2-yi)-(2,3-dihyd ro-benzo[1,4]oxazin-4-yl)-methanone
[4-(3-Morpholin-4-yl-propyl)-3,4-dihydro-2H-quinoxalin-1-yl]-[3-(1 H-pyrazol-4-
yl)-
pyrrolidin-1-yi]-methanone
(5-Hydroxy-3,4-dihydro-2H-quinolin-1-yl)-[3-(1 H-pyrazol-4-yl)-pyrrolidin-1-
yl]-
methanone
[4-(2-Morpholin-4-yi-ethyl)-3,4-dihydro-2H-quinoxalin-1-yl]-[3-(1 H-pyrazol-4-
yl)-
pyrrolidin-1-yl]-methanone
(4,4-Dimethyl-3,4-dihydro-2H-quinolin-1 -yl)-[3-(2-trifluoromethyl-phenyl)-
pyrrolidin-1 -yl]-methanone
(3-Methyl-2,3-dihydro-benzo[1,4]oxazin-4-yl)-[3-(1H-pyrazol-4-yl)-pyrrolidin-1-
yl]-
methanone
5-[1-(2,3-Dihydro-benzo[1,4]oxazine-4-carbonyl)-pyrrolidin-3-yl]-2,4-dihydro-
pyrazol-3-one
[3-(1 H-Pyrazol-4-yl)-pyrrolidin-1-yI]-[4-(2,2,2-trifluoro-ethyl)-3,4-dihydro-
2H-
quinoxalin-1-yl]-methanone
4-{4-[3-(1 H-Pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-1-
yl}-
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
29
benzoic acid
N-Cyclopropyl-4-{4-[3-(1 H-pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-
2H-
quinoxalin-1-yl}-benzamide
(2, 3-Di hyd ro-benzo[ 1,4]oxazi n-4-yl)-[3-(4-fluoro-2-trifl uoromethyl-
phenyl)-
pyrrolidin-1-yl]-methanone
4-{4-[3-Hydroxy-3-(2H-pyrazol-3-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-
quinoxalin-1-ylmethyl}-benzonitrile
[4-(4-Methanesulfonyl-benzyl)-3,4-dihydro-2H-quinoxalin-1-yl]-[3-(1 H-pyrazol-
4-
yI)-pyrrolidin-1-yl]-methanone
3-{4-[3-(1H-Pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-1-
ylmethyl}-benzonitrile
(4-Difluoromethylene-3,4-dihydro-2H-quinolin-1 -yl)-(3-pyridin-3-yl-pyrrolidin-
1 -yl)-
methanone
(4-Benzyl-3,4-dihydro-2H-q uinoxalin-1-yl)-[3-(1 H-pyrazol-4-yl)-pyrrolidin-1-
yl]-
methanone
(2, 3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-hydroxy-3-(2H-pyrazol-3-yi)-pyrrolidin-
l-
yI]-methanone
(3,4-Dihydro-2H-quinoxalin-1-yl)-[3-(1 H-pyrazol-4-yl)-pyrrolidin-1-yl]-
methanone
(6,7-Difluoro-3,4-dihydro-2H-quinoxalin-1-yl)-[3-(1 H-pyrazol-4-yl)-pyrrolidin-
1-yl]-
methanone
6-{4-[3-(1 H-Pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-1-
ylmethyl}-nicotinonitrile
1'-(3,4-dihydroquinoxalin-1(2H)-ylcarbonyl)-3,4-dihydro-2H-spiro[naphthaiene-
1,3'-pyrrolidine]
4-[1-(2,3-Dihydro-benzo[1,4]oxazine-4-carbonyl)-pyrrolidin-3-yl]-1H-pyrazole-3-
carbonitrile
N-Cyclopropyl-3-{4-[3-(1 H-pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-
2H-
quinoxalin-1-ylmethyl}-benzamide
N-Piperidin-1-yI-4-{4-[3-(1 H-pyrazol-4-yl)-pyrrolidine-1 -carbonyl]-3,4-
dihydro-2H-
quinoxalin-1-yl}-benzamide
(4-{4-[3-(1 H-Pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-
1 -yl}-
phenyl)-pyrrolidin-1-yl-methanone
Morpholin-4-yl-(4-{4-[3-(1 H-pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-
2H-
quinoxalin-1-yl}-phenyl)-methanone
(4-Methyl-piperazin-1-yl)-(4-{4-[3-(1H-pyrazol-4-yl)-pyrrolidine-1-carbonyl]-
3,4-
dihydro-2H-quinoxalin-1-yl}-phenyl)-methanone
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
N-Cyclopropyl-2-(4-{4-[3-(1 H-pyrazol-4-yl)-pyrrolid ine-1-carbonyl]-3,4-
dihydro-2H-
quinoxalin-1-yl}-phenyl)-acetamide
Trifluoro-methanesulfonic acid 4-{4-[3-(1 H-pyrazol-4-yl)-pyrrolidine-l-
carbonyl]-
3,4-dihydro-2H-quinoxalin-l-yl}-phenyl ester
5 N-Cyclopropyl-2-methoxy-4-{4-[3-(1H-pyrazol-4-yl)-pyrrolidine-1-carbonyl]-
3,4-
dihydro-2H-q uinoxalin-1-yl}-benzamide
4-{4-[3-(1 H-Pyrazol-4-yl)-pyrrolidine-l-carbonyl]-3,4-dihydro-2H-quinoxalin-1-
yl}-
2-trifluoromethyl-benzonitrile
N-Cyclopropyl-2-(4-{4-[3-(1 H-pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-
dihydro-2H-
10 quinoxalin-1-yl}-phenoxy)-acetamide
N-Cyclopropyl-2-(3-{4-[3-(1 H-pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-
dihydro-2H-
quinoxalin-1-yl}-phenoxy)-acetamide
[4-(5-Bromo-pyridin-2-yl)-3,4-dihydro-2H-quinoxalin-l-yl]-[3-(1 H-pyrazol-4-
yl)-
pyrrolidin-1-yl]-methanone
15 2,2-difluoro-1'-{[3-(1H-pyrazol-4-yl)pyrrolidin-1-yl]carbonyl}-2',3'-
dihydro-1'H-
spiro[cyclopropane-1,4'-quinoline]
1-[3-(1 H-Pyrazol-4-yl)-pyrrolidine-1-carbonyl]-1,2,3,4-tetrahydro-quinoline-4-
carboxylic acid methyl ester
[3-(1 H-Pyrazol-4-yl)-pyrrolidin-1-yl]-(8-trifluoromethyl-2,3-dihydro-
20 benzo[1,4]oxazin-4-yl)-methanone
3-{4-[3-(1 H-Pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-1-
yl}-
benzonitrile
4-{4-[3-(1 H-Pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-1-
yl}-
benzamide
25 5-{4-[3-(1H-Pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-
1-yl}-
pyridine-2-carboxylic acid amide
4-{4-[3-(1 H-Pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-1-
ylmethyl}-benzoic acid methyl ester
5-{4-[3-(1 H-Pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-1-
yl}-
30 nicotinonitrile
[3-(1 H-Pyrazol-4-yl)-pyrrolidin-1 -yl]-(4-pyridin-2-ylmethyl-3,4-dihydro-2H-
quinoxalin-1 -yl)-methanone
(2,3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-(2-trifluoromethyl-pyridin-3-yl)-
pyrrolidin-1-
yI]-methanone
(2,3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-(2-trifluoromethyl-piperidin-3-yl)-
pyrrolidin-
1-yI]-methanone
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
31
[3-(1 H-Pyrazol-4-yl)-pyrrolidin-1-yl]-[4-(5-trifluoromethyl-pyridin-2-yl)-3,4-
dihydro-
2H-q uinoxalin-l-yl]-methanone
4-{4-[3-(2-Trifluoromethyl-phenyl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-
quinoxalin-1-yl}-benzonitrile
[3-(1H-Pyrazol-4-yl)-pyrrolidin-1-yl]-(4-pyridin-3-ylmethyl-3,4-dihydro-2H-
quinoxalin-1-yl)-methanone
[3-(1 H-Pyrazol-4-yl)-pyrrolidin-1-yl]-[4-(4-trifluoromethyl-benzyl)-3,4-
dihydro-2H-
quinoxalin-1 -yl]-methanone
(8-Chloro-2,3-dihydro-benzo[1,4]oxazin-4-yl)-[3-(1 H-pyrazol-4-yl)-pyrrolidin-
1-yl]-
methanone
4-{4-[3-(1 H-Pyrazol-4-yl)-pyrrolidine-1 -carbonyl]-3,4-dihydro-2H-quinoxalin-
1-
ylmethyl}-benzoic acid
[3-(1 H-Pyrazol-4-yl)-pyrrolidin-1-yl]-[4-(4-[1,2,4]triazol-l-yl-benzyl)-3,4-
dihydro-
2H-quinoxalin-1-yl]-methanone
(2,3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-(3-trifluoromethyl-1 H-pyrazol-4-yl)-
pyrrolidin-1 -yl]-methanone
4-{4-[(S)-3-(1 H-Pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-
quinoxalin-l-
yl}-benzonitrile
4-{4-[(R)-3-(1 H-Pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-
quinoxalin-l-
yl}-benzonitrile
4-{4-[3-(1 H-Pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-1-
ylmethyl}-benzamide
5-{4-[3-(1 H-Pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-l-
yl}-
nicotinic acid ethyl ester
N-Cyclopropyl-4-{4-[3-(1 H-pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-
2H-
q uinoxalin-1-ylmethyl}-benzamide
N-(1,1-Dioxo-tetrahydro-1 lambda6-thiophen-3-yl)-4-{4-[3-(1 H-pyrazol-4-yl)-
pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-1 -yl}-benzamide
4-{4-[3-(1 H-Pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-1-
yl}-
benzoic acid N'-phenyl-hydrazide
Les composés ci-dessus peuvent être éventuellement substitués par un ou
plusieurs des groupes ci-après : les atomes d'halogène, les groupes (C1-C5)
alkyle, (C,-
C5) alcoxy, (C1-C5) halogénoalkyle, hydroxy, hydroxy-(C,-C5) alkyle, (C1-C5)
alcoxy-(C,-
C5) alkyle, cyano, phényle éventuellement substitué, benzyle éventuellement
substitué, -
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
32
COOR5, -NR6R7, un groupe - COOR5 -(C1-C5) alkyle, un groupe - NR6R7-(C,-
C5) alkyle, un groupe -CONR6R7, un groupe-CONR6R7-(C,-C5) alkyle, un groupe -
SO2NR6R,.
Dans ce qui suit, on entend par groupe protecteur (Pg) un groupe qui permet,
d'une part, de protéger une fonction réactive telle qu'un hydroxy ou une amine
pendant
une synthèse et, d'autre part, de régénérer la fonction réactive intacte en
fin de
synthèse. Des exemples de groupes protecteurs ainsi que des méthodes de
protection
et de déprotection sont données dans Protective Groups in Organic Synthesis
,
Green et al., 3rd Edition (John Wiley & Sons, Inc., New York).
On entend par groupe partant (Lg), dans ce qui suit, un groupe pouvant être
facilement clivé d'une molécule par rupture d'une liaison hétérolytique, avec
départ
d'une paire électronique. Ce groupe peut ainsi être remplacé facilement par un
autre
groupe lors d'une réaction de substitution, par exemple. De tels groupes
partants sont,
par exemple, les halogènes ou un groupe hydroxy activé tel qu'un mésyle,
tosyle, triflate,
acétyle, paranitrophényle, etc. Des exemples de groupes partants ainsi que des
méthodes pour leur préparation sont donnés dans Advances in Organic
Chemistry ,
J. March, 3d Edition, Wiley Interscience, p. 310-316.
Conformément à l'invention, on peut préparer les composés de formule générale
(I) selon les procédés ci-après. Dans le cas où X représente un atome d'azote,
il doit
être substitué soit par un groupe R2a,b,c,d (différent de H) soit par un
groupe protecteur
Pg tel que défini précédemment.
Schéma 1 (Méthode 1) :
Rlb Rla
H O Rlb Ria O
Rlc N (Rza)p + LgLg -~ RIo N (Rz ~9
Rld X (Rzb)r III Rld X (Rzb)r
(Rza)o (R2c)y
(II) (IV) (Rzd)o (R2c)q
R~b Rla ~
R1b R1a 0 n R4
Rlo N Lg R4 N 4
(Rza)P = H-N 4 Rla N (Rza) 3 (R3b)j
Ria X (Rzb)r 3 (R3b)j P (R3a~
(IV) (Rza)o (Rzc)q (V) (R3a)i Rid Rzb)r
(Rzd)o (Rzc)a (I)
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
33
Dans le schéma 1, les composés de formule (IV) peuvent être préparés par
réaction entre les intermédiaires de formule (II) et un carbonyle de formule
(III)
présentant deux groupes partant Lg (par exemple un atome de chlore, un groupe
trichlorométhoxy, un groupe para-nitrophényle, un groupe imidazole, ou méthyl-
imidazolium) en présence d'une base comme la triéthylamine ou la
diisopropylamine
dans un solvant tel que le dichlométhane, le tétrahydrofurane à une
température variant
de la température ambiante à 80 C. Les composés de formule (I) sont obtenus
par
couplage entre les dérivés activés (IV) et les amines (V) en présence ou non
d'une base
comme la triéthylamine ou le carbonate de potassium dans un solvant tel que le
tétrahydrofurane, le dichlorométhane, l'acétonitrile ou l'eau, à une
température variant
de la température ambiante à 100 C.
Les hétérocycles de formule générale (II) sont disponibles commercialement ou
peuvent être préparés par des méthodes décrites dans la littérature
(c<Comprehensive
hétérocyclic chemistry , Katritzky et al., 2`d Edition (Pergamon press) ;
Kuwabe, S.;
Torraca, K.E.; Buchwald, S. L. JACS. (2001) 123(49), 12202-12206) ; Coudert,
G.;
Guillaumet, G.; Loubinoux, B. Synthesis 7, 541-543. Hoffman, W. W.; Kraska, A.
R.
Eur. Pat. Appl. (1985), EP 130795 A2.
Les hétérocycles de formule générale (V) sont disponibles commercialement ou
peuvent être préparés par des méthodes décrites dans la littérature (
Comprehensive
hétérocyclic chemistry , Katritzky et al., 2d Edition (Pergamon press) ;
Buffat, Maxime
G. P. Tétrahedron (2004), 60(8), 1701-1729; Laschat, S. ; Dickner, T.
Synthesis
(2000), (13), 1781-1813; Y. Terao, H. Kotaki, N. Imai, K. Achiwa Chem. Pharm.
Bull. (1985) 33 (7), 2762-2766. K.Shankaran & coll. Bioorg.Med.Chem.Lett.
(2004), (14),
3419-3424.
Le schéma 2 détaille une synthèse des composés de formule (I) dans lesquels
R4 est placé en position 4 du cycle carboné et représente un groupe aryle ou
hétéroaryle
tel que défini précédemment, ces composés sont appelés ci-après composés de
formule
(VI).
Schéma 2:
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
34
n ~ Y-R4 (IX) n
Pg-N O- Pg-N O-S-A Pg-N R4
3 (R3b)j 3 (R3b)j 0 3 (R3b)j
(VII) (R3a)i (VIII) (R3a)i (X) (R3a)i
Pg-N
C R4 -- H-N R4
>3(R3b)i n
3 (R3b)j
(XI) (R3a)i (VI) (R3a)i
Dans le schéma 2, les héterocycles (VIII) dont la fonction amine est protégée
par
un groupement protecteur Pg (par exemple un groupement Boc ou Fmoc) présentant
un
groupe vinyle sulfonate-A (par exemple A peut être un groupe trifluorométhyle,
un
groupe nonafluorobutyle) peuvent être préparés par transformation des cétones
(VII)
avec un agent de sulfonatation tel que l'anhydride trifluorométhanesulfonique
ou le N-
phényltrifluorométhanesulfonimide en présence d'une base comme le diisopropyle
amidure de lithium ou I'hexaméthyle disilazane de lithium dans un solvant tel
que le
tétrahydrofurane ou l'éthylèneglycol diméthyl éther à une température variant
de -78 C
à la température ambiante. Les hétérocycles (X) sont obtenus par couplage
organométallique entre un composés (VIII) et un composé (IX) où Y est un
dérivé du
bore (par exemple un acide boronique ou un ester boronique), de l'étain (par
exemple
un groupe tri n-butyle étain) ou un atome d'halogène (par exemple le brome ou
l'iode) en
présence d'un dérivé métallique approprié (par exemple des dérivés du
palladium, du
zinc ou du cuivre) en présence d'une base ou non telle que le carbonate de
potassium,
le fluorure de potassium ou le phosphate de sodium dans un solvant ou mélange
de
solvant tel que le dioxane, l'éthylène glycol diméthyléther, le toluène, l'eau
à une
température variant de la température ambiante à 120 C.
La double liaison des hétérocycles (X) est ensuite hydrogénée avec un
catalyseur métallique approprié dans le méthanol ou l'éthanol pour conduire
aux dérivés
(XI). Dans une dernière étape, les amines de formule (VI) sont obtenues par
déprotection de la fonction amine des composés de formule (XI) par des
méthodes
connues de l'homme du métier. Elles comprennent entre autres l'utilisation
d'acide
trifluoroacétique ou d'acide chlorhydrique dans le dichlorométhane, le
dioxane, le
tétrahydrofurane ou le diéthyléther dans le cas d'une protection par un
groupement Boc,
et de pipéridine pour un groupement Fmoc, à des températures variant de -10 C
à
100 C.
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
Le schéma 3 présente une voie de préparation alternative des composés de
formule (I) dans lesquels R4 est placé en position 4 du cycle carboné et
représente un
groupe aryle ou hétéroaryle tels que définis précédemment, ces composés sont
appelés
ci-après composés de formule (XII). Dans le cas où X représente un atome
d'azote, il
5 doit être substitué soit par un groupe R2a,b (différent de H) soit par un
groupe protecteur
Pg tel que défini précédemment.
Schéma 3 (Méthode 2) :
Pg-N OS-A
>3(R3b~j 0
0
R~b Rla O (VIII) R3a)i Rlb R1a 0 - -
n 0
R N jl'I,`L9 " IOI ~N O-S-A
ic (R2a)P = H-N O-S-A -~ Ric N (R ) 3 (R3b)1 O
Rid X (R2b)r 3(R3b)j 0 (Rzb 2a v(R3a)i
(R3a); Rla X r
(IV) (R2d) (R2c)q (XIII) (XIV) (Rza) (R2c)q
R1b R7a 0 n R1b R7a 0 n
Y-R4 (IX) N R4 N R4
Rlc N (Rza)P 3 (R3b)j Ric N (R~)P 3 (R3b)j
(R3a)i ~ R (R3a)i
R~d X(Rzb)r Ria X ( 2b)r
(XV) (R2a) (R2dq (XII) (Rza) (R2~q
10 Dans le schéma 3, les amines (XIII) sont obtenues par déprotection de la
fonction amine des composés de formule (VIII), par des méthodes choisies parmi
celles
connues de l'homme du métier. Elles comprennent entre autres l'utilisation
d'acide
trifluoroacétique ou d'acide chlorhydrique dans le dichlorométhane, le
dioxane, le
tétrahydrofurane ou le diéthyléther dans le cas d'une protection par un
groupement Boc,
15 et de pipéridine pour un groupement Fmoc, à des températures variant de -10
à 100 C.
Les composés de formule (XIV) sont obtenus par couplage entre les dérivés
activés (IV)
et les amines (XIII) en présence ou non d'une base comme la triéthylamine ou
le
carbonate de potassium dans un solvant tel que le tétrahydrofurane, le
dichlorométhane,
l'acétonitrile ou l'eau, à une température variant entre la température
ambiante et 100 C.
20 Dans l'étape suivante, les hétérocycles (XV) sont obtenus par couplage
organométallique entre un composé (XIV) et un composé (IX) où Y est un dérivé
du
bore (par exemple un acide boronique ou un ester boronique), de l'étain (par
exemple
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
36
un groupe tri n-butyle étain) ou un atome d'halogène (par exemple le brome ou
l'iode) en
présence d'un dérivé métallique approprié (par exemple des dérivés du
palladium, du
zinc ou du cuivre) et en présence d'une base ou non telle que le carbonate de
potassium, le fluorure de potassium ou le phosphate de sodium dans un solvant
ou
mélange de solvant tel que le dioxane, l'éthylène glycol diméthyléther, le
toluène, l'eau à
une température variant de la température ambiante à 120 C. Dans une dernière
étape,
la double liaison des hétérocycles (XV) est ensuite hydrogénée avec un métal
approprié
dans le méthanol ou l'éthanol pour conduire aux dérivés (XII).
Le schéma 4 présente une voie de synthèse des composés de formule (I) dans
lesquels i représente 1 et R3a est un groupe CN placé en position 4, R4 est
placé en
position 4 du cycle carboné et représente un groupe aryle ou hétéroaryle tel
que défini
précédemment, ces composés sont appelés ci-après composés de formule (XVI).
Dans
le cas où X représente un atome d'azote, il doit être substitué soit par un
groupe R2a,b,C,d
(différent de H) soit par un groupe protecteur Pg tel que défini précédemment.
Schéma 4 (Méthode 3) :
Rlb Rla ~L
n
- R1b R1a 0
~ N Lg
~n -
R1c N(R2a)P = H-N Lg Rl~ ~
N(Rza)p
Ri d X (R2b)r ~ (R3b)j Lg
R L Rla X (R2b)r
(IV) (R2d)o (R2c)a (XVII) ( 3b)j g (XVIII) (R2ao (Rzc)a
CN Rlb Rla O n CN
(XIX) < -
R4 R,c NN 4 R
(RZa)P 3 4
(R3b)j
Rid X (R2b)r
(XVI) (R2d)o (R2c)q
Dans le schéma 4, les composés de formules (XVIII) sont obtenus par couplage
entre les dérivés activés (IV) et les amines (XVII) présentant deux groupes
partants Lg
(par exemple des atomes de chlore, des groupes mésyle ou tosyle), en présence
ou non
d'une base comme la triéthylamine ou le carbonate de potassium dans un solvant
tel
que le tétrahydrofurane, le dichlorométhane, ou l'acétonitrile à une
température variant
de la température ambiante à 100 C. Dans la dernière étape, les composés (XVI)
sont
obtenus par la réaction des nitriles (XIX) avec les dérivés (XVIII) en
présence d'une
base comme l'hydrure de sodium, le diisopropyle amidure de lithium ou
l'hexaméthyl
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
37
disilazane dans un solvant tel que le tétrahydrofurane à une température
variant de -
C à 80 C.
Le schéma 5 présente une voie de synthèse alternative des composés de
5 formule (I) dans lesquels i représente 1, R3a est un groupe CN placé en
position 4, R4
est placé en position 4 du cycle carboné et représente un groupe alkyle ou
cycloalkyle
tel que défini ci-avant, ces composés sont appelés ci-après composés de
formule (XVI)'.
Dans le cas où X représente un atome d'azote, il doit être substitué soit par
un groupe
R2a,b,c,d (différent de H) soit par un groupe protecteur Pg tel que défini
précédemment.
Schéma 5 (Méthode 4) :
- Rlb Rla O ~ CN
R1b R1a 0 ~1-
N C R N N a CN (XXI) Lg-R4 Rlc N ) 3 4 Ra
2a p
1c (Rpa)p (R3b), R~d X (Rzb)r (R3b)1
Rld X (Rzb)r (R2d)u (R2c)Q
(XX) (R2d)o (R2c)y (XVI)'
Dans le schéma 5, les composés de formules (XVI)' sont obtenus par alkylation
des composés (XX) avec les composés (XXI) présentant un groupe partant Lg (par
exemple un atome de chlore, un groupe mésyle ou tosyle), en présence d'une
base
comme l'hydrure de sodium, le diisopropyle amidure de lithium,
l'hexaméthyldisilazane
de lithium ou l'amidure de lithium dans un solvant tel que le tétrahydrofurane
à une
température variant de -78 C à température ambiante.
Le schéma 6 présente une voie de préparation des composés de formule (I)
dans lesquels R4 est un groupe thiazole substitué par un groupe R,o où R,o
représente
un atome d'hydrogène, un groupe (C1-C5) alkyle ou aryle éventuellement
substitué, ces
composés sont appelés ci-après composés de formule (XXII). Dans le cas où X
représente un atome d'azote, il doit être substitué soit par un groupe
R2a,b,c,d (différent de
H) soit par un groupe protecteur Pg tel que défini précédemment.
Schéma 6 (Méthode 5) :
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
38
Rtb Rla O Rlb Rla O n CSNHz
~L CSNHz N a _ 4~ Rlc N R 9= H-N a Rl7R, (Rza)P 3(R3b)i
( Za)P R
4~3 (R3b)j (' ~3a)i
Rid X (Rzb)r R dX (Rzb)
(M (Rza (R2c)q (XXIII) ( 3a)' (Rzd) (Rzc)q (XXIV)
O R1b R1a O n ~ \R10
(XX~ L9~ ~ N a
S
R10 Rlc N (R ) 3 (R3b)j
2a p
(R3à
Rid X (Rzb)r (XXII)
(Rza) (R2c)q
Dans le schéma 6, les composés de formules (XXIV) sont obtenus par couplage
entre les dérivés activés (IV) et les amines (XXIII) présentant un groupe
thioamide
primaire, en présence ou non d'une base comme la triéthylamine ou le carbonate
de
potassium dans un solvant tel que le tétrahydrofurane, le dichlorométhane, ou
l'acétonitrile, à une température variant de la température ambiante à 100 C.
Dans la
dernière étape, les composés (XXII) sont obtenus par la réaction des
thioamides (XXIV)
avec les dérivés oxo (XXV) présentant en alpha un groupe partant Lg (par
exemple un
atome de chlore ou de brome) où R10 représente un atome d'hydrogène, un groupe
alkyle ou aryle éventuellement substitué en présence d'une base comme la
triéthylamine, la diisopropyléthylamine dans un solvant tel que le
tétrahydrofurane ou
I'acétonitrile à une température variant de la température ambiante à 80 C.
Le schéma 7 présente une voie de préparation des composés de formule (I)
dans lesquels R4 est un groupe 1,2,4-oxadiazole substitué par un groupe Rõ où
Rõ
représente un groupe (C1-C5) alkyle ou aryle éventuellement substitué, ces
composés
sont appelés ci-après composés de formule (XXVI). Dans le cas où X représente
un
atome d'azote, il doit être substitué soit par un groupe R2a,b,c,d (différent
de H) soit par un
groupe protecteur Pg tel que défini précédemment.
Schéma 7 (Méthode 6) :
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
39
R'b R'a ~ Rlb Rla O COOMe
L e3 COOMe N Ya
Ric N(R2aP = H-N R Rlc N(R2a) R 3 (R3b)j
R X~(R2b)r 3b)j P ( 3a)i
ld (R2d)O (R2dq (R3a)i Rid X (R2b)r
(IV) (XXVII) (XXVIII) (R2d)o (R2c)y (1)
N1O
n ~/Rll
Rlb Rla O n a COOH Rlb Rla O N a
N
--R N 3 (R3b) - Rtc N 3 (R3b)j
(R2a)P HO-N (R2a)v
(R3a)i ~ (R)i
Rld /X(R2b)r Rii Rld X(R2b)r 3a
(XXIX) (R2d) (R2c)4 H2 (XXX) (R2d)o (R2Jq (XXVI)
Dans le schéma 7, les composés de formules (XXVIII) sont obtenus par couplage
entre les dérivés activés (IV) et les amines (XXVII) présentant un groupe
ester, en
présence ou non d'une base comme la triéthylamine ou le carbonate de potassium
dans
un solvant tel que le tétrahydrofurane, le dichlorométhane ou l'acétonitrile,
à une
température variant de la température ambiante à 100 C. L'étape suivante
consiste en
la saponification de la fonction ester des composés (XXVIII) en groupe acide
au moyen
de soude, de potasse ou de lithine dans un solvant tel qu'un alcool ou de
l'eau à une
température variant de la température ambiante à 100 C pour conduire aux
acides
(XXIX). Dans la dernière étape, les composés (XXIX) sont obtenus par la
réaction des
acides (XXVI) avec les dérivés hydroxyamidines (XXX) où Rõ représente un
groupe
alkyle ou aryle éventuellement substitué en présence d'un agent de couplage
tel que le
O-benzotriazol-1-yl-N,N,N',N'-tétraméthyluronium tétrafluoroborate, en
présence ou non
de 1-hydroxybenzotriazole, d'une base comme la triéthylamine, la
diisopropyléthylamine
dans un solvant tel que le diméthylformamide, le tétrahydrofurane ou
I'acétonitrile à une
température variant entre la température ambiante et 100 C.
Le schéma 8 présente une voie de synthèse des composés de formule (I) dans
lesquels R4 est un groupe 1,2,4-oxadiazole, ces composés sont appelés ci-après
composés de formule (XXXI). Dans le cas où X représente un atome d'azote, il
doit être
substitué soit par un groupe R2a,b,c,d (différent de H) soit par un groupe
protecteur Pg tel
que défini précédemment.
Schéma 8 (Méthode 7) :
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
NH
R1b R1a O n CN R1b R1a O N n 4 H-OH
N a R N 3 R
R N~ (R ). 1c (R ) ( 3b)1
1c (R ) 3 3b ~ 2a p
2a p (R3a)i
(R)r (R3a)' R1d X (R2b)r
R1d X 2b (R2da (R2c)Q
(XXXII) (R2d)ô (R2c)4 (XXXIII)
H
N=C
R1b R1a O n /O
~-N a N
\ N 3 (R3b)1
R1c (R
2a)P
(R3a)i
R1d X (R2b)r
(R2d)o (R2c)4
(XXXI)
Dans le schéma 8, les hydroxyamidines (XXXIII) sont obtenus par réaction des
nitriles (XXXII) avec l'hydroxylamine en présence ou non d'une base comme la
5 triéthylamine dans un solvant tel que le méthanol ou l'éthanol, à une
température variant
entre la température ambiante et 100 C. Les oxadiazoles (XXXI) sont obtenus
par
condensation des hydroxyamidines (XXXIII) avec un dérivé de l'acide formique
tel que
le triéthylorthoformiate en présence ou non d'un solvant tel que l'éthanol à
une
température comprise entre la température ambiante et 100 C.
Le schéma 9 présente une voie de synthèse des composés de formule (I) dans
lesquels R4 est un groupe imidazole substitué par un groupe R11, où R11
représente un
groupe (C1-C5) alkyle ou benzyle éventuellement substitué, ces composés sont
appelés
ci-après composés de formule (XXXIV) et (XXXV). Dans le cas où X représente un
atome d'azote, il doit être substitué soit par un groupe R2a,b,c,d (différent
de H) soit par un
groupe protecteur Pg tel que défini précédemment.
Schéma 9 (Méthode 8) :
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
41
N=\ N==\
Rtb Rla 0 n N-õI Rlb Rla 0 N n N,
a Ril
a R1c N 3 (R3b)1
R~ N
c \ ~ N (R2ap 3 (~b)i L9-R~~ ~~ R2a ) p (R )i
ld X R2b)r 3a
3a)i (XXXVII) R
Rld X (R2b)r
(R2d)o (R2~q (R2do (R2c)q (XXXIV)
(XXXVI) Ril
, N--\\
Rlb Rla 0 n N
~--N a
R~~ N (R3b)1
(R 3
2ap (Ra)i
Rid X (R2b)r
(R2d)o (R2c)q (XXXV)
Dans le schéma 9, le mélange des imidazoles substitués (XXXIV) et (XXXV) sont
obtenus par alkylation des imidazoles (XXXVI) avec des agents alkylants
(XXXVII)
présentant un groupe partant Lg (par exemple un atome d'iode, un atome de
brome, un
groupe mésyle ou tosyle) où Rõ représente un groupe (C1-C5) alkyle ou benzyle
éventuellement substitué, en présence d'une base comme la triéthylamine ou le
carbonate de potassium dans un solvant tel que le diméthylformamide ou le
tétrahydrofurane, à une température variant de 0 C à 80 C.
Le schéma 10 présente une voie de synthèse des composés de formule (I) dans
lesquels p représente 1, X est un atome d'azote substitué par le groupe R2a,
ces
composés sont appelés ci-après composés de formule (XXXVIII).
Schéma 10 (Méthode 9) :
R1b R1a 0 R4 R1b R1a 0 n R4
N a ~--N a
Rlc \/ N 3 (R3b)j R~c N 3(R3b)i
(R3a)i (R3a)i
R ~N (R2b)r R1d N (R2b)r
,d PG (R2c)q H (R2d)(R2c)4
(R2do
(XXXIX) (XXXX)
R1b R1a 0 R4
~-N a
R1c N 3 (R3b)1
O=R2a (R3a)i
(XXXXI) Rld N (R2b)r
R a(R2d) (R2c)q
2o
(XXXVI 11)
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
42
Dans le schéma 10, les quinoxalines (XXXX) sont obtenues par déprotection de
la fonction amine des composés de formule (XXXIX), par des méthodes choisies
parmi
celles connues de l'homme du métier. Ces méthodes comprennent entre autres
l'utilisation d'acide trifluoroacétique ou d'acide chlorhydrique dans le
dichlorométhane, le
dioxane, le tétrahydrofurane ou le diéthyléther dans le cas d'une protection
par un
groupement Boc, et de pipéridine pour un groupement Fmoc, à des températures
variant de -10 à 100 C. Dans une dernière étape, les quinoxalines substituées
de
formule (XXXVIII) sont obtenues par amination réductrice, réalisée en mettant
les
composés de formule (XXXX) en présence d'un dérivé du groupe RZa de type
aldéhyde
ou cétone, en utilisant un réducteur tel que le borohydrure de sodium, le
triacétoxyborohydrure de sodium ou le cyanoborohydrure de sodium, en présence
ou
non d'un acide de Brônsted (tel que l'acide chlorhydrique) ou de Lewis (tel
que le
tétraisopropoxyde de titane) dans un solvant tel que le dichloroéthane, le
dichlorométhane, l'acide acétique ou le méthanol, à des températures comprises
entre
-10 C et 30 C.
Le schéma 11 présente une voie de synthèse des composés de formule (I) dans
lesquels X est un atome d'azote, p représente 1, R2a est un groupe CO-
N(R12iR,3) qui
substitue X, R12 et R13 représentent R6 et R7 tels que définis dans la formule
(I), ces
composés sont appelés ci-après composés de formule (XXXXII).
Schéma 11 (Méthode 10):
O
Rly Rla O R4 ~(III) Rlb Rla O Ra
N a ~= Lg Lg - ~- N a
Rlc N (R3b)i Ri c N (R3b)i
(R3a)i 2. ~ 12
' ~3a)i
R N (Rzb)r HN R'd N (RZ ~ zb)r (
~a ( 2c)q q R13 O~ (RzdO q
H (Rzd)o
(~~) (XXXXI I I) N-R1z
(XJCXXI I)
R13
Dans le schéma 11, pour conduire aux urées (XXXXII), les quinoxalines (XXXX)
réagissent, dans un premier temps, avec un carbonyle de formule (III)
présentant deux
groupes partant Lg (par exemple un atome de chlore, un groupe
trichlorométhoxy, un
groupe para-nitrophényle, un groupe imidazole, ou méthyl-imidazolium) en
présence
d'une base comme la triéthylamine ou la diisopropylamine dans un solvant tel
que le
dichlométhane, le tétrahydrofurane à une température variant de la température
ambiante à 80 C. Puis, dans un second temps, les urées (XXXXII) sont obtenues
par la
mise en réaction avec les amines (XXXXIII) en présence ou non d'une base comme
la
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
43
triéthylamine ou le carbonate de potassium dans un solvant tel que le
tétrahydrofurane,
le dichlorométhane, l'acétonitrile ou l'eau, à une température variant de la
température
ambiante à 100 C.
Le schéma 12 présente une voie de synthèse des composés de formule (I) dans
lesquels X est un atome d'azote, p représente 1, R2a est un groupe CO-OR14 qui
substitue X, R14 représente R5 tel que défini dans la formule (I), ces
composés sont
appelés ci-après composés de formule (XXXXIV).
Schéma 12 (Méthode 11):
O
Rlb Rla O n R4 ~(III) Rlb Rla O n Ra
~-N a 1. Lg Lg N a
Rlc N 3(R3b)j Rlo N (R3b)i
.R~a (R3a)i
R2b)r (R3a)i 2. H-0 (R2b)r
R~d H N (Rzc)a (XXXXV) Rla O~ (RZd)(R2c)a
(XXXX) (R2d)O O (XXXXIV)
R14
Dans le schéma 12, pour conduire aux carbamates (XXXXIV) les quinoxalines
(XXXX) réagissent premièrement avec un carbonyle de formule (III) présentant
deux
groupes partant Lg (par exemple un atome de chlore, un groupe
trichlorométhoxy, un
groupe para-nitrophényle, un groupe imidazole, ou méthyl-imidazolium) en
présence
d'une base comme la triéthylamine ou la diisopropylamine dans un solvant tel
que le
dichlométhane, le tétrahydrofurane à une température variant de la température
ambiante à 80 C ; puis, dans un second temps, avec les alcools (XXXXV) en
présence
ou non d'une base comme la triéthylamine ou le carbonate de potassium dans un
solvant tel que le tétrahydrofurane, le dichlorométhane, l'acétonitrile ou
l'eau, à une
température variant de la température ambiante à 100 C, pour conduire aux
carbamates
(XXXXIV).
Le schéma 13 présente une voie de synthèse des composés de formule (I) dans
lesquels X est un atome d'azote, p représente 1, R2a est un groupe COR15 qui
substitue
X, R15 représente R5 tel que défini dans la formule (I), ces composés sont
appelés ci-
après composés de formule (XXXXVI).
Schéma 13 (Méthode 12):
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
44
Rlb Rta O n Ra ~(XXXXVII) Rlb Rla O n Ra
N a p N a Ric N3(~b)j L9 R1e Ric N 3(R3b)j
(R2b)r (R3a)i R,d N (R2b)r (R3a)i N ~ 'R 'R
Rld
H(R2d)o 2c)q O~ (R2d)ô 2c)q
(Xxxx) R15 (XXXXVI)
Dans le schéma 13, pour conduire aux amides (XXXXVI) les quinoxalines
(XXXX) réagissent avec un dérivé d'acide de formule (XXXXVII) présentant un
groupe
partant Lg (par exemple un atome de chlore, un groupe trichlorométhoxy, un
groupe
para-nitrophényle, un groupe imidazole, ou méthyl-imidazolium) en présence
d'une base
comme la triéthylamine ou la diisopropylamine dans un solvant tel que le
dichlométhane,
le tétrahydrofurane à une température variant de la température ambiante à 80
C.
Le schéma 14 présente une voie de synthèse des composés de formule (I) dans
lesquels l'un des groupes R, est un groupe -COOH (par exemple placé ci-après,
en
position R,c) ainsi qu'aux composés de formule (IC) dans lesquels l'un des
groupes R,
est un groupe -CH2OH, ces composés sont appelés ci-après composés de formule
(XXXXVI I I).
Schéma 14 (Méthode 13) :
R1b R1a O >3(R3b)j R1b R1a O n
N Ra ~N Ra
3 (R3b)j
R160OC N (R ) (H02C N (R2a) R
2a p p
Rid X (R2b)r R3a)i R~d X (R2b)r ( 3a)i
(R2d)o (R2c)q (R2d)o (R2c)q
(XXXXVI) ()(XXXVI I I)
Rtb R1a O n
~N Ra
HOH2C N 3 (R3b)j
~ R2a)p
Rld X R2b)r (R3a)i
(R2d)o (R2c)q
(IC)
Les composés de formule (XXXXVIII) peuvent être synthétisés par saponification
des esters de formule (XXXXVI), par exemple en présence d'hydroxyde de sodium
ou
d'hydroxyde de lithium dans un solvant tel que le méthanol, le
tétrahydrofurane ou l'eau,
ou un mélange de ces solvants. Les composés de formule (IC) sont obtenus par
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
réduction des acides (XXXXVIII) ou des esters de formule (XXXXVI) en utilisant
des
réducteurs tels que l'hydrure de lithium aluminium ou, après formation d'un
anhydride
mixte en présence de chloroformiate d'isobutyle et de triéthylamine dans le
tétrahydrofurane ou le dioxane, le borohydrure de sodium dans le méthanol ou
l'éthanol
5 à des températures variant de -40 C à 10 C.
Le schéma 15 présente deux voies d'accès aux intermédiaires de synthèses de
formule (C) dans lesquels R17 est un atome d'hydrogène, un groupe (C1-C5)
alcoxy, ou
(C1-C5) halogénoalkyle et L un Iinker (simple liaison, groupe (C1-C5) alcoxy,
groupe (C,-
10 C5) alkyle) et R16 est défini comme précédemment.
Schéma 15
R~n R~a
Rln Rle GP X P GP
R" N i (Rza)v ~F ÇRl7 Rl~ N (R ~P
(R
R N Rla H~(Rzn)1 L p td OIR17
~ ` ZJq
(CI) (RzJQ (CII~ R1e (CIII) Y L-yO, R1e
O
O (CIV)
R17
L-, CN Rlb Rta
H
Rln Rla Rtb Rl-e /
- Boc H R~~ ~ (R~)v
Rio N RR~)P -- Ric N (RR~)v R~e o N (RZq),
R~d N( zn), Rld N~( zn),
(RzJQ OR17 (RzJa R
L~O'R
R~~ >e
L-CN L-COOH O
(CV) (CVI) (C)
Dans le schéma 15, les composés de formule (CIII) peuvent être préparés par
15 couplage entre une tétrahydro-quinoxaline monoprotégée de formule (CI) et
un dérivé
(CII) présentant un groupe X (par exemple un halogène, un groupe tosylate,
triflate ou
nanoflate) en présence d'une espèce organométallique tel qu'un dérivé du
palladium, en
présence ou non d'une phosphine tel que la triterbutylphosphine ou la
triphénylphosphine, en présence d'une base comme le carbonate de potassium, le
20 fluorure de potassium, le tertbutylate de potassium ou le phosphate de
potassium dans
un solvant ou mélange de solvant tel que le dioxane, l'éthylène glycol
diméthyléther, le
toluène, le tétrahydrofurane, l'eau à une température variant de la
température ambiante
à 100 C. Les amines (C) sont obtenues par déprotection de la fonction amine
des
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
46
composés de formule (CIII), par des méthodes choisies parmi celles connues de
l'homme du métier. Elles comprennent entre autres l'utilisation d'acide
trifluoroacétique
ou d'acide chlorhydrique dans le dichlorométhane, le dioxane, le
tétrahydrofurane ou le
diéthyléther dans le cas d'une protection par un groupement Boc, et de
pipéridine pour
un groupement Fmoc, à des températures variant de -10 à 100 C. Une approche
alternative à la synthèse des intermédiaires (C) consiste à réaliser une
réaction de
substitution aromatique nucléophile entre la tétrahydroquinoxaline
monoprotégée (CI) ou
le groupe protecteur est un groupement "boc" et un dérivé cyano aromatique
(CIV) dans
lesquels Y est un atome d'halogène (par exemple le fluor) en présence d'une
base
comme le tert-butylate de potassium ou l'hexaméthyldisilazane de sodium dans
un
solvant tel que la N-méthyle pyrrolidinone ou le dimethylformamide, à une
température
variant de la température ambiante à 100 C. La fonction cyano des composés
(CV) est
ensuite hydrolysée en milieu acide au moyen par exemple d'une solution d'acide
chlorhydrique concentré dans un solvant tel que l'eau à une température
variant de la
température ambiante à 100 C pour conduire aux acides (CVI) dans lesquels le
groupe
protecteur "boc" a été simultanément retiré. Finalement, l'ester (C) est
obtenus par
estérification du dérivé acide (CVI) avec un alcool HOR16 dans des conditions
de
couplage peptidique classiques, en utilisant par exemple comme agent couplant
le
dicyclohexylcarbodiimide, le chlorhydrate du 1-(3-diméthylaminopropyl)-3-
éthylcarbodiimide ou le bromo-tris-pyrrolidino-phosphonium
hexafluorophosphate, en
présence ou non d'hydroxybenzo-triazole, et en utilisant comme base organique
la
triéthylamine ou la diisopropyl-éthylamine dans un solvant tel que le dioxane,
le
dichlorométhane ou l'acétonitrile.
Le schéma 16 présente une voie de synthèse des composés de formule (CVII),
qui correspondent à des composés de formule (I) dans lesquels R2d comprend L2
qui est
un linker (simple liaison ou groupe (C1-C5) alkyle), L et R17 sont définis
comme
précédemment.
Schéma 16 (Méthode 14)
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
47
Rm Rta Rtn RteO~ Rtn Rta ~ Ra
Lg
Rt~ N (~P O Rt~ N Rtc N(~)N (R~j
Rtd NT (R~r LgxLg- Rtd N~( (~n%~r)P + ti-N na R-iRtd N~(Ray), (~a)~
(Rzo)y (III) ~/ (~~Q a (Rx) Lz (Rzo)y
(~a)~
Rn QRI7 M QR17
(C) L y O, Rts (CVIII) Ly O. Rts LY 0\ R (CIX)
ts
O O O
Rte Rta O Ra Rte Rta 0 Ra Rtb Rta 0 n Ra
~-N
N a N a
<
Rto N (~) 3 (Rn)t Rtc N (R,)P (R.)j Rto N (~ (R3 ) (~i
3a i
P (R~) (~a)j Rtd N~(~)rP
Rtd N~(R m)r Rtd ~(~)r h{NRsR7 (RzrI
~ (R 2Jq (R2Jq 4
(CXI)
Rn ~ Rn Rn
LYO`Rts (CIX) LyOH (CX) L (CVII)
O O Rs~N~R7
Dans le schéma 16, les composés de formule (CVIII) peuvent être préparés
par réaction entre les intermédiaires de formule (C) et un carbonyle de
formule (III)
présentant deux groupes partant Lg (par exemple un atome de chlore, un groupe
trichlorométhoxy, un groupe para-nitrophényle, un groupe imidazole, ou méthyl-
imidazolium) en présence d'une base comme la triéthylamine ou la
diisopropylamine
dans un solvant tel que le dichlométhane, le tétrahydrofurane à une
température variant
de la température ambiante à 80 C. Les composés de formule (CIX) sont obtenus
par
couplage entre les dérivés activés (CVIII) et les amines (V) en présence ou
non d'une
base comme la triéthylamine ou le carbonate de potassium dans un solvant tel
que le
tétrahydrofurane, le dichlorométhane, I'acétonitrile ou l'eau, à une
température variant
de la température ambiante à 100 C. La fonction ester des composés (CIX) est
ensuite
saponifié en fonction acide au moyen de soude, de potasse ou de lithine dans
un
solvant ou mélange de solvant tel qu'un alcool, de l'eau ou du
tétrahydrofurane à une
température variant de la température ambiante à 100 C pour conduire aux
acides (CX).
Dans la dernière étape, les composés (CVII) peuvent être préparés par
condensation
entre les intermédiaires acide de formule (CX) et une amine (CXI) dans des
conditions
de couplage peptidique classiques, en utilisant par exemple comme agent
couplant le
dicyclohexylcarbodiimide, le chlorhydrate du 1-(3-diméthylaminopropyl)-3-
éthylcarbodiimide ou le bromo-tris-pyrrolidino-phosphonium
hexafluorophosphate, en
présence ou non d'hydroxybenzo-triazole, et en utilisant comme base organique
la
triéthylamine ou la diisopropyl-éthylamine dans un solvant ou mélange de
solvant tel que
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
48
le dioxane, le dichlorométhane ou l'acétonitrile.
Le schéma 17 présente une voie de synthèse alternative des intermédiaires de
formule (XV) tel que défini précédemment.
Schéma 17:
Rte Rta O n O Rit Rta O Rte Rla O
N S-A ~NB- O N R4
R,c N (R O-~ R1c N (R 3(R3~. R1c N(R (R3t)j
) za)v R ~ V R za)v
(R3a)f ( 3a i
Rld X~(R2n),P Rm X (Rzn)I ( a) (CXII) Rld X~(R~), R).
(R,)u (RZJa (R2d)a (R2da (Rx)u (Rzdy
(XIV) (CXI) (XV)
Dans le schéma 17, les composés de formule (CXI) peuvent être préparés par
transformation de la fonction ester suifonique des composé (XIV) en un dérivé
d'ester
boronique (CXI) par une réaction avec le bispinacolatodiborane en présence
d'un
complexe du palladium tel que le 1,1'-
bis(diphenylphosphino)ferrocedichloropalladium
(II) en présence d'une base comme l'acétate de potassium, de chlorure de
lithium dans
un solvant ou mélange de solvant tel que le dichlorométhane, le dioxane, le
dimethylsulfoxide à une température variant de la température ambiante à 100
C. Dans
une deuxieme étape, les dérivés (XV) peuvent être obtenus par une réaction de
couplage entre le dérivé (CXI) et un composé (CXII) présentant un groupe V
(par
exemple un halogène, un triflate, un nonaflate) en présence d'une espèce
organométallique tel qu'un dérivé du palladium, en présence ou non d'une
phosphine tel
que la tricyclohexylphosphine ou la triphenylphosphine, en présence d'une base
comme
le carbonate de sodium ou potassium, le fluorure de potassium dans un solvant
ou
mélange de solvant tel que le dioxane, le dimethylformamide, l'éthylène glycol
diméthyléther, le tétrahydrofurane, l'eau à une température variant de la
température
ambiante à 100 C.
Le schéma 18 présente une voie de synthèse alternative des composés de
formule (XXXVIII) dans lesquels R2d est un groupe (C1-C5) alkyle, aryl (C1-C5)
alkyle ou
hétéroaryl (C,-C5) alkyle, (les groupes aryle, hétéroaryle pouvant être
éventuellement
substitués).
Schéma 18 (méthodel5):
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
49
Rlu Rla Rle RIa Rio Rla
PG PG H
Rlc N (Rzs)p =R Rlc N (Rza)p -- Ric N (Rze)p
0 zd e(R2 ~R
Rt a N (Rzb)r (= CXI`n) Rld Nr Rtd N ( zb)r
H (Rzdv ~d (Rzàq Rzd (Rzdq
(CI) (CXIII) (CXV)
Rlo Rla
H Rln R1a 0
R / ~ - ~Lg Rio Ria C Ra
N (Rza)p L9 Lg Rlc N a Ra - ~ N e
-- ~~ (Rza)p + HN a Rlc s(Rat
Rid N ( (Rzo)r (III) Rid nj~R2~r a (Rso)1 (Rza)p (~ta)i
'.2d R2d (RzdC (R3a)1 Rld N~(Rb/r
(CXV) (CXVI) Rzd (RzJq
(XXXVIII)
Les tétrahydro-quinoxalines substituées de formule (CXIII) sont obtenues par
amination réductrice, réalisée en mettant les composés de formule (CI) en
présence
5 d'un dérivé du groupe R2d de type aldéhyde ou cétone (CXIV), en utilisant un
réducteur
tel que le borohydrure de sodium, le triacétoxyborohydrure de sodium ou le
cyanoborohydrure de sodium, en présence ou non d'un acide de Brônsted (tel que
l'acide chlorhydrique) ou de Lewis (tel que le tétraisopropoxyde de titane)
dans un
solvant tel que le dichloroéthane, le dichlorométhane, l'acide acétique ou le
méthanol, à
10 des températures comprises entre -10 C et 30 C. Les amines (CXV) sont
obtenues par
déprotection de la fonction amine des composés de formule (CXIII), par des
méthodes
choisies parmi celles connues de l'homme du métier. Elles comprennent entre
autres
l'utilisation d'acide trifluoroacétique ou d'acide chlorhydrique dans le
dichlorométhane, le
dioxane, le tétrahydrofurane ou le diéthyléther dans le cas d'une protection
par un
groupement Boc, et de pipéridine pour un groupement Fmoc, à des températures
variant de -10 à 100 C. Dans une étape suivante, les composés de formule
(CXVI)
peuvent être préparés par réaction entre les intermédiaires de formule (CXV)
et un
carbonyle de formule (III) présentant deux groupes partant Lg (par exemple un
atome de
chlore, un groupe trichlorométhoxy, un groupe para-nitrophényle, un groupe
imidazole,
ou méthyl-imidazolium) en présence d'une base comme la triéthylamine ou la
diisopropylamine dans un solvant tel que le dichlométhane, le tétrahydrofurane
à une
température variant de la température ambiante à 80 C. Les composés de formule
(XXXVIII) sont obtenus par couplage entre les dérivés activés (CXVI) et les
amines (V)
en présence ou non d'une base comme la triéthylamine ou le carbonate de
potassium
dans un solvant tel que le tétrahydrofurane, le dichlorométhane,
I'acétonitrile ou l'eau, à
une température variant de la température ambiante à 1 00 C.
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
Le schéma 19 présente une voie de synthèse des intermédiaires de formule
(CXVII), où l'atome de carbone qui porte le groupe spiro cyclopropyle n'est
pas adjacent
à l'atome d'azote de la tétrahydroquinoline.
5 Schéma 19 :
Rtt Rta
GP Rlo Ria D,Si Rtb Rta
i GP - GP
R~` N -- R~o N C'F``0 _ Rtc ~ ~ N
(~a)p (p ' ~2a)P (CXX) ('p
`2a)P
Rid (R2b]r Rtd (R2Wr R1d F (' ]r
F
(CXVIII) (CXIX) (CXXI)
Rio Rla
- GP Rlo Rta
~ H
R N (R2a)p-~ R~` N p
R1d (p' ~2dr (' ~2a)p
F Rid (R2b)r
F F
F
(CXXI) (CXVII)
10 Les composés (CXIX) peuvent être obtenus par transformation de la fonction
cétone de l'intermédiaire (CXVIII) en dérivé éthylénique, au moyen par exemple
d'une
réaction de Wittig avec du bromure de méthyltriphénylphosphonium, en présence
d'une
base tel que le tert-butylate de potassium, dans un solvant comme l'éther. Les
dérivés
spirocyclorponaiques (CXXI) peuvent être ensuite obtenus par l'utilisation du
fluorosulfonydifluoroacetate de triméthylsilyle (CXX), en présence d'une
source de fluor
tel que le fluorure de sodium, dans un solvant comme le toluène, à une
température
variant de l'ambiante à 100 C. Les amines (CXVII) sont obtenues par
déprotection de la
fonction amine des composés de formule (CXXI), par des méthodes choisies parmi
celles connues de l'homme du métier. Elles comprennent entre autres
l'utilisation d'acide
trifluoroacétique ou d'acide chlorhydrique dans le dichlorométhane, le
dioxane, le
tétrahydrofurane ou le diéthyléther dans le cas d'une protection par un
groupement Boc,
et de pipéridine pour un groupement Fmoc, à des températures variant de -10 à
100 C.
Le schéma 20 présente une voie de synthèse des intermédiaires de formule
(CXXIII) où le groupement difluorovinyle n'est pas adjacent à l'atome d'azote
de la
tetrahydroquinoline.
Schéma 20:
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
51
Rtb Rla Rlo Rla
GP GP R" R'a
~ / H
RiC N (R2a)p R~a N (Rza)v _ Rlc N
(~a)v
Rta O (Rm)r Rla (Rzo)r Ria (Rzo)r
F F F F
(CXVIII) (CXXII I) (CXXII)
Les composés (CXXIII) peuvent être obtenus par transformation de la fonction
cétone de l'intermédiaire (CXVIII) en dérivé difluoroéthylénique, au moyen par
exemple
d'une réaction de Wittig avec de la tri n-butylphosphine et du
chlorodifluoroacetate de
sodium, dans un solvant comme la N-méthylpyrrolidinone à une température
variant de
l'ambiante à 160 C. Les amines (CXVII) sont obtenues par déprotection de la
fonction
amine des composés de formule (CXXI), par des méthodes choisies parmi celles
connues de l'homme du métier. Elles comprennent entre autres l'utilisation
d'acide
trifluoroacétique ou d'acide chlorhydrique dans le dichlorométhane, le
dioxane, le
tétrahydrofurane ou le diéthyléther dans le cas d'une protection par un
groupement Boc,
et de pipéridine pour un groupement Fmoc, à des températures variant de -10 à
100 C.
Le schéma 21 détaille une synthèse racémique de pyrrolidine de formule (CXXXI)
dans laquelle R3 ne peut pas être porté par le même carbone que Ar, ainsi que
la
séparation des deux énantiomères (CXXIV) et (CXXV). Ar étant un groupe aryle
ou
hétéroaryle éventuellement substitué et R3 étant tel que défini précédemment.
Schéma 21 :
N GP O N~GP N GP
W.u r\
O~ ) ~S.G = D-Ar Ar-./
~R, / R3 (CXXVIII) IIR~~3
(CXXVI) (CXXVII) (CXXIX)
GP
N~ /GP (+/-) N Ar~NH (CXXIV)
Ar~% Ar~V / Ar~% (+) R3
R 3 IIRf R3 Ar~NH (CXXV)
(CXXIX) (CXXX) (CXXXI) (-) R3
Dans le schéma 21, les héterocycles (CXXVII) dont la fonction amine est
protégée par un groupement protecteur Pg (par exemple un groupement Boc ou
Fmoc)
présentant un groupe vinyle sulfonate-W (par exemple W peut être un groupe
trifluorométhyle, un groupe nonafluorobutyle) peuvent être préparés par
transformation
des cétones (CXXVI) avec un agent de sulfonatation tel que l'anhydride
trifluorométhanesulfonique ou le N-phényltrifluorométhanesulfonimide en
présence
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
52
d'une base comme le diisopropyle amidure de lithium ou l'hexaméthyle
disilazane de
lithium dans un solvant tel que le tétrahydrofurane ou l'éthylèneglycol
diméthyl éther à
une température variant de -78 C à la température ambiante. Les hétérocycles
(CXXIX)
sont obtenus par couplage organométallique entre un dérivé (CXXVII) et un
composé
(CXXVIII) où D est un dérivé du bore (par exemple un acide boronique ou un
ester
boronique), de l'étain (par exemple un groupe tri n-butyle étain) ou un atome
d'halogène
(par exemple le brome ou l'iode) en présence d'un dérivé métallique approprié
(par
exemple des dérivés du palladium, du zinc ou du cuivre) en présence d'une base
ou non
telle que le carbonate de potassium, le fluorure de potassium ou le phosphate
de
sodium dans un solvant ou mélange de solvant tel que le dioxane, l'éthylène
glycol
diméthyléther, le toluène, l'eau à une température variant de la température
ambiante à
120 C. Dans le cas où le groupe Ar est un pyrazole, si la fonction NH libre de
l'hétérocycle est présente, elle peut-être éventuellement protégée par un
groupe
protecteur (par exemple un groupe Boc), avant de réaliser la réaction de
couplage
catalyser par une espèce organométallique. En générale, au cours de la
réaction de
couplage, le groupe protecteur (spécialement si c'est un groupe Boc) s'enlève
partiellement ou totalement du noyau pyrazole. La double liaison des
hétérocycles
(CXXIX) est ensuite hydrogénée avec un catalyseur métallique approprié dans le
méthanol ou l'éthanol pour conduire aux dérivés (CXXX). Dans une dernière
étape de
synthèse, les amines de formule (CXXXI) sont obtenues par déprotection de la
fonction
amine des composés de formule (CXXX) par des méthodes connues de l'homme du
métier. Elles comprennent entre autres l'utilisation d'acide trifluoroacétique
ou d'acide
chlorhydrique dans le dichlorométhane, le dioxane, le tétrahydrofurane ou le
diéthyléther
dans le cas d'une protection par un groupement Boc, et de pipéridine pour un
groupement Fmoc, à des températures variant de -10 C à 100 C.
Le mélange des deux énantiomères (CXXIV) et (CXXV) peut être séparé au
moyen des méthodes connues de l'homme du métier. En particulier par une
chromatographie haute pression ou super critique sur phase stationnaire
chirale tel
qu'un dérivé l'Amylose tris (3,5-dimethylphenylcarbamate) déposée sur un
support de
silice sphérique, ou par recristallisation en présence d'un acide optiquement
actif tel que
l'acide tartrique ou l'acide camphorsulfonique.
Dans les schémas 1 à 21, les composés de départ et les réactifs, quand leur
mode de préparation n'est pas décrit, sont disponibles dans le commerce ou
décrits
dans la littérature, ou bien peuvent être préparés selon des méthodes qui y
sont décrites
ou qui sont connues de l'homme du métier. De façon générale, les dérivés avec
un
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
53
groupe acide peuvent aussi être obtenus classiquement par hydrolyse des
groupes
cyano correspondant.
L'invention, selon un autre de ses aspects, a également pour objet les
composés
de formules (XIV), (XV), (XVIII), (XXIV), (XXIX), (XXVIII), (XXXIII), (C),
(CIX), (CX),
(CXVII) et (CXXII). Ces composés sont utiles comme intermédiaires de synthèse
des
composés de formule (I).
Les exemples suivants décrivent la préparation de certains composés conformes
à l'invention. Ces exemples ne sont pas limitatifs et ne font qu'illustrer la
présente
invention. Les numéros des composés exemplifiés renvoient à ceux donnés dans
le
tableau ci-après, qui illustre les structures chimiques et les propriétés
physiques de
quelques composés selon l'invention.
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
54
Exemple 1 : 1'-(3,4-dihydroquinolin-1(2H)-ylcarbonyl)spiro[indène-1,4'-
pipéridine] (composé n 15 )
1_1 : 4-nitrophényl 3,4-dihydroquinolin-1(2H)-carboxylate
Dans un ballon de 1 I sont introduits 1.0 g de 1,2,3,4-tétrahydroquinoline,
10,46 ml de triéthylamine, 270 ml de tétrahydrofurane, puis 15,13 g de
paranitrophénylchloroformiate. Le milieu réactionnel est agité pendant deux
heures à
température ambiante puis filtré. Le solvant est évaporé sous pression réduite
et le
résidu est repris par du dichlorométhane, lavé avec une solution aqueuse
d'acide
chlorhydrique 2N, puis deux fois à l'eau. La phase organique est séchée sur
sulfate de
magnésium et le solvant est évaporé sous pression réduite pour conduire à 21,5
g de 4-
nitrophényl 3,4-dihydroquinoline-1(2H)-carboxylate.
M+H+=299, 5
1_2 : 1'-(3,4-dihyd roquinolin-1(2H)-ylcarbonyl)spiro[i ndène-1,4'-pipéridine]
Dans un tube en verre de 10 ml sont introduits 0,4 g de 4-nitrophényl 3,4-
dihydroquinolin-1(2H)-carboxylate, 0,357 g du chlorhydrate de 4-spiroindène-
pipéridine,
0,28 ml de triéthylamine et 2 ml d'eau. Le tube est scellé, puis chauffé à 150
C sous
irradiation micro-ondes pendant 50 minutes. Du dichlorométhane est ajouté. La
phase
organique est séchée sur sulfate de magnésium, et on évapore le solvant sous
pression
réduite. Le résidu est chromatographié sur gel de silice par un gradient
d'heptane/acétate d'éthyle de 9/1 à 0/1. On obtient 0,393 g de 1'-(3,4-
dihydroquinolin-
1(2H)-ylcarbonyl)spiro[indène-1,4'-pipéridine].
Point de fusion =130-133 C; M+H+=345,3
RMN 'H (CDCI3, 200MHz), b(ppm) : 1,34 (m, 2H) ; 1,95-2,15 (m, 2H) ; 2,8 (t,
2H) ; 3,15 (dt, 2H) ; 3,7 (t, 2H) ; 4,0 (m, 2H) ; 6,8 (d, 1 H) ; 6,9 (d, 1H) ;
6,91-7 (m, 1 H) ;
7,1-7,4 (m, 7H).
Exemple 2: 1-(3,4-dihydroquinolin-1(2H)-ylcarbonyl)-4-phénylpipéridine-4-
carbonitrile (composé n 17)
2_1 : Chlorure de l'acide 3,4-dihydroquinolin-1(2H)-carbamique
A une solution de 5,5 g de 1,2,3,4-tétrahydroquinoline et de 6,4 ml de
triéthylamine dans 213 ml de dichlorométhane à 0 C, est ajouté 4,9 g de
triphosgène. Le
mélange réactionnel est mis sous agitation pendant 3h, puis est versé sur un
mélange
d'eau et de glace. Une solution aqueuse saturée d'hydrogénocarbonate de sodium
et du
dichlorométhane sont ajoutés. La phase aqueuse est extraite au
dichlorométhane. Les
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
phases organiques sont rassemblées, lavées à l'eau et avec une solution
aqueuse
saturée en chlorure de sodium, séchées sur sulfate de sodium, puis le solvant
est
évaporé sous pression réduite pour conduire à 7,8 g de 3,4-dihydroquinolin-
1(2H)-
carbonyl chlorure.
5 M+H+=196,4
2_2 : N,N-bis(2-chloroéthyl)-3,4-dihydroquinolin-1(2H)-carboxamide
Dans un ballon de 500 ml est introduite une solution de 7 g de chlorure de
l'acide
3,4-dihydroquinolin-1(2H)-carbamique dans 180 ml d'acétonitrile. On ajoute
ensuite,
9,6 g de chlorhydrate de bis(2-chloroéthyl)amine et 14,83 g de carbonate de
potassium
10 et la réaction est mise sous agitation pendant 18h. L'acétonitrile est
évaporé sous
pression réduite et on ajoute ensuite de l'eau et de l'acétate d'éthyle. La
phase aqueuse
est extraite à l'acétate d'éthyle, puis les phases organiques sont
rassemblées, lavées à
l'eau, séchées sur sulfate de sodium, puis le solvant est évaporé sous
pression réduite.
Le résidu est chromatographié sur gel de silice par un gradient de
15 dichlorométhane/méthanol de 1/0 à 95/5. On obtient 2,91 g de N,N-bis(2-
chloroéthyl)-
3,4-dihydroquinolin-1(2H)-carboxamide.
M+H+=301,3 ;303,4
2_3 : 1-(3,4-dihydroquinolin-1(2H)-ylcarbonyl)-4-phénylpipéridine-4-
carbonitrile
20 Dans un tricol de 25 ml est introduit 0,29 ml de phénylacétonitrile dans 6
ml de
tétrahydrofurane. On ajoute ensuite à 0 C, 0,38 g d'hydrure de sodium. Le
milieu
réactionnel est agité pendant 30 min à température ambiante, puis à 0 C on
ajoute 0,5 g
de N,N-bis(2-chloroéthyl)-3,4-dihydroquinolin-1(2H)-carboxamide. Le mélange
réactionnel est porté au reflux pendant 3h, puis de la glace, de l'eau et de
l'acétate
25 d'éthyle sont ajoutés. La phase aqueuse est extraite à l'acétate d'éthyle
puis les phases
organiques sont rassemblées, lavées à l'eau, séchées sur sulfate de sodium,
puis le
solvant est évaporé sous pression réduite. Le résidu est chromatographié sur
gel de
silice par un gradient d'heptane/méthanol de 1/0 à 95/5. On obtient 2,91 g de
1-(3,4-
dihydroquinolin-1(2H)-ylcarbonyl)-4-phénylpipéridine-4-carbonitrile.
30 Point de fusion = 53-59 C, M+H+=346,3
RMN 'H (CDCI3, 200MHz), b(ppm) : 1,7-1,92 (m, 6H); 2,6 (t, 2H); 3,05 (dt, 2H);
3,48 (t, 2H); 3.8 (m, 2H); 6,78 (t, 1H); 6,84-7 (m, 3H); 7,11-7,31 (m, 5H).
Exemple 3: Chlorhydrate de la 4-[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-
35 3,4-dihydro-2H-1,4-benzoxazine (composé N 26)
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
56
3_1 : 4-nitrophényl 2,3-dihydro-4H-1,4-benzoxazine-4-carboxylate
Dans un ballon de 100 ml est introduit 1 g de 3,4-dihydro-2H-1,4-benzoxazine,
1,03 ml de triéthylamine, 27 ml de tétrahydrofurane, puis 1,5 g de
paranitrophényl-
chloroformiate. Le milieu réactionnel est agité pendant trois heures à
température
ambiante puis filtré. Lé solvant est évaporé sous pression réduite et le
résidu est repris
par du dichlorométhane, lavé avec une solution aqueuse d'acide chlorhydrique
2N, puis
deux fois à l'eau. La phase organique est séchée sur sulfate de magnésium et
le solvant
est évaporé sous pression réduite pour conduire à 2,1 g de 4-nitrophényl 2,3-
dihydro-
4H-1,4-benzoxazine-4-carboxylate.
M+H+=301
3_2 : 4-[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-3,4-dihydro-2H-1,4-
benzoxazine
Dans un tube en verre de 10 ml est introduit 0,2 g de 4-nitrophényl 2,3-
dihydro-
4H-1,4-benzoxazine-4-carboxylate, 0,1 g de 3-pyrrolin-3-ylpyridine, et 1,5 ml
d'eau. Le
tube est scellé, puis chauffé à 100 C sous irradiation micro-ondes pendant 35
minutes.
Du dichlorométhane est ajouté. La phase organique est séchée sur sulfate de
magnésium, et on évapore le solvant sous pression réduite. Le résidu est
chromatographié sur gel de silice par un gradient de dichloromethane/methanol
de 1/0 à
95/5. On obtient 0,19 g de 4-[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-3,4-
dihydro-2H-1,4-
benzoxazine
M+H+=310
3_3: Chlorhydrate de la 4-[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-3,4-
dihydro-2H-1,4-benzoxazine
Dans un ballon de 25 ml contenant 0,18 g de 4-[(3-pyridin-3-ylpyrrolidin-1-
yl)carbonyl]-3,4-dihydro-2H-1,4-benzoxazine est additionné 5,82 ml d'une
solution 0,2N
d'acide chlorhydrique dans l'éther. On maintient l'agitation pendant 10 min.
Après
évaporation, on reprend le résidu dans l'éther. Le précipité est filtré puis
séché sous
vide. On obtient 0,12 g du chlorhydrate de la 4-[(3-pyridin-3-ylpyrrolidin-1-
yl)carbonyl]-
3,4-dihyd ro-2H-1,4-benzoxazine.
Point de fusion =60-90 C, M+H+=310,4
RMN 'H (DMSO-d6, 200MHz), b(ppm) : 1,9-2,18 (m, 1H) ; 2,2-2,4 (m, 1H) ; 3,3-
3,9 (m, 7H) ; 4,08-4,4 (m, 2H) ; 6,7-6,9 (m, 3H) ; 7-7,12 (m, 1 H) ; 7,9 (dd,
1 H) ; 8,4
(d,1 H) ; 8,7(d, 1H) ; 8,8(d,1 H).
Exemple 4 : 1-({4-[3-(2,6-dichlorophényl)-1,2,4-oxadiazol-5-yl]pipéridin-1-
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
57
yl}carbonyl)-1,2,3,4-tétrahydroquinoline (composé n 25)
4_1 : 1-(1 H-imidazol-1-ylcarbonyl)-1,2,3,4-tétrahydroquinoline
Dans un ballon de 500 ml on introduit 15,4 g de 1,1'-carbonyldimidazole, 125
ml
de tétrahydrofurane et 9,43 ml de 1,2,3,4-tétrahydroquinoline. Le milieu
réactionnel est
mis au reflux pendant 20 heures. Le solvant est évaporé sous pression réduite
et le
résidu est repris par de l'acétate d'éthyle, puis lavé à l'eau. La phase
organique est
séchée sur sulfate de sodium et le solvant est évaporé sous pression réduite
pour
conduire à 16,04 g de 1-(1H-imidazol-1-ylcarbonyl)-1,2,3,4-
tétrahydroquinoline.
M+H+=228
4_2: Iodure de 1-(3,4-dihydroquinolin-1(2H)-ylcarbonyl)-3-méthyl-1H-
imidazol- 3-ium.
Dans un ballon de 500 ml on introduit 13,3 g de 1-(1H-imidazol-1-ylcarbonyl)-
1,2,3,4-tétrahydroquinoline, 133 ml d'acétonitrile et 14,6 ml d'iodométhane.
La réaction
est mise sous agitation pendant 20h, puis le solvant est évaporé sous pression
réduite
pour conduire à 23 g d'iodure de 1-(3,4-dihydroquinolin-1(2H)-ylcarbonyl)-3-
méthyl-1H-
imidazol-3-ium.
M+H+=242
4_3 : Ethyl 1-(3,4-dihydroquinolin-1(2H)-ylcarbonyl)pipéridine-4-carboxylate
Dans un ballon de 500 ml on introduit 16,5 g d'iodure de 1-(3,4-
dihydroquinolin-
1(2H)-ylcarbonyl)-3-méthyl-1 H-imidazol-3-ium, 224 ml de dichlorométhane et
8,45 g
d'isonipecotate d'éthyle, puis 31,22 ml de triéthylamine. Le milieu
réactionnel est mis
sous agitation à température ambiante pendant 20 heures. Le solvant est
évaporé sous
pression réduite et le résidu est repris par de l'acétate d'éthyle, puis lavé
à l'eau. La
phase organique est séchée sur sulfate de sodium et le solvant est évaporé
sous
pression réduite pour conduire à 15,2 g d'éthyl 1-(3,4-dihydroquinolin-1(2H)-
ylcarbonyl)pipéridine-4-carboxylate.
M+H+=317
4_4 : acide 1-(3,4-dihydroquinolin-1(2H)-ylcarbonyl)pipéridine-4-
carboxylique
Dans un ballon de 1 I, on introduit 11,2 g d'éthyle 1-(3,4-dihydroquinolin-
1(2H)-
ylcarbonyl)pipéridine-4-carboxylate, 443 ml d'éthanol et 163 ml d'une solution
aqueuse
1 N de soude. Le milieu réactionnel est chauffé à 50 C pendant 4h30. L'éthanol
est
évaporé sous pression réduite et on ajoute ensuite une solution aqueuse 1 N
d'acide
chlorhydrique. Le précipité est filtré, lavé à l'eau puis séché sous pression
réduite. On
obtient 9.5 g d'acide 1-(3,4-dihydroquinolin-1(2H)-ylcarbonyl)pipéridine-4-
carboxylique.
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
58
M+H+=289
4.5 . 1-({4-[3-(2,6-dichlorophenyl)-1,2,4-oxadiazol-5-yl]pipéridin-1 -
yI}carbonyl)-1,2,3,4-tétrahydroquinoline
Dans un ballon de 100 ml, on introduit 0,3 g d'acide 1-(3,4-dihydroquinolin-
1(2F
ylcarbonyl)pipéridine-4-carboxylique, 11 ml de diméthylformamide, 0,67 g de O-
benzotriazol-1-yl-N,N,N',N'-tétraméthyluronium tétrafluoroborate, 0,028 g de 1-
hydroxybenzotriazole, 0,91 ml de diisopropyléthylamine, puis 0,32 g de 2,6-
dichloro-N'-
hydroxybenzènecarboximidamide. Le milieu réactionnel est agité à température
ambiante pendant 1 h30 puis chauffé à 95 C pendant 20 heures. De l'eau est
ajoutée et
le mélange est extrait à l'acétate d'éthyle. La phase organique est lavée
trois fois à l'eau,
séchée sur sulfate de sodium et le solvant est évaporé sous pression réduite.
Le résidu
est chromatographié sur gel de silice par un gradient d'heptane/acétate
d'éthyle de 0/1 à
1/1. On obtient 0,18 g de 1-({4-[3-(2,6-dichlorophényl)-1,2,4-oxadiazol-5-
yl]pipéridin-1-
yl}carbonyl)-1,2,3,4-tétrahydroquinoline.
Point de fusion =63-68 C, M+H+=457
RMN 'H (DMSO, 200MHz), b(ppm) : 1,6-1,92 (m, 4H) ; 1,98-2,14 (m, 2H) ; 2,72
(t, 2H) ; 3,1 (dt, 2H) ; 3,32-3,56 (m, 3H) ; 3,7 (dt, 2H) ; 6,75-7,1 (m, 4H) ;
7,58-7,3
(m,3H).
Exemple 5: Chlorhydrate de la 1-[(4-pyridin-4-ylpipéridin-1-yl)carbonyl]-
1,2,3,4-tétrahydroquinoline (composé n 4)
5_1 : tert-butyl4-{[(trifluorométhyl)sulfonyl]oxy}-3,6-dihydropyridine-1(2H)-
carboxylate
Dans un tricol de 250 ml sous azote, on ajoute goutte à goutte 5,52 ml d'une
solution 2,5 N de n-butyl lithium dans de l'hexane à une solution de 2,11 ml
de
diisopropylamine dans 20 ml de tétrahydrofurane refroidi à-78 C. Après '/2
heure
d'agitation, on ajoute 2,5 g de 1(N)-boc-4-pipéridone dans le tétrahydrofurane
(10 ml) à
0 C. Finalement, toujours à 0 C, on ajoute 4,71 g de N-
phényltrifluorométhanesulfon i m ide. Après 2 heures d'agitation à température
ambiante,
on évapore le tétrahydrofurane et on purifie le produit par filtration rapide
sur alumine en
utilisant comme éluant un mélange d'heptane/acétate d'éthyle 9/1. On obtient
3,35 g du
tert-butyl 4-{[(trifluorométhyl)sulfonyl]oxy}-3,6-dihydropyridine-1(2H)-
carboxylate.
RMN 'H (CDCI3i 200MHz), b(ppm) : 1,44 (s, 9H) ; 2,41 (m, 2H) ; 3,6 (t,
2H,J=5,7Hz) ;
4,0 (m, 2H) ; 5,74 (s, 1 H).
5_2 : tert-butyl 3,6-dihydro-4,4'-bipyridine-1(2H)-carboxylaté
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
59
Dans un tricol de 100 ml sous azote, on introduit 1 g de
tert-butyl 4-{[(trifluorométhyl)sulfonyl]oxy}-3,6-dihydropyridine-1(2H)-
carboxylate, 0,256 g
de chlorure de lithium, 1,418 g de carbonate de potassium, 1,05 g de 4-
(4,4,5,5-
tétraméthyl-1,3,2-dioxaborolan-2-yl)pyridine et 0,209 g de
tétrakistriphénylphosphine
palladium dans 15 ml de 1,2-diméthoxyéthane ; on porte au reflux pendant 1 h
30. On
laisse le milieu revenir à température ambiante, on ajoute 100 ml d'eau et la
phase
aqueuse est extraite avec 3 fois 80 ml d'acétate d'éthyle. On rassemble les
phases
organiques, on sèche sur sulfate de sodium, et on évapore le solvant sous
pression
réduite. Le résidu est chromatographié sur gel de silice par un gradient
d'éluant
dichlorométhane à dichlorométhane/méthanol/ammoniaque 90/10/1. On obtient
0,821 g
de tert-butyl 3,6-dihydro-4,4'-bipyridine-1(2h)-carboxylate.
RMN ' H(CDCI3, 200MHz), 8(ppm) : 1,44 (s, 9H) ; 2,4 (m, 2H) ; 3,6 (t, 2H,
J=5,7Hz) ; 4,0
(m, 2H) ; 5,95 (se,, 1H,) ; 8,45(m,1 H) ; 7,4-7,7(m,3H).
5_3 : tert-butyl 4-pyridin-4-ylpipéridine-1-carboxylate
Dans un réacteur haute pression, sous azote, 0,336 g de Pd/C 5 % est
additionné à 0,821 g du tert-butyl 3,6-dihydro-4,4'-bipyridine-1(2H)-
carboxylate solubilisé
dans 65 ml de méthanol. Le mélange de réaction est mis sous une pression de
3 atmosphères d'hydrogène, à 25 C, et agité mécaniquement pendant 1 heure. Le
palladium est filtré sur papier Whatman (marque déposée) et est lavé par du
méthanol.
Le solvant est évaporé, puis le résidu est chromatographié sur gel de silice,
gradient
d'éluant heptane/acétate d'éthyle (8/2) à heptane/acétate d'éthyle (1/1). On
obtient
0,552 g de tert-butyl-4-pyridin-4-ylpiperidine-1-carboxylate.
M+H+=263
5_4 : 4-pipéridin-4-ylpyridine
Dans un ballon de 25 ml contenant 0,552 g de tert-butyl 4-pyridin-4-
ylpipéridine-
1-carboxylate, on additionne goutte à goutte 1,54 ml d'une solution 4N d'acide
chlorhydrique dans du dioxane à l'aide d'une ampoule à addition. On maintient
l'agitation
pendant 1 heure. Le produit est ensuite concentré sous vide puis traité par
une solution
aqueuse 1 N de soude. La phase aqueuse est extraite 3 fois au dichlorométhane.
La
phase organique est séchée sur sulfate de sodium et concentrée sous pression
réduite.
On obtient 0,341 g de 4-pipéridin-4-ylpyridine.
RMN 'H (CDCI3i 200MHz), b(ppm) : 1,9-2,2 (m, 8H) ; 3 (m, 1H) ; 3,3 (m, 1H) ;
7,1 (d,
2H,), 8,45(d,2H).
5_5 : 1-[(4-pyridin-4-ylpipéridin-1-yl)carbonyl]-1,2,3,4-tétrahydroquinoline
Dans un ballon de 50 ml sous atmosphère d'azote sont placés 0,12g de
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
1,2,3,4-tétrahydroquinoline, 9 ml de dichlorométhane et 0,16 ml de
triéthylamine. On
ajoute à 0 C, 0,09 g de triphosgène, puis la réaction est laissée sous
agitation à
température ambiante pendant 18 h. On rajoute ensuite 0,147 g de 4-pipéridin-4-
ylpyridine et le mélange réactionnel est mis sous agitation pendant 60 h, puis
mis au
5 reflux pendant 12 h. On ajoute 20 ml d'une solution aqueuse saturée
d'hydrogénocarbonate de sodium, puis la phase aqueuse est extraite trois fois
au
dichlorométhane. On rassemble les phases organiques, on sèche sur sulfate de
sodium
et on évapore le solvant sous pression réduite. Le résidu est chromatographié
sur gel de
silice par un mélange de dichlorométhane/méthanol 95/5. On obtient 0,11 g de 1-
[(4-
10 pyridin-4-ylpipéridin-1 -yl)carbonyl]-1,2,3,4-tétrahydroquinoline.
M+H+=322,2
5_6: Chlorhydrate de la 1-[(4-pyridin-4-ylpipéridin-1-yl)carbonyl]-1,2,3,4-
tétrahydroquinoline
Dans un ballon de 25 ml on introduit 0,11 g de 1-[(4-pyridin-4-ylpipéridin-1-
15 yl)carbonyl]-1,2,3,4-tétrahydroquinoline dissous dans 3 ml de
dichlorométhane. On
additionne ensuite 3,5 ml d'une solution 0,2N d'acide chlorhydrique dans
l'éther. On
maintient l'agitation pendant 10min. Après évaporation, on reprend le résidu
dans de
l'acétate d'éthyle. Le précipité est filtré puis séché sous vide. On obtient
0,09 g de
chlorhydrate de la 1-[(4-pyridin-4-ylpipéridin-1-yl)carbonyl]-1,2,3,4-
tétrahydroquinoline.
20 Point de fusion =198 C, M+H+=322,2,
RMN 'H (DMSO-ds, 200MHz), b(ppm) : 1,5-2 (m, 6H) ; 2,6-3,2 (m, 5H) ; 3,5 (t,
2H) ; 3,8-4 (m, 2H) ; 6,75-7,2 (m, 4H) ; 7,9 (d,2H) ; 8,8 (d,2H).
Exemple 6: Chlorhydrate de la 1-butyl-4-[(3-pyridin-3-ylpyrrolidin-1-
25 yl)carbonyl]-1,2,3,4-tétrahydroquinoxaline (composé n 119)
6_1 : tert-butyl 4-[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-3,4-
dihydroquinoxaline-1(2H)-carboxylate
Dans un ballon de 500 ml sous atmosphère d'azote sont placés 2,75 g de
l'ester terbutylique de l'acide 3,4-dihydro-, 1(2H)-quinoxaline carbamique,
117 ml de
30 dichlorométhane et 5,8 ml de diisopropyléthylamine. On ajoute à 0 C, 1,74 g
de
triphosgène, puis la réaction est laissée sous agitation à température
ambiante pendant
trois heures. On rajoute ensuite 2 ml de diisopropyléthylamine et 1,83 g de 3-
pyrrolidin-
3-ylpyridine et le mélange réactionnel est mis sous agitation pendant dix huit
heures. On
ajoute 200 ml d'une solution aqueuse saturée d'hydrogénocarbonate de sodium,
puis la
35 phase aqueuse est extraite trois fois au dichlorométhane. On rassemble les
phases
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
61
organiques, on sèche sur sulfate de sodium et on évapore le solvant sous
pression
réduite. Le résidu est chromatographié sur gel de silice par un mélange de
dichlorométhane/méthanol 95/5. On obtient 3,72 g de tert-butyl 4-[(3-pyridin-3-
ylpyrrolidin-1-yl)carbonyl]-3,4-dihydroquinoxaline-1(2H)-carboxylate.
M+H+=409,3
6_2 : 1-[(3-pyridi n-3-ylpyrrolidin-1-yl)carbonyl]-1,2,3,4-
tétrahydroquinoxaline
Dans un ballon de 250 ml on introduit 3,72 g de tert-butyl 4-[(3-pyridin-3-
ylpyrrolidin-1-yl)carbonyl]-3,4-dihydroquinoxaline-1(2H)-carboxylate dissous
dans
18,2 ml de dioxane. On additionne ensuite 34,1 ml d'une solution 4N d'acide
chlorhydrique dans le dioxane. On maintient l'agitation pendant trois heures.
Après
évaporation, on reprend le résidu dans du dichlorométhane et une solution
aqueuse
saturée d'hydrogénocarbonate de sodium, puis la phase aqueuse est extraite
trois fois
au dichlorométhane. On rassemble les phases organiques, on sèche sur sulfate
de
sodium et on évapore le solvant sous pression réduite. On obtient 2,6 g de 1-
[(3-pyridin-
3-ylpyrrolidin-1 -yl)carbonyl]-1,2,3,4-tétrahydroquinoxaline.
M+H+=309, 3
6_3 : 1-butyl-4-[(3-pyridin-3-yipyrrolidin-1-yl)carbonyl]-1,2,3,4-tétrahydro
quinoxaline
Dans un ballon de 100 ml, on introduit 0,2 g 1-[(3-pyridin-3-ylpyrrolidin-1-
yl)carbonyl]-1,2,3,4-tétrahydroquinoxaline dissous dans 22 ml de
dichlorométhane. On
additionne ensuite 0,29 ml de N-butyraldéhyde puis 0,27 g de triacétoxy
borohydrure de
sodium et le mélange réactionnel est mis sous agitation pendant dix huit
heures. On
ajoute une solution aqueuse saturée d'hydrogénocarbonate de sodium, puis la
phase
aqueuse est extraite trois fois au dichlorométhane. On rassemble les phases
organiques, on sèche sur sulfate de sodium et on évapore le solvant sous
pression
réduite. Le résidu est chromatographié sur gel de silice par un mélange de
dichlorométhane/méthanol 95/5. On obtient 0,032 g de 1-butyl-4-[(3-pyridin-3-
ylpyrrolidin-1-yl)carbonyl]-1,2,3,4-tétrahydro quinoxaline.
M+H+=365,3
6_4: Chlorhydrate de la 1-butyl-4-[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-
1,2,3,4-tétrahydroquinoxaline
Dans un ballon de 10 ml on introduit 0,032 g de 1-butyl-4-[(3-pyridin-3-
ylpyrrolidin-1-yl)carbonyl]-1,2,3,4-tétrahydroquinoxaline dissous dans 0,9 ml
de
dichlorométhane. On additionne ensuite 0,45 ml d'une solution 0,2N d'acide
chlorhydrique dans l'éther. On maintient l'agitation pendant dix minutes.
Après
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
62
évaporation, on obtient 0,030 g de chlorhydrate de la 1-butyl-4-[(3-pyridin-3-
ylpyrrolidin-
1-yl)carbonyl]-1,2,3,4-tétrahydroquinoxaline.
Point de fusion =191 C, M+H+=365,3
RMN'H (DMSO-d6, 200MHz), 6(ppm) : 0,86 (t, 3H) ; 1,17-1,39 (m, 1H) ; 1,39-1,6
(m, 1 H) ; 1,9-2,35 (m, 1 H) ; 3,1-3,9 (m, 14H) ; 6,43-6,54 (m, 1 H) ; 6,6-
6,69 (m, 1 H) ;
6,75-6,88 (m, 1 H) ; 7,97 (dd, 1 H) ; 8,45 (dd,1 H) ; 8,77 (dd,1 H) ; 8,82
(dd,1 H).
Exemple 7: Chlorhydrate du N,N-diméthyl-4-[(3-pyridin-3-ylpyrrolidin-1-
yl)carbonyl]-3,4-dihydroquinoxaline-1(2H)-carboxamide (composé n 110)
7_1: N,N-diméthyl-4-[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-3,4-
dihydroquinoxaline-1(2H)-carboxamide
Dans un ballon de 50 ml sous atmosphère d'azote sont placés 0,25 g de 1-
[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-1,2,3,4-tétrahydroquinoxaline, 8,1
ml de
dichlorométhane et 0,5 ml de diisopropylethylamine. On ajoute à 0 C, 0,12 g de
triphosgène, puis la réaction est laissée sous agitation à température
ambiante pendant
une heure et demie. On rajoute ensuite 0,5 ml de diisopropyléthylamine et 2,03
ml d'une
solution 2N de diméthylamine dans le tétrahydrofurane et le mélange
réactionnel est mis
sous agitation pendant dix huit heures. On ajoute de l'eau, puis la phase
aqueuse est
extraite trois fois au dichlorométhane. On rassemble les phases organiques, on
sèche
sur sulfate de sodium et on évapore le solvant sous pression réduite. Le
résidu est
chromatographié sur gel de silice par un mélange de dichlorométhane/méthanol
90/10.
On obtient 0,22 g de N,N-diméthyl-4-[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-
3,4-
dihydroquinoxaline-1(2H)-carboxamide.
M+H+=380, 3
7_2: Chlorhydrate du N,N-diméthyl-4-[(3-pyridin-3-ylpyrrolidin-1-
yl)carbonyl]-3,4-dihydroquinoxaline-1(2H)-carboxamide
Dans un ballon de 10 ml, on introduit 0,157 g de N,N-diméthyl-4-[(3-pyridin-3-
ylpyrrolidin-1-yl)carbonyl]-3,4-dihydroquinoxaline-1(2H)-carboxamide dissous
dans
8,1 ml de dichlorométhane. On additionne ensuite 4,08 ml d'une solution 0,1N
d'acide
chlorhydrique dans l'éther. On maintient l'agitation pendant dix minutes.
Après
évaporation, on obtient 0,156 g de chlorhydrate de N,N-diméthyl-4-[(3-pyridin-
3-
ylpyrrolidin-1-yl)carbonyl]-3,4-dihydroquinoxaline-1(2H)-carboxamide .
Point de fusion =181 C, M+H+=380,3
RMN ' H(DMSO-ds, 200MHz), b(ppm) : 1,87-2,15 (m, 1 H) ; 2,15-2,33 (m, 1 H) ;
2,75 (s, 6H) 3,2-3,9 (m, 9H) ; 6,8-6,98 (m, 3H) ; 7-7,1 (m, 1 H) ; 7,85 (dd, 1
H) ; 8,35
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
63
(dd,1 H) ; 8,7 (dd,1 H) ; 8,75 (dd,1 H).
Exemple 8 : Méthyl 4-[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-3,4-
dihydroquinoxaline-1(2H)-carboxylate (composé n 118)
Dans un ballon de 50 ml sous atmosphère d'azote sont placés 0,25 g de 1-
[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-1,2,3,4-tétrahydroquinoxaline, 8,1
ml de
dichlorométhane et 0,3 ml de diisopropyléthylamine. On ajoute à 0 C, 0,12 g de
triphosgène, puis la réaction est laissée sous agitation à température
ambiante pendant
trois heures. On rajoute ensuite 0,5 ml de diisopropyléthylamine et 0,33 ml de
méthanol
et le mélange réactionnel est mis sous agitation pendant vingt quatre heures.
Une
solution aqueuse saturée d'hydrogénocarbonate de sodium et du dichlorométhane
sont
ajoutés. La phase aqueuse est extraite trois fois au dichlorométhane. Les
phases
organiques sont rassemblées, lavées à l'eau et avec une solution aqueuse
saturée en
chlorure de sodium, séchées sur sulfate de sodium, puis le solvant est évaporé
sous
pression réduite. Le résidu est chromatographié sur gel de silice par un
mélange de
dichlorométhane/méthanol 95/5. On obtient 0,112 g de méthyl 4-[(3-pyridin-3-
ylpyrrolidin-1-yl)carbonyl]-3,4-dihydroquinoxaline-1(2H)-carboxylate.
Point de fusion =83 C,
RMN'H (DMSO-ds, 200MHz), b(ppm) : 1,8-2,1 (m, 1H) ; 2,1-2,3 (m, 1H) ; 3,1-3,5
(m, 5H) ; 3,6-3,9 (m, 4H) ; 3,7 (s, 3H) ; 6,85-7,1 (m, 2H) ; 7,35 (dd, 1H) ;
7,63-7,8
(m,1H) ; 8,38- 8,54 (m, 3H).
Exemple 9: Chlorhydrate de la 1-acétyl-4-[(3-pyridin-3-ylpyrrolidin-1-
yl)carbonyl]-1,2,3,4-tétrahydroquinoxaline (composé n 120)
9_1: 1-acétyl-4-[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-1,2,3,4-
tétrahydroquinoxaline
Dans un ballon de 10 ml sont placés 0,25 g de 1-[(3-pyridin-3-ylpyrrolidin-1-
yl)carbonyl]-1,2,3,4-tétrahydroquinoxaline et 1,05 ml d'anhydride acétique. Le
milieu
réactionnel est porté au reflux pendant deux heures, puis on ajoute à 0 C une
solution
d'ammoniaque dans l'eau. La phase aqueuse est extraite trois fois à l'acétate
d'éthyle.
On rassemble les phases organiques, on sèche sur sulfate de sodium et on
évapore le
solvant sous pression réduite. Le résidu est chromatographié sur gel de silice
par un
mélange de dichlorométhane/méthanol 95/5. On obtient 0,284 g de 1-acétyl-4-[(3-
pyridin-3-ylpyrrolidin-1 -yl)carbonyl]-1,2,3,4-tétrahydroquinoxaline.
M+H+=351,3
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
64
9.2: Chlorhydrate de la 1-acétyl-4-[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-
1,2,3,4-tétrahydroquinoxaline
Dans un ballon de 25 ml on introduit 0,284 g de 1-acétyl-4-[(3-pyridin-3-
ylpyrrolidin-1-yl)carbonyl]-1,2,3,4-tétrahydroquinoxaline dissous dans 4,05 ml
de d'une
solution 0,2N d'acide chlorhydrique dans l'éther. On maintient l'agitation
pendant dix
minutes. Après évaporation, on obtient 0,126 g de chlorhydrate de la 1-acétyl-
4-[(3-
pyridin-3-ylpyrrolidin-1-yl)carbonyl]-1,2,3,4-tétrahydroquinoxaline
Point de fusion =201 C, M+H+=351.3,
RMN'H (DMSO-d6, 200MHz), b(ppm) : 1,9-3,9 (m, 2H) ; 2,14 (s, 3H) ; 3-4,1 (m,
9H) ; 6,9-7,2 (m, 4H) ; 7,93 (dd, 1 H) ; 8,3 (dd,1 H) ; 8,7 (dd,1 H) ; 8,75
(dd,1 H).
Exemple 10: Chlorhydrate du {4-[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-
3,4-dihydro-2H-1,4-benzoxazin-6-yl}méthanol (composé n 82)
10.1 : Méthyl 3-amino-4-hydroxybenzoate
Dans un tricol de 500 ml est introduit 100mI de méthanol, puis à 0 C, on
ajoute
goutte à goutte 9,75 ml de chlorure d'acétyle. On ajoute ensuite à 0 C, 5 g
d'acide 3-
amino-4-hydroxybenzoique puis le milieu réactionnel est agité pendant dix huit
heures à
température ambiante. Une solution saturée d'hydrogénocarbonate de sodium dans
l'eau est ensuite ajoutée à 0 C, et le mélange est extrait trois fois à
l'acétate d'éthyle.
Les phases organiques sont rassemblées, puis séchées sur sulfate de magnésium
et le
solvant est évaporé sous pression réduite pour conduire à 5,16 g de méthyl 3-
amino-4-
hydroxybenzoate.
M+H+=168, 2
10.2: Méthyl 3,4-dihydro-2H-1,4-benzoxazine-6-carboxylate
Dans un ballon de 500 ml est dissous 5,16g de méthyl 3-amino-4-
hydroxybenzoate dans 100 ml de diméthylformamide. On ajoute ensuite 17,06 g de
carbonate de potassium puis 7,98 ml de dibromoéthane. Le milieu réactionnel
est
chauffé à 110 C sous agitation pendant cinq heures. Après évaporation du
solvant, on
ajoute de l'eau et de l'acétate d'éthyle. La phase aqueuse est extraite trois
fois à
l'acétate d'éthyle. Les phases organiques sont rassemblées, puis séchées sur
sulfate de
magnésium et le solvant est évaporé sous pression réduite. Le résidu est
chromatographié sur gel de silice par un mélange de heptane/acétate d'éthyle
6/4. On
obtient 3,61 g de méthyl 3,4-dihydro-2H-1,4-benzoxazine-6-carboxylate.
M+H+=194, 3
10.3 : Méthyl 4-[(3-pyridin-3-yipyrrolidin-1-yl)carbonyl]-3,4-dihydro-2H-1,4-
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
benzoxazine-6-carboxylate
Dans un ballon de 250 ml sous atmosphère d'azote sont placés 1,8 g de méthyl
3,4-dihydro-2H-1,4-benzoxazine-6-carboxylate, 93,2 ml de dichlorométhane et
4,62 ml
de diisopropyléthylamine. On ajoute à 0 C, 1,38 g de triphosgène, puis la
réaction est
5 laissée sous agitation à température ambiante pendant trois heures. On
rajoute ensuite
1,62 ml de diisopropyléthylamine et 1,45g de 3-pyrrolidin-3-ylpyridine et le
mélange
réactionnel est mis sous agitation pendant dix huit heures. Une solution
aqueuse
saturée d'hydrogénocarbonate de sodium et du dichlorométhane sont ajoutés. La
phase
aqueuse est extraite trois fois au dichlorométhane. Les phases organiques sont
10 rassemblées, lavées à l'eau et avec une solution aqueuse saturée en
chlorure de
sodium, séchées sur sulfate de sodium, puis le solvant est évaporé sous
pression
réduite. Le résidu est chromatographié sur gel de silice par un mélange de
dichlorométhane/méthanol 95/5. On obtient 2,39 g de méthyl 4-[(3-pyridin-3-
ylpyrrolidin-
1-yl)carbonyl]-3,4-dihydro-2H-1,4-benzoxazine-6-carboxylate.
15 Point de fusion =61 C, M+H+=368,3
10.4 : {4-[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-3,4-dihydro-2H-1,4-
benzoxazin-6-yl}méthanol
Dans un ballon de 100 ml sous atmosphère d'azote sont placés 0,4 g de méthyl
4-[(3-pyrid in-3-yl pyrrol id i n- 1 -yl)carbonyl]-3,4-dihydro-2H-1,4-
benzoxazine-6-carboxylate
20 et 10 ml de dichlorométhane. La température du milieu réactionnel est
abaissée à-
78 C, puis on ajoute 5,44ml d'une solution molaire d'hydrure de diisopropyle
aluminium
dans l'hexane. La réaction est laissée sous agitation à-78 C pendant dix huit
heures.
On hydrolyse le mélange réactionnel par du méthanol, puis une solution de
soude
aqueuse et ensuite par une solution aqueuse saturée d'hydrogénocarbonate de
sodium.
25 La phase aqueuse est extraite trois fois au dichlorométhane. Les phases
organiques
sont rassemblées, lavées à l'eau et avec une solution aqueuse saturée en
chlorure de
sodium, séchées sur sulfate de sodium, puis le solvant est évaporé sous
pression
réduite. Le résidu est chromatographié sur gel de silice par un mélange de
dichlorométhane/méthanol 90/10. On obtient 0,21 g de {4-[(3-pyridin-3-
ylpyrrolidin-1-
30 yl)carbonyl]-3,4-dihydro-2H-1,4-benzoxazin-6-yl}methanol.
M+H+=340, 3
10.5: Chlorhydrate du {4-[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-3,4-
dihydro-2H-1,4-benzoxazin-6-yl}méthanol
Dans un ballon de 50 ml on introduit 0,21 g de {4-[(3-pyridin-3-ylpyrrolidin-1-
35 yl)carbonyl]-3,4-dihydro-2H-1,4-benzoxazin-6-yl}méthanol dissous dans 6,19
ml d'une
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
66
solution 0,1 N d'acide chlorhydrique dans l'éther. On maintient l'agitation
pendant dix
minutes. Après évaporation, le résidu est trituré dans de l'éther éthylique,
puis le solide
est filtré pour obtenir après séchage sous vide, 0,108 g de chlorhydrate du {4-
[(3-
pyridin-3-ylpyrrolidin-1-yl)carbonyl]-3,4-dihydro-2H-1,4-benzoxazin-6-
yl}méthanol.
Point de fusion =273 C, M+H+=351,3
RMN 'H (DMSO-d6, 200MHz), b(ppm) : 1,9-2,2 (m, 1 H) ; 2,2-2,45 (m, 1 H) ; 3,3-
4,4 (m, 9H) ; 4,32 (s, 3H) ; 6,68-6,88 (m, 2H) ; 7,01 (s, 1 H) ; 7,83 (dd, 1
H) ; 8,32
(dd,1 H) ; 8,7 (dd,1 H) ; 8,79 (dd,1 H).
Exemale 11: Sel sodique du 1-[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-
1,2,3,4-tétrahydroquinoline-6-carboxylic acid (composé n 79)
11.1 : Chlorhydrate de méthyl 1,2,3,4-tétrahydroquinoline-6-carboxylate
Dans un ballon de 500 ml sous atmosphère d'azote sont placés 0,93 g d'acide
1,2,3,4-tétrahydroquinoline-6-carboxylique et 100 ml de méthanol. On ajoute à
0 C, 0,46
ml de chlorure de thionyle, puis la réaction est mise sous agitation au reflux
pendant
trois heures. Après évaporation du solvant, le résidu est trituré dans l'éther
éthylique
puis le solide obtenu est filtré et séché sous vide. On obtient 1,13 g de
chlorhydrate de
méthyl 1,2,3,4-tétrahydroquinoline-6-carboxylate.
M+H+=192, 3
11.2 : Méthyl 1-[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-1,2,3,4-
tétra hyd roq u i n o l i ne-6-ca rboxylate
Dans un ballon de 100 ml sous atmosphère d'azote sont placés 0,6 g de
chlorhydrate de méthyl 1,2,3,4-tétrahydroquinoline-6-carboxylate, 13,2 ml de
dichlorométhane et 2,54 ml de diisopropyléthylamine. On ajoute à 0 C, 0,31 g
de
triphosgène, puis la réaction est laissée sous agitation à température
ambiante pendant
trois heures. On rajoute ensuite 0,39 g de 3-pyrrolidin-3-ylpyridine et le
mélange
réactionnel est mis sous agitation pendant dix huit heures. De l'eau et du
dichlorométhane sont ajoutés. La phase aqueuse est extraite trois fois au
dichlorométhane. Les phases organiques sont rassemblées, lavées à l'eau et
avec une
solution aqueuse saturée en chlorure de sodium, séchées sur sulfate de sodium,
puis le
solvant est évaporé sous pression réduite. Le résidu est chromatographié sur
gel de
silice par un mélange de dichlorométhane/méthanol 95/5. On obtient 0,675 g de
méthyl
1-[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-1,2,3,4-tétrahydroquinoline-6-
carboxylate.
M+H+=366,4
11.3: Sel sodique de l'acide 1-[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
67
1,2,3,4-tétrahydroquinoline-6-carboxylique
Dans un ballon de 50 mi sont placés 0,2 g de méthyl 1-[(3-pyridin-3-
ylpyrrolidin-1-
yl)carbonyl]-1,2,3,4-tétrahydroquinoline-6-carboxylate et 5,5 ml d'un mélange
de
tétrahydrofurane/méthanol/eau (v/v/v=1/1/1). On ajoute, 0,046 g d'hydroxyde de
lithium,
puis la réaction est laissée sous agitation à température ambiante pendant dix
huit
heures et chauffé à 40 C pendant deux heures. Le mélange réactionnel est
ensuite
versé sur 8 g de résine DOWEX 50WX8 et le mélange hétérogène est mis sous
agitation jusqu'à disparition du produit de la phase liquide (suivi par CCM).
La résine est
filtrée, puis lavée successivement par de l'eau, du tétrahydrofurane et de
l'acétonitrile.
On décroche le composé au moyen d'une solution d'ammoniaque 2N dans le
méthanol,
et le solvant est évaporé sous pression réduite. Le résidu est repris par du
méthanol et
on ajoute 0,95 ml d'une solution 0,5M de méthylate de sodium dans le méthanol.
Le
solvant est évaporé sous pression réduite et on obtient 0,176 g de sel sodique
de l'acide
1-[(3-pyridin-3-ylpyrrolidin-1-yl)carbonyl]-1,2,3,4-tétrahydroquinoline-6-
carboxylique.
Point de fusion =197-202 C, M+H+=352,3,
RMN ' H(CDCI3, 200MHz), b(ppm) : 1,5-2 (m, 1 H) ; 2,1-2,4 (m, 3H) ; 3,1-3,7
(m,
5H) ; 6,5-6,67 (m, 1 H) ; 7-7,18 (m, 1 H) ; 7,5-7,72 (m, 2H) ; 8,23-8,4 (dd,1
H).
Exemale 12: [4-(4-Methanesulfonyl-benzyl)-3,4-dihydro-2H-quinoxalin-1-yl]-
[3-(1H-pyrazol-4-yl)-pyrrolidin-1-yl]-methanone (composé n 161)
On dissous 0,3 g de 4-(4-Methanesulfonyl-benzyl)-3,4-dihydro-2H-quinoxaline
dans 10 ml de dichlorométhane et 0,1 ml de N-méthylmorpholine. On ajoute à 0
C,
0,118 g de triphosgène, puis la réaction est laissée sous agitation à
température
ambiante pendant quatre heures. On rajoute ensuite 0,208 g de dichlorhydrate
de 4-
pyrrolidin-3-yl-1 H-pyrazole et le mélange réactionnel est mis sous agitation
pendant dix
huit heures. Une solution saturée d'hydrogénocarbonate de sodium dans l'eau et
du
dichlorométhane sont ajoutés. La phase aqueuse est extraite deux fois au
dichlorométhane. Les phases organiques sont rassemblées, lavées à l'eau et
avec une
solution aqueuse saturée en chlorure de sodium, séchées sur sulfate de
magnésium,
puis le solvant est évaporé sous pression réduite. Le résidu est
chromatographié sur gel
de silice une première fois par un gradient de mélange de
dichlorométhane/méthanol
1/0 à 85/5 puis une seconde fois par un gradient de mélange de
dichlorométhane/Acétate d'éthyle/méthanol 1/0/0 à 70/25/5. On obtient 0,064 g
de [4-(4-
Methanesulfonyl-benzyl)-3,4-dihydro-2H-quinoxalin-1-yl]-[3-(1 H-pyrazol-4-yl)-
pyrrolidin-1-
yl]-methanone.
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
68
Point de fusion =239 C, M+H+=466,3
RMN'H (CDCI3, 200MHz), b(ppm) : 1,79-1,91 (m, 1H) ; 2,09-2,21 (m, 1H) ; 3,11-
3,44 (m, 4H) ; 3,21 (s, 3H) ; 3,44-3,68 (m, 4H), 3,74-3,85 (m, 1 H) ; 4,68 (s,
2H) ; 6,48-
6,6 (m,2H) ; 6,7-6,79 (m, 1 H) ; 6,81-6,89 (m, 1 H) ; 7,32-7,65 (sI, 1 H) ;
7,51 (d, 2H) ,
7,89 (d, 2H).
Exemale 13 . N-Piperidin-1-yI-4-{4-[3-(1 H-pyrazol-4-yl)-pyrrolidine-1-
carbonyl]-3,4-dihydro-2H-quinoxalin-1-yl}-benzamide (exemple 172)
13.1 : tert-butyl 4-(4-cyanophenyl)-3,4-dihydroquinoxaline-1(2H)-carboxylate
Dans un tube en verre de 20 ml sont introduits 1 g de 3,4-dihydro-2H-
quinoxaline-1-carboxylic acid tert-butyl ester, 10 ml de N-
methylpyrrolidinone, 0,57 g de
4-fluorobenzonitrile et 0,96 g de tert-butylate de potassium. Le milieu
réactionnel est
agité pendant 5 min, additionné d'eau et extrait 3 fois avec de l'éther
diéthylique. Les
phases organiques sont rassemblées, lavées avec de l'eau puis avec une
solution
aqueuse saturée en chlorure de sodium, séchées sur sulfate de sodium et
concentrées
sous pression réduite. Le résidu est chromatographié sur gel de silice élué
par un
gradient d'acétate d'éthyle de 3.5% à 35% dans l'heptane. On obtient 0,9 g de
tert-butyl
4-(4-cyanophenyl)-3,4-dihydroquinoxaline-1(2H)-carboxylate.
M+H+=336
13.2 : Acide 4-(3,4-dihydroquinoxalin-1(2H)-yl)benzoique
Dans un tube en verre sont introduits 3,2 g de tert-butyl 4-(4-cyanophenyl)-
3,4-
dihydroquinoxaline-1(2H)-carboxylate et 30 ml d'acide chlorhydrique concentré.
Le tube
est scellé, puis chauffé à 100 C sous irradiation micro-ondes pendant 2 fois 1
heure.
Après refroidissement, le précipité est filtré, rincé avec de l'eau et sèché
sous vide à
40 C. On obtient 3,0 g d'acide 4-(3,4-dihydroquinoxalin-1(2H)-yl)benzoique. Le
filtrat est
additionné à 4 C de soude 1 N jusqu'à pH basique puis extrait avec du
dichlorométhane.
La phase aqueuse est additionnée d'acide citrique jusqu'à pH=3-4 et extraite 3
fois avec
du dichlorométhane. Les phases organiques sont rassemblées, séchées sur
sulfate de
sodium et concentrées sous pression réduite. Le résidu est chromatographié sur
gel de
silice élué avec un gradient de méthanol de 1% à 2% dans le dichlorométhane.
On
obtient ainsi une quantité additionnelle de 0,8 g d'acide 4-(3,4-
dihydroquinoxalin-1(2H)-
yl)benzoique.
M+H+=255
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
69
13.3 : 4-(3,4-dihydroquinoxalin-1(2H)-yl)benzoate de méthyle
Dans un ballon de 250 ml muni d'un agitateur magnétique, sont introduits 3,8 g
d'acide 4-(3,4-dihydroquinoxalin-1(2H)-yl)benzoique et 70 ml de méthanol. 4,4
ml
d'acide sulfurique 97% sont ajoutés goutte à goutte et le milieu réactionnel
est agité 18 h
à température ambiante. Le méthanol est partiellement évaporé. La solution
restante est
versée sur un mélange eau plus glace, neutralisée par addition lente
d'hydrogénocarbonate de sodium et extraite 3 fois par de l'acétate d'éthyle.
Les phases
organiques sont rassemblées, lavées avec de l'eau et avec une solution saturée
de
chlorure de sodium, séchées sur sulfate de sodium et concentrées sous pression
réduite. Le résidu est chromatographié sur gel de silice élué avec un gradient
d'acétate
d'éthyle de 10% à 20% dans l'heptane. On obtient 2,8g de 4-(3,4-
dihydroquinoxalin-
1(2H)-yl)benzoate de méthyle.
M+H+=269
13.4 : 4-[4-{[3-(1 H-pyrazol-4-yl)pyrrolidin-1-yl]carbonyl}-3,4-
dihydroquinoxalin-1(2H)-yl]benzoate de méthyle.
Dans un tricol muni d'un agitateur magnétique et placé sous atmosphère inerte,
sont introduits 2,7 g de 4-(3,4-dihydroquinoxalin-1(2H)-yl)benzoate de méthyle
et 50 ml
de dichlorométhane. Après refroidissement à 4 C sont ajoutés sucessivement 4,2
ml de
triéthylamine et 1,19 g de triphosgène. Le milieu réactionnel est agité à
température
ambiante pendant 4h. 2,11 g de dichlorhydrate de 4-pyrrolidin-3-yl-1 H-
pyrazole et 1,4 ml
de triéthylamine sont alors introduits et le mélange est agité à température
ambiante
pendant 18h. Le milieu réactionnel est lavé avec une solution aqueuse saturée
d'hydrogénocarbonate de sodium ; la phase organique est séchée sur sulfate de
sodium
et concentrée sous pression réduite. Le résidu est chromatographié sur gel de
silice élué
par un gradient de méthanol de 1,5% à 3% dans le dichlorométhane. On obtient
4,2g de
4-[4-{[3-(1 H-pyrazol-4-yl)pyrrolidin-1-yl]carbonyl}-3,4-dihydroquinoxalin-
1(2H)-
yl]benzoate de méthyle.
M+H+=432
13.5 : Acide 4-[4-{[3-(1 H-pyrazol-4-yl)pyrrolidin-1-yl]carbonyl}-3,4-
dihydroquinoxalin-1(2H)-yl]benzoique
Dans un ballon de 250 ml muni d'un agitateur magnétique et placé dans un bain
de glace, sont introduits 4,2 g de 4-[4-{[3-(1H-pyrazol-4-yl)pyrrolidin-1-
yl]carbonyl}-3,4-
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
dihydroquinoxalin-1(2H)-yl]benzoate de méthyle et 50 ml d'un mélange
tétrahydrofurane-
méthanol-eau 2/1/1. 1,63 g d'hydroxyde de lithium monohydrate sont additionnés
et le
mélange réactionnel est agité à température ambiante pendant 18h. Après
évaporation
des solvants organiques, de l'acide citrique est ajouté jusqu'à pH 5. Le
précipité est filtré
5 et séché sous vide. On obtient 3,87 g d'acide 4-[4-{[3-(1H-pyrazol-4-
yl)pyrrolidin-1-
yI]carbonyl}-3,4-dihydroquinoxalin-1(2H)-yl]benzoique.
M+H+=418
13.6 : N-Piperidin-1-yI-4-{4-[3-(1 H-pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-
10 dihydro-2H-quinoxalin-1-yl}-benzamide
Dans un ballon de 100 ml muni d'un agitateur magnétique sont introduits 0,4 g
d'acide 4-[4-{[3-(1 H-pyrazol-4-yl)pyrrolidin-l-yl]carbonyl}-3,4-
dihydroquinoxalin-1(2H)-
yl]benzoique, 0,19 g de 1-aminopiperidine, 0,26 g d' hydroxybenzotriazole,
0,37 g
d'EDC.HCI et 7 ml d'un mélange dioxane-diméthylformamide 5/2. Le mélange
15 réactionnel est agité pendant 20h à température ambiante et concentré sous
vide. Le
résidu est chromatographié sur gel de silice élué par un mélange
dichlorométhane/acétone/méthanol/NH4OH 88/10/2/0,2 puis 82/15/3/0,3. Après
trituration dans l'éther éthylique, on obtient 0,28 g de N-piperidin-1-yl-4-{4-
[3-(1H-
pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-1 -yl}-
benzamide.
20 Point de fusion =251 C; M+H+=500
RMN 'H (DMSO-d6, 200MHz), b(ppm) : 1,38 (m, 2H) ; 1,60 (m, 4H) ; 1.87 (m,
1H) ; 2.22 (m,1H); 2,81 (m, 4H) ; 3,15 - 3,5 (m, 4H) ; 3,5 - 3,65 (m, 2H); 3,7-
3,9 (m,
3H); 6,83 (m, 2H) ; 7.04 (m, 2H) ; 7,25 (d, 2H) ; 7,4 (m, 1 H) ; 7,60 (m, 1 H)
; 7,75 (d,
2H) ; 9,16 (s, 1 H) ; 12,62 (s, 1 H).
Exemple 14: N-Cyclopropyl-2-methoxy-4-{4-[3-(1 H-pyrazol-4-yl)-pyrrolidine-
1-carbonyl]-3,4-dihydro-2H-quinoxalin-1-yl}-benzamide (exempleN 78)
14.1 : 4-(3-M ethoxy-4-methoxycarbonyl-phenyl)-3,4-d i hyd ro-2H-q u i noxal i
ne-
1-carboxylic acid tert-butyl ester
Dans un tricol de 50 ml sont introduits 0,64 g de 3,4-dihydro-2H-quinoxaline-1-
carboxylic acid tert-butyl ester, 1,44 g de phosphate de potassium et 0,15 g
de
catalyseur de Solvias I (Palladium, [bis(bicyclo[2.2.1]hept-2-
yl)phosphine]chloro[2'-
(dimethylamino-xN)[1,1'-biphenyl]-2-yl-xC]- (9CI) . Le mélange est dégazé et
mis sous
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
71
atmosphère d'azote. 1 g de 4-bromo-2-méthoxybenzoate de méthyle et 14 ml de
diméthoxyéthane sont ajoutés. Le milieu réactionnel est à nouveau dégazé puis
placé
sous atmosphère d'azote et agité à 100 C pendant 18h. Il est versé sur de
l'eau glacée,
neutralisé par addition de chlorure d'ammonium solide et extrait par de
l'acétate d'éthyle.
La phase organique est lavée avec de l'eau et une solution saturée de chlorure
de
sodium, séchée sur sulfate de magnésium et concentrée sous pression réduite.
Le
résidu est purifié par chromatographie sur colonne de silice élué par un
gradient
heptane-acétate d'éthyle 96/4 à 60/40. On obtient 1,1 g de 4-(3-methoxy-4-
methoxycarbonyl-phenyl)-3,4-dihydro-2H-quinoxaline-1-carboxylic acid tert-
butyl ester
sous forme d'huile incolore.
M+H+= 399
14.2: Ester méthylique de l'acide 4-(3,4-Dihydro-2H-quinoxalin-1-yl)-2-
methoxy-benzoique.
Dans un ballon muni d'un agitateur magnétique sont introduits 1,0 g de 4-(3-
methoxy-4-methoxycarbonyl-phenyl)-3,4-dihydro-2H-quinoxaline-1-carboxylic acid
tert-
butyl ester dans 10 ml de dioxane. 10 ml d'une solution d'acide chlorhydrique
4N dans
le dioxane sont additionnés. Après 18h d'agitation à température ambiante le
milieu
réactionnel est concentré sous vide. On obtient 1 g d' ester methylique de
l'acide 4-(3,4-
dihydro-2H-quinoxalin-1 -yl)-2-methoxy-benzoique.
M+H+= 299
14.3 : Ester méthylique de l'acide 2-Methoxy-4-{4-[3-(1 H-pyrazol-4-yl)-
pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-1-yl}-benzoique.
Dans un tricol muni d'un agitateur magnétique et placé sous atmosphère inerte,
sont introduits 0,92 g de l'ester méthylique de l'acide 4-(3,4-dihydro-2H-
quinoxalin-1-yl)-
2-methoxy-benzoique et 15 ml de dichlorométhane. Après refroidissement à+4 C
sont
ajoutés sucessivement 1,92 mIL de triéthylamine et 0,33 g de triphosgène. Le
milieu
réactionnel est agité à température ambiante pendant 3h. 0,64 g de
dichlorhydrate de 4-
pyrrolidin-3-yl-1 H-pyrazole sont alors introduits et le mélange est agité à
température
ambiante pendant 18h. Le milieu réactionnel est lavé avec une solution aqueuse
saturée
d'hydrogénocarbonate de sodium ; la phase organique est séchée sur sulfate de
sodium
et concentrée sous pression réduite. Le résidu est chromatographié sur gel de
silice élué
par un gradient de méthanol de 2% à 4% dans le dichlorométhane. Le produit
obtenu
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
72
est rechromatographié sur gel de silice élué par un gradient de
dichlorométhane -
méthanol 99/1 à 92/8. On obtient 1,06 g de 2-methoxy-4-{4-[3-(1 H-pyrazol-4-
yl)-
pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-l-yl}-benzoic acid methyl
ester.
M+H+= 462
14.4 : Acide 2-Methoxy-4-{4-[3-(1 H-pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-
dihydro-2H-quinoxalin-1-yl}-benzoique.
Dans un ballon de 50 ml muni d'un agitateur magnétique et placé sous
atmosphère inerte, sont introduits 1,06 g d'ester méthylique de l'acide 2-
methoxy-4-{4-
[3-(1 H-pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-1-yl}-
benzoique
dans 12 ml d'un mélange tétrahydrofurane - eau 1/1. 0,39 g d'hydroxyde de
lithium sont
ajoutés et le mélange réactionnel est agité pendant 18h. Le milieu est dilué
avec de
l'eau et acidifié par addition d'acide citrique. Le précipité formé est filtré
et lavé avec de
l'eau. Après séchage sous vide, on obtient 0,82 g d'acide 2-methoxy-4-{4-[3-(1
H-
pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-1-yl}-
benzoique.
M+H+= 448
14.5 : N-Cyclopropyl-2-methoxy-4-{4-[3-(1 H-pyrazol-4-yi)-pyrrolidine-1-
carbonyl]-3,4-dihydro-2H-quinoxalin-1-yl}-benzamide
Dans un ballon de 100 ml muni d'un agitateur magnétique et placé sous
atmosphère d'azote, sont introduits 0,22 g d'acide 2-methoxy-4-{4-[3-(1 H-
pyrazol-4-yl)-
pyrrolidine-1-carbonyl]-3,4-dihydro-2H-quinoxalin-1-yl}-benzoique, 0,06 g de
cyclopropylamine, 0,13 g d' hydroxybenzotriazole, 0,19 g de chlorhydrate du 1-
(3-
diméthylaminopropyl)-3-éthylcarbodiimide et 3,5 ml d'un mélange dioxane-
diméthylformamide 5/2. Le mélange réactionnel est agité pendant 20h à
température
ambiante et concentré partiellement sous vide. Il est dilué avec de l'eau et
extrait avec
de l'acétate d'éthyle. La phase organique est lavée plusieurs fois avec de
l'eau, séchée
sur sulfate de magnésium et concentrée sous pression réduite. Le résidu est
chromatographié sur gel de silice élué par un gradient dichlorométhane/
méthanol 99/1 à
90/10. Après trituration dans l'éther éthylique, on obtient 0,15g de N-
Cyclopropyl-2-
methoxy-4-{4-[3-(1 H-pyrazol-4-yl)-pyrrolidine-1-carbonyl]-3,4-dihydro-2H-
quinoxalin-1-
yl}-benzamide.
Point de fusion =100 C; M+H+=487
RMN 'H (DMSO-d6, 200MHz), b(ppm) : 0,54 (m, 2H) ; 0,71 (m, 2H) ; 1.83 (m,
1 H) ; 2.16 (m,1 H); 2,81 (m, 1 H) ; 3,12 - 3,45 (m, 4H) ; 3,5 - 3,65 (m, 2H);
3,7- 3,9 (m,
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
73
3H) ; 3,83 (s,3H); 6,82 (m, 4H) ; 7.04 (m, 2H) ; 7,38 (m, 1H) ; 7,58 (m, 1 H)
; 7,70 (d,
1 H) ; 7,91 (s, 1 H) ; 12,62 (s, 1 H).
Exemple 15 : (4-Difluoromethylene-3,4-dihydro-2H-quinolin-1-yl)-(3-pyridin-
3-yl-pyrrolidin-1-yl)-methanone (example 163)
15.1 : 4-Difluoromethylene-3,4-dihydro-2H-quinoline-1-tert butyle carbamate
Dans un ballon de 25 ml muni d'un agitateur magnétique et placé sous
atmosphère d'azote sont introduits 0,17 g de 4-Oxo-3,4-dihydro-2H-quinoline-1-
carboxylic acid tert-butyl ester, 0,2 ml de tributylphosphine et 1 ml de N-
méthyl pyrrol id inone . Le mélange est porté à 155 C et additionné par
petites fractions de
0,21 g de chlorodifluoroacétate de sodium et 1 ml de N-méthylpyrrolidinone. Il
est
ensuite chauffé 155 C pendant 1 h et concentré sous pression réduite. Le
résidu est
additionné d'eau et de dichlorométhane. La phase organique est concentrée sous
vide.
Le résidu est purifié par chromatographie sur silice élué avec du
dichlorométhane. On
obtient 0,11 g de 4-difluoromethylene-3,4-dihydro-2H-quinoline-1-te-t butyle
carbamate.
15.2 : 4-Difluoromethylene-1,2,3,4-tetrahydro-quinoline
Dans un ballon muni d'un agitateur magnétique sont introduits 0,11 g 4-
difluoromethylene-3,4-dihydro-2H-quinoline-1-tert butyle carbamate dans 10 ml
de
dichlorométhane. 6 ml d'une solution d'acide chlorhydrique 4N dans le dioxane
sont
additionnés. Après 6h d'agitation à température ambiante, le milieu
réactionnel est
concentré sous vide. On obtient 0,07 g de 4-difluoromethylene-1,2,3,4-
tetrahydro-
quinoline.
15.3: (4-Difluoromethylene-3,4-dihydro-2H-quinolin-1-yl)-(3-pyridin-3-yl-
pyrrolidin-1-yl)-methanone (fumarate)
Dans un tricol muni d'un agitateur magnétique et placé sous atmosphère inerte,
sont introduits 0,07 g de 4-difluoromethylene-1,2,3,4-tetrahydro-quinoline et
5 ml de
dichlorométhane. Après refroidissement à+4 C sont ajoutés successivement 0,11
ml de
triéthylamine et 0,39 ml d'une solution de phosgène à 20% dans le toluène. Le
milieu
réactionnel est agité à température ambiante pendant 2h. Le milieu réactionnel
est
refroidit dans un bain de glace et 0,08 g de 3-pyrrolidin-3-yl-pyridine dans 2
ml de
dichlorométhane sont alors introduits. Le mélange est agité à température
ambiante
pendant 18h. Le milieu réactionnel est lavé avec une solution 1 N de soude ;
la phase
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
74
organique est séchée sur sulfate de sodium et concentrée sous pression
réduite. Le
résidu est chromatographié sur gel de silice élué par un mélange
dichlorométhane -
méthanol 98/2. On obtient 0,05 g de (4-difluoromethylene-3,4-dihydro-2H-
quinolin-1-yl)-
(3-pyridin-3-yl-pyrrolidin-1-yl)-methanone qui sont traités par l'acide
fumarique dans un
mélange éthanol - ether diisopropylique pour donner le fumarate.
M+H+=356
RMN 'H (DMSO-d6, 200MHz), b(ppm) : 1,9-2,05 (m, 1 H) ; 2,15-2,3 (m,1 H); 3,2 -
3,45 (m, 6H) ; 3,55 - 3,85 (m, 3H); 6,62 (m, 7.6H) ; 6,98-7,10 (m, 2H) ; 7,22
(t, 1H) ;
7,37 (m, 1 H) ; 7,54 (d, 1 H) ; 7,71 (m, 1 H) ; 8,4-8,52 (m, 2H).
Exemple 16 : (2,3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-(4-fluoro-2-
trifluoromethyl-phenyl)-pyrrolidin-1-yl]-methanone (composé n 159)
16.1 : 3-Trifluoromethanesuifonyloxy-2,5-dihydro-pyrroie-1- tert-butyl
carbamate
Dans un tricol de 500 ml sous azote, on ajoute goutte à goutte 27 ml d'une
solution 2,5 N de n-butyl lithium dans l'hexane à une solution de 9,86 ml de
diisopropylamine dans 40 ml de tétrahydrofurane refroidi à-78 C. Après 1/4
d'heure
d'agitation, on ajoute goutte à goutte une solution de 10 g de 3-Oxo-
pyrrolidine-1-tert-
butyle carbamate dans 40 ml de tetrahydrofurane à-78 C. Finalement, toujours à-
78 C,
on ajoute 21,22 g de N-phényltrifluorométhanesulfonimide. Après 14 heures
d'agitation à
température ambiante, on évapore le tétrahydrofurane et on purifie le produit
sur gel de
silice en utilisant comme éluant un mélange de cyclohexane/ether 9/1. On
obtient 10,2 g
de 3-Trifluoromethanesulfonyloxy-2,5-dihydro-pyrrole-1-tert-butyl carbamate en
mélange
1/1 avec du C,C,C-Trifluoro-N-phenyl-methanesulfonamide.
(M-tbu)+H+=262
16.2 : Trifluoro-methanesulfonic acid 2,5-dihydro-1 H-pyrrol-3-yl ester
Dans un ballon de 500 ml sont placés 10,2 g de 3-Trifluoromethanesulfonyloxy-
2,5-dihydro-pyrrole-1-tert-butyl carbamate en mélange 1/1 avec du C,C,C-
Trifluoro-N-
phenyl-methanesulfonamide dans 50 ml de dioxanne. On ajoute ensuite doucement,
120,5 ml d'une solution d'acide chlorhydrique 4N dans le dioxanne. Le mélange
réactionnel est mis sous agitation pendant 3h. Le dioxanne est évaporé et on
purifie le
produit sur gel de silice en utilisant comme éluant un mélange de
dichlorométhane/methanol 95/5. On obtient 5 g de trifluoro-methanesulfonic
acid 2,5-
dihydro-1 H-pyrrol-3-yl ester.
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
M+H+=218
16.3: Trifluoro-methanesulfonic acid 1-(2,3-dihydro-benzo[1,4]oxazine-4-
carbonyl)-2,5-dihydro-1 H-pyrrol-3-yl ester
5 Dans un tricol de 250 ml muni d'un agitateur magnétique et placé sous
atmosphère inerte, sont introduits 2,7 g de 3,4-dihydro-2H-benzo[1,4]oxazine
et 50 ml
de dichlorométhane. Après refroidissement à+4 C sont ajoutés successivement
9,92 ml
de diisopropylethylamine et 2,97 g de triphosgène. Le milieu réactionnel est
agité à
température ambiante pendant 3h. 4,52 ml diisopropylethylamine et 3,04 g de
trifluoro-
10 methanesulfonic acid 2,5-dihydro-1 H-pyrrol-3-yl ester sont alors
introduits et le mélange
est agité à température ambiante pendant 18h. Le milieu réactionnel est lavé
avec une
solution aqueuse saturée d'hydrogénocarbonate de sodium ; la phase aqueuse est
extraite deux fois à l'acétate d'éthyle. Les phases organique sont
rassemblées, séchées
sur sulfate de sodium et concentrée sous pression réduite. Le résidu est
15 chromatographié sur gel de silice élué par un gradient d'acétate d'éthyle
de 0% à 10%
dans le dichlorométhane. On obtient 4,4 g de trifluoro-methanesulfonic acid 1-
(2,3-
dihydro-benzo[1,4]oxazine-4-carbonyl)-2,5-dihydro-1 H-pyrrol-3-yl ester.
M+H+=379,1
20 16.4 : (2,3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-(4,4,5,5-tetramethyl-
[1,3,2]dioxaborolan-2-yi)-2,5-dihydro-pyrrol-1-yl]-methanone
Dans un tricol de 100 ml muni d'un agitateur magnétique et placé sous
atmosphère inerte, sont introduits 2,2 g de trifluoro-methanesulfonic acid 1-
(2,3-dihydro-
benzo[1,4]oxazine-4-carbonyl)-2,5-dihydro-1H-pyrrol-3-yl ester, 1,92 g de
25 bispinacolatodiborane, 0,28 g de bis
(diphenylphosphino)ferrocenedichloropalladium(II),
1,7 g d'acétate de potassium, et 0,06 g de 1,1'-
bis(diphenylphosphino)ferrocene. Le
milieu réactionnel est porté au reflux pendant 14h puis concentrée sous
pression
réduite. On ajoute de l'eau et de l'acétate d'éthyle, et le mélange hétérogène
est filtré
sur célite. La phase organique est lavée à l'eau séchée sur sulfate de sodium
et
30 concentrée sous pression réduite. Le résidu est chromatographié sur gel de
silice élué
par un gradient d'acétate d'éthyle de 30% à 50% dans l'heptane. On obtient
1,22 g de
(2, 3-Di hyd ro-benzo[ 1,4]oxazi n-4-yl)-[3-(4,4, 5, 5-tetramethyl-[ 1, 3, 2]d
ioxaborolan-2-yl)-2, 5-
dihydro-pyrrol-1-yl]-methanone.
M+H+=357,2
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
76
16.5: (2,3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-(4-fluoro-2-trifluoromethyl-
phenyl)-2,5-dihyd ro-pyrrol-1-yl]-methanone.
Dans un tricol de 100 ml muni d'un agitateur magnétique et placé sous
atmosphère inerte, sont placés 0,4 g de (2,3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-
(4,4,5,5-
tetramethyl-[1,3,2]dioxaborolan-2-yl)-2,5-dihydro-pyrrol-1-yl]-methanone, 0,4
g de 1-
bromo-4-fluoro-2-trifluoromethyl-benzene, 1,4 ml d'une solution 2N de
carbonate de
sodium dans l'eau et 15 ml d'éthylène glycol diméthyléther. Le mélange
réactionnel est
dégazé avec de l'azote durant 30 minutes, puis le mélange réactionnel est
chauffé au
reflux pendant 14h. Après filtration et concentration à sec, le brut
réactionnel obtenu est
chromatographié sur gel de silice en éluant avec un gradient de d'acétate
d'éthyle dans
le dichlorométhane variant de 0% à 10%. On obtient 0,31 g de (2,3-dihydro-
benzo[1,4]oxazin-4-yl)-[3-(4-fluoro-2-trifluoromethyl-phenyl)-2,5-dihydro-
pyrrol-l-yl]-
methanone.
M+H + = 393,1
16.6: (2,3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-(4-fluoro-2-trifluoromethyl-
phenyl)-pyrrolidin-1-yl]-methanone.
0,07g de (2,3-Dihydro-benzo[1,4]oxazin-4-yl)-[3-(4-fluoro-2-trifluoromethyl-
phenyl)-2,5-dihydro-pyrrol-1-yl]-methanone dans 3,57mL de méthanol est
hydrogéné
dans un appareil H-cube sous pression atmosphérique d'hydrogène avec une
cartouche
de 100mg de palladium sur charbon 10%. Après concentration à sec, le brut
réactionnel
obtenu est chromatographié sur gel de silice en éluant avec un mélange de 5%
d'acétate d'éthyle dans le dichlorométhane On obtient 0,15g de (2,3-Dihydro-
benzo[1,4]oxazin-4-yl)-[3-(4-fluoro-2-trifluoromethyl-phenyl)-pyrrolidin-l-yl]-
methanone.
M+H+=395,2.
RMN 'H (DMSO-d6, 400MHz), b(ppm) : 2,08-2,2 (m, 1 H) ; 2,22-2,34 (m, 1 H) ;
3,42-3,88 (m, 7H) ; 4,2-4,3 (m,1H) ; 4,31-4,4 (m, 1H) ; 6,81-6,96 (m, 3H) ;
7,15-7,21 (m,
1 H) ; 7,6-7,7 (m, 2H) ; 7,78-7,84 (m, 1 H)
Exemale 17: 2,2-difluoro-1'-{[3-(1 H-pyrazol-4-yl)pyrrolidin-1-yl]carbonyl}-
2',3'-
dihydro-1'H-spiro[cyclopropane-1,4'-quinoline] (exemple 183)
17.1 : 4-Methylene-3,4-dihydro-2H-quinoline-1 -tert-butyl carbamate
Dans un tricol de 150 ml muni d'un agitateur magnétique et placé sous
atmosphère inerte, sont placés 3,96 ml d'une solution 1 N de tert-butylate de
potassium
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
77
dans le tetrahydrofuranne, 1,45 g de bromure de méthyltriphénylphosphonium, et
30 ml
de diméthyléther. Le mélange réactionnel est chauffé au reflux pendant 1 h.
Après retour
à température ambiante on ajoute 0,7 g de 4-Oxo-3,4-dihydro-2H-quinoline-1-
tert-butyl
carbamate et le mélange réactionnel est chauffé au reflux pendant 1,5h puis
concentrée
sous pression réduite. On ajoute de l'eau et de l'acétate d'éthyle. La phase
organique
est lavée à l'eau, séchée sur sulfate de magnésium et concentrée sous pression
réduite.
Le résidu est chromatographié sur gel de silice élué par du dichlorométhane.
On obtient
0,556 g de 4-Methylene-3,4-dihydro-2H-quinoline-1-tert-butyl carbamate.
RMN 'H (CDCI3, 200MHz), b(ppm) : 1,4 (s, 9H) ; 2,53-2,68 (m, 2H) ; 3,62-3,74
(m, 2H) ; 4,85 (s,1 H) ; 5,49 (s, 1 H) ; 6,89-7,18 (m, 2H) ; 7,42-7,6 (m, 2H)
17.2 : 2,2-difluoro-2',3'-dihydro-1'H-spiro[cyclopropane-1,4'-quinoline]-1'-
tert-butyl
carbamate
Dans un ballon de 10 ml muni d'un agitateur magnétique et placé sous
atmosphère inerte, sont placés 0,275 g de 4-methylene-3,4-dihydro-2H-quinoline-
1-tert-
butyl carbamate, 0,0028 g de fluorure de sodium et 1,5 ml de toluène. Le
mélange
réactionnel est chauffé au reflux pendant 1 h. On ajoute ensuite, 0,449 g de
fluorosulfonydifluoroacetate de méthyle et le mélange réactionnel est chauffé
au reflux
pendant 2h, filtré sur célite, puis concentrée sous pression réduite. Le
résidu est
chromatographié deux fois sur gel de silice élué par du dichlorométhane. On
obtient
0,23 g de 2,2-difluoro-2',3'-dihydro-1'H-spiro[cyclopropane-1,4'-quinoline]-1'-
tert-butyl
carbamate.
M+H+=296,2
17.3 : 2,2-difluoro-2',3'-dihydro-1'H-spiro[cyclopropane-1,4'-quinoline]
On dissous 0,105 g de 2,2-difluoro-2',3'-dihydro-1'H-spiro[cyclopropane-1,4'-
quinoline]-1'- tert-butyl carbamate dans 5 ml de dichlorométhane, puis on
ajout 7,78 ml
d'une solution 4N d'acide chlorhydrique dans le dioxanne. On maintient
l'agitation
pendant 14 heures. Après évaporation, le résidu est repris par du
dichlorométhane, puis
hydrolysé par une solution saturée d'hydrogénocarbonate de sodium dans l'eau.
Le
mélange est extrait deux fois au dichlorométhane. Les phases organiques sont
rassemblées, lavées à l'eau puis avec une solution saturée
d'hydrogénocarbonate de
sodium dans l'eau, puis séchées sur sulfate de magnésium et le solvant est
évaporé
sous pression réduite. On obtient 0,588 g de 2,2-difluoro-2',3'-dihydro-1'H-
spiro[cyclopropane-1,4'-quinoline].
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
78
M+H+=196, 3
Exemple 17: 2,2-difluoro-1'-{[3-(1 H-pyrazol-4-yl)pyrrolidin-1-yl]carbonyl}-
2',3'-
dihydro-1'H-spiro[cyclopropane-1,4'-quinoline]
Dans un ballon de 50 ml sous atmosphère d'azote sont placés 0,071 g de
2,2-difluoro-2',3'-dihydro-1'H-spiro[cyclopropane-1,4'-quinoline], 0.03mL de
pyridine et
8,4 ml de dichlorométhane. On ajoute à 0 C, 0,17m1 d'une solution à 20% de
phosgène
dans le toluène, puis la réaction est laissée sous agitation à 0 C pendant '/2
heure et à
température ambiante pendant une heure. On rajoute ensuite à 0 C, 0,05 ml de
triéthylamine et 0,044 g de dichlorhydrate de 4-pyrrolidin-3-yl-1 H-pyrazole
et le mélange
réactionnel est mis sous agitation pendant dix huit heures puis concentrée
sous pression
réduite. Le résidu est chromatographié sur gel de silice élué par un mélange
de
méthanol 5% dans du dichlorométhane. On obtient 0,038 g de 2,2-difluoro-1'-{[3-
(1 H-
pyrazol-4-yl)pyrrolidin-1-yl]carbonyl}-2',3'-dihydro-1'H-spiro[cyclopropane-
1,4'-quinoline].
M+H+=359,3
RMN'H (DMSO-d6, 300MHz), b(ppm) : 1,2-1,3(sl, 1H) ; 1,45-1,6 (m, 1H) ; 1,5-2,6
(m, 6H) ; 3-3,8 (m,5H) ; 6,81-7,2 (m, 4H) ; 7,2-7,7 (m, 2H)
Le tableau qui suit illustre les structures chimiques et les propriétés
physiques de
quelques composés selon l'invention. Dans ce tableau :
- dans la colonne sel , - représente un composé sous forme de base
libre,
alors que HCI représente un composé sous forme de chlorhydrate, Ox. un
composé
sous forme d'oxalate, Fum. un composé sous forme de fumarate, Na+ un sel
sodique et
le rapport entre parenthèses est le rapport (acide: base) s'il n 'est pas égal
à 1,
- Me, Et représentent respectivement des groupes méthyle et éthyle ;
- Bn représente le groupe benzyle.
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
79
.- ~ N N
CD N N N N N
~ O O O O O
L L L L L
N
~ ~
â ~~ O O a) ~ tC)
(V N N
0 Z, o~ ~~ 2 2
= 2 2 Z
Z Z~ Z~ I\ I\ z
v ~
Z \ Z Z
M NM
Li..
a
z
~
N ~
O ~ ~ ~a M
~ LL r
Z4
~ ~ 11
û~ \ X'e
2 (~ 2 I 2
a v_ CD
~ ~ II
~ Cr
11
O ~ 2 2 2 2 =
N
~
i 9
U ~ 2 I 2 I =
l1')
O
N
=fa ~ I 2 2 2 I
N
d)
E
(D
X
N
N o
7 U
~ Ç a
Co X U O O U O
Z a- N M 4!
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
CD CD
d â v v ~ -oa v
~ o 0 0 0 0 0
+ N ~
+
O~ M M
~
LL I~N O t~j~
I~CO ~Ln
N ô! O~
~z z~ ~z z~ Z
I \ Z~ I \ I \
0
õ z
~ 2 2 2 I O I
U U U U =
N N N N
~ 2 2 2 2 2 2
2 2 I 2 2 2
2 2 2 I 2 2
2 2 2 2 2 2
2 2 2 2 2 2 !C O O O O O O
co t~ ao oD
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
81
d N N
~ N N 4) G) 4) 4) G)
O O O O O O O
L L_ L_ L_ L L L
+_ M
i i N
M
~ ~ O M ~~ LL. Q- V ~Or ~~ ~ M M N M M
~1f) ~(0
f/) 2
z z Z~ ~ I \
I Z
. iz z
~ 2 2 2 V
N U 2 2 I I I 2
N
~ 2 = 2 2 2 2 2
~ 2 = 2 2 2 2 2
0
~ 2 2 2 = 2 2 2
2 2 2 I 2 2 2
~ I 2 2 2 2 I 2
X U O O O O O U
N M V) eo t- ao
T-
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
82
d N N ~ ~ ~
= O O O O O O O
L L L L L L
N
+
â V ~j~ Oô ô r~i ~ ~o ~~
..- ~~ NN N
m U C~ U ~ ~
t/) 2 2 2
z z
~ Z \ Z z
~n
Y Y V Z~ O
v v
2 2 = 2 2 2 2
JC)
~ I I 2 I 2 2 2
2 I 2 2 2 = 2
2 2 2 2 2 2 2
2 2 2 2 2 2 2
2 2 LL 2 2 2 2
~ 2 2 2 2 2 2 2
C O
X U O U O O U O
0
Z ~ N N N N N N
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
83
N
N N N N N N ~
O O O O O O O
w L t L ~ L L L
+ tt N ~f
N ~ ~ i
M N N N
LL
~% O O i N i i i p~p
a o CO O
V) 2 2
LL 2 2
Z ZZ Z 0
2 w Z Z
P\A
Z Z Z
2 2
2 2 2 2 2 2 2
2 2 2 2 2 = 2
2 = = 2 2 2 2
2 2 2 2 2 2 (j
2 = 2 = 2 2 2
2 2 2 2 2 = 2
C O O T- =- O T-
X O U U U O
N N N N M M M
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
84
~ ~ v v v
0 0 0
L t L L
LL V CV ~f) d) O
N
~ 1 1 1 U
z
ay ~
~Z
~. ~
_
ct
LL
X O O O O
Z M M M M
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
~ N N O O 4) 4)
~ O O O O O O
C ..L_. ~ rÇ.+ +L+ +Ç+ w~..
+_ N
Ln ~ ti O O
ln ~ N
O ~ M
~. ô OO N ~ D) ~ ~ ~ ~ ~
_
z z z z z
Q,iyiy Z-Z
Y"/
~ 2 () 2 2 li 2
a O
LL 2 2 ô 2 2
m
~ 2 I 2 2 = I
C O ~ O O O O
x O O CD O O U
Z M M M ~
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
86
~ O O O O O O
L L L L L L
+ M d'
N
M
â V ~ p O ~~ O i i
.... N N
~
o = `L
Z-Z z Z-Z
O z ~/ Z Y,/
\ ~ _ _ _
gt
x U O O U O O
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
87
N N
t ô ô ô ô ô ô
+
LL tn Ln LC) O
0 Cp ~ ~f) CO ~(O I~ DO cq
= _ É
:3
LL
Z Z \ /Z _
P\Z/ P,\~ O 0
M M ~ \ I O
= 2 O 2 =
~ 2 I 2 2 I I
~ 2 2 2 I 2 2
2 2 2 2 2 2
0
2 2 2 2 2 2
2 2 2 = 2
C e- O O O
x U U U U U U
~ ~
Z ~ ~ i Cq
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
88
s ô ô ô ô ô ô
+' L L L L L L
U)
+ LL V ~ ~ N ~ O ~
a)
/ P\~ / /~ ~Z Z z
c ~ u- ~ ~
P
2 2 2 2 =
2 2 2 = _
_ _ = 2 (D 2
2 2 = 2 2
I 2 I 2 2
C O O O O O O
>C O z U O O O
Z ~ ~ ~ ~ ~ ~
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
89
d (D
v v v v v
L O O O O O O O
L L L L L L
U)
+ c) M
Ln i i
M (N=)
LL. U N 1~ ~p pp CV CO (O
N N
QL V
U V LL
ç2z2zppyy
2 I 2 I 2 2 2
2 2 2 2 2 = 2
~ _ ? I 2 2 I 2
2 2 I 2 2 2 2
2 2 2 2
2 2 LL
~ ~
U
~ 2 2 2 2 2 2 I
c o 0 0 0 0 0 0
)C U Z O D U U U
cMO e~c m ctOO c~o
Z ô N cO
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
N
~ N N ~ N N N N
w O O O O O O O
L L L L L L L
~ M M M M
_ O DO 00 N
M
~ ~ p M O ~ OD
LL V ~ i i p i i
a p CO
V) 2 I 2 2 2 ' 2
N
2 2 = 2 2
0
II
~ 2 2 2 2 2 2
2 2 I 2 2 I 2
~ pp 2 2 ô ~ 2 2
U
C O ~ O O O O O
X U v) U U U U U
Z
l 'l OO ~ ~ i ~ ti ~
i t
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
91
~ CD v
~ o 0 0 o p o 0
_
C)
I~ N O
â (p (O N tp l!)
i i
z
Z PI / /Z z \ Z= Z\ Z=
(D _
p=
~z U
0 2 () 2 = LL
U
2 2 2
2 2 =
O O O O O O O
X U O U O U O O
z ti i= ti ti ' ô ô
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
92
N N r- ~
o 0 0 0 0 0 0
t L L L L L L
y
+ M M M M
O ~ O O
M M M M
â V N ~ N
N ~
N
~ U
i i i ~ o
Z / Z Z ~ Z Z
d O
=
2 2 2 2 I 2 2
2 2 2 2 I 2 2
2 2 Z 2 2 2 2
I 2 2 2 2 2 2
~ 2 2 I 2 I 2 I
2
~ I 2 2 2 2 2
U
2 2 2 2 I 2 2
c o 0 0 0 0 0 0
x O O D U U U U
Z ~ aMo o~o a`0o a~ o o~o a Oo
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
93
r ô ô ô ô ô ô
~ L L L L L L
c7 N N (V Cei
_ rl- m O)
M M c~) ' M M
LL O d o (p ...
~
_ 4)
V V O
It
c o 0 0 0 0 0
)C O O O O O O
ô c ô~ oN i c
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
94
d ~ ~ ~ ~ rn rn
H d) 4) 4) 4) 4) d) G)
= O O O O O O O
w L L L L L t t
N M M
F. N M M M
pp O N
â p) O O
N
LL LL LL
V
Z Z \ ~Z
~
~ N
N ..iZ Z Z O~ I I
Li ~ Z
N Z I Z I Z Z Z
N Z Z Z Z Z Z Z
C O O O O O O O
x O O O O O Z Z
ô ô
Z o~i ~ o~i vw ~
i
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
~ N N N N N N N
O O O O O O O
C :IE W
U) =
LL ~ (O (O (fl
a~,
_
LL
P z ' /z z j Z2 z z
\ ,~ \ ~ \ ~ \
~
z It
z z
~ 4) U)
C O O O O O O O
x O O O D U O O
ô ô ô ô ô ô ô
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
96
d O N N N
~ N 4) 4) a) a) d)
O ~ O O O O O O
+ cl) M M M
_ a)
N N ' M M
pp
â V ~ OO i i M~ i i
U) ~ 2 z z ZV z ~z
/ z
v ~ v v ~ v ~
U 2 2 = = 2 2
v
2 2 2 2 2 2 2
N N
/y i O~ 1 Z 1 I i
LL ~ ~
N I Z Z I I Z Z
{1
N Z I Z Z I I Z
a
m
C O O O O O O O
X U Z O O O O O
o C~ O N
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
97
y y y N N N N
O O O O
L L .~ L rL-. w
N
_
LL.
d ô~ ' ~(fl OMO ~ N OD
N = _ _ _
z Z Z, Z=
v v v v ~ ~ ~
_
a~
, = Q ~ Q m Q m
2 2 2 2 2 2 2
~
~ 2 2 2 2 I 2 2
~ 2 2 2 = 2 2 2
~ 2 2 I = I 2 2
C O O O O O O O
x O U z z z z z
a ~p f~ CO CD O N
N N N
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
98
+~+ t L t L t
_ ~. r... ++ +-~ +.. r-.
G
L,L MO CàN- ptn
tL ô ~f)(0 p~
m U V) 2 Z V LL
~ i p a~ LL
~
~
I I 2 2 2 2
C O O O O O O
!C Z O O O O O
N N N N N
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
99
d
â v ~ v v v v
L o 0 0 0 0
+
_
LL N O ~ ~~ M
0
, Z= , Z= Z Çff ~, Z=
~ 2 2 2 2 2
~
4) N G)
0
LL LL 2 =
tL LL 2 ~
~
~ 2 I 2 2 2 2
c o O o o O o
X O D U U z U
~ N M M M M M
Z r r r r r r
CA 02652852 2008-11-19
,21 sa.n~~fi dventis N 2101 ~
~rinted,22/07/2008 DESCPAMD FR2007001069
i 0(-
v a~ N ~ ¾J Q)
rr; m çr!
Cl Cfl M M
v~ .-
}
fs+~
dd
. C~
x x x 71 x x
. x x x
. ~~
. ... z
x x x x x x
x x x x x x x x x x x
x x x x. x x
c> Q 4 O O
U U = U U O ~
cn e~,r
â ved at the EPO on Apr 24,2008 09:29:54. Pa AMENDED SH EET 24/04/2008
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
101
ô ô ô ô ô ô ô
L L_ L_ L L_ L L
N
+
to M i
LL NCD c) N
Q. o U)~O tn ~ t1-) CD M ' (O
N N
~ Z, ,Z çizI
? LL
2 2 2 = 2 = 2
(D ~
ci
N U) 4)
N T ç
N ~ Z i. 1 1
_ = 2 2 2 = (j
~ 2 (~ 2 2 I 2 I
U LL 2 2 2 I 2 2 2
c o 0 0 0 0 0 0
X U O O O O O O
C4 r) V) Co
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
102
m
~ o v oa v oa v
~ ô 0 0 0 0 0
+ c) M sf
LL (~ GO 0 f M i i
a
Ll, LL
Z\Z= Z\Z= Çff Z= L.L
ce 0 ~
4)
2 = = 2 = 2
2 2 2 I 2 U
2 2 2 2 2 2
c o 0 0 0 0 0
)C Z O Z U Z U
le ~ n ~ i N cli
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
103
.L O O O O O
L L L .~
+ s~ M C? M
_ ~ O 00 i-
^ 4CO
â V ~~ ~
N I I I I 1
~ , Z= Z ~Z= , Z= ~ , Z=
ay / Z~
1 Z Z 1 Z
LL O _ Z~ I
O
N = = v
1
a~
2 2 I 2
N
2 2 2
2 2 2 2 2
2 2 I 2 I
2 2 2 2 I
C O O O O O
X Q Q Z Z Z
Co
Z
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
104
d N LO
v v v
0
+ CV N M M
t0 f'M
LL
N M ~
d U N
LL
Z, Z= ~ , Z= Z, Z=
LL
O 2 2
U
~ - . - ~
a Z .
u
2 2 2 =
I 2 2 2
O O O O
)C O Z Z z
~~L) ~ c0 ~
Z
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
105
Ln Ln
d ~ ~ oa v ~ o
o 0 0 0 ô
0
+ M M M M M M
_ (p pp t!) Co
= Ln ap O) M
CM M (V M
~
LL ~ r ~ O
d v
LL
~ Z2 ÇIuff , Çlzff , Z2 çiI.TI ~ , Z2
_ = O 2 2 I
I 2 2 2 I 2
2 2 2 2 2 2
I 2 2 2 L~ 2
2 2 2 2 ~ 2
2 2 2 2 2 2
C O O O O O O
!C U Z O Z Z Z
Z ~ ~ r= ~ ~
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
106
N
0 0
~to,
N
+ M M
= ap
=
m M M
LL ~ i N
V) 2
U , z= , Z2
2 2
O
2 I 2
2 = 2
C O O O
X Z O z
Z ~
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
107
y
+ d M
+
CD
â U') CD
ô
O~)
, Z= < Z, Z= ~ '-Z=
- Z-Z
ZD o
~ -
~ 2 2 2
~ I 2 2
~ 2 2 2
2 2 2
2 2 2
C O O O
X z Z z
o ~ ~ ~
Z
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
108
a> r
â o o v
o
o 0
Ç L L
+ ~ c) N
to U-)
LL N p (V CD
o I~ ~ pp M
, Z , Z , Z
/ p
= O LL
a~ O
~ 2 2 2
~ 2 2 2
~ 2 2 2
~ 2 2 2
~ = 2 I
c o 0 0
X z z z
Z e-
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
109
r ~
~
o ô
~. 0
c s
M
+ 0~0 00
LL
a o CD M m
r-
~
Z, z= Z`z= Z, z=
v v ~
~ 2
U
U- o~
~
O
~. 2 2 2
c O O O
X z z z
0CD
0
Z ~
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
110
ô ô ô ô ô
M C?
=
[t (Lni) M
a p QO 0~0 ~ (NO (O
pI ~ , z= < Z, z= ~ , z=
O
z-
0 _
0
N
2 2 2 2 U
2 2 2 2
I 2 2 2 2
2 I 2 2 2
C O O O O O
x z z U U O
le- N M Y)
Z pp CO 00 00 00
e-
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
111
N O Op ~
~ L O O O
G C C
+ M M M M
+
LL N
a v 00 a) N
N
, z= , z= , z= , z=
U = _ ~ 0
- - p -Z O
2 2 2 2
2 2 2 I
I I 2 2
2 I 2 2
I = = 2
c o 0 0 0
X z z z z
oCOO o~0 000
0 00
Z ~
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
112
d N N
L O O O O
C L_
M M M M M
=
d M <> el
~ LC)
V M
CL v pp N f~ ~ a0
, Z= , Z= z Z-= , Z2
LL LL
LL
U
Z
~ 2 2 2 2 2
~ = 2 2 2 I
~ 2 I 2 2 2
2 2 2 2 I
2 2 2 2 2
C O O O O O
x Z Z O O Z
CD O~ m CD
Z ~
cy)
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
113
Ln
s o o 0
+ M M M M
=
cCo ~ ccni
LL ~ (fl (O M CD
a ô~ N CD
~, Z 2 <Z, Z 2 , Z 2
~ = 2 2 2
~ - Z - M
~ 2 2 2 2
~
2 2 2 2
a
2 = 2 =
2 2 I 2
C O O O O
x z z z O
1L) ~O f~ 00
Z C~ 01 CD OD
~
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
114
N r
N
N (D ~ N
t a p O
C ~ ~ N
+ M M N ~)
+
cCD) M
LL ~ r0 O ~
a , N N ~ r
, Z Z\~ ~ \Z
co
LL
v v ~ U ~
~ ~ Z Z
"
~
C O O O O
X Z Z O z
Z N N Nt
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
115
Ln
v -o
ô
s 0
+ c? (V M
~ m
ln f~
â (~ 00 N ~
LL
~ , Z2 ~Z= Z, Z2
2 I 2
= O
O ~ ~ z
~
~ 2 2 2
2 2 2
C O O O
x Z z z
Z N N N
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
116
0
+ c?
=
~.
d ô, sr-
N
~
/ , Z2 , Z2
2 2
\ ~4\
. - Z2 =
I 2
u
2 I
C O O
)C z z
Z N N
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
117
d v v ~r
o 0 0
c
+ M N) M
=
~ U
LL N O O
Z, z= Z`z= Z`z=
~ ~r v
2 2
Z-Z ~
C4 z.~
~
_ = 2
a
C O O O
X z z z
Z N N N
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
118
Les composés selon l'invention ont fait l'objet d'essais pharmacologiques
permettant de déterminer leur effet inhibiteur de l'enzyme 11 beta-HSD1 qui
est
une enzyme qui intervient dans le métabolisme des lipides ou le métabolisme du
glucose.
Ces essais ont consisté à mesurer l'activité inhibitrice in vitro des
composés de l'invention grâce à un test SPA (Scintillation Proximity Assay) en
format 384 puits. La protéine 11 beta-HSD1 recombinante a été produite en
levure
S.cerevisiae. La réaction a été réalisée en incubant l'enzyme en présence de
3H-
cortisone et de NADPH, en absence ou en présence de concentration croissante
d'inhibiteur. Des billes SPA couplées à un anticorps anti-souris, préincubées
avec
un anticorps anti- cortisol, ont permis de mesurer la quantité de cortisol
formé au
cours de la réaction.
L'activité inhibitrice vis-à-vis de l'enzyme 11 beta-HSD1 est donnée par la
concentration qui inhibe 50% de l'activité de 11 bêta-HSD1(Clso)=
Les CI50 des composés selon l'invention sont inférieures à 1 I.M. Par
exemple, les C150 des composés n 4, 7, 18, 78, 101, 162 et 188 sont
respectivement de 0,115 M, 0,230 M, 0,043 M, 0,039 M, 0,09 M, 0,057 M
et 0,130 M.
Il apparaît donc que les composés selon l'invention ont une activité
inhibitrice de l'enzyme 11beta-HSD1. Les composés selon l'invention peuvent
donc être utilisés pour la préparation de médicaments, en particulier de
médicaments inhibiteurs de l'enzyme 11 beta-HSD1.
Ainsi, selon un autre de ses aspects, l'invention a pour objet des
médicaments qui comprennent un composé de formule (I), ou un sel d'addition de
ce dernier à un acide pharmaceutiquement acceptable, ou encore un hydrate ou
un solvat du composé de formule (I).
Ces médicaments trouvent leur emploi en thérapeutique, notamment dans
le traitement de l'obésité, des diabètes, de la résistance à l'insuline, du
syndrome
métabolique, du syndrome de Cushing, de l'hypertension, de l'athérosclérose,
de
la cognition et de la démence, des glaucomes, de l'ostéoporose et de certaines
maladies infectieuses en augmentant l'efficacité du système immunitaire.
Selon un autre de ses aspects, la présente invention concerne des
compositions pharmaceutiques comprenant, en tant que principe actif, un
composé selon l'invention. Ces compositions pharmaceutiques contiennent une
dose efficace d'au moins un composé selon l'invention ou un sel
CA 02652852 2008-11-19
WO 2008/000950 PCT/FR2007/001069
119
pharmaceutiquement acceptable, un hydrate ou solvat dudit composé, ainsi qu'au
moins un excipient pharmaceutiquement acceptable.
Lesdits excipients sont choisis selon la forme pharmaceutique et le mode
d'administration souhaité, parmi les excipients habituels qui sont connus de
l'homme du métier.
Dans les compositions pharmaceutiques de la présente invention pour
l'administration orale, sublinguale, sous-cutanée, intramusculaire, intra-
veineuse,
topique, locale, intratrachéale, intranasale, transdermique ou rectale, le
principe
actif de formule (I) ci-dessus, ou son sel, solvat ou hydrate éventuel, peut
être
administré sous forme unitaire d'administration, en mélange avec des
excipients
pharmaceutiques classiques, aux animaux et aux êtres humains pour la
prophylaxie ou le traitement des troubles ou des maladies ci-dessus.
Les formes unitaires d'administration appropriées comprennent les formes
par voie orale, telles que les comprimés, les gélules molles ou dures, les
poudres,
les granules et les solutions ou suspensions orales, les formes
d'administration
sublinguale, buccale, intratrachéale, intraoculaire, intranasale, par
inhalation, les
formes d'administration topique, transdermique, sous-cutanée, intramusculaire
ou
intraveineuse, les formes d'administration rectale et les implants. Pour
l'application
topique, on peut utiliser les composés selon l'invention dans des crèmes,
gels,
pommades ou lotions.
A titre d'exemple, une forme unitaire d'administration d'un composé selon
l'invention sous forme de comprimé peut comprendre les composants suivants :
Composé selon l'invention 50,0 mg
Mannitol 223,75 mg
Croscaramellose sodique 6,0 mg
Amidon de maïs 15,0 mg
Hydroxypropyl-méthylcellulose 2,25 mg
Stéarate de magnésium 3,0 mg
La présente invention, selon un autre de ses aspects, concerne également
une méthode de traitement des pathologies ci-dessus indiquées qui comprend
l'administration, à un patient, d'une dose efficace d'un composé selon
l'invention,
ou un de ses sels pharmaceutiquement acceptables ou hydrates ou solvats.