Note: Descriptions are shown in the official language in which they were submitted.
CA 02655552 2008-12-16
WO 2008/003855 PCT/FR2007/001124
1
UTILISATION DE 2-BENZOYL-IIVIIDAZOPI'RIDINES EN THÉRAPEUTIQUE
La présente invention se rapporte à l'application en thérapeutique de dérivés
de 2-
benzoyl-imidazo[1,2-a]pyridine dans le traitement ou la prévention de maladies
impliquant les
récepteurs nucléaires Nurr-1 aussi appelé NR4A2, NOT, TINUR, RNR-1, et HZF3.
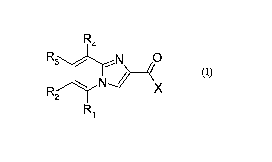
La présente invention a pour objet l'utilisation de composés répondant à la
formule (I) :
R4
R3 N O
N~~~ X
R2
Ri (I)
X est un phényle, Rl, R2, R3 et R4 sont des hydrogènes ; ou
X est un phényle, R3 est méthyle et Rl, R2 et R4 sont des hydrogènes ; ou
X est un phényle, R2 est chlore ou méthoxy et Rl, R3 et R4 sont des hydrogènes
; ou
X est un phényle, R2 et R3 sont méthoxy et Rl et R4 sont des hydrogènes ; ou
X est un phényle, Rl est méthoxy et R2, R3 et R4 sont des hydrogènes ; ou
X est un phényle, R3 est méthoxy et Rl, R2 et R4 sont des hydrogènes ; ou
X est un 4-méthylphényle, R2 est un méthyle et Rl, R3 et R4 sont des
hydrogènes ; ou
X est un 4-chlorophényle, Rl est un chlore ou un méthoxy ou un méthyle, et R2,
R3 et R4 sont des
hydrogènes ; ou
X est un 4-chlorophényle, R2 est un chlore ou un méthyle et Rl, R3 et R4 sont
des hydrogènes ; ou
X est un 4-chlorophényle, R3 est un méthyle, et Rl, R2 et R3 sont des
hydrogènes ; ou
X est un 4-chlorophényle, R4 est un méthyle et Rl, R2 et R4 sont des
hydrogènes ; ou
X est un 4-chlorophényle, Rl et R3 sont des méthyles et R2 et R4 sont des
hydrogènes, ou
X est un 4-chlorophényle et Rl, R2, R3 et R4 sont des hydrogènes, ou
X est un 2-chlorophényle et Rl, R2, R3 et R4 sont des hydrogènes, ou
X est un 4-méthylphényle et Rl, R2, R3 et R4 sont des hydrogènes,
à l'état de base ou de sel d'addition à un acide
pour la préparation d'un médicament pour le traitement et la prévention des
maladies dans
lesquelles le récepteur NOT est impliqué.
Parmi les composés de formule (I) objets de l'invention, un premier groupe de
composés
est constitué des composés pour lesquels :
X est un phényle, Rl, R2, R3 et R4 sont des hydrogènes ; ou
X est un phényle, R2 est chlore ou méthoxy et Rl, R3 et R4 sont des hydrogènes
;
à l'état de base ou de sel d'addition à un acide.
Les composés de formule (I) peuvent exister à l'état de bases ou de sels
d'addition à des
CA 02655552 2008-12-16
WO 2008/003855 PCT/FR2007/001124
2
acides. De tels sels d'addition font partie de l'invention.
Ces sels peuvent être préparés avec des acides pharmaceutiquement acceptables,
mais les sels
d'autres acides utiles, par exemple, pour la purification ou l'isolement des
composés de formule
(I) font également partie de l'invention.
Les composés de formule (I) peuvent également exister sous forme d'hydrates ou
de solvats, à
savoir sous forme d'associations ou de combinaisons avec une ou plusieurs
molécules d'eau ou
avec un solvant. De tels hydrates et solvats font également partie de
l'invention.
Parmi les composés de formule (I) objets de l'invention, on peut notamment
citer les
composés suivants :
(5-Méthoxyimidazo[1,2-a]pyridin-2-yl)(phényl)méthanone
(7-Méthoxyimidazo[1,2-a]pyridin-2-yl)(phényl)méthanone
(6,7-diinéthoxyimidazo[1,2-a]pyridin-2-yl)(phényl)méthanone et son bromhydrate
(1 : 1)
(Imidazo[1,2-a]pyridin-2-yl)(phényl)méthanone et son chlorhydrate (1:1)
(6-Chloroimidazo[1,2-a]pyridin-2-yl)(phényl)méthanone et son bromhydrate (1:1)
(6-Méthoxyimidazo[1,2-a]pyridin-2-yl)(phényl)méthanone
(7-Méthylimidazo[1,2-a]pyridin-2-yl)(phényl)méthanone
(6-Méthylimidazo[ 1,2-a]pyridin-2-yl)(4-méthylphényl)méthanone
(4-Chlorophényl)(6-méthylimidazo [ 1,2-a] pyridin-2-yl)méthanone
(6-Chloroimidazo [ 1,2-a]pyridin-2-yl)(4-chlorophényl)méthanone
(5-Chloroimidazo[ 1,2-a]pyridin-2-yl)(4-chlorophényl)méthanone
(4-Chlorophényl)(5-méthoxyimidazo [ 1,2-a]pyridin-2-yl)méthanone
(4-Chlorophényl)(5-méthylimidazo[ 1,2-a]pyridin-2-yl)méthanone
(4-Chlorophényl)(8-méthylimidazo [ 1,2-a]pyridin-2-yl)méthanone
(4-Chlorophényl)(7-méthylimidazo[ 1,2-a]pyridin-2-yl)méthanone
(4-Chlorophényl)(5,7-diméthylimidazo[ 1,2-a]pyridin-2-yl)méthanone
(Imidazo[ 1,2-a]pyridin-2-yl)(4-méthylphényl)méthanone
(4-Chlorophényl)(imidazo [ 1,2-a]pyridin-2-yl)méthanone
(2-Chlorophényl)(imidazo [ 1,2-a]pyridin-2-yl)méthanone
Conformément à l'invention, on peut préparer les composés de formule générale
(I) selon le
procédé décrit dans le schéma 1.
CA 02655552 2008-12-16
WO 2008/003855 PCT/FR2007/001124
3
O
RHal X R4
:41NNH2 3 2 A R2
R1 (III) R1 (~)
B E X-M(V) D
R4 R
4
R3 N O R3 N O
N~v% OH C
R2 N_N-OMe
R1 R2 R
1
(V~~) (VI)
Schéma 1
La voie A consiste à préparer les 2-amino-pyridines de fonnule (III) selon les
méthodes
connues de l'homme du métier et à former le cycle imidazo[1,2-a]pyridine par
condensation sur
un dérivé de 1-aryl-propane-1,2-dione (IV) dans lequel Hal représente un
halogène par exemple
selon la méthode décrite par J-J. Bourguignon et coll. dans Aust. J.
Chem.1997, 50, 719-725.
La seconde voie de synthèse B, C, D consiste à faire réagir un dérivé
organométallique de
formule générale (V) dans laquelle X est défini comme ci-dessus et M
représente un atome de
lithium ou un groupe Mg-Hal sur un amide de Weinreb de formule (VI) dont les
fonctions
réactives sont éventuellement protégées, selon des méthodes connues de l'homme
du métier telles
que décrites dans Nahm, S.; Weinreb, S. M., Tetrahedron Letters (1981),
22(39), 3815-18 et dans
Sibi, M.P. Organic Preparations and Procedures Int. 1993, 25, 15-40. L'amide
de Weinreb de
formule (VI) est obtenu par couplage du dérivé acide de formule (V) ou de l'un
de ses dérivés
réactifs avec une N,O-dialkylamine selon les méthodes décrites dans les
références ci-dessus.
Le couplage peut être réalisé en présence d'un agent de couplage tel que CDI,
EDCI,
HATU ou HBTU et d'une base telle que la diisopropyléthylamine, la
triéthylamine ou la pyridine,
dans un solvent inerte tel que le THF, le DMF ou le dichlorométhane.
Alternativement on peut
faire réagir la N,O-dialkylamine avec un ester de l'acide de formule (V) en
présence d'un
catalyseur tel que le triméthylaluminium (Weinreb. S. M. Synth. Commun. 1982,
12, 989.).
On peut également selon une troisième voie de synthèse (B, E) faire réagir le
dérivé
organométallique de formule générale (V) défini comme ci-dessus sur un acide
imidazo[1,2-
a]pyridine-2-carboxylique de formule générale (VII) dans lequel Rl, R2, R3 et
R4 sont définis
CA 02655552 2008-12-16
WO 2008/003855 PCT/FR2007/001124
4
comme précédemment ou un de ses sels ou dérivés réactifs tels que ester,
halogénure d'acide,
anhydride ou amide selon des méthodes connues de l'homme du métier, telles que
décrites dans J.
March, Advanced Organic Chemistry (Wiley, 5th Ed. 2001) p 567 et 1213 ou dans
les références
citées.
Les produits de formule (I), peuvent être soumis, si désiré et si nécessaire,
pour obtenir
des produits de formule (I) ou être transformés en d'autres produits de
formule (I), à l'une ou
plusieurs des réactions de transformations suivantes, dans un ordre quelconque
:
a) une réaction de transformation de fonction hydroxyle en fonction alcoxy,
b) une réaction de couplage catalytique d'un dérivé halogèné et d'un dérivé
organométallique tel
que stannique ou boronique pour introduire un substituant méthyle,
c) une réaction de protection des fonctions réactives,
d) une réaction d'élimination des groupements protecteurs que peuvent porter
les fonctions
réactives protégées,
e) une réaction de salification par un acide minéral ou organique ou par une
base pour obtenir le
sel correspondant,
Dans le schéma 1, les composés de départ et les réactifs, quand leur mode de
préparation
n'est pas décrit, sont disponibles dans le commerce ou décrits dans la
littérature, ou bien peuvent
être préparés selon des méthodes qui y sont décrites ou qui sont connues de
l'Homme du métier.
Les exemples suivants décrivent la préparation de certains composés conformes
à
l'invention. Ces exemples ne sont pas limitatifs et ne font qu'illustrer la
présente invention. Les
numéros des exemples renvoient à ceux donnés dans les tableaux ci-après, qui
illustrent les
structures chimiques et les caractéristiques spectroscopiques de quelques
coinposés selon
l'invention.
Exemple 1 : (5-Méthoxyimidazo [1,2-a] pyridin-2-yl)(phényl)méthanone
A une solution de 110 mg de (5-bromoimidazo[1,2-a]pyridin-2-
yl)(phényl)méthanone dans 14 mL
de méthanol, on ajoute 268 mg de méthylate de sodium et 108 mg de poudre de
cuivre. Le
mélange est chauffé 45 minutes à 120 dans un appareil à microondes puis
refroidi et traité par 20
mL d'eau et concentré à sec. Le résidu est repris dans du dichlorométhane.
L'insoluble est éliminé
et le filtrat concentré à sec. Le résidu est chromatographié sur une colonne
de silice en éluant par
un mélange de dichlorométhane et de méthanol 97/3. Les fractions contenant le
produit attendu
sont réunies et concentrées à sec sous pression réduite pour donner 26 mg de
(5-
méthoxyimidazo[1,2-a]pyridin-2-yl)(phényl)méthanone sous la forme d'un solide
jaune.
Exemple 2 : (7-Méthoxyimidazo [1,2-a] pyridin-2-yl)(phényl)méthanone
CA 02655552 2008-12-16
WO 2008/003855 PCT/FR2007/001124
A une solution de 110 mg de bromhydrate (1:1) de (7-hydroxyimidazo[1,2-
a]pyridin-2-
yl)(phényl)méthanone dans 10 mL d'acétone, on ajoute 96 mg de carbonate de
potasium et 78 mg
d'iodure de méthyle. Le mélange réactionnel est chauffé au reflux 15 heures
puis concentré à sec.
Après cliromatographie sur une colonne de silice en éluant par un mélange de
dichlorométhane et
5 de méthanol 96/4, les fractions contenant le produit attendu sont réunies et
concentrées pour
donner 44 mg de (7-méthoxyimidazo[1,2-a]pyridin-2-yl)(phényl)inéthanone sous
la forme d'un
solide jaune pâle.
Exemple 3 . Bromhydrate (1:1) de (6-chloroimidazo[1,2-a]pyridin-2-
yl)(phényl)méthanone
A une solution de 0,82 g de 3-bromo-1-phénylpropane-1,2-dione dans 3 mI., de
DMF refroidie à
4 C on ajoute goutte à goutte une solution de 386 mg de 2-amino-5-chloro-
pyridine dans 7 mL de
DMF. Le mélange réactionnel est agité 6 heures à 4 C puis conservé à la même
température sans
agiter pendant 64 heures à 4 C. Le précipité est filtré et lavé par de l'éther
diéthylique puis placé
en suspension dans 10 mL d'éthanol. Le milieu réactionnel est chauffé au
reflux pendant 2 heures
puis concentré sous pression réduite. Le résidu est repris par de l'éther
diéthylique et trituré puis
filtré et lavé par de l'éther diéthylique. On obtient 0,235 g de bromhydrate
(1:1) de (6-
chloroimidazo[1,2-a]pyridin-2-yl)(phényl)méthanone sous la forme d'un solide
beige.
Les intermédiaires décrits ci-dessous sont utiles à la préparation des
composés de la présente
invention.
Bromhydrate (1:1) de (7-hydroxyimidazo[1,2-a]pyridin-2-yl)(phényl)méthanone
A une suspension de 0,250 g de 4-hydroxypyridine-2-amine dans 4 mL de THF, on
ajoute une
solution de 0,619 g de 3-bromo-1-phénylpropane-1,2-dione dans 4 mL de THF. Le
mélange
réactionnel est agité 15 h à 20 C, puis chauffé au reflux 3 heures et
concentré à sec. Le résidu est
repris dans du méthanol et filtré sur une cartouche échangeuse de cations
(Bond Elut SCX Varian,
5 g). Les fractions contenant le produit attendu sont réunies et concentrées.
Le produit est purifié
par chromatographie sur une colonne de silice en éluant par un mélange de
dichlorométhane et de
méthano195/5. Les fractions contenant le produit attendu sont réunies et
concentrées. pour donner
55 mg de bromhydrate (1:1) de (7-hydroxyimidazo[1,2-a]pyridin-2-
yl)(phényl)méthanone sous la
forme d'un solide beige.
Spectre RMN 'H (DMSO-d6, S en ppm) : 6,67 (dd, J = 2,5 et 7,5 Hz, 1H) ; 6,75
(d, J = 2,5 Hz,
1H) ; 7,55 (t large, J= 7,5 Hz, 2H) ; 7,65 (t large, J = 7,5 Hz, 1H) ; 8,26 (d
large, J = 8,0 Hz, 2H) ;
8,40 (s, 1H) ; 8,43 (d, J = 7,5 Hz, 1H) ; 10,5 (s, 1H)
Spectre de masse (IE) : m/z 238 (pic de base) :[M',], m/z 210 :[M+-]-[CO], m/z
105 : PhCO+.
Spectre IR (KBr) : 3165; 2597; 1637; 1551; 1234; 1160; 907; 714 & 698 cm 1.
CA 02655552 2008-12-16
WO 2008/003855 PCT/FR2007/001124
6
5-Bromoimidazo [1,2-a] pyridin-2-yl)(phényl)méthanone
La 5-bromoimidazo[1,2-a]pyridin-2-yl)(phényl)méthanone est obtenue de manière
similaire en
remplaçant la 4-hydroxypyridine-2-amine par la 2-amino-6-bromopyridine.
Spectre R1VIN 1H (DMSO-d6, 8 en ppm) : 7,39 (dd, J = 7,5 et 9,0 Hz, 1H) ; 7,47
(d large, J = 7,5
Hz, 1H) ; 7,59 (t large, J = 7,5 Hz, 2H) ; 7,70 (t large, J = 7,5 Hz, 1H) ;
7,82 (d large, J = 9,0 Hz,
1H) ; 8,33 (d large, J= 8,0 Hz, 2H) ; 8,48 (s, 1H)
Spectre de masse (LCMS) : m/z 300 (pic de base) :[M+H]+.
Spectre IR (KBr) : 3156; 1639; 1511; 1260; 1237; 1179; 1125; 895; 775; 705 &
697 cm 1.
4,5-Diméthoxy-pyridine-2-amine
On ajoute 0,48 g de 4,5-diméthoxy-2-pyridineméthanol à une solution de 0,316 g
de carbonate de
sodium dans 8 mL d'eau puis par portions 0,529 g de permanganate de potassium
de façon à
maintenir la température inférieure à 22 C. Après 2 heures d'agitation à 20 C
on filtre le milieu
réactionnel et rince l'insoluble à l'eau. Le filtrat est amené à pH inférieur
à 1 par addition d'acide
chlorhydrique 5N puis concentré à sec sous pression réduite. Le résidu est
repris dans 16 mL de
terbutanol. Après addition de 0,734 mL d'azoture de diphénylphosphoryle et de
0,95 mL de
triéthylamine, le mélange réactionnel est chauffé à 80 C pendant 16 heures
puis ramené à 20 C.
L'insoluble est filtré et le filtrat concentré à sec sous pression réduite. Le
résidu est trituré avec du
méthanol, l'insoluble est éliminé et le filtrat concentré à sec. Le résidu est
repris dans 10 mL de
dichlorométhane et traité par 2 mL d'acide trifluoroacétique pendant 16 heures
à 20 C. A près
évaporation le résidu est purifié par filtration sur une cartouche échangeuse
de cations (Bond Elut
SCX Varian, 2 g) en éluant par du méthanol ammoniacal 3,5 N. La fraction
contenant le produit
attendu est concentrée et le résidu chromatographié sur une cartouche de
silice en éluant par un
mélange de dichlorométhane et de méthanol 95/5. Les fractions contenant le
produit attendu sont
concentrées sous pression réduite pour donner 0,147 g de 4,5-diméthoxy-
pyridine-2-amine sous la
forme d'un solide beige.
Spectre R1VIlV 1H (DMSO-d6, S en ppm) : 3,65 (s, 3H) ; 3,72 (s, 3H) ; 5,42 (s
large, 2H) ; 6,07 (s,
1H) ; 7,48 (s, 1H).
Spectre de masse (ES) : m/z=155 [MH]+ (pic de base)
Les tableaux qui suivent illustrent les structures chimiques (tableau 1) et
les caractéristiques
spectroscopiques (tableau 2) de quelques composés selon l'invention. Les
tableaux reprennent les
n de composés des exemples ci dessus
CA 02655552 2008-12-16
WO 2008/003855 PCT/FR2007/001124
7
R4
R3 N O
R ,~%
2 N
X
Ri
Tableau 1
Composé Rl R2 R3 R4 X Sel
1 OMe H H H Ph
2 H H OMe H Ph
3 H Cl H H Ph HBr
4 H OMe OMe H Ph HBr
H OMe H H Ph
6 H H Me H Ph
7 H H H H H HCl
CA 02655552 2008-12-16
WO 2008/003855 PCT/FR2007/001124
8
Tableau 2
Composé Caractérisations
Spectre RMN 1H (DMSO-d6, S en ppm) : 4,14 (s, 3H) ; 6,49 (d, J = 7,5 Hz, 1H) ;
7,35
(d, J = 9,0 Hz, 1H) ; 7,45 (dd, J= 7,5 et 9,0 Hz, 1H) ; 7,58 (t, J = 7,5 Hz,
2H) ; 7,68 (t,
J= 7,5 Hz, 1H) ; 8,31 (m, 2H).
1 Spectre de masse (IE) : m/z 252 (pic de base) :[M+'], m/z 237 :[M+']-CH3 ,
m/z 209
237-[CO], m/z 105 : PhCO+, m/z 77 : Ph+
Spectre IR (KBr) : 3172; 2946; 1643; 1545; 1529; 1270; 1234; 1106; 975; 899;
771;
731 & 713 cm'.
Spectre RMN 'H (DMSO-d6, 8 en ppm) : 3,86 (s, 3H) ; 6,76 (dd, J= 2,5 et 7,5
Hz,
1H) ; 7,05 (d, J = 2,5 Hz, 1H) ; 7,56 (t large, J = 7,5 Hz, 2H) ; 7,66 (t
large, J = 7,5 Hz,
1H) ; 8,30 (d large, J= 8,0 Hz, 2H) ; 8,47 (m, 2H)
2 Spectre de masse (IE) : m/z 252 (pic de base) :[M+'], m/z 224 :[M+']- [CO],
m/z 237 :
[M+']-CH3, m/z 209 : 237+-[CO] , m/z 105 : PhCO+, m/z 77 : W.
Spectre IR (KBr) : 3159; 1653; 1548; 1491; 1335; 1236; 1212; 1173; 1018; 897;
714 &
681 cm 1.
Spectre RMN 'H (CDC13-dl, S en ppm) : de 7,51 à 7,64 (m, 3H) ; 7,71 (t large,
J= 7,5
Hz, 1H) ; 7,81 (d, J = 9,5 Hz, 1H) ; 8,27 (d large, J = 8,0 Hz, 2H) ; 8,64 (s,
1H) ; 8,92
3 (d, J= 2,0 Hz, 1H).
Spectre de masse (IE) : m/z 256 :[M}'], m/z 228 :[M+-]-[CO].
Spectre IR (KBr) : 3067; 2792; 1655; 1546; 1438; 1289; 1268; 1244; 1088; 916;
811 &
725 cm 1
Spectre RMN 1H (DMSO-d6, 8 en ppm) : 3,88 (s, 3H) ; 4,03 (s, 3H) ; 7,08 (s,
1H) ; 7,65
(t large, J = 7,5 Hz, 2H) ; 7,77 (t large, J = 7,5 Hz, 1H) ; 8,10 (d large, J
= 8,0 Hz, 2H) ;
7,44 (s, 1H) ; 8,62 (s, 1H).
4 Spectre IR (KBr) : 3284, 1660, 1597, 1563, 1447, 1439, 1316, 1285, 1266,
1239, 1227,
992 cm 1
Spectre de masse (IE) : m/z=282 [M]+ (pic de base), m/z=267 [M - CH3]+,
m/z=239
[m/z=267 - CO]+, m/z=105 PH5O]}, m/z=77 [C6H5]+.
Les composés selon l'invention ont fait l'objet d'essais pharmacologiques
permettant de déterminer
leur effet modulateur sur NOT
Evaluation de l'activité in vitro sur cellule N2A
Des essais ont consisté à mesurer l'activité in vitro des composés de
l'invention sur une lignée
cellulaire (N2A) exprimant de manière endogène le récepteur de souris Nurrl et
transfectées de
manière stable avec l'élément de réponse liant NOT (NBRE) couplé au gène
rapporteur luciférase.
Les EC50 sont comprises entre 0,01 et 1000 nM. Les essais ont été réalisés
selon le mode
opératoire décrit ci dessous.
La lignée cellulaire Neuro-2A provient de source commerciale standard (ATCC).
Le clone Neuro-
2A a été obtenu à partir d'une tumeur spontamiée provenant d'une souche de
souris A albino par
R.J Klebe et col. Cette lignée Neuro-2A est ensuite stablement transfectée
avec 8NBRE-
luciférase. Les cellules N2A-8NBRE sont cultivées jusqu'à confluence dans des
flacons de culture
de 75 cm2 contenant du DMEM supplémenté par 10% de sérum foetal de veau, 4.5
g/L de glucose
CA 02655552 2008-12-16
WO 2008/003855 PCT/FR2007/001124
9
et 0.4 mg/inl de Généticine. Après une semaine de culture les cellules sont
récupérées par de la
thypsine 0.25% pendant 30 secondes puis remises en suspension dans du DMEM
sans rouge de
phénol contenant 4.5g/L de glucose, 10% de sérum délipidé Hyclone et déposées
dans des
plaques blanches 96 puits fond transparent. Les cellules sont déposées à
raison de 60.000 par puit
dans 75 L pendant 24 heures avant l'addition des produits. Les produits sont
appliqués dans
25 L et incubés 24 heures supplémentaires. Le jour de la mesure, on ajoute à
chaque puit un
volume équivalent (1001iL) de Steadylite, puis attendre 30 minutes pour
obtenir une lyse complète
des cellules et la production maximale du signal. Les plaques sont ensuite
mesurées dans un
compteur de luminescence pour microplaques après avoir été scellées par un
film adhésif. Les
produits sont préparés sous forme de solution stock à 10"2M, puis dilués dans
100% de DMSO.
Chaque concentration de produit est préalablement diluée dans du milieu de
culture avant
incubation avec les cellules contenant ainsi 0.625% fmal de DMSO.
Par exemple, les composés n 7 et 6 ont montré une EC50 de respectivement 31
nM et 1,2 nM
Evaluation de la liaison au récepteur humain NOT
La liaison directe entre des composés de l'invention et le récepteur humain
NOT a été évaluée en
utilisant la technologie SPR (surface plasmon resonance). Dans cet essai la
protéine est
immobilisée de façon covalente à la matrice et la molécule à étudier est
injectée dans la chambre
contenant la sensor chip. Le signal est directement proportionnel à la
quantité de produit fixé à la
protéine. Les essais de liaison ont été réalisés dans un instrument BIACORE
S51 (Biacore Inc.,
Piscataway N.J.). La protéine entière GST-NOT (NOT-FL) a été fournie par
Invitrogen (PV3265).
Le domaine de liaison au ligand de NOT (His-Thr-NOT 329-598) a été exprimé et
purifié coinme
décrit dans Nature 423, 555-560. Les deux protéines, diluées à une
concentration de 20 g/ml
dans un tampon acétate pH 5.0 contenant 5 mM de DTT, ont été immobilisées sur
une surface de
carboxymethyl 5' dextrane (CM5 sensor chip, Biacore Inc.) par couplage amine
en suivant le
protocole recommandé par Biacore en éluant par un tampon BBS-N (10 mM HEPES,
0.15 M
NaCI, 3 mM EDTA, pH 7.4). Approximativement 10000-15000 unités de resonance
(RU) des
protéines sont capturées sur la surface du sensor chip CM5. Les solutions
stock des composés à
étudier à 1,5 mM dans le DMSO sont diluées en série dans du tampon d'élution
(50 mM HEPES
pHB; 150 mM NaCI; 10 mM MgC12; 2% DMSO, 1 mM DTT) à des concentrations allant
de 3,75
à 0,1 M. Chaque concentration de produit est injectée à 4 C pendant 1 minute
à 30 Umin. La
dissociation a été enregistrée pendant 5 minutes sans autre procédure de
régénération de la
surface. Les signaux obtenus sont corrigés en testant chaque concentration de
produit sur une
surface de dextrane non modifiée (blanc). Le signal dû au tainpon de migration
est déduit du
signal total ( double referencing ) ainsi que l'effet du DMSO. L'analyse des
signaux est
effectuée à l'aide du logiciel d'analyse Biacore S51 (version 1.2.1). Les
composés sont ensuite
classés en fonction de leur niveau de fixation maximal et de paramètres
cinétiques de liaison à la
CA 02655552 2008-12-16
WO 2008/003855 PCT/FR2007/001124
protéine iinmobilisée.
A titre d'exemple, le composé n 6 a une affinité moyenne et le composé n 3 a
une
affinité forte.
Il apparaît donc que les composés selon l'invention ont un effet modulateur de
NOT.
5 Les composés selon l'invention peuvent donc être utilisés pour la
préparation de
médicaments pour leur application en thérapeutique dans le traitement ou la
prévention de
maladies impliquant les récepteurs NOT.
Ces médicaments trouvent leur emploi en thérapeutique, notamment dans le
traitement et
la prévention des maladies neurodégénératives telles que par exemple la
maladie de Parkinson,
10 d'Alzheimer, les tauopathies (ex. la paralysie progressive supranucléaire,
la déinence fronto
temporale, la dégénérescence corticobasale, la maladie de Pick), la sclérose
en plaque ; les
traumatismes cérébraux comme l'ischémie et les traumatismes crâniens et
l'épilepsie ; les
maladies psychiatriques conune la schizophrénie, la dépression, la dépendance
à une substance les
troubles déficit de l'attention et de l'hyperactivité ; les maladies
inflammatoires comme les
pathologies vasculaires, l'athérosclérose, les inflammations des
articulations, l'arthrose, l'arthrite
rhumatoïde ostéoarthrite, maladies inflammatoires allergiques telle que
l'asthme et pour finir le
traitement de l'ostéoporose, les cancers.
Ces composés pourraient être aussi utilisés comme traitement associé à des
greffes et/ou
transplantations de cellules souches
Selon un autre de ses aspects, la présente invention concerne des compositions
pharmaceutiques
comprenant, en tant que principe actif, un composé selon l'invention. Ces
compositions
pharmaceutiques contiennent une dose efficace d'au moins un composé selon
l'invention, ou un sel
pharmaceutiquement acceptable dudit composé, ainsi qu'au moins un excipient
pharmaceutiquement acceptable.
Lesdits excipients sont choisis selon la forme pharmaceutique et le mode
d'administration
souhaité, parmi les excipients habituels qui sont comius de l'Homme du métier.
Dans les compositions pharmaceutiques de la présente invention pour
l'administration
orale, sublinguale, sous-cutanée, intramusculaire, intra-veineuse, topique,
locale, intratrachéale,
intranasale, transdermique ou rectale, le principe actif de formule (I) ci-
dessus, ou son sel, peut
être administré sous forme unitaire d'administration, en mélange avec des
excipients
pharmaceutiques classiques, aux animaux et aux êtres humains pour la
prophylaxie ou le
traitement des troubles ou des maladies ci-dessus.
Les formes unitaires d'administration appropriées comprennent les formes par
voie orale
telles que les comprimés, les gélules molles ou dures, les poudres, les
granules et les solutions ou
suspensions orales, les formes d'administration sublinguale, buccale,
intratrachéale, intraoculaire,
intranasale, par inhalation, les formes d'administration topique,
transdermique, sous-cutanée,
CA 02655552 2008-12-16
WO 2008/003855 PCT/FR2007/001124
11
intramusculaire ou intraveineuse, les fonnes d'administration rectale et les
implants. Pour
l'application topique, on peut utiliser les composés selon l'invention dans
des crèmes, gels,
pommades ou lotions.
A titre d'exemple, une forme unitaire d'administration d'un composé selon
l'invention
sous forme de comprimé peut comprendre les composants suivants :
Composé selon l'invention 50,0 mg
Mannitol 223,75 mg
Croscarmellose sodique 6,0 mg
Amidon de maïs 15,0 mg
Hydroxypropyl-méthylcellulose 2,25 mg
Stéarate de magnésium 3,0 mg
Il peut y avoir des cas particuliers où des dosages plus élevés ou plus
faibles sont
appropriés ; de tels dosages ne sortent pas du cadre de l'invention. Selon la
pratique habituelle, le
dosage approprié à chaque patient est déterminé par le médecin selon le mode
d'administration, le
poids et la réponse dudit patient.
La présente invention, selon un autre de ses aspects, concerne également une
méthode de
traitement des pathologies ci-dessus indiquées qui comprend l'administration,
à un patient, d'une
dose efficace d'un composé selon l'invention, ou un de ses sels
pharmaceutiquement acceptables.