Note: Descriptions are shown in the official language in which they were submitted.
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
1
PROCEDES ET OUTILS POUR LA THERAPIE DE PATHOLOGIES
NEURODEGENERATIVES
La présente invention concerne des compositions et méthodes pour le traitement
de
pathologies neurodégénératives dans lesquelles les fonctions cognitives sont
altérées,
comme observé dans la maladie d'Alzheimer. Plus particulièrement, l'invention
présente une stratégie pour suivre en clinique humaine l'activité et/ou
l'efficacité de
traitements neuro-protecteurs, basée sur le dosage biochimique de certains
paramètres
des plaquettes, et donc réalisable à partir de prélèvements sanguins.
L'invention
concerne également des méthodes, outils, constructions et compositions
adaptées à la
mise en oeuvre de ces stratégies.
La maladie d'Alzheimer représente la principale cause de démence et la maladie
neurodégénérative la plus fréquente. Cette maladie, d'évolution progressive,
est
caractérisée par la perte de mémoire et par une dégradation des aptitudes au
langage, à
l'orientation et au jugement. L'examen de cerveaux de patients atteints de
cette maladie
révèle une perte de neurones de l'hippocampe, centre important de la mémoire,
et du
cortex cérébral, impliqué dans le raisonnement, le langage et la mémoire. Les
neurones
cholinergiques sont particulièrement affectés par cette déplétion.
Une anomalie majeure observée dans les cerveaux des malades atteints de la
maladie
d'Alzheimer est l'accumulation d'agrégats intracellulaires et extracellulaires
de
protéines. Des plaques séniles formées par agrégation intra et extracellulaire
de peptide
beta-amyloïde (A(3), résultant du clivage de l'APP (Amyloid Precursor
Protein),
caractérisent des régions d'altérations impliquant des neurones et des
cellules gliales.
D'autres agrégats intracellulaires, neurofibrillaires, de la protéine tau
semblent bien
corrélés avec la gravité de la démence.
Les études génétiques menées sur les formes familiales ont montré que 4 gènes
sont
associés au développement de la maladie. L'APP, les présénilines 1 et 2(PSl et
PS2) et
l'apolipoprotéine E (Apo E). Bien que des mutations ou polymorphismes dans
chacun
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
2
de ces gènes aboutissent à une production accrue de peptide A(3, les
mécanismes qui
président aux pertes synaptiques et neuronales restent mal connus. Plusieurs
hypothèses
et mécanismes semblent ainsi coexister, qui impliquent des phénomènes tels que
le
stress oxydatif, qui peut être induit notamment par le peptide A(3, les
phénomènes
inflammatoires et immunitaires ou encore les défauts d'hormones sexuelles, les
défauts
d'insuline et l'hypothyroïdisme. D'autres hypothèses soulignent le rôle des
modifications des influx de calcium et de l'excitotoxicité. Toutefois, aucun
élément ne
permet de rentre compte de la vulnérabilité particulière des neurones
cholinergiques.
Les traitements actuellement disponibles, basés sur l'utilisation
d'inhibiteurs
d'acétylcholinestérase, ne font qu'améliorer de façon transitoire les
fonctions cognitives
des patients et ne représentent pas une approche thérapeutique susceptible de
ralentir la
progression de la maladie d'Alzheimer et encore moins de la guérir.
Si de récentes observations soulignent la possibilité d'intervenir
pharmacologiquement
par des approches d'immunothérapie dirigée contre le peptide A5, il est encore
plus
pertinent de cibler directement les sécrétases qui sont les protéases
impliquées dans le
métabolisme de l'APP et la production du peptide A(3.
Le peptide A(3 est un fragment de 40/42 résidus qui est produit, dans la voie
amyloïdogénique, via un clivage séquentiel de la protéine APP par deux
protéases
appelées (3-secretase (BACE) et y-secretase (présénilines). La séquence du
peptide A(3
est localisée à la jonction entre les domaines intramembranaire et
extracellulaire de
l'APP. Dans la voie non- amyloïdogénique, l'APP est clivé dans le domaine A(3
par une
a-secretase entre les acides aminés 16(Lys) et 17(Leu) de la région A(3,
générant la
partie APP soluble a(sAPP(x, 105-125 kDa, résidus 1-688 de la forme APP770)
relarguée dans le milieu extracellulaire et un fragment retenu à la membrane
(contenant
une partie du domaine transmembranaire et la partie intracellulaire C
terminale) appelé
C83 (10 kDa), lui-même clivé par la y-secrétase pour générer le peptide APP
IntraCellular Domain (AICD) et le peptide P3 (3 kDa). L'action de l'a-
secretase
empêche donc non seulement la formation du peptide amyloide, mais stimule
aussi la
génération du grand fragment extracellulaire N-terminal (ectodomaine) de
l'APP. Les
fragments solubles N-terminaux de l'APP générés par l'a-secretase, ou sAPPa
sont
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
3
relargués de façon constitutive dans le lumen vésiculaire et à la surface de
la cellule. De
telles espèces de l'APP sont sécrétées, in vitro, dans le milieu de culture
conditionné par
les cellules exprimant l'APP, et sont retrouvées in vivo dans le plasma et le
liquide
céphalorachidien.
Les approches décrites pour stimuler l'activité a-secretase, et augmenter les
niveaux de
sAPPa mettent en jeu l'activation de récepteurs couplés aux protéines G tels
que les
récepteurs aux nucléotides P2Y2, le récepteur au PACAP PACl, ou les récepteurs
de
divers neurotransmetteurs comme les récepteurs muscariniques, le récepteur
métabotropique au glutamate ou encore les récepteurs de la sérotonine (ref iii
pour
revue). Les voies stimulées par les neurotransmetteurs mettent en jeu les
systèmes
protéine kinase C (PKC) et phospholipase C, ainsi que les MAP kinases, bien
décrits
dans la littérature comme modulateurs de la production de sAPPa, comme la
stimulation de voies PKC-dépendantes par les esters de phorbol ou encore par
des
agonistes des récepteurs de la sérotonine 5-HT2a et 2c. D'autres voies mettent
en jeu le
récepteur de la sérotonine 5-HT(4), connu pour jouer un rôle dans la cognition
et la
mémoire, via la production d'AMPc et le recrutement de la GTPase Racl ou
encore des
inhibiteurs d'acétylcholine agissant via la PKC et ou les MAP-kinases, les
oestrogènes
tels le 17 (3 oestradiol ou encore la testostérone. Certaines hormones et
facteurs de
croissance tels l'EGF et l'insuline sont également connus pour stimuler la
production de
sAPPa via la PKC ou la PI3K, respectivement. D'autres agents pharmacologiques
ont
été récemment décrits comme stimulant la production de sAPPa, selon une voie
cAMP-
Protéine kinase A (PKA) comme la forskoline, ou selon une voie PKC/MAP-kinase,
comme les agents anti-inflammatoires non stéroïdiens tels les inhibiteurs des
cyclooxygénase COX (Ibuprofen), les statines inhibiteurs de la HMG-CoA
réductase
(lovastatine), les dérivés de la rasagiline ou encore les polyphénols tels le
(-)-
epigallocatechin-3-gallate. Mais toutes ces approches, si elles ont permis de
valider la
pertinence de la stratégie visant à stimuler la production de sAPPalpha à
l'aide d'outils
pharmacologiques, n'ont pas abouti à de nouveaux composés adaptés à la
clinique
humaine.
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
4
La présente invention fournit un rationnel à l'utilisation d'agents
pharmacologiques
comme des composés chimiques appartenant à la classe des pyrazolopyridines,
dont
l'étazolate, destinés à stimuler la production du fragment sAPPa.
La présente invention décrit également le lien entre l'augmentation de la
production de
sAPPalpha et la capacité de l'étazolate à inhiber les effets induits par les
ROS
("Reactive Oxygen Species"), c'est-à-dire par le stress oxydatif
Ce phénomène de stress oxydatif joue un rôle essentiel dans plusieurs aspects
de la
maladie d'Alzheimer : non seulement la dégénéresence neuronale et
l'inflammation
astrocytaire mais également l'activation et l'agrégation plaquettaire. Ces
derniers
phénomènes participent aux complications vasculaires de la maladie d'Alzheimer
et
sont à l'origine des démences vasculaires.
Il est par conséquent possible de suivre un effet inhibiteur de l'étazolate
sur les voies
initiées par le stress oxydatif au niveau de l'activation plaquettaire. Plus
généralement,
il est possible de suivre l'effet inhibiteur de composés neuroprotecteurs au
niveau de
l'activation plaquettaire.
Ainsi, la présente invention permet de proposer, pour la première fois, la
mesure de tout
phénomène biologique relié à l'activation ou à l'agrégation plaquettaire pour
le suivi
clinique ou thérapeutique de l'efficacité de composés neuroprotecteurs. La
capacité de
générer à partir de l'APP les peptides Abeta et sAPPalpha est partagée par le
système
nerveux et les plaquettes. Par conséquent, l'action inhibitrice de l'étazolate
sur le stress
oxydatif se traduisant par une augmentation de la production de sAPPalpha, la
présente
invention fournit un rationnel pour suivre l'action de 1'étazolate sur la
maturation de
1'APP à partir d'échantillons plaquettaires ou plus généralement
d'échantillons
sanguins.
La présente invention revendique également la mesure de tout phénomène
biologique
relié à l'activation ou à l'agrégation plaquettaire pour le suivi clinique ou
thérapeutique
de l'efficacité de tout composé de la famille des pyrazolopyridines. De plus,
la présente
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
invention permet de revendiquer la mesure de toute modification de la
maturation de
l'APP dans le sang, notamment le dosage de la sAPPalpha, à partir
d'échantillons de
sang ou de préparations de plaquettes afin d'assurer le suivi clinique et
thérapeutique de
l'efficacité de tout composé de la famille des pyrazolopyridines.
Ainsi, un objet de l'invention réside dans une méthode pour évaluer ou suivre
l'efficacité
d'un traitement neuroprotecteur chez un mammifère, comprenant une étape de
mesure
(de préférence in vitro ou ex vivo) de la production de sAPPalpha dans un
échantillon
biologique du mammifère ayant reçu ledit traitement, ledit échantillon
contenant des
plaquettes, la production de sAPPalpha étant une indication de l'efficacité du
traitement.
Un autre objet de l'invention réside dans un procédé de dosage immunologique
de la
sAPPalpha dans un échantillon, comprenant une étape de traitement thermique de
l'échantillon (pour démasquer la sAPPalpha), et une étape de dosage
immunologique.
Le procédé est adapté au dosage de la sAPPalpha à partir de tout échantillon,
et
notamment d'échantillons de sang ou dérivé de sang (sérum, plaquettes, etc.),
d'autres
fluides biologiques. L'échantillon peut être pré-traité, notamment par
dilution,
enrichissement, filtration, etc.
Traitement neuroprotecteur
L'invention peut être utilisée pour évaluer ou suivre l'efficacité de tout
traitement
neuroprotecteur chez un mammifère. Au sens de l'invention, on entend par
traitement
neuroprotecteur tout traitement utilisable ou utilisé dans le traitement des
maladies
affectant le système nerveux, notamment de maladies neurodégénératives. Dans
ce
contexte, on peut citer notamment les composés choisis parmi les
pyrazolopyridines et
les agents modulateurs des récepteurs GABA(A).
Au sens de l'invention, un composé de la famille des pyrazolopyridines désigne
avantageusement tout composé de formule (I) suivante, qui peut être substitué
ou non,
sur l'une quelconque des positions.
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
6
N
HN~ ~
N\ /
(I)
Les composés de la famille des pyrazolopyridines utilisés dans la présente
invention
sont en particulier choisis parmi les composés suivants :
- L'étazolate de formule (II) suivante :
CH3-CH2--N-' N
N~
N\ ~ H
O
O
(II)
1'étazolate constituant un mode de mise en oeuvre préféré de l'invention,
- Ester éthylique de l'acide 4-butylamino-1-ethyl-6-methyl-lH-pyrazolo[3,4-
b]pyridine-
5-carboxylique (tracazolate),
- Ester éthylique de l'acide 4-butylamino-1-ethyl-lH-pyrazolo[3,4-b]pyridine-5-
carboxylique,
- 1-(4-amino-pyrazolo[3,4-b]pyridin-1-yl)-(3-D-1-deoxy-ribofuranose
- Ester éthylique de l'acide 1-ethyl-4-(N'-isopropylidene-hydrazino)-1H-
pyrazolo[3,4-
b]pyridine-5-carboxylique (SQ 20009),
- 4-amino-6-methyl-1-n-pentyl-lH-pyrazolo[3,4-b]pyridine
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
7
- Ester éthylique de l'acide 4-Amino-1-ethyl-6-methyl-lH-pyrazolo[3,4-
b]pyridine-5-
carboxylique (desbutyl tracacolate),
- 4-amino-1-pentyl-lH-pyrazolo[3,4-b]pyridine-5-carboxamide,
- Ester éthylique de l'acide 1-ethyl-6-methyl-4-methylamino-lH-pyrazolo[3,4-
b]pyridine-5-carboxylique,
- Ester éthylique de l'acide 4-amino-6-methyl-1-propyl-lH-pyrazolo[3,4-
b]pyridine-5-
carboxylique,
- Ester éthylique de l'acide 1-ethyl-4-ethylamino-6-methyl-lH-pyrazolo[3,4-
b]pyridine-
5-carboxylique,
- Ester éthylique de l'acide 4-amino-1-butyl-6-methyl-lH-pyrazolo[3,4-
b]pyridine-5-
carboxylique,
- 5-(4-amino-pyrazolo[3,4-b]pyridin-1-yl)-2-hydroxymethyl-tetrahydro-furan-3-
ol,
- ester allylique de l'acide 1-allyl-4-amino-6-methyl-lH-pyrazolo[3,4-
b]pyridine-5-
carboxylique,
- acide 4-amino-6-methyl-1-pentyl-lH-pyrazolo[3,4-b]pyridine-5-carboxylique,
- ester éthylique de l'acide 4-amino-1-ethyl-3,6-dimethyl-lH-pyrazolo[3,4-
b]pyridine-
5-carboxylique,
- ester éthylique de l'acide 4-dimethylamino-1-ethyl-6-methyl-lH-pyrazolo[3,4-
b]pyridine-5-carboxylique,
- ester éthylique de l'acide 1-ethyl-6-methyl-4-propylamino-lH-pyrazolo[3,4-
b]pyridine-5-carboxylique,
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
8
- ester éthylique de l'acide 4-amino-1-pentyl-lH-pyrazolo[3,4-b]pyridine-5-
carboxylique,
- ester éthylique de l'acide 4-amino-6-methyl-1-pent-4-ynyl-lH-pyrazolo[3,4-
b]pyridine-5-carboxylique,
- 4-amino-1-but-3-enyl-lH-pyrazolo[3,4-b]pyridine-5-allylamide,
- 4-amino-1-pentyl-lH-pyrazolo[3,4-b]pyridine-5-isopropylamide,
- 4-amino-1-pentyl-N-n-propyl-lH-pyrazolo-[3,4-b]pyridine-5-carboxamide,
- ester allylique de l'acide 4-amino-1-butyl-6-methyl-lH-pyrazolo[3,4-
b]pyridine-5-
carboxylique,
- ester éthylique de l'acide 4-amino-6-methyl-1-pent-3-ynyl-lH-pyrazolo[3,4-
b]pyridine-5-carboxylique,
- 4-amino-1-pentyl-lH-pyrazolo[3,4-b]pyridine-5-prop-2-ynylamide
- ester allylique de l'acide 4-amino-l-(3-methyl-butyl)-1H-pyrazolo[3,4-
b]pyridine-5-
carboxylique,
- 4-amino-1-pentyl-lH-pyrazolo[3,4-b]pyridine-5-N-(2-propenyl)carboxamide,
- ester allylique de l'acide 4-amino-1-pentyl-lH-pyrazolo[3,4-b]pyridine-5-
carboxylique,
- 4-amino-1-pentyl-lH-pyrazolo[3,4-b]pyridine-5-butylamide,
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
9
- ester allylique de l'acide 4-amino-1-but-3-ynyl-6-methyl-lH-pyrazolo[3,4-
b]pyridine-
5-carboxylique,
- ester allylique de l'acide 4-amino-1-but-3-enyl-6-methyl-lH-pyrazolo[3,4-
b]pyridine-
5-carboxylique,
- 4-amino-6-methyl-1-pentyl-lH-pyrazolo[3,4-b]pyridine-5-allylamide,
- ester allylique de l'acide 4-amino-6-methyl-1-pentyl-lH-pyrazolo[3,4-
b]pyridine-5-
carboxylique,
- ester allylique de l'acide 4-amino-6-methyl-l-(3-methyl-butyl)-1H-
pyrazolo[3,4-
b]pyridine-5-carboxylique,
- ester isobutylique de l'acide 4-amino-6-methyl-1-pentyl-lH-pyrazolo[3,4-
b]pyridine-
5-carboxylique,
- 4-amino-6-methyl-1-pentyl-lH-pyrazolo[3,4-b]pyridine-5-butylamide,
- ester allylique de l'acide 4-amino-6-methyl-l-(3-methyl-but-2-enyl)-1H-
pyrazolo[3,4-
b]pyridine-5-carboxylique,
- 4-amino-1-pentyl-lH-pyrazolo[3,4-b]pyridine-5-cyclopropylamide,
- ethyl4-amino-1-pentyl-lH-pyrazolo[3,4-b]pyridine-5-hydroxamate,
- ester prop-2-ynylique de l'acide 4-amino-6-methyl-1-pentyl-lH-pyrazolo[3,4-
b]pyridine-5-carboxylique,
- ester allylique de l'acide 4-amino-6-methyl-1-pent-4-ynyl-lH-pyrazolo[3,4-
b]pyridine-5-carboxylique,
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
- ester allylique de l'acide 4-amino-6-methyl-1-pent-4-enyl-lH-pyrazolo[3,4-
b]pyridine-5-carboxylique,
- 4-amino-1-pent-3-ynyl-lH-pyrazolo[3,4-b]pyridine-5-propylamide,
- 4-amino-1-pentyl-lH-pyrazolo[3,4-b]pyridine-5-cyclopropylmethyl-amide,
- ester 2-méthyl-allylique de l'acide 4-amino-6-methyl-1-pentyl-lH-
pyrazolo[3,4-
b]pyridine-5-carboxylique,
- 4-Amino-1-pent-3-ynyl-lH-pyrazolo[3,4-b]pyridine-5-allylamide (ICI 190,622),
- 4-amino-1-pent-4-ynyl-N-2-propenyl-lH-pyrazolo[3,4-b]pyridine-5-carboxamide,
- 4-amino-1-pent-3-ynyl-lH-pyrazolo[3,4-b]pyridine-5-prop-2-ynylamide,
- 4-amino-1-pentyl-lH-pyrazolo[3,4-b]pyridine-5-but-2-ynylamide,
- ester allylique de l'acide 4-amino-6-methyl-1-pent-3-ynyl-lH-pyrazolo[3,4-
b]pyridine-5-carboxylique,
- ester allylique de l'acide 4-amino-l-(2-cyclopropyl-ethyl)-6-methyl-lH-
pyrazolo[3,4-
b]pyridine-5-carboxylique,
- ester allylique de l'acide 4-amino-1-hex-5-ynyl-6-methyl-lH-pyrazolo[3,4-
b]pyridine-
5-carboxylique,
- 4-amino-1-pent-3-ynyl-lH-pyrazolo[3,4-b]pyridine-5-cyclopropylmethyl-amide,
- ester but-3-énylique de l'acide 4-amino-6-methyl-1-pentyl-lH-pyrazolo[3,4-
b]pyridine-5-carboxylique,
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
11
- ester cyclopropylméthylique de l'acide 4-amino-6-methyl-1-pentyl-lH-
pyrazolo[3,4-
b]pyridine-5-carboxylique,
- 4-butylamino-1-pentyl-lH-pyrazolo[3,4-b]pyridine-5-allylamide,
- ester 2-cyclopropyl-éthylique de l'acide 4-amino-6-methyl-1-pentyl-lH-
pyrazolo[3,4-
b]pyridine-5-carboxylique,
- ester cyclopropylméthylique de l'acide 4-amino-6-methyl-1-pent-3-ynyl-lH-
pyrazolo [3,4-b]pyridine-5-carboxylique,
- ester cyclopropylméthylique de l'acide 4-amino-6-methyl-1-pent-4-ynyl-lH-
pyrazolo [3,4-b]pyridine-5-carboxylique,
- ester éthylique de l'acide 4-amino-1-benzyl-6-methyl-lH-pyrazolo[3,4-
b]pyridine-5-
carboxylique,
- 4-amino-1-pentyl-lH-pyrazolo[3,4-b]pyridine-5-benzylamide,
- 4-amino-1-pentyl-lH-pyrazolo[3,4-b]pyridine-5-phenylamide,
- ester benzylique de l'acide 4-amino-6-methyl-1-pentyl-lH-pyrazolo[3,4-
b]pyridine-5-
carboxylique,
- 4-Azido-1-5-D-ribofuranosylpyrazolo[3,4-b]pyridine,
- 1-pent-3-ynyl-N-2-propenyl-4-propionamido-lH-pyrazolo[3,4-b]pyridine-5-
carboxamide,
- 2-(4-amino-pyrazolo[3,4-b]pyridin-1-yl)-5-hydroxymethyl-tetrahydro-furan-3,4-
diol,
- 2-(6-methyl-lH-pyrazolo[3,4-b]pyridin-4-ylamino)-éthanol,
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
12
- 3-(6-methyl-lH-pyrazolo[3,4-b]pyridin-4-ylamino)-propan-1-o1,
- ester propylique de 1`acide 3-(6-methyl-lH-pyrazolo[3,4-b]pyridin-4-ylamino)-
acétique,
- ester éthylique de l'acide 2-(6-methyl-lH-pyrazolo[3,4-b]pyridin-4-ylamino)-
propionique,
- ester éthylique de l'acide 2-(6-methyl-lH-pyrazolo[3,4-b]pyridin-4-ylamino)-
pentanoique,
- ester éthylique de l'acide 2-(6-methyl-lH-pyrazolo[3,4-b]pyridin-4-ylamino)-
benzoique,
- ester propylique de l'acide 3-(6-methyl-lH-pyrazolo[3,4-b]pyridin-4-ylamino)-
pentanoïque,
- N-benzylidene-N-(3-methyl-1-phenyl-lH-pyrazolo[3,4-b]pyridin-4-yl)-
hydrazine,
- N-furan-2-ylmethylene-N-(3-methyl-1-phenyl-lH-pyrazolo[3,4-b]pyridin-4-yl)-
hydrazine,
- N-(4-fluoro-benzylidene)-N-(3-methyl-1-phenyl-lH-pyrazolo[3,4-b]pyridin-4-
yl)-
hydrazine,
- N-(3-furan-2-yl-allylidene)-N-(3-methyl-1-phenyl-lH-pyrazolo[3,4-b]pyridin-4-
yl)-
hydrazine,
- N-(4-methoxy-benzylidene)-N-(3-methyl-1-phenyl-lH-pyrazolo[3,4-b]pyridin-4-
yl)-
hydrazine,
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
13
- 4-[(3-methyl-1-phenyl-lH-pyrazolo[3,4-b]pyridin-4-yl)-hydrazonomethyl]-
benzonitrile,
- N-benzo[1,3]dioxol-5-ylmethylene-N-(3-methyl-1-phenyl-lH-pyrazolo[3,4-
b]pyridin-
4-yl)-hydrazine,
- N-(3-methyl-1-phenyl-lH-pyrazolo[3,4-b]pyridin-4-y1)-N-(4-nitro-benzylidene)-
hydrazine,
- N-(3-methyl-1-phenyl-lH-pyrazolo[3,4-b]pyridin-4-y1)-N-(2-nitro-benzylidene)-
hydrazine,
- N-(3-methyl-1-phenyl-lH-pyrazolo[3,4-b]pyridin-4-y1)-N-(4-trifluoromethyl-
benzylidene)-hydrazine,
- N-(3-methyl-1-phenyl-1H-pyrazolo[3,4-b]pyridin-4-y1)-N-(5-nitro-furan-2-
ylmethylene)-hydrazine,
- N-(3-methyl-1-phenyl-lH-pyrazolo[3,4-b]pyridin-4-y1)-N-(2-trifluoromethyl-
benzylidene)-hydrazine,
- N-(3-methyl-1-phenyl-lH-pyrazolo[3,4-b]pyridin-4-y1)-N-(6-nitro-
benzo[1,3]dioxol-
5-ylmethylene)-hydrazine,
- Acide 4-(3-chloro-4-methoxy-benzylamino)-l-ethyl-lH-pyrazolo[3,4-b]pyridine-
5-
carboxylique,
- 4-(3-chloro-4-methoxy-benzylamino)-l-ethyl-lH-pyrazolo[3,4-b]pyridine-5-
(pyridin-
4-ylmethyl)-amide,
- 4-(3-chloro-4-methoxy-benzylamino)-l-ethyl-lH-pyrazolo[3,4-b]pyridine-5-
(tetrahydro-furan-2-ylmethyl)-amide,
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
14
- 4-(3-chloro-4-methoxy-benzylamino)-l-ethyl-lH-pyrazolo[3,4-b]pyridine-5-(5-
hydroxy-pentyl)-amide,
- 4-(3-chloro-4-methoxy-benzylamino)-l-ethyl-lH-pyrazolo[3,4-b]pyridine-5-[3-
(2-
oxo-pyrrolidin-1-yl)-propyl]-amide,
- ester éthylique de l'acide 4-tert-butylamino-l-(2-chloro-2-phenyl-ethyl)-1H-
pyrazolo [3,4-b]pyridine-5-carboxylique,
- ester éthylique de l'acide 1-(2-chloro-2-phenyl-ethyl)-4-cyclopropylamino-lH-
pyrazolo [3,4-b]pyridine-5-carboxylique,
- ester éthylique de l'acide 1-(2-chloro-2-phenyl-ethyl)-4-propylamino-lH-
pyrazolo [3,4-b]pyridine-5-carboxylique,
- ester éthylique de l'acide 1-(2-chloro-2-phenyl-ethyl)-4-phenylamino-lH-
pyrazolo [3,4-b]pyridine-5-carboxylique,
- ester éthylique de l'acide 4-butylamino-l-(2-chloro-2-phenyl-ethyl)-1H-
pyrazolo[3,4-
b]pyridine-5-carboxylique,
- ester éthylique de l'acide 1-(2-chloro-2-phenyl-ethyl)-4-(2-ethoxy-
ethylamino)-1H-
pyrazolo [3,4-b]pyridine-5-carboxylique,
- ester éthylique de l'acide 4-benzylamino-1-(2-chloro-2-phenyl-ethyl)-1H-
pyrazolo [3,4-b]pyridine-5-carboxylique,
- ester éthylique de l'acide 1-(2-chloro-2-phenyl-ethyl)-4-phenethylamino-lH-
pyrazolo [3,4-b]pyridine-5-carboxylique.
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
Ces composés peuvent être sous forme de sel, ester, racémique, isomère actif,
etc. Dans
un mode particulier de mise en oeuvre, le composé neuroprotecteur est choisi
parmi
l'étazolate, le tracazolate ou le cartazolate, plus préférentiellement
l'étazolate.
L'agent modulateur du GABA(A) peut être tout composé chimique, d'origine
naturelle
ou synthétique, notamment une molécule organique ou inorganique, d'origine
végétale,
bactérienne, virale, animale, eucaryote, synthétique ou semi-synthétique,
capable de
moduler l'expression ou l'activité des radicaux libres (ROS). A titre
d'exemple
particulier, on peut citer notamment les benzodiazépines.
Les composés ou traitements utilisés dans le cadre de la présente invention
peuvent être
formulés et administrés de différentes façons. L'administration peut être
réalisée par
toute méthode connue de l'homme du métier, de préférence par voie orale ou par
injection, systémique ou locale. L'injection est typiquement réalisée par voie
intra-
oculaire, intra-péritonéale, intra-cérébrale, intra-veineuse, intra-
artérielle, sous-cutanée
ou intra-musculaire. L'administration par voie orale ou systémique est
préférée. Les
doses administrées peuvent être adaptées par l'homme de l'art. Typiquement, de
0,01
mg à 100 mg / kg environ sont injectés, pour des composés de nature chimique.
Des
dosages unitaires particuliers sont par exemple de 0,5 à 40 mg par dose
administrée. Il
est entendu que des injections répétées peuvent être réalisées, éventuellement
en
combinaison avec d'autres agents actifs ou tout véhicule acceptable sur le
plan
pharmaceutique (ex., tampons, solutions saline, isotonique, en présence
d'agents
stabilisants, etc.).
Le véhicule ou excipient acceptable sur le plan pharmaceutique peut être
choisi parmi
des solutés tampons, solvants, liants, stabilisants, émulsifiants, etc. Des
solutés tampons
ou diluant sont notamment le phosphate de calcium, sulfate de calcium,
lactose,
cellulose, kaolin, mannitol, chlorure de sodium, amidon, sucre en poudre et
hydroxy
propyl méthyl cellulose (HPMC) (pour libération retard). Des liants sont par
exemple
l'amidon, la gélatine et des solutés de remplissage comme le sucrose, glucose,
dextrose,
lactose, etc. Des gommes naturelles ou synthétiques peuvent aussi être
utilisées, comme
notamment l'alginate, la carboxyméthylcellulose, la méthylcellulose, la
polyvinyl
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
16
pyrrolidone, etc. D'autres excipients sont par exemple la cellulose et du
stéarate de
magnésium. Des agents stabilisants peuvent être incorporés aux formulations,
comme
par exemple des polysaccharides (acacia, agar, acide alginique, gomme guar et
tragacanth, la chitine ou ses dérivés et des éthers de cellulose). Des
solvants ou solutés
sont par exemple la solution Ringer, l'eau, l'eau distillée, des tampons
phosphates, des
solutions salines phosphatées, et autres fluides conventionnels.
Echantillon
Pour la mise en oeuvre de la méthode décrite ci-dessus, il est possible
d'utiliser tout
échantillon contenant des plaquettes, provenant du sujet traité. L'invention
montre en
effet que des composés neuroprotecteurs sont capables d'induire la production
de
sAPPalpha dans les plaquettes. Ainsi, l'efficacité du traitement peut être
évaluée et
suivie par un dosage de sAPPalpha dans tout échantillon contenant des
plaquettes.
Dans un mode particulier de mise en oeuvre, l'échantillon biologique est un
échantillon
de sang ou dérivé de sang. On entend par échantillon "dérivé" de sang tout
échantillon
de sang traité, par exemple par dilution, filtration, purification, etc., afin
par exemple
d'enrichir l'échantillon en plaquettes, d'éliminer d'autres populations
cellulaires,
d'inactiver des pathogènes éventuels, de calibrer un dosage, etc.
La méthode ci-dessus est applicable chez tous mammifères, de préférence chez
les
humains, en particulier atteints de maladies neurodégénératives, telles que la
maladie
d'Alzheimer, de Parkinson, la SLA, la maladie de Huntigton, etc.
Dosage de la sAPPalpha
Différentes techniques connues en soi de l'homme du métier peuvent être
utilisées pour
doser la sAPPalpha. Ainsi notamment, on peut mentionner des techniques
immunologiques, basées sur l'utilisation d'anticorps spécifiques de la
sAPPalpha. De
tels anticorps sont disponibles dans la littérature (Exp. Neurol. 2003
Sep;l83(1):74-80),
ou peuvent être produits par des techniques connues en soi de l'homme du
métier. Ainsi,
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
17
il est possible de produire de tels anticorps par immunisation d'un mammifère
non
humain avec la sAPPalpha ou tout épitope ou fragment de celle-ci, puis
isolement et/ou
sélection des anticorps polyclonaux ou monoclonaux capables de lier la
sAPPalpha in
vitro. La spécificité des anticorps peut ensuite être confirmée par
détermination des tests
de liaison des anticorps à la protéine APP entière et/ou à d'autres peptides
dérivés de la
protéine APP, tels que le fragment C83, le peptide AICD et le peptide P3. De
préférence, on utilise des anticorps capables de lier spécifiquement la
sAPPalpha et
incapables de lier de manière spécifique le fragment C83, le peptide AICD et
le peptide
P3. La "spécificité" de liaison indique que la liaison à la sAPPalpha peut
être
discriminée d'une liaison éventuelle à d'autres protéines ou peptides.
La méthode de mesure de la production de sAPPalpha peut impliquer une
technique
ELISA, RIA, l'emploi de substrats revêtus d'anticorps spécifiques, de billes
magnétiques, de colonnes, de plusieurs anticorps (anticorps de capture et
anticorps de
révélation), etc. De manière préférée, on utilise un test de type ELISA.
Typiquement, la production de sAPPalpha mesurée est comparée à un niveau de
référence ou à une valeur mesurée avant le traitement, ou à un stade antérieur
de
traitement, chez ledit mammifère. Ainsi, il est possible déterminer si le
niveau de
production de la sAPPalpha évolue chez le patient consécutivement au
traitement, ou au
cours du traitement. Un maintien ou une augmentation du niveau de sAPPalpha
constitue une indication de l'efficacité du traitement.
Par ailleurs, les inventeurs ont mis au point un procédé amélioré de dosage
immunologique de la sAPPalpha, applicable à tout échantillon. La méthode
repose
notamment sur une étape de traitement de l'échantillon, permettant de
démasquer (et
ainsi de rendre accessible) des épitopes spécifiques du fragment soluble
sAPPalpha. En
effet, les résultats présentés par les inventeurs montrent que, sans un
protocole adapté,
la sAPPalpha ne peut être détectée de manière quantifiable et spécifique en
ELISA.
Ainsi, un autre objet de l'invention réside dans un procédé de dosage
immunologique de
la sAPPalpha dans un échantillon, comprenant une étape de traitement thermique
de
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
18
l'échantillon (permettant de démasquer des épitopes de la sAPPalpha), et une
étape de
dosage immunologique. Le procédé est adapté au dosage de la sAPPalpha à partir
de
tout échantillon, et notamment d'échantillons de sang ou dérivé de sang
(sérum,
plaquettes, etc.), d'autres fluides biologiques, des sumageants de culture.
L'échantillon
peut être pré-traité, notamment par dilution, enrichissement, filtration, etc.
De préférence, l'étape de traitement thermique comprend un traitement de
l'échantillon
à une température comprise entre 60 C et 70 C environ, pendant une période de
temps
suffisante pour démasquer des épitopes de la sAPPalpha, typiquement pendant
une
période comprise entre 30 secondes et 10 minutes, environ. Comme le montrent
les
exemples, une telle méthode permet un dosage fiable, reproductif et spécifique
de la
sAPPalpha à partir d'échantillons sanguins humains.
Le dosage immunologique peut être réalisé par différentes techniques connues
en soi,
telles que notamment ELISA, avec tout réactif spécifique de la sAPPalpha,
notamment
tout anticorps spécifique comme décrit ci-dessus. Parmi ces anticorps, on peut
citer
notamment tout anticorps reconnaissant un épitope contenu dans les résidus
d'acides
aminés 1-17 de l'APP. Plus spécifiquement, de tels anticorps ou kits sont
disponibles
dans le commerce, comme le kit ELISA APP, vendu par Sigma ou Biosource, ou
certains anticorps spécifiques de la sAPPu (au niveau de la coupure de l'APP)
ou
reconnaissant la sAPPu et l'APP :
- anticorps monoclona16E10 (spécifique de la sAPPa)
- anticorps monoclonal 2B3 (inclu dans le kit IBL de détection de la sAPPa),
spécifique de la sAPPu
- anticorps monoclonal BAN50, produit par immunisation contre le peptide
Abeta 1-16 (PMID: 10480887)
- anticorps monoclona122C11 (anti-APP reconnnaissant la sAPPa)
- Polyclonal polyCl 1(Upstate /Millipore, Cat # AB5368, produit par Chemicon)
- sAPP (poly) de OYC (Cat# APP-KPI- Antiserum)
- sAPPa (poly) de Signet Covance (Cat# SIG-39139)
- anticorps 3329 de lapin anti-sAPP, qui reconnaît spécifiquement la forme
recombinante de la sAPPu (PMID: 9465092).
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
19
Applications thérapeutiques
La mise en évidence inattendue que les traitements neuroprotecteurs définis ci-
dessus
permettent d'induire ou de stimuler la production de sAPPalpha dans les
plaquettes
permet d'envisager de nouvelles utilisations thérapeutiques de ce type de
composés.
Ainsi, un objet de l'invention réside dans l'utilisation d'un composé choisi
parmi les
pyrazolopyridines et les agents modulateurs des récepteurs GABA (A) pour la
préparation d'un médicament pour stimuler ou induire la production de
sAPPalpha par
les plaquettes chez un mammifère.
L'invention concerne également l'utilisation d'un composé choisi parmi les
pyrazolopyridines et les agents modulateurs des récepteurs GABA (A) pour la
préparation d'un médicament pour diminuer le risque de formation de thrombus
chez un
mammifère.
L'invention concerne également l'utilisation d'un composé choisi parmi les
pyrazolopyridines et les agents modulateurs des récepteurs GABA (A) pour la
préparation d'un médicament pour réduire les complications vasculaires chez
les
patients atteints de maladies neurodégénératives.
L'invention concerne encore l'utilisation d'un composé choisi parmi les
pyrazolopyridines et les agents modulateurs des récepteurs GABA (A) pour la
préparation d'un médicament pour inhiber l'agrégation plaquettaire chez un
mammifère,
en particulier chez les patients atteints de maladies neurodégénératives.
La présente invention sera décrite plus en détails à l'aide des exemples qui
suivent, qui
doivent être considérés comme illustratifs et non limitatifs.
Légende des Figures
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
Figure 1: Dosage de la sAPPalpha dans du sérum non-traité
Figure 2 Effet d'un traitement thermique sur la détection de sAPPalpha en
ELISA
Figure 3 Détection de sAPPalpha dans du sérum humain
Figure 4 Détection de sAPPalpha recombinant dans du sérum
Figure 5: L'étazolate stimule in vitro la production de sAPPalpha
Figure 6: L'étazolate stimule la production de sAPPalpha dans les neurones
Figure 7: L'étazolate stimule in vivo la production de sAPPalpha
Figure 8 Effet de l'etazolate sur la toxicité du peptide amyloide et effet
d'inhibiteurs
du récepteur GABAA sur la neuroprotection induite par l'etazolate.
Statistiques : Test
de Wilcoxon :###, p<0.001; **, p<0.01; ***, p<0.001
Figure 9: Effet d'inhibiteurs des alpha secretase sur la neuroprotection
induite par
l'etazolate. Statistiques : Test de Wilcoxon :*, p<0.05; ***, p<0.001
Figure 10: Effet d'un anticorps neutralisant anti-sAPPa sur la neuroprotection
induite
par l'etazolate. Statistiques : Test de Wilcoxon : ##, p<0.01; ***, p<0.001
Exemples
Exemple 1: Procédé de dosage de la sAPP alpha
Le fragment soluble de l'APP (sAPPa) circulant dans le sang est issu des
cellules
plaquettaires et de l'activité a-secretase associée. Celui-ci a été montré
diminuant avec
l'âge et au cours du processus physiopathologique de la maladie d'Alzheimer
(MA). Le
sAPPa circulant dans le sang peut donc être considéré comme un bio marqueur
pour
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
21
monitorer les changements dans le processing de l'APP qui apparaissent avec
l'âge et
au cours du processus physiopathologique de la maladie d'Alzheimer et qui
pourront
être corrigés suite la prise de traitements médicamenteux.
Il existe donc un véritable intérêt à quantifier de façon précise les niveaux
de sAPPa
dans le sang et plus particulièrement dans le sérum, après la coagulation
sanguine et
l'activation des plaquettes, afin d'évaluer l'efficacité de traitements ayant
pour but de
modifier le processing de l'APP pour un traitement de la maladie d'Alzheimer.
La méthode décrite ci-dessous a été développée afin de démasquer et de rendre
accessible l'épitope spécifique du fragment soluble sAPPa pour une détection
de type
anticorps-antigène de haute affinité selon la technique double sandwich de
type ELISA.
En effet, sans un protocole adapté aux traitements des échantillons de sérum,
le sAPPa
ne peut être détecté de manière quantifiable et spécifique en ELISA. Comme le
montre
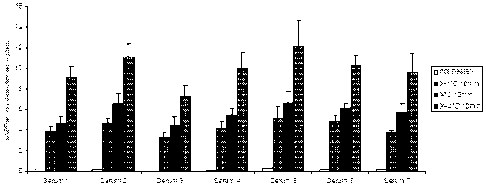
la figure 1, le sérum seul sans traitement préalable montre une détection de
sAPPa très
nettement quantifiable (3.5 ng/mL), mais qui ne semble pas s'additionner au
sAPPa
recombinant rajouté (+10 ng/mL), alors que la même quantité de sAPPa rajouté
montre
une détection (8.7 ng/mL) aux alentours de la quantité attendue (lOng/mL). La
détection
ELISA dans le sérum pur sans aucun traitement particulier ne semble pas être
spécifique
au sAPPa soluble et circulant.
Pour avoir accès au sAPPa soluble dans le sérum et être capable de le
quantifier de
manière fiable, spécifique et reproductible, nous avons développé une méthode
de
préparation et de traitement des échantillons permettant à l'aide d'un
traitement
thermique de rendre accessible le sAPPa présent dans le sérum aux anticorps
spécifiques de l'ELISA.
Les échantillons sériques sont initialement dilués dans du tampon Dulbecco's
phosphate
buffered saline (PBS) pH 7.4 (Sigma # D8537), 5% BSA, 0.05% Tween-20. Les
échantillons dilués sont ensuite traités par la chaleur à 66 C pendant 10
minutes, puis
refroidis à 4 C. Les échantillons sont ensuite analysés par la technique ELISA
à l'aide
d'un kit spécifique du sAPPa.
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
22
Comme le montre la figure 2, la détection du sAPPa en ELISA à partir de sérum
augmente de manière significative en fonction de la température de chauffage
et de la
durée du traitement thermique (gamme de température 60- 70 C ; X = 66 C).
Cette méthode de préparation des échantillons de sérum et le traitement
thermique ont
été évalués sur 7 sérums humains différents, dans 3 expériences distinctes.
Comme la
montre la figure 3, la détection de sAPPa en ELISA à partir de sérums humains
semble
reproductible avec cette méthode (X = 66 C).
Afin dévaluer au mieux cette méthode de dosage du sAPPa dans le sérum, nous
avons
évalué la linéarité de la détection du sAPPa dans un sérum humain en utilisant
trois
quantités croissantes de sAPPa recombinant (5 ; 7,5 et 10 ng/mL). La figure 4,
représente la moyenne de 3 expériences distinctes, réalisées à partir du même
sérum sur
3 jours différents.
Comme le montre la figure 4, il existe une très bonne relation de
proportionnalité entre
les quantités de sAPPa rajouté/spikés et les quantités de sAPPa détectées en
ELISA
dans la matrice biologique (sérum) après la préparation et le traitement
thermique. Ces
résultats montrent que le sAPPa rajouté au sérum traité ne rentre pas en
compétition
avec le sAPPa libéré du sérum. Ces résultats présentent une bonne
reproductibilité sur 3
expériences réalisées à 3 jours différents.
A partir de ces résultats, le recouvrement du sAPPa recombinant dans le sérum
traité a
pu être calculé en comparaison à des échantillons correspondant à la matrice
biologique
sans sAPPa endogène et auquel a été rajouté avec les mêmes quantités de sAPPa.
Comme le montre le tableau ci-dessous, le recouvrement (exprimé en % de la
valeur
attendue) du sAPPa recombinant dans le sérum à 3 quantités croissantes se
situe dans
des limites acceptables 100% 25%.
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
23
Recouvrement du sAPPa recombinant dans le serum
concentrations attendues (ng/mL)
Echantillons 5 7,5 10
1/ aliquot -1 106,0 95,2 100,7
1/ aliquot -2 122,2 113,1 114,2
1/ aliquot -3 118,9 103,5 101,1
1/ aliquot -4 113,4 109,9 111,3
1/ aliquot -5 119,2 104,1 101,2
i~Q~t~t~ t~~''t~;~'~jti#~#~~k3~; 115,9 105,2 105,7
....... .. ....:.......................
Ecart type 6,4 6,9 6,5
CV% 5,5 6,5 6,2
La FDA définit les critères de performances des dosages ELISA appliqués aux
procédés
diagnostiques dans le dcument US Food And Drug Administration Guidance for
Industry, Bioanalytical Method Validation, May 2001. Les documents suivants
précisent les critères d'acceptance et de validation des immunoessais
- Findlay et al. Validation of immunoassays for bioanalysis: a pharmaceutical
industry perspective. Journal of Pharmaceutical and Biomedical Analysis 21
(2000)
1249-1273
- Viswanathan et al. Workshop/Conference Report - Quantitative Bioanalytical
Methods Validation and Implementation: Best Practices for Chromatographic and
Ligand Binding Assays. The AAPS Journal 2007; 9 (1) Article 4
Les données ci-dessous montrent que la performance de la méthode de dosage de
l'invention, mise en oeuvre à l'aide du kit sAPPu vendu par IBL, est conforme
aux
critères recommandés par la FDA.
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
24
Concentration (ng/ml)
sAPPa 5 7.5 10
Recouvrement % Recouvrement 115.9 105.2 105.7
CV% 5.5 6.5 6.2
Précision CV% 4.6 6.4 5.5
inter-série
Précision CV% 5.3 5.3 1.9
intra-série
Linéarité r2 0.99923
CV% 1.8 4.0 4.1
Justesse % 98.1 96.6 96.0
LOQ (ng/ml) 1.0
Effet matrice % Recouvrement 95.8
CV% 13.1
Justesse % 90.0
Spécificité % 95.1
CV% 6.2
LOQ : limite de quantification ; CV% coefficient de variation
Exemple 2 : L'étazolate stimule la production de sAPPalpha
Des cellules HEK293 transfectées de manière stable sur-exprimant l'APP humaine
ont
été maintenues dans du milieu Eagle Modifié contenant du sel Earle et
supplémenté par
10% de sérum de veau foetal (FBS), 2mM L-glutamine (Sigma, Lyon, France), 1X
Acides Aminés Non Essentiels et des antibiotiques. Les cellules ont été
traitées 48
heures après étalement sur plaques de 10cm avec des concentrations variables
des
molécules indiquées, ou avec du DMSO comme véhicule, pendant 24 heures. La
sAPPalpha a été mesurée par ELISA et Western blot au moyen d'anticorps
disponibles
dans le commerce.
Les résultats obtenus sont présentés dans la figure 5 et montrent que
l'étazolate induit
une sécrétion de sAPPalpha.
Exemple 3: L'étazolate stimule la production de sAPPalpha par des neurones
corticaux
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
La production de sAPPalpha a été mesurée sur des neurones corticaux isolés à
partir
d'embryons de rat Wistar agés de 17 jours. Les cellules sont obtenues à partir
des
structures corticales qui sont disséquées dans une solution contenant 0.25% de
trypsine.
Les cellules dissociées sont ensemencées à la densité de 500,000 par cm~ dans
du milieu
Neurobasal contenant des additifs (1X B27, 2mM L-glutamine, 0.6% glucose, des
antibiotiques et des antimycotiques ainsi que du sérum de cheval à 2%) dans
des boites
de culture coatées avec 6 g/ml de polyornithine Les cellules sont maintenues
à 37 C et
5% C02. 24 heures après ensemencement, les cellules sont traitées avec 5 M
AraC (5
Cytosine arabinofuranoside) comme antimitotique. Après 4 jours in vitro, la
moitié du
milieu est changée avec du milieu sans sérum de cheval et la culture est
maintenue pour
maturation dans ce milieu pendant 7 à 10 jours.
La sAPPalpha a été mesurée par Western blot au moyen d'anticorps disponibles
dans le
commerce après un changement de milieu et une accumulation dans du milieu
frais
pendant 24 heures. Les quantifications ont été réalisées à partir d'analyses
de
densitométrie des images autoradiographiques scannées. Comme le montre la
figure 6,
l'etazolate (0,2 et 2 M pendant 24h) stimule le relargage de sAPPalpha à
partir des
neurones corticaux. Les résultats présentés sont la moyenne SEM de trois
expériences
indépendantes réalisées en duplicat et sont exprimés sous la forme du
pourcentage du
contrôle (cultures non traitées).
Exemple 4 : L'étazolate stimule la production de sAPPalpha in vivo
La production de sAPPalpha a été étudiée in vivo chez le cochon d'Inde, un
modèle
physiologique de processing de l'APP dans le cerveau. L'etazolate ou du
véhicule
(solution saline physiologique) a été administré à des cochons d'Inde mâles
albinos
Hartley, pesant 250-270 g au début de l'expérience une fois par jour pendant
15 jours
consécutifs, per os à la dose de l0mg/kg. 1 h après la derniére administration
les
cochons d'Inde ont été sacrifiés et les cerveaux immédiatement extraits,
congelés dans
de l'azote et stockés à -80 C. Les cortex ont été homogénéisés à 4 C dans une
solution
de Tris base 20mM pH 7,5 contenant 0,2% Triton X-100, 50 g/mL gentamycine et
un
cocktail d'inhibiteurs de protéases . Le sAPPalpha soluble a été mesuré par un
test
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
26
ELISA et les résultats normalisés par rapport à la quantité de protéines
présentes dans
les extraits.
La figure 7 présente l'augmentation de la quantité de sAPPalpha mesurée dans
les
cerveaux des animaux traités avec 1'etazolate, comparé aux animaux contrôles
traités
avec le véhicule. L'augmentation d'un facteur trois induite par l'etazolate
est
statistiquement très significative (* * * : p<1 E-4 selon le test de
Wilcoxon).
Les résultats obtenus montrent que l'étazolate induit une sécrétion de
sAPPalpha.
Exemple 5 : L'effet neuroprotecteur de l'étazolate requiert la production de
sAPPalpha in vivo
Le peptide A(325-35 contient le fragment neurotoxique du peptide amyloïde et
est un
outil classiquement utilisé pour étudier les effets neuroprotecteurs de
composés. Au
début de chaque expérience, les cultures neuronales âgées de 7-10 jours sont
changées
avec du milieu de culture frais et traitées avec le composé inhibiteur
étazolate, six
heures avant l'addition du peptide amyloïde A(325-35 à la concentration de
33.5 M. De
façon classique et reproductible, cette concentration génère 30 à 40% de
toxicité dans
les cultures neuronales.
Plusieurs expériences sont entreprises pour caractériser l'effet
neuroprotecteur de
l'étazolate. Afin de vérifier si la neuroprotection met en jeu le récepteur
GABAA, les
antagonistes du récepteur GABAA Picrotoxine (PTX), Gabazine/SR95531,
Bicuculine
(BIC) sont préincubés une heure avant l'étazolate à la concentration de 50 M,
20 M et
M, respectivement.
Récemment, plusieurs études ont démontré que la sAPPu présente des propriétés
neurotrophiques et neuroprotectives, notamment contre le peptide amyloïde in
vitro et
in vivo, suggérant que l'étazolate pourrait médier ses effets neuroprotecteurs
via la voie
alpha secretase. Pour déterminer si l'inhibition du sAPPalpha, ou sa
production,
prévient l'effet neuroprotecteur de 1'étazolate contre le peptide amyloide, un
anticorps
neutralisant anti sAPPu (anticorps 3E9) et des inhibiteurs des alpha
secretases sont
respectivement utilisés. Pour la neutralisation du sAPPa, l'anticorps 3E9 (5
g/ml) est
ajouté aux cellules corticales en même temps que l'étazolate. Deux inhibiteurs
des alpha
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
27
secretases, le composé Furin Inhibitor I(Hwang EM, Kim SK, Sohn JH, Lee JY,
Kim
Y, Kim YS, Mook-Jung I. Furin is an endogenous regulator of alpha-secretase
associated APP processing. Biochem Biophys Res Commun. 2006 Oct 20;349(2):654-
9.) et le TAPI (Slack BE, Ma LK, Seah CC. Constitutive shedding of the amyloid
precursor protein ectodomain is up-regulated by tumour necrosis factor-alpha
converting enzyme. Biochem J. 2001 Aug 1;357(Pt 3):787-94) sont utilisés en
pré-
traitement une heure avant l'addition de l'étazolate.
Tous les traitements sont effectués au minimum en double et dans au moins deux
cultures différentes. Après une incubation de 48 heures la toxicité est
mesurée par un
test MTT. Les résultats, normalisés à la moyenne du non-traité, sont
statistiquement
analysés par le test de Wilcoxon. La valeur significative est déterminée à p
inférieur ou
égal à 0.05.
MTT:
La toxicité est mesurée en utilisant le test MTT. Après l'incubation avec les
composés,
du MTT est ajouté à une concentration finale de 0,5 mg/ml par puits. Les
plaques sont
ensuite incubées pendant 30 minutes à 37 C dans le noir. Le milieu est aspiré
et les
cristaux sont remis en suspension dans 500 l de DMSO (diméthylsulfoxyde).
L'absorbance à 550 nm est lue et le pourcentage de viabilité est calculé.
Résultats :
Les résultats obtenus sont présentés sur les figures 8-10. Ces résultats
illustrent l'effet
protecteur du composé de l'invention sur la mort neuronale induite par le
peptide
amyloïde A(3 25-35.
Lors du co-traitement des neurones par 1'etazolate, un effet protecteur dose-
dépendent
est observé (Figure 8) avec en particulier 90% de viabilité cellulaire obtenue
pour la
dose de 0,2 M. Cet effet est bloqué par l'utilisation des trois agents
inhibiteurs du
récepteur GABAA et l'analyse statistique indique que cet effet est largement
significatif
(p<le-4 avec le test Wilcoxon après comparaison 0,2 M EHT 0202 versus 0,2 M
CA 02658464 2009-01-20
WO 2008/009868 PCT/FR2007/051706
28
EHT 0202 plus antagonistes). Les résultats correspondent aux moyennes+/-sem de
sept
expériences indépendantes.
Les figures 9 et 10 présentent des résultats obtenus à l'aide de l'étazolate
sur les
neurones corticaux en présence d'inhibiteurs de la production de sAPPa ou de
son
activité. Les résultats présentés montrent que l'étazolate permet d'atteindre
sur ces
cellules un effet protecteur qui est inhibé par le traitement avec deux
inhibiteurs des
alpha secretases, le composé Furin Inhibitor I et le TAPI (Figure 9). Ces
données
indiquent que l'activité alpha secretase responsable de la production de sAPPa
est
nécessaire à la neuroprotection induite par l'etazolate.
La figure Figure 10 montre que la neuroprotection induite par 1'etazolate
requiert la
production de sAPPa, car l'effet neuroprotecteur de l'étazolate est perdu
lorsqu' un
anticorps neutralisant anti-sAPPa est rajouté au milieu de culture.
La présente invention documente l'effet neuroprotecteur de l'étazolate sur la
toxicité
induite par le peptide amyloïde comme agissant via le récepteur GABAA. Cet
effet
neuroprotecteur est associé à l'activation de la voie alpha sécrétase et à la
production du
sAPPa.