Note: Descriptions are shown in the official language in which they were submitted.
CA 02668524 2009-06-09
NOUVEAU PROCEDE DE SYNTHESE DE LA 7,8-DIMETHOXY-I,3-DIHYDRO-
2H-3-BENZAZEPIN-2-ONE, ET APPLICATION A LA SYNTHESE DE
L'IVABRADINE ET DE SES SELS D'ADDITION A UN ACIDE
PI:[ARMACEUTIQUEMENT ACCEPTABLE
La présente invention concerne un procédé de synthèse de la 7,8-diméthoxy-1,3-
dihydro-
2H-3-benzazépin-2-one de formule (I), et son application à la synthèse de
l'ivabradine, de
ses sels d'addition à un acide pharmaceutiquement acceptable et des leurs
hydrates.
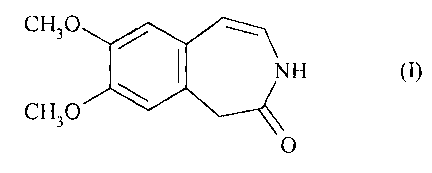
CH30 / ~
I NH (I)
\
CH30
O
Le composé de formule (I) obtenu selon le procédé de l'invention est utile
dans la synthèse
de l'ivabradine de formule (II)
CH30 H ~H3
3
CH,O ~ I / (m
N OCH3
O
ou 3-{3-[{[(7S)-3,4-diméthoxybicyclo[4.2.0]octa-I,3,5-lxién-7-
yl]méthyl}(méthyl)amino]
propyl} -7,8-diméthoxy-1,3,4,5-tétrahydro-2H-3-benzazépin-2-one,
de ses sels d'addition à un acide pharmaceutiquement acceptable et de leurs
hydrates.
L'ivabradine, ainsi que ses sels d'addition à un acide pharmaceutiquement
acceptable, et
plus particulièrement son chlorhydrate, possèdent des propriétés
pharmacologiques et
thérapeutiques très intéressantes, notamment des propriétés bradycardisantes,
qui rendent
ces composés utiles dans le traitement ou la prévention des différentes
situations cliniques
d'ischémie myocardique telles que l'angine de poitrine, l'infarctus du
myocarde et les
CA 02668524 2009-06-09
troubles du rythme associés, ainsi que dans les différentes pathologies
comportant des
troubles du rythme, notamment supra-ventriculaires, et dans l'insuffisance
cardiaque.
La préparation et l'utilisation en thérapeutique de l'ivabradine et de ses
sels d'addition à un
acide pharmaceutiquement acceptable, et plus particulièrement de son
chlorhydrate, ont été
décrits dans le brevet européen EP 0 534 859.
Ce brevet décrit la synthèse du chlorhydrate de l'ivabradine à partir du
composé de formule
(III) :
CH3O
I N~~~CI (III)
\
CH30
O
et fait référence à la publication J. Med. Chem 1990, Vol. 33 (5), 1496-1504
pour la
préparation de ce composé.
La voie de synthèse du composé de formule (III) décrite dans cette publication
utilise une
réaction d'alkylation du composé de formule (I) :
CH30
I NH ~I)
\
CH3O
O
La publication précitée décrit la préparation du composé de fonnule (I) en
utilisant comme
intermédiaire le N-(2,2-diméthoxyéthyl)-2-(3,4-diméthoxyphényl)-acétamide
obtenu à
partir de l'acide (3,4-diméthoxyphényl) acétique. La cyclisation du
phénylacétamide
obtenu se fait en présence de l'acide chlorhydrique dans l'acide acétique,
pour conduire au
composé de formule (I) avec un rendement global de 58% par rapport à l'acide
(3,4-
diméthoxyphényl)acétique.
2
CA 02668524 2009-06-09
Compte-tenu de l'intérêt industriel de l'ivabradine et de ses sels, il était
impératif de
trouver un procédé performant permettant notamment d'accéder à la 7,8-
diméthoxy-1,3-
dihydro-2H-3-benzazépin-2-one de formule (I) avec un excellent rendement.
Or, la Demanderesse s'est aperçue que de manière surprenante, en utilisant des
conditions
opératoires spécifiques, il était possible d'obtenir à l'échelle industrielle
le composé de
formule (I) avec un rendement supérieur à 92% et une pureté chimique
supérieure à 99,5%.
Plus spécifiquement, la présente invention concerne un procédé de synthèse du
composé de
formule (I) :
CH30 / ~
I NI-I (I)
\
CH30
O
caractérisé en ce que l'acide (3,4-diméthoxyphényl) acétique de formule (IV) :
CH30 0
CH3OOH
est transformé en composé de formule (V) :
CHsO O Ri Rz
CH30 H
3
CA 02668524 2009-06-09
dans laquelle les groupements RI et R2, identiques ou différents, représentent
des
groupements alkoxy (Ci-C6) linéaires ou ramifiés, ou bien forment ensemble
avec l'atome
de carbone qui les porte un cycle 1,3-dioxane, 1,3-dioxolane ou 1,3-dioxépane,
lequel est soumis à une réaction de cyclisation en milieu acide pour conduire
après
isolement au composé de formule (I).
Dans l'un des modes de réalisation préférés de l'invention, la transformation
du composé
de formule (IV) en composé de formule (V) est effectuée par transfonnation
préliminaire
du composé de formule (IV) en composé de formule (VI) :
CH30 0
CH30 X
dans laquelle X représente un atome d'halogène ou un groupement OCOR3 où R3
est un
groupement alkyle (C,-C6) linéaire ou ramifié, un groupement phényle, un
groupement
benzyle ou un groupement imidazole,
dans un solvant organique,
puis le composé de formule (VI) est soumis à une réaction de condensation avec
un
composé de formule (VII) :
HZN""Y RI (VII)
R2
dans laquelle les groupements RI et R2, identiques ou différents, représentent
des
groupements alkoxy (CI-C6) linéaires ou ramifiés, ou bien forment ensemble
avec l'atome
de carbone qui les porte un cycle 1,3-dioxane, 1,3-dioxolane ou 1,3-dioxépane,
en présence d'une base dans un solvant organique,
pour conduire au composé de formule (V) :
4
CA 02668524 2009-06-09
CH30 O Ri RZ
I
\ (V)
CH30 H
Dans un autre mode de réalisation préféré de l'invention, la transformation du
composé de
formule (IV) en composé de formule (V) est effectuée par réaction avec un
composé de
formule (VII) :
R~
HzN~ (VII)
R2
dans laquelle les groupements R, et R2, identiques ou différents, représentent
des
groupements alkoxy (Cl-C6) linéaires ou ramifiés, ou bien forment ensemble
avec l'atome
de carbone qui les porte un cycle 1,3-dioxane, 1,3-dioxolane ou 1,3-dioxépane,
en présence d'un agent de couplage dans un solvant organique,
pour conduire au composé de formule (V) :
CH30 O Ri R2
\ (V)
CH30 H
Parmi les agents de couplage pouvant être utilisés pour la réaction de
condensation du
composé de formule (VII) sur le composé de formule (IV), on peut citer à titre
non limitatif
les réactifs ou couples de réactifs suivants : EDCI, EDCI/HOBT, EDCI/HOAT,
EDCI/NHS, DCC, DCC/HOBT, DCC/HOAT, DCC/NHS, HATU, HBTU, TBTU, BOP,
PyBOP, CDI, T3P.
5
CA 02668524 2009-06-09
Parmi les solvants organiques pouvant être utilisés pour la réaction de
condensation du
composé de formule (VII) sur le composé de formule (IV) en présence d'un agent
de
couplage, on peut citer à titre non limitatif le toluène, le dichlorométhane,
le 2-
méthyltétrahydrofurane, le chlorobenzène, le 1,2-dichloroéthane, le
chloroforme et le
dioxane.
Dans l'un des modes de réalisation préférés de l'invention, le composé de
formule (V)
n'est pas isolé.
Dans l'un des modes de réalisation préférés de l'invention, le composé de
formule (VI)
n'est pas isolé.
Le groupement X dans le composé de formule (VI) représente préférentiellement
un atome
de chlore.
Parmi les solvants organiques pouvant être utilisés pour la réaction de
transformation du
composé de formule (IV) en composé de formule (VI), on peut citer à titre non
limitatif le
toluène, le dichlorométhane, le 2-méthyltétrahydrofurane, le chlorobenzène, le
1,2-
dichloroéthane, le chloroforme et le dioxane.
Le solvant organique préféré pour la réaction de transformation du composé de
formule
(IV) en composé de formule (VI) est le dichlorométhane.
La température de la réaction de transformation du composé de formule (IV) en
composé
de formule (VI) est préférentiellement comprise entre 20 et 40 C.
Le réactif préférentiellement utilisé pour réaliser la transformation du
composé de formule
(IV) en composé de formule (VI) pour lequel X représente un atome de chlore
est le
chlorure de thionyle.
6
CA 02668524 2009-06-09
La quantité de chlorure de thionyle engagée dans la réaction de transformation
du
composé de formule (IV) en composé de formule (VI) est préférentiellement
comprise
entre 1 et 1,3 moles par mole de composé de formule (IV).
Parmi les solvants organiques pouvant être utilisés pour la réaction entre le
composé de
formule (VI) et le composé de formule (VII), on peut citer à titre non
limitatif le toluène, le
dichlorométhane, le 2-méthyltétrahydrofurane, le chlorobenzène, le 1,2-
dichloroéthane, le
chloroforme et le dioxane.
Le solvant organique préféré pour la réaction entre le composé de formule (VI)
et le
composé de formule (VII) est le dichlorométhane.
La température de la réaction entre le composé de formule (VI) et le composé
de formule
(VII) est préférentiellement comprise entre 0 et 40 C.
La quantité de composé de formule (VII) engagée dans la réaction avec le
composé de
formule (VI) est préférentiellement comprise entre 1 et 1,2 moles par mole de
composé de
formule (VI).
La quantité de base engagée dans la réaction entre le composé de formule (VI)
et le
composé de formule (VII) est préférentiellement comprise entre 1 et 1,3 moles
par mole de
composé de formule (VI).
Parmi les bases qui peuvent être utilisées pour la réaction entre le composé
de formule (VI)
et le composé de formule (VII), on peut citer à titre non limitatif la
pyridine, la DMAP et
les amines tertiaires, par exemple la triéthylamine, la DIEA, la N-
méthylpipéridine, la
DBU, le DABCO, le DBN et la N-méthylmorpholine.
La base préférentiellement utilisée pour la réaction entre le composé de
formule (VI) et le
composé de formule (VII) est la triéthylamine.
7
CA 02668524 2009-06-09
Parmi les acides pouvant être utilisés pour effectuer la cyclisation du
composé de formule
(V) en composé de formule (I), on peut citer à titre non limitatif l'acide
sulfurique
concentré, l'acide polyphosphorique, l'acide chlorhydrique concentré en
solution aqueuse,
l'acide chlorhydrique concentré en solution dans l'acide acétique, l'acide
bromhydrique
concentré en solution dans l'acide acétique et l'acide méthanesulfonique.
La quantité d'acide engagée dans la réaction de cyclisation du composé de
formule (V) en
composé de formule (1) est préférentiellement comprise entre 5 et 15 moles par
mole de
composé de formule (V).
La température de la réaction de cyclisation en milieu acide du composé de
formule (V) est
préférentiellement comprise entre 0 et 40 C.
L'acide préférentiellement utilisé pour effectuer la cyclisation du composé de
formule (V)
en composé de formule (I) est l'acide sulfurique concentré.
Lorsque les intermédiaires réactionnels ne sont pas isolés au cours du
procédé, la quantité
d'acide sulfurique concentrée engagée dans la réaction de cyclisation du
composé de
formule (V) est préférentiellement comprise entre 1,5 et 3 millilitres par
gramme d'acide
(3,4-diméthoxyphényle) acétique de formule (IV).
Le composé de formule (I) obtenu selon le procédé de la présente invention est
particulièrement utile comme intermédiaire de synthèse dans la synthèse de
l'ivabradine,
de ses sels d'addition à un acide pharmaceutiquement acceptable et de ses
hydrates.
A titre d'exemple, l'alkylation du composé de fonnule (I) par un composé de
formule
(VIII) :
y Ra (VIII)
RS
dans laquelle R4 et R5, identiques ou différents, représentent chacun un
groupement alkoxy
(CI -C6) linéaire ou ramifié, ou bien forment ensemble avec l'atome de carbone
qui les porte
s
CA 02668524 2009-06-09
un cycle 1,3-dioxane ou 1,3-dioxolane, et Y représente un atome d'halogène,
préférentiellement un atome de brome, ou un groupement tosylate, mësylate ou
triflate,
conduit au composé de formule (IX)
CH30 /
TI R4 (IX)
\
CH30 R
O
dont l'hydrogénation catalytique conduit au composé hydrogéné correspondant de
formule
(X):
CH3O /
R4 (X)
CH30 R
s
dans laquelle R4 et R5 sont tels que définis dans la formule (VIII),
dont la déprotection du diacétal conduit à l'aldéhyde de formule (XI) :
CH3O
N (XI)
CH3O H
O
qui est mis en réaction avec la (7S)-3,4-diméthoxybicyclo[4.2.0]octa-1,3,5-
trién-7-yl] 1V-
méthylméthanamine dans des conditions d'amination réductrice, pour conduire à
l'ivabradine, qui peut éventuellement étre transformée en ses sels d'addition
à un acide
pharmaceutiquement acceptable, choisi parmi les acides chlorhydrique,
bromhydrique,
sulfurique, phosphorique, acétique, trifluoroacétique, lactique, pyruvique,
malonique,
9
CA 02668524 2009-06-09
succinique, glutarique, fumarique, tartrique, maléïque, citrique, ascorbique,
oxalique,
méthanesulfonique, benzènesulfonique et camphorique, et en leurs hydrates.
Lexique des abréviations utilisées :
BOP : benzotriazol-1-yl-oxy-tris-(diméthylamino)-phosphonium
hexafluorophosphate
CDI : carbonyldiimidazole
DABCO : 1,4-diazabicyclo[2.2.2]octane
DBN : 1,5-diazabicyclo[4.3.0]non-5-ène
DBU : 1,8-diazabicyclo[5.4.0]undec-7-ène
DCC : dicyclohexylcarbodiimide
DIEA : N,N-diisopropyléthylamine
DMAP : 4-diméthylaminopyridine
EDCI: 1-(3-diméthylaminopropyl)-3-éthyl-carbodiimide chlorhydrate
HATU: O-(7-azabenzotriazol-1-y1)-1,1,3,3-tétraméthyluronium
hexafluorophosphate
HBTU: O-(benzotriazol-1-yl)-1,1,3,3-tétraméthyluronium hexafluorophosphate
HOAT: 1-hydroxy-7-azabenzotriazole
HOBT : 1-hydroxybenzotriazole
NHS : N-hydroxysuccinimide
NMP : N-méthylpyrrolidone
PyBOP : O-(benzotriazol-1-yi)-oxytripyrrolidinophosphonium hexafluorophosphate
TBTU : O-(benzotriazol-1-yl)-1,1,3,3-tétraméthyluronium tétrafluoroborate
T3P : n-propane phosphonic anhydride
L'exemple ci-dessous illustre l'invention.
Préuaration de la 7.8-diméthoxv-l.3-dihvdro-2H-3-benzazénin-2-one
Stade A Chlorure de l'acide (3, 4-diméthoxyphényl) acétique
CA 02668524 2009-06-09
Dans un réacteur, charger 135g d'acide (3,4-diméthoxyphényl) acétique et 270
mi de
dichlorométhane puis amener la température du milieu réactionnel à reflux et
ajouter
goutte à goutte 90g de chlorure de thionyle. Agiter le mélange à reflux
pendant 3 h. La
solution obtenue est utilisée telle que pour l'étape suivante.
Stade B : N-(2,2-diméthoxyéthyl)-2-(3,4-diméthoxyphényl)acétamide
Dans un réacteur, charger 225m1 de dichlorométhane, 44,15g de 2,2-
diméthoxyéthylamine
et 44,35g de triéthylamine puis refroidir le milieu à 10 C et ajouter goutte à
goutte 237,4g
de la solution obtenue à l'étape précédente (correspondant à 75g d'acide (3,4-
diméthoxyphényl) acétique) en maintenant la température masse à 10 C. Agiter
le mélange
2h à 15 C. La solution obtenue est utilisée telle que pour l'étape suivante.
Stade C: 7, 8-diméthozy-1, 3-dihydro-2H-3-benzazépin-2-one
Dans un réacteur contenant la solution obtenue à l'étape précédente et
refroidi à 10 C,
ajouter 150m1 d'acide sulfurique 36N en maintenant la température en dessous
de 20 C.
Agiter le mélange à 15-20 C pendant 10h puis laisser décanter le milieu
réactionnel et
recueillir la phase acide sulfurique contenant le produit.
Le produit est obtenu par précipitation dans un mélange eau/NMP (4/1),
filtration et
séchage avec un rendement de 92,9% par rapport à l'acide (3,4-diméthoxyphényl)
acétique
et une pureté chimique supérieure à 99,5%.
11