Note: Descriptions are shown in the official language in which they were submitted.
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
-1-
Nouveaux dérivés triazabenzo[a]naphtho[2,1,8-cde]azulène,
leur procédé de préparation
et les compositions pharmaceutiques qui les contiennent
La présente invention concerne de nouveaux dérivés triazabenzo[a]naphtho[2,1,8-
cde]azulène, leur procédé de préparation et les compositions pharmaceutiques
qui les
contiennent.
La littérature fournit de nombreux exemples de composés possédant une
structure
éburnane. C'est le cas notamment du brevet US 3 454 583 traitant de la
vincamine
((3a,14(3,16(x)-(14,15-dihydro-14-hydroxy-éburnaménine-14-carboxylate de
méthyle) et
de ses dérivés pour leurs propriétés vasodilatatrices. Les demandes de brevets
FR 2 433 528 et FR 2 381 048 présentent de nouveaux dérivés de 20,21-dinoré-
burnaménine et la demande EP 0 287 468, de nouveaux dérivés des 17-aza-20,21-
dinoré-
bumaménine. La demande de brevet EP 0 658 557 décrit des dérivés de l'éburnane
modifiés en position 14 et 15 du squelette éburnane. La demande de brevet EP 0
563 916
décrit des dérivés de 1H-indole-cyclohexanecarboxamide.
Les composés de la présente invention outre le fait qu'ils soient nouveaux,
présentent des
propriétés pharmacologiques très intéressantes. Ils se révèlent notamment être
de puissants
inducteurs de tyrosine hydroxylase, de manière sélective ou non.
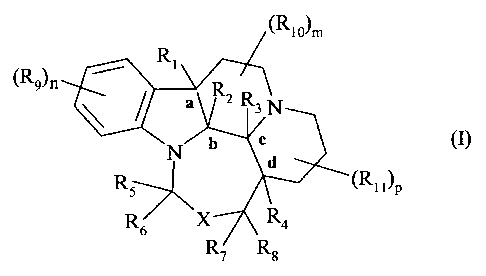
Plus particulièrement, la présente invention concerne les composés de formule
(I)
(R10)m
(R9)n R1
a RZ R3 N
N b ~
d
R5 (Ri i )p
R6 X Ra
R7 R8
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
-2-
dans laquelle :
- Rl représente un atome d'hydrogène ou un groupement alkyle (Cl-C6) linéaire
ou
ramifié, aminoalkyle (CI-C6) linéaire ou ramifié, ou hydroxyalkyle (CI-C6)
linéaire
ou ramifié,
- R2 représente un atome d'hydrogène,
ou Rl et R2 ensemble avec les atomes de carbone qui les portent forment une
liaison carbone-carbone,
- R3 représente un atome d'hydrogène,
- R4 représente un atome d'hydrogène ou un groupement méthyle ou alkyle (C3-
C6)
linéaire ou ramifié, aminoalkyle (C1-C6) linéaire ou ramifié, hydroxyalkyle
(C1-C6)
linéaire ou ramifié, arylalkyle (C1-C6) linéaire ou ramifié,
hétérocycloalkylalkyle
(C1-C6) linéaire ou ramifié,
ou R3 et R4 ensemble avec les atomes de carbone qui les portent forment une
liaison carbone-carbone,
- R5, R6, R7, R8, identiques ou différents, indépendamment l'un de l'autre,
représentent un atome d'hydrogène,
ou deux substituants géminaux (R5 et R6 et/ou R7 et R8) forment un groupement
oxo, thioxo ou imino,
- R9 représente un atome d'hydrogène ou d'halogène ou un groupement alkyle (C1-
C6) linéaire ou ramifié éventuellement substitué, alkoxy (C1-C6) linéaire ou
ramifié,
hydroxy, cyano, nitro, polyhalogénoalkyle (C1-C6) linéaire ou ramifié, amino
(éventuellement substitué par un ou deux alkyle (CI-C6) linéaire ou ramifié,
alkényle (C2-C6) linéaire ou ramifié, alkyle et alkényle pouvant être
identiques ou
différents),
- Rlo, Rl,, identiques ou différents, indépendamment l'un de l'autre,
représentent un
atome d'hydrogène ou d'halogène ou un groupement alkyle (C1-C6) linéaire ou
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
-3-
ramifié, alkoxy (C1-C6) linéaire ou ramifié, hydroxy, cyano, nitro,
polyhalogénoalkyle (C1-C6) linéaire ou ramifié, amino (éventuellement
substitué
par un ou deux alkyle (C1-C6) linéaire ou ramifié, alkényle (CZ-C6) linéaire
ou
ramifié, alkyle et alkényle pouvant être identiques ou différents),
- n représente un entier compris entre 0 et 4 (0, 1, 2, 3, 4),
- m représente un entier compris entre 0 et 2 (0, 1, 2),
- p représente un entier compris entre 0 et 3 (0, 1, 2,3),
- X représente un groupement NR12,
- R12 représente un atome d'hydrogène ou un groupement alkyle (C1-C6) linéaire
ou
ramifié éventuellement substitué, alkényle (CZ-C6) linéaire ou ramifié
éventuellement substitué, arylalkyle (C1-C6) linéaire ou ramifié,
polyhalogénoalkyle (C1-C6) linéaire ou ramifié,
leurs énantiomères, diastéréoisomères, N-oxydes, ainsi que leurs sels
d'addition à un acide
ou à une base pharmaceutiquement acceptable,
étant entendu que :
par arylalkyle, on entend le groupement aryle-alkyle dans lequel le groupement
alkyle
désigne une chaîne de 1 à 6 atomes de carbone, linéaire ou ramifié et le
groupement aryle
désigne un groupement phényle ou naphtyle éventuellement substitué,
l'expression "éventuellement substitué" lorsqu'elle concerne les groupements
alkyle (C1-
C6) linéaire, ramifié ou alkényle (C2-C6) linéaire ou ramifié ou arylalkyle
signifie que ces
groupements peuvent être substitués par un ou plusieurs atomes d'halogène, un
ou
plusieurs groupements hydroxy, alkoxy (CI-C6) linéaire ou ramifié ou amino
éventuellement substitué par un ou deux groupements, identiques ou différents,
alkyle (C1-
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
-4-
C6) linéaire ou ramifié,
par a, b, c et d on entend les centres chiraux éventuellement présents sur les
composés de
formule (I).
Parmi les acides pharmaceutiquement acceptables, on peut citer à titre non
limitatif les
acides chlorhydrique, bromhydrique, sulfurique, phosphorique, acétique,
trifluoroacétique,
lactique, pyruvique, malonique, succinique, glutarique, fumarique, tartrique,
maléique,
citrique, ascorbique, oxalique, méthane sulfonique, camphorique, etc...
Parmi les bases pharmaceutiquement acceptables, on peut citer à titre non
limitatif
l'hydroxyde de sodium, l'hydroxyde de potassium, la triéthylamine, la
tertbutylamine, la
lysine, etc...
Une variante avantageuse conceme les composés de formule (I) pour lesquels X
représente
un groupement NR12 dans lequel R12 représente un atome d'hydrogène.
Une autre variante avantageuse concerne les composés de formule (I) pour
lesquels Rl, R2,
R3 et R4 représentent chacun un atome d'hydrogène.
Un autre aspect particulier de l'invention concerne les composés de formule
(I) pour
lesquels Rl et R2 ensemble avec les atomes de carbone qui les portent forment
une liaison
carbone-carbone.
R9 représente avantageusement un atome d'hydrogène ou d'halogène.
Rlo et Rll représentent chacun avantageusement un atome d'hydrogène.
Les composés préférés de l'invention sont les composé de formule (I) pour
lesquels les
deux substituants géminaux (R5 et R6 et R7 et R8) forment un groupement oxo
chacun.
Un autre aspect particulier de l'invention concerne les composés de formule
(I) pour
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
-5-
lesquels R5 et R6 représentent chacun un atome d'hydrogène et, les deux
substituants
géminaux (R7 et R8) forment un groupement oxo.
Encore plus particulièrement, l'invention concerne les composés de formule (I)
qui sont :
= (5aRS, 1 2aSR, 12bSR, 12cSR)-7-chloro-2,3,4,5,5a, 10, 11, 12a, 1 2b, 12c-
décahydro-
IH, 12H-3a,9b, 11 -triazabenzo[a]naphtho[2,1,8-cde]azulén- 1 2-one,
= (5aRS,12aSR,12bSR,12cSR)-7-chloro-2,3,5a,12a,12b,12c-hexahydro-1H,4H-
3a,9b,11-
triazabenzo[a]naphtho[2,1,8-cde]azulène-10,12(5H, I IH)-dione,
= (1 2aRS, 12bRS)-7-chloro-2,3,12a, 12b-tétrahydro- 1 H,4H-3 a,9b,11-
triazabenzo[a]naphtho[2,1,8-cde] azulène- 10, 12(5H, 1 1H)-dione,
= (5aRS,12aSR,12bSR,12cSR)-2,3,5a,12a,12b,12c-hexahydro-IH,4H-3a,9b,11-
triazabenzo[a]naphtho[2,1,8-cde]azulène-10,12(5H,11H)-dione,
= (5aS,12aR,12bR,12cR) ou (5aR,12aS,12bS,12cS)-2,3,5 a,12a,12b,12c-hexahydro-
IH,4H-3a,9b,11-triazabenzo[a]naphtho[2,1,8-cde]azulène-10,12(5H, I 1H)-dione
(énantiomère a),
= (5aR,12aS,12bS,12cS) ou (5aS,12aR,12bR,12cR)-2,3,5a,12a,12b,12c-hexahydro-
IH,4H-3 a,9b,11-tri azabenzo[a]naphtho[2,1,8-cde]azulène-10,12(5H,1 IH)-dione
(énantiomère (3),
= (12aRS,12bRS)-2,3,12a,12b-tétrahydro-IH,4H-3a,9b,11-
triazabenzo[a]naphtho[2,1,8-
cde] azulène-10,12(5H,11H)-dione.
Les énantiomères, diastéréoisomères, N-oxydes, ainsi que les sels d'addition à
un acide ou
à une base, pharmaceutiquement acceptables, des composés préférés font partie
intégrante
de l'invention.
La notation (5aRS,12aSR,12bSR,12cSR) suivi du nom du composé signifie que le
produit
obtenu est un mélange racémique et donc, que les deux configurations sont
possibles.
A titre d'exemple :
(5aRS, 12aSR, 1 2bSR, 1 2cSR)-7-chloro-2,3,4,5,5a, 10, 11, 12a, 1 2b, 12c-
décahydro- IH,12H-
3a,9b,11-triazabenzo[a]naphtho[2,1,8-cde]azulén-12-one signifie que le produit
obtenu, le
mélange racémique, contient le (5aR,12aS,12bS,12cS)-7-chloro-
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
-6-
2,3,4,5,5a,10,11,12a,12b,12c-décahydro-1H,12H-3a,9b,11-tri azabenzo [a]
naphtho [2,1,8-
cde]azulén-12-one et le (5aS,12aR,12bR,12cR)-7-chloro-
2,3,4,5,5a,10,11,12a,12b,12c-
décahydro-1H,12H-3a,9b,11-triazabenzo[a]naphtho[2,1,8-cde] azulén-12-one.
La notation (5 aR,12aS,12bS,12cS) ou (5 aS,12aR,12bR,12cR) suivi du nom du
composé
signifie que le produit obtenu est un énantiomère optiquement pur.
A titre d'exemple :
(5aS,12aR,12bR,12cR) ou (5aR,12aS,12bS,12cS)-7-chloro-
2,3,4,5,5a,10,11,12a,12b,12c-
décahydro-1H,12H-3a,9b,11-triazabenzo[a]naphtho[2,1,8-cde]azulén-12-one
signifie que
le produit obtenu, l'énantiomère optiquement pur, est le (5aS,12aR,12bR,12cR)-
7-chloro-
2,3,4,5,5a,10,11,12a,12b,12c-décahydro-1H,12H-3a,9b,11-
triazabenzo[a]naphtho[2,1,8-
cde]azulén-12-one ou le (5aR,12aS,12bS,12cS)-7-chloro-
2,3,4,5,5a,10,11,12a,12b,12c-
décahydro-1H,12H-3 a,9b,11-triazabenzo[a]naphtho[2,1,8-cde] azulén-12-one.
Par énantiomère a et énantiomère (3, on entend les énantiomères optiquement
purs du
mélange racémique correspondant.
A titre d'exemple :
(5aR,12aS,12bS,12cS) ou (5aS,12aR,12bR,12cR)-7-chloro-
2,3,4,5,5a,10,11,12a,12b,12c-
décahydro-1H,12H-3a,9b,11-triazabenzo[a]naphtho[2,1,8-cde]azulén-12-one
(énantiomère
(x) signifie que si l'énantiomère a représente le (5aR,12aS,12bS,12cS)-7-
chloro-
2,3,4,5,5a,10,11,12a,12b,12c-décahydro-1H,12H-3a,9b,11-
triazabenzo[a]naphtho[2,1,8-
cde]azulén-12-one, alors l'énantiomère (3 réprésente le (5aS,12aR,12bR,12cR)-7-
chloro-
2,3,4,5,5a,10,11,12a,12b,12c-décahydro-1H,12H-3 a,9b,11-
triazabenzo[a]naphtho[2,1,8-
cde] azulén-12-one.
La présente invention s'étend également au procédé de préparation des composés
de
formule (I), caractérisé en ce que l'on utilise comme produit de départ un
composé de
formule (II) (dont la voie de synthèse est décrite par R.N. Schut et T.J.
Leipzig, J. Het.
Chem. 3, (1966), 101-102) :
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
-7-
(Rt 0)m
N
(R9)n I \ \ (Rll)p (II)
N
H
dans laquelle R9, R10,RI 1, n, m et p sont tels que définis dans la formule
(I),
qui est soumis à l'action d'un composé de formule (III) :
R'O- i -Hal (III)
dans laquelle R' représente un groupement alkyle (C1-C6) linéaire ou ramifié
et Hal
représente un atome d'halogène, pour conduire au composé de formule (IV) :
(Rle)m
(R9) N (RI i)p
/ I \ \ (N)
N
H
O
OR'
dans laquelle R', R9, Rlo, Rll, n, m et p sont tels que définis précédemment,
que l'on soumet à une réaction d'hydrogénation en présence de cyanoborohydrure
de
sodium et d'acide acétique en milieu anhydre, pour conduire à un mélange
d'énantiomères
cis de formule (Vcis) :
(Rle)m
N
/ \ H ~- (Rl l)p (Vcis)
(~)n ~
~ N
H
O H
OR'
dans laquelle R', R9, Rto, Ri1, n, m et p sont tels que définis précédemment,
qui subit une réaction d'épimérisation en présence d'un hydrure alcalin dans
un solvant
anhydre à 0 C pour conduire au mélange d'énantiomères trans de formule
(Vtrans) :
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
-8-
(RI0)m
H N (Rii)p
(Vtrans)
(R9)n
N
H O H
OR'
dans laquelle R', Ry, Rlo, Rll, n, m et p sont tels que définis précédemment,
l'ensemble des composés de formules (Vcis) et (Vtrans) forment l'ensemble des
composés
de formule (V)
(R10)m
H N (Ri i)r
(R )n I \ (V)
y~9 \ N
H O H
OR'
dans laquelle R', R9, Rlo, Rll, n, m et p sont tels que définis précédemment,
composés de formule (V) que l'on soumet à une réaction d'hydrogénation en
présence de
cyanoborohydrure de sodium et d'acide trifluoroacétique pour conduire au
composé de
formule (VI) :
H (RIo)m
H N (Rll)p (VI)
(R9)õ
N H
H O H
OR'
dans laquelle R', R9, Rlo, Rll, n, m et p sont tels que définis précédemment,
que l'on soumet :
= soit à l'action de chlorure d'ammonium en présence de triméthylaluminium
dans un
solvant anhydre à 0 C pour conduire au composé de formule (VII) :
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
-9-
H (Rt0)m
H N (Rll) (VII)
(R9)n
N H
H
H
O
NH2
dans laquelle R9, Rlo, Rll, n, m et p sont tels que définis précédemment,
que l'on cyclise en présence de paraformaldéhyde et d'acide acétique pour
conduire au
composé de formule (I/a), cas particulier des composés de formule (I) :
H (Rto)m
H N (R11)p
(Ua)
(R9)
N H
N H
H O
dans laquelle R9, Rlo, Rl l, n, m et p sont tels que définis précédemment,
= soit à l'action de cyanate de potassium en présence d'acide
trifluoroacétique dans un
solvant anhydre pour conduire au composé de formule (VIII) :
H (Rio)m
H N (Rll)P
(R9) (VIII)
N H
O H
HZN O OR'
dans laquelle R', R9, Rto, Rl l, n, m et p sont tels que définis précédemment,
que l'on soumet à l'action de carbonate de potassium pour conduire au composé
de formule
(Ub), cas particulier des composés de formule (I) :
H (Rto)rn
H N (Rll)p (~)
(R9)n
N H
N H
O H
0
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
- 10 -
dans laquelle R9, Rto, Rl l, n, m et p sont tels que définis précédemment,
les composés de formules (Ua) et (I/b) formant l'ensemble des composés de
formule (Uc)
H (RIo)m
H N (Rll)p (Uc)
(Rq)n
N g
Rts N H
R'6 H O
dans laquelle R'5 et R'6 représentent chacun un atome d'hydrogène ou forment
ensemble un
groupement oxo et R9, Rlo, Rll, n, m et p sont tels que définis précédemment,
que l'on réduit en présence d'un hydrure alcalin pour conduire au composé de
formule (I/d),
cas particulier des composés de formule (I) :
H (RIo)m
H N (Rll)p (Ud)
(R9)n
N H
Rt s N H
; 6 H
dans laquelle R'5, R'6, R9, Rlo, Rl l, n, m et p sont tels que définis
précédemment,
composés de formules (Uc) et (Ud) qui sont soumis à l'action d'un composé de
formule
(lx) :
R'12 - Hal (IX)
dans laquelle R'12 prend les mêmes définitions que R12 sauf l'hydrogène et Hal
représente
un atome d'halogène, pour conduire au composé de formule (Ue), cas particulier
des
composés de formule (I) :
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
-11-
H (RI )m
/ H N (RI1)p
I (Ue)
(R9)n
\ N H
R~s N H R R~
~ R' g
6 R~ ~
12
dans laquelle R'7 et R'8 représentent chacun un atome d'hydrogène ou forment
ensemble un
groupement oxo et R'5, R'6, R9, R10, Ri1, n, m et p sont tels que définis
précédemment,
qui est soumis, lorsque R'5 et R'6 et/ou R'7 et R'8 forment ensemble un
groupement oxo, à
l'action du réactif de Lawesson pour conduire au composé de formules (Ufl),
(Uf2) et (I/f3),
cas particulier des composés de formule (I) :
H
N
H (R10)m ~1 1) p (RI )m (Ri i)a
/ H H N
(R9)n ~ I (R9)n
N H N H
S~N H H
S S N ~
R112 Ri2 R,7R8
(Ufl) (I/f2)
H (Rio)m
H N (Rll)p
(R,)n
N g
R'SN H
R,6 / S
Rr12
(Uf3)
dans lesquelles R'5, R'6, R'7, R'8, R9, R10, R'12, n, m et p sont tels que
définis précédemment,
les composés de formules (Ua) à(Uf3) formant la totalité des composés de
formule (I), qui
peuvent être purifiés selon une technique classique de séparation, que l'on
transforme, si on
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
-12-
le souhaite en leurs sels d'addition à un acide ou à une base
pharmaceutiquement
acceptable et dont on sépare éventuellement les isomères selon une technique
classique de
séparation.
Les composés de formules (II), (III) et (IX) sont soit des produits
commerciaux, soit
obtenus selon des méthodes classiques de la synthèse organique bien connues de
l'homme
du métier.
Les composés de formule (I) possèdent d'intéressantes propriétés
pharmacologiques et
notamment celle d'être de puissants inducteurs de tyrosine hydroxylase (TH).
On sait que
la tyrosine hydroxylase est une enzyme limitante qui contrôle particulièrement
la synthèse
des neurotransmetteurs dans les neurones catécholaminergiques et
dopaminergiques
centraux. La vitesse de synthèse de ces neurotransmetteurs est notamment
reliée à
l'apparition de dysfonctions toniques du cerveau que sont de nombreuses
pathologies
comportementales chez l'homme, telles que l'anxiété, les psychoses, les
dépressions, le
stress, etc...
Grâce à leur capacité d'induction de tyrosine hydroxylase, les composés de
l'invention
trouvent donc leur utilisation thérapeutique dans le traitement des
dépressions, de l'anxiété,
des troubles de la mémoire au cours de la sénescence et/ou de maladies
neurodégénératives, et dans le traitement palliatif de la maladie de Parkinson
et pour
l'adaptation au stress.
La présente invention a également pour objet les compositions pharmaceutiques
renfermant comme principe actif au moins un composé de formule (I), ses
énantiomères,
diastéréoisomères, N-oxydes ou un de ses sels d'addition à une base ou un
acide
pharmaceutiquement acceptable, seul ou en combinaison avec un ou plusieurs
excipients
ou véhicules inertes, non toxiques pharmaceutiquement acceptables.
Les compositions pharmaceutiques ainsi obtenues se présentent généralement
sous forme
dosée. Elles peuvent par exemple revêtir la forme de comprimés, dragées,
gélules,
suppositoires, solutions injectables ou buvables et être administrées par voie
orale, rectale,
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
- 13-
intramusculaire ou parentérale.
Parmi les compositions pharmaceutiques selon l'invention, il sera cité plus
particulièrement
celles qui conviennent pour l'administration orale, parentérale
(intraveineuse,
intramusculaire, ou sous-cutanée), per ou trans-cutanée, intravaginale,
rectale, nasale,
perlinguale, buccale, oculaire ou respiratoire.
Les compositions pharmaceutiques selon l'invention pour les injections
parentérales
comprennent notamment les solutions stériles aqueuses et non aqueuses, les
dispersions,
les suspensions ou émulsions ainsi que les poudres stériles pour la
reconstitution des
solutions ou des dispersions injectables.
Les compositions pharmaceutiques selon l'invention, pour les administrations
orales
solides, comprennent notamment les comprimés simples ou dragéifiés, les
comprimés
sublinguaux, les sachets, les gélules, les granules, et pour les
administrations liquides
orales, nasales, buccales ou oculaires, comprennent notamment les émulsions,
les
solutions, les suspensions, les gouttes, les sirops et les aérosols.
Les compositions pharmaceutiques pour l'administration rectale ou vaginale
sont
préférentiellement des suppositoires ou ovules, et celles pour
l'administration per ou trans-
cutanée comprennent notamment les poudres, les aérosols, les crèmes, les
pommades, les
gels et les patchs.
Les compositions pharmaceutiques citées précédemment illustrent l'invention
mais ne la
limitent en aucune façon.
Parmi les excipients ou véhicules inertes, non toxiques, pharmaceutiquement
acceptables,
on peut citer à titre indicatif et non limitatif les diluants, les solvants,
les conservateurs, les
agents mouillants, les émulsifiants, les agents dispersants, les liants, les
agents gonflants,
les agents désintégrants, les retardants, les lubrifiants, les absorbants, les
agents de
suspension, les colorants, les aromatisants, etc...
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
-14-
La posologie utile varie selon l'âge et le poids du patient, la voie
d'administration, la
composition pharmaceutique utilisée, la nature et la sévérité de l'affection,
et la prise de
traitements associés éventuels. La posologie s'échelonne de 0,1 mg à 100 mg en
une ou
plusieurs prises par jour.
Les exemples suivants illustrent l'invention mais ne la limitent en aucune
façon.
Les produits de départ utilisés sont des produits connus ou préparés selon des
modes
opératoires connus. Les différentes préparations conduisent à des
intermédiaires de
synthèse utiles pour la préparation des composés de l'invention.
Les structures des composés décrits dans les exemples et dans les préparations
ont été
déterminées selon les techniques spectrométriques usuelles (infrarouge,
résonance
magnétique nucléaire, spectrométrie de masse, ...).
Les points de fusion ont été déterminés sur appareil TOTTOLI (sans correction
de colonne
émergente). Lorsque le composé existe sous forme de sel, le point de fusion
correspond à
celui du produit salifié.
PREPARATION 1 : (1SR,7aRS,12aSR,12bSR)-9-Chloro-1,2,3,4,6,7,7a,12,12a,12b-
décahydroindolof2,3-alguinolizine-1-carboxylate d'éthyle
Stade A : 1-f2-(5-Chloro-lH-indol-3-yl)éthylluipéridin-2-one
A une solution de 100 g chlorhydrate de 5-chlorotryptamine dans 1,4 1 de 2-
méthoxyéthanol sont ajoutés 60 g de NaZCO3. Le mélange réactionnel est agité
au reflux
sous azote. Une solution de 111,2 g de 5-bromovalérianate dans 200 ml de 2-
méthoxyéthanol est ajoutée goutte à goutte sur une période de 5-6 heures et le
mélange est
chauffé sous reflux pendant 24 heures. Après refroidissement, le mélange
réactionnel est
filtré sur Célite et les filtrats sont concentrés sous pression réduite.
L'huile est extraite avec
500 ml de CHZC12 et 300 ml d'eau. La phases organiques sont lavées avec une
solution
saturée en chlorure de sodium puis séchées sur NazSO4 and concentrées sous
pression
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
- 15-
réduite. Le solide est recristallisé dans un mélange acétone/pentane :9/1 pour
donner 107 g
du produit attendu..
Point de,fusion_= 155 C
Spectrométrie de masse_(IE, m/z) : 276,8 (M+).
Stade B : Tétrafluoroborate de 9-chloro-2,3,4,6,7,12-hexahydro-lH-indolo-f2,3-
a1
quinolizin-5-ylium
A une solution du composé du stade A précédent dans 1,2 1 de toluène sont
ajoutés 83 ml
de POC13. Le milieu réactionnel est chauffé à 90 C pendant 5 heures sous
azote. Après
refroidissement tout en agitant le mélange, 3 à 4 1 d'eau sont ajoutés puis
laisser décanter.
436 ml d'une solution de HBF4 sont ajoutés goutte à goutte à la phase aqueuse.
98 g du
produit attendu sont obtenus après filtration, lavage à l'eau puis séchage sur
P205 sous.
Point de,fusion_ > 280 C
Spectrométrie de masse_(IE, m/z) : 346,5 (M+).
Stade C : 9-Chloro-2,3,4,6,7,12-hexahydroindolof 2,3-al guinolizine
61 g du produit du stade B précédent est solubilisé dans 510 ml de méthanol et
115 ml
d'eau permutée. Le mélange réactionnel est agité vigoureusement et chauffé
sous reflux
pendant 2,5 heures jusqu'à solubilisation. Le reflux est arrêté et 115 ml
d'une solution 4M
de NaOH sont ajoutés goutte à goutte. Après addition complète, le milieu
réactionnel est
refroidi à 0- 5 C et 35 ml d'une solution 4M de NaOH est ajouté sous agitation
vigoureuse pendant 0,5 heure. Le résidu solide est filtré, lavé avec de l'eau,
séché sur PZO5
sous vide pour donner 42 g du produit attendu.
Point de usion _ 114 C
Spectrométrie de masse_(IE, mlz) : 257,78 (M+).
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
-16-
Stade D (1RS)-9-Chloro-2,3,4,6,7,12-hexahydroindolof2,3-alguinolizine-1-
carboxylate d'éthyle
A une solution de 25 g du composé du stade C précédent dans 500 ml de CH2C1Z
distillé,
sont ajoutés 1,75 g de 4-(diméthylamino)pyridine et 25 ml de DIEA sous
atmosphère
d'argon. L'ensemble est agité à température ambiante jusqu'à solubilisation.
Une solution
de 19 ml de CICOZEt (97 %) dans du dichlorométhane distillé est ajoutée. Après
agitation à
température ambiante pendant 12 heures, la réaction est filtrée, l'insoluble
est rincé avec
120 ml de CH2C12 et le filtrat est concentré sous pression réduite. Une
chromatographie sur
gel de silice (CHZC12) suivie d'une recristallisation dans un mélange
acétone/pentane : 9/1
permet d'obtenir 22 g du produit attendu.
Point de,fusion_ 128 - 130 C
Spectrométrie de masse (IE, m/z) : 330,82 (M+).
Stade E : (1SR, 12bRS)-9-Chloro-1,2,3,4,6,7,12,12b-octahydroindolof2,3-
alguinolizine
-1-carboxylate d'éthyle (diastéréoisomère cis)
16 ml d'acide acétique sont ajoutés à une solution de 16 g du produit du stade
D précédent
dans 300 ml de THF distillé. 4,4 g NaBH3CN sont ajoutés par petites portions
sous
atmosphère d'azote et à 0 C, puis le milieu réactionnel est agité
vigoureusement à
température ambiante pendant 12 h. Une solution saturée de NaZCO3 est ensuite
ajoutée à
0 C, puis le solvant est évaporé sous pression réduite. 200 ml de CHZCIZ et 80
ml d 'eau
sont ajoutés au résidu. Après extraction avec CH2ClZ, les phases organiques
sont lavées
avec une solution saturée en chlorure de sodium, séchées sur NaZSO4 puis
concentrée sous
pression réduite. 20 ml d'une solution HC12M sont ajoutés au brut réactionnel
dans 350 ml
d'éthanol et le mélange réactionnel est chauffé sous reflux pendant 5 heures.
Le milieu
réactionnel est concentré sous pression réduite et le solide est solubilisé
dans 270 ml de
CHZC12. Cette solution organique est ajoutée à 130 ml d'eau. La solution est
rendue alcaline
(pH = 8 - 9) par addition d'une solution saturée de NazCO3 et extraite avec
CHZC12. Les
phases organiques sont combinées, lavées avec une solution saturée en chlorure
de sodium,
séchées sur NazSO4 puis concentrées sous pression réduite. Une
recristallisation dans un
mélange acétone/pentane : 9/1 permet d'obtenir 15 g du produit attendu.
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
- 17-
Point de fusion,= 184 C
Analyse élémentaire-:
C% H% N%
Calculé : 64,95 6,36 8,41
Trouvé : 65,01 6,39 8,36
Stade F : (1SR,12bSR)-9-Chloro-1,2,3,4,6,7,12,12b-octahydroindolo(2,3-
alguinolizine-
1-carboxylate d'éthyle (diastéréoisomère trans)
Sous un flux d'argon et à 0 C, 2,5 g de NaH sont ajoutés par petites portions
à une solution
de 9 g du composé du stade E précédent dans 300 ml de DME. Après agitation à
température ambiante pendant 12 heures, le milieu réactionnel est
précautionneusement
versé dans de la glace et agité pendant 1 heure. Le solvant organique est
évaporé et la
phase aqueuse est refroidie à 0- 5 C, température à laquelle une solution HCl
4M est
ajoutée jusqu'à pH = 2-4. Après agitation, une solution saturée de NaZCO3 est
ajoutée
jusqu'à pH = 9. Le milieu réactionnel est extrait avec AcOEt et les phases
organiques sont
séchées sur NaZSO4, filtrées puis concentrées sous pression réduite. Le brut
réactionnel est
recristallisé dans le minimum d'AcOEt, le solide est séché sous vide pour
donner 8,3 g du
produit attendu.
Point de,fusion_ 88 - 90 C
In~rarouge . 3442 ; 2933 ; 1709
Stade G : (1SR,7aRS,12aSR,12bSR)-9-Chloro-1,2,3,4,6,7,7a,12,12a,12b-décahydro
indolof2,3-alguinolizine-1-carboxylate d'éthyle (diastéréoisomère trans)
A une solution de 350 ml de TFA à 0 C sous un large flux d'argon sont
additionnés
alternativement et par petites portions 10,3 g du produit du stade F précédent
et 15 g de
NaBH3CN. La réaction est agitée pendant 10 minutes à température ambiante
entre chaque
addition. Après 8 heures, 3 g de NaBH3CN sont à nouveau additionnés puis agité
pendant
12 heures supplémentaires à température ambiante. 20 ml d'eau sont additionnés
goutte à
goutte au milieu réactionnel à 0 C puis CHZC12 jusqu'à solubilisation. Après
agitation à
température ambiante, le solvants (TFA, CHZC12) sont évaporés. La phase
aqueuse est
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
- 18-
refroidie à 0 C et une solution de NaOH 4M est ajoutée. Après extraction avec
Et20, les
phases organiques sont séchées sur NazSO4, filtrées puis concentrées sous
pression réduite.
Une recristallisation dans Et20, suivie d'une chromatographie sur gel de
silice
(CHZCIz/MeOH : 100/5) permet d'obtenir 8 g du produit attendu.
Point de, fusion : 126 - 129 C
Spectrométrie de masse_(IE, m/z) : 335,2 [M+H]
In~rarouge ~v ,õ_l~ : 3374 ; 2948 ; 1726
EXEMPLE 1 : (5aRS,12aSR,12bSR,12cSR)-7-Chloro-2,3,4,5,5a,10,11,12a,12b,12c-
décahydro-1H,12H-3a,9b,11-triazabenzo f al naphtho[2,1,8-cdel azulén-12-one
Stade A (1SR,7aRS,12aSR,12bSR)-9-Chloro-1,2,3,4,6,7,7a,12,12a,12b-
décahydroindolo[2,3-alguinolizine-1-carboxamide
A une suspension de 2,77 g de chlorure d'ammonium dans 55 ml de toluène
anhydre
préalablement refroidie à 0 C, est ajoutée une solution de 26 ml de A1Me3
(solution 2M).
Le mélange réactionnel est agité sous azote pendant 1 h 30 en laissant la
température
remonter lentement à l'ambiante. Une solution de 2,89 g du composé de la
préparation 1
dans 20 ml de toluène anhydre est alors ajoutée. Le mélange réactionnel est
agité à
température ambiante pendant 24 h. Après refroidissement à 0 C, sont ajoutés
une
solution 100 ml de HCl 1M (addition lente au début), puis 250 ml d'eau. Le
milieu est
extrait avec de l'éther diéthylique (3 x 100 ml). La phase aqueuse est
alcalinisée avec une
solution saturée de NaZC03 jusqu'à pH 10 et extraite avec du dichlorométhane
(3 x 100
ml). La phase organique est séchée sur sulfate de sodium, filtrée et
concentrée sous
pression réduite. L'amide est purifié par lavage avec de l'éther diéthylique
(100 ml) pour
donner 2,37 g du produit attendu.
Point de fusion_ 270 C
Analyse élémentaire_:
C% H% N%
Calculé : 62,84 6,59 13,74
Trouvé : 62,59 6,66 13,71
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
- 19-
Stade B (5aRS,12aSR,12bSR,12cSR)-7-Chloro-2,3,4,5,5a,10,11,12a,12b,12c-
décahydro-1H,12H-3a,9b,11-triazabenzofalnaphthof 2,1,8-cdel azulén-12-one
A une solution de 358 mg du composé du stade A précédent dans 30 ml de
méthanol, sont
ajoutés 536 .l d'acide acétique et 6,5 g de paraformaldéhyde. Le mélange est
chauffé à
reflux sous azote pendant 48 h. Après élimination du solvant par évaporation
sous vide,
une solution de HCl (1M, 10 ml) est ajoutée au résidu et la phase aqueuse est
extraite par
du dichlorométhane (3 x 20 ml). La phase aqueuse est alcalinisée à pH 9 à
l'aide de
Na2CO3 et extraite avec du dichlorométhane (3 x 20 ml). La phase organique est
séchée sur
NaZSO4, filtrée et évaporée sous vide pour livrer 406 mg d'un résidu solide
qui est repris
' par du dichlorométhane (30 ml) et une solution de NaOH (1M, 10 ml). Le
mélange est
agité à température ambiante pendant 6 h. Après traitement habituel, 324 mg du
produit
attendu sont obtenus par recristallisation dans 35 ml d'éthanol.
Point de, fusion : > 250 C
Spectrométrie de masse_(IE, m/z) : 317 et 319.
Analyse élémentaire :
C% H% N%
Calculé : 64,25 6,34 13,22
Trouvé : 64,01 6,42 13,13
EXEMPLE 2 : (5aRS,12aSR,12bSR,12cSR)-7-Chloro-2,3,5a,12a,12b,12c-hexahydro-
1H,4H-3a,9b,11-triazabenzo f al naphtho f 2,1,8-cdel azulène-10,12(5H,11H)-
dione
Stade A (1SR,7aRS,12aSR,12bSR)-12-(Aminocarbonyl)-9-chloro-
1,2,3,4,6,7,7a,12,12a,-12b-décahydroindolof2,3-alguinolizine-1-carboxylate
d'éthyle
Une solution de 385 mg du composé de la préparation 1 dans 6 ml de THF anhydre
est
ajoutée, en une seule fois à l'aide d'une seringue, à une solution de 2,33 g
de KOCN et
4,43 ml d'acide trifluoroacétique dans 12 ml de THF anhydre. Le mélange
réactionnel est
agité à température ambiante sous azote pendant 2 h. Après élimination du
solvant sous
vide, du dichlorométhane (30 ml) est ajouté au résidu. La phase organique est
extraite par
une solution de HCl (1M, 6 x 10 ml). La phase aqueuse est ajustée à pH 9 à
l'aide de
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
-20-
Na2CO3 et extraite avec du dichlorométhane (3 x 20 ml). La phase organique est
séchée sur
Na2SO4, filtrée et évaporée sous vide pour donner 500 mg du produit attendu.
Le produit
est engagé aussitôt dans l'étape suivante.
Stade B : (5aRS,12aSR,12bSR,12cSR)-7-Chloro-2,3,5a,12a,12b,12c-hexahydro-1H,4H-
3a,9b,11-triazabenzofalnaphthof2,1,8-cdelazulène-10,12(5H,11H)-dione
Une solution de 500 mg du produit du stade A précédent dans 25 ml d'éthanol
est traitée
par 6,36 mg de K2C03. Le mélange réactionnel est chauffé à reflux pendant 1 h.
Après
élimination du solvant sous vide, de l'eau (50 ml) est ajoutée et extraite
avec du
dichlorométhane (3 x 20 ml). La phase organique est séchée sur Na2SO4, filtrée
et évaporée
sous vide. Une cristallisation dans de l'éthanol (50 ml) permet d'obtenir 220
mg du produit
attendu.
Point de,fusion_ 243 C
Spectrométrie de masse_(IE, m/z) : 331.
Analyse élémentaire :
C% H% N%
Calculé : 61,54 5,47 12,66
Trouvé : 61,39 5,54 12,58
EXEMPLE 3 : (12aRS,12bRS)-7-Chloro-2,3,12a,12b-tétrahydro-1H,4H-3a,9b,11-
triazabenzo (al naphtho f 2,1,8-cdel azulène-10,12(5H,11H)-dione
A une solution de 201 mg du composé de l'exemple 2 dans 5 ml de DMF (5 ml),
526 mg
de Mn02 sont rajoutés. Le mélange réactionnel est agité à température ambiante
pendant
52 h puis, filtré sur célite. Le solvant est éliminé par évaporation sous vide
et une
cristallisation dans un minimum d'éthanol permet d'obtenir 80 mg du produit
attendu.
Point de, fusion : 214 C
Spectrométrie de masse (IE, m/z) : 329.
Analyse élémentaire_:
C% H% N%
Calculé : 61,91 4,89 12,74
Trouvé : 61,59 4,81 12,71
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
-21-
EXEMPLE 4 : (5aRS,12aSR,12bSR,12cSR)-2,3,5a,12a,12b,12c-Hexahydro-1H,4H-
3a,9b,11-triazabenzo f al naphtho f 2,1,8-cdel azulène-10,12(5H,11H)-dione
A une solution de 109 mg du composé de l'exemple 2 dans 10 ml de THF anhydre
additionnée de 140 l de triéthylamine, une pointe de spatule de Pd/C 10 %
est ajoutée.
Le réacteur est purgé en effectuant plusieurs cycles vide-azote puis, le
milieu réactionnel
est placé sous atmosphère d'hydrogène et agité à température ambiante pendant
24 h. Le
mélange est filtré sur célite et le solvant est éliminé par évaporation sous
vide. Au résidu,
est rajoutée une solution de HCl (IM, 30 ml) ; le milieu est ensuite extrait
par du
dichlorométhane (3 x 20 ml). La phase aqueuse est amenée à pH 9 à l'aide de
Na2CO3 et
extraite par dichlorométhane (3 x 20 ml). La phase organique est séchée sur
Na2SO4, filtrée
et évaporée sous vide. Une cristallisation dans un minimum d'éthanol permet
d'obtenir 65
mg du produit attendu.
Point de,fusion_ 255 C
Spectrométrie de masse_(IE, m/z) : 298.
Analyse élémentaire
C% H% N%
Calculé : 68,67 6,44 14,13
Trouvé : 68,56 6,53 14,10
EXEMPLE 5 : (5aS,12aR,12bR,12cR) ou (5aR,12aS,12bS,12cS)-2,3,5a,12a,12b,12c-
Hexahydro-1H,4H-3a,9b,11-triazabenzofalnaphthof2,1,8-cdelazulène-10,12(5H,11H)-
dione (énantiomère a)
Le composé de l'exemple 4 est dédoublé par cristallisation fractionnée des
sels
diastéréomères préparés par addition sur une solution méthanolique de composé
de
l'exemple 4 soit, d'une solution d'acide (-)-di-O, O' para-toluyl-L-tartrique
soit, d'une
solution d'acide (+)-di-O, O' para-toluyl-D-tartrique. Après séparation du sel
diastéréoisomère, la base est isolée selon un traitement classique.
Point de,fusion_ 250 C
Pouvoir rotatoire aD = + 95 (c = 1 dans CHC13).
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
-22-
Analyse élémentaire-:
C% H% N%
Calculé : 68,15 6,48 14,03
Trouvé : 68,12 6,62 14,01
EXEMPLE 6 : (5aS,12aR,12bR,12cR) ou (5aR,12aS,12bS,12cS)-2,3,5a,12a,12b,12c-
Hexahydro-1H,4H-3a,9b,11-triazabenzolal naphtho f 2,1,8-cdel azulène-
10,12(5H,11H)-
dione (énantiomère R)
Le composé de l'exemple 4 est dédoublé par cristallisation fractionnée des
sels
diastéréomères préparés par addition sur une solution méthanolique de composé
de
l'exemple 4 soit, d'une solution d'acide (-)-di-O, O' para-toluyl-L-tartrique
soit, d'une
solution d'acide (+)-di-O, O' para-toluyl-D-tartrique. Après séparation du sel
diastéréoisomère, la base est isolée selon un traitement classique.
Point de fusion= 250 C
Pouvoir rotatoire aD = - 95 (c = 1 dans CHC13).
Analyse élémentaire_:
C% H% N%
Calculé : 68,15 6,48 14,03
Trouvé : 68,12 6,57 13,98
EXEMPLE 7 (12aRS,12bRS)-2,3,12a,12b-Tétrahydro-1H,4H-3a,9b,11-
triazabenzofalnaphthof2,1,8-cdelazulène-10,12(5H,11H)-dione
A une solution de 1,047 g du composé de l'exemple 4 dans 10 ml de DMF, 4,3 g
de Mn02
sont rajoutés. Le mélange est agité à température ambiante pendant 24 heures
puis est filtré
sur célite. Après évaporation du solvant sous vide le résidu est repris avec
une solution
saturée de NaZCO3 (50 ml), puis de l'eau est ajoutée (300 ml). La phase
aqueuse est extraite
ensuite avec du dichlorméthane (3 x 50 ml). La phase organique est séchée sur
Na2SO4,
filtrée et évaporée sous vide. Une chromatographie sur colonne de silice
(AcOEt/cyclohexane : 25:75) suivie d'une recristallisation dans l'éthanol (75
ml) permet
d'obtenir 154 mg du produit attendu.
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
-23-
Point de,fusion : 235 C
Spectrométrie de masse_(IE, mlz) : 295.
Analyse élémentaire :
C% H% N%
Calculé : 69,14 5,80 14,23
Trouvé : 69,09 5,77 14,21.
ETUDE PHARMA COLOGIQUE DES DERIVES DE L'INVENTION
EXEMPLE A: Induction de tyrosine hydroxylase
Il est recherché, parmi les dérivés, ceux qui sont capables d'induire une
augmentation de la
protéine tyrosine hydroxylase (TH) dans le cerveau de la souris Balb/C, au
niveau du locus
coeruleus (LC).
Les animaux utilisés sont des souris mâles de la lignée pure Balb/C
(Charles River Laboratories), âgées de 7 à 8 semaines au moment du traitement.
Les souris reçoivent une injection unique par voie intrapéritonéale du composé
à tester,
dissous dans une solution d'HCl 0.04 M (contrôle correspondant : HCl 0.004 M)
si le
composé est suffisamment soluble, ou dans l'huile d'olive 90 % / DMSO 10 %
(contrôle
correspondant : huile d'olive 90 % / DMSO 10 %) pour les composés insolubles
en milieu
aqueux.
Trois jours après l'injection de chaque molécule, tous les animaux sont
sacrifiés par
décapitation. Les cerveaux extraits sont ensuite congelés dans de l'azote
liquide et
conservés à -80 C.
Des coupes coronales de 8 microns d'épaisseur sont pratiquées le long de l'axe
postéro-
antérieur du LC et fixées. Les coupes sont transférées sur membranes Immobilon-
P. La TH
est mesurée par immunodétection et analyse d'image.
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
-24-
Résultats =
Les résultats d'induction de la TH au niveau du LC sont présentés dans le
tableau I suivant.
TABLEA U I
Mesure de la quantité de TH au niveau des différentes coupes du LC numérotées
de 1
à 8 dans le sens antérieur vers postérieur, après administration i.p. (20
mg/kg)
Les résultats sont exprimés en %par rapport à la valeur moyenne du groupe
témoin 1
% 1 2 3 4 5 6 7 8
Ex.2 53 54 46 35 25 14 5 3
Ex.3 55 58 47 48 33 19 5 3
Ex.4 88 78 70 58 27 14 9 3
Ex.7 63 67 48 47 43 23 7 6
'animaux traités par le même véhicule
EXEMPLE B : Affinité pour les récepteurs
L'affinité pour les récepteurs est déterminée selon les méthodes habituelles
de relation
entre le ligand spécifique et le récepteur, qui peut être d'origine animale ou
un recombinant
humain. Elle a été déterminée par la méthode du déplacement du ligand
spécifique marqué
par le composé étudié, et exprimée par la constante de dissociation K.
L'affinité réceptorielle pour 28 récepteurs classiques a ainsi été étudiée.
L'étude montre que
l'induction de TH observée ne passe pas par une affinité vis-à-vis des
récepteurs
habituellement touchés par les produits psychotropes, comme les récepteurs
adrénergiques
alpha (de type aZ), 5HT (de type 5HT2A), dopaminergiques (de type D1 et D2).
Quelques dérivés montrent une affinité non négligeable pour les récepteurs
sigma (6)
(ligand halopéridol) ou muscarinique (M).
CA 02674083 2009-06-29
WO 2008/099081 PCT/FR2008/000012
-25-
TABLEA U II
% d'inhibition az 5HT2A D1 D2 M 6
concentration (M) 10-7 10"5 10-7 10-5 10"7 10-5 10-7 10-5 10-7 10-5 10-7 10-5
Exemple 5 - - - - - - - - - - - -
Exemple 6 - - - - - - - - - -
Exemple 7 - - 34 96 - - - - - - - -
EXEMPLE C : Prédiction de stabilité métabolique
La prédiction de stabilité métabolique est testée par incubation des dérivés à
la
concentration de 10-7 M en présence de microsomes hépatiques de souris, rat ou
d'homme
(0,33 mg prot/ml). Après addition de NADPH (nicotinamide adénine dinucléotide
phosphate, forme réduite), des prélèvements sont réalisés à 0, 5, 15, 30 et 60
minutes. La
réaction enzymatique est arrêtée avec le méthanol (V/V). La protéine est
précipitée par
centrifugation et le surnageant analysé par LC-MS-MS.
La bonne stabilité métabolique de ces dérivés permet d'envisager un traitement
per os.
TABLEA U III
% de prédiction de stabilité métabolique sur microsomes hépatiques
Souris Rat Homme
Exemple 5 100 90 75
Exemple 6 100 76 71
EXEMPLE E : Composition pharmaceutique
Formule de préparation pour 1000 comprimés dosés à 10 mg
Composé de l'exemple 7
...............................................................................
......10 g
Hydroxypropylcellulose
...............................................................................
........ 2 g
Amidon de blé
...............................................................................
.....................10 g
Lactose
...............................................................................
............................... 100 g
Stéarate de magnésium
...............................................................................
.......... 3 g
Talc
...............................................................................
......................................... 3g