Note: Descriptions are shown in the official language in which they were submitted.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
Nouveaux dérivés d'acide 3-phenyl acrylique activateurs des récepteurs de type
PPAR, leur méthode de préparation et leur utilisation dans des compositions
cosmétiques ou pharmaceutiques
L'invention concerne, à titre de produits industriels nouveaux et utiles, une
nouvelle classe
de dérivés d'acide 3-phenyl acrylique activateurs des récepteurs de type
Peroxisome
Proliferator-Activated Receptor de sous-type y (PPARy). Elle concerne
également leur
méthode de préparation et leur utilisation dans des compositions
pharmaceutiques destinées
à un usage en médecine humaine ou vétérinaire, ou bien encore dans des
compositions
cosmétiques.
L'activité des récepteurs de type PPARs a fait l'objet de nombreuses études.
On peut citer à
titre indicatif la publication intitulée "Differential Expression of
Peroxisome Proliferator-
Activated Receptor Subtypes During the Differentiation of Human
Keratinocytes", Michel
Rivier et al., J. Invest. Dermatol 111, 1998, p 1116-1121, dans laquelle est
répertorié un
grand nombre de références bibliographiques concernant les récepteurs de type
PPARs. On
peut également citer à titre indicatif, le dossier intitulé "The PPARs: From
orphan receptors to
Drug Discovery", Timothy M. Willson, Peter J. Brown, Daniel D. Sternbach, et
Brad R.
Henke, J. Med.Chem., 2000, Vol.43, p. 527-550.
Les récepteurs PPARs activent la transcription en se liant à des éléments de
séquences
d'ADN, appelés les éléments de réponse des proliférateurs de peroxysome
(PPRE), sous
forme d'un hétérodimère avec les récepteurs X des rétinoïdes (appelés les
RXRs).
Trois sous-types de PPARs humains ont été identifiés et décrits : les PPARa,
PPARy et
PPARâ (ou NUC1).
PPARa est principalement exprimé dans le foie alors que PPARâ est ubiquitaire.
PPARy est le plus étudié des trois sous-types. L'ensemble des références
suggère un rôle
critique des PPARy dans la régulation de la différentiation des adipocytes, où
il est fortement
exprimé. Il joue également un rôle clé dans l'homéostasie lipidique
systémique.
Il a été notamment décrit dans la demande internationale WO 96/33724 que des
composés
sélectifs des PPARy, tels qu'une prostaglandine-J2 ou -D2, sont des actifs
potentiels pour le
traitement de l'obésité et du diabète.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
2
Par ailleurs, la Demanderesse a déjà décrit dans les demandes internationales
WO 02/12210, WO 03/055867 et WO 2006/018326 l'utilisation de composés bi-
aromatiques
activateurs des récepteurs de type PPARy dans la préparation d'une composition
pharmaceutique, la composition étant destinée à traiter les désordres cutanés
liés à une
anomalie de la différentiation des cellules épidermiques.
Il n'en demeure pas moins qu'il reste nécessaire de rechercher de nouveaux
composés
activateurs des récepteurs de type PPARy et présentant des propriétés
pharmaceutiques
avantageuses.
La Demanderesse a maintenant identifié de nouveaux dérivés d'acide 3-phenyle
acrylique
pour lesquels elle a découvert de façon surprenante qu'ils avaient une
activité vis-à-vis des
récepteurs PPARs gamma.
Par ailleurs, les composés selon la présente invention sont obtenus, le plus
souvent, sous
forme solide, ce qui présente l'avantage de rendre leur synthèse et leur
purification plus
faciles.
Enfin, l'utilisation de composés solides pour la préparation de compositions
pharmaceutiques
et/ou cosmétiques présente un réel avantage dans le cadre de leur
développement
pharmaceutique et/ou cosmétique en raison du taux de solvants résiduels quasi
nul que ces
composés contiennent comparativement à celui qu'ils peuvent contenir
lorsqu'ils se
présentent sous forme d'huile.
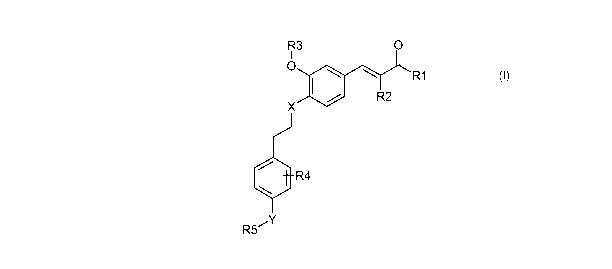
Ainsi, la présente invention concerne un composé répondant à la formule
générale (I)
suivante :
R3 O
R1
R2
R4
R5~Y
(I)
dans laquelle :
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
3
- R, représente un radical hydroxyle ou un radical alkoxy ;
- R2 représente un radical alkyle, un radical alkoxy ou un radical aralkoxy;
- R3 représente un hydrogène, un radical alkyle, un radical aralkyle
éventuellement substitué
ou un radical polyéther ;
- R4 représente un hydrogène, un halogène, un radical alkyle ou un radical
alkoxy ;
- R5 représente un radical alkyle, un radical aryle éventuellement substitué
ou un radical
aralkyle éventuellement substitué ;
- X représente un atome d'oxygène ou un radical CH2 ;
- Y représente un atome d'oxygène, un radical NR6, un radical OSOZ, OCO, NR6CO
ou
N R6S02,
- R6 représente un atome d'hydrogène ou un radical alkyle ;
ainsi que ses sels avec un acide ou une base pharmaceutiquement acceptable,
ses solvates
pharmaceutiquement acceptables et ses hydrates.
En particulier, lorsque les composés selon l'invention se présentent sous
forme d'un sel, il
s'agit d'un sel d'un métal alcalin, en particulier, un sel de sodium ou de
potassium, ou d'un
sel d'un metal alcalino-terreux, en particulier le magnésium ou le calcium, ou
encore d'un sel
avec une amine organique, plus particulièrement, avec un acide aminé tel que
l'arginine ou
la lysine.
Lorsque les composés selon l'invention possèdent une fonction amine et se
présentent sous
la forme d'un sel de cette amine, il s'agit d'un sel d'acide inorganique comme
par exemple
l'acide chlorhydrique, l'acide sulfurique, ou l'acide bromhydrique ou d'un sel
d'acide
organique comme par exemple l'acide acétique, l'acide triflique, l'acide
tartrique, l'acide
oxalique, l'acide citrique, l'acide trifuoroacétique ou l'acide méthane
sulfonique.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
4
Selon la présente invention, par radical alkyle, on entend une chaîne
hydrocarbonée saturée,
linéaire ou ramifiée, comprenant de 1 à 12 atomes de carbone et, plus
particulièrement, de 1
à 6 atomes de carbone.
De préférence, les radicaux alkyles mis en oeuvre dans le cadre de la présente
invention
sont choisis parmi les radicaux méthyle, éthyle, propyle, isopropyle, butyle,
isobutyle,
tertiobutyle, pentyle, isoamyle, amyle, hexyle, heptyle, octyle et décyle.
Plus
particulièrement, les radicaux alkyles sont choisis parmi les radicaux
méthyle, éthyle,
propyle, isopropyle, butyle, isobutyle, tertiobutyle, pentyle, isoamyle, amyle
et hexyle.
Selon la présente invention, par radical alkyle inférieur, on entend un
radical alkyle tel que
précédemment défini et comprenant de 1 à 4 atomes de carbone et,
avantageusement, 1 à 3
atomes de carbone. Ainsi, de préférence, de tels radicaux sont choisis parmi
les radicaux
méthyle, éthyle, propyle, isopropyle, butyle, isobutyle et tertiobutyle.
Selon la présente invention, par radical aryle, on entend un phenyle ou un
naphtyle non
substitué.
Selon la présente invention, par radical aryle substitué, on entend un phényle
ou un naphtyle
substitué par un ou plusieurs atomes ou groupes d'atome choisis parmi :
alkyle, alkoxy,
halogène, hydroxy, cyano, trifluorométhyle et nitro.
Le radical aryle substitué est de préférence choisi parmi les radicaux
phényles
monosubstitués par un radical alkoxy inférieur et les radicaux naphtyles
monosubstitués par
un radical alkyle inférieur.
Selon la présente invention, par radical aralkyle, on entend un alkyle
substitué par un
phényle ou un naphtyle non substitué.
De préférence, le radical aralkyle est un radical benzyle ou phénéthyle.
Selon la présente invention, par radical aralkyle substitué, on entend un
radical aralkyle
substitué par un ou plusieurs atomes ou groupes d'atome choisis parmi :
alkyle, alkoxy,
halogène, hydroxy, cyano, trifluorométhyle et nitro.
Le radical aralkyle substitué est de préférence choisi parmi les radicaux
phénéthyles et
benzyles monosubstitués par un radical alkyle inférieur.
Selon la présente invention, par atome d'halogène, on entend un atome de
fluor, de chlore,
de brome ou d'iode.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
Selon la présente invention, par radical hydroxyle, on entend le radical -OH.
Selon la présente invention, par radical alkoxy, on entend un atome d'oxygène
substitué par
un alkyle.
5 Les radicaux alkoxy sont de préférence les radicaux méthoxy, éthoxy,
isopropyloxy, n-
propyloxy, tertio-butoxy, n-butoxy, n-pentyloxy et n-hexyloxy.
Selon la présente invention, par radical alkoxy inférieur, on entend un atome
d'oxygène
substitué par un alkyle inférieur.
Selon la présente invention, par radical aralkoxy, on entend un atome
d'oxygène substitué
par un aralkyle.
Selon la présente invention, par radical polyéther, on entend un radical ayant
de 1 à 7
atomes de carbone interrompu par au moins un atome d'oxygène. De préférence,
le radical
polyéther est choisi parmi les radicaux tels que méthoxyéthoxy, éthoxyéthoxy,
éthoxyéthyle
ou méthoxyéthoxyéthoxy.
Parmi les composés de formule générale (I) ci-dessus rentrant dans le cadre de
la présente
invention, on peut notamment citer les suivants :
1. Acide (Z)-3-(4-{2-[4-(butane-1-sulfonyloxy)-phenyl]-ethoxy}-3-methoxy-
phenyl)-2-ethoxy-
acrylique
2. Acide (Z)-3-(4-{3-[4-(butane-1-sulfonyloxy)-3-methoxy-phenyl]-propyl}-3-
butoxy-phenyl)-2-
methoxy-acrylique
3. Acide (Z)-3-(4-{3-[4-(butane-1-sulfonyloxy)-3-methoxy-phenyl]- propyl}-3-
butoxy-phenyl)-2-
ethoxy-acrylique
4. Acide (E)-3-(4-{3-[4-(butane-1-sulfonyloxy)-3-methoxy-phenyl]- propyl}-3-
butoxy-phenyl)-2-
methyl-acrylique
5. Acide (Z)-3-{3-butoxy-4-[2-(4-methanesulfonyloxy-phenyl)-ethoxy]-phenyl}-2-
ethoxy-
acrylique
6. Acide (Z)-3-(4-{2-[4-(butane-1-sulfonyloxy)-phenyl]-ethoxy}-3-butoxy-
phenyl)-2-ethoxy-
acrylique
7. Acide (Z)-3-{3-butoxy-4-[2-(4-methanesulfonyloxy-3-methoxy-phenyl)-ethoxy]-
phenyl}-2-
ethoxy- acrylique
8. Acide (Z)-3-(4-{2-[4-(butane-1-sulfonyloxy)-3-methoxy-phenyl]-ethoxy}-3-
butoxy-phenyl)-2-
ethoxy-acrylique
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
6
9. Acide (Z)-3-(4-{2-[4-(butane-l-sulfonyloxy)-2-methoxy-phenyl]-ethoxy}-3-
butoxy-phenyl)-2-
ethoxy-acrylique
10. Acide (Z)-3-{3-butoxy-4-[2-(4-methanesulfonyloxy-2-methoxy-phenyl)-ethoxy]-
phenyl}- 2-
ethoxy-acrylique
11. Acide (Z)-3-{3-butoxy-4-[2-(4-ethoxy-3-fluoro-phenyl)-ethoxy]-phenyl}-2-
ethoxy-acrylique
12. Acide (Z)-3-{3-butoxy-4-[2-(3-fluoro-4-pentyloxy-phenyl)-ethoxy]-phenyl}-2-
ethoxy-
acrylique
13. Acide (Z)-3-(4-{2-[4-(butane-1-sulfonyloxy)-3-fluoro-phenyl]-ethoxy}-3-
butoxy-phenyl)-2-
ethoxy- acrylique
14. Acide (Z)-3-{3-butoxy-4-[2-(3-chloro-4-ethoxy-phenyl)-ethoxy]-phenyl}-2-
ethoxy-acrylique
15. Acide (Z)-3-{3-butoxy-4-[2-(3-chloro-4-pentyloxy-phenyl)-ethoxy]-phenyl}-2-
ethoxy-
acrylique
16. Acide (Z)-3-{3-butoxy-4-[2-(3-chloro-4-methanesulfonyloxy-phenyl)-ethoxy]-
phenyl}-2-
ethoxy-acrylique)
17. Acide (Z)-3-(4-{2-[4-(butane-1-sulfonyloxy)-3-chloro-phenyl]-ethoxy}-3-
butoxy-phenyl)-2-
ethoxy- acrylique
18. Acide (Z)-2-éthoxy-3-{4-[2-(4-methanesulfonyloxy-phenyl)-ethoxy]-3-methoxy-
phenyl}-
acrylique
19. Acide (Z)-2-éthoxy-3-{4-[2-(4-ethoxy-phenyl)-ethoxy]-3-methoxy-phenyl}-
acrylique
20. Acide (Z)-2-éthoxy-3-{3-methoxy-4-[2-(4-pentyloxy-phenyl)-ethoxy]-phenyl}-
acrylique
21. Acide (Z)-3-{4-[2-(4-acetylamino-phenyl)-ethoxy]-3- butoxy-phenyl}-2-
ethoxy-acrylique
22. Acide (Z)-3-(4-{2-[4-(butane-1-sulfonylamino)-phenyl]-ethoxy}-3-butoxy-
phenyl)-2-
ethoxy- acrylique
23. Acide (Z)-3-(3-butoxy-4-{2-[4-(méthanesulfonyl-méthyl-amino)-phenyl]-
ethoxy} -phenyl)-
2-éthoxy-acrylique
24. Acide (Z)-3-{3-butoxy-4-[2-(4-methanesulfonylamino-phenyl)-ethoxy]-phenyl}-
2-ethoxy-
acrylique
25. Acide (Z)-3-[4-(2-{4-[(butane-1-sulfonyl)-methyl-amino]-phenyl}-ethoxy)-3-
butoxy-phenyl]-
2- ethoxy-acrylique
26. Acide (Z)-3-{3-butoxy-4-[3-(4-methoxy-phenyl)-propyl]-phenyl}- 2-ethoxy-
acrylique
27. Acide (Z)-3-(4-{2-[4-(acétyl-méthyl-amino)-phenyl]-éthoxy}-3-butoxy-
phenyl)-2-ethoxy-
acrylique
28. Acide (Z)-3-{3-butoxy-4-[2-(4-propionylamino-phenyl)-ethoxy]- phenyl}-2-
ethoxy-acrylique
29. Acide (E)-3-(4-{3-[4-(butane-1-sulfonyloxy)-phenyl]-propyl}-3-butoxy-
phenyl)-2-methoxy-
acrylique
30. (Z)-3-[4-{3-[4-(butane-1-sulfonyloxy)-phenyl]-propyl}-3-(2-ethoxy-ethoxy)-
phenyl]-2-
methoxy-acrylate de méthyle
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
7
31. Acide (E)-3-(4-{2-[4-(butane-1-sulfonyloxy)-phenyl]-ethoxy}-3-butoxy-
phenyl)-2-methoxy-
acrylique
32. (Z)-3-(4-{2-[4-(butane-1-sulfonyloxy)-phenyl]-ethoxy}-3-butoxy-phenyl)-2-
ethoxy-acrylate
d'éthyle
33. Acide (Z)-3-(4-{2-[4-(benzoyl-methyl-amino)-phenyl]-ethoxy}-3-butoxy-
phenyl)-2-
methoxy-acrylique
34. Acide (Z)-3-[4-{2-[4-(butane-1-sulfonylamino)-phenyl]-ethoxy}-3-(2-ethoxy-
ethoxy)-
phenyl]-2-ethoxy-acrylique
35. Acide (Z)-3-(3-butoxy-4-{2-[4-(2-m-tolyl-ethanesulfonylamino)-phenyl]-
ethoxy}-phenyl)-2-
ethoxy-acrylique
36. Acide (Z)-3-(3-butoxy-4-{2-[4-(3-ethoxy-benzoylamino)-phenyl]-ethoxy}-
phenyl)-2-ethoxy-
acrylique
37. Acide (Z)-3-(3-butoxy-4-{2-[4-(methyl-naphthalen-1-ylmethyl-amino)-phenyl]-
ethoxy}-
phenyl)-2-methoxy-acrylique
38. Acide (Z)-3-{3-benzyloxy-4-[3-(4-m-tolylmethanesulfonyloxy-phenyl)-propyl]-
phenyl}-2-
methoxy-acrylique
39. Acide (Z)-3-{3-hydroxy-4-[3-(4-m-tolylmethanesulfonyloxy-phenyl)-propyl]-
phenyl}-2-
methoxy-acrylique
Selon la présente invention, les composés préférés répondant à la formule
générale (I) sont
ceux qui présentent l'une au moins des caractéristiques suivantes
- R, est un radical hydroxyle,
- R2 est un radical alkyle inférieur ou un radical alkoxy inférieur,
- R3 représente un radical alkyle ou un radical polyéther,
- R4 représente un atome d'hydrogène, un radical alkoxy inférieur ou un
halogène,
- R5 représente un radical alkyle,
- X représente un atome d'oxygène ou un groupement CH2,
- Y représente un enchaînement -NR6SO2 ou un enchaînement -OS02 avec R6 tel
que
précédemment défini.
Selon la présente invention, les composés particulièrement préférés répondant
à la formule
générale (I) sont ceux qui présentent l'une au moins des caractéristiques
suivantes
- R, est un radical hydroxyle,
- R2 est un radical alkoxy inférieur,
- R3 représente un radical alkyle,
- R4 représente un atome d'hydrogène, un radical alkoxy inférieur ou un
halogène,
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
8
- R5 représente un radical alkyle,
- X représente un atome d'oxygène ou un groupement CH2,
- Y représente un enchaînement -OS02.
Une description générale des méthodes de préparation des composés de formule
générale
(I) est donnée ci-après, en référence aux schémas des figures 1, 2, 3, 4 et 5.
Sur ces
schémas et dans la description du procédé qui va suivre, à moins qu'il ne soit
spécifié
autrement, tous les substituants sont tels que définis pour les composés de
formule générale
(I).
Comme présenté sur la figure 1, les composés de formule générale (I) pour
lesquels X O
peuvent être obtenus à partir des intermédiaires de formule générale (3):
R3 O
1
O
I R1
R2
O
R4
Z=NH,O
ZI~ P P= groupement protecteur
(3)
L'obtention des dérivés (3) peut être réalisée par réaction de Mitsunobu entre
les dérivés de
formule générale (1)
OH
R4
Z~I P (1)
et les composés de formule générale (2)
O
I \ \ R1
/ R2
HO
O
R3 (2)
en présence de triphénylphosphine et de diéthylazodicarboxylate par exemple.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
9
Le schéma de la figure 2 décrit des méthodes d'obtention des dérivés de
formule générale
(1) et (2).
Les composés de formule générale (2) sont généralement obtenus par réaction de
Wittig ou
de Horner-Emmons entre leurs précurseurs aldéhydes et les phosphonates (par
exemple
(diéthoxy-phosphoryl)-éthoxy-acétate d'éthyle) ou phosphoniums (par exemple,
chlorure de
1-méthoxycarbonyl-éthyl- triphényl phosphonium) correspondants.
Les dérivés de formule générale (1) peuvent être obtenus après réaction de
protection par
un groupement P des intermédiaires de type (4-amino-phényl)-acétate de
méthyle, (4-
hydroxy -phényl)-acétate de méthyle puis réduction par du borohydrure de
lithium ou à partir
des intermédiaires de type 4-aminobenzaldéhyde , 4-hydroxybenzaldéhyde par
réaction
d'Horner- Emmons avec du diéthyl méthylphosphonate puis protection du
groupement Z et
oxydation en présence du dimère de 9-borabicyclo[3.3.1] nonane.
Comme présenté sur la figure 1, après déprotection du groupement protecteur P
des
composés de formule générale (3), on obtient les composés de formule générale
(3').
R3 O
O \ \ R1
R2
R4
Z=NH,O
Z~
" (3')
Le procédé conduisant des composés de formule générale (3') aux composés de
formule
générale (4)
R3 O
1
(J I R1
O R2
R4
Y
~R5 (4)
comprend les étapes suivantes :
a) soit une addition sur un chlorure d'acide sulfonique (R5SO2CI)
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
b) soit une addition sur un halogénure d'acide carboxylique (par exemple
R5COCI)
c) soit une réaction avec un dérivé halogéné (par exemple R5Br ou R5CI) en
présence
d'une base telle que l'hydrure de sodium ou le carbonate de potassium.
Les dérivés ainsi obtenus peuvent éventuellement être alkylés par réaction
avec un dérivé
5 halogéné (par exemple R6Br ou R6CI) en présence d'une base telle que
l'hydrure de sodium
ou le carbonate de potassium.
Dans le cas des composés pour lesquels Y correspond à un groupement de type
NR6,
NR6CO ou NR6SO2, les composés (4) peuvent également être obtenus à partir de
dérivés 4-
nitrophénéthylalcools par réaction de Mitsunobu avec le composé (2) par
exemple puis
10 réduction du groupement nitro en fonction amine en présence de chlorure
d'étain dihydrate
par exemple (figure 3).
Les composés de formule générale (5)
R3 O
1
O
OH
R2
O
R4
Y
~I R5 (5)
sont ensuite obtenus par réaction de saponification des composés de formule
générale (4)
en présence d'hydroxyde de sodium dans un mélange de tétrahydrofurane et d'eau
ou
d'acétone et d'eau par exemple.
Une autre alternative pour l'obtention des composés de formule générale (I)
avec X = O est
présentée dans le schéma réactionnel de la figure 4 en utilisant des
conditions de réaction,
analogues à celles utilisées dans le schéma réactionnel de la figure 1.
Comme présenté sur la figure 5, les composés de formule générale (I) pour
lesquels X =CH2
peuvent être obtenus à partir des intermédiaires de formule générale (10) :
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
11
R3
0
R4
Y, R5 (10)
L'obtention des dérivés de formule générale (10) peut être réalisée par
réaction de type Heck
entre les composés de formule générale (8)
R4
Y\R5 (ô)
et un halogénure de benzène (les dérivés iodés (9) par exemple),
R3
1
0
0
(9)
en présence d'un catalyseur au palladium (par exemple, du palladium (II)
acétate en
présence d'une phosphine).
Le procédé permettant la synthèse des composés de formule générale (8) à
partir de dérivés
de type 4-allylphénol ou 4-allyl-phénylamine (composé (7) de la figure 5)
comprend les
étapes suivantes :
a) soit une addition sur un chlorure d'acide sulfonique (R5SO2C1)
b) soit une addition sur un halogénure d'acide carboxylique (par exemple
R5COCI)
c) soit une réaction avec un dérivé halogéné (par exemple R5Br ou R5CI) en
présence
d'une base telle que l'hydrure de sodium ou le carbonate de potassium.
Les dérivés ainsi obtenus peuvent éventuellement être alkylés par réaction
avec un dérivé
halogéné (par exemple R6Br ou R6CI) en présence d'une base telle que l'hydrure
de sodium
ou le carbonate de potassium.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
12
Les dérivés iodés (9) sont préalablement préparés par iodation de l'acide 3-
hydroxy
benzoique, estérification et substitution du phénol par un dérivé halogéné de
type R3Br par
exemple.
Après hydrogénation de la double liaison des composés de formule générale
(10), on obtient
les composés de formule générale (11).
R3 O
O I \ O
R4
Y, R5 (11)
Le procédé conduisant des composés de formule générale (11) aux composés de
formule
générale (15) comprend les étapes suivantes :
a) une réduction de l'ester méthylique en alcool de formule générale (12)
R3
OH
R4
Y, R5 (12)
en présence d'un réducteur comme le borohydrure de lithium par exemple.
b) une oxydation de l'alcool de formule générale (12) en aldéhyde de formule
générale
(13)
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
13
R3 O
1
(J
H
R4
Y, R5 (13)
en présence d'un oxydant tel que le dioxyde de manganèse par exemple.
c) une réaction de Wittig ou de Horner-Emmons entre les précurseurs aldéhydes
de
formule générale (13) et les phosphonates (par exemple (diéthoxy-phosphoryl)-
éthoxy-acétate d'éthyle) ou phosphoniums (par exemple, chlorure de 1-
méthoxycarbonyl-éthyl- triphényl phosphonium) correspondants pour conduire aux
composés de formule générale (14).
R3 O
1
O R1
I R2
R4
Y, R5 (14)
d) une réaction de saponification des composés de formule générale (14) en
présence
d'hydroxyde de sodium par exemple dans un mélange de tétrahydrofurane et d'eau
ou dans un mélange d'acétone et d'eau pour conduire aux composés de formules
générale (15).
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
14
R3 O
O \ \ OH
R2
R4
Y, R5 (15)
Les groupes fonctionnels éventuellement présents dans les intermédiaires
réactionnels
utilisés dans le procédé peuvent être protégés, soit sous forme permanente,
soit sous forme
temporaire, par des groupes protecteurs qui assurent une synthèse univoque des
composés
attendus. Les réactions de protection et déprotection sont effectuées selon
des techniques
bien connues de l'homme du métier. Par groupe protecteur temporaire des
amines, alcools
ou des acides carboxyliques on entend les groupes protecteurs tels que ceux
décrits dans
Protective Groups in Organic Chemistry , ed McOmie J. W. F., Plenum Press,
1973,
dans Protective Groups in Organic Synthesis , 2nde édition, Greene T.W. et
Wuts P.G.M.,
ed John Wiley et Sons, 1991 et dans Protecting Groups , Kocienski P.J.,
1994, Georg
Thieme Verlag.
Les composés selon l'invention présentent des propriétés modulatrices des
récepteurs de
type PPARs. Cette activité sur les récepteurs PPARa, â et y est mesurée dans
un test de
transactivation et quantifiée par la constante de dissociation Kdapp
(apparent), tel que décrit
à l'exemple 29.
Les composés préférés de la présente invention présentent une constante de
dissociation
inférieure ou égale à 1000 nM, et avantageusement inférieure ou égale à 100
nM.
De préférence, les composés sont des modulateurs des récepteurs de type PPARy
spécifique, c'est à dire qu'ils présentent un rapport entre le Kdapp pour les
récepteurs
PPARa ou PPARâ, et le Kdapp pour les récepteurs PPARy, supérieur ou égal à 10.
De
préférence, ce rapport PPAR/PPARy ou PPARâ/PPARy est supérieur ou égal à 50
et plus
avantageusement supérieur ou égal à 100.
La présente invention a également pour objet à titre de médicament les
composés de
formule générale (I) tels que décrits ci-dessus.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
Ainsi les composés tels que décrits précédemment selon l'invention peuvent
être utilisés
dans la fabrication d'un médicament destiné à réguler et/ou à restaurer le
métabolisme des
lipides cutanés.
5 L'invention a également pour objet un produit choisi parmi les composés de
formule (I) pour
son utilisation dans le traitement et/ou la prévention des désordres ci-
dessous.
Les composés selon l'invention conviennent particulièrement bien dans les
domaines de
traitement suivants :
10 1) pour traiter les affections dermatologiques liées à un désordre de la
kératinisation portant
sur la différenciation et sur la prolifération, notamment pour traiter les
acnés vulgaires,
comédoniennes, polymorphes, rosacées, les acnés nodulokystiques, conglobata,
les acnés
séniles, les acnés secondaires telles que l'acné solaire, médicamenteuse ou
professionnelle,
2) pour traiter d'autres types de troubles de la kératinisation, notamment les
ichtyoses, les
15 états ichtyosiformes, la maladie de Darrier, les kératodermies
palmoplantaires, les
leucoplasies et les états leucoplasiformes, le lichen cutané ou muqueux
(buccal),
3) pour traiter d'autres affections dermatologiques avec une composante immuno-
allergique
inflammatoire, avec ou sans trouble de la prolifération cellulaire, et
notamment toutes les
formes de psoriasis, qu'il soit cutané, muqueux ou unguéal, et même le
rhumatisme
psoriasique, ou encore l'atopie cutanée, telle que l'eczéma ou l'atopie
respiratoire ou encore
l'hypertrophie gingivale,
4) pour traiter toutes les proliférations dermiques ou épidermiques qu'elles
soient bénignes
ou malignes, qu'elles soient ou non d'origine virale telles que verrues
vulgaires, les verrues
planes et l'épidermodysplasie verruciforme, les papillomatoses orales ou
florides, le
lymphome T, et les proliférations pouvant être induites par les ultra-violets
notamment dans
le cas des épithélioma baso et spinocellulaires, ainsi que toute lésion
précancéreuse
cutanées telles que les kératoacanthomes,
5) pour traiter d'autres désordres dermatologiques tels que les dermatoses
immunes telles le
lupus érythémateux, les maladies immunes bulleuses et les maladies du
collagène, telle la
sclérodermie,
6) dans le traitement d'affections dermatologiques ou générales à composante
immunologique,
7) dans le traitement de désordres cutanés dus à une exposition aux
rayonnements U.V.
ainsi que pour réparer ou lutter contre le vieillissement de la peau, qu'il
soit photo-induit ou
chronologique, ou pour réduire les pigmentations et les kératoses actiniques,
ou toutes
pathologies associées au vieillissement chronologique ou actinique, telle la
xérose,
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
16
8) pour lutter contre les troubles de la fonction sébacée tels que
l'hyperséborrhée de l'acné
ou la séborrhée simple,
9) pour prévenir ou traiter les troubles de la cicatrisation, ou pour prévenir
ou pour réparer
les vergetures,
10) dans le traitement des désordres de la pigmentation, tel
l'hyperpigmentation, le
mélasma, l'hypopigmentation ou le vitiligo,
11) dans le traitement des affections du métabolisme des lipides, tel
l'obésité,
l'hyperlipidémie, ou le diabète non insulino-dépendant,
12) dans le traitement d'affections inflammatoires telles que l'arthrite,
13) dans le traitement ou la prévention des états cancéreux ou précancéreux,
14) dans la prévention ou le traitement de l'alopécie de différentes origines,
notamment
l'alopécie due à la chimiothérapie ou aux rayonnements,
15) dans le traitement des troubles du système immunitaire, tel l'asthme, le
diabète sucré de
type I, la sclérose en plaque, ou autres disfonctionnements sélectifs du
système immunitaire,
16) dans le traitement d'affections du système cardiovasculaire telles que
l'artériosclérose ou
l'hypertension.
La présente invention a également pour objet une composition pharmaceutique ou
cosmétique comprenant, dans un milieu physiologiquement acceptable, au moins
un
composé de formule générale (I) tel que défini ci-dessus.
Par milieu physiologiquement acceptable, on entend un milieu compatible avec
la peau, les
muqueuses et les phanères.
La présente invention a aussi pour objet l'utilisation des composés de formule
générale (I)
pour fabriquer un médicament destiné au traitement des affections
susmentionnées, en
particulier pour réguler et/ou restaurer le métabolisme des lipides cutanés.
L'administration de la composition selon l'invention peut être effectuée par
voie orale,
enterale, parentérale topique ou oculaire. De préférence, la composition
pharmaceutique est
conditionnée sous une forme convenant à une application par voie topique. Par
voie topique,
on entend une administration sur la peau ou les muqueuses.
Par voie orale, la composition, plus particulièrement la composition
pharmaceutique, peut se
présenter sous formes de comprimés, de gélules, de dragées, de sirops, de
suspensions, de
solutions, de poudres, de granulés, d'émulsions, de microsphères ou
nanosphères ou
vésicules lipidiques ou polymériques permettant une libération contrôlée. Par
voie
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
17
parentérale, la composition peut se présenter sous forme de solutions ou
suspensions pour
perfusion ou pour injection.
Les composés selon l'invention sont généralement administrés à une dose
journalière
d'environ 0,001 mg/kg à 100 mg/kg de poids corporel, en 1 à 3 prises.
Les composés sont utilisés par voie systémique à une concentration
généralement comprise
entre 0,001 et 10% en poids, de préférence entre 0,01 et 1% en poids, par
rapport au poids
de la composition.
Par voie topique, la composition pharmaceutique selon l'invention est plus
particulièrement
destinée au traitement de la peau et des muqueuses et peut se présenter sous
forme
d'onguents, de crèmes, de laits, de pommades, de poudres, de tampons imbibés,
de
solutions, de gels, de sprays, de lotions ou de suspensions. Elle peut
également se
présenter sous forme de microsphères ou nanosphères ou vésicules lipidiques ou
polymériques ou de patches polymériques et d'hydrogels permettant une
libération contrôlée.
Cette composition par voie topique peut se présenter sous forme anhydre, sous
forme
aqueuse ou sous la forme d'une émulsion.
Les composés sont utilisés par voie topique à une concentration généralement
comprise
entre 0,001 et 10% en poids, de préférence entre 0,01 et 1% en poids, par
rapport au poids
total de la composition.
Les composés de formule générale (I) selon l'invention trouvent également une
application
dans le domaine cosmétique, en particulier dans l'hygiène corporelle et
capillaire et plus
particulièrement pour réguler et/ou restaurer le métabolisme des lipides
cutanés.
L'invention a donc également pour objet l'utilisation cosmétique d'un composé
de formule (I)
ou d'une composition comprenant, dans un milieu physiologiquement acceptable,
au moins
un des composés de formule (I) pour l'hygiène corporelle ou capillaire.
La composition cosmétique selon l'invention contenant, dans un milieu
cosmétiquement
acceptable, au moins un composé de formule générale (I) ou l'un de ses
isomères optiques
ou géométriques ou l'un de ses sels, peut se présenter notamment sous forme
d'une crème,
d'un lait, d'une lotion, d'un gel, de microsphères ou nanosphères ou vésicules
lipidiques ou
polymériques, d'un savon ou d'un shampooing.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
18
La concentration en composé de formule générale (I) dans la composition
cosmétique est
comprise entre 0,001 et 3 % en poids, par rapport au poids total de la
composition.
Les compositions telles que décrites précédemment peuvent bien entendu en
outre contenir
des additifs inertes ou même pharmacodynamiquement actifs ou des combinaisons
de ces
additifs, et notamment : des agents mouillants; des agents dépigmentants tels
que
l'hydroquinone, l'acide azélaïque, l'acide cafëique ou l'acide kojique; des
émollients; des agents
hydratants comme le glycérol, le PEG 400, la thiamorpholinone, et ses dérivés
ou bien encore
l'urée; des agents antiséborrhéiques ou antiacnéiques, tels que la S-
carboxyméthylcystéine, la
S-benzyl-cystéamine, leurs sels ou leurs dérivés, ou le péroxyde de benzoyle;
des agents
antifongiques tels que le kétoconazole ou les polyméthylène-4,5
isothiazolidones-3; des
antibactériens, des caroténôides et, notamment, le [3-carotène; des agents
anti-psoriatiques tels
que l'anthraline et ses dérivés; les acides eicosa-5,8,11,14-tétraynoïque et
eicosa-5,8,11-
triynoïque, leurs esters et amides et enfin les rétinoïdes. Les composés de
formule générale (I)
peuvent également être combinés avec les vitamines D ou leurs dérivés, avec
des
corticostéroïdes, avec des anti-radicaux libres, des a-hydroxy ou a-céto
acides ou leurs dérivés,
ou bien encore avec des bloqueurs de canaux ioniques.
Ces compositions peuvent également contenir des agents d'amélioration de la
saveur, des
agents conservateurs tels que les esters de l'acide parahydroxybenzoïque, les
agents
stabilisants, des agents régulateurs d'humidité, des agents régulateurs de pH,
des agents
modificateurs de pression osmotique, des agents émulsionnants, des filtres UV-
A et UV-B,
des antioxydants, tels que l'a-tocophérol, le butylhydroxyanisole ou le
butylhydroxytoluène.
Bien entendu, l'homme du métier veillera à choisir le ou les éventuels
composés à ajouter à ces
compositions de telle manière que les propriétés avantageuses attachées
intrinsèquement à la
présente invention ne soient pas ou substantiellement pas altérées par
l'addition envisagée.
A titre d'illustration et sans aucun caractère limitatif, sont donnés ci-après
plusieurs exemples
d'obtention de composés actifs de formule générale (I) selon l'invention,
ainsi que des
résultats d'activité biologique de tels composés et diverses formulations
concrètes à base de
ces composés.
Exemple 1 : acide (Z)-3-(4-{2-[4-(butane-1-sulfonyloxy)-phenyl]-ethoxy}-
3-methoxy-phenyl)-2-ethoxy-acrylique
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
19
a- (diéthoxy_phosphorYl -éthoxv-acétate d'éthyle
18,5 g(112 mmoles) de chloro-éthoxy-acétate d'éthyle, 19,2 ml (112 mmoles) de
triéthylphosphite sont placés dans un ballon et chauffés à 150 C pendant 5
heures.
L'évolution de la réaction est suivie par RMN. 34g (100%) de (diéthoxy-
phosphoryl)-éthoxy-
acétate d'éthyle sont obtenus directement sous la forme d'un liquide incolore.
b- 3-méthoxv-4-(4-méthoxv-benzvloxv)-benzaldéhvde
5g (36,1 mmoles) de carbonate de potassium puis 4,9m1 (36,1 mmoles) de 1-
chlorométhyl-4-
methoxy-benzène sont additionnés à une solution de 5g (33 mmoles) de 4-hydroxy-
3-
méthoxy-benzaldéhyde dans 100m1 d'acétone. Le milieu réactionnel est ensuite
agité à 55 C
pendant 28 heures puis filtré. Le filtrat est concentré sous vide. Le résidu
obtenu est repris
dans l'heptane et filtré. 8,9g (100%) de 3-méthoxy-4-(4-méthoxy-benzyloxy)-
benzaldéhyde
sont obtenus sous la forme d'un solide beige.
c- LZ -2-éthoxv-3-(3-methoxv-4-(4-methoxv-benzvloxy -phenyil-acrvlate d'éthvle
0,48g (12 mmoles) d'hydrure de sodium 60% sont additionnés à une solution
préalablement
refroidie à 0 C de 3,25g (12 mmoles) de (diéthoxy-phosphoryl)-éthoxy-acétate
d'éthyle dans
35m1 de tétrahydrofuranne. Le milieu réactionnel est ramené à température
ambiante et agité
pendant 45 minutes puis 3g (11 mmoles) de 3-méthoxy-4-(4-méthoxy-benzyloxy)-
benzaldéhyde dans 40m1 de tétrahydrofurane sont additionnés. Après agitation à
température ambiante pendant 15 heures, de l'eau et de l'acétate d'éthyle sont
additionnés
puis le milieu réactionnel est extrait à l'acétate d'éthyle. La phase
organique est lavée par
une solution saturée de chlorure de sodium, séchée sur sulfate de magnésium,
filtrée,
évaporée. Le résidu est purifié par chromatographie sur colonne de silice élué
avec un
mélange heptane / acétate d'éthyle 80/20. 2,6g (43%) de (Z)-2-éthoxy-3-[3-
methoxy-4-(4-
methoxy-benzyloxy)-phenyl]-acrylate d'éthyle sont obtenus.
d- (Z)-2-éthoxy-3-(4-hydroxy-3-methoxy-phenyl)-acrylate d'éthyle
1,7m1 (22mmoles) d'acide trifluoroacétique sont ajoutés sur une solution de
1,7g
(4,4mmoles) de (Z)-2-éthoxy-3-[3-methoxy-4-(4-methoxy-benzyloxy)-phenyl]-
acrylate
d'éthyle dans 15m1 de dichlorométhane. Le mélange réactionnel est agité à
température
ambiante pendant 2 heures. Après addition d'eau, et d'une solution aqueuse
d'hydroxyde de
sodium 1M jusqu'à pH 8-9, le milieu réactionnel est extrait au
dichlorométhane. Les phases
organiques sont rassemblées, lavées à l'eau, séchées sur sulfate de sodium
puis les
solvants sont évaporés sous vide. Le résidu brut obtenu est purifié par
chromatographie sur
colonne de silice élué avec un mélange heptane/acétate d'éthyle 80/20 pour
donner 0,45g
(38%) de (Z)-2-éthoxy-3-(4-hydroxy-3-methoxy-phenyl)-acrylate d'éthyle.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
e- (4-(2-méthoxv-ethoxvmethoxx -phenyll-acétate de méthyle
0,53g (132mmoles) d'hydrure de sodium 60% sont ajoutés par portions sur une
solution à
0 C de 20g (120mmoles) de (4-Hydroxy-phenyl)-acétate de méthyle dilué dans
100m1 de
5 tétrahydrofuranne et 100m1 de diméthylformamide. Le mélange réactionnel est
agité à
température ambiante puis 15m1 (132mmoles) de 1-Chlorométhoxy-2-méthoxy-ethane
sont
additionnés goutte à goutte. Après agitation à température ambiante pendant 2
heures, puis
addition d'eau, le milieu réactionnel est extrait avec de l'acétate d'éthyle.
Les phases
organiques sont rassemblées, lavées par une solution saturée de chlorure de
sodium puis
10 séchées sur sulfate de magnésium. Après évaporation des solvants, 25g (86%)
de [4-(2-
méthoxy-ethoxymethoxy)-phenyl]-acétate de méthyle sont obtenus sous la forme
d'une huile
incolore.
f- 2-(4-(2-methoxv-ethoxvmethoxv)-phenvll-ethanol
15 2,7g (122,3 mmoles) de borohydrure de lithium sont ajoutés sur une solution
de 10g (41
mmoles) de [4-(2-Methoxy-ethoxymethoxy)-phenyl]-acétate de méthyle dans 100 ml
de
tetrahydrofurane. Le mélange réactionnel est agité à 60 C pendant 4h. Après
refroidissement, le mélange réactionnel est plongé dans un mélange glace et
solution
aqueuse de chlorure d'ammonium saturé, acidifié par une solution aqueuse
d'acide acétique
20 de concentration 1M puis extrait par de l'acétate d'éthyle. Les phases
organiques sont
rassemblées, lavées avec une solution saturée de chlorure de sodium, séchées
sur sulfate
de magnésium. Après évaporation des solvants, 8,9g (97%) de 2-[4-(2-methoxy-
ethoxymethoxy)-phenyl]-ethanol sous la forme d'une huile incolore.
ç)- (Z)-2-éthoxv-3-(3-methoxv-4-f2-r4-(2-methoxv-ethoxvmethoxv)-phenvll-
ethoxv)-phenvl)-
acrvlate d'éthvle
0,45g (1,70 mmoles) de 2-[4-(2-methoxy-ethoxymethoxy)-phenyl]-ethanol, 0,42g
(1,87 mmoles) de (Z)-2-éthoxy-3-(4-hydroxy-3-methoxy-phenyl)-acrylate d'éthyle
et 0,67g
(2,55 mmoles) de triphénylphosphine sont placés dans 10 ml de
tétrahydrofurane. Après
complète dissolution, 0,40m1 (2,55 mmoles) de diéthylazodicarboxylate sont
additionnés très
lentement puis le milieu réactionnel est agité à température ambiante pendant
24 heures.
Après évaporation sous vide, le résidu brut est purifié par chromatographie
sur colonne de
silice élué avec un mélange heptane/acétate d'éthyle 70/30 pour donner 0,41
g(51 %) de ~Z)-
2-éthoxy-3-(3-methoxy-4-{2-[4-(2-methoxy-ethoxymethoxy)-phenyl]-ethoxy}-
phenyl)-acrylate
d'éthyle sous la forme d'une huile incolore.
h- (Z -2-éthoxv-3-{4-(2-(4-hvdroxy_phenvi -ethoxy]-3-methoxy_phenYl}-acrvlate
d'éthyle
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
21
0,2m1 d'acide sulfurique sont additionnés sur une solution de 0,41g (0,86
mmoles) de (Z)-2-
éthoxy-3-(3-methoxy-4-{2-[4-(2-methoxy-ethoxymethoxy)-phenyl]-ethoxy}-phenyl)-
acrylate
d'éthyle dans 5ml de tetrahydrofurane et 5ml de méthanol. La réaction est
agitée à
température ambiante pendant 15 heures puis les solvants sont évaporés sous
vide. Après
addition d'eau et d'acétate d'éthyle, le milieu réactionnel est extrait à
l'acétate d'éthyle. La
phase organique est lavée par de l'eau, séchée sur sulfate de magnésium,
filtrée et
concentrée sous vide pour donner 0,31g (94%) de (Z)-2-éthoxy-3-{4-[2-(4-
hydroxy-phenyl)-
ethoxy]-3-methoxy-phenyl}-acrylate d'éthyle sous la forme d'une huile
incolore.
i- (Z)-3-(4-f214-(butane-1-sulfonyloxy)-phenyll-ethoxyl-3-methoxy-phenyl)-2-
ethoxy-acrylate
d'éthyle
0,11ml (0,88 mmoles) de chlorure de butanesulfonyle sont additionnés sur une
solution de
0,31g (0,80 mmoles) de (Z)-2-éthoxy-3-{4-[2-(4-hydroxy-phenyl)-ethoxy]-3-
methoxy-phenyl}-
acrylate d'éthyle et 0,14m1 (0,96 mmoles) de triéthylamine dans 7ml de
dichlorométhane. La
réaction est agitée à température ambiante pendantl5h. Après addition d'eau,
extraction au
dichlorométhane, les phases organiques sont rassemblées, lavées par de l'eau
puis séchées
sur sulfate de magnésium. Après évaporation des solvants, le résidu brut
obtenu est purifié
par chromatographie sur colonne de silice élué avec un mélange heptane/acétate
d'éthyle
70/30 pour donner 0,25g (62%) de (Z)-3-(4-{2-[4-(butane-1-sulfonyloxy)-phenyl]-
ethoxy}-3-
methoxy-phenyl)-2-ethoxy-acrylate d'éthyle sous la forme d'une huile incolore.
i- acide (Z)-3-(4-12-14-(butane-1-sulfonvloxv)-ahenvll-ethoxv)-3-methoxv-
phenvl)-2-ethoxv-
acrvliaue
1,7m1 (1,7mmoles) d'une solution aqueuse d'hydroxyde de sodium de
concentration 1M sont
additionnés sur une solution de 0,25g (0,49 mmoles) de (Z)-3-(4-{2-[4-(butane-
1-
sulfonyloxy)-phenyl]-ethoxy}-3-methoxy-phenyl)-2-ethoxy-acrylate d'éthyle dans
10m1 de
tétrahydrofurane. Le mélange réactionnel est agité à 68 C pendant 48h. Après
refroidissement, la réaction est traitée par l'addition de 3ml d'une solution
aqueuse d'acide
chlorhydrique de concentration 1M ainsi que 20m1 d'eau puis extraite avec de
l'acétate
d'éthyle. Les phases organiques sont rassemblées, lavées par une solution
saturée de
chlorure de sodium, séchées sur sulfate de magnésium, filtrées. Après
évaporation des
solvants, le produit est recristallisé dans un mélange pentane/acétone pour
obtenir 0,15g
(65%) d'acide (Z)-3-(4-{2-[4-(butane-1-sulfonyloxy)-phenyl]-ethoxy}-3-methoxy-
phenyl)-2-
ethoxy-acrylique sous la forme d'un solide blanc de point de fusion 94 C.
RMN'H (8, CDCI3) : 1,00 (t, 3H, J= 7,4Hz); 1,43 (t, 3H, J=7,1Hz); 1,51 (m,
2H); 1,98 (m, 2H);
3,20 (t, 2H, J=7,1 Hz); 3,26 (t, 2H, J=7,8Hz); 3,92 (s, 3H); 4,06 (q, 2H,
J=7,4Hz); 4,27 (t, 2H,
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
22
J=7,1 Hz); 6,86 (d, 1 H, J=8,4Hz); 7,13 (s, 1 H); 7,23-7,28 (m, 3H); 7,36 (d,
1 H, J= 8,4Hz); 7,62
(s, 1 H).
Exemple 2 : acide (Z)-3-(4-{3-[4-(butane-1-sulfonyloxy)-3-methoxy-
phenyl]-propyl}-3-butoxy-phenyl)-2- methoxy-acrylique
a- acide 3-hvdroxy-4-iodo-benzoique
21g (520 mmoles) d'hydroxyde de sodium puis 79g (520 mmoles) d'iodure de
sodium sont
ajoutés sur une solution de 69g (500 mmoles) d'acide 3-hydroxybenzoïque dans
700m1 de
méthanol. Le mélange réactionnel est refroidi à 0 C puis on ajoute goutte à
goutte de l'eau
de javel (520 mmoles). Le milieu réactionnel est agité à 0-5 C pendant 2
heures puis à
température ambiante pendantl5h. Après évaporation du méthanol, le milieu
réactionnel est
acidifié avec une solution d'acide chlorhydrique concentré. Le produit
précipité est filtré, lavé
à l'eau et séché. 41,9g d'acide 3-hydroxy-4-iodo-benzoïque sont obtenus sous
forme d'un
solide blanc de point de fusion 218 C. La phase aqueuse est extraite à
l'acétate d'éthyle, la
phase organique obtenue est séchée sur sulfate de magnésium, filtrée,
évaporée. Le résidu
obtenu est repris dans l'heptane et le précipité obtenu est filtré.
Au bilan, 61,3g (56%) d'acide 3-hydroxy-4-iodo-benzoïque sont obtenus.
b- 3-hydroxy-4-iodo-benzoate de méthvle
6,1g (35,6 mmoles) d'acide paratoluène sulfonique sont ajoutés sur une
solution de 47g
(150 mmoles) d'acide 3-hydroxy-4-iodo benzoïque dans 300m1 de méthanol. Le
mélange
réactionnel est chauffé à 70 C pendant 48 heures. Après addition de 1000ml
d'eau, le
produit précipité est filtré, rincé à l'eau jusqu'à pH neutre. 37.4g (76%) de
3-hydroxy-4-iodo
benzoate de méthyle sont obtenus sous forme d'une poudre beige.
c- 3-butoxy-4-iodo-benzoate de méthy/e
14,7m1 (130 mmoles) d'iodobutane sont ajoutés sur une solution de 30g (110
mmoles) de 3-
hydroxy-4-iodo benzoate de méthyle et 17,9 g (130 mmoles) de carbonate de
potassium
dans 300m1 de 2-butanone. Le mélange réactionnel est chauffé à 60 C pendant 16
heures.
Après addition de 100m1 d'eau puis extraction avec de l'acétate d'éthyle, les
phases
organiques sont rassemblées, séchées sur sulfate de sodium, filtrées. Les
solvants sont
évaporés puis le résidu est repris dans l'heptane et filtré. 18,2g de 3-butoxy-
4-iodo-benzoate
de méthyle sous forme de cristaux blancs sont obtenus. Le filtrat est
concentré et le résidu
est purifié par chromatographie sur colonne de silice élué avec un mélange
heptane/acétate
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
23
d'éthyle 8/2, 11,6g de 3-butoxy-4-iodo-benzoate de méthyle sont ainsi obtenus.
29,8g (82%)
de 3-butoxy-4-iodo-benzoate de méthyle sont ainsi obtenus.
d- 1-butane su/fonate de 4-al/vl-2-methoxv-ahenvle
13m1 (100 mmoles) de chlorure de butanesulfonyle sont ajoutés goutte à goutte
sur une
solution de 15g (90 mmoles) d'eugenol et de 16m1 (110 mmoles) de triéthylamine
dans
150m1 de dichlorométhane préalablement refroidie à-20 C puis le mélange
réactionnel est
agité pendant 4 heures à température ambiante. Après addition de 50 ml d'eau
et extraction
au dichlorométhane, la phase organique est séchée sur sulfate de sodium,
filtrée et
évaporée. Le résidu brut est purifié par chromatographie sur colonne de silice
élué avec un
mélange heptane/acétate d'éthyle 90/10. 24,3g (74%) de 1-butane sulfonate de 4-
allyl-2-
methoxy-phenyle sont obtenus sous forme d'une huile jaune.
e- 4-{(E)-3-[4-(butane-1-sulfonvloxv)-3-methoxv-phenv/l-propenvll-3-butoxv-
benzoate de
methvle
42mg (0,12 mmoles) de 2-(dicyclohexylphosphino)biphényle, 13mg (0,06 mmoles)
d'acétate
de palladium puis 0,63m1 (4,5mmoles) de triéthylamine sont ajoutés sur une
solution de 1g (3
mmoles) de 3-butoxy-4-iodo-benzoate de méthyle et 0,85g (3 mmoles) de 1-butane
sulfonate
de 4-allyl-2-methoxy-phenyle dans 10 ml de diméthylformamide. Le mélange
réactionnel est
chauffé à 90 C pendant 15 heures. Après addition de 20 ml d'eau puis
extraction avec de
l'acétate d'éthyle, les phases organiques sont rassemblées, lavées avec une
solution
saturée de chlorure de sodium et séchées sur sulfate de sodium, filtrées,
évaporées. Le
résidu brut obtenu est purifié par chromatographie sur colonne de silice élué
avec un
mélange heptane/acétate d'éthyle 80/20. 1,2g (81 %) de 4-{(E)-3-[4-(butane-1-
sulfonyloxy)-3-
methoxy-phenyl]-propenyl}-3-butoxy-benzoate de méthyle sont obtenus sous forme
d'une
huile jaune.
f- 4-{3-(4-(butane-1-sulfonvloxy)-3-methoxy_phenyil-prolpvll-3-butoxv-benzoate
de méthvle
0,7g de palladium sur charbon 10% sont ajoutés sur une solution de 7g (14,3
mmoles) de 4-
{(E)-3-(butane-1-sulfonyloxy)-3-methoxy-phenyl]-propenyl}-3-butoxy-benzoate de
méthyle
dans 250m1 de méthanol. Le mélange réactionnel est mis sous pression
atmosphérique
d'hydrogène et agité pendant 12 heures à température ambiante. Le milieu
réactionnel est
filtré sur célite, rincé au dichlorométhane puis les solvants sont évaporés et
le résidu est
purifié par chromatographie sur colonne de silice élué avec un mélange
heptane/acétate
d'éthyle 90/10. 5,21g (75%) de 4-{3-[4-(butane-1-sulfonyloxy)-3-methoxy-
phenyl]-propyl}-3-
butoxy-benzoate de méthyle sont obtenus sous forme d'une huile incolore.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
24
g- 1-butane su/fonate de 4-(3-(2-butoxv-4-hvdroxvmethvl-phenvl -propvll-2-
methoxyphenvle
0,69 (32 mmoles) de borohydrure de lithium sont ajoutés sur une solution de
5,2 g
(11 mmoles) de 4-{3-[4-(butane-1-sulfonyloxy)-3-methoxy-phenyl]-propyl}-3-
butoxy-benzoate
de méthyle dans 50m1 de tétrahydrofuranne. Le mélange réactionnel est chauffé
à 60 C
pendant 15 heures puis hydrolysé délicatement dans une solution glacée et
saturée de
chlorure d'ammonium. Le milieu réactionnel est neutralisé avec de l'acide
chlorhydrique
concentré puis extrait avec de l'acétate d'éthyle. Les phases organiques sont
lavées avec de
l'eau, séchées sur sulfate de sodium, filtrées, évaporées. Le résidu est
purifié par
chromatographie sur colonne de silice élué avec un mélange heptane/acétate
d'éthyle 70/30.
4,21g (86%) de 1-butane sulfonate de 4-[3-(2-butoxy-4-hydroxymethyl-phenyl)-
propyl]-2-
methoxy-phenyle sont obtenus sous forme d'une huile incolore
h- 1-butane su/fonate de 4-I3-(2-butoxv-4-formvl-phenvl)-propv/1-2-methoxv-
phenvle
7,9g (9,1 mmoles) d'oxyde de manganèse sont ajoutés sur une solution de 4,2g
(9,1
mmoles) de 1-butane sulfonate de 4-[3-(2-butoxy-4-hydroxymethyl-phenyl)-
propyl]-2-
methoxy-phenyle dans 300m1 de dichlorométhane. Le mélange réactionnel est
agité pendant
15 heures à température ambiante. Le milieu réactionnel est filtré sur célite,
rincé au
dichlorométhane. Les solvants sont évaporés. 3,95g (94%) de 1-butane sulfonate
de 4-[3-
(2-butoxy-4-formyl-phenyl)-propyl]-2-methoxy-phenyle sont obtenus sous forme
d'une huile
jaune.
i- chlorure de méthoxv-méthoxvcarbonvl-méthv/ triphénvl-phosphonium
25g (186 mmoles) de diméthoxyacétate de méthyle sont ajoutés à 27m1 (215
mmoles) de
chlorure d'acétyle à température ambiante. 0,1g (0,2% molaire) d'iode sont
ajoutés puis le
mélange réactionnel est agité à 55 C pendant 16 heures. L'excès de chlorure
d'acétyle est
évaporé sous vide puis le résidu est dissous dans 100m1 de dichlorométhane.
49g (204
mmoles) de triphénylphosphine sont ajoutés puis le mélange réactionnel est
agité à 37 C
pendant 3 heures. Les solvants sont évaporés et le résidu est cristallisé dans
de l'éther
diisopropylique. 70g (88%) de chlorure de (méthoxy-méthoxycarbonyl-méthyl)-
triphenyl-
phosphonium sont obtenus.
j - (Z)-3-(4-(3-[4-(butane-1-su/fonv/oxv)-3-methoxv-phenvll-propvll-3-butoxv-
phenvl)-2-
methoxv-acrvlate de méthyle
1,3g (4 mmoles) de chlorure de méthoxy-méthoxycarbonyl-méthyl triphényl-
phosphonium, et
0,45 ml (3,24 mmoles) de triethylamine sont ajoutés sur une solution de 1g
(2,16 mmoles) de
1-butane sulfonate de 4-[3-(2-butoxy-4-formyl-phenyl)-propyl]-2-methoxy-
phenyle dans 10m1
de tétrahydrofuranne. Le mélange réactionnel est chauffé à 60 C pendant 6
heures. Après
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
addition de 20 ml d'eau puis extraction avec de l'acétate d'éthyle, les phases
organiques
sont rassemblées, séchées sur sulfate de sodium, filtrées et évaporées. Le
résidu obtenu est
purifié par chromatographie sur colonne de silice élué avec un mélange
heptane/acétate
d'éthyle 80/20.
5 0,78g (62%) de (Z)-3-(4-{3-[4-(butane-1-sulfonyloxy)-3-methoxy-phenyl]-
propyl}-3-butoxy-
phenyl)-2-methoxy-acrylate de méthyle sont obtenus sous forme d'un solide
jaune.
k- acide (Z)-3-(4-{3-(4-(butane-1-su/fonvloxy)-3-methoxy_phenyll-proovll-3-
butoxy_phenvi)-2m
10 methoxv-acrvlique
2,6m1 (2,6 mmoles) d'une solution aqueuse d'hydroxyde de lithium de
concentration 1M sont
ajoutés sur une solution de 0,72 g (1,3mmoles) de (Z)-3-[4-{3-[4-(butane-1-
sulfonyloxy)-3-
methoxy-phenyl]-propyl}-3-buthoxy-phenyl)-2-methoxy-acrylate de méthyle dans 7
ml de
tétrahydrofuranne. Le mélange réactionnel est agité pendant 12 heures à
température
15 ambiante. La réaction est traitée par l'addition de 20 ml d'eau et
acidification avec une
solution aqueuse d'acide chlorhydrique 1 M puis extraction avec de l'acétate
d'éthyle. Les
phases organiques sont rassemblées, séchées sur sulfate de sodium, filtrées,
évaporées. Le
résidu obtenu est purifié par chromatographie sur colonne de silice élué avec
un mélange
dichlorométhane/acétate d'éthyle 80/20. Après évaporation des solvants, le
produit obtenu
20 est cristallisé dans l'heptane et filtré. 232,5mg (33%) d'acide (Z)-3-(4-{3-
[4-(butane-1-
sulfonyloxy)-3-methoxy-phenyl]-propyl}-3-butoxy-phenyl)-2-methoxy-acrylique
sont obtenus
sous forme d'une poudre blanche de point de fusion 72.5 C.
RMN'H (â, CDC13) :0,99 (t, 3H, J=7,4Hz); 1,01 (t, 3H, J=7,lHz); 1,49-1,56 (m,
4H); 1,81 (m,
25 2H); 1,94-1,99 (m, 4H); 2,65-2,73 (m, 4H); 3,28-3,32 (m, 2H); 3,79 (s, 3H);
3,9 (s, 3H); 4,01
(t, 2H, J=6,4Hz); 6,80 (m, 2H); 7,14 (s, 1H); 7,15(m, 1H); 7,20-7,27 (m, 2H);
7,38 (d, 1H,
J=1,2Hz).
Exemple 3 : acide (Z)-3-(4-{3-[4-(butane-1-sulfonyloxy)-3-methoxy-
phenyl]- propyl]-3-butoxy-phenyl)-2-ethoxy-acrylique
a- chlorure de (éthoxv-ethoxvcarbonvl-methvl)-triphenvl-phosphonium
2,Og (7,6 mmoles) de triphénylphosphine sont dissous dans 5ml de chloroforme
puis 1,3g
(7,6 mmoles) de 2-ethoxy-2-chloro-acétate d'éthyle sont ajoutés. Le mélange
est agité à
80 C pendant 3 heures puis concentré sous vide. Le résidu obtenu est
cristallisé avec un
mélange de diéthyléther et de pentane. 2g (61%) de chlorure de (éthoxy-
ethoxycarbonyl-
methyl)-triphenyl-phosphonium sont obtenus sous forme d'un solide blanc.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
26
b- (Z)-3-(4-{3-[4-(butane-1-sulfonyloxY)-3-methoxy-phenyll-propyl}-3-butoxy-
phenylL
ethoxv-acrvlate d'éthyle
1,39g (3,2 mmoles) de chlorure de (éthoxy-éthoxycarbonyl-methyl)-triphényl-
phosphonium et 0,45m1 (3,24mmoles) de triéthylamine sont ajoutés sur une
solution de 1g
(2,2 mmoles) de 1-butane sulfonate de 4-[3-(2-butoxy-4-formyl-phenyl)-propyl]-
2-methoxy-
phenyle (préparé comme décrit dans l'exemple 2h) dans 10 ml de
tétrahydrofuranne. Le
mélange réactionnel est agité à 60 C pendant 4 heures. Après addition de 20m1
d'eau puis
extraction avec de l'acétate d'éthyle, les phases organiques sont rassemblées,
séchées sur
sulfate de sodium, filtrées et évaporées. Le résidu obtenu est purifié par
chromatographie sur
colonne de silice élué avec un mélange heptane/acétate d'éthyle 80/20.
738mg (59%) de (Z)-3-(4-{3-[4-(butane-1-sulfonyloxy)-3-methoxy-phenyl]-propyl}-
3-butoxy-
phenyl)-2-ethoxy-acrylate d'éthyle sont obtenus sous forme d'une huile
incolore.
c- acide (Z) -3-(4-{3-(4-(butane-1-su/fonvioxy)-3-methoxy_phenVII-prop yi/-3-
butoxy_phenA L
ethoxv-acrvlique
2,6m1 (2,6 mmoles) d'une solution aqueuse d'hydroxyde de lithium de
concentration 1M sont
ajoutés sur une solution de 0,74g (1,3mmoles) de (Z)-3-(4-{3-[4-(butane-1-
sulfonyloxy)-3-
methoxy-phenyl]-propyl}-3-butoxy-phenyl)-2-ethoxy-acrylate d'éthyle dans 7ml
de
tétrahydrofuranne. Le mélange réactionnel est agité pendant 12 heures à
température
ambiante. Après addition de 20m1 d'eau et acidification avec une solution
aqueuse d'acide
chlorhydrique de concentration 1M, le milieu réactionnel est extrait avec de
l'acétate d'éthyle.
Les phases organiques sont rassemblées, séchées sur sulfate de sodium,
filtrées,
évaporées. Le résidu est purifié par chromatographie sur colonne de silice
élué avec un
mélange dichlorométhane/acétate d'éthyle 80/20. Après évaporation des
solvants, le produit
obtenu est cristallisé dans l'heptane.
308mg (43%) d'acide (Z)-3-(4-{3-[4-(butane-1-sulfonyloxy)-3-methoxy-phenyl]-
propyl}-3-
butoxy-phenyl)-2-éthoxy-acrylique sont obtenus sous forme d'une poudre blanche
de point
de fusion 75 C.
RMN'H (â, CDC13) : 0,90 (t, 3H, J=7,4Hz); 0,92 (t, 3H, J=7,1Hz); 1,31 (t, 3H,
J=7,1Hz); 1,43
(m, 4H); 1,73 (m, 2H); 1,85-1,91 (m, 4H); 2,56-2,63 (m, 4H); 3,19-3,22 (m,
2H); 3,79 (s, 3H);
3,91 (t , 2H, J=6,4Hz); 3,96 (q, 2H, J=7,1 Hz); 6,72 (m, 2H); 7,04-7,19 (m,
4H); 7,39 (s, 1 H).
Exemple 4 : acide (E)-3-(4-{3-[4-(butane-1-sulfonyloxy)-3-methoxy-
phenyl]- propyl]-3-butoxy-phenyl)-2-methyl-acrylique
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
27
a- 1-butane sulfonate de 4-(3-(2-butoxv-4-hvdroxvmethvl-phenvl -propvll-2-
methoxy_phenvle
0,7 (32 mmoles) de borohydrure de lithium sont ajoutés sur une solution de 5,2
g
(11 mmoles) de 4-{3-[4-(butane-1-sulfonyloxy)-3-methoxy-phenyl]-propyl}-3-
butoxy-benzoate
de méthyle (préparé selon l'exemple 2f) dans 50m1 de tétrahydrofuranne. Le
mélange
réactionnel est chauffé à 60 C pendant 15 heures puis hydrolysé délicatement
dans une
solution glacée et saturée de chlorure d'ammonium. Le milieu réactionnel est
neutralisé avec
de l'acide chlorhydrique concentré puis extrait avec de l'acétate d'éthyle.
Les phases
organiques sont lavées avec de l'eau et séchées sur sulfate de sodium. Les
solvants sont
évaporés et le résidu est purifié par chromatographie sur colonne de silice
élué avec un
mélange heptane/acétate d'ethyle 70/30.
4,2g (86%) de 1- butane sulfonate de 4-[3-(2-butoxy-4-hydroxymethyl-phenyl)-
propyl]-2-
methoxy-phenyle sont obtenus sous forme d'une huile incolore.
b- 1-butane suifonate de 4-(3-(2-butoxv-4-formvl-phenyl -proov/1-2-methoxy-
phenv/e
7,9g (91 mmoles) d'oxyde de manganèse sont ajoutés sur une solution de 4,2g
(9,1 mmoles)
de 1-butane sulfonate de 4-[3-(2-butoxy-4-hydroxymethyl-phenyl)-propyl]-2-
methoxy-phenyle
dans 300m1 de dichlorométhane. Le mélange réactionnel est agité pendant 15
heures à
température ambiante puis filtré sur célite. Les solvants sont évaporés. On
obtient 3,9g
(94%) de 1-butane sulfonate de 4-[3-(2-butoxy-4-formyl-phenyl)-propyl]-2-
methoxy-phenyle
sous forme d'une huile jaune.
c-LZL(4-{3-(4-(butane-1-sulfonvloxy)-3-methoxyphenyli-proovll-3-butoxy_phenLrl
-2-methvl-
acrvlate de méthvle
1,3g (40 mmoles) de chlorure de 1-méthoxycarbonyl-éthyl- triphényl phosphonium
et 0,45m1
(3,2 mmoles) de triéthylamine sont ajoutés sur une solution de 1g (2,2 mmoles)
de 1-butane
sulfonate de 4-[3-(2-butoxy-4-formyl-phenyl)-propyl]-2-methoxy-phenyle dans
10m1 de
tétrahydrofurane. Le mélange réactionnel est agité à 60 C pendant 6 heures. La
réaction est
traitée par l'ajout de 20m1 d'eau puis extraite avec de l'acétate d'éthyle.
Les phases
organiques sont rassemblées, et séchées sur sulfate de sodium. Les solvants
sont évaporés
puis le résidu est purifié par chromatographie sur colonne de silice élué avec
un mélange
heptane/acétate d'éthyle 80/20. 0,8g (62%) de (Z)-3-(4-{3-[4-(butane-1-
sulfonyloxy)-3-
methoxy-phenyl]-propyl}-3-butoxy-phenyl)-2-methyl-acrylate de méthyle sous
forme d'un
solide jaune sont obtenus.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
28
d- acide (E)-3-(4-{3-(4-(butane-1-sulfonv/oxy)-3-methoxyphenyl]-propvlj*-3-
butoxyphenyl)-2m
methvl-acrvlique
3,5m1 (3,4 mmoles) d'une solution aqueuse d'hydroxyde de lithium de
concentration 1M sont
ajoutés sur une solution de 923mg (1,7 mmoles) de (E)-3-(4-{3-[4-(butane-1-
sulfonyloxy)-3-
methoxy-phenyl]-propyl}-3-butoxy-phenyl)-2-methyl-acrylate de méthyle dans
10m1 de
tétrahydrofuranne. Le mélange réactionnel est agité pendant 12 heures à
température
ambiante. Après addition de 20 ml d'eau et acidification avec une solution
aqueuse d'acide
chlorhydrique 1M, le milieu réactionnel est extrait avec de l'acétate
d'éthyle. Les phases
organiques sont rassemblées, séchées sur sulfate de sodium, filtrées et
évaporées. Après
évaporation des solvants, le résidu est purifié par chromatographie sur
colonne de silice élué
avec un mélange de dichlorométhane/méthanol 80/20. 261 mg (30%) d'acide (Z)-3-
(4-{3-[4-
(butane-1-sulfonyloxy)-3-methoxy-phenyl]-propyl}-3-butoxy-phenyl)-2-methyl-
acrylique sont
obtenus sous forme d'une huile jaune.
RMN ' H(8, CDCI3) : 0,89 (t, 3H, J=7,4Hz); 0,92 (t, 3H, J=7,1 Hz); 1,19 (m,
4H); 1,72 (m, 2H);
1,88 (m, 2H); 2,09 (s, 3H); 2,59 (m, 4H); 3,20 (m, 2H); 3,79 (s, 3H); 3,90 (t,
2H, J=6,3Hz);
6,70 (m, 2H); 6,73 (s, 1 H); 6,91 (d, 1 H, J=7,7Hz); 7,07-7,19 (m, 2H); 7,71
(s, 1 H).
Exemple 5 : acide (Z)-3-{3-butoxy-4-[2-(4-methanesulfonyloxy-phenyl)-
ethoxy]-phenyl}-2-ethoxy-acrylique
a- 3-butoxv-4-hvdroxv-benzaldehvde
4,3g (188 mmoles) de sodium sont placés au fond d'un ballon sous azote et 40m1
de 1-
butanol sont versés dessus. Le milieu réactionnel est agité et chauffé
progressivement
jusqu'à 120 C, le butanolate formé étant peu soluble, 20m1 de 1-butanol sont
additionnés.
Quand tout le sodium est consommé, le milieu réactionnel est ramené à
température
ambiante et 40m1 de diméthylformamide sont additionnés. Sous azote, 6,8g
(68,2mmoles) de
chlorure de cuivre (I) sont additionnés puis 12,4g (62 mmoles) de 3-bromo-4-
hydroxy-
benzaldehyde. Le milieu réactionnel est progressivement chauffé à 120 C et
agité pendant 2
heures. Après refroidissement à température ambiante puis acidification
jusqu'à pH5 avec
une solution aqueuse d'acide chlorhydrique de concentration 2M, le milieu
réactionnel est
extrait à l'acétate d'éthyle. Les phases organiques sont rassemblées, lavées
par une solution
saturée de chlorure de sodium , séchées sur sulfate de magnésium, filtrées,
évaporées.
Après trituration puis recristallisation dans le pentane du résidu, 9,7g (81%)
de 3-butoxy-4-
hydroxy-benzaldéhyde sont obtenus.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
29
b- LZL(3-butoxv-4-hvdroxy_phenYl -2-éthoxv-acrvlate d'éthvle
9,7g (50 mmoles) de 3-butoxy-4-hydroxy-benzaldéhyde sont placés dans 250m1 de
tetrahydrofurane puis 32,1g (75 mmoles) de chlorure de (éthoxy-ethoxycarbonyl-
methyl)-
triphenyl-phosphonium (préparé selon l'exemple 3a) et 15m1 (100 mmoles) de
triéthylamine
sont additionnés. Le mélange réactionnel est agité à 40 C pendant 6 heures
puis filtré et le
filtrat est évaporé à sec. Le produit brut obtenu est repris dans l'éther
éthylique puis filtré
pour éliminer le phosphonium en excès. Le filtrat est à nouveau concentré sous
vide puis
purifié par chromatographie sur colonne de silice élué avec un mélange
heptane/acétate
d'éthyle 80/20 pour donner 16,2g (100%) de (Z)-3-(3-butoxy-4-hydroxy-phenyl)-2-
ethoxy-
acrylate d'éthyle sous la forme d'une huile caramel.
c- (Z)-3-(3-butoxv-4-{2-I4-(2-methoxv-ethoxvmethoxv)-phenvll-ethoxvl-ahenvl)-2-
ethoxv-
acrvlate de méthvle
2,2g (9,7 mmoles) de 2-[4-(2-methoxy-ethoxymethoxy)-phenyl]-ethanol (préparé
selon
l'exemple 1c), 2,Og (6,5 mmoles) de (Z)-3-(3-butoxy-4-hydroxy-phenyl)-2-ethoxy-
acrylate
d'éthyle et 2,5g (9,7 mmoles) de triphénylphosphine sont placés dans 45m1 de
tetrahydrofurane. Après complète dissolution, 1,5m1 (9,7 mmoles) de
diéthylazodicarboxylate
sont coulés très lentement sur ce mélange réactionnel. La réaction est agitée
pendant 2h à
température ambiante. Les solvants sont évaporés sous vide et le produit brut
est purifié par
chromatographie sur colonne de silice élué avec un mélange heptane/acétate
d'éthyle 70/30
pour donner 2,7g (82%) de (Z)-3-(3-butoxy-4-{2-[4-(2-methoxy-ethoxymethoxy)-
phenyl]-
ethoxy}-phenyl)-2-ethoxy-acrylate de méthyle sous la forme d'une huile
incolore.
d- LZL{3-butoxv-4-(2-(4-hvdroxy-phenYl -ethoxy]-phenyIl-2-ethoxv-acrvlate
d'éthvle
0,5m1 d'acide sulfurique sont additionnés sur une solution de 2,7g (5,2
mmoles) de (Z)-3-(3-
butoxy-4-{2-[4-(2-m ethoxy-eth oxymeth oxy)-ph enyl]-eth oxy}-phenyl )-2-
ethoxy-acrylate
d'éthyle dans 20m1 de tetrahydrofurane et 20m1 de méthanol. La réaction est
agitée à
température ambiante pendant 15h puis les solvants sont évaporés sous vide. Le
résidu est
repris avec de l'eau et de l'acétate d'éthyle puis extrait à l'acétate
d'éthyle. Après séparation
des phases, la phase organique est lavée par de l'eau, séchée sur sulfate de
magnésium,
filtrée et concentrée sous vide pour donner 2,2g (100%) de (Z)-3-{3-butoxy-4-
[2-(4-hydroxy-
phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle sous la forme d'une huile
jaune clair qui
cristallise.
e- (Z)-3-(3-butoxy-4-[2-(4-methanesu/fony/oxy-phenyl)-ethoxyl-phenyll-2-ethoxy-
acrylate
d'éth yle
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
0,16m1 (2,1 mmoles) de chlorure de methanesulfonyle est additionné sur une
solution de
0,6g (1,4 mmoles) de (Z)-3-{3-butoxy-4-[2-(4-hydroxy-phenyl)-ethoxy]-phenyl}-2-
ethoxy-
acrylate d'éthyle et 0,24m1 (1,7 mmoles) de triéthylamine dans 10m1 de
dichlorométhane. La
réaction est agitée à température ambiante pendant15 heures. Après addition de
10m1 d'eau
5 et extraction avec du dichlorométhane, les phases organiques sont
rassemblées, lavées par
de l'eau, séchée sur sulfate de magnésium et filtrées. Les solvants sont
évaporés. Le produit
brut obtenu est purifié par chromatographie sur colonne de silice élué avec un
mélange
heptane/acétate d'éthyle 70/30 pour donner 0,48g (68%) de (Z)-3-{3-butoxy-4-[2-
(4-
methanesulfonyloxy-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle sous la
forme d'un
10 solide blanc.
f- (Z)-3-[3-butoxv-4-[2-(4-methanesulfonvloxv-phenvl)-ethoxvl-ahenvll-2-ethoxv
acrvliaue
0,11g (2,8 mmoles) d'hydroxyde de sodium solide et 2ml d'eau sont additionnés
sur une
solution de 0,48g (0,95 mmole) de (Z)-3-{3-butoxy-4-[2-(4-methanesulfonyloxy-
phenyl)-
15 ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle dans 10m1 de tétrahydrofurane.
Le mélange
réactionnel est agité à 68 C pendant 24 heures. Après refroidissement, la
réaction est traitée
par l'addition d'une solution aqueuse d'acide chlorhydrique de concentration
1M ainsi que
20m1 d'eau puis extraite avec de l'acétate d'éthyle. Les phases organiques
sont
rassemblées, lavées par une solution saturée de chlorure de sodium, séchées
sur sulfate de
20 magnésium, filtrées, évaporées. Le produit est recristallisé dans un
mélange
pentane/acétone pour obtenir 0,15g (33%) d'acide (Z)-3-{3-butoxy-4-[2-(4-
methanesulfonyloxy-phenyl)-ethoxy]-phenyl}-2-ethoxy acrylique sous la forme
d'un solide
blanc de point de fusion 117 C.
25 RMN ' H(â, CDCI3) : 1,02 (t, 3H, J=7,4Hz); 1,41 (t, 3H, J=7,1 Hz); 1,54 (m,
2H); 1,85 (m, 2H);
3,15 (s, 3H); 3,17 (m, 2H); 4,01-4,06 (m, 4H); 4,25 (t, 2H, J=6,7Hz); 6,85 (d,
1H, J=8,4Hz);
7,11 (s, 1 H); 7,23-7,28 (m, 3H); 7,41 (d, 1 H, J=8,5Hz); 7,58 (s, 1 H).
Exemple 6 : acide (Z)-3-(4-{2-[4-(butane-1-sulfonyloxy)-phenyl]-ethoxy}-
30 3-butoxy-phenyl)-2-ethoxy-acrylique
a- LZL{3-butoxv-4-(2-(4-butanesulfonv/oxy_phenvi -ethoxy]-phenYl)-2-ethoxv-
acrvlate
d'éthvle
0,2m1 (1,5 mmoles) de chlorure de butanesulfonyle sont additionnés sur une
solution de
0,6g (1,4 mmoles) de (Z)-3-{3-butoxy-4-[2-(4-hydroxy-phenyl)-ethoxy]-phenyl}-2-
ethoxy-
acrylate d'éthyle (préparé selon l'exemple 5d) et 0,24m1 (1,7 mmoles) de
triéthylamine dans
10m1 de dichlorométhane. La réaction est agitée à température ambiante pendant
15 heures.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
31
Après addition de 10m1 d'eau puis extraction avec du dichlorométhane. Les
phases
organiques sont rassemblées, lavées par de l'eau, séchées sur sulfate de
magnésium,
filtrées et évaporées. Le produit brut obtenu est purifié par chromatographie
sur colonne de
silice élué avec un mélange heptane/acétate d'éthyle 80/20 pour donner 0,46g
(68%) de (Z)-
3-{3-butoxy-4-[2-(4-butanesulfonyloxy-phenyl)-ethoxy]-phenyl}-2-ethoxy-
acrylate d'éthyle
sous la forme d'une huile orangée.
b- acide (Z)-3-f3-butoxv-4-f2-(4-butanesu/fonv/oxv-phenvl)-ethoxvl-phenvll-2-
ethoxv
acrylique
0,10g (2,5mmoles) d'hydroxyde de sodium solide et 2ml d'eau sont additionnés
sur une
solution de 0,46g (0,84mmoles) de (Z)-3-{3-butoxy-4-[2-(4-butanesulfonyloxy-
phenyl)-
ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle dans 10m1 de tétrahydrofurane. Le
mélange
réactionnel est agité à 68 C pendant 24 heures. Après refroidissement, la
réaction est traitée
par l'addition d'une solution aqueuse d'acide chlorhydrique de concentration
1M ainsi que 20
ml d'eau puis extraite avec de l'acétate d'éthyle. Les phases organiques sont
rassemblées,
lavées par une solution saturée de chlorure de sodium, séchées sur sulfate de
magnésium,
filtrées, évaporées. Le produit obtenu est recristallisé dans un mélange
pentane/acétone
pour obtenir 0,15g (35%) d'acide (Z)-3-{3-butoxy-4-[2-(4-butanesulfonyloxy-
phenyl)-ethoxy]-
phenyl}-2-ethoxy acrylique sous la forme d'un solide blanc de point de fusion
96 C.
RMN ' H(8, CDCI3) : 0,91 (t, 3H, J=7,4Hz); 0,94 (t, 3H, J=7,1 Hz); 1,34 (t,
3H, J=7,1 Hz); 1,43-
1,48 (m, 4H); 1,77 (m, 2H); 1,89 (m, 2H); 3,08 (t, 2H, J=6,6Hz); 3,16 (m, 2H);
3,93-3,97 (m,
4H); 4,16 (t, 2H, J=6,6Hz); 6,76 (d, 1 H, J=8,4Hz); 7,12 (s, 1 H); 7,13-7,19
(m, 3H); 7,30 (d,
1 H, J=8,5Hz); 7,49 (s, 1 H).
Exemple 7 : acide (Z)-3-{3-butoxy-4-[2-(4-methanesulfonyloxy-3-methoxy-
phenyl)-ethoxy]-phenyl}-2-ethoxy- acrylique
a- (3-methoxv-4-(2-methoxv-ethoxvmethoxy -phenyIL-acétate d'éthvle
0,9g (23 mmoles) d'hydrure de sodium 60% sont ajoutés par portions à une
solution
préalablement refroidie de 4g (19 mmoles) de (4-hydroxy-3-méthoxy-phenyl)-
acétate d'éthyle
dans 20m1 de tétrahydrofuranne et 20m1 de diméthylformamide. Après agitation à
température ambiante pendant 45 minutes, 2,4m1 (21 mmoles) de 1-chlorométhoxy-
2-
méthoxy-éthane sont additionnés goutte à goutte. Après agitation à température
ambiante
pendant 1 heure, de l'eau et de l'acétate d'éthyle sont additionnés. La phase
organique est
lavée avec une solution saturée de chlorure de sodium, séchée sur sulfate de
magnésium,
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
32
filtrée, évaporée. 5,5 g (97%) de [3-methoxy-4-(2-methoxy-ethoxymethoxy)-
phenyl]-acétate
d'éthyle sont obtenus.
b- 2-(3-methoxv-4-(2-methoxv-ethoxvmethoxv)-ahenvll-ethanol:
1,2g (57,1 mmoles) de borohydrure de lithium sont ajoutés par portions sur une
solution de
5,4g (19,0 mmoles) de [3-méthoxy-4-(2-methoxy-ethoxymethoxy)-phenyl]-acétate
d'éthyle
dilué dans 60m1 de tétrahydrofurane. Après agitation à 60 C pendant 2 heures
puis à
température ambiante pendant 15 heures, le milieu réactionnel est versé dans
100m1 d'une
solution aqueuse saturée de chlorure d'ammonium refroidie à 0 C puis extrait à
l'acétate
d'éthyle. Les phases organiques sont rassemblées, lavées par une solution
saturée de
chlorure de sodium séchées sur sulfate de magnésium, filtrées, évaporées. Le
produit brut
obtenu est purifié par chromatographie sur colonne de silice élué avec un
mélange
heptane/acétate d'éthyle 50/50 pour donner 3,55g (74%) de 2-[3-methoxy-4-(2-
methoxy-
ethoxymethoxy)-phenyl]-ethanol sous la forme d'une huile incolore.
c- LZL(3-butoxv-4-{2-(3-methoxv-4-(2-methoxv-ethoxvmethoxx -phenyll-ethoxyl-
phenvl)-2-
ethoxv-acrvlate d'éthyle:
2,5g (9,7 mmoles) de 2-[3-methoxy-4-(2-methoxy-ethoxymethoxy)-phenyl]-ethanol,
2,Og (6,5
mmoles) de (Z)-3-(3-butoxy-4-hydroxy-phenyl)-2-ethoxy-acrylate d'éthyle et
3,4g (13
mmoles) de triphénylphosphine sont placés dans 50m1 de tetrahydrofurane. Après
complète
dissolution, 2,lml (13 mmoles) de diéthylazodicarboxylate sont coulés très
lentement sur ce
mélange réactionnel. La réaction est agitée pendant 15 heures à température
ambiante. Les
solvants sont évaporés sous vide et le produit brut est purifié par
chromatographie sur gel de
silice élué avec un mélange heptane/acétate d'éthyle 70/30 pour donner 2,3g
(66%) de (Z)-
3-(3-butoxy-4-{2-[3-methoxy-4-(2-methoxy-ethoxymethoxy)-phenyl]-ethoxy}-
phenyl)-2-
ethoxy-acrylate d'éthyle sous la forme d'une huile incolore.
d- (Z)-3-{3-butoxv-4-[2-(4-hvdroxv-3-methoxv-phenvl)-ethoxvl-ahenv/1-2-ethoxv-
acrv/ate
d'éth vle
0,5m1 d'acide sulfurique sont additionnés sur une solution de 2,3g (4,2
mmoles) de (Z)-3-(3-
butoxy-4-{2-[3-methoxy-4-(2-methoxy-ethoxymethoxy)-phenyl]-ethoxy}-phenyl)-2-
ethoxy-
acrylate d'éthyle dans 20m1 de tétrahydrofurane et 20m1 de méthanol. La
réaction est agitée
à température ambiante pendant 15 heures. Les solvants sont évaporés sous vide
et une
extraction acétate d'éthyle/eau est effectuée. Après séparation des phases, la
phase
organique est lavée par de l'eau, séchée sur sulfate de magnésium, filtrée et
concentrée
sous vide pour donner 1,9g (100%) de (Z)-3-{3-butoxy-4-[2-(4-hydroxy-3-methoxy-
phenyl)-
ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle sous la forme d'une huile orangée
qui cristallise.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
33
e- LZL{3-butoxv-4-(2-(4-methanesu/fonvloxv-3-methoxy_phenvl -ethoxy]-phenyl)-2-
ethoxy-
acrvlate d'éthvle
0,24m1 (3,1 mmoles) de chlorure de methanesulfonyle sont additionnés sur une
solution de
0,95g (2,1 mmoles) de (Z)-3-{3-butoxy-4-[2-(4-hydroxy-3-methoxy-phenyl)-
ethoxy]-phenyl}-2-
ethoxy-acrylate d'éthyle et 0,34m1 (2,50 mmoles) de triéthylamine dans 10m1 de
dichlorométhane. La réaction est agitée à température ambiante pendant 15
heures puis les
solvants sont évaporés. Le produit brut obtenu est purifié par chromatographie
sur colonne
de silice élué avec un mélange heptane/acétate d'éthyle 70/30 pour donner
0,89g (80%) de
(Z)-3-{3-butoxy-4-[2-(4-methanesulfonyloxy-3-methoxy-phenyl)-ethoxy]-phenyl}-2-
ethoxy-
acrylate d'éthyle sous la forme d'une huile jaune pâle.
f- acide (Z)-3-f3-butoxy-4-[2-(4-methanesulfonyloxy-3-methoxy-phenyl)-ethoxyl-
phenyl}-2-
ethoxv-acrvligue
8,5m1 (8,5 mmoles) d'une solution aqueuse d'hydroxyde de sodium de
concentration 1 M sont
additionnés sur une solution de 0,9g (1,7 mmoles) de (Z)-3-{3-butoxy-4-[2-(4-
methanesulfonyloxy-3-methoxy-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylate
d'éthyle dans
15m1 de tétrahydrofurane. Le mélange réactionnel est agité à 68 C pendant 30
heures.
Après refroidissement, la réaction est traitée par l'addition d'une solution
aqueuse d'acide
chlorhydrique de concentration 1M ainsi que 20m1 d'eau puis extraite avec de
l'acétate
d'éthyle. Les phases organiques sont rassemblées, lavées par une solution
saturée de
chlorure de sodium, séchées sur sulfate de magnésium, filtrées, évaporées. Le
produit est
recristallisé dans un mélange heptane/acétate d'éthyle pour obtenir 0,55g
(65%) d'acide (Z)-
3-{3-butoxy-4-[2-(4-methanesulfonyloxy-3-methoxy-phenyl)-ethoxy]-phenyl}-2-
ethoxy-
acrylique sous la forme d'un solide blanc de point de fusion 97 C.
RMN'H (â, CDC13) : 1,01 (t, 3H, 7,4Hz); 1,42 (t, 3H, J=7,1Hz); 1,53 (m, 2H);
1,84 (m, 2H);
3,15 (t, 2H, J= 6,6Hz); 3,19 (s, 3H); 3,91 (s, 3H); 4,05 (m, 2H); 4,26 (t, 2H,
J= 6,7 Hz); 6,85
(d, 1 H, J=8,4Hz); 6,96 (m, 1 H); 6,99 (s, 1 H); 7,12 (s, 1 H); 7,24-7,28 (m,
2H); 7,59 (s, 1 H).
Exemple 8 : acide (Z)-3-(4-{2-[4-(butane-1-sulfonyloxy)-3-methoxy-
phenyl]-ethoxy}-3-butoxy-phenyl)-2- ethoxy-acrylique
a- (Z)-3-{3-butoxv-4-(2-(4-butanesulfonvloxv-3-methoxyphenvi)-ethoxy]-phenyl)-
2-ethoxy
acrvlate d'éthv/e
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
34
0,4m1 (3,1 mmoles) de chlorure de butanesulfonyle sont additionnés sur une
solution de
0,95g (2,1 mmoles) de (Z)-3-{3-butoxy-4-[2-(4-hydroxy-3-methoxy-phenyl)-
ethoxy]-phenyl}-2-
ethoxy-acrylate d'éthyle (préparé selon l'exemple 7d) et 0,34m1 (2,5 mmoles)
de
triéthylamine dans 10m1 de dichlorométhane. La réaction est agitée à
température ambiante
pendant 15 heures puis le milieu réactionnel est concentré sous vide. Le
produit brut obtenu
est purifié par chromatographie sur colonne de silice élué avec un mélange
heptane/acétate
d'éthyle 80/20 pour donner 0,73g (61%) de (Z)-3-{3-butoxy-4-[2-(4-
butanesulfonyloxy-3-
methoxy-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle sous la forme d'une
huile jaune
pâle.
b- acide (Z)-3-{3-butoxy-4-f2-(4-butanesu/fonyloxy-3-methoxy-phenyl)-ethoxyl-
phenyl}-2-
ethoxy-acryligue
6,3m1 (6,3mmoles) d'une solution aqueuse d'hydroxyde de sodium de
concentration 1M sont
additionnés sur une solution de 0,73g (1,26 mmoles) de (Z)-3-{3-butoxy-4-[2-(4-
butanesulfonyloxy-3-methoxy-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle
dans 15 ml
de tétrahydrofurane. Le mélange réactionnel est agité à 68 C pendant 30h.
Après
refroidissement, la réaction est traitée par l'addition d'une solution aqueuse
d'acide
chlorhydrique de concentration 1M ainsi que 20m1 d'eau puis extraite avec de
l'acétate
d'éthyle. Les phases organiques sont rassemblées, lavées par une solution
saturée de
chlorure de sodium, séchées sur sulfate de magnésium, filtrées puis évaporées.
Le produit
est recristallisé dans le diisopropyl éther pour obtenir 0,5g (72%) d'acide
(Z)-3-{3-butoxy-4-
[2-(4-butanesulfonyloxy-3-methoxy-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylique
sous la forme
d'un solide blanc de point de fusion 94 C.
RMN'H (8, CDC13) : 093 (t, 3H, J=7,4Hz); 0,95 (t, 3H, J=7,4Hz); 1,36 (t, 3H,
J=7,1Hz); 1,45
(m, 2H); 1,78 (m, 2H); 1,95 (m, 2H); 3,09 (t, J=6,6Hz); 3,24 (m, 2H); 3,83 (s,
3H); 3,95-4,00
(m, 4H); 4,20 (t, 2H, J=6,8Hz); 6,79 (d, 1 H, J=8,4Hz); 6,88 (dd, 1 H,
J=8,2Hz, J=1,9Hz); 6,92
(s, 1 H); 7,06 (s,1 H); 7,17-7,22 (m, 2H); 7,53 (s, 1 H);
Exemple 9 : acide (Z)-3-(4-{2-[4-(butane-1-sulfonyloxy)-2-methoxy-
phenyl]-ethoxy}-3-butoxy-phenyl)-2-ethoxy-acrylique
a- 2-méthoxv-4-(2-méthoxv-ethoxvmethoxy)-benzaldehvde
1,8g (41,2 mmoles) d' hydrure de sodium 60% sont ajoutés par portions sur une
solution à
0 C de 5,7g (37,5 mmoles) de 4-hydroxy-2-méthoxy-benzaldéhyde dilué dans 30m1
de
tétrahydrofuranne et 30m1 de diméthylformamide. Le mélange réactionnel est
agité à
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
température ambiante pendant 30 minutes puis 4,7m1 (41,2 mmoles) de chlorure
de 2-
méthoxyéthoxyméthyle sont additionnés goutte à goutte. Le mélange réactionnel
est agité à
température ambiante 45 minutes puis la réaction est traitée par l'addition
d'eau et extraite
avec de l'acétate d'éthyle. Les phases organiques sont rassemblées, lavées par
une solution
5 saturée de chlorure de sodium, séchées sur sulfate de magnésium, filtrées,
évaporées. Le
produit brut est purifié par chromatographie sur colonne de silice élué avec
un mélange
heptane/acétate d'éthyle 70/30 pour donner 8,6g (95%) de 2-méthoxy-4-(2-
méthoxy-
ethoxyméthoxy)-benzaldéhyde sous la forme d'une huile incolore.
10 b- 2-methoxy-4-(2-methoxy-ethoxymethoxy)-1-vinyl-benzene
12,5m1 (31,2 mmoles) de n-butyllithium sont ajoutés goutte à goutte sur une
solution à-40 C
de 11,1g (31,2 mmoles) de methyl-triphényl-phosphonium dilués dans 100m1 de
tétreahydrofurane. Le mélange réactionnel est agité à 0 C pendant 30 minutes
puis refroidi à
-25 C et une solution de 5g (20,8 mmoles) de 2-méthoxy-4-(2-méthoxy-
ethoxymethoxy)
15 -benzaldéhyde dilués dans 50m1 de tétrahydrofuranne est additionnée goutte
à goutte. Le
mélange réactionnel est agité à température ambiante 2 heures. La réaction est
traitée par
l'addition d'eau puis extraite avec de l'acétate d'éthyle. Les phases
organiques sont
rassemblées, lavées par une solution saturée de chlorure de sodium, séchées
sur sulfate de
magnésium, filtrées, évaporées. Le produit brut est purifié par
chromatographie sur colonne
20 de silice élué avec un mélange heptane/acétate d'éthyle 75/25 pour donner
4,4g (90%) de 2-
méthoxy-4-(2-méthoxy-ethoxymethoxy)-1-vinyl-benzène sous la forme d'une huile
incolore.
c- 2-[2-methoxy-4-(2-methoxy-ethoxymethoxy)-phenyll-ethanol
3,9g (16,4 mmoles) de 2-méthoxy-4-(2-méthoxy-ethoxymethoxy)-1-vinyl-benzène
dilués
25 dans 30m1 de tétrahydrofurane sont ajoutés goutte à goutte sur une solution
à température
ambiante de 4g (16,4mmoles) du dimère de 9-borabicyclo[3.3.1] nonane dilués
dans 10m1
de tétrahydrofuranne. Après agitation à température ambiante pendant 20
heures, le milieu
réactionnel précédent est refroidi à 0 C et 10m1 d'eau sont ajoutés goutte à
goutte. Le milieu
réactionnel est agité à température ambiante pendant 1 heure puis de nouveau
refroidi à 0 C
30 et 10m1 d'eau oxygéné sont additionnés. Après 2 heures d'agitation à
température ambiante,
la réaction est traitée par addition de 3ml d'une solution aqueuse d'hydroxyde
de sodium de
concentration 3M et agitée pendant 30 minutes. Le milieu réactionnel est
extrait à l'acétate
d'éthyle. Les phases organiques sont rassemblées, lavées par une solution
saturée de
chlorure de sodium, séchées sur sulfate de magnésium, filtrées, évaporées._Le
produit brut
35 est purifié par chromatographie sur colonne de silice élué avec un mélange
heptane/acétate
d'éthyle 60/40 pour donner 3,3g (78%) de 2-[2-methoxy-4-(2-methoxy-
ethoxymethoxy)-
phenyl]-ethanol sous la forme d'une huile jaune claire.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
36
d- LZL(3-butoxv-4-{2-(2-methoxv-4-(2-methoxv-ethoxvmethoxy -phenyIL-ethoxy)-
phenyl)-2
ethoxv-acrvlate d'éthyle
3,3g (13 mmoles) de 2-[2-methoxy-4-(2-methoxy-ethoxymethoxy)-phenyl]-éthanol,
2g (6,5
mmoles) de (Z)-3-(3-butoxy-4-hydroxy-phényl)-2-éthoxy-acrylate d'éthyle
(préparé selon
l'exemple 5b) et 3,4g (13 mmoles) de triphénylphosphine sont placés dans 70m1
de
tetrahydrofurane. Après complète dissolution, 2,lml (13 mmoles) de
diéthylazodicarboxylate
sont coulés très lentement sur ce mélange réactionnel. La réaction est agitée
pendant 15
heures à température ambiante. Après avoir additionnés 30m1 de méthanol, les
solvants sont
évaporés sous vide et le produit brut est purifié par chromatographie sur
colonne de silice
élué avec un mélange heptane/acétate d'éthyle 75/25 pour donner 2,6g (74%) de
(Z)-3-(3-
butoxy-4-{2-[2-methoxy-4-(2-methoxy-ethoxymethoxy)-phenyl]-ethoxy}-phenyl)-2-
ethoxy-
acrylate d'éthyle sous la forme d'une huile jaune claire.
e- LZL{3-butoxv-4-(2-(4-hvdroxv-2-methoxy_phenyl -ethoxy]-phenyl}-2-ethoxv-
acrvlate
d'éth vle
0,5m1 d'acide sulfurique sont additionnés sur une solution de 2,6g (4,7
mmoles) de (Z)-3-(3-
butoxy-4-{2-[2-methoxy-4-(2-methoxy-ethoxymethoxy)-phenyl]-ethoxy}-phenyl)-2-
ethoxy-
acrylate d'éthyle dans 15m1 de tetrahydrofurane et 15m1 de méthanol. La
réaction est agitée
à température ambiante pendant 3 heures. Les solvants sont évaporés sous vide
et une
extraction acétate d'éthyle/eau est effectuée. Après séparation des phases, la
phase
organique est lavée par de l'eau, séchée sur sulfate de magnésium, filtrée et
concentrée
sous vide pour donner 2,1g (100%) de (Z)-3-{3-butoxy-4-[2-(4-hydroxy-2-methoxy-
phenyl)-
ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle sous la forme d'un solide jaune
clair.
f- (Z)-3-f3-butoxv-4-f2-(4-butanesulfonvloxv-2-methoxv-ahenvl)-ethoxvl-phenvl)-
2-ethoxv-
acrylate d'éthyle
0,44m1 (3,4 mmoles) de chlorure de butanesulfonyle est additionné sur une
solution de 1,05g
(2,3 mmoles) de (Z)-3-{3-butoxy-4-[2-(4-hydroxy-2-methoxy-phenyl)-ethoxy]-
phenyl}-2-
ethoxy-acrylate d'éthyle et 0,47m1 (3,4 mmoles) de triéthylamine dans 15m1 de
dichlorométhane. La réaction est agitée à température ambiante pendant 15
heures puis le
milieu réactionnel est concentré sous vide. Le produit brut obtenu est purifié
par
chromatographie sur colonne de silice élué avec un mélange heptane/acétate
d'éthyle 75/25
pour donner 1,3g (98%) de (Z)-3-{3-butoxy-4-[2-(4-butanesulfonyloxy-2-methoxy-
phenyl)-
ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle sous la forme d'une huile orangée.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
37
g- acide (Z)-3-{3-butoxv-4-(2-(4-butanesulfonv/oxv-2-methoxyphenvl -ethoxy]-
phenrl)-2-
ethoxv-acrvlique
11,2m1 (11,2 mmoles) d'une solution aqueuse d'hydroxyde de sodium de
concentration 1M
sont additionnés sur une solution de 1,3g (2,25 mmoles) de (Z)-3-{3-butoxy-4-
[2-(4-
butanesulfonyloxy-2-methoxy-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle
dans 30 ml
de tétrahydrofurane. Le mélange réactionnel est agité à 68 C pendant 3 jours.
Après
refroidissement, la réaction est traitée par l'addition d'une solution aqueuse
d'acide
chlorhydrique de concentration 1M ainsi que 20 ml d'eau puis extraite avec de
l'acétate
d'éthyle. Les phases organiques sont rassemblées, lavées par une solution
saturée de
chlorure de sodium, séchées sur sulfate de magnésium, filtrées, évaporés. Le
produit brut
est recristallisé dans un mélange heptane/acétate d'éthyle pour obtenir 0,7g
(58%) d'acide
(Z)-3-{3-butoxy-4-[2-(4-butanesu Ifonyloxy-2-methoxy-phenyl )-eth oxy]-phenyl}-
2-eth oxy-
acrylique sous la forme d'un solide blanc de point de fusion 90 C.
RMN'H (8, CDC13) : 093 (t, 3H, J=7,4Hz); 0,95 (t, 3H, J=7,4Hz); 1,32 (t, 3H,
J=7,1Hz); 1,42
(m, 2H); 1,78 (m, 2H); 3,08 (t, 2H, J=7Hz); 3,18 (m, 2H); 3,78 (s, 3H); 3,95
(m, 4H); 4,13 (t,
2H, J=7,1 Hz); 6,71 (d, 1 H, J=7,8Hz); 6,73 (s, 1 H); 6,80 (d, 1 H, J=8,4Hz);
7,04 (s, 1 H); 7,15-
7,22 (m, 2H); 7,50 (s, 1 H).
Exemple 10 : acide (Z)-3-{3-butoxy-4-[2-(4-methanesulfonyloxy-2-
methoxy-phenyl)-ethoxy]-phenyl}- 2-ethoxy-acrylique
a- (Z)-3-(3-butoxy-4-[2-(4-methanesu/fonyloxy-2-methoxy-phenyl)-ethoxyl-
pheny/1-2-ethoxy-
acrylate d'éthy/e
0,26m1 (3,40 mmoles) de chlorure de methanesulfonyle sont additionnés sur une
solution de
1,05g (2,30 mmoles) de (Z)-3-{3-butoxy-4-[2-(4-hydroxy-2-methoxy-phenyl)-
ethoxy]-phenyl}-
2-ethoxy-acrylate d'éthyle (préparé selon l'exemple 9e) et 0,47m1 (3,40
mmoles) de
triéthylamine dans 15m1 de dichlorométhane. La réaction est agitée à
température ambiante
pendant 15 heures puis le milieu réactionnel est concentré sous vide. Le
produit brut obtenu
est purifié par chromatographie sur colonne de silice élué avec un mélange
heptane/acétate
d'éthyle 70/30 pour donner 1g (80%) de (Z)-3-{3-butoxy-4-[2-(4-
methanesulfonyloxy-2-
methoxy-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle sous la forme d'une
huile
incolore.
b- acide (Z)-3-{3-butoxv-4-(2-(4-methanesu/fonv/oxv-2-methoxyphenvi -ethoxy]-
phenyl~-2-
ethoxv-acrvliaue
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
38
9,5m1 (9,5mmoles) d'une solution aqueuse d'hydroxyde de sodium de
concentration 1M sont
additionnés sur une solution de 1g (1,86 mmoles) de (Z)-3-{3-butoxy-4-[2-(4-
methanesulfonyloxy-2-methoxy-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylate
d'éthyle dans
30m1 de tétrahydrofurane. Le mélange réactionnel est agité à 68 C pendant 2
jours.
Après refroidissement, la réaction est traitée par l'addition d'une solution
aqueuse d'acide
chlorhydrique de concentration 1M ainsi que 20 ml d'eau puis extraite avec de
l'acétate
d'éthyle. Les phases organiques sont rassemblées, lavées par une solution
saturée de
chlorure de sodium, séchées sur sulfate de magnésium, filtrées et évaporées.
Le produit brut
est recristallisé dans un mélange heptane/acétate d'éthyle pour obtenir 0,35g
(65%) d'acide
(Z)-3-{3-butoxy-4-[2-(4-methanesulfonyloxy-2-methoxy-phenyl)-ethoxy]-phenyl}-2-
ethoxy-
acrylique sous la forme d'un solide blanc de point de fusion 112 C.
RMN'H (8, CDC13) :0,93 (t, 3H, J=7,4Hz); 1,32 (t, 3H, J=7,1Hz); 1,45 (m, 2H);
1,78 (m, 2H);
3,06 (m, 2H); 3,08 (s, 3H); 3,78 (s,3H); 3,92-3,97 (m, 4H); 4,14 (t, 2H,
J=7,1Hz); 6,73 (m,
2H); 6,80 (d, 1 H, J=8,4Hz); 7,03 (s, 1 H); 7,15-7,24 (m, 2H); 7,49 (s, 1 H);
Exemple 11 : acide (Z)-3-{3-butoxy-4-[2-(4-ethoxy-3-fluoro-phenyl)-
ethoxy]-phenyl}-2-ethoxy-acrylique
a- (3-fluoro-4-hvdroxv-ahenvl)-acétate de méthv/e
1 ml d'acide sulfurique sont additionnés à une solution de 9,6g (56,4 mmoles)
d'acide (3-
fluoro-4-hydroxy-phenyl)-acétique dans 100m1 de méthanol. Le milieu
réactionnel est agité à
68 C pendant 2 heures puis concentré sous vide. Après addition de 100m1 d'eau
et 100m1
d'acétate d'éthyle, le milieu réactionnel est extrait à l'acétate d'éthyle.
Les phases
organiques sont rassemblées, lavées par une solution saturée de chlorure de
sodium puis
séchées sur sulfate de magnésium, filtrées, évaporées. 10g (100%) de (3-fluoro-
4-hydroxy-
phenyl)-acétate de méthyle sont obtenus sous forme d'une huile jaune clair.
b- (3-fluoro-4-(2-methoxv-ethoxvmethoxy -phenyil-acetate de méthvle
2,6g (65,1 mmoles) d' hydrure de sodium 60% sont ajoutés par portions sur une
solution à
0 C de 10g (54,3 mmoles) de (3-fluoro-4-hydroxy-phenyl)-acétate de méthyle
dilué dans
50m1 de tétrahydrofuranne et 50m1 de diméthylformamide. Le mélange réactionnel
est agité
à température ambiante pendant 45 minutes puis 6,8m1 (59,7 mmoles) de chlorure
de 2-
méthoxyéthoxyméthyle sont additionnés goutte à goutte. Le mélange réactionnel
est agité à
température ambiante pendant 2 heures puis la réaction est traitée par
l'addition d'eau et
extraite avec de l'acétate d'éthyle. Les phases organiques sont rassemblées,
lavées par une
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
39
solution aqueuse saturée de chlorure de sodium, séchées sur sulfate de
magnésium, filtrées,
évaporées. Le produit brut est purifié par chromatographie sur colonne de
silice élué avec un
mélange heptane/acétate d'éthyle 70/30. 9,7g (65%) de [3-fluoro-4-(2-methoxy-
ethoxymethoxy)-phenyl]-acétate de méthyle sont obtenus sous la forme d'une
huile incolore.
c- 2-(3-fluoro-4-(2-methoxv-ethoxvmethoxv)-ahenvll-ethanol
2,4g (107 mmoles) de borohydrure de lithium sont ajoutés par portions sur une
solution de
9,7g (36 mmoles) de [3-fluoro-4-(2-méthoxy-ethoxymethoxy)-phenyl]-acétate de
méthyle
dans 100m1 de tétrahydrofuranne. Le mélange réactionnel est agité à 60 C
pendant 1 h30
puis il est versé dans 500m1 de glace et extrait à l'acétate d'éthyle. Les
phases organiques
sont rassemblées, lavées par une solution aqueuse saturée de chlorure de
sodium, séchées
sur sulfate de magnésium, filtrées, évaporées. 8,6g (99%) de 2-[3-fluoro-4-(2-
methoxy-
ethoxymethoxy)-phenyl]-éthanol sont obtenus sous la forme d'une huile
incolore.
d- LZL(3-butoxv-4-{2-(3-fluoro-4-(2-methoxv-ethoxvmethoxx -phenLII-ethoxy}-
phenvl)-2
ethoxv-acrvlate d'éthyle
2,2g (9,1 mmoles) de 2-[3-fluoro-4-(2-methoxy-ethoxymethoxy)-phenyl]-éthanol,
2g (6,5
mmoles) de (Z)-3-(3-butoxy-4-hydroxy-phenyl)-2-ethoxy-acrylate d'éthyle
(préparé selon
l'exemple 5b) et 3,4g (13 mmoles) de triphénylphosphine sont placés dans 70m1
de
tetrahydrofurane. Après complète dissolution, 2,1 ml (13 mmoles) de
diéthylazodicarboxylate
sont coulés très lentement sur ce mélange réactionnel. La réaction est agitée
pendant 15
heures à température ambiante. Après avoir additionné 50m1 de méthanol, les
solvants sont
évaporés sous vide et le produit brut est purifié par chromatographie sur
colonne de silice
élué avec un mélange heptane/acétate d'éthyle 70/30 pour donner 2,5g (71 %) de
(Z)-3-(3-
butoxy-4-{2-[3-fluoro-4-(2-methoxy-ethoxymethoxy)-phenyl]-ethoxy}-phenyl)-2-
ethoxy-
acrylate d'éthyle sous la forme d'une huile rose.
e- (Z)-3-f3-butoxy-4-(2-(3-fluoro-4-hydroxy-phenyl)-ethoxyl-phenyl}-2-ethoxy-
acrylate d'éthy/e
0,5m1 d'acide sulfurique sont additionnés sur une solution de 2,5g (4,7
mmoles) de (Z)-3-(3-
butoxy-4-{2-[3-fluoro-4-(2-méthoxy-éthoxymethoxy)-phenyl]-ethoxy}-phenyl)-2-
éthoxy-
acrylate d'éthyle dans 15m1 de tétrahydrofurane et 15m1 de méthanol. La
réaction est agitée
à température ambiante pendant 15 heures. Les solvants sont évaporés sous vide
et une
extraction acétate d'éthyle/eau est effectuée. Après séparation des phases, la
phase
organique est lavée par de l'eau puis séchée sur sulfate de magnésium, filtrée
et concentrée
sous vide pour donner 2,1g (100%) de (Z)-3-{3-butoxy-4-[2-(3-fluoro-4-hydroxy-
phenyl)-
ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle sous la forme d'un solide rose.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
f- LZL{3-butoxv-4-(2-(4-ethoxv-3-fluoro-phenvi)-ethoxy]-phenYl)-2-ethoxv-
acrvlate d'éthvle
0,13m1 (1,7 mmoles) d'iodure d'éthyle sont additionnés sur une solution de
0,50g (1,1
mmole) de (Z)-3-{3-butoxy-4-[2-(3-fluoro-4-hydroxy-phenyl)-ethoxy]-phenyl}-2-
ethoxy-
acrylate d'éthyle et 0,23g (1,7 mmoles) de carbonate de potassium dans 10m1 de
2-
5 butanone. La réaction est agitée et chauffée à 80 C pendant 4 heures puis le
milieu
réactionnel est filtré et le filtrat concentré sous vide. Le produit brut
obtenu est purifié par
chromatographie sur colonne de silice élué avec un mélange heptane/acétate
d'éthyle 90/10
pour donner 0,4g (75%) de (Z)-3-{3-butoxy-4-[2-(4-ethoxy-3-fluoro-phenyl)-
ethoxy]-phenyl}-2-
ethoxy-acrylate d'éthyle sous la forme d'une huile jaune pâle qui cristallise.
g- acide (Z)-3-{3-butoxy-4-f2-(4-ethoxy-3-fluoro-phenyl)-ethoxyl-phenyll-2-
ethoxy-acryligue
2,5m1 (2,5mmoles) d'une solution aqueuse d'hydroxyde de lithium de
concentration 1M sont
additionnés sur une solution de 0,4g (0,84 mmoles) de (Z)-3-{3-butoxy-4-[2-(4-
ethoxy-3-
fluoro-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle dans 6 ml de
tétrahydrofurane. Le
mélange réactionnel est agité à température ambiante pendant 4 jours. La
réaction est
traitée par l'addition d'une solution aqueuse d'acide chlorhydrique de
concentration 1M ainsi
que 10m1 d'eau puis extraite avec de l'acétate d'éthyle. Les phases organiques
sont
rassemblées, lavées par une solution aqueuse saturée de chlorure de sodium,
séchées sur
sulfate de magnésium, filtrées et évaporées. Le produit brut est recristallisé
dans un mélange
heptane/acétate d'éthyle 80/20 pour obtenir 0,3g (81%) d' acide (Z)-3-{3-
butoxy-4-[2-(4-
ethoxy-3-fluoro-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylique sous la forme d'un
solide blanc
de point de fusion 119 C.
RMN ' H(â, CDC13) : 1,02 (t, 3H, J=7,4Hz); 1,44 (t, 3H, J=7,1 Hz); 1,53 (t,
3H, J=7,5Hz); 1,85
(m, 2H); 1,89 (m, 2H); 3,08 (t, 2H, J=6,6Hz, 4,02 (m, 4H); 4,10 (q, 2H,
J=7,1Hz); 4,21 (t, 2H,
J=6,7Hz); 6,84-6,90 (m, 2H); 7,00 (d, 1 H, J=8,2Hz); 7,11 (m, 1 H); 7,13 (s, 1
H); 7,24 (m, 1 H);
7,57 (s, 1 H).
Exemple 12 : acide (Z)-3-{3-butoxy-4-[2-(3-fluoro-4-pentyloxy-phenyl)-
ethoxy]-phenyl}-2-ethoxy-acrylique
a- LZL{3-butoxv-4-(2-(3-fluoro-4-pentvloxyphenYl -ethoxy]-phenYll-2-ethoxv-
acrvlate
d'éthvle
0,2m1 (1,7 mmoles) d' iodure de pentyle sont additionnés sur une solution de
0,5g (1,1
mmoles) de (Z)-3-{3-butoxy-4-[2-(3-fluoro-4-hydroxy-phenyl)-ethoxy]-phenyl}-2-
ethoxy-
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
41
acrylate d'éthyle (préparé selon l'exemple 11 e) et 0,2g (1,7 mmoles) de
carbonate de
potassium dans 10m1 de 2-butanone. La réaction est agitée à 80 C pendant 7
heures. Le
milieu réactionnel est filtré et le filtrat concentré sous vide. Le produit
brut obtenu est purifié
par chromatographie sur colonne de silice élué avec un mélange heptane/acétate
d'éthyle
90/10 pour donner 0,42g (72%) de (Z)-3-{3-butoxy-4-[2-(3-fluoro-4-pentyloxy-
phenyl)-
ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle sous la forme d'une huile incolore.
b- acide (Z)-3-f3-butoxv-4-[2-(3-fluoro-4-pentvloxv-phenvl)-ethoxvl-ahenvll-2-
ethoxv-
acrylipue
2,4m1 (2,4 mmoles) d'une solution aqueuse d'hydroxyde de lithium de
concentration 1M sont
additionnés sur une solution de 0,42g (0,8 mmoles) de (Z)-3-{3-butoxy-4-[2-(3-
fluoro-4-
pentyloxy-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle dans 6 ml de
tétrahydrofurane.
Le mélange réactionnel est agité à température ambiante pendant 4 jours. La
réaction est
traitée par l'addition d'une solution aqueuse d'acide chlorhydrique de
concentration 1M ainsi
que 10m1 d'eau puis extraite avec de l'acétate d'éthyle. Les phases organiques
sont
rassemblées, lavées par une solution saturée de chlorure de sodium, séchées
sur sulfate de
magnésium, filtrées, évaporées. Le produit brut est recristallisé dans un
mélange
heptane/acétate d'éthyle 80/20 pour obtenir 0,34g (87%) d'acide (Z)-3-{3-
butoxy-4-[2-(3-
fluoro-4-pentyloxy-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylique sous la forme
d'un solide
blanc de point de fusion 102 C.
RMN ' H(S, CDC13) : 0,94 (t, 3H, J=7,lHz); 1,02 (t, 3H, J=7,4Hz); 1,41 (t,
J=7Hz); 1,45 (m,
2H); 1,83 (m, 2H); 3,08 (t, 2H, J=6,6Hz); 4,00-4,06 (m, 6H); 4,21 (t, 2H,
J=6,7Hz); 6,84-6,90
(m, 4H); 6,99 (d, 1 H, J=8,3Hz); 7,10 (m, 1 H); 7,13 (s, 3H); 7,24 (m, 1 H);
7,57 (s,1 H).
Exemple 13 : acide (Z)-3-(4-{2-[4-(butane-1-sulfonyloxy)-3-fluoro-phenyl]-
ethoxy}-3-butoxy-phenyl)-2-ethoxy- acrylique
a- LZL{3-butoxy-4-(2-(3-fluoro-4-butanesulfony/oxy_phenvi)-ethoxy]-phenYl)-2-
ethoxy-
acrvlate d'éthvle
0,22m1 (1,75 mmoles) de chlorure de butanesulfonyle sont additionnés sur une
solution de
0,52g (1,16 mmoles) de (Z)-3-{3-butoxy-4-[2-(3-fluoro-4-hydroxy-phenyl)-
ethoxy]-phenyl}-2-
ethoxy-acrylate d'éthyle (préparé selon l'exemple 11e) et 0,24m1 (1,75 mmoles)
de
triéthylamine dans 10m1 de dichlorométhane. La réaction est agitée à
température ambiante
pendant 15 heures puis le milieu réactionnel est concentré sous vide. Le
produit brut obtenu
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
42
est purifié par chromatographie sur colonne de silice élué avec un mélange
heptane/acétate
d'éthyle 80/20 pour donner 0,41g (62%) de (Z)-3-{3-butoxy-4-[2-(3-fluoro-4-
butanesulfonyloxy-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle sous la
forme d'une
huile incolore.
b- acide (Z)-3-(4-{2-(4-(butane-1-sulfonvloxv)-3-fluoro-ahenvll-ethoxvl-3-
butoxv-ahenvl)-2-
ethoxv-acrvligue
1,4m1 (1,4 mmole) d'une solution aqueuse d'hydroxyde de lithium de
concentration 1M sont
additionnés sur une solution de 0,4g (0,7 mmole) de (Z)-3-(4-{2-[4-(butane-1-
sulfonyloxy)-3-
fluoro-phenyl]-ethoxy}-3-butoxy-phenyl)-2-ethoxy-acrylate d'éthyle dans 6ml de
tétrahydrofurane. Le mélange réactionnel est agité à température ambiante
pendant 3 jours.
La réaction est traitée par l'addition d'une solution aqueuse d'acide
chlorhydrique de
concentration 1M ainsi que 10m1 d'eau puis extraite avec de l'acétate
d'éthyle. Les phases
organiques sont rassemblées, lavées par une solution aqueuse saturée de
chlorure de
sodium, séchées sur sulfate de magnésium, filtrées, évaporées. Le produit brut
est purifié
par chromatographie sur colonne de silice élué avec un mélange
dichlorométhane/méthanol
99/1 pour obtenir 0,1g (26%) d'acide (Z)-3-(4-{2-[4-(butane-1-sulfonyloxy)-3-
fluoro-phenyl]-
ethoxy}-3-butoxy-phenyl)-2-ethoxy-acrylique sous la forme d'un solide blanc de
point de
fusion 99 C.
RMN'H (8, CDC13) : 0,91 (t, 3H, J=7,3Hz); 0,93 (t, 3H, J=7,3Hz); 1,32 (t, 3H,
J=7,lHz); 1,44
(m, 2H); 1,75 (m, 2H); 1,92 (m, 2H); 3,06 (t, 2H, J=6,3Hz); 3,23 (m, 2H); 3,93-
3,97 (m, 4H);
4,15 (t, 2H, J=6,3Hz); 6,75 (d, 1H, J=8,4Hz); 7,14 (s, 1H); 7,15 (m, 1H); 7,17-
7,20 (m, 3H);
7,49 (s, 1 H).
Exemple 14: acide (Z)-3-{3-butoxy-4-[2-(3-chloro-4-ethoxy-phenyl)-
ethoxy]-phenyl}-2-ethoxy-acrylique
a- [3-chloro-4-hvdroxv-phenv/l-acétate de méthyle
1 ml d'acide sulfurique sont additionnés à une solution de 10g (53,6 mmoles)
d'acide (3-
chloro-4-hydroxy-phenyl)-acétique dans 100m1 de méthanol. Le milieu
réactionnel est agité
à 68 C pendant 15 heures puis concentré sous vide. Après addition de 100m1
d'eau et 100m1
d'acétate d'éthyle, le milieu réactionnel est extrait à l'acétate d'éthyle.
Les phases
organiques sont rassemblées, lavées par une solution saturée de chlorure de
sodium puis
séchées sur sulfate de magnésium, filtrées, évaporées. 11g (100%) de (3-chloro-
4-hydroxy-
phenyl)-acétate de méthyle sont obtenus sous forme d'une huile jaune clair.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
43
b- (3-chloro-4-(2-methoxv-ethoxvmethoxx -phenyll-acétate de méthyle
2,75g (68,4 mmoles) d'hydrure de sodium 60% sont ajoutés par portions sur une
solution à
0 C de 11g (57 mmoles) de (3-chloro-4-hydroxy-phenyl)-acétate de méthyle dilué
dans 60m1
de tétrahydrofuranne et 60m1 de diméthylformamide. Le mélange réactionnel est
agité à
température ambiante pendant 45 minutes puis 7,2m1 (62,7 mmoles) de chlorure
de 2-
méthoxyéthoxyméthyle sont additionnés goutte à goutte. Le mélange réactionnel
est agité à
température ambiante pendant 2 heures puis la réaction est traitée par
l'addition d'eau et
extraite avec de l'acétate d'éthyle. Les phases organiques sont rassemblées,
lavées par une
solution saturée de chlorure de sodium, séchées sur sulfate de magnésium,
filtrées,
évaporées. Le produit brut est purifié par chromatographie sur colonne de
silice élué avec un
mélange heptane/acétate d'éthyle 70/30. 10,6g (66%) de [3-chloro-4-(2-methoxy-
ethoxymethoxy)-phenyl]-acétate de méthyle sont obtenus sous la forme d'une
huile incolore.
c- 2-(3-ch/oro-4-(2-methoxv-ethoxvmethoxx -phenyIL-ethanol
2,4g (110 mmoles) de borohydrure de lithium sont ajoutés par portions sur une
solution de
10,6g (36,7 mmoles) de [3-chloro-4-(2-methoxy-ethoxymethoxy)-phenyl]-acétate
de méthyle
dilué dans 110m1 de tétrahydrofurane. Le mélange réactionnel est agité à 60 C
pendant 2
heures. Le milieu réactionnel est ensuite versé dans 500m1 de glace puis
extrait à l'acétate
d'éthyle. Les phases organiques sont rassemblées, lavées par une solution
aqueuse saturée
de chlorure de sodium, séchées sur sulfate de magnésium, filtrées, évaporées.
Les solvants
sont évaporés pour donner 7,3g (77%) de 2-[3-chloro-4-(2-methoxy-
ethoxymethoxy)-phenyl]-
ethanol sous la forme d'une huile incolore.
d- (Z)-3-(3-butoxv-4-f2-[3-chloro-4-(2-methoxv-ethoxvmethoxv)-phenvll-ethoxvl-
phenvl)-2-
ethoxv-acrvlate d'éthyle
2,7g (9,1 mmoles) de 2-[3-chloro-4-(2-methoxy-ethoxymethoxy)-phenyl]-éthanol,
2g (6,5
mmoles) de (Z)-3-(3-butoxy-4-hydroxy-phenyl)-2-ethoxy-acrylate d'éthyle
(préparé selon
l'exemple 5b) et 3,4g (13 mmoles) de triphénylphosphine sont placés dans 80m1
de
tetrahydrofurane. Après complète dissolution, 2,1 ml (13 mmoles) de
diéthylazodicarboxylate
sont coulés très lentement sur ce mélange réactionnel. La réaction est agitée
pendant 15
heures à température ambiante. Après avoir additionné 50m1 de méthanol, les
solvants sont
évaporés sous vide et le produit brut est purifié par chromatographie sur
colonne de silice
élué avec heptane/acétate d'éthyle 80/20 pour donner 2,6g (72%) de (Z)-3-(3-
butoxy-4-{2-[3-
chloro-4-(2-methoxy-ethoxymethoxy)-phenyl]-ethoxy}-phenyl)-2-ethoxy-acrylate
d'éthyle
sous la forme d'une huile incolore.
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
44
e- LZL{3-butoxv-4-(2-(3-ch/oro-4-hvdroxyphenYl -ethoxy]-phenYl,)-2-ethoxv-
acrv/ate
d'éth vle
0,5m1 d'acide sulfurique sont additionnés sur une solution de 2,6g (4,7
mmoles) de (Z)-3-(3-
butoxy-4-{2-[3-chloro-4-(2-methoxy-ethoxymethoxy)-phenyl]-ethoxy}-phenyl)-2-
ethoxy-
acrylate d'éthyle dans 15m1 de tetrahydrofurane et 15m1 de méthanol. La
réaction est agitée
à température ambiante pendant 15 heures. Les solvants sont évaporés sous vide
et une
extraction acétate d'éthyle/eau est effectuée. Après séparation des phases, la
phase
organique est lavée par de l'eau puis séchée sur sulfate de magnésium, filtrée
et concentrée
sous vide pour donner 2,2g (100%) de (Z)-3-{3-butoxy-4-[2-(3-chloro-4-hydroxy-
phenyl)-
ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle sous la forme d'un solide jaune
clair.
f- (Z)-3-f3-butoxy-4-[2-(4-ethoxy-3-chloro-phenyl)-ethoxyl-phenyl}-2-ethoxy-
acry/ate d'éthyle
0,2m1 (2,4 mmoles) d'iodure d'éthyle sont additionnés sur une solution de
0,55g (1,2
mmoles) de (Z)-3-{3-butoxy-4-[2-(3-chloro-4-hydroxy-phenyl)-ethoxy]-phenyl}-2-
ethoxy-
acrylate d'éthyle et 0,25g (1,8 mmoles) de carbonate de potassium dans 10m1 de
2-
butanone. La réaction est agitée à 80 C pendant 6 heures. Le milieu
réactionnel est filtré et
le filtrat concentré sous vide. Le produit brut obtenu est purifié par
chromatographie sur
colonne de silice élué avec un mélange heptane/acétate d'éthyle 85/15 pour
donner 0,4g
(61%) de (Z)-3-{3-butoxy-4-[2-(4-ethoxy-3-chloro-phenyl)-ethoxy]-phenyl}-2-
ethoxy-acrylate
d'éthyle sous la forme d'une huile incolore.
cr- acide (Z)-3-(3-butoxv-4-[2-(4-ethoxv-3-chloro-phenvl)-ethoxvl-phenvll-2-
ethoxv-acrvliaue
2,2m1 (2,2mmoles) d'une solution aqueuse d'hydroxyde de lithium de
concentration 1M sont
additionnés sur une solution de 0,4g (0,75 mmoles) de (Z)-3-{3-butoxy-4-[2-(4-
ethoxy-3-
chloro-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle dans 6ml de
tétrahydrofurane. Le
mélange réactionnel est agité à température ambiante pendant 4 jours. La
réaction est
traitée par l'addition d'une solution aqueuse d'acide chlorhydrique de
concentration 1M ainsi
que 10m1 d'eau puis extraite avec de l'acétate d'éthyle. Les phases organiques
sont
rassemblées, lavées par une solution saturée de chlorure de sodium séchées sur
sulfate de
magnésium, filtrées et évaporées. Le produit est recristallisé dans un mélange
heptane/acétate d'éthyle 80/20 pour obtenir 0,33g (94%) d'acide (Z)-3-{3-
butoxy-4-[2-(4-
ethoxy-3-chloro-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylique sous la forme d'un
solide blanc
de point de fusion 109 C.
RMN'H (8, CDCI3) :1,02 (t, 3H, J=7,4Hz); 1,41 (t, 3H, J=7,1 Hz); 1,48 (t, 3H,
J=7Hz); 1,56 (m,
2H); 1,86 (m, 2H); 3,08 (t, 2H, J=6,7Hz); 4,01-4,06 (m, 4H); 4,12 (q, 2H,
J=7Hz); 4,21 (t, 2H,
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
J=6,8Hz); 6,84-6,88 (m, 4H); 7,12 (s, H); 7,16 (m, 1 H); 7,24 (m, 1 H); 7,36
(d, 1 H, J= 2,1 Hz);
7,58 (d, 1 H, J=1,9Hz).
Exemple 15: acide (Z)-3-{3-butoxy-4-[2-(3-chloro-4-pentyloxy-phenyl)-
5 ethoxy]-phenyl}-2-ethoxy-acrylique
a- (Z)-3-(3-butoxv-4-[2-(3-chloro-4-pentvloxv-phenvl)-ethoxvl-phenvl)-2-ethoxv-
acrvlate
d'éthvle
0,3m1 (2,4 mmoles) d'iodure de pentyle sont additionnés sur une solution de
0,55g (1,2
10 mmoles) de (Z)-3-{3-butoxy-4-[2-(3-chloro-4-hydroxy-phenyl)-ethoxy]-phenyl}-
2-ethoxy-
acrylate d'éthyle (préparé selon l'exemple 14e) et 0,25g (1,8 mmoles) de
carbonate de
potassium dans 10m1 de 2-butanone. La réaction est agitée à 80 C pendant 6
heures. Le
milieu réactionnel est filtré et le filtrat concentré sous vide. Le produit
brut obtenu est purifié
par chromatographie sur colonne de silice élué avec un mélange heptane/acétate
d'éthyle
15 90/10 pour donner 0,5g (79%) de (Z)-3-{3-butoxy-4-[2-(3-chloro-4-pentyloxy-
phenyl)-ethoxy]-
phenyl}-2-ethoxy-acrylate d'éthyle sous la forme d'une huile incolore.
b- acide LZL{3-butoxv-4-(2-(3-chloro-4-pentv/oxy_phenvl -ethoxy]-phenYl)-2-
ethoxy-
acrvlique
20 2,8m1 (2,8 mmoles) d'une solution aqueuse d'hydroxyde de lithium de
concentration 1M sont
additionnés sur une solution de 0,5g (0,94 mmoles) de (Z)-3-{3-butoxy-4-[2-(3-
chloro-4-
pentyloxy-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle dans 6ml de
tétrahydrofurane.
Le mélange réactionnel est agité à température ambiante pendant 4 jours puis
la réaction est
traitée par l'addition d'une solution aqueuse d'acide chlorhydrique de
concentration 1M ainsi
25 que 10m1 d'eau puis extraite avec de l'acétate d'éthyle. Les phases
organiques sont
rassemblées, lavées par une solution saturée de chlorure de sodium puis
séchées sur
sulfate de magnésium, filtrées, et évaporées. Le produit brut obtenu est
recristallisé dans un
mélange heptane/acétate d'éthyle 80/20 pour obtenir 0,4g (80%) d' acide (Z)-3-
{3-butoxy-4-
[2-(3-chloro4-pentyloxy-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylique sous la
forme d'un solide
30 blanc de point de fusion 95 C.
RMN ' H(8, CDCI3) : 0,95 (t, 3H, J=7,1 Hz); 1,02 (t, 3H, J=7,4Hz); 1,43 (t,
3H, J=7,1 Hz); 1,47-
1,57 (m, 2H); 1,86 (m, 4H); 3,07 (t, 2H, J=6,7Hz); 4,00-4,07 (m, 6H); 4,21 (t,
2H, J=6,8Hz);
6,84-6,87 (m, 2H); 7,13 (s, 1 H); 7,14 (m, 1 H); 7,24 (m, 1 H); 7,35 (d, 1 H,
J=2,1 Hz); 7,59 (d,
35 1H, J=1,9Hz).
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
46
Exemple 16: acide (Z)-3-{3-butoxy-4-[2-(3-chloro-4-methanesulfonyloxy-
phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylique
a- (Z)-3-(3-butoxv-4-(2-(3-ch/oro-4-methanesulfonvloxv-ahenvl)-ethoxvl-ahenvll-
2-ethoxv-
acrvlate d'éthvle
0,12m1 (1,6 mmoles) de chlorure de méthanesulfonyle sont additionnés sur une
solution de
0,50g (1,1 mmoles) de (Z)-3-{3-butoxy-4-[2-(3-chloro-4-hydroxy-phenyl)-ethoxy]-
phenyl}-2-
ethoxy-acrylate d'éthyle (préparé selon l'exemple 14e) et 0,22m1 (1,6 mmoles)
de
triéthylamine dans 10m1 de dichlorométhane. La réaction est agitée à
température ambiante
pendant 15 heures puis le milieu réactionnel est concentré sous vide. Le
produit brut obtenu
est purifié par chromatographie sur colonne de silice élué avec un mélange
heptane/acétate
d'éthyle 85/15 pour donner 0,5g (84%) de (Z)-3-{3-butoxy-4-[2-(3-chloro-4-
methanesulfonyloxy-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle sous la
forme d'une
huile incolore.
b- acide LZL{3-butoxv-4-(2-(3-chloro-4-methanesu/fonv/oxy_phenvi -ethoxy]-
phenE-2-
ethoxv-acrvlique
1,8m1 (1,8mmol) d'une solution d'hydroxyde de lithium de concentration 1M sont
additionnés
sur une solution de 0,5g (0,9 mmoles) de (Z)-3-{3-butoxy-4-[2-(3-chloro-4-
methanesulfonyloxy-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle dans 6ml
de
tétrahydrofurane. Le mélange réactionnel est agité à température ambiante
pendant 3 jours.
La réaction est traitée par l'addition d'une solution aqueuse d'acide
chlorhydrique de
concentration I M ainsi que 10m1 d'eau puis extraite avec de l'acétate
d'éthyle. Les phases
organiques sont rassemblées, lavées par une solution aqueuse saturée de
chlorure de
sodium, séchées sur sulfate de magnésium, filtrées puis évaporées. Le produit
brut est
purifié par chromatographie sur colonne de silice élué avec un mélange
dichlorométhane/méthanol 99/1 pour obtenir 0,15g (33%) d' acide ( Z)-3-{3-
butoxy-4-[2-(3-
chloro-4-methanesulfonyloxy-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylique sous la
forme d'un
solide blanc de point de fusion 113 C.
RMN ' H(â, CDC13) : 0,93 (t, 3H, J=7,4Hz); 1,32 (t, 3H, J=7,1 Hz); 1,45 (t,
3H, J=7,1 Hz); 1,45
(m, 2H); 1,77 (m, 2H); 3,03 (t, 2H, J=6,3Hz); 3,16 (s, 3H); 3,92-3,97 (s, 3H);
3,92-3,98 (m,H);
4,16 (t, 2H, J=6,34Hz); 6,75 (d, 1 H, J=8,4Hz); 7,03 (s, 1 H); 7,15-7,23 (m,
2H); 7,30 (m, 1 H);
7,42 (d, 1 H, J=2Hz); 7,49 (d, 1 H, J=1,9Hz).
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
47
Exemple 17 acide (Z)-3-(4-{2-[4-(butane-1-sulfonyloxy)-3-chloro-
phenyl]-ethoxy}-3-butoxy-phenyl)-2-ethoxy- acrylique
a- (Z)-3-{3-butoxv-4-(2-(3-chloro-4-butanesulfonvloxv-ahenvl)-ethoxvl-ahenvll-
2-ethoxv-
acrylate d'éthvle
0,2m1 (1,6 mmoles) de chlorure de butanesulfonyle sont additionnés sur une
solution de
0,5g (1,1 mmole) de (Z)-3-{3-butoxy-4-[2-(3-chloro-4-hydroxy-phenyl)-ethoxy]-
phenyl}-2-
ethoxy-acrylate d'éthyle (préparé selon l'exemple 14e) et 0,2m1 (1,6 mmoles)
de
triéthylamine dans 10m1 de dichlorométhane. La réaction est agitée à
température ambiante
pendant 15 heures puis le milieu réactionnel est concentré sous vide. Le
produit brut obtenu
est purifié par chromatographie sur colonne de silice élué avec un mélange
heptane/acétate
d'éthyle 90/10 pour donner 0,4g (62%) de (Z)-3-{3-butoxy-4-[2-(3-chloro-4-
butanesulfonyloxy-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle sous la
forme d'une
huile incolore.
b- acide LZL(4-{2-(4-(butane-1-su/fonv/oxy -3-chloro-phenyll-ethoxx)-3-
butoxy_phenvl)-2-
ethoxv-acrvlique
1,3m1 (1,3 mmoles) d'une solution aqueuse d'hydroxyde de lithium de
concentration 1M sont
additionnés sur une solution de 0,4g (0,7 mmoles) de (Z)-3-(4-{2-[4-(butane-1-
sulfonyloxy)-3-
chloro-phenyl]-ethoxy}-3-butoxy-phenyl)-2-ethoxy-acrylate d'éthyle dans 6ml de
tétrahydrofurane. Le mélange réactionnel est agité à température ambiante
pendant 3 jours.
La réaction est traitée par l'addition d'une solution aqueuse d'acide
chlorhydrique de
concentration I M ainsi que 10m1 d'eau puis extraite avec de l'acétate
d'éthyle. Les phases
organiques sont rassemblées, lavées par une solution aqueuse saturée de
chlorure de
sodium, séchées sur sulfate de magnésium, filtrées et évaporées. Le produit
brut est purifié
par chromatographie sur colonne de silice élué avec un mélange
dichlorométhane/méthanol
99/1 pour obtenir 0,07g (19%) d' acide (Z)-3-(4-{2-[4-(butane-1-sulfonyloxy)-3-
chloro-phenyl]-
ethoxy}-3-butoxy-phenyl)-2-ethoxy-acrylique sous la forme d'un solide blanc de
point de
fusion 80 C.
RMN ' H(â, CDCI3) : 0,91 (t, 3H, J=7,3Hz); 0,93 (t, 3H, J=7,3Hz); 1,31 (t, 3H,
J=7,1 Hz); 1,43-
1,48 (m, 4H); 1,75 (m, 2H); 1,94 (m, 2H); 6,75 (d, 1H, J=8,4Hz); 7,03 (s, 1H);
7,16-7,21 (m,
2H); 7,30 (d, 1 H, J=8,4Hz); 7,40 (d, 1 H, J=2Hz); 7,49 (d, 1 H, J=1,9Hz).
Exemple 18 : acide (Z)-2-Ethoxy-3-{4-[2-(4-methanesulfonyloxy-phenyl)-
ethoxy]-3-methoxy-phenyl}-acrylique
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
48
a- L)-3-(4-{2-(4-methanesulfonv/oxy -phenyll-ethoxyl-3-methoxy_phenyl -2-
ethoxv-acrvlate
d'éth vle
0,13m1 (1,75 mmoles) de chlorure de méthanesulfonyle sont additionnés sur une
solution de
0,50g (1,2 mmoles) de (Z)-2-Ethoxy-3-{4-[2-(4-hydroxy-phenyl)-ethoxy]-3-
methoxy-phenyl}-
acrylate d'éthyle (préparé selon 1h) et 0,24m1 (1,75 mmoles) de triéthylamine
dans 10m1 de
dichlorométhane. La réaction est agitée à température ambiante pendant 15
heures puis les
solvants sont évaporés sous vide. Le produit brut obtenu est purifié par
chromatographie sur
colonne de silice élué avec un mélange heptane/acétate d'éthyle 70/30 pour
donner 0,46g
(85%) de (Z)-3-(4-{2-[4-(methanesulfonyloxy)-phenyl]-ethoxy}-3-methoxy-phenyl)-
2-ethoxy-
acrylate d'éthyle sous la forme d'une huile incolore.
b- acide (Z)-3-(4-{2-[4-(methanesulfonyloxy)-phenyll-ethoxy}-3-methoxy-phenyl)-
2-ethoxy-
acryligue
1,5m1 (1,5 mmoles) d'une solution aqueuse d'hydroxyde de lithium de
concentration 1M sont
additionnés sur une solution de 0,5g (1 mmoles) de (Z)-3-(4-{2-[4-
(methanesulfonyloxy)-
phenyl]-ethoxy}-3-methoxy-phenyl)-2-ethoxy-acrylate d'éthyle dans 15m1
d'acétone et 5ml
d'eau. Le mélange réactionnel est agité à 35 C pendant 18 heures. Après
refroidissement, la
réaction est traitée par l'addition de 2,5m1 d'une solution aqueuse d'acide
chlorhydrique de
concentration 1M ainsi que 30m1 d'eau puis extraite avec de l'acétate
d'éthyle. Les phases
organiques sont rassemblées, lavées par une solution saturée de chlorure de
sodium,
séchées sur sulfate de magnésium, filtrées et évaporées. Le produit est
recristallisé dans un
mélange heptane/acétate d'éthyle pour obtenir 0,3g (70%) d' acide (Z)-3-(4-{2-
[4-
(methanesulfonyloxy)-phenyl]-ethoxy}-3-méthoxy-phenyl)-2-ethoxy-acrylique sous
la forme
d'un solide blanc de point de fusion 147 C;
RMN'H (8, CDC13) : 1,43 (t, 1H, J=7,1Hz); 3,16 (s, 3H); 3,20 (t, 2H, J=7,1Hz);
3,92 (s, 3H);
4,07 (q, 2H, J=7,1 Hz); 4,27 (t, 2H, J=7,1 Hz); 6,86 (d, 1 h, 8,4Hz); 7,14 (s,
1 H); 7,25-7,28 (m,
3H); 7,38 (m, 2H); 7,62 (d, 1H, J=1, 9Hz);
Exemple 19 : acide (Z)-2-éthoxy-3-{4-[2-(4-ethoxy-phenyl)-ethoxy]-3-
methoxy-phenyl}-acrylique
a- LZ -2-éthoxv-3-{4-(2-(4-ethoxyphenvl -ethoxy]-3-méthoxyphenyl)-acrvlate
d'éthvle
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
49
0,3m1 (3,5 mmoles) d'iodure d'éthyle sont additionnés sur une solution de 0,5g
(1,2 mmoles)
de (Z)-2-éthoxy-3-{4-[2-(4-hydroxy-phenyl)-ethoxy]-3-methoxy-phenyl}-acrylate
d'éthyle
(préparé selon 1 h) et 0,4g (2,6 mmoles) de carbonate de potassium dans 10m1
de 2-
butanone. La réaction est agitée à 80 C pendant 24 heures puis le milieu
réactionnel est
filtré et le filtrat concentré sous vide. Le produit brut obtenu est purifié
par chromatographie
sur colonne de silice élué avec un mélange heptane/acétate d'éthyle 90/10 pour
donner 0,5g
(96%) de (Z)-2-éthoxy-3-{4-[2-(4-ethoxy-phenyl)-ethoxy]-3-méthoxy-phenyl} -
acrylate d'éthyle
sous la forme d'une huile incolore.
b- acide ((Z)-2-éthoxv-3-f4-[2-(4-ethoxv-ahenvl)-ethoxvl-3-methoxv-phenvll-
acrvlipue
1,7m1 (1,7 mmoles) d'une solution aqueuse d'hydroxyde de lithium de
concentration 1M sont
additionnés sur une solution de 0,5g (1,1 mmoles) de (Z)-2-éthoxy-3-{4-[2-(4-
ethoxy-phenyl)-
ethoxy]-3-méthoxy-phenyl}-acrylate d'éthyle dans 15m1 d'acétone et 5ml d'eau.
Le mélange
réactionnel est agité à 35 C pendant 18 heures. Après refroidissement, la
réaction est traitée
par l'addition de 2,6m1 d'une solution aqueuse d'acide chlorhydrique de
concentration 1M
ainsi que 30m1 d'eau puis extraite avec de l'acétate d'éthyle. Les phases
organiques sont
rassemblées, lavées par une solution aqueuse saturée de chlorure de sodium
puis séchées
sur sulfate de magnésium. Après évaporation des solvants, le produit est
recristallisé dans
un mélange heptane/acétate d'éthyle pour obtenir 0,25g (58%) d'acide ((Z)-2-
éthoxy-3-{4-[2-
(4-ethoxy-phenyl)-ethoxy]-3-methoxy-phenyl}-acrylique sous la forme d'un
solide blanc de
point de fusion 121 C.
RMN ' H(S, CDCI3) :1,32 (t, 3H, J=6,2Hz); 1,35 (t, 3H, J=7Hz); 3,05 (t, 2H,
J=7,7Hz); 3,83 (s,
3H); 3,92-3,98 (m, 4H); 4,14 (t, 2H, J=7,6Hz); 6,77-6,79 (m, 3H); 7,05 (s,
1H); 7,12-7,19 (m,
3H); 7,53 (d, 1 H, J=1,9Hz).
Exemple 20 : acide (Z)-2-éthoxy-3-{3-methoxy-4-[2-(4-pentyloxy-phenyl)-
ethoxy]-phenyl}-acrylique
a- LZ -2-ethoxy-(3-4-(2-(4-pentyloxy_phenvl -ethoxy]-3-methoxy_phenyl) -
acrylate d'éthy/e
0,5m1 (3,5 mmoles) d'iodure de pentyle sont additionnés sur une solution de
0,5g (1,2
mmoles) de (Z)-2-éthoxy-3-{4-[2-(4-hydroxy-phenyl)-ethoxy]-3-méthoxy-phenyl}-
acrylate
d'éthyle (préparé selon l'exemple 1 h) et 0,4g (2,6 mmoles) de carbonate de
potassium dans
10m1 de 2-butanone. La réaction est agitée à 80 C pendant 24 heures puis le
milieu
réactionnel est filtré et le filtrat concentré sous vide. Le produit brut
obtenu est purifié par
chromatographie sur colonne de silice élué avec un mélange heptane/acétate
d'éthyle 90/10
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
pour donner 0,4g (75%) de (Z)-2-ethoxy-{3-4-[2-(4-pentyloxy-phenyl)-ethoxy]-3-
methoxy-
phenyl} -acrylate d'éthyle sous la forme d'une huile incolore.
b- acide (Z)-2-éthoxv-3-(4-(2-(4-pentvloxv-ahenvl)-ethoxvl-3-methoxv-ahenvil-
acrvliaue
5 1,3m1 (1,3 mmoles) d'une solution aqueuse d'hydroxyde de lithium de
concentration 1M sont
additionnés sur une solution de 0,4g (0,9 mmoles) de ((Z)-2-éthoxy-3-{4-[2-(4-
pentyloxy-
phenyl)-ethoxy]-3-methoxy-phenyl}-acrylate d'éthyle dans 15m1 d'acétone et 5ml
d'eau. Le
mélange réactionnel est agité à 35 C pendant 18 heures. Après refroidissement,
la réaction
est traitée par l'addition de 2,3m1 d'une solution aqueuse d'acide
chlorhydrique de
1 0 concentration I M ainsi que 30m1 d'eau puis extraite avec de l'acétate
d'éthyle. Les phases
organiques sont rassemblées, lavées par une solution saturée de chlorure de
sodium,
séchées sur sulfate de magnésium, filtrées, évaporées. Le produit est
recristallisé dans un
mélange heptane/acétate d'éthyle pour obtenir 0,3g (84%) d'acide ((Z)-2-éthoxy-
3-{4-[2-(4-
pentyloxy-phenyl)-ethoxy]-3-methoxy-phenyl}-acrylique sous la forme d'un
solide blanc de
15 point de fusion 135 C.
RMN ' H(8, CDC13) : 0,95 (t, 3H, J=7,1 Hz); 1,38 (t, 3H, J=8Hz); 1,39-1,48 (m,
4H); 1,82 (m,
2H); 3,14 (t, 2H, J=7,7Hz); 3,93 (s, 3H); 3,97 (m, 2H); 4,04 (q, 2H, J=7,1Hz);
4,23 (t, 2H,
J=7,6Hz).
Exemple 21 : acide (Z)-3-{4-[2-(4-acetylamino-phenyl)-ethoxy]-3- butoxy-
phenyl}-2-ethoxy-acrylique
a- (Z)-3-(3-butoxV-4-[2-(4-nitro-phenyl)-ethoxVl-phenVl}-2-ethoxV-acrVlate
d'éthyle
A une solution de 2,5g (8 mmoles) de (Z)-3-(3-butoxy-4-hydroxy-phenyl)-2-
ethoxy-acrylate
d'éthyle (préparé selon l'exemple 5b), de 4,2g (16 mmoles) de
triphénylphosphine et de 2g
(12 mmoles) de 4-nitrophénéthylalcool dans 50m1 de tétrahydrofuranne, 2,5m1
(16 mmoles)
de diéthylazodicarboxylate sont additionnés très lentement. La réaction est
agitée pendant
15 heures à température ambiante. Après avoir additionné 50m1 de méthanol, les
solvants
sont évaporés sous vide et le produit brut est purifié par chromatographie sur
colonne de
silice élué avec un mélange heptane/acétate d'éthyle 70/30 pour donner 1,4g
(38%) de (Z)-
3-{3-butoxy-4-[2-(4-nitro-phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylate d'éthyle
sous la forme
d'un solide jaune.
b- LZ,L{4-(2-(4-amino-phenvl 1-ethoxv-3-butoxyphen,yl)-2-ethoxv-acrvlate
d'éthv/e
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
51
3,1g (13 mmoles) de chlorure d'étain dihydrate sont additionnés sur une
solution de 1,2g (2,7
mmoles) de (Z)-3-{3-butoxy-4-[2-(4-nitro-phenyl)-ethoxy]-phenyl}-2-ethoxy-
acrylate d'éthyle
dans 20m1 d'éthanol absolu. Le milieu réactionnel est chauffé à 70 C pendant
15 heures.
Après addition d'une solution aqueuse d'hydrogénocarbonate de sodium à 5%
jusqu'à pH7-
8, le milieu réactionnel est extrait à l'acétate d'éthyle. Les phases
organiques sont
rassemblées, séchées sur sulfate de magnésium, filtrées et concentrées. Le
résidu obtenu
est purifié par chromatographie sur colonne de silice élué avec un mélange
heptane /
acétate d'éthyle. 1g (87%) de (Z)-3-{4-[2-(4-amino-phenyl)]-ethoxy-3-butoxy-
phenyl}-2-
ethoxy-acrylate d'éthyle est obtenu.
c- (Z)-3-f4-(2-(4-acetylamino-phen yl)-ethoxyl-3-butoxy-phen yl}-2-ethoxy-
acrylate d'éthyle
0,08 ml (1,1 mmole) de chlorure d'acétyle sont additionnés sur une solution de
0,4g (1
mmole) de (Z)-3-{4-[2-(4-amino-phenyl)]-ethoxy-3-butoxy-phenyl}-2-ethoxy-
acrylate d' éthyle,
0,2 ml (1,2 mmoles) de triéthylamine dans 8 ml de tétrahydrofurane
préalablement refroidie à
0 C. Après agitation à température ambiante pendant 15 heures, le milieu
réactionnel est
traité avec de l'eau et de l'acétate d'éthyle. Les phases organiques sont
lavées à l'eau,
séchées sur sulfate de magnésium, filtrées, évaporées. Le résidu obtenu est
purifié par
chromatographie sur colonne de silice élué avec un mélange heptane / acétate
d'éthyle
80/20. 0,3g (70%) de (Z)-3-{4-[2-(4-acetylamino-phenyl)-ethoxy]-3-butoxy-
phenyl}-2-ethoxy-
acrylate d'éthyle.
d- acide (Z)-3-f4-[2-(4-acetvlamino-phenvl)-ethoxvl-3-butoxv-ahenvll-2-ethoxv-
acrvliaue
80mg (2 mmoles) d'hydroxyde de sodium en pastilles sont ajoutés sur une
solution de 0,3g
(0,6 mmoles) de (Z)-3-{4-[2-(4-acetylamino-phenyl)-ethoxy]-3-butoxy-phenyl}-2-
ethoxy-
acrylate d'éthyle dans 5ml de tétrahydrofuranne et 0,5m1 d'eau. Le mélange
réactionnel est
agité à température ambiante pendant 18 heures. Après refroidissement, la
réaction est
traitée par l'addition d'une solution aqueuse d'acide chlorhydrique de
concentration 1M ainsi
que de l'eau puis extraite avec de l'acétate d'éthyle. Les phases organiques
sont
rassemblées, lavées par une solution saturée de chlorure de sodium, séchées
sur sulfate de
magnésium, filtrées, évaporées. 0,05g (16%) d' acide (Z)-3-{4-[2-(4-
acetylamino-phenyl)-
ethoxy]-3-butoxy-phenyl}-2-ethoxy-acrylique sous la forme d'un solide blanc de
point de
fusion 160 C.
RMN ' H(â, CDCI3) : 0,90 (t, 3H, J=7,4Hz); 1,25 (t, 3H, J=7,1 Hz); 1,43 (m,
2H); 1,67 (m, 2H);
2,95 (t, 2H, J=6,5Hz); 3,84-3,89 (m, 2H); 4,10 (t, 2H, J=6,6Hz); 6,81 (d, 1H,
J=8,4Hz); 6,86
(s, 1H); 7,12 (dd, 1H, J=1,9Hz, J=8,4Hz); 7,17 (d, 2H, J=8,4Hz); 7,37 (d, 2H,
J=8,4Hz); 7,47
(d, 1H, J=1,9Hz).
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
52
Exemple 22 : acide (Z)-3-(4-{2-[4-(butane-1-sulfonylamino)-phenyl]-
ethoxy}-3-butoxy-phenyl)-2-ethoxy- acrylique
a- (Z)-3-(4-{2-(4-(butane-1-su/fonvlamino)-ahenvll-ethoxvl-3-butoxv-ahenvl)-2-
ethoxv-
acrvlate d'éthvle
A une solution de 1,2g (2,8 mmoles) de (Z)-3-{4-[2-(4-amino-phenyl)]-ethoxy-3-
butoxy-
phenyl}-2-ethoxy-acrylate d'éthyle (préparé selon l'exemple 21b), 0,6m1 (4,2
mmoles) de
triéthylamine dans 15m1 de dichlorométhane, 0,5m1 (4,2 mmoles) de chlorure de
butanesulfonyle sont additionnés. Le milieu réactionnel est agité à
température ambiante
pendant 15 heures puis concentré sous vide. Le résidu obtenu est purifié par
chromatographie sur colonne de silice élué avec un mélange heptane / acétate
d'éthyle
80/20. 0,64g (43%) de (Z)-3-(4-{2-[4-(butane-1-sulfonylamino)-phenyl]-ethoxy}-
3-butoxy-
phenyl)-2-ethoxy-acrylate d'éthyle sont obtenus.
b- acide LZL(4-{2-(4-(butane-1-su/fonv/amino)_phenyil-ethoxyl-3-butoxy_phenvl -
2-ethoxy-
acrvlique
2ml (5 mmoles) d'une solution aqueuse d'hydroxyde de sodium 10% sont
additionnés sur
une solution de 0,8g (1,2 mmoles) de (Z)-3-(4-{2-[4-(butane-1-sulfonylamino)-
phenyl]-
ethoxy}-3-butoxy-phenyl)-2-ethoxy-acrylate d'éthyle dans 15m1 d'acétone. Le
mélange
réactionnel est agité à 56 C pendant 2 heures. Après refroidissement, la
réaction est traitée
par l'addition de 6ml d'une solution aqueuse d'acide acétique de concentration
1M ainsi que
50m1 d'eau puis extraite avec de l'acétate d'éthyle. Les phases organiques
sont
rassemblées, lavées par une solution saturée de chlorure de sodium, séchées
sur sulfate de
magnésium, filtrées et évaporées. Le produit est recristallisé dans un mélange
diisopropyléther/acétate d'éthyle pour obtenir 0,4g (61%) d'acide (Z)-3-(4-{2-
[4-(butane-1-
sulfonylamino)-phenyl]-ethoxy}-3-butoxy-phenyl)-2-ethoxy-acrylique sous la
forme d'un
solide beige de point de fusion 164 C.
RMN ' H(â, CDCI3) : 0,83 (t, 3H, J=7,3Hz); 0,94 (t, 3H, J=7,3Hz); 1,32 (t, 3H,
J=7,1 Hz); 1,43-
1,48 (m, 2H); 1,71-1,78 (m, 4H); 2,98-3,07 (m, 2H); 3,92-3,98 (m, 4H); 4,14
(t, 2H, J=6,7Hz);
6,34 (s, 1 H); 6,76 (d, 1 H, J=8,4Hz); 7,02 (s, 1 H); 7,08 (d, 2H, J=8,4Hz);
7,14 (m, 1 h); 7,24 (d,
2H, J=8,4Hz); 7,49 (s, 1 H).
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
53
Exemple 23 : acide (Z)-3-(3-butoxy-4-{2-[4-(méthanesulfonyl-méthyl-
amino)-phenyl]-ethoxy} -phenyl)-2-éthoxy-acrylique
a- (Z)-3-(3-butoxv-4-(2-(4-méthanesulfonvlamino-ahenvl)-ethoxvl-ahenvll-2-
éthoxv-acrvlate
d'éthvle
A une solution de 0,1g (0,2 mmoles) de (Z)-3-{4-[2-(4-amino-phényl)]-ethoxy-3-
butoxy-
phenyl}-2-ethoxy-acrylate d'éthyle (préparé selon l'exemple 21b), 0,05m1 (0,3
mmoles) de
triéthylamine dans 5ml de dichlorométhane, 0,3m1 (4,2 mmoles) de chlorure de
méthanesulfonyle sont additionnés. Le milieu réactionnel est agité à
température ambiante
pendant 15 heures puis concentré sous vide. Le résidu obtenu est purifié par
chromatographie sur colonne de silice élué avec un mélange heptane / acétate
d'éthyle
70/30. 0,1g (83%) de (Z)-3-(3-butoxy-4-{2-[4-(méthanesulfonyl-méthyl-amino)-
phenyl]-
ethoxy}-phenyl)-2-ethoxy-acrylate d'éthyle sont obtenus.
b- LZL(3-butoxv-4-{2-(4-(methanesulfonvl-methvl-amino)_phenyll-ethoxy}-phenvl -
2-ethox~
acrvlate d'éthvle
8mg (0,2 mmole) d'hydrure de sodium 60% sont ajoutés à une solution de 0,09g
(0,2 mmole)
de (Z)-3-(3-butoxy-4-{2-[4-(méthanesulfonyl-méthyl-amino)-phenyl]-ethoxy}-
phenyl)-2-
ethoxy-acrylate d'éthyle dans 5ml de diméthylformamide puis le milieu
réactionnel est agité
pendant dix minutes à température ambiante et 0,02m1 (0,3 mmole) d'iodométhane
sont
additionnés. Après addition d'eau, le milieu réactionnel est extrait à
l'acétate d'éthyle. Les
phases organiques sont rassemblées, séchées sur sulfate de magnésium,
filtrées,
évaporées. 45mg (50%) de (Z)-3-(3-butoxy-4-{2-[4-(méthanesulfonyl-méthyl-
amino)-phenyl]-
ethoxy}-phenyl)-2-éthoxy-acrylate d'éthyle sont obtenus.
c- acide (Z)-3-(3-butoxv-4-(2-[4-(methanesulfonvl-methvl-amino)-ghenvll-
ethoxv)-ahenvl)-2-
ethoxy-acryligue:
0,12m1 (0,12 mmole) d'une solution aqueuse d'hydroxyde de lithium de
concentration 1M
sont additionnés sur une solution de 0,04g (0,08 mmole) de (Z)-3-(3-butoxy-4-
{2-[4-
(methanesulfonyl-méthyl-amino)-phenyl]-éthoxy}-phenyl)-2-éthoxy-acrylate
d'éthyle dans 3ml
d'acétone et 1 ml d'eau. Le mélange réactionnel est agité à 35 C pendant 18
heures._Après
refroidissement, la réaction est traitée par l'addition de 0,2m1 d'une
solution aqueuse d'acide
acétique de concentration 1M et 10m1 d'eau puis extraite avec de l'acétate
d'éthyle. Les
phases organiques sont rassemblées, lavées par une solution aqueuse saturée de
chlorure
de sodium, séchées sur sulfate de magnésium, filtrées, évaporées._Le produit
est purifié par
chromatographie sur colonne de silice élué avec un mélange heptane/acétate
d'éthyle: 50/50
pour obtenir 25mg (64%) d'acide (Z)-3-(3-butoxy-4-{2-[4-(methanesulfonyl-
methyl-amino)-
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
54
phenyl]-ethoxy}-phenyl)-2-ethoxy-acrylique sous la forme d'un solide blanc de
point de fusion
112 C.
RMN ' H(â, CDCI3) : 0,94 (t, 3H, J=7,4Hz); 1,32 (t, 3H, J=7,1 Hz); 1,45 (m,
2H); 1,78 (m, 2H);
2,77 (s, 3H); 3,08 (t, 2H, J=6,7Hz); 3,24 (s, 3H); 3,92-3,97 (m, 4H); 4,16 (t,
2H, J=6,8Hz);
6,76 (d, 1 H, J=8,4Hz); 7,02 (s, 1 H); 7,14-7,30 (m, 5H); 7,49 (d, 1 H,
J=1,9Hz).
Exemple 24 : acide (Z)-3-{3-butoxy-4-[2-(4-methanesulfonylamino-
phenyl)-ethoxy]-phenyl}-2-ethoxy-acrylique
4,4m1 (11 mmoles) d'une solution aqueuse d'hydroxyde de sodium 10% sont
additionnés sur
une solution de 1,6g (2,7 mmoles) de (Z)-3-(3-butoxy-4-{2-[4-
(méthanesulfonylamino)-
phenyl]-éthoxy}-phenyl)-2-éthoxy-acrylate d'éthyle (préparé selon l'exemple
23a) dans 30m1
d'acétone et 5ml d'eau. Le mélange réactionnel est agité à 56 C pendant 24
heures. Après
refroidissement, la réaction est traitée par l'addition de 12m1 d'une solution
aqueuse d'acide
acétique de concentration 1 M ainsi que 100m1 d'eau puis extraite avec de
l'acétate d'éthyle.
Les phases organiques sont rassemblées, lavées par une solution saturée de
chlorure de
sodium, séchées sur sulfate de magnésium, filtrées, évaporées. Le produit est
recristallisé
dans un mélange diisopropylether/acétate d'éthyle pour obtenir 0,8g (61 %)
d'acide (Z)-3-(4-
{2-[4-(méthanesulfonylamino)-phenyl]-ethoxy}-3-butoxy-phenyl)-2-ethoxy-
acrylique sous la
forme d'un solide beige de point de fusion 141 C.
RMN'H (6, CDC13) : 0,94 (t, 3H, J=7,4Hz); 1,32 (t, 3H, J=7,lHz); 1,43-1,49 (m,
2H); 1,73-
1,78 (m, 2H); 2,93 (s, 3H); 3,05 (t, 2H, J=6,6Hz); 3,92-3,98 (m,4H); 4,14 (t,
2H, J=6,7Hz);
6,56 (s, 1 H); 6,76 (d, 1 H, J= 8,4Hz); 7,02 (s, 1 H); 7,09 (d, 2H, J=8,4Hz);
7,15 (m, 1 H); 7,25
(d, 2H, J=8,4Hz); 7,50 (s, 1 H).
Exemple 25 : acide (Z)-3-[4-(2-{4-[(butane-1-sulfonyl)-methyl-amino]-
phenyl}-ethoxy)-3-butoxy-phenyl]-2- ethoxy-acrylique
a- (Z)-3-j4-(2-{4-[(butane-1-sulfonvl)-methvl-amino]_phenvll-ethoxY)-3-
butoxv-phenvll-2-ethoxv-acrvlate d'éthyle
56mg (1,4 mmole) d'hydrure de sodium 60% sont ajoutés à une solution de 0,64g
(1,2
mmole) de (Z)-3-(4-{2-[4-(butane-1-sulfonylamino)-phenyl]-ethoxy}-3-butoxy-
phenyl)-2-
ethoxy-acrylate d'éthyle (préparé selon l'exemple 22a) dans 10m1 de
diméthylformamide puis
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
le milieu réactionnel est agité pendant vingt minutes à température ambiante
et 0,1ml (1,75
mmole) d'iodométhane sont additionnés et le milieu réactionnel est agité à
température
ambiante pendant 2 heures. Après addition d'eau, le milieu réactionnel est
extrait à l'acétate
d'éthyle. Les phases organiques sont rassemblées, séchées sur sulfate de
magnésium,
5 filtrées, évaporées. Le résidu obtenu est purifié par chromatographie sur
colonne de silice
élué avec un mélange heptane / acétate d'éthyle 70/30. 0,54g (82%) de (Z)-3-[4-
(2-{4-
[(butane-1-sulfonyl)-methyl-amino]-phenyl}-ethoxy)-3-butoxy-phenyl]-2-ethoxy-
acrylate
d'éthyle sont obtenus.
10 b- acide (Z)-3-(3-butoxy-4-f2-[4-(butane-1-sulfonyl-methyl-amino)-phenyll-
ethoxyl-phenyl)-2-
ethoxy-acryligue
1,4m1 (1,4 mmoles) d'une solution aqueuse d'hydroxyde de lithium de
concentration 1M sont
additionnés sur une solution de 0,54g (1 mmole) de (Z)-3-(3-butoxy-4-{2-[4-
(butane-1-
sulfonyl-methyl-amino)-phenyl]-ethoxy}-phenyl)-2-ethoxy-acrylate d'éthyle dans
12m1
15 d'acétone et 3ml d'eau. Le mélange réactionnel est agité à 35 C pendant 18
heures. Après
refroidissement, la réaction est traitée par l'addition de 2,5m1 d'une
solution aqueuse d'acide
acétique de concentration 1 M ainsi que 30m1 d'eau puis extraite avec de
l'acétate d'éthyle.
Les phases organiques sont rassemblées, lavées par une solution saturée de
chlorure de
sodium, séchées sur sulfate de magnésium, filtrées et évaporées. Le produit
brut est
20 recristallisé dans un mélange diisopropyl éther/acétate d'éthyle pour
obtenir 0,4g (82%)
d'acide (Z)-3-(3-butoxy-4-{2-[4-(butane-1-sulfonyl-methyl-amino)-phenyl]-
ethoxy}-phenyl)-2-
ethoxy-acrylique sous la forme d'un solide blanc de point de fusion 144 C.
RMN'H (8, CDCI3) : 0,69 (t, 3H, J=7,3Hz); 0,78 (t, 3H, J= 7,4Hz); 1,17 (t, 3H,
J=7,1Hz); 1,30
25 (, 2H); 1,56-1,163 (m, 4H); 2,73-2,77 (m, 2H); 2,92 (t, 2H, J=6,7Hz); 3,10
(s, 3H); 3,76-3,81
(m, 4H); 4,00 (t, 2H, J=6,7Hz); 6,61 (d, 1H, J=8,4Hz); 6,99 (s, 1H); 7,01-7,13
(m, 5H); 7,33
(d, 1H, J=1,9Hz).
30 Exemple 26 : acide (Z)-3-{3-butoxy-4-[3-(4-methoxy-phenyl)-propyl]-
phenyl]- 2-ethoxy-acrylique
a- 3-butoxv-4-(3-(4-methoxyphenvl -propenyil-benzoate de méthvle
35 170mg (0,5 mmoles) de 2-(dicyclohexylphosphino)biphényle, 50mg (0,25
mmoles) d'acétate
de palladium puis 2ml (14 mmoles) de triéthylamine sont ajoutés sur une
solution de 4g (12
mmoles) de 3-butoxy-4-iodo-benzoate de méthyle (préparé selon l'exemple 2c) et
2,1g (14
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
56
mmoles) de 4-allylanisole dans 10 ml de diméthylformamide. Le mélange
réactionnel est
chauffé à 90 C pendant 15 heures. Après addition de 20 ml d'eau puis
extraction avec de
l'acétate d'éthyle, les phases organiques sont rassemblées, lavées avec une
solution
saturée de chlorure de sodium et séchées sur sulfate de sodium, filtrées,
évaporées. 4,5g
(100%) de 3-butoxy-4-[(E)-3-(4-methoxy-phenyl)-propenyl]-benzoate de méthyle
sont
obtenus sous forme d'une huile jaune.
b- 3-butoxv-4-[3-(4-methoxv-phenvl)-propvll-benzoate de méthvle
0,45g (10% en poids) de palladium sur charbon 10% sont ajoutés à une solution
de 4,5g (13
mmoles) de 3-butoxy-4-[(E)-3-(4-methoxy-phenyl)-propenyl]-benzoate de méthyle
dans 60m1
de tétrahydrofurane préalablement purgé à l'azote. Le milieu est ensuite placé
sous 3 bars
d'hydrogène pendant 3 heures. Après filtration sur célite, le filtrat est
concentré sous vide.
3,6g (80%) de 3-butoxy-4-[3-(4-methoxy-phenyl)-propyl]-benzoate de méthyle
sont obtenus.
c- {3-butoxv-4-(3-(4-methoxy_phenvl -propvll-phenyl}-méthanol
0,9g (40 mmoles) de lithium borohydrure sont ajoutés par portions à une
solution
préalablement refroidie à 0 C de 3,6g (10 mmoles) de 3-butoxy-4-[3-(4-methoxy-
phenyl)-
propyl]-benzoate de méthyle dans 80m1 de tétrahydrofurane et 4ml de
diméthylformamide.
Après addition de 0 C jusqu'à température ambiante pendant 15 heures, le
milieu
réactionnel est hydrolysé par addition lente de glace et d'eau puis extrait
avec de l'acétate
d'éthyle. La phase organique est lavée avec une solution aqueuse de chlorure
de sodium,
séchée sur sulfate de sodium, filtrée, évaporée. Le résidu est purifié par
chromatographie sur
colonne de silice élué avec un mélange heptane / acétate d'éthyle. 2,1g (75%)
de {3-butoxy-
4-[3-(4-methoxy-phenyl)-propyl]-phenyl}-méthanol.
d- 3-butoxv-4-f2-(4-methoxv-ahenvl)-ethoxvl-benzaldéhvde
8,2g (94 mmoles) de dioxyde de manganèse sont ajoutés à une solution de 2,05g
(6,2
mmoles) de {3-butoxy-4-[3-(4-methoxy-phenyl)-propyl]-phenyl}-methanol dans
50m1 de
dichlorométhane. Après agitation à température ambiante pendant 15 heures, le
milieu
réactionnel est filtré sur célite et le filtrat est concentré sous vide. Le
résidu est purifié par
chromatographie sur colonne de silice élué avec un mélange heptane / acétate
d'éthyle 92/8.
1,6g (79%) de 3-butoxy-4-[2-(4-methoxy-phenyl)-ethoxy]-benzaldéhyde sont
obtenus.
e- (Z)-3-{3-butoxv-4-(3-(4-methoxv-ahenvl)-proovll-ahenvl)- 2-ethoxy-
acrylate d'éthyle
2,8m1 (20 mmoles) de triéthylamine sont additionnés à une solution de 1,6g (5
mmoles) de 3-
butoxy-4-[2-(4-methoxy-phenyl)-ethoxy]-benzaldehyde et de 3,1g (7,3 mmoles) de
chlorure
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
57
de (éthoxy-éthoxycarbonyl-methyl)-triphenyl-phosphonium (préparé selon
l'exemple 3a) dans
30m1 de tétrahydrofurane. Après agitation à 60 C pendant 7 heures, le milieu
réactionnel est
concentré sous vide. Le résidu est purifié par chromatographie sur colonne
élué avec un
mélange heptane / acétate d'éthyle. 1,3g (60%) de (Z)-3-{3-butoxy-4-[3-(4-
méthoxy-phényl)-
propyl]-phenyl}- 2-éthoxy-acrylate d'éthyle sont obtenus.
f- acide (Z)-3-{3-butoxv-4-(3-(4-méthoxv-phenvl)-propv/l-phenvl)- 2-éthoxv-
acrvlipue
0,1g (2,7 mmoles) d'hydroxyde de sodium en pastilles sont ajoutés sur une
solution de 0,4g
(0,9 mmoles) de (Z)-3-{3-butoxy-4-[2-(4-méthoxy-phenyl)-éthoxy]-phenyl}-2-
éthoxy-acrylate
d'éthyle dans 5ml d'un mélange tétrahydrofuranne/ eau / méthanol 5/1/1. Le
mélange
réactionnel est agité à 55 C pendant 7 heures puis 0,2g (0,5 mmoles)
d'hydroxyde de
sodium et 5ml d'acétone sont additionnés et le milieu réactionnel est à
nouveau chauffé
pendant 15 heures. Après refroidissement, la réaction est traitée par
l'addition d'une solution
aqueuse d'acide acétique jusqu'à pH4-5 ainsi que de l'eau puis extraite avec
de l'acétate
d'éthyle. Les phases organiques sont rassemblées, lavées par une solution
saturée de
chlorure de sodium, séchées sur sulfate de magnésium, filtrées, évaporées. Le
résidu
obtenu est purifié par chromatographie sur colonne élué avec un mélange
heptane / acétate
d'éthyle 80/20. 0,2g (50%) d' acide (Z)-3-{3-butoxy-4-[3-(4-méthoxy-phényl)-
propyl]-phenyl}-
2-éthoxy-acrylique sont obtenus sous forme d'un solide blanc de point de
fusion 65 C.
RMN ' H(8, CDCI3) : 0,91 (t, 3H, J=7,4Hz); 1,33 (t, 3H, J=7,1 Hz); 1,45 (m,
2H); 1,70 (m, 2H);
1,79 (m, 2H); 2,52-2,60 (m, 4H); 3,70 (s, 3H); 3,90 (t, 2H, J=6,6Hz); 3,97 (q,
2H, J=7,lHz);
6,74 (d, 2H, J=8,4Hz); 7,02-7,10 (m, 2H); 7,12 (d, 2H, J=8,4Hz); 7,16 (m, 1H);
7,39 (s, 1H).
Exemple 27 : acide (Z)-3-(4-{2-[4-(acétyl-méthyl-amino)-phenyl]-éthoxy}-
3-butoxy-phenyl)-2-ethoxy-acrylique
a- (Z)-3-(4-{2-(4-(acétvl-méthvl-amino)_phenvil-ethoxy)-3-butoxv-phenvl)-2-
ethoxy-acrylate d'éthyle
50mg (1,2 mmole) d'hydrure de sodium 60% sont ajoutés à une solution de 0,5g
(1 mmole)
de (Z)-3-{4-[2-(4-acétylamino-phenyl)-ethoxy]-3-butoxy-phenyl}-2-ethoxy-
acrylate d'éthyle
(préparé selon l'exemple 21c) dans 8ml de diméthylformamide puis le milieu
réactionnel est
agité pendant dix minutes à température ambiante et 0,2m1 (3 mmoles)
d'iodométhane sont
additionnés. Après addition d'eau, le milieu réactionnel est extrait à
l'acétate d'éthyle. Les
phases organiques sont rassemblées, séchées sur sulfate de magnésium,
filtrées,
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
58
évaporées. Le résidu obtenu est purifié par chromatographie sur colonne de
silice élué avec
un mélange heptane / acétate d'éthyle 75/25. 410mg (80%) de (Z)-3-(4-{2-[4-
(acétyl-méthyl-
amino)-phényl]-éthoxy}-3-butoxy-phenyl)-2-éthoxy-acrylate d'éthyle sont
obtenus.
b- acide (Z)-3-(4-{2-(4-(acétvl-méthvl-amino)-ahenvll-ethoxvl-3-butoxv-
phenvl)-2-éthoxv-acrvlioue
0,2g (5 mmoles) d'hydroxyde de sodium en pastilles sont ajoutés sur une
solution de 0,4g
(0,8 mmoles) de (Z)-3-(4-{2-[4-(acétyl-méthyl-amino)-phényl]-éthoxy}-3-butoxy-
phenyl)-2-ethoxy-acrylate d'éthyle dans 5ml d'un mélange acétone / eau 1/1. Le
mélange réactionnel est agité à température ambiante pendant 18 heures. Après
refroidissement, la réaction est traitée par l'addition d'une solution aqueuse
d'acide acétique
jusqu'à pH4-5 ainsi que de l'eau puis extraite avec de l'acétate d'éthyle. Les
phases
organiques sont rassemblées, lavées par une solution aqueuse saturée de
chlorure de
sodium, séchées sur sulfate de magnésium, filtrées, évaporées. Le résidu
obtenu est purifié
par chromatographie sur colonne élué avec un mélange heptane / acétate
d'éthyle 75/25.
0,3g (80%) d' acide (Z)-3-(4-{2-[4-(acétyl-méthyl-amino)-phényl]-éthoxy}-3-
butoxy-phenyl)-2-
éthoxy-acrylique sont obtenus sous forme d'un solide blanc de point de fusion
121 C.
RMN ' H(S, CDCI3) : 0,92 (t, 3H, J=7,4Hz); 1,30 (t, 3H, J=7,1 Hz); 1,40-1,50
(m, 2H); 1,75 (m,
2H); 1,83 (s, 3H); 3,09 (t, 2H, J=6,6Hz); 3,19 (s, 3H); 3,93-3,99 (m, 4H);
4,17 (t, 2H,
J=6,6Hz); 6,76 (d, 1H, J= 8,4Hz); 7,04 (s, 1H); 7,15 (d, 2H, J=8,4Hz); 7,17
(m, 1H); 7,31 (d,
2H, J=8,4Hz); 7,51 (d, 1H, J=1,9Hz).
Exemple 28 : acide (Z)-3-{3-butoxy-4-[2-(4-propionylamino-phenyl)-
ethoxy]- phenyl}-2-ethoxy-acrylique
a- (Z)-3-{3-butoxv-4-(2-(4-propionvlamino-phenvl)-éthoxy]-phenvi)-2-éthoxv-
acrvlate d'éthyle
0,1 ml (1,3 mmole) de chlorure de propionyle sont additionnés sur une solution
de 0,5g (1,2
mmole) de (Z)-3-{4-[2-(4-amino-phényl)]-éthoxy-3-butoxy-phenyl}-2-éthoxy-
acrylate d'éthyle
(préparé comme décrit dans l'exemple 21b), 0,2 ml (1,2 mmoles) de
triéthylamine dans 8 ml
de tétrahydrofurane préalablement refroidie à 0 C. Après agitation à
température ambiante
pendant 15 heures, le milieu réactionnel est traité avec de l'eau et de
l'acétate d'éthyle. Les
phases organiques sont lavées à l'eau, séchées sur sulfate de magnésium,
filtrées,
évaporées. Le résidu obtenu est purifié par chromatographie sur colonne de
silice élué avec
un mélange heptane / acétate d'éthyle 80/20. 0,5g (88%) de (Z)-3-{3-butoxy-4-
[2-(4-
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
59
propionylamino-phenyl)-éthoxy]-phenyl}-2-éthoxy-acrylate d'éthyle sont
obtenus.
b- acide (Z)-3-(3-butoxv-4-(2-(4-proaionv/amino-phenvl)-ethoxvl- phenvll-2-
ethoxv-acrvlipue
0,15g (3,1 mmoles) d'hydroxyde de sodium en pastilles sont ajoutés sur une
solution de
0,25g (5,2 mmoles) de (Z)-3-{3-butoxy-4-[2-(4-propionylamino-phenyl)-éthoxy]-
phenyl}-2-
éthoxy-acrylate d'éthyle dans 5ml d'un mélange acétone / eau 1/1. Le mélange
réactionnel
est agité à température ambiante pendant 18 heures. Après refroidissement, la
réaction est
traitée par l'addition d'une solution aqueuse d'acide acétique jusqu'à pH4-5
ainsi que de
l'eau puis extraite avec de l'acétate d'éthyle. Les phases organiques sont
rassemblées,
lavées par une solution saturée de chlorure de sodium, séchées sur sulfate de
magnésium,
filtrées, évaporées. Le résidu obtenu est purifié par chromatographie sur
colonne de silice
élué avec un mélange heptane / acétate d'éthyle 75/25. 0,2g (87%) d'acide (Z)-
3-{3-butoxy-
4-[2-(4-propionylamino-phényl)-ethoxy]- phenyl}-2-éthoxy-acrylique sont
obtenus sous forme
d'un solide blanc de point de fusion 164 C.
RMN ' H(8, CDC13) : 0,88 (t, 3H, J=7,4Hz); 1,09 (t, 3H, J=7,1 Hz); 1,23 (t,
3H, J=7,1 Hz); 1,40
(m, 2H); 1,65 (m, 2H); 2,24 (q, 2H, J=7,6Hz); 2,27 (t, 2H, J=6,5Hz); 3,83-3,89
(m, 4H); 4,08
(t, 2H, J=6,5Hz); 6,78 (d, 1H, J=8,4Hz); 6,85 (s, 1H); 7,10 (dd, 1H, J=1,7Hz,
J=8,4Hz); 7,15
(d, 2H, J=8,4Hz); 7,37 (d, 2H, J=8,4Hz); 7,46 (s, 1 H).
Exemple 29 : TESTS DE TRANSACTIVATION PPARs EN COURBES CROISEES
L'activation des récepteurs PPAR par un agoniste (activateur) dans des
cellules HeLN
conduit à l'expression d'un gène reporter, la luciférase, qui, en présence
d'un substrat
génère de la lumière. La modulation des récepteurs PPAR est mesurée en
quantifiant la
luminescence produite après incubation des cellules en présence d'un agoniste
de
référence. Les ligands vont déplacer l'agoniste de son site. La mesure de
l'activité se fait par
la quantification de la lumière produite. Cette mesure permet de déterminer
l'activité
modulatrice des composés selon l'invention par la détermination de la
constante qui
représente l'affinité de la molécule pour le récepteur PPAR. Cette valeur
pouvant fluctuer
selon l'activité basale et l'expression du récepteur, on la dénomme Kd
apparent (KdApp en
nM).
Pour déterminer cette constante, des courbes croisées du produit à tester
contre un
agoniste de référence sont réalisées en plaque de 96 puits : 10 concentrations
du produit à
tester plus une concentration 0 sont disposées en ligne, et 7 concentrations
de l'agoniste
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
plus une concentration 0 sont disposées en colonne. Ceci représente 88 points
de mesure
pour 1 produit et 1 récepteur. Les 8 puits restants sont utilisés pour des
contrôles de
répétabilité.
Dans chaque puits, les cellules sont en contact avec une concentration du
produit à tester et
5 une concentration de l'agoniste de référence, l'acide 2-(4-{2-[3-(2,4-
difluoro-phenyl)-1-heptyl-
ureido]-ethyl}-phenylsulfanyl)-2-methyl-propionique pour PPARa, l'acide {2-
methyl-4-[4-
methyl-2-(4-trifluoromethyl-phenyl)-thiazol-5-ylmethylsulfanyl]-phenoxy}-
acetique pour
PPAR8 et le 5-{4-[2-(methyl-pyridin-2-yl-amino)-ethoxy]-benzyl}-thiazolidine-
2,4-dione pour
PPARy. Des mesures sont également réalisées pour les témoins agonistes totaux
avec les
10 mêmes produits.
Les lignées cellulaires HeLN utilisées sont des transfectants stables
contenant les plasmides
ERE-RGlob-Luc-SV-Neo (gène reporter) et PPAR (a, â, y) Gal-hPPAR. Ces cellules
sont
ensemencées en plaques 96 puits à raison de 10 000 cellules par puits dans
100u1 de milieu
DMEM sans rouge de phénol et supplémenté par 10% de sérum de veau délipidé.
Les
15 plaques sont ensuite incubées à 37 C, 7% C02 pour 16 heures.
Les différentes dilutions des produits à tester et du ligand de référence sont
rajoutées à
raison de 5 pl par puits. Les plaques sont ensuite incubées 18 heures à 37 C,
7% C02.
Le milieu de culture est éliminé par retournement et 100 pl d'un mélange 1 : 1
PBS/Luciferine
est ajouté à chaque puits. Après 5 minutes, les plaques sont lues par le
lecteur de
20 luminescence.
Ces courbes croisées permettent de déterminer les AC50 (concentration à
laquelle on
observe 50% d'activation) du ligand de référence à différentes concentrations
de produit à
tester. Ces AC50 sont utilisées pour calculer la régression de Schild en
traçant une droite
répondant à l'équation de Schild ( quantitation in receptor pharmaco/ogy
Terry P.Kenakin,
25 Receptors and Channels, 2001,Z, 371-385) qui conduit à l'obtention des
valeurs de Kd app
(en nM).
Résultats de transactivation
PPAR alpha PPARs delta PPAR gamma
Composés Kd app (nM) Kd app (en nM) Kd app (en nM)
Référence 1 : acide 2-(4-{2-[3- 200 n.a. n.a
(2,4-difluoro-phenyl)-1-heptyl-
ureido]-ethyl}-phenylsulfanyl)-2-
meth I-propionique
Référence 2 : acide {2-methyl-4- n.a. 10 n.a
[4-methyl-2-(4-trifluoromethyl-
phenyl)-thiazol-5-
ylmethylsulfanyl]-phenoxy}-
acetique
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
61
Référence 3 : 5-{4-[2-(methyl- n.a n.a 30
pyrid in-2-yl-am i no)-eth oxy]-
benz I -thiazolidine-2,4-dione
Exemple 1 9999 9999 8
Exemple 3 60 250 15
Exemple 6 120 4000 2
Exemple 7 250 4000 15
Exemple 8 120 2000 15
Exemple 9 2000 4000 8
Exemple 13 250 2000 8
Exemple 17 60 1000 8
Ces résultats montrent l'affinité des composés pour les récepteurs PPAR et
plus
particulièrement la spécificité de l'affinité des composés de l'invention pour
le sous-type
PPARy, comparée à l'affinité des composés pour le sous-type PPAR ou pour le
sous-type
PPARB.
EXEMPLE 30 : COMPOSITIONS
Dans cet exemple, diverses formulations concrètes à base des composés selon
l'invention
sont illustrées.
A- VOIE ORALE
(a) Comprimé de 0,2 g
- Composé de l'exemple 1 0,001 g
-Amidon 0,114 g
- Phosphate bicalcique 0,020 g
- Silice 0,020 g
- Lactose 0,030 g
- Talc 0,010 g
- Stéarate de magnésium 0,005 g
(b) Suspension buvable en ampoules de 5 ml
- Composé de l'exemple 3 0,001 g
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
62
- Glycérine 0,500 g
- Sorbitol à 70% 0,500 g
- Saccharinate de sodium 0,010 g
- Parahydroxybenzoate de méthyle 0,040 g
- Arome qs
- Eau purifiée qsp5 ml
(c) Comprimé de 0,2 g
- Composé de l'exemple 6 0,050 g
- Lactose monohydrate 0,132 g
- Crospovidone 0,007 g
- Povidone 0,005 g
- Aérosil 200 0,004 g
- Stéarate de magnésium 0,002g
(d) Suspension buvable en ampoules de 10 ml
- Composé de l'exemple 7 0,200 g
- Glycérine 1,000 g
- Sorbitol à 70% 1,000 g
- Saccharinate de sodium 0,010 g
- Parahydroxybenzoate de méthyle 0,080 g
- Arome qs
- Eau purifiée qsp 10 ml
B- VOIE TOPIQUE
(a) Onguent
- Composé de l'exemple 8 0,020 g
- Myristate d'isopropyle 81,700 g
- Huile de vaseline fluide 9,100 g
- Silice ("Aérosil 200") 9,180 g
(b) Onguent
- Composé de l'exemple 3 0,300 g
- Vaseline blanche codex qsp 100 g
CA 02688241 2009-11-25
WO 2008/152334 PCT/FR2008/050997
63
(c) Crème Eau-dans-Huile non ionique
- Composé de l'exemple 1 0,100 g
- Mélange d'alcools de lanoline émulsifs, de cires
et d'huiles ("Eucerine anhydre") 39,900 g
- Parahydroxybenzoate de méthyle 0,075 g
- Parahydroxybenzoate de propyle 0,075 g
- Eau déminéralisée stérile qsp 100 g
(d) Lotion
- Composé de l'exemple 3 0,100 g
- Polyéthylène glycol (PEG 400) 69,900 g
- Ethanol à 95% 30,000 g
(e) Onguent hydrophobe
- Composé de l'exemple 6 0,300 g
- Miristate d'isopropyle 36,400 g
- Huile de silicone ("Rhodorsil 47 V 300" 36,400 g
- Cire d'abeille 13,600 g
- Huile de silicone ("Abil 300.000 cst" qsp 100 g
(f) Crème Huile-dans-Eau non ionique
- Composé de l'exemple 9 1,000 g
- Alcool cétylique 4,000 g
- Monostéarate de glycérole 2,500 g
- Stéarate de PEG 50 2,500 g
- Beurre de karité 9,200 g
- Propylène glycol 2,000 g
- Parahydroxybenzoate de méthyle 0,075 g
- Parahydroxybenzoate de propyle 0,075 g
- Eau déminéralisée stérile qsp 100 g