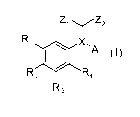Note: Descriptions are shown in the official language in which they were submitted.
CA 02726907 2010-12-03
WO 2009/147217 PCT/EP2009/056885
DIHYDRO ISO CA-4 ET ANALOGUES : PUISSANTS CYTOTOXIQUES,
INHIBITEURS DE LA POLYMERISATION DE LA TUBULINE.
L'invention concerne de nouveaux composés inhibiteurs de la polymérisation de
la tubuline utiles pour le traitement du cancer, leurs procédés de préparation
ainsi que
leurs utilisations.
Le cancer est la cause majeure de décès dans le monde après les maladies
cardiovasculaires. Sur un total mondial de 58 millions de décès enregistrés en
2005, 7,6
millions (soit 13%) étaient dus au cancer. De très nombreux efforts ont été
déployés ces
dernières années en matière de prévention, confort apporté aux patients et
traitements
ciblés. Les progrès de l'oncologie médicale sont dus en grande partie à la
compréhension des différents mécanismes d'action mis en cause lors de cancers,
mais
également au développement de nombreux médicaments cytotoxiques associés ou
non
en polythérapie. On peut citer par exemple le cisplatine, les anthracyclines,
le
méthotrexate, le 5FU, les taxoïdes, l'irinotécan....
Si la chirurgie et la radiothérapie sont des traitements particulièrement
efficaces
lorsqu'un cancer est limité à une seule région de l'organisme, la
chimiothérapie devient
indispensable lorsque les cellules cancéreuses se sont dispersées. Les
médicaments
cytotoxiques peuvent être administrés avant une intervention chirurgicale ou
une
radiothérapie pour réduire la taille de la tumeur. Ils sont très souvent
utilisés après ces
interventions afin d'éliminer les métastases et l'ensemble des cellules
cancéreuses qui
auraient résisté à ces traitements.
Si de très nombreux traitements à base de cytotoxiques ont fait progresser la
recherche médicale (association de cytotoxiques pour éviter les phénomènes de
résistance, réduction des effets indésirables améliorant le confort des
patients, etc.), les
chimiothérapies antitumorales ont besoin de nouvelles molécules efficaces pour
pallier
les phénomènes de résistance aux traitements usuels de plus en plus
fréquemment
rencontrés. Par ailleurs les médicaments actuels utilisés dans les cancers du
sein (27,4%
des cas de cancers chez la femme), poumon (13% des cas et en augmentation
CA 02726907 2010-12-03
WO 2009/147217 2 PCT/EP2009/056885
vertigineuse chez la femme), prostate (15,5%), colon et rectum (13%)
permettent de
diminuer le degré de gravité des tumeurs sans pour autant mener à des
guérisons totales.
Parmi les principaux médicaments anticancéreux utilisés en thérapeutique
humaine, les agents interagissant avec la tubuline occupent une place
importante. Il est
possible de distinguer deux familles d'agents :
(a) les taxanes qui agissent en inhibant la division des cellules cancéreuses
provoquant
ainsi leur mort. Ils favorisent la polymérisation de la tubuline, la
stabilisation de
microtubules non fonctionnels et en inhibent la dépolymérisation. Il s'agit du
paclitaxel
(Taxol) et du docétaxel (Taxotèré ). Ce dernier est l'un des agents de
chimiothérapie
les plus utilisés au monde pour le traitement du cancer du sein, du cancer du
poumon
non à petites cellules et du cancer de la prostate métastatique hormono -
résistant ; et
(b) les alcaloïdes de la pervenche, dont la liaison à la tubuline entraîne une
inhibition de
la polymérisation en microtubules, empêchant ainsi la constitution du fuseau
mitotique.
Il s'agit de la vincristine, de la vindésine, de la vinblastine et de la
vinorelbine, qui
constituent sur le plan mondial près de 10% du marché des produits
antitumoraux
cytotoxiques.
Bien qu'ils soient efficaces, l'utilisation des taxanes et des alcaloïdes des
Vinca
est limitée par le développement de phénomènes de résistance et l'induction
d'effets
indésirables qui nécessitent donc une surveillance systématique. A titre
d'exemple,
citons que la vincristine possède une toxicité nerveuse sensitomotrice alors
que la
toxicité hématologique est souvent le facteur limitant dans le cas d'un
traitement avec la
vinblastine, la vindésine ou la vinorelbine.
Devant l'urgence de cette situation, le développement de nouveaux inhibiteurs
est devenu un enjeu majeur ces dernières années. Les critères recherchés pour
les
nouveaux composés anti-tumoraux sont:
1. l'efficacité de l'activité antitumorae sur diverses souches dans des
modèles in vitro
mais également dans des modèles animaux in vivo,
2. la levée de la multirésistance aux médicaments,
3. la conception de molécules originales hydrosolubles et si possible
possédant une
structure chimique simple,
4. la diminution de la toxicité systémique, et
5. l'identification du mécanisme d'action.
CA 02726907 2010-12-03
WO 2009/147217 3 PCT/EP2009/056885
En 1982, Pettit et coll. (Can. J. Chem. 1982, 60, 1374-1376) ont isolé de
l'écorce
du Combretum caffrum, saule d'Afrique du Sud de la famille des Combretaceae,
la
combrétastatine A-4 (CA-4) représentée ci-dessous.
MeO OH
MeO OMe OMe
CA-4
Cette molécule naturelle de structure extrêmement simple, est caractérisée par
un
motif stilbène de configuration Z substitué sur les deux noyaux aromatiques
par des
groupements méthoxy et un hydroxy. L'intérêt porté à cette molécule par la
communauté scientifique est lié tout particulièrement à ses activités
antitumorales
(cytotoxique et inhibiteur de la polymérisation de la tubuline).
Les premières évaluations biologiques de la combrétastatine A-4 (CA-4) ont
montré:
- une activité cytotoxique très puissante sur de nombreuses lignées
cellulaires avec une
CI50 de l'ordre du nanomolaire (ex: CI50 = 0,9 nM sur cellules HCT 15).
L'activité
cytotoxique de la CA-4 a été également étudiée sur des cellules endothéliales
de la
veine ombilicale humaine (HUVEC) et semble faire intervenir un mécanisme par
apoptose plutôt que par nécrose cellulaire ;
- une activité antimitotique (agent poison du fuseau). Elle se lie à la
tubuline sur le site
de fixation de la Colchicine ce qui a pour conséquence d'inhiber sa
polymérisation en
microtubules empêchant ainsi la formation du fuseau mitotique ; et
- une activité anti-angiogénique in vitro par inhibition de la prolifération
de cellules
endothéliales.
Cependant, in vivo, l'activité antitumorale de la CA-4 décroît, voire
disparaît
totalement (par exemple on n'observe aucune activité antitumorale sur
l'adénocarcinome du colon 26 de souris). Cette baisse ou absence d'activité
peut-être
expliquée d'une part par la faible solubilité dans l'eau due au caractère
lipophile de la
CA-4, ce qui entraîne in vivo une mauvaise pharmacocinétique, et d'autre part
par la
facilité de l'isomérisation de la double liaison de configuration Z en E. A
cet égard, il a
été montré que l'isomère E de la CA-4 possède une activité cytotoxique sur des
cellules
leucémiques P-388 de souris environ 60 fois plus faible que l'isomère Z
naturel.
CA 02726907 2010-12-03
WO 2009/147217 4 PCT/EP2009/056885
En raison de la structure chimique très simple de la CA-4 (par comparaison à
celles des alcaloïdes de Vinca) et de ses activités biologiques, de nombreux
travaux ont
été réalisés sur ce composé et on dénombre à ce jour près de 500 publications
et plus de
70 demandes de brevets.
Des composés analogues de la CA-4 ont été synthétisés et évalués. Les
molécules CA-4-P, OXI4503 et AVE-8062A représentées ci-dessous sont
actuellement
en développement dans différents laboratoires.
OPO3HK - O`\ _OH
MeO OPO3Na2 MeO OPO3HK MeO NHNH2
MeO OMe OMe MeO OMe OMe MeO OMe OMe
CA-4-P 0X14503 AVE-8062A
Elles possèdent cependant une double-liaison de géométrie Z pouvant conduire à
l'isomère E biologiquement peu actif.
La demande internationale WO 2006/026747 et le brevet US 5 929 117
décrivent des dérivés diphényléthylène répondant à la formule suivante
R1 R2
Ra Rc
R3 ~R8
R4 Rb Rd R7
R5 R6
Ces composés, qui existent sous forme d'isomères E ou Z ou de leur mélange,
sont décrits comme étant des inhibiteurs de la tubuline. La plupart des
exemples cités
sont des composés pour lesquels la double liaison est substituée, et en
particulier
monosubstituée par un groupement CN (c'est-à-dire que RI, R2 = H, CN).
Cependant,
aucun test biologique n'a été réalisé. Il est donc difficile de pouvoir
évaluer le réel
potentiel anticancéreux de ces composés.
La publication de Janendra K. Batra et al. (Molecular Pharmacology 1984, 27,
94-102) présente également une étude sur l'activité inhibitrice de la
polymérisation de
la tubuline de dérivés 6-benzyl- 1,3-benzodioxoles de formule suivante :
0 R
O
Ri R2
OMe
CA 02726907 2010-12-03
WO 2009/147217 5 PCT/EP2009/056885
avec R1 et R2 représentant H ou OMe. Il est ainsi apparu que la présence de
groupements méthoxy supplémentaires (c'est-à-dire lorsque R1 et/ou R2 = OMe)
sur le
noyau phényle diminuait l'activité de ces dérivés benzodioxoles.
La demanderesse a ainsi découvert de manière surprenante une nouvelle famille
de composés dérivés de la CA-4 présentant une forte cytotoxicité (CI50 dans la
gamme
nanomolaire) sur une grande variété de lignées cellulaires cancéreuses
humaines, avec
une inhibition de la polymérisation de la tubuline à des concentrations de
l'ordre du
micromolaire. De plus, ces nouveaux composés possèdent des activités anti-
vasculaires.
Plus précisément, l'invention a pour objet les composés de formule (I)
suivante
zl y Z2
R, \ X,A
R 2 R4
R 3 (I)
dans laquelle :
- R1 et R3 représente, indépendamment l'un de l'autre, un groupe méthoxy
éventuellement substitué par un ou plusieurs atomes de fluor,
- R2 et R4 représentent, indépendamment l'un de l'autre, un atome d'hydrogène
ou un
groupe méthoxy éventuellement substitué par un ou plusieurs atomes de fluor,
- A est un cycle choisi dans le groupe comprenant les groupes aryles et
hétéroaryles,
lesdits hétéroaryles étant avantageusement choisis parmi les groupes
quinolyle,
isoquinolyle, imidazolyle, indolyle, benzothiophényle, benzofuranyle,
benzoimidazolyle, purinyle, pyridinyle, pyrrolyle, furanyle et thiophényle,
ledit cycle
pouvant être :
^ soit accolé à un hétérocycle comportant de 5 à 7, et de préférence 6,
chaînons,
comportant éventuellement une ou plusieurs insaturations et étant
éventuellement substitué par un ou plusieurs groupements alkyles en Ci à C4
et/ou par un groupe oxo (=0),
^ soit substitué par un ou plusieurs groupes choisis parmi les atomes
d'halogène, les groupes -B(OH)2, alkyles en Ci à C6 éventuellement substitué
par OH, alcényles en C2 à C4, alcynyles en C2 à C4, aryles, hétéroaryles,
aryloxy,
aryl-(alkyle en Ci à C4), -000H, -NO2, -NR7R8, -NHCOR7, -CONR7R8,
-NHCOOR9, -OSi(alkyle en C1 à C4)3, -NHSO2R9, alkoxy en C1 à C4
CA 02726907 2010-12-03
WO 2009/147217 6 PCT/EP2009/056885
éventuellement substitué par un ou plusieurs atomes de fluor, -OCONR7R8,
-OS02CF3, -OS02R9, -S02R9, -SO3R9, -OSO3H, -OPO(OR10)2, -ONR7R8, -OR11,
-S02NR12R13, -S02NHR14, -OCOR15, -OCOOR16, -SR17 et un résidu d'une
molécule à activité antitumorale lié par l'intermédiaire d'une liaison ester
ou
amide,
les noyaux aryles desdits groupes étant éventuellement substitués par un ou
plusieurs groupes OH, alkoxy en C1 à C4, NR7R8,
- X représente un atome d'azote ou un groupe CH,
- Z1 représente un atome d'hydrogène ou un atome d'halogène, de préférence de
fluor,
et
- Z2 représente un atome d'hydrogène, un atome d'halogène, de préférence de
fluor, un
alkyle en C1 à C4, un aryle ou un groupe -CN, -S02NR12R13, -SO3R9, -COOR15 ou -
COR15,
dans lesquels :
= R7 et R8 représentent, indépendamment l'un de l'autre, un atome d'hydrogène
ou
un groupe alkyle en C1 à C4, aryle ou hétéroaryle, et avantageusement
représentent un atome d'hydrogène ou un groupe alkyle en C1 à C4,
= R9 représente un groupe alkyle en C1 à C4, aryle ou hétéroaryle, et
avantageusement représente un groupe alkyle en C1 à C4,
= R10 représente un atome d'hydrogène ou un groupe alkyle en C1 à C4 ou un
groupe benzyle,
= R11 représente un atome d'hydrogène, un groupe O-protecteur, un sucre, un
aminosucre ou un acide aminé, les groupements OH et NH2 libres des sucres,
aminosucres et acides aminés pouvant être éventuellement substitués par un
groupement O-protecteur et N-protecteur, respectivement,
= R12 et R13 représentent, indépendamment l'un de l'autre, un atome
d'hydrogène
ou un groupe alkyle en C1 à C4, aryle ou hétéroaryle,
= R14 représente un groupe -CO-(alkyle en C1 à C4) ou le reste d'une molécule
d'acide aminé liée au groupement -SO2NH- par l'intermédiaire de sa fonction
acide carboxylique,
CA 02726907 2010-12-03
WO 2009/147217 7 PCT/EP2009/056885
= R15 représente un atome d'hydrogène, un groupe alkyle en C1 à C4, aryle, ou
hétéroaryle, ou un groupe -(CH2)mCO2H ou -(CH2)mNR7R8 avec m représentant
un nombre entier compris entre 1 et 3,
= R16 représente un groupe alkyle en C1 à C4, aryle, ou hétéroaryle, ou un
groupe -
(CH2)mCO2H ou -(CH2)mNR7R8 avec m représentant un nombre entier compris
entre 1 et 3, et
= R17 représente un atome d'hydrogène ou un groupe alkyle en C1 à C4 ou aryle,
ainsi que ses sels pharmaceutiquement acceptables, ses isomères dont les
énantiomères
et mélanges d'isomères en toutes proportions, et ses prodrogues,
à l'exclusion des composés suivants :
o o
OMe Me OEt OEt
OMe MeO MeO OMe
MeO I OMe MeO I I OMe MeO I OMe
OMe OMe OMe OMe
CO2H CO2H
MeO MeO OMe
I I OMe MeO I I
MeO OMe
OMe et OMe
Les composés exclus sont des composés décrits dans les documents suivants : J.
K.
Batra et al. Molécular Pharmacology 1984, 27, 94-102; Klemm, L. H.; Bower, G.
M. J.
Org. Chem. 1958, 23, 344-348; Rigby, J. H. et al. J. Org. Chem. 1990, 55, 5078-
5088.
Cependant, aucun de ces composés n'est décrit comme ayant une activité anti-
cancéreuse. Par le terme "halogène", on entend au sens de la présente
invention les
atomes de fluor, chlore, brome et iode. De manière avantageuse, il s'agira du
fluor, du
brome et du chlore et encore plus avantageusement du fluor.
Par le terme "groupe alkyle en C1 à C4", on entend au sens de la présente
invention tout groupe hydrocarboné saturé comportant de 1 à 4 atomes de
carbone,
linéaire ou ramifié, en particulier les groupes méthyle, éthyle, n-propyle,
isopropyle, n-
butyle, iso-butyle, sec-butyle, et tert-butyle.
Par le terme "groupe alkyle en C1 à C6", on entend au sens de la présente
invention tout groupe hydrocarboné saturé comportant de 1 à 6 atomes de
carbone,
CA 02726907 2010-12-03
WO 2009/147217 8 PCT/EP2009/056885
linéaire ou ramifié, en particulier les groupes méthyle, éthyle, n-propyle,
isopropyle, n-
butyle, iso-butyle, sec-butyle, tert-butyle, pentyle et hexyle.
Par le terme "groupe alcényle en C2 à C4", on entend au sens de la présente
invention tout groupe hydrocarboné comportant de 2 à 4 atomes de carbone,
linéaire ou
ramifié, et comportant au moins une double liaison, tel qu'un groupe vinyle
(éthényle).
Par le terme "groupe alcynyle en C2 à C4", on entend au sens de la présente
invention tout groupe hydrocarboné comportant de 2 à 4 atomes de carbone,
linéaire ou
ramifié, et comportant au moins une triple liaison, tel qu'un groupe éthynyle
ou
propynyle.
Par le terme "groupe alkoxy en C1 à C4", on entend au sens de la présente
invention tout groupe -O-alkyle comportant de 1 à 4 atomes de carbone,
linéaire ou
ramifié, en particulier les groupes méthoxy, éthoxy, propoxy, n-butoxy, iso-
butoxy et
tert-butoxy.
Par le terme "groupe aryle", on entend au sens de la présente invention un ou
plusieurs cycles aromatiques ayant de 5 à 10 atomes de carbone, pouvant être
accolés.
En particulier, les groupes aryles peuvent être des groupes monocycliques ou
bicycliques, comme par exemple le groupe phényle ou naphthyle.
Avantageusement, le
groupe aryle est un phényle.
Par le terme "groupe aryloxy", on entend au sens de la présente invention tout
groupe -0-aryle, le groupe aryle étant tel que défini ci-dessus. Il pourra
s'agir en
particulier d'un groupe phényloxy.
Par le terme "groupe aryl-(alkyle en C1 à C4", on entend au sens de la
présente
invention tout groupe aryle tel que défini ci-dessus lié au reste de la
molécule par
l'intermédiaire d'un groupe alkyle en C1 à C4 tel que défini ci-dessus. Il
pourra s'agir en
particulier d'un groupe benzyle ou encore phényléthyle.
Par le terme "groupe hétéroaryle", on entend au sens de la présente invention
tout groupe aromatique comprenant de 5 à 10 atomes cycliques, qui sont des
atomes de
carbone et un ou plusieurs hétéroatomes, tels que par exemple des atomes de
soufre,
d'azote ou d'oxygène. L'hétéroaryle selon la présente invention peut être
constitué par
un ou deux cycles accolés. De préférence, le groupe hétéroaryle sera un groupe
quinolyle, isoquinolyle, imidazolyle, indolyle, benzothiophényle,
benzofuranyle,
benzoimidazolyle, purinyle, pyridinyle, pyrrolyle, ou thiophényle.
CA 02726907 2010-12-03
WO 2009/147217 9 PCT/EP2009/056885
Par le terme "hétérocycle", on entend au sens de la présente invention tout
cycle
hydrocarboné, saturé ou non, mais non aromatique, de 5 à 7, et de préférence
de 6,
chaînons, contenant un ou plusieurs hétéroatomes, tels que par exemple des
atomes de
soufre, d'azote ou d'oxygène, et de préférence contenant un hétéroatome choisi
parmi un
atome d'azote et d'oxygène.
Dans le cadre de la présente invention, le groupement constitué par un
hétérocycle accolé à un groupe aryle peut être avantageusement un chromanyle,
un
chroményle, un 1,2-dihydroquinolyle ou un 1,4-dihydroquinolyle.
Dans le cas où ce groupement est substitué par un groupe oxo, il s'agira
avantageusement d'un des groupements de formules suivantes :
O
/ O N N
O O H et H
ces groupements pouvant être substitués par ailleurs, notamment par un groupe
alkyle
en C 1 à C4 sur l'atome d'azote.
Par "sucre", on entend notamment, au sens de la présente invention,
l'érythrose,
le thréose, le ribose, l'arabinose, le xylose, le lyxose, l'allose, l'altrose,
le glucose, le
mannose, le gulose, l'idose, le galactose, le talose, l'érythrulose, le
ribulose, le xylulose,
le psicose, le fructose, le sorbose ou encore le tagatose, sous forme D ou L.
Avantageusement, il s'agit du glucose, du mannose, de l'arabinose ou du
galactose
On entend par "aminosucre", au sens de la présente invention, un sucre dans
lequel un groupe amino remplace un groupe hydroxyle, comme par exemple la
glucosamine et la galactosamine.
On entend par "acide aminé", au sens de la présente invention, tous les
résidus
des acides a-aminés naturels (par exemple Alanine (Ala), Arginine (Arg),
Asparagine
(Asn), Acide aspartique (Asp), Cystéine (Cys), Glutamine (Gln), Acide
glutamique
(Glu), Glycine (Gly), Histidine (His), Isoleucine (Ile), Leucine (Leu), Lysine
(Lys),
Méthionine (Met), Phénylalanine (Phe), Proline (Pro), Sérine (Ser), Thréonine
(Thr),
Tryptophane (Trp), Tyrosine (Tyr) et Valine (Val)) sous la forme D ou L, ainsi
que les
acides aminés non naturels (par exemple (1-naphthyl)alanine, (2-
naphthyl)alanine,
homophénylalanine, (4-chlorophényl)alanine, (4-fluorophényl)alanine, (3-
CA 02726907 2010-12-03
WO 2009/147217 10 PCT/EP2009/056885
pyridyl)alanine, phénylglycine, acide diaminopimélique, acide 2,6-
diaminoheptane-1,7-
dioïque, acide 2-aminobutyrique, acide 2-aminotétralin-2-carboxylique, erythro-
(3-
méthylphénylalanine, threo-(3-méthylphénylalanine, (2-méthoxyphényl)alanine,
acide 1-
amino-5-hydroxyindan-2-carboxylique, acide 2-aminohéptane- 1,7-dioïque, (2,6-
diméthyl-4-hydroxyphényl)alanine, erythro-(3-méthyltyrosine ou threo-(3-
méthyltyro sine).
Par le terme "groupe O-protecteur", on entend au sens de la présente invention
tout substituant qui protège le groupe hydroxyle ou carboxyle, c'est à dire un
atome
d'oxygène réactif, contre les réactions indésirables tels que les groupes O-
protecteurs
décrits dans Greene, "Protective Groups In Organic Synthesis", (John Wiley &
Sons,
New York (1981)) et Harrison et al. "Compendium of Synthetic Organic Methods",
Vols. 1 à 8 (J. Wiley & sons, 1971 à 1996). Les groupes O-protecteurs
comprennent les
éthers de méthyle ou d'alkyle substitués ou non, par exemple, méthoxyméthyle,
benzyloxyméthyle, 2-méthoxyéthoxyméthyle, 2-(triméthylsilyle) éthoxyméthyle, t-
butyle, benzyle et triphénylméthyle, les éthers de benzyle (substitués ou
non), les
tétrahydropyranyle éthers, les éthers d'allyle, les éthyle éthers substitués,
par exemple,
2,2,2-trichloroéthyle, les silyle éthers ou les éthers d'alkylsilyle, par
exemple,
triméthylsilyle, t-butyldiméthylsilyle et t-butyldiphénylsilyle, les éthers
d'hétérocycle et
les esters préparés par réaction du groupe hydroxyle avec un acide
carboxylique par
exemple, les esters de tert-butyle, de benzyle ou de méthyle, les carbonates
en
particulier le carbonate de benzyle ou d'halogénoalkyle, l'acétate, le
propionate, le
benzoate et similaires. Avantageusement, il s'agit d'un tert-butyle, d'un
acétyle ou d'un
benzyle.
Par le terme "groupe N-protecteur", on entend au sens de la présente invention
tout substituant qui protège le groupe NH2 contre les réactions indésirables
tels que les
groupes N-protecteur décrits dans Greene, "Protective Groups In Organic
synthesis",
(John Wiley & Sons, New York (1981)) et Harrison et al. Compendium of
Synthetic
Organic Methods", Vols. 1 à 8 (J. Wiley & sons, 1971 à 1996). Les groupes N-
protecteur comprennent les carbamates, amides, dérivés N-alkylés, dérivés
amino
acétale, dérivés N-benzylé, dérivés imine, dérivés énamine et dérivés N-
hétéroatome.
En particulier, le groupe N-protecteur comprend le formyle, l'acétyle, le
benzoyle, le
pivaloyle, le phénylsulfonyle, le benzyle (Bn), le t-butyloxycarbonyle (Boc),
le
CA 02726907 2010-12-03
WO 2009/147217 11 PCT/EP2009/056885
benzyloxycarbonyle (Cbz), le 9-fluorénylméthoxycarbonyle (Fmoc), le p-
méthoxybenzyloxycarbonyle, le p-nitrobenzyl-oxycarbonyle, le
trichloroéthoxycarbonyl
(TROC), l'allyloxycarbonyl (Alloc), le 9-Fluorénylméthyloxycarbonyl (Fmoc), le
trifluoro-acétyle, les carbamates de benzyle (substitués ou non) et
similaires.
Avantageusement, il s'agit du groupe Fmoc.
On entend par "liaison ester ou amide", un groupement -C(O)O- ou -C(O)NH-,
respectivement. Dans le cas particulier de la présente invention, le carbonyle
de la
liaison ester ou amide sera préférentiellement lié au résidu de la molécule à
activité
antitumorale tandis que l'oxygène ou le groupe NH de cette même liaison sera
lié au
groupe aryle ou hétéroaryle défini dans A.
Dans la présente invention, on entend désigner par "pharmaceutiquement
acceptable" ce qui est utile dans la préparation d'une composition
pharmaceutique, qui
est généralement sûr, non toxique et ni biologiquement ni autrement non
souhaitable et
qui est acceptable pour une utilisation vétérinaire de même que pharmaceutique
humaine.
On entend désigner par "sels pharmaceutiquement acceptables" d'un composé
des sels qui sont pharmaceutiquement acceptables, comme définis ici, et qui
possèdent
l'activité pharmacologique souhaitée du composé parent. De tels sels
comprennent
(1) les hydrates et les solvates,
(2) les sels d'addition d'acide formés avec des acides inorganiques tels que
l'acide chlorhydrique, l'acide bromhydrique, l'acide sulfurique, l'acide
nitrique, l'acide
phosphorique et similaires ; ou formés avec des acides organiques tels que
l'acide
acétique, l'acide benzènesulfonique, l'acide benzoïque, l'acide
camphosulfonique,
l'acide citrique, l'acide éthanesulfonique, l'acide fumarique, l'acide
glucoheptonique,
l'acide gluconique, l'acide glutamique, l'acide glycolique, l'acide
hydroxynaphtoïque,
l'acide 2-hydroxyéthanesulfonique, l'acide lactique, l'acide maléique, l'acide
malique,
l'acide mandélique, l'acide méthanesulfonique, l'acide muconique, l'acide 2-
naphtalènesulfonique, l'acide propionique, l'acide salicylique, l'acide
succinique,
l'acide dibenzoyl-L-tartrique, l'acide tartrique, l'acide p-toluènesulfonique,
l'acide
triméthylacétique, l'acide trifluoroacétique et similaires. Avantageusement,
il s'agit de
l'acide chlorhydrique ; ou
CA 02726907 2010-12-03
WO 2009/147217 12 PCT/EP2009/056885
(3) les sels formés lorsqu'un proton acide présent dans le composé parent soit
est
remplacé par un ion métallique, par exemple un ion de métal alcalin, un ion de
métal
alcalino-terreux ; soit se coordonne avec une base organique ou inorganique.
Les bases
organiques acceptables comprennent la diéthanolamine, l'éthanolamine, N-
méthylglucamine, la triéthanolamine, la trométhamine et similaires. Les bases
inorganiques acceptables comprennent l'hydroxyde d'aluminium, l'hydroxyde de
calcium, l'hydroxyde de potassium, le carbonate de sodium et l'hydroxyde de
sodium.
Avantageusement, le proton acide est déplacé par un ion Na-,-, notamment en
utilisant de
l'hydroxyde de sodium.
Les sels d'addition d'acide sont formés en particulier avec une fonction amine
ou avec une pyridine. Les sels d'addition de base sont formés en particulier
avec une
fonction acide carboxylique (-COOH), phosphate (-OP(O)(OH)2) ou encore sulfate
(-
OSO3H).
Dans la présente invention, on entend désigner par isomères , au sens de la
présente invention, des diastéréoisomères ou des énantiomères. Il s'agit donc
d'isomères de configuration encore appelés stéréoisomères . Les
stéréoisomères qui
ne sont pas des images dans un miroir l'un de l'autre sont ainsi désignés par
diastéréoisoméres , et les stéréoisomères qui sont des images l'un de l'autre
dans un
miroir mais non superposables sont désignés par énantiomères , encore
appelés
isomères optiques .
Un atome de carbone lié à quatre substituants non identiques est appelé un
centre chiral . Lorsqu'une molécule possède un tel centre chiral, elle est
dite chirale
et possède deux formes énantiomères. Lorsqu'une molécule possède plusieurs
centres
chiraux, alors elle possédera plusieurs formes diastéréoisomères et
énantiomères.
Un mélange équimolaire de deux énantiomères est appelé mélange racémique.
Par "prodrogue", on entend désigner, au sens de la présente invention, un
composé qui est administré sous une forme inactive (ou moins active) et qui
est
métabolisé in vivo, notamment par action d'enzymes ou de l'acide gastrique, en
une
forme active (ou plus active). L'utilisation d'une prodrogue permet
d'améliorer en
particulier les paramètres physico-chimiques d'une molécule tels que la
solubilité ainsi
que la pharmaco-cinétique (vectorisation, biodisponibilité, etc.), afin de
favoriser son
assimilation par un organisme après administration. En particulier, une
prodrogue d'une
CA 02726907 2010-12-03
WO 2009/147217 13 PCT/EP2009/056885
molécule portant un groupement amino (NH2) pourra résulter notamment de
l'acylation
ou de la phosphorylation de ce groupement amino. Lorsqu'une molécule porte un
groupement hydroxy (OH), la prodrogue pourra résulter en particulier de
l'acylation ou
de la phosphorylation de ce groupement hydroxy.
De manière encore avantageuse, R4 représente un atome d'hydrogène.
De manière également avantageuse, R2 représente un groupe méthoxy
éventuellement substitué par un ou plusieurs atomes de fluor, et de préférence
représente un groupe méthoxy
Avantageusement, R1, R2 et R3 représentent, indépendamment les uns des autres,
un groupe méthoxy éventuellement substitué par un ou plusieurs atomes de
fluor, et de
préférence représentent chacun un groupe méthoxy.
Encore avantageusement, R4 représente un atome d'hydrogène et R1, R2 et R3
représentent, indépendamment les uns des autres, un groupe méthoxy
éventuellement
substitué par un ou plusieurs atomes de fluor, et de préférence représentent
chacun un
groupe méthoxy.
Avantageusement, Z2 représente un atome d'hydrogène, un atome de fluor, un
groupe alkyle en Ci à C4, -CN, -S03R9, -COOR15 ou -COR15.
Selon un mode de réalisation avantageux, Z1 représente un atome d'hydrogène
ou d'halogène selon les conditions suivantes :
lorsque Z1 représente un atome d'halogène, alors Z2 représente un atome
d'halogène, et de préférence Z1 et Z2 représentent le même atome d'halogène,
avantageusement le fluor, et
^ lorsque Z1 représente un atome d'hydrogène, alors Z2 représente un atome
d'hydrogène, un alkyle en C1 à C4, un aryle ou un groupe -CN, -S02NR12R13,
-S03R9, -COOR15 ou -COR15, R9, R12, R13 et R15 étant tels que définis
précédemment, et avantageusement, Z2 représente un atome d'hydrogène, un atome
de fluor, un groupe alkyle en C1 à C4, -CN, -S03R9, -COOR15 ou -COR15, encor
plus avantageusement représente un atome d'hydrogène, un groupe acétyle ou un
groupe -CN, de préférence, représente un atome d'hydrogène ou un groupe -CN,
et
encore de préférence représente un atome d'hydrogène.
CA 02726907 2010-12-03
WO 2009/147217 14 PCT/EP2009/056885
De manière avantageuse, soit Z1 et Z2 représentent chacun un atome de fluor,
soit Z1 représente un atome d'hydrogène et Z2 représente un atome d'hydrogène
ou un
groupe -CN ou -COCH3.
Encore avantageusement, Z1 et Z2 représentent chacun un atome d'hydrogène.
Encore avantageusement, X représente un groupement CH.
De manière encore avantageuse, la molécule à activité antitumorale sera une
molécule à activité anti-vasculaire, cytotoxique, anti-angiogénique, anti-
apoptotique ou
inhibitrice de kinase. En particulier, elle pourra être choisie parmi la 6-
mercaptopurine,
la fludarabine, la cladribine, la pentostatine, la cytarabine, le 5-
fluorouracile, la
gemcitabine, le méthotrexate, le raltitrexed, l'irinotécan, le topotécan,
l'étoposide, la
daunorubicine, la doxorubicine, l'épirubicine, l'idarubicine, la pirarubicine,
la
mitoxantrone, la chlorméthine, la cyclophosphamide, l'ifosfamide, le
melphalan, le
chlorambucil, le busulfan, la carmustine, la fotémustine, la streptozocine, le
carboplatine, le cisplatine, l'oxaliplatine, la procarbazine, la dacarbazine,
la bléomycine,
la vinblastine, la vincristine, la vindésine, la vinorelbine, le paclitaxel,
le docétaxel, la
L-asparaginase, la flutamide, la nilutamide, la bicalutamide, l'acétate de
cyprotérone, la
triptoréline, la leuproréline, la goséréline, la buséréline, le formestane,
l'aminoglutéthimide, l'anastrazole, le létrozole, le tamoxiféne, l'octréotide,
le lanréotide,
l'acide (Z)-3-[2,4-diméthyl-5-(2-oxo-1,2-dihydro-indol-3-ylidèneméthyl)-1H-
pyrrol-3-
yl]-propionique (SU 6668), l'acide 4-((9-chloro-7-(2,6-difluorophényl)-5H-
pyrimidol(5,4-d)(2)benzazépin-2-yl)amino) benzoïque (MLN-8054), l'acide 5,6-
diméthylxanthénone-4-acétique (DMXAA) ou encore l'acide 3-(4-(1,2-diphénylbut-
1-
ényl)phényl)acrylique (GW 5638). Avantageusement, il s'agit de SU 6668, MLN-
8054,
DMXAA ou GW 5638 et encore plus avantageusement de DMXAA.
Avantageusement, la molécule à activité antitumorale comportera une fonction
acide carboxylique COOH, telle que SU 6668, MLN-8054, DMXAA ou GW 5638,
permettant ainsi de la coupler au groupement aryle ou hétéroaryle de A,
substitué par au
moins un groupement OH ou NH2, par une réaction d'estérification ou
d'amidification.
Il pourra cependant être utilisé une molécule à activité antitumorale sur
laquelle une
fonction acide aura été greffée pour permettre le couplage avec le groupement
aryle ou
hétéroaryle de A.
CA 02726907 2010-12-03
WO 2009/147217 15 PCT/EP2009/056885
La liaison ester ou amide ainsi formée présente l'avantage de pouvoir être
facilement hydrolysée in vivo. Ainsi, après administration du composé de
l'invention, la
molécule à activité antitumorale ainsi qu'une nouvelle molécule de l'invention
pourront
être libérées, permettant une double action thérapeutique.
Dans un mode de réalisation particulier de l'invention, A est un cycle choisi
dans le groupe comprenant les groupes aryles et hétéroaryles, et en
particulier les
groupes phényle, naphtyle et indolyle, et de préférence phényle, ledit cycle
pouvant
être :
^ soit accolé à un hétérocycle comportant de 5 à 7, de préférence 6 chaînons,
comportant éventuellement une ou plusieurs insaturations et éventuellement
substitué par un ou plusieurs groupements alkyles en Ci à C4 et/ou par un
groupe
oxo,
^ soit substitué par un ou plusieurs groupes choisis parmi les atomes
d'halogène, les groupes -B(OH)2, alkyles en Ci à C4, alcényles en C2 à C4,
alcynyles en C2 à C4, aryles, hétéroaryles, -COOH, -NO2, -NR7R8, -NHCOR7,
-CONR7R8, -NHCOOR9, -OSi(alkyle en C1-C4)3, -NHS02R9, alkoxy en C1 à C4
éventuellement substitué par un ou plusieurs atomes de fluor, -OCONR7R8,
-OSO2CF3, -OS02R9, -S02R9, -S03R9, -OSO3H, -OPO(OR10)2, -ONR7R8, -OR11,
-S02NR12R13, -S02NHCOR14, -OCOR15, -OCOOR16, -SR17 et un résidu d'une
molécule à activité antitumorale lié par l'intermédiaire d'une liaison ester
ou
amide,
R7, R8, R9, Rio, R11, R12, R13, R14, R15, R16 et R17 étant tels que définis ci-
dessus.
Dans un autre mode de réalisation particulier de l'invention, A est un cycle
choisi dans le groupe comprenant les groupes phényle, naphtyle, purinyle,
benzofuranyle, pyridinyle, quinolyle et indolyle, ledit cycle pouvant être :
^ soit accolé à un hétérocycle comportant 6 chaînons, comportant
éventuellement une ou plusieurs insaturations et étant éventuellement
substitué
par un ou plusieurs groupements alkyles en Ci à C4 et/ou par un groupe oxo
(=0),
^ soit substitué par un ou plusieurs groupes choisis parmi les atomes
d'halogène, les groupes -B(OH)2, alkyles en Ci à C6 éventuellement subsitué
par
OH, alcényles en C2 à C4, alcynyles en C2 à C4, aryles, hétéroaryles, aryloxy,
CA 02726907 2010-12-03
WO 2009/147217 16 PCT/EP2009/056885
aryl-(alkyle en Ci à C4), -COOH, -NO2, -NR7R8, -NHCOR7, -CONR7R8,
-NHCOOR9, -OSi(alkyle en C1 à C4)3, -NHS02R9, alkoxy en C1 à C4
éventuellement substitué par un ou plusieurs atomes de fluor, -OCONR7R8,
-OS02CF3, -OS02R9, -S02R9, -SO3R9, -OSO3H, -OPO(OR10)2, -ONR7R8, -OR11,
-S02NR12R13, -S02NHR14, -OCOR15, -OCOOR16, -SR17 et un résidu d'une
molécule à activité antitumorale lié par l'intermédiaire d'une liaison ester
ou
amide,
les noyaux aryles desdits groupes étant éventuellement substitués par un ou
plusieurs groupes OH, alkoxy en C1 à C4, NR7R8,
R7, R8, R9, Rio, R11, R12, R13, R14, R15, R16 et R17 étant tels que définis ci-
dessus.
Dans un autre mode de réalisation particulier de l'invention, A est un cycle
choisi dans le groupe comprenant les groupes aryle, quinolyle, isoquinolyle,
imidazolyle, indolyle, benzothiophényle, benzofuranyle, benzoimidazolyle,
purinyle,
pyridinyle, pyridazinyle, pyrrolyle, furanyle et thiophényle, et en
particulier comprenant
les groupes phényle, naphtyle, purinyle, benzofuranyle, pyridinyle, quinolyle
et
indolyle,
ledit cycle pouvant être soit substitué par un ou plusieurs groupes choisis
parmi les
atomes d'halogène, les groupes -B(OH)2, alkyles en C1 à C6 éventuellement
subsitué par
OH, alcényles en C2 à C4, alcynyles en C2 à C4, aryles, hétéroaryles, aryloxy,
aryl-
(alkyle en C1 à C4), -COOH, -NO2, -NR7R8, -NHCOR7, -CONR7R8, -NHCOOR9, -
OSi(alkyle en C1 à C4)3, -NHSO2R9, alkoxy en C1 à C4 éventuellement substitué
par un
ou plusieurs atomes de fluor, -OCONR7R8, -OSO2CF3, -OS02R9, -S02R9, -S03R9,
-OSO3H, -OPO(OR1o)2, -ONR7R8, -OR11, -S02NR12R13, -S02NHR14, -OCOR15,
-OCOOR16, -SR17 et un résidu d'une molécule à activité antitumorale lié par
l'intermédiaire d'une liaison ester ou amide, et notamment choisis parmi -
S02R9 et -
OR11,
les noyaux aryles desdits groupes étant éventuellement substitués par un ou
plusieurs
groupes OH, alkoxy en C1 à C4, NR7R8,
R7, R8, R9, Rio, R11, R12, R13, R14, R15, R16 et R17 étant tels que définis ci-
dessus.
Avantageusement, A est un cycle choisi dans le groupe comprenant les groupes
aryles et hétéroaryles, et plus particulièrement les groupes phényle,
naphtyle, quinolyle,
isoquinolyle, imidazolyle, indolyle, benzothiophényle, benzofuranyle,
CA 02726907 2010-12-03
WO 2009/147217 17 PCT/EP2009/056885
benzoimidazolyle, purinyle, pyridinyle, pyridazinyle, pyrimidinyle,
pyrazinyle,
pyrrolyle, furanyle et thiophényle, et notamment les groupes phényle,
naphtyle,
purinyle, benzofuranyle, pyridinyle, quinolyle et indolyle, ledit cycle
pouvant être
substitué par un ou plusieurs groupes choisis parmi -Me, -Bn, -C6H4-OMe, -CH2-
C6H4-
OMe, -(CH2)2-C6H4-OMe, -(CH2)2-C6H2-(OMe)3, -OH, -OMe, -OBn -OCOMe, -
C6H4NH2, -OC6H4NH2, -NH2, -OCONEt2, -(CH2)X OH avec x = 3, 4, 5 ou 6,
NHFmoc
-)-0Y' : OtBu
-OCOCH2NMe2, -OP03H2, -F et 0 ou pouvant être accolé à un
I ~N
O O N O
hétérocycle de formule U,-
ou O la liaison en pointillé représentant
la liaison commune entre l'hétérocycle et ledit cycle.
Avantageusement, les composés de l'invention répondent à la formule (la)
suivante
ziyZ2Ra
R X I Rb
2 ~R4 OMe
R J::
R 3 (la)
ou à un sel pharmaceutiquement acceptable, un isomère ou une prodrogue de
celui-ci,
dans laquelle :
- Ri, R2, R3, R4, X, Z1 et Z2 sont tels que définis ci-dessus pour le composé
de formule
(I),
- Ra représente un atome d'hydrogène ou d'halogène, ou un groupe -B(OH)2,
alkyle en
Ci à C4, alcényle en C2 à C4, alcynyle en C2 à C4, aryle, hétéroaryle, -COOH, -
NO2,
-NR7R8, -NHCOR7, -CONR7R8, -NHCOOR9, -OSi(alkyle en C1-C4)3, -NHSO2R9,
alkoxy en C1 à C4 éventuellement substitué par un ou plusieurs atomes de
fluor,
-OCONR7R8, -OSO2CF3, -OS02R9, -S02R9, -S03R9, -OSO3H, -OPO(OR1O)2,
-ONR7R8, -ORii, -S02NR12Ri3, -S02NHCOR14, -OCOR15, -OCOOR16 ou -SR17,
- Rb représente un atome d'halogène, et de préférence un atome de fluor, un
groupe
aryloxy, -OR, i, -OCOR15, -OCOOR15, -OCONR7R8, -OS02R9, -OSO2CF3, -OSO3H,
-OPO(OR10)2, -ONR7R8, -NR7R8, -NHCOR7, -NHCOOR9 ou -NHSO2R9 ou un
CA 02726907 2010-12-03
WO 2009/147217 18 PCT/EP2009/056885
résidu d'une molécule anti-vasculaire lié par l'intermédiaire d'une liaison
ester ou
amide,
les noyaux aryles desdits groupes de Ra et Rb étant éventuellement substitués
par un ou
plusieurs groupes OH, alkoxy en C1 à C4, NR7R8,
R7, R8, R9, Rio, R11, R12, R13, R14, R15, R16 et R17 étant tels que définis
précédemment.
Avantageusement, Ra représente un atome d'hydrogène ou un groupe -NR7R8, -
NHCOR7, -CONR7R8, -NHCOOR9, -NHSO2R9, -OCONR7R8, -OSO2CF3, -OS02R9,
-OSO3H, -OPO(OR1o)2, -ONR7R8, -OR11, -S03R9, -S02NR12R13, -S02NHCOR14,
-OCOR15 ou -OCOOR16, avec R7, R8, R9, Rio, R11, R12, R13, R14, R15 et R16 tels
que
définis ci-dessus.
De manière encore plus avantageuse, Ra représente un atome d'hydrogène ou un
groupe -NR7R8, -NHCOR7, -CONR7R8, -NHCOOR9, -OCONR7R8, -OPO(OR1o)2,
-OCOR15 ou -OCOOR16, avec R7, R8, R9, Rio, R15 et R16 tels que définis ci-
dessus.
Encore plus avantageusement, Ra représente un atome d'hydrogène.
En particulier, les composés de l'invention pourront être choisis parmi :
I-1 I-2
MeO MeO
MeO OMe MeO OMe
OMe OH OMe
I-3 I-4
Meo :xcc
Meo OMe OMe
1-6 1-7 NH2
MeO OCOMe MeO
MeO OMe MeO OMe
OMe OMe
1-8 NH2 1-9
Meo Meo
Meo MeO OMe
OMe OMe OMe F
CA 02726907 2010-12-03
WO 2009/147217 19 PCT/EP2009/056885
I-10 0
HN O
:pc:fOtBU \ / OMe
1-il meo I-12 meo O ô NEt2
MeO / N \ / meo OMe
OMe H OMe
I-13 I-14
MeO iO~NMe MeO O(NMe
z
MeO OMe MeO OMe HCI
OMe OMe
I-15 OMe I-16
I I OPO(OH)2
meo I L I OH meo
meo / OMe
meo OMe
OMe
I-18 I-19 CN
meo OH
meo OH
OMe
OMe meo OMe
OMe
I-20 CHF2 I-21
meo OH
MeO OMe :.:~.
OMe OME,
I-22 I-23 NH2
:-~ MeO N
N- N
MeO
OMe
CA 02726907 2010-12-03
WO 2009/147217 20 PCT/EP2009/056885
I-24 Meo N NH2 I-25
MeO
OH
N N MeO
Meo OMe
N-J OMe
OMe
OMe
1-26 MeO OH 1-27 Meo I I OH
MeOI I OMe MeO OMe
OMe OMe
1-28 Meo OH 1-29 OMe
MeO OMe
MeO
OMe
Meo OMe
OMe
1-30 OMe 1-31 NH2
/ OMe
MeO \ OMe
Meo Meo OMe
OMe
Meo \ OMe
OMe
I-32 I-33
Meo / O
MeO NH2
Meo \ OMe NH2
Meo OMe OMe
OMe
I-34
Meo
\ I I / \ OMe
MeO
OMe
CA 02726907 2010-12-03
WO 2009/147217 21 PCT/EP2009/056885
I-35 I-36
MeO #nA. MeO N
MeO N-Me MeO OMe
- OMe
I-37 I-38
MeO \ I \ \ MeO I \ I \ H2
MeO N OMe
OMe OMe
I-39 I I-40
MeO \ N \ OBn MeO OH
Me0 OMe MeO :q" OMe
OMe OMe
I-41 Ac I-42 Ac
OBn MeO / N \ OH
MeO N IC~0M \ I I /
e0 e MeO OMe
OMe OMe
I-43 I I-44 Ac
Me0 / N / MeO / N /
MeO O N \
MeO O O
OMe OMe
I-45 I I-46 Ac
MeO N N O
Me0 N
MeO
OMe MeO \ N
OMe
L'absence de double liaison éthylénique des composés de formule (I), résout de
manière définitive le problème d'isomérisation susceptible d'intervenir in
vivo,
entraînant des chutes (ou des absences) d'activité cytotoxique comme c'est par
exemple
le cas de la CA-4.
L'invention a également pour objet les procédés de synthèse des composés de
formule (I).
CA 02726907 2010-12-03
WO 2009/147217 22 PCT/EP2009/056885
Les composés de formule (I) peuvent être synthétisés selon des procédés connus
de l'homme du métier, à partir de produits disponibles dans le commerce ou
préparés
selon des méthodes connues de l'homme du métier.
En particulier, les composés de formule (I) dans laquelle X représente un
groupement CH peuvent être préparés par hydrogénation de la double liaison
d'un
composé de formule (II) suivante :
Z1l Z2
R
~ A
R 2 R4
R 3 (II)
dans laquelle R1, R2, R3, R4, A, Z1 et Z2 sont tels que définis précédemment
pour le
composé de formule (I),
puis séparation du milieu réactionnel du composé (I) ainsi obtenu.
Cette étape peut être suivie d'éventuelles étapes supplémentaires classiques
de
modification des substituants de A et éventuellement de Z2.
Le composé ainsi obtenu pourra être séparé du milieu réactionnel par des
méthodes bien connues de l'homme du métier, comme par exemple par extraction,
évaporation du solvant ou encore par précipitation et filtration.
Le composé pourra être par ailleurs purifié si nécessaire par des techniques
bien
connues de l'homme du métier, comme par recristallisation si le composé est
cristallin,
par distillation, par chromatographie sur colonne sur gel de silice ou encore
par
chromatographie liquide haute performance (HPLC).
L'hydrogénation est réalisée sous atmosphère d'hydrogène, notamment en
présence de palladium sur charbon (Pd/C) comme catalyseur ou éventuellement de
Pt02. Avantageusement, 5 à 30 mol%, de préférence environ 10 mol% de
catalyseur
sont utilisés lors de cette réaction. De plus, l'acétate d'éthyle sera
avantageusement
utilisé comme solvant lors de cette étape.
Selon une première variante, le composé de formule (II), pour lequel Z1
représente un atome d'hydrogène et Z2 représente un atome d'hydrogène, un
alkyle en
C1 à C4 ou un aryle, peut être préparé selon les étapes successives suivantes
- mise en réaction d'un composé de formule (III) suivante :
CA 02726907 2010-12-03
WO 2009/147217 23 PCT/EP2009/056885
Z, Z2
R,
O
R 2 R4
R 3 (III)
dans laquelle R1, R2, R3 et R4 sont tels que définis précédemment, et Z1 et Z2
sont tels
que définis ci-dessus dans le cadre de cette première variante,
avec un composé organométallique de formule A-M dans laquelle A est tel que
défini
précédemment et M représente un métal alcalin ou un métal alcalino-terreux
substitué
par un halogène, pour former le composé de formule (IV) suivante :
Z, Z2
R, A
OH
R2 R4
R3 (IV)
dans laquelle R1, R2, R3 et R4 sont tels que définis précédemment, et Z1 et Z2
sont tels
que définis ci-dessus dans le cadre de cette première variante,
- mise en réaction du composé de formule (IV) obtenu à l'étape précédente avec
un
acide pour donner le composé de formule (II).
Ces étapes pourront être suivies d'éventuelles étapes supplémentaires
classiques
de modification des substituants de A.
Par métal alcalin , on entend notamment le sodium (Na), le lithium (Li) ou
le
potassium (K).
Par métal alcalino-terreux , on entend notamment le calcium (Ca) ou le
magnésium (Mg).
Avantageusement, M représente l'atome de lithium ou le groupe MgX dans
lequel X représente un halogène, de préférence le brome ou le chlore, et
avantageusement, le brome.
Le dérivé A-Li sera alors avantageusement obtenu par réaction du dérivé A-Hal,
où Hal représente un atome d'halogène tel qu'un atome d'iode, de brome ou de
chlore,
avec un dérivé (alkyle en C1 à C6)-Li tel que le tert-BuLi.
CA 02726907 2010-12-03
WO 2009/147217 24 PCT/EP2009/056885
Si le magnésien de formule A-MgX n'est pas disponible commercialement, il
pourra être préparé notamment par réaction d'un dérivé A-Hal tel que défini ci-
dessus
avec du magnésium.
De manière également avantageuse, l'acide utilisé dans la dernière étape est
de
l'acidepara-toluénesulfonique (APTS).
Selon une deuxième variante, les composés de formule (II), pour lesquels Z1 et
Z2 représentent chacun un atome d'halogène ou Z1 représente un atome
d'hydrogène et
Z2 représente un radical choisi dans le groupe constitué par un atome
d'hydrogène, un
groupe alkyle en C1 à C4, -CN ou -CO2R, avec R représentant un alkyle en C1 à
C4,
peuvent être préparés à partir du composé de formule (V) suivante :
O
R1
I~ CA
R z R4
R3 (V)
pour laquelle R1, R2, R3, R4 et A sont tels que définis précédemment,
par une réaction de Wittig, en présence d'une base et du phosphonium de
formule (VI)
suivante
z
1
P z
z2
(VI)
dans laquelle Z1 et Z2 sont tels que définis ci-dessus dans le cadre de la
seconde variante
et Z représente un atome de brome ou de chlore,
cette réaction pouvant être éventuellement suivie d'étapes classiques
supplémentaires de
modification des substituants de A.
De manière avantageuse, la base utilisée pour la réaction de Wittig sera le
lithium hexamethyldisilazide (LiHMDS). Le THF pourra être avantageusement
utilisé
comme solvant.
Dans le cas où Z2 représente un groupe -C02R15 avec R15 différent de R tel que
défini ci-dessus, et Z1 = H, le procédé décrit ci-dessus pour Z2 = CO2R pourra
être
poursuivie par une étape de saponification de l'ester (groupe CO2R) et d'une
éventuelle
CA 02726907 2010-12-03
WO 2009/147217 25 PCT/EP2009/056885
étape de substitution de l'acide carboxylique ainsi obtenu, afin de former le
composé
(II) désiré pour lequel Z2 = C02R15.
Par ailleurs, les composés de formule (II), pour lesquels Z1 représente un
atome
d'hydrogène et Z2 représente un groupe -S03R9 ou -S02NR12R13, peuvent être
préparés
selon le même procédé que celui décrit ci-dessus en seconde variante (procédé
utilisant
une réaction de Wittig), en remplaçant le phosphonium (VI) précédent par un
composé
de formule générale (Vlbis) suivante :
o
-11
SO R
' \/ 3
(Vlbis)
avec R représentant un alkyle en C1 à C4.
Cette réaction de Wittig pourra éventuelle être suivie d'une étape de
saponification de la fonction -SO3R pour donner -SO3H, puis d'une étape de
substitution ou d'amidification de cette fonction -SO3H.
La base utilisée dans ce cas, pour la réaction de Wittig, sera avantageusement
le
n-butyl lithium
Le composé de formule (V) peut être obtenu notamment par oxydation de
l'alcool correspondant de formule (VII) suivante :
OH
R,
DÇ A
R 2 R4
R 3 (VII)
pour laquelle R1, R2, R3, R4 et A sont tels que définis précédemment,
en utilisant par exemple l'oxyde de manganèse ou le chlorochromate de
pyridinium
(PCC).
L'alcool (VII) peut lui-même être obtenu à partir de l'aldéhyde de formule
(VIII) suivante :
O
R,
(1 H
R2 R4
R 3 (VIII)
pour laquelle R1, R2, R3 et R4 sont tels que définis précédemment,
CA 02726907 2010-12-03
WO 2009/147217 26 PCT/EP2009/056885
par réaction avec un composé organométallique de formule A-M dans laquelle A
et M
sont tels que définis précédemment.
Selon une troisième variante, les composés de formule (II), pour lesquels Z1=
H
et Z2 représente un atome d'hydrogène, un groupe alkyle en C1 à C4 ou aryle,
peuvent
être préparés à partir du composé de formule (XI) suivante :
H /A1
N,N-SO2
R' Z2
Z1
R2 R4
R 3 (XI),
pour laquelle R1, R2, R3 et R4 sont tels que définis précédemment, Z1 et Z2
sont tels que
définis dans le cadre de cette troisième variante, et Al représente un groupe
phényle
éventuellement substitué par un ou plusieurs groupes choisis parmi un groupe
alkyle en
C1 à C4, tel que méthyle, ou alkoxy en C1 à C4, tel que méthoxy, et de
préférence
représente un groupe para-méthyl-phényle.
par réaction avec A-Z3, avec A tel que défini ci-dessus et Z3 représentant un
atome
d'halogène tel qu'un atome de brome ou un groupe -OSO2CF3, en présence d'un
catalyseur et d'une base.
La base sera avantageusement une base lithiée telle que t-BuOLi.
Le catalyseur sera avantageusement un catalyseur au palladium tel que Pd2dba3,
utilisé en association avec une phosphine telle que X-Phos.
Le composé de formule (XI) peut être préparé à partir de la cétone de formule
(XII) suivante
O
R, Z2
Dg Z1
R2 R
R 3 (XII),
pour laquelle R1, R2, R3 et R4 sont tels que définis précédemment et Z1 et Z2
sont tels
que définis dans le cadre de cette troisième variante,
par réaction avec la para-toluènesulfonyle hydrazine.
CA 02726907 2010-12-03
WO 2009/147217 27 PCT/EP2009/056885
Selon une quatrième variante, les composés de formule (II), pour lesquels Z1 =
H et Z2 représente un groupe CO2R15, peuvent être préparés à partir du composé
de
formule (XIII) suivante :
R5
R1 OH
R Z R4
R 3 (XIII)
pour laquelle R1, R2, R3, R4 et R15 sont tels que définis précédemment,
par une réduction partielle de la triple liaison, notamment en présence de
LiA1H4, pour
donner le composé de formule (XIV) suivante :
5
OH
RÇêR
Ri R 4R3 (XIV)
pour laquelle R1, R2, R3, R4 et R15 sont tels que définis précédemment,
suivie d'une réaction d'oxydation pour donner le composé de formule (XV)
suivante :
R15
R O
R Z R4
R3 (XV)
pour laquelle R1, R2, R3, R4 et R15 sont tels que définis précédemment,
puis enfin d'une réaction de Heck en présence de A-Hal, avec A tel que défini
ci-dessus
et Hal représentant un atome d'halogène tel qu'un iode ou un brome, pour
donner le
composé de formule (I) souhaité avec Z1 = H et Z2 = CO2R15=
Par ailleurs, les composés de formule (I) dans laquelle X représente un atome
d'azote peuvent être préparés selon les étapes successives suivantes :
- mise en réaction d'un composé de formule (IX) suivante :
CA 02726907 2010-12-03
WO 2009/147217 28 PCT/EP2009/056885
R, \ NHZ
R 2 R4
R 3 (IX)
dans laquelle R1, R2, R3 et R4 sont tels que définis précédemment,
avec un composé de formule A-Z3, dans laquelle A et Z3 sont tels que définis
précédemment et en présence d'un catalyseur et d'une base B1.
pour donner un composé de formule (X) suivante :
H
R P2~ NA
R R4
R3 (X)
dans laquelle R1, R2, R3, R4 et A sont tels que définis précédemment,
- mise en réaction du composé de formule (X) obtenu à l'étape précédente avec
un
composé de formule Z1Z2CH-X1, dans laquelle Z1 et Z2 sont tels que définis
pour le
composé de formule (I) et X1 représente un atome d'halogène, avantageusement
un
iode ou un chlore, en présence d'une base B2 pour donner le composé de formule
(I), et
- séparation du milieu réactionnel du composé (I) obtenu à l'étape précédente.
Ces étapes peuvent également être suivies d'étapes supplémentaires classiques
de modification des groupements de A et éventuellement du groupement Z2.
Le composé ainsi obtenu pourra être séparé du milieu réactionnel par des
méthodes bien connues de l'homme du métier, comme par exemple par extraction,
évaporation du solvant ou encore par précipitation et filtration.
Le composé pourra être par ailleurs purifié si nécessaire par des techniques
bien
connues de l'homme du métier, comme par recristallisation si le composé est
cristallin,
par distillation, par chromatographie sur colonne sur gel de silice ou encore
par
chromatographie liquide haute performance (HPLC).
La base B1 sera avantageusement du carbonate de césium (Cs2CO3).
Le catalyseur sera avantageusement un catalyseur au palladium tel que
Pd(OAc)2 et sera avantageusement utilisé en présence d'uns phosphine tel que
le bis[-2-
diphénylphosphinophényl]éther (DPEphos) ou le 4,5-bis(diphénylphosphino)-9,9-
diméthylxanthène (XantPhos).
CA 02726907 2010-12-03
WO 2009/147217 29 PCT/EP2009/056885
De manière avantageuse, la base B2 sera de l'hydrure de sodium et la réaction
d'alkylation de l'amine sera avantageusement réalisée à température ambiante,
notamment dans un solvant tel que le DMF.
De manière avantageuse, Z1 représente un atome d'hydrogène.
De manière encore avantageuse, Z2 représente un atome d'hydrogène, un alkyle
en C1 à C4, un aryle ou un groupe -COR15, et encore avantageusement,
représente un
atome d'hydrogène ou un acétyle.
Les étapes de synthèse sont ainsi compatibles avec les exigences
industrielles.
Par ailleurs, les analogues ainsi préparés possédant un résidu de sucre ou une
fonction
phosphate ou acide boronique sont solubles dans l'eau et potentiellement
assimilables
par voie orale.
L'invention a également pour objet les composés de formules (I), ainsi que
leurs
sels pharmaceutiquement acceptables, leurs isomères et leurs prodrogues, pour
leur
utilisation en tant que médicaments, avantageusement en tant que médicaments
inhibiteurs de la polymérisation de la tubuline, et encore avantageusement, en
tant que
médicaments destinés à traiter ou à prévenir les maladies prolifératives,
telles que le
cancer, le psoriasis ou la fibrose, et en particulier le cancer.
En particulier, les composés de l'invention, y compris les composés de formule
o o
OMe Me OEt OEt
OMe MeO MeO OMe
MeO I OMe MeO I I OMe MeO I OMe
OMe OMe OMe OMe
CO2H CO2H
MeO MeO OMe
I I OMe MeO I I
MeO OMe
OMe et OMe
pourront être utiles dans le traitement d'un cancer, tel que ceux susceptibles
d'être
traités par CA-4 ou par le taxotère.
L'invention concerne également l'utilisation d'un composé de formule (I) ou
d'un
composé de formule :
CA 02726907 2010-12-03
WO 2009/147217 30 PCT/EP2009/056885
O O
OMe Me OEt OEt
OMe MeO MeO OMe
MeO OMe MeO I I OMe MeO I I OMe
OMe OMe OMe OMe
CO2H CO2H
MeO MeO OMe
OMe MeO I I
MeO OMe
OMe ou OMe , ou d'un de leurs sels
pharmaceutiquement acceptables, de leurs isomères ou de leurs prodrogues, pour
la
fabrication d'un médicament inhibiteur de la polymérisation de la tubuline, et
avantageusement destiné à traiter ou à prévenir les maladies prolifératives,
telles que le
cancer, le psoriasis ou la fibrose, et en particulier le cancer.
L'invention a également pour objet une composition pharmaceutique comprenant
au
moins un composé de formule (I) ou un composé de formule :
o o
OMe Me OEt OEt
OMe MeO MeO OMe
MeO OMe MeO I I OMe MeO I I OMe
OMe OMe OMe OMe
CO2H CO2H
MeO MeO OMe
OMe MeO I I
MeO OMe
OMe ou OMe , ou un de ses sels
pharmaceutiquement acceptables, de ses isomères ou de ses prodrogues, en
association
avec un ou plusieurs excipients pharmaceutiquement acceptables.
L'invention a également pour objet une composition pharmaceutique comprenant
au
moins un composé de formule (I) ou un composé de formule :
CA 02726907 2010-12-03
WO 2009/147217 31 PCT/EP2009/056885
O O
OMe Me OEt OEt
OMe MeO MeO OMe
MeO I I OMe MeO I I OMe MeO I I OMe
OMe OMe OMe OMe
CO2H CO2H
MeO MeO OMe
I I OMe MeO I I
MeO OMe
OMe ou OMe , ou un de ses sels
pharmaceutiquement acceptables, de ses isomères ou de ses prodrogues, en
association
avec au moins un autre principe actif, notamment un composé anti-cancéreux,
cytotoxique ou non, en association avec un ou plusieurs excipients
pharmaceutiquement
acceptables.
A titre d'exemples de principes actifs pouvant être associés au composé de
formule (I) dans une composition selon l'invention, on cite de façon non
limitative la 6-
mercaptopurine, la fludarabine, la cladribine, la pentostatine, la cytarabine,
le 5-
fluorouracile, la gemcitabine, le méthotrexate, le raltitrexed, l'irinotécan,
le topotécan,
l'étoposide, la daunorubicine, la doxorubicine, l'épirubicine, l'idarubicine,
la
pirarubicine, la mitoxantrone, la chlorméthine, la cyclophosphamide,
l'ifosfamide, le
melphalan, le chlorambucil, le busulfan, la carmustine, la fotémustine, la
streptozocine,
le carboplatine, le cisplatine, l'oxaliplatine, la procarbazine, la
dacarbazine, la
bléomycine, la vinblastine, la vincristine, la vindésine, la vinorelbine, le
paclitaxel, le
docétaxel, la L-asparaginase, la flutamide, la nilutamide, la bicalutamide,
l'acétate de
cyprotérone, la triptoréline, la leuproréline, la goséréline, la buséréline,
le formestane,
l'aminoglutéthimide, l'anastrazole, le létrozole, le tamoxifène, l'octréotide,
le lanréotide,
l'acide (Z)-3-[2,4-diméthyl-5-(2-oxo-1,2-dihydro-indol-3-ylidèneméthyl)-1H-
pyrrol-3-
yl]-propionique, l'acide 4-((9-chloro-7-(2,6-difluorophényl)-5H-pyrimidol(5,4-
d)(2)benzazépin-2-yl)amino)benzoïque, l'acide 5,6-diméthylxanthénone-4-
acétique ou
encore l'acide 3-(4-(1,2-diphénylbut-1-ényl)phényl)acrylique.
Les composés selon l'invention peuvent être administrés par voie orale,
sublinguale, parentérale, sous-cutanée, intramusculaire, intraveineuse,
transdermique,
locale ou rectale.
CA 02726907 2010-12-03
WO 2009/147217 32 PCT/EP2009/056885
Les composés selon l'invention peuvent être utilisés dans le traitement et la
prévention des maladies prolifératives comme les cancers, le psoriasis et la
fibrose.
Ils peuvent être utilisés à des doses comprises entre 0,01 mg et 1000 mg par
jour,
donnés en une seule dose une fois par jour ou de préférence administrés en
plusieurs
doses tout au long de la journée, par exemple deux fois par jour en doses
égales. La
dose administrée par jour est avantageusement comprise entre 5 mg et 500 mg,
encore
plus avantageusement entre 10 mg et 200 mg. Il peut être nécessaire d'utiliser
des doses
sortant de ces gammes ce dont l'homme du métier peut se rendre compte lui-
même.
Les composés selon l'invention peuvent être utilisés pour diminuer ou inhiber
la
polymérisation de la tubuline, notamment in vitro et également in vivo.
La présente invention a également pour objet une composition pharmaceutique
comprenant :
(i) au moins un composé de formule (I) ou un composé de formule :
o o
OMe Me OEt OEt
OMe MeO MeO OMe
MeO I OMe MeO I I OMe MeO I OMe
OMe OMe OMe OMe
CO2H CO2H
MeO MeO OMe
I I OMe MeO I I
MeO OMe
OMe ou OMe
(ii) au moins un autre principe actif, notamment utile pour le traitement de
maladies
prolifératives telles que le cancer, le psiorasis ou la fibrose, et
avantageusement un
agent anti-cancéreux tel qu'un agent anti-vasculaire, cytotoxique ou anti-
angiogénique,
en tant que produits de combinaison pour une utilisation simultanée, séparée
ou étalée
dans le temps.
A titre de principe actif, on peut citer notamment, de façon non limitative,
la 6-
mercaptopurine, la fludarabine, la cladribine, la pentostatine, la cytarabine,
le 5-
fluorouracile, la gemcitabine, le méthotrexate, le raltitrexed, l'irinotécan,
le topotécan,
l'étoposide, la daunorubicine, la doxorubicine, l'épirubicine, l'idarubicine,
la
pirarubicine, la mitoxantrone, la chlorméthine, la cyclophosphamide,
l'ifosfamide, le
melphalan, le chlorambucil, le busulfan, la carmustine, la fotémustine, la
streptozocine,
CA 02726907 2010-12-03
WO 2009/147217 33 PCT/EP2009/056885
le carboplatine, le cisplatine, l'oxaliplatine, la procarbazine, la
dacarbazine, la
bléomycine, la vinblastine, la vincristine, la vindésine, la vinorelbine, le
paclitaxel, le
docétaxel, la L-asparaginase, la flutamide, la nilutamide, la bicalutamide,
l'acétate de
cyprotérone, la triptoréline, la leuproréline, la goséréline, la buséréline,
le formestane,
l'aminoglutéthimide, l'anastrazole, le létrozole, le tamoxiféne, l'octréotide,
le lanréotide,
l'acide (Z)-3-[2,4-diméthyl-5-(2-oxo-1,2-dihydro-indol-3-ylidéneméthyl)-1H-
pyrrol-3-
yl]-propionique, l'acide 4-((9-chloro-7-(2,6-difluorophényl)-5H-pyrimidol(5,4-
d)(2)benzazépin-2-yl)amino)benzoïque, l'acide 5,6-diméthylxanthénone-4-
acétique ou
encore l'acide 3-(4-(1,2-diphénylbut-1-ényl)phényl)acrylique.
La composition pharmaceutique telle que décrite ci-dessus peut être utile en
particulier pour le traitement des maladies prolifératives, telles que le
cancer, le
psoriasis ou la fibrose, et en particulier le cancer.
La présente invention concerne également l'utilisation d'une composition
pharmaceutique comprenant :
(i) au moins un composé de formule (I) ou un composé de formule :
o o
OMe Me OEt OEt
OMe MeO MeO OMe
MeO I OMe MeO I I OMe MeO I OMe
OMe OMe OMe OMe
CO2H CO2H
MeO MeO OMe
I I OMe MeO I I
MeO OMe
OMe ou OMe
(ii) au moins un autre principe actif, notamment notamment utile pour le
traitement de
maladies prolifératives telles que le cancer, le psiorasis ou la fibrose, et
avantageusement un agent anti-cancéreux tel qu'un agent anti-vasculaire,
cytotoxique ou anti-angiogénique,
en tant que produits de combinaison pour une utilisation simultanée, séparée
ou étalée
dans le temps, pour la fabrication d'un médicament destiné au traitement de
maladies
prolifératives, telles que le cancer, le psoriasis ou la fibrose, et en
particulier le cancer.
L'invention va maintenant être illustrée, de manière non limitative, par les
exemples 1 à 4 et les figures 1 à 4 qui suivent.
CA 02726907 2010-12-03
WO 2009/147217 34 PCT/EP2009/056885
FIGURES :
La Figure 1 illustre l'activité cytotoxique du composé (I-1) sur les cellules
endothéliales humaines EAhy926, mesurée immédiatement à la fin d'un traitement
de
3heures ou de 6 heures avec le composé (I-1).
La Figure 2 illustre l'activité cytotoxique du composé (I-1) sur les cellules
endothéliales humaines EAhy926 mesurée après 72 heures d'un traitement de 3, 6
ou 72
heures.
La Figure 3 illustre l'activité anti-vasculaire des composés (I-1) et (I-16),
en
comparaison avec du DMSO à 0,1%, sur des cellules endothéliales humaines
EAhy926,
immédiatement après la mise en culture dans du matrigel.
La Figure 4 illustre l'activité anti-vasculaire des composés (I-1) et (I-16),
en
comparaison avec du DMSO à 0,1%, sur des cellules endothéliales humaines
EAhy926,
après 24h de culture dans du matrigel afin de permettre aux tubes vasculaires
de se
former.
EXEMPLES :
Exemple 1 : Synthèse des molécules de l'invention
Les abréviations suivantes ont été utilisées :
APCI Ionisation chimique à pression atmosphérique
APTS Acide para-toluènesulfonique
CCM Chromatographie sur Couche Mince
dba Dibenzylidèneacétone
DMAP Diméthylaminopyridine
DME 1,2-Diméthoxyéthane
DMSO Diméthylsulfoxyde
EDCI 1 -Ethyl-3-(3-diméthylaminopropyl)carbodiimide
ESI Ionisation par électrospray
Fmoc 9-Fluorénylméthoxycarbonyle
HMDS 1, 1, 1,3,3,3-Hexaméthyldisilazane
HPLC Chromatographie Liquide Haute Performance
MM Masse moléculaire
NMP N-Méthyl-2-pyrrolidinone
CA 02726907 2010-12-03
WO 2009/147217 35 PCT/EP2009/056885
PCC Chlorochromate de pyridinium
Rf Rapport frontal
RMN résonance Magnétique Nucléaire
T.A. Température ambiante
TBAF Fluorure de tétrabutylammonium
THF Tétrahydrofurane
X-Phos 2-Dicyclohexylphosphino-2',4',6'-triisopropylbiphényle
Xantphos 4,5-Bis(diphénylphosphino)-9,9-diméthylxanthène
1.1. Synthèse des composés intermédiaires de formule (II)
Composé de formule (II-1)
MeO. ,OSitBuMe2
MeO~ OMe
OMe (II-1)
A -78 C, on additionne 1 mmol de tBuLi (2 éq) à une solution contenant 0,5
mmol de
tbutyl[(5-iodo-2-méthoxyphenoxy)]diméthylsilane dissous dans 15 mL d'hexane
distillé. Après 45 minutes d'agitation à cette température on ajoute 0,5 mmol
de 3,4,5-
triméthoxyacétophénone dilué dans 5 mL de toluène distillé. Ce mélange est
agité 12
heures en laissant progressivement remonter la température puis est lentement
hydrolysé par une solution de NH4C1 saturée jusqu'à pH = 7-8. Après extraction
à
l'éther diéthylique (3 x 20 mL), les phases organiques réunies sont séchées
sur Na2SO4
et concentrées à l'évaporateur rotatif. Le brut réactionnel est repris dans 10
mL de
CH2C12 auxquels on additionne quelques grains d'acide para-toluènesulfonique
(APTS)
hydraté puis est agité 3 heures à température ambiante. La solution est lavée
par une
solution saturée de NaC1, extraite au CH2C12. Après séchage sur Na2SO4 et
concentration à l'évaporateur rotatif, on recueille une huile qui est purifiée
sur gel de
silice. Rendement 55%.
'H RMN: 8, ppm, CDC13, 300 MHz: 0,14 (s, 6H), 0,97 (s, 9H), 3,81 (s, 6H), 3,82
(s,
3H), 3,87 (s, 3H), 5,30 (d, 1H, J= 1,3 Hz), 5,35 (d, 1H, J= 1,3 Hz), 6,54 (s,
2H), 6,80
(d, 1H, J = 8,3 Hz), 6,85 (d, 1H, J = 2,2 Hz), 6,91 (dd, 1H, J = 8,3 Hz, J =
2,2 Hz).
Analyse élémentaire: (MM = 430,22) Calculé C: 66,94, H: 7,96; Trouvé C: 66,85,
H:
7,92.
CA 02726907 2010-12-03
WO 2009/147217 36 PCT/EP2009/056885
Composé de formule (II-2)
MeO OH
MeO OMe
OMe (II-2)
Le composé silylé (II-1) (0,17 mmol) est dissous dans 10 mL de méthanol auquel
on
ajoute 0,25 mmol de K2C03. La solution est agitée à température ambiante
pendant 12
heures puis est lavée par une solution saturée de NaC1. La phase aqueuse est
extraite par
de l'acétate d'éthyle (3 x 10 mL). Les phases organiques réunies sont séchées
sur
Na2SO4 et concentrées à l'évaporateur rotatif. Le résidu obtenu est purifié
sur gel de
silice. Rendement 94%.
'H RMN: 8, ppm, CDC13, 300 MHz: 3,81 (s, 6H), 3,87 (s, 3H), 3,91 (s, 3H), 5,30
(d,
1H, J= 1,5 Hz), 5,37 (d, 1H, J= 1,5 Hz), 5,60 (sl, 1H), 6,55 (s, 2H), 6,82 (m,
2H), 6,97
(d, 1H, J= 2,1 Hz). Spectrométrie de masse (ESI) [M+Na]+ = 339. Analyse
élémentaire:
(MM = 316,13) Calculé C: 68,34, H: 6,37; Trouvé C: 68,25, H: 6,33.
Composé de formule (II-3)
Meo
McOi 0OMe
OMe (II-3)
A 0 C et sous atmosphère d'argon, on additionne lentement au goutte à goutte
une
solution commerciale de bromure de (4-méthoxyphényl) magnésium (2,2 mmol) à
une
solution contenant 1 mmol de 3,4,5-triméthoxyacétophénone diluée dans 5 mL de
tétrahydrofurane (THF) distillé. La solution est agitée 12 heures à
température ambiante
puis est hydrolysée par ajout d'une solution saturée de NH4C1 jusqu'à pH = 7-
8. Après
extraction au dichlorométhane (3 x 20 mL), les phases organiques réunies sont
séchées
sur Na2SO4 et concentrées à l'évaporateur rotatif. Le brut réactionnel est
ensuite traité
comme pour (II-2) à l'acide para-toluènesulfonique pour conduire après
purification sur
gel de silice au dérivé attendu II-3. Rendement 64%.
'H RMN: 8 ppm, CD3COCD3, 300 MHz: 3,75 (s, 3H), 3,78 (s, 6H), 3,82 (s, 3H),
5,34
(m, 2H), 6,60 (s, 2H), 6,92 (d, 2H, J = 8,7 Hz), 7,29 (d, 2H, J = 8,7 Hz).
Analyse
élémentaire: (MM = 300,14) Calculé C: 71,98, H: 6,71; Trouvé C: 71,85, H:
6,66.
CA 02726907 2010-12-03
WO 2009/147217 37 PCT/EP2009/056885
Composé de formule (II-4)
MeO
MeO
OMe (II-4)
Il a été préparé selon le mode opératoire décrit pour le composé de formule
(II-3) à
partir de bromure de para-tolylmagnésium et de 3,4,5-triméthoxyacétophénone.
Rendement 54%.
'H RMN: 8, ppm, CDC13, 300 MHz: 2,33 (s, 3H), 3,75 (s, 3H), 3,76 (s, 6H), 5,38
(d,
1H, J = 1,2 Hz), 5,40 (d, 1H, J = 1,2 Hz), 6,59 (s, 2H), 7,22-7,25 (m, 4H).
Analyse
élémentaire: (MM = 284,14) Calculé C: 76,03, H: 7,09; Trouvé C: 75,74, H:
6,99.
Composé de formule (II-5)
Meo
Me0
OMe (II-5)
Il a été préparé à partir de bromure de 2-naphtylmagnésium et de 3,4,5-
triméthoxyacétophénone selon le mode opératoire décrit pour le composé de
formule
(II-3). Rendement 81 %.
'H RMN: 8, ppm, CDC13, 300 MHz: 3,77 (s, 9H), 5,54-5,64 (m, 2H), 6,67 (s, 2H),
7,50-
7,55 (m, 3H), 7,87-7,91 (m, 4H). Analyse élémentaire: (MM = 320,14) Calculé C:
78,73, H: 6,29; Trouvé C: 78,64, H: 6,20.
Composé de formule (II-6)
Meo O
Me0 O
OMe (II-6)
A -78 C, on additionne 1 mmol de tBuLi (2 eq) à une solution contenant 0,5
mmol de 5-
bromo-benzo[1,3]dioxole dissous dans 15 mL d'hexane distillé. Après 45 minutes
d'agitation à cette température on ajoute 0,5 mmol de 3,4,5-
triméthoxyacétophénone
diluée dans 5 mL de toluène distillé. Ce mélange est agité 12 heures en
laissant
progressivement remonter la température puis est lentement hydrolysé par une
solution
de NH4C1 saturée jusqu'à pH = 7-8. Après extraction à l'éther diéthylique (3 x
20 mL),
les phases organiques réunies sont séchées sur Na2SO4 et concentrées à
l'évaporateur
CA 02726907 2010-12-03
WO 2009/147217 38 PCT/EP2009/056885
rotatif. Le brut réactionnel est repris dans 10 mL de CH2C12 auxquels on
additionne
quelques grains d'APTS hydraté puis est agité 3 heures à température ambiante.
La
solution est lavée par une solution saturée de NaC1, extraite au CH2C12. Après
séchage
sur Na2SO4 et concentration à l'évaporateur rotatif, on recueille une huile
qui est
purifiée sur gel de silice. Rendement 19%.
'H RMN: 8, ppm, CDC13, 300 MHz: 3,72 (s, 6H), 3,78 (s, 3H), 5,21 (d, 1H, J=
1,5 Hz),
5,25 (d, 1H, J= 1,5 Hz), 5,86 (s, 2H), 6,46 (s, 2H), 6,67 (d, 1H, J= 8,7 Hz),
6,72-6,76
(m, 2H). Spectrométrie de masse (ESI) [M+Na]+ = 337. Analyse élémentaire: (MM
=
314,12) Calculé C: 68,78, H: 5,77; Trouvé C: 68,68, H: 5,72.
Composé de formule (II-7)
MeO OCOMe
MeO I I OMe
OMe (II-7)
A une solution du composé (II-2) (0,316 mmol) dissous dans 1 mL de CH2C12
sont ajoutés 54 L de pyridine et 0,016 mmol de DMAP. Le mélange est refroidi
à 0 C,
puis 42 L d'anhydride acétique (0,442 mmol) sont additionnés lentement. Après
1
heure d'agitation à 0 C, le mélange réactionnel est hydrolysé (H20, 3 mL) puis
extrait à
l'acétate d'éthyle (3 x 3 mL). Les phases organiques sont rassemblées, séchées
sur
sulfate de sodium, et concentrées pour donner un résidu qui est purifié sur
gel de silice.
Rendement 65%.
'H RMN: 8, ppm, CDC13, 300 MHz: 2,28 (s, 3H), 3,74 (s, 6H), 3,78 (s, 3H), 3,84
(s,
3H), 5,26 (d, 1H, J= 1,5 Hz), 5,31 (d, 1H, J= 1,5 Hz), 6,48 (s, 2H), 6,86 (d,
1H, J= 8,7
Hz), 6,97 (d, 1 H, J = 2,1 Hz), 7,16 (dd, 1 H, J = 8,4 Hz, J = 2,1 Hz).
Spectrométrie de
masse (ESI) [M+Na]+ = 381. Analyse élémentaire: (MM = 358,14) Calculé C:
67,03, H:
6,19; Trouvé C: 66,88, H: 6,06.
Composé de formule (II-8)
MeO OP(O)(OBn)2
MeO II OMe
OMe (II-8)
Le composé (II-2) (0,136 mmol) est dilué dans un mélange composé de 153 L de
tétrachlorure de carbone et 1,3 mL d'acétonitrile sec à -25 C. Après 10
minutes
CA 02726907 2010-12-03
WO 2009/147217 39 PCT/EP2009/056885
d'agitation, sont ajoutés successivement de la diisopropyléthylamine (0,663
mmol), de
la diméthylaminopyridine (0,0136 mmol) et du phosphite de dibenzyle (0,458
mmol) au
milieu réactionnel. Après 1 heure 30 min d'agitation à -25 C, le mélange
réactionnel est
hydrolysé par une solution aqueuse saturée de KH2PO4 et extrait avec de
l'acétate
d'éthyle (3 x 3 mL). Les phases organiques sont rassemblées, séchées sur
sulfate de
sodium, et concentrées pour donner un résidu qui est purifié sur gel de
silice.
Rendement 40%.
'H RMN: 8, ppm, CDC13, 300 MHz: 3,81 (s, 6H), 3,82 (s, 3H), 3,88 (s, 3H), 5,17
(d,
4H, J= 7,8 Hz,), 5,32 (s, 1H), 5,33 (d, 1H, J= 0,6 Hz), 6,55 (s, 2H), 6,89 (d,
1H, J= 8,4
Hz), 7,14 (m, 1H), 7,23 (t, 1H, J= 7,3 Hz), 7,23-7,4 (m, 10 H). Spectrométrie
de masse
(ESI) [M+Na]+ = 599. Analyse élémentaire: (MM = 576,19) Calculé C: 66,66, H:
5,77;
Trouvé C: 66,58, H: 5,72.
Composé de formule (II-9)
MeO NO2
MeO I I OMe
OMe (II-9)
Sous atmosphère inerte, 1,07 g de bromure de méthyl triphénylphosphonium (3
mmol, 1
éq.) sont dilués dans 10 mL de THF. Puis, 2,83 mL d'une solution molaire de
lithium
hexamethyldisilazide (LiHMDS) dans le THF (3 mmol) sont additionnés lentement
goutte à goutte à 0 C. Le milieu réactionnel est agité à 0 C durant 1 heure.
La solution
vire au jaune vif. Puis une solution de 520 mg de diarylcétone (1,5 mmol)
(préparée
selon US 2005/107 339) dans 10 mL de THF est additionnée goutte à goutte à 0
C. Le
mélange est laissé sous agitation durant 30 minutes sous atmosphère inerte à 0
C puis à
température ambiante. On ajoute au milieu 1 mL d'eau puis le milieu est
concentré sous
vide. Le résidu est dissout dans 20 mL de dichlorométhane puis est lavé 3 fois
à l'eau.
La phase organique est séchée sur MgS04 puis condensée sous vide. Le résidu
est
chromatographié sur gel de silice. Rendement 70%.
'H RMN: 8, ppm, CDC13, 300 MHz: 3,82 (s, 6H), 3,88 (s, 3H), 3,98 (s, 3H), 5,44
(s,
2H), 6,80 (s, 2H), 7,05 (d, 1H, J= 8,7 Hz), 7,52 (dd, 1H, J= 8,7 Hz, J= 2,3
Hz), 7,87
(d, 1H, J= 2,3 Hz). Spectrométrie de masse (ESI) [M+Na]+ = 368.
CA 02726907 2010-12-03
WO 2009/147217 40 PCT/EP2009/056885
Composé de formule (II-10)
NO2
MeO
MeO OMe
OMe
(II-10)
Ce composé a été préparé selon le mode opératoire décrit pour le composé de
formule
(II-9) à partir de la diarylcétone correspondante (préparée selon US 2005/107
339).
Rendement 70%.
'H RMN: 8, ppm, CDC13, 300 MHz: 3,77 (s, 6H), 3,83 (s, 3H), 3,89 (s, 3H), 6,44
(s,
2H), 7,14 (dd, 1H, J= 8,4 Hz, J= 2,7 Hz), 7,34 (d, 1H, J= 8,4 Hz), 7,42 (d,
1H, J= 2,7
Hz). Spectrométrie de masse (ESI) [M+Na]+ = 368.
Composé de formule (II-11)
NO
Z
MeO
MeO
OMe OMe (II-11)
Ce composé a été préparé selon le mode opératoire décrit pour le composé de
formule
(II-9) à partir de la diarylcétone correspondante (préparée selon US 2005/107
339).
Rendement 54%.
'H RMN: 8, ppm, CDC13, 300 MHz: 3,77 (s, 6H), 3,83 (s, 3H), 3,92 (s, 3H), 6,45
(s,
2H), 6,91 (d, 1H, J= 3,0 Hz), 6,96 (dd, 1H, J= 9,0 Hz, J= 3,0 Hz), 8,05 (d,
1H, J= 9,0
Hz). Spectrométrie de masse (ESI) [M+Na]+ = 368.
Composé de formule (II-12)
MeO
MeO I I OMe
OMe F (II-12)
Ce composé a été préparé selon le mode opératoire décrit pour le composé de
formule
(II-1) à partir de 3,4,5-triméthoxyacétophénone et de 2-fluoro-4-iodoanisole.
Rendement 48%
CA 02726907 2010-12-03
WO 2009/147217 41 PCT/EP2009/056885
'H RMN: 8, ppm, CDC13, 300 MHz: 3,82 (s, 6H), 3,88 (s, 3H), 3,92 (s, 3H), 5,35
(d,
1H, J= 1,5 Hz), 5,38 (d, 1H, J= 1,5 Hz), 6,58 (s, 2H), 6,95 (m, 1H), 7,05-7,19
(m, 2H).
Spectrométrie de masse (ESI) [M+Na]+ = 341.
Composé de formule (II-13)
O
HN O
MeO I I O` ^ \ /
MeO OFVQe Ot-Bu
OMe (II-13)
A une solution du composé (II-2) (0,79 mmol) dans 15 mL de CH2C12 sont ajoutés
0,94
mmol de chlorhydrate de 1-éthyl-3-(3-diméthylaminopropyl)carbodiimide (EDCI),
0,87
mmol de N,N-4-diméthylaminopyridine (DMAP) et 0,87 mmol de N-Fmoc sérine (Ot-
Bu) (sérine dont la fonction amine est protégée par un groupement 9-
fluorénylméthoxycarbonyle (Fmoc) et dont la fonction acide est protégée par un
groupement tert-butyle). Après une nuit d'agitation, le mélange réactionnel
est
hydrolysé avec une solution aqueuse saturée de NaHCO3, et extrait à l'acétate
d'éthyle
(3 x 10 mL). Les phases organiques sont rassemblées, séchées sur sulfate de
sodium,
filtrées et le solvant est évaporé puis le résidu obtenu est chromatographié
sur gel de
silice. Rendement 39.%.
'H RMN: 8, ppm, CDC13, 300 MHz: 1,09 (s, 9H), 3,64 (dd, 1H, J= 9,0 Hz, J= 2,7
Hz),
3,73 (s, 6H), 3,76 (s, 3H), 3,79 (s, 3H), 3,95 (dd, 1H, J= 9,0 Hz, J= 3,0 Hz),
4,19 (t,
1H, J= 6,9 Hz), 4,27-4,39 (m, 2H), 4,72 (m, 1H), 5,26 (s, 1H), 5,31 (s, 1H),
6,67 (d,
1 H, J = 9,0 Hz), 6,47 (s, 2H), 6,87 (d, 1 H, J = 8,7 Hz), 6,98 (d, 1 H, J =
2,1 Hz), 7,18
(dd, 1H, J= 8,4 Hz , J= 2,4 Hz), 7,23 (d, 2H, J= 7,5 Hz), 7,31 (t, 2H, J= 7,2
Hz), 7,53
(m, 2H), 7,68 (d, 2H, J= 7,2 Hz). Spectroscopie de masse (ESI) [M+Na]+ = 704.
Composé de formule (II-14)
MeO OCON(Et)2
MeO I I OMe
OMe (II-14)
A une solution du composé (II-2) (0,316 mmol) dans 2 mL de CH2C12 sec sont
ajoutés
54 L de pyridine et 0,632 mmol de chlorure d'acide N,N-diéthylcarbamique.
Après une
CA 02726907 2010-12-03
WO 2009/147217 42 PCT/EP2009/056885
nuit d'agitation à température ambiante, le mélange réactionnel est hydrolysé
et extrait
avec de l'acétate d'éthyle (3x 3 mL). Les phases organiques sont rassemblées,
séchées
sur sulfate de sodium, filtrées et le solvant est évaporé. Le résidu ainsi
obtenu est
chromatographié sur gel de silice. Rendement 50%.
'H RMN: 8, ppm, CDC13, 300 MHz: 1,11-1,20 (m, 6H), 3,28-3,39 (m, 4H), 3,75 (s,
6H),
3,77 (s, 3H), 3,80 (s, 3H), 5,25 (d, 1H, J= 0,9 Hz), 5,32 (d, 1H, J= 1,2 Hz),
6,50 (s,
2H), 6,82 (d, 1H, J = 8,4 Hz), 7,05-7,10 (m, 2H). Spectroscopie de masse (ESI)
[M+Na]+ = 438.
Composé de formule (II-15)
MeO O
~NMe2
MeO I I OMé
OMe (II-15)
A une solution du composé (II-2) (0,316 mmol) dans 5 mL de CH2C12 sont ajoutés
0,47
mmol de l'EDCI, 0,47 mmol DMAP et 0,47 mmol de N,N-diméthylglycine. Après une
nuit d'agitation à température ambiante, le mélange réactionnel est hydrolysé
avec 6 mL
d'une solution aqueuse saturée de NaHCO3, et extrait avec de l'acétate
d'éthyle (3x 3
mL). Les phases organiques sont rassemblées, séchées sur sulfate de sodium,
filtrées et
le solvant est évaporé. Le résidu ainsi obtenu est chromatographié sur gel de
silice.
Rendement 65%.
'H RMN: 8, ppm, CDC13, 300 MHz: 2,37 (s, 6H); 3,37 (s, 2H); 3,74 (s, 6H), 3,77
(s,
3H), 3,80 (s, 3H), 5,26 (s, 1H), 5,31 (s, 1H), 6,47 (s, 2H), 6,86 (d, 1H, J=
8,7 Hz), 6,97
(d, I H, J = 2,1 Hz), 7,16 (dd, I H, J = 8,4 Hz , J = 2,1 Hz). Spectroscopie
de masse
(ESI) [M+Na]+ = 424.
Composé de formule (II-16)
(11-16)
A une solution d'indole (165 mg, 1,41 mmol) dans 5 ml de THF anhydre, sont
ajoutés
successivement 1,83 mmol de 3,4,5-triméthoxyacétophénone et 0,14 mmol de
TiC14. Le
mélange est agité sous atmosphère d'azote à température ambiante pendant 2
heures. On
CA 02726907 2010-12-03
WO 2009/147217 43 PCT/EP2009/056885
additionne 100 mL d'eau dans le milieu réactionnel et il se forme une
suspension
blanche qui est filtrée sur fritté pour livrer 150 mg de poudre blanche. Le
filtrat est
extrait avec 3 x 30 mL de dichlorométhane. La phase aqueuse est alors traitée
avec une
solution saturée de carbonate de sodium jusqu'à pH = 10 puis est extraite à
nouveau
avec 3 x 30 mL de dichlorométhane. La phase organique est lavée par une
solution
saturée de carbonate de sodium, puis est séchée sur sulfate de sodium, filtrée
et
concentrée sous pression réduite pour fournir 415 mg de produit brut qui est
dissout
dans 5 mL de dichlorométhane et 0,68 mmol d'APTS sont additionnés. Le mélange
est
agité sous atmosphère d'azote à température ambiante pendant 30 minutes. 100
mL
d'une solution saturée de carbonate de sodium sont ajoutés, et la solution est
extraite
avec 3 x 30 mL de dichlorométhane. La phase organique est séchée sur sulfate
de
sodium, filtrée et concentrée sous pression réduite pour fournir 110 mg de
produit brut
qui est purifié sur colonne de silice. Rendement = 70%.
'H RMN: 8, ppm, CDC13, 300 MHz: 3.72 (s, 6H); 3,81 (s, 3H); 5,33 (s, 1H), 5,50
(s,
1H), 6,64 (s, 2H), 7.04-7.07 (m, 2H), 7.15 (t, 1H, J= 8,0 Hz), 7,33 (d, 1H, J=
8,0 Hz),
7,56 (d, 1H, J= 8,0 Hz), 8.30 (sl, 1H). Spectroscopie de masse (ESI) (M+Na+) =
332,0.
Composé de formule (II-17)
OMe
MeO I I OH
MeO OMe (II-17)
A -78 C, on additionne 1 mmol de tBuLi (2 eq) à une solution contenant 0,5
mmol de
tbutyl[(5-iodo-2-méthoxyphenoxy)]diméthylsilane dissous dans 15 mL d'hexane
distillé. Après 45 minutes d'agitation à cette température on ajoute 0,5 mmol
de 2,3,4-
triméthoxyacétophénone dilué dans 5 mL de toluène distillé. Ce mélange est
agité 12
heures en laissant progressivement remonter la température puis est lentement
hydrolysé par une solution de NH4C1 saturée jusqu'à pH = 7-8. Après extraction
à
l'éther diéthylique (3 x 20 mL), les phases organiques réunies sont séchées
sur Na2SO4
et concentrées à l'évaporateur rotatif. Le brut réactionnel est ensuite
dissous dans 10 mL
de méthanol auquel on ajoute 0,25 mmol de K2C03. La solution est agitée à
température
ambiante pendant 12 heures puis est lavée par une solution saturée de NaC1. La
phase
aqueuse est extraite par de l'acétate d'éthyle (3 x 10 mL). Les phases
organiques réunies
CA 02726907 2010-12-03
WO 2009/147217 44 PCT/EP2009/056885
sont séchées sur Na2SO4 et concentrées à l'évaporateur rotatif pour donner un
résidu qui
est ensuite purifié sur gel de silice. Rendement 51 %.
'H RMN: 8, ppm, CDC13, 300 MHz: 3,60 (s, 3H), 3,82 (s, 3H), 3,84 (s, 3H), 3,88
(s,
3H), 5,21 (d, 1H, J= 1,5 Hz), 5,54 (d, 1H, J= 1,5 Hz), 5,63 (sl, 1H), 6,70 (d,
1H, J=
8,7 Hz), 6,78-6,84 (m, 2H), 6,95-6.99 (m, 2H). Spectroscopie de masse (ESI)
(M+Na+)
= 339.
Composé de formule (II-18)
OMe
MeO I I OH
OMe (II-18)
A -78 C, on additionne 1 mmol de tBuLi (2 eq) à une solution contenant 0,5
mmol de
tbutyl[(5-iodo-2-méthoxyphenoxy)]diméthylsilane dissous dans 15 mL d'hexane
distillé. Après 45 minutes d'agitation à cette température on ajoute 0,5 mmol
de 2.3-
diméthoxybenzaldéhyde dilué dans 5 mL de toluène distillé. Ce mélange est
agité 12
heures en laissant progressivement remonter la température puis est lentement
hydrolysé par une solution de NH4C1 saturée jusqu'à pH = 7-8. Après extraction
à
l'éther diéthylique (3 x 20 mL), les phases organiques réunies sont séchées
sur Na2SO4
et concentrées à l'évaporateur rotatif. Le brut réactionnel est dilué dans 30
mL de
CH2C12 et on ajoute par portion 3 équivalents de PDC. L'ensemble est agité 12
h à
température ambiante puis est filtré sur silice. Après concentration au
rotavapor, on
obtient la cétone brute, suffisamment propre pour être utilisée sans
purification.
Rendement 87%. La cétone brute est traitée selon le protocole décrit pour (II-
9) et est
ensuite désilylée sans purification préalable selon le protocole décrit pour
(II-2).
Rendement: 54%.
'H RMN: 8, ppm, CDC13, 300 MHz: 3,50 (s, 3H), 3,80 (s, 6H), 5,17 (d, 1H, J=
1.5 Hz),
5,49 (s, 1H), 5,60 (d, 1H, J= 1,5 Hz), 6,70-6,98 (m, 6H). Spectroscopie de
masse (ESI)
(M+Na+) = 309.
CA 02726907 2010-12-03
WO 2009/147217 45 PCT/EP2009/056885
Composé de formule (II-19)
CN
MeO I OH
MeO I I OMe
OMe (II-19)
Ce composé (mélange 1/1 d'isomères Z/E) a été préparé selon le mode opératoire
décrit
pour le composé de formule (II-9) à partir de la phenstatine silylée (G. R.
Pettit et al. J.
Med. Chem. 1998, 41, 1688-1695) et de l'ylure correspondant préparé à partir
du
bromure de cyanométhyltriphénylphosphonium. (Rendement 87%).
'H RMN: 8, ppm, CDC13, 300 MHz: 3,80 (s, 3H), 3,83 (s, 3H), 3,88 (s, 1,5H),
3,91 (s,
1,5H), 3,93 (s, 1,5H), 3,95 (s, 1,5H), 5,56 (s, 0,5H), 5,60 (s, 0,5H), 5,67
(s, 1H), 6,49 (s,
1H), 6,36 (s, 1H), 6,83 (s, 1H), 6,90-6,95 (m, 1,5H), 7,10 (dd, 0,5H, J= 9,0
Hz, J= 2,1
Hz). Spectroscopie de masse (ESI) (M+Na+) = 364.
Composé de formule (II-20)
F F
MeO I OH
MeO I I OMe
OMe (II-20)
Ce composé a été préparé selon le mode opératoire décrit pour le composé de
formule
(II-9) à partir de la phenstatine silylée (G. R. Pettit et al. J. Med. Chem.
1998, 41, 1688-
1695) et de l'ylure correspondant préparé à partir du
difluoromethylphosphonate
d'éthyle. (Rendement 89%).
'H RMN: 8, ppm, CDC13, 300 MHz: 3,85 (s, 6H), 3,92 (s, 3H), 3,99 (s, 3H), 5,68
(s,
1H), 6,50 (s, 2H), 6,80-6,98 (m, 3H). Spectrométrie de masse (ESI) [M+Na]+ =
375,2.
Composé de formule (II-21)
MeO N NH2
N N
MeO
N~
OMe
- (II-21)
CA 02726907 2010-12-03
WO 2009/147217 46 PCT/EP2009/056885
Une solution de N-benzyladénine (1,0 mmol, 1 éq.) et de 1-iodo-l-(3,4,5-
triméthoxyphényl)éthène (1,5 mmole, 1,5 éq.) en présence de CsCO3 (2,0 mmol, 2
éq.),
de Cul (2,0 mmole, 2 éq.) et de Pd(OH)2/C (20 % en masse) est préparée dans un
tube
sec, bouché par un septum. Après un flux d'argon, la NMP (6 mL) est
additionnée à
travers le septum à l'aide d'une seringue. Après cette opération, le tube est
scellé, et le
mélange est mis sous agitation à 160 C sous irradiation micro-onde pendant 30
minutes.
La suspension résultante est refroidie jusqu'à la température ambiante et
filtrée sur un
fritté portant une mince couche de celite en utilisant un mélange CH2C12/MeOH
(7 :3,
v/v) comme solvant d'élution. Le filtrat est concentré et le résidu est
purifié par
chromatographie sur une colonne de gel de silice (cyclohexane/acétate d'éthyle
: 7/3.
(Rendement 40%).
'H RMN: 8, ppm, CD3OD, 300 MHz: 3,68 (s, 3H), 3,73 (s, 2H), 5,25 (s, 2H), 5,65
(s,
1H), 5,98 (s, 1H), 6,52 (s, 2H), 6,96-7,20 (m, 1H), 8,28 (bs, 1H).
Spectrométrie de
masse (ESI positive) : [M+H]+ = 418, [M+Na]+ = 440.
Composé de formule (II-22)
MeO / \ I
MeO OMe
OMe (II-22)
Etape 1 : Synthèse du composé de formule (V-1) suivante .
o
MeO I
MeO OMe
OMe (V-1)
A 0 C et sous atmosphère d'argon, on additionne lentement une solution 1 M
(2,2 mL)
de bromure de 3,4,5-triméthoxyphényl magnésium (2,2 mmol) à une solution
contenant
1 mmol de 3-iodo-4-méthoxybenzaldéhyde diluée dans 5 mL de tétrahydrofurane
(THF)
distillé. La solution est agitée 12 heures à température ambiante puis est
hydrolysée par
ajout d'une solution saturée de NH4C1 jusqu'à pH = 7-8. Après extraction au
dichlorométhane (3 x 20 mL), les phases organiques réunies sont séchées sur
Na2SO4 et
CA 02726907 2010-12-03
WO 2009/147217 47 PCT/EP2009/056885
concentrées à l'évaporateur rotatif. L'alcool secondaire brut réactionnel est
ensuite
mélangé à 215.5 mg de chlorochromate de pyridinium (PCC, 1 eq) dans le CH2C12
pendant 1 h. On ajoute ensuite 215 mg supplémentaires de PCC au milieu
réactionnel
qui est agité 1 h à température ambiante. Cette opération est renouvelée avec
100 mg de
PCC et l'ensemble est mis à réagir 2 h supplémentaires. Le brut réactionnel
est filtré sur
silice et est concentré à l'évaporateur rotatif. Le résidu est chromatographié
sur gel de
silice. (Rendement sur les 2 étapes : 40%).
'H RMN: 8, ppm, CDC13, 300 MHz: 3,90 (s, 6 H), 3,95 (s, 3 H), 4,00 (s, 3 H),
6,90 (d, 1
H, J= 8,5 Hz), 6,95 (s, 2 H), 7,82 (dd, 1 H, J= 8,5 Hz, J= 1.2 Hz), 8,32 (d, 1
H, J= 1,2
Hz). Analyse élémentaire: (MM = 428,22) Calculé C: 47,68, H: 4,00; Trouvé C:
47,48,
H: 3,92.
Etape 2 : Synthèse du composé (II-22)
Sous atmosphère inerte, 1,07 g de bromure de méthyl triphénylphosphonium (3
mmol, 1
éq.) sont dilués dans 10 mL de THF. Puis, 2,83 mL d'une solution molaire de
lithium
hexamethyldisilazide (LiHMDS) dans le THF (3 mmol) sont additionnés lentement
goutte à goutte à 0 C. Le milieu réactionnel est agité à 0 C durant 1 heure.
La solution
vire au jaune vif. Puis une solution de 520 mg de composé (V-1) (1,5 mmol)
dans 10
mL de THF est additionnée goutte à goutte à 0 C. Le mélange est laissé sous
agitation
durant 30 minutes sous atmosphère inerte à 0 C puis à température ambiante.
On ajoute
au milieu 1 mL d'eau puis le milieu est concentré sous vide. Le résidu est
dissout dans
20 mL de dichlorométhane puis est lavé 3 fois à l'eau. La phase organique est
séchée
sur MgS04 puis condensée sous vide. Le résidu est chromatographié sur gel de
silice.
(Rendement 82%).
'H RMN: 8, ppm, CDC13, 300 MHz: 4,07 (s, 6 H), 4,13 (s, 3 H), 4,15 (s, 3 H),
5, 60 (d,
2 H, J= 5,0 Hz), 6,70 (s, 2 H), 7,03 (d, 1 H,J= 8,5 Hz), 7,53 (dd, 1 H, J 8,5
Hz, J
1.2 Hz), 8,06 (d, 1 H, J= 1,2 Hz). Spectrométrie de masse (APCI+) [M+H] = 427.
Composé de formule (II-23)
OH
Me0
MeO \ OMe
oMe (II-23)
CA 02726907 2010-12-03
WO 2009/147217 48 PCT/EP2009/056885
A une solution de composé II-22 (l,lg, 2, 58 mmol, 1 eq) dans 25 mL de
tétrahydrofurane, 1,2 mL de triéthylamine distillée, sont ajoutés, sous
atmosphère inerte,
100 mg de PdC12(PPh3)2, et 54 mg d'iodure cuivreux. Après agitation du mélange
réactionnel, celui-ci est plongé dans un bain d'huile à 60 C et une solution
de prop-2-
yn-1-ol (0,5 mL, 3,3 eq) dans 25 mL de THF, est additionnée au goutte à
goutte. Après
16 heures sous agitation à 60 C, sous atmosphère inerte, le milieu
réactionnel est repris
par 40 mL d'acétate d'éthyle. La phase organique est lavée avec une solution
saturée de
NH4C1(3x 30 mL), séchée sur sulfate de sodium, filtrée sur verre fritté, puis
concentrée
sous vide. Le résidu est ensuite purifié par chromatographie sur colonne de
gel de silice.
(Rendement 50%).
'H RMN: 8, ppm, CDC13, 300 MHz: 3,75 (s, 6 H), 3,81 (s, 3 H), 3,84 (s, 3 H),
4,46 (s, 2
H), 5,28 (d, 2 H, J = 8,5 Hz), 6,45 (s, 2 H), 6,78 (d, 1 H, J = 8,5 Hz), 7,24
(m, 1 H5),
7,37 (d, 1 H, J= 2,3 Hz). Spectrométrie de masse (APCI+) [M+H] = 355.
Composé de formule (II-24)
OH
Meo
Meo OMe
OMe (II-24)
Le composé (II-24) est préparé selon le protocole opératoire décrit pour (II-
23) en
utilisant 3,3 équivalents de but-3-yn-1-ol et après 16 h d'agitation.
(Rendement 46%).
'H RMN: 8, ppm, CDC13, 300 MHz: 2,42 (t, 2 H, J= 6,3 Hz), 2,64 (t, 2 H, J= 6,3
Hz),
3,73 (s, 6 H), 3,79 (s, 3 H), 3,81 (s, 3 H), 5,26 (d, 2 H, J = 6,7 Hz), 6,44
(s, 2 H), 6,75
(d, 1 H6, J = 8,6 Hz), 7,15 (dd, 1 H, J = 2,2 Hz, J = 8,6 Hz), 7,32 (d, 1 H, J
= 2,2 Hz).
Spectrométrie de masse (APCI+) [M+H]+ = 369.
Composé de formule (II-25)
OH
Me0
Me0 OMe
OMe (II-25)
CA 02726907 2010-12-03
WO 2009/147217 49 PCT/EP2009/056885
Le composé (II-25) est préparé selon le protocole opératoire décrit pour (II-
23) en
utilisant 3,3 équivalents de pent-4-yn-1-ol et après 16 h d'agitation.
Rendement 54%.
'H RMN: 8, ppm, CDC13, 300 MHz: 1,88 (q, 2 H, J = 6,8 Hz), 2,60 (t, 2 H, J =
6,8
Hz), 3,81 (m, 8 H), 3,88 (s, 3 H), 3,89 (s, 3 H), 5,34 (d, 2 H, J = 7,2 Hz),
6,52 (s, 2
H), 6,81 (d, 1 H, J= 8,6 Hz), 7,22 (dd, 1 H, J= 2,3 Hz, J= 8,6 Hz), 7,39 (d, 1
H, J= 2,3
Hz). Spectrométrie de masse (APCI+) [M+H]+ = 383.
Composé de formule (II-26)
OH
MeO / \
MeO \ / OMe
OMe (II-26)
Le composé (II-26) est préparé selon le protocole opératoire décrit pour (II-
23) en
utilisant 3,3 équivalents de hex-5-yn-1-ol et après 16 h d'agitation.
(Rendement 45%).
'H RMN: 8, ppm, CDC13, 300 MHz: 1,73 (m, 4 H), 2,51 (t, 2 H, J= 6,5 Hz), 3,71
(t, 2
H, J= 5,5 Hz), 3,80 (s, 6 H), 3,87 (s, 3 H), 3,89 (s, 3 H), 5,34 (d, 2 H, J=
7,9 Hz), 6,52
(s, 2 H), 6,81 (d, 1 H, J= 8,6 Hz), 7,20 (dd, 1 H, J= 2,2 Hz, J= 8,6 Hz), 7,39
(d, 1 H, J
= 2,2 Hz). Spectrométrie de masse (APCI+) [M+H]+ = 397.
Composé de formule (II-27)
OMe
MeO /
MeO \ OMe
OMe (II-27)
Le composé (II-27) est préparé selon le protocole opératoire décrit pour (II-
23) en
utilisant 2,0 équivalents de 4-méthoxyphényl-1-éthyne et après 16 h
d'agitation.
(Rendement 80%).
CA 02726907 2010-12-03
WO 2009/147217 50 PCT/EP2009/056885
'H RMN: 8, ppm, CDC13, 300 MHz: 3,78 (s, 3 H), 3,81 (s, 6 H), 3,88 (s, 3 H),
3,91 (s, 3
H), 5,37 (d, 2 H, J= 10,6 Hz), 6,55 (s, 2 H), 6,84 (m, 3 H), 7,25 (dd, 1 H, J=
2,0 Hz, J
= 8,8 Hz), 7,52-7,46 (m, 3 H). Spectrométrie de masse (APCI+) [M+H]+ = 431.
Composé de formule (II-28)
OMe
OMe
:::roMe
OMe
OMe (II-28)
Le composé (II-28) est préparé selon le protocole opératoire décrit pour (II-
23) en
utilisant 2,5 équivalents de 3,4,5-triméthoxyphényl-1-éthyne et après 16 h
d'agitation.
Rendement 74%).
'H RMN: 8, ppm, CDC13, 300 MHz: 3,78 (s, 3 H), 3,81 (s, 6 H), 3,88 (s, 3H),
3,91 (s, 3
H), 5,37 (d, 2 H, J = 10,6 Hz), 6,55 (s, 2 H), 7,25 (s, 2 H), 7,30 (d, 1 H, J
= 8,7
Hz), 7,48 (dd, 1 H, J = 2,0 Hz, J = 8,7 Hz), 7,51 (d, 1 H, J = 2,0 Hz).
Spectrométrie de
masse (APCI+) [M+H]+ = 491.
Composé de formule (II-29)
NO2
Meo
Meo CM.
OMe (II-29)
A une solution de (II-22) (426 mg ;l mmol ; 1 eq) dans 2 mL de DME sont
ajoutés,
sous atmosphère inerte, à température ambiante, l'acide 4-nitrophényl
boronique (488
mg , 2.5 mmol), NaHCO3 (420 mg, 5 eq) dans 0,4 mL d'eau distillée, et
Pd(PPh3)4 (70
mg, 0.06 mmol). Le mélange est porté au reflux durant 24 heures. La phase
organique
est lavée avec une solution saturée de NH4C1(3x 30 mL), séchée sur sulfate de
sodium,
filtrée sur verre fritté, puis concentrée sous vide. Le résidu est ensuite
purifié par
chromatographie sur colonne de gel de silice. (Rendement 56%).
CA 02726907 2010-12-03
WO 2009/147217 51 PCT/EP2009/056885
'H RMN: 8, ppm, CDC13, 300 MHz: 3,76 (s, 6 H), 3,80 (s, 3 H), 3,81 (s, 3 H),
5,32 (d, 2
H, J = 10,6 Hz), 6,51 (s, 2 H), 6,91 (d, 1 H, J = 8,3 Hz), 7,19 (s, 1 H), 7,29
(m, 1
H), 7,62 (d, 2 H, H,6, J = 8,0 Hz), 8,18 (d, 2 H, J = 8,0 Hz). Spectrométrie
de masse
(APCI+) [M+H]+ = 422.
Composé de formule (II-30)
MOMe (II-30)
Le composé (II-30) est préparé selon le protocole opératoire décrit pour (II-
29) en
utilisant l'acide 3-nitrophényl boronique. (Rendement 60%).
'H RMN: 8, ppm, CDC13, 300 MHz: 3,83 (s, 6 H), 3,87 (s, 3 H), 3,88 (s, 3 H),
5,41 (d, 2
H, J= 11,8 Hz), 6,59 (s, 2 H), 6,99 (d, 1 H, J= 8,1 Hz), 7,36 (m, 2 H), 7,56
(t, 1 H, J=
7,9 Hz), 7,82-7,86 (m, 1 H), 8,15-8,19 (m, 1 H), 8,41 (t, 1 H, J= 1,9 Hz).
Spectrométrie
de masse (APCI+) [M+H]+ = 422.
Composé de formule (II-31)
Me0 / \
Me0 OMe NOZ
OMe (II-31)
A une suspension de K2C03 (l eq) dans le DMSO anhydre (5 mL) est ajouté, à -15
C,
II-2 (l eq). Après 30 minutes d'agitation à température ambiante, une solution
de 4-
fluoro-nitrobenzène (l eq) est ajoutée goutte à goutte et le tube réactionnel
est scellé.
Après 1 h d'agitation à 100 C, le brut réactionnel est extrait par l'acétate
d'éthyle (10
mL) puis lavé avec une solution saturée en NH4C1 (10 mL). Le brut est ensuite
purifié
sur colonne de gel de silice. (Rendement 99%).
'H RMN: 8, ppm, CDC13, 300 MHz: 3,80 (s, 3 H), 3,81 (s, 6 H), 3,86 (s, 3 H),
5,38 (d, 2
H, J = 13,8 Hz), 6,54 (s, 2 H), 6,94 (d, 2 H, J = 9,3 Hz), 7,01 (d, 1 H, J =
8,5 Hz), 7,13
CA 02726907 2010-12-03
WO 2009/147217 52 PCT/EP2009/056885
(d, 1 H, J = 2,2 Hz), 7,29 (dd, 1H, J = 2,2 Hz, J = 8,5 Hz), 8,16 (d, 2 H, J =
9,3
Hz). Spectrométrie de masse (APCI+) [M+H]+ = 438.
Composé de formule (II-32)
MeO /
1 1 \ / \ OMe
Me0 O
OMe (II-32)
Le dérivé (II-27) (l00 mg, 1 eq) et l'acide para-toluène sulfonique (APTS, 0,1
eq) sont
mis en solution dans 3 mL d'éthanol dans un tube scellé (M. Jacubert et al.
Tetrahedron
Lett. 2009, 50, 3588-3592). Ce tube est chauffé à 170 C sous irradiation micro-
ondes
pendant 30 minutes. Après ajout d'acétate d'éthyle au milieu réactionnel (3
mL), la
phase organique est lavée à l'eau, séchée sur sulfate de sodium, filtrée puis
concentrée.
Le résidu est purifié par chromatographie sur colonne de gel de silice.
(Rendement
71%).
'H RMN: 8, ppm, CDC13, 300 MHz: 3,81 (s, 6H), 3,86 (s, 3 H), 3,90 (s, 3 H),
5,44 (dd,
2 H, J= 1,2 Hz, J= 6,8 Hz), 6,60 (s, 2 H), 6,86 (s, 1 H), 6,98 (d, 2 H, J= 8,8
Hz), 7,27
(dd, 1 H, J = 1,8 Hz ; J = 8,5 Hz), 7,5 (d, 1 H, J = 8,5 Hz), 7,54 (bs, 1 H, J
= 1,8
Hz), 7,80 (d, 2 H, J= 8,8 Hz). Spectrométrie de masse (APCI+) [M+H]+ = 417.
Composé de formule (II-33)
OTBDMS
MeO I OTBDMS
I
MeO OMe
OMe (II-33)
Etape 1 . Synthèse du composé (XI-1)
H
N,~/
Me0 N' OS \\
MeO
OMe (XI-1)
CA 02726907 2010-12-03
WO 2009/147217 53 PCT/EP2009/056885
g de 3,4,5-triméthoxyacétophénone (24 mmol ; 1 éq.) et 5,48 g de p-
toluenesulfonyl
hydrazine (28,8 mmol ; 1,2 éq.) sont mis en solution dans 100 mL d'éthanol
absolu. Le
milieu réactionnel (solution jaune) est agité à reflux et la réaction est
suivie par CCM
(Cyclohexane/Acétate d'éthyle : 7/3, Rf = 0,49). Après 4 h, le milieu
réactionnel
5 (solution jaune) est refroidi à 0 C. Un précipité jaune se forme. Ce
précipité est
récupéré par filtration sur fritté et lavé par de l'éthanol froid, puis
recristallisé dans de
l'éthanol. (Rendement 79%).
'H RMN: 8, ppm, CDC13, 300 MHz: 2,14 (s, 3H); 2,41 (s, 3H); 3,85 (s, 3H); 3,86
(s,
6H); 6,86 (s, 2H); 7,31 (d, 2H, J = 8,05 Hz); 7,74 (s, 1H); 7,92 (d, 2H, J =
8.20 Hz).
Spectrométrie de masse (APCI+) [M+H]+= 379.
Etape 2 : Synthèse du composé (II-33)
A une solution de 454 mg de XI-1 (1,2 mmol ; 1,2 éq.), de 196 mg de t-BuOLi
(2,4
mmol ; 2,4 éq.), de 52 mg de Pd2dba3 (0,005 mmol ; 10 %), de 98 mg de X-Phos
dans
mL de dioxane est ajoutée à température ambiante une solution de 448 mg de 1-
15 bromo-2,3-di-tert-butyldiméthylsilyloxy-4-méthoxybenzène (l mmol ; 1 éq.)
dans 5 mL
de dioxane. Le milieu réactionnel est ensuite chauffé à 70 C et la réaction
est suivie par
CCM (Cyclohexane/acétate d'éthyle - 7/3 pour l'hydrazine et cyclohexane pour
le
dérivé bromé aromatique). Après 6 h, le milieu réactionnel est refroidi à T.A.
et dilué
par du CH2C12, puis est filtré sur célite et concentré sous pression réduite.
Le produit
20 brut est purifié sur une colonne de gel de silice (Cyclohexane/Acétate
d'éthyle - 9/1).
(Rendement 82%).
'H RMN: 8, ppm, CDC13, 300 MHz: 0,05 (s, 6H), 0,71 (s, 6H), 0,76 (s, 9H), 0,98
(s,
9H), 3,77 (s, 6H), 3,79 (s, 3H), 3,83 (s, 3H), 5,32 (s, 1H), 5,65 (s, 1H),
6,52 (d, 1H, J =
8,4 Hz), 6,56 (s, 2H), 6,78 (d, 1H, J = 8,5 Hz).
Composé de formule (II-34)
OH
MeO OH
I I
MeO OMe
OMe (II-34)
CA 02726907 2010-12-03
WO 2009/147217 54 PCT/EP2009/056885
A une solution de 0,46 g de composé II-33 (8,2 mmol, 1 éq.) dans 20 mL de THF
sont
ajoutés à 0 C 11,5 mL de fluorure de tetra-butyl amonium 1M (l1, 5 mmol, 1,4
éq.). Le
milieu réactionnel est agité à température ambiante et suivi par CCM
(Cyclohexane/acétate d'éthyle - 9/1). Après 1, 5h0, le milieu réactionnel est
hydrolysé,
le THF est évaporé et le résidu est repris par de l'acétate d'éthyle. Les
phases
organiques sont lavées par une solution saturée de NaC1, séchées par MgSO4 et
concentrées sous pression réduite. Le produit brut est purifié sur une colonne
de gel de
silice (Cyclohexane/ acétate d'éthyle - 1/1). (Rendement 37 %).
'H RMN: 8, ppm, CDC13, 300 MHz: 3,78 (s, 6H) 3,84 (s, 3H) 3,87 (s, 3H), 5,35
(d, 1H,
J=1,3Hz), 5,47 (s, 1H), 5,65 (d, 1H, J=1,3Hz), 5,69 (s, 1H), 6,48 (d, 1H,
J=8,6Hz), 6,57
(s, 2H), 6,69 (d, 1H, J=8,5Hz). Spectrométrie de masse (ESI, m/z, %): 355
(M+Na,
100).
Composé de formule (II-35)
MeO
Me
MeO PIIc-~ O
OMe (II-35)
Ce composé a été préparé selon le mode opératoire décrit pour le composé de
formule
(II-33) à partir de 5-bromo-2-méthoxypyridine. (Rendement 60%).
'H RMN: 8, ppm, CDC13, 300 MHz: 3,80 (s, 6H), 3,85 (s, 3H), 3,94 (s, 3H), 5,37
(d,
2H, J= 1,2 Hz), 6,51 (s, 2H), 6,70 (d, 1H, J = 8,6 Hz), 7,51 (dd, 1H, J = 2,5
Hz, J = 8,6
Hz), 8,17 (d, 1H, J = 2,4 Hz). Spectrométrie de masse (APCI+) [M+H] 302.
Composé de formule (II-36)
MeO N NH2
Me0
OMe
L
bMe (II-36)
CA 02726907 2010-12-03
WO 2009/147217 55 PCT/EP2009/056885
Ce composé a été préparé selon le mode opératoire décrit pour le composé de
formule
(II-21) par couplage entre le 1-iodo-l-(3,4,5-trimethoxyphenyl)ethene et le N9-
4-
méthoxybenzyladenine. (Rendement 42%).
'H RMN: 8, ppm, CDC13, 300 MHz: 3,71 (s, 9H), 3,84 (s, 3H), 5.10 (s, 2H), 5,65
(s,
lHz), 5,90 (s, 2H), 6,25 (s, 2H), 6,34 (s, 2H), 6,68 (d, 2H, J = 8,4 Hz), 6,93
(d, 2H, J =
8,4 Hz), 8,40 (se, 1H). Spectrométrie de masse (APCI+) [M+H] 448.
Composé de formule (II-37)
MeO
MeO
OMe (II-37)
Ce composé a été préparé selon le mode opératoire décrit pour le composé de
formule
(II-33) à partir 5-bromo-N-méthylindole. (Rendement 53%).
'H RMN: 8, ppm, CDC13, 300 MHz: 3,79 (s, 6H), 3,83 (s, 3H), 3,84 (s, 3H), 5,38
(d,
1H, J = 1,5 Hz), 5,41 (d, 1H, J = 1,4 Hz), 6.44 (dd, 1H, J = 0,6 Hz, J = 3,1
Hz), 6,66 (s,
2H), 7,18 (d, 1H, J = 3,2 Hz), 7,18 (dd, 1H, J = 1,7 Hz, J = 8,3 Hz), 7,35 (d,
1H, J = 8,5
Hz), 7,53 (dd, 1H, J = 0,6 Hz, J = 1,6 Hz). Spectrométrie de masse (APCI+)
[M+H]+=
324.
Composé de formule (II-38)
MeO
Me0 P N
OMe (II-38)
Ce composé a été préparé selon le mode opératoire décrit pour le composé de
formule
(II-33) à partir de 6-bromoquinoléine. (Rendement 47%).
'H RMN: 8, ppm, CDC13, 300 MHz: 3,80 (s, 6H), 3,90 (s, 3H), 5,56 (s, 1H), 5,59
(s,
1H), 6,57 (s, 2H), 7,41 (dd, 1H, J = 4,3 Hz, J = 8,3 Hz), 7,75 (dd, 1H, J =
2,0 Hz, J = 8,7
Hz), 7,79 (d, 1H, J = 1,6 Hz), 8,08 (d, 1H, J = 8,7 Hz), 8,14 (dd, 1H, J = 0,8
Hz, J = 8,3
Hz), 8,91 (dd, 1H, J = 1,6 Hz, J = 4,2 Hz). Spectrométrie de masse (APCI+)
[M+H]
322.
CA 02726907 2010-12-03
WO 2009/147217 56 PCT/EP2009/056885
Composé de formule (II-39)
MeO I I O2
OMe
OMe (II-39)
Etape 1 Synthèse du composé de formule (XI-2) suivante
H
,
MeO N OS I ~~
OMe (XI-2)
Le composé de formule (XI-2) a été obtenu selon le protocole de préparation
décrit pour
le composé (XI-1) à partir de la 3,5-diméthoxyacétophénone. (Rendement 76%).
'H RMN: 8, ppm, CDC13, 300 MHz: 2.11 (s, 3H), 2.41 (s, 3H), 3.79 (s, 6H), 6.45
(t, 1H,
J=2.lHz), 6.78 (dd, 2H, J=1,lHz, J=2,2Hz), 7,30 (d, 2H, J=8,OHz), 7,92 (d, 2H,
J=8,2Hz). Spectrométrie de masse (ESI) [M+H]+= 349
Etape 2 : Synthèse du composé (II-39)
A une solution de XI-2 (1,2 mmol ; 1,2 éq.), de 196 mg de t-BuOLi (2,4 mmol ;
2,4
éq.), de 52 mg de Pd2dba3 (0,005 mmol ; 10 mol%), de 98 mg de X-Phos dans 20
mL de
dioxane est ajoutée à température ambiante une solution de 5-bromo-2-méthoxy
nitrobenzène (l mmol ; 1 éq.) dans 5 mL de dioxane. Le milieu réactionnel est
ensuite
chauffé à 70 C et la réaction est suivie par CCM. Après 6 h, le milieu
réactionnel est
refroidi à température ambiante et dilué par du CH2C12, puis est filtré sur
célite et
concentré sous pression réduite. Le produit brut est purifié sur une colonne
de gel de
silice (Cyclohexane/Acétate d'éthyle - 7/3). (Rendement 80%).
'H RMN: 8, ppm, CDC13, 300 MHz: 3,77 (s, 6H), 3,98 (s, 3H); 5,46 (d, J = 5,33
Hz,
2H), 6,44 (m, 3H); 7,04 (d, J = 8,73 Hz, 1H); 7,50 (dd, J = 2,31 et 8,72 Hz,
1H), 7,86 (d,
J = 2,31 Hz, 1H).
CA 02726907 2010-12-03
WO 2009/147217 57 PCT/EP2009/056885
Composé de formule (II-40)
MeO I I H
-11OMe
OMe (II-40)
A une solution de XI-2 (1,2 mmol ; 1,2 éq.), de 196 mg de t-BuOLi (2,4 mmol ;
2,4
éq.), de 52 mg de Pd2dba3 (0,005 mmol ; 10 mol%), de 98 mg de X-Phos dans 20
mL de
dioxane est ajoutée à température ambiante une solution de 4-iodo-2-tert-
butyldiméthylsilyloxy anisole (l mmol ; 1 éq.) dans 5 mL de dioxane. Le milieu
réactionnel est ensuite chauffé à 70 C et la réaction est suivie par CCM.
Après 6 h, le
milieu réactionnel est refroidi à température ambiante et dilué par du CH2C12,
puis est
filtré sur célite et concentré sous pression réduite. Le produit brut est
ensuite désilylé en
présence de fluorure de tétrabutylammonium (TBAF) selon le protocole décrit
pour le
produit II-34. Le composé II-40 est purifié sur colonne de gel de silice
(Cyclohexane/Acétate d'éthyle - 7/3). (Rendement 78%).
'H RMN: 8, ppm, CDC13, 300 MHz: 3,78 (s, 6H), 3,88 (s, 3H); 5,36 (d, J = 1 Hz,
1H),
5,41 (d, J = 1 Hz, 1H), 5,72 (s, 3H); 6,46 (t, J = 2,1 Hz, 1H); 6,52 (d, J =
2,1 Hz, 1H),
6,77-6,83 (m, 2H), 6,99 (d, J = 2,0 Hz, 1H). Spectrométrie de masse (ESI)
[M+Na]+ _
309, [2M+Na] = 595.
1.2. Synthèse des composés de l'invention de formule (I) avec X = CH
Protocole général de réduction catalytique de diaryléthylènes:
1 mmol de diaryléthylène est dissoute dans 5 mL d'acétate d'éthyle en présence
de 10
mol% de Pd/C. L'ensemble est mis à réagir sous atmosphère d'hydrogène jusqu'à
disparition totale du produit de départ (CCM). Le catalyseur est filtré puis
le solvant est
évaporé sous pression réduite et le résidu obtenu est chromatographié sur gel
de silice.
Composé de formule (I-1) (nommé également Dihydro iso CA-4 ou DHiCA-4 ou
isoérianine)
CA 02726907 2010-12-03
WO 2009/147217 58 PCT/EP2009/056885
MeO
MeO OMe
OMe OH (I-1)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-2).
Rendement 98%.
'H RMN: 8, ppm, CDC13, 300 MHz: 1.58 (d, 3H, J= 7.2 Hz), 3.81 (s, 9H), 3.83
(s, 3H),
3.8 8 (q, 1 H, J = 7.2 Hz), 5.60 (s, 1 H), 6.43 (s, 2H), 6.70 (dd, 1 H, J =
10.2 Hz, J = 2.2
Hz), 6.78 (d, 1H, J= 10.2 Hz), 6.81 (d, 1H, J= 2.2 Hz). Spectrométrie de masse
(ESI)
[M+Na]+ = 341.
Les deux énantiomères (I-la) et (I-lb) ont été séparés par HPLC sur colonne
chirale
(colonne AD-H, P = 621 psi, débit = 1 mL/min; éluant hexane/éthanol : 75/25)
(I-la =
8,5 min et I-lb = 12,5 min).
Composé de formule (I-2)
MeO
MeO OMe
OMe (I-2)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-3).
Rendement 93%.
'H RMN: 8, ppm, CDC13, 300 MHz: 1.50 (d, 3H, J= 7.2 Hz), 3.66 (s, 6H), 3.72
(s, 3H),
3.74 (s, 3H), 3.95 (q, 1H, J= 7.2 Hz), 6.30 (s, 2H), 6.75 (d, 1H, J= 7.2 Hz),
7.05 (d,
1H, J= 10.2 Hz). Spectrométrie de masse (ESI) [M+Na]+ = 325.
Composé de formule (I-3)
Meo
Meo
OMe (I-3)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-4).
Rendement 99%.
CA 02726907 2010-12-03
WO 2009/147217 59 PCT/EP2009/056885
'H RMN: 8, ppm, CDC13, 300 MHz: 1.52 (d, 3H, J= 7.2 Hz), 2.20 (s, 3H), 3.70
(s, 6H),
3.72 (s, 3H), 3.94 (q, 1H, J= 7.2 Hz), 6.35 (s, 2H), 6.98-7.05 (m, 4H).
Spectrométrie de
masse (ESI) [M+Na]+ = 309.
Composé de formule (I-4)
Meo
Meo
OMe (I-4)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-5).
Rendement 91 %.
'H RMN: 8, ppm, CDC13, 300 MHz: 1.62 (d, 3H, J= 7.2 Hz), 3.70 (s, 6H), 3.74
(s, 3H),
4.16 (q, 1 H, J = 7.2 Hz), 6.3 8 (s, 2H), 7.22 (dd, 1 H, J = 8.5 Hz, J = 2.2
Hz), 7.28-7.42
(m, 2H), 7.61 (s, 1H), 7.64-7.77 (m, 3H). Spectrométrie de masse (ESI) [M+Na]+
= 345.
Composé de formule (I-5)
Meo 0
Me0
OMe (I-5)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-6).
Rendement 86 %.
'H RMN: 8, ppm, CDC13, 300 MHz: 1.52 (d, 3H, J= 7.2 Hz), 3.75 (s, 9H), 4.00
(q, 1H,
J= 7.2 Hz), 5.80 (s, 2H), 6.35 (s, 2H), 6.62-6.68 (m, 3H). Spectrométrie de
masse (ESI)
[M+Na]+ = 339.
Composé de formule (I-6)
MeO OCOMe
MeO OMe
OMe (I-6)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-7).
Rendement 90%.
CA 02726907 2010-12-03
WO 2009/147217 60 PCT/EP2009/056885
'H RMN: 8, ppm, CDC13, 300 MHz: 1.51 (d, 3H, J= 7.2 Hz), 2.22 (s, 3H), 3.73(s,
3H),
3.74 (s, 6H), 3.75 (s, 3H), 3.95 (q, 1H, J= 7.2 Hz), 6.32 (s, 2H), 6.79-6.83
(m, 2H), 6.97
(dd, 1H, J= 8.4 Hz, J= 1.7 Hz). Spectrométrie de masse (ESI) [M+Na]+ = 383.
Composé de formule (I-7)
NH2
MeO
MeO I I / OMe
OMe (I-7)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-10).
Rendement 86%.
'H RMN: 8, ppm, CDC13, 300 MHz: 1.50 (d, 3H, J= 7.2 Hz), 3.63 (s, 3H), 3.70
(s, 6H),
3.74 (s, 3H), 3.85 (q, 1 H, J = 7.2 Hz), 6.14 (m, 1 H), 6.32 (m, 3H), 7.06 (d,
1 H, J = 8.4
Hz). Spectrométrie de masse (ESI) [M+H]+ = 318.
Composé de formule (I-8)
NH2
Meo
Meo
OMe OMe(I-8)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-11).
Rendement 89%.
'H RMN: 8, ppm, CDC13, 300 MHz: 1.50 (d, 3H, J= 7.2 Hz), 3.71 (s, 6H), 3.72
(s, 3H),
3.74 (s, 3H), 3.85 (q, I H, J = 7.2 Hz), 6.33 (s, 2H), 6.55 (d, I H, J = 8.4
Hz), 6.60 (dd,
1H, J = 8.4 Hz, J = 2.7 Hz), 6.80 (d, 1H, J = 2.7 Hz). Spectrométrie de masse
(ESI)
[M+Na]+ = 340.
Composé de formule (I-9)
MeO
MeO OMe
OMe F (1-9)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-12).
Rendement 97%.
CA 02726907 2010-12-03
WO 2009/147217 61 PCT/EP2009/056885
'H RMN: 8, ppm, CDC13, 300 MHz: 1.50 (d, 3H, J= 7.2 Hz), 3.73 (s, 6H), 3.74
(s, 3H),
3.78 (s, 3H), 3.95 (q, 1H, J= 7.2 Hz), 6.32 (s, 2H), 6.68-6.90 (m, 3H).
Spectrométrie de
masse (ESI) [M+Na]+ = 343.
Composé de formule (I-10)
O
HN O
:pc:fOtBU
OMe (I-10)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-13).
Rendement 91 %.
'H RMN: 8, ppm, CDC13, 300 MHz: 1.15 (s, 9H), 1.53 (d, 3H, J = 7.2 Hz), 3.60-
3.71
(m, 1H), 3.73 (s, 3H), 3.74 (s, 6H), 3.78 (s, 3H), 3.90-4.06 (m, 2H), 4.21 (t,
1H, J= 7.8
Hz), 4.31-4.49 (m, 2H), 4.72-4.79 (m, I H), 5.70 (m, I H), 6.30 (s, 2H), 6.60-
6.83 (m,
2H), 6.95 (dd, 1 H, J = 8.4 Hz, J = 2.7 Hz), 7.22 (t, 2H, J = 7.4 Hz), 7.32
(t, 2H, J = 7.4
Hz), 7.54 (m, 2H), 7.68 (d, 2H, J = 7.4 Hz). Spectrométrie de masse (ESI)
[M+Na]+ _
706,7.
Composé de formule (I-11)
Meo
Meo PN
OMe H (I-11)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-16).
Rendement 79%.
'H RMN: 8, ppm, CDC13, 300 MHz: 1.55 (d, 3H, J= 7.2 Hz), 3.72 (s, 6H), 3.74
(s, 3H),
4.20 (q, 1 H, J = 7.2 Hz), 6.43 (s, 2H), 6.92-6.99 (m, 2H), 7.06-7.09 (dd, 1
H, J = 8.1 Hz,
J = 0.9 Hz), 7.15 (d, I H, J = 7.8 Hz), 7.27 (d, I H, J = 7.8 Hz), 7.95 (s, I
H).
Spectrométrie de masse (ESI) [M+Na]+ = 334.
CA 02726907 2010-12-03
WO 2009/147217 62 PCT/EP2009/056885
Composé de formule (I-12)
MeO I I O ô NEt2
MeO OMe
OMe (I-12)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-14).
Rendement 91 %.
1H RMN: 8, ppm, CDC13, 300 MHz: 1.10-1.30 (m, 6H), 1.50 (d, 3H, J= 7.2 Hz),
3.25-
3.45 (m, 4H), 3.72 (s, 6H), 3.74 (s, 3H), 3.75 (s, 3H), 3.95 (q, 1H, J= 7.2
Hz), 6.32 (s,
2H), 6.78 (d, 1H, J = 8.4 Hz), 6.86-6.95 (m, 2H). Spectrométrie de masse (ESI)
[M+Na]+ = 440.
Composé de formule (I-13)
MeO OY'~ NMe2
MeO I / OMe
OMe (I-13)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-15).
Rendement 93%.
1H RMN: 8, ppm, CDC13, 300 MHz: 1.50 (d, 3H, J= 7.2 Hz), 2.35 (s, 6H), 3.35
(s, 2H),
3.72 (s, 3H), 3.74 (s, 6H), 3.76 (s, 3H), 3.95 (q, 1H, J= 7.2 Hz), 6.31 (s,
2H), 6.78-6.85
(m, 2H), 6.97 (dd, 1 H, J = 8.5 Hz, J = 2.0 Hz). Spectrométrie de masse (ESI)
[M+Na]
= 426.
Composé de formule (I-14)
MeO ONMe2 , HCI
MeO OMe
OMe (I-14)
A une solution de 0,2 mmol du composé (I-13) dans 1 mL de méthanol anhydre est
ajouté 1 mL d'une solution saturée de HCUMeOH. Après 12 h d'agitation à
température
ambiante, le solvant est évaporé et le brut est repris dans l'éther. Le solide
formé est
filtré sur verre fritté puis lavé à l'éther. Rendement 69%.
CA 02726907 2010-12-03
WO 2009/147217 63 PCT/EP2009/056885
Analyses élémentaires: (MM = 439.18) Calculé C: 60.06, H: 6.87, N: 3.18;
Trouvé C:
59.87, H: 6.74, N: 3.12.
Composé de formule (I-15)
OMe
::oze I (1-15)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-17).
Rendement 84%.
'H RMN: 8, ppm, CDC13, 300 MHz: 1.48 (d, 3H, J= 7.2 Hz), 3.59 (s, 3H), 3.70
(s, 3H),
3.75 (s, 3H), 3.77 (s, 3H), 4.25 (q, 1H, J= 7.2 Hz), 6.50-6.60 (m, 2H), 6.60-
6.65 (d, 1H,
J = 8.3 Hz), 6.70 (d, 1 H, J = 1.9 Hz), 6.79 (d, 1 H, J = 8.6 Hz).
Spectrométrie de masse
(ESI négative) [M-H]- = 317.
Composé de formule (I-16)
Meo I I OPO(OH)2
MeO OMe
OMe (I-16)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-8).
Rendement 70 %.
'H RMN: 8, ppm, CD3OD, 300 MHz: 1.40 (m, 3H), 3.50 (s, 3H), 3.61 (s, 9H), 3.95
(m,
1H), 6.40 (m, 2H), 6.75-6.90 (m, 2H), 7.10-7.30 (m, 1H). Spectrométrie de
masse (ESI
négative) [M-H]- = 397.
Composé de formule (I-17)
OMe
Meo I I OH
OMe(1-17)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-18).
Rendement 81 %.
'H RMN: 8, ppm, CDC13, 300 MHz: 1.51 (d, 3H, J= 7.1 Hz), 3.65 (s, 3H), 3.81
(s, 6H),
4.48 (q, 1H, J = 7.2 Hz), 6.71-6.82 (m, 5H), 6.97 (t, 1H, J = 8.0 Hz).
Analyses
élémentaires: (MM = 288.14) Calculé C: 70.81, H: 6.99; Trouvé C: 70.58, H:
6.94.
CA 02726907 2010-12-03
WO 2009/147217 64 PCT/EP2009/056885
Composé de formule (I-18)
Meo I I OH
OMe
OMe (I-18)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
II-40.
Rendement 87%.
'H RMN: 8, ppm, CDC13, 300 MHz: 1.52 (d, 3H, J= 7.1 Hz), 3.65 (s, 3H), 3.81
(s, 6H),
4.48 (q, 1H, J = 7.2 Hz), 6.71 (s, 1H), 6.71-6.81 (m, 5H), 6.98 (t, 1H, J =
8.1 Hz).
Analyses élémentaires: (MM = 288.14) Calculé C: 70.81, H: 6.99; Trouvé C:
70.74, H:
6.96.
Composé de formule (I-19)
CN
MeO I I OH
MeO OMe
OMe (I-19)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-19).
Rendement 50 %.
'H RMN: 8, ppm, CDC13, 300 MHz: 2.97 (d, 2H, J= 7.5 Hz), 3.83 (s, 9H), 3.88
(s, 3H),
4.21 (t, 1H, J= 7.6 Hz), 5.61 (s, 1H), 6.42 (s, 2H), 6.73-6.83 (m, 3H).
Spectrométrie de
masse (ESI) [M+Na]+ = 366.
Composé de formule (I-20)
CHF2
Meo DÇ H
MeO OMe
OMe (I-20)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-20)
correspondant. Rendement 62 %
'H RMN: 8, ppm, CDC13, 300 MHz: 3.76 (s, 9H), 3.83 (s, 3H), 4.15 (td, 1H, J=
15.8
Hz, J = 4.2 Hz), 5.51 (s, 1 H), 6.15 (td, 1 H, J = 5 5.9 Hz, J = 4.2 Hz), 6.42
(s, 2H), 6.70-
6.83 (m, 3H). Analyses élémentaires: (MM = 354.35) Calculé C: 61.01, H: 5.69;
Trouvé
C: 60.81, H: 5.46.
CA 02726907 2010-12-03
WO 2009/147217 65 PCT/EP2009/056885
Composé de formule (I-21)
(1-21)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-9).
Rendement 58%
'H RMN: 8, ppm, CDC13, 300 MHz: 1.57 (d, 3H, J = 7.2 Hz), 3.82 (s, 12H), 3.98
(q,
1 H, J = 7.2 Hz), 6.44 (s, 2H), 6.56 (d, 1 H, J = 2.1 Hz), 6.60 (dd, 1 H, J =
8.2 Hz, J = 2.1
Hz), 6.72 (d, 1H, J= 8.2 Hz). Spectrométrie de masse (ESI) [M+H]+ = 318.
Composé de formule (I-22)
(I-22)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-34).
Rendement 95%.
'H RMN: 8, ppm, CDC13, 300 MHz: 1.57 (d, 3H, J= 7.2 Hz), 3.82 (s, 9H), 3.86
(s, 3H),
4.39 (q, 1H, J= 7.0 Hz), 5.37 (s, 2H), 6.44 (d, 1H, J= 8.6 Hz), 6.50 (s, 2H),
6.65 (d,
1H, J= 8.6 Hz). Spectrométrie de masse SM (APCI, m/z, %): 335 (M+1, 100).
Composé de formule (I-23)
MeO N NH2
N ~ \
Me0 N
OMe N~
(I-23)
A une solution de II-21 dans un mélange AcOEt/MeOH (4 : 1) sont additionnés
30% en
masse de Pt02. Le milieu réactionnel est ensuite mis sous vide grâce à une
trompe à eau
puis placé sous atmosphère d'hydrogène. Après 72h à température ambiante, le
milieu
réactionnel est filtré sur fritté portant une mince couche de célite en éluant
avec de
CA 02726907 2010-12-03
WO 2009/147217 66 PCT/EP2009/056885
l'AcOEt. Après concentration sous vide le résidu est purifié par
chromatographie sur gel
de silice cyclohexane/acétone (1 / 1). (Rendement 30%).
'H RMN: 8, ppm, CD3OD, 300 MHz: 1,64 (d, 1H, J = 7,0 Hz), 3,65 (s, 3H), 3,68
(s,
3H), 4,27 (q, 1H, J = 7,0 Hz), 5,15 (d, J = 16,2 Hz), 5,46 (d, J = 16,2 Hz),
6,64 (bs, 2H),
7,03-7,23 (m, 1H), 8,18 (s, 1H). Spectrométrie de masse (ESI positive) : [M+H]-
= 420.
Composé de formule (I-24)
MeO N NH2
\ I N ~ \N
MeO
N
OMe
OMe (I-24)
Ce composé est préparé selon la même procédure que celui décrit pour I-23 à
partir de
II-36. (Rendement 39%).
'H RMN: 8, ppm, CDC13, 300 MHz: 2.05 (s, 3H), 3,65 (s, 3H), 3,70 (s, 6H), 3,73
(s,
3H), 5,08 (d, 1H, J = 15,8 Hz), 5,37 (d, 1H, J = 15,8 Hz), 6,48 (s, 1H), 6,56
(s, 1H),
6,76-6,79 (m, 2H), 7,00-7,02 (m, 2H), 8,19 (s, 1H). Spectrométrie de masse
(APCI+)
[M+H]+= 450.
Composé de formule (I-25)
MeO
P--'I OH
MeO OMe
OMe
(I-25)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-23).
(Rendement 92%).
'H RMN: 8, ppm, CDC13, 300 MHz: 1,59 (d, 3 H, J = 7,2 Hz), 1,83 (q, 2 H, J =
6,3
Hz), 2,69 (t, 2 H, J= 7,2 Hz), 3,59 (t, 2 H, J= 6,3 Hz), 3,81 (s, 9 H), 3,82
(s, 3 H), 4,00
(q, 1 H, J = 7,2 Hz), 6,42 (s, 2 H), 6, 8 (d, 1 H, J = 8,0 Hz), 7,01-7,04 (m,
2
H). Spectrométrie de masse (APCI+) [M+H]+ = 361.
CA 02726907 2010-12-03
WO 2009/147217 67 PCT/EP2009/056885
Composé de formule (I-26)
MeO I I OH
MeO O M e
OMe
(I-26)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-24).
(Rendement 85%).
'H RMN: 8, ppm, CDC13, 300 MHz: 1,58-1,63 (m, 7 H), 2,61 (t, 2 H, J= 7,0 Hz),
3,66
(t, 2 H, J= 6,0 Hz), 3,79 (s, 3 H), 3,81 (m, 9 H), 3,70-4,06 (m, 1 H), 6,42
(s, 2 H), 6,76
(d, 1 H, J = 8,2 Hz), 6,96-7,02 (m, 2 H). Spectrométrie de masse (APCI+)
[M+H]+ _
375.
Composé de formule (I-27)
MeO I I OH
MeO OMe
OMe (I-27)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-25).
(Rendement 100%).
'H RMN: 8, ppm, CDC13, 300 MHz: 1,36-1,43 (m, 2 H), 1,60-1,66 (m, 7 H,), 2,56-
2,61
(m, 2 H), 3,62 (t, 2 H, J= 6,6 Hz), 3,80 (s, 3 H), 3,81 (m, 9 H), 3,97-4,05
(m, 1 H), 6,43
(s, 2 H), 6,76 (d, 1 H, J= 8,3 Hz), 6,97-7,03 (m, 2 H). Spectrométrie de masse
(APCI+)
[M+H]+ = 389.
Composé de formule (I-28)
MeO I OH
MeOI OMe
OMe (I-28)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-26).
(Rendement 93%).
'H RMN: 8, ppm, CDC13, 300 MHz: 1,33-1,36 (m, 4 H), 1,52-1,60 (m, 7 H), 2,54-
2,60
(m, 2 H), 3,61 (t, 2 H, J = 6,6 Hz), 3,79 (s, 3 H), 3,81 (s, 9H), 4,01 (q, 1
H, J = 7,3
CA 02726907 2010-12-03
WO 2009/147217 68 PCT/EP2009/056885
Hz), 6,43 (s, 2H), 6,76 (d, 1 H, J = 8,3 Hz), 6,96 (d, 1 H, J = 2,5 Hz), 7,00
(dd, 1 H, J =
2,5 Hz, J= 8,3 Hz). Spectrométrie de masse (APCI+) [M+H] = 403.
Composé de formule (I-29)
OMe
MeO /
Me0 OMe
OMe (I-29)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-27).
(Rendement 98%).
'H RMN: 8, ppm, CDC13, 300 MHz: 1,56 (d, 3 H, J = 7,2 Hz), 2,76-2,89 (m, 4
H), 3,79 (s, 3 H,), 3,80 (s, 3 H), 3,81 (s, 6 H), 3,82 (s, 3 H), 3,99 (q, 1 H,
J = 7,2 Hz),
6,42 (s, 2 H), 6,77-6,82 (m, 3 H), 6,94 (d, 1 H, J= 2,2 Hz), 7,02 (dd, 1 H, J=
2,2 Hz, J
= 8,4 Hz), 7,10 (d, 2 H, J= 8,6 Hz). Spectrométrie de masse (APCI+) [M+H]+ =
437.
Composé de formule (I-30)
OMe
OMe
OMe
MeO
MeO~-- ~OMe
OMe
(I-30)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-28).
(Rendement 98%).
'H RMN: 8, ppm, CDC13, 300 MHz: 1,56 (d, 3 H, J= 7,2 Hz), 2,76-2,91 (m, 4 H),
3,81
(m, 21 H), 3,95-4,05 (m, 1 H), 6,38 (s, 2 H), 6,42 (s, 2 H), 6,79 (d, 1 H, J =
8,4
Hz), 6,93 (d, 1 H, J = 2,1 Hz), 7,01-7,05 (m, 1 H5). Spectrométrie de masse
(APCI+)
[M+H]+ = 497.
CA 02726907 2010-12-03
WO 2009/147217 69 PCT/EP2009/056885
Composé de formule (I-31)
NHZ
Me0
Meo OMe
OMe (I-31)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-29).
(Rendement 88%).
'H RMN: 8, ppm, CDC13, 300 MHz: 1,62 (d, 3 H, J= 7,2 Hz), 3,78 (s, 3 H), 3,82
(s, 9
H), 4,02-4,10 (m, 3 H), 6,46 (s, 2 H), 6,74 (d, 2 H, J = 8,5 Hz), 6,87 (d, 1
H, J = 8,4
Hz), 7,10 (dd, 1 H, J = 2,2 Hz, J = 8,4 Hz), 7,17 (d, 1 H, J = 2,2 Hz), 7,33
(d, 2 H, J =
8,5 Hz). Spectrométrie de masse (APCI+) [M+H]+ = 394.
Composé de formule (I-32)
Me0 NHZ
MeO \ OMe
OMe (I-32)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-30).
(Rendement 89%).
'H RMN: 8, ppm, CDC13, 300 MHz: 1,62 (d, 3 H, J= 7,2 Hz), 3,78 (s, 3 H), 3,82
(s, 11
H), 4,03-4,09 (m, 1 H), 6,45 (s, 2 H), 6,64-6,68 (m, 1 H), 6,84 (m, 1 H), 6,89
(d, 2 H, J
= 8,4 Hz), 7,12-7,19 (m, 3 H). Spectrométrie de masse (APCI+) [M+H]+ = 394.
Composé de formule (I-33)
MeO O
MeO OMe NHZ
OMe (I-33)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-31).
(Rendement 85%).
CA 02726907 2010-12-03
WO 2009/147217 70 PCT/EP2009/056885
'H RMN: 8, ppm, CDC13, 300 MHz: 1,52 (d, 3 H, J= 7,2 Hz), 3,79 (s, 6 H), 3,81
(s, 5
H), 3,84 (s, 3 H), 3,90-3,98 (m, 1 H), 6,35 (s, 2 H), 6,62 (d, 2 H, J= 8,9
Hz), 6,76-6,81
(m, 3 H), 6,88 (m, 2 H, H5, H6). Spectrométrie de masse (APCI+) [M+H]+ = 410.
Composé de formule (I-34)
:::xcoooMe
\ 5 OMe (I-34)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-32).
(Rendement 98%).
'H RMN: 8, ppm, CDC13, 300 MHz: 1,68 (d, 3 H, J= 7,2 Hz), 3,82 (s, 6 H), 3,83
(s, 3
H), 3,86 (s, 3 H), 4,19 (q, 1 H, J= 7,2 Hz), 6,48 (s, 2 H), 6,84 (s, 1 H),
6,97 (d, 2 H, J=
9,0 Hz), 7,10-7,14 (m, 1 H), 7,40-7,42 ( m, 2 H), 7,77 (d, 2 H, J = 9,0 Hz).
Spectrométrie de masse (APCI+) [M+H]+ = 419.
Composé de formule (I-35)
MeO
MeO IN-Me
OMe (I-35)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
(II-37).
(Rendement 59%).
'H RMN: 8, ppm, CDC13, 300 MHz: 1,67 (d, 3H, J = 7,2 Hz), 3,74 (s, 3H), 3,76
(s, 9H),
4,19 (q, 1H, J = 7,1 Hz), 6,38 (dd, 1H, J = 0,6 Hz, J = 3,0 Hz), 6.55 (s, 2H),
7.05 (dd,
1H, J = 1,4 Hz, J = 8,5 Hz), 7,10 (d, 1H, J = 3,1 Hz), 7,26 (d, 1H, J = 8,5
Hz), 7,45 (s,
1H). Spectrométrie de masse (APCI+) [M+H]+ = 326.
Composé de formule (I-36)
MeO -N
MeO
OMe
OMe (I-36)
CA 02726907 2010-12-03
WO 2009/147217 71 PCT/EP2009/056885
Une solution de 30 mg de II-35 (0,099 mmol ; 1 éq.) dans 4,5 mL de méthanol
est
hydrogénée par le H-Cube (hydrogénateur en flux continu. Conditions : 1
mL/min,
température ambiante). Le filtrat récupéré est concentré sous pression
réduite. Le
produit brut est purifié par chromatographie sur gel de silice
(cyclohexane/diéthyléther
- 1/1, Rf = 0,27). (Rendement 99%).
'H RMN: 8, ppm, CDC13, 300 MHz: 1,63 (d, 3H, J = 7,2 Hz), 3,75 (s, 3H), 3,81
(s, 6H),
3,89 (s, 3H), 4,11 (q, 1H, J = 7,2 Hz), 6,55 (s, 2H), 6,75 (d, 1H, J = 8,6
Hz), 7,59 (dd,
1H, J = 2,3Hz, J = 8,6 Hz), 8,04 (d, 1H, J = 2,3 Hz). Spectrométrie de masse
(APCI+)
[M+H]+ = 304.
Composé de formule (I-37)
MeO
MeO / N
OMe (I-37)
Une solution de 26 mg de II-38 (0,081 mmol ; 1 éq.) dans 4 mL de méthanol est
hydrogénée par le H-Cube (hydrogénateur en flux continu. Conditions : 1
mL/min,
température ambiante). Le filtrat récupéré est concentré sous pression
réduite. Le
produit brut est purifié sur colonne de gel de silice (diéthyléther. Rf =
0,24).
(Rendement 54%).
'H RMN: 8, ppm, CDC13, 300 MHz: 1,76 (d, 3H, J = 7,2 Hz), 3,76 (s, 3H), 3,80
(s, 6H),
4,36 (q, 1H, J = 7,0 Hz), 6,61 (s, 2H), 7,53 (dd, 1H, J = 4,4 Hz, J = 8,3 Hz),
7,70 (dd,
1H, J = 1,8 Hz, J = 8,8 Hz), 7,87 (s, 1H), 7,96 (d, 1H, J = 8.8 Hz), 8,36 (d,
1H, J = 8,0
Hz), 8,81 (dd, 1H, J = 1,5 Hz, J = 4,3 Hz). Spectrométrie de masse (APCI+)
[M+H]+ _
324.
Composé de formule (I-38)
MeO I I H2
OMe
OMe (I-38)
Il a été préparé selon le mode opératoire général à partir du diaryléthylène
II-39
correspondant. (Rendement 65%).
CA 02726907 2010-12-03
WO 2009/147217 72 PCT/EP2009/056885
'H RMN: 8, ppm, CDC13, 300 MHz: 1,56 (d, 3H, J = 7,2 Hz), 3,76 (s, 6H), 3,82
(s, 3H),
3,95 (q, 1H, J = 7,2 Hz), 6,29 (t, 1H, J = 2,3 Hz), 6,39 (d, 2H, J = 2,3 Hz),
6,57 (d, 1H, J
= 2,1 Hz), 6,61 (dd, 1H, J = 2,1 Hz, J = 8,2 Hz), 6,71 (d, 1H, J = 8,2 Hz).
Spectrométrie
de masse (APCI+) [M+H]+ = 288.
1.3. Synthèse des composés intermédiaires de formule (X)
Ces composés ont été préparés par couplage du 3,4,5-triméthoxyaniline avec
l'halogénure correspondant selon la procédure générale décrite dans la
référence
suivante : Antimitotic and cell growth inhibitory properties of combretastatin
A-4-like
ethers. Lawrence, N. J.; Rennison, D.; Woo, M.; McGown, A. T.; Hadfield, J. A.
Bioorg. Med. Chem. Lett. 2001, 11, 51-54.
Protocole général : A un mélange de Pd(OAc)2 (7,5 mg, 0,05 mmol, 5 mol%), de
Xantphos (29 mg, 0,05 mmol, 5 mol%), de bromure d'aryle ou d'hétéroaryle (1,0
mmol), de la 3,4,5-triméthoxyaniline (1,5 mmol) et de Cs2CO3 (651 mg, 2 mmol)
est
additionné du dioxane (2 mL) sous un flux d'argon Le tube est scellé et le
mélange est
chauffé à 100 C pendant une nuit. Le mélange est refroidi, filtré sur célite,
puis lavé
avec de l'acétate d'éthyle. Le solvant est évaporé et le résidu est
chromatographié sur
gel de silice.
Composé de formule (X-1)
H /
MeO N \ O \
I /
Me0 OMe
OMe (X-1)
Il a été préparé selon la procédure générale de couplage en utilisant le 2-
benzyloxy-4-
iodoanisole. (Rendement 61%).
'H RMN: 8, ppm, CDC13, 300 MHz: 3,12 (s, 3H), 3,66 (s, 6H), 3,75 (s, 3H), 3,80
(s,
3H), 5,02 (s, 2H), 6,06 (s, 2H), 6,57 (dd, 1H, J = 2,4 Hz, J = 8,4 Hz), 6,63
(d, 1H, J =
2,4 Hz), 6,76 (d, 1H, J = 8,4 Hz), 7,18-7,35 (m, 5H). Spectrométrie de masse
(ESI)
[M+Na]+ = 419.
CA 02726907 2010-12-03
WO 2009/147217 73 PCT/EP2009/056885
Composé de formule (X-2)
H
MeO N
\ I I /
Me0 O N
OMe 1 (X-2)
Il a été préparé selon la procédure générale de couplage en utilisant le 3-
bromo-N-
méthyl-2-quinolone. (Rendement 88.
'H RMN: 8, ppm, CDC13, 300 MHz: 3,76 (s, 6H), 3,78 (s, 3H) 6,47 (se, 1H), 6,53
(s,
2H), 6,65 (t, 1 H, J = 8,2 Hz), 6,75 (d, 1 H, J = 8,4 Hz), 7,41 (t, 1 H, J =
8,2 Hz), 8,12 (d,
1H, J= 4,8 Hz). Spectrométrie de masse (ESI) [M+H]+ = 341.
Composé de formule (X-3)
H
1
:rxc
O O
OMe (X-3)
Il a été préparé selon la procédure générale de couplage en utilisant le 3-
bromo-
coumarine. (Rendement 83%).
'H RMN: 8, ppm, CDC13, 300 MHz: 3,79 (s, 9H), 6,40 (s, 2H), 6,59 (s, 1H), 7,00
(s,
1H), 7,13-7,25 (m, 4H). Spectrométrie de masse (ESI) [M+H]+ = 328.
Composé de formule (X-4)
H
1
Me0 N N
MeO
OMe (X-4)
Il a été préparé selon la procédure générale de couplage en utilisant le 3-
bromo-pyridine
correspondante. (Rendement 69%).
'H RMN: 8, ppm, CDC13, 300 MHz: 3,76 (s, 6H), 3,78 (s, 3H) 6,47 (se, 1H), 6,63-
6,67
(m 1H), 6,75 (d, 1H, J = 8,4 Hz), 7,39-7 ;44 (m, 1H), 8,12 (d, 1H, J = 4,8
Hz).
Spectrométrie de masse (APCI) [M+H]+ = 261.
CA 02726907 2010-12-03
WO 2009/147217 74 PCT/EP2009/056885
Composé de formule (X-5)
N
H :çrôc
OMe 1 (X-5)
Il a été préparé selon la procédure générale de couplage en utilisant le 3-
bromo-N-
méthyl-4-quinolone correspondante. (Rendement 80%).
'H RMN: 8, ppm, CDC13, 300 MHz: 3,82 (s, 3H), 3,83 (s, 6H), 3,84 (s, 3H), 6,37
(s,
2H), 7,35 (t, 2H, J = 7,5 Hz), 7,41 (dd, 2H, J = 2,7 Hz, J = 8,4 Hz), 7,70 (s,
2H), 8,52 (d,
1H, J = 8,4 Hz). Spectrométrie de masse (ESI) [M+H]+ = 341.
1.4. Synthèse des composés de l'invention de formule (I) avec X = N
Procédure générale d'alkylation ou d'acylation des composés de formule (X) :
A une solution de 0,14 mmol de diarylaniline ou d'aryl-hétéroarylaniline dans
2 mL de
DMF est ajoutée 0,28 mmol d'hydrure de sodium (2 eq), Après 20 min d'agitation
à
température ambiante, 0,28 mmol d'iodure de methyle ou de chlorure d'acétyle
sont
ajoutés. L'ensemble est agité 3 heures à température ambiante avant d'être
hydrolysé
par une solution 1M d'acide chlorhydrique (3 mL). La phase organique est
séparée et la
phase aqueuse est extraite à l'acétate d'éthyle (2 x 10 mL). Les phases
organiques sont
rassemblées, séchées sur sulfate de sodium, et concentrées pour donner un
résidu qui est
purifié sur gel de silice.
Composé de formule (I-39)
Me0 I q N OBn
Meo OMe
OMe (I-39)
Il a été préparé par alkylation de la diarylamine secondaire (préparée selon
Lawrence,
N.J.; Rennison, D.; Woo, M.; McGown, A.T.; Hadfield, J.A. Bioorg. Med. Chem.
Lett.
2001, 11, 51-54) selon la procedure générale. Rendement 61%.
CA 02726907 2010-12-03
WO 2009/147217 75 PCT/EP2009/056885
'H RMN: 8, ppm, CDC13, 300 MHz: 3.12 (s, 3H), 3.65 (s, 6H), 3.73 (s, 3H), 3.81
(s,
3H), 5.00 (s, 2H), 5.97 (s, 2H), 6.55-6.59 (m, 2H), 6.78 (d, 1H, J= 8.4 Hz),
7.18-7.30
(m, 5H). Spectrométrie de masse (ESI) [M+Na]+ = 432.
Composé de formule (I-40)
Me0 I q N OH
Meo OMe
OMe (I-40)
1 mmol de I-39 est dissoute dans 5 mL d'acétate d'éthyle en présence de 10
mol% de
Pd/C. L'ensemble est mis à réagir sous atmosphère d'hydrogène jusqu'à
disparition
totale du produit de départ (CCM). Le catalyseur est filtré puis le solvant
est évaporé
sous pression réduite et le résidu obtenu est chromatographié sur gel de
silice.
Rendement 98%.
'H RMN: 8, ppm, CDC13, 300 MHz: 3.22 (s, 3H), 3.76 (s, 6H), 3.80 (s, 3H), 3.86
(s,
3H), 5.40-5.80 (se, 1H), 6.14 (s, 2H), 6.53 (dd, 1H, J= 8.7 Hz, J = 2.7 Hz),
6.66 (d, 1H,
J= 2.7 Hz), 6.79 (d, 1H, J= 8.7 Hz). Spectrométrie de masse (ESI) [M+Na] =
342.
Composé de formule (I-41)
Ac /
1 "
Me0 / N O
\ I
MeO OMe
OMe (I-41)
Il a été préparé selon la procédure générale d'acylation à partir de X-1.
Rendement 54%.
'H RMN: 8, ppm, CDC13, 300 MHz: 1,96 (s, 3H), 3,67 (s, 6H), 3,74 (s, 3H), 3,80
(s,
3H), 5,06 (s, 2H), 6,33 (s, 2H), 6,69-6,80 (m, 3H), 7,18-7,27 (m, 5H).
Spectrométrie de
masse (ESI) [M+H]+ = 438.
Composé de formule (I-42)
Ac
MeO / N U1i5~ OH \ I Me0 OMe
OMe (I-42)
CA 02726907 2010-12-03
WO 2009/147217 76 PCT/EP2009/056885
1 mmol de I-41 est dissoute dans 5 mL d'acétate d'éthyle en présence de 10
mol% de
Pd/C. L'ensemble est mis à réagir sous atmosphère d'hydrogène jusqu'à
disparition
totale du produit de départ (CCM). Le catalyseur est filtré puis le solvant
est évaporé
sous pression réduite et le résidu obtenu est chromatographié sur gel de
silice.
Rendement 93%.
'H RMN: 8, ppm, CDC13, 300 MHz: 2,00 (s, 3H), 3,73 (s, 9H), 3,81 (s, 3H), 5,90
(se,
1H) 6,42 (s, 2H), 6,74-6,79 (m, 3H). Spectrométrie de masse (ESI) [M+H]+ =
348.
Composé de formule (I-43)
MeO / N / \
\ I I /
MeO O N
OMe 1 (I-43)
Il a été préparé selon la procédure générale d'alkylation à partir de X-2.
Rendement
80%.
'H RMN: 8, ppm, CDC13, 300 MHz: 3,24 (s, 3H), 3,69 (s, 9H), 3,73 (s, 3H), 6,11
(s,
2H), 7,14-7,19 (m, 1H), 7,27-7,30 (m, 1H), 7,34 (s, 1H), 7,40-7,44 (m, 2H).
Spectrométrie de masse (ESI) [M+H]+ = 355.
Composé de formule (I-44)
Ac
1
MeO / N /
\ I
MeO O O
OMe (I-44)
Il a été préparé selon la procédure générale d'acylation à partir de X-3.
Rendement 43%.
'H RMN: 8, ppm, CDC13, 300 MHz: 2,06 (s, 3H), 3,78 (s, 3H), 3,79 (s, 6H), 6,63
(s,
2H), 7,20-7,30 (m, 2H), 7,38-7,46 (m, 2H), 7,60 (s, 1H). Spectrométrie de
masse (ESI)
[M+H]+ = 370.
CA 02726907 2010-12-03
WO 2009/147217 77 PCT/EP2009/056885
Composé de formule (I-45)
MeO N
MeO
OMe (I-45)
Il a été préparé selon la procédure générale d'alkylation à partir de X-4.
Rendement
71%.
'H RMN: 8, ppm, CDC13, 300 MHz: 3,37 (s, 3H), 3,75 (s, 3H), 3,80 (s, 6H), 6,41-
6,44
(m, 3H), 6,53 (td, 1H, J = 5,7 Hz, J = 0,6 Hz) 7,22-7,28 (m, 1H), 8,14-8,16
(m, 1H).
Spectrométrie de masse (ESI) = 275.
Composé de formule (I-46)
Ac
1 0
MeO /
MeO \ N
OMe 1 (I-46)
Il a été préparé selon la procédure générale d'acylation à partir de X-5.
Rendement 54%.
'H RMN: 8, ppm, CDC13, 300 MHz: 2,07 (s, 9H), 2,11 (s, 3H), 3,75 (s, 6H), 3,78
(s,
3H), 6,64 (s, 1H), 6,75 (s, 1H), 7,34-7,37 (m, 2H), 7,64-7,71 (m, 2H), 8,47
(m, 1H).
Spectrométrie de masse (ESI) [M+H]+ = 383.
Exemple 2 : Étude in vitro de la cytotoxicité des composés de l'invention
Les effets sur la prolifération de différentes cellules cancéreuses ainsi que
sur la
prolifération de cellules endothéliales ont été étudiés.
L'activité biologique des composés de l'invention a été étudiée in vitro sur 7
lignées cellulaires cancéreuses humaines d'origines tissulaires différentes
(HCTJ16:
carcinome colorectal; K562: leucémie myéloïde chronique; B16-FIO: mélanome;
U87:
glioblastome; H1299: cancer du poumon non à petites cellules et MDA-MB 231 et
MDA-MB 435: cancer du sein). Les cellules sélectionnées pour cette étude ont
été
incubées à 37 C en présence de l'un des composés ajouté dans le milieu de
culture à
différentes concentrations. L'ensemble des expériences réalisées a permis de
déterminer
CA 02726907 2010-12-03
WO 2009/147217 78 PCT/EP2009/056885
le degré de toxicité du composé testé, son effet sur le déroulement du cycle
cellulaire
ainsi que sa capacité à induire une mort cellulaire par apoptose.
Les lignées cellulaires cancéreuses proviennent de l'American Type Culture
Collection (Rockville, MD, USA) et ont été cultivées selon les recommandations
du
fournisseur.
Les cellules H1299, U87, MDA-MB231, MDA-MB435 et B16F10 ont été
cultivées dans du milieu de culture "Dulbecco minimal essential medium" (DMEM)
contenant 4,5 g/L de glucose et supplémenté avec 10% de sérum de veau foetal
et 1 % de
glutamine. Les cellules K562 et HCT116 ont été cultivées dans du milieu RPMI
1640
contenant 10% de sérum de veau foetal et 1% de glutamine. Toutes les lignées
cellulaires ont été maintenues en culture à 37 C dans une atmosphère humide
contenant
5% de C02. La viabilité cellulaire a été évaluée en utilisant le réactif
"CellTiter-Blue
TM" (Promega, WI, USA) en respectant les instructions du fabriquant. Les
cellules ont
été ensemencées dans des plaques de culture de 96 puits à raison de 5000
cellules par
puits dans 50 l de milieu de culture. Après 24 heures de culture, les
composés de
formule générale (I) dissous dans du DMSO ont été ajoutés individuellement
dans
chacun des puits à raison de 50 l par puits. Tous les composés ont été testés
en triplicat
pour chaque concentration définie et chaque expérience a été répétée 3 fois.
Après 72
heures d'incubation, 20 L de resazurin ont été ajoutés dans chaque puits.
Après 2
heures d'incubation, la fluorescence émise a été mesurée à 590 nm après
excitation à
560 nm à l'aide d'un lecteur de fluorescence de type Victor (Perkin-Elmer,
USA).
La concentration de chacun des composés qui induit la mort de 50% des cellules
(C150) a été déterminée après 72 heures d'incubation. Certains composés
conformes à
l'invention présentent une CI50 de l'ordre du nanomolaire. Les résultats
obtenus sont
présentés dans le tableau 1 suivant.
On constate notamment que les deux énantiomères (I-la) et (I-lb) possèdent la
même activité cytotoxique.
Tableau 1
Molécules de l'invention CI50 pour différentes lignées cellulaires (nM)
HCT116 H1299 M231
(I-1) 50-65 - 40
CA 02726907 2010-12-03
WO 2009/147217 79 PCT/EP2009/056885
(I-la) 60 35 -
(I-lb) 50 30 -
(I-9) 85 - -
(I-16) 90a 50a
100b 50b
(I-14) 5Oa 5Oa
90b 50b
(I-19) 80 - -
(I-20) 30 - -
(I-21) 60 - -
- signifie qu'aucune mesure n'a été effectuée.
'dans le DMSO, b dans l'eau
Exemple 3 : Étude de l'inhibition de la polymérisation de la tubuline
Des tests concernant l'inhibition de la polymérisation de la tubuline ont été
effectués sur les composés qui présentaient les meilleures activités
cytotoxiques. Ces
tests ont été effectués sur une tubuline purifiée par la méthode Shelanski
(Shelanski, M.
C.; Gaskin, F.; Cantor, C. R. Proc. Natl. Acad. Sci. USA, 1973, 70, 765-768) à
partir de
cerveaux de porcs, où elle constitue 20 à 25% des protéines solubles. La
méthode de
purification est basée sur des cycles d'assemblage-désassemblage température
dépendants. La polymérisation de la tubuline a été suivie par turbidimétrie
suivant la
méthode de Gaskin (Gaskin, F.; Cantor, C. R.; Shelanski, M. L. J. Bio. Mol.,
1974, 89,
737) à une longueur d'onde de 350 nm. Les différents échantillons ont été
dissous dans
le DMSO et incubés 10 minutes à 37 C puis 5 minutes à 0 C.
Le composé CA-4 et le DMSO ont été pris comme référence.
Les tests ont montré, pour ces composés, une activité inhibitrice de la
polymérisation de la tubuline similaire à celle du composé CA-4 de référence
(de l'ordre
du micromolaire à quelques dizaines de micromolaires seulement). Les résultats
obtenus
sont présentés dans le tableau 3 suivant.
On constate également que les deux énantiomères (I-la) et (I-lb) possèdent la
même capacité d'inhibition de la polymérisation de la tubuline.
CA 02726907 2010-12-03
WO 2009/147217 80 PCT/EP2009/056885
Tableau 3
Inhibition de la tubuline
Molécules de l'invention
(CI50 en M)
(I-1) 3,2
(I-la) 5,0-6,0
(I-lb) 6,7-8,0
(I-9) 6,0
(I-18) 11
(I-38) 11
Exemple 4 : Étude de l'activité anti-vasculaire
4.1. Étude in vitro de la cytotoxicité sur les cellules endothéliales
humaines.
La cytotoxicité du composé (I-1) vis-à-vis des cellules endothéliales humaines
(EAhy926) a été évaluée après 3, 6 ou 72 heures de traitement. Le nombre de
cellules
vivantes a été compté soit immédiatement à la fin d'un traitement de 3 ou 6
heures
(Figure 1), soit 72 heures après l'arrêt d'un traitement de 3, 6 ou 72 heures
(Figure 2).
On observe que lorsque les cellules endothéliales sont traitées pendant 72
heures avec le
composé (I-1), la C150 est de 50 nM. En revanche, après 3 heures de
traitement, le
composé (I-1) ne présente pas d'activité cytotoxique même à la dose de 10 nM.
4.2. Étude in vitro sur la formation de tubes vasculaires sur Matrigel
Pour savoir si le composé (I-1) ou (I-16) perturbe l'organisation spatiale des
cellules endothéliales en structures similaires à des capillaires vasculaires,
des cellules
endothéliales humaines (EAhy926) ont été traitées immédiatement après la mise
en
culture sur MatrigelTM ou après 24 heures de culture, afin de leur permettre
de former
des tubes vasculaires.
Les cellules EAhy926 (cellules endothéliales macro-vasculaires HUVEC
immortalisées) ont été cultivées dans du milieu de culture "Dulbecco minimal
essential
medium" (DMEM) contenant 4,5 g/L de glucose et supplémenté avec 10% de sérum
de
veau foetal, 1% de glutamine et complément HAT (100 M de hypoxanthine, 0,4 M
d'aminoptérine et 16 M de thymidine, Invitrogen; Cergy-Pontoise, France). Les
cellules ont été maintenues en culture à 37 C dans une atmosphère humide
contenant
5% deC02.
CA 02726907 2010-12-03
WO 2009/147217 81 PCT/EP2009/056885
Les cellules ont été ensemencées dans des plaques de culture de 96 puits à
raison
de 3000 cellules par puits dans 50 L de milieu de culture. Après 24 heures
d'incubation, le composé (I-1) a été ajouté à différentes concentrations
pendant 1 heure,
3 heures, 6 heures ou 72 heures. A la fin du traitement le nombre de cellules
a été
évalué en utilisant le réactif "CellTiter-Blue TM" (Promega, WI, USA) comme
décrit
précédemment. En parallèle, après 1 heure, 3 heures ou 6 heures de traitement
avec le
composé (I-1), le milieu de culture a été retiré et remplacé par du milieu
frais pendant
72 heures et le nombre de cellules vivantes a ensuite été mesuré en utilisant
le réactif
"CellTiter-Blue TM".
Pour évaluer l'activité anti-vasculaire des composés (I-1) et (I-16), les
cellules
EAhy926 ont été mise en culture dans des plaques de culture de 96 puits
préalablement
recouvertes avec un extrait de matrice extracellulaire (MatrigelTM, BD
Biosciences, Le
Pont-de-Claix, France) dans lequel elles forment spontanément des tubes
capillaires.
Tout d'abord, nous avons mesuré la capacité des composés (I-1) et (I-16) à
inhiber la formation du réseau capillaire. Le MatrigelTM est déposé dans des
plaques de
culture de 96 puits à raison de 70 L/puits et laissé à incuber à 37 C pendant
45 minutes
pour permettre sa polymérisation. 15 000 cellules en suspension dans 150 L de
milieu
de culture sont ensemencées par puits dans chacun des puits contenant le
MatrigelTM en
absence ou en présence de différentes concentrations du composé (I-1) ou (I-
16) (0,5 M
ou 1 M), à raison de 3 puits par concentration. Après 3 heures d'incubation à
37 C, les
cellules sont observées et photographiées à l'aide d'un microscope optique de
type
TE2000 (Nikon, France), équipé d'une caméra (Figure 3).
En parallèle, 15 000 cellules EAhy926 en suspension dans 150 L de milieu de
culture ont été ensemencées dans chacun des puits contenant le MatrigelTM.
Après 24
heures d'incubation, quand le réseau capillaire est bien formé, le composé (I-
1) ou (I-
16) a été ajouté à différentes concentrations (0,5 M ou 1 M). L'effet du
produit a été
observé et photographié après 3 heures d'incubation à l'aide d'un microscope
optique
(Figure 4).
On peut observer qu'après un traitement de 3 heures à une dose de 0,5 M ou 1
M (non toxique), les composés (I-1) ou (I-16) induisent une diminution très
importante
du nombre de tubes vasculaires. Ces résultats indiquent que les composés (I-1)
et (I-16)
possèdent également une activité anti-vasculaire potentiellement utile en
thérapeutique.